TETTY CHAIDAMSARI
Utilization of marginal lands such as acid soils could be an alternative solution
to increase rice cultivation area. One main problem found in acid soils is high
solubility of Al
3+ion that toxic for plant. Al tolerant varities are required to
overcome this problem. Generally, Al-tolerant varieties have poor agronomic
characteristics, such as low productivity, compared to the popular varieties that
typically Al-sensitive. Genetic engineering could be an alternative way to improve
agronomic characters. One candidate of Al tolerant genes, namely
B11
gene, has
been successfully isolated from Al-tolerant rice, Hawara Bunar, an Indonesian
local rice genotype. The
B11
gene was inserted into pBIN and pGWB5 plasmids
and introduced to several rice genotypes through particle bombardment and
Agrobacterium
-mediated transformation techniques.
Agrobacterium
mediated
transformation efficiency in T309 genotype was 10%. However, transformation
into IR64 genotype through callus and immature embrio infection was not
succesfull.
In-planta
transformation was succesffully introduced the gene into
several rice genotypes with various transformation efficiency, which were 80.0,
75.0, 66.7, 33.3 and 33.3 percent for rice genotype IR64, Grogol, Krowal Oval,
T309, and Situbagendit, respectively. The
in-planta
technique has not been
succcesfully transformed the gene into rice genotype Hawara Bunar and Danau
Gaung.
Kebutuhan pangan akan semakin bertambah seiring dengan pertambahan
jumlah penduduk dan konversi lahan untuk pemukiman. Hal ini mendorong untuk
dilakukannya ekstensifikasi pertanian pada lahan marginal, salah satunya lahan
masam. Kelarutan Aluminium (Al) yang tinggi pada lahan masam menyebabkan
masalah tersendiri karena Al dalam bentuk kation trivalen bersifat toksik pada
tanaman, salah satunya padi. Penggunaan varietas-varietas toleran Al sebenarnya
dapat menjadi solusi dalam ekstensifikasi pertanian. Namun, karakter agronomis
varietas toleran umumnya tidak sebaik varietas-varietas populer yang banyak
digunakan oleh petani. Perbaikan sifat tanaman padi perlu dilakukan untuk
menghasilkan tanaman dengan karakter agronomis yang baik dan toleran Al.
Salah satu cara perbaikan sifat tanaman dapat dilakukan dengan rekayasa genetika
melalui peningkatan ekspresi gen yang berperan dalam toleransi Al. Salah satu
kandidat gen yang diduga berperan dalam toleransi Al adalah gen
B11
yang
berhasil diisolasi dari genotipe padi toleran Al, Hawara Bunar. Transformasi gen
ini pada tanaman tembakau menunjukkan peningkatan toleransi terhadap cekaman
Al dibandingkan pada tanaman kontrol.
Penelitian ini bertujuan untuk mengkonstruksi plasmid ekspresi pBIN
yang membawa gen
B11
lalu mengintroduksikannya pada tanaman padi melalui
beberapa pendekatan. Melalui penelitian ini diharapkan diperoleh konstruk
plasmid rekombinan pBIN-B11 dan diperoleh pula metode transformasi yang
paling efektif untuk menghasilkan tanaman padi transgenik.
Penelitian dilakukan mulai Februari 2009 hingga Mei 2012 bertempat di
laboratorium penelitian Fisiologi dan Genetika Tumbuhan, Departemen Biologi
FMIPA IPB. Konstruksi dilakukan menggunakan metode konvensional berupa
restriksi-ligasi. Introduksi gen dilakukan dengan membandingkan penggunaan
particle bombardment
, infeksi oleh
Agrobacterium tumefaciens
pada kalus dan
embrio muda, serta secara
in-planta
. Penembakan kalus padi dengan particle
bombardment dilakukan oleh Dr. Saptowo J. Pardal dan tim. Evaluasi hasil
transformasi dilakukan melalui seleksi antibiotik, uji toleransi terhadap cekaman
Al, uji keberadaan gen sisipan, dan analisis ekspresi gen sisipan.
Penyisipan gen
B11
dalam pBIN menghasilkan 4 macam konstruksi
dengan beberapa ukuran gen sisipan, antara lain pBIN-E, pBIN-F, pBIN-I, dan
pBIN-K. Plasmid rekombinan pBIN-B11 digunakan langsung untuk penembakan
pada kalus genotipe T309 dan IR64 menggunakan
particle bombardment
. Untuk
genotipe T309 penembakan partikel dengan pBIN-F menghasilkan satu tanaman
yang lolos seleksi antibiotik. Analisis toleransi Al biji transgenik dari generasi T1
hingga T3 menunjukkan peningkatan toleransi terhadap cekaman Al dibandingkan
tipe liarnya (kontrol). Uji keberadaan gen sisipan menunjukkan bahwa gen tersisip
ke dalam DNA genom padi. Analisis ekspresi menunjukkan secara umum terjadi
peningkatan ekspesi gen
B11
pada padi transgenik, namun nilai ekspresinya masih
menggunakan konstruk
B11
dalam pGWB5 hasil penelitian peneliti sebelumnya
(Roslim
2009).
Penggunaan
plasmid
pGWB5
memungkinkan
seleksi
menggunakan higromisin. Infeksi kalus T309 menghasilkan tanaman lolos seleksi
lebih banyak dibandingkan saat penggunaan
particle bombardment
dengan
pBIN-B11. Nilai efisiensi transformasi genotipe T309 sebesar 10% sesuai dengan hasil
uji sisipan gen. Transformasi pada kalus dan embrio muda genotipe IR64 belum
memberikan hasil seperti yang diharapkan.
Sifat genotipe IR64 yang rekalsitran menjadi masalah tersendiri dalam
proses transformasi melalui kultur jaringan. Infeksi secara
in-planta
dilakukan
untuk mengatasi masalah ini. Teknik ini dilakukan pada 7 genotipe padi tanpa
melalui tahapan kultur jaringan. Berdasarkan pengujian sisipan gen, teknik infeksi
in-planta
berhasil dilakukan dengan nilai efisiensi yang bervariasi antar genotipe,
yaitu sebesar 80.0, 75.0, 66.7, 33.3 dan 33.3 persen berturut-turut untuk genotipe
IR64, Grogol, Krowal Oval, T309, dan Situbagendit. Genotipe Hawara Bunar dan
Danau Gaung masih belum berhasil ditransformasi.
Konstruksi gen
B11
dalam pBIN dapat digunakan untuk pekerjaan
lanjutan pada rekayasa tanaman padi dengan sedikit modifikasi pada prosedur
seleksi untuk menghindari kejadian albino. Teknik infeksi
A.tumefaciens
secara
in-planta
dapat menjadi pilihan teknik yang mudah, murah, dan efektif untuk
mengintroduksi gen pada tanaman padi dibanding metode menggunakan
particle
bombardment
dan infeksi
A. tumefaciens
berbasis kultur jaringan.
PENDAHULUAN
Latar Belakang
Usaha ekstensifikasi tanaman padi ke lahan-lahan marginal seperti tanah masam perlu diupayakan, seiring berkurangnya areal pertanian tanaman pangan di Indonesia terutama di pulau Jawa. Namun, usaha pertanian pada tanah masam terutama terkendala oleh keracunan Aluminium (Al). Kelarutan ion Al trivalen yang tinggi menjadi penghambat pertumbuhan dan fungsi akar, yang selanjutnya dapat menurunkan produksi tanaman (Kochian 1995).
Penggunaan varietas padi toleran cekaman Al dapat menjadi salah satu solusi dalam ekstensifikasi pertanian tanaman padi di tanah masam. Namun, produktivitas varietas toleran Al secara alami tidak sebaik varietas unggul yang umumnya sensitif cekaman Al. Pemuliaan tanaman melalui persilangan maupun rekayasa genetika menjadi upaya untuk memperbaiki sifat tanaman. Rekayasa genetika memungkinkan untuk merakit tanaman transgenik melalui modifikasi satu jenis gen tanpa mempengaruhi sifat-sifat lain. Hal ini menjadi keunggulan dari rekayasa genetika dibandingkan persilangan.
Mekanisme toleransi tanaman terhadap cekaman Al beragam antar spesies yang berbeda. Namun pada tanaman pangan seperti gandum (Triticum aestivum L.), barley (Hordeum vulgare L.), rye (Secale cereale L.), sorgum (Sorgum bicolor L.), jagung (Zea mays L.) secara umum menunjukkan mekanisme toleransi terhadap cekaman Al yang mirip yaitu melalui pengaktifan sekresi asam organik berupa anion malat, sitrat, maupun oksalat (Li et al. 2000, Furukawa et al. 2007, Ryan et al. 2009). Penelitian Miftahudin dan Chikmawati (2008) menunjukkan adanya peningkatan sekresi asam malat dan sitrat pada genotipe Hawara Bunar dan Grogol (toleran Al) dibandingkan genotipe IR64 (sensitif Al) saat diberi cekaman Al. Selain itu, terdapat pula akumulasi Al pada daerah apoplas sel akar yang mengindikasikan bahwa Al tidak masuk ke dalam sel. Hal ini memberikan dugaan bahwa ada peran protein transporter untuk mengeluarkan asam organik yang mengkelat Al dari dalam sel seperti ALMT-1. Namun demikian, penelitian Sasaki et al. (2004) menunjukkan bahwa ekspresi berlebih
antara tanaman transgenik ALMT-1 dan non-transgenik. Oleh karena itu untuk tanaman padi, mungkin masih ada gen lain yang lebih bertanggung jawab dalam mekanisme toleransi tanaman padi terhadap cekaman Al.
Penelitian Miftahudin et al. (2005) pada tanaman rye menunjukkan adanya hubungan sinteni antara daerah pada lengan panjang kromosom 4 rye dan daerah pada lengan pendek kromosom 3 padi terkait dengan toleransi terhadap cekaman Al. Berdasarkan hubungan sinteni ini, Roslim (2009) melakukan penapisan beberapa marka pada daerah kromosom 3 padi. Daerah B11 mengalami peningkatan ekspresi (up-regulated) saat diberi perlakuan Al. Pada genotipe padi toleran Al peningkatan ekspresi daerah tersebut lebih tinggi dibanding genotipe sensitif Al. Oleh karena itu, daerah B11 yang kemudian disebut sebagai gen B11 dapat dijadikan sebagai salah satu kandidat gen yang berperan dalam toleransi Al.
Roslim (2011) berhasil mengisolasi gen B11 dari padi lokal Indonesia yang toleran Al, Hawara Bunar. Paralel dengan penelitian pada padi, Roslim (2011) melakukan penyisipan gen B11 pada plasmid ekspresi pGWB5 lalu diintroduksikan pada tembakau melalui infeksi Agrobacterium tumefaciens. Tembakau transgenik B11 mengalami peningkatan toleransi Al dibandingkan non- transgenik. Hipotesis peran B11 sebagai salah satu gen toleransi Al perlu dibuktikan pada padi sebagai tanaman asal gen tersebut.
Empat macam plasmid rekombinan pBIN-B11 hasil konstruksi yang dilakukan pada penelitian ini digunakan oleh Saptowo dan timnya (Balai Besar Sumberdaya Genetik Pertanian, Badan Litbang Deptan) untuk transformasi padi melalui particle bombardment. Hanya satu konstruk yaitu pBIN-B11-F yang menghasilkan satu tanaman fertil dari penembakkan tersebut, yang kemudian dievaluasi dalam penelitian ini hingga generasi T3. Sejalan dengan evaluasi tanaman hasil penembakan partikel, dilakukan pula introduksi gen B11 pada padi dengan bantuan A. tumefaciens melalui beberapa pendekatan.
Tujuan Penelitian
generasi T1-T3 hasil transformasi dengan teknik particle bombardment, serta mengintroduksi gen B11 pada tanaman padi. Introduksi dilakukan terutama melalui infeksi A. tumefaciens dengan beberapa metode infeksi untuk memperoleh efisiensi transformasi yang terbaik.
Manfaat Penelitian
Penelitian ini dapat memberikan manfaat berupa:
1. Konstruk gen B11 dalam plasmid ekspresi dapat digunakan untuk pekerjaan- pekerjaan downstream lainnya dalam rekayasa padi toleran Al.
2. Protokol yang efektif untuk melakukan perakitan padi transgenik yang dapat diterapkan untuk produksi padi transgenik.
3. Galur padi transgenik toleran Al yang dapat dikembangkan menjadi varietas unggul spesifik lokasi (VUSL) khususnya untuk tanah masam.
Alur dan Pengembangan Penelitian
Konstruksi plasmid rekombinan pBIN-B11
Transfromasi genetik dengan
particle bombardment pada IR64 dan
T309 (Pardal dan tim 2009)
Konstruksi plasmid rekombinan pGWB5-B11 (Roslim 2011)
Transfromasi genetik melalui infeksi
Agrobacterium Kalus IR64 Kalus T309 Kalus T309 Kalus IR64 Embrio muda Teknik In-planta
Analisis putatif transgenik:
Seleksi antibiotik, toleransi terhadap Al, uji insersi, uji ekspresi
Padi transgenik B11 toleran Al
TINJAUAN
PUSTAKA
Padi dan Cekaman Aluminium
Padi (Oryza sativa L.) merupakan tanaman serealia semusim yang merupakan sumber karbohidrat utama bagi penduduk dunia, terutama Indonesia. Secara taksonomi padi termasuk dalam Divisi Angiospermae, Kelas Monocotiledoneae, Ordo Poales, Famili Poaceae atau Gramineae serta Genus Oryza. Oryza sativa terdiri dari tiga sub spesies yaitu indica, japonica, serta
javanica yang hanya terdapat di pulau Jawa dengan sifat antara kedua subspesies pertama (Matsuo & Hoshikawa 1993).
Secara alami, tanaman selalu dihadapkan pada berbagai cekaman lingkungan baik biotik maupun abiotik. Cekaman biotik disebabkan oleh serangan hama, penyakit dan gulma, sedangkan cekaman abiotik disebabkan oleh kekeringan, salinitas, suhu tinggi, suhu rendah dan tanah masam. Keracunan Al merupakan hambatan dalam produksi pertanian di tanah masam. Kelarutan Al berhubungan dengan bentuk senyawa Al dan pH larutan. Menurut Kochian (1995) terdapat tiga bentuk senyawa Al yaitu mononuklear (Al3+), Al polinuklear, dan molekul Al kompleks. Endapan Al(OH)3 terbentuk pada pH netral, sedangkan pada pH tinggi Al terdapat dalam bentuk Al(OH)4-. Ketika pH rendah (kurang dari 4) akan terbentuk Al(H2O)63+ atau dikenal dengan Al3+ yang merupakan bentuk Al paling toksik bagi tanaman karena dapat menghambat pertumbuhan dan fungsi akar (Kochian 1995, Matsumoto 2000).
Kerusakan sistem perakaran tanaman akibat keracunan Al selanjutnya akan mengubah anatomi dan morfologi akar (memendek, menebal, dan menggulung), mengganggu penyerapan unsur hara (khususnya Ca dan K), mengganggu sitoskeleton dan proses-proses pada apoplas yang berdampak pada penghambatan pertumbuhan, gangguan dalam transport intraseluler, dan memicu radikal bebas yang menyebabkan cekaman oksidatif sehingga tanaman menjadi rentan terhadap cekaman lingkungan lain, hingga pada akhirnya menurunkan produktivitas tanaman (Ryan et al. 2011).
contoh genotipe toleran Al antara lain IRAT 144, IRAT 303, Hawara Bunar, IAC- 1246, Azucena, IRAT 351, IRAT 352, IRAT 379, Grogol, Danau Gaung (Silitonga 2008, Roslim 2011), sedangkan contoh genotipe padi sensitif Al antara lain IR64 dan Krowal (Roslim 2011). Ciherang dan Situ Bagendit juga merupakan dua genotipe yang sensitif Al dari pengujian RRG yang dilakukan pada penelitian pendahuluan sebelumnya. Penggunaan genotipe padi toleran Al dapat menjadi solusi dalam ekstensifikasi pada lahan-lahan masam. Namun karena pada umumnya varietas-varietas toleran Al memiliki produktivitas yang rendah, maka penggunaan varietas toleran Al kurang menguntungkan petani.
Mekanisme Toleransi Cekaman Aluminium
Ryan dan Delhaize (2010) mengelompokkan mekanisme pertahanan terhadap cekaman Al menjadi 2 strategi, yaitu strategi toleransi dan strategi resistensi (eksklusi). Strategi toleransi merupakan mekanisme tanaman untuk dapat mengizinkan ion Al trivalen masuk dalam aliran simplas namun kemudian dikelat dalam kompleks atau diisolasi dalam organel tertentu sehingga tidak berbahaya bagi metabolisme sel. Mekanisme ini umum terjadi pada spesies- spesies endemik tropis yang memiliki banyak tanah masam. Contoh tanaman yang melakukan mekanisme toleransi ini adalah teh (Camellia sinensis), buckwheat (Fagopyrum esculentum), Melastoma, dan Hydrangea sp. Tanaman-tanaman ini mengakumulasi Al pada daun sehingga disebut juga tanaman akumulator.
B11 sebagai Salah Satu Kandidat Gen Toleransi Aluminium
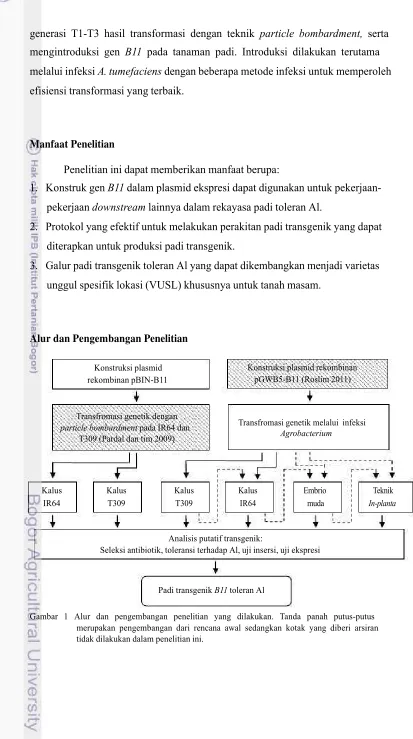
Miftahudin (2005) telah mengidentifikasi daerah Alt3 yang memegang peranan dalam toleransi Al pada tanaman rye (Secale cereale L.). Berdasarkan hubungan kolinearitas antara genom rye dan padi, terdapat sinteni antara daerah
Alt3 rye dengan klon BAC pada kromosom 3 padi. Kemudian dikembangkan marka-marka molekular berdasarkan sekuen BAC kromosom 3 padi dan diterapkan pada rye. Terdapat 4 marka (B11, B25, B26, B27) yang kemudian diuji pada populasi F2 hasil silangan antara rye varietas sensitif dan toleran Al. Dari keempat marka tersebut, diketahui bahwa dua marka, B11 dan B26 mengalami ko-segregasi dengan lokus Alt3. Hasil ini mengindikasikan bahwa gen
Alt3 berjarak sangat dekat dengan kedua marka tersebut. Hubungan sinteni antara padi dan rye ditampilkan pada Gambar 2. Peta resolusi tinggi menunjukkan bahwa Alt3 terletak di antara interval B11 dan B26, atau bahkan dapat merupakan B11 atau B26 itu sendiri (Miftahudin et al. 2005).
Gambar 2 Homologi kromosom 4RL rye dengan kromosom 3 pada padi. Gen Alt3 yang memegang peranan terhadap toleransi Al pada rye berjarak sangat dekat dengan marka B11 dan B26 (Miftahudin et al. 2005).
lebih tinggi pada genotipe toleran Al dibanding ekspresi pada genotipe sensitif Al. Hasil ini menjadikan marka B11 yang kemudian disebut sebagai gen B11 dapat dijadikan sebagai salah satu kandidat gen yang berperan dalam toleransi Al.
Gen B11 berhasil diisolasi dan diklon ke dalam plasmid ekspresi pGWB5. Transformasi gen B11 pada tanaman telah dilakukan pada tanaman tembakau. Pengujian cekaman Al pada tembakau transgenik menunjukkan peningkatan toleransi Al dibandingkan tembakau kontrol (Roslim 2011).
Teknik Introduksi Gen ke Tanaman Particle Bombardment
Teknik introduksi gen secara langsung dapat dilakukan dengan penembakan menggunakan particle bombardment. Metode penembakan ini dilakukan dengan melapisi DNA dalam plasmid ekspresi yang akan ditransformasi dengan partikel emas. Dengan tekanan yang berasal dari gas helium, plasmid yang telah dilapis ditembakkan ke material yang menjadi target transformasi (Glick & Pasternak 1998). Variabel yang dapat diatur adalah pengaturan jarak tembak. Jarak tembak yang lebih dekat akan memberikan tekanan yang lebih kuat. Tekanan yang kuat akan melubangi sel dan plasmid dapat masuk ke dalam sel target.
Transformasi dengan particle bombardment dipastikan bahwa DNA yang diintroduksikan masuk ke dalam sel, namun dengan masuknya DNA asing dalam sel belum dapat dipastikan bahwa DNA tersebut akan diekspresikan. Hal ini yang menjadi kekurangan teknik penembakan, di samping DNA yang akhirnya masuk ke dalam sel umumnya tidak hanya satu copy. Jumlah DNA yang masuk lebih dari satu copy dalam sel mampu menyebabkan silensing gen sisipan melalui mekanisme silensing pasca transkripsi. Hal ini dapat menyebabkan ekspresi gen yang disisipkan rendah atau bahkan termutasi sama sekali (Kakkar & Verma 2011).
Infeksi A. tumefaciens
Cara lain untuk menghasilkan tanaman transgenik adalah melalui infeksi
khusus, dapat dilakukan dengan peralatan laboratorium yang sederhana, dan sisipan gen tunggal berpeluang lebih tinggi dibanding dengan particle bombardment, sehingga stabilitas ekspresi gen lebih tinggi (Hansen & Chilton 1996, Dai et al. 2001, Rahmawati 2006).
Proses infeksi yang dilakukan A. tumefaciens mampu menyebabkan transfer DNA dari bakteri ke tanaman inang. Kemampuan transfer ini karena adanya 6-8 operon (bergantung pada strain bakteri) pada plasmid Ti yang meregulasi proses transfer dan integrasi DNA ke dalam genom inang (Rahmawati 2006). Daerah T-DNA (yang dibatasi oleh LB dan RB ) merupakan daerah yang akan ditransfer ke dalam genom inang. Pada A. tumefaciens tipe liar, T-DNA mengandung gen-gen fitohormon (auksin, sitokinin), dan opine (sumber C dan N bagi bakteri) yang ekspresinya dapat menyebabkan terbentuknya tumor mahkota (Glick & Pasternak 1998).
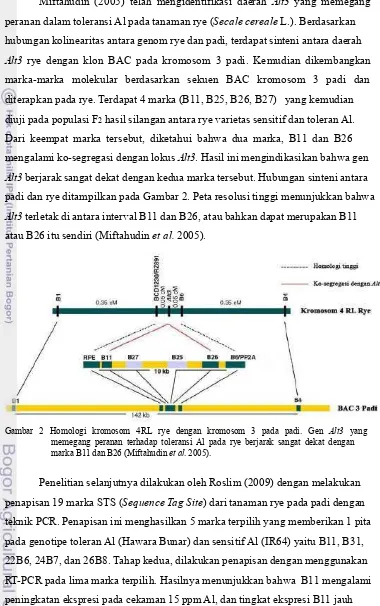
Kompleks T-DNA matang kemudian ditransfer ke inti melalui NPC (nuclear pore complex). Di dalam inti, T-DNA dilepaskan dari protein VirD2 dan selubung VirE2 melalui interaksi dengan VirF dan beberapa protein yang terdapat pada inang (host factor) seperti karyopherin α, CAK2M (Cyclin-dependent
kinase-activating kinase), VIP1 (VirE2-interacting protein), histon H2A-1 (core
histone), ASK1 (protease VirE2), DSBs (double-strand breaks), dan KU80 (Tzfira dan Citovsky 2006).
Gambar 3 Mekanisme integrasi T-DNA dari A. tumefaciens ke genom tanaman (Tzfira & Citovsky 2006).
Operon Vir akan tetap mentransfer apa yang terkandung di dalam daerah T-DNA, sekalipun T-DNA sudah tidak berisi gen-gen fitohormon dan opine. Oleh karena itu, penyisipan suatu gen sasaran di daerah T-DNA akan memungkinkan untuk ditransfer ke genom tanaman. Pengetahuan inilah yang kemudian digunakan sebagai media untuk mentransfer DNA dari bakteri ke dalam genom tanaman.
Infeksi A. tumefaciens secara In-Planta
Infeksi in-planta merupakan teknik transformasi sederhana yang pertama kali dikembangkan oleh Kojima et al. (2000). Kelebihan dari teknik ini adalah tidak membutuhkan teknik kultur jaringan sehingga tidak membutuhkan kondisi aseptik, tidak terjadinya variasi somaklonal, tidak ada masalah dalam hal regenerasi sehingga waktu pengerjaan dapat diprediksi. Berbagai kelebihan tersebut membuat teknik ini memungkinkan dilakukan siapapun, bahkan oleh orang yang belum pernah melakukan sekalipun. Teknik ini meniru infeksi
Agrobacterium secara alami yang pada awalnya dikembangkan untuk transformasi pada Arabidopsis (Bent 2000) melalui infeksi pada organ bunga. Berbagai kelebihan infeksi in-planta membuat Kojima et al. (2000) melakukan modifikasi teknik agar metode ini dapat digunakan untuk tanaman lain. Modifikasi dilakukan dengan menjadikan sel meristem kecambah sebagai objek infeksi melalui penusukan jarum yang dilumuri suspensi A. tumefaciens. Penelitian Kojima et al. (2000) yang dilakukan pada kecambah tanaman buckwheat (Fagophyrum esculentum) berumur 4-5 hari memberikan efisiensi yang cukup tinggi (sekitar 70%) berdasarkan pengujian dengan PCR. Teknik ini dicobakan pula pada tanaman kenaf (Hibiscus cannabinus) dan memberikan efisiensi transformasi sebesar sekitar 85% (Kojima et al. 2004).
berhasil memberikan efisiensi transformasi sebesar 40% berdasarkan pengujian PCR pada generasi T1.
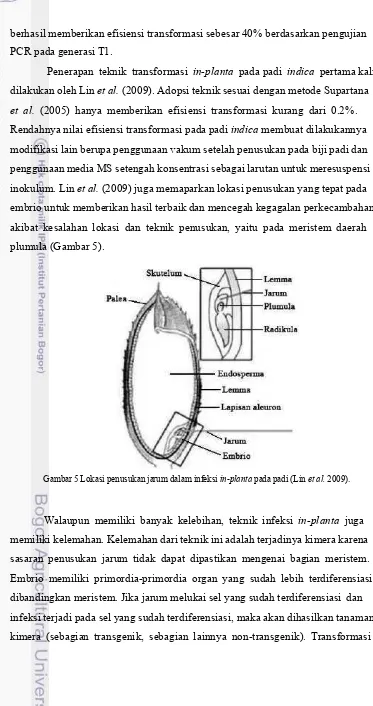
Penerapan teknik transformasi in-planta pada padi indica pertama kali dilakukan oleh Lin et al. (2009). Adopsi teknik sesuai dengan metode Supartana
et al. (2005) hanya memberikan efisiensi transformasi kurang dari 0.2%. Rendahnya nilai efisiensi transformasi pada padi indica membuat dilakukannya modifikasi lain berupa penggunaan vakum setelah penusukan pada biji padi dan penggunaan media MS setengah konsentrasi sebagai larutan untuk meresuspensi inokulum. Lin et al. (2009) juga memaparkan lokasi penusukan yang tepat pada embrio untuk memberikan hasil terbaik dan mencegah kegagalan perkecambahan akibat kesalahan lokasi dan teknik penusukan, yaitu pada meristem daerah plumula (Gambar 5).
Gambar 5 Lokasi penusukan jarum dalam infeksi in-planta pada padi (Lin et al. 2009).
menggunakan teknik infeksi in-planta akan memberikan generasi T0 yang hampir dapat dipastikan kimera, sehingga hal penting yang perlu dilakukan adalah seleksi intensif pada generasi T1 untuk mendapatkan keturunan yang sepenuhnya transgenik (Keshamma et al. 2008).
Hingga saat ini selain tanaman yang telah disebutkan, teknik infeksi in-
planta telah banyak diterapkan pada beberapa tanaman dengan beberapa modifikasi. Beberapa tanaman tersebut antara lain gandum (Supartana et al. 2006, Risacher et al. 2009), kaktus Notocactus scopa cv Soonjung (Seol et al. 2008), alfalfa (Weeks et al. 2008), jagung (Chumakov et al. 2006), Medicago truncatula (Trieu et al. 2000), kacang tanah (Rohini dan Rao 2000), dan kapas (Keshamma et
al. 2008).
Marka Seleksi untuk Tanaman Transgenik
Setelah proses infeksi dilakukan, proses seleksi dibutuhkan untuk dapat memilah regeneran yang mengandung gen sisipan (transgenik) dan regeneran yang non-transgenik. Untuk dapat melakukan seleksi, harus ada sekuen lain yang berada dalam fragmen T-DNA yang memang berperan dalam proses seleksi. Dalam melakukan konstruksi gen dalam plasmid ekspresi, marka seleksi selalu disertakan untuk masuk dalam ruas T-DNA.
Berdasarkan mekanisme kerjanya, marka seleksi digolongkan ke dalam empat kategori (Wei et al. 2012), antara lain:
1. Marka positif, yaitu marka seleksi yang tidak menyebabkan letal pada regeneran non-transgenik namun memberikan peningkatan pertumbuhan atau laju metabolisme pada regeneran transgenik. Regeneran transgenik akan terlihat tumbuh lebih pesat dibanding regeneran non-transgenik. Marka positif dikelompokkan kembali menjadi tiga kelas:
a. Marka berupa gen-gen terkait biosintesis hormon, contohnya gen
uidA penyandi enzim β-glucoronidase (GUS) dan ipt (isopentenil transferase). Gen-gen ini mampu meningkatkan pertumbuhan melalui peningkatan ekspresi gen biosintesis hormon.
2001); atlD, arabitol dehidrogenase (LaFayette et al. 2005). Marka-marka dalam kelas ini memungkinkan transforman memanfaatkan sakarida-sakarida yang tidak umum seperti manosa, xilosa, dan arabitol.
c. Marka yang berasosiasi dengan metabolisme asam amino seperti
AK (aspartate kinase), DAO1 (D-amino acid oxidase), TSB (Triptophan synthase beta1), yang mampu mengaktivasi lintasan metabolisme asam amino yang dapat menjadi pemicu pertumbuhan.
2. Marka negatif, yaitu marka seleksi yang menyebabkan penghambatan bahkan kematian pada regeneran non-transgenik, sedangkan regeneran transgenik tetap mampu tumbuh. Contoh marka negatif adalah gen-gen penyandi resistensi terhadap antibiotik seperti npt (resistensi kanamisin) dan hpt (resistesi higromisin) (Kutty et al. 2011) atau bar penyandi resistensi herbisida Basta (Lin et al. 2009).
3. Marka visual, yaitu marka diferensial yang dapat membedakan transgenik dan non-transgenik. Umumnya marka visual digunakan sebagai reporter gene. Contoh marka visual adalah GFP, green fluorescence protein (Vain
et al. 1998), lacZ atau GUS, β-glucoronidase (Helmer et al. 1984), dan
Luc, Luciferase (Chia et al.1994).
4. Marka berbasis patogen, yaitu marka terkait toleransi terhadap patogen. Contohnya pflp, plant feredoxin-like protein (You et al. 2003) yang dapat meningkatkan resistensi tanaman terhadap infeksi bakteri Erwinia
GOI 35S CaMVTnos
Pro‐GOI‐Term
BAHAN
DAN
METODE
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan Februari 2009 sampai Mei 2012 di Laboratorium Penelitian Fisiologi dan Biologi Molekular Tumbuhan serta Rumah Kaca Departemen Biologi FMIPA IPB, Darmaga, Bogor.
Bahan Penelitian
Padi genotipe T309, IR64, Situbagendit, Danau Gaung, Grogol, Krowal Oval, dan Hawara Bunar digunakan dalam penelitian ini. Penelitian ini juga menggunakan bahan berupa tanaman transgenik T309 hasil penembakan dengan
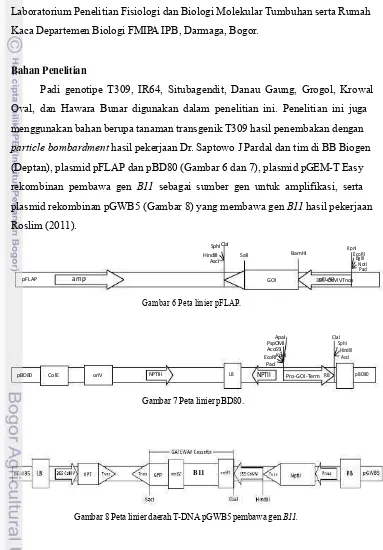
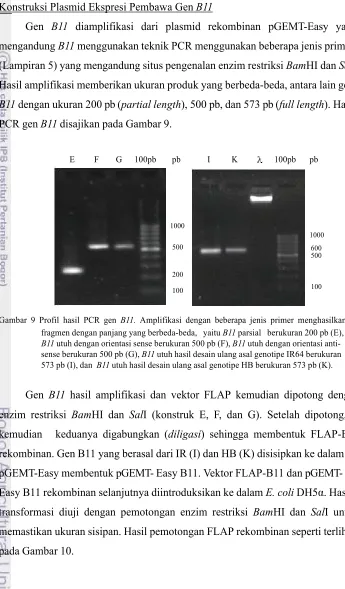
particle bombardment hasil pekerjaan Dr. Saptowo J Pardal dan tim di BB Biogen (Deptan), plasmid pFLAP dan pBD80 (Gambar 6 dan 7), plasmid pGEM-T Easy rekombinan pembawa gen B11 sebagai sumber gen untuk amplifikasi, serta plasmid rekombinan pGWB5 (Gambar 8) yang membawa gen B11 hasil pekerjaan Roslim (2011).
SphIClaI HindIII
AscI
SalI
BamHI
KpnI
EcoRI BglII NotI PacI
pFLAP ampr pFLAP
Gambar 6 Peta linier pFLAP.
ApaI PspOMI Acc65I EcoRIKpnI
PacI
ClaI SphI
HindIII AscI
pBD80 ColE oriV NPTIII LB NPTII RB pBD80
Gambar 7 Peta linier pBD80.
B11
Metode Penelitian
Konstruksi Plasmid Rekombinan Pembawa Gen B11
Gen B11 diamplifikasi dengan reaksi PCR (Polimerase Chain Reaction) menggunakan tiga macam pasangan primer spesifik gen B11 yang telah mengandung adapter situs BamHI dan SalI pada ujungnya. Hasil pita DNA yang diharapkan antara lain 200 pb (sekuen parsial), 500 pb (sekuen penuh), dan 573 pb (sekuen penuh hasil desain ulang). PCR dilakukan menggunakan Dreamtaq DNA polimerase (Fermentas, Kanada) dengan suhu penempelan primer 65oC. Hasil PCR divisualisasi pada 1% gel Agarose (LE GQ Top Vision, Fermentas, Kanada) dengan pewarnaan menggunakan 5µg/ml etidium bromida.
Sebagai vektor entry, digunakan pFLAP. Plasmid pFLAP terlebih dahulu dipotong dengan enzim restriksi BamHI dan SalI (Fermentas, Kanada) dengan inkubasi 37oC selama 18 jam untuk membuatnya menjadi linear. Kemudian sisipan dan vektor FLAP dielektroforesis dan dipurifikasi dari gel (elusi) menggunakan kit Wizard SV Minicolumn PCR Clean-up System (Promega, USA), lalu selanjutnya diligasi dengan enzim T4 DNA ligase (Promega, USA). Hasil ligasi kemudian diintroduksikan ke dalam E. coli DH5α mengikuti prosedur kejutan panas (Sambrook et al. 1989).
Transformasi Tanaman Padi dengan Gen B11
Transformasi menggunakan particle bombardment. Transformasi dengan particle bombardment dilakukan oleh Dr. Saptowo J Pardal dan timnya di BB Biogen, Cimanggu, Bogor. Hanya satu tanaman T0 fertil hasil penembakan yang diperoleh untuk kemudian dianalisis lebih lanjut.
Infeksi A. tumefaciens pada kalus padi. Kultur A. tumefaciens AgL0 pembawa plasmid biner pGWB5 (Gambar 8) hasil pekerjaan Roslim (2011) dengan OD660 = 0.6 digunakan untuk menginfeksi kalus dua genotipe yang berbeda (T309 dan IR64). Kalus disiapkan dengan menumbuhkan biji padi genotipe T309 dan IR64 pada media MS (Lampiran.1) yang mengandung 2 ppm 2,4-D. Kalus kemudian diinfeksi dengan merendamnya di dalam suspensi A. tumefaciens dalam media ko-kultivasi cair yang mengandung 100 µM acetosiringone. Seleksi dilakukan menggunakan higromisin 5 ppm. Regenerasi kalus dilakukan menggunakan media MS + 2 ppm BAP (Lampiran.2).
Infeksi A. tumefaciens pada embrio muda padi. Infeksi embrio muda dilakukan sesuai metode Hiei dan Komari (2008). Bahan embrio muda dipanen dari malai padi berumur 7 hari setelah penyerbukan saat biji masih dalam bentuk cairan (matang susu). Terdapat 5 jenis media yang dipergunakan, antara lain media ko-kultivasi, media resting, media pre-regenerasi, media regenerasi, dan media pengakaran. Komposisi media sesuai dengan Hiei dan Komari (2008) disajikan pada Lampiran 3
(diameter 0.5 mm) yang sebelumnya dicelupkan dalam suspensi A. tumefaciens sedalam kira-kira 1-1.5 mm. Biji yang embrionya telah ditusuk kemudian diletakkan pada cawan petri yang sebelumnya diberi alas kapas dan kertas saring basah, lalu diinkubasi selama 7 hari pada suhu 23oC (gelap).
Evaluasi Tanaman Hasil Transformasi dan Penanaman Padi di Rumah Kaca
Seleksi antibiotik. Seleksi antibiotik dilakukan terhadap kalus padi hasil infeksi secara aseptik dan biji generasi T1 hasil infeksi secara in-planta. Seleksi terhadap kalus hasil transformasi pBIN-B11 menggunakan kanamisin 25 ppm, sedangkan pada kalus hasil transformasi pGWB5-B11 menggunakan higromisin 30 ppm. Seleksi dilakukan selama 2-3 minggu pada media regenerasi yang ditambahkan antibiotik sesuai konsentrasi masing-masing antibiotik (Lampiran 2) dengan suhu ruang kultur 28oC dan intensitas cahaya 300 PPFD (Photo Proton Flux Density)
Seleksi biji T1 hasil infeksi secara in-planta dilakukan dengan menumbuhkan biji pada larutan higromisin 20 ppm dalam air steril. Skoring hasil seleksi antibiotik dilakukan pada hari keempat pengujian. Biji yang mampu berkecambah normal (memunculkan akar dan tunas) merupakan biji putatif transgenik.
Uji toleransi terhadap cekaman Al. Analisis toleransi Al dilakukan untuk biji generasi T1 dan T2 menggunakan parameter Root-Re-Growth (RRG) dengan cekaman 15 ppm Al (Al diberikan dalam bentuk larutan AlCl3·6H2O) sesuai dengan metode yang diuraikan Miftahudin et al. (2002) (Lampiran 4). Kategori sensitif jika nilai RRG < 2 cm, dan toleran jika nilai RRG ≥ 2 cm.
100 ng DNA template, 1x buffer PCR (mengandung 2 mM Mg2+), 0.2 mM dNTPs, 0.4 µM masing-masing primer, dan 1 unit Taq Polimerase dalam 20 µl total reaksi PCR. Kondisi PCR adalah sebagai berikut: pre denaturasi 94oC selama 5 menit, 35 siklus yang terdiri dari denaturasi (94oC selama 30 detik), penempelan primer 30 detik, polimerisasi (72oC selama 30 detik), dengan pasca-PCR 72oC selama 10 menit. Suhu penempelan primer disesuaikan dengan suhu optimum masing-masing primer. Hasil PCR dianalisis menggunakan elektroforesis gel agarose 1% dengan pewarnaan menggunakan 5µg/ml etidium bromida. Gel hasil elektroforesis didokumentasikan menggunakan WiseDoc Gel Documentation
System (Daihan Scientific, Korea Selatan). Khusus untuk tanaman padi hasil infeksi in-planta, isolasi dilakukan pada daun bendera tiap anakan. DNA masing- masing anakan kemudian dibuat bulk untuk tiap rumpun. Uji insersi tahap pertama dilakukan pada DNA bulk tiap rumpun. Rumpun yang menunjukkan hasil positif, diuji lebih lanjut untuk tiap anakannya.
Analisis ekspresi tanaman hasil transformasi. Uji ekspresi pada generasi T3 dilakukan dengan terlebih dahulu mengisolasi RNA total dari daun padi dengan reagen Trizol (Invitrogen, USA) sesuai prosedur yang diberikan produsen. Sintesis cDNA dilakukan menggunakan kit Superscript III Reverse Transcriptase (Invitrogen, USA) sesuai instruksi produsen menggunakan primer oligo dT18. Komposisi reaksi sintesis cDNA sebagai berikut: 5000 ng RNA yang telah diperlakukan DNAse, 1x first strand buffer, 1 µM primer oligo dT18, 0.5 mM dNTPs, 10 mM DTT, 40 unit enzim RTase, dan 0.01% ddH2O yang telah diperlakukan DEPC hingga total reaksi 20 µl. Uji ekspresi dilakukan dengan reaksi PCR biasa dengan reaksi yang seperti disebutkan sebelumnya namun menggunakan template berupa cDNA dengan primer B11 serta ubiquitin sebagai kontrol internal. Analisis semi kuantitatif hasil RT-PCR dilakukan menggunakan software AlphaView (Alpha Innotech, USA).
tanah dan pupuk kandang dengan perbandingan 3:1 yang telah dilumpurkan sebelumnya selama 14 hari. Pemupukan dilakukan menggunakan pupuk majemuk NPK (1:1:1) dengan 3x aplikasi yaitu pada saat tanam (0 MST), 4 MST, dan 7 MST dengan dosis 0.8 gram per tanaman. Untuk padi hasil infeksi in-planta, tidak dilakukan aklimatisasi. Biji padi langsung disemai pada bak semaian. Setelah 14 hari kemudian ditanam pada pot di rumah kaca seperti yang dilakukan pada penanaman sebelumnya.
HASIL
DAN
PEMBAHASAN
Hasil Percobaan
Konstruksi Plasmid Ekspresi Pembawa Gen B11
Gen B11 diamplifikasi dari plasmid rekombinan pGEMT-Easy yang mengandung B11 menggunakan teknik PCR menggunakan beberapa jenis primer (Lampiran 5) yang mengandung situs pengenalan enzim restriksi BamHI dan SalI. Hasil amplifikasi memberikan ukuran produk yang berbeda-beda, antara lain gen
B11 dengan ukuran 200 pb (partial length), 500 pb, dan 573 pb (full length). Hasil PCR gen B11 disajikan pada Gambar 9.
E F G 100pb pb I K 100pb pb
1000
1000 500
200 100
600 500 100
Gambar 9 Profil hasil PCR gen B11. Amplifikasi dengan beberapa jenis primer menghasilkan fragmen dengan panjang yang berbeda-beda, yaitu B11 parsial berukuran 200 pb (E),
B11 utuh dengan orientasi sense berukuran 500 pb (F), B11 utuh dengan orientasi anti- sense berukuran 500 pb (G), B11 utuh hasil desain ulang asal genotipe IR64 berukuran 573 pb (I), dan B11 utuh hasil desain ulang asal genotipe HB berukuran 573 pb (K).
pb 1 2 3 4 5 6 7 8 9 10 11 12 13 14
10000 3000 2000 1500 1000 500
Gambar 10 Hasil pemotongan FLAP rekombinan dengan BamHI dan SalI. FLAP E utuh (1), FLAP E [BamHI] (2), FLAP E [BamHI+SalI] (3), FLAP F utuh (4), FLAP F [BamHI] (5), FLAP F [BamHI+SalI] (6), FLAP G utuh (7), FLAP G [BamHI] (8), FLAP G [BamHI+SalI] (9), 1 Kb Ladder (10), pGEMT K utuh (11), pGEMT K [BamHI] (12), pGEMT K [BamHI+SalI] (13), Lambda 100 ng (14). Tanda panah menunjukkan ukuran gen B11 yang disisipkan.
Plasmid pFLAP-B11 rekombinan kemudian dipotong menggunakan enzim restriksi AscI-PacI. Fragmen yang diambil dari FLAP-B11 rekombinan adalah fragmen berukuran 1397 pb (konstruk E), 1697 pb (konstruk F dan G), dan 1770 (konstruk I dan K) yang berturut-turut membawa ukuran sisipan gen B11 200, 500, dan 573 pb. Hasil pemotongan pFLAP tertera pada Gambar 11, dan pemotongan pBD80 pada Gambar 12.
pb 1 2 3 4 1kb 5 6 7 8 9 10
10000 3000 2000 1500 1000
11091 pb
3658 pb
Gambar 12 Hasil pemotongan pBD80 menggunakan enzim AscI dan PacI. Fragmen yang diambil adalah fragmen besar yang berukuran 11091 pb. 1 dan 2: vektor pBD80, M: 1 kb Ladder.
Selanjutnya fragmen 1397, 1697, dan 1770 pb hasil pemotongan FLAP dengan AscI-PacI serta fragmen 11091 pb hasil pemotongan pBD80 dengan enzim yang sama dipurifikasi dari gel kemudian diligasi membentuk pBIN-B11 dengan insert masing-masing. Lima jenis konstruk pBIN-B11 rekombinan berhasil diperoleh (dengan inisial E, F, G, I, dan K). Plasmid pBIN rekombinan kemudian diintroduksikan ke dalam E. coli DH5α, lalu empat konstruk (kecuali pBIN-G) diisolasi plasmidnya. Hasil isolasi plasmid disajikan pada Gambar 13 sedangkan peta linearnya pada Gambar 14.
1 2 3 4 5 6
Gambar 13 Plasmid pBIN rekombinan hasil isolasi. Plasmid pBIN E1 berukuran 12488 pb (1), pBIN E5 berukuran 12488 pb (2), pBIN F6 berukuran 12448 pb (3), pBIN F9 berukuran 12788 pb (4), pBIN I5 berukuran 12861 pb (5), dan pBIN K5 berukuran 12861 (6).
B11 NPTII
Transformasi Tanaman Padi dengan Gen B11
Transformasi dengan Particle Bombardment.
Transformasi dengan particle bombardment dilakukan menggunakan pBIN-B11 rekombinan hasil konstruksi sebelumnya. Transformasi ini dilakukan oleh Dr. Saptowo J. Pardal beserta tim pada penelitian terpisah. Hanya diperoleh 1 tanaman putatif transgenik fertil yang lolos seleksi kanamisin. Tanaman lolos seleksi ini kemudian dianalisis lebih lanjut.
Infeksi A. tumefaciens pada Kalus Padi
Infeksi kalus padi dengan bantuan A. tumefaciens dilakukan menggunakan konstruksi gen B11 dalam plasmid ekspresi pGWB5 hasil pekerjaan Roslim (2011). Infeksi kalus dilakukan pada dua genotipe padi, yaitu T309 dan IR64. Untuk genotipe T309 berhasil diperoleh cukup banyak planlet yang lolos seleksi dibandingkan saat menggunakan particle
bombardment. Dari 20 tanaman yang diuji, 2 diantaranya positif transgenik. Tahapan infeksi kalus pada genotipe T309 disajikan pada Gambar 15.
A
B
C
D
E
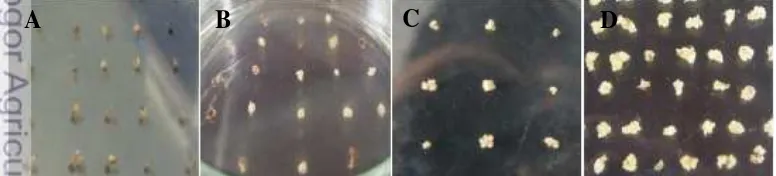
Berbeda dengan infeksi pada T309, infeksi pada kalus genotipe IR64 masih belum berhasil memperoleh regeneran lolos seleksi. Saat regenerasi telah terbentuk spot hijau (Gambar 16), namun tidak berhasil beregenerasi hingga menjadi planlet utuh. Infeksi pada kalus IR64 belum berhasil, sehingga dilakukan pada material infeksi yang lain berupa embrio muda.
Gambar 16 Spot hijau yang tumbuh dari kalus IR64 pada media seleksi.
Infeksi A. tumefaciens pada Embrio Muda Padi
Infeksi A. tumefaciens terhadap embrio muda pada awalnya menunjukkan tanda-tanda keberhasilan, yaitu pertumbuhan kalus yang cepat baik pada media resting, seleksi, hingga pre-regenerasi. Proses seleksi menunjukkan ada perbedaan morfologi pada kalus, beberapa tampak berwarna kekuningan sedangkan beberapa yang lain terlihat mencoklat. Hal ini memberikan indikasi bahwa proses seleksi berjalan dengan baik. Namun saat dilakukan regenerasi, terjadi perbedaan perkembangan antara kalus kontrol (yang tidak diinfeksi) dan kalus hasil infeksi. Kalus kontrol lebih cepat tumbuh dan segera mengalami regenerasi, sedangkan kalus hasil infeksi tidak berkembang sama sekali hingga akhirnya mengering. Pertumbuhan kalus dari embrio muda hasil infeksi disajikan pada Gambar 17.
A
B
C
D
C
Infeksi A. tumefaciens secara In-Planta
Infeksi A. tumefaciens terhadap embrio padi secara dilakukan pada 7 genotipe padi, yaitu: T309, IR64, Situbagendit, Danau Gaung, Hawara Bunar, Krowal Oval, dan Grogol. Masing-masing genotipe diperlakukan sama. Setelah inkubasi selama 6 hari dalam kondisi gelap, biji kemudian disemai pada media tanah yang telah dilumpurkan lalu kemudian ditanam di rumah kaca (Gambar 18). Perkecambahan padi setelah diinfeksi bervariasi antar genotipe, berturut-turut antara lain Krowal Oval, IR64, Situbagendit, Danau Gaung, Grogol, T309, dan Hawara Bunar dengan nilai persentase masing- masing sebesar 93.3, 80, 76, 66.7, 40, 37.5, dan 25%.
A
D
B
Gambar 18 Padi hasil infeksi in-planta. Tanda panah menunjukkan lokasi penusukan (A), biji setelah inkubasi telah memunculkan akar dan tunas (B), padi setelah dipindah pada ember individu (C), padi dewasa generasi T0 hasil infeksi, bar menunjukkan 30 cm (D).
Evaluasi Tanaman Hasil Transformasi
Transformasi dengan Particle Bombardment
Parameter toleransi Al diukur berdasarkan nilai RRG (root-re-growth), yaitu pertambahan panjang akar setelah 24 jam pemulihan dari cekaman AlCl3· 6H2O 15 ppm. Kategori toleran jika nilai RRG > 2.0 cm, dan sensitif jika RRG < 2.0 cm. Nilai RRG biji generasi T1 hasil penembakkan dengan teknik
Tabel 1. Sebaran nilai RRG pada populasi sampling generasi T1
Genotipe Min Maks Rataan
Grogol (toleran) IR64 (sensitif) T1-T309 T309 WT
2.35 0.0 0.1 0.2 2.8 1.6 4.8 2.8 2.57 1.15 2.42 1.91
Dari populasi contoh generasi T1, dilakukan pemilihan nomor biji dengan nilai RRG yang tinggi (>2,8) yaitu sebanyak 7 nomor (Tabel 2). Ketujuh nomor tersebut kemudian ditanam dan dianalisis keberadaan sisipan gen B11 pada genom tanaman hasil transformasi tersebut. Hasil analisis terhadap tujuh nomor generasi T1 terpilih tersebut menunjukkan adanya pita DNA pada ukuran 500 pb, tetapi hanya terlihar samar (Gambar 19). Hal ini mendukung data RRG yang menunjukkan adanya peningkatan toleransi terhadap cekaman Al.
Tabel 2. Tujuh nomor terpilih dari generasi T1 beserta nilai RRG-nya
T309 T1 terpilih Nilai RRG
T1-6 T1-7 T1-23 T1-25 T1-29 T1-33 T1-34 pb 2.8 2.8 4.8 2.9 2.9 3.0 2.8
1kb 6 7 23 25 29 33 34 WT + 100pb
1000 500 100
Gambar 19 Profil hasil PCR tujuh nomor T1 terpilih menggunakan primer gen B11. Tanda panah menunjukkan ukuran target. WT: tipe liar (non transgenik), + : plasmid.
dibandingkan tipe liarnya (Tabel 3). Dari populasi sampling yang diuji, dipilih enam nomor dengan nilai RRG tertinggi (Tabel 4).
Tabel 3. Sebaran nilai RRG pada populasi sampling generasi T2
Genotipe Min Maks Rataan
Grogol (toleran) IR64 (sensitif) T2-T309 T309 WT
2.35 0.0 0.0 0.05 2.8 1.6 3.4 3.6 2.57 1.15 2.61 1.54
Tabel 4. Enam nomor terpilih dari generasi T2 beserta nilai RRG-nya
T309 T2 terpilih Nilai RRG
T2-20 T2-38 T2-39 T2-43 T2-44 T2-45 3.10 2.85 3.40 2.80 2.75 2.60
Enam nomor yang terpilih, diseleksi lebih lanjut melalui uji insersi. Nomor T2-20, yang memberikan hasil konsisten antara hasil PCR dengan primer kanamisin dan hasil PCR dengan primer gen yang diintroduksikan (gen
B11), dipilih dan digunakan untuk menghasilkan generasi T3 (Gambar 20). pb 1000 700 600
2 4 6 8 10 13 M 16 17 19 20 21 22 24 27 28 31 32 35 38 39 40 M 41 43 44 45 34 - +
pb 1000 700 600
- WT 20 38 39 43 44 45 M + pb 1000 400 300 100
Gambar 20 Profil hasil PCR T2 menggunakan primer kanamisin (target 665pb) (atas) dan cds
[image:30.612.102.483.156.746.2] [image:30.612.110.492.449.678.2]Analisis toleransi Al kecambah dari biji padi transgenik T3 juga menunjukkan adanya peningkatan toleransi dibandingkan tipe liarnya (Tabel 5). Dari populasi sampling, dilakukan uji integrasi transgen ke dalam genom (Gambar 21) dan memberikan empat nomor potensial pada generasi T3 (Tabel 6), yaitu nomor 13, 14, 16, dan 23.
Tabel 5. Sebaran nilai RRG pada populasi sampling generasi T3
Genotipe Min Maks Rataan
Grogol (toleran) IR64 (sensitif) T3-T309 T309 WT
2.35 0.0 0.5 0.05 2.8 1.6 4.9 3.6 2.57 1.15 2.80 1.54 pb - 12 13 14 16 1kb 18 22 23 35 WT + 100pb 1000 600 500
Gambar 21 Profil hasil PCR T3 menggunakan primer kanamisin. Tanda panah menunjukkan pita target. Terdapat 4 nomor yang memunculkan pita target yaitu nomor 13, 14, 16, dan 23.
Tabel 6. Empat nomor terpilih dari generasi T3 beserta nilai RRG-nya
T309 T3 terpilih Nilai RRG T3-13 T3-14 T3-16 T3-23 4.9 1.1 2.7 2.9
[image:31.612.107.480.43.788.2]N
ilaiEkpr
esiR
elat
if
0,8
13 23 WT 14 16
RNA
B11
UBQ
0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0
T3-13 T3-23 WT T3-14 T3-16
Gambar 22 Hasil uji ekspresi menggunakan primer B11 dan UBQ sebagai referensi (kiri), dan nilai ekspresi relatif (kanan).
Infeksi A. tumefaciens pada Kalus Padi
Seleksi kalus yang resisten terhadap antibiotik dilakukan pada saat kultur untuk menseleksi kalus-kalus putatif transgenik dengan kalus non-transgenik. Antibiotik yang digunakan adalah higromisin karena pGWB memiliki marka seleksi higromisin. Kalus tidak lolos seleksi mencoklat, menghitam, lalu mati, sedangkan kalus yang lolos seleksi tetap berkembang (Gambar 23).
A
B
C
Gambar 23 Kalus lolos seleksi (panah utuh) dan tidak lolos seleksi (panah putus-putus) berdasarkan seleksi antibiotik (A dan B). Kalus yang menghitam dan mati setelah seleksi (C).
[image:32.612.54.479.31.775.2]
pb
100pb + 5.1 10.1 3.1 4.1 WT
1000 600 500
100
Gambar 24 Profil hasil PCR insersi T0 hasil infeksi A. tumefaciens dengan primer higromisin. Tanda panah menunjukkan pita target (574 pb).
Infeksi A. tumefaciens secara In-Planta
Infeksi in-planta dilakukan terutama untuk padi indica. Uji sisipan pada padi hasil infeksi in-planta dilakukan dalam dua tahap. Tahap pertama merupakan uji tiap anakan menggunakan DNA bulk dalam satu rumpun. Tahap kedua menggunakan DNA tiap anakan dari rumpun yang hasilnya positif. Uji sisipan tahap pertama dan kedua ditampilkan pada Gambar 25 dan Gambar 26.
- I---IR---I I----T-309---I I‐---HB----II---DG---‐I + I---SB----I I‐---GR---II‐---KO---I
Gambar 25 Profil hasil PCR bulk tiap rumpun hasil infeksi in-planta. Tanda panah menunjukkan pita higromisin (574 pb). 11 dari 22 nomor sampel menunjukkan hasil positif¸ yaitu IR-4, IR-10, IR-11, IR-19, T309-3, SB-15, GR-3, GR-4, GR- 5, KO-2, dan KO-5.
M I---IR-4---II---IR-10---I I---IR-11---I + I---IR-19---I M pb 10000
3000 1000
600 500 I----GR-3----II---T309-3---I I---SB-15---II---KO-2---I M I---KO-5---I ‐ M pb
10000 3000 1000 500600
[image:33.612.89.521.39.747.2] [image:33.612.212.387.92.182.2] [image:33.612.126.531.458.672.2]Nilai efisiensi transformasi dihitung dengan membandingkan jumlah tanaman yang positif dibanding dengan jumlah sampel tanaman yang diambil tiap genotipe. Pengambilan sampel tanaman yang diuji tiap genotipe dilakukan secara acak. Nilai efisiensi transformasi ketujuh genotipe yang diinfeksi ditampilkan pada Tabel 7.
Tabel 7. Nilai efisiensi transformasi menggunakan teknik infeksi in-planta
Genotipe Hasil pengujian positif
Jumlah sampel yang diuji
Efisiensi (%)
IR64 4 5 80.0
Grogol 3 4 75.0
Krowal Oval 2 3 66.7
T309 1 3 33.3
Situ Bagendit 1 3 33.3
Ket: Hawara Bunar dan Danau Gaung belum berhasil memperoleh hasil positif.
Seleksi lebih lanjut pada biji T1 hasil infeksi in-planta dilakukan dengan mengecambahkan biji pada larutan higromisin 20 ppm selama 4 hari. Kriteria lolos adalah jika biji mampu menumbuhkan tunas dan akar. Pada generasi T1 terdapat biji yang dapat berkecambah dan ada pula biji yang tidak berkecambah (Gambar 27A). Biji yang diseleksi adalah biji T1- IR64-4 anakan nomor 1 (IR64-4-1) yang positif dari hasil pengujian PCR. Total jumlah biji yang diuji higromisin adalah 70 biji dengan 29 biji lolos dan 41 biji tidak lolos seleksi.
A
C
D
B
[image:34.612.114.472.175.759.2] [image:34.612.121.471.500.653.2]
Biji T1 yang lolos seleksi higromisin kemudian ditumbuhkan di rumah kaca untuk kemudian diisolasi DNA-nya dan diuji keberadaan sisipan gen target pada tanaman putatif transgenik dengan teknik PCR menggunakan primer dari gen B11 dan dan gen hpt penyandi ketahanan terhadap higromisin. Isolasi DNA hanya dilakukan pada empat tanaman. Hasil uji sisipan menunjukkan hanya satu dari empat tanaman yang memberikan hasil positif (Gambar 28).
1kb - 1 2 3 4 WT WT + - 100pb 1 2 3 4 WT WT + 100pb pb 10000
1000 1000
500 500
300 200 100 Primer higromisin Primer B11
Pembahasan
Konstruksi Plasmid Ekspresi pembawa Gen B11
Perakitan plasmid ekspresi pBIN rekombinan tidak semudah melakukan penyisipan pada plasmid ekspresi tunggal. Struktur pBIN merupakan gabungan antara pFLAP dengan pBD80. Ada fragmen yang tetap dipertahankan pada masing-masing plasmid, sehingga untuk menghasilkan plasmid rekombinan pBIN harus dilakukan dalam dua tahap. Gen B11 yang akan disisipkan terlebih dahulu dimasukkan ke dalam pFLAP, lalu pFLAP rekombinan dipotong dan digabung dengan fragmen dari pBD80 untuk membentuk pBIN (Gambar 29).
Gambar 29 Peta plasmid rekombinan pFLAP-B11 dan pBIN-B11.
Hasil uji sisipan gen B11 dengan 3 pasang primer yag didesain dari sekuen gen B11 menghasilkan produk yang berbeda, yaitu ukuran 200 (gen parsial), 500 (gen utuh), dan 573 pb (gen utuh hasil desain ulang). Plasmid pFLAP rekombinan
[image:36.612.96.477.66.491.2]sirkuler, maupun superkoil (Sambrook et al. 1989). Pemotongan dengan dua enzim, BamHI dan SalI dapat mengeluarkan pita sisipan dari vektor FLAPnya. Hal ini dapat menjadi konfirmasi terhadap ukuran sisipan.
Tahap kedua dari proses pembentukan plasmid ekspresi pBIN adalah konstruksi pBIN rekombinan dengan pemotongan menggunakan enzim AscI dan
PacI. Enzim AscI dan PacI merupakan enzim dengan situs pengenalan restriksi yang unik (pemotong sangat jarang) dan tidak dijumpai pada sekuen gen B11, sehingga aman digunakan karena tidak memotong gen sisipan. Konfirmasi kemungkinan potongan pada gen sisipan dilakukan terlebih dahulu menggunakan sofware NEB cutter. Plasmid pBIN rekombinan berhasil dirakit dengan ukuran 12488 (pBIN-E), 12788 (pBIN-F), dan 12861 pb (pBIN-I dan pBIN-K).
Transformasi Padi dengan Gen B11 dan Evaluasi Hasil Transformasi
Transformasi dengan Particle Bombardment
Tingginya persentase planlet albino akibat paparan kanamisin sebagai agen seleksi menjadi masalah tersendiri pada transformasi padi dengan gen B11 dalam pBIN. Plasmid pBIN memiliki marka seleksi berupa gen npt, noemycin phosphotransferase, yaitu gen penyandi resistensi terhadap kanamisin. Namun ternyata padi sangat rentan terhadap paparan kanamisin. Hal ini yang menyebabkan rendahnya persentase keberhasilan transformasi akibat peristiwa albino. Walaupun saat dikultur pada media kultur jaringan mampu tumbuh, saat dikeluarkan dari media dan ditanam di tanah tanaman albino tidak mampu berfotosintesis, dan akhirnya tanaman mati.
Respon padi terhadap paparan antibiotik diamati juga oleh Pipatpanukul
Penggunaan dua jenis antibiotik ini dapat mencegah terjadinya albino pada planlet padi walaupun marka antibiotik yang terkandung pada plasmid rekombinan adalah npt.
Evaluasi melalui uji toleransi Al didukung uji integrasi mulai dari generasi T1 hingga T3 menunjukkan peningkatan toleransi terhadap cekaman Al pada tanaman transgenik dibandingkan tipe liarnya. Hal ini sejalan dengan penelitian Roslim (2011) pada tembakau transgenik B11. Secara empiris, benar bahwa gen B11 memegang peranan dalam peningkatan toleransi Al, namun mekanisme fisiologis B11 masih belum diketahui. Analisis bioinformatika yang dilakukan Roslim (2011) menyatakan bahwa B11 merupakan protein yang mirip dengan protein L32 ribosomal bakteri dan diprediksi berperan sebagai faktor transkripsi dengan domain bZIP dan motif seperti C2H2-zinc finger yang aktivitasnya diinduksi oleh keberadaan ion Al.
Analisis ekspresi pada tanaman T3 menunjukkan peningkatan ekspresi relatif pada T3 13, 23, dan 14 (kecuali T3-16) dibandingkan tipe liarnya (WT). Namun, tingkat ekspresi ini masih belum sesuai harapan, mengingat promoter yang digunakan adalah promoter konstitutif (35S CaMV). Hal ini sebenarnya dapat saja terjadi karena tingkat ekspresi pada tanaman transgenik mengikuti sebaran normal (Chaidamsari et al. 2006). Peluang tingkat ekspresi tinggi akan lebih kecil dibandingkan ekspresi sedang, dan tingkat ekspresi sedang akan lebih kecil dibandingkan tingkat ekspresi rendah, sehingga untuk mendapatkan tanaman transgenik dengan tingkat ekspresi yang tinggi, perlu dilakukan peningkatan jumlah material yang ditransformasi. Semakin banyak yang ditransformasi, semakin besar peluang mendapatkan tanaman dengan ekspresi tinggi.
Infeksi A. tumefaciens pada Kalus Padi dan Embrio Muda
Masalah albino yang dihadapi pada penggunaan plasmid pBIN mendorong penggunaan konstruk B11 dalam pGWB5 hasil pekerjaan Roslim (2011) untuk infeksi menggunakan bantuan A. tumefaciens. Plasmid pGWB5 (Gambar 30) memiliki fitur yang lebih lengkap dibandingkan pBIN (Nakagawa
dalam sistem Gateway® (Invitrogen, USA). Plasmid ini memiliki tambahan marka seleksi berupa kaset hpt, higromycin phosphotransferase, penyandi resistensi higromisin yang memungkinkan seleksi menggunakan higromisin. Higromisin merupakan agen seleksi yang lebih cocok dan banyak digunakan dalam transformasi padi (Tyagi et al. 2007, Hiei & Komari 2008, Ozawa 2009). Selain itu, pGWB5 juga memiliki gen reporter berupa GFP yang memungkinkan fusi dengan protein gen yang disisipkan sehingga dapat berpendar jika diamati dibawah mikroskop fluoresens.
Gambar 30 Peta plasmid pGWB5 (Nakagawa et al. 2007).
Hasil infeksi A. tumefaciens pada kalus T309 menghasilkan planlet resisten antibiotik yang cukup banyak dibandingkan dengan penembakan partikel. Dari 20 nomor T0 dari hasil infeksi yang diambil secara acak, 2 nomor adalah positif transgenik, sehingga efisiensi transformasi sebesar 10%.
Hasil transformasi padi IR64 tidak menghasilkan planlet yang resisten antibiotik. Kalus terlihat menghijau saat berada di media seleksi, namun tidak mengalami regenerasi hingga akhirnya mengering dan mati. Transformasi pada IR64 tidak dapat dilakukan dengan perendaman kalus pada suspensi
Agrobacterium dengan prosedur standar. Hal ini diduga Agrobacterium tidak mampu menginfeksi kalus IR64 yang rekalsitran tanpa adanya luka terlebih dahulu.
padi (Guo et al. 2011), namun karena penyediaannya sangat menyita waktu dan masa panennya pendek, embrio muda menjadi kurang populer dibandingkan penggunaan kalus sebagai bahan transformasi. Teknik ini cocok digunakan untuk genotipe yang rekalsitran seperti IR64 (Hiei & Komari 2008). Infeksi yang dilakukan hingga tahap seleksi menunjukkan hasil yang baik. Beberapa kalus tetap tumbuh sementara kalus lain mencoklat lalu mengering. Namun masalah timbul saat regenerasi. Kalus yang tidak diinfeksi menunjukkan perkembangan yang cepat, hingga akhirnya berhasil beregenerasi. Namun, kalus hasil infeksi mengalami pertumbuhan yang stagnan. Penggunaan konsentrasi higromisin yang tinggi (mencapai 75 ppm) diduga sebagai penyebab terhambatnya pertumbuhan hingga akhirnya mengering dan mati. Selain itu, perlu dilakukan optimasi terlebih dahulu pada kecepatan perlakuan sentrifugasi dan suhu pre-heating sebelum embrio diinfeksi.
Infeksi A. tumefaciens secara In-Planta
Sasaran dalam infeksi secara in-planta pada biji adalah sel-sel apikal meristem yang terdapat pada embrio, lebih tepatnya pada meristem apikal pada plumula (Lin et al. 2009). Sel ini berkontribusi pada pembentukan polen dan ovum untuk generasi selanjutnya. Namun, embrio pada biji dapat dipastikan telah membentuk primordia organ yang telah terlebih dahulu terdiferensiasi. Apabila A. tumefaciens menginfeksi pada daerah primordia yang sudah terdiferensiasi, maka besar kemungkinan tanaman T0 yang dihasilkan kimera, sehingga pada generasi T0 dibutuhkan seleksi ketat untuk memperoleh biji T1 transgenik.
non-transgenik (kimera). Namun ada juga kemungkinan bahwa keseluruhan anakannya dapat transgenik seperti yang terjadi pada IR64-19 dan GR-3.
Analisis T0 juga harus dilakukan pada tajuk (dapat berupa daun bendera atau dapat pula daun kedua di bawah malai). Hal ini dilakukan untuk memastikan bahwa jaringan yang diambil untuk seleksi berasal dari germ cell. Dengan demikian, material genetik antara jaringan yang diambil untuk seleksi dengan yang terkandung dalam biji T1 sama (Supartana et al. 2005).
Teknik lain untuk menyeleksi T0 adalah dengan melakukan perendaman daun bendera pada agen seleksi. Seperti yang dilakukan oleh Lin
et al. (2009) menggunakan higro