UJI KARAKTERISTIK ORALLY DISINTEGRATING
TABLET (ODT) IBUPROFEN YANG DIFORMULASI
DENGAN PROSES LIOFILISASI MENGGUNAKAN
GELATIN DAN MANITOL
SKRIPSI
OLEH:
DITYA FATMA
NIM 091501005
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI KARAKTERISTIK ORALLY DISINTEGRATING
TABLET (ODT) IBUPROFEN YANG DIFORMULASI
DENGAN PROSES LIOFILISASI MENGGUNAKAN
GELATIN DAN MANITOL
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
DITYA FATMA
NIM 091501005
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
UJI KARAKTERISTIK ORALLY DISINTEGRATING TABLET (ODT) IBUPROFEN YANG DIFORMULASI DENGAN PROSES LIOFILISASI
MENGGUNAKAN GELATIN DAN MANITOL OLEH:
DITYA FATMA NIM 091501005
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 27 Juli 2013 Pembimbing I, Panitia Penguji:
Prof. Dr. Karsono, Apt. Prof. Dr. Julia Reveny, M.Si., Apt. NIP 195409091982011001 NIP 195807101986012001
Pembimbing II, Prof. Dr. Karsono, Apt. NIP 195409091982011001
Dra. Juanita Tanuwijaya, M.Si., Apt. Dr. Kasmirul Ramlan Sinaga, M.S., Apt. NIP 195111021977102001 NIP 195504241983031003
Dra. Fat Aminah, M.Sc., Apt. NIP 195212041980021001
Medan, Agustus 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah Yang Maha Kuasa yang telah melimpahkan rahmat, karunia, dan ridha-Nya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Uji Karakteristik Orally Disintegrating Tablet (ODT) Ibuprofen yang Diformulasi dengan Proses Liofilisasi Menggunakan Gelatin dan Manitol”. Shalawat dan salam kepada Rasullullah SAW sebagai suri tauladan dalam hidup. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Tujuan penelitian ini adalah untuk mengetahui karakteristik ODT yang diformulasikan dengan proses liofilisasi menggunakan kombinasi gelatin dan manitol sebagai matriks serta mengetahui pengaruh bahan tambahan dan proses formulasi terhadap ODT yang diperoleh. Hendaknya hasil penelitian ini dapat digunakan sebagai informasi bagi industri farmasi di Indonesia dalam memproduksi ODT dan dapat dimanfaatkan oleh peneliti selanjutnya untuk perkembangan ilmu pengetahuan, khususnya di bidang farmasi.
Selama menyelesaikan penelitian dan skripsi ini penulis telah banyak mendapat bantuan dan dorongan dari berbagai pihak. Untuk itu penulis ingin menyampaikan ucapan terima kasih serta penghargaan yang tiada terhingga kepada:
kesabaran kepada penulis selama melakukan penelitian hingga selesainya penulisan skripsi ini.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan beserta para Pembantu Dekan Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan fasilitas dan sarana.
3. Ibu Dra. Saodah, M.Sc., Apt., sebagai penasehat akademik atas nasehat dan bimbingan selama proses perkuliahan.
4. Bapak Prof. Dr. M. Timbul Simanjuntak, M.Sc., Apt., Ibu Prof. Dr. Julia Reveny, M.Si., Apt., Bapak Dr. Kasmirul Ramlan Sinaga, M.S., Apt., dan Ibu Dra. Fat Aminah, M.Sc., Apt., sebagai panitia penguji atas segala arahan dan masukan yang sangat berarti dalam penyempurnaan skripsi ini.
5. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, Apt., Kepala Laboratorium Penelitian Fakultas Farmasi USU, dan Ibu Dra. Fat Aminah, M.Sc., Apt., Kepala Laboratorium Teknologi Formulasi Sediaan Farmasi II Fakultas Farmasi USU beserta staf, laboran dan asisten atas seluruh bantuan dan fasilitas yang diberikan selama penelitian.
7. Bapak dan Ibu dosen pengajar Fakultas Farmasi USU yang telah mendidik penulis selama perkuliahan.
8. PT Dexa Medica yang telah memberi bantuan bahan untuk memperlancar pengerjaan skripsi.
Terima kasih sedalam-dalamnya penulis sampaikan kepada Ayahanda Haryadi Boerhan dan Ibunda Rahmawati MS tercinta, atas segala doa, perhatian, dukungan, dan pengorbanan baik moril maupun materiil yang tidak pernah putus kepada penulis sehingga dapat menyelesaikan skripsi ini.
Terakhir penulis juga mengucapkan terima kasih kepada rekan-rekan penulis angkatan 2009 dan seluruh rekan yang tidak dapat disebutkan satu-persatu atas doa, dukungan dan bantuan yang diberikan kepada penulis.
Penulis menyadari bahwa skripsi ini masih belum sempurna, maka diharapkan masukan berupa kritik dan saran yang membangun demi penyempurnaan skripsi ini. Akhir kata, harapan penulis semoga skripsi ini bermanfaat bagi kita semua dan dapat menjadi sumbangan yang berarti bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, 23 Juni 2013 Penulis
UJI KARAKTERISTIK ORALLY DISINTEGRATING TABLET (ODT) IBUPROFEN YANG DIFORMULASI DENGAN PROSES LIOFILISASI
MENGGUNAKAN GELATIN DAN MANITOL Abstrak
Orally disintegrating tablet (ODT) adalah bentuk sediaan padat yang mengandung bahan aktif obat yang hancur kurang dari 60 detik tanpa memerlukan air ketika diletakkan di atas lidah. Ibuprofen yang praktis tidak larut air menunjukkan bioavailabilitas rendah. Salah satu proses yang dapat mengatasi hal ini dalam formulasi ODT adalah proses liofilisasi yang dapat mengubah bentuk kristal senyawa obat menjadi bentuk amorf. Adapun tujuan penelitian ini adalah untuk mengetahui karakteristik ODT yang dihasilkan, pengaruh proses pembuatan dan penambahan eksipien.
ODT ibuprofen dibuat dengan proses liofilisasi menggunakan bahan-bahan yang mudah larut dalam air yaitu gelatin 5% dan manitol dengan perbandingan 0:200 (F1); 50:150 (F2); 100:100 (F3); 150:50 (F4); 200:0 (F5) dengan cara dimasukkan campuran masing-masing formula ke dalam blister (d = 13 mm) hingga bobot 400 mg/tablet, kemudian dibekukan di dalam freezer
dan diletakkan tablet beku di dalam freeze dryer untuk menghilangkan air. Tablet yang dihasilkan dievaluasi dengan menggunakan parameter: kekerasan, friabilitas, waktu hancur dengan disintegration tester USP, waktu hancur dengan alat termodifikasi, waktu hancur di rongga mulut, waktu pembasahan, absorbsi air, penetapan kadar bahan aktif, keseragaman sediaan dan disolusi.
Hasil penelitian menunjukkan bahwa ODT ibuprofen yang dibuat dengan proses liofilisasi menggunakan campuran gelatin 5% dan manitol memenuhi persyaratan kadar zat berkhasiat, keseragaman sediaan, kekerasan, friabilitas, waktu hancur menggunakan disintegration tester USP, waktu hancur di rongga mulut, dan disolusi, kecuali untuk formula F5 tidak menghasilkan bentuk fisik tablet yang utuh. Formula ODT dengan jumlah gelatin 5% lebih banyak memperlihatkan waktu hancur yang lebih cepat (19 detik untuk F1; 29,2 detik untuk F2; 36 detik untuk F3; dan 57,5 detik untuk F4). Berbanding terbalik dengan kekerasan tablet, dimana formula ODT dengan jumlah manitol yang lebih banyak membentuk tablet dengan kekerasan yang lebih tinggi. Uji pelepasan obat secara in vitro pada semua formula ODT pada menit ke-1 sudah memiliki persen kumulatif yang tinggi dimana pada formula F1 97,77%; F2 89,66%; F3 87,80%; F4 72,97%, berbeda jauh dengan baku ibuprofen yang pada menit ke-1 hanya melepaskan 27,15%. Dari uji ANOVA dengan program SPSS 15.0 (p < 0,05) diketahui adanya perbedaan signifikan profil disolusi dari semua formula ODT dengan baku ibuprofen.
CHARACTERISTICS TEST OF IBUPROFEN ORALLY DISINTEGRATING TABLETS (ODTs) THAT FORMULATED BY LYOPHILIZATION PROCESS USING GELATINE AND MANNITOL
Abstract
Orally disintegration tablets are solid dosage forms containing active pharmaceutical ingredient which disintegrate rapidly usually less than 60 seconds without need a water when placed on the tongue. Ibuprofen, which is practically water insoluble, shows low bioavailability. One of technique that can solve this problem in ODTs formulation is lyophilization that can change the crystalline form of drug into amorf form. The aim of this study are determining the characteristics of ODTs product, the effect of formulation technique and excipients adding.
Ibuprofen ODTs were formulated by using water soluble matrix consisting gelatine 5% and mannitol in the ratio 0:200 (F1); 50:150 (F2); 100:100 (F3); 150:50 (F4); 200:0 (F5) in way poured mixture into each of the pockets of tablet blister (d = 13 mm) to contain weight 400 mg/tablet, then freezed in the freezer and placed frozen tablets in a freeze dryer to remove water. The resulting tablets were evaluated using parameters: hardness, friability, disintegration time using disintegration tester USP, disintegration time modified tester, disintegration time in the oral cavity, wetting time, water absorption, assay, dosage uniformity and dissolution.
The results showed that ibuprofen ODTs, were prepared by lyophilization process using a mixture of gelatine 5% and mannitol as matrix, fulfilled the requirements for active ingredient, dosage uniformity, hardness, friability, disintegration time using disintegration tester USP, disintegration time in the oral cavity and dissolution except for F5 formula didn’t produce physical shape intact tablet. ODTs using more amount of gelatine 5% showed faster disintegration time (19 s (F1); 29.2 s (F2); 36 s (F3) and 57.5 s (F4)). Inversely, more amount of mannitol used in ODTs formulas, higher tablet hardness was resulted. In vitro drug release of all formulation ODTs showed high drug release in the first minute where the F1 97.77%; F2 89.66%, 87.80% F3; F4 72.97%, much different with pure ibuprofen released only 27.15%. From ANOVA test using SPSS program 15.0 (p < 0,05) showed that presence of significant differences dissolution profiles between all ODTs formulas with pure ibuprofen.
Ibuprofen ODTs that were formulated by liophilization process, have fast disintegration time characteristics and optimal tablet hardness. Formulation process produces a changging the crystalline towards the amorphous form. Gelatine 5% acts as a binder and a disintegrant while mannitol affects the ODT hardness.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Orally Disintegrating Tablets (ODT) ... 6
2.2 Karakteristik Ideal ODT ... 7
2.3 Kelebihan ODT ... 8
2.4 Metode Formulasi ODT ... 9
2.4.2 Prinsip liofilisasi ... 10
2.4.3 Proses formulasi menggunakan teknik liofilisasi ... 11
2.4.4 Keunggulan liofilisasi ... 12
2.5 Ibuprofen sebagai Model Obat ... 12
2.6 Eksipien ... 14
2.7 Uraian Tentang Manitol ... 18
2.8 Uraian Tentang Gelatin ... 21
BAB III METODE PENELITIAN ... 25
3.1 Alat-alat ... 25
3.2 Bahan-bahan ... 25
3.3 Prosedur Kerja ... 25
3.3.1 Pembuatan pereaksi ... 25
3.3.1.1 Air bebas karbondioksida ... 25
3.3.1.2 Natrium hidroksida 0,1 N ... 26
3.3.1.3 Natrium hidroksida 0,2 N ... 26
3.3.1.4 Kalium fosfat monobasa 0,2 M ... 26
3.3.1.5 Dapar fosfat pH 7,2 ... 26
3.3.2 Pembuatan kurva serapan ibuprofen ... 26
3.3.2.1 Dalam medium NaOH 0,1 N ... 26
3.3.2.2 Dalam medium dapar fosfat pH 7,2 ... 27
3.3.3 Pembuatan kurva kalibrasi ibuprofen ... 27
3.3.3.1 Dalam medium NaOH 0,1 N ... 27
3.3.4 Pembuatan orally disintegrating tablet (ODT)
ibuprofen proses liofilisasi ... 28
3.3.5 Karakterisasi orally disintegrating tablet ibuprofen proses liofilisasi ... 29
3.3.5.1 Penetapan kadar ibuprofen dalam tablet ... 29
3.3.5.2 Uji kekerasan tablet ... 29
3.3.5.3 Uji friabilitas (kerapuhan) tablet ... 30
3.3.5.4 Uji waktu hancur ... 30
3.3.5.4.1 Uji waktu hancur menggunakan disintegration tester ... 30
3.3.5.4.2 Uji waktu hancur dengan alat termodifikasi ... 31
3.3.5.4.3 Uji waktu hancur dalam rongga mulut ... 31
3.3.5.5 Uji waktu pembasahan ... 31
3.3.5.6 Uji Absorbsi Air ... 32
3.3.5.7 Uji keseragaman sediaan (keragaman bobot) 32
3.3.5.8 Analisa pola difraksi sinar –X ... 33
3.3.5.9 Uji disolusi tablet (profil pelepasan bahan obat) ... 33
3.4 Analisis Data Secara Statistik ... 35
3.4.1 Uji statistik terhadap evaluasi waktu hancur ... 35
3.4.2 Uji statistik terhadap profil pelepasan obat ... 36
BAB IV HASIL DAN PEMBAHASAN ... 37
4.2 Hasil Penentuan Serapan Maksimum dan Linieritas Kurva
Kalibrasi Ibuprofen dalam Larutan Dapar Fosfat pH 7,2 ... 39
4.3 Hasil Evaluasi ODT Ibuprofen ... 40
4.3.1 Hasil penetapan kadar ibuprofen dalam tablet ... 41
4.3.2 Hasil uji kekerasan tablet ... 41
4.3.3 Hasil uji kerapuhan tablet ... 42
4.3.4 Hasil uji waktu hancur ... 43
4.3.5 Hasil uji waktu pembasahan ... 46
4.3.6 Hasil uji absorbsi air ... 48
4.3.7 Hasil uji keseragaman sediaan ... 49
4.3.8 Hasil analisis pola difraksi sinar –X ... 49
4.3.9 Hasil uji disolusi tablet (profil pelepasan bahan obat) ... 52
4.3.9.1 Hasil uji ANOVA dan Duncan disolusi formula ODT menit ke-1 ... 54
4.3.9.2 Hasil uji ANOVA dan Duncan disolusi formula ODT menit ke-3 ... 56
4.3.9.2 Hasil uji ANOVA dan Duncan disolusi formula ODT menit ke-7 ... 57
BAB V KESIMPULAN DAN SARAN ... 59
5.1 Kesimpulan ... 59
5.2 Saran ... 60
DAFTAR PUSTAKA ... 61
DAFTAR TABEL
Halaman
Tabel 2.1 Komposisi asam amino pada gelatin ... 22
Tabel 2.2 Perbedaan gelatin A dan B ... 24
Tabel 3.1 Formula sediaan ODT ibuprofen proses liofilisasi menggunakan kombinasi gelatin 5 % dan manitol sebagai matriks dengan berbagai variasi konsentrasi ... 29
Tabel 3.2 Kriteria penerimaan uji disolusi ... 34
Tabel 4.1 Data hasil penetapan kadar tablet ibuprofen ... 41
Tabel 4.2 Hasil uji ANOVA waktu hancur in vitro formula ODT ... 45
Tabel 4.3 Hasil uji duncan waktu hancur in vitro formula ODT ... 45
Tabel 4.4 Hasil uji ANOVA waktu hancur termodifikasi formula ODT ... 46
Tabel 4.5 Hasil uji duncan waktu hancur dengan alat termodifikasi formulasi ODT ... 46
Tabel 4.6 Hasil uji rasio absorbsi air (wetting time) ... 48
Tabel 4.7 Hasil uji keragaman bobot berbagai formula ODT ibuprofen ... 49
Tabel 4.8 Hasil persen kumulatif rata-rata uji disolusi bahan baku dan ODT ibuprofen ... 53
Tabel 4.9 Hasil uji ANOVA disolusi ODT menit ke-1 ... 55
Tabel 4.10 Hasil uji Duncan disolusi ODT menit ke-1 ... 55
Tabel 4.11 Hasil uji ANOVA disolusi ODT menit ke-3 ... 56
Tabel 4.12 Hasil uji Duncan disolusi ODT menit ke-3 ... 56
Tabel 4.13 Hasil uji ANOVA disolusi ODT menit ke-5 ... 57
DAFTAR GAMBAR
Halaman
Gambar 2.1 Rumus bangun ibuprofen ... 12
Gambar 2.2 Proses mengembang ... 16
Gambar 2.3 Proses aksi porositas dan kapilaritas ... 17
Gambar 2.4 Proses gaya repulsif partikel ... 17
Gambar 2.5 Proses deformasi ... 18
Gambar 2.6 Rumus bangun D-manitol ... 19
Gambar 4.1 Kurva serapan ibuprofen dengan konsentrasi 230 mcg/ml dalam larutan NaOH 0,1 N ... 37
Gambar 4.2 Data panjang gelombang maksimum dan absorbansi ibuprofen dengan konsentrasi 230 mcg/ml secara spektrofotometri ultraviolet ... 38
Gambar 4.3 Kurva kalibrasi ibuprofen (PT Dexa Medica) dalam pelarut NaOH 0,1 N pada panjang gelombang 264,5 nm 39
Gambar 4.4 Kurva serapan ibuprofen dengan konsentrasi 8 mcg/ml dan panjang gelombang maksimum secara spektrofotometri ultraviolet ... 39
Gambar 4.5 Kurva kalibrasi ibuprofen dalam daparfosfat pH 7,2 ... 39
Gambar 4.6 Tablet hasil proses liofilisasi dari berbagai formula ... 40
Gambar 4.7 Diagram hasil uji kekerasan tablet ... 42
Gambar 4.8 Diagram hasil uji kerapuhan tablet ... 43
Gambar 4.9 Diagram hasil berbagai uji waktu hancur ... 44
Gambar 4.10 Diagram hasil uji waktu pembasahan ... 47
Gambar 4.12 Grafik hasil difraksi sinar –X dari: (a) ibuprofen
(b) ODT F1 (c) ODT F2 (d) ODT F3 (e) ODT F4 ... 52 Gambar 4.13 Grafik hasil persen kumulatif rata-rata disolusi bahan
DAFTAR LAMPIRAN
Halaman Lampiran 1. Perhitungan pembuatan orally disintegrating tablet
ibuprofen ... 66
Lampiran 2. Kurva kalibrasi ibuprofen dalam NaOH 0,1 N ... 68
Lampiran 3. Data uji penetapan kadar ODT ibuprofen ... 69
Lampiran 4. Analisis dat statistik untuk mencari kadar sebenarnya dari ibuprofen dalam formulasi ODT ... 72
Lampiran 5. Data simpangan baku kadar ODT ibuprofen ... 77
Lampiran 6. Data hasil uji friabilitas (kerapuhan) tablet ... 78
Lampiran 7. Data hasil pengujian kekerasan tablet ... 79
Lampiran 8. Data hasil pengujian waktu hancur ... 80
Lampiran 9. Data hasil pengujian waktu pembasahan ... 81
Lampiran 10. Data perhitungan rasio absorbsi air ODT ibuprofen ... 82
Lampiran 11. Perhitungan keragaman bobot ... 83
Lampiran 12. Data uji keragaman bobot ODT ibuprofen hasil proses liofilisasi ... 86
Lampiran 13. Kurva kalibrasi ibuprofen dalam dapar fosfat pH 7,2 ... 90
Lampiran 14. Contoh Perhitungan hasil disolusi ... 91
Lampiran 15. Data disolusi baku ibuprofen dan semua formula ODT 93
Lampiran 16. Data persen kumulatif disolusi bahan baku dan semua formula ODT ibuprofen ... 108
Lampiran 17. Uji ANOVA disolusi ODT menit ke 1, 3, dan 5 ... 111
Lampiran 19. Foto waktu hancur in vivo (di dalam mulut) ... 116 Lampiran 20. Sertifikat analisis bahan baku ibuprofen
UJI KARAKTERISTIK ORALLY DISINTEGRATING TABLET (ODT) IBUPROFEN YANG DIFORMULASI DENGAN PROSES LIOFILISASI
MENGGUNAKAN GELATIN DAN MANITOL Abstrak
Orally disintegrating tablet (ODT) adalah bentuk sediaan padat yang mengandung bahan aktif obat yang hancur kurang dari 60 detik tanpa memerlukan air ketika diletakkan di atas lidah. Ibuprofen yang praktis tidak larut air menunjukkan bioavailabilitas rendah. Salah satu proses yang dapat mengatasi hal ini dalam formulasi ODT adalah proses liofilisasi yang dapat mengubah bentuk kristal senyawa obat menjadi bentuk amorf. Adapun tujuan penelitian ini adalah untuk mengetahui karakteristik ODT yang dihasilkan, pengaruh proses pembuatan dan penambahan eksipien.
ODT ibuprofen dibuat dengan proses liofilisasi menggunakan bahan-bahan yang mudah larut dalam air yaitu gelatin 5% dan manitol dengan perbandingan 0:200 (F1); 50:150 (F2); 100:100 (F3); 150:50 (F4); 200:0 (F5) dengan cara dimasukkan campuran masing-masing formula ke dalam blister (d = 13 mm) hingga bobot 400 mg/tablet, kemudian dibekukan di dalam freezer
dan diletakkan tablet beku di dalam freeze dryer untuk menghilangkan air. Tablet yang dihasilkan dievaluasi dengan menggunakan parameter: kekerasan, friabilitas, waktu hancur dengan disintegration tester USP, waktu hancur dengan alat termodifikasi, waktu hancur di rongga mulut, waktu pembasahan, absorbsi air, penetapan kadar bahan aktif, keseragaman sediaan dan disolusi.
Hasil penelitian menunjukkan bahwa ODT ibuprofen yang dibuat dengan proses liofilisasi menggunakan campuran gelatin 5% dan manitol memenuhi persyaratan kadar zat berkhasiat, keseragaman sediaan, kekerasan, friabilitas, waktu hancur menggunakan disintegration tester USP, waktu hancur di rongga mulut, dan disolusi, kecuali untuk formula F5 tidak menghasilkan bentuk fisik tablet yang utuh. Formula ODT dengan jumlah gelatin 5% lebih banyak memperlihatkan waktu hancur yang lebih cepat (19 detik untuk F1; 29,2 detik untuk F2; 36 detik untuk F3; dan 57,5 detik untuk F4). Berbanding terbalik dengan kekerasan tablet, dimana formula ODT dengan jumlah manitol yang lebih banyak membentuk tablet dengan kekerasan yang lebih tinggi. Uji pelepasan obat secara in vitro pada semua formula ODT pada menit ke-1 sudah memiliki persen kumulatif yang tinggi dimana pada formula F1 97,77%; F2 89,66%; F3 87,80%; F4 72,97%, berbeda jauh dengan baku ibuprofen yang pada menit ke-1 hanya melepaskan 27,15%. Dari uji ANOVA dengan program SPSS 15.0 (p < 0,05) diketahui adanya perbedaan signifikan profil disolusi dari semua formula ODT dengan baku ibuprofen.
CHARACTERISTICS TEST OF IBUPROFEN ORALLY DISINTEGRATING TABLETS (ODTs) THAT FORMULATED BY LYOPHILIZATION PROCESS USING GELATINE AND MANNITOL
Abstract
Orally disintegration tablets are solid dosage forms containing active pharmaceutical ingredient which disintegrate rapidly usually less than 60 seconds without need a water when placed on the tongue. Ibuprofen, which is practically water insoluble, shows low bioavailability. One of technique that can solve this problem in ODTs formulation is lyophilization that can change the crystalline form of drug into amorf form. The aim of this study are determining the characteristics of ODTs product, the effect of formulation technique and excipients adding.
Ibuprofen ODTs were formulated by using water soluble matrix consisting gelatine 5% and mannitol in the ratio 0:200 (F1); 50:150 (F2); 100:100 (F3); 150:50 (F4); 200:0 (F5) in way poured mixture into each of the pockets of tablet blister (d = 13 mm) to contain weight 400 mg/tablet, then freezed in the freezer and placed frozen tablets in a freeze dryer to remove water. The resulting tablets were evaluated using parameters: hardness, friability, disintegration time using disintegration tester USP, disintegration time modified tester, disintegration time in the oral cavity, wetting time, water absorption, assay, dosage uniformity and dissolution.
The results showed that ibuprofen ODTs, were prepared by lyophilization process using a mixture of gelatine 5% and mannitol as matrix, fulfilled the requirements for active ingredient, dosage uniformity, hardness, friability, disintegration time using disintegration tester USP, disintegration time in the oral cavity and dissolution except for F5 formula didn’t produce physical shape intact tablet. ODTs using more amount of gelatine 5% showed faster disintegration time (19 s (F1); 29.2 s (F2); 36 s (F3) and 57.5 s (F4)). Inversely, more amount of mannitol used in ODTs formulas, higher tablet hardness was resulted. In vitro drug release of all formulation ODTs showed high drug release in the first minute where the F1 97.77%; F2 89.66%, 87.80% F3; F4 72.97%, much different with pure ibuprofen released only 27.15%. From ANOVA test using SPSS program 15.0 (p < 0,05) showed that presence of significant differences dissolution profiles between all ODTs formulas with pure ibuprofen.
Ibuprofen ODTs that were formulated by liophilization process, have fast disintegration time characteristics and optimal tablet hardness. Formulation process produces a changging the crystalline towards the amorphous form. Gelatine 5% acts as a binder and a disintegrant while mannitol affects the ODT hardness.
BAB I PENDAHULUAN 1.1Latar Belakang
Rute pemberian obat secara oral adalah rute paling umum dan nyaman digunakan oleh pasien. Tablet merupakan salah satu di antara sediaan oral yang banyak digunakan, terdapat 50-60% dari bentuk sediaan yang ada karena mempunyai keuntungan mudah dibawa, memiliki durasi aksi kerja obat yang dapat dikontrol, dan dengan teknik tertentu, rasa dan aromanya dapat diperbaiki. Namun pasien tertentu, seperti pediatri, geriatri, pasien stroke dan psikiatri seringkali mengalami kesulitan menelan tablet konvensional secara utuh walaupun telah minum air (Thakur dan Kashi, 2011; Darkwah, 2011). Oleh karena itu, praktisi medis dan farmasi dituntut agar turut mempertimbangkan masalah ini dalam mengembangkan formulasi obat agar diperoleh sediaan yang lebih cepat larut sehingga dapat meningkatkan laju absorpsi dan bioavailabilitas.
yang tinggi, sehingga berpotensi meningkatkan kepatuhan pasien dalam menggunakan obat (Alhusban, et al., 2010; Fu, et al., 2004; Andersen, et al., 1995).
Disintegrasi merupakan salah satu faktor penting untuk tablet yang rute penggunaannya per oral. Namun, proses disintegrasi saja belum menggambarkan pelarutan sempurna dari suatu obat, terlebih untuk obat-obat yang mempunyai kelarutan rendah dalam air (poorly soluble drug), sepeti ibuprofen yang memiliki sifat praktis tidak larut dalam air, disolusi merupakan faktor yang lebih penting dibandingkan disintegrasi sehingga kecepatan disolusi merupakan tahap penentu (rate limiting step) pada proses absorbsi obat yang memungkinkan untuk mengkorelasikannya dengan ketersediaan hayati dari bahan aktif (Abdou, 1989; Niazi, 2009; Shargel dan Yu, 2005; Ditjen POM, 1995).
Sejauh ini, ada beberapa metode yang dapat digunakan dalam pembuatan ODT yaitu freeze drying (liofilisasi), tablet molding, metode pencetakan konvensional, tablet loading, dan sublimasi (Shukla, et al., 2009; Jones, 2011). Dari beberapa teknologi tersebut, freeze drying (liofilisasi) dianggap yang paling sukses karena dapat memaksimalkan struktur berpori dari matriks tablet sehingga memperlihatkan waktu disintegrasi dan disolusi yang cepat ketika saliva berpenetrasi melalui matriks tablet (Alhusban, et al., 2010; Jones, et al., 2011).
yang sangat rendah, sehingga telah digunakan untuk mengeringkan produk yang termolabil (Ansel, 1976). Kelebihan lainnya, teknik ini dapat meningkatkan kelarutan untuk obat-obat yang mempunyai kelarutan rendah dalam air. Menurut Keshavarao, et al. (2011), hal ini dapat terjadi karena ketika proses liofilisasi terjadi, banyak bentuk amorf dari bahan aktif yang terbentuk. Pendekatan selanjutnya adalah penggunaan bahan tambahan yang mudah larut air dalam formulasi ODT liofilisasi, yaitu gelatin dan manitol. Gelatin, merupakan salah satu protein, yang telah digunakan secara luas sebagai pengikat untuk memberikan bentuk dan kekuatan struktur tablet setelah proses liofilisasi. Hal ini berhubungan dengan kekuatan gel (bloom), semakin tinggi kekuatan gel maka semakin keras tablet yang dihasilkan. Gelatin dapat digunakan pula sebagai penghancur karena dapat membentuk struktur berpori banyak dari bentuk sediaan obat. Manitol (gula alkohol) digunakan dalam formulasi tablet karena memberikan rasa manis, sensasi dingin di mulut, memiliki sifat higroskopis yang rendah, dan dapat mengkristal dengan mudah sehingga sesuai digunakan sebagai bahan pengisi dalam formulasi tablet dengan proses liofilisasi yang dapat memperbaiki stabilitas, kekerasan dan penampilan tablet. Serta air digunakan sebagai media dalam proses pembuatan ODT yang dapat menginduksi struktur berpori selama sublimasi pada tahap liofilisasi (Alhusban, et al., 2010; Jones, et al., 2011).
waktu hancur, kerapuhan (friabilitas), waktu pembasahan, dan absorbsi air, serta mengetahui kegunaan dan pengaruh yang diberikan bahan tambahan serta proses pembuatan terhadap ODT yang dihasilkan.
1.2Rumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut:
a) Apakah orally disintegrating tablet (ODT) yang diformulasikan dengan proses liofilisasi menggunakan gelatin dan manitol sebagai matriks mampu memenuhi karakteristik ODT.
b) Apa kegunaan dan pengaruh yang diberikan gelatin dan manitol serta proses pembuatan terhadap ODT yang dihasilkan.
1.3Hipotesis
Berdasarkan perumusan masalah di atas maka dibuat hipotesis analisis sebagai berikut:
a) ODT yang diformulasikan dengan proses liofilisasi menggunakan kombinasi gelatin dan manitol sebagai matriks mampu memenuhi beberapa karakteristik ODT.
1.4Tujuan Penelitian
Tujuan penelitian ini adalah:
a) Untuk mengetahui karakteristik ODT yang diformulasikan dengan proses liofilisasi menggunakan kombinasi gelatin dan manitol sebagai matriks.
b) Untuk mengetahui pengaruh yang diberikan oleh gelatin dan manitol serta proses formulasi pada ODT yang diperoleh.
1.5Manfaat Penelitian
a) Hasil penelitian ini dapat digunakan sebagai informasi bagi industri farmasi
di Indonesia akan manfaat proses liofilisasi menggunakan kombinasi
gelatin dan manitol dalam memproduksi tablet ODT.
b) Hasil penelitian dapat dimanfaatkan oleh peneliti selanjutnya untuk
BAB II
TINJAUAN PUSTAKA 2.1 Orally Disintegrating Tablet (ODT)
Orally disintegrating tablet (ODT) adalah suatu bentuk sediaan padat mengandung senyawa aktif obat yang dapat hancur secara cepat, biasanya dalam hitungan detik, ketika diletakkan di atas lidah. Orally disintegrating tablet juga disebut dengan Oro-disperse, mouth dissolving, rapidly disintegrating, fast melt, dan quick dissolve (Kundu dan Sahoo, 2008). ODT telah mendapatkan perhatian sebagai alternatif pilihan dari tablet konvensional dan kapsul, karena dapat memberikan kepatuhan pasien yang lebih baik. Teknologi ODT memenuhi beberapa kebutuhan pasien dalam kenyamanan penggunaan obat seperti pada pasien geriatrik, pasien pediatrik dan pasien disfagia (Hirani, et al., 2009).
lambung sehingga ketersediaan hayati obat akan meningkat dan pada akhirnya juga meningkatkan efektivitas terapi.
2.2 Karakteristik Ideal ODT
Sediaan ODT berbeda dari tablet konvensional umumnya, maka sediaan ODT harus memiliki beberapa karakteristik yang ideal antara lain:
a. disintegrasi harus cepat. Secara umum, hal ini berarti bahwa tablet ODT harus terdisintegrasi dalam waktu kurang dari 1 menit. Namun demikian, akan lebih disukai bila disintegrasi terjadi secepat mungkin di dalam rongga mulut. Begitu juga ODT harus terdisintegrasi dengan sedikit atau tanpa meminum air sama sekali dan dimaksudkan untuk terdispersi dengan air ludah pasien sendiri.
b. penutupan rasa (taste-masking) dari senyawa aktif. Hal ini dikarenakan ODT akan mengalami disintegrasi di dalam mulut. Setelah melarut, sediaan diharapkan tidak meninggalkan residu serta rasa enak di mulut. Teknologi penutupan rasa yang ideal hendaknya mampu menghasilkan mouthfeel yang baik dan tidak memberikan sensasi berpasir (grittiness) di mulut.
c. kekerasan dan porositas tablet yang optimal. Oleh karena ODT dirancang untuk memiliki waktu disintegrasi dan disolusi yang cepat maka dibutuhkan zat tambahan (excipient) dan struktur tablet dengan porositas yang tinggi, yang dimaksudkan untuk absorpsi air yang cepat ke dalam tablet.
hal ini, diperlukan strategi pengemasan yang baik agar tablet terlindungi dari berbagai pengaruh lingkungan (Fu, et al., 2004).
2.3 Kelebihan ODT
ODT memiliki semua kelebihan dari bentuk sediaan solida, antara lain ketepatan dosis, kemudahan produksi dan praktis dibawa bepergian. ODT juga memiliki kelebihan lain seperti kemudahan penggunaan obat, tidak ada resiko sesak nafas (tersedak) akibat obstruksi fisik bentuk solida di tenggorokan (Fu, et al., 2004), kecepatan absorpsi dan onset kerja obat yang cepat, serta ketersediaan hayati yang tinggi serta rasa yang enak pada mulut sehingga membantu untukmengubah persepsi bahwa obat itu pahit pada anak-anak.
Berdasarkan hal-hal yang telah disebutkan di atas, zat aktif dapat diabsorpsi baik di daerah bucal, faring maupun esofagus selama larutan obat turun ke lambung. Karena absorpsi pra-gastrik akan menghindarkan zat aktif dari metabolisme lintas pertama di hati, maka dosis obat juga dapat dikurangi bila sejumlah besar zat aktif mengalami metabolisme tersebut selama pemberian tablet konvensional (Fu, et al., 2004). Oleh karena itu dalam kasus terapi tertentu, ODT merupakan obat pilihan untuk mendapatkan konsentrasi sistemik yang tinggi secara cepat atau high drug loading (Kundu dan Sahoo, 2008).
perjalanan, dimana diinginkan onset kerja obat yang cepat (Verma dan Garg, 2001; Bhowmik, et al., 2009).
2.4 Metode Formulasi ODT
Sifat ODT yang cepat larut (fast-dissolving) berasal dari jalan masuk air yang sangat singkat ke dalam matriks tablet sehingga mengakibatkan disintegrasi yang sangat cepat. Oleh karena itu, pendekatan mendasar dalam mengembangkan tablet jenis ini meliputi:
a. memaksimalkan struktur berpori dari matriks tablet.
b. menambahkan senyawa penghancur (disintegrant) yang tepat.
c. menggunakan zat tambahan (excipient) yang sangat mudah larut air dalam formulasi.
Sejauh ini, beberapa metode pembuatan ODT telah dikembangkan dengan berbagai prinsip dasar yang berbeda (Shukla, et al., 2009). Formulasi ODT dapat dibagi menjadi 2 bagian utama yaitu metode yang menggunakan proses pemanasan dan yang tidak menggunakan pemanasan. Menurut Goel, et al. (2008), metode yang menggunakan proses pemanasan antara lain: proses gula kapas (cotton candy process), tekanan leburan (melt extrusion), pencetakan tablet (tablet molding), dan sublimasi (sublimation). Sementara itu, metode yang tidak menggunakan proses pemanasan meliputi pengeringan beku (freeze drying), cetak langsung (direct compression) dan sistem effervescent (effervescent system).
umum memperlihatkan waktu disintegrasi dan disolusi yang cepat karena dapat memaksimalkan struktur berpori dari matriks tablet, sehingga memungkinkan penetrasi saliva melalui matriks tablet yang mengakibatkan tablet terdisintegrasi (Alhusban, et al., 2010; Jones, et al., 2011).
2.4.1 Pengertian liofilisasi
Liofilisasi merupakan suatu proses yang juga dikenal sebagai “freeze drying”, adalah suatu proses pengeringan material dengan menyublimasi air dari sampel beku pada tekanan yang sangat rendah. Secara umum, proses ini telah digunakan untuk mengeringkan produk yang termolabil (Ansel,1976). Oleh karena senyawa farmasi dapat diproses dengan tanpa adanya peningkatan temperatur, sehingga menghilangkan efek yang merugikan akibat pengaruh temperatur tinggi dan disimpan dalam keadaan kering sehingga masalah yang berkaitan dengan stabilitas produk dapat dihindari (Khan, et al., 2011).
2.4.2 Prinsip liofilisasi
Hal yang mendasari proses ini yaitu sampel dibekukan dan diterapkan secara vakum sehingga air akan tersublimasi tanpa meleleh. Oleh sebab itu, proses ini disebut freeze drying (pengeringan beku).
Secara fisik, bahan-bahan ini juga dapat membuat bahan aktif terperangkap di dalamnya selama proses freeze drying berlangsung (Darkwah, 2011).
Komponen besar kedua mencakup gula-gula (seperti sukrosa, laktosa, glukosa) dan poliol (seperti xylitol, manitol). Bahan-bahan ini bekerja untuk meningkatkan sifat mekanik dari ODT. Bagaimanapun pula, untuk mencapai sifat mekanik yang diinginkan, penambahan gula dan poliol dalam jumlah besar diperlukan (Chandrasekhar, et al., 2009; Seager, 1998).
2.4.3 Proses formulasi menggunakan teknik liofilisasi
Untuk membuat ODT menggunakan teknologi liofilisasi, bahan aktif farmasi didispersikan ke dalam matriks yang terdiri dari pembetuk struktur polimerik (seperti gelatin) dan sakarida (utamanya manitol) yang dilarutkan di dalam air. Selanjutnya, campuran bahan-bahan tesebut dibekukan menjadi es yang kemudian es tersebut akan diubah fasenya secara sublimasi pada suhu + 15ºC dengan suhu kondensor < -40ºC dan dalam keadaan vakum pada tekanan < 50 mTorr menggunakan freeze dryer (Alhusban, et al., 2010; Jones, et al., 2011).
transportasi. Oleh karena manitol mudah larut dalam air, sehingga dapat pula berfungsi untuk memperbaiki tekstur, rasa, dan kenyamanan di mulut (mouthfeel) (Alhusban, et al., 2010; Jones, et al., 2011).
2.4.4 Keunggulan liofilisasi
Keungulan liofilisasi dibandingkan metode lainnya, antara lain (Pujihastuti, 2009):
a. Dapat meningkatkan daya rehidrasi karena hasil liofilisasi menghasilkan pori-pori kecil yang banyak sehingga memperlihatkan peningkatan waktu disintegrasi yang cepat ketika kontak dengan saliva dan segera melepaskan obat dari bentuk sediaan.
b. Dapat mempertahankan stabilitas produk (menghindari perubahan aroma, warna, dan unsur organoleptik lain).
c. Dapat mempertahankan stabilitas struktur bahan (pengkerutan dan perubahan bentuk setelah pengeringan sangat kecil).
2.5 Ibuprofen Sebagai Model Obat
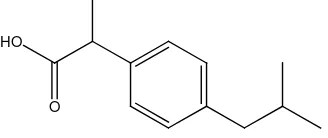
Ibuprofen ((±)-2-(p-isobutilfenil) asam propionat) dengan rumus molekul C
13H18O2 dan berat molekul 206,28. Rumus bangun ibuprofen seperti
yang ditunjukkan pada Gambar 2.1.
[image:31.595.224.388.608.677.2]O HO
Ibuprofen merupakan OAINS (Obat Anti Inflamsi Non Steroid) derivat asam fenil propionat, yang sering menunjukkan efek samping tukak peptik (tukak duodenum dan tukak lambung). Efek samping ini secara dominan disebabkan oleh penghambatan sintesis prostaglandin, yaitu senyawa yang disintesis di mukosa lambung untuk melindungi fungsi fisiologis tubuh, seperti mukosa lambung. Oleh sebab itu, ibuprofen dijadikan model obat untuk formulasi ODT pada penelitian ini. Alasan lainnya berkaitan dengan kelarutan ibuprofen yang praktis tidak larut dalam air (Ditjen POM, 2005; Misnadiarly, 2009).
Ibuprofen berupa serbuk hablur, putih hingga hampir putih, berbau khas lemah. Ibuprofen praktis tidak larut dalam air, sangat mudah larut dalam etanol, metanol, aseton dan dalam kloroform, sukar larut dalam etil asetat, larut dalam larutan alkali hidroksida dan karbonat (Ditjen POM, 1995). Senyawa ini mempunyai titik lebur 75-77ºC dengan pKa 4,4; 5,2 dan log P (oktanol/air) 4,0 (Moffat, et al., 2005).
hingga sedang, khususnya nyeri oleh karena inflamasi seperti pada arthritis dan gout (Trevor, et al., 2005; Anderson, et al., 2002). Untuk mengurangi nyeri ringan hingga sedang, secara umum dosis penggunaan ibuprofen per oral adalah 200-400 mg (5-10 mg/kg pada anak-anak) setiap 4-6 jam bila diperlukan, untuk nyeri haid 400 mg per oral jika perlu, untuk arthritis rheumatoid 400-800 mg, untuk demam pada anak-anak 5 mg/kg berat badan, dan untuk nyeri pada anak-anak 10 mg/kg berat badan (Anderson, et al., 2002).
2.6 Eksipien
Eksipien adalah suatu bahan yang digunakan untuk membuat sediaan farmasi yang tidak berefek farmakologis (Wade dan Weller, 2009). Eksipien digolongkan berdasarkan fungsinya dalam membuat sediaan farmasi. Untuk sediaan tablet, eksipien terdiri dari:
1. Pengisi
Pengisi merupakan bahan yang ditambahkan untuk mendapatkan bobot tablet yang diharapkan bila dosis obat tidak dapat memenuhinya. Pengisi juga berfungsi untuk memperbaiki daya kohesi sehingga membuat laju alir menjadi baik dan dapat dikempa langsung. Contoh bahan pengisi adalah laktosa, pati dan derivatnya, selulosa dan derivatnya, manitol, sorbitol, dan sebagainya (Lachman, Lieberman, dan Kanig, 1986).
2. Pengikat
adalah gelatin, tragakan, akasia, selulosa dan derivatnya, pati dan derivatnya, alginat, dan sebagainya (Lachman, Lieberman, dan Kanig, 1986).
3. Penghancur (Disintegran)
Penghancur merupakan eksipien yang ditambahkan pada pembuatan tablet yang berguna untuk memudahkan pecahnya tablet ketika kontak dengan cairan saluran pencernaan. Penghancur juga berfungsi untuk menarik air ke dalam tablet, mengembang dan menyebabkan pecahnya tablet menjadi bagian-bagian kecil yang akan menentukan kelarutan obat dan tercapainya bioavailabilitas yang diharapkan. Konsentrasi dan bahan yang digunakan mempengaruhi kecepatan pecahnya tablet dan lepasnya zat aktif dalam obat untuk melarut. Adanya bahan-bahan lain seperti eksipien yang larut dalam air dapat mempercepat proses disintegrasi (Bhowmik, et al., 2009).
Ada empat mekanisme utama penghancur tablet, yaitu (Bhowmik, et al., 2009):
a. Mengembang (Swelling)
akan menurun. Proses mengembang dari penghancur tablet dapat dilihat pada Gambar 2.2 berikut.
Gambar 2.2 Proses mengembang b. Aksi Porositas dan Kapilaritas (Wicking)
Gambar 2.3 Proses aksi porositas dan kapilaritas c. Gaya Repulsif Partikel (Tolak Menolak Antar Partikel)
Mekanisme lain dari bahan penghancur dapat dijelaskan pada tablet yang dibuat dengan bahan penghancur yang “tidak mengembang”. Guyot-Hermann mengajukan suatu teori repulsif partikel berdasarkan penelitian dari partikel yang tidak bisa mengembang juga menyebabkan tablet terdisintegrasi. Gaya elektrik repulsif antara partikel merupakan mekanisme dari disintegrasi dan air dibutuhkan untuk hal itu. Peneliti menemukan bahwa repulse merupakan kejadian yang menyebabkan wicking. Proses penghancur tablet dengan mekanisme di atas dapat dilihat pada Gambar 2.4.
d. Deformasi
Selama proses pengempaan kapasitas pengembangan akan mengalami peningkatan. Akibatnya partikel yang terdisintegrasi akan mengalami deformasi. Bentuk deformasi ini akan menjadi bentuk normal jika kontak dengan cairan. Proses deformasi dari penghancur tablet dapat dilihat pada Gambar 2.5 berikut.
Gambar 2.5 Proses deformasi 4. Pemanis
Bahan pemanis sangat penting dalam pembuatan ODT. Rasa tablet yang dirasakan saat tablet berada dalam rongga mulut berkaitan dengan keterimaan oleh pasien dan berarti pula berpengaruh terhadap kualitas produk. Bahan pemanis yang biasa digunakan seperti aspartam, manitol atau sorbitol. 2.7 Uraian Tentang Manitol
Manitol dengan rumus kimia C6H14O6 atau D-manitol, merupakan gula
(Rowe, et al., 2009). Rumus bangun manitol dalam bentuk planar dapat dilihat pada Gambar 2.6.
Manitol berupa serbuk putih, tidak berbau, kristalin atau berupa granul yang mudah mengalir dan alirannya dapat ditingkatkan oleh material lain, larut dalam air, sangat sukar larut dalam alkohol dan tidak larut hampir dalam semua pelarut organik. Manitol memiliki rasa manis dengan tingkat kemanisan relatif sebesar 0,5 sampai dengan 0,7 kali tingkat kemanisan sukrosa, dan memberikan sensasi dingin di mulut. Secara mikroskopik, manitol berbentuk jarum-jarum ketika dikristalisasi dari alkohol. Manitol juga menunjukkan polimorfisme (Rowe, et al., 2009).
C
CH
2OH
C
H
C
C
CH
2OH
HO
H
HO
OH
H
OH
H
Gambar 2.6 Rumus bangun D-manitol
Manitol biasanya digunakan dalam formula sediaan farmasi dan produk makanan. Dalam formulasi sediaan farmasi, manitol digunakan sebagai diluen (10–90% b/b) dalam formulasi tablet, dimana menjadi nilai lebih karena tidak bersifat higroskopis dan dapat digunakan bersama bahan aktif yang mempunyai kelembaban sensitif. Manitol dapat digunakan pada formulasi tablet cetak langsung dimana manitol terdapat dalam bentuk granul atau bentuk
Manitol mempunyai keunggulan dibandingkan jenis gula lainnya terkait dengan kesehatan, antara lain (Kepala Badan POM RI, 2008):
• Manitol termasuk dalam kategori GRAS (Generally Recognized as Safe) menurut pengaturan JECFA (The Joint FAO/WHO Expert Committee on Food Additives) sehingga aman dikonsumsi manusia.
• Penggunaan manitol tidak menyebabkan karies gigi.
• Manitol (gula alkohol) memiliki kalori lebih sedikit daripada gula biasa. Nilai kalori manitol sebesar 1,6 kkal/g atau 6,69 kJ/g. Ini berarti bahwa gula alkohol dapat dianggap sebagai pemanis berkalori rendah, dan dapat membantu dalam pengendalian berat badan.
• Manitol dapat meningkatkan kadar gula darah karena termasuk karbohidrat. Tetapi, karena tubuh tidak menyerap gula alkohol seluruhnya, maka efek pada kenaikan kadar glukosa dalam darah lebih sedikit dibandingkan gula-gula lainnya. Penderita diabetes dapat mengkonsumsi manitol tetapi tetap harus memperhatikan jumlah total karbohidrat dalam makanan dan makanan ringan.
Dan menurut pengaturan CAC (Codex Alimentarius Commission), batas maksimal penggunaan manitol adalah 60.000 mg/kg produk (Kepala Badan POM RI, 2008).
2.8 Uraian Tentang Gelatin
Gelatin berasal dari bahasa latin, yaitu gelatus yang berarti kuat atau beku. Nama gelatin mulai digunakan secara umum sekitar tahun 1700-an. Menurut Leiner Davis Gelatin Co (2000), gelatin diperoleh dari hidrolisis terkontrol serat protein kolagen yang banyak ditemukan di alam sebagai unsur pokok dari kulit, tulang, dan jaringan ikat.
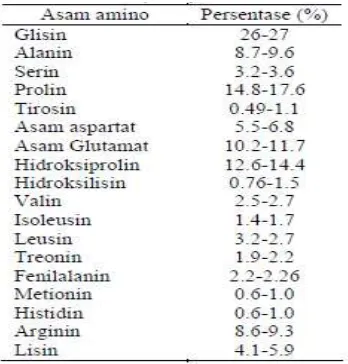
Tabel 2.1 Komposisi asam amino pada gelatin (Cole, 2000)
Parker (1982) juga menambahkan bahwa gelatin merupakan suatu polimer linear dari asam amino yang umumnya terjadi dari pengulangan asam amino glisin-prolin-prolin atau glisin-prolin-hidroksiprolin. Komposisi asam amino gelatin bervariasi tergantung pada spesies hewan penghasil, sumber kolagen, dan jenis kolagen. Gelatin bukan termasuk protein yang lengkap karena gelatin tidak mengandung asam amino triptofan (Cole, 2000), namun gelatin mengandung sedikit asam amino yang jarang ditemui yaitu hidroksilisin (Glicksman, 1969). Gelatin mengandung asam glutamat dengan jumlah yang cukup tinggi. Asam glutamat ini sangat berperan dalam pengolahan makanan karena dapat menimbulkan citarasa yang lezat (Winarno, 1997).
berbentuk bubuk dapat langsung digunakan. Gelatin murni biasanya tidak berasa, tidak berbau, dan berwarna sedikit kuning (Mark dan Stewart, 1957). Gelatin dapat berubah dari bentuk sol menjadi gel dan sebaliknya dapat berubah dari bentuk gel menjadi sol kembali. Gelatin juga dapat membengkak atau mengembang dalam air dingin, membentuk film, mempengaruhi viskositas suatu bahan, dan dapat melindungi sistem koloid (Parker, 1982). Menurut Jones (1977), sifat gelatin yang dapat berubah dari sol menjadi gel secara reversible itulah yang membuat gelatin lebih istimewa daripada gel hidrokoloid lain yang tidak dapat berubah secara reversible seperti pati, alginat, protein susu, dan albumin telur. Salah satu sifat fisik gelatin yang penting adalah kekuatan untuk membentuk gel yang disebut kekuatan gel. Gel gelatin terbentuk akibat adanya pembentukan jala atau jaring tiga dimensi oleh molekul polimer yang membentuk ikatan silang di antara sesamanya. Ikatan atau interaksi yang berperan dalam pembentukan ikatan silang ini diperkirakan adalah ikatan hidrogen, ikatan ion, dan ikatan hidrofobik antar rantai (Fardiaz, 1989). Perubahan sol ke gel atau sebaliknya dipengaruhi oleh perubahan suhu, komposisi pelarut, dan tingkat keasaman (pH). Pembentukan atau perubahan menjadi gel ini akan terganggu jika kondisi terlalu asam atau terlalu basa.
perendaman selama 10-48 jam. Asam klorida memiliki kelebihan yaitu dapat menguraikan serat kolagen lebih banyak dan lebih cepat tanpa mengurangi kualitas gelatin yang dihasilkan, serta mengubah serat kolagen tripel heliks menjadi rantai tunggal (Ward dan Courts, 1977). Gelatin B dihasilkan dari ekstraksi dengan larutan yang bersifat basa seperti air kapur. Waktu perendaman yang diperlukan untuk ekstraksi menggunakan basa biasanya lebih lama, dapat mencapai 12 minggu dan menghasilkan kolagen rantai ganda (Poppe, 1992). Secara umum semua gelatin mempunyai kegunaan yang sama, namun terdapat perbedaan sifat antara gelatin A dan gelatin B, di antaranya adalah dalam hal viskositas, kadar abu, pH, dan titik isoelektrik yang dapat dilihat pada Tabel 2.2.
Tabel 2.2 Perbedaan gelatin A dan B (GMIA, 2012)
BAB III
METODE PENELITIAN
Penelitian ini menggunaan metode eksperimental yang meliputi formulasi orally disintegrating tablet (ODT) ibuprofen dan evaluasi sediaan.
3.1Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah blister (d = 13 mm), freezer, freeze dryer (VIRTIS), disintegration tester (Copley),
dissolution tester tipe dayung, friabilator (Copley), hardness tester (Copley), spektrofotometer UV/Visible (UVmini 1240 Shimadzu), difraksi sinar-X (Philips Analytical X-Ray), mixer, stopwatch, neraca digital (Henherr BL-H2),
alat-alat gelas dan alat laboratorium lainnya.
3.2 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah ibuprofen (PT Dexa Medica), manitol, gelatin berkekuatan gel 140 bloom, akuades bebas
CO2, NaOH p.a (E. Merck), dan kalium fosfat mono basa p.a (E. Merck). 3.3 Prosedur Kerja
3.3.1 Pembuatan pereaksi
3.3.1.1 Air bebas karbondioksida
3.3.1.2 Natrium hidroksida 0,1 N
Dilarutkan 4 gram natrium hidroksida P dalam air bebas karbondioksida secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.3.1.3 Natrium hidroksida 0,2 N
Dilarutkan 8 gram natrium hidroksida P dalam air bebas karbondioksida secukupnya hingga 1000 ml (Ditjen POM, 1979).
3.3.1.4 Kalium fosfat monobasa 0,2 M
Dilarutkan 27,22 gram kalium fosfat monobasa P dalam air suling dan encerkan hingga air 1000 ml (Ditjen POM, 1995).
3.3.1.5 Dapar fosfat pH 7,2
Dimasukkan 50 ml kalium fosfat monobasa 0,2 M ke dalam labu tentukur 200 ml, kemudian ditambahkan NaOH 0,2 M sebanyak 34,7 ml dicukupkan dengan air suling sampai garis tanda (Ditjen POM, 1995).
3.3.2Pembuatan kurva serapan ibuprofen
3.3.2.1 Dalam medium NaOH 0,1 N
3.3.2.2 Dalam medium dapar fosfat pH 7,2
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100 ml kemudian ditambahkan dapar fosfat pH 7,2 sampai garis tanda. Di pipet 0,8 ml kemudian dimasukkan ke dalam labu tentukur 50 ml, lalu ditambahkan dapar fosfat pH 7,2 sampai garis tanda. Maka diperoleh larutan dengan konsentrasi 8 ppm. Serapan diukur pada panjang gelombang 200-400 nm dengan menggunakan spektrofotometer UV. Panjang gelombang yang dipilih adalah panjang gelombang dimana Ibuprofen memperlihatkan serapan paling tinggi.
3.3.3 Pembuatan kurva kalibrasi ibuprofen
3.3.3.1 Dalam medium NaOH 0,1 N
Ditimbang seksama 50 mg ibuprofen dimasukkan ke dalam labu tentukur 100 ml kemudian ditambahkan NaOH 0,1 N sampai garis tanda. Dari larutan tersebut di pipet masing-masing 7,5 ml, 9,5 ml, 11,5 ml, 13,5 ml dan 15,5 ml. Dimasukkan ke dalam labu tentukur 25 ml kemudian diencerkan dengan larutan NaOH 0,1 N sampai garis tanda. Serapan diukur pada panjang gelombang maksimum yang diperoleh dari kurva serapan ibuprofen menggunakan spektrofotometer UV dan sebagai blanko digunakan NaOH 0,1 N. Kurva kalibrasi antara jumlah serapan dan konsentrasi dibuat dari data yang diperoleh, lalu dihitung persamaan regresi dan koefisien korelasinya.
3.3.3.2Dalam medium dapar fosfat pH 7,2
masing-masing diencerkan dengan larutan dapar fosfat pH 7,2 sampai garis tanda. Serapan diukur pada panjang gelombang maksimum yang diperoleh dari kurva serapan ibuprofen menggunakan spektrofotometer UV dan sebagai blanko digunakan dapar fosfat pH 7,2. Kurva kalibrasi antara jumlah serapan dan konsentrasi dibuat dari data yang diperoleh, lalu dihitung persamaan regresi dan koefisien korelasinya.
3.3.4 Pembuatan orally disintegrating tablet (ODT) ibuprofen proses liofilisasi
Pembuatan ODT ibuprofen dilakukan dengan proses liofilisasi menggunakan gelatin 5% dan manitol sebagai matriks. Adapun berbagai formula yang dirancang seperti yang ditunjukkan pada Tabel 3.1.
Larutan gelatin 5% selalu dibuat baru untuk setiap formula ODT, yaitu dengan cara 5 gram serbuk gelatin ditaburkan dalam air dingin, dibiarkan mengembang, dipanaskan di atas penangas air sampai larut, dicukupkan dengan air panas sampai 100 ml dan digunakan ketika panas. Kemudian ditimbang masing-masing bahan. Dimasukkan larutan gelatin 5% dan manitol ke dalam lumpang, ditambahkan ibuprofen dan dicampur hingga homogen. Lalu campuran dipindahkan ke dalan beaker glass, diaduk menggunakan
mixer, dan dimasukkan ke dalam blister berdiameter 13 mm dengan bobot 400 mg. Kemudian dimasukkan ke dalam freezer sampai sediaan mengeras dan di
Tabel 3.1 Formula sediaan ODT ibuprofen proses liofilisasi menggunakan kombinasi gelatin 5% dan manitol sebagai matriks dengan berbagai variasi konsentrasi
Kode Formulasi
Bahan (mg)
Total Ibuprofen Gelatin
5% Manitol
F1 200 200 0 400
F2 200 150 50 400
F3 200 100 100 400
F4 200 50 150 400
F5 200 0 200 400
3.3.5 Karakterisasi orally disintegrating tablet ibuprofen proses liofilisasi 3.3.5.1 Penetapan kadar ibuprofen dalam tablet
Ditimbang seksama 20 tablet, kemudian digerus menjadi serbuk, dari serbuk ditimbang sejumlah zat setara 50 mg ibuprofen, dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan NaOH 0,1 N dicukupkan sampai garis tanda. Kemudian larutan disaring, beberapa tetes filtrat pertama dibuang dan filtrat selanjutnya ditampung. Dari larutan tersebut dipipet 11,5 ml dimasukkan ke dalam labu tentukur 25 ml dan ditambahkan dengan NaOH 0,1 N sampai batas tanda. Selanjutnya diukur secara spektofotometri UV pada panjang gelombang maksimum. Dihitung kadar ibuprofen.
Dalam Farmakope Indonesia Edisi IV, tablet ibuprofen mengandung zat berkhasiat tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
3.3.5.2 Uji kekerasan tablet
tombol ditekan. Pada saat tablet pecah, angka yang terbaca pada layar digital dicatat. Persyaratan kekerasan untuk ODT adalah 0,1-3 kP (1 kg = 1 kP) (Abu-Izza, 2004).
3.3.5.3 Uji friabilitas (kerapuhan) tablet
Pemeriksaan kerapuhan ODT dilakukan dengan alat Friabilator
(Copley). Pemeriksaan uji kerapuhan tablet dilakukan dengan cara diambil 10 tablet, kemudian dibersihkan satu per satu dengan menggunakan kuas. Tablet yang sudah dibersihkan tersebut ditimbang sekaligus dan dicatat beratnya (a gram). Masukkan ke dalam alat friabilator tester,putar dengan kecepatan 25 putaran per menit selama 4 menit. Setelah 4 menit tablet diambil dan dibersihkan lagi dengan kuas satu per satu, ditimbang sekaligus, dan dicatat beratnya (b gram). Pengurangan berat menunjukkan nilai kerapuhan tablet dan dinyatakan dalam persen terhadap berat tablet mula-mula. Nilai kerapuhan tablet dianggap cukup baik bila 0,1-0,9% (Saurabh, et al., 2012).
�(������ℎ��) =� − �
� × 100%
3.3.5.4 Uji waktu hancur
3.3.5.4.1 Uji waktu hancur menggunakan disintegration tester
Alat: Disintegration tester (Copley)
pada monografi, angkat keranjang dan amati keenam tablet. Semua tablet harus hancur sempurna.
Persyaratan: Waktu yang diperlukan untuk menghancurkan tablet kurang dari 1 menit (Manivannan, 2009).
3.3.5.4.2 Uji waktu hancur dengan alat termodifikasi
Satu tablet dimasukkan ke dalam cawan petri berdiameter 9 cm yang telah berisi 9 ml aquadest. Dicatat waktu yang dibutuhkan tablet untuk hancur sempurna.
3.3.5.4.3 Uji waktu hancur dalam rongga mulut
Uji ini menggunakan sukarelawan untuk 4 kode formula ODT yang terbentuk sempurna. Sebelum memulai uji, sukarelawan diharuskan kumur-kumur terlebih dahulu. Satu tablet ODT diletakkan di atas lidah dan dibiarkan tablet hingga hancur sempurna. Setelah itu, tablet dapat diludahkan. Dicatat waktu yang dibutuhkan tablet untuk hancur sempurna di mulut (Fu, et al., 2004).
3.3.5.5 Uji waktu pembasahan
3.3.5.6 Uji absorbsi air
Kertas saring yang berbentuk lingkaran diletakkan ke dalam cawan petri berdiameter 9 cm yang telah berisi 9 ml larutan warna metilen blue 0,1% b/v dalam air suling. Satu tablet diletakkan perlahan-lahan di bagian tengah cawan petri tersebut, kemudian dicatat waktu pembasahan sempurna dari tablet, kemudian ditimbang berat tablet sebelum dan sesudah terbasahi. Rasio absorbsi air dihitung dengan rumus R = (wa - wb) / wb x 100% dimana wb adalah berat tablet sebelum menyerap air dan wa adalah berat tablet setelah menyerap air (Singh dan Singh, 2009).
3.3.5.7 Uji keseragaman sediaan (keragaman bobot)
Tablet yang dibuat mengandung ibuprofen 200 mg, berarti 50% jumlah zat berkhasiat lebih besar dari 50 mg, karena itu penetapan keseragaman sediaan dilakukan dengan menetapkan keragaman bobot yang dilakukan sebagai berikut:
Ditimbang seksama 10 tablet satu per satu dan dihitung bobot rata-rata, kemudian ditentukan secara spektrofotometri UV. Dari hasil penetapan kadar dihitung jumlah zat aktif dari masing-masing 10 tablet dengan anggapan zat aktif terdistribusi homogen.
Cara penetapan kadar:
dilarutkan dengan NaOH 0,1 N dan dicukupkan sampai garis tanda. Kemudian larutan disaring, beberapa tetes filtrat pertama dibuang dan filtrat selanjutnya ditampung. Dari larutan tersebut dipipet 11,5 ml dimasukkan ke dalam labu tentukur 25 ml dan ditambahkan dengan NaOH 0,1 N sampai garis tanda. Selanjutnya diukur serapannya secara spektofotometri UV pada panjang gelombang maksimum.
Persyaratan: Keragaman bobot terletak antara 85,0% sampai 115% dari yang tertera pada etiket dan simpangan baku kurang dari atau sama dengan 6%. 3.3.5.8 Analisa pola difraksi sinar -X
Pola difraksi sinar -X serbuk ibuprofen dan ODT hasil proses liofilisasi direkam pada sistem difraksi sinar -X menggunakan sumber pancaran radiasi Cu, tegangan 40 KV dan arus 30 mA. Pengamatan dilakukan pada 2θ dan kecepatan skanning 0,020º per detik.
3.3.5.9 Uji disolusi tablet (profil pelepasan bahan obat)
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester.
Medium: 900 ml dapar fosfat pH 7,2 Alat: tipe 2 (metode dayung)
Kecepatan putaran: 50 rpm Waktu: 60 menit
Cara kerja:
kecepatan 50 rpm. Dalam interval waktu 1, 3, 5, 7, 10, 15, 20, 30, 45, 60 menit diambil cuplikan sebanyak 1 ml. Pengambilan cuplikan dilakukan pada posisi yang sama yaitu pertengahan antara permukaan medium disolusi dan bagian atas dari dayung tidak kurang 1 cm dari dinding wadah (Ditjen POM, 1995) dan dimasukkan ke dalam labu tentukur 25 ml. Lalu diiencerkan dengan dapar fosfat pH 7,2 sampai garis tanda. Serapan diukur pada panjang gelombang maksimum terhadap medium dapar fosfat pH 7,2 sebagai blanko. Volume medium diusahakan tetap dengan menambahkan medium dapar fosfat pH 7,2 sebanyak 1 ml setelah pemipetan. Pengujian dilakukan terhadap 6 tablet.
Persyaratan: Dalam waktu 30 menit harus larut tidak kurang dari 70% (Q) C13H18O2 dari jumlah yang tertera pada etiket (Ditjen POM, 1995).
Interpretasi: Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Apabila tidak memenuhi persyaratan maka pengujian dilanjutkan sampai tiga tahap, kecuali bila hasil pengujian memenuhi tahap S1 atau S2.
Tabel 3.2 Kriteria penerimaan uji disolusi Tahap Jumlah
yang diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 15%
S2 6
Rata–rata dari 12 unit (S1 + S2) adalah sama dengan atau lebih besar dari Q dan tidak 1 unit sediaan yang lebih kecil dari Q – 15%
S3 12
Rata–rata dari 24 unit (S1 + S2 + S3) adalah sama dengan atau lebih besar dari Q, tidak lebih dari 2 unit sediaan yang lebih kecil dari Q – 15% dan tidak 1 unit sediaan yang lebih kecil dari Q – 25%
3.4 Analisis Data Secara Statistik
Menurut Gandjar dan Rohman (2007), kadar zat aktif sebenarnya yang terkandung dalam sampel dapat diketahui menggunakan uji distribusi t. Data diterima atau ditolak dihitung dengan menggunakan metode standar deviasi
dengan rumus: ��= �∑|��−��|2 �−1
Keterangan: Xi = nilai dari masing-masing pengukuran
X
� = rata-rata dari pengukuran
Untuk mencari thitung digunakan rumus: t hitung =
��−� ��
√� �
Menurut Wibisono (2005), sebagai dasar penolakan data hasil uji analisis adalah thitung≥ ttabel atau thitung≤ - ttabel. Untuk menentukan kadar zat aktif dalam
sampel dengan taraf kepercayaan 99%, α = 0,01, dk = n - 1, dapat digunakan rumus:
Kadar sebenarnya: μ = ± t(α/2,dk) x (SD/√�)
Keterangan:
X = Interval kepercayaan kadar sampel
��
= Kadar rata-rata sampelSD = Standar Deviasi
dk = derajat kebebasan (dk = n - 1)
α = taraf kepercayaan dan n = jumlah perlakuan
3.4.1 Uji statistik terhadap evaluasi waktu hancur
3.4.2 Uji statistik terhadap profil pelepasan obat
BAB IV
HASIL DAN PEMBAHASAN
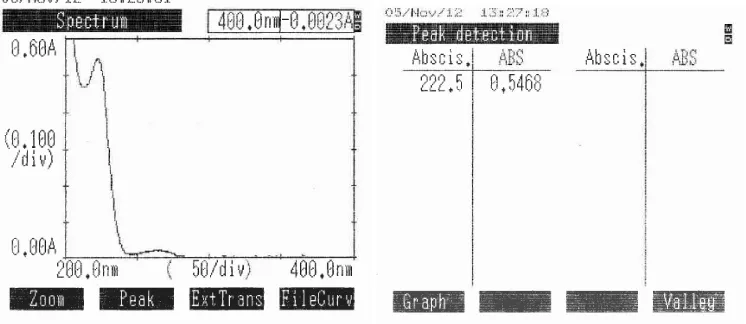
4.1 Hasil Penentuan Serapan Maksimum dan Linieritas Kurva Kalibrasi Ibuprofen dalam larutan NaOH 0,1 N
Menurut Moffat, et al. (2005), ibuprofen memberikan serapan maksimum pada panjang gelombang 265 nm dalam pelarut alkali NaOH 0,1 N dengan A1
1 = 18,5a dan 273 nm. Dari hasil pengukuran panjang gelombang
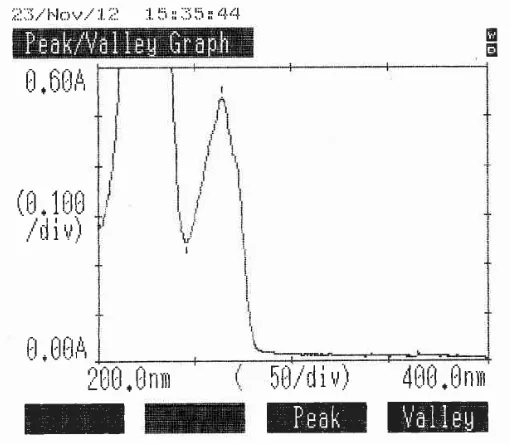
[image:56.595.178.433.381.603.2]maksimum bahan baku ibuprofen dalam pelarut NaOH 0,1 N secara spektrofotometri ultraviolet diperoleh serapan maksimum pada panjang gelombang 264,5 nm seperti pada gambar 4.1 dan gambar 4.2.
Gambar 4.2 Data panjang gelombang maksimum dan absorbansi ibuprofen dengan konsentrasi 230 mcg/ml secara spektrofotometri ultraviolet
Dari hasil pengukuran panjang gelombang maksimum dalam pelarut NaOH 0,1 N secara spektrofotometri ultraviolet diperoleh bahwa panjang gelombang serapan maksimum ini memenuhi persyaratan yaitu lebih kurang 2 nm dari λ maksimum yang terdapat dalam literatur (Ditjen POM, 1995).
Pada penentuan kurva kalibrasi, larutan ibuprofen dibuat dengan konsentrasi berturut-turut: 150 mcg/ml; 190 mcg/ml; 230 mcg/ml; 270 mcg/ml dan 310 mcg/ml pada panjang gelombang 264,5 nm. Dari hasil perhitungan koefisien korelasi diperoleh r2 = 0,9998, ini menunjukkan bahwa terdapat hubungan yang linier antara serapan dan konsentrasi dan dari hasil perhitungan diperoleh persamaan regresi Y = 0,002327 X - 0,001342.
Gambar 4.3 Kurva kalibrasi ibuprofen (PT Dexa Medica) dalam pelarut NaOH 0,1 N pada panjang gelombang 264,5 nm.
4.2 Hasil Penentuan Serapan Maksimum dan Linieritas Kurva Kalibrasi Ibuprofen dalam larutan Dapar Fosfat pH 7,2
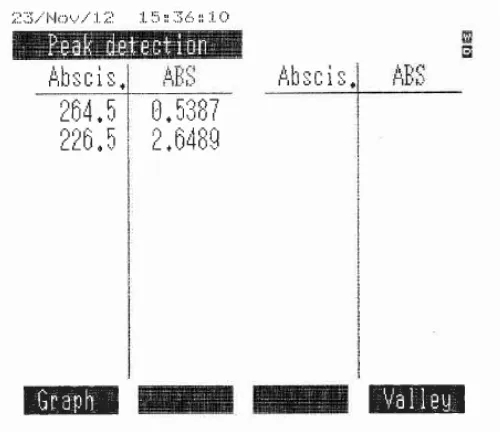
Gambar 4.4 Kurva serapan ibuprofen dengan konsentrasi 8 mcg/ml dan panjang gelombang maksimum secara spektrofotometri ultraviolet
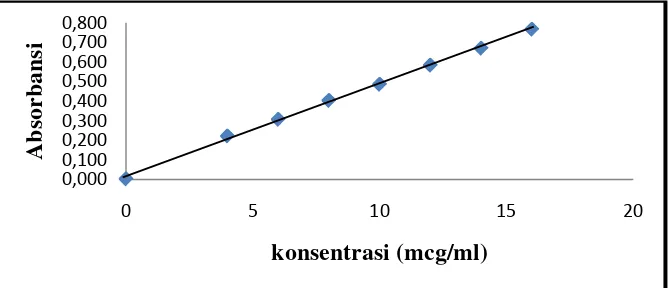
Penentuan linieritas kurva kalibrasi ibuprofen dalam larutan dapar fosfat pH 7,2 dilakukan pada rentang konsentrasi 0,00–16,00 mcg/ml. Dari hasil perhitungan koefisien korelasi diperoleh r2 = 0,9991, ini menunjukkan bahwa terdapat hubungan yang linier antara serapan dan konsentrasi dan dari hasil perhitungan diperoleh persamaan regresi Y = 0,047028 X + 0,018505.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
0 50 100 150 200 250 300 350
A
bso
rba
nsi
konsentrasi (mcg/ml)
[image:58.595.119.492.380.542.2]Gambar 4.5 menunjukkan kurva kalibrasi ibuprofen dalam dapar fosfat pH 7,2.
Gambar 4.5 Kurva kalibrasi ibuprofen dalam dapar fosfat pH 7,2
4.3 Hasil Evaluasi ODT Ibuprofen
[image:59.595.236.378.569.713.2]Dari lima rancangan formula yang ada, terdapat satu formula ODT yang tidak menghasilkan fisik tablet yang utuh, yaitu ODT dengan kode formula F5. Hal ini terjadi dikarenakan dalam rancangan formula ini hanya mengandung satu matriks saja yaitu manitol, sedangkan matriks yang berfungsi sebagai pengikat, dalam hal ini gelatin 5% tidak terdapat. Sehingga tidak terlihat fisik tablet yang sempurna pada formula tersebut. Adapun tablet yang dapat dihasilkan dengan utuh dapat dilihat pada Gambar 4.6 berikut.
Gambar 4.6 Tablet hasil proses liofilisasi dari berbagai formula 0,000
0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800
0 5 10 15 20
A
bs
or
ban
si
4.3.1 Hasil penetapan kadar ibuprofen dalam tablet
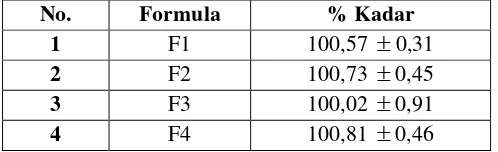
[image:60.595.107.356.269.345.2]Berdasarkan hasil penelitian, kadar ibuprofen dalam berbagai formula yang dapat menghasilkan tablet dari proses liofilisasi masih memenuhi persyaratan menurut Farmakope Indonesia Edisi IV, yaitu 90,0% sampai 110,0% seperti yang ditunjukkan pada Tabel 4.1.
Tabel 4.1 Data hasil penetapan kadar tablet ibuprofen
No. Formula % Kadar
1 F1 100,57 ±0,31
2 F2 100,73 ±0,45
3 F3 100,02 ±0,91
4 F4 100,81 ±0,46
Keterangan:
F1 (ODT dengan campuran gelatin 5% : manitol = 200 mg : 0 mg) F2 (ODT dengan campuran gelatin 5% : manitol = 150 mg : 50 mg) F3 (ODT dengan campuran gelatin 5% : manitol = 100 mg : 100 mg) F4 (ODT dengan campuran gelatin 5% : manitol = 50 mg : 150 mg) 4.3.2 Hasil uji kekerasan tablet
Berdasarkan Gambar 4.7 diketahui bahwa setiap tablet yang diuji mempunyai kekerasan yang tidak jauh berbeda.
Gambar 4.7 Diagram hasil uji kekerasan tablet Keterangan:
F1 (ODT dengan campuran gelatin 5% : manitol = 200 mg : 0 mg) F2 (ODT dengan campuran gelatin 5% : manitol = 150 mg : 50 mg) F3 (ODT dengan campuran gelatin 5% : manitol = 100 mg : 100 mg) F4 (ODT dengan campuran gelatin 5% : manitol = 50 mg : 150 mg)
Selain itu, manitol termasuk eksipien yang dapat menghasilkan kekakuan sehingga mempengaruhi kekerasan tablet hasil proses liofilisasi (Jones, 2011; Rowe, 2009). Hal ini sejalan dengan hasil penelitian yang diperoleh seperti yang dapat dilihat pada Gambar 4.7 bahwa semakin banyak jumlah manitol yang ditambahkan, semakin meningkat pula kekerasan tablet yang dihasilkan.
4.3.3 Hasil uji kerapuhan tablet
Menurut Saurabh, et al. (2012) bahwa friabilitas atau kehilangan berat yang dialami setiap jenis tablet baik, jika berkisar antara 0,1-0,9%. Dengan terpenuhinya syarat uji friabilitas, maka keutuhan tablet sampai ke tangan konsumen dapat terjamin. Walaupun hasil yang ditunjukkan bervariasi tetapi masih berada dalam batas penerimaan evaluasi friabilitas tablet. Adapun data uji friabilitas dapat dilihat pada gambar 4.8.
2,08 2,34
2,35
2,65
0 0,5 1 1,5 2 2,5 3
F1 F2 F3 F4
K
e
ke
ra
sa
n
(kg)
Gambar 4.8 Diagram hasil uji kerapuhan tablet Keterangan:
F1 (ODT dengan campuran gelatin 5% : manitol = 200 mg : 0 mg) F2 (ODT dengan campuran gelatin 5% : manitol = 150 mg : 50 mg) F3 (ODT dengan campuran gelatin 5% : manitol = 100 mg : 100 mg) F4 (ODT dengan campuran gelatin 5% : manitol = 50 mg : 150 mg) 4.3.4 Hasil uji waktu hancur
Hasil ketiga jenis uji waktu hancur yang dilakukan yaitu waktu hancur in vitro, dengan alat termodifikasi, dan in vivo dapat dilihat pada Gambar 4.9.
Berbeda dengan persyaratan uji waktu hancur in vitro tablet konvensional yang menggunakan medium asam atau buffer, medium yang dipakai pada uji waktu hancur ODT adalah air. Hal ini dikarenakan ODT dirancang untuk hancur di rongga mulut dan larut dalam air ludah yang sebagian besar komposisinya adalah air (Fu, et.al., 2004).
0,89
0,70
0,66
0,55
0,00 0,20 0,40 0,60 0,80 1,00
F1 F2 F3 F4
F
ri
a
b
il
ita
s (
%
)
Gambar 4.9 Diagram hasil berbagai uji waktu hancur Keterangan:
F1 (ODT dengan campuran gelatin 5% : manitol = 200 mg : 0 mg) F2 (ODT dengan campuran gelatin 5% : manitol = 150 mg : 50 mg) F3 (ODT dengan campuran gelatin 5% : manitol = 100 mg : 100 mg) F4 (ODT dengan campuran gelatin 5% : manitol = 50 mg : 150 mg)
Pada Gambar 4.9 terlihat bahwa waktu hancur in vitro dari semua formula ODT lebih cepat dibandingkan waktu hancur dengan alat termodifikasi dikarenakan matriks-matriks yang digunakan larut dalam air sehingga memiliki absorbsi air yang cepat ketika ODT terendam seluruhnya di dalam medium serta adanya efek laju pengadukan dari disintegration tester yang tinggi. Selain itu, hal ini dapat terjadi karena pada uji waktu hancur dengan alat termodifikasi, medium yang digunakan relatif lebih sedikit dan tanpa pengadukan. Sedangkan waktu hancur yang diperoleh dari uji in vivo di dalam mulut untuk semua formula ODT merupakan waktu hancur paling cepat dibandingkan kedua jenis waktu hancur lainnya. Hal ini diduga karena adanya gerakan lidah, walaupun gerakan tersebut tidak lebih cepat daripada pengadukan disintegration tester dan cairan di dalam mulut pun lebih sedikit daripada medium yang digunakan pada uji waktu hancur lainnya. Namun, uji
19 29,17
36
57,5
82,1 90,97 94,1
111,1
7,1 12,5 15,3
21,2
0 20 40 60 80 100 120
F1 F2 F3 F4
W
a
k
tu
(
d
eti
k
)
Formula
di dalam mulut dipengaruhi oleh pH saliva yang bersifat basa dan adanya enzim ptialin dapat membantu mempercepat waktu hancur tablet di mulut, di mana pada kedua uji waktu hancur lainnya dilakukan menggunakan medium air yang bersifat netral.
Selain itu, pada proses formulasi secara liofilisasi terjadi penghilan