Ekspresi Gen Penyandi Asam
δ
-aminolevulinat Sintase
dari Rhodobacter sphaeroides pada Arabidopsis thaliana
IRAWAN TAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa disertasi yang berjudul:
Ekspresi Gen Penyandi Asam
δ
-aminolevulinat Sintase
dari
Rhodobacter
sphaeroides
pada
Arabidopsis thaliana
Adalah benar merupakan hasil karya sendiri dan belum pernah dipublikasikan
orang lain. Semua sumber data dan informasi yang digunakan telah dinyatakan
secara jelas dan dapat diperiksa kebenarannya.
Bogor, Mei 2005
ABSTRAK
IRAWAN TAN. Ekspresi Gen Penyandi Asam δ-aminolevulinat Sintase dari
Rhodobacter sphaeroides pada Arabidopsis thaliana. Dibimbing oleh
ANTONIUS SUWANTO (Ketua Komisi Pembimbing), MAGGY THENAWIDJAYA SUHARTONO, MAGDALENA IRENE JOSEPHINE UMBOH (Anggota Komisi Pembimbing)
Sintesis prekursor senyawa tetrapirol asam δ-aminolevulinat (ALA) di tanaman dimulai dari glutamat dan merupakan biosintesis tergantung pada tRNA
yang terdiri atas tiga tahapan enzimatik yang terjadi di plastida. Pada hewan,
khamir dan sejumlah bakteri, ALA dibentuk melalui satu tahapan dari
suksinil-CoA dan glisin oleh δ-aminolevulinate sintase (ALA-S).
Gen yang menyandikan ALA-S (hemA) dari Rhodobacter sphaeroides
telah berhasil dikonstruksi di bawah promotor 35S promoter dan diintroduksikan
ke dalam genom Arabidopsis thaliana melalui perantaraan Agrobacterium
tumefaciens secara in planta. Lima kandidat tanaman transgenik yang dianalisis
dengan PCR ternyata empat diantaranya membawa gen hemA dan kanamisin.
Hasil analisis transkrip dengan Reverse Transcriptase-PCR menunjukkan
keempat tanaman transgenik tersebut terekspresi pada tarap mRNA. Pengukuran
berat basah dan berat kering menunjukkan kenaikan tertinggi sebesar 16.8% dan
16.6%. Namun terdapat dua tanaman yang mengalami kelainan yaitu satu
mengalami penurunan berat basah dan berat kering akibat perkembangan akar
yang jelek (transgenik no 3) sedangkan satu lagi mengalami penurunan jumlah
biji dan keterlambatan pembungaan (transgenik no 4). Hasil analisis aktivitas
ALAS, total kandungan ALA dan klorofil pada tanaman transgenik no 4
menunjukkan aktivitas sebesar 40.5 nmol.mg-1.h-1, total ALA meningkat 153.6% dan total klorofil meningkat 43% Selain itu juga mengalami peningkatan
toleransi terhadap salinitas sampai dengan konsentrasi 200 mM NaCl. Pada
penelitian ini juga telah dilakukan kloning gen Chlorophyll A Oxygenase dari
ABSTRACT
IRAWAN TAN. Expression of δ-aminolevulinate Sintase from Rhodobacter
sphaeroides in Arabidopsis thaliana. Supervised by ANTONIUS SUWANTO
(Major Advisor), MAGGY THENAWIDJAYA SUHARTONO, MAGDALENA IRENE JOSEPHINE UMBOH (Coadvisors)
Synthesis of the tetrapyrrole precursor δ-Aminolevulinate (ALA) in plants starts with glutamate and is a tRNA dependent pathway consisting of three
enzymatic steps localized in plastids. In animals, yeast and some of the bacteria,
ALA is formed in a single step from succinyl CoA and glycine by
aminolevulinate synthase (ALA-S) inside mithochondria.
A gene encoding ALA-S from Rhodobacter sphaeroides under 35S
promoter was introduced into the genome of Arabidopsis thaliana employing
Agrobacterium tumefaciens-mediated transformation in planta. Five putative
transgenic lines were obtained and four among them were positive carrying hemA
dan kanamycin. All the transgenic lines expressed the transgene at the level of
RNA confirmed by RT-PCR analysis. The fresh and dry weigth was increased up
to 16.8% and 16.6%, respectively. But, two lines was abnormal, one was reduced
in fresh and dry weight because of poor root development (line no 3) and the other
reduced in seed production for about one quarter and exhibited late flowering (line
no 4). The ALAS activity in line no 4 was 40.5 nmol.mg-1.h-1 and the capacity to synthesize ALA and chlorophyll was increased 153.6% and 43%, respectively. In
addition it could also improve tolerance of salinity stress when exposed to 200
mM NaCl. In this study, the gene for Chlorophyll A Oxygenase has been cloned
Ekspresi Gen Penyandi Asam
δ
-aminolevulinat Sintase
dari Rhodobacter sphaeroides pada Arabidopsis thaliana
IRAWAN TAN
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Ekspresi Gen Penyandi Asam δ-aminolevulinat Sintase dari Rhodobactersphaeroides pada Arabidopsis thaliana Nama : IRAWAN TAN
NIM : 995205
Menyetujui
Komisi Pembimbing
Prof. Dr. Antonius Suwanto Ketua
(Prof. Dr. Maggy T. Suhartono) (Prof. Dr. M. Irene J. Umboh)
Anggota Anggota
Mengetahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Dedy Duryadi Solihin Prof. Dr. Syafrida Manuwoto
PRAKATA
Puji syukur penulis panjatkan kehadirat Tuhan YME, atas berkah yang
melimpah sehingga penulis dapat menyelesaikan penulisan disertasi dengan judul:
Ekspresi Gen Penyandi Asam δ-aminolevulinat Sintase dari Rhodobacter sphaeroides pada Arabidopsis thaliana
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan
yang sebesar-besarnya kepada Prof. Dr. Antonius Suwanto selaku pembimbing
utama, yang telah membimbing penulis selama hampir 10 tahun sejak S1.
Banyak contoh, pengalaman dan kesempatan serta kepercayaan yang penulis
peroleh selama dibimbing Beliau. Penulis juga menyampaikan rasa terima kasih
kepada Prof Dr. Maggy T. Suhartono dan Prof. Dr. M. Irene J. Umboh selaku
anggota komisi pembimbing, atas semua bimbingan dan arahan sejak awal
penelitian sampai penulisan disertasi ini.
Penulis juga menyampaikan rasa terima kasih yang sebesar-besarnya
kepada Almahumah Dr. Puspa Dewi Tjondronegoro, yang kepada Beliau lah
penulis menyampaikan rencana penelitian ini pada akhir tahun 1996 dan sejak
saat itu sampai akhir hayatnya, beliau selalu mendukung penulis untuk dapat
mengerjakan penelitian ini. Penelitian ini merupakan janji penulis kepada Beliau
dan baru saat ini janji tersebut penulis penuhi.
Penulis mengucapkan terima kasih kepada Dr. Robert Harling dan The
British Council atas kesempatan dan dana yang diberikan untuk melakukan
Ucapan terima kasih penulis sampaikan kepada The Habibie Center dan
Research Center for Microbial Diversity atas bantuan beasiswa dan dana
penelitian selama studi S3 ini berlangsung.
Kepada semua pihak yang tidak dapat disebutkan satu persatu selama
penulis melakukan penelitian baik di Laboratorium Biokimia dan Mikrobiologi,
PAU Biotek IPB dan Laboratorium Biologi Molekuler, SEAMEO-BIOTROP,
penulis mengucapkan terima kasih atas semua bantuan dan kerjasamanya.
Jakarta, Mei 2005
RIWAYAT HIDUP
Penulis dilahirkan di Jambi pada tanggal 8 Oktober 1972 dari ayah Eddie
Sinatra dan ibu Kastina Tjandra. Pendidikan sarjana di tempuh di Program Studi
Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB, lulus pada tahun
1997. Pada tahun 1997, penulis diterima di Program Studi Biologi pada Program
Pascasarjana IPB dan menamatkannya pada tahun 1999. Kesempatan untuk
melanjutkan ke program doktor pada program studi dan pada perguruan tinggi
yang sama diperoleh pada awal tahun 2000. Selama studi program doktor, penulis
mendapat beasiswa selama setahun dari The Habibie Center pada tahun 2000 dan
Research Center for Microbial Diversity untuk beasiswa dan dana penelitian
(2001-2004).
Selama mengikuti program S3, penulis pernah menjadi instruktur
laboratorium pada workshop “International Training Course on Advances in
Molecular Biology Techniques to Assess Microbial Biodiversity I-IV” dan
“Lokakarya Teknologi DNA dan Deteksi Produk Rekayasa Genetika pada Bahan
Pangan” yang diselenggarakan oleh SEAMEO-BIOTROP dari tahun 2000-2003.
Instruktur laboratorium pada workshop “Advances in Molecular Biology
Techniques to Assess Microbial Biodiversity, Taxonomy and Detection” tahun
2001 dan “ Pulsed-Field Gel Electrophoresis (PFGE) for DNA Fingerprinting”
tahun 2002 yang diselenggarakan oleh Office of Biotechnology Research and
Development, Department of Agriculture The Government of Thailand. Sebagai
instruktur laboratorium pada “Lokakarya Pengajaran Bioteknologi Modern untuk
Guru SMU” tahun 2003 dan 2004 yang diselenggarakan oleh Fakultas
Teknobiologi, Unika Atma Jaya. Penulis juga mendapatkan kesempatan
melakukan Short-term research di Scottish Agricultural College dari tanggal
Agustus – September 2003 yang dibiayai oleh British Council. Penulis juga
menjadi instruktur laboratorium pada workshop “Regional Training Course on
Utilization of Molecular Marker Techniques in Plant Breeding” pada bulan Mei
DAFTAR ISI
Biosintesis asam δ-aminolevulinat (ALA) ………. 4
Aplikasi ALA untuk pertanian ……….. 5
Ketahanan terhadap salinitas ……….. 8
Chlorophyll A oxygenase ………... 18
Transformasi yang diperantarai Agrobacterium ………. 24
BAHAN DAN METODE ………. 29
Galur bakteri dan plasmid yang digunakan ………. 28
Pembuatan E. coli kompeten……… 29
Transformasi E. coli ……… 29
Purifikasi DNA dari gel agarose ………. 30
Isolasi DNA plasmid ………... 30
Konstruksi vektor ekspresi ALAS ……….. 31
Transformasi rekombinan binary vector ke A. tumefaciens EHA 105……… 36
Transformasi rekombinan binary vector ke Arabidopsis thaliana .. 37
Analisis kandidat tanaman transgenik dengan PCR ……..………. 39
Analisis transkrip dengan RT-PCR ………. 40
Pengukuran kandungan klorofil ……….. 42
Esei aktivitas ALA sintase dan total kandungan ALA ………….. 42
Pengukuran berat basah dan berat kering ………... 43
Pengujian ketahanan terhadap salinitas …...……… 43
Kloning gen Chlorophyll A Oxygenase dari Arabidopsis thaliana……… 43
Tempat dan waktu penelitian ……….. 44
HASIL DAN PEMBAHASAN ……… 45
Transformasi rekombinan binary vector ke Arabidopsis thaliana . 47
Analisis tanaman Arabidopsis transgenik ……….. 48
Ekspresi ALAS meningkatkan kandungan klorofil ……… 56
Analisis penurunan sifat monogenik Mendel ……….. 57
Pengujian ketahanan terhadap salinitas ………... 57
Kloning gen Chlorophyll A Oxygenase (CAO) ……….. 59
SIMPULAN DAN SARAN ……….. 62
Simpulan ………. 62
Saran ……… 63
DAFTAR TABEL
Teks Halaman
1. Galur bakteri dan plasmid yang digunakan ………. 28 2. Hasil analisis berat basah dan berat kering Arabidopsis thaliana
transgenik dan non transgenik ……….
54
DAFTAR GAMBAR
Teks Halaman
1. Biosintesis asam δ-aminolevulinat (ALA) dan senyawa tetrapirol
4 2. Sensitivitas perkecambahan biji Arabidopsis terhadap NaCl
……… 10
3. Sensitivitas tanaman Arabidopsis terhapa NaCl selama fase
vegetatif ……….. 11
4. SOS pathway berperanan dalam homeostasis ion pada saat
cekaman salinitas ………..……… 14
5. Cekaman salinitas menghambat pengambilan ion K pada
Arabidopsis ...……….
15
6.. Model bagi induksi reactive oxygen species (radikal bebas superoksida, hydrogen peroksida dan hidroksil) yang terjadi pada saat perlakuan dengan NaCl dan peranan enzim antioksidatif superoksida dismutase (SOD), ascorbat peroksidase (APX) dan glutathione peroksidase (GPX) dalam menghancukan radikal
bebas superoksida, hydrogen peroksida dan hidroksil ………….. 17 7. Halliwell-Asada pathway (Siklus Askobat-glutathione) 18 8. Struktur klorofil A dan klorofil B ……….. 19 9. Struktur fotosistem II pada keadaan cahaya redup (atas) atau
cahaya terang (tengah) pada tanaman tingkat tinggi tipe liar dan
mutan tanpa klorofil b (bawah) …………... 19 10. Sebuah model yang diusulkan untuk siklus klorofil ……….. 23 11. Model hipotetik proses transfer T-DNA ……… 28 12. Kloning hemA ke plasmid pOK12 menghasilkan plasmid
pOK-hemA ……….……… 32
13. Konstruksi gen hemA dibawah promoter 35S dengan orientasi
sense ………..………. 33
14. Konstruksi binary vektor yang membawa gen hemA dibawah
promoter 35S dengan orientasi sense ………... 33 15. Konstruksi gen hemA dibawah promoter 35S dengan orientasi
antisense ………... 34 16. Konstruksi binary vektor yang membawa gen hemA dibawah
promoter 35S dengan orientasi antisense ………... 35
17. Peta plasmid pSOUP ……….. 35
18. Tanaman Arabidopsis thaliana yang ditumbuhkan pada tabung
PVC (A) dan siap diinfeksi (B) ……….. 38 19. Tahapan infeksi dengan suspensi Agrobacterium (A) dan pasca
infeksi (B) ……….. 38
20. Hasil analisis restriksi plasmid rekombinan pOK12-hemA,
p35S-2hemA dan pGII0029-hemA ………. 46
21. Hasil analisis restriksi plasmid rekombinan pGII0029-hemA (A) dan pGII0029-AShemA (B) yang didigesti dengan BamHI (3 &
22. Peta plasmid rekombinan hemA dan
pGII0029-AShemA ………. 47
23. Kecambah Arabidopsis yang akan (A) dan setelah (B, C dan D) diseleksi dengan penyemprotan antibiotic kanamisin (in solium
selection) ……… 48
24. Analisis kandidat tanaman transgenik menggunakan PCR dengan
primer spesifik gen hemA dan kanamisin resisten ………. 49 25. Hasil analisis RT-PCR pada tanaman transgenik T1 ………. 50 26. Profil tanaman transgenik no 4 (tanda panah) ………... 52 27. Kondisi perakaran tanaman transgenik no 4 (A) dan 3 (B) …… 55 28. Hasil analisis PCR turunan pertama tanaman transgenik No. 4 … 57 29. Pengujian ketahanan terhadap cekaman salinitas ………. 59 30. Peta plasmid rekombinan pAS900-CAO1 yang membawa gen
CAO ………... 60
31. Urutan nukleotida gen CAO dari Arabidopsis thalianaecotype
Columbia ……… 60
PENDAHULUAN Latar Belakang
Populasi penduduk dunia telah mencapai lebih dari 6 milyar jiwa pada
tahun 2000 dan diperkirakan dapat mencapai sekitar 8.5 milyar jiwa pada tahun
2025. Untuk memenuhi kebutuhan pangan dunia dibutuhkan peningkatan hasil
yang signifikan dari tanaman pangan utama yang dibudidayakan di negara
berkembang. Padi, sebagai contoh, diperkirakan butuh peningkatan hasil sekitar
50% pada tahun 2030 dari yang ada sekarang. Peningkatan potensi hasil akan
melibatkan peningkatan biomassa tanaman pangan itu sendiri yang berarti
peningkatan produksi asimilat yang berasal dari fotosintesis (Horton 2000).
Proses fotosintesis merupakan proses yang sangat penting dalam produksi
bahan pangan dan serat. Rata-rata hasil per luas lahan secara global dari tanaman
pangan utama seperti gandum, padi dan jagung mengalami peningkatan lebih dari
dua kali lipat dalam periode antara 1940 dan 1980 dan kecendrungan ini terus
berlanjut. Peningkatan hasil biji-bijian ini sejalan dengan periode dimana
pengertian kita tentang fotosintesis telah meningkat secara luar biasa. Kemajuan
dalam penelitian fotosintesis ini berlanjut dengan terobosan baru yang dibawa
oleh kemajuan dalam bidang biologi molekuler (Richards 2000).
Sejumlah kondisi lingkungan memperlihatkan pengaruhnya terhadap
pertumbuhan dan perkembangan serta produktivitas tanaman. Tanaman
menghadapi berbagai tekanan baik secara biotik (hama dan penyakit) dan abiotik
(salinitas, kekeringan, suhu yang ekstrem dll). Dalam sistem pertanian, tekanan
penting dalam menurunnya potensial hasil dari berbagai tanaman pertanian
(Boyer, 1982).
Asam δ-aminolevulinat (ALA) merupakan prekursor kunci dalam biosintesis porfirin seperti klorofil dan heme. Sejauh ini, ALA diketahui
mempunyai banyak kegunaan bukan saja sebagai herbisida (Rebeiz et al. 1984),
insektisida (Rebeiz et al. 1988) dan faktor pemacu pertumbuhan dengan
meningkatkan fiksasi CO2 dalam keadaan terang dan menurunkan pelepasan CO2
pada keadaan gelap (Hotta et al. 1997a, b), tetapi juga kemampuannya untuk
meningkatkan toleransi tanaman terhadap stres oleh salinitas (Watanabe et al.
2000) dan temperatur dingin (Hotta and Watanabe 1999, Wang et al. 2004).
Yoshida et al. (2004) melaporkan bahwa ALA pada konsentrasi 30-100 ppm
dapat meningkatkan pertumbuhan dan penyerapan nitrogen pada tanaman
Komatsuna yang ditanam di tanah alkalin yang apabila tidak diberi perlakuan
ALA dapat menurunkan hasil sampai 50%. ALA juga diketahui mempunyai
aktivitas hormonal seperti auksin dan sitokinin dalam induksi kalus dan
rhizogenesis serta pertunasan (Bindu and Vivekanandan 1998a).
Biosintesis ALA secara biologis dilakukan melalui dua jalur yang
berbeda: (1) melalui suksinil-CoA dan glisin (Jalur Shemin atau Jalur C-4), dan
(2) dari glutamat (Jalur C-5). Tumbuhan tingkat tinggi, briofita, sianobakter dan
sebagian eubakteria menggunakan jalur C-5 untuk biosintesis ALA yang
melibatkan tiga macam enzim yaitu Glutamil-tRNA sintase, Glutamil-tRNA
reduktase dan Glutamat semialdehida aminotransferase. Sedangkan hewan,
khamir dan sejumlah bakteri kelompok α-proteobacteria seperti Rhodobacter,
melibatkan hanya satu enzim yaitu ALA sintase (von Wettstein, Gough, and
Kannangara 1995). Introduksi gen ALA sintase dari jalur C-4 ke tanaman (C-5)
diharapkan dapat memperpendek jalur biosintesis selain efek lain yang diinginkan
seperti telah disebutkan diatas.
Dalam melakukan penelitian pada bidang biologi molekular dan rekayasa
genetika tanaman dibutuhkan suatu sistem atau tanaman model untuk mempelajari
ekspresi suatu gen dalam tanaman. Untuk keperluan ini Arabidopsis thaliana
telah menjadi tanaman model yang secara luas digunakan dalam studi biologi
tanaman (Meinke et al., 1998), termasuk didalamnya transformasi genetik. Hal
ini dikarenakan Arabidopsis thaliana mempunyai ukuran genom yang kecil (125
Mb), siklus hidup yang pendek (sekitar 6 minggu sejak dikecambahkan) dan
menghasilkan biji yang relatif banyak dari satu siklus Satu hal penting adalah
telah berhasil diselesaikannya sekuen total genom tanaman ini pada tahun 2000
dan pengembangan metode transformasi yang efisien sehingga memungkinkan
studi ekspresi gen secara lebih lengkap (TAIR, 2003).
Tujuan
Penelitian ini bertujuan untuk mempelajari ekspresi gen penyandi asam δ -aminolevulinat sintase (hemA) pada Arabidopsis thaliana.
Manfaat Penelitian
Penelitian ini diharapkan dapat meningkatkan performa pertumbuhan
tanaman melalui peningkatan laju fotosintesis, ketahanan cekaman salinitas dan
ketahanan tanaman terhadap naungan. Informasi yang diperoleh dari penelitian
TINJAUAN PUSTAKA
Biosintesis asam δ-aminolevulinat
Cincin porfirin merupakan komponen dari berbagai molekul biologis
penting termasuk diantaranya haemoglobin, sitokrom, vitamin B12 dan klorofil.
Prekursor kunci dari cincin porfirin ini adalah asam δ-aminolevulinat (ALA). Biosintesis ALA dapat dilakukan melalui dua jalur: (1) dari suksinil-CoA dan
glisin (Shemin pathway, C-4 pathway), dan (2) dari glutamat (C-5 pathway)
seperti yang tersaji dalam Gambar 1.
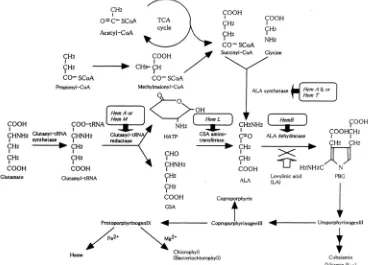
Gambar 1. Biosintesis asam δ-aminolevulinat (ALA) dan senyawa tetrapirol (Sasaki et al. 2002).
Pada jalur Shemin, suksinil-CoA disediakan melalui siklus TCA.
Suksinil-CoA dan glisin dikondensasi dengan bantuan enzim ALA sintase
dalam kelompok α-proteobacteria seperti Rhodobacter, Rhodospirillum dan Rhizobium. Di sejumlah bakteri, suksinil-CoA disintesis dari propionil-CoA
melalui jalur biosintesis metilmalonil-CoA (Sasaki et al. 1990). ALAS merupakan
enzim pembatas kunci untuk biosintesis senyawa tetrapirol, dan sintesis enzim ini
sendiri diatur secara ketat (Sasikala and Ramana 1995) melalui pengaturan secara
umpan balik pada gen penyandi HemA atau HemT (Neidle and Kaplan 1993).
Jalur biosintesis C-5 merupakan karakteristik dari tumbuhan tingkat tinggi,
Briofita, Sianobakteri dan sejumlah Eubakteria. Jalur biosintesis ini melibatkan
tiga buah enzim yaitu Glutamat-tRNA sintase, Glutamil-tRNA reduktase (gtr
A/hemA), dan Glutamat 1-semialdehida aminotransferase (hemL). Pada tumbuhan
tingkat tinggi, gen penyandi tRNAGlu terdapat di DNA kloroplas, sedangkan
ketiga macam enzim yang terlibat dalam biosintensis ALA disandikan oleh DNA
inti dan diimpor ke dalam stroma kloroplas setelah disintesis oleh ribosom
sitoplasma. Pada fitoflagelata Euglena gracilis ditemukan adanya dua jalur
biosintesis (C-4 dan C-5) yang dioperasikan di dalam organel yang berbeda. Jalur
C-5 beroperasi di kloroplas dan secara eksklusif bertanggung-jawab untuk sintesis
klorofil, sementara di mitokondria, ALA sintase bertanggung-jawab untuk sintesis
heme a dari sitokrom c oksidase (Weinstein and Beale 1983).
Aplikasi ALA untuk pertanian
Aplikasi praktis ALA sebagai bioherbisida pertama kali di demonstrasikan
oleh Rebeiz et al. (1984). Hasil yang dicapai sangatlah berarti karena ALA dapat
bekerja secara selektif, tidak berbahaya dan merupakan bahan yang dapat
diuraikan secara biologis. Mekanisme ALA sebagai “photodynamic herbicide”
perlakuan dengan ALA dengan jumlah tinggi akan mengakumulasi secara
berlebihan molekul protoporfirin IX (PPIX) pada tahap biosintesis klorofilnya.
Ketika tanaman terkena cahaya, PPIX yang berlebih akan menghasilkan radikal
bebas (O2-), yang akan mengoksidasi asam lemak tak jenuh pada membran sel dan
pada akhirnya merusak tanaman. Oleh karena itu ALA dapat digunakan sebagai
bahan pengganti yang aman untuk herbisida yang sangat toksik seperti Paraquat.
Mekanisme yang sama juga ditunjukkan oleh ALA jika digunakan sebagai
bioinsektisida untuk membasmi Trichopusia ni (Rebeiz et al. 1988).
Namun dilain pihak, telah banyak penelitian yang melaporkan efek yang
menguntungkan terhadap pertumbuhan berbagai jenis tanaman jika ALA
diaplikasikan dalam jumlah rendah (30-100 ppm), seperti meningkatkan berat
kering tanaman, peningkatan aktivitas fotosintesis dan efek penghambatan atas
respirasi serta mempunyai aktivitas hormonal dalam induksi kallus dan
mikropropagasi (Tanaka et al. 1992; Yoshida et al. 1996a; 1996b; Bindu and
Vivekanandan 1998a; 1998b; Yoshida et al. 2004). Watanabe et al. (2000)
menemukan bahwa aplikasi ALA pada konsentrasi rendah (100 ppm)
meningkatkan toleransi terhadap salinitas pada tanaman kapas muda. Hal yang
sama juga ditemukan pada tanaman bayam yang diberi perlakuan 0.6 dan 1.8 mM
ALA pada media yang mengandung 50 dan 100 mM NaCl, ternyata bukan saja
dapat tumbuh dengan baik, yang berarti tanaman menjadi toleran terhadap NaCl,
tetapi juga menyebabkan meningkatnya laju fotosintesis (Nishihara et al. 2003).
Pada barley, pemberian ALA 30-100 ppm dapat menyebabkan peningkatan hasil
sampai 40% yang disebabkan oleh meningkatnya jumlah biji yang dihasilkan
gandum dan padi. Tanaman kacang merah yang diberi perlakuan ALA pada fase
awal seperti fase daun primer atau daun pertama, meningkat hasilnya sampai
20-30%, sedangkan perlakuan pada fase pembungaan menurunkan hasil sekitar 10%.
Dalam hal ini hasil yang dicapai sangat tergantung pada fase pertumbuhan mana
tanaman diberi perlakuan dengan ALA. Pada tanaman bawang dan kentang
pemberian ALA pada fase pembentukan umbi dapat meningkatkan jumlah
maupun berat umbi yang terbentuk. Wang et al. (2004) melaporkan bahwa jika
kecambah melon (Cucumis melo L. Ximiya No. 1) yang ditumbuhkan dengan
intensitas penyinaran 150 µmol m-2 s-1 dan diberi aplikasi larutan ALA dapat
meningkatkan secara signifikan laju fotosintesis netto (Pn), jumlah CO2 yang
difiksasi per jumlah foton (AQY), Efisiensi karboksilasi (CE) dan konduktansi
stomata (Gs). Setelah pemberian dengan 10 ml larutan ALA (10 mg l-1 atau
100 mg l-1) per wadah yang diisi dengan 250 g pasir bersih selama 3 hari, Pn
daun sekitar 40-200% lebih tinggi dibandingkan kontrol, dan AQY, CE and Gs
meningkat secara berturut-turut sekitar 21-271%, 55-210% dan 60-335%. Lebih
lanjut, perlakuan ALA meningkatkan kandungan klorofil daun dan tingkat gula
terlarut demikian juga dengan laju respirasi dalam keadaan gelap, tetapi
menurunkan laju respirasi dalam keadaan terang. Dilain pihak, Setelah kecambah
melon yang ditumbuhkan di dalam ruang pertumbuhan diberi perlakuan
pendinginan pada suhu 8°C selama 4 jam dan dikembalikan lagi ke suhu 25-30°C
selama 2 dan 20 jam, Pn tanaman yang diberi air (kontrol) hanya sekitar 12-18%
dan 37-47%, dibandingkan dengan Pn awal sebelum diberi perlakuan
pendinginan. Jika kecambah dengan diberi perlakuan sama tetapi diberi ALA
dengan kontrol sebelum pemberian cekaman dingin. Jika lama pendinginan
menjadi 6 jam, tanaman yang diberi perlakuan ALA hanya memperlihatkan
sedikit gejala nekrosis pada daun sedangkan semua tanaman yang hanya diberi air
akan mati, hal ini menyimpulkan bahwa ALA meningkatkan torelansi tanaman
terhadap stres dingin dibawah kondisi cahaya rendah.
Ketahanan terhadap salinitas
Tanaman membutuhkan mineral nutrien esensial untuk tumbuh dan
berkembang. Namun demikian, kelebihan garam-garam mineral yang terlarut di
tanah dapat berbahaya bagi kebanyakan tanaman. Cekaman salinitas merupakan
salah satu faktor lingkungan penting yang membatasi pertumbuhan dan
produktivitas tanaman pertanian di seluruh dunia. Di perkirakan bahwa masalah
salinitas mempengaruhi setidaknya 20% lahan yang dapat ditanami di seluruh
dunia dan lebih dari 40% lahan beririgasi dengan berbagai tingkat kerusakan
(Rhoades and Loveday 1990). Pada kasus yang ekstrem, produktivitas lahan
pertanian tidak dapat lagi menunjang kelangsungan produksi pertanian dan harus
ditinggalkan. Di daerah pantai invasi air laut secara periodik langsung
menambahkan garam ke tanah. Tanah di daerah semi-arid atau arid, khususnya
dengan sistem drainase yang jelek, akumulasi garam sebagai akibat evaporasi air
irigasi, meninggalkan deposit garam garam terlarut.
Berdasarkan kemampuannya untuk tumbuh di tempat berkadar garam
tinggi, secara tradisional tanaman dikelompokkan atas glikofita dan halofita
(Flowers et al. 1977). Halofita toleran terhadap konsentrasi NaCl yang tinggi;
beberapa dapat bertahan pada kadar garam dua kali konsentrasi garam pada air
masuk ke dalam kelompok glikofita dan tidak dapat mentolerir salinitas yang
tinggi. Untuk glikofita, salinitas menyebabkan cekaman ionik, osmotik dan
cekaman lanjutan seperti penghambatan pengambilan ion dan cekaman radikal
oksida (Zhu 2001a). Toksisitas oleh natrium merupakan cekaman ionik utama
yang berhubungan dengan salinitas tinggi. Sebagai tambahan, sejumlah tanaman
juga sensitif terhadap klorida, anion utama yang ditemukan pada tanah salin.
Pada tanah salin tertentu, toksisitas ion diperparah oleh pH alkalin. Potensial
osmotik yang rendah dari larutan salin menghambat pengambilan air dan
menyebabkan kekeringan fisiologis. Untuk tanaman halofita yang toleran
terhadap toksisitas natrium, cekaman osmotik merupakan penyebab utama
terhambatnya pertumbuhan. Pemahaman atas mekanisme toleransi tanaman
terhadap salinitas akan membantu secara efektif proses pemuliaan atau rekayasa
genetika tanaman yang tahan terhadap salinitas. Beberapa aspek dalam respon
tanaman terhadap cekaman salinitas berhubungan sangat erat dengan respon
terhadap cekaman kekeringan dan dingin (Zhu 2001b). Studi tentang toleransi
tanaman terhadap salinitas akan memberikan pemahaman tentang mekanisme
toleransi silang pada cekaman abiotik.
Arabidopsis thaliana merupakan tanaman glikofita yang sensitif terhadap
cekaman salinitas dimana dapat terjadi penghambatan pertumbuhan dan
kerusakan jaringan yang menuju kematian. Seperti kebanyakan glikofita,
sensitivitas Arabidopsis thaliana terhadap cekaman salinitas diperlihatkan pada
semua fase perkembangannya. Sebagai contoh, perlakuan selama 8 jam dengan
150 mM NaCl pada fase pembentukan biji menyebabkan terjadinya deposisi
mengindikasikan kematian sel (Sun and Hauser 2001). Sensitivitas Arabidopsis
thaliana terhadap cekaman salinitas sangat terlihat pada fase perkecambahan biji
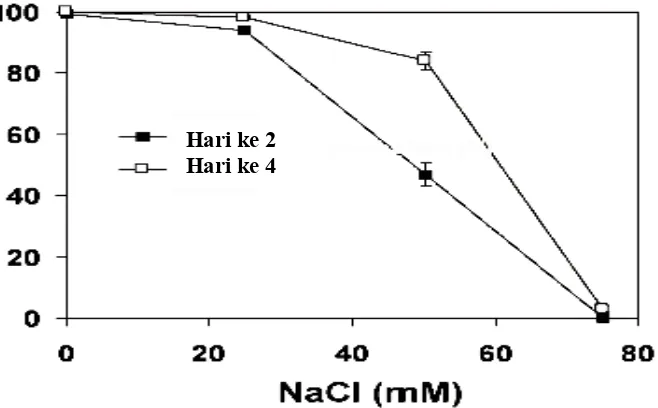
dan kecambahnya. Perkecambahan biji Arabidopsis thaliana sangat terganggu
pada konsentrasi 75 mM NaCl atau lebih (Gambar 2). Pertumbuhan kecambah
juga sangat sensitif terhadap NaCl. Bahkan pada konsentrasi NaCl yang lebih
rendah (< 50 mM NaCl) dapat secara nyata mempengaruhi berat basah sedangkan
pada konsentrasi yang lebih dari 50 mM NaCl akan menghambat pertumbuhan
(Gambar 3) dan bahkan dapat menyebabkan kematian.
Gambar 2. Sensitivitas perkecambahan biji Arabidopsis terhadap NaCl. Biji ecotype C24 (Salah satu ecotype yang sensitif NaCl) ditumbuhkan pada kertas filter yang telah dibasahi dengan larutan NaCl dan diinkubasi pada suhu 4°C selama 2 hari sebelum dipindahkan ke suhu ruang (23°C) dibawah penyinaran cahaya putih untuk perkecambahan (Xiong and Zhu 2002).
Gambar 3. Sensitivitas tanaman Arabidopsis terhadap NaCl selama fase vegetatif. Kecambah berumur dua minggu (ecotype Columbia) ditumbuhkan ditanah yang di beri larutan 0, 50, 75, dan 100 mM NaCl. Dokumentasi diambil pada minggu ke tiga (Panel atas) dan minggu ke empat (Panel bawah) setelah perlakuan (Xiong and Zhu 2002)
Tanaman yang diadaptasikan dengan konsentrasi garam rendah dapat
meningkatkan toleransi tanaman terhadap cekaman salinitas menunjukkan bahwa
tanaman glikofita memiliki perangkat untuk membuatnya toleran terhadap
salinitas yang mungkin tidak berkerja secara efektif pada keadaan yang tidak
teradaptasi. Oleh karena itu, perbedaan toleransi terhadap salinitas antara glikofita
dan halofita lebih pada tingkat kuantitatif daripada kualitatif, dan mekanisme
dasar toleransi terhadap salinitas kemungkinan bersifat konservatif pada semua
spesies tanaman (Xiong and Zhu 2002). Sebagai contoh, gen vakuolar Na+/H+
antiporter AtNHX1 tidak indusibel dibandingkan dengan gen yang homolog pada
halofita, dan tingkat ekspresi yang tinggi gen AtNHX1 menggunakan promoter
Minggu ke-3
kuat 35S CaMV dapat secara nyata meningkatkan toleransi Arabidopsis terhadap
salinitas (Apse et al.1999; Hamada et al. 2001).
Ion natrium sebenarnya tidak dibutuhkan dalam pertumbuhan oleh
sebagian besar tumbuhan. Bahkan tumbuhan sepertinya tidak memiliki sistem
transpor khusus untuk pengambilan Na+. Namun demikian, Na+ masih dapat
memasuki sel tanaman melalui beberapa jalur. Karena konsentrasi Na+ di tanah
biasanya lebih tinggi dibandingkan dengan yang ada di sitosol sel akar,
pergerakan Na+ kedalam sel akar dapat terjadi secara pasif. Bukti yang didapat
baru-baru ini menunjukkan bahwa sebagian besar Na+ memasuki sel akar melalui
saluran kation tidak tergantung voltase (VIC) atau yang dikenal dengan nama lain
saluran kation tidak selektif (NSCC) (Amtmann and Sanders 1999; Demidchik
and Tester 2002).
Selain itu, disebabkan oleh kemiripan antara ion Na+ and K+, transporter
K+ HKT1 kemungkinan merupakan pintu masuknya ion Na+ ke dalam sel akar
karena transporter ini mempunyai afinitas terhadap Na+ pada saat konsentrasi Na+
diluar sel tinggi (Rubio et al. 1995). Gen yang homolog pada Arabidopsis,
AtHKT1, memperantarai pengambilan Na+ ketika diekspresikan di
Saccharomyces cerevisiae atau oosit Xenopus (Uozumi et al. 2000). Mutan
supresor hkt1 mempunyai kandungan Na+yang lebih rendah, menunjukkan bahwa
AtHKT1 memerantarai pengambilan Na+ kedalam tanaman. Studi ini juga
menunjukkan bahwa SOS3 pada tipe liar, bekerja bersama-sama dengan SOS2,
mungkin menekan aktivitas AtHKT1 dalam memungkinkan Na+masuk kedalam
Tanaman mempunyai sejumlah cara untuk mengatasi cekaman ionik yang
diakibatkan oleh salinitas yang tinggi termasuk diantaranya membatasi
pengambilan, meningkatkan pengeluaran dan lokalisasi Na+ dalam vakuola dan
mengontrol transport jarak jauh ke daerah daun. Kelebihan Na+ pada permukaan
akar akan menganggu proses pengambilan K+ yang sangat penting dalam menjaga
turgor sel, potensial membran dan aktivitas sejumlah enzim (Lazof and Bernstein
1999). Karena kemiripan sifat fisiko-kimia Na+ dan K+, Na+ pada konsentrasi
tinggi mempunyai efek inhibisi yang kuat pada proses pengambilan ion kalium
oleh akar. Sebagai contoh, pengambilan K+melalui KUP1 Arabidopsis dihambat
oleh konsentrasi 5 mM NaCl atau lebih tinggi (Kim et al. 1998; Fu and Luan
1998). Tanaman mengunakan sistem pengambilan K+ baik yang berafinitas tinggi
maupun rendah. Ion natrium mempunyai efek yang lebih merusak pada sistem
yang berafinitas rendah yang memiliki selektivitas K+/N+ yang rendah. Pada
keadaan cekaman salinitas, merupakan hal yang penting bagi tanaman untuk
mengoperasikan sistem pengambilan K+ yang berafinitas tinggi dalam rangka
menjaga ketersediaan K+ yang dibutuhkannya. Sudah merupakan fenomena yang
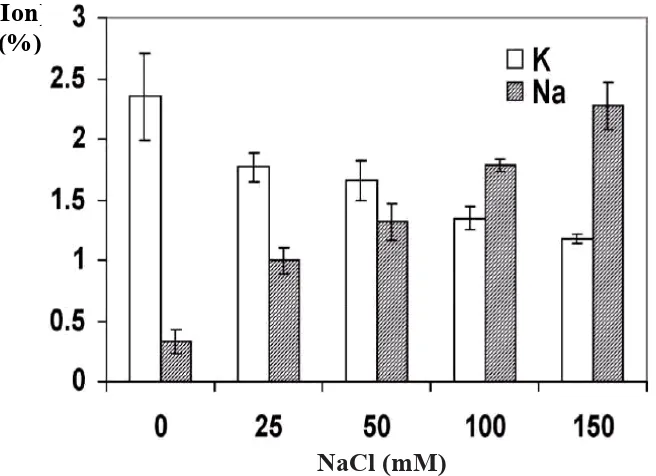
umum bahwa perlakuan NaCl pada tanaman menyebabkan menurunnya
kandungan K+ (Gambar 5), yang secara parsial bertanggung jawab terhadap
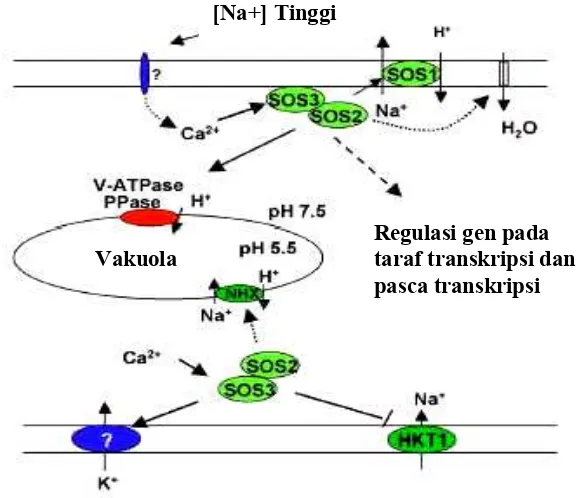
Gambar 4. SOS pathway berperanan dalam homeostasis ion pada saat stres oleh salinitas. Konsentrasi NaCl ekstraselular yang tinggi akan memicu meningkatnya konsentrasi Ca2+ di sitosol. Sensor Ca2+ SOS3 yang menanggapi signal Ca2+ ini akan berinteraksi dan mengaktifkan protein kinase SOS2. SOS2 yang teraktivasi kemudian akan mengatur aktivitas transporter ion atau aktivator transkripsional untuk menjaga kesetimbangan ion atau ekspresi gen. Target protein SOS2 termasuk Na+/H+ antiporter (SOS1), penukar Na+/H+ vakuola ( NHX), dan Na+ transporter (HKT1). Target potensial lainnya termasuk ATPase tonoplas dan pirofosfatase, saluran air, dan kalium transporter (Zhu 2003).
.Pengeluaran Na+ dari sel merupakan cara cepat untuk menghindari
akumulasi ion natrium di dalam sitosol. Di perkirakan bahwa pengeluaran ion
natrium mungkin lebih penting pada sel tertentu, misalnya sel epidermal akar. Hal
ini disebabkan karena sebagian besar sel lain di tanaman dikelilingi sel
tetangganya dan pengeluaran Na+ akan menimbulkan masalah bagi sel
tetangganya. Pada analisis ekspresi promoter SOS1-GUS menunjukkan bahwa
gen Na+/ H+ antiporter terekspresi dengan baik hanya pada sel epidermal yang
mengelilingi ujung akar dan di sel parenkima yang menyelubungi xylem diseluruh
tanaman (Shi et al. 2002a). Pada Arabidopsis thaliana, ekstrusi Na+ terjadi
[Na+] Tinggi
melalui Na+/ H+ antiporter SOS1 yang terlokalisasi di membran plasma (Shi et
al. 2000a; Shi et al. 2002b). Mutasi pada SOS1 menyebabkan tanaman mutan
menjadi sangat sensitif terhadap ion natrium(Wu et al. 1996).
Gambar 5. Stres oleh salinitas menghambat pengambilan ion K pada Arabidopsis. Dengan meningkatnya NaCl di dalam medium kultur, kandungan Na+ di dalam tanaman meningkat sedangkan kandungan K+ menurun. Kecambah Arabidopsis
(ecotype Columbia) ditumbuhkan di larutan ½MS (pH 5.3) selama 2 minggu yang diberi perlakuan NaCl. Kecambah ditumbuhkan selama 3 hari sebelum dipanen dan dianalisa kandungan ionnya (berdasarkan berat kering) (Xiong and Zhu 2002)
Toleransi terhadap cekaman salinitas merupakan suatu karakter yang
komplek melibatkan berbagai respon selular terhadap cekaman osmotik dan ionik,
demikian juga efek cekaman sekunder. Banyak penelitian yang mempelajari
berbagai efek cekaman salinitas dan melindungi tanaman dari reactive oxygen
species (ROS) sepertinya merupakan salah satu komponen penting dari karakter
tanaman yang toleran. Konsentrasi NaCl yang tinggi biasanya akan mengganggu
transpor elektron selular pada berbagai organel subselular dan menyebabkan
terbentuknya ROS seperti singlet oxygen, superoksida, hidrogen peroksida dan
[Ion]
(%)
radikal hidroksil (Noctor and Foyer 1998). Kelebihan ROS memicu reaksi
fitotoksik seperti peroksidasi lipid, degradasi protein dan mutasi DNA. Sumber
utama ROS adalah radikal superoksida, yang dibentuk diberbagai organel
subselular seperti mitokondria, kloroplas dan sitoplasma melalui sejumlah jalur
metabolik selama kondisi cekaman oksidatif (Noctor and Foyer 1998). Tingkat
kerusakan sel akibat proses peroksidasi ditentukan oleh potensi sistem enzim
antioksidatif (Gambar 6).
Untuk mengontrol jumlah ROS dan melindungi sel dibawah kondisi
cekaman, sel tanaman mempunyai sejumlah enzim untuk mendetoksikasi ROS
(superoksida dismutase, catalase, peroksidase dan glutathion peroksidase),
detoksikasi produk peroksidasi lipid (glutathion S-transferase,
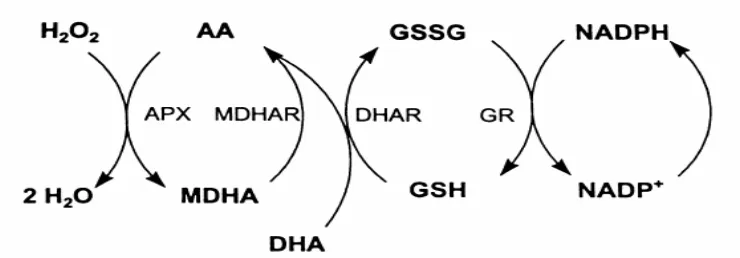
phospholipid-hidroperoksida glutathion peroksidase dan askorbat peroksidase) dan antioksidan
berberat molekul rendah (antosianin, α-tokoferol, askorbat, glutathion dan senyawa polifenol) serta seluruh enzim yang dibutuhkan untuk meregenerasi
bentuk aktif dari antioksidan (monodehidroaskorbat reduktase, dehidroaskorbat
reduktase dan glutathion reduktase, Gambar 7 (May et al. 1998; Blokhina et al.
2003)). Di dalam sel, superoksida dismutase (SOD) merupakan pertahanan
pertama terhadap ROS yang mengkatalisis dismutasi anion superoksida menjadi
oksigen dan hidrogen peroksida (H2O2). O2- dihasilkan disetiap tempat dimana
terdapat rantai transfer elektron dan oleh karena itu aktivasi O2 dapat terjadi di
organel yang berbeda (Elstner 1991), termasuk mitokondria, kloroplas, mikrosom,
glikosisom, peroksisom, apoplas dan sitosol. Oleh karena itu SOD dapat
ditemukan di semua lokasi subselular. Kloroplas, mitokondria dan peroksisom
SOD APX GPX
Berdasarkan penggunaan kofaktor logam oleh enzim, SOD dapat
dikelompokkan menjadi tiga: Fe-SOD, Mn-SOD dan Cu-Zn SOD dan ketiga
SOD ini terletak di kompartemen sel yang berbeda. Fe-SOD terdapat di
kloroplas, Mn-SOD di mitokondria dan peroxisome, dan Cu-Zn SOD terdapat di
kloropls, sitosol dan kemungkinan di ruang ekstraselular (Alscher et al. 2002).
Untuk mendetoksikasi H2O2 yang terbentuk, tanaman mengembangkan enzim
antioksidatif seperti peroksidase dan katalase. Peroksidase tanaman menggunakan
substrat yang berbeda seperti guaikol, askorbat dan glutathion untuk
mendetoksikasi H2O2 intraselular. Berdasarkan spesifisitas substrat peroksidase
dikelompokkan menjadi guaikol peroksidase, askorbat peroksidase and glutathion
peroksidase. H2O2 yang dihasilkan di glyoxysom dan peroxisom dalam proses β
-oksidasi didetoksikasi menjadi H2O oleh enzim katalase, sedangkan di organel
subselular lain H2O2 dikonversi menjadi H2O oleh enzim askorbat peroksidase
dan glutathion peroksidase (Halliwell and Gutteridge 1989; Sen-Gupta et al.
1993). .
Gambar 6. Model bagi induksi reactive oxygen species (radikal superoksida, hydrogen peroksida dan hidroksil) yang terjadi pada saat perlakuan dengan NaCl dan peranan enzim antioksidatif superoksida dismutase (SOD), askorbat peroksidase (APX) dan glutathion peroksidase (GPX) dalam mendetoksikasi radikal bebas superoksida, hidrogen peroksida dan hidrosil (Xiong and Zhu 2002).
Radikal Superoksida
NaCl Hidrogen
Gambar 7. Halliwell-Asada pathway (Siklus Askorbat-glutathione). APX, ascorbat-peroksidase; MDHAR, monodehidroaskorbat reduktase; DHAR, dehidroaskorbat reduktase; GR, glutathion reduktase (May et al 1998)
Chlorophyll A Oxygenase(CAO)
Klorofil merupakan inti dari proses fotosintesis dalam pemanenan energi
cahaya dan pengkonversiannya menjadi energi kimia. Tumbuhan darat, algae
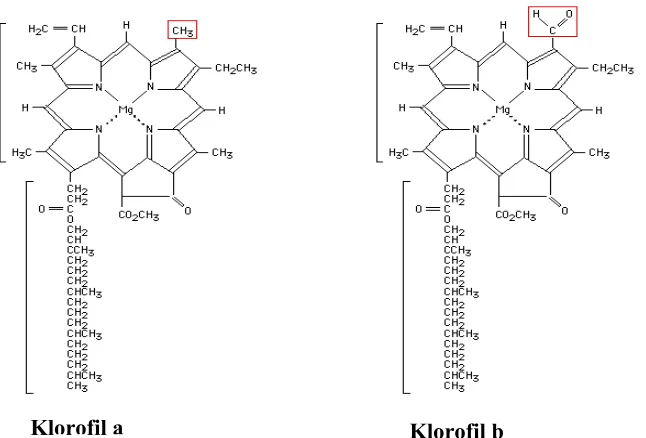
hijau dan proklorofita menghasilkan klorofil a dan klorofil b (Gambar 8). Klorofil
a sendiri terdapat di pusat reaksi dari komplek fotosistem yang memiliki
komposisi dan organisasi yang sangat konservatif. Di lain pihak, klorofil a dan
klorofil b merupakan komponen antena penangkap cahaya periferal. Komplek
antena penangkap cahaya memperlihatkan perubahan yang terkontrol dalam
beradaptasi terhadap berbagai kondisi pertumbuhan, yang memungkinkan
penggunaan yang optimal dari cahaya yang tersedia. Diketahui bahwa rasio
klorofil a dan b tinggi pada kondisi pertumbuhan dengan cahaya terang
dibandingkan pada kondisi pertumbuhan cahaya redup, dimana terjadi
pembesaran ukuran komplek antena penangkap cahaya pada kondisi cahaya redup
(Gambar 9) (Tanaka and Tanaka 2005). Oleh karena itu regulasi biosintesis
klorofil b menjadi sangat penting dalam memahami mekanisme adaptasi tanaman
Gambar 8. Struktur klorofil A dan klorofil B. Perbedaan terletak pada gugus dalam kotak merah. Pada klorofil a berupa gugus metil sedangkan klorofil b aldehida
Gambar 9. Struktur fotosistem II pada keadaan cahaya redup (atas) atau cahaya terang (tengah) pada tanaman tingkat tinggi tipe liar dan mutan tanpa klorofil b (bawah).
A. Protein-protein pusat reaksi (Chl a)
B. Protein-protein antena utama (Chl a)
C. Protein-protein antena periferal minor (Chl a, Chl b)
D. Protein-protein antena periferal mayor (Chl a, Chl b)
Kondisi intensitas cahaya rendah Kondisi intensitas cahaya tinggi
Mutan minus Chl b
Terdapat dua hipotesis mengenai regulasi ukuran antena penangkap
cahaya: regulasi oleh ekspresi gen-gen Lhc dan regulasi oleh biosintesis klorofil
b. Hipotesis pertama berdasarkan penemuan bahwa pola ekspresi gen-gen
tersebut berhubungan erat dengan ukuran antena (Maxwell et al. 1995; Escoubas
et al. 1995). Namun demikian, terdapat sejumlah bukti yang berlawanan dengan
hipotesis pertama dan cenderung mendukung hipotesis kedua. Pertama, pada
sejumlah mutan chl b-less, lebih banyak protein LHC yang hilang ketika jumlah
klorofil b menurun. Pada Arabidopsis thaliana mutan yang tidak bisa sama sekali
membentuk klorofil b, tidak ada protein LHC yang terbentuk (Espineda 1999),
sementara itu di barley mutan yang masih mengandung sejumlah kecil klorofil b,
satu atau lebih protein masih dapat ditemui (Bossmann et al 1997). Proses
transkripsi, translasi dan transpor protein LHC berjalan normal, menunjukkan
bahwa stabilitas protein LHC yang mengalami gangguan (Bellemare, 1982).
Kedua, prekursor protein LHC membutuhkan klorofil b untuk kestabilan
insersi ke dalam membran (Kuttkat et al. 1997). Ketiga, telah dibuktikan bahwa
mRNA Lhc dengan jumlah kurang dari 5% dari keadaan normalnya sudah cukup
untuk menghasilkan ukuran antena yang terbesar sekalipun. Flachman and
Kühlbrandt (1997) dan Flachman (1995) melakukan transformasi tanaman
tembakau dengan antisense gen Lhc. Di tanaman ini ekspresi gen Lhc mengalami
tekanan oleh ekspresi antisensenya. Uniknya, tingkat protein LHC tidak
mengalami perubahan bahkan pada tanaman transgenik yang hanya
mengekspresikan 5% mRNA dengan orientasi sense. Hasil ini menunjukkan
dalam membran dan transkripsi gen-gen Lhc bukanlah faktor utama yang
mengatur ukuran antena penangkap cahaya.
Transformasi Arabidopsis dengan gen CAO dibawah kontrol promotor
35S CaMV menunjukkan bahwa ukuran antena pada fotosistem II meningkat
antara 10-20% jika dibandingkan dengan tanaman tipe liarnya, hal ini
memperlihatkan bahwa biosintesis klorofil b dapat mengatur ukuran antena
penangkap cahaya pada tanaman (Tanaka et al. 2001).
Sebelum gen yang bertanggung-jawab dalam biosintesis klorofil b
ditemukan, sangat sedikit yang diketahui tentang jalur biosintesis klorofil ini.
Identifikasi gen untuk biosintesis klorofil b dilakukan dengan mutagenesis insersi
pada Chlamydomonas reinhardtii yang menghasilkan sejumlah chl b-less mutan.
Hasil analisis genom yang termutasi berhasil mengidentifikasi sebuah gen yang
diperkirakan suatu monooxygenase yang memiliki [2Fe-2S] Rieske center motif
dan mononuclear iron-binding motif (Tanaka et al. 1998). Kloning gen homolog
yang dilakukan menggunakan PCR dan pencarian dari database pada alga laut
prokariotik, Prochlorothrix dan Prochlorococcus, dan tanaman tingkat tinggi,
Arabidopsis thaliana menunjukkan bahwa gen ini konservatif dari prokariot
sampai tanaman tingkat tinggi (Tomitani et al. 1999).
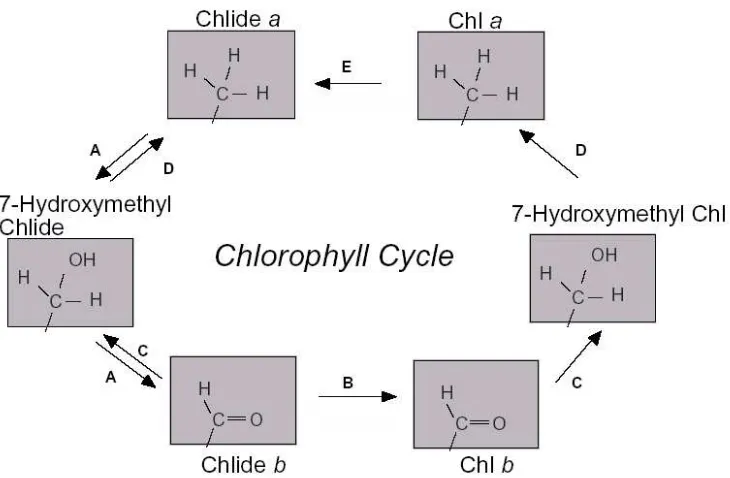
Protein dari gen yang diklon dari Arabidopsis thaliana dan diproduksi di
Escherichia coli mengkatalisis dua tahapan reaksi dari chlorophyllide (Chlide) a
menjadi Chlide b (Chlorophyllide merupakan prekursor tidak teresterifikasi dari
klorofil). Berdasarkan aktivitas ini, enzim ini dinamakan CAO (Chlorophyllide a
monooxygenase) (Tanaka and Tanaka 2005). Hal yang menarik adalah bahwa
pertama-tama harus di de-esterifikasi kembali menjadi clorophyllide a dan kemudian
dikonversi menjadi clorophyllide b dan kemudian diesterifikasi kembali menjadi
klorofil b(Oster et al. 2000).
Penemuan yang tidak terduga lainnya adalah bahwa CAO mengkatalisis
dua tahapan reaksi. Tahapan pertama adalah oksigenasi gugus metil menjadi
gugus hidroksil menghasilkan 7-hydroxymethyl-chlorophyll. Pada tahap kedua
gugus hidroksil dioksigenasi lagi menjadi gugus formil menghasilkan klorofil b.
Kedua tahapan ini membutuhkan NADPH dan ferredoxin sebagai tenaga
pereduksi (Tanaka and Tanaka 2005).
Walaupun sudah secara jelas dibuktikan dari eksperimen menggunakan
tanaman yang mengekspresikan secara berlebihan gen CAO bahwa biosintesis
klorofil b memegang peranan penting dalam mengatur ukuran antena, namun jalur
degradatif klorofil b tetap merupakan hal yang menarik untuk diketahui. Selama
ini jalur degradatif klorofil hanya diketahui untuk klorofil a saja, karena produk
degradatif klorofil a dapat teramati. Alasan mengapa tidak terdapat produk
degradatif klorofil b baru dapat diketahui setelah ditemukannya jalur konversi
klorofil b menjadi klorofil a (Ito et al. 1993). Sekarang telah diketahui bahwa
klorofil b pertama-tama dikonversi menjadi 7-hydroxymethyl-chl dan kemudian
direduksi menjadi klorofil a(Ito et al. 1994; Ito et al. 1996; Ito and Tanaka 1996;
Scheumann et al. 1996a; 1996b; Scheumann et al, 1998). Tahap pertama dan
kedua membutuhkan NADPH dan ferredoxin sebagai tenaga pereduksi
(Scheumann et al. 1998). Aktivitas dari tahap pertama meningkat selama proses
senescen pada daun (Scheumann et al. 1999). Penelitian yang dilakukan
kembali ke dalam protein pengikat klorofil, yang berarti bahwa jalur ini juga
berfungsi untuk menggunakan kembali klorofil b (Ohtsuka 1997). Mungkin saja
konversi klorofil b menjadi klorofil a dan aktivitas CAO dikoordinasi untuk
mengatur kesetimbangan antara klorofil a dan klorofil b. Oleh karena itu
interkonversi klorofil a dan klorofil b disebut "chlorophyll cycle" dan diperkirakan
siklus ini memainkan peranan penting dalam mengatur ukuran antena (Gambar
10) (Tanaka et al. 1998; Oster et al. 2000).
Salah satu tantangan kedepan dalam penelitian tentang klorofil b adalah
identifikasi protein atau gen yang terlibat dalam konversi klorofil b menjadi
klorofil a. Dengan selesainya sekuensing genom Arabidopsis thaliana
memungkinkan hal ini dapat dilakukan lebih mudah (The Arabidopsis Genome
Initiative 2000). Dengan mengklon gen yang terlibat dalam konversi klorofil b
menjadi klorofil a, memungkinkan dilakukannya pengujian hipotesis bahwa
degradasi klorofil memicu terjadinya proses senescen (Vincentini et al. 1995;
Matile et al. 1996). Jika hipotesis ini benar, memungkinkan ditundanya proses
senescen tanaman melalui supresi aktivitas konversi klorofil b menjadi klorofil a
dengan ekspresi berlebih antisense gen yang mengkode enzim pereduksi klorofil
b.
Transformasi yang diperantarai Agrobacterium:
Agrobacterium tumefaciens mempunyai peranan penting dalam
perkembangan rekayasa genetika tanaman dan penelitian dasar dalam biologi
molekular. Hampir 80% tanaman transgenik dihasilkan melalui cara ini. Pada
awalnya, orang percaya bahwa hanya tanaman dikotil, gymnosperma dan
beberapa spesies monokotil saja yang dapat ditransformasi menggunakan bakteri
ini; namun hasil yang dicapai baru-baru ini merubah secara total pandangan ini
yang diperlihatkan oleh beberapa spesies “rekalsitran” yang tidak termasuk inang
alami seperti monokotil dan fungi ternyata dapat ditransformasi (Chan et al.
1993;Bundock et al. 1995). Sebagai tambahan, sel yang tertransformasi biasanya
membawa jumlah kopi T-DNA terintregrasi dalam jumlah rendah didalam
genomnya dengan sedikit atau tanpa penantaan kembali, dan DNA berukuran
Dasar molekular transformasi genetik sel tanaman oleh Agrobacterium
tumefaciens adalah transfer dari bakteri dan integrasi ke dalam genom tanaman
suatu bagian dari plasmid Ti (tumor-inducing) atau Ri (rhizogenic-inducing)
(Gambar 11). Transfer T-DNA diperantarai oleh produk yang disandikan oleh
suatu daerah vir yang berukuran 30-40 kb pada plasmid Ti. Daerah ini terdiri
sedikitnya 6 operon esensial (vir A, vir B, vir C, vir D, vir E, vir G) dan dua non
esensial (vir F, vir H). Operon yang konstitutif hanya operon vir A dan vir G,
yang menyandikan sistem dua komponen (VirA-VirG) yang akan mengaktifkan
transkripsi gen-gen vir lainnya. Vir A merupakan suatu protein sensor dimer
transmembran yang dapat menditeksi molekul signal, terutama senyawa fenolik
kecil yang dilepaskan oleh tanaman yang terluka (Pan et al. 1993). Signal lain
bagi aktivasi Vir A diantaranya pH asam, senyawa fenolik seperti acetosyringon
(Winans et al. 1992) dan monosakarida jenis tertentu yang bekerja secara sinergis
dengan senyawa fenolik (Ankenbauer et al. 1990; Cangelosi et al. 1990; Shimoda
et al. 1990a; Doty et al. 1996).
Protein VirA secara struktural dapat dibagi menjadi tiga domain: domain
periplasma (input) dan dua domain transmembran (TM1 dan TM2). Domain TM1
dan TM2 bertindak sebagai suatu transmiter (signaling) dan penerima (sensor)
(Parkinson 1993). Domain periplasma sangat penting untuk deteksi monosakarida
(Chang and Winans 1992). TM2 merupakan suatu domain kinase dan mempunyai
peranan yang penting dalam aktivasi VirA yaitu memfosforilasi dirinya sendiri
pada residu His-474 (Huang et al. 1990; Jin et al. 1990a; 1990b) sebagai respon
atas molekul signal dari tanaman yang terluka. Deteksi monosakarida oleh VirA
fenolik yang rendah. Induksi sistem ini hanya mungkin melalui protein pengikat
gula (glukosa/galaktosa) periplasma ChvE (Ankenbauer and Nester 1990;
Cangelosi et al. 1990), yang berinteraksi dengan VirA (Shimoda et al. 1990b;
Chang and Winans 1992; Turk et al. 1993). VirA yang teraktivasi mempunyai
kemampuan untuk mentransfer gugus fosfatnya ke residu aspartat dari suatu
protein pengikat DNA sitoplasma VirG (Jin et al. 1990a; 1990b; Pan et al., 1993).
VirG berfungsi sebagai faktor transkripsional yang mengatur ekspresi gen-gen vir
lainnya ketika terfosforilasi oleh VirA (Jin et al. 1990a; 1990b). Daerah
C-terminal bertanggung-jawab untuk aktivitas pengikatan DNA sedangkan daerah
N-terminal adalah domain fosforilasi dan mempunyai kemiripan dengan domain
penerima signal VirA (sensor). Aktivasi sistem vir juga tergantung pada faktor
luar seperti suhu dan pH. Pada suhu yang melebihi 32°C, gen-gen vir tidak akan
terekspresi karena perubahan konformasi dalam proses pelipatan protein VirA
yang menyebabkan protein ini tidak aktif (Jin et al. 1993).
VirD1 dan VirD2 bertanggung-jawab untuk pembentukan T-strand,
T-DNA utas tunggal, dengan mengenali dan memotong secara spesifik utas bagian
bawah T-DNA pada kedua pembatas, yang mana batas kanan merupakan titik
awal dan sangat penting dalam proses ini. Setelah pemotongan, VirD2 tetap
terikat secara kovalen pada ujung 5’ utas T, membentuk suatu komplek dengan
karakter polar dimana ujung 5’ akan bertindak sebagai bagian kepala dalam
proses transfer. Komplek VirD2/utas T dan protein pengikat DNA utas tunggal
lain yang disebut VirE2 dipercaya ditransferkan secara terpisah ke dalam sel
tanaman melalui suatu struktur yang mirip pilus yang terdiri atas suatu komplek
menempel ke utas T karena adanya protein chaperonin yang disebut VirE1 (Deng
et al. 1999; Sundberg and Ream 1999). Sekali memasuki sel tanaman, molekul
VirE2 akan bersama-sama menempel ke utas T, membentuk komplek T
(Sundberg et al. 1996), yang kemudian ditargetkan ke dalam nukleus oleh
nuclear target signals (NLS) yang terdapat pada VirD2 dan VirE2, dimana
T-DNA diintegrasikan secara acak ke dalam genom tanaman dengan kopi tunggal
atau ganda. Mekanisme yang terlibat dalam integrasi T-DNA belum
terkarakterisasi, namun diperkirakan melibatkan proses rekombinasi yang tidak
BAHAN DAN METODE
Galur-galur bakteri dan plasmid
Bakteri dan plasmid yang digunakan pada penelitian ini tercantum pada Tabel1.
Tabel 1. Galur-galur Bakteri dan Plasmid yang Digunakan
Galur dan Plasmid Karakteristik Referensi
Galur E. coli DH5α
SupE44 ∆lacU169 (Ǿ80 lacZ∆M15) hsdR17 recA1 endA1 gyrA96 thi-1 relA1
Sambrook et al. (1989)
pOK-hemA pOK12 yang disisipi fragmen pada situs HindIII dan EcoRI hemA yang diklon Penelitian ini
pBBR1MCS2-AShemA Fragmen situs EcoRV dan hemA dari pOK-hemA disubklon pada EcoRI Penelitian ini
p35S-hemA Plasmid p35S-2 yang disisipi fragmen pada situs HindIII dan EcoRI hemA Penelitian ini
p35S-AshemA Fragmen yang diangkat dengan hemA dari pBBR1MCS2-AshemA EcoRV dan SpeI disubklon ke p35S-2 pada situs XbaI dan SmaI
Penelitian ini
pGII0029-hemA pGII0029 yang disisipi 35 dari p35S-hemA pada situs EcoRV hemA dibawah promotor Penelitian ini
pGII0029-AshemA
pAS900-CAO1
pGII0029 yang disisipi hemA pada posisi antisense dibawah promotor 35S dari p35S-AshemA pada situs EcoRV
pAS900 yang disisipi CAO pada situ SpeI dan
SacI
Penelitian ini
Pembuatan E. coli kompeten
E. coli strain DH5α ditumbuhkan dalam botol kultur berisi 25 ml medium LB selama 16 jam dengan pengocokan 150 rpm pada suhu 37°C. Keesokkan
harinya sebanyak 250 µl inokulum diinokulasikan ke dalam 25 ml medium LB
segar dan diinkubasi pada suhu 37°C dengan pengocokan 150 rpm selama 3 jam
atau sampai mencapai OD600 nm = 0.4. Kultur selanjutnya diinkubasikan diatas
es selama 30 menit dan sebanyak 3 ml dipanen dalam tabung eppendorf dengan
sentrifugasi pada kecepatan 5000 rpm selama 2 menit. Sel kemudian dicuci
dengan 1 ml larutan NaCl (0.1M NaCl, 5 mM Tris-Cl, 5 mM MgCl2, pH 7). Sel
yang telah dicuci ini kemudian diresuspensi dalam 1 ml larutan CaCl2 (0.1M
CaCl2, 5 mM Tris-Cl, 5 mM MgCl2, pH 7) selanjutnya diinkubasi selama 20
menit diatas es. Selasai inkubasi, sel diendapkan dengan sentrifugasi pada
kecepatan 5000 rpm 2 menit dan diresuspensikan kembali dalam 200 µl larutan
CaCl2 dan diinkubasi kembali selama 1 jam.
Transformasi E. coli
Sel kompeten yang telah dibuat dengan cara di atas kemudian
ditambahkan dengan 10µl hasil ligasi dan diinkubasi selama 45 menit diatas es.
Selanjutnya dilakukan kejutan pada suhu 42ºC selama 1 menit dan diinkubasikan
kembali diatas es selama 2 menit. Untuk recovery ditambahkan sebanyak 250 µl
LB dan diinkubasi selama 1 jam dengan digoyang pada kecepatan 170 rpm.
Setelah itu sel hasil transformasi disebar di atas media dengan antibiotik yang
sesuai dan diinkubasi selama semalam. Keesokan harinya transforman yang
Purifikasi DNA dari gel agarose
Fragmen DNA yang didapat dari hasil digesti dipisahkan dengan
elektroforesis gel agarose dan fragmen yang diinginkan dipotong keluar dari gel
menggunakan pisau scalpel bersih. DNA kemudian dipurifikasi menggunakan
QiaQuick spin columns (Qiagen, Studio City, CA) mengikuti protocol yang
disarankan oleh pembuatnya. Volume bufer elusi yang digunakan adalah 30µl
dan sebanyak 1 µl hasil elusi diukur konsentrasinya dengan spektrofotometer.
Isolasi DNA plasmid
Koloni bakteri yang didapat dari hasil transformasi ditumbuhkan di
medium LB dengan antibiotik yang sesuai selama semalam pada suhu 37°C.
Sebanyak 3 ml kultur dipelet dalam tabung eppendorf dengan sentrifugasi pada
kecepatan 13.000 rpm selama 2 menit. Supernatan kemudian dibuang dan
diresuspensikan dalam 200 µl bufer P1 (50 mM Tris-Cl pH 8, 10 mM EDTA pH
8, 10 mg/ml RNAse). Selanjutnya ditambahkan 200µl bufer P2 (0.2 N NaOH, 1%
SDS) dan dibolak-balik beberapa kali sampai lisis sempurna. Kemudian
ditambahkan 200 µl bufer P3 (3 M Kalium asetat bufer pH 5) dan divortex selama
10 detik. Selanjutnya sentrifugasi pada kecepatan 10.000 rpm selama 10 menit.
Supernatan kemudian pindahkan pada tabung baru dan diekstrak dengan 350µl
fenol:kloroform:isoamilalkohol (25:24:1) dan divortex selama 20 detik dan
disentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Fase air yang
terbentuk dipindahkan ke tabung baru dan dipresipitasi dengan 0.7 volume
isopropanol dingin dan diinkubasi di -20°C selama 10 menit. Setelah itu
disentrifugasi pada kecepatan 10.000 rpm selama 1 menit. Pelet yang terbentuk
kemudian dilarutkan dengan 50 µl dH2O. Sebanyak 5µl DNA digunakan untuk
analisis restriksi.
Konstruksi vektor ekspresi ALAS
Gen hemA diamplifikasi dari plasmid pUI1014 (Neidle and Kaplan 1993)
menggunakan primer IrawanHF (5’-CCCAAGCTTATGGACTACAATCTG-3’)
IrawanER (5’-ACCGGAATTCTCAGGCAACGACCTC) yang telah diberi
tambahan situs restriksi HindIII dan EcoRI menggunakan enzim DyNAzymeTM
EXT DNA Polymerase (FinnZymes, Singapore), kemudian diklon ke dalam
plasmid pOK12 (Vieira and Messing 1991) untuk menghasilkan plasmid
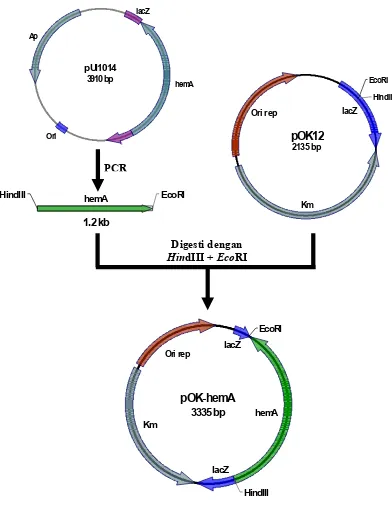
rekombinan pOK-hemA (Gambar 12). Fragmen hemA ini lalu disisipkan
dibawah promoter 35S pada plasmid p35S-2 (Hellens et al. 2000) yang telah
didigesti dengan enzim HindIII dan EcoRI (Gambar 13). Gen hemA yang telah
diletakkan dibawah promoter 35S dengan orientasi sense ini kemudian diklon ke
dalam plasmid pGII0029 (Hellens et al. 2000) pada situs EcoRV menghasilkan
plasmid rekombinan pGII0029-hemA (Gambar 14). Untuk mengkonstruksi gen
hemA dengan orientasi antisense, gen hemA yang telah diklon ke plasmid pOK12
(Vieira and Messing 1991) diangkat lagi menggunakan enzim EcoRI dan EcoRV
untuk disubklon ke plasmid pBBR1MCS2 (Kovach et al 1994) menghasilkan
plasmid rekombinan pBBR1MCS2-AShemA (Gambar 15). Kemudian fragmen
hemA diangkat kembali dengan enzim EcoRV dan SpeI untuk selanjutnya
disubklon ke plasmid p35S-2 yang telah didigesti dengan enzim XbaI dan SmaI
menghasilkan plasmid rekombinan p35S-AShemA (Gambar 16). Selanjutnya
diklon ke plasmid pGII0029 (Hellens et al. 2000) yang telah didigesti dengan
Gambar 13. Konstruksi gen hemA dibawah promoter 35S dengan orientasi sense
Gambar 16. Konstruksi binary vektor yang membawa gen hemA dibawah promoter 35S dengan orientasi antisense
Gambar 17. Peta plasmid pSOUP
Transformasi plasmid rekombinan ke Agrobacterium tumefaciens EHA 105
Transformasi plasmid dilakukan menggunakan metode freeze-thaw (An et
al. 1988) ke dalam Agrobacterium tumefaciens EHA 105 (Hood et al. 1993).
Plasmid rekombinan ditransformasi secara bersamaan dengan plasmid pSOUP
(Gambar 17) (Hellens et al. 2000). Agrobacterium thumefaciens EHA105
(pGII0029-hemA/AShemA) ditumbuhkan selama semalam pada suhu 28°C dalam
25 ml medium TYNG (10g/l Tripton, 5g/l ekstrak khamir, 5g/l NaCl, 1g/l
glukosa, 0.2 g/l MgSO4, pH 7.5). Keesokkan harinya dilakukan subkultur
sebanyak 1% ke medium yang baru dan diinkubasikan pada kondisi yang sama
selama semalam. Selanjutnya kultur didiamkan diatas es selama 10 menit
kemudian di panen dengan disentrifugasi pada kecepatan 5000 rpm 4°C selama
10 menit. Setelah supernatant dibuang, sel dicuci dengan 1 ml 20mM CaCl
dingin dan disentrifugasi kembali dengan kondisi yang sama. Sel kembali
diresuspensi dalam 1 ml 20 mM CaCl2 dingin. Kedalam 150 µl sel
Agrobacterium ditambahkan sebanyak 1µg plasmid dan dicampur rata kemudian
dibekukan dengan nitrogen cair selama 5 menit. Setelah itu dicairkan kembali
dengan meletakkannya diatas meja pada suhu ruang dan ditambahkan 1 ml LB
(10g/l Tripton, 5g/l ekstrak khamir, 5g/l NaCl) untuk kemudian diinkubasi selama
semalam pada suhu 28°C dengan kecepatan 200 rpm. Setelah kurang lebih 16
jam, kultur kemudian disebar diatas medium TYNG yang diberi antibiotic
kanamisin 50µg/ml dan tetrasiklin 2µg/ml diinkubasikan kembali sampai ada
Transformasi rekombinan binary vector ke Arabidopsis thaliana
Transformasi dilakukan dengan mencelupkan bunga tanaman Arabidopsis
thaliana ecotype Columbia ke dalam suspensi Agrobacterium tumefaciens
EHA105 (pGII0029-hemA) (Floral dip transformation)(Clough and Bent 1998)
sedangkan seleksi transforman dilakukan secara in solium (Xiang et al. 1999).
Arabidopsis thaliana ditumbuhkan sampai fase pembungaan di dalam
walk-in incubator dengan suhu 22°C dan penyinaran ~ 80 µE.m-2.s-1 selama 24
jam. Tanaman ditanam pada tabung PVC yang berdiameter 4.5 cm dengan tanah
(Trubus) yang dipasteurisasi. Untuk mencegah terjatuhnya tanah pada saat infeksi
bakteri, tabung ditutupi dengan kain kassa yang diikat dengan karet gelang
(Gambar 18a).
Tanaman ditumbuhkan selama 32-34 hari atau sampai tangkai bunga
mencapai panjang 2-9 cm dengan beberapa bunga yang telah mekar (Gambar
18b). Agrobacterium tumefaciens strain EHA105 (pGII029hemA) ditumbuhkan
selama semalam (~ 18 jam) pada medium cair YEP (10 g/l yeast extract, 10 g/l
peptone, 5 g/l NaCl) yang diberi antibiotik kanamisin (50 mg/l) dan diinkubasi
pada suhu 28°C dengan kecepatan 180 rpm. Sel bakteri kemudian dipanen
dengan sentrifugasi pada kecepatan 6000 g pada suhu 4°C selama 10 menit dan
diresuspensikan pada medium infeksi (5% sukrosa + 0.05% Agristick® (Bayer
CropScience, Jakarta) sehingga mencapai OD600 sekitar 0.80 (Clough and Bent
A B
Gambar 18. Tanaman Arabidopsis thaliana yang ditumbuhkan pada tabung PVC (A) dan siap diinfeksi (B)
Tanaman dicelupkan kedalam suspensi bakteri selama 3-5 detik dengandigoyang
secara perlahan (Gambar 19a) dan selanjutnya diberi selubung dengan ujung yang
ditutup untuk menjaga kelembaban dan mencegah perkawinan silang (Gambar
19b). Tanaman yang telah diinfeksi diinkubasi di ruang gelap selama semalam
sebelum dikembalikan ke kondisi lingkungan yang telah disiapkan. Plastik
penutup pada ujung selubung dibuka setelah 24 jam pasca infeksi. Tanaman
ditumbuhkan sampai menghasilkan biji untuk selanjutnya dilakukan seleksi untuk
mendapatkan kandidat tanaman yang tertransformasi.
A B
Seleksi kandidat tanaman transgenik dilakukan secara In-solium mengikuti
metode yang dikembangkan oleh Xiang et al. (1999). Biji yang telah dikeringkan
dikecambahkan secara langsung ditanah (1,000-3,000 biji pada wadah plastik
berdiameter 18). Setelah melewati tahap stratifikasi selama 3 hari pada suhu 4°C,
wadah dipindahkan ke walk-in incubator dengan penyinaran ~ 80 µE.m-2.s-1
selama 24 jam dan suhu 22°C. Setelah kecambah tumbuh dan dua daun
pertamanya telah muncul, dilakukan penyemprotan dengan kanamisin yang telah
dicampur dengan 0.1% Agristick® (Bayer CropScience, Jakarta).
Penyemprotan kanamisin dilakukan setiap hari dengan jumlah yang cukup
untuk membasahi seluruh permukaan daun. Tanaman disemprot dengan 100 mg/l
kanamisin selama 2 hari, dilanjutkan dengan 200 mg/l kanamisin selama 2 hari,
dan akhirnya dengan 500 mg/l kanamisin (Xiang et al. 1999). Selama tahap
seleksi kecambah ditutupi dengan plastic untuk mencegah efek terbakarnya daun
dan dehidrasi yang berlebihan akibat kombinasi perlakuan dengan antibiotik dan
surfaktan.
Analisis kandidat tanaman transgenik dengan PCR
Kandidat tanaman transgenik diisolasi total DNA genomnya menggunakan
metode dari Lassner et al. (1989): Sebanyak 0.2 g bahan tanaman segar digerus
dengan menggunakan nitrogen cair dan dimasukkan ke tabung 1.5 ml. Sebanyak
0.5 ml bufer isolasi (2% (w/v) CTAB, 1.4 M NaCl, 20 mM EDTA, 100 mM
Tris-HCl, pH 8.0, 0.2% ß-merkaptoetanol) ditambahkan kedalam tabung dan dicampur
dengan cara dibolak-balik sampai homogen. Selanjutnya dilakukan inkubasi pada
suhu 65˚C selama satu jam dengan setiap 10 menit dibolak-balik agar homogen.