PEMBUATAN DAN KARAKTERISASI BAHAN TABLET VITAMIN C MENGGUNAKAN KITOSAN DAN AMYLUM MANIHOT SEBAGAI
MATRIKS MELALUI METODE GRANULASI BASAH
SKRIPSI
NIA PERMATA SARI 060802022
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PEMBUATAN DAN KARAKTERISASI BAHAN TABLET VITAMIN C MENGGUNAKAN KITOSAN DAN AMYLUM MANIHOT SEBAGAI
MATRIKS MELALUI METODE GRANULASI BASAH
SKRIPSI
Diajukan untuk melengkapi tugas syarat untuk mencapai gelar Sarjana Sains
NIA PERMATA SARI 060802022
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PEMBUATAN DAN KARAKTERISASI BAHAN
TABLET VITAMIN C MENGGUNAKAN
KITOSAN DAN AMYLUM MANIHOT SEBAGAI MATRIKS MELALUI METODE GRANULASI BASAH
Kategori : SKRIPSI
Nama : NIA PERMATA SARI
Nim : 060802022
Program studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Desember 2010
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dr. Yuniarti Yusak, MS. Prof. BasukiWirjosentono.MS.Ph.D NIP. 130809726 NIP. 195204181980021001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PEMBUATAN DAN KARAKTERISASI BAHAN TABLET VITAMIN C
MENGGUNAKAN KITOSAN DAN AMYLUM MANIHOT SEBAGAI
MATRIKS MELALUI METODE GRANULASI BASAH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2010
NIA PERMATA SARI
KATA PENGANTAR
Syukur Alhamdulillah kehadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya kepada penulis, sehingga penulis dapat menyelesaikan penelitian dan
penulisan skripsi ini sebagaimana mestinya. Adapun skripsi ini disusun untuk
memenuhi syarat mencapai gelar sarjana di bidang kimia.
Pada kesempatan ini penulis ingin sekali menyampaikan rasa terimakasih dan
kasih sayang yang sebesar-besarnya kepada Ayahanda Abuzar Mandai dan Ibunda
Niswati Tanjung, Kakanda Nia Oktari, Adinda M. Hafiz, Adinda Nia Annisa Ferani,
Adinda M. Akbar, Adinda Nia Julia Ulfah serta seluruh keluarga lainnya yang telah
mendoakan, memberikan dukungan serta bantuan moril dan materil yang tak terhingga
nilainya kepada penulis.
Selanjutnya penulis ingin mengucapkan terimakasih kepada:
1. Bapak Prof. Basuki Wirjosentono, MS.Ph.D. selaku dosen pembimbing I dan
Ibu Dr. Yuniarti Yusak, MS. selaku dosen pembimbing II yang dengan ikhlas
dan senantiasa memberikan bimbingan dan pengarahan selama penulis
melakukan penelitian dan penulisan skripsi ini.
2. Ibu Dr. Rumondang Bulan Nst, MS. dan Bapak Drs. Firman Sebayang, MS.
selaku ketua dan sekretaris jurusan kimia yang telah mensyahkan skripsi ini.
3. Bapak Prof. Dr. Thamrin, MSc. selaku dosen wali yang selalu membimbing
penulis.
4. Sahabat-sahabat dekatku : Afrima, Meniq, Fatma serta seluruh teman-teman
rekan seperjuanganku stambuk 2006 terutama Maria.
5. Rekan-Rekan Asisten Kimia Fisika tercinta: Bang Fendy, Bang Fadli, Kak
Tarra, Kak Sri, Kak Sari, Kak Kiki, Kak Rina, Kak Rahma, Kak Mega, Bang
Misbah, Ismail, Ai, Amy, Reni, serta adik-adik : Wulan, Fika, Destia, Tisna,
Semoga Allah SWT memberikan imbalan yang berlipat ganda akan kebaikan
kita semua.
Akhirnya penulis menyadari atas kekurangan materil dan keterbatasan literatur
yang disajikan dalam skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan
saran yang bersifat membangun demi kesempurnaan skripsi ini. Semoga skripsi ini
bermanfaat dan menjadi informasi yang baru bagi penelitian selanjutnya.
Medan, Desember 2010
Penulis,
ABSTRAK
Telah dilakukan penelitian mengenai keunggulan kitosan sebagai bahan pengisi dibandingkan amylum manihot dalam pembuatan bahan tablet vitamin C menggunakan metode granulasi basah. Suplemen vitamin C dibuat dalam 3 jenis formula dengan variasi perbandingan amilum dengan kitosan sebesar 100:0; 50:50; dan 0:100 (% b/b). Pengujian yang dilakukan meliputi sifat aliran granul melalui perhitungan laju alir dan sudut istirahat granul melalui metode corong; Penentuan laju disolusi vitamin C pada menit ke 2; 4; 6; 8; dan 10 menggunakan metode spektroskopi UV-Visibel serta interaksi intermolekular melalui hasil kajian FT-IR. Dari pengolahan data diperoleh bahwa: Suplemen matriks kitosan memiliki sifat aliran yang baik dengan nilai laju alir dan sudut diam masing-masing sebesar 16,95 g.det-1 dan 27,980, juga memiliki laju disolusi yang baik dengan nilai kelarutan vitamin C pada menit ke 2; 4; 6; 8; dan 10 masing-masing sebesar 0,0907; 0,4828; 2,246; 4,2311; dan 7,1815
THE MAKING AND CHARACTERIZATION SUPLEMEN OF VITAMIN C USING CHYTOSAN AND AMYLUM MANIHOT AS A MATRIX BY WET
GRANULATION METHOD
ABSTRACT
The research have done about the advantage of chytosan as a matrix comparison with amylum manihot in the making of vitamin C suplemen made by wet granulation method. The suplemen of vitamin C was made became 3 kinds of formula by variation of amylum manihot to chytosan were 100:0; 50:50; 0:100 (%w⁄w). Test characteristic include the flow of granule with measure speed flow and inactive angle using funnel method; the dissolution test of vitamin C at the various time 2; 4; 6; 8; and 10 minutes using spectroscopy UV-Visible methods and intermolecular interaction using spectroscopy Infra Red method. The result showed that: Suplemen of vitamin C with chytosan as a matrix have a flow properties was very well with value the speed flow and inactive angle as 16,95 g.sec-1 and 27,980; the disolution of vitamin C was very well with value of vitamin C solubility 0,0907; 0,4828; 2,246; 4,2311; and 7,1815
DAFTAR ISI
DAFTAR LAMPIRAN 14
BAB I PENDAHULUAN
1.1. Latar Belakang 15
1.2. Permasalahan 17
1.3. Tujuan Penelitian 17
1.4. Pembatasan Masalah 17
1.5. Manfaat Penelitian 18
1.6. Metodologi Penelitian 18
1.7. Lokasi Penelitian 19
BAB II TINJAUAN PUSTAKA 2.1. Kitosan
2.1.1. Struktur Kitosan 20
2.1.2. Sifat-Sifat Kitosan 21
2.1.3. Prospek Aplikasi Kitosan 22
2.2. Vitamin C
2.2.1. Struktur Vitamin C 23
2.2.2. Sifat-Sifat Umum Vitamin C 23
2.2.3. Farmakokinetik 24
2.2.4. Fungsi Vitamin C 24
2.2.5. Defisiensi Vitamin C 25
2.2.6. Sumber-Sumber Vitamin C 25
2.3. Pati
2.3.1. Amilosa 26
2.3.2. Amilopektin 27
2.3.3. Kegunaan Pati 28
2.4. Tablet
2.4.1. Granulasi 29
2.4.1.1. Pembuatan Bahan Tablet Menggunakan 29 Metode Granulasi Basah
2.4.1.2. Mekanisme Granulasi Basah 30
2.4.2. Bahan Pengikat 30
2.4.3. Karakter Fisik Granul
2.4.3.1.1. Kecepatan Aliran Granul 31 2.4.3.1.2. Sudut Istirahat Granul 32 2.5. Spektrofotometri Ultra Violet dan Visibel (UV-VIS)
2.5.1. Instrumentasi 34
2.5.2. Hukum Lambert-Beer 34
2.6. Spektrofotometri Infra Merah
2.6.1. Kegunaan Analisa Spektroskopi Infra Merah 36 2.6.2. Syarat – Syarat Interpretasi Spektrum 36 2.6.3. Spektrum Infra Merah Bahan Polimer 37 BAB III METODE PENELITIAN
3.1. Alat – Alat 38
3.2. Bahan – Bahan 38
3.3. Prosedur Percobaan
3.3.1. Isolasi Amilum Dari Umbi Singko ng 39 (Manihot Utilissima)
3.3.2. Pembuatan Granul Dengan Metode Granulasi Basah 39 3.3.2.1. Pembuatan Bahan Pengikat Musilago Amylum 39 3.3.2.2. Pencampuran Bahan Aktif dan Pengisi Dengan 41 Penambahan Musilago Amylum Sebagai Pengikat 3.3.3. Karakterisasi Sifat Aliran Dengan Menghitung 42 Kecepatan Alir dan Sudut Istirahat Granul Melalui
Metode Corong.
3.3.4. Karakterisasi Laju Disolusi Bahan Aktif Vitamin C 43 Dengan Metode Spektoskopi UV-Visibel
3.3.4.1. Pembuatan Larutan HCl 0,1 N 43 3.3.4.2. Pembuatan Larutan Standar Kurva Kalibrasi 43
Vitamin C
3.3.4.2.1. Larutan Induk Standar Vitamin C 43 500 μg/ml
3.3.4.2.2. Larutan Induk Standar Vitamin C 43 100 μg/ml
3.3.4.2.3. Larutan Standar 8 μg/ml Untuk 43 Pembuatan λmaks
3.3.4.2.4. Larutan Seri Standar Vitamin C 44 Vitamin C
Untuk Pembuatan Kurva Kalibrasi
3.3.4.3. Pembuatan Kurva Kalibrasi Vitamin C 44 3.3.4.2.1. Penentuan λmaks
Vitamin C
Larutan Standar 44 3.3.4.2.2. Penentuan Kurva Kalibrasi Larutan 44
Standar Vitamin C
3.3.4.4. Penentuan Laju Disolusi Vitamin C Dalam 44 Interval Waktu Pengambilan Sampel Larutan
Pada Saat Ekstraksi
3.3.5. Karakterisasi Interaksi Intermolekular Bahan Selama 45 Proses Pencampuran Dalam Pembuatan Granul Melalui
Analisis FT-IR 3.4. Bagan Percobaan
3.4.2. Bagan Pembuatan Bahan Pengikat Musilago Amylum 47 3.4.3. Bagan Pembuatan Granul Suplemen Vitamin C 48 Menggunakan Kitosan dan Amylum Manihot Sebagai
Matriksnya
3.4.4. Bagan Pengambilan Data Untuk Menghitung Kecepatan 49 Alir dan Sudut Istirahat Granul Menggunakan Metode BAB IV HASIL DAN PEMBAHASAN
4.1. Analisa Sifat Aliran Granul Dengan Menghitung Kecepatan 52 Aliran dan Sudut Istirahat Granul Dengan Metode Corong.
4.1.1. Data Hasil Pengukuran 52
4.1.2. Pengolahan Data 53
4.1.3. Analisa Sifat Aliran Granul 54
4.1.4. Pembahasan 54
4.2. Penentuan Laju Disolusi Vitamin C Dalam Interval Waktu 55 Pengambilan Sampel Larutan Pada Saat Ekstraksi
4.2.1. Penentuan Kadar Vitamin C Menggunakan Persamaan 56 Garis Regresi Metode Least Square
4.2.2. Pembahasan 57
4.3. Analisis Spektroskopi FT-IR
4.3.1. Spektrum FT-IR Amilum/(Starch) 59
4.3.2. Spektrum FT-IR Kitosan 60
4.3.3. Spektrum FT-IR Vitamin C 61
4.3.4. Spektrum FT-IR Material Campuran Amilum-Vitamin C 62 4.3.5. Spektrum FT-IR Material Campuran Kitosan-Vitamin C 63 4.3.6. Spektrum FT-IR Material Campuran Amilum-Kitosan- 64 Vitamin C
4.3.7. Pembahasan 65
BAB V KESIMPULAN DAN SARAN 67
5.1. Kesimpulan 5.2. Saran
DAFTAR PUSTAKA 68
DAFTAR TABEL
Halaman Tabel 2.1. Hubungan Antara Kecepatan Alir Dengan Sifat Aliran Granul 32 Tabel 2.2. Hubungan Sudut Istirahat Dengan Tipe Aliran 33
Tabel 3.1. Formulasi Granul 39
Tabel 4.1. Data Hasil Pengukuran Waktu Alir Granul Serta Tinggi 52 dan Diameter Timbunan Granul
Tabel 4.2. Data Hasil Perhitungan Kecepatan Alir dan Sudut Istirahat Granul 53 Tabel 4.3. Data Hasil Analisa Sifat Aliran Granul Yang Dihasilkan 54 Tabel 4.4. Data Absorbansi Larutan Seri Standar Vitamin C 56 Tabel 4.5. Data Absorbansi dan Kadar Vitamin C Pada Sampel Larutan 57 Yang Diambil Dalam Interval Waktu Tertentu Selama Proses
Ekstraksi Dari Formula A, B, dan C
Tabel F.1. Penurunan Persamaan Garis Regresi Metode Least Square 77 Kurva Kalibrasi Dari Larutan Seri Standar Vitamin C
DAFTAR GAMBAR
Halaman
Gambar 2.1. Struktur Kitosan 21
Gambar 2.2. Struktur Vitamin C 23
Gambar 2.3. Struktur Amilosa 27
Gambar 2.4. Struktur Amilopektin 27
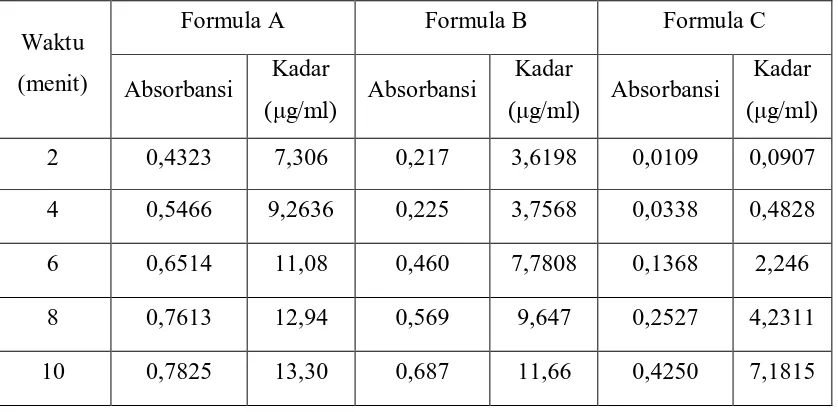
Gambar 4.1. Grafik Kadar Vitamin C Yang Terlarut Pada Granul 58 Formula A, B dan C
Gambar 4.2. Spektrum FT-IR Amilum/(Starch) 59
Gambar 4.3. Spektrum FT-IR Kitosan 60
Gambar 4.4. Spektrum FT-IR Vitamin C 61
DAFTAR LAMPIRAN
Halaman Lampiran A. Perhitungan Pembuatan Larutan Pereaksi HCl 0,1 N 71 Lampiran B. Perhitungan Konsentrasi Larutan Standar yang Digunakan 72
Untuk Menentukan λmaks
Lampiran C. Perhitungan Konsentrasi Larutan Seri Standar Vitamin C 73 Larutan Vitamin C
Untuk Pembuatan Kurva Kalibrasi
Lampiran D. Kurva Spektrum λmaks
Lampiran E. Kurva Kalibrasi Larutan Seri Standar Vitamin C 76 Larutan Standar Vitamin C 8 µg/ml 75
Lampiran F. Pengolahan Data Metode Least Square Hasil Pengukuran 77 Absorbansi Larutan Seri Standar Vitamin C
ABSTRAK
Telah dilakukan penelitian mengenai keunggulan kitosan sebagai bahan pengisi dibandingkan amylum manihot dalam pembuatan bahan tablet vitamin C menggunakan metode granulasi basah. Suplemen vitamin C dibuat dalam 3 jenis formula dengan variasi perbandingan amilum dengan kitosan sebesar 100:0; 50:50; dan 0:100 (% b/b). Pengujian yang dilakukan meliputi sifat aliran granul melalui perhitungan laju alir dan sudut istirahat granul melalui metode corong; Penentuan laju disolusi vitamin C pada menit ke 2; 4; 6; 8; dan 10 menggunakan metode spektroskopi UV-Visibel serta interaksi intermolekular melalui hasil kajian FT-IR. Dari pengolahan data diperoleh bahwa: Suplemen matriks kitosan memiliki sifat aliran yang baik dengan nilai laju alir dan sudut diam masing-masing sebesar 16,95 g.det-1 dan 27,980, juga memiliki laju disolusi yang baik dengan nilai kelarutan vitamin C pada menit ke 2; 4; 6; 8; dan 10 masing-masing sebesar 0,0907; 0,4828; 2,246; 4,2311; dan 7,1815
THE MAKING AND CHARACTERIZATION SUPLEMEN OF VITAMIN C USING CHYTOSAN AND AMYLUM MANIHOT AS A MATRIX BY WET
GRANULATION METHOD
ABSTRACT
The research have done about the advantage of chytosan as a matrix comparison with amylum manihot in the making of vitamin C suplemen made by wet granulation method. The suplemen of vitamin C was made became 3 kinds of formula by variation of amylum manihot to chytosan were 100:0; 50:50; 0:100 (%w⁄w). Test characteristic include the flow of granule with measure speed flow and inactive angle using funnel method; the dissolution test of vitamin C at the various time 2; 4; 6; 8; and 10 minutes using spectroscopy UV-Visible methods and intermolecular interaction using spectroscopy Infra Red method. The result showed that: Suplemen of vitamin C with chytosan as a matrix have a flow properties was very well with value the speed flow and inactive angle as 16,95 g.sec-1 and 27,980; the disolution of vitamin C was very well with value of vitamin C solubility 0,0907; 0,4828; 2,246; 4,2311; and 7,1815
BAB I
PENDAHULUAN
1.1. Latar Belakang
Kitosan merupakan produk deasetilasi kitin melalui proses reaksi kimia menggunakan
basa natrium hidroksida atau reaksi enzimatis menggunakan enzim chitin deacetylase.
Serat ini bersifat tidak dicerna dan tidak diserap tubuh. Sifat menonjol kitosan adalah
kemampuan mengabsorpsi lemak hingga 4-5 kali beratnya. Untuk meningkatkan
efektivitas pengikat lemak, kapsul kitosan dicampur dengan asam sitrat dan asam
askorbat. Penambahan asam askorbat meningkatkan jumlah lemak yang hilang sebagai
feses dan dapat menurunkan penyerapan lemak oleh tubuh hingga 50 %. Penambahan
asam askorbat juga berfungsi sebagai antioksidan untuk mengurangi jumlah radikal
bebas (http://4-healthyfood.blogspot.com).
Kitosan memiliki struktur molekul yang hampir sama dengan struktur molekul
senyawa turunan karbohidrat lainnya seperti selulosa dan amilum. Selulosa dan
amilum telah sering digunakan sebagai bahan tambahan/pengisi dalam proses
pembuatan bahan dasar tablet. Komponen utama bahan dasar tablet adalah bahan
aktif/obat, sering kali bahan aktif diperlukan dalam dosis yang kecil. Agar dapat
mudah dicetak menjadi tablet, diperlukan bahan pengisi tambahan untuk
mencukupkan massa agar mudah dicetak.
Bahan-bahan dasar massa cetak tablet harus dicampur hingga homogen dan
dibuat menjadi bentuk granul. Proses pembuatan granul ini dapat dilakukan dengan
dua metode yaitu metode granulasi basah dan metode granulasi kering. Metode
granulasi basah yang paling sering digunakan karena memiliki beberapa keuntungan
penggunaan bahan pengikat yang ditambahkan ke dalam campuran bahan dasar yang
telah dihomogenkan untuk memperoleh massa granul.
Berdasarkan latar belakang di atas, maka peneliti tertarik untuk melakukan
penelitian dengan memanfaatkan biopolimer kitosan sebagai matriks/bahan pengisi
dalam pembuatan bahan dasar suplemen vitamin C sebelum dicetak menjadi tablet.
Pemanfaatan kitosan sebagai matriks dalam pembuatan suplemen Vitamin C dapat
mengurangi pengaruh nyeri lambung karena sistem pelepasan vitamin C secara
berkala oleh kitosan di dalam tubuh dan untuk mencegah terjadi naiknya kolesterol
dalam darah karena kemampuan kitosan dalam menyerap lemak.
Bahan tablet ini diproses menjadi granul melalui metode granulasi basah.
Granul yang dihasilkan akan dikarakterisasi sesuai standar massa cetak granul sebelum
dicetak menjadi tablet untuk melihat apakah kitosan mempunyai kemampuan yang
sama dengan matriks yang umum digunakan seperti amylum manihot sebagai matriks
dalam pembuatan bahan tablet.
Karakterisasi bahan tablet berupa granul yang dihasilkan akan dikarakterisasi
secara fisika dan kimia. Karakterisasi fisika yaitu karakterisasi sifat aliran dengan
menghitung kecepatan alir dan sudut istirahat granul yang dihasilkan untuk melihat
apakah granul yang dihasilkan mempunyai sifat fisika massa cetak tablet yang baik
melalui metode corong. Karakterisasi kimia meliputi uji laju disolusi bahan aktif
melalui metode spektroskopi UV-Visibel dan uji interaksi intermolekular antar bahan
yang mungkin terjadi selama proses pencampuran bahan menjadi granul melalui
metode spektroskopi infra merah (FT-IR).
Telah diteliti sebelumnya oleh Ang Lee Fung (2007) dalam pembuatan
membran kitosan sebagai biosensor glukosa. Hasil kajian analisis FT-IR menunjukkan
interaksi intermolekular antara kitosan dan glukosa oksidase (GOD) melalui
ikatan-silang dengan glutaraldehid pada proses penyerapannya (Fung, A.L., 2007).
Berdasarkan hal tersebut, peneliti juga tertarik untuk mengetahui apakah terjadi
interaksi intermolekular antar bahan selama proses pencampuran bahan menjadi granul
1.2. Permasalahan
1. Bagaimanakah pengaruh penggunaan kitosan sebagai matriks terhadap sifat
aliran granul jika dibandingkan dengan matriks amylum manihot.
2. Bagaimanakah laju disolusi bahan aktif yaitu vitamin C dalam granul setelah
dicampurkan dengan matriks kitosan dan amylum manihot.
3. Apakah interaksi intermolekular terjadi antar bahan selama proses
pencampuran bahan menjadi granul.
1.3. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Untuk mengetahui pengaruh penggunaan kitosan sebagai matriks terhadap sifat
aliran granul jika dibandingkan dengan matriks amylum manihot.
2. Untuk mengetahui laju disolusi bahan aktif yaitu vitamin C dalam granul
setelah dicampurkan dengan matriks kitosan dan amylum manihot.
3. Untuk mengetahui interaksi intermolekular yang terjadi antar bahan selama
proses pencampuran bahan menjadi granul.
1.4. Pembatasan Masalah
Dalam penelitian ini hanya dibatasi untuk pembuatan granul suplemen vitamin C,
dengan memvariasikan kitosan dan amilum yang digunakan sebagai matriksnya.
Parameter yang diamati meliputi karakterisasi sifat fisika dan kimia granul yang
dihasilkan. Karakterisasi sifat fisika yaitu karakterisasi sifat aliran dengan menghitung
kecepatan aliran dan sudut istirahat granul yang dihasilkan sesuai standar massa granul
yang baik sebelum dicetak menjadi tablet melalui metode corong. Karakterisasi sifat
kimia meliputi uji disolusi bahan aktif yaitu vitamin C setelah dicampurkan dengan
matriks melalui metode spektroskopi UV-Visibel dan uji interaksi intermolekular yang
mungkin terjadi antar bahan selama proses pencampuran bahan menjadi granul
1.5. Manfaat Penelitian
Adapun hasil dari penelitian diharapkan dapat digunakan sebagai bahan informasi
tentang manfaat kitosan sebagai aplikasinya dalam bidang farmasi dan biomedikal
serta sebagai bahan penelitian lebih lanjut mengenai karakteristik kitosan melalui
interaksinya dengan senyawa lain.
1.6. Metodologi Penelitian
Penelitian ini bersifat eksperimental laboratorium yaitu untuk mengetahui sejauh mana
kitosan dapat digunakan sebagai matriks pada pembuatan granul suplemen vitamin C
melalui karakterisasi fisika dan kimia granul yang dihasilkan.
Granul suplemen vitamin C dibuat melalui metode granulasi basah
menggunakan amylum manihot dan kitosan sebagai matriks atau bahan pengisi
tambahan. Pembuatan granul melalui metode granulasi basah tidak lepas dari peran
penggunaan bahan pengikat untuk mengubah bahan campuran berpartikel halus
menjadi partikel dalam bentuk kasar yang disebut dengan granul. Peneliti memilih
menggunakan amylum manihot sebagai perekat karena merupakan bahan yang umum
digunakan sebagai bahan pengikat dan mudah diperoleh.
Tahapan penelitian meliputi :
1. Isolasi amilum dari umbi singkong (Manihot Utilissima)
2. Pembuatan granul melalui metode granulasi basah.
2.1. Pembuatan bahan perekat musilago amylum/gelatin dari amylum manihot.
2.2. Pencampuran bahan aktif dan pengisi hingga homogen dan penambahan
bahan pengikat hingga diperoleh massa granul yang kompak.
3. Karakterisasi fisik granul yaitu karakterisasi sifat aliran dengan menghitung
4. Karakterisasi kimia granul meliputi :
4.1. Uji laju disolusi bahan aktif melalui metode spektroskopi UV-Visibel.
4.2. Uji interaksi intermolekular yang terjadi antar bahan selama proses
pencampuran bahan menjadi granul melalui metode spektroskopi infra merah
(FT-IR).
Adapun parameter yang digunakan antara lain :
1. Parameter tetap meliputi :
1.1 Massa vitamin C
1.2. Massa bahan pengikat musilago amylum
2. Parameter bebas meliputi :
Massa kitosan : massa amylum manihot (0:100 ; 50:50 ; 100:0) % b�b
3. Parameter terikat meliputi :
3.1. Karakterisasi sifat aliran granul dengan menghitung kecepatan alir dan
sudut istirahat granul melalui metode corong.
3.2. Karakterisasi laju disolusi bahan aktif yaitu vitamin C dalam granul setelah
dicampurkan dengan matriks kitosan dan amylum manihot.
3.3. Karakterisasi interaksi intermolekular yang mungkin terjadi antar bahan
selama proses pencampurann bahan menjadi granul melalui hasil analisa
spektroskopi infra merah ( FT-IR ).
1.7. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Fisika F-MIPA USU dan
Laboratorium Kuantitatif F-FARMASI USU serta uji FT-IR di Laboratorium Bea
BAB II
TINJAUAN PUSTAKA
2.1. Kitosan
Cangkang dari lobster, kumbang, dan laba-laba mengandung kitin. Kitin merupakan
polisakarida terbanyak kedua yang berlimpah di alam (selulosa merupakan yang
terbanyak). Kitin merupakan bahan polimer yang memiliki struktur yang keras.
Tersusun atas N-asetil-d-glukosamin yang lebih banyak dari glukosa, tetapi
mempunyai struktur yang hampir sama dengan selulosa (McMurray, J., 2007).
Kitosan adalah biopolimer alami terutama sebagai penyusun cangkang
(kulit-kulit keras), udang-udangan, dan serangga, serta penyusun dinding sel ragi dan jamur.
Karena sifatnya yang khas seperti bioaktivitas, biodegradasi, dan kelihatannya kitosan
dapat memberikan kegunaan yang diterapkan dalam berbagai bidang (Manskarya,S.M.
& Drodsora, 1968).
2.1.1. Struktur Kitosan
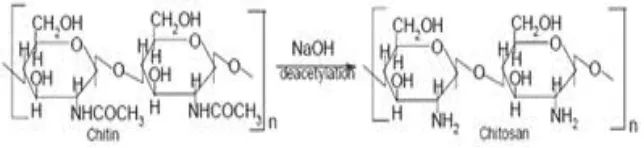
Kitosan ditemukan oleh Rouget pada tahun 1959. Kitosan memiliki struktur
{(1-4)-2-Amino-2-Deoksi-β-D-Glukosa}. Perbedaan kandungan amina adalah sebagai patokan
untuk menentukan apakah polimer ini dapat dibentuk menjadi kitin atau kitosan.
Kitosan mengandung gugus amina lebih besar 60%, sebaliknya amina lebih kecil 60%
Kitosan juga terdapat secara alami dalam beberapa jamur namun tidak
sebanyak kitin. Struktur idealnya dapat dilihat dari gambar dibawah ini :
Gambar 2.1. Struktur Kitin dan Kitosan
2.1.2. Sifat – Sifat Kitosan
Kitosan adalah suatu senyawa yang memiliki rantai linear dari D-Glukosamin dan
N-Asil D-Glukosamin yang terangkai pada posisi β (1-4). Kitosan dihasilkan dari
deasetilasi kitin. Karena dalam bentuk kationik, bentuk kitosan yang tidak larut dalam
air akan membentuk polielektronik dengan anion polielektronik. Kitosan telah
digunakan dalam bidang biomedikal dan farmasi karena kitosan bersifat
biokompatibel, biodegradasi dan tidak beracun. Sifat basa ini menjadikan kitosan:
1. Dapat larut dalam media asam encer membentuk larutan yang kental sehingga
dapat digunakan dalam pembuatan gel. Dalam beberapa variasi konfigurasi
seperti butiran, membran, pelapis kapsul, serat dan spons.
2. Membentuk kompleks yang tidak larut dengan air dengan polianion yang dapat
juga digunakan untuk pembuatan butiran gel, kapsul dan membran.
3. Dapat digunakan sebagai pengkelat ion logam berat dimana gelnya
menyediakan sistem produksi terhadap efek dekstruksi dari ion (Meriaty,
2002).
Kitosan tidak larut dalam air, pelarut-pelarut organik, juga tidak larut dalam
maka dapat larut dalam air - metanol, air - etanol, dan campuran lainnya. Kitosan larut
dalam asam formiat dan asam asetat dan menurut Peniston dalam 20% asam sitrat juga
dapat larut. Asam organik lainnya juga tidak dapat melarutkan kitosan, asam-asam
anorganik lainnya pada pH tertentu setelah distirer dan dipanaskan dan asam sitrat
juga dapat melarutkan kitosan.
Kitosan bersifat polikationik yang dapat mengikat lemak dan logam berat
pencemar. Kitosan yang mempunyai gugus amina yaitu adanya unsur N bersifat sangat
reaktif dan bersifat basa (Inoue et al, 1994).
Kitosan dalam bentuk terprotonasi menunjukkan kerapatan muatan yang tinggi
dan bersifat sebagai polielektrolit kationik dan sangat efektif berinteraksi dengan
biomolekul bermuatan negative dan biomolekul permukaan. Sedangkan dalam bentuk
netralnya, kitosan mampu mengompleks ion logam berat berbahaya seperti Cu, Cr, Cd,
Co, Ph, Hg, Zn, dan Pd (Sugita, P., 2009).
2.1.3. Prospek Aplikasi Kitosan
Kitosan banyak dimanfaatkan dalam bidang biomedik, farmasi, pengawetan pangan,
mikrobiologi, dan lain-lain. Beberapa fungsi kitosan adalah sebagai aktivitas
antimikroba, koagulasi darah, mempercepat pembentukan fibroblast dalam tubuh
binatang dan yang lainnya.
Kitosan teregenerasi adalah aplikasi lain yang menonjol pada masa yang akan
datang untuk tujuan biomedik karena sifatnya yang biodegradabel dengan toksisitas
rendah dan biokompatibilitas dalam tubuh binatang. Banyak fungsi kitosan yang telah
dipublikasikan, fungsi ini termasuk biodegradabilitas dalam tubuh binatang, aktivitas
antimikroba, flokulan, adsorbsi logam berat dan sebagai pembawa untuk sistem
2.2. Vitamin C ( Asam Askorbat )
Vitamin ini digolongkan sebagai vitamin yang larut dalam air. Susunan kimia vitamin
C ditemukan pada tahun 1933 oleh ilmuwan Inggris dan Swiss. Isolasi asam askorbat
mula-mula ditemukan oleh King dari USA dan Szent-Gyorgy dari Hungaria. Vitamin
ini mempunyai dua bentuk, yaitu bentuk oksidasi (bentuk dehidro) dan bentuk reduksi.
Kedua bentuk ini mempunyai aktivitas biologi. Dalam makanan bentuk reduksi yang
terbanyak. Bentuk dehidro dapat terus teroksidasi menjadi diketogulanic acid yang
inaktif.
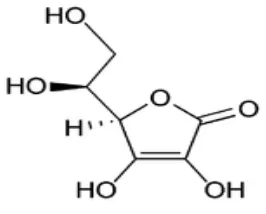
2.2.1. Struktur Vitamin C
Struktur vitamin C dapat dilihat pada gambar di bawah ini :
Gambar 2.2 Struktur Vitamin C
Keadaan vitamin C inaktif sering terjadi pada proses pemanasan (bila
sayur-sayuran dimasak). Di dalam suasana asam vitamin ini lebih stabil daripada dalam basa
yang menjadi inaktif (Prawirokusumo, S., 1991).
2.2.2. Sifat – Sifat Umum Vitamin C
Vitamin C yang mempunyai rumus empiris C6H8O6 dalam bentuk murni merupakan
Kristal putih, tidak berwarna, tidak berbau dan mencair pada suhu 190-1920 C.
mudah larut dalam air, sedikit larut dalam alkohol dan tidak larut dalam benzene, eter,
khloroform, minyak dan sejenisnya. Walaupun vitamin C stabil dalam bentuk Kristal,
tetapi mudah rusak atau terdegradasi jika berada dalam bentuk larutan, terutama jika
terdapat udara, logam-logam seperti Cu dan Fe dan cahaya. Sifat utama dari vitamin C
adalah kemampuan mereduksinya yang kuat dan mudah teroksidasi yang dikatalis oleh
beberapa logam, terutama Cu dan Ag (Andarwulan, N., 1992).
2.2.3. Farmakokinetik
Vitamin C mudah diabsorpsi melalui saluran cerna. Pada keadaan normal tampak
kenaikan kadar vitamin C dalam darah setelah diabsorpsi. Kadar dalam leukosit dan
trombosit lebih besar dari pada dalam plasma dan sel darah merah. Distribusinya luas
keseluruh tubuh dengan kadar tertinggi dalam kelenjar dan terendah dalam otot dan
jaringan lemak. Ekskresi melalui urin dalam bentuk utuh dan bentuk garam sulfatnya
terjadi jika kadar dalam darah melewati ambang rangsang ginjal 1,4 mg%. Efisiensi
absorpsi akan berkurang dan kecepatan ekskresi meningkat bila digunakan jumlah
lebih besar (Rosmiati, H. & S.Wardhini, 1987).
2.2.4. Fungsi Vitamin C
Fungsi utama vitamin C adalah sebagai Anti Oksidan. Asam askorbat diperlukan
untuk pembentukan semua jaringan tubuh, terutama untuk pembentukan jaringan ikat.
Jaringan ikat adalah bahan pembungkus yang terpisah, yang melindungi dan
menyangga berbagai organ. Asam askorbat membantu absorpsi zat besi dalam usus
(Gaman, M., & Sherrington K.B., 1981).
Vitamin C juga berperan menghambat reaksi-reaksi oksidasi dalam tubuh yang
berlebihan dengan bertindak sebagai inhibitor. Tampaknya vitamin C merupakan
vitamin yang essensial untuk memelihara fungsi normal semua unit sel termasuk
struktur-struktur subsel seperti ribosom dan mitokondria. Kemampuan vitamin ini
proses metabolisme. Peranan vitamin C dalam menanggulangi flu telah banyak
dilaporkan. Pada binatang percobaan ternyata bahwa kadar vitamin C yang tinggi
dapat meningkatkan sintesis vitamin B kompleks dalam intestin (Poedjiadi, A., 1994).
2.2.5. Defisiensi Vitamin C
Beberapa akibat dari kekurangan konsumsi vitamin C :
1. Skorbut, pendarahan gusi, kulit mengelupas (Poedjiadi, A., 1994).
2. Mudah terjadi luka dan infeksi tubuh, dan kalau sudah terjadi sukar
disembuhkan.
3. Hambatan pertumbuhan pada bayi dan anak-anak.
Skorbut dalam bentuk berat sekarang jarang terjadi karena sudah diketahui cara
mencegah dan mengobatinya. Tanda-tanda awal antara lain lelah, lemah, nafas
pendek, kejang otot, tulang otot persendian sakit serta kurang nafsu makan, kulit
menjadi kering , kasar dan gatal, warna merah kebiruan di bawah kulit, perdarahan
gusi, kedudukan gigi menjadi longgar, mulut dan mata kering dan rambut rontok. Di
samping itu luka sukar sembuh, terjadi anemia, kadang-kadang jumlah sel darah putih
menurun, serta depresi dan timbul gangguan saraf. Gangguan saraf dapat terjadi
berupa histeria, depresi diikuti oleh gangguan psikomotor. Gejala skorbut terlihat bila
taraf asam askorbat dalam serum turun di bawah 0,20 mg/dl (Almatsier, S., 2001).
2.2.6. Sumber-Sumber Vitamin C
Vitamin C pada umumnya hanya terdapat di dalam pangan nabati, yaitu sayur dan
buah terutama yang asam, seperti jeruk, nenas, rambutan, pepaya, gandaria, dan tomat.
Vitamin C juga banyak terdapat di dalam sayuran daun-daunan dan jenis kol
Sediaan yang banyak beredar di pasaran adalah sediaan 500 mg.
kadang-kadang juga dijumpai sediaan 1000 mg. rasanya pun bermacam-macam. Ada rasa
jeruk, strawberi, anggur, dan lain-lain.
Kebutuhan vitamin C harian yang dianjurkan berbeda-beda untuk beberapa
Negara. Di Inggris (food Standard agency) menganjurkan 40 mg sehari; di Kanada 60
mg sehari; di Amerika Serikat (National Academy of Sciences) 60-95 mg sehari.
Sedangkan WHO menganjurkan konsumsi vitamin C 45 mg sehari. Batas tertinggi
konsumsi vitamin C yang masih bisa di toleransi oleh tubuh menurut National
Academy of Science adalah 2000 m
2.3. Pati
Pati merupakan cadangan makanan dari sel tanaman. Pati merupakan sumber
terpenting pada bahan makanan manusia berupa karbohidrat. Beberapa makanan
pokok manusia (seperti kentang, beras, jagung, dan gandum) mengandung pati.
Polisakarida yang terkandung di dalam pati yaitu amilosa dan amilopektin.
2.3.1. Amilosa
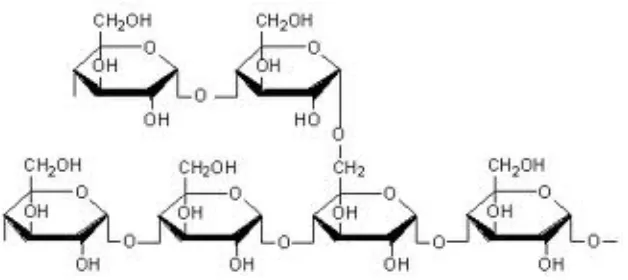
Amilosa memiliki struktur rantai panjang yang tidak bercabang yang tersusun atas
monomer - monomer glukosa dengan ikatan α (1,4) glikosida. Molekul amilum yang
mengandung ribuan gugus glukosa, yang memiliki berat molekul dari 150.000 hingga
600.000 D. Struktur rantai polimer amilum lurus dan rapat, sehingga amilum dapat
disimpan lama. Adanya enam unit glukosa perputaran heliks menyebabkan amilosa
berbentuk tabung dan kompleks. Hal ini disebabkan bermacam – macam molekul kecil
dapat masuk ke dalam kumparannya. Bukti pembentukan kompleks tersebut adalah
warna biru tua yang dihasilkan oleh pati bila ditambahkan iod (Fessenden, R.J. &
Gambar 2.3. Struktur Amilosa
2.3.2. Amilopektin
Amilopektin, suatu polisakarida yang jauh lebih besar daripada amilosa, mengandung
1000 satuan glukosa atau lebih per molekul. Rantai utama dalam amilopektin
mengandung 1,4-α-D-glukosa. Amilopektin memiliki percabangan, sehingga terdapat
satu glukosa ujung untuk kira – kira tiap 25 satuan glukosa. Ikatan pada titik
percabangan ialah ikatan 1,6-α-glikosida.
Gambar 2.4. Struktur Amilopektin
Pati dalam jaringan tanaman berbentuk granul (butir) yang berbeda – beda.
Dengan mikroskop, jenis pati dapat dibedakan karena mempunyai bentuk, ukuran,
letak hilum yang unik dan juga dapat merefleksikan cahaya terpolarisasi.
Granul pati dapat dibuat membengkak luar biasa dan bersifat tidak dapat
kembali lagi pada kondisi semula. Perubahan tersebut disebut dengan gelatinasi. Suhu
konsentrasi pati dan pH. Jadi, gelatinasi juga dapat didefinisikan sebagai konversi dari
keadaan kristalin, butir pati menjadi terdispersi dalam keadaan amorf (Wurzburg,
1986).
2.3.4. Kegunaan Pati
Pati sebagai bahan perekat, sering digunakan pada kertas karton, label botol, alat tulis
dan keperluan ringan lainnya. Pati juga merupakan bahan mentah penting bagi aplikasi
industri, baik sebagai bahan makanan, maupun bukan makanan, seperti untuk industri
polimer terdegradasi, dan pengganti selulosa dalam industri kertas (Jansson, C., 1995).
2.4. Tablet
Tablet adalah sediaan padat, dibuat secara kempa - cetak, berbentuk rata atau cembung
rangkap, umumnya bulat, mengandung satu jenis obat atau lebih dengan atau tanpa zat
tambahan. Untuk membuat tablet diperlukan zat tambahan berupa :
1. Zat pengisi : ditambahkan untuk memperbesar volume tablet, biasanya
digunakan Saccharum Lactis, Amylum Manihot, dan zat lain yang cocok.
2. Zat pengikat : ditambahkan agar tablet tidak pecah atau retak dan dapat
merekat, biasanya yang digunakan adalah Amylum Manihot.
Bila bahan bersifat hidrofob maka bahan pengikatnya 30% dari berat tablet.
Bila bahan bersifat hidrofil maka bahan pengikatnya 10-20% dari berat tablet.
Dalam pembuatan tablet, zat berkhasiat, zat-zat lain, kecuali zat pelicin dibuat
granul (butiran kasar), karena serbuk yang halus tidak mengisi cetakan tablet dengan
baik, maka dibuat granul agar mudah mengalir mengisi cetakan serta menjaga agar
tablet tidak retak. Cara membuat granul ada 2 macam, yaitu cara basah dan cara kering
2.4.1. Granulasi
Granulasi adalah proses pembesaran ukuran di mana partikel kecil bersama-sama
menjadi besar, berupa agregat permanen di mana partikel asal masih dapat
diidentifikasi. Granulasi digunakan terutama untuk produksi tablet atau kapsul.
Sebagai produk antara digunakan granul dengan distribusi ukuran lebar. Granul dapat
pula digunakan sebagai bentuk sediaan.
Granulasi diawali sesudah pencampuran serbuk bahan obat dengan eksipien
yang dibutuhkan (pengisi, penghancur, dan sebagainya) sehingga distribusi uniform
tercapai.
Tujuan granulasi dalam manufaktur tablet :
1. Meningkatkan sifat aliran yang berarti uniformitas massa dari sediaan/dosis.
2. Mencegah pemisahan komponen campuran.
3. Meningkatkan karakteristik dari campuran.
2.4.1.1. Pembuatan Bahan Tablet Menggunakan Metode Granulasi Basah
Granulasi basah atau aglomerasi serbuk dilakukan dengan cara
pengadukan/agitasi serbuk atau campuran serbuk dengan keberadaan cairan yang
biasanya berupa larutan pengikat yang sudah dicampurkan dengan serbuk kering.
Pembentukan granul dan pertumbuhan berlangsung karena efek ikatan mobil-liquid
yang terbentuk antara partikel primer.
Prosesnya meliputi tahap-tahap sebagai berikut:
1. Deaglomerasi bahan awal dengan penggilingan atau pengayakan.
2. Pencampuran kering bahan awal.
3. Penambahan cairan dan pembentukan massa basah/lembab.
4. Pengayakan massa basah untuk menghilangkan bongkahan besar.
5. Pengeringan.
6. Penggilingan atau pengayakan granul kering untuk mencapai ukuran
2.4.1.2. Mekanisme Granulasi Basah
Mekanisme granulasi basah didasarkan pada kekuatan ikatan cairan dalam aglomerat
basah. Apabila serbuk dicampur dengan cairan yang membasahi permukaan partikel
yang mempunyai sudut kontak rendah terhadap padat, sistem cenderung menurunkan
energi bebas permukaan dengan cara pembentukan jembatan cairan antara partikel.
Jika jumlah cairan meningkat, jembatan cairan berkoalesensi, dan secara bertahap
berubah manjadi cair.
Serbuk sangat halus dapat beraglomerasi secara spontan bila diaduk karena
efek ikatan Van Der Waals dan elektrostatik. Biasanya aglomerasi serbuk memerlukan
penambahan jumlah tepat cairan yang membasahi permukaan padat dan menghasilkan
ikatan cairan yang diperlukan. Pembesaran ukuran berlangsung menurut metode
agitasi sesuai dengan beberapa mekanisme berikut :
1. Nukleasasi dari partikel primer karena pembentukan ikatan jembatan.
2. Koalesensi antara aglomerat yang bertumbukan.
3. Pelapisan partikel dari penguraian aglomerat yang sudah mantap.
4. Pertumbuhan bola (Agoes, G., 2008).
2.4.2. Bahan Pengikat
Merupakan bahan yang mempunyai sifat kohesif dan adhesif yang mampu
mengaglomerasi partikel serbuk kering membentuk granul sesudah pengeringan.
Ditambahkan pada campuran serbuk setelah dilarutkan dalam cairan penggranul.
Kadar tinggi pengikat, terutama turunan selulosa dapat menimbulkan masalah
disintegrasi dan disolusi tablet karena membentuk lapisan musilago di sekitar
permukaan partikel. Pada obat yang bersifat hidrofob, pengikat dapat mempercepat
disolusi (Agoes, G., 2008).
Pati sering digunakan sebagai bahan pengikat, pati yang sering digunakan yaitu
terhidrolisis menjadi dekstrin dan kemudian glukosa. Oleh karena itu, ketelitian dalam
pembuatan musilago amili diperlukan untuk menghasilkan perbandingan pati dan
produk hidrolisisnya konsisten dan benar, dan juga untuk pencegahan pengarangan.
Musilago amili merupakan pengikat serbaguna untuk menghasilkan tablet yang
terdisintegrasi dengan cepat, dan granulasi hanya dibuat dengan menggunakan pati
sebagai pengikat internal dan digranulasi dengan air (Wikarsa, S.,2008).
2.4.3. Karakter Fisik Granul
Sifat-sifat fisikomekanik granul mencakup ukuran partikel, luas permukaan, aliran
granul yang dapat ditentukan dengan menghitung kecepatan alir dan sudut istirahat
granul. Yang akan dibahas disini adalah sifat aliran granul.
2.4.3.1. Sifat Aliran Granul
2.4.3.1.1. Kecepatan Alir Granul
Sifat aliran granul sangat penting untuk pembuatan tablet yang efisien. Aliran granul
yang baik untuk dikempa sangat penting untuk memastikan pencampuran yang efisien.
Oleh karena itu, selama evaluasi praformulasi terhadap zat aktif, karakteristik mampu
alirnya harus dipelajari, terutama apabila dosisi obat yang diantisipasi besar.
Sifat aliran serbuk yang baik merupakan hal penting untuk pengisian yang
seragam ke dalam lubang cetak mesin tablet dan untuk memudahkan gerakan bahan di
sekitar fasilitas produksi. Sifat aliran dipengaruhi oleh ukuran dan bentuk partikel,
partikel yang lebih beasar dan bulat menunjukkan aliran yang lebih baik. Metode
untuk mengevaluasi sifat aliran granul yang sering digunakan adalah metode corong
(langsung).
Kecepatan alir diketahui melalui metode corong. Metode ini paling sederhana
dengan bobot tertentu melalui corong diukur dalam detik. Suatu penutup sederhana
ditempatkan pada lubang keluar corong lalu diisi dengan granul yang telah ditimbang
terlebih dahulu. Ketika penutup dibuka, waktu yang dibutuhkan granul untuk keluar
dicatat. Dengan membagi massa serbuk dengan waktu keluar tersebut, kecepatan alir
diperoleh sehingga dapat digunakan untuk perbandingan kuantitatif granul yang
berbeda.
Kecepatan aliran granul = massa (g)
waktu (s) (Persamaan 2.1)
Tabel 2.1. Hubungan Antara Kecepatan Alir Dengan Sifat Aliran Granul Laju Alir ( g/s ) Sifat Aliran
>10 Sangat baik
4-10 Baik
1,6-4 Sukar
<1,6 Sangat sukar
2.4.3.1.2. Sudut Istirahat Granul
Metode sudut istirahat telah digunakan sebagai metode tidak langsung untuk
mengukur mampu alir granul karena hubungannya dengan kohesi antarpartikel.
Banyak metode yang berbeda untuk menetapkan sudut istirahat dan salah satunya yang
digunakan adalah metode corong.
Granul dengan massa tertentu dilewatkan melalui corong dan jatuh ke atas
sehelai kertas grafik. Setelah onggokan granul membentuk kerucut stabil, sudut
istirahatnya diukur. Metode ini disebut “uji sudut jatuh”. Untuk kebanyakan
farmasetik, nilai sudut istirahat berkisar dari 25o- 45o, dengan nilai yang rendah
menunjukkan karakteristik yang lebih baik.
Suatu granul yang tidak kohesif mengalir baik, menyebar, membentuk
tinggi yang kurang menyebar. Definisi sudut istirahat adalah sudut permukaan bebas
dari tumpukan granul dengan bidang horizontal.
Sudut istirahat (θ) : Arc Tangen θ = 2 tinggi puncak granul
diameter lingkaran (Persamaan 2.2)
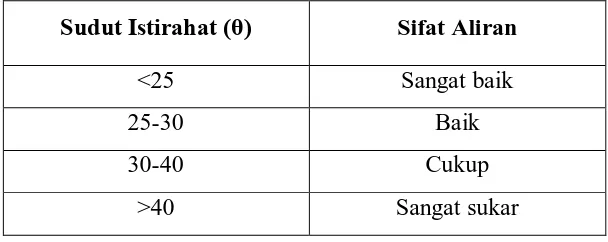
Tabel 2.2. Hubungan Sudut Istirahat Dengan Tipe Aliran
Sudut Istirahat (θ) Sifat Aliran
<25 Sangat baik
25-30 Baik
30-40 Cukup
>40 Sangat sukar
(Wikarsa, S.,2008).
2.5. Spektrofotometri Ultraviolet dan Visibel (UV-VIS)
Spektrofotometri UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar
ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan
cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit
terluar ke tingkat energi yang lebih tinggi. Spektroskopi UV-Vis biasanya digunakan
untuk molekul dan ion anorganik atau kompleks di dalam larutan. Spektrum UV-Vis
mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa
didapatkan dari spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran
secara kuantitatif. Konsentrasi dari analit di dalam larutan bisa ditentukan dengan
mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum
Lambert-Beer.
Sinar ultraviolet berada pada panjang gelombang 200-400 nm sedangkan sinar
2.5.1. Instrumentasi
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau deuterium untuk
pengukuran UV dan lampu tungsten untuk pengukuran pada cahaya tampak. Panjang
gelombang dari sumber cahaya akan dibagi oleh pemisah panjang gelombang seperti
prisma atau monokromator. Spektrum didapatkan dengan cara scanning oleh
monokromator sedangkan pengukuran kuantitatif bisa dibuat dari spektrum atau
panjang gelombang tertentu. Ada dua jenis instrumentasi spektrofotometri UV-Vis,
yaitu :
1. Spektrofotometri UV-Vis yang memiliki sumber cahaya tunggal (single beam),
dimana sinyal pelarut dihilangkan terlebih dahulu dengan mengukur pelarut,
setelah itu larutan sampel diukur.
2. Spektrofotometri UV-Vis yang memiliki sumber cahaya ganda (double beam),
dimana larutan sampel dimasukkan secara bersama-sama dengan pelarut yang
tidak mengandung sampel. Alat ini lebih praktis dan mudah serta memberikan
hasil yang optimal.
2.5.2. Hukum Lambert-Beer
Hukum Lambert-Beer (Beer’s laaw) adalah hubungan linearitas antara absorban
dengan konsentrasi larutan analit. Biasanya hukum Lambert-Beer ditulis dengan:
A =
ε
. b. C (Persamaan 2.3)A = absorban (serapan)
ε
= koefisian ekstingsi molar (M-1cm-1b = tebal kuvet (cm)
)
Pada beberapa buku ditulis juga :
A = E . b . C (Persamaan 2.4)
E = koefisien ekstingsi spesifik (ml g-1 cm-1
b = tebal kuvet (cm)
)
C = konsentrasi (gram/100 ml)
Hubungan antara E dan
ε
adalah : E = 10.������ ����� (Persamaan 2.5)
Pada percobaan, yang terukur adalah transmitan (T), yang didefinisikan sebagai
berikut :
T = I / I0
I = intensitas cahaya setelah melewati sampel
(Persamaan 2.6)
I0 = intensitas cahaya awal
Hubungan antara A dan T adalah : A = -log T = -log I / I0
(Dachriyanus, 2004). (Persamaan 2.7)
2.6. Spektrofotometri Infra Merah
Konsep radiasi infra merah diajukan pertama kali oleh Sir William Herschel (1800)
melalui percobaannya mendispersikan radiasi matahari dengan prisma. Ternyata pada
daerah sesudah sinar merah menunjukkan adanya kenaikan temperatur tertinggi yang
berarti pada daerah panjang gelombang radiasi tersebut banyak kalori (energi tinggi).
Daerah spektrum tersebut selanjutnya disebut infrared. Spektroskopi
inframerah ditujukan untuk maksud penentuan gugus-gugus fungsi molekul pada
2.6.1. Kegunaan Analisa Spektroskopi Infra Merah
Spektrofotometer infra merah pada umumnya digunakan untuk :
1. Menentukan gugus fungsi suatu senyawa organik.
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan
daerah sidik jarinya.
Pengukuran pada spektrum infra merah dilakukan pada daerah cahaya
inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2,5 - 50 μm atau
bilangan gelombang 4000 - 200 cm-1. Energi yang dihasilkan oleh radiasi ini akan
menyebabkan vibrasi atau getaran pada molekul. Pita absorbsi inframerah sangat khas
dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi.
Spektrum yang dihasilkan berupa grafik yang menunjukkan persentase
transmitan yang bervariasi pada setiap frekuensi radiasi inframerah.
2.6.2. Syarat – Syarat Interpretasi Spektrum
Tidak ada aturan yang pasti dalam menginterpretasikan spektrum IR. Tetapi beberapa
syarat harus dipenuhi dalam menginterpretasikan spektrum :
1. Spektrum harus tajam dan jelas serta memiliki intensitas yang tepat.
2. Spektrum harus berasal dari senyawa yang murni.
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilkan pita atau
serapan pada bilangan gelombang yang tepat.
4. Metoda penyiapan sampel harus dinyatakan. Jika digunakan pelarut maka jenis
pelarut, konsentrasi dan tebal sel harus diketahui.
Karakteristik frekuensi vibrasi IR sangat dipengaruhi oleh perubahan yang
sangat kecil pada molekul sehingga sangat sukar untuk menentukan struktur
berdasarkan data IR saja. Spektrum IR sangat berguna untuk mengidentifikasikan
terutama pada daerah sidik jari. Secara praktikal, spektrum IR hanya dapat digunakan
untuk menentukan gugus fungsi (Dachriyanus, 2004).
2.6.3. Spektrum Infra Merah Bahan Polimer
Molekul polimer dikenal dengan karakteristik rantai yang terdiri dari sejumlah satuan
ulangan. Secara teori spektrum infra merah bahan polimer akan tergantung dari
karakteristik spektrum dan struktur kimia satuan ulangannya.
Beberapa sifat fisik juga mempengaruhi bentuk spektrum bahan polimer,
antara lain sifat geometri rantai dan kristalinitas. Bila bahan polimer ditarik ke satu
arah maka rantai – rantai molekul akan cenderung terorientasi kearah tarikan, maka
vibrasi ikatan yang tegak lurus arah tarikan akan lebih dibatasi dan menjadi tidak peka
terhadap serapan radiasi.
Tahap awal dari identifikasi bahan polimer, maka harus diketahui pita serapan
yang karakteristik untuk masing – masing polimer. Pita serapan yang khas ditunjukkan
oleh monomer penyusun material dan struktur molekulnya. Umumnya pita serapan
polimer pada spektrum infra merah adanya ikatan C-H regangan pada daerah 2880 cm -1
– 2900 cm-1 dan regangan dari gugus fungsi lain yang mendukung untuk analisis
BAB III
METODE PENELITIAN
3.1. Alat – Alat
Nama Alat Merek
Gelas Beker Pyrex
Gelas Ukur Pyrex
Alu dan Lumpang -
Ayakan 12 mesh -
Desikator -
Neraca analitik Tettler Toledo
Penyaring Buchner -
Statif dan Klem -
Corong -
Labu Takar Pyrex
Spektrofotometer UV-Visibel Shimadzu
Spektrofotometer Infra Merah Shimadzu
3.2. Bahan – Bahan
Nama Bahan Merek
Kitosan Komersil -
Vitamin C p.a.Merck
Umbi Singkong komersil -
Akuades -
Alkohol 96% Teknis
3.3. Prosedur Percobaan
3.3.1. Isolasi Amilum Dari Umbi Singkong (Manihot Utilissima)
Dikupas kulit umbi lalu dicuci bersih kemudian diparut. Ditimbang sebanyak 100 g
lalu dimasukkan ke dalam blender kemudian tambahkan 200 ml akuades, diblender
selama ± 30 detik. Disaring, kemudian larutan keruh ditampung dalam gelas ukur 500
mL. Ditambahkan 20 mL akuades lalu diaduk dan dibiarkan mengendap kemudian
dekantasi. Ditambahkan 200 mL akuades, diaduk dan biarkan mengendap lalu
dekantasi. Ditambahkan 100 mL alkohol 96% sambil diaduk. Disaring dengan
penyaring Buchner dan keringkan amilum yang dihasilkan.
3.3.2. Pembuatan Granul Dengan Metode Granulasi Basah
Granul dibuat dalam bentuk 3 formula dengan memvariasikan massa kitosan dan
amilum yang digunakan sebagai matriks dimana massa bahan aktif yaitu vitamin C
dan bahan pengikat adalah tetap.
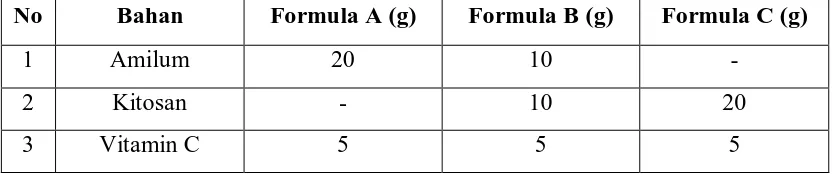
Tabel. 3.1. Formulasi Granul
No Bahan Formula A (g) Formula B (g) Formula C (g)
1 Amilum 20 10 -
2 Kitosan - 10 20
3 Vitamin C 5 5 5
Berat teoritis tiap fomulasi adalah 25 gram. Masing-masing forrmulasi ini dirancang
untuk pencetakan 100 tablet dengan mempunyai berat teoritis 250 mg tiap tablet.
3.3.2.1. Pembuatan Bahan Pengikat Musilago Amylum
Musilago amylum merupakan zat hasil gelatinasi amilum menggunakan akuades yang kemudian dipanaskan hingga amilum terdispersi membentuk gelatin yang tembus
yang diperbolehkan sebesar 10-20% dari total bahan yang digranulasi untuk bahan
yang tidak bersifat hidrofob dan 30% untuk bahan yang bersifat hidrofob. Musilago
amylum dibuat dengan mencampurkan amilum dan akuades dengan perbandingan 10% b/b.
Kitosan dan amilum yang digunakan sebagai matriks bersifat hidrofob,
sehingga banyaknya musilago amylum yang diperlukan sebagai bahan pengikat
sebesar 30% dari tiap forrmulasi yang akan dibuat menjadi granul.
Perhitungan:
1. Perhitungan massa musilago amylum yang diperlukan sebagai bahan perekat
untuk pembentukan granul terhadap tiap formulasi.
Dik : massa teoritis formula = 25 gram
Dit : massa musilago amylum yang diperlukan ?
Penyelesaian : massa musilago amylum = 30% dari massa formula
= 30
100 x 25 gram = 7,5 gram 2. Perhitungan massa amilum yang diperlukan untuk membuat musilago amylum
dengan penambahan air dengan perbandingan 10% b/b amilum dalam akuades.
Dik : massa musilago amylum yang diperlukan = 7,5 gram
Dit : massa amilum yang diperlukan dengan perrbandingan 10% b/b amilum
dalam akuades ?
Penyelesaian : massa amilum = 10% dari massa musilago amylum
= 10
100 x 7,5 gram = 0,75 gram
3. Perhitungan massa akuades yang diperlukan dalam pembuatan musilago
amylum.
Dik : massa amilum yang diperlukan = 0,75 gram
massa musilago amylum yang akan dibuat = 7,5 gram
Dit : massa akuades yang diperlukan dalam pembuatan musilago amylum!
Penyelesaian : massa akuades = massa musilago amylum - massa amilum
= 7,5 gram – 0,75 gram
Perincian Bahan :
1. Massa musilago amylum yang diperlukan sebagai bahan pengikat untuk
membuat granul adalah 7,5 gram.
2. Massa amilum yang diperlukan untuk membuat musilago amylum adalah 0,75
gram.
3. Massa akuades yang diperlukan untuk membuat musilago amylum adalah 6,75
gram atau sama dengan 6,75 ml.
Pembuatan musilago amylum sebagai bahan pengikat :
Ditimbang 0,75 gram amilum dan dimasukkan ke dalam cawan petri.
Ditambahkan 6,75 ml akuades lalu diaduk. Dipanaskan sambil diaduk hingga
terbentuk gelatin yang tembus cahaya.
Musilago amylum yang diperoleh digunakan untuk 1 formulasi granul, dilakukan prosedur yang sama pembuatan musilago amylum untuk formulasi granul
lainnya.
3.3.2.2. Pencampuran Bahan Aktif dan Pengisi Dengan Penambahan Musilago Amylum Sebagai Pengikat
Langkah-langkah yang dilakukan dalam proses pembuatan granul adalah sebagai
berikut :
1. Semua bahan pembuat granul diayak dan ditimbang sesuai dengan kebutuhan.
2. Kitosan, amylum manihot, dan Vitamin C (pada formula A, B dan C)
dicampur hingga homogen.
3. Diayak hingga homogen dan dimasukkan ke dalam lumpang.
4. Ditambahkan musilago amylum yang telah disediakan sebelumnya.
5. Dicampur hingga homogen dan diperoleh massa granul yang kompak.
6. Dikeringkan dalam desikator.
7. Massa yang telah kering digranulasi dengan ayakan No. 12 mesh.
8. Massa granul yang dihasilkan siap untuk dikarakterisasi secara fisika dan
3.3.3. Karakterisasi Sifat Aliran Dengan Menghitung Kecepatan Alir dan Sudut Istirahat Granul Melalui Metode Corong.
Langkah-langkah pengambilan data untuk menghitung kecepatan alir dan sudut
istirahat granul :
1. Dirangkai corong pada statif dan klem dengan ketinggian tertentu.
2. Ditimbang dan dicatat massa granul yang akan diuji sebagai m ( dalam
pengujian ini digunakan massa granul sebanyak 20 gram).
3. Ditutup bagian dasar corong.
4. Dimasukkan massa granul ke dalam corong.
5. Dibuka penutup bagian dasar corong.
6. Dihitung dan dicatat waktu yang diperlukan oleh granul untuk turun melalui
corong alat penguji dengan menggunakan stopwatch dari mulai dibukanya
tutup bagian bawah hingga semua granul mengalir keluar dari alat uji.
7. Dicatat tinggi dan diameter timbunan granul yang dihasilkan setelah granul
mengalir keluar dari corong.
8. Dilakukan percobaan sebanyak 3 kali agar diperoleh data yang akurat dan
dihitung nilai rata-ratanya.
Data yang diperoleh digunakan untuk menentukan sifat aliran granul dengan
menghitung kecepatan alir granul menggunakan persamaan (1) dan menghitung sudut
istirahat granul menggunakan persamaan (2).
Sifat aliran granul dapat ditentukan dengan membandingkan nilai hasil
perhitungan terhadap nilai standar aliran granul yang baik sesuai dengan yang
3.3.4. Karakterisasi Laju Disolusi Bahan Aktif Vitamin C Dengan Metode Spektoskopi UV-Visibel
3.3.4.1. Pembuatan Larutan HCl 0,1 N
Dipipet 8,3 ml HCl(p) dan dimasukkan ke dalam labu takar 1000 ml, kemudian
diencerkan dengan akuades sampai garis lalu dihomogenkan. Diperoleh larutan HCl
0,1 N.
3.3.4.2. Pembuatan Larutan Standar Kurva Kalibrasi Vitamin C
3.3.4.2.1. Larutan Induk Standar Vitamin C 500 μg/ml
Ditimbang 50 mg vitamin C dan ditambahkan sedikit demi sedikit dengan larutan HCl
0,1 N hingga larut kemudian dimasukkan ke dalam labu takar 100 ml dan diencerkan
dengan HCl 0,1 N sampai garis lalu dihomogenkan. Diperoleh larutan induk standar vitamin C 500 μg/ml.
3.3.4.2.2. Larutan Standar Vitamin C 100 μg/ml
Dipipet 10 ml larutan induk standar vitamin C 500 μg/ml dan dimasukkan ke dalam labu takar 50 ml kemudian diencerkan dengan HCl 0,1 N sampai garis tanda dan dihomogenkan. Diperoleh larutan standar vitamin C 100 μg/ml.
3.3.4.2.3. Larutan Standar 8 μg/ml Untuk Penentuan λmaks Vitamin C
Dipipet 4 ml larutan standar C 100 μg/ml dan dimasukkan ke dalam labu takar 50 ml kemudian diencerkan dengan HCl 0,1 N sampai garis tanda dan dihomogenkan.
3.3.4.2.4. Larutan Seri Standar Vitamin C Untuk Pembuatan Kurva Kalibrasi
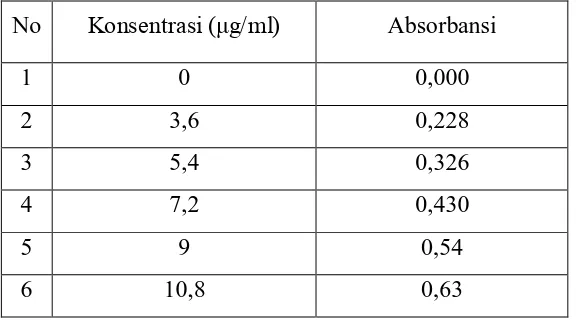
Dibuat konsentrasi larutan seri standar vitamin C bervariasi 3,6; 5,4; 7,2; 9; dan 10,8 μg/ml. Masing-masing dipipet sebanyak 1,8; 2,7; 3,6; 4,5; dan 5,4 ml larutan standar Vitamin C 100 μg/ml dan dimasukkan ke dalam labu takar 50 ml kemudian diencerkan
dengan HCl 0,1 N sampai garis tanda dan dihomogenkan.
3.3.4.3. Pembuatan Kurva Kalibrasi Vitamin C
3.3.4.3.1. Penentuan λmaks Larutan Standar Vitamin C
Diambil larutan standar vitamin C 8 mg/L. dan diukur λmaks dengan melihat spektrum puncak serapan maksimum vitamin C kemudian dilakukan pemeriksaan spektrum puncak vitamin C dan diperoleh λmaks pada absorbansi maksimum. Dari literature, diketahui bahwa λmaks vitamin C adalah 243 nm.
3.3.4.3.2. Penentuan Kurva Kalibrasi Larutan Standar Vitamin C
Dinolkan absorbansinya dengan blanko akuades. Masing-masing larutan seri standar
Vitamin C 0; 3,6; 5,4; 7,2; 9; dan 10,8 μg/mldiukur absorbansinya pada λmaks 243 nm
lalu diplotkan konsentrasi dan absorbansi larutan seri standar.
3.3.4.4. Penentuan laju disolusi Vitamin C Dalam Interval Waktu Pengambilan Sampel Larutan Pada Saat Ektraksi
Ditimbang 1 g granul Formula A kemudian diekstraksi dengan 250 ml HCl 0,1 N.
Dipipet 1 ml larutan ekstrak pada menit ke 2; 4; 6; 8; dan 10 saat ekstraksi. Kemudian
diencerkan dengan HCl 0,1 N dalam labu takar 50 ml dan dihomogenkan. Diukur
absorbansi masing-masing sampel larutan ekstrak pada λmaks 243 nm.
3.3.5. Karakterisasi Interaksi Intermolekular Bahan Selama Proses Pencampuran Dalam Pembuatan Granul Melalui Analisis FT-IR
Langkah pengambilan data interaksi intermolekuler yang mungkin terjadi antara bahan
selama proses pencampuran bahan dalam pembuatan granul menggunakan metode
spektroskopi infra merah (FT-IR) :
1. Sampel granul dihaluskan dan diambil secukupnya.
2. Ditambahkan pellet KBr lalu ditekan kemudian diletakkan pada tempat sampel.
3. Selanjutnya diarahkan sinar IR untuk melewati sampel.
4. Hasilnya akan direkam ke dalam kertas berskala aluran kurva gelombang
terhadap intensitas pada spektra FT-IR.
5. Dianalisis kurva gelombang sampel yang dihasilkan sesuai dengan gugus
3.4. Bagan Percobaan
3.4.1. Bagan Isolasi Amilum Dari Umbi Singkong (Manihot Utilissima)
Dikeringkan
Umbi Singkong
Dikupas, cuci, kemudian diparut
Ditimbang sebanyak 100 g
Diblender dengan ditambahkan 200 ml akuades selama ± 30 detik.
disaring
Larutan keruh Ampas
Ditambahkan 20 ml akuades
Diaduk dan dibiarkan mengendap
Didekantasi
Ditambahkan 200 ml akuades
Diaduk dan dibiarkan mengendap
Didekantasi
Filtrat Endapan putih
Filtrat Endapan putih
Ditambahkan 100 ml alkohol 96%
Diaduk
Disaring
Endapan putih Filtrat
3.4.2. Bagan Pembuatan Bahan Pengikat Musylago Amilum
0,75 g amilum
Dimasukkan ke dalam cawan petri
Ditambahkan 6,75 ml akuades
Diaduk
Suspensi putih
Dipanaskan sambil diaduk hingga terbentuk
gelatin yang tembus cahaya
3.4.3. Bagan Pembuatan Granul Suplemen Vitamin C Menggunakan Kitosan dan Amilum Manihot Sebagai Matriksnya
Granul dibuat dalam bentuk 3 forrmulasi granul.
Kitosan Vitamin C Amilum
Diayak Diayak Diayak
Dibuat 3 formulasi granul dengan mencampur ketiga bahan dengan
perbandingan massa amilum dan vitamin C yaitu :
Formulasi A = (100 : 0) % b/b Formulasi B = (50 : 50) % b/b Formulasi C = (0 : 100) % b/b
Dimana variasi massa vitamin C tetap
Formulasi C
Dikarakterisasi secara fisika dan kimia
Uji kecepatan alir granul dengan metode
corong
Uji sifat aliran meliputi
3.4.4. Bagan Pengambilan Data Untuk Menghitung Kecepatan Alir dan Sudut Istirahat Granul Menggunakan Metode Corong
20 g granul
Dimasukkan ke dalam corong yang dirangkai pada
statif dan klem dengan bagian dasar corong yang
ditutup.
Dihitung dan dicatat waktu yang diperlukan oleh
granul untuk turun melalui corong alat penguji dengan
menggunakan stopwatch dari mulai dibukanya tutup
bagian bawah hingga semua granul mengalir keluar
dari alat uji.
Dicatat tinggi dan diameter timbunan granul yang
dihasilkan setelah granul keluar dari corong
Dilakukan percobaan sebanyak 3 kali agar diperoleh
data yang akurat dan dihitung nilai rata-ratanya.
3.4.5. Pembuatan Kurva Kalibrasi Vitamin C
50 mg Vitamin C
Ditambahkan larutan HCl 0,1 N sedikit demi sedikit hingga larut
Dimasukkan ke dalam labu takar 100 ml
Diencerkan dengan HCl 0,1 N hingga garis tanda
Dihomogenkan
Vitamin C 500 μg/ml
Dipipet 10 ml
Dimasukkan ke dalam labu takar 50 ml
Diencerkan dengan HCl 0,1 N hingga garis tanda
Dihomogenkan
Vitamin C 100 μg/ml
Dipipet 4 ml
Dimasukkan ke dalam labu takar 50 ml
Diencerkan dengan HCl 0,1 N hingga garis tanda
Dihomogenkan
Diukur absobansinya
Dipipet masing-masing 1,8; 2,7; 3,6; 4,5; dan 5,4 ml
Dimasukkan ke dalam labu takar 50 ml
3.4.6. Penentuan Laju Disolusi Vitamin C Dalam Interval Waktu Pengambilan Sampel Larutan Pada Saat Ektraksi
Dilakukan prosedur yang sama untuk granul fomula B dan C.
3.4.7. Bagan Pengambilan Data Spektrum Hasil FT-IR
Granul
Dihaluskan dan diambil sesuai keperluan
Ditambahkan pellet KBr lalu ditekan kemudian
diletakkan pada tempat sampel
Diarahkan sinar IR melewati sampel
Hasilnya direkam dalam kertas berskala aluran
kurva gelombang terhadap intensitas pada
spektra IR
Hasil
1 g Granul Formula A
Ditambahkan 250 ml HCl 0,1N
Diekstraksi
Dipipet 1 ml larutan ekstrak pada menit ke
2; 4; 6; 8; dan 10 saat ekstraksi
Diencerkan masing-masing sampel larutan
dengan HCl 0,1 N dalam labu takar 50 ml
Diukur absorbansi masing-masing sampel larutan ekstrak pada λmaks 243 nm
BAB IV
HASIL DAN PEMBAHASAN
4.1. Analisa Sifat Aliran Granul Dengan Menghitung Kecepatan Aliran dan Sudut Istirahat Granul Dengan Metode Corong.
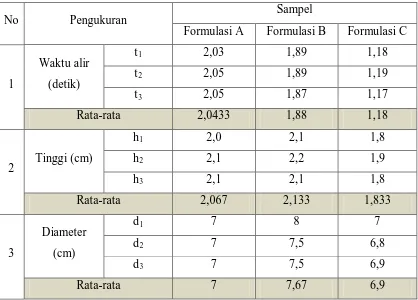
4.1.1. Data Hasil Pengukuran
Pengambilan data dilakukan sebanyak 3 kali untuk masing-masing sampel granul agar
data hasil pengukuran yang diperoleh lebih tepat dan teliti. Data hasil pengukuran
waktu alir, tinggi puncak serta diameter lingkaran timbunan granul yang terbentuk
untuk masing-masing sampel dapat dilihat pada tabel di bawah ini :
Tabel 4.1. Data Hasil Pengukuran Waktu Alir Granul Serta Tinggi dan Diameter Timbunan Granul
No Pengukuran Sampel
Formulasi A Formulasi B Formulasi C
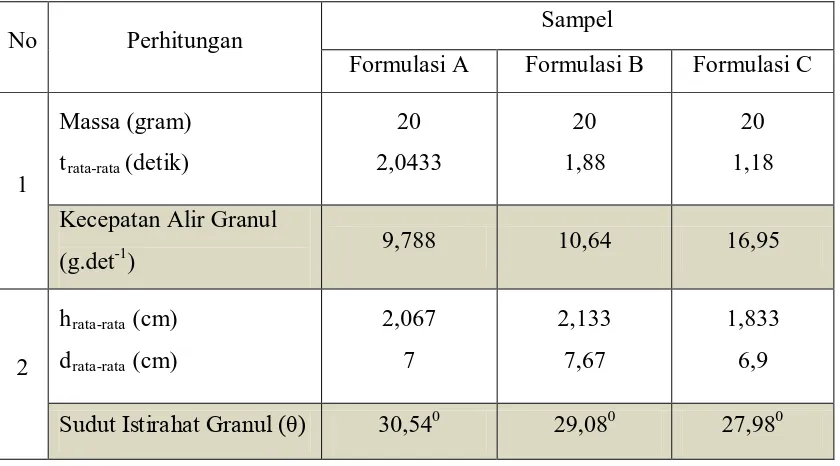
4.1.2. Pengolahan Data
Kecepatan alir granul dapat dihitung dengan menggunakan persamaan (2.1).
Kecepatan aliran granul = massa (g) waktu (s)
Massa granul yang digunakan sebagai sampel untuk mengukur waktu alir granul
adalah 20 gram untuk masing-masing formulasi.
Besar sudut istirahat granul dapat dihitung dengan menggunakan persamaan (2.2).
Sudut istirahat (θ) : Arc Tangen θ = 2 tinggi puncak granul diameter lingkaran
= 2 ℎ
�
Dengan menghitung kecepatan alir granul dan sudut istirahat granul menggunakan
nilai rata-rata data yang telah diukur sebelumnya, maka diperoleh data baru yang
menunjukkan kecepatan alir dan sudut istirahat granul dari masing-masing sampel
formulasi pada tabel di bawah ini :
Tabel 4.2. Data Hasil Perhitungan Kecepatan Alir dan Sudut Istirahat Granul
No Perhitungan Sampel
Formulasi A Formulasi B Formulasi C
1
4.1.3. Analisa Sifat Aliran Granul
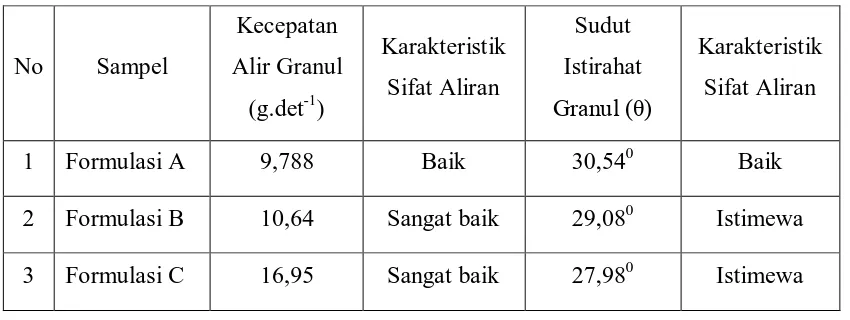
Sifat aliran granul dapat ditentukan berdasarkan data mengenai sifat-sifat aliran granul
sesuai dengan kecepatan aliran dan sudut istirahat granul yang terdapat pada tabel 2.1
dan tabel 2.2. Dengan membandingkan kecepatan aliran dan sudut istirahat granul
yang diperoleh dari percobaan dengan sifat-sifat aliran granul yang terdapat pada tabel
2.1 dan tabel 2.2, maka diperoleh sifat aliran dari 3 formulasi granul yang diterangkan
pada tabel di bawah ini :
Tabel 4.3. Data Hasil Analisa Sifat Aliran Granul Yang Dihasilkan
No Sampel
Salah satu evaluasi yang dilakukan terhadap granul sebelum dicetak menjadi tablet
adalah evaluasi sifat aliran. Evaluasi ini dimaksudkan untuk melihat apakah granul
memiliki sifat aliran baik, sifat aliran yang baik sangat diperlukan pada saat granul
dialirkan melalui corong masuk ke dalam tabung pencetak untuk memperoleh tablet
yang mempunyai ukuran dan bobot yang seragam.
Dari hasil analisa diperoleh data bahwa ketiga formulasi granul memiliki sifat
aliran yang baik, dan bahkan istimewa. Amilum yang sudah umum digunakan sebagai
bahan pengisi dalam pembuatan bahan tablet memiliki sifat aliran granul yang baik.
Sifat aliran ganul yang baik sangat menentukan apakah granul dapat dengan mudah