Lampiran 2.Gambar tumbuhan, rimpang dan simplisia temulawak
(A) (B)
(C) (D)
(E) Keterangan :
A : tanaman temulawak B : rimpang temulawak
Lampiran 3. Hasil mikroskopik serbuk rimpang temulawak
Keterangan:
1 : fragmen berkas pembuluh 2 : fragmen parenkim korteks 3 : serabut sklerenkim
4 : butir pati
Lampiran 4.Flowsheetpembuatan simplisia
Dihaluskan dengan blender Disimpan dalam wadah yang tertutup rapat sebelum digunakan Ditiriskan
Ditimbang berat basahnya Dikeringkan di lemari pengering Ditimbang berat keringnya Dicuci hingga bersih
Serbuk Simplisia Simplisia
Pembuatan ekstrak
Skrining Fitokimia
Senyawa golongan :
• Alkaloid
• Glikosida
• Flavonoid
• Steroid/Triterpenoid
• Saponin
• Tanin Karakterisasi
• Makroskopik
• Mikroskopik
• Penetapan Kadar
Abu Total
• Penetapan Kadar
Abu yang Tidak Larut Asam
• Penetapan Kadar
Sari Larut Air
• Penetapan Kadar
sari Larut Etanol
• Penetapan Kadar Air
Lampiran 5. Flowsheet pembuatan ekstrak etanol rimpang temulawak
Dimasukkan ke dalam Ditambahkan dengan 75
Dibiarkan selama 5 hari,
Digabungkan
Suling atau uapkan maserat pada tekanan rendah dan suhu tidak lebih dari 50oC hingga
konsistensi yang dikehendaki
Dicuci dengan etanol 96% hingga diperoleh 100 bagian
Disaring
Dimasukkan ke dalam wadah Ditambahkan 75 bagian etanol 96% Dibiarkan selama 5 hari terlindung dari cahaya, sambil sesekali diaduk
Dibiarkan selama 2 hari terlindung dari cahaya
Disaring 850 g serbuk simplisia
Ampas Maserat I
Ampas Maserat II
Lampiran 6. Perhitungan rendemen ekstrak rimpang temulawak
Rendemendariekstrakdihitungdenganrumus: % Rendemen = berat ekstrak yang diperoleh (g)
berat bahan yang diekstrak (g) x 100%
= 141,187 g
Lampiran 7. Perhitungan dosis tablet
Kandungan kurkumin pada simplisiatemulawak 1-2% (Wiryowidagdo, 2008). Pada penelitian Noviza (2013), ekstrak temulawak yang digunakan 120 mg. Pada penelitian Meilisa (2009), ekstrak temulawak yang digunakan 150 mg.
Perhitungan:
Ekstrak kental : simplisia = 1:10 Jika mengandung 1 %
1000 mg simplisia rimpang temulawak → 10 mg kurkumin 1000 mg simplisia → 100 mg ekstrak kental → 10 mg kurkumin 1000 mg simplisia → 150 mg ekstrak kental → 15 mg kurkumin Jika mengandung 2 %
1000 mg simplisia rimpang temulawak → 20 mg kurkumin 1000 mg simplisia → 100 mg ekstrak kental → 20 mg kurkumin 1000 mg simplisia → 150 mg ekstrak kental → 30 mg kurkumin
Jadi, range dosis yang diambil berkisar 100-150 mg ekstrak kental yang diharapkan dapat memberikan aktifitas.
Pada metode cetak langsung digunakan dosis 125 mg yang merupakan nilai tengah dari dosis 100-150 mg, tetapi karna perbandingan fines dan granul yang kurang baik maka dibagi menjadi dua sehingga sekali mengkonsumsi 2 tablet dimana kandungan tiap tablet adalah 62,5 mg ≈ 63 mg.
Perbandingan ekstrak kental : zat pengering (amilum) = 1:2
Lampiran 8. Perhitungan hasil karakterisasi simplisia
1. Penetapan kadar air
Kadar air = Volume air (mL)
Berat sampel (g) × 100%
No. Berat sampel Volume air (mL) Kadar air (%) 1. 2. 2,07 2,05 0,15 0,15 7,25% 7,32% Kadar air I = 0,15
2,07 × 100% = 7,25% Kadar air II = 0,15
2,05 × 100% = 7,32% Kadar air rata-rata = 7,25% +7,32%
2 = 7,285 % 2. Penetapan kadar sari larut etanol
Kadar sari larut etanol = Berat sari (g) Berat sampel (g)×
100
20 × 100%
No. Berat sampel Berat sari (g) Kadar sari larut etanol (%) 1. 2. 5,00 5,00 0,18 0,13 18% 13% Kadar sari larut etanol I =0,18
5,00 × 100
20 × 100% = 18%
Kadar sari larut etanol II = 0,13
5,00 × 100
20 × 100% = 13%
Kadar sari larut etanol rata-rata = 18%+13%
2 = 15,5%
3.Penetapan kadar sari larut air
Kadar sari larut air = Berat sari (g)
Berat sampel (g) ×
100
20 × 100%
No. Berat sampel Berat sari (g) Kadar sari larut air (%) 1. 2. 5,00 5,00 0,21 0,18 21% 18% Kadar sari larut air I = 0,21
5,00 × 100
20 × 100% = 21%
Kadar sari larut air II = 0,18
5,00 × 100
20 × 100% = 18%
Kadar sari larut air rata-rata = 21%+18%
Lampiran 8. (lanjutan)
4. Penetapan kadar abu total
Kadar abu total = Berat abu (g)
Berat sampel (g) × 100%
No. Berat sampel Berat abu (g) Kadar abu total (%) 1. 2. 3. 2,0004 2,0009 2,0004 0,0861 0,0879 0,0874 4,30 4,39 4,37 Kadar abu total I = 0,0861
2,0004 × 100% = 4,30% Kadar abu total II = 0,0879
2,0009 × 100% = 4,39%
Kadar abu total III = 0,0874
2,0004 × 100% = 4,37%
Kadar abu total rata-rata = 4,30%+ 4,39%+4,37%
3 = 4,35%
5. Penetapan kadar abu tidak larut asam
Kadar abu tidak larut asam = Berat abu (g)
Berat sampel (g) × 100%
No. Berat sampel Berat abu (g) Kadar abu tidak larut asam (%) 1. 2. 3. 2,0004 2,0009 2,0004 0,0135 0,0156 0,0135 0,67 0,77 0,67 Kadar abu tidak larut asam I = 0,0135
2,0004 × 100% = 0,67% Kadar abu tidak larut asam II = 0,0156
2,0009 × 100% = 0,77%
Kadar abu tidak larut asam III = 0,0135
2,0004 × 100% = 0,67%
Kadar abu tidak larut asam rata-rata = 0,67% + 0,77% + 0,67%
Lampiran 9. Perhitungan bahan tablet
Formula 1 (Granulasi Basah)
R/ Ekstrak kering rimpang temulawak 0,300 Pasta amilummanihot10% b/b 30%
Talk 2%
Mg stearat 2%
Laktosa q.s ad 625 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasibasah 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan/ Tablet
1. Ekstrak rimpang temulawak = 0,300 g 2. Pasta amilummanihot10%
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,625 g = 0,1875 g mengandung amilummanihot sebanyak: 10/100 x 18,75 = 0,01875 g
Aquadest = 0,1875 g – 0,01875 g = 0,16875 g 3. Talkum = 2/100 x 0,625 g = 0,0125 g 4. Mg Stearat = 2/100 x 0,625 g= 0,0125 g
Lampiran 9. (lanjutan)
Formula 2 (Granulasi Basah)
R/ Ekstrak kering rimpang temulawak 0,375 Pasta amilummanihot10% b/b 30%
Talk 2%
Mg stearat 2%
Laktosa q.s ad 625 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasibasah 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan/ Tablet
1. Ekstrak rimpang temulawak = 0,375 g 2. Pasta amilummanihot10%
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,625 g = 0,1875 g mengandung amilummanihot sebanyak: 10/100 x 0,1875 = 0,01875 g
Aquadest = 0,1875 –0,01875 = 0,16875 g 3. Talkum = 2/100 x 0,625 g = 0,0125 g 4. Mg Stearat = 2/100 x 0,625 g = 0,0125 g
Lampiran 9. (lanjutan)
Formula 3 (Granulasi Basah)
R/ Ekstrak kering rimpang temulawak 0,4125 Pasta amilummanihot10% b/b 30%
Talk 2%
Mg stearat 2%
Laktosa q.s ad 625 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasibasah 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan
1. Ekstrak rimpang temulawak = 0,4125 g x 100 = 41,25 g 2. Pasta amilummanihot10%
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,625 g = 0,1875 g mengandung amilummanihot sebanyak: 10/100 x 0,1875 = 0,01875 g
Aquadest = 0,1875 –0,01875 = 0,16875 g 3. Talkum = 2/100 x 0,625 g = 0,0125 g 4. Mg Stearat = 2/100 x 0,625 g = 0,0125 g
Lampiran 9. (lanjutan)
Formula 4 (Granulasi Basah)
R/ Ekstrak kering rimpang temulawak 0,450 Pasta amilummanihot10% b/b 30%
Talk 2%
Mg stearat 2%
Laktosa q.s ad 625 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 625 mg 2. Diameter tablet = 13 mm
3. Metode = granulasibasah 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan
1. Ekstrak rimpang temulawak = 0,450 g x 100 = 45 g 2. Pasta amilummanihot10%
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,625 g = 0,1875 g mengandung amilummanihot sebanyak: 10/100 x 0,1875 = 0,01875 g
Aquadest = 0,1875 –0,01875 = 0,16875 g 3. Talkum = 2/100 x 0,625 g = 0,0125 g 4. Mg Stearat = 2/100 x 0,625 g = 0,0125 g
Lampiran 9. (lanjutan)
Formula 5 (Cetak Langsung)
R/ Ekstrak kering rimpang temulawak 0,190
Talk 2%
Mg stearat 2%
Granul amilum q.s ad 500 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 500 mg 2. Diameter tablet = 13 mm
3. Metode = cetak langsung 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan/ Tablet
1. Ekstrak kering rimpang temulawak = 0,190 g 2. Talkum = 2/100 x 0,500 = 0,0100 g
3. Mg Stearat = 2/100 x 0,500= 0,0100 g
4. Granul amilum = 0,500 – (0,190 + 0,0100 + 0,0100) = 0,290 g R/ Pasta amilum manihot 10% 30%
Amilum manihot q.s ad 29 g
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,290 g = 0,087 g mengandung amilummanihot sebanyak: 10/100 x 0,087 = 0,0087 g
Aquadest = 0,087 - 0,0087 = 0,0783 g
Lampiran 9. (lanjutan)
Formula 6 (Cetak Langsung)
R/ Ekstrak kering rimpang temulawak 0,190
Talk 2%
Mg stearat 2%
Granul laktosa q.s ad 500 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 500 mg 2. Diameter tablet = 13 mm
3. Metode = cetak langsung 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan
1. Ekstrak kering rimpang temulawak = 0,190 g 2. Talkum = 2/100 x 0,500 = 0,0100 g
3. Mg Stearat = 2/100 x 0,500 = 0,0100 g
4. Granul laktosa = 0,500 – (0,190 + 0,0100 + 0,0100) = 0,290 g R/ Pasta amilum manihot 10% 30%
Laktosa q.s ad 29 g
Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,290 g = 0,087 g mengandung amilummanihot sebanyak: 10/100 x 0,087 = 0,0087 g
Lampiran 9. (lanjutan)
Formula 7 (Cetak Langsung)
R/ Ekstrak kering rimpang temulawak 0,190
Talk 2%
Mg stearat 2%
Granul amilum + laktosa q.s ad 500 mg m.f tab dtd No C
I. Rencanakerja
1. Bobottablet = 500 mg 2. Diameter tablet = 13 mm
3. Metode = cetak langsung 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan
1. Ekstrak kering rimpang temulawak = 0,190 g 2. Talkum = 2/100 x 0,500 = 0,0100 g
3. Mg Stearat = 2/100 x 0,500 = 0,0100 g
4. Granul amilum + laktosa = 0,500 – (0,190 + 0,0100 + 0,0100) = 0,290 g
R/ Pasta amilum manihot 10% 30% Amilum manihot + laktosa (50 : 50) q.s ad 29 g Pasta amilum manihot terpakai 30% dari berat total maka :
30/100 x 0,290 g = 0,087 gmengandung amilummanihot sebanyak: 10/100 x 0,087 = 0,0087 g
Aquadest = 0,087 - 0,0087 = 0,0783 g
Lampiran 9. (lanjutan)
Formula 8 (Cetak Langsung)
R/ Ekstrak kering rimpang temulawak 0,190
Talk 2%
Mg stearat 2%
Avicel q.s ad 500 mg
m.f tab dtd No C I. Rencanakerja
1. Bobottablet = 500 mg 2. Diameter tablet = 13 mm
3. Metode = cetak langsung 4. Bentuk tablet = bulatpipih II. Perhitungan Bahan
1. Ekstrak kering rimpang temulawak = 0,190 g 2. Talkum = 2/100 x 0,500 = 0,0100 g
3. Mg Stearat = 2/100 x 0,500 = 0,0100 g
Lampiran 10. Hasil uji preformulasi granul
Formula Waktu Alir Lebar Tinggi
1. 4,14 11,4 3,35
2. 6,46 11,6 3,43
3. 9,39 11,4 4,03
4. 10,40 12,3 4,53
5. 3,13 11,6 3,6
6. 2,57 12,1 3,1
7. 2,81 11,9 3,4
8. 2,78 12,5 2,9
Sudut diam :
��� = 2� �
F1 :���= 2 � 3,35
11,4 � = 33,84
F2 :���= 2 � 3,43
11,6 � = 34,03
F3 : ��� = 2 � 4,03
11,4 � = 39,17 F4 : ��� = 2 � 4,53
12,3 � = 40,43 F5 : ��� = 2 � 3,6
11,6 � = 35,36
F6 : ��� = 2 � 3,1
12,1 � = 30,14
F7 : ��� = 2 � 3,4
11,9 � = 33,05 F8 : ��� = 2 � 2,9
12,5 � = 27,66
Indeks tap :
Indeks Tap = �1− �2
�2 � 100% F1 : Indeks Tap = 100−84
84 X 100% = 19,05 F2 : Indeks Tap = 100−85
85 X 100% = 17,65 F3 : Indeks Tap = 100−89
89 X 100% = 12,36 F4 : Indeks Tap = 100−90,5
90,5 X 100% = 10,49 F5 : Indeks Tap = 100−87
87 X 100% = 19,05 F6 : Indeks Tap = 100−84,5
84,5 X 100% = 17,65
F7 : Indeks Tap = 100−86,5
86,5 X 100% = 12,36
F8 : Indeks Tap = 100−90
Lampiran 11. Gambar tablet ekstrak temulawak
(A) (B)
(C) (D)
(E)
Keterangan :
A: Tablet ekstrak temulawak dosis 300 mg dengan metode granulasi basah
B: Tablet ekstrak temulawak dengan granul amilum manihot dengan metode cetak langsung
C: Tablet ekstrak temulawak dengan granul laktosa dengan metode cetak langsung
D: Tablet ekstrak temulawak dengan granul amilum manihot : laktosa dengan metode cetak langsung
Lampiran 12.Hasil uji evaluasi tablet
Uji Evaluasi (Formula 1) Waktu hancur : 20 menit 37 detik Kekerasan :
No. Kekerasan (kg)
1. 0,57
2. 0,53
3. 0,59
4. 0,54
5. 0,57
Rata - rata 0,56 Friabilitas : 10,345−10,271
10,271 � 100% = 0,72%
Keseragaman bobot :
No. Bobot (gram) No. Bobot (gram)
1. 0,625 11. 0,625
2. 0,600 12. 0,635
3. 0,610 13. 0,630
4. 0,600 14. 0,625
5. 0,620 15. 0,625
6. 0,620 16. 0,630
7. 0,625 17. 0,625
8. 0,625 18. 0,635
9. 0,625 19. 0,625
10. 0,630 20. 0,625
Rata-rata 0,623
Keseragaman bobot = 0,635−0,623
0,623 X 100% = 1,93%
Keseragaman bobot = 0,623−0,600
Lampiran 12. (lanjutan)
Uji Evaluasi (Formula 5) Waktu hancur : 1 menit 22 detik Kekerasan :
No. Kekerasan (kg)
1. 0,28
2. 0,24
3. 0,30
4. 0,27
5. 0,29
Rata - rata 0,276 Friabilitas : 9,795−9,235
9,235 � 100% = 6,07%
Keseragaman bobot :
No. Bobot (gram) No. Bobot (gram)
1. 0,490 11. 0,510
2. 0,485 12. 0,510
3. 0,480 13. 0,500
4. 0,480 14. 0,500
5. 0,500 15. 0,500
6. 0,500 16. 0,520
7. 0,500 17. 0,500
8. 0,495 18. 0,500
9. 0,495 19. 0,500
10. 0,500 20. 0,515
Rata-rata 0,499
Keseragaman bobot = 0,520−0,499
0,499 X 100% = 4,2%
Keseragaman bobot = 0,499−0,480
Lampiran 12. (lanjutan)
Uji Evaluasi (Formula 6) Waktu hancur : 5 menit 15 detik Kekerasan :
No. Kekerasan (kg)
1. 0,39
2. 0,45
3. 0,39
4. 0,36
5. 0,37
Rata - rata 0,392 Friabilitas : 10,120−9,862
9,862 � 100% = 2,62%
Keseragaman bobot :
No. Bobot (gram) No. Bobot (gram)
1. 0,500 11. 0,505
2. 0,510 12. 0,500
3. 0,510 13. 0,500
4. 0,500 14. 0,500
5. 0,500 15. 0,490
6. 0,495 16. 0,500
7. 0,500 17. 0,500
8. 0,515 18. 0,495
9. 0,500 19. 0,500
10. 0,500 20. 0,500
Rata-rata 0,501
Keseragaman bobot = 0,515−0,501
0,501 X 100% = 2,79%
Keseragaman bobot = 0,501−0,490
Lampiran 12. (lanjutan)
Uji Evaluasi (Formula 7) Waktu hancur : 1 menit 14 detik Kekerasan :
No. Kekerasan (kg)
1. 0,35
2. 0,27
3. 0,30
4. 0,33
5. 0,32
Rata - rata 0,314 Friabilitas : 10,060−9,670
9,670 � 100% = 4,03%
Keseragaman bobot :
No. Bobot (gram) No. Bobot (gram)
1. 0,520 11. 0,500
2. 0,500 12. 0,500
3. 0,490 13. 0,485
4. 0,500 14. 0,500
5. 0,500 15. 0,500
6. 0,495 16. 0,485
7. 0,505 17. 0,505
8. 0,515 18. 0,480
9. 0,505 19. 0,500
10. 0,495 20. 0,500
Rata-rata 0,499
Keseragaman bobot = 0,520−0,499
0,499 X 100% = 4,2%
Keseragaman bobot = 0,499−0,480
Lampiran 12. (lanjutan)
Uji Evaluasi (Formula 8) Waktu hancur : 54 detik Kekerasan :
No. Kekerasan (kg)
1. 1,29
2. 1,26
3. 1,37
4. 1,27
5. 1,18
Rata - rata 1,27 Friabilitas : 10,050−9,896
9,896 � 100% = 1,55%
Keseragaman bobot :
No. Bobot (gram) No. Bobot (gram)
1. 0,500 11. 0,500
2. 0,500 12. 0,500
3. 0,505 13. 0,510
4. 0,505 14. 0,500
5. 0,500 15. 0,500
6. 0,510 16. 0,510
7. 0,505 17. 0,515
8. 0,500 18. 0,500
9. 0,510 19. 0,500
10. 0,510 20. 0,500
Rata-rata 0,504
Keseragaman bobot = 0,515−0,504
0,504 X 100% = 2,18%
Keseragaman bobot = 0,504−0,500
Lampiran 13. Alat-alat penelitian
(A)(B)
(C)(D)
(E)(F) Keterangan :
A : rotary evaporator
B : corong uji waktu alir dan sudut diam C : uji indeks tap
DAFTAR PUSTAKA
Agoes, G. (2008).Pengembangan Sediaan Farmasi.Bandung: Penerbit ITB. Hal. 99-208.
Ahsan, H., Parveen, N., Khan, N.U., dan Hadi, S.M. (1999). Pro-oxidant, Anti-Oxidant and Cleavage Activities on DNA of Curcumin and Its Derivatives Demethoxycurcumin and Bisdemethoxycurcumin. Chem-Biol. Interact. 121(2): 161-175.
Anief, M. (2008). Ilmu Meracik Obat, Teori dan Praktek. Yogyakarta: Gadjah Mada University Press. Hal. 161-162.
Anggoro, D., Rezki, R.S., dan Siswarni, M.Z. (2015). Ektraksi Multi Tahap Kurkumin dari Temulawak (Curcuma xanthorriza Roxb.) menggunakan Pelarut Etanol. Jurnal Teknik Kimia USU. 4(2): 39-45.
Ansel, H.C. (2008). Pengantar Bentuk Sediaan Farmasi. Edisi IV. Jakarta: UI Press. Hal. 244-272.
Banker, G.S. dan Anderson N.R. (1994).Tablet.Edisi III. Jilid II. Jakarta: UI-Press. Hal.643-703.
BPOM RI. (2005). Info POM: Gerakan Nasional Minum Temulawak. Majalah. Edisi November. Jakarta: Pusat Informasi Obat dan Makanan BPOM. 6(6): 1-4.
Cartensen, J.T. (1977). Pharmaceutical of Solids and Dosage Forms.A Willey Interscience Publication. New York: John Willey and Sons. Hal.133-135,209-214, 216-218, 342.
Dalimartha, S. (2007). Atlas Tumbuhan Obat Indonesia. Jakarta: Trubus Agriwidya. Hal. 36.
Depkes RI. (1978). MateriMedika Indonesia.Jilid II. Jakarta: DepartemenKesehatan RI. Hal.150-156,165-167.
Depkes RI. (1989). MateriMedika Indonesia.Jilid V. Jakarta: DepartemenKesehatan RI. Hal. 516, 518-519, 522.
Depkes RI. (1979). Farmakope Indonesia.Edisi III. Jakarta: DepartemenKesehatan RI. Hal. 6-9, 32.
Depkes RI. (1995). Farmakope Indonesia.Edisi IV. Jakarta: DepartemenKesehatan RI. Hal. 970-971, 999, 1083-1087.
Ditjen POM RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: DepartemenKesehatan RI. Hal.13-31.
Duthie, G., dan Crozier, A. (2000). Plant-derived Phenolic Antioxidants. Wolters Kluwer Health.3(6): 447-451.
Halim, M.R.A., Tan, M.S.M.Z., Imail, S., dan Mahmud, R. (2006). Standardization and Phytochemical Studies of Curcuma xanthorrhiza Roxb. International Journal of Pharmacy and Pharmaceutical Sciences.4(3): 606-610.
Harborne, J.B. (1987). Metode Fitokimia, Penuntun Cara Modern Menganalisa Tumbuhan. Terjemahan K.Padmawinata. Edisi II. Bandung: ITB Press.
Hal. 259-260.
Hayani, E. (2006). Analisis Kandungan Kimia RimpangTemulawak. Bogor: Balai Penelitian Tanaman Rempah dan Obat. Hal. 309-311.
Hayati, M. (2003). Terampil Membuat Ekstrak Temu-temuan. Yogyakarta: Adicita Karya Nusa. Hal. 12-13.
Ketaren, S. (1998). Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI-Press. Hal. 46.
Lachman, L., Lieberman, H.A., dan Kanig, J.L. (1986). The Theory and Practice of Industrial Pharmacy. Edisi III. Philadelphia: Lea & Febinger. Hal. 311-314.
Liang, O.B., Widjaja, Y., dan Puspa, S. (1985). Beberapa Aspek Isolasi, Identifikasi dan Penggunaan Komponen-Komponen Curcuma xanthorrhiza Roxb. dan Curcuma domestica Val.. Prosiding Simposium Nasional Temulawak. Bandung: Lembaga Penelitian Universitas Padjajaran.
Lieberman, H.A., Lachman, L., dan Schwartz, J.B. (1989). Pharmaceutical Dosage Forms: Tablets. Vol. I. Edisi II. New York: Marcel and dekker Inc. Hal. 131-132, 149-150, 153, 188-245.
Loftus, B.T., dan Nash, R.A. (1984). Pharmaceutical Process Validation. New York: Marcel Dekker Inc. Hal. 212-213.
Lu, F.C. (1995). Toksikologi Dasar. Jakarta: Universitas Indonesia Press. Hal. 212.
Munir, M.B. (2012). Formulasi Tablet Effervescent Ekstrak Temulawak (Curcuma xanthorrhiza Roxb.). Skripsi. Depok: Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia. Hal 1, 25-35.
Noviza, D. (2013). Formulasi Tablet Hisap Ekstrak Temulawak (Curcuma xanthorriza Roxb.) dengan Gelatin sebagai Pengikat. Skripsi. Padang: Fakultas Farmasi Universitas Andalas. Hal. 16-19.
Oei, B.L., Apsarton, Y., Puspa, S., dan Widjaja, T. (1985). Beberapa Aspek Isolasi, Identifikasi dan Penggunaan Komponen-Komponen Curcuma xanthorrhiza Roxb. dan Curcuma domestica Vahl. Bandung: Lembaga Penelitian Univesitas Padjajaran. Hal. 15-18.
Parrot, L. (1971).Pharmaceutical Technology. United States of America: Burges Publishing Company. Hal. 82.
Rismunandar. (1988). Rempah-Rempah Komoditi Ekspor Indonesia. Bandung: Penerbit Sinar Baru. Hal. 15.
Sharma, R., Rajput, M., Prakash, P., dan Sharma, S. (2011).Fast Disolving Delivery System On review.International Journal of Pharmacy.2(10): 21-29.
Siregar, C.J.P., dan Wikarsa, S. (2010). TeknologiFarmasiSediaan Tablet Dasar-DasarPraktis.Edisi II. Jakarta: PenerbitBukuKedokteran EGC.Hal.1-2,8,416-418.
Solichedi, K. (2003). Pemanfaatan kunyit (Curcuma domestica Val.) dalam ransum broiler sebagai upaya penurunan lemak abdimal dan kadar kolesterol darah. Jurnal Pengembangan Peternakan Tropis. 28: 172-177. Suharjo, J.B. (2010). Hepatitis B: Cegah Kanker Hati. Yogyakarta: Kanisius. Hal.
51.
Suharmiati dan Handayani, L. (2006). Cara Benar Meracik Obat Tradisional. Edisi I. Jakarta: Agromedia Pustaka. Hal. 1.
Sulaiman, T.N.S. (2007). Teknologi dan Formulasi Sediaan Tablet. Cetakan Pertama. Yogyakarta: Mitra Communications Indonesia. Hal. 149-153. Swarbrick, J., dan Boylan, J.C. (1992). Encyclopedia of Pharmaceutical
Technology. Vol. V. New York: Marcel Dekker Inc. Hal. 278-279.
Tjay, T.H., dan Rahardja, K. (2007). Obat-obat Penting. Jakarta: PT. Alexmedia Komputindo. Hal. 63-65.
Widman, F.K. (1989). Tinjauan Klinis atas Hasil Pemeriksaan Laboratorium. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 468-469.
Wijayakusuma, M.H. (2007). Penyembuhan dengan Temulawak I. Jakarta: Sarana Pustaka Prima. Hal 2.
BAB III
METODE PENELITIAN
3.1 Tempat Penelitian
Penelitian dilakukan di Laboratorium Farmakognosi dan Teknologi Sediaan Farmasi II Fakultas Farmasi Universitas Sumatera Utara pada bulan Maret sampai Juni 2016.
3.2 Alat
Alat-alat yang digunakan adalah lemari pengering, pisau, talam, tanur, aluminium foil, kertas saring, kurs porselen, cawan, batang pengaduk, penjepit
tabung, blender, kain kasa, gelas ukur, pipet tetes, mikroskop, corong, rotary evaporator,waterbath, neraca kasar, lumpang, alu, termometer, ayakan mesh 14 dan 12, spatula, desintegrator (Copley), Roche friabilator (Erweka), hardness tester (Copley), neraca analitik (Boeco), stopwatch, mesin cetak tablet single
punch (Erweka) dan sejumlah alat gelas lainnya.
3.3 Bahan
Bahan-bahan yang digunakan adalah rimpang temulawak, etanol 96%, akuades, kloralhidrat, toluena, eter, eter petroleum, metanol pekat, kloroform, asam sulfat pekat, asam sulfat 2N, asam klorida 2N, asam klorida 3N, Na sulfat anhidrat, timbal (II) asetat, FeCl3 10%, isopropanol, asam asetat glasial, pereaksi
3.4 Prosedur Kerja
3.4.1 Pengambilan bahan
Pengambilan bahan dilakukan secara purposif di Pematang Raya, Kabupaten Simalungun, Sumatera Utara. Bahan yang digunakan adalah rimpang temulawak (Curcuma xanthorrhiza Roxb.) dengan umur panen 8 bulan.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Laboratorium Herbarium Medanese, Universitas Sumatera Utara, Medan.
3.4.3 Pembuatan simplisia
Bahan yang digunakan pada penelitian ini adalah rimpang temulawak. Rimpang temulawak yang masih segar disortasi basah dan ditimbang. Rimpang diiris-iris dengan ketebalan 2-5 mm, lalu dikeringkan dalam lemari pengering pada suhu ± 40oC selama 3-8 hari. Irisan rimpang yang telah kering ditandai dengan rapuh saat dipatahkan dan mempunyai berat konstan. Bahan dihaluskan dengan menggunakan blender sehingga menjadi serbuk simplisia (Melissa, 2009). 3.4.4 Pemeriksaan karakterisasi simplisia
3.4.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati morfologi rimpang temulawak (Curcuma xanthorrrhiza Roxb.) dengan cara memperhatikan bentuk, warna, bau dan rasa (Melissa, 2009).
3.4.4.2 Pemeriksaan mikroskopik
3.4.4.3 Penetapan kadar abu total
Serbuk simplisia sebanyak 2 g dimasukkan dalam kurs porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam kurs yang sama. Filtrat dimasukkan ke dalam kurs, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.4.4 Penetapan kadar abu tidak larut asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 mL asam klorida 3N selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas, dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.4.5 Penetapan kadar sari larut dalam air
3.4.4.6 Penetapan kadar sari larut dalam etanol
Serbuk simplisia sebanyak 5 g, dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama kemudian dibiarkan selama 18 jam, kemdian disaring cepat untuk menghindari penguapan etanol. Filtrat sejumlah 20 mL diuapkan sampai kering dalam cawan penguap yang rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap.Kadar dalam persen sari yang larut pada etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.4.7 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi toluena). Alat terdiri dari labu alas bulat 500 mL, pendingin, tabung penyambung, tabung penerima 5 mL berskala 0,05 mL, alat penampung dan pemanas listrik.
3.4.5 Pembuatan ekstrak rimpang temulawak
Metode pembuatan ekstrak yang umum digunakan adalah ekstraksi menggunakan suatu pelarut, ekstraksi dapat dilakukan dengan cara panas atau cara dingin. Pelarut atau cairan penyari yang digunakan dalam ekstraksi dapat berupa air, etanol, campuran etanol-air dan eter (Harborne, 1987). Pembuatan ekstrak serbuk simplisia rimpang temulawak menggunakan cara dingin dengan metode maserasi menggunakan pelarut etanol 96%. Menurut Anggoro, et al., (2015), kadar kurkumin tertinggi diperoleh menggunakan etanol 96%.
Maserasi merupakan proses pengekstrakan simplisia dengan pelarut dengan cara 10 bagian simplisia dengan derajat halus yang cocok dimasukkan dalam bejana, dituangkan 75 bagian cairan penyari, ditutup dan dibiarkan selama 5 hari terhindar dari cahaya dan sering diaduk, serkai, peras, cuci ampas dengan cairan penyari secukupnya sehingga diperolah 100 bagian. Pindahkan ke dalam bejana tertutup, biarkan ditempat sejuk, terlindung dari cahaya, selama 2 hari. Enap tuangkan atau saring, dipekatkan dengan penguapan dan tekanan pada suhu rendah 50oC hingga konsentrasi yang dikehendaki (Depkes RI, 1979).
Rendemen dari ektrak kemudian dihitung dengan rumus: % Rendemen = berat ekstrak yang diperoleh
berat bahan yang diekstrak
x100%
Ekstrak kental dikeringkan dengan penambahan sejumlah amilum manihot sebanyak 1 g dan digerus, penambahan sebanyak 1 g lalu dilanjutkan hingga diperoleh ekstrak kering. Ektrak kering diayak dengan mesh 20.
3.4.6 Skrining fitokimia
xanthorrhizaRoxb.). Golongan senyawa kimia yang diperiksa meliputi senyawa
alkaloid, flavonoid, glikosida, tanin, saponin dan steroid/triterpenoid. 3.4.6.1 Pemeriksaan alkaloid
Ektrak rimpang temulawak sebanyak 0,5 g yang telah dihaluskan kemudian di tambahkan 1 mL asam klorida 2N dan 9 mL air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan adalah sebagai berikut:
a. Filtrat sebanyak 3 tetes di tambahkan 2 tetes pereaksi Meyer, akan terbentuk endapan berwarna putih atau kuning jika mengandung alkaloida.
b. Filtrat sebanyak 3 tetes ditambahkan 2 tetes pereaksi Bourchardat, akan terbentuk endapan berwarna coklat sampai hitam jika mengandung alkaloida. c. Filtrat sebanyak 3 tetes ditambahkan 2 tetes pereaksi Dragendorff, akan
terbentuk endapan berwarna merah sampai coklat jika mengandung alkaloida. Jika reaksi 1 dan 2 hanya terjadi kekeruhan dilanjutkan pemeriksaan berikut: filtrat sebanyak 8 mL ditambahkan 2 mL ammonia pekat dan dikocok dengan 5 mL campuran eter-kloroform (3:1) dan dibiarkan memisah, diambil lapisan eter-kloroform, ditambahkan sedikit natrium sulfat anhidrat, disaring dan diuapkan filtrat di dalam gelas arloji di atas penangas air, dilarutkan residunya dengan sedikit asam klorida 2N. Alkaloid positif jika terjadi endapan atau kekeruhan paling banyak dua dari tiga percobaan di atas (Depkes RI, 1989).
3.4.6.2 Pemeriksaan flavonoid
didiamkan. Lapisan metanol diambil, lalu diuapkan pada suhu 40oC, sisanya dilarutkan dalam 5 mL etil asetat, lalu disaring. Filtratnya digunakan untuk uji flavonoid sebagai berikut:
a. Filtrat sebanyak 1 mL diuapkan sampai kering, sisanya dilarutkan dalam 2 mL etanol 96% lalu ditambahkan 0,5 g serbuk Zn dan 2 ml asam klorida 2N, didiamkan selama 1 menit. Ditambahkan 10 tetes asam klorida pekat. Jika dalam waktu 2-5 menit terjadi warna merah intensif menunjukkan bahwa adanya flavonoida (glikosida-3-flavonol)
b. Filtrat sebanyak 1 mL diuapkan sampai kering, sisanya dilarutkan dalam 1mL etanol 96%, lalu ditambahkan 0,1 g serbuk magnesium dan 10 tetes asam klorida pekat. Jika terlihat warna merah jingga sampai merah ungu menunjukkan adanya flavonoid (Depkes RI, 1989).
3.4.6.3 Pemeriksaan glikosida
Ekstrak rimpang temulawak sebanyak 3 g dicampurkan dengan 30 mL campuran 7 bagian etanol 96% dan 3 bagian air, ditambahkan 10 mL asam sulfat 2N, lalu direfluks selama 10 menit, didinginkan dan disaring. Filtrat sebanyak 20 mL tambahkan 25 mL air dan 25 mL larutan timbal (II) asetat 0,4 M, dikocok dan didiamkan selama 5 menit lalu disaring. Filtrat disari 3 kali, tiap kali dengan 20 mL campuran 3 bagian kloroform dan 2 bagian isopropanol, pada kumpulan sari ditambahkan natrium sulfat anhidrat pekat lalu disaring dan diuapkan pada suhu tidak lebih dari 50oC. Sisa dilarutkan dengan 2 mL metanol pekat. Larutan sisa digunakan untuk percobaan berikut:
pada batas cairan, menunjukkan adanya ikatan gula (Depkes RI, 1989). 3.4.6.4 Pemeriksaan tanin
Ekstrak rimpang temulawak sebanyak 500 mg, dipanaskan dengan 10 mL air, disaring, diencerkan sampai hampir tidak berwarna. Pada 2 mL larutan sampel ditambahkan 1-2 tetes larutan FeCl3 10%, diperhatikan warna yang terjadi,
warna biru atau hijau kehitaman menandakan adanya tanin (Depkes RI, 1989). 3.4.6.5 Pemeriksaan saponin
Ekstrak rimpang temulawak sebanyak 0,5 g dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 mL air panas, didinginkan dan kemudian dikocok kuat-kuat selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan jika pada penambahan asam klorida 2N buih tidak hilang, menunjukkan adanya saponin (Depkes RI, 1989).
3.4.6.6 Pemeriksaan steroid/triterpenoid
Ekstrak rimpang temulawak sebanyak 1 g dimaserasi dengan 20 mL eter selama 2 jam kemudian disaring. Filtrat digunakan untuk reaksi berikut: 5 ml larutan eter diuapkan diatas penangas air, kemudian sisa ditambahkan 20 tetes asam asetat glasial dan 1 tetes asam sulfat pekat (pereaksi Liebermann-Bourchard). Reaksi steroid/triterpenoid positif bila terjadi warna merah ungu atau biru hijau. (Harborne, 1987).
3.4.7 Formula sediaan tablet
Proses pembuatan sediaan tablet ekstrak rimpang temulawak (Curcuma xanthorrhiza Roxb.) sebagai zat aktif menggunakan metode granulasi basah dengan dosis ekstrak kering rimpang temulawak 300 mg, 375 mg, 412,5 mg dan 450 mg dengan bobot tablet 625 mg dan diameter 13 mm dan metode cetak langsung dengan dosis ekstrak kering rimpang temulawak 190 mg dengan menggunakan pengisi granul amilum manihot, granul laktosa, granul kombinasi amilum manihot-laktosa sama banyak, dan avicel PH 102 dengan bobot tablet 500 mg dan diameter 13 mm. Perhitungan dosis dapat dilihat pada Lampiran 7 halaman 60.
Formula yang digunakan dalam pembuatan tablet metode granulasi basah adalah sebagai berikut:
Tabel 3.1 Formula untuk metode granulasi basah
Bahan F1 F2 F3 F4
Ekstrak kering rimpang temulawak (mg) 300 375 412,5 450 Pasta amilum manihot 10% (mg) 187,5 187,5 187,5 187,5
Mg Stearat (mg) 12,5 12,5 12,5 12,5
Talkum (mg) 12,5 12,5 12,5 12,5
Laktosa (mg) 281,25 206,25 168,75 131,25
Bobot 625 mg
Keterangan:
F1: Formula tablet ekstrak kering temulawak dengan dosis 300 mg F2: Formula tablet ekstrak kering temulawak dengan dosis 375 mg F3: Formula tablet ekstrak kering temulawak dengan dosis 412,5 mg F4: Formula tablet ekstrak kering temulawak dengan dosis 450 mg
Formula yang digunakan dalam pembuatan tablet metode cetak langsung yang terdapat pada halaman belakang, yaitu:
Tabel 3.2 Formula untuk metode cetak langsung
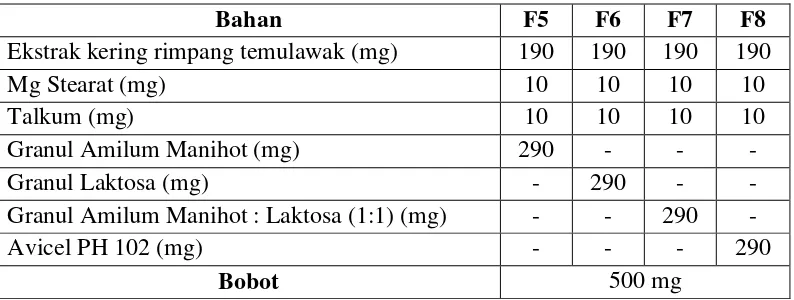
Bahan F5 F6 F7 F8
Ekstrak kering rimpang temulawak (mg) 190 190 190 190
Mg Stearat (mg) 10 10 10 10
Talkum (mg) 10 10 10 10
Granul Amilum Manihot (mg) 290 - - -
Granul Laktosa (mg) - 290 - -
Granul Amilum Manihot : Laktosa (1:1) (mg) - - 290 -
Avicel PH 102 (mg) - - - 290
Bobot 500 mg
Keterangan:
F5: Formula tablet ekstrak kering temulawak dengan granul amilum manihot F6: Formula tablet ekstrak kering temulawak dengan granul laktosa
F7: Formula tablet ekstrak kering temulawak dengan granul amilum manihot : laktosa sama banyak
F8: Formula tablet ekstrak kering temulawak dengan Avicel PH 102
Cetak langsung digunakan untuk menyatakan proses ketika tablet dikempa langsung dari campuran serbuk zat aktif dan eksipien yang sesuai (termasuk pengisi, disintegran dan lubrikan), yang akan mengalir dengan seragam ke dalam lubang kempa dan membentuk suatu padatan yang kokoh (Siregar dan Wikarsa, 2010).
3.4.8 Pembuatan sediaan tablet
Pembuatan sediaan tablet dengan menggunakan metode granulasi basah dilakukan dengan cara:
ukuran yang diperlukan dan ditambahkan bahan pelicin dan dicetak menjadi tablet dengan mesin tablet (Anief, 2008).
Pembuatan bahan pengikat pasta amilum manihot 10 % b/b adalah dengan cara sebagai berikut: amilum manihot ditimbang sebanyak 1,875 g dimasukkan ke beaker glass ditambahkan aquades 16,875 g sehingga terbentuk suspensi. Suspensi dipanaskan dengan api langsung sambil diaduk-aduk sampai mendidih dan membentuk gel, didinginkan, ditimbang dan dicek beratnya, sehingga diperoleh massa pasta amilum manihot 18,75 g (Cartensen, 1977).
Prosedur pembuatan sediaan tablet ekstrak kering temulawak dengan menggunakan metode granulasi basah dilakukan dengan cara:
1. Alat-alat yang digunakan dibersihkan
2. Laktosa dimasukkan kedalam lumpang dan digerus
3. Ekstrak kering temulawak ditambahkan kedalam lumpang dan digerus homogen
4. Pasta amilum manihot dibuat hingga terbentuk massa yang transparan dan didinginkan
5. Pasta amilum yang telah dingin ditambahkan kedalam lumpang sedikit demi sedikit hingga terbentuk massa yang kompak
6. Massa yang kompak diayak dengan mesh 14 dan dikeringkan 7. Massa yang kering diayak kembali dengan mesh 16
8. Talkum dan Mg stearat ditambahkan kedalam granul yang kering dan dilakukan uji preformulasi
9. Tablet dapat dicetak dan dilakukan uji evaluasi
1. Alat-alat yang digunakan dibersihkan
2. Amilum manihot/ laktosa/ amilum manihot : laktosa dibuat terlebih dahulu menjadi granul dengan metode granulasi basah
a. Amilum manihot/ laktosa/ amilum manihot : laktosa ditimbang, dimasukkan kedalam lumpang dan digerus
b. Pasta amilum manihot dibuat hingga terbentuk massa yang transparan dan didinginkan
c. Pasta amilum yang telah dingin ditambahkan kedalam lumpang sedikit demi sedikit hingga terbentuk massa yang kompak
d. Massa yang kompak diayak dengan mesh 14 dan dikeringkan e. Massa yang kering diayak kembali dengan mesh 16
3. Ekstrak kering temulawak ditambahkan kedalam lumpang dan ditambahkan granul amilum manihot/ laktosa/ amilum manihot : laktosa/ avicel 102 dihomogenkan dengan sudip
4. Talkum dan Mg stearat ditambahkan kedalam lumpang, dihomogenkan dengan sudip dan dilakukan uji preformulasi
5. Tablet dapat dicetak dan dilakukan uji evaluasi 3.4.9 Uji preformulasi
3.4.9.1 Sudut diam granul
Penentuan sudut diam granul dilakukan dengan cara:
���= 2� �
Keterangan: θ = sudut diam
H = tinggi tumpukan granul (cm) D = diameter tumpukan granul (cm)
Granul yang mempunyai daya alir bebas akan mempunyai sudut diam antara 20° sampai 40° (Banker dan Anderson, 1994).
3.4.9.2 Waktu alir granul
Penentuan waktu granul dilakukan dengan cara:
Granul sebanyak 100 g, ditimbang, kemudian dimasukkan ke dalam corong yang telah dirangkai kemudian permukaanya diratakan. Penutup bawah dibuka bersamaan dengan dihidupkan stopwatch. Stopwatch dihentikan tepat pada saat garnul habis melewati corong dan dicatat waktu alirnya. Syarat waktu alir granul lebih kecil dari 10 detik (Voigt, 1995).
3.4.9.3 Indeks tap granul
Penentuan indeks tap dilakukan dengan cara:
Granul dimasukkan ke dalam gelas ukur sampai garis tanda dan dinyatakan sebagai volume awalnya (V1), kemudian gelas ukur dihentakkan sebanyak 20 kali dengan alat yang dimodifikasi sehingga diperoleh volume akhir (V2). Indeks tap dapat dihitung dengan rumus :
���������= �1− �2
�2 � 100%
Syarat indeks tap lebih kecil dari 20 % (Voigt, 1995). 3.4.10 Evaluasi tablet
3.4.10.1 Keseragaman bobot
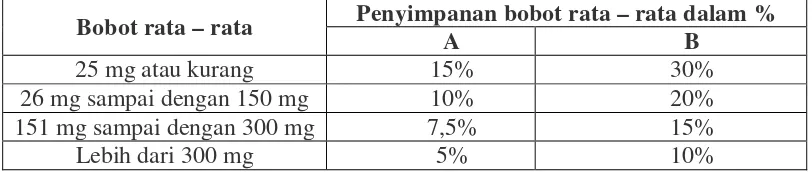
sebagai berikut: Timbang 20 tablet, hitung bobot rata-rata tiap tablet. Jika ditimbang satu persatu, tidak boleh lebih dari 2 tablet yang masing-masing bobotnya menyimpang dari bobot rata-ratanya lebih besar dari harga yang ditetapkan kolom A, dan tidak satu tablet pun yang bobotnya menyimpang dari bobot rata-ratanya lebih dari harga yang ditetapkan kolom B. Jika tidak mencukupi 20 tablet, dapat digunakan 10 tablet; tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan kolom A dan tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan kolom B (Depkes RI, 1979).
Tabel 3.3 Syarat penyimpangan bobot
Bobot rata – rata Penyimpanan bobot rata – rata dalam %
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 mg sampai dengan 300 mg 7,5% 15%
Lebih dari 300 mg 5% 10%
3.4.10.2 Uji friabilitas
Penetapan friabilitas tablet menggunakan alat Roche friabilator. Tablet yang akan diuji sebanyak 20 tablet. Ditimbang 20 tablet yang telah dibersihkan dari debu (A) dimasukkan ke dalam alat dan diputar selama 4 menit. Tablet dikeluarkan dan dibersihkan dari debu kemudian ditimbang (B), kehilangan bobot tidak lebih dari 0,8 % (Banker dan Anderson, 1994). Friabilitas dapat dihitung dengan rumus:
Friabilitas = A − B
B x 100%
3.4.10.3 Uji kekerasan
anvil dan punch tegak lurus, tablet dijepit dengan cara memutar skrup pemutar sampai lampu stop menyala. Skrup ditekan dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet pecah. Percobaan ini dilakukan untuk 5 tablet. Syarat kekerasan tablet 4 kg–8 kg (Parrott, 1971).
3.4.10.4 Uji waktu hancur
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dikirim ke Laboratorium Herbarium Medanese, Universitas Sumatera Utara, dinyatakan tumbuhan yang digunakan adalah rimpang temulawak (Curcuma xanthorrhiza Roxb.) dari famili Zingiberaceae.
4.2 Pemeriksaan Karakterisasi Simplisia
Hasil pemeriksaan makroskopik simplisia rimpang temulawak, yaitu berbentuk bulat atau bulat memanjang, warna kuning, warna daging kuning kecoklatan, panjang 5-9 cm. Hasil pemeriksaan makroskopik simplisia diperoleh rajangan warna kuning kecoklatan, bau khas, rasa pahit, getir, sedikit pedas dan permukaan luar berkerut. Gambar tumbuhan dan simplisia dapat dilihat di Lampiran 2 halaman 55.
Hasil pemeriksaan mikroskopik simplisia rimpang temulawak menunjukkan adanya butiran pati, rambut penutup, serabut sklerenkim, berkas pembuluh, jaringan gabus, berkas pembuluh, parenkim korteks, tetesan minyak. Gambar mikroskopik dapat dilihat di Lampiran 3 halaman 56.
Hasil penetapan kadar rimpang temulawak dapat dilihat pada Tabel 4.1. Tabel 4.1 Hasil penetapan kadar rimpang temulawak
No. Pengujian Persyaratan MMI Hasil
1. 2. 3. 4. 5.
Penetapan kadar abu total
Penetapan kadar abu tidak larut asam Penetapan kadar sari larut air
Penetapan kadar sari larut etanol Penetapan kadar air
<4,4% <0,74% >8,9% >3,5% <10% 4,35% 0,70% 19,5% 15,5% 7,285%
4.3 Hasil Ekstraksi Rimpang Temulawak
Bahan segar rimpang temulawak sebanyak 10 kg dibuat menjadi simplisia. Dari ekstraksi sebanyak 850 gram simplisia temulawak diperoleh ekstrak kental etanol sebanyak 141,187 gram. Berdasarkan hasil tersebut diperoleh rendemen sebesar 16,61%. Perhitungan dapat dilihat di Lampiran 6 halaman 59.
4.4 Skrining Fitokimia
Hasil skrining fitokimia terhadap ektrak rimpang temulawak dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil skrining fitokimia ekstrak rimpang temulawak
No. Golongansenyawakimia Ekstrak rimpang temulawak 1. 2. 3. 4. 5. 6. 7. Alkaloid Flavonoid Tanin Saponin Triterpenoid Steroid Glikosida + + - + + - + Keterangan : (+) = Mengandung senyawa
Uji skrining fitokimia dilakukan untuk mengetahui golongan senyawa kimia yang terkandung di dalam ekstrak rimpang temulawak. Berdasarkan hasil pada Tabel 4.2 bahwa temulawak mengandung senyawa kimia berupa alkaloid, flavonoid, saponin, triterpenoid dan glikosida. Menurut Hayani (2006), temulawak mengandung senyawa alkaloid, flavonoid, triterpenoid, glikosida, fenolik dan sedikit senyawa saponin.
4.5 Uji Preformulasi
4.5.1 Sudut diam granul
[image:47.595.115.513.415.461.2]Hasil sudut diam granul dari berbagai variasi dosis ekstrak rimpang temulawak dengan metode granulasi basahdapat dilihat pada Tabel 4.3.
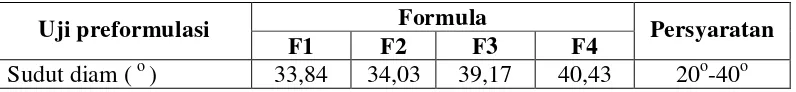
Tabel 4.3 Hasil uji sudut diam granul dengan metode granulasi basah
Uji preformulasi Formula Persyaratan
F1 F2 F3 F4
[image:47.595.165.459.564.680.2]Sudut diam ( o ) 33,84 34,03 39,17 40,43 20o-40o Kebanyakan serbuk farmasetik (massa tablet), nilai sudut diam berkisar dari 25o sampai 45o, dengan nilai yang rendah menunjukkan karakteristik yang lebih baik (Lieberman, et al., 1989).
Gambar 4.1 Histogram sudut diam granul dengan metode granulasi basah
Gambar 4.1 diatas menunjukkan bahwa sudut diam granul dengan metode granulasi basah mengalami peningkatan dengan meningkatnya kandungan
33,84 34,03
39,17 40,43
30 35 40 45
F1 F2 F3 F4
(
°
)
dosis pada setiap formula. F4 menunjukkan bahwa sudut diam granul paling tinggi dibandingkan formula lainnya yang menandakan daya alir granul F4 kurang baik tetapi masih memenuhi persyaratan. Sudut antara 28o dan 42o biasanya berarti bahwa aliran yang baik untuk tablet. Sudut yang lebih tinggi menandakan serbuk dapat menghubungkan hopper dan die, sehingga proses pembuatan tablet terjadi ketidakseragaman atau terisi sempurna (Carstensen, 1977).
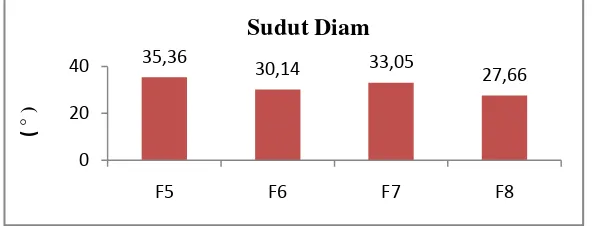
[image:48.595.119.512.362.406.2]Hasil sudut diam granul dapat dilihat pada Tabel 4.4, berikut yang merupakan hasil uji sudut diam granul dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung. Tabel 4.4 Hasil uji sudut diam granul dengan metode cetak langsung
Uji preformulasi Formula Persyaratan
F5 F6 F7 F8
[image:48.595.164.460.538.651.2]Sudut diam ( o ) 35,36 30,14 33,05 27,66 20o-40o Suatu serbuk yang tidak kohesif mengalir baik, menyebar, membentuk timbunan yang rendah. Bahan yang lebih kohesif membentuk timbunan lebih tinggi yang kurang menyebar. Definisi sudut diam adalah sudut permukaan bebas dari tumpukan serbuk dengan bidang horizontal (Swarbrick dan Boylan, 1992).
Gambar 4.2 Histogram sudut diam granul dengan metode cetak langsung
Gambar 4.2 diatas menunjukkan bahwa sudut diam granul dengan metode cetak langsung memiliki nilai yang berbeda setiap formula dan masih memenuhi persyaratan. Sudut diam lebih kecil sama dengan 20o biasanya bahwa
35,36
30,14 33,05 27,66
0 20 40
F5 F6 F7 F8
(
°
)
bahan dapat mengalir bebas, bila sudut lebih besar atau sama dengan 40o biasanya daya mengalirnya kurang baik (Sharma, et al., 2011). Pada F3 dan F4 terdapat sudut alir yang tinggi menandakan bahwa waktu alirnya yang kurang baik. Perhitungan dapat dilihat di Lampiran 10 halaman 71.
4.5.2 Waktu alir granul
[image:49.595.118.511.333.380.2]Hasil waktu alir granul dapat dilihat pada Tabel 4.5 berikut ini yang merupakan hasil uji waktu alir granul dari berbagai variasi dosis ekstrak rimpang temulawak dengan metode granulasi basah.
Tabel 4.5 Hasil uji waktu alir granul dengan metode granulasi basah
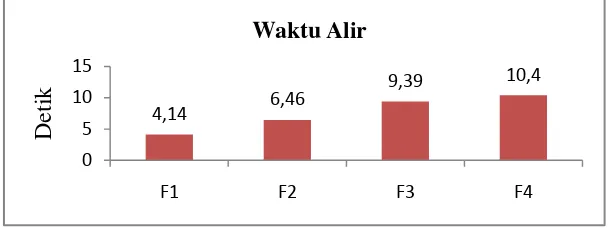
Uji preformulasi Formula Persyaratan
F1 F2 F3 F4
[image:49.595.159.466.538.652.2]Waktu alir ( detik) 4,14 6,46 9,39 10,40 < 10 detik Proses pengisian lubang kempa didasarkan pada aliran granul yang kontiniu dan seragam dari corong. Apabila granul tidak mudah mengalir atau kecepatan mesin melebihi kemampuan aliran granul, maka granul yang cenderung bergerak tak teratur melalui bingkai pengisi yang menyebabkan beberapa lubang kempa tidak terisi sempurna (Lachman, et al., 1986).
Gambar 4.3 Histogram waktu alir granul dengan metode granulasi basah
Gambar 4.3 diatas menunjukkan bahwa tiap formula memiliki waktu alir yang bervariasi tetapi pada F4 waktu alirnya tidak memenuhi persyaratan sehingga granul cenderung bergerak tak teratur yang menyebabkan lubang kempa
4,14 6,46
9,39 10,4
0 5 10 15
F1 F2 F3 F4
D
etik
tidak terisi sempurna.
[image:50.595.119.512.224.269.2]Hasil waktu alir granul dapat dilihat pada Tabel 4.6 dibawah yang merupakan hasil uji waktu alir granul dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung. Tabel 4.6 Hasil uji waktu alir granul dengan metode cetak langsung
Uji preformulasi Formula Persyaratan
F5 F6 F7 F8
[image:50.595.158.464.427.542.2]Waktu alir ( detik) 3,13 2,57 2,81 2,78 < 10 detik Gerakan aliran yang berlebihan menyebabkan variasi bobot yang buruk. Sering kali pembatasan aliran keluar corong memperbaiki masalah tersebut. Dewasa ini telah dipatenkan desain bingkai pengisi yang baru yang mengakomodasi aliran yang berlebihan dari corong tanpa merusak variasi bobot yang seragam (Lachman, et al., 1986).
Gambar 4.4 Histogram waktu alir granul dengan metode cetak langsung
Gambar 4.4 diatas menunjukkan bahwa keempat formula memiliki waktu alir yang bervariasi dan memenuhi persyaratan berdasarkan pendapat Voigt (1995). Perhitungan dapat dilihat di Lampiran 10 halaman 71.
4.5.3 Indeks tap granul
Hasil indeks tap granul dapat dilihat pada Tabel 4.7, berikut yang merupakan hasil uji indeks tap granul dari berbagai variasi dosis ekstrak rimpang temulawak dengan metode granulasi basah.
3,13
2,57 2,81 2,78
0 2 4
F5 F6 F7 F8
D
etik
Tabel 4.7 Hasil uji indeks tap granul dengan metode granulasi basah
Uji preformulasi Formula Persyaratan
F1 F2 F3 F4
[image:51.595.160.465.312.439.2]Indeks tap ( %) 19,05 17,65 12,36 10,49 ≤ 20% Masalah penting yang berkenaan dengan zat aktif misalnya penetapan pengaruh ukuran partikel pada ketermampatan, dan juga pengaruh bentuk kristal (kristalin atau amorf) pada ketermampatan. Terkadang mungkin perlu untuk menggranulasi zat aktif dengan membuat bongkahan guna memperbaiki ketermampatan dan meningkatkan bobot jenis (Lieberman, et al., 1989).
Gambar 4.5 Histogram indeks tap massa granul dengan metode granulasi basah
Gambar 4.5 diatas menunjukkan bahwa semakin kecil nilai dari indeks tap granul maka penyusutan volume yang terjadi akan rendah. Diperoleh nilai indeks tap yang bervariasi, tetapi masih memenuhi persyaratan indeks tap yaitu lebih kecil dari 20% (Voigt, 1995).
Hasil indeks tap granul dapat dilihat pada Tabel 4.8 berikut yang merupakan hasil uji indeks tap granul dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung. Tabel 4.8 Hasil uji indeks tap granul dengan metode cetak langsung
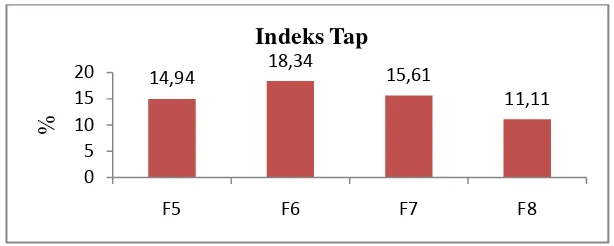
Uji preformulasi Formula Persyaratan
F5 F6 F7 F8
Indeks tap ( %) 14,94 18,34 15,61 11,11 ≤ 20% 19,05 17,65
12,36 10,49
0 10 20 30
F1 F2 F3 F4
%
Ukuran partikel saling berhubungan langsung dengan berbagai variabel pemrosesan yang penting, yaitu keseragaman campuran, larutan atau bahan pengikat granulasi yang digunakan dan efisiensi lubrikan. Untuk memperoleh campuran zat aktif dan bahan lain dalam formula, baik campuran yang akan diproses dengan granulasi basah ataupun kempa langsung. Hal yang sangat penting diperhatikan adalah ukuran partikel, bobot jenis dan bentuk zat aktif harus kompatibel dengan ukuran partikel, bobot jenis dan bentuk bahan lain. Hal ini sangat penting karena memungkinkan bahan terdistribusi acak di dalam campuran sebelum pengempaan (Loftus dan Nash, 1984).
Gambar 4.6 Histogram indeks tap massa granul dengan metode cetak langsung
Gambar 4.6 diatas menunjukkan nilai indeks tap yang diperoleh bervariasi dan F6 memliki nilai yang lebih tinggi dibandingkan yang lain yang berarti semakin besar nilai dari indeks tap granul maka penyusutan volume yang terjadi akan tinggi. Perhitungan dapat dilihat di Lampiran 10 halaman 71.
Metode granulasi basah pada F4 menunjukkan waktu alir dan sudut diam yang kurang baik. Kadang-kadang aliran buruk disebabkan oleh adanya lembap. Dalam hal ini, pengeringan serbuk akan mengurangi kohesivitas serbuk. Serbuk yang tidak kohesif mengalir baik, menyebar, membentuk timbunan yang rendah. Bahan lebih kohesif membentuk timbunan yang lebih tinggi yang kurang menyebar. Secara komersial, pati dapat mengandung lembap yang beragam antara
14,94
18,34
15,61
11,11
0 5 10 15 20
F5 F6 F7 F8
%
11-14% (Siregar dan Wikarsa, 2010). Penggunaan pati yang cukup banyak pada formula dapat menyebabkan waktu alir dan sudut diam yang kurang baik.
4.6 Uji Evaluasi Tablet
Pada proses pencencetakan tablet formula F2, F3 dan F4 tidak dapat dicetak menjadi tablet yang sempurna. Uji evaluasi hanya dilakukan pada formula F1, F5, F6, F7 dan F8 yang dapat dicetak menjadi tablet.
4.6.1 Keseragaman bobot
Hasil keseragaman bobot tablet dengan berbagai variasi dosis ekstrak rimpang temulawak pada F1 memenuhi persyaratan. Tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan. Perhitungan dapat dilihat di Lampiran 10 halaman 71. Hasil keseragaman bobot tablet keempat formula berturut-turut F5, F6, F7 dan F8 memenuhi persyaratan dimana tidak satu tablet pun yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan dalam kolom A menurut Tabel 3.3. Perhitungan dapat dilihat di Lampiran 12 halaman 73 sampai halaman 77.
Variasi bobot tablet yang merupakan salah satu ukuran kendali yang penting dalam proses (in-process) dan spesifikasi variasi bobot telah diberikan. Bobot tablet ditentukan oleh jumlah granul dalam ruang kompresi sebelum sediaan dikempa. Karena itu setiap hal yang dapat mengubah proses pengisian ruang kompresi dapat merubah bobot tablet dan menimbulkan variasi bobot (Lachman, et al., 1986).
4.6.2 Uji friabilitas
dengan metode granulasi basah.
Tabel 4.9 Hasil uji evaluasi friabilitas tablet dengan metode granulasi basah
Uji evaluasi Formula Persyaratan
F1 F2 F3 F4
Friabilitas ( % ) 0,72 - - - ≤ 1%
Friabilitas, yaitu suatu karakteristik penting yang saling berhubungan yang menunjukkan apakah tablet akan menjadi sumbing, retak atau berdebu selama proses pengemasan (Loftus dan Nash, 1984).
Gambar 4.7 Histogram uji friabilitas tablet dengan metode granulasi basah
Gambar 4.7 diatas menunjukkan bahwa hasil friabilitas memenuhi persyaratan. Menurut Siregar dan Wikarsa (2010), menjelaskan bahwa persyaratan friabilitas yaitu maksimal 1% untuk sediaan tablet konvensional. Perhitungan dapat dilihat di Lampiran 12 halaman 73.
[image:54.595.157.466.286.398.2]Hasil uji friabilitas dapat dilihat pada Tabel 4.10, berikut yang merupakan uji friabilitas tablet dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung.
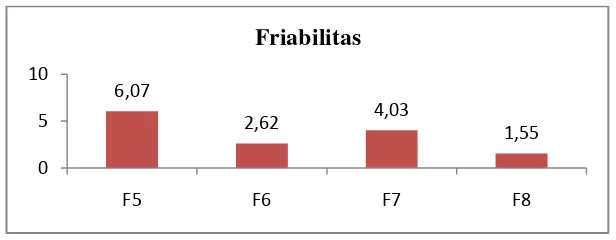
Tabel 4.10 Hasil uji evaluasi friabilitas tablet dengan metode cetak langsung
Uji evaluasi Formula Persyaratan
F5 F6 F7 F8
Friabilitas ( % ) 6,07 2,62 4,03 1,55 ≤ 1% Uji friabilitas memberi pentunjuk tentang kemampuan tablet mencegah sumbing dan goresan pada penanganan selama pengemasan dan pengiriman.
0,72
0 0 0
0 0,5 1
F1 F2 F3 F4
[image:54.595.113.511.660.707.2]Biasanya untuk tablet kunyah (karena kekerasan tablet yang lebih rendah), nilai friabilitas sampai 4% dapat diterima (Lieberman, et al., 1989).
Gambar 4.8 Histogram uji friabilitas tablet dengan metode cetak langsung
Gambar 4.8 di atas menunjukkan bahwa hasil friabilitas tidak memenuhi persyaratan berdasarkan pendapat Siregar dan Wikarsa (2010) dimana ketahanan yang kurang pada tablet terhadap goncangan selama proses pengangkutan dan penyimpanan. Tablet yang mudah rapuh dan pecah akan kehilangan keindahan dalam penampilannya serta menimbulkan variasi pada bobot tablet tablet dan keseragaman dosis obat (Banker dan Anderson, 1986). Perhitungan dapat dilihat di Lampiran 12 halaman 74 sampai halaman 77.
4.6.3 Uji kekerasan
[image:55.595.117.512.634.680.2]Hasil kekerasan tablet dapat dilihat pada Tabel 4.11, dibelakang yang merupakan hasil uji kekerasan tablet dari berbagai variasi dosis ekstrak rimpang temulawak dengan metode granulasi basah.
Tabel 4.11 Hasil uji evaluasi kekerasan tablet dengan metode granulasi basah
Uji evaluasi Formula Persyaratan
F1 F2 F3 F4
Kekerasan tablet (Kg) 0,56 - - - 4-8 Kg
Setiap granul tablet, baik dibuat dengan metode granulasi basah atau dengan metode kempa langsung, harus memenuhi persyaratan tertentu, yaitu granul tersebut harus dapat terikat bersama-sama bila diberi tekanan. Granulasi
6,07
2,62 4,03
1,55
0 5 10
F5 F6 F7 F8
dikatakan ideal apabila menghasilkan granul yang terikat bila diberikan tekanan minimum untuk waktu tersingkat. Apabila gaya ikatan partikel makin besar, kekerasan yang dicapai makin mendekati optimum (Lieberman, et al., 1989).
Gambar 4.9 Histogram uji kekerasan tablet dengan metode granulasi basah
Gambar 4.9 di depan menunjukkan bahwa F1 ini mempunyai kekerasan yang tidak memenuhi persyaratan. Menurut Siregar dan Wikarsa (2010), kekerasan tergantung pada bobot bahan dan celah antara punch atas dan punch bawah pada waktu pengempaan. Jika volume bahan atau jarak antara punch bervariasi, kekerasan juga bervariasi. Perhitungan dapat dilihat di Lampiran 12 halaman 73.
[image:56.595.117.512.607.653.2]Hasil kekerasan tablet dapat dilihat pada Tabel 4.12, berikut yang merupakan hasil uji kekerasan tablet dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung. Tabel 4.12 Hasil uji evaluasi kekerasan tablet dengan metode cetak langsung
Uji evaluasi Formula Persyaratan
F5 F6 F7 F8
Kekerasan tablet (Kg) 0,28 0,39 0,31 1,27 4-8 Kg Eksipien yang dipilih sebaiknya yang akan menghasilkan tablet dengan kekerasan yang konstan terhadap waktu (tidak boleh ada terjadi pengerasan selama penyimpanan). Eksipien higroskopis cenderung menghasilkan tablet yang
0,56
0 0 0
0 0,2 0,4 0,6
F1 F2 F3 F4
Kg
melunak sesuai waktu, sedangkan tablet yang cenderung kehilangan kelembapan cenderung akan mengeras sesuai waktu usia (Agoes, 2008).
[image:57.595.160.465.254.372.2]Penyebab masalah variasi kekerasan sama dengan penyebab variasi berat. Kekerasan tergantung pada berat dari materi serta ruangan antara punch atas dan bawah pada waktu pencetakan. Bila volume materi atau jarak kedua punch berbeda, maka kekerasan tidak akan konsisten (Lachman, et al., 1986).
Gambar 4.10 Histogram uji kekerasan tablet dengan metode cetak langsung
Gambar 4.10 di depan menunjukkan bahwa keempat formula ini mempunyai kekerasan yang berbeda-beda dan tidak memenuhi persyaratan. Menurut Siregar dan Wikarsa (2010), kekerasan tergantung pada bobot bahan dan celah antara punch atas dan punch bawah pada waktu pengempaan. Jika volume bahan atau jarak antara punch bervariasi, kekerasan juga bervariasi. Perhitungan dapat dilihat di Lampiran 12 halaman 74 sampai halaman 77.
4.6.4 Uji waktu hancur
Hasil waktu hancur tablet dapat dilihat pada Tabel 4.13 di belakang yang merupakan hasil uji kekerasan tablet dari berbagai variasi dosis ekstrak rimpang temulawak dengan metode granulasi basah.
Tabel 4.13 Hasil uji evaluasi waktu hancur tablet dengan metode granulasi basah
Waktu Hancur Formula Persyaratan
F1 F2 F3 F4
Dengan cakram (menit) 20,62 - - - ≤ 15 menit
0,28 0,39 0,31
1,27
0 0,5 1 1,5
F5 F6 F7 F8
Kg
Pendapat yang secara umum diterima mengatakan bahwa obat harus berada dalam bentuk larutan agar segera siap diabsorbsi (terdapat dalam tubuh). Bagi tablet, langkah penting pertama sebelum melarut adalah pecahnya tablet menjadi partikel-partikel kecil atau granul; langkah ini disebut disintegrasi (Lachman, et al., 1986).
Gambar 4.11 Histogram uji waktu hancur dengan metode granulasi basah
Gambar 4.11 di atas menunjukkan bahwa F1 tidak memenuhi persyaratan waktu hancur dan formula lainnya tidak dapat dicetak. Pada Farmakope Indonesia Edisi IV yaitu tidak lebih dari 15 menit. Perhitungan dapat dilihat di Lampiran 12 halaman 73.
[image:58.595.118.512.607.653.2]Hasil waktu hancur dapat dilihat pada Tabel 4.14, berikut yang merupakan hasil uji waktu hancur dari berbagai variasi granul sebagai bahan pengisi pada tablet ekstrak rimpang temulawak dengan metode cetak langsung. Tabel 4.14 Hasil uji evaluasi waktu hancur tablet dengan metode cetak langsung
Waktu Hancur Formula Persyaratan
F5 F6 F7 F8
Dengan cakram (menit) 1,37 5,25 1,23 0,9 ≤ 15 menit Hasil penelitian menunjukkan bahwa hubungan antara disintegrasi dan kelarutan tidak seharusnya diterima begitu saja. Akan tetapi karena kelarutan obat dari pecahan-pecahan tablet tampaknya mengontrol sebagian atau seluruh obat yang ada dalam darah, disintegrasi tetap dipakai sebagai petunjuk dalam
20,62
0 0 0
0 10 20 30
F1 F2 F3 F4
me
n
it
pembuatan formula optimum tablet, serta sebagai uji kontrol dalam proses untuk menjamin keseragaman antar batch (Lachman, et al., 1986).
Gambar 4.12 Histogram uji waktu hancur dengan metode cetak langsung
Gambar 4.12 di atas menunjukkan bahwa keempat formula memiliki waktu hancur yang berbeda. Pada Farmakope Indonesia Edisi IV yaitu tidak lebih dari 15 menit. Pada F6 memliki waktu hancur yang lebih lama dibandingkan formula lainnya dan memenuhi persyaratan. Perhitungan dapat dilihat di Lampiran 12 halaman 74 sampai halaman 77.
Metode granulasi basah menunjukkan bahwa dari keempat formula hanya formula F1 yang dapat tercetak sempurna. Dilihat dari hasil evaluasi tablet nilai kekerasan, friabilitas, waktu hancur dan keseragaman bobot secara umum memenuhi syarat, kecuali nilai kekerasan hanya 0,56.
Tablet yang keras pada umumnya memiliki waktu hancur yang lama (lebih sukar hancur) dan disolusi yang rendah, namun tak selamanya demikian. Pada umumnya tablet yang baik dinyatakan mempunyai kekerasan 4-8 kg. Namun hal ini tidak mtlak, artinya kekerasan tablet dapat lebih kecil dari 4 atau lebih tinggi dari 8 kg. Kekerasan tablet kurang dari 4 kg masih dapat diterima dengan syarat kerapuhannya tidak melebihi batas yang diterapkan. Kekerasan tabletlebih besar dari 10 kg masih dapat diterima, jika masih memenuhi persyaratan waktu hancur/disintegrasi dan disolusi yang dipersyaratkan (Sulaiman, 2007). Sehingga
1,37
5,25
1,23
0,9
0 2 4 6
F5 F6 F7 F8
me
n
it
F1 pada metode granulasi basah dapat dikatakan sebagai tablet yang baik karena nilai kekerasannya dapat diterima.
Metode cetak langsung menunjukkan bahwa dari keempat formula, yaitu F5, F6, F7 dan F8 dapat tercetak sempurna. Dilihat dari hasil evaluasi tablet kekersan, friabilitas, waktu hancur dan keseragaman bobot secara umum memenuhi syarat, kecuali nilai kekerasan dan nilai friabilitas yang kurang baik.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Tablet yang mengandung 300 mg ekstrak kering temulawak (Curcuma xanthorrhiza Roxb.) dapat dibuat menjadi sediaan tablet dengan metode
granulasi basah..
2. Granul amilum manihot, granul laktosa, granul amilum manihot-laktosa dan avicel PH 102 kurang baik dijadikan sebagai bahan pengisi pada metode cetak langsung.
5.2Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Temulawak (Curcuma xanthorrhiza Roxb.) dikenal dengan banyak nama di berbagai daerah, seperti temu besar (bahasa Melayu), koneng gede (Sunda), dan temu labak (Madura). Tanaman ini tidak hanya dikenal sebagai bahan baku jamu
tradisional dalam negeri saja, tetapi sudah sejak lama dikenal di Eropa Barat sebagai bahan obat-obatan (Hayati, 2003).
2.1.1 Sistematika tumbuhan
Dalam taksonomi tumbuhan Temulawak diklasifikasikan sebagai berikut: Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Monocotyledoneae Ordo : Zingiberales
Familia : Zingiberaceae
Genus : Curcuma
Spesies : Curcuma xanthorriza Roxb. (Wijayakusuma, 2007). 2.1.2 Morfologi tumbuhan
Tumbuhan temulawak mempunyai ukuran rimpang yang besar dan bercabang-cabang. Rimpang induk berbentuk bulat atau bulat telur dan disampingnya terbentuk 3-4 rimpang cabang yang memanjang. Warna kulit rimpang coklat kemerahan atau kuning tua, sedangkan warna daging rimpang kuning jingga atau jingga kecoklatan. Perbungaan lateral yang keluar dari rimpangnya, dalam rangkaian bentuk bulir dengan tangkai yang ramping. Bunga mempunyai daun pelindung yang banyak dan berukuran besar, berbentuk bulat telur sungsang yang warnanya beraneka ragam (Wijayakusuma, 2007).
2.1.3 Kandungan kimia
Rimpang temulawak mengandung zat warna kuning (kurkumin), desmetoksikurkumin, glukosa, kalium oksalat, protein, serat, pati, minyak atsiri yang terdiri dari d-kamfer, siklo isoren, mirsen, p-toluil metilkarbinol, falandren, borneol, tumerol, xanthorrhizol, sineol, isofuranogermakren, zingiberen, zingeberol, turmeron, artmeron, sabinen, germakron, atlantone (Wijayakusuma, 2007). Kandungan kurkumin dalam rimpang temulawak adalah 1-2% (Wiryowidagdo, 2008).
reaksi peroksidasi (Ahsan, et al., 1999). Senyawa fenol merupakan senyawa yang memiliki paling sedikit satu cincin aromatik yang berikatan dengan satu atau lebih gugus OH. Kapasitas antioksidan dari senyawa fenolik disebabkan oleh disumbangkannya atom hidrogen dari gugus hidroksil (OH) aromatik kepada radikal bebas (Duthie dan Crozier, 2000).
Menurut Rismunandar (1988), rimpang temulawak mengandung kurkumin sebesar 1,93%. Kadar kurkumin dan minyak atsiri tergantung pada umur rimpang. Kadar kurkumin dan minyak atsiri optimum tercapai saat rimpang berumur 10-12 bulan.
2.1.4 Manfaat tumbuhan
Temulawak dapat digunakan untuk meningkatkan nafsu makan, memperbaiki fungsi pencernaan, memelihara fungsi hati (hepatoprotektor), pereda nyeri sendi dan tulang, menurunkan lemak darah, antioksidan, dan membantu menghambat pembekuan darah. Hasil uji klinik menunjukkan bahwa dosis yang digunakan untuk memperoleh manfaat penurunan SGOT dan SGPT adalah 15-30 mg kurkumin (BPOM RI, 2005). Efek antioksidan dari kurkumin dapat menghambat poliferasi sel tumor, kanker usus besar dan kanker payudara (Tjay dan Rahardja, 2007).
meningkatnya pengeluaran cairan empedu maka partikel padat dalam kandung empedu berkurang. Keadaan ini akan mengurangi kolik empedu, perut kembung akibat gangguan metabolisme lemak, dan menurunkan kadar kolesterol darah yang tinggi(Solichedi, 2003).
Konsumsi temulawak pada orang sehat juga sangat penting untuk memelihara kesehatan fungsi hati dan menjaga stamina tubuh. Usia antara 20-60 tahun merupakan usia produktif untuk melakukan berbagai aktivitas yang berat dan melelahkan. Salah satu penyebab menurunnya fungsi hati adalah faktor kelelahan sehingga kerja hati menjadi bertambah berat. Hal ini menyebabkan tubuh rentan untuk tertular virus hepatitis yang berbahaya karena virus ini mampu bertahan dan menetap di dalam tubuh, bersifat kronis serta dalam perjalanan selanjutnya berpotensi merusak hati, ukurannya mengecil dan mengeras (sirosis hati) dan dapat berakhir menjadi kanker hati (Suharjo, 2010).
Salah satu jenis pemeriksaan yang sering dilakukan untuk mengetahui adanya kerusakan pada hati adalah pemeriksaan enzim transaminase. Dalam keadaan normal terdapat keseimbangan antara pembentukan enzim dengan penghancurannya. Apabila terjadi gangguan fungsi hati, enzim transaminase di dalam sel akan masuk ke dalam peredaran darah karena terjadi perubahan permeabilitas membran sel sehingga kadar enzim transaminase dalam darah akan meningkat (Widman, 1989).