SINTESIS, KARAKTERISASI, DAN APLIKASI TURUNAN SENYAWA ORGANOTIMAH(IV) 4-AMINOBENZOAT SEBAGAI INHIBITOR KOROSI PADA
BAJA LUNAK DALAM MEDIUM KOROSIF
( Skripsi )
Oleh
DEWI KARLINA
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
SINTESIS, KARAKTERISASI, DAN APLIKASI TURUNAN SENYAWA ORGANOTIMAH(IV) 4-AMINOBENZOAT SEBAGAI INHIBITOR
KOROSI PADA BAJA LUNAK DALAM MEDIUM KOROSIF
Oleh
Dewi Karlina
Telah dilakukan penelitian mengenai sintesis, karakterisasi, dan aplikasi turunan senyawa organotimah(IV) 4-aminobenzoat sebagai inhibitor korosi pada baja lunak tipe HRP (Hot Roller Plat) dalam medium korosif DMSO-HCl. Dilakukan sintesis senyawa difeniltimah(IV) aminobenzoat dan dibutiltimah(IV) di-4-aminobenzoat. Senyawa hasil sintesis dikarakterisasi menggunakan spektrofotometri IR, UV, NMR, dan microelemental analyzer serta pengujian aktivitas antikorosi menggunakan potensiostat EA10. Analisis permukaan baja dilakukan dengan menggunakan mikroskop Trinokuler. Dari hasil karakterisasi dapat diketahui bahwa senyawa difeniltimah(IV) di-4-aminobenzoat dan dibutiltimah(IV) di-4-aminobenzoat telah berhasil disintesis dengan adanya gugus-gugus fungsi, λmax, dan komposisi unsur dari senyawa yang diharapkan. Senyawa difeniltimah(IV) di-4-aminobenzoat berupa padatan putih keruh dengan rendemen senyawa 93,16 % dan senyawa dibutiltimah(IV) di-4-aminobenzoat berupa padatan berwarna kuning keputihan dengan rendemen senyawa 87,47 %. Hasil pengujian aktivitas antikorosi menunjukkan penghambatan tertinggi masing-masing terjadi pada konsentrasi 100 mg/L oleh senyawa difeniltimah(IV) di-4-aminobenzoat dan senyawa dibutiltimah(IV) di-4-aminobenzoat dengan persen efisiensi inhibisi masing-masing sebesar 40,54 dan 37,5 %.
Oleh
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
Penulis dilahirkan di Seputih Raman, 22 tahun yang lalu pada tanggal 03 September 1993 sebagai anak bungsu dari dua bersaudara, dengan seorang kakak laki-laki bernama Salim Nurudin dari pasangan Bapak Kartam dan Ibu Santi,.
!
" #
$
%
" &
&
“Sesungguhnya Allah tidak akan mengubah nasib suatu kaum kecuali
kaum itu sendiri yang mengubah apa apa yang pada diri mereka”
SANWACANA
Puji dan syukur penulis ucapkan kepada Allah S.W.T karena atas limpahan rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Sintesis, Karakterisasi, dan Aplikasi Turunan Senyawa Organotimah(IV) 4-aminobenzoat sebagai Inhibitor Korosi pada Baja Lunak dalam Medium Korosif”. Shalawat serta salam tidak lupa penulis haturkan kepada Nabi Besar Muhammad S.A.W, semoga kita bisa mendapaat syafaatnya kelak di yaummil qiyammah. Amiin.
Ucapan syukur dan terimaksih penulis sampaikan kepada :
1. Allah S.W.T yang senantiasa memberikan rahmat dan hidayahNya kepada penulis
2. Kedua Orangtua, bapak Kartam dan ibu Santi yang selalu memberikan do’a, kasih sayang, serta dukungan untuk terus semangat dalam
menyelesaikan penelitian dan skripsi ini. Semoga Allah senantiasa memberikan kebaikan dan cintaNya.
kesabaran, keikhlasan sehingga skripsi penulis dapat terselesaikan dengan baik.
5. Ibu Prof. Buhani, M.Si. selaku Pembahas dalam penelitian penulis atas semua nasihat, bimbingan, dan kesabaran beliau sehingga skripsi ini dapat terselesaikan.
6. Bapak Rudy T.M Situmeang selaku Kepala Laboratorium Kimia Anorganik/Fisik atas izinnya untuk menyelesaikan penelitian.
7. Bapak Dr. Eng. Suripto Dwi Yuwono, M. T. selaku Ketua Jurusan Kimia FMIPA Unila.
8. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas seluruh ilmu dan bimbingan yang diberikan selama penulius menempuh perkuliahan. Semoga Allah melimpahkan berkah kepada Bapak dan Ibu. 9. Bapak Prof. Suharso, Ph.D selaku dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung
10. Kakak laki-laki satu-satunya dan hanya satu, Salim Nurudin yang selalu memberikan semangat sejak mulai diterima sebagai mahasiswa,
mengahadapi perkuliahan sampai menjalankan penelitian dan mengerjakan skripsi
11. Rekan juang penelitian yang lulus lebih dulu Asti Nurul Aini S.Si, dan rekan satu bimbingan Melli Novita Windiyani, Nopitasari, Bu Hastin, Pak Nuris, Pak Bambang, Sukamto, Jean, Murni, dan Adi yang selalu
13. Teman-teman penelitian di Laboratorium Kimia Anorganik/Fisik (Rina, Rio W, Tamara, Yunia, Mely Antika, Nico, Irkham, Fatma, Eva, Yudak, mbak Lolita, dan mbak Surtini) dan teman-teman di Laboratorium Analitik (Daniar, Mila “ebol”, Fani “Tante”, Ayu “Pinces”, Angginok, Lewi) atas kerja samanya.
14. Teman-teman tercinta Kimia 2011 “Cheven” : Ayu B “ Ay-ay”, Endah gegek, Mega “Bobby”, Ana “Magnae”, Nira, April, Cimoy,
Lusi“Luzeek”,Vevi, Ajeng “Nenek”, Windy, Umee, Uus, Yulia N., Mirfat, Jelita S., Jelita P.S “Tatak”, Mardian, Azies, Juned, Arik, Ari, Miftahur, Ridho, Wagiran, Ivan, Ramos, J. Julianser, Rio F, Yusri, Andri, Gani, Ananda J, dan Lisa atas kebersamaannya.
15. Mba Liza, Mb Nora, Pak Gani, Mas Nomo, Bunda Iin, dan Mas Udin terima kasih atas seluruh bantuan yang diberikan kepada penulis.
16. Seseorang yang selalu memberikan do’a, dukungan dan semangatnya bagi penulis untuk menyelesaikan penelitian dan skripsi dengan baik
17. Sahabat lama tersayang (Indah, Yoyo, Echie, dan Asri) atas dukungan dan kebersamaan tak terlupakannya
18. Teman satu kamar selama 4 tahun tak terpisahkan, si “Mbah” Resty Wulandari atas kebersamaan dan perhatiannya.
19. Seluruh keluarga besar Jurusan Kimia FMIPA Angkatan 2009 – 2014 .
lebih baik. Semoga dengan terselesaikannya skripsi ini dapat memberikan manfaat bagi semua pihak khususnya dalam bidang ilmu pengetahuan.
Bandar Lampung, Oktober 2015 Penulis
DAFTAR GAMBAR
Gambar Halaman
1. Reaksi sintesis senyawa dibutiltimah(IV) di-4-aminobenzoat ... 11
2. Reaksi sintesis senyawa difeniltimah(IV) di-4-aminobenzoat ... 11
3. Sketsa instrumen eDAQ dan benda uji ... 31
4. Struktur asam 4-aminobenzoat ... 32
5. Grafik hasil pemindaian senyawa difeniltimah(IV) di-3-nitrobenzoat terhadap kontrol medium korosif tanpa inhibitor ... 34
6. Grafik hasil pemindaian senyawa trifeniltimah(IV) 3-nitrobenzoat terhadap kontrol medium korosif tanpa inhibitor ... 35
7. Padatan senyawa difeniltimah(IV) di-4-aminobenzoat hasil sintesis ... 46
8. Padatan senyawa dibutiltimah(IV) di-4-aminobenzoat hasil sintesis ... 48
9. Spektrum inframerah senyawa asam 4-aminobenzoat ... 51
10. Spektrum inframerah difeniltimah(IV) oksida dan difeniltimah(IV) di-4-aminobenzoat ... 53
11. Spektrum inframerah senyawa dibutiltimah(IV) oksida dan dibutiltimah(IV) di-4-aminobenzoat. ... 55
12. Spektra UV-Vis asam 4-aminobenzoat ... 57
13. Spektra UV-Vis difeniltimah(IV) oksida dan difeniltimah(IV) di-4-aminobenzoat ... 58
15. Spektra 1H NMR dibutiltimah(IV) di-4-aminobenzoat dan
difeniltimah(IV) di-4-aminobenzoat ... 63 16. Spektra 13C NMR dibutiltimah(IV) di-4-aminobenzoat dan
difeniltimah(IV) di-4-aminobenzoat ... 65 17. Potongan baja sebelum diamplas dan potongan baja setelah diamplas .... 67 18. Grafik hasil pemindaian ligan asam 4-aminobenzoat terhadap kontrol
medium korosif DMSO-HCl tanpa inhibitor ... 69 19. Grafik hasil pemindaian senyawa difeniltimah(IV) oksida terhadap
kontrol medium korosif DMSO-HCl tanpa inhibitor ... 71 20. Grafik hasil pemindaian senyawa difeniltimah(IV) di-4-aminobenzoat
terhadap kontrol medium korosif DMSO-HCl tanpa inhibitor ... 74 21. Grafik perbandingan persen efisiensi inhibisi senyawa difeniltimah(IV)
di-4-aminobenzoat terhadap senyawa awal difeniltimah(IV) oksida dan ligan asam 4-aminobenzoat ... 76 22. Grafik hasil pemindaian senyawa dibutiltimah(IV) oksida terhadap
kontrol medium korosif DMSO-HCl tanpa inhibitor ... 78 23. Grafik hasil pemindaian senyawa dibutiltimah(IV) di-4-aminobenzoat
terhadap kontrol medium korosif DMSO-HCl tanpa inhibitor ... 81 24. Grafik persen efisiensi inhibisi senyawa dibutiltimah(IV)
di-4-aminobenzoat dibandingkan terhadap senyawa awal
dibutiltimah(IV) oksida dan ligan asam 4-aminobenzoat ... 83 25. Kenampakan mikroskop permukaan baja setelah direndam dalam larutan
medium korosif DMSO-HCl ... 84 26. Hasil analisis permukaan baja dalam senyawa inhibitor difeniltimah(IV)
di-4-aminobenzoat dan dibutiltimah(IV) di-4-aminobenzoat ... 85 27. Grafik perbandingan persen efisiensi inhibisi (% EI) senyawa
difeniltimah(IV) di-4-aminobenzoat dan dibutiltimah(IV)
di-4-aminobenzoat dengan meningkatnya konsentrasi ... 86 28. Struktur senyawa difeniltimah(IV) di-4-aminobenzoat dan
dibutiltimah(IV) di-4-aminobenzoat ... 87 29. Kurva polarisasi anoda difeniltimah(IV) di-4-aminobenzoat dan
30. Kurva polarisasi katoda difeniltimah(IV) di-4-aminobenzoat dan
DAFTAR TABEL
Tabel Halaman
1. Data pH larutan dan efisiensi inhibisi penambahan senyawa difeniltimah(IV) di-3-nitrobenzoat dibandingkan kontrol DMSO-HCl... 13 2. Data pH larutan dan efisiensi inhibisi penambahan senyawa
difeniltimah(IV) di-3-nitrobenzoat dibandingkan kontrol DMSO-HCl... 34
3. Data pH larutan dan efisiensi inhibisi penambahan senyawa
trifeniltimah(IV) 3-nitrobenzoat dibandingkan kontrol
DMSO-HCl... 36
4. Data berat senyawa difeniltimah(IV) di-4-aminobenzoat hasil
sintesis ... 46 5. Data berat senyawa dibutiltimah(IV) di-4-aminobenzoat hasil
sintesis ... 49 6. Bilangan gelombang gugus fungsi yang terkandung dalam senyawa
asam 4-aminobenzoat ... 52 7. Pergeseran bilangan gelombang gugus-gugus fungsi dalam senyawa
difeniltimah(IV) oksida dan difeniltimah(IV) di-4-aminobenzoat ... 54 8. Pergeseran bilangan gelombang gugus-gugus fungsi dalam senyawa
dibutiltimah(IV) oksida dan dibutiltimah(IV) di-4-aminobenzoat ... 56 9. Data komposisi (%) unsur C, N, dan H dibandingkan terhadap
perhitungan komposisi secara teori ... 61 10. Data persen efisiensi inhibisi penambahan senyawa asam
11. Data persen efisiensi inhibisi penambahan senyawa difeniltimah(IV) oksida dengan variasi konsentrasi dibandingkan dengan kontrol
DMSO-HCl ... 72
12. Data persen efisiensi inhibisi penambahan senyawa difeniltimah(IV) di-4-aminobenzoat dengan variasi konsentrasi dibandingkan dengan kontrol DMSO-HCl ... 75 13. Data persen efisiensi inhibisi penambahan senyawa dibutiltimah(IV)
oksida dengan variasi konsentrasi dibandingkan dengan kontrol
DMSO-HCl ... 79 14. Data persen efisiensi inhibisi penambahan senyawa dibutiltimah(IV)
di-4-aminobenzoat dengan variasi konsentrasi dibandingkan dengan kontrol DMSO-HCl ... 82 15. Data perbandingan persen inhibisi kontrol, ligan, senyawa awal, dan
DAFTAR ISI
1.2. Tujuan Penelitian ... 5
1.3. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA A. Organologam ... 6
B. Organotimah ... 8
1. Senyawa organotimah halida ... 9
2. Senyawa organotimah hidroksida dan oksida ... 10
3. Senyawa organotimah karboksilat ... 10
C. Analisis Senyawa Organotimah ... 12
1. Analisis spektroskopi IR senyawa organotimah ... 12
2. Analisis spektroskopi UV-Vis senyawa organotimah ... 13
3. Analisis unsur menggunakan microelemental analyzer ... 15
4. Analisis senyawa menggunakan spektrometer NMR (Nuclear Magnetic Resonance) ... 15
D. Aplikasi Senyawa Organotimah ... 16
E. Baja Lunak ... 17
F. Korosi ... 18
G. Jenis-jenis Korosi ... 20
1. Korosi Galvanis ... 20
2. Korosi Sumuran (Pitting Corrosion) ... 20
3. Korosi Erosi (Errosion Corrosion) ... 21
4. Korosi Regangan (Stress Corrosion) ... 21
5. Korosi Celah (Crevice Corrosion) ... 21
6. Korosi Kavitasi (Cavitation Corrosion) ... 21
7. Korosi Lelah (Fatigue Corrosion) ... 22
H. Faktor-faktor Penyebab Korosi ... 22
1. Polarisasi potensiodinamik ... 25
2. Metode tafel ... 27
3. Laju korosi ... 27
J. Inhibitor Korosi dan Jenisnya ... 28
1. Inhibitor korosi katodik ... 29
2. Inhibitor korosi anodik ... 29
3. Inhibitor korosi organik... 29
4. Inhibitor korosi adsorpsi ... 30
K. Potensiostat ... 31
L. Asam 4-aminobenzoat ... 32
M. Uji Aktivitas Antikorosi Senyawa Organotimah ... 33
1. Senyawa turunan organotimah(IV) 3-nitrobenzoat ... 33
2. Senyawa turunan organotimah(IV) 2-nitrobenzoat ... 36
3. Mekanisme kerja inhibitor ... 37
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian ... 39
B. Alat dan Bahan ... 40
C. Prosedur Penelitian ... 40
1. Sintesis senyawa organotimah(IV) 4-aminobenzoat ... 40
2. Preparasi baja lunak ... 42
3. Pembuatan medium korosif... 42
4. Uji aktivitas inhibitor korosi ... 43
5. Uji permukaan baja ... 44
IV. HASIL DAN PEMBAHASAN 4.1 Sintesis Turunan Senyawa Organotimah(IV) 4-aminobenzoat ... 45
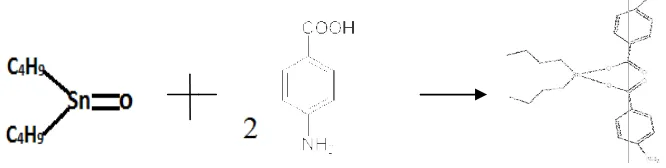
a. Sintesis senyawa difeniltimah(IV) di-4-aminobenzoat [(C6H5)2Sn(p-OCOC6H4NH2)2] ... 45
b. Sintesis senyawa dibutiltimah(IV) di-4-aminobenzoat [(C4H9)2Sn(p-OCOC6H4NH2)2] ... 48
4.2 Karakterisasi Senyawa Menggunakan Spektrofotometer IR ... 50
a. Karakterisasi senyawa asam 4-aminobenzoat (H2NC6H4CO2H) .... 50
b. Karakterisasi senyawa difeniltimah(IV) oksida [(C6H5)2SnO] dan senyawa difeniltimah(IV) di-4-aminobenzoat [(C6H5)2 Sn(p-OCOC6H4NH2)2] ... 52
4.3 Karakterisasi Senyawa menggunakan Spektrofotometri Ultra
Violet (UV) ... 57
a. Senyawa asam 4-aminobenzoat (C6H4NH2COOH) ... 57
b. Senyawa difeniltimah(IV) oksida [(C6H5)2SnO] dan senyawa difeniltimah(IV) di-4-aminobenzoat [(C6H5)2Sn(p-OCOC6H4NH2)2] ... 58
c. Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] dan senyawa dibutiltimah(IV) di-4-aminobenzoat [(C4H9)2Sn(p-OCOC6H4NH2)2] ... 60
4.4 Analisis Unsur menggunakan Microelemental Analyzer ... 61
4.5 Karakterisasi Senyawa mengguankan NMR (Nuclear Magnetic Resonance ... 62
a. 1H NMR ... 62
b. 13C NMR ... 64
4.6 Pembuatan Medium Korosif dan Larutan Inhibitor ... 66
4.7 Preparasi Baja Lunak ... 67
4.8 Uji Aktivitas Antikorosi ... 68
a. Pengujian aktivitas antikorosi senyawa asam 4-aminobenzoat ... 68
b. Pengujian aktivitas antikorosi difeniltimah(IV) oksida ... 71
c. Pengujian aktivitas antikorosi difeniltimah(IV) di-4-aminobenzoat ... 73
d. Pengujian aktivitas antikorosi dibutiltimah(IV) oksida ... 77
e. Pengujian aktivitas antikorosi dibutiltimah(IV) di-4-aminobenzoat ... 80
4.9 Analisis Kualitatif Permukaan Baja ... 84
4.10 Mekanisme Inhibisi Korosi ... 86
V. SIMPULAN DAN SARAN A. Simpulan ... 94
B. Saran ... 95
DAFTAR PUSTAKA
I. PENDAHULUAN
1.1Latar Belakang
Indonesia memiliki lahan tambang yang cukup luas di beberapa wilayahnya. Salah satu bahan tambang yang banyak fungsinya yaitu batu bara, misalnya untuk produksi besi dan baja. Besi dan baja paling banyak penggunaannya dalam industri, diantaranya yaitu dalam pembuatan alat penghilang kotoran pada permukaan logam, pisau bergerigi, dan tahanan suhu detektor. Baja merupakan produk utama industri besi-baja (Asdim, 2007). Salah satu jenis baja yaitu baja ringan, yang pada sebagian besar penggunaannya, cepat atau lambat mudah mengalami korosi.
dari segi lingkungan misalnya adanya proses pengkaratan besi yang berasal dari berbagai konstruksi yang dapat mencemarkan lingkungan (Asdim, 2007). Besar kecilnya kerugian yang ditimbulkan dari korosi tergantung seberapa jauh korosi telah berlangsung pada logam tersebut (Haidir dkk., 2007). Sifat tahan korosi suatu logam merupakan parameter yang harus dipertimbangkan dalam memilih logam yang dapat digunakan pada suatu konstruksi, peralatan industri maupun keperluan sehari-hari (Siregar, 2010). Korosi bahan biasanya terjadi dengan adanya oksigen dan kelembaban yang melibatkan dua reaksi elektrokimia, yaitu reaksi oksidasi yang terjadi pada anodik dan reaksi reduksi yang terjadi pada katodik (Al-Sultani, 2013).
Di Indonesia permasalahan korosi perlu mendapat perhatian serius, mengingat dua per tiga wilayah nusantara terdiri dari lautan dan terletak pada daerah tropis dengan curah hujan tinggi, kandungan senyawa klorida yang tinggi, dimana lingkungan seperti ini dikenal sangat korosif. Lingkungan yang menyebabkan korosi sangat dipengaruhi oleh adanya gas limbah (sulfur dioksida, sulfat, hidrogen sulfida, klorida), kandungan O2, pH larutan, temperatur, kelembaban,
kecepatan alir, dan aktivitas mikroba. Beberapa cara yang dapat memperlambat laju reaksi korosi antara lain dengan cara pelapisan permukaan logam agar
Inhibitor korosi merupakan senyawa kimia yang bisa memperlambat laju korosi. Inhibitor korosi bekerja dengan membentuk lapisan pasif berupa lapisan tipis atau film dipermukaan material yang berfungsi sebagai penghalang antara logam dengan media yang korosif (Febrianto, 2010). Inhibitor, ketika ditambahkan dalam porsi kecil ke dalam sistem dapat melindungi logam dari korosi. Inhibitor biasanya melindungi logam dengan menyerap ke dalam substrat melalui
pembentukan lapisan pasif (Al-Sultani, 2013). Sejauh ini, penggunaan inhibitor merupakan salah satu cara yang paling efektif untuk mencegah korosi, karena biayanya yang relatif murah dan prosesnya yang sederhana (Butarbutar dan Geni, 2011).
Salah satu jenis inhibitor adalah senyawa turunan organotimah(IV). Hampir semua senyawa organotimah memiliki atom pusat Sn, dengan hibridisasi sp3, dan maksimum memiliki 4 gugus yang berikatan secara kovalen. Efisiensi inhibisi korosi dapat ditingkatkan dengan adanya gugus aromatik dan gugus pendonor atau ligan seperti fenil, benzil, etoksi, amina dan lain-lain (Singh et al., 2010). Penelitian penggunaan kompleks organotimah sebagai inhibitor korosi telah dilakukan oleh Anggraini (2014) dan Afriyani (2014). Korosi yang terjadi yaitu korosi sumuran, yang merupakan akibat serangan terhadap logam di tempat-tempat yang lapisan pelindung permukaannya tergores atau pecah akibat perlakuan mekanik dan inhibitor korosinya adalah inhibitor katodik, yang
menurunkan laju korosi pada salah satu tahap proses katodik seperti pembebasan ion-ion hidrogen dan penangkapan oksigen (Afriyani, 2014).
Dalam penelitian Anggraini (2014) dan Afriyani (2014), senyawa organotimah yang digunakan sebagai inhibitor korosi masing-masing yaitu senyawa turunan organotimah(IV) 2-nitrobenzoat dan organotimah(IV) 3-nitrobenzoat. Hasil yang didapatkan dari penelitian yang dilakukan yaitu dilihat dari nilai efisiensi inhibisi antara senyawa difeniltimah dan trifeniltimah. Dalam Anggraini (2014), nilai efisiensi inhibisi yang dihasilkan dari senyawa difeniltimah(IV) di-2-nitrobenzoat yaitu 32,06 %, dan nilai efisiensi inhibisi dari senyawa trifeniltimah(IV)
maka akan dilakukan penelitian lebih lanjut mengenai inhibitor korosi menggunakan turunan senyawa organotimah yang lain.
1.2 Tujuan Penelitian
Adapun tujuan dilakukannya penelitian ini yaitu :
1. Mensintesis senyawa organotimah dari senyawa awal dibutiltimah(IV) oksida dan difeniltimah(IV) oksida dengan menggunakan ligan asam 4-aminobenzoat. 2. Menguji aktivitas antikorosi senyawa turunan organotimah(IV)
4-aminobenzoat yaitu dibutiltimah(IV) di-4-4-aminobenzoat dan difeniltimah(IV) di-4-aminobenzoat.
3. Membandingkan efektifitas antikorosi senyawa turunan organotimah(IV) 4-aminobenzoat yaitu antara dibutiltimah(IV) di-4-4-aminobenzoat dan
difeniltimah(IV) di-4-aminobenzoat.
1.3 Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Organologam
Senyawa organologam merupakan senyawa dimana minimal terdapat satu atom karbon dari gugus organik yang berikatan langsung dengan logam. Tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa
organologam. Sifat senyawa organologam yang umum ialah dimilikinya atom karbon yang lebih elektronegatif daripada kebanyakan logamnya. Terdapat beberapa kecenderungan jenis-jenis ikatan yang terbentuk pada senyawaan organologam:
a. Senyawaan ionik dari logam elektropositif
kestabilan ion karbon. Adapun contoh gugus organik dalam garam-garaman tersebut seperti (C6H5)3C-Na+ dan (C5H5)2Ca2+.
b. Senyawaan yang memiliki ikatan-σ (sigma)
Senyawaan organo dimana sisa organiknya terikat pada suatu atom logam dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di atas, dan sehubungan dengan beberapa faktor berikut:
1. Kemungkinan penggunaan orbital d yang lebih tinggi, seperti pada SiR4 yang
tidak tampak dalam CR4.
2. Kemampuan donor alkil atau aril dengan pasangan elektron menyendiri. 3. Keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh seperti
ada BR2 atau koordinasi tak jenuh seperti ZnR2.
4. Pengaruh perbedaan keelektronegatifan antara ikatan logam-karbon (M-C) atau karbon-karbon (C-C).
c. Senyawaan yang terikat secara nonklasik
Dalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan
elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom boron pada B(CH3)3. Atom B
untuk membentuk konfigurasi oktet dalam senyawaannya. Ada kecenderungan untuk memanfaatkan orbital-orbital kosong pada atom B dengan
menggabungkannya pada gugus suatu senyawa yang memiliki kelebihan pasangan elektron menyendiri. Senyawa ini terbagi menjadi dua golongan:
1. Senyawa organologam yang terbentuk antara logam-logam transisi dengan alkena, alkuna, benzena, dan senyawa organik tak jenuh lainnya.
2. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan (Cotton dan Wilkinson, 1989).
B. Organotimah
Senyawa organotimah(IV) dikarakterisasi oleh sedikitnya ada satu ikatan kovalen C-Sn. Senyawanya terdiri dari pusat yang tetravalent (Sn) dan diklasifikasikan sebagai mono-, di-, tri-, dan tetra organotimah(IV), tergantung jumlah gugus alkil (R) atau aril (Ar). Anion biasanya Cl-, F-, O2-, OH-, -COO- atau -S-. Aktivitas biologi yang penting ditentukan oleh jumlah dan sifat dasar dari gugus organik yang mengelilingi atom pusat (Sn) (Pellerito et al., 2006).
Hampir semua senyawa organotimah memiliki atom pusat Sn, dengan hibridisasi sp3, yang berikatan secara kovalen dengan 4 gugus maksimum. Timah adalah unsur yang mempunyai jumlah terbesar turunan organologam dalam
(contohnya, bis(tri-n-butiltimah) oksida, trifeniltimah hidroksida, di-n-butiltimah diklorida). Hanya senyawa mono-, di- and tri organotimah yang mempunyai aplikasi dalam skala besar dan tidak beresiko pada kesehatan manusia (Singh et al., 2010).
1. Senyawa organotimah halida
Senyawa organotimah halida dengan rumus umum RnSnX4-n (n = 1-3; X = Cl,
Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif.
Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
2 EtI + Sn Et2Sn + I2
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dengan timah(IV) klorida. Caranya dengan mengubah perbandingan material awal, seperti pada persamaan reaksi berikut:
SnR4 + 3 SnCl4 4 RSnCl3
SnR4 + SnCl4 2 R2SnCl2
3 SnR4 + SnCl4 4 R3SnCl
Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut:
R4SnCl4-n + (4-n) MX R4SnX4-n + (4-n) MCl
(X = F, Br atau I; M = K, Na, NH4) (Wilkinson, 1982).
2. Senyawa organotimah hidroksida dan oksida
Produk kompleks yang diperoleh melalui hidrolisis dari trialkiltimah halida dan senyawa yang berikatan R3SnX merupakan rute utama pada trialkiltimah oksida
dan trialkiltimah hidroksida. Prinsip tahapan intermediet ditunjukkan pada reaksi berikut ini:
OH
R3SnX R2Sn XR2SnOSnR2X XR2SnOSnR2OH R2SnO
X atau R3SnOH
(Wilkinson, 1982).
3. Senyawa organotimah karboksilat
RnSnCl4-n + (4-n) MO
dari asam karboksilat dengan organotimah oksid n melalui dehidrasi azeotropik dari reaktan dala pada reaksi berikut:
2 R’COOH R2Sn(OCOR’)2 + H
R’COOH R3SnOCOR’ + H2O
dilakukan sintesis senyawa dibutiltimah(IV) di-difeniltimah(IV) di-4-aminobenzoat seperti reak
ibutiltimah(IV) oksida denga asam 4-aminoben
sintesis senyawa dibutiltimah(IV) di-4-aminobe
ifenililtimah(IV) oksida denga asam 4-aminobe
C. Analisis Senyawa Organotimah
Pada penelitian yang dilakukan, hasil yang diperolah dianalisis dengan menggunakan spektroskopi IR, spektroskopi UV-Vis dan analisis unsur menggunakan microelemental analyzer.
1. Analisis spektroskopi IR senyawa organotimah
Spektra IR memberikan absorpsi yang bersifat aditif atau bisa juga sebaliknya. Sifat aditif disebabkan karena overtone dari vibrasi-vibrasinya. Penurunan absorpsi disebabkan karena kesimetrian molekul, sensitifitas alat, dan aturan seleksi. Aturan seleksi yang mempengaruhi intensitas serapan IR ialah perubahan momen dipol selama vibrasi yang dapat menyebabkan molekul menyerap radiasi IR. Dengan demikian, jenis ikatan yang berlainan (C-H, C-C, atau O-H) menyerap radiasi IR pada panjang gelombang yang berlainan. Suatu ikatan dalam molekul dapat mengalami berbagai jenis getaran, oleh sebab itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Puncak-puncak yang muncul pada daerah 4000-1450 cm-1 biasanya berhubungan dengan energi untuk vibrasi uluran diatomik. Daerahnya dikenal dengan group frequency region (Sudjadi, 1985).
Secara umum, spektrum serapan IR dapat dibagi menjadi tiga daerah:
a. Inframerah dekat, dengan bilangan gelombang antara 14.300 hingga 4.000 cm-1. Fenomena yang terjadi ialah absorpsi overtone C-H.
650 cm-1. Fenomena yang terjadi ialah vibrasi dan rotasi.
c. Inframerah jauh, dengan bilangan gelombang 650 hingga 200 cm-1.
Fenomena yang terjadi ialah penyerapan oleh ligan atau spesi lainnya yang berenergi rendah.
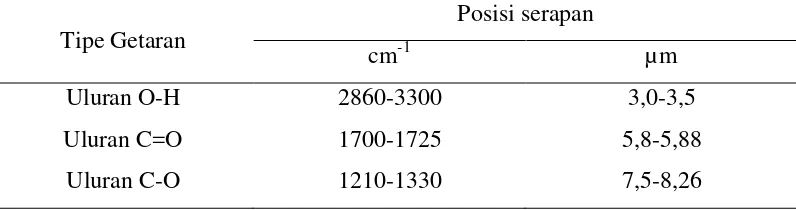
Dari daerah IR yang luas, yang biasa dikenal dan dipakai untuk spektrofotometri IR dengan batas bilangan gelombang (v) 4000-670 cm-1. Terdapat dua jenis informasi yang dapat dimanfaatkan dalam spektrum IR, yaitu informasi daerah gugus fungsi (4000-1600 cm-1). Dengan menggunakan analisis spektroskopi IR terhadap senyawa organotimah karboksilat, dapat ditunjukkan adanya serapan vibrasi ulur Sn-O pada bilangan gelombang 600-500 cm-1. Selain itu dapat pula ditunjukkan beberapa karakteristik absorpsi gelombang IR dari asam karboksilat seperti yang terdapat pada Tabel 1.
Tabel 1. Serapan karakteristik IR untuk asam-asam karboksilat
Tipe Getaran
Posisi serapan
cm-1 µm
Uluran O-H 2860-3300 3,0-3,5
Uluran C=O 1700-1725 5,8-5,88
Uluran C-O 1210-1330 7,5-8,26
(Fessenden dan Fessenden, 1986)
2. Analisis spektroskopi UV-Vis senyawa organotimah
gelombang cahaya UV dan tampak adalah nanometer (1 nm = 10-7 cm). Spektrum tampak terentang dari sekitar 400 nm (ungu) sampai 750 nm (merah), sedangkan spektrum ultraviolet terentang dari 100 sampai 400 nm. Absorpsi cahaya
ultraviolet atau cahaya tampak mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi (Fessenden dan Fessenden, 1986).
Di atas 200 nm merupakan daerah eksitasi elektron dari orbital p, d, dan orbital π terutama sistem π terkonjugasi mudah pengukurannya dan spektrumnya
memberikan banyak keterangan. Kegunaan spektrofotometer UV-Vis ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tak terkonjugasi, diena terkonjugasi dari triena dan sebagainya. Letak serapan dapat dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dari senyawa karbonil (Sudjadi, 1985).
dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
3. Analisis unsur menggunakan microelemental analyzer
Mikroanalisis merupakan penentuan kandungan unsur penyusun suatu senyawa yang dilakukan dengan menggunakan microelemental analyzer. Unsur yang umum ditentukan adalah Karbon (C), Hidrogen (H), Nitrogen (N), dan Sulfur (S), sehingga alat yang digunakan untuk tujuan mikroanalisis ini biasa dikenal sebagai CHNS microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda antara 1-5 %, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costech Analytical Technologies, 2011).
4. Analisis senyawa menggunakan spektrometer NMR (Nuclear Magnetic Resonance)
Spektrometri NMR atau dalam bahasa indonesia disebut spektrometri resonansi magnit inti (RMI) berhubungan dengan sifat magnit dari inti atom. Mempelajari molekul senyawa organik secara spektrometri resonansi magnit inti akan
memperoleh gambaran perbedaan sifat magnit dari berbagai inti yang ada dan untuk menduga letak inti tersebut dalam molekul. Semua inti bermuatan. Dalam beberapa inti, muatan ini berputar pada sumbu inti dan putaran muatan inti ini menghasilkan suatu dipol magnit sepanjang sumbu dengan momentum ini µ. Momentum sudut dari muatan yang berputar dapat dinyatakan dalam bilangan
intinya. Inti atom seperti 1H, 19F, 13C, dan 31P mempunyai bilangan spin I = dan
mempunyai distribusi muatan berbentuk bola yang seragam.
Proton yang terikat pada atom yang bersifat elektronegatif, seperti pada OH, SH, dan NH, pergeseran kimianya dipengaruhi oleh konsentrasi dan suhu. Pada beberapa sistem, dimana ada gugus OH, SH, atau NH dan kecepatan pertukaran proton diantara lingkungan yang berbeda ini dapat lebih lambat dibandingkan dengan waktu transisi diantara tingkat energi magnitik (Sudjadi, 1985).
D. Aplikasi senyawa organotimah
Perkembangan cepat dalam industri (katalis pada PVC dan produksi busa), pertanian (contoh, sebagai fungisida dan acarida, bahan pengawet kayu dan batu, dan lain-lain) dan aplikasi biologi dari senyawa organotimah(IV) selama beberapa dekade terakhir diakumulasikan dalam lingkungan dan hasilnya pada sistem biologi. Sehingga, diketahui bahwa senyawa organotimah(IV) menampilkan aktivitas biologi yang kuat (Pellerito et al., 2006).
Dalam beberapa penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai anti mikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroba (Bonire et al., 1998). Diketahui kompleks di- dan tri-organotimah halida dengan berbagai ligan yang mengandung nitrogen, oksigen, dan sulfur memiliki aktivitas biologi dan farmakologi, serta digunakan sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain et al., 2002).
E. Baja lunak
Baja lunak adalah logam yang paling serbaguna, murah dan secara luas digunakan pada bahan permesinan yang aplikasinya dapat ditemukan dalam berbagai
industri. Ini digunakan secara besar-besaran dalam aplikasi kelautan, tenaga nuklir, dan bahan bakar dari fosil tumbuhan, transportasi, proses kimia, produksi bensin dan penyulingan, pipa saluran, pertambangan, konstruksi maupun
Baja ringan digunakan dalam suatu lingkungan karena banyak tersedia sehingga mudah mendapatkannya, harganya murah dan memiliki sifat fisik yang sangat baik, namun penggunaan dan daya tahannya dibatasi karena kerentanan terhadap korosi (Durowaye et al., 2014).
F. Korosi
Korosi adalah degradasi atau penurunan mutu logam akibat reaksi kimia suatu logam dengan lingkungannya. Korosi menjadi masalah besar bagi peralatan yang menggunakan bahan dasar logam seperti mobil, jembatan, mesin, pipa, kapal dan lain sebagainya (Asdim, 2007).
Proses korosi merupakan fenomena elektrokimia pada penggunaan bahan logam di berbagai macam kondisi lingkungan. Fenomena ini tentu saja tidak
Korosi yang disebabkan oleh garam klorida, asam organik, dan gas CO2 pada
temperatur tinggi merupakan masalah utama pada pertambangan minyak bumi dan gas alam. Dalam sumur produksi minyak bumi, korosi pada permukaan bagian luar pipa dapat ditanggulangi dengan pelapisan atau proteksi katodik, tetapi pada permukaan bagian dalam pipa hanya dapat dikendalikan dengan cara menambahkan inhibitor korosi (Sunarya dkk., 2008).
Terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah suatu proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron tersebut (reaksi reduksi pada katodik). Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dimana jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima. Suatu logam yang dicelupkan pada suatu larutan elektrolit, maka akan terbentuk dua lokasi yang disebut anoda dan katoda. Pada anoda terjadi reaksi oksidasi dan pada katoda terjadi reaksi reduksi seperti dinyatakan dalam persamaan reaksi di bawah ini.
•••• Pada anoda, tempat terjadinya reaksi oksidasi dan biasanya terkorosi :
M → Mz+ + ze-
•••• Pada katoda, tempat terjadinya reaksi reduksi dan tidak mengalami korosi.
Dua reaksi penting yang umum terjadi pada katoda, tergantung pH larutan bersangkutan, adalah :
pH < 7 : 2H+ + 2e- → H2
pH ≥7 : O2 + 2H2O + 4e- → 4OH
G. Jenis-jenis korosi
Adapun beberapa jenis korosi yang umum terjadi pada logam sebagai berikut. 1. Korosi Galvanis
Korosi Galvanik terjadi karena perbedaan potensial antara dua logam yang tidak sama, bila kedua logam ini bersinggungan akan menghasilkan aliran elektron di antara kedua logam tersebut. Logam yang lebih mulia bersifat katodik dan akan diserang korosi lebih kecil, sedangkan logam yang kurang mulia bersifat anodik dan akan lebih mudah diserang korosi (Fontana, 1986).
2. Korosi Sumuran (Pitting Corrosion)
Korosi sumuran adalah bentuk penyerangan korosi setempat yang menghasilkan sumur pada logam ditempat tertentu (Fontana, 1986). Logam mula-mula
terserang korosi pada suatu titik pada permukaannya atau pada daerah tertentu yang sangat kecil dan diteruskan menuju ke dalam logam. Penyebab korosi sumuran yang paling umum adalah serangan selektif terhadap logam di tempat-tempat yang lapisan pelindung permukaannya tergores atau pecah akibat
3. Korosi Erosi (Errosion Corrosion)
Korosi erosi disebabkan oleh gabungan peristiwa korosi akibat aliran fluida sehingga proses korosi lebih cepat. Korosi ini dicirikan oleh adanya gelombang, lembah yang biasanya merupakan suatu pola tertentu (Fontana, 1986).
4. Korosi Regangan (Stress Corrosion)
Gaya-gaya seperti tarikan (tensile) atau kompresi (compressive) berpengaruh sangat kecil pada proses pengkaratan. Adanya kombinasi antara regangan tarik (tensile stress) dan lingkungan yang korosif, maka akan terjadi kegagalan material berupa retakan yang disebut retak karat regangan (Fontana, 1986).
5. Korosi Celah (Crevice Corrosion)
Korosi ini terjadi pada suatu logam di daerah yang berhubungan langsung dengan bahan lain yang bukan logam. Umumnya terjadi karena terdapat perbedaan konsentrasi larutan atau konsentrasi oksigen, sehingga menyebabkan adanya perbedaan potensial oksida pada logam tersebut (Fontana, 1986).
6. Korosi Kavitasi (Cavitation Corrosion)
Terjadi karena tingginya kecepatan cairan menciptakan daerah-daerah bertekanan tinggi dan rendah secara berulang-ulang pada permukaan peralatan cairan tersebut mengalir. Maka terjadi gelembung-gelembung uap air pada permukaan tersebut, yang apabila pecah kembali menjadi cairan akan menimbulkan pukulan pada permukaan yang cukup besar untuk memecahkan film oksida pelindung
Karena bagian tersebut menjadi anodik terhadap bagian yang terlindungi (Fontana, 1986).
7. Korosi Lelah (Fatigue Corrosion)
Bila logam mendapat beban siklus yang berulang-ulang, tetapi masih di bawah batas kekuatan luluhnya, maka setelah sekian lama akan patah karena terjadinya kelelahan logam. Kelelahan dapat dipercepat dengan adanya serangan korosi. Kombinasi antara kelelahan dan korosi yang mengakibatkan kegagalan disebut korosi lelah (Fontana, 1986).
8. Korosi batas butir
Korosi batas butir merupakan korosi yang terjadi pada batas butir logam. Dalam hal ini timbul keretakan pada logam akibat korosi melalui batas butir. Retak yang ditimbulkan korosi jenis ini disebut strees corrosion cracking (SCC) yang terdiri atas retak interglanular dan retak transgranular. Retak intergranular berjalan sepanjang batas butir, sedangkan retak transganular berjalan tanpa menyusuri batas butir tersebut (Fontana, 1986).
H. Faktor-faktor penyebab korosi
1. Atmosfer atau udara
Udara yang dimaksud disini adalah udara luar. Udara luar ini dapat dibedakan atas udara kering dan udara basah (lembab). Udara kering hanya mengandung sedikit sekali uap air, sedangkan udara lembab dapat mengandung lebih banyak uap air. Udara yang kering dan basah, proses korosi berjalan sangat lambat. Logam yang mudah terkena korosi sekalipun seperti baja atau besi akan tahan dalam udara seperti ini, sedangkan pada udara lembab korosi dapat terjadi dengan lebih cepat. Hal ini terjadi karena udara yang jenuh dengan uap air banyak mengandung garam-garam, asam, zat-zat kimia, dan gas-gas (Trethewey dan Chamberlin, 1991).
2. Air
3. Tanah
Korosi di dalam tanah selain terjadi pada pipa-pipa dan kabel-kabel juga terjadi pada pondasi-pondasi logam yang terendam di dalamnya. Tiang- tiang baja yang dikubur jauh di dalam tanah yang sudah lama tidak digali, lama sekali terkena korosi, karena kurangnya oksigen dalam tanah. Pada pemasangan pipa-pipa dalam tanah, tanah yang digali dan kemudian ditutup lagi memungkinkan adanya
oksigen terkurung di dalam tanah dapat menyebabkan korosi. Korosi elektrokimia dapat terjadi dalam tanah akibat adanya arus listrik yang disebabkan oleh
kebocoran arus listrik dari kabel-kabel jalan rel kereta api atau sumber-sumber lain. Untuk menanggulangi masalah seperti itu dibutuhkan teknik isolasi yang baik terhadap kabel yang dikubur dalam tanah. Tanah harus dianalisis terlebih dahulu sebelum logam-logam dimasukkan ke dalamnya, karena tanah dapat mengandung berbagai macam asam, zat-zat kimia dan mineral-mineral yang korosif. Setelah dianalisis, kita dapat menentukan usaha perlindungan yang tepat terhadap logam-logam tersebut dari serangan korosi di dalam tanah (Trethewey dan Chamberlin, 1991).
4. Zat-zat kimia
I. Metode Analisis Korosi
1. Polarisasi potensiodinamik
Polarisasi potensiodinamik adalah suatu metode untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik atau katodik. Jika logam berada kontak dengan larutan yang bersifat korosif, maka pada permukaan logam dapat terjadi reaksi reduksi dan reaksi oksidasi secara bersamaan, hal ini disebabkan pada permukaan logam terbentuk banyak mikrosel (mikroanoda dan mikrokatoda). Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan dari luar sistem. Hal ini disebabkan ada perbedaan potensial antara logam dan larutan sebagai lingkungannya. Beda potensial ini dinamakan sebagai potensial korosi, Ekorr
(Sunarya, 2008).
Jika ke dalam sistem sel elektrokimia diberikan arus searah dari luar (sumber DC) atau ditambahkan zat yang dapat mempengaruhi potensial sel, maka potensial logam akan lebih positif atau lebih negatif dibanding potensial korosinya, menghasilkan arus anodik atau katodik. Perubahan potensial dinamakan
Polarisasi adalah perubahan potensial elektroda setengah sel dari posisi
kesetimbangan dengan lingkungannya pada suatu proses elektrodik. Hubungan potensial lebih dan arus dapat digunakan untuk mengungkapkan laju korosi. Untuk menghitung persentase inhibisi pada metode ini digunakan Persamaan (1):
% % = ₋ 100%...(1)
dengan %EI adalah persentase efektivitas penghambatan, ! adalah arus sebelum ditambahkan inhibitor, " adalah arus sesudah ditambahkan inhibitor (Butarbutar dan Febrianto, 2009).
Dalam metode polarisasi potensiodinamik terdapat 3 elektroda, yaitu elektroda pembanding AgCl, elektroda bantu platina, dan elektroda kerja baja lunak. Ketiga elektroda tersebut dibilas dengan akuades. Setelah itu dirangkai pada suatu sel korosi yang disebut sebagai sel tiga elektroda dengan larutan medium korosif sebagai elektrolitnya. Lalu elektroda–elektroda tersebut dihubungkan dengan alat potensiostat dan komputer. Data yang didapat dari metode ini adalah kurva polarisasi anodik atau katodik yang menyatakan hubungan antara arus (µA/cm2) sebagai fungsi potensial (mV). Selanjutnya kurva tersebut diekstraposisi untuk dapat menentukan laju korosi (Butarbutar dan Febrianto, 2009). Laju korosi dapat ditentukan dengan persamaan :
#$ % = 0, 1288 Jcorr (E/D) ...(2)
dengan
E : berat ekivalen material
D : densitas (g/($3) (Rastogi et al., 2011).
Untuk proses kimia yang dikendalikan oleh transfer muatan (kinetika) berlaku persamaan Butler –Volmer yang dirumuskan pada persamaan berikut:
………..(4)
Potensial lebih pada persamaan tersebut adalah selisih antara potensial sembarang akibat gangguan terhadap sistem dan potensial korosi, atau η = E – Ekorr
(Butarbutar dan Febrianto, 2009).
2. Metode Tafel
Analisa Tafel digunakan untuk mendapatkan data-data tentang arus korosi (Ikor)
dan laju korosi (CorrRate) yaitu dengan mengolah data hasil mesin EDAQ untuk mendapatkan arus korosi yang selanjutnya dikonversi untuk mendapatkan nilai laju korosi (Butarbutar dan Geni, 2011).
3. Laju korosi
antara larutan dengan logam (arus korosi) selama beberapa saat. Transfer elektron tersebut merupakan parameter menentukan laju korosi logam (Sunarya, 2008). Laju korosi dapat dilakukan dengan metode polarisasi potensiodinamik. Data yang didapat dari metode ini adalah kurva polarisasi anodik atau katodik yang menyatakan hubungan arus antara arus ( µA. cm-2) sebagai fungsi potensial (mV). Selanjutnya kurva tersebut diektrapolasi untuk menentukan laju korosi dan arus melalui Persamaan 2 dan Persamaan 3 (Sunarya, 2008).
J. Inhibitor Korosi dan Jenisnya
Suatu inhibitor kimia adalah suatu zat kimia yang dapat menghambat atau memperlambat suatu reaksi kimia. Secara khusus, inhibitor korosi merupakan suatu zat kimia yang bila ditambahkan kedalam suatu lingkungan tertentu, dapat menurunkan laju penyerangan lingkungan itu terhadap suatu logam (Dalimunthe, 2004).
beberapa katagori yakni;
1. Inhibitor Korosi Katodik
Inhibitor katodik menurunkan laju korosi dengan cara memperlambat reaksi katodik. Inhibitor katodik membentuk senyawa tak larut yang mengendap pada katodik dengan membentuk lapisan penghalang. Senyawa yang biasa dipakai sebagai inhibitor katodik yaitu garam kalsium (kalsium karbonat dan kalsium fosfat), garam magnesium dan poli fosfat.
2. Inhibitor Korosi Anodik
Inhibitor anodik menurunkan laju korosi dengan cara memperlambat reaksi anodik. Berkurangnya daerah anodik yang efektif menyebabkan turunnya laju korosi. Senyawa di bawah ini biasa digunakan sebagai inhibitor anodik yaitu Kromat (CrO42-), Nitrit (NO22-), Molibdat (MoO42-), dan Ortofosfat (PO43-).
3. Inhibitor Korosi Organik
4. Inhibitor Korosi Adsorpsi
Inhibitor korosi adsorpsi menurunkan laju korosi disebabkan polarisasi logam dengan lapisan tipis dari molekul inhibitor yang teradsorpsi pada permukaan. Berkurangnya luas permukaan efektif bisa menurunkan laju korosi. Senyawa yang biasa dipakai sebagai inhibitor adsorpsi yaitu amin (R-NH2), karboksil
(R-COOH), thiourea (NH2CSNH2), fosfonat (R-PO3H2), benzonat (C6H5COO-), dan
antimoni triklorida (SbCl3) (Febrianto, 2010).
Mekanisme kerja inhibitor dapat dibedakan sebagai berikut :
a. Inhibitor teradsorpsi pada permukaan logam, dan membentuk suatu lapisan tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh mata biasa, namun dapat menghambat penyerangan lingkungan terhadap logamnya.
b. Melalui pengaruh lingkungan (misal pH) menyebabkan inhibitor dapat mengendap dan selanjutnya teradsopsi pada permukaan logam serta
melidunginya terhadap korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat teramati oleh mata.
c. Inhibitor lebih dulu mengkorosi logamnya, dan menghasilkan suatu zat kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut
membentuk suatu lapisan pasif pada permukaan logam.
K. Potensiostat
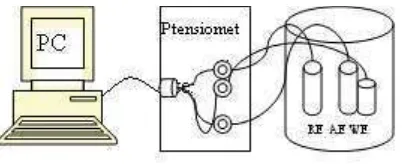
Potensiostat merupakan peralatan yang digunakan pada penelitian elektrokimia untuk mengamati fenomena yang terjadi selama proses korosi terjadi. Potensiostat akan mengaplikasikan tegangan listrik inputan kepada benda uji sehingga nilai arus selama proses korosi dapat diperoleh. Peralatan potensiostat biasanya dilengkapi dengan tiga jenis elektroda yaitu:
a. Elektroda kerja (working electrode): elektroda ini dibentuk dari logam benda uji yang akan diteliti, terkoneksi dengan sambungan listrik,dan permukaannya harus digerinda atau diamplas untuk menghilangkan oksida-oksidayang mungkin ada.
b. Elektroda bantu (auxiliary electrode): elektroda yang khusus digunakan untuk mengalirkan arus hasil proses korosi yang terjadi dalam rangkaian sel.
c. Elektroda acuan (reference electrode): Adalah suatu elektroda yang tegangan sirkuit terbukanya (open-circuit potential) konstan dan digunakan untuk mengukur potensial elektroda kerja. Rangkaian alat potensiostat dan tiga elektrodanya ditunjukkan pada Gambar 3.
Alat ini merupakan peralatan elektronik yang sangat penting dan berfungsi untuk : 1. Mengontrol potensial yang diberikan antara elektroda kerja (working electrode) dan elektrode pembanding (reference electrode). Potensial ini merupakan
potensial yang dipakai (Eapp).
2. Mengukur besarnya arus yang mengalir antara elektroda kerja dan elektroda pembantu (counter electrode) yang merupakan arus total (I Total ) (Chaidir, 2008).
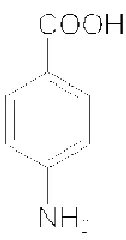
L. Asam 4-aminobenzoat
Asam 4-aminobenzoat (juga disebut sebagai para-asam aminobenzoat atau PABA karena karbon nomor 4 pada cincin benzen juga diketahui sebagai posisi para) adalah suatu senyawa organik dengan formula H2NC6H4CO2H. PABA adalah
kristal zat kimia putih-abu yang hanya sedikit larut dalam air. Senyawa ini terdiri dari cincin benzen yang disubstitusi dengan suatu gugus amino dan sebuah gugus karboksil. Struktur asam 4-aminobenzoat dapat dilihat dalam Gambar 4.
Sifat asam 4-aminobenzoat yaitu memiliki rumus kimia umum C7H7NO2,
memiliki massa molar 137.14 g.mol−1, berbentuk kristal putih keabu-abuan, memiliki densitas 1.374 g/mL, memiliki titik leleh dan titik didih masing-masing 187 hingga 189 °C (369 hingga 372 °F; 460 hingga 462 K) dan 340 °C (644 °F; 613 K), kelarutan dalam airnya adalah 1 g/170 mL pada suhu 25 °C dan 1 g/90 mL pada suhu 90 °C (Wikipedia, 2014).
M. Uji Aktivitas Antikorosi Senyawa Organotimah
Aplikasi senyawa turunan organotimah sebagai anti korosi telah dilakukan oleh Afriyani (2014) dan Anggraini (2014). Senyawa organotimah yang digunakan yaitu turunan senyawa organotimah(IV) 3-nitrobenzoat dan turunan senyawa organotimah(IV) 2-nitrobenzoat.
1. Senyawa Turunan Organotimah(IV) 3-Nitrobenzoat
• Pengujian Aktivitas Antikorosi Difeniltimah(IV) Di-3-nitrobenzoat
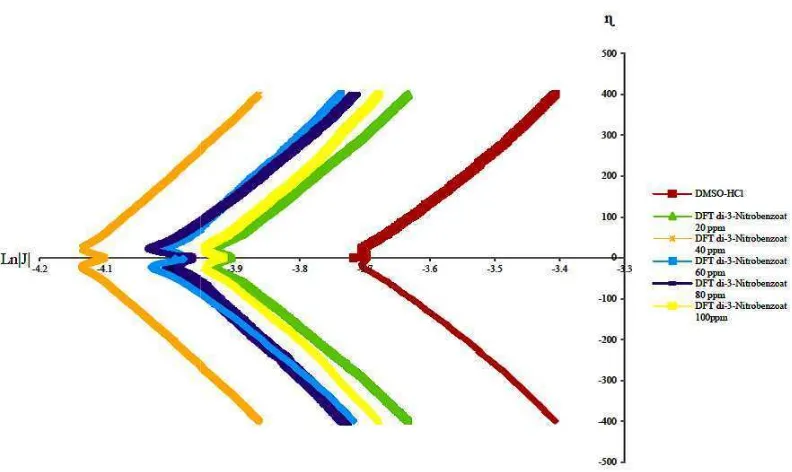
Senyawa difeniltimah(IV) di-3-nitrobenzoat yang digunakan adalah senyawa dengan variasi konsentrasi 20, 40, 60, 80 dan 100 mg/L yang diperoleh dari pengenceran larutan stok 400 mg/L. Hasil pemindaian menunjukan penambahan senyawa difeniltimah(IV) di-3-nitrobenzoat menyebabkan nilai Ln|Jcorr| yang
Gambar 5. Grafik ha terhadap k
Dari Gambar 5 dapat di-3-nitrobenzoat yang turunnya arus korosi y Besarnya persen prote yang ditambahkan dap
Tabel 2. Data pH laru difeniltimah(
hasil pemindaian senyawa difeniltimah(IV) di-p kontrol medium korosif tandi-pa inhibitor.
at dijelaskan bahwa peningkatan konsentrasi dif ang ditambahkan ke dalam sistem larutan meny si yang menyebabkan naiknya persen proteksi in
oteksi inhibisi dari masing-masing variasi konse dapat dilihat pada Tabel 2.
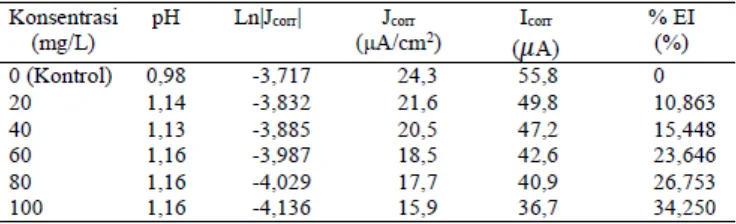
arutan dan efisiensi inhibisi penambahan senyaw ah(IV) di-3-nitrobenzoat dibandingkan kontrol D
Persen efisiensi inhibi
Dari Gambar 6 dapat nitrobenzoat dengan k menyebabkan turunny
ibisi dari senyawa difeniltimah(IV) di-3-nitrobe 531 % pada konsentrasi 20 mg/L hingga 32,155
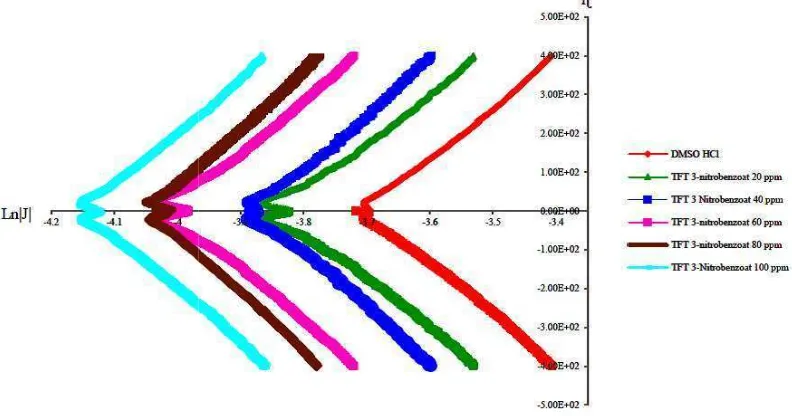
/L (Afriyani, 2014).
ktivitas Antikorosi Trifeniltimah(IV) 3-Nitrobe ah(IV) 3-nitrobenzoat yang digunakan adalah s 20, 40, 60, 80, 100 mg/L yang masing-masing d or 400 mg/L. Hasil pemindaian menunjukan pen h(IV) 3-nitrobenzoat pada sel elektrolisis menye corr| dari -3832 A/cm2 pada konsentrasi 20 mg
konsentrasi 100 mg/L seperti dapat dilihat pada
hasil pemindaian senyawa trifeniltimah(IV) 3-n kontrol medium korosif tanpa ihibitor.
at dijelaskan bahwa penambahan trifeniltimah(I n konsentrasi yang lebih tinggi ke dalam sel ele
nya arus yang menyebabkan naiknya persen pr
Besarnya persen efisiensi inhibisi dari masing-masing variasi konsentrasi senyawa yang ditambahkan dapat dilihat pada Tabel 3.
Tabel 3. Data pH larutan dan efisiensi inhibisi penambahan senyawa
trifeniltimah(IV) 3-nitrobenzoat dibandingkan kontrol DMSO-HCl
Dari data pada Tabel 3 dapat dijelaskan bahwa senyawa trifeniltimah(IV) 3-nitrobenzoat pada konsentrasi 100 mg/L memiliki tingkat penghambatan tertinggi terhadap korosi baja lunak tipe HRP dalam medium korosif DMSO-HCl dengan nilai efisiensi inhibisi 34,250 % dibandingkan dengan senyawa difeniltimah(IV) di-3-nitrobenzoat (Afriyani, 2014).
2. Senyawa Turunan Organotimah(IV) 2-Nitrobenzoat
Aktivitas korosi pada penambahan senyawa turunan organotimah(IV)
2-nitrobenzoat dapat ditunjukkan dari nilai efisiensi inhibisi yang diperoleh. Nilai efisiensi inhibisi masing-masing pada penambahan senyawa asam 2-nitrobenzoat, difeniltimah(IV) diklorida, trifeniltimah(IV) klorida, difeniltimah(IV)
yaitu -20,27; 20,56; 21,32; 32,06; dan 51,55 %, sehingga dapt diketahui bahwa pada penambahan senyawa asam 2-nitrobenzoat menunjukkan nilai efisiensi inhibisi yang paling rendah yaitu -20, 27 % dan nilai efisiensi inhibisi paling tinggi pada senyawa trifeniltimah(IV) 2-nitrobenzoat yaitu 51, 55 % (Anggraini, 2014).
3. Mekanisme Kerja Inhibitor
Pada penelitian antara kompleks trifeniltimah(IV) 2-nitrobenzoat dengan difeniltimah(IV) di-2-nitrobenzoat, nilai efisiensi inhibisi relatif lebih tinggi dihasilkan oleh kompleks trifeniltimah(IV) 2-nitrobenzoat yaitu sebesar 51,55 %. Hal ini dapat disebabkan pada kompleks trifeniltimah(IV) 2-nitrobenzoat
memiliki gugus fenil yang lebih banyak yaitu tiga gugus fenil dibandingkan pada kompleks difeniltimah(IV) di-2-nitrobenzoat yg memiliki dua gugus fenil
(Anggraini, 2014). Dengan adanya gugus-gugus fenil yang lebih banyak ini maka akan semakin banyak juga menarik elektron-elektron bebas yang mudah untuk melepaskan Cl- pada senyawa awalnya dan menyebabkan pada difeniltimah(IV) di-2-nitrobenzoat tidak membentuk kompleks yang lebih kuat dibandingkan dengan trifeniltimah(IV) 2-nitrobenzoat (Rastogi, 2005).
tolakan energi dibandingkan bentuk asimetri yanglebih sulit untuk menolak energi sehingga lebih stabil (Fessenden dan Fessenden, 1982).
Senyawa difeniltimah(IV) di-2-nitrobenzoat dan trifeniltimah(IV) 2-nitrobenzoat merupakan inhibitor katodik yang memperlambat atau menghambat reaksi katodik pada baja lunak maka logam Sn4+ yang bersifat elektropositif akan berinteraksi dengan oksigen (O2) pada reaksi reduksi pada katoda karena tidak mungkin Sn4+
III. METODOLOGI PENELITIAN
A. Waktu dan tempat penelitian
Penelitian ini dilakukan pada bulan Januari 2015 sampai dengan Mei 2015 di Laboratorium Kimia Anorganik/Fisik, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung untuk sintesis, preparasi sampel dan analisis senyawa menggunakan spektroskopi UV. Analisis senyawa
menggunakan spektroskopi IR dilakukan di Laboratorium Instrumentasi MIPA Terpadu, UII, Yogyakarta, analisis unsur dengan menggunakan microelemental analyzer dilakukan di School of Chemical and Food Technology, Universiti Kebanggaan Malaysia dan analisis senyawa menggunakan NMR (Nuclear Magnetic Resonance) dilakukan di School of Chemical Science, University in Malaysia. Dilakukan pengujian aktivitas inhibisi korosi pada baja lunak di
Laboratorium Analitik, Jurusan Kimia dan analisis permukaan baja menggunakan mikroskop Trinokuler dilakukan di Laboratorium Botani, Jurusan Biologi,
B. Alat dan Bahan
Adapun alat yang digunakan dalam penelitian ini yaitu peralatan gelas di laboratorium kimia, pengaduk magnet dengan pemanas, alat pengukuran potensiodinamik EA410 Integrated Potentiostat System EDAQ, mikroskop Trinokuler wolfe 994367, spektrofotometer IR Thermo Nicoleat Avatar, spektrofotometer UV-Vis Agilent Cary 100, spektrofotometer NMR Brucker Avance 400 MHz, microelemental analyzer, seperangkat alat refluks, termometer, stopwatch, neraca analitik, botol fial, dan spatula.
Sedangkan bahan yang digunakan dalam penelitian ini diantaranya yaitu zat-zat kimia dengan kualitas GR (Grade Reagent) atau PA (Pro Analysis) yang terdiri dari: HCl, aseton, DMSO ((CH3)2SO), metanol, difeniltimah(IV) oksida,
dibutiltimah(IV) oksida, asam 4-aminobenzoat, air KCKT, baja lunak HRP, aluminium foil serta kertas abrasif mulai dari grit 240, 360, 400, 600, dan 800.
C. Prosedur Penelitian
1. Sintesis senyawa organotimah(IV) 4-aminobenzoat
Prosedur untuk sintesis masing-masing senyawa turunan organotimah(IV) 4-aminobenzoat yaitu senyawa dibutiltimah(IV) di-4-4-aminobenzoat,
yang dilakukan oleh Szorcsik et al.(2002); Hadi et al. (2008); Hadi et al. (2009); dan Hadi and Rilyanti (2010).
Sintesis senyawa organotimah(IV) 4-aminobenzoat yaitu dengan menggunakan senyawa awal berupa dibutiltimah(IV) oksida dan difeniltimah(IV) oksida dengan menggunakan ligan asam 4-aminobenzoat.
a. Sintesis senyawa dibutiltimah(IV) di-4-aminobenzoat
Sintesis dilakukan dengan mencampurkan 0,8935 gram senyawa awal dibutiltimah(IV) oksida dan 0,8311 gram ligan asam 4-aminobenzoat serta 30 mL metanol. Kemudian campuran direfluks selama 4 jam dan mengatur stabilitas suhunya antara 58-60 oC. Setelah itu, membagi hasilnya ke dalam 3 buah botol fial. Kemudian memasukkan senyawa hasil sintesis dalam botol ke dalam desikator dan mendiamkannya selama 3-4 minggu. Selanjutnya padatan senyawa hasil sintesis dianalisis menggunakan spektroskopi IR, UV, NMR, dan Mikroanalisis Unsur.
b. Sintesis senyawa difeniltimah(IV) di-4-aminobenzoat
refluks dalam botol ke dalam desikator dan mendiamkannya selama 3-4 minggu. Selanjutnya menganalisis padatan senyawa hasil sintesis menggunakan spektroskopi IR, UV, NMR, dan Mikroanalisis Unsur.
2. Preparasi Baja Lunak
Preparasi baja lunak dilakukan dengan memotong plat baja dengan ukuran (2x1) cm dan mengamplas dengan variasi kertas abrasif mulai dari grit 240, 360, 400, 600, dan grit 800. Setelah permukaan baja lunak rata atau homogen selanjutnya mencuci baja dengan akuades, larutan HCl encer, dan aseton encer secara berturut-turut. Baja yang telah bersih selanjutnya dikeringkan dan diukur luas permukaannya sehingga dapat digunakan dalam pengukuran (Afriyani, 2014).
3. Pembuatan Medium Korosif
Medium korosif dibuat dengan komposisi larutan DMSO 0,02 M, dan HCl 0,2 M (Rastogi et al., 2005, Rastogi et al., 2011) dengan perbandingan 1:1.
4. Uji aktivitas inhibitor korosi
Alat potensiostat yang digunakan terdiri dari tiga elektroda, yaitu elektroda pembanding (AgCl), elektroda bantu platina (Pt), dan elektroda kerja baja lunak. Preparasinya dilakukan dengan membilas elektroda-elektroda tersebut dengan akuades, HCl, dan aseton sebelum digunakan kemudian merangkai dan mencelupkan ke dalam larutan medium korosif sebagai elektrolitnya dan dihubungkan dengan alat potensiostat.
Langkah pertama adalah melakukan pengukuran laju tanpa inhibitor dengan membiarkan ketiga elektroda tersebut selama 10 menit di dalam larutan elektrolit. Pengaturan potensial akan dilakukan dengan laju pemindaian 0,5 mV/s.
Selanjutnya mencatat perubahan arus pada elektrodanya kemudian data yang didapatkan dianalisis untuk menentukan grafik potensiodinamik (η terhadap Ln|J|) dan di peroleh data densitas arus korosi (Jcorr) dan potensial korosi (Ecorr).
Langkah selanjutnya adalah pengukuranan laju dengan penambahan inhibitor senyawa turunan organotimah(IV) 4-aminobenzoat yaitu senyawa
5. Uji permukaan baja
V. SIMPULAN DAN SARAN
A. SIMPULAN
Dari hasil penelitian yang telah didapatkan, maka dapat disimpulkan bahwa : 1. Senyawa difeniltimah(IV) di-4-aminobenzoat hasil sintesis berbentuk
padatan berwarna putih keruh dan senyawa dibutiltimah(IV) di-4-aminobenzoat berwarna kuning keputihan.
2. Rendemen hasil sintesis senyawa difeniltimah(IV) di-4-aminobenzoat sebesar 93,16% dan senyawa dibutiltimah(IV) di-4-aminobenzoat sebesar 87,47%.
3. Hasil analisis menggunakan microelemental analyzer menunjukkan selisih komposisi unsur C, N, dan H hasil analisis terhadap perhitungan teori sekitar 0-1 %, sehingga senyawa hasil sintesis dapat dikategorikan murni. 4. Senyawa difeniltimah(IV) di-4-aminobenzoat memiliki aktivitas inhibisi
korosi lebih tinggi yaitu sebesar 40,54 % dibandingkan senyawa
5. Dalam penelitian ini senyawa yang memiliki aktivitas inhibisi korosi tertinggi yaitu senyawa difeniltimah(IV) di-4-aminobenzoat pada konsentrasi 100 mg/L dengan efisiensi inhibisi sebesar 40,54%.
6. Dalam penelitian ini senyawa difeniltimah(IV) di-4-aminobenzoat pada konsentrasi 100 mg/L memiliki laju korosi terendah yaitu sebesar 8,1122 mpy.
B. Saran
Adapun saran dalam pelaksanaan penelitian ini yaitu:
DAFTAR PUSTAKA
Afriyani, H. 2014. Kajian Aktivitas Antikorosi Beberapa Senyawa Turunan Organotimah(IV) 3-Nitrobenzoat pada Baja Lunak dalam Medium Korosif DMSO-HCl [Skripsi]. Univeraitas Lampung. Lampung.
Al-sultani, K.F dan S.A. Abdulsada. 2013. Improvement Corrosion Resistance of Low Carbon Steel by Using Natural Corrosion Inhibitor. International Journal of Advanced Research. 1 (4): 239-243.
Anggraini, W.A. 2014. Kajian Senyawa Turunan Organotimah(IV)
2-Nitrobenzoat sebagai Inhibitor Korosi pada Baja Lunak dalam Medium Korosif [Skripsi].Universitas Lampung. Lampung. 95 halaman.
Aryani, S.D. 2013. Sintesis dan Karakterisasi serta Uji Pendahuluan Aktivitas Antikanker Beberapa Senyawa Organotimah(IV) 3-Nitrobenzoat terhadap Sel Leukemia L-1210 [Skripsi]. Universitas Lampung. Lampung.
Asdim. 2007. Penentuan Efisiensi Inhibisi Ekstrak Kulit Buah Manggis (Garcinia mangostana L) pada Reaksi Korosi Baja dalam Larutan Asam. Jurnal Gradien. 3 (2): 273-276.
Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil, and A.A. Omachi. 1998. Synthesis and Antifungal Activity of Some Organotin(IV) Carboxylates. Metal-Based Drugs. 5 (4): 233-236.
Butarbutar, S.L. dan Febrianto. 2009. Pengujian Mesin EDAQ untuk Mengukur Laju Korosi. Pusat Teknologi Reaktor dan Keselamatan Nuklir – BATAN. 13 (2): 54-58.
Chaidir, A. 2008. Penentuan Laju Korosi Paduan ZrNbSnFe dengan Metode Elektrokimia. Prosiding Seminar Pengelolaan Perangkat Nuklir. Halaman 46-51.
Costech Analytical Technologies. 2011. Elemental Combiustion System CHNS. http://costech analytical.com/. Diakses pada 30 Desember 2014.
Cotton, F.A. dan G. Wilkinson. 1989. Kimia Anorganik Dasar. Terjemahan oleh S. Suharto. UI Press. Jakarta.
Dalimunthe, I.S. 2004. Kimia dari Inhibitor Korosi. e-USU Repository. Universitas Sumatera Utara. Halaman 1-8.
Day, R.A. dan A.L. Underwood. 1998. Analisis Kimia Kuantitatif Edisi Keenam. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
Durowaye, S.I., V.O. Durowaye, and B.M. Begusa. 2014. Corrosion Inhibition of Mild Steel in Acidic Medium by Methyl Red (2, 4-Dimethylamino-2'-carboxylazobenzene). International Journal of Engineering and Technology. 4 (8): 469-475.
Febrianto, G.L. Sunaryo, dan S.L. Butarbutar. 2010. Analisis Laju Korosi dengan Penambahan Inhibitor Korosi pada Pipa Sekunder Reaktor RSG-GAS. STTN-BATAN & Fak. Saintek UIN SUKA. Halaman 615-620.
Fessenden, R.J., dan J.S. Fessenden. 1986. Kimia Organik. Erlangga. Jakarta.
Fontana, M.C. 1986. Corrosion Enginering Hand book. Mc Graw Hill Book Company. New York.
Hadi, S., B. Irawan and Efri. 2008. The antifungal activity test of some organotin(IV) carboxylates. J. Appl. Sci. Res. 4 (11): 1521-1525.
Hadi, S., M. Rilyanti, Nurhasanah. 2009. Comparative Study on the Antifungal
Activity of Some Di- and Tributyltin(IV) Carboxylate Compounds. Modern
Applied Science. 3 (2): 12-17.
Haidir, A., M.H.Al Hasa, dan Y.D.Agus. 2007. Aplikasi Metode Elektrokimia untuk Pengukuran Laju Korosi Paduan Alfeni *). Prosiding Seminar Pengelolaan Perangkat Nuklir PTBN-BATAN. Hal 31-36.
Iswantoro, B. 2015. Sintesis dan Karakterisasi Senyawa Difeniltimah(IV) Klorobenzoat sebagai Antikorosi pada Baja Lunak [Tesis]. Universitas Lampung. Bandar Lampung.
Jain, M.G., K. Agarwal, and R.V. Singh. 2003. Studies on Nematicidal, Fungicidal and Bacterial Activities of Organotin(IV) Complexes with Heterocyclic Sulphonamide Azomethine. Chemistry: An Indian Journal. 1: 378-391.
Kurniasih, H. 2015. Sintesis dan Karakterisasi Senyawa Dibutiltimah(IV) Klorobenzoat sebagai Antikorosi pada Baja Lunak [Tesis]. Universitas Lampung. Bandar Lampung.
Nik, W.W.B., F. Zulkifli, M.M. Rahman, and R. Roslia. 2011. Corrosion Behavior of Mild Steel in Seawater from Two Different Sites of Kuala Terengganu Coastal Area. International Journal of Basic & Applied Sciences IJBAS-IJENS. 11 (6): 75-80.
Nurissalam, M. 2015. Sintesis dan Karakterisasi Senyawa Trifeniltimah(IV) klorobenzoat sebagai Antikorosi pada Baja Lunak [Tesis]. Universitas Lampung. Lampung.
Pellerito, L. and L. Nagy. 2002. Organotin (IV)n+ Complexes Formed with Biologically Active Ligands: Equilibrium and Structural Studies and Some Biological Aspect. Coordination Chemistry Review. 224: 111–50.
Pellerito, C., L. Nagy, L. Pellerito, and A. Szorcsik. 2006. Biological activity studies on organotin(IV)n+ complexes and parent compounds. Journal of Organometallic Chemistry. 691: 1733–1747.
Rastogi, R.B., M.M. Singh, K. Singh, and M. Yadav. 2005. Organotin dithiohydrazodicarbonamides as corrosion inhibitors for mild steel dimethyl sulfoxide containing HCl. Port. Electrochim. Acta. 22, 315– 332.
Siregar, T. 2010. Laju Korosi dan Mekanisme Inhibisi Aluminium Murni menggunakan Kalium dan Kalsium Stearat. Jurnal Kimia. 4 (2): 113-124.
Sudjadi. 1985. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta.
Sukarjo. 1992. Kimia Koordinasi. P.T. Bina Aksara. Jakarta.
Sunarya, Y. 2008. Mekanisme dan Efisiensi Inhibisi Sistein Pada Korosi Baja Karbon Dalam Larutan Elektrolit Jenuh Gas Karbondioksida. Jurnal Matematika Dan Sains.13 (3): 90-96.
Sunarya, Y., C.L. Radiman, S. Achmad, and B. Bundjali. 2008. Pengaruh Temperatur terhadap Mekanisme Inhibisi oleh Sistein pada Korosi Baja Karbon dalam Larutan NaCl Jenuh CO2. ITB. Bandung. Halaman 90-96.
Supriyanto, R. 1999. Buku Ajar Kimia Analitik III. Universitas Lampung. Bandar Lampung.
Szorcsik, A., L. Nagy, L. Pellerito, T. Yamaguchi, and K. Yoshida. 2002. Preparation and Structural Studies of Organotin(IV) Complexes Formed with Organic Carboxylic Acids. Journal Radioanalytical and Nuclear Chemistry. 256(1): 3-10.
Trethewey, K.R. dan J. Chamberlin. 1991. Korosi untuk Mahasiswa Sains dan Rekayasawan. Terjemahan oleh Widodo. PT Gramedia Pustaka Utama. Jakarta.
Van Der Weij, F.W. 1981. Kinetics and Mechanism of Urethane Formation Catalysed by Organotin Compound. Journal Science Polymer Chemistry. 19 (2): 381-388.
Wikipedia. 2014. 4-Aminobenzoic_acid.
http://en.wikipedia.org/wiki/4-Aminobenzoic_acid. Diakses pada 17 Desember 2014 pukul 19.30 WIB.