SINTESIS DAN KARAKTERISASI SERTA UJI AKTIVITAS ANTIKOROSI SENYAWA TURUNAN ORGANOTIMAH(IV)
3-AMINOBENZOAT PADA BAJA LUNAK DALAM MEDIUM KOROSIF
(Skripsi)
Oleh Asti Nurul Aini
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
SYNTHESIS, CHARACTERIZATION, AND ANTICORROSION ACTIVITY TEST OF SOME ORGANOTIN(IV) 3-AMINOBENZOATE
COMPOUNDS ON MILD STEEL IN THE CORROSIVE MEDIUM
By
Asti Nurul Aini
In this research, the syntheses of diphenyltin(IV) di-3-aminobenzoate as a yellowish-white solid with percentage yield 95.2 %, and triphenyltin(IV) 3-aminobenzoate as reddish-brown solid with percentage yield of 80.85 % were performed. The compounds were mainly characterized by UV, IR, 1H, 13C NMR spectroscopies and based on the microanalytical data that lead to the structure of diphenyltin(IV) di-3-aminobenzoate and triphenyltin(IV) 3-aminobenzoate. The anti-corrosion test with potentiodynamic method indicated that the triphenyltin(IV) 3-aminobenzoate compound has shown to inhibit corrosion better than that of diphenyltin analogues, with percentage inhibition of 50.34 % and 42.88 %, respectively, and with corrosion rate of 6.71 and 7.72 mpy respectively, in the concentration of 100 mg/L. The organotin(IV) aminobenzoates tend to behave predominantly as cathodic inhibitor. The qualitative analysis of mild steel surface using microscope showed that in the presence of diphenyl- and triphenyltin(IV) 3-aminobenzoate was able to inhibit the corrosion rate on steel surface.
ABSTRAK
SINTESIS DAN KARAKTERISASI SERTA UJI AKTIVITAS ANTIKOROSI SENYAWA TURUNAN ORGANOTIMAH(IV)
3-AMINOBENZOAT PADA BAJA LUNAK DALAM MEDIUM KOROSIF
Oleh
Asti Nurul Aini
Pada penelitian ini telah dilakukan sintesis senyawa difeniltimah(IV) di-3-aminobenzoat yaitu berupa padatan berwarna putih kekuningan dengan rendemen 95,2 % dan trifeniltimah(IV) 3-aminobenzoat berupa padatan berwarna cokelat kemerahan dengan rendemen 80,85 %. Senyawa-senyawa hasil sintesis telah dikarakterisasi dengan spektroskopi UV, IR, 1H, 13C NMR dan berdasarkan data mikroanalisis yang mengarah pada struktur senyawa difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-di-3-aminobenzoat. Pengujian antikorosi dengan metode potensiodinamik menunjukkan bahwa senyawa trifeniltimah(IV) 3-aminobenzoat memiliki kemampuan menghambat korosi baja lebih tinggi dibandingkan dengan difeniltimah(IV) di-3-aminobenzoat pada konsentrasi yang sama yaitu sebesar 50,34 % dan 42,88 % dengan laju korosi sebesar 6,71 dan 7,72 mpy pada penambahan masing-masing 100 mg/L. Senyawa organotimah(IV) 3-aminobenzoat cenderung mengikuti pola inhibitor katodik. Analisis kualitatif permukaan baja menggunakan mikroskop menunjukkan bahwa senyawa difenil- dan trifeniltimah(IV) 3-aminobenzoat mampu menghambat laju korosi pada permukaan baja.
SINTESIS DAN KARAKTERISASI SERTA UJI AKTIVITAS ANTIKOROSI SENYAWA TURUNAN ORGANOTIMAH(IV)
3-AMINOBENZOAT PADA BAJA LUNAK DALAM MEDIUM KOROSIF
Oleh
Asti Nurul Aini
(Skripsi)
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Natar, lampung Selatan, pada tanggal 29 September 1993. Penulis merupakan puteri ke tujuh dari sembilan puteri dan seorang putera anak dari pasangan
Bapak Pudjiono (Alm) dan Ibu Uni’am. Pada Tahun 1999, penulis menyelesaikan pendidikan taman kanak-kanak di RA (Rhaudatul Athfal) Al-Fatah, pendidikan sekolah dasar pada tahun 2005. Penulis melanjutkan pendidikan tingkat menengah di MTS Al-Fatah hingga tahun 2008. Kemudian, menyelesaikan pendidikan SMA (Sekolah Menengah Atas) di MA Al-Fatah Lampung pada tahun 2011. Pada tahun yang sama, penulis diterima sebagai mahasiswi kimia S1 Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
MOTTO
Tbe best Plan, do your best, and get the best.
(Asti Nurul Aini)
Jika kamu hendak bahagia di dunia maka carilah ilmu,
jika kamu hendak bahagia di akhirat maka carilah
ilmu, dan jika kamu hendak bahagia dunia dan akhirat
maka carilah ilmu.
(H.R. Bukhari)
Hargai setiap proses, lihat masa depan sebagai tujuan
dan lihat masa lalu sebagai pelajaran
(Asti Nurul Aini)
Wahai kaumku! Sesugguhnya kehidupan dunia ini
hanya kesenangan (sementara) dan sesungguhnya
akhirat lah negeri yang kekal.
(Al-
Mu’min: 39)
Atas rahmat Allah SWT, kupersembahkan karya
sederhana ini teruntuk...
Kedua orang tuaku, Bapak Pudjiono(Alm) dan Ibu
Uni’am, atas semua do’a, cinta, dan kasih sayang
Segenap keluarga besar yang selalu mendo’akan
keberhasilanku
Prof. Sutopo Hadi, M.Sc., Ph.D dan Bapak Ibu Dosen
Jurusan Kimia FMIPA Unila, atas semua ilmu yang
diberikan
Seluruh sahabat yang senantiasa memberikan
semangat dan bantuan untukku
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillahirobbil ‘Alamin, puji syukur kehadirat Allah SWT atas rahmat dan
nikmat yang tak terhingga, yang telah memudahkan penulis dalam menyelesaikan skripsi ini. Shalawat serta salam kepada Nabi Muhammad SAW sebagai suri tauladan yang baik dan pemberi syafaat di hari akhir kelak.
Skripsi dengan Judul “Sintesis dan karakterisasi serta Uji Aktivitas Antikorosi
Senyawa Turunan Organotimah(IV) 3-aminobenzoat pada Baja Lunak
dalam Medium Korosif” adalah salah sat syarat untuk memperoleh gelar sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung. Penulis menyadari dalam penyelesaian skripsi ini tak lepas dari bantuan serta dukungan dari berbagai pihak. Akhirnya, dengan kerendahan dan ketulusan hati, jazakumullah khairan jaza’, penulis mengucapkan terima kasih kepada:
dan saran sehingga penulisan skripsi dapat terselesikan dengan baik
3. Bapak Dr. Rudy T. M. Situmeang M.Sc. selaku pembahas atas kritik, saran, dan arahan sehingga skripsi dapat terselesaikan, serta selaku pembimbing akademik atas kesediaannya memberikan bimbingan, bantuan, nasihat, dan motivasi kepada penulis.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku ketua Jurusan Kimia FMIPA Unila.
5. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Unila yang telah mendidik dan memberikan ilmu pengetahuan yang bermanfaat kepada penulis.
6. Bapak Prof. Suharso, Ph.D. selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Kedua orang tuaku yang aku hormati dan sayangi. Bapakku tersayang Pudjiono (Alm) yang selalu aku rindukan. Mamaku tercinta Uni’am yang
selalu memberikan kasih sayang, perhatian, dukungan, nasihat, serta atas
semua do’a tulusmu akan keberhasilan anak-anakmu. Semoga Allah membalas dengan Jannah-Nya. Amiin.
8. Mbak Nur Hayati, Mas Jamal, Mas Zae, Kak Eka, Mbak Tri Rahayu, Mas Roni, Mbak Iin, A’a Adi, Mbak Evi, Mas Ari, Mba Mimin, Mbak Umi, kedua adikku Nawa Nurul Fauziah dan Osa Farida Sari, serta keluarga besar atas
semua do’a, dukungan, dan motivasi yang diberikan kepada penulis.
10.Teman-teman seperjuangan penelitian di Laboratorium Kimia Anorganik-Fisik Jurusan Kimia FMIPA Unila: Rio Wicaksono, Yunia, Rina, Dia Tamara, Fatma, Yudha, Eva, Irkham, Mely Antika, Nico, Mbak Lolita, Mbak Surtini, atas semangat, motivasi, saran, bantuan, dan canda tawa yang tercipta selama ini.
11.Teman-teman seperjuangan angkatan 2011: Umi, Lusi, Gegek, Vevi, Yusri, Windi, Jeje, Miftah, Wagiran, Arik, Tata, Ramos, Ivan, Ajeng, Ay-ay, Aziz, April, Uswah, Ana, Daniar, Ayu Fit, Mila, Fani, Anggino, Mardian, Megga, Lewi, Nira, Cindy, Ari, Juli, Ridho, Andri, Rio Febriansyah, Mirfat, Juned, atas dukungan, semangat, keceriaan, dan kebersamaan selama ini. Sukses untuk kita semua.
12.Rekan-rekan Pimpinan UKMF Natural FMIPA Unila 2013-2014 Umi Fadilah, Sepria Herdiansyah, Andri Nosya, Sigit Sopandi, Estu, Iril, Novi, Ona, Puja, Irsan, Rani, Arik Irawan, Rizki, Fajrin Nuraida, Imas, Tiyas, Tri, dan seluruh
keluarga besar UKMF Natural, atas do’a dan dukungan yang diberikan kepada
penulis.
13.Mbak Liza, Mbak Nora, Pak Gani, Mas Nomo, Mba Iin, dan Mas Udin, terimakasih atas seluruh bantuan yang diberikan kepada penulis.
14.Seluruh keluarga besar Jurusan Kimia Angkatan 2009 – 2014. 15.Almamater tercinta, Universitas Lampung.
masa datang. Semoga bermanfaat.
Bandar Lampung, Agustus 2015
DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR GAMBAR ... iv
DAFTAR TABEL ... vii
DAFTAR LAMPIRAN ... ix
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA A. Senyawa Organologam ... 6
B. Asam 3-aminobenzoat ... 8
C. Timah(Sn) ... 9
D. Senyawa Organotimah ... 9
1. Senyawa organotimah halida ... 11
2. Senyawa organotimah hidroksida dan oksida ... 11
3. Senyawa organotimah karboksilat ... 12
E. Aplikasi Senyawa Organotimah ... 13
F. Analisis Senyawa Organotimah ... 15
1. Analisis spektroskopi UV-Vis senyawa organotimah ... 16
2. Analisis spektroskopi IR senyawa organotimah ... 17
3. Analisis spektroskopi NMR senyawa organtimah ... 19
4. Analisis unsur dengan menggunakan microelemental analyzer ... 21
G. Baja Lunak ... 21
H. Korosi ... 22
I. Proses Korosi ... 23
1. Proses korosi kering ... 23
2. Proses korosi basah ... 24
J. Faktor-faktor Penyebab Korosi ... 25
1. Atmosfer atau udara ... 25
2. Air ... 26
4. Zat-zat kimia ... 27
K. Bentuk-bentuk Korosi ... 27
1. Korosi merata (uniform corrosion) ... 27
2. Korosi galvanik (galvanic Corrosion) ... 28
3. Korosi celah (crevice corrosion) ... 28
4. Korosi sumuran (pitting corrosion) ... 28
5. Korosi batas butir (interglanular corrosion) ... 29
6. Korosi kavitasi ... 29
7. Korosi erosi (erosion corrosion) ... 30
8. Korosi regangan (stress corrosion) ... 30
L. Inhibitor Korosi ... 30
M. Metode Analisis Korosi ... 35
N. Integrated Potentiostat System ... 37
III. METODOLOGI PENELITIAN A. Waktu dan Tempat Penelitian ... 39
B. Alat dan Bahan ... 39
C. Cara Kerja ... 40
1. Sintesis difeniltimah(IV) 3-aminobenzoat ... 40
2. Sintesis trifeniltimah(IV) 3-aminobenzoat ... 41
3. Preparasi baja lunak ... 41
4. Pembuatan medium korosif... 42
5. Pembuatan larutan inhibitor ... 42
6. Pengujian korosi ... 43
7. Analisis data ... 44
8. Analisis kualitatif permukaan baja ... 45
IV. HASIL DAN PEMBAHASAN A. Sintesis ... 46
1. Sintesis senyawa difeniltimah(IV) di-3-aminobenzoat ... 46
2. Sintesis senyawa trifeniltimah(IV) 3-aminobenzoat ... 47
B. Karakterisasi Menggunakan Spektroskopi UV ... 48
1. Senyawa asam 3-aminobenzoat ... 48
2. Senyawa difeniltimah(IV) oksida dan difeniltimah(IV) di-3-aminobenzoat ... 49
3. Senyawa trifeniltimah(IV) hidroksida dan trifeniltimah(IV) 3-aminobenzoat ... 51
C. Karakterisasi Menggunakan Spektroskopi IR ... 52
1. Senyawa asam 3-aminobenzoat ... 53
2. Senyawa difeniltimah(IV) oksida dan difeniltimah(IV) di-3-aminobenzoat ... 53
3. Senyawa trifeniltimah(IV) hidroksida dan trifeniltimah(IV) 3-aminobenzoat ... 55
D. Karakterisasi Menggunakan Spektroskopi NMR ... 57
1. Senyawa difeniltimah(IV) di-3-aminobenzoat ... 57
2. Senyawa trifeniltimah(IV) 3-aminobenzoat ... 59
E. Analisis Unsur Menggunakan Microelemental Analyzer ... 60
1. Preparasi baja lunak ... 61 2. Pengujian aktivitas antikorosi asam 3-aminobenzoat ... 62 3. Pengujian aktivitas antikorosi difeniltimah(IV) oksida dan
difeniltimah(IV) di-3-aminobenzoat ... 65 4. Pengujian aktivitas antikorosi senyawa trifeniltimah(IV)
hidroksida dan trifeniltimah(IV) 3-aminobenzoat ... 69 5. Penentuan laju korosi baja ... 74 6. Analisis kualitatif permukaan baja ... 77 7. Mekanisme inhibisi korosi senyawa organotimah(IV)
3-aminobenzoat ... 78
V. SIMPULAN DAN SARAN
A. Simpulan ... 86 B. Saran ... 87
DAFTAR GAMBAR
Gambar Halaman
1. Struktur asam 3-aminobenzoat ... 8
2. Reaksi sintesis senyawa difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-aminobenzoat ... 13
3. Skema transisi elektronik dari tingkat energi rendah ke tingkat energi yang lebih tinggi ... 17
4. Proses korosi kering dengan dua elektroda ... 24
5. Proses korosi basah dengan dua elektroda ... 25
6. Sketsa instrumentasi eDAQ dan benda uji ... 37
7. Pengaturan pemindaian anoda dan katoda ... 43
8. Senyawa difeniltimah(IV) di-3-aminobenzoat ... 46
9. Senyawa trifeniltimah(IV) 3-aminobenzoat ... 47
10.Spektrum UV asam 3-aminobenzoat ... 49
11.Spektrum UV difeniltimah(IV) oksida dan difeniltimah(IV) di-3-aminobenzoat... 50
12.Spektrum UV trifeniltimah(IV) hidroksida dan trifeniltimah(IV) 3-aminobenzoat ... 51
13. Spektrum IR asam 3-aminobenzoat ... 52
14.Spektrum IR difeniltimah(IV) oksida dan difeniltimah(IV) di-3-aminobenzoat... 54
16.Spektrum 1H dan 13C NMR senyawa difeniltimah(IV)
di-3-aminobenzoat... 58 17.Spektrum 1H dan 13C NMR senyawa trifeniltimah(IV)
3-aminobenzoat ... 60 18.Potongan baja sebelum dan setelah diamplas ... 61 19.Grafik pemindaian senyawa asam 3-aminobenzoat terhadap kontrol
medium korosif tanpa inhibitor ... 63 20.Grafik hasil pemindaian senyawa difeniltimah(IV) oksida terhadap
kontrol medium korosif tanpa inhibitor ... 65 21.Grafik hasil pemindaian senyawa difeniltimah(IV) di-3-aminobenzoat terhadap kontrol medium korosif tanpa inhibitor... 67 22.Grafik presentase efisiensi inhibisi senyawa difeniltimah(IV)
di-3-aminobenzoat dibandingkan dengan senyawa awal difeniltimah(IV) oksida dan ligan asam 3-aminobenzoat... 68 23.Grafik hasil pemindaian senyawa trifeniltimah(IV) hidroksida
terhadap kontrol tanpa inhibitor ... 70 24.Grafik hasil pemindaian senyawa trifeniltimah(IV) 3-aminobenzoat
terhadap kontrol tanpa inhibitor ... 72 25.Grafik presentase efisiensi inhibisi senyawa trifeniltimah(IV)
di-3-aminobenzoat dibandingkan dengan senyawa awal trifeniltimah(IV) hidroksida dan ligan asam 3-aminobenzoat ... 73 26.Grafik perbandingan nilai laju korosi baja pada penambahan
difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV)
3-aminobenzoat ... 76 27.Hasil analisis mikroskop permukaan baja pada medium korosif
tanpa inhibitor, penambahan senyawa difeniltimah(IV) di-3-aminobenzoat, dan penambahan trifeniltimah(IV)
3-aminobenzoat ... 77 28.Perbandingan presentase efesiensi inhibisi difeniltimah(IV)
di-3-aminobenzoat dan trifeniltimah(IV) 3-di-3-aminobenzoat ... 78 29.Struktur difeniltimah(IV) di-aminobenzoat dan trifeniltimah(IV)
3-aminobenzoat ... 79 30.Kurva polarisasi anoda difeniltimah(IV) di-3-aminobenzoat dan
31.Kurva polarisasi katoda difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-aminobenzoat ... 82 32.Skema proses korosi baja karbon dalam larutan asam ... 84 33.Deskripsi penentuan luas permukaan baja terukur pada
DAFTAR TABEL
Tabel Halaman
1. Serapan karakteristik IR untuk asam-asam karboksilat ... 19 2. Letak pergeseran kimia dalam spektra 1H NMR ... 20 3. Letak pergeseran kimia dalam spektra 13C NMR ... 20 4. Data spektrum UV untuk senyawa asam 3-aminobenzoat dan
organotimah(IV) 3-aminobenzoat ... 52 5. Bilangan gelombang untuk gugus fungsi yang terdapat dalam
senyawa difeniltimah(IV) oksida dan difeniltimah(IV)
di-3-aminobenzoat... 55 6. Bilangan gelombang untuk gugus fungsi yang terdapat dalam
senyawa trifeniltimah(IV) hidroksida dan trifeniltimah(IV)
3-aminobenzoat ... 57 7. Spektra 1H dan 13C NMR senyawa hasil sintesis ... 59 8. Hasil mikroanalisis unsur senyawa hasil sintesis ... 61 9. Data efesiensi inhibisi senyawa asam 3-aminobenzoat dibandingkan
kontrol DMSO-HCl ... 64 10.Data efesiensi inhibisi senyawa difeniltimah(IV) oksida
dibandingkan kontrol DMSO-HCl ... 66 11.Data efesiensi inhibisi senyawa difeniltimah(IV) di-3-aminobenzoat
dibandingkan kontrol DMSO-HCl ... 67 12.Data efisiensi inhibisi senyawa trifeniltimah(IV) hidroksida
dibandingkan kontrol DMSO-HCl ... 70 13.Data efisiensi inhibisi senyawa trifeniltimah(IV) 3-aminobenzoat
14.Data laju korosi baja dengan penambahan senyawa organotimah(IV) 3-aminobenzoat dibandingkan dengan
medium korosif tanpa inhibitor ... 75 15.Data kerapatan arus korosi dan arus korosi untuk seluruh
pemindaian ... 98
DAFTAR LAMPIRAN
Lampiran Halaman
1. Skema lengkap tahap penelitian ... 92 2. Perhitungan persentasi berat senyawa hasil sintesis ... 93 3. Perhitungan data mikroanalisis unsur ... 95 4. Perhitungan efisiensi inhibisi ... 97 5. Perhitungan laju korosi baja ... 103
I. PENDAHULUAN
A. Latar Belakang
Korosi merupakan suatu peristiwa kerusakan atau penurunan kualitas suatu bahan logam yang disebabkan oleh reaksi logam dengan lingkungan yang terjadi secara elektrokimia (Fontana, 1986). Korosi merupakan masalah besar bagi peralatan yang menggunakan material dasar logam seperti mobil, jembatan, mesin, pipa, kapal dan lain sebagainya (Trethew and Chamberlein, 1991). Di Indonesia, permasalahan korosi perlu mendapat perhatian serius sebab dua per tiga
wilayahnya terdiri dari lautan dan terletak pada daerah tropis dengan curah hujan dan kandungan senyawa klorida yang tinggi, lingkungan seperti ini dikenal sangat korosif (Priest, 1992).
Berbagai cara telah dilakukan untuk mengurangi laju korosi diantaranya dengan cara pelapisan permukaan logam, membuat paduan logam yang cocok sehingga tahan korosi, dan dengan penambahan zat tertentu yang berfungsi sebagai inhibitor korosi (Haryono dkk, 2010). Inhibitor korosi adalah suatu senyawa organik atau anorganik yang apabila ditambahkan dalam jumlah relatif sedikit ke dalam sistem logam-media elektrolit akan menurunkan laju korosi logam
korosi dan memiliki kemampuan untuk meningkatkan ketahanan baja terhadap korosi adalah senyawa organotimah(IV) karboksilat.
Senyawa organotimah merupakan senyawa yang mengandung sedikitnya satu ikatan kovalen C-Sn. Sebagian besar senyawa organotimah dapat dianggap sebagai turunan dari RnSnX4-n (n = 1-4) dan diklasifikasikan sebagai mono-, di-, tri-, dan tetra- organotimah(IV) tergantung pada jumlah gugus alkil (R) atau aril (Ar) yang terikat. Gugus (R) pada senyawa organotimah biasanya metil, butil, oktil atau fenil, sedangkan anion (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002).
Di antara senyawa kompleks organotimah, turunan senyawa organotimah(IV) karboksilat memiliki sifat biologi yang lebih kuat dibandingkan kompleks lainnya diantaranya sebagai antibakteri (Bonire et al., 1998; Mahmood et al., 2003), antitumor (De Vos et al., 1998), antifungi (Ruzika et al., 2002; Mahmood et al., 2003; Hadi et al., 2007; Hadi et al., 2008), dan antikanker (De Vos et al., 1998; Gielen, 2003; Hadi dan Rilyanti, 2010; Hadi et al., 2012). Selain itu, beberapa senyawa turunan organotimah baik golongan karboksilat, fosfat, ligan donor –N maupun –S juga diketahui memiliki aktivitas yang baik sebagai inhibitor korosi
lebih tinggi dibandingkan kompleks dibutiltimah dengan ligan dan konsentrasi yang sama. Efisiensi inhibisi meningkat seiring meningkatnya konsentrasi inhibitor yang digunakan.
Pada penelitian sebelumnya, Afriyani (2014) menggunakan asam 3-nitrobenzoat sebagai ligan asam karboksilat diperoleh efisiensi inhibisi tertinggi sebesar 34,25 %, dan Anggraini (2014), menggunakan asam 2-nitrobenzoat sebagai ligan asam karboksilat diperoleh efisiensi inhibisi tertinggi sebesar 51,55 %. Kedua penelitian tersebut menunjukkan bahwa senyawa yang memiliki efektifitas inhibisi tertinggi yaitu senyawa kompleks trifeniltimah(IV) pada konsentrasi tertinggi 100 mg/L. Berdasarkan hasil penelitian tersebut, maka akan dilakukan pula uji aktivitas antikorosi senyawa turunan organotimah(IV) karboksilat dengan menggunakan asam 3-aminobenzoat sebagai ligan asam karboksilatnya.
Metode polarisasi potensiodinamik merupakan suatu metode untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik atau katodik, jika logam berada kontak dengan larutan yang bersifat korosif (Rastogi et al., 2005). Hasil pengujian yang diperoleh berupa grafik, kemudian diolah dengan metoda analisis Tafel untuk mendapatkan arus korosi, laju korosi, dan nilai
efisiensi inhibisi. Selain itu, analisis permukaan baja dengan mikroskop juga dilakukan untuk melihat pengaruh proteksi senyawa inhibitor yang dibandingkan dengan medium korosif tanpa inhibitor.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mensintesis senyawa difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-aminobenzoat.
2. Mengkarakterisasi senyawa awal difeniltimah(IV) oksida dan
trifeniltimah(IV) hidroksida dan senyawa hasil sintesis difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-di-3-aminobenzoat menggunakan
spektrofotometer UV-Vis, spektrofotometer IR, spektrofotometer NMR, dan microelemental analyzer.
3. Menguji dan membandingkan efektivitas antikorosi senyawa difeniltimah(IV) di-3-aminobenzoat, trifeniltimah(IV) 3-aminobenzoat pada pelat baja lunak tipe HRP.
4. Mengetahui laju korosi baja pada penambahan inhibitor senyawa
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Senyawa Organologam
Senyawa organologam merupakan senyawa yang setidaknya terdapat satu atom karbon dari gugus organik yang berikatan langsung dengan atom logam. Senyawa yang mengandung ikatan karbon dengan fosfor, arsen, silikon, ataupun boron termasuk dalam katagori ini, tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam. Sebagai contoh suatu alkoksida seperti (C3H7O4)Ti bukan termasuk senyawa organologam, karena gugus organiknya terikat pada Ti melalui atom oksigen. Sedangkan senyawa (C6H5)Ti(OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
a. Senyawaan ionik dari logam elektropositif
Senyawa organologam yang relatif sangat elektropositif umumnya bersifat ionik, tidak larut dalam pelarut organik, serta sangat reaktif terhadap udara dan air. Senyawa ini terbentuk bila suatu radikal pada logam terikat pada logam dengan keelektropositifan yang sangat tinggi, misalnya logam alkali atau alkali tanah. Kestabilan dan kereaktifan senyawa ionik bergantung pada kestabilan radikal organiknya.
b. Senyawaan organotimah yang memiliki ikatan σ (sigma)
Senyawa ini memiliki ikatan σ yang terbentuk antara gugus organik dan atom
logam dengan keelektropositifan rendah. Jenis ikatannya dapat digolongkan sebagai ikatan kovalen (walaupun masih ada sifat ionik) dan sifat kimianya adalah dari sifat kimia karbon yang disebabkan oleh beberapa faktor berikut: 1.Kemungkinan penggunaan orbital d yang lebih tinggi, seperti pada SiR4
yang tidak tampak dalam CR4.
2.Kemampuan donor alkil atau aril dengan pasangan elektron menyendiri seperti pada Pet3, Sme2 dan sebagainya.
3.Keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh seperti pada BR3 atau koordinasi tak jenuh seperti pada ZnR2.
c. Senyawaan organologam yang terikat secara nonklasik
Dalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ikatan ionik atau pasangan elektron. Senyawa ini terbagi menjadi dua golongan:
1. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan 2. Senyawa organologam yang terbentuk antara logam-logam transisi dengan
alkena, alkuna, benzena, dan sistem cincin lainnya seperti C5H5-. (Cotton dan Wilkinson, 2007).
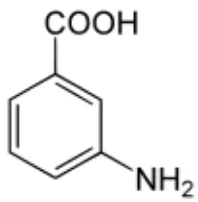
B. Asam 3-aminobenzoat
Asam 3-aminobenzoat (Gambar 1) memiliki rumus molekul C6H4(NH2)COOH dengan berat molekul 137,14 gram/mol, titik didih 178-180oC, kelarutan dalam air 5,9 gram/Liter, dan densitas 1,51 gram/cm3.
Gambar 1. Struktur asam 3-aminobenzoat
C. Timah (Sn)
Timah merupakan logam putih dan melebur pada suhu 232oC. Timah larut dalam asam basa, senyawa-senyawa oksidanya dengan asam atau basa akan membentuk garam. Timah tidak reaktif terhadap oksigen bila dilapisi oleh oksida film dan tidak reaktif terhadap air pada suhu biasa, tetapi akan mempengaruhi kilauannya (Svehla, 1985). Sn memiliki bilangan oksidasi utama yaitu +2 dan +4. Dalam bilangan oksidasi +2, pasangan elektron ns2 tidak terlibat dalam pembentukan ikatan, sedangakan pada bilangan oksidasi +4 semua pasangan elektron terpakai. Reduksi Sn(IV) menjadi Sn(II) mempunyai harga positif Eo yang kecil (+0,15) sehingga Sn(II) dapat bertindak sebagai senyawa pereduksi, sebagai contoh SnCl2 merupakan senyawa pereduksi yang baik untuk Fe(III), Hg(II), dan Cu(II).
Timah memiliki tiga bentuk alotrop, yaitu timah abu-abu (α), timahputih ( ) dan timah rombik ( ). Pada suhu ruang, timah lebih stabil sebagai logam timah putih
dalam bentuk tetragonal. Sedangkan pada suhu rendah, timah putih berubah menjadi timah abu-abu berbentuk intan kubik berupa nonlogam. Perubahan ini terjadi cepat karena timah membentuk oksida. Peristiwa ini dikenal sebagai plak timah atau timah plague. Timah putih mempunyai densitas yang lebih tinggi dari pada timah abu-abu (Petruci, 1989).
D. Senyawa Organotimah
sebagai turunan dari RnSn(IV)X4-n(n = 1-4) dan diklasifikasikan sebagai mono-, di-, tri-, dan tetra- organotimah(IV), tergantung dari jumlah gugus alkil (R) atau aril (Ar) yang terikat. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002).
Ikatan Sn-X memiliki derajat ion tertentu bergantung pada anion (X) dan alkil (R). Sebagai contoh, titik leleh dari (CH3)3SnX bervariasi untuk fluorida (300ºC) > klorida (37ºC) > bromida (27ºC) > iodida (3,4ºC) (Tayer, 1988). Kecenderungan terhidrolisis dari senyawa organotimah lebih lemah dibandingkan senyawa Si atau Ge yang terikat dan ikatan Sn-O dapat bereaksi dengan larutan asam. Senyawa organotimah tahan terhadap hidrolisis atau oksidasi pada kondisi normal
walaupun dibakar menjadi SnO2, CO2, dan H2O. Kemudahan putusnya ikatan Sn-C oleh halogen atau reagen lainnya bervariasi berdasarkan gugus organiknya dan urutannya meningkat dengan urutan: Bu (paling stabil) < Pr < et < me < vinil < Ph < Bz < alil < CH2CN < CH2CO2R (paling tidak stabil).
1. Senyawa organotimah halida
Senyawa organotimah halida dengan rumus umum RnSnX4-n (n = 1-3; X = Cl, Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif. Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
2 EtI + Sn Et2Sn + I2
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dangan timah(IV) klorida. Caranya dengan mengubah perbandingan material awal, seperti pada persamaan reaksi berikut:
3 R4Sn+SnCl4 4 R3SnCl R4Sn+ SnCl4 2 R2SnCl2
Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut:
R4SnCl4-n + (4-n) MX R4SnX4-n+ (4-n) MCl (X = F, Br atau I; M = K, Na, NH4) (Wilkinson, 1982).
2. Senyawa organotimah hidroksida dan oksida
dan trialkiltimah hidroksida. Prinsip tahapan intermediet ditunjukkan pada reaksi berikut ini:
OH
R3SnX R3Sn XR3SnOSnR3X XR3SnOSnR3OH R2SnO
X atau
R3SnOH (Wilkinson, 1982).
3. Senyawa organotimah karboksilat
Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan asam karboksilat, dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal.
Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksinya adalah sebagai berikut:
RnSnCl4-n + (4-n) MOCOR RnSn(OCOR)4-n + (4-n) MCl
R2SnO + β R’COOH R2Sn(OCOR’)2 + H2O R3SnOH + R’COOH R3SnOCOR’+ H2O (Wilkinson, 1982).
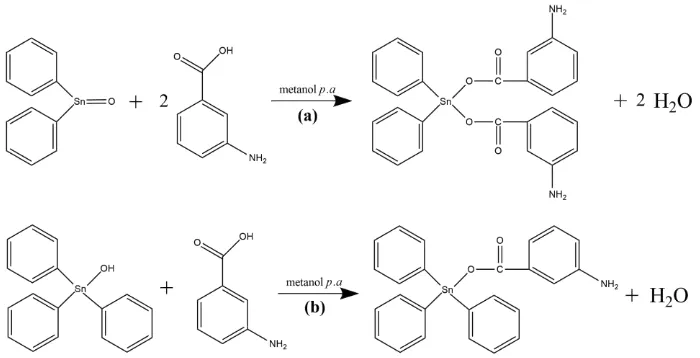
Pada penelitian ini senyawa difeniltimah(IV) oksida dan trifeniltimah(IV) hidroksida direaksikan dengan asam 3-aminobenzoat sebagai ligan sehingga diharapkan senyawa difeniltimah(IV) di-aminobenzoat dan trifeniltimah(IV) 3-aminobenzoat dapat terbentuk berdasarkan reaksi pada Gambar 2.
Gambar 2. Reaksi sintesis senyawa (a) difeniltimah(IV) di-3-aminobenzoat dan (b) trifeniltimah(IV) 3-aminobenzoat.
E. Aplikasi Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa
penggunaan tersebut, tidak kurang dari 25.000 ton timah digunakan per tahun (Pellerito and Nagy, 2002).
Mono- dan diorganotimah digunakan secara luas sebagai stabilizer
polivinilklorida untuk mengurangi degradasi polimer polivinilklorida tersebut. Empat tipe utama penstabil timah berdasarkan gugus alkilnya yaitu: oktil, butil, fenil dan metil. Oktiltimah diketahui memiliki kandungan timah paling sedikit dan kurang efisien. Ligan-ligan utama yang digunakan untuk membedakan berbagai penstabil timah yaitu, asam tioglikolat ester dan asam karboksilat. Senyawa organotimah yang paling umum digunakan sebagai katalis dalam sintesis kimia yaitu katalis mono dan diorganotimah. Senyawa organotimah merupakan katalis yang bersifat homogen yang baik untuk pembuatan polisilikon, poliuretan dan untuk sintesis poliester.
Senyawa organotimah ditemukan berikutnya antara lain sebagai biocide (senyawa yang mudah terdegradasi), sebagai pestisida yang pertama kali diperkenalkan di Jerman yaitu dari senyawa trifeniltimah asetat pada akhir 1950-an. Kegunaan yang utama dari agrokimia senyawa organotimah karena senyawa ini relatif memiliki fitotoksisitas (daya racun pada tanaman) yang rendah dan terdegradasi dengan cepat sehingga residunya tidak berbahaya terhadap lingkungan (Cotton dan Wilkinson, 2007).
konsentrasi rendah. Aktivitas biologi ini ditentukan oleh jumlah dan gugus organik yang terikat pada pusat atom Sn. Senyawa organotimah karboksilat diberikan perhatian khusus dikarenakan senyawa ini memiliki kemampuan biologi yang kuat dibandingkan senyawa organotimah lainnya (Mahmood et al., 2003; Pellerito and Nagy, 2002).
Dalam beberapa penelitian, diketahui senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroba (Bonire et al., 1998). Diketahui pula bahwa kompleks di- dan tri- organotimah halida dengan berbagai ligan yang mengandung nitrogen, oksigen, dan sulfur memiliki aktivitas biologi dan farmakologi yang digunakan sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain et al., 2003). Selain itu, penelitian terbaru menjelaskan bahwa senyawa organotimah dapat dimanfaatkan sebagai inhibitor korosi (Rastogi et al.,2005; Singh et al.,2010; Rastogi et al.,2011; Afriyani, 2014; Anggraini, 2014).
F. Analisis Senyawa Organotimah
1. Analisis spektroskopi UV-Vis senyawa organotimah
Pada spektroskopi UV-Vis, senyawa yang dianalisis akan mengalami transisi elektronik sebagai akibat penyerapan radiasi sinar UV dan sinar tampak oleh senyawa yang dianalisis. Transisi tersebut pada umumnya antara orbital ikatan atau pasangan elektron bebas dan orbital antiikatan. Panjang gelombang serapan merupakan ukuran perbedaan tingkat-tingkat energi dari orbital-orbital. Agar elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada 120-200 nm (1 nm = 10-7cm = 10 Å). Daerah ini dikenal sebagai daerah ultraviolet hampa, karena pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur.
Serapan diatas 200 nm merupakan daerah eksitasi elektron dari orbital p, d, dan orbital π terutama sistem π terkonjugasi mudah pengukurannya dan spektrumnya
memberikan banyak keterangan. Kegunaan spektrofotometer UV-Vis ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tak terkonjugasi, diena terkonjugasi dari triena dan sebagainya. Letak serapan dapat dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dari senyawa karbonil (Sudjadi, 1985).
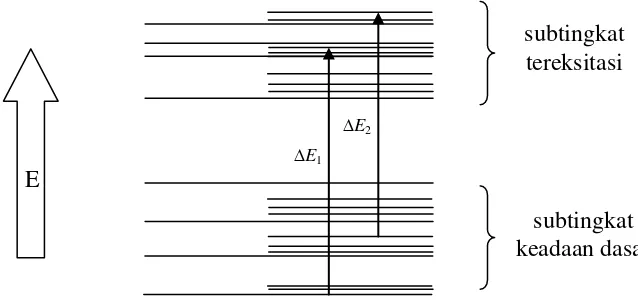
dalam orbital ikatan (bonding) dieksitasikan ke orbital antibonding. Transisi elektronik dapat terjadi dari subtingkat apa saja dari keadaan dasar ke subtingkat apa saja dari keadaan eksitasi seperti pada Gambar 3.
Gambar 3. Skema transisi elektronik dari tingkat energi rendah ke tingkat energi yang lebih tinggi (Fessenden dan Fessenden, 1986)
Identifikasi kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam daerah inframerah, dikarenakan pita serapan pada daerah UV-Vis terlalu lebar dan kurang terperinci. Tetapi gugus-gugus fungsional tertentu seperti karbonil, nitro, dan sistem tergabung menunjukkan puncak karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
2. Analisis spektroskopi IR senyawa organotimah
Pada spektroskopi IR, radiasi inframerah dengan rentang panjang gelombang dan intensitas tertentu dilewatkan terhadap sampel. Molekul-molekul senyawa pada sampel akan menyerap seluruh atau sebagian radiasi itu. Penyerapan ini
E
subtingkat tereksitasi
subtingkat keadaan dasar
∆E2
berhubungan dengan adanya sejumlah vibrasi yang terkuantisasi dari atom-atom yang berikatan secara kovalen pada molekul-molekul itu. Penyerapan ini juga berhubungan dengan adanya perubahan momen dari ikatan kovalen pada waktu terjadinya vibrasi. Bila radiasi itu diserap sebagian atau seluruhnya, radiasi itu akan diteruskan. Detektor akan menangkap radiasi yang diteruskan itu dan mengukur intensitasnya (Supriyanto, 1999).
Secara umum, spektrum serapan IR dapat dibagi menjadi tiga daerah:
a. Inframerah dekat, dengan bilangan gelombang antara 14.300 hingga 4.000 cm-1. Fenomena yang terjadi ialah absorpsi overtone C-H.
b. Inframerah sedang, dengan bilangan gelombang antara 4.000 hingga 650 cm-1. Fenomena yang terjadi ialah vibrasi dan rotasi.
c. Inframerah jauh, dengan bilangan gelombang 650 hingga 200 cm-1. Fenomena yang terjadi ialah penyerapan oleh ligan atau spesi lainnya yang berenergi rendah.
Dengan menggunakan analisis spektroskopi IR terhadap senyawa organotimah karboksilat, dapat ditunjukkan adanya vibrasi ulur Sn-O pada bilangan gelombang 500 – 400 cm-1 dan Sn-C pada bilangan gelombang 600 – 500 cm-1. Selain itu
Tabel 1.Serapan karakteristik IR untuk asam-asam karboksilat
(Fessenden dan Fessenden, 1986)
3. Analisis spektroskopi NMR senyawa organotimah
Spektroskopi NMR (Nuclear Magnetic Resonance), sesuai dengan namanya, spektroskopi ini berhubungan dengan sifat magnet dari inti atom. Analisis menggunakan spektrometer magnet inti akan memperoleh gambaran perbedaan sifat magnet dari berbagai inti yang ada serta dapat menduga letak inti tersebut dalam molekul. Pelarut yang biasa digunakan pada analisis ini yaitu
karbontetraklorida (CCl4), kloroform terdeterasi (CDCl3), dan karbondisulfida (CS2) dikarenakan dalam senyawa ini tidak mengandung proton di dalam strukturnya, titik didih rendah, tidak polar, dan bersifat inert.
Perbedaan frekuensi resonansi setiap proton dalam cuplikan diukur relatif terhadap frekuensi resonansi dari proton-proton senyawa baku. Senyawa baku yang umum digunakan yaitu tetrametilsilan (TMS). TMS dipilih karena dapat memberikan puncak tunggal yang tajam dan kuat walaupun digunakan
daripada proton pada TMS, hal ini dikarenakan Si bersifat lebih elektropositif terhadap senyawa karbon (Sudjadi, 1985).
Pergeseran kimia dapat diperngaruhi oleh berbagai faktor diantaranya, efek elektronegatifitas, pengaruh hibridisasi, proton asam dan ikatan hidrogen, efek anisotropi, dan pengaruh deshielding van der Walls. Selain itu, suhu, konsentrasi, dan solvent juga mempengaruhi pergeseran walaupun pengaruhnya kecil. Letak pergeseran kimia untuk 1H dan 13C NMR dapat dilihat pada Tabel 2 dan Tabel 3.
Tabel 2. Letak pergeseran kimia dalam spektra 1H NMR
Senyawa proton 1H (δ) ppm
Tabel 3. Letak pergeseran kimia dalam spektra 13C NMR
4. Analisis unsur dengan menggunakan microelemental analyzer
Mikroanalisis adalah penentuan kandungan unsur penyusun suatu senyawa yang dilakukan dengan menggunakan microelemental analyzer. Unsur yang umum ditentukan adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Sehingga alat yang biasanya digunakan untuk tujuan mikroanalisis ini dikenal sebagai CHNS microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, perbedaan biasanya antara 1–5%, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costecsh Analytical Technologies, 2011).
G. Baja Lunak
Menurut komposisi kimianya, baja dibedakan menjadi dua yaitu baja karbon dan baja padanan. Baja karbon adalah baja yang bukan hanya tersusun atas padanan besi dan karbon, tetapi juga unsur lain yang tidak mengubah sifat baja.Baja karbon diproduksi dalam bentuk balok, profil, lembaran dan kawat. Ada beberapa jenis baja karbon antara lain sebagai berikut:
Baja karbon rendah yang mengandung 0,022 – 0,3 % C yang dibagi menjadi
empat bagian menurut kandungannya yaitu :
Baja karbon rendah mengandung 0,04 % C digunakan untuk plat-plat strip.
Baja karbon rendah mengandung 0,05 % C digunakan untuk badan
Baja karbon rendah mengandung 0,05 – 0,25 % C digunakan untuk konstruksi
jembatan dan bangunan.
Baja karbon rendah mengandung 0,05 – 0,3 % digunakan untuk baut paku
keling, karena kepalanya harus di bentuk.
Baja karbon menengah memiliki sifat-sifat mekanik yang lebih baik dari pada
baja karbon rendah. Baja karbon menengah mengandung 0,3 – 0,6 % C dan
memiliki ciri khas yang lebih kuat dan keras daripada baja karbon rendah. Tidak
mudah dibentuk dengan mesin, lebih sulit dilakukan untuk pengelasan dan dapat
dikeraskan dengan baik.
Baja karbon tinggi.
Baja karbon tinggi memiliki kandungan antara karbon antara 0,6 – 1,7 % karbon.
Memiliki ciri-ciri sangat kuat, getas/rapuh, sulit dibentuk mesin, mengandung
unsur sulfur dan posfor, dan dapat dilakukan proses heat treatment dengan baik
(Amanto dan Daryanto, 2006).
Pada penelitian ini digunakan baja berkarbon rendah dengan kadar karbon berkisar 0,04% yang diproses melalui pemanasan dan berupa lembaran, jenis ini dikenal dengan nama hot roller plate atau HRP.
H. Korosi
logam yang disebabkan oleh reaksi oksidasi. Kerusakan terhadap logam-logam tersebut dipengaruhi oleh adanya gas oksigen, amoniak, klorida, air, larutan garam, basa, asam, dan juga akibat arus listrik. Pada umumnya korosi yang paling banyak terjadi adalah korosi oleh udara dan air (Fontana, 1986).
Faktor-faktor yang mempengaruhi proses korosi diantaranya:
1. Fisika : Panas, perubahan temperatur, pendinginan, radiasi matahari. 2. Kimia : Larutan asam, basa, garam, bahan-bahan organik, gas buangan. 3. Biologi : Mikroorganisme, jamur, ganggang, binatang laut, bakteri.
I. Proses Korosi
Berdasarkan proses terjadinya, korosi dapat dibagi menjadi dua jenis yaitu proses korosi kering dan proses korosi basah (Trethewey and Chamberlein, 1991).
1. Proses korosi kering
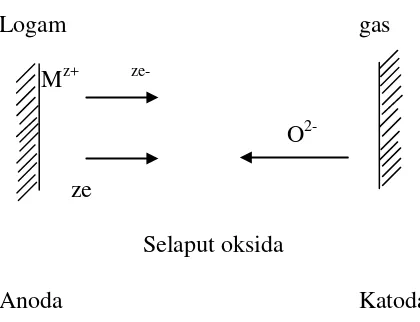
Proses korosi kering yaitu korosi yang tidak mengikutsertakan air atau larutan dalam reaksinya. Persamaan reaksinya adalah sebagai berikut :
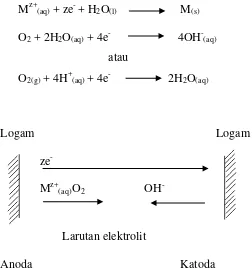
M Mz+ + ze-
Logam gas Mz+
ze-O 2-ze
Selaput oksida
Anoda Katoda
Gambar 4. Proses korosi kering dengan dua elektroda
Berdasarkan Gambar 4, permukaan batas logam atau oksida dapat dianggap sebagai anoda dan permukaan batas gas atau oksida dapat dianggap sebagai katoda.
2. Proses korosi basah
Pada proses korosi ini, oksida logam dan reduksi nonlogam terjadi pada daerah berbeda pada permukaan logam, sehingga terjadi transfer elektron melalui logam dari anoda (logam teroksidasi) ke katoda (nonlogam tereduksi) seperti ditunjukan pada Gambar 5. Fase padat dan stabil yang terbentuk pada permukaan batas logam (larutan) dapat berupa senyawa padat atau ion terhidrasi (anion atau kation). Fase padat ini dapat disingkirkan dari permukaan batas melalui proses seperti migrasi, difusi, atau konveksi (secara alami ataupun tidak). Pada keadaan ini reaktan-reaktan tidak akan terpisah oleh barier (batas) dan kecepatan
Mz+
(aq) + ze- + H2O(l) M(s) O2 + 2H2O(aq) + 4e- 4OH-(aq)
atau
O2(g) + 4H+(aq) + 4e- 2H2O(aq)
Logam Logam
ze-
Mz+(aq) O2 OH
-Larutan elektrolit
Anoda Katoda
Gambar 5. Proses korosi basah dengan dua elektroda
J. Faktor-faktor Penyebab Korosi
Faktor-faktor penyebab terjadinya korosi antara lain adalah atmosfer atau udara, air, tanah, air, tanah, gas-gas korosif dan zat-zat kimia (Trethewey and
Chamberlein, 1991)
1. Atmosfer atau udara
jenuh dengan uap air banyak mengandung garam-garam, asam, zat-zat kimia dan gas-gas.
2. Air
Air dapat dibedakan atas air laut dan air tawar. Air laut merupakan larutan elektrolit yang mengandung garam-garam (terutama NaCl) yang sangat korosif. Air tawar seperti air sungai, air danau atau air tanah dapat mengandung berbagai macam garam alamiah, asam, oksigen dan zat-zat kimia lain yang berasal dari susunan geologi dan mineral dari daerah yang bersangkutan. Korosi akan dipercepat oleh air yang mengandung garam, karena sifat elektrolit memberikan suasana yang baik untuk terjadinya suatu reaksi reduksi-oksidasi. Biasanya zat terlarut yang membentuk asam, misalnya belerang dioksida dan karbon dioksida yang akan mempercepat laju korosi.
3. Tanah
Korosi di dalam tanah selain terjadi pada pipa-pipa dan kabel-kabel juga terjadi pada pondasi-pondasi logam yang terpendam di dalamnya. Pada pemasangan pipa-pipa dalam tanah, tanah yang digali dan kemudian ditutup lagi
Tanah harus dianalisis terlebih dahulu sebelum logam-logam dimasukan ke dalamnya, karena tanah dapat mengandung berbagai macam asam, zat-zat kimia dan mineral-mineral yang korosif. Setelah dianalisis, kita dapat menentukan usaha perlindungan yang tepat terhadap logam-logam tersebut dari serangan korosi di dalam tanah.
4. Zat-zat kimia
Zat-zat kimia yang dapat menyebaban korosi antara lain adalah asam, basa dan garam baik dalam bentuk cair, padat maupun gas. Pada umumnya korosi oleh zat-zat kimia pada suatu material dapat terjadi bila material mengalami kontak langsung dengan zat-zat kimia tersebut.
K. Bentuk-bentuk Korosi
Korosi dapat dibagi menjadi delapan jenis berdasarkan bentuknya diantaranya; korosi merata, korosi galvanik, korosi celah, korosi sumuran, korosi batas butir, korosi kavitasi, korosi erosi, dan korosi regangan (Fontana, 1986).
1. Korosi merata (uniform corrosion)
Contohnya sebatang besi (Fe) atau seng (Zn) direndam dalam larutan H2SO4. Keduanya akan larut dengan laju yang merata pada permukaan logam.
2. Korosi galvanik (galvanic corrosion)
Korosi galvanik terjadi karena perbedaan potensial antara dua logam yang tidak sama, bila kedua logam ini bersinggungan akan menghasilkan aliran elektron diantara kedua logam tersebut. Logam yang lebih mulia bersifat katodik dan akan diserang korosi lebih kecil, sedangkan logam yang kurang mulia bersifat anodik dan akan lebih mudah diserang korosi.
3. Korosi celah (crevice corrosion)
Korosi ini terjadi pada suatu logam di daerah yang berhubungan langsung dengan bahan lain yang bukan logam. Umumnya terjadi karena terdapat perbedaan konsentrasi larutan atau konsentrasi oksigen, sehingga menyebabkan adanya perbedaan potensial oksidasi pada logam tersebut.
4. Korosi sumuran (pitting corrosion)
pada permukaan oksida pelindung logam yang terjadi sebagai stimulasi dari reaksi anoda, aktivasi anion dan reaksi katoda melalui kehadiran agen pengoksidasi dan melalui permukaan katoda efektif dengan polarisasi rendah. Korosi sumuran akan terjadi jika logam memenuhi potensial korosi minimum yang selanjutnya disebut sebagai potensial pitting.
5. Korosi batas butir (interglanular corrosion)
Korosi batas butir merupakan korosi yang terjadi pada batas butir logam. Dalam hal ini timbul keretakan pada logam akibat korosi melalui batas butir. Retak yang ditimbulkan korosi jenis ini disebut stress corrosion cracking (SCC) yang terdiri atas retak interglanular dan retak transgranular. Retak intergranular berjalan sepanjang batas butir, sedangkan retak transgranular berjalan tanpa menyusuri batas butir tersebut.
6. Korosi kavitasi
Korosi kavitasi terjadi karena tingginya kecepatan cairan yang menciptakan daerah-daerah bertekanan tinggi dan rendah secara berulang-ulang pada permukaan peralatan cairan tersebut mengalir. Maka terjadi
7. Korosi erosi (erosion corrosion)
Korosi erosi disebabkan oleh gabungan peristiwa korosi dan korosi akibat aliran fluida sehingga proses korosi lebih cepat. Korosi ini dicirikan oleh adanya gelombang, lembah yang biasanya merupakan suatu pola tertentu.
8. Korosi regangan (stress corrosion)
Gaya-gaya seperti tarikan (tensile) atau kompresi (compressive) berpengaruh sangat kecil pada proses pengkaratan. Adanya kombinasi antara regangan tarik (tensile stress) dan lingkungan yang korosif, maka akan terjadi kegagalan material berupa retakan yang disebut retak korosi regangan.
L. Inhibitor Korosi
Inhibitor korosi adalah suatu senyawa organik atau anorganik yang apabila ditambahkan dalam jumlah relatif sedikit ke dalam sistem logam-media elektrolit akan menurunkan laju korosi logam (Fontana, 1986). Senyawa inhibitor ini dapat di adsorbsi oleh logam dari larutan penyebab korosi. Inhibitor korosi larut dalam air dan membentuk lapisan yang tidak larut pada permukaan logam yang
diproteksi dengan ketebalan tidak lebih dari suatu nanolayer. Lapisan ini disebut pelindung dan penghambat reaksi korosi dengan cara menghindari ion-ion logam atau reduksi oksigen terlarut pada permukaan logam. Fungsi lapisan ini
Mekanisme kerja inhibitor korosi ini diawali dengan proses adsorbsi pada permukaan logam, kemudian menutupi permukaan yang dapat mencegah proses elektrokimia. Efisiensi meningkat dengan bertambahnya permukaan yang tertutup. Ada beberapa faktor yang mempengaruhi adsorbsi inhibitor, yaitu muatan pada permukaan logam, gugus fungsi dan struktur inhibitor, interaksi inhibitor dengan molekul air dan reaksi lain pada inhibitor. Inhibitor yang dapat digunakan diantaranya adalah amina, natrium nitrit, natrium hidrogen, natrium hidrogen fosfat, natrium silika dan boraks. Dalam penelitian ini yang digunakan sebagai inhibitor adalah beberapa senyawa turunan organotimah(IV)
3-aminobenzoat.
Ada beberapa kemungkinan mekanisme penghambatan korosi oleh turunan senyawa organotimah(IV) yang dapat ditentukan berdasarkan kajian struktur, gugus aktif, dan kesterikan senyawa. Kemungkinan pertama yaitu interaksi baja pada elektroda kerja. Interaksi ini mungkin terjadi ketika anoda mengalami oksidasi, Fe lepas sebagai Fe2+ dan sumber elektron eksternal mengalir pada baja menyebabkan baja cenderung elektronegatif. Dalam deret volta, nilai potensial reduksi standar Sn lebih tinggi dibanding dengan Fe sehingga diharapkan baja akan lebih sulit terkorosi.
dalam larutan. Jika populasi oksigen bebas dalam larutan berkurang, maka proses reduksi oksigen oleh asam yang terjadi dalam katoda menjadi lebih lambat. Sehingga reaksi oksidasi pada anoda pun juga akan terhambat, dan proses korosi cenderung terjadi lebih lambat (Afriyani, 2014).
Pada penelitian sebelumnya senyawa kompleks trifeniltimah(IV) karboksilat memiliki nilai efisiensi lebih besar dibandingkan dengan senyawa kompleks difeniltimah(IV) karboksilat (Afriyani, 2014; Anggraini, 2014). Hal ini
disebabkan senyawa difeniltimah(IV) karboksilat memiliki struktur molekul yang cenderung simetri dengan dua ligan yang sama terikat pada atom pusat timah. Sedangkan senyawa trifeniltimah(IV) karboksilat merupakan senyawa asimetri. Struktur asimetri ini yang justru lebih disukai karena banyaknya gugus fenil yang terikat pada atom pusat timah (Rastogi et al, 2011). Fenil merupakan gugus penarik elektron yang baik (Fessenden dan Fessenden, 1986), sehingga timah yang terinduksi elektropositif oleh gugus fenil lebih banyak cenderung akan lebih elektropositif sehingga akan meningkatkan kemampuannya untuk bereaksi dengan senyawa lain dalam proses penghambatan korosi.
a. Inhibitor anodik
Inhibitor yang menurunkan lajunya dengan cara menghambat transfer ion-ion logam kedalam larutan karena berkurangnya daerah anoda akibat pasivasi. Inhibitor anodik disebut juga inhibitor antar muka.
b. Inhibitor katodik
Inhbitor yang menurunkan laju korosi dengan cara menghambat salah satu tahap pada proses katodik seperti pembebasan ion-ion hidrogen dan penangkapan oksigen. Inhibitor katodik disebut juga inhibitor antarfasa. c. Inhibitor campuran
Inhibitor yang menurunkan laju korosi dengan cara menghambat proses anodik dan katodik secara bersamaan.
d. Inhibitor teradsorpsi
Merupakan jenis inhibitor senyawa-senyawa organik. Inhibitor teradsorpsi yaitu inhibitor yang menurunkan laju korosi dengan cara mengisolasi permukaan logam dari lingkungan korosif melalui pembentukan film teradsorpsi. Adsorpsi yang terjadi diakibatkan oleh sifat muatan atau
kepolaran molekul organik atau spesi ionik yang membentuk film permukaan secara fisikosorpsi, dan distabilkan melalui kemisorpsi, atau bahkan secara kemisorpsi sempurna. Terdapat tiga cara yang dilakukan inhibitor teradsorpsi terhadap permukaan logam yaitu :
Pembentukan penghalang secara fisika atau kimia.
Isolasi langsung situs- situs anodik dan katoda, dan
Kemampuan inhibisi korosi dari senyawa karbon bergantung pada sifat adsorpsi dan konsentrasi inhibitor teradsorpsi dalam melindungi permukaan logam media korosif atau memodifikasi reaksi elektroda dari pelarutan logam pada proses anodik. Adanya adsorpsi senyawa organik pada permukaan elektroda memberikan informasi tentang lapis rangkap listrik, kinetika transfer elektron, dan peranan antarmedia dalam mekanisme inhibisi dari proses elektroda. Seperti pada sintesis elektroorganik dan elektroplating. Adsorpsi sangat bergantung pada sifat fisika dan kimia dari molekul inhibitor, seperti gugus fungsi, faktor sterik, sifat aromatis, rapat elektron atom donor, dan karakter orbital π dari donor elektron
(Fahrurrozie, 2009).
Pendekatan secara termodinamika merupakan teknik utama dalam menentukan mekanisme inhibisi korosi melalui adsorpsi isotermal berdasarkan nilai energi bebas adsorpsi. Jika energi bebas yang terlihat lebih dari 40 kJ.mol-1
dikategorikan sebagai adsorpsi kimia (kemisorpsi), jika kurang dari 20 kJ.mol-1 dikategorikan sebagai adsorpsi fisik (fisiosorpsi) atau gaya Van der Waals. Umumnya inhibitor korosi dari senyawa karbon yang mengandung atom nitrogen atau sulfur bekerja dengan cara teradsorpsi pada permukaan logam. Adsorpsi secara fisika bergantung pada fraksi penutupan permukaan, karakter lapisan pelindung teradsorpsi pada antarmuka logam atau media, karakter interaksi antara molekul-molekul inhibitor dengan atom-atom pada permukaan elektroda
atom sulfur dalam molekul inhibitor yang ditransfer kepada orbital-d dari atom-atom besi hingga terbentuk senyawa kompleks.
M. Metode Analisis Korosi
Pada penelitian ini analisis korosi dilakukan dengan metode polarisasi
potensiodinamik. Polarisasi potensiodinamik adalah metode untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik/katodik. Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan di luar sistem. Hal ini disebabkan ada perbedaan potensial antara logam dan larutan sebagai lingkungannya
(Sunarya, 2008).
Data yang diperoleh dari metode ini adalah kurva polarisasi anodik/katodik yang menyatakan hubungan antara arus (µA/cm2) sebagai fungsi potensial (mV). Selanjutnya kurva tersebut diekstrapolasi menggunakan metode analisis Tafel untuk dapat menentukan laju korosi yaitu melalui persamaan di bawah ini :
... (1)
dengan
Rmpy : laju korosi (mili inch/year)
Jcorr :densitas arus korosi (
: berat ekivalen material (g)
Sedangkan besarnya efisiensi inhibitor dalam menghambat korosi dapat diperoleh berdasarkan persamaan berikut:
(
%... (2)
dengan
% EI: persentase efektivitas penghambatan
: arus sebelum ditambahkan inhibitor
: arus sesudah ditambahkan inhibitor (Rastogi et al., 2005).
Analisis Tafel digunakan untuk menentukan besarnya logaritma normal dari nilai
kerapatan arus (Ln |Jcorr|) dengan overpotensial (ɳ) yang selanjutnya diekstrapolasi ke
dalam bentuk grafik. Melalui grafik yang diperoleh antara laju selusur katoda dan
anoda, ditentukan titik potong (Ln |Jcorr|) kedua grafik tersebut pada ɳ=0. Nilai Ln
|Jcorr| tersebut selanjutnya dieksponensialkan sehingga diperoleh nilai kerapatan arus
korosi (Jcorr). Nilai kerapatan arus korosi selanjutnya dikalikan dengan luas
permukaan elektroda kerja terukur untuk menentukan besarnya arus korosi (Icorr)
sesuai dengan persamaan berikut:
... (3)
dengan
Icorr : Besaran arus korosi (mA)
Jcorr : Kerapatan arus korosi (mA/cm2)
A : Luas permukaaan elektroda kerja terukur (cm2)
Berdasarkan ektrapolasi Tafel ini dapat diketahui dominasi reaksi yang terjadi antara
polarisasi atau reaksi anodik yang berperan ditandai dengan terjadinya oksidasi pada
baja karbon. Namun jika potensial korosi bergeser kearah positif maka reaksi katodik
yang berperan ditandai dengan terjadinya reduksi ion-ion H+ yang banyak
(Fahrurrozie, 2009).
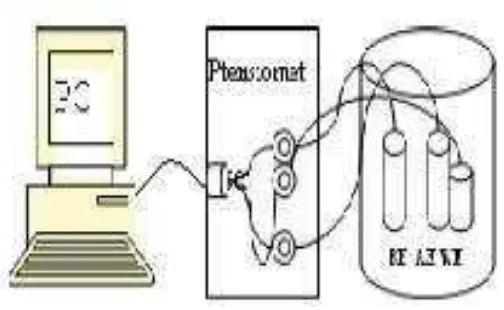
N. Integrated Potentiostat System eDAQ
Instrumentasi Integrated Potentiostat System eDAQ terdiri dari potensiostat dan E-chem, seperti pada Gambar 6. Potensiostat berfungsi untukmengontroltegangan elektroda yang kemudian direkam datanya oleh e-corder. Sedangkan E-chem berfungsi dalam menampilkan data dalam bentuk grafis untuk selanjutnya dianalisis. Hasil pengujian ditampilkan dalam bentuk grafis, kemudian diolah dengan metoda analisis Tafel untuk mendapatkan arus korosi. Arus korosi ini kemudian dapat dikonversi menjadi laju korosi.
Gambar 6. Sketsa Instrumentasi eDAQ dan benda uji (Butarbutar dan Febrianto, 2009)
Potensiostat akan mengaplikasikan tegangan listrik masukan kepada benda uji sehingga nilai arus selama proses korosi dapat diperoleh (Trethew and
Chamberlein, 1991).
Peralatan potensiostat dilengkapi dengan tiga jenis elektroda diantaranya yaitu:
Elektroda kerja (working electrode): elektroda logam yang akan diteliti (benda uji) yang dapat menghantarkan arus listrik. Permukaanya harus digerinda dan diamplas untuk menghilangkan oksida-oksida yang mungkin ada.
Elektroda bantu (auxiliary electrode): elektroda yang khusus digunakan untuk mengalirkan arus hasil proses korosi yang terjadi dalam rangkaian sel.
Elektroda acuan (reference electrode): elektroda yang tegangan sirkuit terbukanya (open-circuit potential) konstan dan digunakan untuk mengukur potensial elektroda kerja (Butarbutar dan Febrianto, 2009).III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini akan dilaksanakan pada bulan Januari sampai Mei 2015 di Laboratorium Kimia Anorganik-Fisik. Analisis senyawa menggunakan
spektrofotometer UV-Vis dilakukan di Laboratorium Kimia Anorganik FMIPA Universitas Lampung dan analisis senyawa menggunakan spektrofotometer IR dilakukan di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia (UII) Yogyakarta. Analisis senyawa menggunakan spektrofotometer NMR dilakukan di School of Chemical Science, University Science in Malaysia, dan analisis unsur dengan menggunakan microelemental analyzer dilakukan di School of Food Technology and Chemical Science, Universiti Kebangsaan Malaysia. Pengujian aktivitas antikorosi dilakukan di Laboratorium Analitik FMIPA Universitas Lampung. Sedangkan analisis kualitatif permukaan baja dengan mikroskop dilakukan di Laboratorium Botani, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Lampung.
B. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas dalam
desikator, spektrofotometer IR Thermo Nicolet Avatar, spektrofotometer UV-Vis Agilent Cary 100, spektrofotometer NMR Bruker Avance 400 MHz,
microelemental analyzer, pengujian korosi dilakukan dengan alat EA410 Integrated Potentiostat System eDAQ, dan analisis permukaan baja dengan mikroskop trinokuler wolfe no 994367.
Bahan yang digunakan dalam penelitian ini adalah (C6H5)2SnO, (C6H5)3SnOH, HCl, aseton, DMSO ((CH3)2SO), asam 3-aminobenzoat, kertas abrasif, water HPLC, metanol p.a., aquades, serta pelat baja lunak tipe HRP.
C. Cara Kerja
Prosedur umum untuk sintesis senyawa R2Sn(OOCR)2 ataupun R3Sn(OOCR) dengan R baik alkil maupun fenil dilakukan berdasarkan prosedur yang telah digunakan sebelumnya (Hadi et al., 2009; Hadi and Rilyanti, 2010; Hadi et al., 2012) yang merupakan hasil adaptasi dari Szorcsik et al. (2002).
1. Sintesis senyawa difeniltimah(IV) di-3-aminobenzoat
UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), spektrofotometer IR, spektrofotometer NMR, dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer.
2. Sintesis senyawa trifeniltimah(IV) 3-aminobenzoat
Senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH] 1,1010 gram direaksikan dengan asam 3-aminobenzoat (m-C6H4NH2COOH) sebanyak 0,4198 gram dengan perbandingan mol 1:1 dalam 30 mL pelarut methanol p.a. dan direfluks selama 4 jam dengan pemanas pada suhu 60C. Setelah reaksi sempurna, metanol diuapkan
dan dikeringkan di dalam desikator sampai diperoleh kristal kering. Kemudian kristal senyawa hasil sintesis siap untuk dikarakterisasi dengan spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), spektrofotometer IR, spektrofotometer NMR, dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer.
3. Preparasi baja lunak
4. Pembuatan medium korosif
Medium korosif yang akan digunakan dibuat dengan mencampurkan larutan DMSO 0,02 M dan HCl 0,2 M (Rastogi et al., 2005, Rastogi et al., 2011) dengan perbandingan 1:1. Sebanyak 0, 14347 ml DMSO p.a. dengan kadar 99 %
dilarutkan dengan water HPLC dalam labu 100 mL sehingga diperoleh larutan DMSO 0,02 % sedangkan larutan HCl 0,2 M dibuat dengan 1,6667 mL larutan HCl p.a. dilarutkan pada labu 100 mL dengan pelarut water HPLC. Kedua larutan tersebut kemudian dicampurkan dengan perbandingan 1:1 dan dihomogenkan.
5. Pembuatan larutan inhibitor
Larutan inhibitor dibuat dengan melarutkan 0,01 gram zat baik senyawa awal, ligan maupun senyawa hasil sintesis dalam 1,25 mL DMSO p.a. Selanjutnya setelah padatan terlarut sempurna ditambahkan dengan water HPLC hingga volume larutan tepat 25 ml dan diperoleh larutan stok inhibitor dengan
6. Pengujian korosi
Aktivitas antikorosi senyawa organotimah(IV) 3-aminobenzoat diukur dengan metode polarisasi potensiodinamik dengan EA410 Integrated Potentiostat System eDAQ yang terdiri dari tiga elektroda, yaitu elektroda pembanding AgCl,
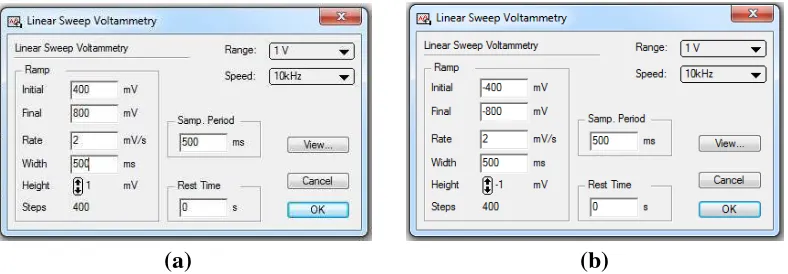
elektroda bantu platina (Pt), dan elektroda kerja baja lunak. Sebelum melakukan pengujian, terlebih dahulu membilas elektroda bantu dan elektroda acuan dengan aquades serta mencuci elektroda kerja dengan akuades, HCl dan aseton secara berturut-turut. Selanjutnya merangkai dan mencelupkan elektroda-elektroda pada sel elektrolisis yang telah diisi dengan larutan medium korosif tanpa inhibitor, kemudian potensiostat dihidupkan. Setelah lampu pada potensiostat berwarna hijau, software E-chem v. 21.8 pada komputer dibuka, kemudian pemindaian dilakukan dengan cara pilih Technique pada menu bar, linear sweep dan pengaturan anoda maupun katoda diatur seperti pada Gambar 7, selanjutnya ketiga elektroda tersebut dibiarkan berinteraksi selama 10 menit dalam medium korosif.
Gambar 7. Pengaturan pemindaian (a) anoda dan (b) katoda
Nilai initial dan final pada pemindaian tersebut berdasarkan nilai Ecorr yang
diperoleh pada penelitian yang telah dilakukan oleh Afriyani (2014) melalui pengukuran sebesar 400 mV. Batasan arus pada keseluruhan pemindaian adalah 100 mA. Hal ini disebabkan karena pada pemindaian anoda, menunjukan nilai arus yang sangat tinggi melebihi 50 mA sehingga digunakan rentang arus 100 mA untuk menghindari arus yang overflow sehingga akan mempengaruhi hasil
pemindaian. Waktu pemindaian yang dibutuhkan untuk melakukan sekali pemindaian baik anoda maupun katoda adalah 200 s.
Selanjutnya setelah dibiarkan selama 10 menit, pilih start pada kanan bawah layar dan setelah 200 s diperoleh voltammogram hasil pemindaian yang menyatakan hubungan potensial dan arus korosi. Data yang didapatkan dari hasil pengujian dapat diperoleh dengan cara memilih seluruh voltammogram hasil pemindaian, kemudian pilih edit pada menu bar, copy special, as text, calculated current, dan pilih ok. Setelah itu pilih menu paste pada lembar kerja software Microsoft Oficce Excel. Pengukuran laju korosi berbagai variasi konsentrasi juga dapat ditentukan dengan metode pemindaian anoda dan katoda yang sama dengan perbandingan larutan inhibitor dan medium korosif 1 : 5.
7. Analisis data
selanjutnya pilih insert pada menu bar, scatter, scatter with smooth lines and markers, kemudian klik kanan pada grafik, pilih move chart untuk memindahkan grafik pada sheet baru. Untuk laju selusur anoda, Ln|J| sebagai absis dan η sebagai ordinat, sedangkan untuk katoda nilai Ln|J| pada pemindaian anoda sebagai absis dan η pada pemindaian katoda sebagai ordinat.
Kemudian ditentukan titik potong Ln |J| kedua grafik tersebut pada nilai ɳ = 0. Nilai Ln |J| tersebut selanjutnya dieksponensialkan sehingga diperoleh nilai kerapatan arus korosi (Jcorr). Nilai kerapatan arus korosi selanjutnya dikalikan
dengan luas permukaan elektroda kerja terukur untuk menentukan besarnya arus korosi (Icorr) sesuai dengan persamaan 3. Dari nilai tersebut selanjutnya dapat ditentukan besarnya laju korosi dan % efisiensi inhibisi menurut Persamaan 1 dan 2.
8. Analisis kualitatif permukaan baja
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, diperoleh simpulan sebagai berikut: 1. Hasil sintesis difeniltimah(IV) di-3-aminobenzoat berupa padatan putih
kekuningan dengan rendemen 95,2 % dan trifeniltimah(IV) 3-aminobenzoat berupa padatan cokelat kemerahan dengan rendemen 80,85 %.
2. Hasil karakterisasi UV menunjukkan adanya transisi elektronik π –π* pada puncak λmax 206 nm untuk difeniltimah(IV) di-3-aminobenzoat dan puncak λmax 209 nm trifeniltimah(IV) 3-aminobenzoat. Sedangkan, transisi elektronik n – π* pada λmax 307 dan 306 nm untuk masing-masing senyawa hasil sintesis
yang berasal dari ligan asam 3-aminobenzoat.
3. Hasil karakterisasi IR senyawa difeniltimah(IV) di-3-aminobenzoat dan trifeniltimah(IV) 3-aminobenzoat menunjukkan adanya pita serapan C=O pada daerah 1623,85 dan 1622,21 cm-1. Selain itu, serapan C-N aromatik amina pada daerah 1268,00 dan 1265,10 cm-1 menunjukkan adanya gugus amina pada kedua senyawa tersebut.
5. Berdasarkan data mikroanalisis dengan menggunakan microelemental analyzer menunjukkan bahwa senyawa hasil sintesis telah murni.
6. Senyawa hasil sintesis baik difeniltimah(IV) di-3-aminobenzoat maupun trifeniltimah(IV) 3-aminobenzoat memiliki kemampuan menghambat korosi yang cukup baik dibuktikan dengan nilai efesiensi inhibisi pada penambahan inhibitor dengan konsentrasi 100 mg/L berturut-turut sebesar 42,88 % dan 50,34 % dengan nilai laju korosi sebesar 7,72 dan 6,71 mpy.
7. Senyawa inhibitor organotimah(IV) 3-aminobenzoat cenderung mengikuti pola inhibitor katodik.
8. Analisis kualitatif permukaan baja menunjukkan penambahan
trifeniltimah(IV) 3-aminobenzoat mampu menghambat korosi sumuran pada permukaan baja.
B. Saran
DAFTAR PUSTAKA
Afriyani, H. 2014. Kajian Aktivitas Antikorosi Beberapa Senyawa Turunan Organotimah(IV) 3-Nitrobenzoat pada Baja Lunak dalam Medium Korosif DMSO-HCl. (Skripsi). Universitas Lampung. Bandar Lampung. 76 hlm. Amanto, H dan Daryanto. 2006. Ilmu Bahan. Penerbit Bumi Aksara. Jakarta. Anggraini, W. D. 2014. Kajian Senyawa Turunan Organotimah(IV)
2-nitrobenzoat Sebagai Inhibitor Korosi pada Baja Lunak dalam Medium Korosif. (Skripsi). Universitas Lampung. Bandar Lampung. 95 hlm.
Bonire, J. J., G. A., Ayoko, P. F., Olurinola, J. O., Ehinmidu, N. S. N., Jalil, and A. A., Omachi. 1998. Synthesis and Antifungal Activity of Some
Organotin(IV) Carboxylates. Metal-Based Drugs. Vol. 5(4), pp 233-236. Butarbutar, S. L. dan Febrianto. 2009. Pengujian Mesin eDAQ untuk Mengukur
Laju Korosi. Sigma Epsilon. Vol. 13(2), hlm 54-58.
Butarbutar, S. L. dan G. N. Sunaryo. 2011. Analisis Mekanisme Pengaruh Inhibitor Siskem pada Material Baja Karbon. Prosiding Seminar Nasional Ke-17 Teknologi dan Keselamatan PLTN Serta Fasilitas Nuklir Yogyakarta. Hlm 559-566.
Costech Analytical Technologies. 2011. Elemental Combiustion System CHNS. http://costech analytical.com/. Diakses pada 28 Desember 2014.
Cotton, F. A. dan G. Wilkinson. 2007. Kimia Anorganik Dasar alih bahasa S. Suharto. Penerbit UI Press. Jakarta. Hlm 572-608.
Dalimunthe, I. S. 2004. Kimia dari Inhibitor Korosi. e-USU Repository. Medan. Hlm 1-8.
Day, R.A. dan A.L. Underwood. 1998. Analisis Kimia Kuantitatif Edisi Kelima. Alih bahasa A.H. Pudjaatmaka. Erlangga. Jakarta. Hlm 388-390.