ABSTRAK
SINTESIS DAN KARAKTERISASI SENYAWA TRIFENILTIMAH(IV) KLOROBENZOAT SEBAGAI ANTIKOROSI PADA BAJA LUNAK
Oleh
MUHAMAD NURISSALAM
Pada penelitian ini telah dilakukan sintesis, karakterisasi, dan uji aktifitas antikorosi pada baja lunak dari senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat, dan trifeniltimah(IV) 4-klorobenzoat dengan metode potensiostat. Sintesis senyawa trifeniltimah(IV) klorobenzoat dimulai dari sintesis trifeniltimah(IV) hidroksida dengan mereaksikan trifeniltimah(IV) klorida dengan NaOH dalam metanol. Kemudian senyawa ini direaksikan dengan ligan: (1) asam 2-klorobenzoat menghasilkan trifeniltimah(IV) 2-klorobenzoat, (2) asam 3-klorobenzoat menghasilkan trifeniltimah(IV) 3-klorobenzoat, dan (3) asam 4-klorobenzoat menghasilkan trifeniltimah(IV) 4-klorobenzoat. Ketiga senyawa memberikan rendemen kristal masing masing sebanyak 82,44; 82,87; dan 98,08 %, dengan waktu refluks 4 jam. Seluruh senyawa tersebut dikarakterisasi dengan menggunakan spektrofotometer IR, UV, 1H NMR, 13C NMR, dan mikroanalisis unsur dengan menggunakan microelemental analyzer. Aktivitas antikorosi senyawa-senyawa produk diujikan pada baja lunak memberikan efek inhibisi untuk senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat, dan trifeniltimah(IV) 4-klorobenzoat masing-masing sebesar 61,55; 56,52; dan 51,35% pada konsentrasi 100 mg/L.
ABSTRACT
THE SYNTHESIS AND CHARACTERIZATION OF TRIPHENYLTIN(IV) CHLOROBENZOATE AS ANTICORROSION FOR MILD STEEL
By
MUHAMAD NURISSALAM
In this research, the synthesis and characterization of triphenyltin(IV) 2-chlorobenzoate, triphenyltin(IV) 3-chlorobenzoate and triphenyltin(IV) 4-chlorobenzoate were succesfully performed and the anticorrosion activity tests on mild steel for these compounds have been performed using potensiostat method. The preparations of triphenlyltin(IV) chlorobenzoate compound series were commenced by the synthesis of triphenyltin(IV) hydroxide from triphenyltin(IV) chloride with NaOH in methanol. The triphenyltin(IV) hydroxide compound was then reacted with the ligands of 2-chlorobenzoic acid, 3-chlorobenzoic acid and 4-chlorobenzoic acid to produce triphenyltin(IV) 2-chlorobenzoate, triphenyltin(IV) 3-chlorobenzoate and triphenyltin(IV) 4-chlorobenzoate, respectively. The percentage yield of the synthesis of triphenyltin(IV) chlorobenzoate series at the optimum reflux time of 4 hours were 82.44; 82.87; and 98.08%. These compounds were well characterized by spectroscopy techniques of infra red (IR), ultraviolet (UV), 1H NMR and 13C NMR as well as based on the microelemental analysis. The results of anticorrosion test of the compunds synthesized toward mild steel showed that the percentage efficiency inhibition (%EI) values for the triphenyltin(IV) 2-chlorobenzoate, triphenyltin(IV) 3-chlorobenzoate and triphenyltin(IV) 4-chlorobenzoate were 61,55; 56,52 and 51,35%, respectively, at concentration of 100 ppm.
SINTESIS DAN KARAKTERISASI SENYAWA
TRIFENILTIMAH(IV) KLOROBENZOAT SEBAGAI ANTIKOROSI PADA BAJA LUNAK
Oleh
MUHAMAD NURISSALAM
Tesis
Sebagai Salah Satu Syarat untuk Memperoleh Gelar MAGISTER SAINS
Pada
Program Studi Pascasarjana Magister Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Kecamatan Sekampung, sekarang berada di wilayah kabupaten Lampung Timur, propinsi Lampung, 10 Maret 1979 sebagai anak kedua dari dua bersaudara, putra dari Bapak Suwarno dan Ibu Siti Romlah. Penulis menikah tahun 2004 dengan Eva andriani dan dianugerahi dua putri cantik, Fauzia Amrina Rosyada dan Marwah Nurvaza.
Persembahanku....
Dengan mengucap
Alhamdulillahirabbil’alamin kepada Allah SWT
Ku persembahkan karya kecilku ini
untuk bapak, ibu, dan Mertua tercinta yang
selalu dan tak pernah bosan memberikan
motivasi, nasehat, kasih sayang,
do’a dan
perhatiannya.
Istriku Eva Andriani yang tercinta,
pendamping setia, motivator, dan curahan
kasih dalam bahtera rumah tangga.
“
Kehidupan ini punya periode...
Dan setiap periode ada pertanggungjawaban
i
SANWACANA
Segala Puji bagi Allah, Rabb semesta alam atas nikmat-Nya yang tak terhingga, kasih sayang-Nya yang tak terbilang, serta nikmat persaudaraan yang senantiasa terjaga hingga hari ini sehingga penulis dapat menyelesaikan tesis yang berjudul Sintesis dan Karakterisasi Senyawa Trifeniltimah(IV) klorobenzoat sebagai Antikorosi pada Baja Lunak. Shalawat teriring salam semoga tersampaikan kepada Rasulullah SAW beserta keluarga dan sahabat serta umatnya di akhir zaman, Aamiin.
Teriring doa nan tulus jazaakumullah khaiiran katsir, penulis mengucapkan terima kasih kepada:
1. Bapak Prof. Sutopo Hadi, M. Sc., Ph. D. selaku Pembimbing I, Pembimbing Akademik sekaligus Kaprodi magister kimia, atas seluruh dedikasi yang beliau berikan selama menempuh pendidikan di kampus, atas semua kesabaran, keikhlasan, bimbingan dan nasihat yang diberikan hingga
penelitian dan tesis ini dapat terselesaikan. Semoga Allah membalas kebaikan beliau dengan baraakah yang tidak ternilai.
ii 3. Ibu Prof. Dr. Buhani, S.Pd. M.Si. selaku Pembahas dalam penelitian penulis
atas semua bimbingan, nasihat, dan kesabaran beliau sehingga tesis ini dapat terselesaikan. Semoga Allah membalasnya dengan kebaikan.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M. T. selaku Ketua Jurusan Kimia FMIPA Unila.
5. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas seluruh dedikasi dan ilmu yang diberikan selama penulis menempuh perkuliahan. Semoga Allah melimpahkan baraakah kepada Bapak dan Ibu. 6. Bapak Prof. Suharso, Ph.D. selaku dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
7. Bapak Prof. Dr. Sudjarwo, M.S. selaku Direktur Program Pascasarjana Universitas Lampung.
8. Bapak Dr. Rudy T.M. Situmeang, M.Sc. Selaku kepala laboratorium anorganik-fisik, Ibu Dra. Nuning Nurcahayani, M.Sc. selaku ketua jurusan biologi, dan Dra. Yulianty, M.Si. selaku kepala laboratorium botani yang telah memberikan izin dan kemudahan dalam penggunaan laboratorium sehingga dapat melaksanakan penelitian.
9. Teriring syukur ananda, untuk orang tuaku Bapak Suwarno dan Ibu Siti Romlah, atas seluruh cinta, kasih sayang, kesabaran, keikhlasan, doa serta semua dedikasi dalam mendidik ananda, semoga Allah membalas cintanya dengan jannah-Nya, aamiin Allahuma aamiin.
10. Isriku tercinta, Eva Andriani, kedua buah hati kami Fauzia Amrina Rosyada dan Marwah Nurvaza sebagai inspirator sekaligus motivator dalam
iii 11. Keluarga besarku, Kedua mertua, Mbak Sulistiyani, Uni Yanti, dan adinda
Almarum Hendriyanto, ante eli serta keponakan-keponakan atas kasih sayangnya dan doa untuk menyelesaikan tesis ini.
12. Adinda Hapin Apriyani yang sangat setia membantu penelitian kami, semoga Adinda diberikan kemudahan oleh Allah untuk semua urusan.
13. Teruntuk Pak Bambang, Bu Hastin serta teman teman peer anorganik, serta seluruh teman teman angkatan 2013 magister kimia untuk persaudaraan yang berdasar atas ukhuwah. Semoga Allah limpahkan kebaikannya.
14. Pimpinan kami disekolah, Pak Ruslani, Pak Roni, pak Wiwik dan semua teman-teman kerja yang sangat membantu kelancaran perkuliaan.
15. Mb Liza, Mb Putri, Mb Nora, Mas Nomo dan Pak Gani terima kasih atas seluruh bantuan yang diberikan kepada penulis.
16. Almamater tercinta, Universitas Lampung.
Penulis menyadari bahwa dalam penulisan tesis ini masih terdapat kekurangan dan kesalahan, untuk itu penulis mengharapkan kritik dan saran yang membangun demi perbaikan penulisan dimasa mendatang.
Bandar Lampung, 2 Mei 2015 Penulis
iv
D. Senyawa Organotimah (IV) karboksilat... 10
E. Asam Klorobenzoat ... 13
F. Karakterisasi Senyawa Trifeniltimah(IV) klorobenzoat ... 15
G. Baja Lunak HRP ... 18
H. Korosi ... 19
1. Korosi Galvanis (Bimetal Corrosion) ... 21
2. Korosi Sumuran (Pitting Corrosion) ... 21
3. Korosi Erosi (Errosion Corrosion) ... 21
4. Korosi Regangan (Stress Corrosion) ... 22
5. Korosi Celah (Crevice Corrosion) ... 22
6. Korosi Kavitasi (Cavitation Corrosion) ... 22
7. Korosi Lelah (Fatigue Corrosion) ... 23
8. Korosi Antar Butiran (Intergranular Corrosion) ... 23
I. Reaksi pada Baja ... 23
J. Korosi Baja dalam Larutan HCl-DMSO ... 25
K. Antikorosi ... 27
L. Metode Karakterisasi Korosi ... 29
v
III. METODE PENELITIAN ... 36
A. Waktu dan Tempat Penelitian ... 36
B. Alat dan Bahan ... 36
C. Metode Penelitian... 37
1. Sintesis senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH] .... 37
2. Sintesis senyawa trifeniltimah(IV) klorobenzoat ... 38
3. Preparasi Baja Lunak ... 38
4. Pembuatan Medium Korosif ... 39
5. Pembuatan Larutan Inhibitor... 39
6. Pengaturan Pemindaian dengan Potensiostat ... 39
7. Pengujian Korosi ... 40
8. Analisis Data ... 41
9. Pengujian Morfologi Korosi pada Baja Lunak secara Kualitatif . 42 IV. HASIL DAN PEMBAASAN... 43
A. Sintesis Senyawa Trifeniltimah(IV) hidroksida... 43
B. Sintesis Senyawa-senyawa Trifeniltimah(IV) klorobenzoat ... 47
C. Preparasi Baja Lunak... 61
D. Pengujian Aktivitas Antikorosi Ligan Asam klorobenzoat... 62
E. Pengujian Aktivitas Antikorosi Trifeniltimah(IV) klorida ... 70
F. Pengujian Aktivitas Antikorosi Trifeniltimah(IV) hidroksida... 73
G. Pengujian Aktivitas Antikorosi Trifeniltimah(IV) klorobenzoat .. .. 76
H. Analisis Kualitatif Permukaan Baja ... 84
I. Mekanisme Inhibisi Korosi Trifeniltimah(IV) klorobenzoat... 87
V. SIMPULAN DAN SARAN... 97
A. Simpulan ... 97
B. Saran ... 98 DAFTAR PUSTAKA
vi
DAFTAR TABEL
Tabel Halaman
1. Penggunaan timah dibeberapa sektor ... 6
2. Perbandingan antikorosi beberapa material terhadap logam alumunium pada media elektrolit ... 12
3. Harga pKa untuk beberapa asam benzoat ... 14
4. Bilangan gelombang untuk gugus fungsi yang terdapat dalam senyawa trifeniltimah(IV) klorida, trifeniltimah(IV) hidroksida, dan trifeniltimah(IV) klorobenzoat ... 17
5. Data komposisi unsur (%) C dan H teoritis ... 18
6. Persen unsur-unsur kimia pada baja lunak HRP ... ... 19
7. Persen Efisiensi Inhibitor (%EI) korosi dengan beberapa senyawa trifeniltimah(IV) dan di-n-butiltimah(IV) menggunakan ligan 1-phenyl-2,5-dithiohydrazodicarbonamide. ... 35
8. Persen rendemen sintesis trifeniltimah(IV) hidroksida... 44
9. Pengamatan waktu refluks terhadap pembentukan trifeniltimah(IV) 2-klorobenzoat pada suhu 60ºC ... 49
10. Pengamatan waktu refluks terhadap pembentukan trifeniltimah(IV) 3-klorobenzoat pada suhu 60ºC... 50
11. Pengamatan waktu refluks terhadap pembentukan trifeniltimah(IV) 4-klorobenzoat pada suhu 60ºC ... 50
12. Perbandingan pergeseran λmax senyawa awal, ligan dan hasil sintesis ... 56
13. Spektra 1H dan 13C pada senyawa hasil sintesis ... 60
vii 15. Data efisiensi inhibisi penambahan senyawa asam 2-klorobenzoat,
asam 3-klorobenzoat, asam 4-klorobenzoat dibandingkan kontrol DMSO-HCl... ... 66 16. Data efisiensi inhibisi penambahan senyawa trifeniltimah(IV) klorida
dibandingkan kontrol DMSO-HCl ... 73 17. Data efisiensi inhibisi penambahan senyawa trifeniltimah(IV) hidroksida
dibandingkan kontrol DMSO-HCl... 75 18. Data efisiensi inhibisi penambahan senyawa trifeniltimah(IV)
2-klorobenzoat, senyawa trifeniltimah(IV) 2-klorobenzoat, senyawa
xi
DAFTAR LAMPIRAN
Lampiran Halaman 1. Persentase berat senyawa trifeniltimah(IV) hidroksida
[(C6H5)3SnOH] hasil sintesis... 104
2. Persentase berat senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat dan trifeniltimah(IV) 4-klorobenzoat hasil
sintesis... 105 3. Perhitungan data mikroanalisis untuk senyawa trifeniltimah(IV)
viii
DAFTAR GAMBAR
Gambar Halaman 1. Struktur senyawa trifeniltimah(IV) klorida ... 13 2. Asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat ... 15 3. Hot Roller Plate ... 18 4. Contoh skematik korosi pada permukaan besi dalam lingkungan berair .... 24 5. Struktur Dimethyl sulfoxide (DMSO) ... 26 6. ER466 Integrated Potentiostat System eDAQ ... 31 7. Sel tiga elektroda yang dihubungkan dengan alat potensiostat dan
komputer dengan perangkat lunak EChem ... 31 8. Kurva polarisasi pada korosi baja ... 32 9. Kurva ekstrapolasi Tafel ... 34 10. Spektrum UV (a) trifeniltimah(IV) hidroksida (b) trifeniltimah(IV)
klorida... 44 11. Spektrum IR (a) trifeniltimah(IV) klorida, (b) trifeniltimah(IV)
hidroksida... 46
12. Mekanisme reaksi (a) trifeniltimah(IV) 2-klorobenzoat (b) trifeniltimah(IV) 3-klorobenzoat (c) trifeniltimah(IV)
4-klorobenzoat... 48 13. Kristal senyawa (a) trifeniltimah(IV) 2-klorobenzoat,
ix 14. Spektrum IR (a) trifeniltimah(IV) hidroksida, (b) trifeniltimah(IV)
2-klorobenzoat, (c) trifeniltimah(IV) 3-klorobenzoat (d) trifeniltimah(IV) 4-klorobenzoat... 53 15. Spektrum UV (a) trifeniltimah(IV) hidroksida (b) trifeniltimah(IV)
2-klorobenzoat, (c) trifeniltimah(IV) 3-2-klorobenzoat, (d) trifeniltimah(IV) 4-klorobenzoat ... 55 16. Spektrum 1H NMR (a) trifeniltimah(IV) 2-klorobenzoat,
(b) trifeniltimah(IV) 3-klorobenzoat, (c) trifeniltimah(IV) 4-klorobenzoat ... 57 17. Spektrum 13C NMR (a) trifeniltimah(IV) 2-klorobenzoat,
(b) trifeniltimah(IV) 3-klorobenzoat, (c) trifeniltimah(IV) 4-klorobenzoat 58 18. (a) trifeniltimah(IV) 2-klorobenzoat (b) trifeniltimah(IV) 3-klorobenzoat,
dan (c) trifeniltimah(IV) 4-klorobenzoat ... 59 19. (a) Potongan baja sebelum diamplas dan (b) Potongan baja setelah
diamplas ... 62 20. Grafik hasil pemindaian senyawa asam 2-klorobenzoat, asam 2-klorobenzoat,
asam 2-klorobenzoat terhadap kontrol medium korosif tanpa inhibitor .... . 64 21. Grafik persen efisiensi inhibisi ligan asam 2-klorobenzoat, asam
3-klorobenzoat dan asam 4-3-klorobenzoat... 69 22. Grafik hasil pemindaian senyawa trifeniltimah(IV) klorida
terhadap kontrol medium korosif tanpa inhibitor... 72 23. Grafik hasil pemindaian senyawa trifeniltimah(IV) hidroksida terhadap
kontrol medium korosif tanpa inhibitor... 74 24. Grafik persen efisiensi inhibisi trifeniltimah(IV) klorida dibandingkan
dengan trifeniltimah(IV) hidroksida ... 76 25. Grafik hasil pemindaian senyawa trifeniltimah(IV) 2-klorobenzoat,
trifeniltimah(IV) 3-klorobenzoat, trifeniltimah(IV) 4-klorobenzoat
terhadap kontrol medium korosif tanpa inhibitor... 78 26. Grafik persen efisiensi inhibisi trifeniltimah(IV) 2-klorobenzoat,
trifeniltimah(IV) 3-klorobenzoat, dan trifeniltimah(IV) 4-klorobenzoat... 82 27. Perendaman permukaan baja pada (a) medium korosif tanpa inhibitor, (b)
penambahan senyawa trifeniltimah(IV) 2-klorobenzoat, (c) penambahan senyawa trifeniltimah(IV) 3-klorobenzoat, (d) penambahan senyawa
x 28. Permukaan baja pada (a) medium korosif tanpa inhibitor
(b) penambahan senyawa trifeniltimah(IV) 2-klorobenzoat, (c) penambahan senyawa trifeniltimah(IV) 3-klorobenzoat, dan
(d) penambahan senyawa trifeniltimah(IV) 4-klorobenzoat ... 86 29. Kurva polarisasi anoda (a) trifeniltimah(IV) 2-klorobenzoat (b)
trifeniltimah(IV) 3-klorobenzoat, dan (c) trifeniltimah(IV) 4-klorobenzoat... 90 30. Kurva polarisasi katoda (a) trifeniltimah(IV) 2-klorobenzoat (b)
trifeniltimah(IV) 3-klorobenzoat, dan (c) trifeniltimah(IV) 4-klorobenzoat. ... 91 31. Skema proses korosi baja karbon dalam larutan asam (diadopsi dari
I. PENDAHULUAN
A. Latar Belakang Masalah
Korosi merupakan salah satu permasalahan penting yang harus dihadapi oleh berbagai sektor industri di Indonesia terutama industri-industri menggunakan material dasar logam dari produk yang dihasilkan. Korosi terjadi pada peralatan yang menggunakan material dasar logam seperti mobil, jembatan, mesin, pipa, kapal, dan lain sebagainya (Rieger, 1992). Indonesia adalah negara kepulauan yang beriklim tropis serta memiliki bentang laut luas, dengan tingkat humiditas tinggi maka proses korosi adalah sesuatu yang tidak dapat hindarkan. Kerugian akibat korosi di Indonesia diperkirakan mencapai angka triliun rupiah,
perhitungan ini meliputi kehilangan jam produksi, ganti rugi kerusakan, klaim-klaim, biaya perbaikan, resiko kecelakaan kerja, pencemaran lingkungan dan kurangnya keandalan peralatan produksi yang mengakibatkan waktu
berproduksinya berkurang serta kerugian waktu, sehingga korosi harus dikendalikan mengingat arti penting pengendalian korosi (Widharto, 1999).
2 diakibatkan oleh reaksi reduksi-oksidasi yang terjadi pada logam dengan berbagai zat yang ada di lingkungan sekitarnya sehingga menghasilkan suatu senyawa yang tidak dikehendaki (Alwi dan Kusuma, 2012). Pengaruh berbagai zat dari
lingkungan ini menyebabkan korosi tidak dapat dihindari, namun hanya dapat dicegah atau dikendalikan. Laju korosi dapat mengalami penurunan pada daerah anodik disebabkan karena terbentuknya lapisan pasif sehingga laju transfer ion-ion logam ke dalam larutan menjadi berkurang (Siregar, 2010). Pengendalian korosi dapat dilakukan dengan menggunakan bahan kimia sebagai antikorosi. Berbagai senyawa dengan sifat antikorosi telah diuji efektifitasnya diantaranya senyawa aniline-4-sulfonate (Fadli, 2011), polianilin-TiO2 (Permana dan Darminto, 2012), dan kalsium stearat (Siregar,
2010).
3 baja atau logam lain mampu menghambat 25 hingga 100 kali terhadap korosi dibandingkan tanpa antikorosi atau dengan antikorosi lain (Singh et al., 2010).
Pada penelitian ini akan disintesis senyawa golongan organotimah(IV)
klorobenzoat dengan bahan awal trifeniltimah(IV) klorida dengan berbagai jenis senyawa asam klorobenzoat sebagai ligan yang diharapkan mendapatkan titik aktif senyawa hasil sintesis untuk menghambat perkaratan baja lunak Hot Roller Plate (HRP) dalam medium korosif Dimethyl sulfoxide-asam klorida (DMSO-HCl) dan uji antikorosi menggunakan metode polarisasi potensiodinamik untuk memonitor laju korosi yang terjadi. Penelitian ini diharapkan akan mendapatkan bahan antikorosi pada baja lunak HRP yang paling efektif dari senyawa-senyawa hasil sintesis.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mensintesis dan mengkarakterisasi senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat, dan trifeniltimah(IV) 4-klorobenzoat. 2. Menguji beberapa senyawa trifeniltimah(IV) klorobenzoat hasil sintesis
sebagai antikorosi pada baja lunak HRP dalam medium korosif DMSO-HCl. 3. Menentukan senyawa trifeniltimah(IV) klorobenzoat hasil sintesis yang
4 C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Timah
Timah dengan nama latin stannum (Sn) merupakan unsur golongan IVA (grup 14) periode 5 dalam tabel periodik, mempunyai berat molekul 118,69 dan nomor atom 50 mempunyai titik leleh 231,968 ºC, titik didih 2270 ºC dan telah dikenal sejak ribuan tahun yang lalu. Logam ini berada dalam 3 bentuk alotrop dibawah suhu 13,2 ºC berada dalam bentuk-α (berupa serbuk berwarna abu abu) dan pada pemanasan bentuk -α berubah menjadi bentuk – (berwarna putih yang
merupakan bentuk logam dikenal). Pada pemanasan suhu antara 161 ºC sampai dengan titik lelehnya di sebut bentuk – . Timah dengan bilangan oksidasi +2, +4 lebih cenderung ke logam berwarna putih keperakan, dapat ditempa dan ditarik, cukup tahan dari pengaruh udara (bila dipanaskan membentuk oksidanya SnO2,
mudah bereaksi dengan asam kuat dan juga basa kuat dengan membentuk asam stannat, H2SnO3 (adanya O2dalam larutan dapat mempercepat reaksi ini
(Mulyono, 2006).
Timah dalam bentuk senyawannya memiliki tingkat oksidasi +2 dan +4, tingkat oksidasi +4 lebih stabil daripada +2. Pada tingkat oksidasi +4, timah
6 Tetapi perbedaan energi antara kedua tingkat ini rendah (Cotton dan Wilkinson, 2007).
Di Indonesia pemanfaatan timah dalam senyawa sintesis seperti organologam belum berkembang pesat. Logam timah dimanfaatkan sebagai bahan baku cendera mata, industri, dan elektronik. Kegunaan timah lainnya dapat dijelaskan pada Tabel 1.
Tabel 1. Penggunaan timah dibeberapa sektor.
No Sektor Contoh
1. Industri Material kontruksi bangunan, campuran cat, pelapis plastik, industri mesin, lampu bohlam, stick golf, dan industri peralatan perang.
2. Kesehatan Kapsul botol minuman, pengalengan makanan, dan penambalan gigi.
3. Elektronik TV, radio, papan sirkuit, kamera, telepon dan komputer. 4. Perhiasan Cincin, kalung, dan gelang.
(Sumber: PT Timah Tbk, 2012).
Beberapa penelitan bidang anorganik telah mengembangkan senyawa
7 B. Senyawa Organologam
Senyawa-senyawa anorganik menunjukkan variasi tidak hanya dalam tingkat oksidasi, jenis senyawa, bentuk, dan tipe reaksi akan tetapi juga manfaat yang beragam tergantung jenis senyawa yang disintesis atau dihasilkan (Shriver et al, 2006).
Senyawa organologam merupakan senyawa dimana terdapat minimal satu ikatan langsung antara atom karbon dari gugus organik dengan atom logam. Senyawa yang mengandung ikatan karbon dengan fosfor, arsen, silikon, ataupun boron termasuk kedalam senyawa organologam. Tetapi untuk senyawa yang
mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, atau dengan suatu halogen tidak termasuk sebagai senyawa organologam
(Cotton dan Wilkinson, 2007).
Berdasarkan sifat keelektronegatifannya, pada umumnya unsur-unsur yang berikatan dengan karbon berada pada bilangan oksidasi negatif, turunan organiknya sebagai senyawaan organik. Turunan senyawa organik dimana unsur-unsur yang berikatan dengan karbon berada pada oksidasi positif, termasuk senyawaan organologam (Tayer, 1988).
Berdasarkan ikatannya, organologam dikelompokkan menjadi tiga golongan:
1. Senyawa ionik dari logam elektropositif
8 Senyawa-senyawa ini tidak stabil di udara, mudah terhidrolisis dalam air dan tidak larut dalam pelarut hidrokarbon. Kestabilannya bergantung pada kestabilan radikal organiknya.
2. Senyawa organologam dengan ikatan σ (sigma)
Senyawa ini memiliki ikatan σ dua pusat dua elektron yang terbentuk antara
gugus organik dan atom logam dengan keelektropositifan rendah. Pada umumnya, senyawa organologam dengan ikatan ini memiliki ikatan utama kovalen dan sifat kimianya adalah dari kimiawi karbon yang disebabkan karena beberapa faktor, yaitu kemungkinan penggunaan orbital d yang lebih tinggi, kemampuan donor alkil atau aril dengan pasangan elektron menyendiri, keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh dan pengaruh perbedaan keelektronegatifan antara ikatan logam-karbon (M-C) atau karbon-karbon (C-C).
1. Senyawa organologam dengan ikatan nonklasik
Dalam senyawa organologam dengan ikatan nonklasik ini terdapat jenis ikatan antara logam dengan karbon yang tidak dapat dijelaskan secara ikatan ionik atau pasangan elektron. Senyawa ini terbagi menjadi dua golongan:
a. Senyawa organologam yang terbentuk antara logam-logam transisi dengan alkena, alkuna, benzena dan senyawa organik tak jenuh lainnya. b. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan.
9 C. Senyawa Organotimah
Senyawa-senyawa organotimah merupakan senyawa organologam yang didalam strukturnya terdapat satu atau beberapa ikatan antara atom timah (Sn), dengan atom karbon, C (Sn – C). Senyawa-senyawa ini diperoleh sebagai turunan dari RnSnX4-n(n = 1-4; dan X = halogen, OH, OR, S, sisa asam, hidrida). Sebagian
besar senyawa ini dapat dianggap sebagai turunan dari RnSnX4-n (n = 1-4) dan
diklasifikasikan sebagai mono-, di-, tri-, dan tetra- organotimah(IV), tergantung dari jumlah alkil (R) atau aril(Ar) yang terikat pada atom logam. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002).
Senyawa organotimah merupakan monomer yang dapat membentuk
makromolekul stabil, padat dan cairan yang sangat mudah menguap dan tidak berwarna serta stabil terhadap hidrolisis dan oksidasi. Atom halogen, khususnya klor yang dimiliki oleh senyawa organotimah mudah lepas dan berikatan
dengan senyawa yang mengandung logam natrium atau ion logam positif lainnya. Meskipun kekuatan ikatannya bervariasi, akan tetapi atas dasar sifat itulah
senyawa-senyawa turunan organotimah dapat disintesis. Senyawa turunan organotimah yang berhasil disintesis pertama kali tahun 1971 adalah
[MeSn(4-anisil)(1-naftil)(CH2CH2C(OH)Me2)] (Greenwood and Earnshaw,
10 membedakan berbagai penstabil timah yaitu, asam tioglikolat ester dan asam karboksilat (Van Der Weij, 1981).
Ketertarikan terhadap senyawa organotimah(IV) tidak hanya karena sifat kimia dan strukturnya yang sangat menarik (Tiekink, 1991; Shahid et al., 2003; Bhatti et al., 2005), tetapi juga karena penggunaannya yang terus meningkat. Senyawa organotimah diketahui memiliki aktivitas biologis yang kuat. Aktivitas ini dipengaruhi oleh jumlah dan gugus organik yang terikat pada pusat atom Sn. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa penstabil PVC, pestisida nonsistematik, katalis antioksidan, antifouling agent dalam cat, penstabil pada plastik dan karet sintetik, sebagai stabilizer untuk parfum dan berbagai macam peralatan yang berhubungan dengan medis dan gigi. Salah satu pemanfaatan organotimah lainnya adalah sebagai antikorosi yang merupakan senyawa golongan organotimah(IV) karboksilat dan turunannya Rastogi et al., 2005; Singh et al., 2010; Rastogi et al., 2011).
D. Senyawa Organotimah(IV) karboksilat
Senyawa organotimah(IV) karboksilat dapat disintesis melalui organotimah oksida atau organotimah hidroksidanya dengan garam karboksilat dan dari organotimah halidanya dengan garam karboksilat (Cotton dan Wilkinson, 2007). Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau
hidroksida dilakukan seperti pada reaksi berikut:
R2SnO + β R’COOH R2Sn(OCOR’)2 + H2O
11 Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah menggunakan organotimah halida sebagai material awal, dalam penelitian ini adalah trifeniltimah(IV) klorida. Penggantian ligan klor menghasilkan trifeniltimah(IV) hidroksida yang selanjutnya direaksikan dengan ligan asam klorobenzoat. Tahapan ini dilakukan supaya pemisahan dari hasil samping lebih mudah dibandingkan langsung mereaksikan organotimah(IV) halida dengan asam klorobenzoat.
Dari beberapa penelitian yang telah dilaporkan, dengan adanya senyawa organotimah(IV) dalam baja atau logam lain, akan meningkatkan ketahanan material tersebut terhadap korosi dibandingkan tanpa antikorosi atau bahan antikorosi jenis lain. Hasil penelitian tentang antikorosi berbagai jenis organotimah(IV) dengan ligan aktif asam karboksilat yang dilaporkan
menunjukkan peningkatan ketahanan material yang cukup tinggi (25 kali atau bahkan mencapai 100 kali lebih mampu menahan korosi dibandingkan tanpa antikorosi atau bahkan dengan antikorosi yang lain) disajikan pada Tabel 2. Berdasarkan hasil pengujian terhadap logam alumunium sebuah logam yang cukup kuat terhadap korosi pada media berion seperti air laut atau media yang berminyak (Singh et al., 2010). Namun untuk turunan tributiltimah(IV) karboksilat tidak boleh dilakukan sintesis lagi karena telah dilarang
12 Tabel 2. Perbandingan antikorosi beberapa material terhadap logam alumunium
pada media elektrolit.
berkarat dan semakin
banyak dengan
bertambahnya hari
2 x
2 Pentaklorofenol 10 hari Permukaan logam berkarat semakin bertambah dengan bertambahnya hari
5 x
3 Dirodanometana 20 hari Perkaratan permukaan logam lebih lambat dibandingkan bahan no. 2 dengan bertambahnya hari
10 x
4
Tri-n-butiltimahasetat
30 hari Perkaratan permukaan logam lebih lambat dibandingkan bahan no. 2 dan 3 dengan bertambahnya hari
15 x
5 Tri-n -butiltimah-t-butoksiasetat
250 hari Perkaratan terjadi sangat lambat dan memerlukan waktu yang sangat lama
(Sumber: Singh et al., 2010)
Berdasarkan uraian di atas dan pengamatan yang ditampilkan pada Tabel 2, maka penelitian yang dipilih dan direncanakan ini sangat penting dilakukan sebagai dasar untuk melakukan pengujian lebih lanjut kemampuan senyawa organotimah (IV) sebagai bahan antikorosi. Trifeniltimah(IV) dengan berbagai ligan
13 Penelitian ini menggunakan trifeniltimah(IV) klorida sebagai bahan awal dalam sintesis berbagai jenis senyawa trifeniltimah(IV) klorobenzoat. Trifeniltimah(IV) klorida merupakan senyawa organologam dengan atom pusat timah (Sn) dengan bilangan koordinasi 4 yang mengikat 3 gugus fenil dan satu gugus klor seperti disajikan pada Gambar 1.
Gambar 1. Struktur senyawa trifeniltimah(IV) klorida.
Senyawa yang diharapkan dari sintesis yang akan dilakukan adalah trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat dan trifeniltimah(IV) 4-klorobenzoat dengan bahan awal trifeniltimah(IV) klorida dengan ligan asam 2-klorobenzoat, 3-klorobenzoat dan 4-klorobenzoat.
E. Asam Klorobenzoat
Asam klorobenzoat adalah asam benzoat tersubstitusi dengan kekuatan asam dari asam benzoat akan mengalami perubahan oleh adanya substituen elektronegatif. Sebagai perbandingan Tabel 3 memberikan data pKa dari tiap jenis asam
karboksilat dengan berbagai subtituen pada posisi orto, meta dan para.
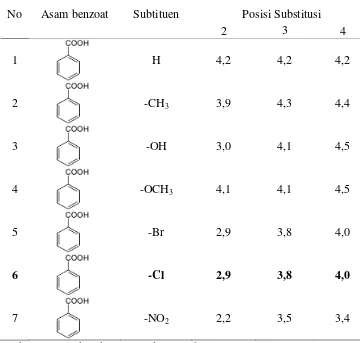
14 dengan efek induktifnya. Tanpa memperhatikan posisi substitusi, suatu gugus penarik elektron biasanya akan menaikkan keasaman suatu asam benzoat. (Fessenden dan Fessenden, 1986).
Tabel 3. Harga pKa untuk beberapa asam benzoat.
No Asam benzoat Subtituen Posisi Substitusi
2 3 4
1 H 4,2 4,2 4,2
2 -CH3 3,9 4,3 4,4
3 -OH 3,0 4,1 4,5
4 -OCH3 4,1 4,1 4,5
5 -Br 2,9 3,8 4,0
6 -Cl 2,9 3,8 4,0
7 -NO2 2,2 3,5 3,4
(Sumber: Fessenden dan Fessenden, 1986)
Asam klorobenzoat dengan posisi klor yang berbeda yaitu 2-klorobenzoat, 3-klorobenzoat, 4-klorobenzoat memiliki rumus molekul C7H5ClO2 dan berat
15 Struktur dari asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam
4-klorobenzoat dapat dilihat pada Gambar 2.
a b c
Gambar 2. Senyawa asam klorobenzoat (a) asam 2-klorobenzoat (b) asam 3-klorobenzoat dan (c) asam 4-3-klorobenzoat.
F. Karakterisasi Senyawa Trifeniltimah(IV) klorobenzoat
Hasil sintesis berbagai senyawa trifeniltimah(IV) klorobenzoat dikarakterisasi menggunakan beberapa jenis instrumen kimia untuk memberikan penguatan terhadap struktur senyawa yang disintesis. Karakterisasi yang dilakukan
menggunakan spektrofotometer UV, spektrofotometer Inframerah (IR), 1H NMR,
13
C NMR, dan microelemental analyzer.
Pada spektroskopi UV-Vis, spektrum tampak (vis) terentang antara 400 nm (ungu) sampai 750 (merah) sedangkan spektrum ultraviolet (UV) terentang antara 200-400 nm. Informasi yang diperoleh dari spektroskopi ini yaitu adanya ikatan rangkap atau ikatan terkonjugasi dan gugus kromofor yang terikat pada
16 Pergantian ligan dapat diamati dengan adanya pergeseran λmax untuk transisi
elektron ππ* ketika ligan klorida tergantikan dengan ligan hidroksi (lebih bersifat penarik elektron) sehingga bergeser ke arah λmax yang lebih panjang,
sedangkan untuk transisi nπ* mengalami pergeseran batokromik. Transisi elektronik ππ* dapat terlihat dari ikatan konjugasi gugus fenil dan memberikan λmax tertentu yangberasal dari elektron menyendiri atom O yang terdapat pada
gugus kromofor pada ligan asam klorobenzoat. Semua molekul dapat menyerap radiasi dalam daerah UV-tampak karena mereka mengandung elektron, baik sekutu maupun menyendiri, yang dapat dieksitasikan ke tingkat energi yang lebih tinggi (Day dan Underwood, 1998).
Serapan pergantian Sn-Cl pada trifeniltimah(IV) klorida yang telah tergantikan dengan serapan Sn-OH dapat dilihat dari perubahan puncak bilangan gelombang pada IR, yang menandakan bahwa senyawa antara berupa trifeniltimah(IV) hidroksida telah terbentuk. Serapan lain yang muncul yaitu serapan C-H aromatik yang berasal dari gugus fenil dan vibrasi ulur C=C. Pengamatan juga dilakukan pada serapan Sn-O-C, Sn-O, C=O, C-Cl. Pergeseran bilangan dapat dilihat pada Tabel 4.
17 pergeseran kimia adalah satu-satunya informasi yang dihasilkan oleh spektroskopi NMR, nilai informasi dalam penentuan struktural senyawa organik sangat besar maknanya. Selain itu, spektroskopi NMR dapat memberikan informasi tambahan, yakni informasi yang terkait dengan kopling spin-spin (Takeuchi, 2006).
Tabel 4. Bilangan gelombang untuk gugus fungsi yang terdapat dalam senyawa trifeniltimah(IV) klorida, trifeniltimah(IV) hidroksida dan
trifeniltimah(IV) klorobenzoat.
Senyawa Gugus fungsi Bilangan gelombang (cm-1)
Trifeniltimah(IV) klorida Sn-Cl 500-330
Trifeniltimah(IV) hidoksida Sn-OH 3500-3100
Trifeniltimah(IV) klorobenzoat (Sumber: Fessenden dan Fessenden, 1986).
Untuk mengetahui kandungan penyusun suatu senyawa dilakukan menggunakan microelemental analyzer. Unsur yang umum ditentukan adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Alat yang biasanya digunakan untuk tujuan mikroanalisis ini dikenal sebagai CHNS microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini selanjutnya dibandingkan dengan
perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costech Analytical Technologies, 2011). Prinsip dasar dari
18 dengan detektor yang sesuai. Sampel yang diketahui jenisnya, dapat diperkirakan beratnya dengan menghitung setiap berat unsur yang diperlukan untuk mencapai nilai kalibrasi terendah atau tertinggi (Caprette, 2007). Senyawa hasil disintesis dikatakan murni jika perbedaan hasil yang diperoleh dari mikroanalisis
dibandingkan dengan perhitungan secara teori masih berkisar antara 1-5%. Data teoritis dari atom C dan H pada senyawa-senyawa yang menjadi target penelitian disajikan pada Tabel 5.
Tabel 5. Data komposisi unsur (%) C dan H teoritis.
Senyawa Komposisi unsur (%) teoritis
C H
[(C6H5)3Sn(OH) ] 58,91 4,40
[(C6H5)3Sn(o-C6H4(Cl)COO)] 59,33 3,75
[(C6H5)3Sn(m-C6H4(Cl)COO)] 59,33 3,75
[(C6H5)3Sn(p-C6H4(Cl)COO)] 59,33 3,75
G. Baja Lunak HRP
Pada penelitian ini digunakan baja berkarbon rendah yang diproses melalui pemanasan dan berupa lembaran, salah satu jenis ini yang dikenal dengan nama HRP. Contoh baja jenis ini seperti terdapat pada Gambar 3. Spesimen baja karbon memiliki komposisi seperti terlihat pada Tabel 6.
19 Tabel 6. Persen unsur-unsur kimia pada baja lunak HRP.
(Sumber: Butarbutar dan Sunaryo, 2011)
H. Korosi
Korosi adalah proses kerusakan/degradasi pada material akibat berinteraksi dengan lingkunganya. National Association of Corrosion Engineers (NACE) International mendefinisikan korosi sebagai kerusakan atau degradasi sifat sifat logam oleh lingkungan korosif. Terkorosinya suatu logam dalam lingkungan elektrolit (air) adalah suatu proses elektrokimia. Proses ini terjadi bila ada reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron tersebut (reaksi reduksi pada katodik). Kedua reaksi ini akan terus berlangsung sampai terjadi kesetimbangan dinamis dimana jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima (Butarbutar dan Sunaryo, 2011).
Hampir semua logam yang mempunyai kemampuan membentuk lapisan pasif yang bersifat protektif pada permukaannya. Lapisan pasif ini biasanya terbentuk dari oksida logam atau senyawa lain yang akan memisahkan logam dari media, biasanya berupa larutan. Namun bila logam pasif itu berkontak dengan media
Informasi kimia untuk Baja lunak HRP
Unsur Persentase (%)
C 0,42-0,5
Fe 98,51-98,98
Mn 0,6-0,9
P 0,04 maksimal
20 yang mengandung ion-ion agresif misalanya ion klor (Cl-), ion flour (F-), dan sulfat (SO42-) maka korosi dapat terjadi (Butarbutar dan Febrianto, 2009).
Secara garis besar korosi ada dua jenis yaitu korosi internal dan korosi eksternal. Korosi internal yaitu korosi yang terjadi akibat adanya kandungan CO2 dan H2S
pada minyak bumi, sehingga apabila terjadi kontak dengan air akan membentuk asam yang merupakan penyebab korosi. Pada korosi eksternal, korosi yang terjadi pada bagian permukaan dari sistem perpipaan dan peralatan, baik yang kontak dengan udara bebas dan permukaan tanah, akibat adanya kandungan zat asam pada udara dari tanah (Halimatuddahliana, 2003).
21 Berbagai jenis korosi yang umum terjadi pada logam sebagai berikut:
1. Korosi Galvanis (Bimetal Corrosion)
Disebut juga korosi dwilogam yang merupakan perkaratan elektrokimiawi apabila dua macam metal yang berbeda potensial dihubungkan langsung di dalam elektrolit yang sama. Elektron akan mengalir dari metal yang kurang mulia (anodik) menuju ke metal yang lebih mulia (katodik). Akibatnya metal yang kurang mulia berubah menjadi ion-ion positif karena kehilangan
elektron. Ion-ion positif metal bereaksi dengan ion-ion negatif yang berada di dalam elektrolit menjadi garam metal. Karena peristiwa ini, permukaan anoda kehilangan metal sehingga terbentuk sumur-sumur karat atau jika merata akan terbentuk karat permukaan.
2. Korosi Sumuran (Pitting Corrosion)
Korosi sumuran adalah korosi yang terjadi karena komposisi logam yang tidak homogen dan ini menyebabkan korosi yang dalam pada berbagai tempat. Dapat juga adanya kontak antara logam, maka pada daerah batas akan timbul korosi berbentuk sumur.
3. Korosi Erosi (Errosion Corrosion)
22 4. Korosi Regangan (Stress Corrosion)
Gaya-gaya seperti tarikan (tensile) atau kompresi (Compressive) berpengaruh sangat kecil pada proses pengkaratan. Adanya kombinasi antara regangan tarik (tensile stress) dan lingkungan yang korosif, maka akan terjadi kegagalan material berupa retakan yang disebut retak karat regangan.
5. Korosi Celah (Crevice Corrosion)
Korosi yang terjadi pada logam yang berdempetan dengan logam lain atau non logam dan diantaranya terdapat celah yang dapat menahan kotoran dan air sebagai sumber terjadinya korosi. Konsentrasi oksigen pada mulut lebih kaya dibandingkan pada bagian dalam, sehingga bagian dalam lebih anodik dan bagian mulut menjadi katodik. Maka terjadi aliran arus dari dalam menuju mulut logam yang menimbulkan korosi.
6. Korosi Kavitasi (Cavitation Corrosion)
Terjadi karena tingginya kecepatan cairan menciptakan daerah-daerah
23 7. Korosi Lelah (Fatigue Corrosion)
Bila logam mendapat beban siklus yang berulang-ulang, tetapi masih di bawah batas kekuatan luluhnya. Maka setelah sekian lama akan patah karena
terjadinya kelelahan logam. Kelelahan dapat dipercepat dengan adanya serangan korosi. Kombinasi antara kelelahan dan korosi yang mengakibatkan kegagalan disebut korosi lelah. Korosi lelah terjadi di daerah yang menderita beban.
8. Korosi batas butir (intergranular corrosion)
Korosi yang terjadi pada perbatasan butiran yang dapat menyebabkan
hilangnya kekuatan (strength) dan keuletan (ductility). Batas butir pada area tertentu bertindak sebagai anoda dalam kondisi kontak dengan area yang luas dari butiran bertindak sebagai katoda (Fontana, 1986).
Umumnya problem korosi disebabkan oleh air, tetapi ada beberapa faktor selain air yang mempengaruhi laju korosi. Faktor-faktor yang mempengaruhi laju korosi diantaranya adalah faktor gas terlarut, temperatur, pH, bakteri pereduksi, padatan terlarut (Halimatuddahliana, 2003).
I. Reaksi pada Baja
24 maka besi hidroksida akan mengikat air dan terbentuk besi oksida hidrat (Fe2O3. n
H2O). Reaksi yang terjadi diuraikan pada Persamaan (2.1), (2.2) dan (2.3).
Anoda : Fe(s) Fe2+(aq) + 2e- (2.1)
Katoda : 1/2 O2(g) + H2O(l) + 2e- 2OH- (aq) (2.2)
Reaksi Total : Fe(s) +1/2 O2(g) + H2O(l) Fe(OH)2 (2.3)
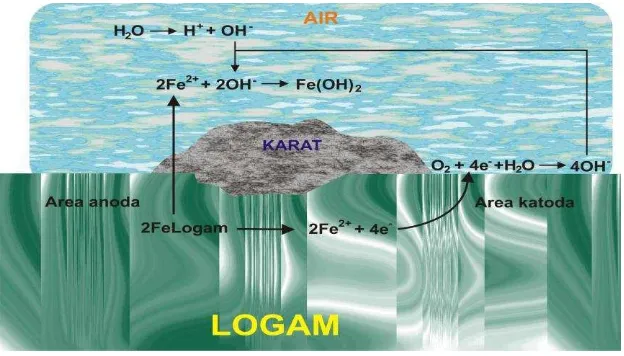
Oksida besi bersifat porous dan tidak protektif terhadap logam besi di bawahnya (Fadli, 2011). Pembentukan besi hidroksida dalam lingkungan berair disajikan pada Gambar 4.
Gambar 4. Contoh skematik korosi pada permukaan besi dalam lingkungan berair.
Oksidasi pada anoda terjadi karena berlangsungnya reaksi kimia antara besi dan oksigen yang terdapat dalam air. Lapisan Fe(OH)2 yang terbentuk pada
25 jenuh. Semakin banyak oksigen yang masuk dalam air, maka korosi akan
semakin cepat reaksi di katoda. Fe(OH)2 yang terbentuk pada anoda selanjutnya
oleh karena kehadiran oksigen yang berlebih pada lingkungan akan
mengakibatkan karat besi (produk korosi) yang diamati berwarna kecoklatan di dalam larutan elektrolit dan mengendap di dasar wadah.
Adanya inhibitor pada sistem tersebut, maka mata rantai korosi tersebut dapat diputus. Apabila seluruh permukaan logam telah tertutupi oleh lapisan pelindung maka logam bersifat lebih katodik dan laju korosi akan berkurang. Meskipun lapisan pelindung yang terbentuk stabil, akan tetapi ada kemungkinan pada kondisi riil bisa lepas, dikarenakan adanya laju alir yang tinggi, oleh sebab itu inhibitor harus diinjeksikan secara periodik (Butarbutar dan Sunaryo, 2011).
J. Korosi Baja dalam Larutan DMSO- HCl
Larutan asam merupakan media korosif yang sangat mempercepat terjadinya korosi pada baja. Larutan asam mengandung ion hidrogen (H+) yang berperan dalam reaksi reduksi oksidasi. Pada perkaratan umumnya logam besi bertindak sebagai anoda (reaksi oksidasi) membentuk oksida besi Fe2O3.nH2O berwarna
26 Fe(s) + 2H+(aq) + 2Cl-(aq) Fe2+(aq) + 2Cl-(aq) + H2(g) (2.4)
Setelah Fe(s) berubah menjadi Fe2+(aq) yang mengalami solvasi sehingga besi yang
berada di bawahnya menjadi terbuka dan terus menerus mengalami reaksi oksidasi sehingga korosi terus berlangsung (Fadli, 2011).
Penelitian ini menggunakan medium korosif HCl sebagai pemicu korosi dalam Dimethyl sulfoxide (DMSO). Pelarut DMSO dengan rumus molekul C2H6OS
dengan berat molekul 78,13 g/mol dalam bentuk cairan bening mendidih pada 189 ºC dengan massa jenis 1,1 g/ mL adalah pelarut polaritas aprotik yang efektif melarutkan berbagai bahan kimia organik dan anorganik. Karakteristik keselamatannya yang sangat baik telah menyebabkannya digunakan untuk berbagai tujuan, terutama sebagai agen pembersih untuk komponen elektronik, dan sebagai larutan reaksi terhadap obat-obatan dan bahan kimia pertanian, DMSO juga dapat dipromosikan sebagai pelarut yang ramah lingkungan (Sigma-Aldrich, 2014).
Gambar 5. Struktur dimethyl sulfoxide (DMSO).
K. Antikorosi
Pencegahan korosi didasarkan pada dua prinsip berikut: 1. Mencegah kontak dengan oksigen dan/atau air
27 peristiwa korosi tidak dapat terjadi. Korosi dapat dicegah dengan melapisi besi dengan cat, oli dan logam lain yang tahan korosi (logam yang lebih aktif seperti seng dan krom). Penggunaan logam lain yang kurang aktif (timah dan tembaga) sebagai pelapis pada kaleng bertujuan agar kaleng cepat hancur di tanah. Timah atau tembaga bersifat mampercepat proses korosi.
2. Perlindungan katoda (pengorbanan anoda)
Besi yang dilapisi atau dihubungkan dengan logam lain yang lebih aktif akan membentuk sel elektrokimia dengan besi sebagai katoda. Besi berfungsi hanya sebagai tempat terjadinya reduksi oksigen. Logam lain berperan sebagai anoda, dan mengalami reaksi oksidasi. Dalam hal ini, besi sebagai katoda, terlindungi oleh logam lain (sebagai anoda, dikorbankan). Besi akan aman terlindungi selama logam pelindungnya masih ada/belum habis. Untuk perlindungan katoda pada sistem jaringan pipa bawah tanah lazim digunakan logam magnesium, Mg. Logam ini secara berkala harus dikontrol dan diganti. 3. Membuat alloy atau paduan logam yang bersifat tahan karat, misalnya besi
dicampur dengan logam Ni dan Cr menjadi baja stainless (komposisi Fe,Cr, dan Ni masing 72, 19 dan 9%). Beberapa cara untuk menanggulangi besi atau logam lain agar tahan dari proses perkaratan:
a. Melapisi besi atau logam lainnya dengan cat khusus besi yang banyak dijual di toko-toko bahan bangunan.
b. Membuat logam dengan campuran yang serba sama atau homogen ketika pembuatan atau produksi besi atau logam lainnya di pabrik.
c. Pada permukaan logam diberi oli atau vaselin.
28 agar yang berkarat adalah magnesiumnya. Hal ini banyak dilakukan untuk mencegah berkarat pada tiang listrik besi atau baja. Magnesium ditanam tidak jauh dari tiang listrik.
e. Melakukan proses galvanisasi dengan cara melapisi logam besi dengan seng tipis atau timah yang terletak disebelah kiri deret volta.
f. Melakukan proses elektrokimia dengan jalan memberi lapisan timah seperti yang biasa dilakukan pada kaleng (Rahmani, 2011).
Salah satu metode untuk menghambat kerusakan yang terjadi adalah dengan cara menggunakan inhibitor atau antikorosi. Antikorosi adalah senyawa kimia yang dapat mencegah atau memperlambat proses korosi. Penggunaan antikorosi merupakan salah satu cara paling efektif untuk mencegah korosi, karena biayanya yang relatif murah dan prosesnya sederhana. Biasanya proses korosi berlangsung secara elektrokimia yang terjadi secara simultan pada daerah anoda dan katoda yang membentuk rangkaian arus listrik tertutup. Antikorosi biasanya
ditambahkan dalam jumlah sedikit, baik kontinu maupun periodik menurut suatu selang tertentu. Cara antikorosi mereduksi laju korosi adalah dengan
29 logamnya dan membentuk lapisan pasif sehingga mampu menghilangkan
konstituen agresif dari lingkunganya (Butarbutar dan Sunaryo, 2011).
L. Metode Karakterisasi Korosi
Polarisasi potensiodinamik adalah metode untuk menentukan perilaku korosi logam berdasarkan hubungan potensial dan arus anodik/katodik. Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan di luar sistem. Hal ini disebabkan ada perbedaan potensial antara logam dan larutan sebagai lingkungannya (Sunarya, 2008).
Analisis elektrokimia telah menjadi metoda yang penting dalam mempelajari fenomena yang terjadi selama proses korosi berlangsung seperti repasifasi lapisan pasif dan korosi sumuran (pitting corrosion) pada logam. Selama
berlangsungnya proses korosi biasanya terjadi fluktuasi arus atau tegangan tergantung mode pengukuran yang dilakukan. Pada kondisi potensiostat, yang diamati fluktuasi arus dan bisa dipisahkan menjadi bentuk gelombang arus
tersendiri yang berhubungan dengan proses perusakan. Fluktuasi arus meningkat tajam saat terjadi korosi dan menurun saat terjadi lapisan pasif. Potensiostat AE466 ini tidak dapat mengukur laju korosi secara langsung dari pengujian ini harus dikonversi menjadi arus korosi (I corr). Selanjutnya dengan menggunakan data input yang ada diperoleh laju reaksi (Butarbutar dan Febrianto, 2009).
30 dapat dilakukan. Benda uji harus dapat menghantarkan listrik dan permukaannya harus diamplas untuk menghilangkan oksida-oksida yang mungkin ada.
Beberapa jenis elektroda pada potensiostat diantaranya adalah elektroda bantu (Auxiliary Electrode) yang digunakan untuk mengangkut arus hasil proses korosi yang terjadi dalam rangkaian sel. Elektroda acuan (Reference Electrode) digunakan sebagai titik dasar yang sangat mantap untuk mengacukan
poengukuran potensial elektroda kerja. Elektroda yang terakhir adalah elektroda kerja (Working Electrode) yaitu elektroda logam yang akan diteliti (benda uji) yang disiapkan dengan memasang sebuah benda uji kecil dalam resin pendingin. (Butarbutar dan Sunaryo, 2011).
Dalam penelitian ini akan digunakan instrumen ER466 Integrated Potentiostat System eDAQ seperti pada Gambar 6. Potensiostat jenis ini dapat digunakan dalam berbagai pengukuran seperti temperatur, intensitas cahaya, ORP, pH tekanan, dan kadar oksigen terlarut. Keunggulan potensiostat jenis ini adalah penggunaannya yang relatif mudah, dapat memonitoring arus dari nanoampere hingga 100mA, praktis, dan lain-lain (Anonim, 2010).
31
Gambar 6. ER466 Integrated Potentiostat System eDAQ (sumber: www.eDAQ.com)
Dalam pengujian korosi digunakan potensiodinamik karena dengan ini dapat dilakukan analisis Tafel untuk mendapatkan data data tentang arus korosi (Icorr) dan laju korosi (Corr Rate). Rangkaian alat yang digunakan ditunjukkan dalam Gambar 7.
Gambar 7. Sel tiga elektroda yang dihubungkan dengan alat potensiostat dan komputer dengan perangkat lunak EChem.
M. Metode Polarisasi Potensiodinamik
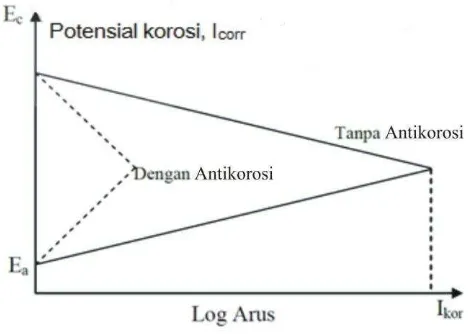
32 saat pengukuran berlangsung menggunakan bantuan kurva ekstrapolasi Tafel seperti yang ditunjukkan pada Gambar 8.
Gambar 8. Kurva polarisasi pada korosi baja.
Kurva polarisasi yang dihasilkan dapat diukur potensial korosi dan arus korosi yang terjadi dengan bantuan metode ekstrapolasi Tafel. Terjadinya korosi pada baja lunak juga dapat diketahui dari polar kurva yang dihasilkan.
Penerapan potensial dari luar yang melebihi potensial ini disebut potensial lebih (over potential). Peningkatan potensial lebih yang diterapkan tidak diikuti dengan peningkatan arus, maka pada potensial tersebut telah terjadi polarisasi seperti pada pola kurva yang terbentuk setelah zona Tafel (Fadli, 2011).
33 Trendline daerah anodik ditentukan pada daerah dimana arus turun tanpa naik lagi untuk selang over potential tertentu, sehingga Tafel slope positif. Sedangkan trendline daerah katodik ditentukan pada daerah dimana arus naik tanpa turun lagi untuk selang over potential tertentu, sehingga Tafel slope negatif. Oleh karena laju oksidasi dan laju reduksi sama maka persamaan garis ini adalah ekivalen. Perpotongan garis terhadap sumbu X dinyatakan sebagai Icorr (Butarbutar dan Febrianto, 2009). Dengan memasukkan data berat ekivalen dan densitas material dapat diketahui laju korosi dengan menggunakan rumus pada persamaan:
Rmpy = 0,13 I corr e / ρ (2.5) Keterangan:
R mpy : laju korosi (mili inch/year) Icorr : densitas arus korosi ( A/cm2) e : berat ekivalen material (g) ρ : densitas material (gr/cm3)
Penggunaan senyawa antikorosi mampu mengubah Icorr menjadi lebih kecil seperti ditunjukkan pada Gambar 9. Pada kurva ektrapolasi menunjukkan perbandingan pola ekstrapolasi Tafel dari diagram polarisasi logam baja dalam larutan asam yang mengandung inhibitor dan tanpa inhibitor.
Kurva ekstrapolasi Tafel menunjukkan bahwa sebelum dan sesudah diberikan inhibitor atau antikorosi, terjadi penurunan arus korosi (Fadli, 2011) . Arus korosi dan laju korosi memiliki hubungan yang linear. Pada saat benda uji
34 dihasilkan menjadi lebih tinggi. Semakin tinggi arus yang dihasilkan maka laju korosi juga semakin tinggi (Butarbutar dan Febrianto, 2009).
Gambar 9. Kurva ekstrapolasi Tafel.
Polarisasi atau potensial lebih, adalah perubahan potensial elektroda setengah sel dari posisi kesetimbangan dengan lingkungannya pada suatu proses elektrodik. Hubungan potensial lebih dan arus dapat digunakan untuk mengungkapkan laju korosi. Untuk menghitung persentase inhibisi pada metode ini digunakan Persamaan (1):
Icorr 0 - I corr i
% proteksi (%EI) = 100% (2.6)
Icorr 0
35 terhadap senyawa trifeniltimah(IV) dan di-n-butiltimah(IV) pada berbagai ligan yang dihitung %EI dengan teknik polarisasi disajikan pada Tabel 7.
Tabel 7. Persen Efisiensi Inhibitor (%EI) korosi pada beberapa senyawa
trifeniltimah(IV) dan di-n-butiltimah(IV) menggunakan ligan 1-phenyl-2,5-dithiohydrazodicarbonamide (PTHCH).
Senyawa Efisiensi Inhibitor korosi (%)
Ligan (PTHCH) 72,87
n-Bu2Sn(PTHCH)2 79,80
Ph3Sn(PTHCH) 85,43
Ligan (THCH) 79,80
n-Bu2Sn(THCH)2 82,13
Ph3Sn(THCH) 90,26
Ligan (EtOPTHC) 85,94
n-Bu2Sn(EtOPTHC)2 89,43
Ph3Sn(EtOPTHC) 95,17
(Sumber: Singh et al., 2010)
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Juli sampai dengan Januari 2015. Sintesis beberapa senyawa trifeniltimah(IV) klorobenzoat dilakukan di laboratorium kimia anorganik-fisik, uji analisis antikorosi di laboratorium analitik dan analisis senyawa menggunakan spektrofotometer UV dilakukan di laboratorium
anorganik-fisik, pada Jurusan Kimia FMIPA Universitas Lampung. Analisis senyawa menggunakan spektrofotometer IR dilakukan di laboratorium instrumentasi FMIPA Universitas Islam Indonesia dan analisis senyawa menggunakan 1H NMR dan 13C NMR dilakukan di Universiti Sains Malaysia. Analisis unsur dengan menggunakan microelemental analyzer dilakukan di School of Chemical and Food Technology, Universiti Kebangsaan Malaysia.
B. Alat dan Bahan
37
Untuk uji aktifitas antikorosi digunakan mikropipet, kertas abrasif mulai dari grit 240, 360, 400, 500, 600 dan 800, alat pengukuran potensiodinamik EA466
Potentiostat, dan untuk mengetahui bentuk morfologi korosi logam secara kualitatif menggunakan mikroskop.
Bahan-bahan yang akan digunakan dalam penelitian ini adalah zat-zat kimia dengan kualitas GR (Grade Reagent) atau PA (Pro Analysis) yang terdiri dari: (C6H5)3SnCl, HCl, aseton, DMSO (CH3)2SO), berbagai asam klorobenzoat,
NaOH, metanol p.a, dan air HPLC.
C. Metode Penelitian
Prosedur untuk sintesis masing-masing senyawa trifeniltimah(IV) klorobenzoat pada penelitian ini diadopsi dari prosedur yang dilakukan oleh Szorscik et al. (2002); Hadi et al. (2009).
1. Sintesis senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH]
Trifeniltimah(IV) klorida [(C6H5)3SnCl] dengan berat molekul 385,46 g/mol
sebanyak 0,03 mol (11,56 gram) direaksikan dengan 0,03 mol (1,20 gram) NaOH untuk mengganti ligan klor dengan hidroksida dalam 50 ml metanol p.a.,
selanjutnya endapan yang dihasilkan disaring dengan menggunakan kertas saring Whatman No. 42, lalu dicuci dengan akuabides dan metanol p.a. kemudian didiamkan di dalam desikator selama kurang lebih 2 minggu untuk menghasilkan (C6H5)3SnOH. Kristal (C6H5)3SnCl dan (C6H5)3SnOH dikarakterisasi dengan,
38
2. Sintesis senyawa trifeniltimah(IV) klorobenzoat
Senyawa trifeniltimah(IV) hidroksida (C6H5)3SnOH dengan berat molekul 367,02
g/mol sebanyak 1,10 gram direaksikan dengan 2-klorobenzoat dengan
perbandingan mol 1:1 dalam 30 mL metanol p.a. dan direfluks dengan variasi waktu 3, 4 dan 5 jam dengan pemanas pada suhu 60°C. Setelah reaksi sempurna, metanol p.a. diuapkan dan dikeringkan di dalam desikator selama kurang lebih 4 minggu sampai diperoleh kristal kering. Cara yang sama juga dilakukan pada sintesis trifeniltimah(IV) hidroksida dengan senyawa asam 3-klorobenzoat dan asam 4-klorobenzoat. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks tersebut siap untuk dikarakterisasi dengan dengan 1H NMR,
13
C NMR, spektrofotometer IR dan spektrofotometer UV. Analisis kandungan unsur C dan H dengan menggunakan alat microelemental analyzer.
3. Preparasi Baja Lunak
Preparasi baja lunak dilakukan dengan memotong plat dengan ukuran (2x1) cm dan mengamplas dengan kertas abrasif mulai dari grit 240, 360, 400, 500, 600 sampai dengan grit 800. Setelah permukaan baja lunak rata atau homogen selanjutnya mencuci dengan akuades, larutan HCl encer dan aseton secara berturut-turut.
4. Pembuatan Medium Korosif
Medium korosif dibuat dengan komposisi larutan DMSO 0,02 M, dan HCl 0,2 M (Rastogi et al., 2005, Rastogi et al., 2011). Pembuatan larutan tersebut
39
pelarutnya. Kedua larutan tersebut kemudian dicampurkan dengan perbandingan 1:1 kemudian dihomogenkan.
5. Pembuatan Larutan Antikorosi
Larutan antikorosi dibuat dengan melarutkan 0,01 gram zat baik senyawa awal, ligan maupun senyawa hasil sintesis dengan 5 ml DMSO p.a., yang kemudian diencerkan menggunakan air HPLC hingga volume larutan tepat 25 ml dan diperoleh larutan stok inhibitor dengan konsentrasi 400 mg/L. Pembuatan larutan dengan variasi konsentrasi inhibitor dilakukan dengan metode pengenceran meggunakan pelarut DMSO 5%. Variasi konsentrasi antikorosi 20, 40, 60, 80, dan 100 mg/L dibuat dari larutan stok antikorosi 400 mg/L secara berturut-turut sebanyak 1,25; 2,5; 3,75; 5 dan 6,25 mL yang diencerkan dalam labu 25 mL hingga tepat pada batas tera.
6. Pengaturan Pemindaian dengan Potensiostat
40
7. Pengujian Korosi
Aktivitas antikorosi beberapa senyawa trifeniltimah(IV) klorobenzoat diukur dengan metode polarisasi potensiodinamik dengan ER466 Integrated Potentiostat System eDAQ yang terdiri dari tiga elektroda, yaitu elektroda pembanding AgCl, elektroda bantu platina (Pt), dan elektroda kerja baja lunak. Preparasinya
dilakukan dengan membilas elektroda bantu dan elektroda acuan dengan akuades sebelum digunakan. Elektroda kerja dicuci menggunakan akuades, HCl 0,1 M dan aseton 1 M berturut-turut. Ketiga elektroda tersebut selanjutnya dirangkaikan pada sel elektrolisis yang telah diisi dengan 30 mL medium korosif tanpa inhibitor yang sebelumnya telah ditentukan pH-nya menggunakan pH meter, kemudian potensiostat dihidupkan. Setelah lampu pada potensiostat berwarna hijau, alat dihubungkan dengan komputer melalui kabel USB dan software E-chem v.2 1.8 dibuka dan pemindaian anoda diatur, selanjutnya ketiga elektroda tersebut dibiarkan berinteraksi dengan medium korosif selama 10 menit.
41
pemindaian anoda dan katoda yang sama dengan perbandingan volume uji dari larutan antikorosi dan medium korosif sebesar 1:5.
8. Analisis Data
Setelah diperoleh data besarnya beda potensial dan arus, dilakukan analisis Tafel untuk menentukan besarnya logaritma normal dari nilai kerapatan arus (ln |J|) dengan overpotensial (ɳ) yang selanjutnya diekstrapolasi ke dalam bentuk grafik. Analisis Tafel dan pembuatan grafik dikerjakan pada Microsoft Office Excel. Pembuatan grafik dilakukan dengan memilih data ln |J| dan ɳ dari hasil
pemindaian anoda untuk masing masing pengujian, kemudian dipilih menu insert, charts, scatter kemudian memilih menu scatters with smoth lines and markes. Selanjutnya setelah data terplotkan dalam bentuk grafik, grafik dipindahkan dalam sheet baru untuk memudahkan kerja. Untuk laju selusur anoda, dipilih nilai ln|J| sebagai nilai absis dan ɳ sebagai ordinat pada pemindaian anoda, dan untuk laju selusur katoda dipilih nilai ln |J| pada pemindaian anoda sebagai absis dan ɳ sebagai ordinat pada pemindaian katoda dari masing-masing uji.
Langkah selanjutnya setelah diperoleh grafik antara laju selusur katoda dan anoda dari masing-masing pemindaian, ditentukan titik potong ln |J| kedua grafik
42
Icorr = Jcorr x A (2.7)
Keterangan:
Icorr : Besaran arus korosi (mA) Jcorr : Kerapatan arus korosi (mA/cm2)
A : Luas permukaaan elektroda kerja terukur (cm2)
Dari nilai tersebut selanjutnya dapat ditentukan besarnya % proteksi antikorosi dan laju korosi menurut Persamaan 2.6.
9. Pengujian Morfologi Korosi pada Baja Lunak secara Kualitatif
Setelah melakukan perhitungan % proteksi inhibitor, maka akan diketahui antikorosi dengan tingkat proteksi terbaik. Kemudian larutan antikorosi pada konsentrasi tersebut diinteraksikan dengan baja yang telah dibersihkan selama 1 minggu. Selanjutnya baja yang telah diinteraksikan dipisahkan dari larutan uji dan dan dikeringkan. Baja tersebut selanjutnya diamati permukaannya dengan menggunakan mikroskop dengan perbesaran 400-100 kali, kemudian
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka diperoleh simpulan sebagai berikut:
1. Sintesis senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat dan trifeniltimah(IV) 4-3-klorobenzoat telah berhasil dilakukan dengan karakterisasi menggunakan spektrofotometer IR, UV, 1H dan 13C dan mikroanalisis unsur menggunakan microelemental analyzer menunjukkan bahwa senyawa hasil sintesis adalah murni. Rendemen masing-masing senyawa sebesar 82,44; 82,87; dan 98,08%.
2. Senyawa trifeniltimah(IV) 2-klorobenzoat, trifeniltimah(IV) 3-klorobenzoat dan trifeniltimah(IV) 4-klorobenzoat yang diuji aktifitas antikorosi pada baja lunak dengan metode potensiostat secara keseluruan menyebabkan kenaikan persen efisiensi inhibisi korosi.
98 .
B. Saran
99
DAFTAR PUSTAKA
Anonim. 2010. eDAQ Potentiostat 466 System (Model ER466). http://www.eDAQ.com/ diakses pada 3 Desember 2013.
Anonim. 2011. Standard Operating Procedure for Cyclic Voltammetry using the eDAQ Potentiostat and Electrochemical Analysis System.
http://www.eDAQ.com/ diakses pada 3 Desember 2013.
Anonim. 2012. Laporan Tahunan tahun 2012. Tahunan PT Timah Tbk. Jakarta. Anonim. 2014. Galeri Aneka Baja Besi. http://www.tokobesionline.com/diakses
pada 13 Mei 2014.
Alwi, S. Sarwito dan I.R. Kusuma. 2012. Analisa Teknis Dan Ekonomis Perubahan Sacrificial Anode Menjadi Impressed Current Cathodic Protection Untuk Meminimalisir Korosi Pada Lambung Kapal. Teknik Sistem Perkapalan, Fakultas Teknologi Kelautan, Institut Teknologi Sepuluh Nopember (ITS).
Bhatti, M.H., S. Ali., F. Huma. and S. Shahzadi. 2005. Organotin(IV) Derivatives of N-Maleoylamino Acids: Their Synthesis and Structural Elucidation, Turk. J. Chem. 29, 463-476.
Blunden, S.J., P. A. Cusack and R. Hill. 1987. in The Industrial uses of tin Chemicals. The Royal Society of Chemistry. London.
Blunden, S.J. and R. Hill. 1987. in Surface Coating 1. Wilson, A.D., J.W Nicholson,. and H.J. Prosser. (Eds). Elsevier Applied Science Publisher, pp. 17 – 167.
Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil and A.A. Omachi. 1998. Syntheses and Antifungal Activity of some
organotin(IV)carboxylates. Metal-Based Drugs. 5 (4), 233 - 236.
100 Butarbutar, S. L. dan G.R. Sunaryo. 2011. Analisis Mekanisme Pengaruh
Inhibitor Siskem pada Material Baja Karbon. Prosiding Seminar Nasional ke-17 N Serta Fasilitas Nuklir. Yogyakarta. 01 Oktober 2011.
Caprette, D.R. 2007. Using a Caunting Chamber. Lab Guides. Rice University. Costech Analytical Technologies. 2011. Elemental Combiustion System CHNS.
http://costech analytical.com/. Diakses pada 10 Februari 2013.
Cotton, F.A. and G. Wilkinson. 2007. Kimia Anorganik Dasar. Terjemahan oleh S. Suharto. UI Press. Jakarta.
Dalimunthe, I. S. 2004. Kimia dari Inhibitor Korosi. e-USU Repository. Medan. Day, R.A. dan A.L. Underwood. 1998. Analisis Kimia Kuantitatif Edisi Keenam.
Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
Fadli. 2012. Studi Laju Korosi Baja API 5L GRB N didalam Larutan Asam Sulfat 1M dengan Penambahan Inhibitor Aniline-4-Sulfonate.(Tesis) FMIPA UI. 2012.
Fessenden, R.J dan J.S. Fessenden. 1996. Kimia Organik Dasar Jilid 2.
Terjemahan oleh A.H. Pudjaatmaka. Penerbit Erlangga. Jakarta. 523 hlm. Fontana, M.G. 1986. Corrosion Engineering, Third Edition. McGraw Hill Book Company. New York.
Greenwood, N.N., and A. Earnshaw, 1990, Chemieder Elemente, Willey-VCH Verlags gesellschaft mbH, Weinheim.
Hadi, S., M. Rilyanti. and Nurhasanah. 2009. Comparative Study on the Antifungal Activity of Some Di- and Tributyltin(IV) Carboxylate Compounds. Modern Applied Science. 3 (2), 12-17.
Hadi, S., and M. Rilyanti. 2010. Synthesis and in vitro anticancer activity of some organotin(IV) benzoate compounds. Oriental Journal of Chemistry. 26 (3): 775-779.
Hadi, S., H, Afriani., W.D. Anggraini., H.I. Qudus., and T. Suhartati. 2015. The Synthesis and Potency Study of Some Dibutyltin(IV) Dinitrobenzoate Compounds as Corrosion Inhibitor for Mild Steel HRP in DMSO-HCl Solution. Asian Journal of Chemistry, 27 (4), 1509-1512.
101 Lesbani, A., 2008. Sintesis dan Karakterisasi Struktur Kristal Ion
[Cr3O(OOCC6H5)6(H2O)3]4[α-SiW12O40]⋅10H2O⋅8CH3COCH3. Jurnal
matematika dan Sains, Juni 2008, VOL.13: 60-65.
Lesbani, A., R. Mohadi., dan N. Hidayati. 2012 Sintetesis dan Karakterisasi Senyawa Oksotrinuklir [Ru2Co(O)(OOCCH3)6(C5H5N)3](ClO4 Jurnal
Kimia 6 (2), Juli 2012 : 110-114.
Mulyono, H.A.M. 2006. Kamus kimia. bumiaksara. Bandung. 2006. 505 hlm. NACE TM-0169-76, Standart Test Method Laboratory Corrosion Testing of
metals the Process Industries Item No.5300. Reprinted May 1992.
Pellerito, L. and L. Nagy. 2002. Organotin(IV)n+ Complexes Formed with Biologically Active Ligands: Equilibrium and Structural Studies, and Some Biological Aspects, Coord. Chem. Rev. 224: 111 – 150.
Permana, A dan Darminto. 2012. Fabrikasi Polianilin-TiO2 dan Aplikasinya sebagai Pelindung Anti Korosi pada Lingkungan Statis, Dinamis dan Atmosferik. Jurnal Fisika dan Aplikasinya. 18 (I): 120106-1-120106-4.
Rieger, H.P. 1992. Electrochemistry, 2nd ed. Chapman and Hall Inc. New York. 412-421.
Rahmani, B. 2011. Kimia Fisika. Analis Kimia. Makassar.
Rastogi, R.B., M.M. Singh, K. Singh and M. Yadav. 2005. Organotin Dithiohydrazodicarbonamides as Corrosion Inhibitors for Mild Steel Dimethyl Sulfoxide Containing HCl. Port. Electrochim. Acta. 22: 315– 332.
Rastogi, R.B., M.M. Singh, K. Singh and M. Yadav. 2011. Organotin
Dithiobiurets as Corrosion Inhibitors for Mild Steel-Dimethyl Sulfoxide Containing Hcl. Afr. J. of Pure Appl. Chem. 5(2): 19-33.
Saito, T. 1996. Buku Teks Kimia Anorganik Online. Diterjemahkan dari versi bahasa Inggrisnya oleh Ismunandar.Iwanami Publishing Company. 201 hlm.
Shahid, K., S. Ali., S. Shahzadi. and Z. Akhtar. 2003. Organotin(IV) Complexes on Aniline Derivaties Part-II-Synthesis and Spectroscopic Characterization of Organotin(IV) Derivatives of 2-[4-Bromoanailine)carboxyl]benzoic Acid, Turk. J. Chem. 27, 209-215.
102 Sigma-Aldrich. 2014. Safetey Data Sheet. Version 5.0 Revision Date
23.12.2010 Print Date 13.03.2014
Singh, R., P. Chaudary and N.K. Khausik. 2010. A Review: Organotin
Compounds in Corrosion Inhibition. Rev. Inorg. Chem. 30 (4), 275 – 294. Siregar, T. 2010. Laju Korosi dan Mekanisme Inhibisi Alumunium Murni
Menggunakan Kalium dan Kalsium Stearat. Jurnal Kimia. 4 (2), 113-124. Sunarya, Y., C.L. Radiman., S. Achmad dan B. Bundjali. 2008. Pengaruh
Temperatur terhadap Mekanisme Inhibisi oleh Sistein pada Korosi Baja Karbon dalam Larutan NaCl Jenuh CO2. Jurnal Matematika dan Sains UPI. 13 (3), 90-96.
Szorcsik, A., L. Nagy, K. Gadja-Schrantz, L. Pallerito, E. Nagy and E.T. Edelmann. 2002. Structural Studies on Organotin(IV) Complexes Formed with Ligands Containing {S, N, O} Donor Atoms, J. Radioanal. Nucl. Chem. 252 (3): 523 – 530.
Takeuchi, Y. 2006. Buku Pengantar Kimia online. Penerjemah Ismunandar. Iwanami Publishing Company. 272 halaman.
Tayer, J. 1988. Organometallic Chemistry and Overview. VCH Publisher Inc/ United State. P 7, 12, 14.
Tiekink, E.R.T. 1991. Structural Chemistry of Organotin Carboxylates: a Review of the Crystallographic Literature, App. Organomet. Chem., 5, 1-30. United Nation Environment Program (UNEP). 2004. Tributyltin Tin Compounds.
Report by Rotterdam Convention on the Prior Informed, Consent Procedure for Certain Hazardous, Chemicals and Pesticides in International Trade Chemical Review Committee. UNEP, 27 pages.
Van Der Weij, F.W. 1981. Kinetics and Mechanism of Urethane Formation Catalysed by Organotin Compound. Journal Science Polymer Chemistry. 19 (2): 381-388.
Widharto, S. 1999. Karat dan Pencegahannya. Pradnya Paramita. Jakarta. 180 hlm.