SINTESIS DAN KARAKTERISASI SENYAWA TURUNAN TRIFENILTIMAH(IV) HIDROKSIBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK DALAM MEDIUM NATRIUM KLORIDA
(Tesis)
Oleh Hapin Afriyani
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2016
ABSTRACT
THE SYNTHESIS AND CHARACTERIZATION OF TRIPHENYLTIN(IV) HYDROXYBENZOATE DERIVATIVES AS CORROSION INHIBITORS
FOR MILD STEEL IN SODIUM CHLORIDE MEDIUM
By
Hapin Afriyani
Synthese and characterization of triphenyltin(IV) 2-hydroxybenzoate, triphenyltin(IV) 3-hydroxybenzoate, and triphenyltin(IV) 4-hydroxybenzoate have been successfully performed by reacting the triphenyltin(IV) hydroxide with 2-, 3-, 4-hydroxybenzoic acid and was supported by characterization result using1H and 13
C NMR, UV, IR spectrophotometer and microelemental analyzer. The percentage yield of the synthesis of triphenyltin(IV) hydroxybenzoate series were 79.77; 88.60; dan 89.70%, respectively. The anticorrosion activity for these compounds were tested using gravimetry and potentiodynamic method with EA 161 potentiostat eDAQ. The result revealed that the triphenyltin(IV) hydroxybenzoate derivative has a good ability in inhibiting corrosion with the highest efficiency inhibition in the addition of triphenyltin(IV) 4-hydroxybenzoate compound at concentration of 100 mg/L with the percentage efficiency inhibition value was 80.41% and free energy of adsorption was -34.72 kJ/mole. Based on the value of it’s free energy of adsorption, triphenyltin(IV) hydroxybenzoate compound was able to inhibit corrosion by forming a thin layer on the metal surface.
ABSTRAK
SINTESIS DAN KARAKTERISASI SENYAWA TURUNAN TRIFENILTIMAH(IV) HIDROKSIBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK DALAM MEDIUM NATRIUM KLORIDA
Oleh
Hapin Afriyani
Sintesis senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-3-hidroksibenzoat telah berhasil dilakukan dengan mereaksikan senyawa trifeniltimah(IV) hidroksida dengan ligan asam 2-, 3-, dan 4-hidroksibenzoat dan didukung dengan hasil karakterisasi menggunakan spektrofotometer UV, IR,1H dan13C NMR serta analisis mikrounsur. Nilai persen rendemen untuk ketiga senyawa tersebut berturut-turut 79,77; 88,60; dan 89,70%. Pengujian efektivitas penghambatan korosi senyawa hasil sintesis dilakukan dengan metode gravimetri dan polarisasi potensiodinamik menggunakan EA 161 potensiostat eDAQ. Hasil penelitian menunjukkan bahwa ketiga senyawa yang diuji memiliki kemampuan menghambat korosi dengan penghambatan tertinggi pada penambahan senyawa trifeniltimah(IV) 4-hidroksibenzoat pada konsentrasi 100 mg/L dengan nilai persen efisiensi inhibisi 80,41% dan perubahan energi bebas adsorbsi sebesar -34,72 kJ/mol. Berdasarkan nilai energi bebas adsorpsinya, maka senyawa trifeniltimah(IV) hidroksibenzoat dapat menghambat korosi pada baja melalui pembentukan lapisan pasif pada permukaan logam.
SINTESIS DAN KARAKTERISASI SENYAWA TURUNAN TRIFENILTIMAH(IV) HIDROKSIBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK DALAM MEDIUM NATRIUM KLORIDA
Oleh Hapin Afriyani
Tesis
Sebagai Salah Satu Syarat untuk Memperoleh Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Lampung
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2016
RIWAYAT HIDUP
Penulis dilahirkan di Lampung Selatan, 23 tahun silam tanggal 6 April 1993 sebagai anak pertama dari dua bersaudara, dari Bapak Sugini dan Ibu Suhatni.
Penulis menyelesaikan pendidikan Taman Kanak-Kanak di TK Dharma Pertiwi tahun 1998. Penulis kemudian melanjutkan pendidikan dasar di SDN 1 Merbau Mataram dan menyelesaikannya tahun 2004, pendidikan tingkat menengah hingga tahun 2007 di SMP Negeri 2 Merbau Mataram Lampung Selatan. Kemudian penulis melanjutkan pendidikan di SMA Negeri 5 Bandar Lampung dan
menyelesaikannya tahun 2010 sebagai salah satu lulusan terbaik. Penulis diterima sebagai mahasiswa S1 Jurusan Kimia FMIPA Universitas Lampung melalui jalur Penelusuran Kemampuan Akademik dan Bakat (PKAB) dan lulus di tahun 2014 sebagai Wisudawati terbaik ke-2 tingkat Universitas. Selama menempuh
pendidikan S1 di kampus, penulis pernah menjadi Finalis Olimpiade Nasional Matematika dan Ilmu Pengetahuan Alam Perguruan Tinggi (ONMIPA PT) Bidang Kimia tahun 2012 dan 2013. Didasari kecintaannya terhadap ilmu kimia, penulis kemudian melanjutkan pendidikan dengan medaftar sebagai mahasiswa Program Studi Magister Kimia Universitas Lampung pada tahun 2014.
Aktivitas organisasi penulis dimulai sejak menjadi Brigade BEM FMIPA dan Kader Muda Himaki tahun 2010–2011. Penulis juga pernah menjadi Sekretaris
Departemen Kewirausahaan BEM FMIPA dan Anggota Bidang Sains dan
Penalaran Ilmu Kimia Himaki FMIPA Unila tahun 2011–2012, Sekretaris Umum Himaki FMIPA tahun 2012–2013 dan Wakil Gubernur BEM FMIPA Universitas Lampung tahun 2013–2014.
Atas Rahmat Allah swt.,
ku persembahkan karya
sederhana ini teruntuk
Bapak, Ibu, Adek, dan Kakakku
untuk semua doa dan keikhlasan
dalam membersamaiku, hingga
hari ini
Pak Wo M,
suatu hari pipin pasti sukses
Wo
Prof. Sutopo Hadi, M. Sc., Ph.
D.
serta Bapak dan Ibu Dosen
Jurusan Kimia FMIPA
terima kasih atas seluruh
dedikasi dalam membimbing
ananda di kampus
Alamamater tercinta
Setiap orang dari kita
pantas
untuk mendapatkan posisi
bernama
keberhasilan
. Hanya
saja pengenalan terhadap
konsep kegagalan membuat kita
terlalu mudah menyerah.
Jika bukan, mengapa tidak
sejak kecil kita memutuskan
untuk merangkak seumur hidup?
Bukankah saat itu kita selalu
gagal saat belajar berdiri dan
berjalan?
(Kak @mahdinasution, Semasa Kepanitiaan
Rakerwil ILMMIPA Wilayah 1,
KBB BEM FMIPA 2011
─
2012)
i SANWACANA
Segala Puji bagi Allah, Rabb semesta alam atas nikmat-Nya yang tak terhingga dan kasih sayang-Nya yang tak terbilang, penulis dapat menyelesaikan tesis yang berjudul Sintesis dan Karakterisasi Senyawa Turunan Trifeniltimah(IV) Hidroksibenzoat sebagai Inhibitor Korosi pada Baja Lunak dalam Medium Natrium Klorida. Shalawat teriring salam semoga tersampaikan kepada
Rasulullah Muhammad SAW beserta keluarga dan sahabat serta umatnya di akhir zaman, Allahuma aamiin.
Teriring doa jazaakumullahu khairan katsiiran, penulis mengucapkan terima kasih kepada:
1. Bapak Prof. Sutopo Hadi, M. Sc., Ph. D. selaku Pembimbing I dan
Pembimbing Akademik penulis, atas dedikasinya selama penulis menempuh pendidikan S1 dan S2, serta untuk semua keikhlasan, bimbingan dan nasihat yang diberikan hingga penelitian dan tesis ini dapat terselesaikan. Semoga Allah limpahkan barakah kepadanya.
2. Bapak Dr. Hardoko Insan Qudus, M. S selaku Pembimbing II yang telah membimbing penulis dengan penuh kesabaran, keikhlasan, serta ilmu yang telah diberikan sehingga tesis penulis dapat terselesaikan dengan baik. Semoga Allah membalasnya dengan kebaikan.
ii 3. Bapak Prof. Suharso, Ph. D. selaku Pembahas dalam penelitian penulis atas
semua bimbingan, nasihat, dan kesabaran beliau sehingga tesis ini dapat terselesaikan. Semoga Allah membalasnya dengan kebaikan.
4. Bapak Dr. Eng. Suripto Dwi Yuwono, M. T. selaku Ketua Jurusan Kimia FMIPA Unila.
5. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas seluruh dedikasi dan ilmu yang diberikan selama penulis menempuh perkuliahan. Semoga Allah melimpahkan baraakah kepada Bapak dan Ibu. 6. Bapak Prof. Warsito, S. Si., D.E.A., Ph. D. selaku dekan Fakultas Matematika
dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Alhamdulillahirrobil’alamiin, Allah lahirkan ananda ditengah keluarga kecil
yang begitu bahagia, kagem Bapak Sugini lan Ibu Suhatni tersayang, meski dunia dan seluruh isinya kelak pipin berikan tapi tak akan pernah cukup untuk membalas semua kasih sayang Bapak lan Ibu. Terima kasih untuk seluruh cinta, perjuangan, kesabaran, keikhlasan, doa serta semua dedikasi dalam mendidik ananda, semoga Allah membalas Surga untuk Bapak dan Ibu.
Allahuma aamiin.
8. Adikku Dwiky Ihwan Ma’ruf, semoga kita menjadi qurata’ayyun untuk Bapak dan Ibu, bersaudara dan selalu saling mengingatkan dalam kebaikan. 9. Pak Wo M dan Pak Wo A yang belum sempat melihat pipin sukses, tapi pipin
yakin Wo suatu hari atas izin Allah pipin akan sukses, serta untuk Mak Wo dan Mbok Wo yang selalu sayang pipin.
10. Kak Miftahudin Ramli Thohir, jazaakallahu khairan katsiran untuk semua doa, motivasi, dan kesabaran akak hingga hari ini, semoga Allah menjadikan
iii kita pribadi yang lebih baik dan pribadi yang selalu bersyukur. Baarakallah akak, tetap semangat untuk memantaskan diri.
11. Teruntuk sahabat seperjuanganku Mbak Ariyanti, Hanif Amrulloh ZA, dan Ridho Nahrowi, semoga persahabatan kita tidak hanya di dunia tapi kekal hingga Surga-Nya.
12. Magister Kimia 2014 yang hanya selusin: Kak Nawan, Pak Bas, Bu Waty, Bu Romi, Bu Iis, Mbak Putri, Mbak Yuli, Mbak Tini, Mbak Sinta, Mbak Endah, dan Mbak Ratu semangat pasti bisa.
13. Prof. Sutopo Hadi’s Research Group Pak Nuris, Pak Bambang, Bu Hastin,
Kamto, Murni, Adi, Jeje, dan adik-adik yang lain terima kasih untuk kerjasama dan bantuannya.
14. Mb Liza, Mb Nora, dan Pak Gani terima kasih atas seluruh bantuan yang diberikan kepada penulis.
15. Cici, Shasa, Riza, Yuli terima kasih ya adik-adik untuk keceriaannya di kosan.
16. Almamater tercinta, Universitas Lampung.
Penulis menyadari bahwa dalam penulisan tesis ini masih terdapat kekurangan dan kesalahan, untuk itu penulis mengharapkan kritik dan saran yang membangun demi perbaikan penulisan di masa datang. Semoga bermanfaat.
Bandar Lampung, April 2016 Penulis
iv DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... x
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
A. Senyawa Organologam ... 6
B. Senyawa Organotimah ... 6
C. Senyawa Organotimah Karboksilat ... 8
D. Kegunaan Senyawa Organotimah ... 10
E. Karakterisasi Senyawa Trifeniltimah(IV) Hidroksibenzoat... 13
1. Karakterisasi dengan Spektrofotometer UV-Vis ... 13
2. Karakterisasi dengan Spektrofotometer IR ... 14
3. Karakterisasi dengan Spektrometer NMR ... 16
4. Analisis Mikroelementer ... 18
F. Korosi ... 18
1. Korosi Batas Bulir... 20
2. Korosi Merata... 20
3. Korosi Sumuran ... ... 20
4. Korosi Celah... ... 21
5. Korosi Galvanik ... 21
6. Korosi Erosi ... 21
G. Korosi Baja Lunak pada Larutan Garam ... 22
H. Metode Penghambatan Korosi ... 24
1. Inhibitor Anodik... 25
2. Inhibitor Katodik... 25
3. Inhibitor Campuran ... 25
v
I. Metode Analisis Korosi ... 27
1. MetodeKehilangan Berat ... 27
2. Metode Polarisasi Potensiodinamik ... 28
III. METODE PENELITIAN ... 31
A. Waktu dan Tempat Penelitian ... 31
B. Alat dan Bahan ... 31
C. Prosedur Penelitian... 32
1. Sintesis Senyawa Trifeniltimah(IV) Hidroksibenzoat ... 32
2. Pembuatan Medium Korosif ... 33
3. Pembuatan Larutan Inhibitor... 34
4. Preparasi Baja Lunak ... 34
5. Pengujian Korosi dengan Metode Gravimetri... 34
6. Pengujian Korosi dengan Metode Polarisasi Potensidinamik... 36
7. Analisis Data ... 36
8. Analisis Kualitatif Permukaan Baja ... 37
IV. HASIL DAN PEMBAHASAN ... 38
A. Sintesis Senyawa Trifeniltimah(IV) Hidroksibenzoat ... 38
B. Karakterisasi Senyawa Trifeniltimah(IV) Hidroksibenzoat... 43
1. Karakterisasi Menggunakan Spektrofotometer Uv-Vis ... 43
2. Karakterisasi Menggunakan Spektrofotometer IR... 46
3. Karakterisasi Menggunakan Spektrometer NMR ... 53
4. Analisis Mikroelementer ... 59
C. Pengujian Korosi dengan Metode Gravimetri... 60
D. Pengujian Korosi dengan Metode Polarisasi Potensidinamik... 72
1. Aktivitas Antikorosi Senyawa Trifeniltimah(IV) Hidroksida... 73
2. Aktivitas Antikorosi Senyawa Asam Hidroksibenzoat... 75
3. Aktivitas Antikorosi Senyawa Trifeniltimah(IV) Hidroksibenzoat ... 80
E. Adsorpsi Isotermal Langmuir ... 90
F. Mekanisme Inhibisi Korosi Trifeniltimah(IV) Hidroksibenzoat ... 95
V. SIMPULAN DAN SARAN... 106
A. Simpulan ... 106
B. Saran... 107
DAFTAR PUSTAKA ... 108
vi DAFTAR TABEL
Tabel Halaman
1. Nilai pKa untuk beberapa turunan asam benzoat... 10 2. Efisiensi inhibisi korosi beberapa senyawa organotimah(IV) karboksilat
100 mg/L pada medium korosif DMSO-HCl ... 12 3. Serapan panjang gelombang spektrum UV dari senyawa trifeniltimah(IV)
hidroksibenzoat yang telah disintesis dengan bahan awal berbeda ... 14 4. Serapan karakteristik spektrum IR dari senyawa trifeniltimah(IV)
hidroksibenzoat yang telah disintesis dengan bahan awal berbeda ... 16 5. Kadar teoritis unsur C dan H pada senyawa organotimah(IV)
hidroksibenzoat ... 18 6. Komposisi baja karbon berdasarkan referensi... ... 22 7. Persen rendemen senyawa hasil sintesis ... 42 8. Serapan karakteristik spektrum IR dari senyawa trifeniltimah(IV)
2-hidroksibenzoat yang telah disintesis dan dibandingkan
dengan referensi ... 48 9. Serapan karakteristik spektrum IR dari senyawa trifeniltimah(IV)
3-hidroksibenzoat yang telah disintesis dan dibandingkan
dengan referensi ... 51 10. Serapan karakteristik spektrum IR dari senyawa trifeniltimah(IV)
4-hidroksibenzoat yang telah disintesis dan dibandingkan
dengan referensi ... 53 11. Data pergeseran kimia 1H dan13C NMR pada senyawa hasil sintesis.... 58 12. Komposisi persen unsur dalam senyawa hasil sintesis... ... 59 13. Penentuan laju korosi dan efisiensi inhibisi dengan metode gravimetri ... 61
vii 14. Efisiensi inhibisi penambahan senyawa trifeniltimah(IV) hidroksida
dibandingkan kontrol NaCl 0,1 M ... 75 15. Efisiensi inhibisi penambahan senyawa asam hidroksibenzoat
dibandingkan kontrol NaCl 0,1 M ... 78 16. Efisiensi inhibisi penambahan senyawa trifeniltimah(IV) hidroksibenzoat
dibandingkan kontrol NaCl 0,1 M ... 83 17. ∆ dari masing senyawa pada berbagai variasi konsentrasi... 93 18. Data kerapatan arus korosi dan arus korosi untuk seluruh pemindaian .... 119
viii DAFTAR GAMBAR
Gambar Halaman
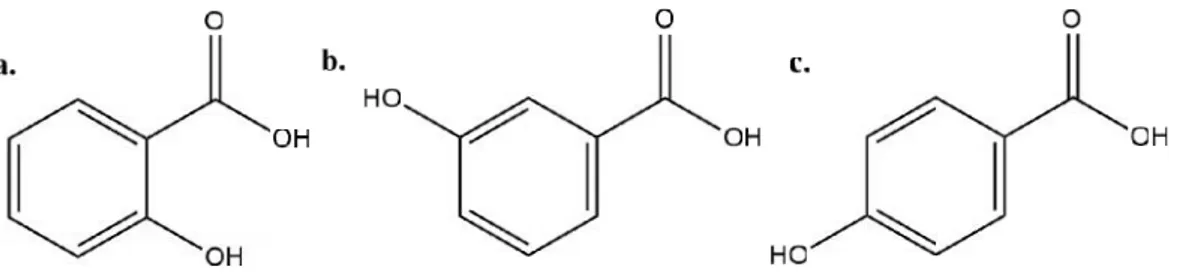
1. Struktur a. Asam 2-hidroksibenzoat b. Asam 3-hidroksibenzoat dan
c. Asam 4-hidroksibenzoat ... 9
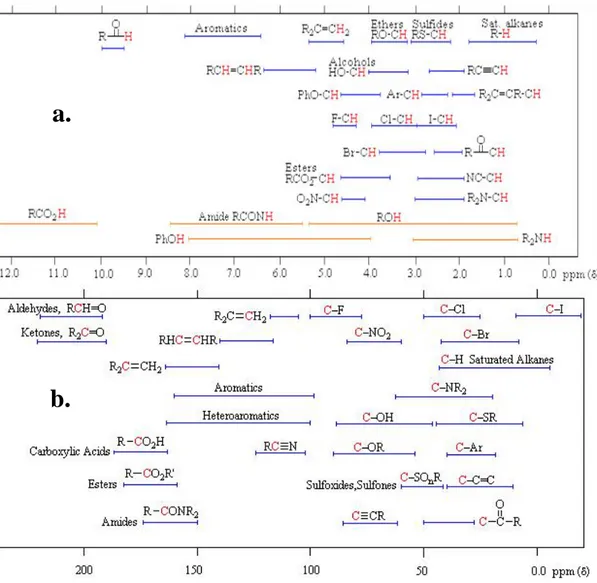
2. Serapan karakteristik spektrum a.1H dan b.13C NMR ... 17
3. Baja lunak yang digunakan dalam pengujian korosi... 22
4. Pengaruh kadar ion Cl-terhadap laju korosi ... 24
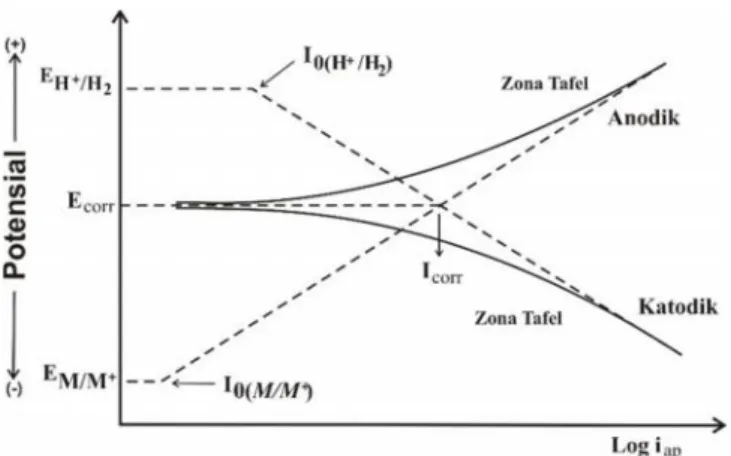
5. Kurva polarisasi anodik dan katodik ... 29
6. Pengaturan pemindaian a. katoda dan b. anoda ... 36
7. Reaksi pembentukan senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat, dan trifeniltimah(IV) 4-hidroksibenzoat... 38
8. Mekanisme asosiasi pembentukan senyawa trifeniltimah(IV) hidroksibenzoat ... 40
9. Senyawa hasil sintesis (a). trifeniltimah(IV) 2-hidroksibenzoat, (b). trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV) 4-hidroksibenzoat... 41
10. Perbedaan kelarutan dalam DMSO 5% (a). trifeniltimah(IV) 2-hidroksibenzoat, (b). trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV) 4-hidroksibenzoat... 42
11. Spektrum UV senyawa (a). trifeniltimah(IV) hidroksida (b). trifeniltimah(IV) 2-hidroksibenzoat, (c). trifeniltimah(IV) 3-hidroksibenzoat dan (d). trifeniltimah(IV) 4-3-hidroksibenzoat ... 44
12. Spektrum IR senyawa (a). trifeniltimah(IV) hidroksida (b). asam 2-hidroksibenzoat, (c). trifeniltimah(IV) 2-hidroksibenzoat... 47
ix 13. Spektrum IR senyawa (a). trifeniltimah(IV) hidroksida
(b). asam 3-hidroksibenzoat, (c). trifeniltimah(IV) 3-hidroksibenzoat... 49 14. Spektrum IR senyawa (a). trifeniltimah(IV) hidroksida
(b). asam 4-hidroksibenzoat, (c). trifeniltimah(IV) 4-hidroksibenzoat... 52 15. Spektrum12C NMR (a). trifeniltimah(IV) 2-hidroksibenzoat, (b).
trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV)
4-hidroksibenzoat ... 55 16. Spektrum1H NMR (a). trifeniltimah(IV) 2-hidroksibenzoat, (b).
trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV)
4-hidroksibenzoat ... 56 17. Penomoran unsur pada senyawa hasil sintesis ... 58 18. Contoh medium uji pada saat (a). awal perendaman dan (b). setelah
5 hari... 60 19. Efisiensi inhibisi senyawa trifeniltimah(IV) hidroksida dengan variasi
waktu perendaman dan konsentrasi ... 64 20. Efisiensi inhibisi dengan variasi waktu dan konsentrasi (a) asam
2-hidroksibenzoat (b) asam 3-2-hidroksibenzoat dan (c). asam
4-hidroksibenzoat... 65 21. Efisiensi inhibisi dengan variasi waktu dan konsentrasi (a) trifeniltimah(IV)
2-hidroksibenzoat (b) trifeniltimah(IV) 3-hidroksibenzoat dan
(c). trifeniltimah(IV) 4-hidroksibenzoat... 69 22. Medium uji setelah proses elektrolisis ... 72 23. Grafik pemindaian senyawa trifeniltimah(IV) hidroksida terhadap
kontrol medium korosif tanpa inhibitor ... 74 24. Grafik pemindaian senyawa (a) asam 2-hidroksibenzoat (b) asam
3-hidroksibenzoat dan (c). asam 4-3-hidroksibenzoat terhadap kontrol
medium korosif tanpa inhibitor... 76 25. Grafik perbandingan efisiensi inhibisi asam 2-hidroksibenzoat, asam
3-hidroksibenzoat dan asam 4-3-hidroksibenzoat ... 79 26. Grafik pemindaian senyawa (a) trifeniltimah(IV) 2-hidroksibenzoat
(b) trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV)
4-hidroksibenzoat terhadap kontrol medium korosif tanpa inhibitor... 82 27. Grafik perbandingan efisiensi inhibisi trifeniltimah(IV) hidroksida,
x 28. Grafik perbandingan efisiensi inhibisi trifeniltimah(IV) hidroksida,
asam 3-hidroksibenzoat dan trifeniltimah(IV) 3-hidroksibenzoat ... 85
29. Grafik perbandingan efisiensi inhibisi trifeniltimah(IV) hidroksida, asam 4-hidroksibenzoat dan trifeniltimah(IV) 4-hidroksibenzoat ... 87
30. Grafik perbandingan efisiensi inhibisi trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-hidroksibenzoat ... 87
31. Perbedaan larutan hasil uji gravimetri senyawa (a). trifeniltimah(IV) 2-hidroksibenzoat, (b). trifeniltimah(IV) 3-hidroksibenzoat dan (c). trifeniltimah(IV) 4-hidroksibenzoat... 88
32. Perbedaan permukaan baja diamati dengan mikroskop (a). tanpa penambahan inhibitor dan (b). dengan penambahan senyawa trifeniltimah(IV) 4-hidroksibenzoat ... 89
33. Hubungan linier antara Cinh/ dengan konsentrasi inhibitor berdasarkan persamaan adsorpsi isotermal Langmuir... 91
34. Kurva polarisasi (a). katoda dan (b). anoda senyawa trifeniltimah(IV) 4-hidroksibenzoat... 97
35. Interaksi inhibitor dengan elektroda... 102
36. Proses penghambatan korosi oleh inhibitor di alam ... 103
DAFTAR LAMPIRAN
Lampiran Halaman
1. Skema tahapan penelitian... 114 2. Perhitungan rendemen hasil sintesis... 114 3. Penentuan komposisi teoritis unsur C dan H... 115 4. Penentuan luas baja terukur pada metode gravimetri dan potensiostat... 116 5. Perhitungan nilai laju korosi dan persen efisiensi inhibisi senyawa uji
dengan metode gravimetri (kehilangan berat)... 117 6. Perhitungan efisiensi inhibisi senyawa uji dengan metode polarisasi
potensiodinamik ... 118 7. Perhitungan nilai energi bebas adsorpsi ... 120
1
I. PENDAHULUAN
A. Latar Belakang
Baja karbon adalah baja yang bukan hanya tersusun atas padanan besi dan karbon, tetapi juga unsur lain yang tidak mengubah sifat baja. Baja karbon diproduksi dalam bentuk balok, profil, lembaran dan kawat. Salah satu jenis baja karbon adalah baja lunak yaitu baja dengan kandungan karbon yang relatif rendah
berkisar antara 0,022 – 0,3 % (Amanto dan Daryanto, 2006). Baja lunak memiliki sifat yang ringan, harga relatif murah, dan banyak digunakan di berbagai bidang seperti proses industri (Prabhu et al., 2003; Doner et al., 2011), pembangkit listrik tenaga nuklir, proses pengolahan bahan bakar fosil, transportasi, proses kimia, pipa-pipa pertambangan dan pengolahan minyak bumi, dan konstruksi (Wan Nik
et al., 2011; Ketis dkk., 2010). Di sisi lain, penggunaan baja lunak dalam jumlah
besar tersebut tidak sebanding dengan ketahanan baja lunak terhadap korosi. Hal ini tentu akan menimbulkan masalah terutama di bidang industri sehingga
diperlukan metode yang tepat untuk menanggulangi korosi pada baja lunak (Wan Nik et al., 2011)
Lingkungan dengan kadar garam yang tinggi seperti air laut memiliki tingkat korosivitas yang tinggi, sehingga diperlukan suatu metode yang tepat untuk menanggulangi korosi pada daerah ini (Nugroho, 2011). Pada penelitian ini
2
pengujian korosi tidak dilakukan dalam air laut secara langsung tetapi
menggunakan larutan garam, sebab larutan garam memiliki agresifitas yang lebih besar dibandingkan air laut alami. Hal ini dikarenakan adanya ion Mg2+dan Ca2+ dalam air laut dapat memperkecil laju korosi akibat kemampuannya dalam
membentuk lapisan CaCO3dan Mg(OH)2di permukaan logam akibat reaksi katodik oksigen dipermukaan logam (Scumacer, 1999). Menurut Iswahyudi (2007), laju korosi baja karbon optimum pada larutan dengan konsentrasi NaCl 3-3,5%, hal ini dikarenakan oksigen dapat terlarut maksimum di dalam air pada konsentrasi tersebut sehingga pada penelitian ini digunakan medium garam dengan konsentrasi NaCl 3,5% pada pengujian dengan metode gravimetri dan NaCl 0,1 M pada metode polarisasi potensiodinamik.
Korosi pada permukaan luar suatu material dapat ditangani dengan berbagai cara antara lain pengecatan, metode perlindungan katodik dan pelapisan dengan logam atau dengan membuat padanan logam seperti stainless stell (Ketis dkk., 2010; Rahmani, 2011) tetapi korosi pada bagian dalam suatu material seperti pipa hanya dapat dikendalikan oleh suatu inhibitor korosi (Ketis dkk., 2010). Beberapa contoh inhibitor yang digunakan dalam menangani korosi baja dalam medium garam antara lain berupa inhibitor seperti ekstrak ubi ungu (Nugroho, 2011), asam glutamat (Ketis dkk., 2010), dan tanin pada mangrove (Yahya et al., 2011).
Inhibitor tersebut tergolong ke dalam inhibitor organik, inhibitor jenis ini ramah lingkungan dan dapat teradsorpsi pada permukaan logam tetapi tidak tahan terhadap perubahan fisik lingkungan seperti perubahan suhu. Inhibitor lain yang digunakan dalam penghambatan korosi baja antara lain senyawaan kromat, nitrat, silikat, posfat (Halimatudahliana, 2003; Zuas, 2003). Inhibitor tersebut tergolong
3
dalam inhibitor anorganik yang dapat melindungi permukaan baja dengan membentuk lapisan tipis pada permukaan logam melalui proses adsorpsi (Zuas, 2003). Senyawa organotimah merupakan senyawa anorganik yang mengikat gugus-gugus organik sehingga diharapkan mampu memberikan penghambatan korosi yang baik melalui perpaduan sifat senyawa anorganik dan organiknya.
Senyawa organotimah adalah senyawa yang mengandung sedikitnya satu ikatan kovalen C-Sn (Pellerito and Nagy, 2002). Ketertarikan terhadap senyawa organotimah(IV) tidak hanya karena sifat kimia dan strukturnya yang sangat menarik (Tiekink, 1991), tetapi juga karena penggunaannya yang terus meningkat diantaranya sebagai biosida pertanian (Pellerito and Nagy, 2002; Gielen, 2003), antifouling bagi cat kapal dilautan (Blunden and Hill, 1987), pengawet kayu (Blunden and Hill, 1991), antifungi (Bonire et al., 1998; Hadi et al., 2009), sebagai katalis (Blunden et al., 1987), antikanker (de Vos et al., 1998; Gielen, 2003; Hadi and Rilyanti, 2010; Hadi et al., 2012) dan penelitian terbaru
menerangkan bahwa senyawa turunan dibutiltimah(IV) di-3-nitrobenzoat (Hadi et
al., 2015), organotimah ditiohidrazodikarbonamida (Rastogi et al., 2005),
organotimah ditiobiurets (Rastogi et al., 2011) dan beberapa senyawa turunan organotimah baik golongan karboksilat, posfat, ligan donor –N maupun –S, diketahui memiliki aktivitas yang baik sebagai inhibitor korosi (Singh et al., 2010).
Pada penelitian ini dilakukan sintesis, karakterisasi dan uji antikorosi dari
senyawa trifeniltimah(IV) hidroksibenzoat yang merupakan turunan organotimah karboksilat. Pengujian korosi dilakukan dalam medium NaCl dengan 2 metode
4
yaitu metode kehilangan berat dan metode polarisasi potensiodinamik untuk mengukur laju korosi dan efisiensi inhibisi masing-masing inhibitor. Data arus korosi hasil ekstrapolasi Tafel dari metode polarisasi potensiodinamik juga digunakan untuk menentukan kesesuaian adsorpsinya dengan adsorpsi isotermal Langmuir. Ligan asam hidroksibenzoat memiliki gugus -OH yang terikat pada gugus fenil merupakan gugus pendonor elektron yang lebih kuat dibanding gugus -Cl dan -NO2(McMurry, 2012). Efek dorongan elektron ini berpengaruh
terhadap sifat kebasaan senyawanya. Berdasarkan penelitian yang telah dilakukan sebelumnya, nilai efisiensi inhibisi memiliki hubungan dengan nilai pKa ligan. Semakin tinggi nilai pKa akan meningkatkan kemampuan inhibisi korosinya. Asam hidroksibenzoat memiliki nilai pKa yang lebih tinggi jika dibandingkan dengan asam nitrobenzoat dan asam klorobenzoat diharapkan dapat meningkatkan efisiensi inhibisi dari senyawa yang diuji.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mensintesis senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-3-hidroksibenzoat yang didukung dengan data hasil karakterisasinya.
2. Menghitung efisiensi inhibisi korosi senyawa trifeniltimah(IV)
2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-hidroksibenzoat yang disintesis pada medium garam.
5
3. Mengkaji kesesuaian pola adsorpsi senyawa trifeniltimah(IV) hidroksibenzoat dengan adsorpsi isotermal Langmuir.
C. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan sumbangan pengetahuan pada bidang kimia organologam terkait pemanfaatan senyawa turunan organotimah(IV) hidroksibenzoat sebagai inhibitor korosi dalam medium garam.
6
II. TINJAUAN PUSTAKA
A. Senyawa Organologam
Senyawa organologam merupakan senyawa yang setidaknya terdapat satu atom karbon dari gugus organik yang berikatan langsung dengan logam. Sebagai contoh suatu alkoksida seperti (C3H7O4)Ti bukan termasuk senyawa
organologam, karena gugus organiknya terikat pada Ti melalui atom oksigen, sedangkan senyawa (C6H5)Ti(OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik (Cotton dan Wilkinson, 2007).
B. Senyawa Organotimah
Senyawa organotimah adalah senyawa-senyawa yang mengandung sedikitnya satu ikatan kovalen C-Sn. Sebagian besar senyawa organotimah dapat dianggap sebagi turunan dari RnSn(IV)X4-n (n = 1-4) dan diklasifikasikan sebagai mono-, di-, tri- dan tetra- organotimah (IV), tergantung pada jumlah gugus alkil (R) atau aril (Ar) yang terikat. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002).
7
Gugus alkil (R) atau aril (Ar) dan ligan X yang terikat dalam senyawa
organotimah mempengaruhi derajat ion dari ikatan Sn-X. Sebagai contoh, titik leleh dari (CH3)3SnX bervariasi untuk: fluorida (300ºC) > klorida (37ºC) > bromida (27ºC) > iodida (3,4ºC) (Tayer, 1988). Hal ini dikarenakan dalam satu golongan semakin ke bawah jari jari atom F, Cl, Br, I meningkat sehingga interaksi ikatann antara Sn-F lebih kuat dibanding Sn-Cl, dan Sn-Cl lebih kuat dibanding Sn-Br, sehingga kemudahan anion X mengion lebih mudah terjadi pada Sn-Br, kemudian Sn-Cl dan Sn-F.
Meskipun kekuatan ikatannya bervariasi, akan tetapi atas dasar sifat tersebut senyawa-senyawa turunan organotimah dapat disintesis. Senyawa turunan organotimah yang berhasil disintesis pertama kali tahun 1971 adalah
[MeSn(4-anisil)(1-naftil)(CH2CH2C(OH)Me2)] (Greenwood and Earnshaw, 1990). Empat tipe utama penstabil timah berdasarkan gugus alkilnya yaitu: oktil, butil, fenil dan metil. Senyawa oktil timah memiliki kandungan timah paling sedikit dan paling kurang efisien. Ligan-ligan utama yang digunakan untuk membedakan berbagai penstabil timah yaitu, asam tioglikolat ester dan asam karboksilat (Van Der Weij, 1981).
Senyawa organotimah merupakan monomer yang dapat membentuk
makromolekul stabil, padatan dan cairan yang sangat mudah menguap dan tidak berwarna serta stabil terhadap hidrolisis dan oksidasi. Kecenderungan
terhidrolisis dari senyawa organotimah lebih lemah dibandingkan senyawa Si atau Ge yang terkait dan ikatan Sn-O dapat bereaksi dengan larutan asam. Senyawa organotimah tahan terhadap hidrolisis atau oksidasi pada kondisi normal
8
walaupun dibakar menjadi SnO2, CO2dan H2O. Kemudahan putusnya ikatan Sn-C oleh halogen atau reagen lainnya bervariasi berdasarkan gugus organiknya dan urutannya meningkat dengan urutan :
Butil (paling stabil) < Propil < etil < metil < vinil < Fenil < Benzil < alil < CH2CN < CH2CO2R (paling tidak stabil) (Van der Weij,1981).
C. Organotimah Karboksilat
Organotimah karboksilat merupakan bagian dari organotimah yang mendapat perhatian paling luas karena penemuan potensi aplikasi dari senyawa organotimah karboksilat dan turunnya untuk berbagai uji biologis sudah semakin mendunia. Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan asam karboksilat dan dari organotimah halidanya dengan garam karboksilat.
Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal. Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksinya adalah sebagai berikut :
RnSnCl4-n + (4-n) MOCOR RnSn(OCOR)4-n + (4-n) MCl
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada reaksi berikut :
R2SnO + 2 R’COOH R2Sn(OCOR’)2 + H2O
9
Pada penelitian ini telah disintesis senyawa turunan organotimah(IV) 2-hidroksibenzoat, organotimah(IV) 3-2-hidroksibenzoat, dan organotimah(IV) 4-hidroksibenzoat dari bahan awal suatu trifeniltimah(IV) hidroksida dan ligan asam 2-hidroksibenzoat, asam 3-hidroksibenzoat, serta 4-hidroksibenzoat dalam pelarut metanol dengan waktu sintesis selama 4 jam. Ligan asam hidroksibenzoat
memiliki gugus -OH yang terikat pada gugus fenil merupakan gugus donor elektron yang lebih kuat dibanding gugus -Cl dan -NO2(McMurry, 2012) sehingga diharapkan mampu memberikan efek inhibisi korosi yang yang lebih kuat. Struktur ligan yang digunakan dalam sintesis dapat dilihat pada Gambar 1.
Gambar 1. Struktur a. Asam 2-hidroksibenzoat b. Asam 3-hidroksibenzoat dan c. Asam 4-hidroksibenzoat.
Gugus –OH yang terikat pada posisi orto dari asam benzoat mempunyai ikatan hidrogen intramolekul yang secara tidak langsung mengurangi aktivitas gugus -OH dan -CO-OH terhadap molekul air sehingga kelarutan dalam air menurun. Asam orto-hidroksibenzoat juga memiliki nilai keasaman yang lebih tinggi dan kemampuan membentuk kelat lebih besar dibanding posisi meta dan para. Posisi meta dan para hidroksibenzoat cenderung lebih sulit membentuk ikatan hidrogen intermolekul sehingga kelarutanya dalam air lebih besar dibandingkan pada posisi orto. Perubahan sifat fisika kimia tersebut juga mempengaruhi aktivitas
10
antibiologis dari senyawa organotimahnya (Petra, 2012). Nilai pKa beberapa turunan asam benzoat dapat dilihat pada Tabel 1.
Tabel 1. Nilai pKa untuk beberapa turunan asam benzoat.
No Asam benzoat Subtituen Posisi Substitusi
2- 3- 4-1 H 4,2 4,2 4,2 2 -OH 3,0 4,1 4,5 3 -OCH3 4,1 4,1 4,5 4 -Br 2,9 3,8 4,0 5 -Cl 2,9 3,8 4,0 6 -NO2 2,2 3,5 3,4
(Sumber: Fessenden dan Fessenden, 1986)
D. Kegunaan Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa
stabilizer polivinilklorida, pestisida nonsistematik, katalis antioksidan, antifouling agents dalam cat, stabilizer pada plastik dan karet sintetik, stabilizer untuk parfum
dan berbagai macam peralatan yang berhubungan dengan medis dan gigi (Pellerito and Nagy, 2002).
11
Mono- dan diorganotimah digunakan secara luas sebagai stabilizer
polivinilklorida untuk mengurangi degradasi polimer polivinilklorida. Senyawa organotimah yang paling umum digunakan sebagai katalis dalam sintesis kimia yaitu katalis mono dan diorganotimah. Senyawa organotimah merupakan katalis yang bersifat homogen yang baik untuk pembuatan polisilikon, poliuretan dan untuk sintesis poliester.
Senyawa organotimah ditemukan berikutnya antara lain sebagai biosida (senyawa yang mudah terdegradasi), sebagai pestisida yang pertama kali diperkenalkan di Jerman yaitu dari senyawa trifeniltimah asetat pada akhir 1950-an. Kegunaan yang utama dari agrokimia senyawa organotimah karena senyawa ini relatif memiliki fitotoksisitas (daya racun pada tanaman) yang rendah dan terdegradasi dengan cepat sehingga residunya tidak berbahaya terhadap lingkungan (Cotton dan Wilkinson, 2007).
Senyawa organotimah(IV) telah diketahui memiliki aktivitas biologi yang kuat. Sebagian besar senyawa organotimah(IV) bersifat toksik walaupun pada
konsentrasi rendah. Aktivitas biologi ini ditentukan oleh jumlah dan gugus organik yang terikat pada pusat atom Sn. Senyawa organotimah karboksilat diberikan perhatian khusus dikarenakan senyawa ini memiliki kemampuan biologi yang kuat dibandingkan senyawa organotimah lainnya (Mahmood et al., 2003; Pellerito and Nagy, 2002).
Dalam beberapa penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroba (Bonire et al., 1998). Diketahui
12
bahwa kompleks di- dan triorganotimah halida dengan berbagai ligan yang mengandung nitrogen, oksigen, dan sulfur memiliki aktivitas biologi dan farmakologi dan digunakan sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain et al., 2003). Penelitian terbaru menjelaskan bahwa senyawa organotimah dapat dimanfaatkan sebagai inhibitor korosi (Rastogi et al., 2005; Singh et al., 2010; Rastogi et al., 2011; Hadi et al., 2015). Beberapa contoh senyawa organotimah karboksilat yang pernah diuji sebagai inhibitor korosi dalam medium DMSO-HCl pada konsentrasi 100 mg/L antara lain dirangkum pada Tabel 2.
Tabel 2. Efisiensi inhibisi korosi beberapa senyawa organotimah(IV) karboksilat 100 mg/L pada medium korosif DMSO-HCl.
(Sumber: Afriyani, 2014; Anggraini, 2014; Nurissalam,2015; Iswantoro, 2015; Kurniasih, 2015)
Senyawa Organotimah Efisiensi Inhibisi(%) Difeniltimah(IV) 2-Nitrobenzoat 36,12 Trifeniltimah(IV) 2-Nitrobenzoat 51,35 Difeniltimah(IV) 3-Nitrobenzoat 32,15 Trifeniltimah(IV) 3-Nitrobenzoat 34,25 Dibutiltimah(IV) 2-klorobenzoat 53,70 Difeniltimah(IV) 2-klorobenzoat 55,96 Trifeniltimah(IV) 2-klorobenzoat 61,55 Dibutiltimah(IV) 3-klorobenzoat 50,84 Difeniltimah(IV) 3-klorobenzoat 51,32 Trifeniltimah(IV) 3-klorobenzoat 56,52 Dibutiltimah(IV) 4-klorobenzoat 48,31 Difeniltimah(IV) 4-klorobenzoat 48,31 Trifeniltimah(IV) 4-klorobenzoat 51,35
13
E. Karakterisasi Senyawa Trifeniltimah(IV) Hidroksibenzoat
Untuk meyakinkan senyawa trifeniltimah(IV) hidroksibenzoat yang disintesis telah terbentuk dengan baik maka perlu dilakukan pengujian rendemen secara kuantitatif dan kualitatif. Pengujian secara kuantitatif dilakukan dengan
menghitung besarnya nilai persen rendemen dan analisis mikroelementer untuk mengetahui tingkat kemurniannya sedangkan pengujian secara kualitatif
dilakukan dengan spektrofotometer UV-Vis, spektrofotometer IR, spektrometer NMR.
1. Karakterisasi dengan Spektrofotometer UV-Vis
Spektrofotometri UV-Vis adalah salah satu teknik analisis spektroskopi yang terjadi akibat interaksi radiasi elektromagnetik ultraviolet dekat (200-380 nm) dan sinar tampak (380-780 nm) dengan suatu materi menggunakan alat
spektrofotometer. Absorbsi cahaya UV-Vis mengakibatkan transisi elektronik, yaitu promosi elektron-elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi. Energi yang terserap
kemudian terkuantisasi sebagai cahaya atau tersalurkan dalam reaksi kimia. Absorbsi cahaya tampak dan radiasi ultraviolet meningkatkan energi elektronik sebuah molekul, artinya energi yang disumbangkan oleh foton-foton
memungkinkan elektron-elektron itu tereksitasi ke tingkat energi yang lebih tinggi.
Spektrum UV maupun tampak terdiri dari pita absorbsi, lebar pada daerah panjang gelombang yang lebar. Hal ini disebabkan terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Transisi
14
elektronik dapat terjadi dari berbagai tingkat energi keadaan dasar ke tingkat energi pada keadaan eksitasi. Karena perbedaan energi dari berbagai transisi elektronik tersebut hanya berbeda sedikit, maka panjang gelombang absorpsinya juga berbeda sedikit dan menimbulkan pita lebar yang tampak dalam spektrum.
Karakterisasi dengan spektrofotometer UV ditujukan untuk mengetahui
pergeseran serapan panjang gelombang akibat pergantian kromofor yang terikat pada logam dan ligan. Data pembanding serapan panjang gelombang senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat, dan trifeniltimah(IV) 4-hidroksibenzoat yang telah disintesis dari bahan awal yang berbeda oleh ‘Aini (2010), Sulistriani (2012), dan Elianasari dan Hadi (2012) dapat dilihat pada Tabel 3.
Tabel 3. Serapan panjang gelombang spektrum UV dari senyawa
trifeniltimah(IV) hidroksibenzoat yang telah disintesis dengan bahan awal berbeda (‘Aini, 2010; Sulistriani, 2012; Elianasari dan Hadi, 2012).
Senyawa Organotimah Panjang Gelombang (nm)
→ ∗ → ∗ Asam 2-hidroksibenzoat 233 290 Asam 3-hidroksibenzoat 233 290 Asam 4-hidroksibenzoat 233 290 Trifeniltimah(IV) hidroksida 204 293 Trifeniltimah(IV) 2-hidroksibenzoat 223 297 Trifeniltimah(IV) 3-hidroksibenzoat 215 298 Trifeniltimah(IV) 4-hidroksibenzoat 206 254
2. Karakterisasi dengan Spektrofotometer IR
Spektrofotometri IR merupakan suatu metode yang digunakan untuk mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah
15
panjang gelombang 0,75-1000 µm atau pada bilangan gelombang 13000-10cm-1 menggunakan alat spektrometer. Setiap senyawa yang memiliki ikatan kovalen, baik senyawa organik, anorganik, maupun organologam akan menyerap berbagai frekuensi radiasi elektromagnetik dalam daerah spektrum inframerah sehingga atom-atom yang berikatan dalam molekul tidak tinggal diam tetapi bervibrasi secara kontinyu. Beberapa vibrasi menghasilkan pemindahan periodik atom-atom sehingga menyebabkan perubahan simultan dalam jarak antar atom-atomnya. Frekuensi dari vibrasi berada pada kisaran 1013-1014putaran per detik, dimana kisaran tersebut sama dengan frekuensi radiasi inframerah (Settle, 1997).
Jika suatu molekul bervibrasi dengan disertai perubahan momen dipol diradiasi dengan sinar inframerah, maka frekuensi radiasi yang sesuai dengan frekuensi transisi vibrasi intramolekul akan diserap seluruhnya atau sebagian. Jika persentase radiasi radiasi terserap diplotkan terhadap (panjang gelombang) maka frekuensi yang diperoleh menggambarkan vibrasi intramolekulnya. Grafik tersebut akan memberikan informasi karakteristik untuk setiap material sehingga dapat diperoleh informasi tentang struktur dan sifat-sifat ikatan dalam molekul. Vibrasi-vibrasi interatom secara umum diklasifikasikan menjadi dua, yaitu vibrasi ulur (stretching) dan vibrasi tekuk (bending) (Settle, 1997).
Dalam sintesis suatu senyawa organotimah(IV) karboksilat, monitoring jalannya reaksi dapat dilihat dari perubahan spektrum IR dari senyawa awal, ligan dan senyawa akhir. Daerah yang menjadi fokus perhatian dalam spektrumnya adalah munculnya puncak karbonil dari senyawa akhir yang menunjukkan telah
16
serapan karakteristik dari senyawa organotimah(IV) karboksilat dan refrensi serapan dari senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat, dan trifeniltimah(IV) 4-hidroksibenzoat yang telah disintesis oleh ‘Aini(2010), Sulistriani(2012), dan Elianasari dan Hadi (2012) dapat dilihat pada Tabel 4.
Tabel 4. Serapan karakteristik spektrum IR dari senyawa trifeniltimah(IV) hidroksibenzoat yang telah disintesis dengan bahan awal berbeda (‘Aini, 2010; Sulistriani, 2012; Elianasari dan Hadi, 2012).
Serapan Bilangan gelombang (C6H5)3Sn(OCOC6H4(OH)(cm
-1 )
Refrensi orto meta para
Sn-O 800-600 759,17 760,31 755,41 Sn-O-C 1250-1000 1248,6 1234,59 1298,70 CO2asimetri 1500-1400 1442,36 1448,47 1562,30
O-H 3100-3500 3446,15 3415,02 3413,50 C = O 1600-1760 1659,37 1547,77 1548,60
3. Karakterisasi dengan Spektrometer NMR
Karakterisasi dengan spektrometer ini diidasarkan pada interaksi medan magnet dengan inti suatu molekul dengan jumlah proton ganjil. Apabila suatu materi dikenakan energi dari medan magnet dengan kuat medan magnet permanen sebesar 7046-14002 Gauss atau setara dengan 30-60 MHz maka akan terjadi perubahan orientasi spin menjadi lebih teratur kemudian proton tersebut
diinteraksikan dengan gelombang radio sehingga menyebabkan proton menyerap energi dan berpindah ke tingkat energi yang lebih tinggi disertai perubahan arah orientasi spin. Perubahan energi tersebut kemudian dikuantisasi oleh alat dan dibaca detektor kemudian diperoleh data berupa pergeseran kimia ( ) yang nilainya telah dibandingkan dengan standar berupa tetrametilsilan (TMS).
17
Masing-masing proton memiliki serapan yang berbeda bergantung lingkungan kimia disekitar proton (McMurry, 2012).
Senyawa organotimah(IV) yang telah disintesis kemudian dikarakterisasi dengan spektrometri1H dan13C NMR untuk mengetahui lingkungan kimia dari masing-masing proton sehingga dapat digunakan untuk memastikan senyawa yang disintesis telah terbentuk dengan membandingkan data spektrum hasil
karakterisasi dengan referensi. Beberapa serapan karakteristik spektrum1H dan 13
C NMR dapat dilihat pada Gambar 2.
Gambar 2. Serapan karakteristik spektrum a.1H dan b.13C NMR.
a.
18
4. Analisis Mikroelementer
Analisis mikroelementer merupakan salah satu analisis kuantitatif yang dapat digunakan untuk menentukan kemurnian sampel senyawa organotimah yang disintesis dengan membandingkan data kadar unsur yang dihasilkan alat dengan data hasil perhitungan. Unsur-unsur yang umum ditentukan kadarnya adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S) dengan menggunakan instrumen CHNS microelemental analyzer (Costech Analytical Technologies, 2011). Senyawa hasil sintesis dikatakan murni jika perbedaan hasil yang
diperoleh dari mikroanalisis dibandingkan dengan perhitungan secara teori masih berkisar antara 1-5% (Caprette, 2007). Kadar teoritis unsur C dan H pada
senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat, dan trifeniltimah(IV) 4-hidroksibenzoat dapat dilihat pada Tabel 5.
Tabel 5. Kadar teoritis unsur C dan H pada senyawa organotimah(IV) hidroksibenzoat.
Senyawa Kadar teoritis (%)
C H
[(C6H5)3Sn(OCOC6H4(2-OH)] 61,6 4,1
[(C6H5)3Sn(OCOC6H4(3-OH)] 61,6 4,1
[(C6H5)3Sn(OCOC6H4(4-OH)] 61,6 4,1
F. Korosi
Korosi secara umum didefinisikan sebagai suatu peristiwa kerusakan atau penurunan kualitas suatu bahan yang disebabkan oleh terjadinya reaksi dengan lingkungannya. Korosi pada logam (perkaratan) yaitu peristiwa perusakan pada logam yang disebabkan oleh reaksi oksidasi (Fontana, 1986). Dampak yang dapat
19
ditimbulkan akibat kerusakan oleh korosi akan sangat besar pengaruhnya terhadap kehidupan manusia, antara lain dari segi ekonomi dan lingkungan. Dari segi ekonomi misalnya tingginya biaya perawatan, tingginya biaya bahan bakar dan energi akibat kebocoran uap, kerugian produksi pada suatu industri akibat adanya pekerjaan yang terhenti pada waktu perbaikan bahan yang terserang korosi, dan dari segi lingkungan misalnya adanya proses pengkaratan besi yang berasal dari berbagai konstruksi yang dapat mencemarkan lingkungan (Yerimadesi, 2001).
Korosi dapat dipengaruhi oleh beberapa faktor antaralain faktor fisika seperti temperatur, kelembaban, arus listrik, dan kecepatan alir, faktor biologi seperti aktifitas mikroorganisme serta faktor kimia seperti adanya air, udara, amoniak, klorida, larutan asam, basa, garam dan gas buang industri (Trethewey and Chamberlein, 1991). Faktor utama penyebab korosi adalah udara dan air karena udara yang jenuh dengan uap air banyak mengandung garam-garam, asam, zat-zat kimia dan gas-gas yang dapat mempercepat laju korosi (Fontana, 1986).
Korosi sangat mudah terjadi dalam medium berair, baik larutan asam maupun garam. Adanya zat terlarut yang membentuk asam seperti belerang dioksida dan karbon dioksida dapat mempercepat laju korosi. Dalam medium garam, korosi akan lebih cepat terjadi karena sifat elektrolit dari larutan garam memungkinkan proses reduksi dan oksidasi berlangsung dengan baik (Trethewey and
Chamberlein, 1991). Pada penelitian ini digunakan medium korosif berupa larutan garam NaCl 3,5% untuk mengetahui kemampuan inhibisi korosi senyawa trifeniltimah(IV) hidroksibenzoat pada baja lunak.
20
Korosi dapat dibagi menjadi enam jenis berdasarkan bentuknya yaitu; korosi batas bulir, korosi merata, korosi sumuran, korosi celah, korosi galvanik dan korosi erosi (Fontana, 1986).
1. Korosi Batas Bulir
Korosi batas butir merupakan korosi yang terjadi pada batas butir logam. Dalam hal ini timbul keretakan pada logam akibat korosi melalui batas butir. Retak yang ditimbulkan korosi jenis ini disebut stress corrosion cracking (SCC) yang terdiri atas retak interglanular dan retak transgranular. Retak intergranular berjalan sepanjang batas butir, sedangkan retak transgranular berjalan tanpa menyusuri batas butir tersebut.
2. Korosi Merata
Korosi merata merupakan bentuk korosi yang sering terjadi dan banyak dijumpai pada besi yang mengalami perendaman dalam larutan asam. Logam besi akan menjadi tipis secara merata pada permukaannya dengan kecepatan yang hampir sama, sehingga daerah-daerah anoda dan katoda tersebar pada seluruh permukaan. Contohnya sebatang besi (Fe) atau seng (Zn) direndam dalam larutan H2SO4, keduanya akan larut dengan laju yang merata pada permukaan logam.
3. Korosi Sumuran
Korosi sumuran adalah bentuk penyerangan korosi setempat yang menghasilkan sumur pada logam ditempat tertentu (Fontana, 1986). Logam mula-mula
terserang korosi pada suatu titik di permukaannya atau pada daerah tertentu yang sangat kecil dan diteruskan menuju ke dalam logam. Penyebab korosi sumuran yang paling umum adalah serangan selektif terhadap logam di tempat-tempat yang
21
lapisan pelindung permukaannya tergores atau pecah akibat perlakuan mekanik. Korosi ini terjadi pada permukaan oksida pelindung logam yang terjadi sebagai stimulasi dari reaksi anoda, aktivasi anion, reaksi katoda melalui kehadiran agen pengoksidasi dan melalui permukaan katoda efektif dengan polarisasi rendah. Korosi sumuran akan terjadi jika logam memenuhi potensial korosi minimum yang selanjutnya disebut sebagai potensial pitting.
4. Korosi Celah
Korosi ini terjadi pada suatu logam di daerah yang berhubungan langsung dengan bahan lain yang bukan logam. Umumnya terjadi karena terdapat perbedaan konsentrasi larutan atau konsentrasi oksigen, sehingga menyebabkan adanya perbadaan potensial oksidasi pada logam tersebut.
5. Korosi Galvanik
Korosi galvanik terjadi karena perbedaan potensial antara dua logam yang tidak sama, bila kedua logam ini bersinggungan akan menghasilkan aliran elektron diantara kedua logam tersebut. Logam yang lebih mulia bersifat katodik dan akan diserang korosi lebih kecil, sedangkan logam yang kurang mulia bersifat anodik dan akan lebih mudah diserang korosi.
6. Korosi Erosi
Korosi erosi disebabkan oleh gabungan peristiwa korosi dan korosi akibat aliran fluida sehingga proses korosi lebih cepat. Korosi ini dicirikan oleh adanya gelombang, lembah yang biasanya merupakan suatu pola tertentu.
22
G. Korosi Baja Lunak pada Larutan Garam
Pada penelitian ini digunakan baja berkarbon rendah dengan kadar karbon berkisar antara0,022 – 0,3 %yang diproses melalui pemanasan dan berupa lembaran dan biasa digunakan sebagai plat strip, jenis ini dikenal dengan nama
hot roller plate atau HRP. Contoh baja yang digunakan pada pengujian korosi
terdapat pada Gambar 3. Komposisi baja karbon ini berdasarkan referensi dapat dilihat pada Tabel 6.
Gambar 3. Baja lunak yang digunakan dalam pengujian korosi.
Tabel 6. Komposisi baja karbon berdasarkan referensi (Ketis dkk., 2010).
Unsur Kadar (%) Unsur Kadar (%)
Fe 99,5756 Nb 0,0012 C 0,2298 V 0,0029 Ni 0,0046 Cu 0,0066 Cr 0,0189 W 0.0001 P 0,0123 Ti 0,0025 Mn 0,2298 Sn 0,0014 Zn 0,0023 Pb 0,0022 Al 0,0475
23
Lingkungan dengan kadar garam yang tinggi seperti air laut memiliki tingkat korosivitas yang tinggi, sehingga diperlukan suatu metode yang tepat untuk menanggulangi korosi pada daerah ini (Nugroho, 2011). Pengujian korosi dengan medium air laut biasanya tidak menggunakan air laut secara langsung tetapi menggunakan air laut buatan, sebab air laut buatan memiliki agresifitas yang lebih besar dibandingkan air laut alami. Hal ini dikarenakan adanya ion Mg2+dan Ca2+ dalam air laut dapat memperkecil laju korosi akibat kemampuannya dalam membentuk lapisan CaCO3dan Mg(OH)2dipermukaan logam akibat reaksi katodik oksigen dipermukaan logam. Faktor-faktor yang mempengaruhi korosi dalam medium air laut antara lain jumlah O2dan CO2terlarut, salinitas, pH, kadar karbonat, temperatur, tekanan, dan faktor biologi dari hewan dan tumbuhan laut (Scumacer, 1999).
Menurut Iswahyudi (2007), laju korosi baja karbon optimum pada larutan dengan konsentrasi NaCl 3-3,5%, hal ini dikarenakan oksigen dapat terlarut maksimum di dalam air pada konsentrasi tersebut. Grafik hasil percobaan Iswahyudi (2007) yang menunjukan hubungan antara laju korosi dengan konsentrasi NaCl ditunjukan pada Gambar 4. Berdasarkan hal tersebut, maka pada penelitian ini digunakan medium korosif dengan konsentrasi NaCl sebesar 3,5%.
24
Gambar 4. Pengaruh kadar NaCl terhadap laju korosi (Iswahyudi, 2007).
H. Metode Penghambatan Korosi
Korosi pada permukaan luar suatu material dapat ditangani dengan berbagai cara antaralain pengecatan, pelapisan dengan logam dan metode perlindungan katodik, tetapi korosi pada bagian dalam suatu material seperti pipa hanya dapat
dikendalikan oleh suatu inhibitor korosi (Ketis dkk., 2010).
Inhibitor korosi adalah zat yang ketika ditambahkan dalam konsentrasi kecil pada lingkungan, efektif mengurangi laju korosi logam pada lingkungan tersebut (Rahim and Kassim, 2008). Sejumlah inhibitor menghambat korosi melalui cara adsorpsi untuk membentuk suatu lapisan tipis dan melalui pengaruh lingkungan (misalnya pH) menyebabkan inhibitor dapat mengendap dan selanjutnya
teradsopsi pada permukaan logam serta melindunginya terhadap korosi (Dalimunthe, 2004). Pada umumnya inhibitor korosi berasal dari senyawa-senyawa organik dan anorganik yang mengandung gugus-gugus yang memiliki pasangan elektron bebas, seperti nitrit, kromat dan fosfat senyawa-senyawa amina (Haryono dkk, 2010). 0 0.4 0.8 1.2 1.6 2 0 5 10 15 20 25 30 35 cor ros ion ra te ( m m /y ) NaCl (%)
25
Mekanisme kerja inhibitor korosi umumnya diawali dengan proses adsorpsi pada permukaan logam, kemudian menutupi permukaan yang dapat mencegah proses elektrokimia. Efisiensi meningkat dengan bertambahnya permukaan yang tertutup. Ada beberapa faktor yang mempengaruhi adsorpsi inhibitor, yaitu muatan pada permukaan logam, gugus fungsi dan struktur inhibitor, interaksi inhibitor dengan molekul air dan reaksi lain pada inhibitor. Pada penelitian ini digunakan senyawa turunan trifeniltimah(IV) hidroksibenzoat sebagai inhibitor korosi.
Berdasarkan mekanisme proteksinya, inhibitor dibagi dalam beberapa jenis yaitu inhibitor anodik, katodik, campuran dan teradsorpsi (Fahrurrozie, 2009). Berikut ini jenis-jenis inhibitor dan mekanisme proteksinya :
1. Inhibitor Anodik
yaitu inhibitor yang menurunkan lajunya dengan cara menghambat transfer ion-ion logam ke dalam larutan ruah karena berkurangnya daerah anoda akibat pasivasi. Inhibitor anodik disebut juga inhibitor antar muka.
2. Inhibitor Katodik
yaitu inhbitor yang menurunkan laju korosi dengan cara salah satu tahap pada proses katodik seperti pembebasan ion-ion hidrogen dan penangkapan oksigen. Inhibitor katodik disebut juga inhibitor antarfasa.
3. Inhibitor Campuran
yaitu inhibitor yang menurunkan laju korosi dengan cara menghambat proses anodik dan katodik secara bersamaan.
26
4. Inhibitor Teradsorpsi
Inhibitor teradsorpsi yaitu inhibitor yang menurunkan laju korosi dengan cara mengisolasi permukaan logam dari lingkungan korosif melalui pembentukan film teradsorpsi. Adsorpsi yang terjadi diakibatkan dari sifat muatan atau kepolaran molekul organik atau spesi ionik yang membentuk film permukaan secara fisikosorpsi, dan distabilkan melalui kemisorpsi, atau bahkan secara kemisorpsi sempurna.
Terdapat tiga cara yang dilakukan inhibitor teradsorpsi terhadap permukaan logam yaitu :
a. Pembentukan penghalang secara fisika atau kimia. b. Isolasi langsung situs-situs anodik dan katoda, dan c. Berinteraksi dengan medium reaksi korosi.
Pendekatan secara termodinamika merupakan teknik utama dalam menentukan mekanisme inhibisi korosi melalui adsorpsi isotermal berdasarkan nilai energi bebas adsorpsi. Jika energi bebas yang terlihat lebih dari 200 kJ.mol-1
dikategorikan sebagai adsorpsi kimia (kemisorpsi), jika kurang dari 40 kJ.mol-1 dikatogarikan sebagai adsorpsi fisik (fisiosorpsi) atau gaya Van der Waals (Atkins dan de Paulo, 2006).
Pada penelitian ini telah dilakukan pengujian adsobsi inhibitor ke permukaan logam menggunakan data tafel untuk menentukan derajat penutupan permukaan baja oleh inhibitor berdasarkan Persamaan 1 (Morad and Kamal El-Dean, 2006).
27
dengan dan adalah kerapatan arus korosi (mA/cm2) dengan dan tanpa penambahan inhibitor. Nilai selanjutnya dibandingkan dengan data konsentrasi inhibitor korosi dibagi dengan (Cinh/ ) dan diplotkan ke dalam bentuk grafik untuk mengetahui kesesuaiannya dengan adsorpsi isotermal Langmuir. Besarnya kooefisien adsorpsi dapat ditentukan berdasarkan Persamaan 2.
= (2)
Nilai b merupakan nilai koefisien adsorpsi yang juga merupakan nilai konstanta kesetimbangan adsorpsi (Kads) jika mengikuti adsorpsi isotermal Langmuir. Jenis adsorpsi yang terjadi dapat ditentukan dengan menghitung nilai energi bebas adsorpsi (∆ ) berdasarkan Persamaan 3.
= ,
∆
(3)
dengan R adalah tetapan gas ideal (8,314 J/mol.K), nilai 55,55 adalah konsentrasi air dalam larutan (mol), dan T adalah suhu dalam K (Morad and Kamal El-Dean, 2006).
I. Metode Analisis Korosi
1. Metode Kehilangan Berat
Metode ini didasarkan pada pengukuran selisih berat spesimen uji seperti baja lunak yang direndam dalam medium korosif dengan penambahan inhibitor dalam rentang waktu tertentu yang dibandingkan dengan selisih berat baja lunak yang
28
direndam dalam medium korosif tanpa inhibitor. Laju korosi dan efisiensi inhibisi dari metode ini dapat ditentukan dengan Persamaan 4 dan Persamaan 5.
= . . × 87600 (4)
dengan v adalah laju korosi (mm/tahun), W selisih selisih massa baja sebelum dan sesudah pengujian (g), A adalah luas permukaan baja terukur, adalah massa jenis baja (7,87 g/cm3), t adalah waktu perendaman (jam)
%EI= × 100% (5)
dengan EI adalah efisiensi inhibisi (%), v0adalah laju korosi baja pada medium korosif tanpa inhibitor, v1adalah laju korosi baja pada medium korosif dengan inhibitor (Doner et al., 2011).
2. Metode Polarisasi Potensiodinamik
Polarisasi potensiodinamik adalah metode untuk menentukan perilaku korosi logam berdasarkan hubungan potenial dan arus anodik/katodik dengan
menggunakan alat potensiostat. Korosi logam terjadi jika terdapat arus anodik yang besarnya sama dengan arus katodik, walaupun tidak ada arus yang diberikan di luar sistem. Hal ini disebabkan ada perbedaan potensial antara logam dan larutan sebagai lingkungannya (Sunarya, 2008).
Laju korosi dapat ditentukan dengan metode ini dengan menggunakan
potensiostat dengan tiga elektroda, yaitu elektroda acuan AgCl, elektroda bantu berupa platina dan elektroda kerja berupa spesimen baja. Elektroda kerja
29
merupakan logam benda uji yang akan diteliti berfungsi untuk melakukan proses elektrolisis, elektroda bantu berfungsi untuk digunakan untuk mengalirkan arus hasil proses elektrolisis yang terjadi dalam rangkaian sel dan elektroda acuan berfungsi sebagai potensial acuan untuk menyatakan potensial analit atau elektroda kerja (Butarbutar dan Febrianto, 2009).
Data yang didapat dari metode ini adalah kurva polarisasi anodik/katodik yang menyatakan hubungan antara arus (µA/cm2) sebagai fungsi potensial (mV). Selanjutnya kurva tersebut diplotkan ke dalam bentuk grafik dan diekstraposisi untuk dapat menentukan besarnya arus korosi melalui analisis Tafel pada
Software Micrososft Office Excel dengan menentukan perpotongan garis lurus
(trendline) antara kurva polarisasi anodik dan katodik seperi pada Gambar 5.
Gambar 5. Kurva polarisasi anodik dan katodik.
Arus korosi (Icorr), laju korosi dan efisiensi inhibisi masing-masing konsentrasi inhibitor dapat ditentukan dengan Persamaan 6, 7, dan 8.
30
dengan Icorradalah arus korosi ( A), Jcorradalah kerapatan arus korosi ( A/cm2), dan A adalah luas permukaan elektroda kerja terukur (cm2).
= 0,13 (7)
dengan Rmpyadalah laju korosi (mili inch/year), Jcorradalah kerapatan arus korosi ( / ), e adalah masa ekivalen material (g) dan adalah densitas material (g/ ) (Butarbutar dan Febrianto, 2009).
%EI = × 100% (8)
dengan %EI adalah presentase efektifitas inhibisi,I adalah arus korosi pada medium korosif tanpa inhibitor danI adalah arus korosi pada medium korosif dengan inhibitor (Rastogi et al., 2005).
31
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan Agustus 2015 sampai Maret 2016. Sintesis dan karakterisasi senyawa trifeniltimah(IV) hidroksibenzoat dengan spektrofotometer UV dilakukan di Laboratorium Kimia Anorganik-Fisik Jurusan Kimia FMIPA Universitas Lampung. Karakterisasi dengan spektofotometer IR dilakukan di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia, analisis kemurnian unsur dilakukan dengan microelementar analyzer di School of
Chemical and Food Technology, Universiti Kebangsaan Malaysia sedangkan
karakterisasi dengan 1H NMR dan13C NMR dilakukan di Universiti Sains Malaysia. Pengujian aktivitas antikorosi senyawa dilakukan di Laboratorium Instrumentasi dan Analitik Jurusan Kimia sedangkan analisis kualitatif permukaan baja dilakukan di Laboratorium Botani Jurusan Biologi FMIPA Universitas Lampung.
B. Alat dan Bahan
Alat yang digunakan dalam sintesis senyawa organotimah adalah adalah alat-alat gelas dalam laboratorium, neraca analitik, satu set alat refluks, hot plate magnetic
32
dengan spektrofotometer UV-Vis, spektrofotometer IR Thermo Nicolet Avatar
360,1H dan13C NMR BRUKER AVANCE 600 MHz untuk1H NMR dan 150 MHz untuk13C NMR, analisis mikroelementer dengan Fision EA 1108 CHNS
Elemental Analyzer. Pengujian korosi dilakukan dengan EA 161 potensiostat
eDAQ dengan elektroda bantu Pt, elektroda pembanding Ag/AgCl, dan elektroda kerja baja lunak tipe HRP yang diamplas menggunakan kertas abrasif. Pengujian secara gravimetri dilakuakan dengan shaker orbital dan analisis permukaan baja dilakukan dengan mikroskop trinokuler.
Bahan yang digunakan dalam penelitian ini adalah zat-zat kimia dengan kualitas
pro analysis (p.a.) yang terdiri dari senyawa trifeniltimah hidroksida, asam
2-hidroksibenzoat, asam 3-2-hidroksibenzoat, asam 4-2-hidroksibenzoat, metanol, akuades, air HPLC, dimetilsulfoksida (DMSO), HCl, aseton, dan NaCl.
C. Prosedur Penelitian
1. Sintesis dan Karakterisasi Senyawa Trifeniltimah(IV) Hidroksibenzoat Prosedur sintesis senyawa trifeniltimah(IV) hidroksibenzoat dilakukan
berdasarkan pada prosedur yang telah dilakukan sebelumnya (Hadi et al., 2009; Hadi and Rilyanti, 2010; Hadi et al., 2012) yang merupakan adaptasi dari
Szorcsik et al. (2002). Sebanyak 0,003 mol (1,10 gram) senyawa trifeniltimah(IV) hidroksida direaksikan dengan 0,003 mol (0,42 gram) asam 2-hidroksibenzoat dalam 30 mL metanol kemudian direfluks selama 4 jam dengan pemanas pada suhu 60℃. Setelah reaksi berlangsung sempurna, senyawa hasil sintesis dikeringkan dalam desikator selama 2 minggu sehingga metanol dan air yang
33
terbentuk sebagai hasil samping reaksi sintesis trifeniltimah(IV)
2-hidroksibenzoat dihilangkan dari produk yang terbentuk. Sintesis senyawa trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-hidroksibenzoat juga dilakukan dengan prosedur yang sama dengan mengganti ligan asam
2-hidroksibenzoat dengan asam 3-2-hidroksibenzoat dan asam 4-2-hidroksibenzoat. Persen rendemen diperoleh dari hasil perbandingan massa senyawa hasil sintesis dengan massa teoritis hasil perhitungan seperti pada Persamaan 9.
% Rendemen = massa sintesis
massa teoritis ×100% (9)
Karakterisasi senyawa organotimah dengan spektrofotometer UV dilakukan dengan melarutkan senyawa trifeniltimah hidroksida dan senyawa hasil sintesis dalam pelarut metanol hingga diperoleh larutan dengan konsentrasi 10-5M kemudian diukur pada panjang gelombang 200-400 nm. Senyawa hasil sintesis selanjutnya dikarakterisasi lebih lanjut dengan menggunakan spektrofotometer IR,
microelementer analyzer, spektrometer1H dan13C NMR dengan pelarut DMSO.
2. Pembuatan Medium Korosif
Medium korosif yang digunakan pada penelitian dengan metode grafimetri adalah larutan NaCl 3,5% (w/v) (Nugroho, 2011). Sebanyak 3,5 gram NaCl dilarutkan dengan air HPLC dalam labu 100 mL hingga batas tera. Pada pengujian dengan menggunakan metode polarisasi potensiodinamik medium korosif yang digunakan adalah NaCl 0,1 M yang dibuat dengan melarutkan 0,585 gram NaCl dalam labu 100 mL.
34
3. Pembuatan Larutan Inhibitor
Sebanyak 0,02 gram senyawa trifeniltimah(IV) hidroksibenzoat dilarutkan dengan 2,5 mL DMSO p.a. dalam labu ukur 50 mL kemudian ditambahkan air HPLC hingga batas tera sehingga diperoleh stok inhibitor dengan konsentrasi 400 mg/L. Larutan stok tersebut selanjutnya diencerkan dengan pelarut DMSO 5% berturut-turut sebanyak 2,5; 5; 7,5; 10, dan 12,5 mL dalam labu 50 mL tepat hingga batas tera sehingga diperoleh variasi konsentrasi inhibitor 20, 40, 60, 80, dan 100 mg/L Metode yang sama digunakan untuk membuat larutan trifeniltimah(IV) hidroksida dan ligan asam hidroksibenzoat yang digunakan sebagai pembanding internal.
4. Preparasi Baja Lunak
Plat baja lunak dipotong dengan ukuran 2x1 cm kemudian diamplas dengan kertas abrasif mulai dari grit 240, 360, 400, 500, 600 hingga 800. Setelah permukaan baja homogen, plat baja kemudian dicuci dengan HCl 0,1 M, akuades, dan aseton secara berturut-turut sehingga pengotor pada permukaan baja dapat dihilangkan. Baja lunak yang telah dicuci selanjutnya dikeringkan dan ditimbang sehingga siap digunakan untuk pengukuran.
5. Pengujian Korosi dengan Metode Gravimetri
Medium uji yang digunakan dalam penelitian ini adalah campuran 25 ml medium korosif yang ditambahkan dengan 5 mL inhibitor dengan variasi konsentrasi 20, 40, 60, 80, 100 mg/L kemudian dimasukan dalam botol uji. Spesimen baja lunak yang telah ditimbang, dimasukan ke dalam botol uji kemudian ditutup dan digoyangkan di atas orbital shaker dengan kecepatan 125 rpm selama 24 jam. Variasi waktu uji yang akan dilakukan pada penelitian ini adalah 24, 48, 72, 96
35
dan 120 jam. Setelah tepat 24, 48, 72, 96 dan 120 jam, spesimen baja dikeluarkan dari medium uji kemudian dicuci dengan HCl 0,1 M, akuades, dan aseton
kemudian dikeringkan dan ditimbanga hingga diperoleh massa setelah
perendaman. Hasil yang diperoleh selanjutnya dibandingkan dengan kontrol baja lunak yang direndam dalam medium korosif tanpa inhibitor (Doner et al., 2011).
Laju korosi dan efisiensi inhibisi dari metode ini dapat ditentukan dengan Persamaan 4 dan Persamaan 5.
6. Pengujian Korosi dengan Metode Polarisasi Potensiodinamik Pengujian korosi dengan metode ini dilakukan dengan alat potensiostat menggunakan elektroda kerja baja lunak, elektroda bantu platina (Pt), dan
elektroda pembanding Ag/AgCl. Sebelum digunakan dalam pengujian, elektroda kerja dan elektroda pembanding dicuci dengan akuades. Ketiga elektroda yang telah dicuci dirangkaikan ke sel elektrolisis larutan medium korosif tanpa inhibitor sebanyak 30 mL dengan susunan kabel berwarna hijau untuk elektroda kerja, kuning untuk elektroda pembanding dan merah untuk elektroda bantu. Alat potensiostat selanjutnya dihidupkan, kemudian setelah lampu status berwarna hijau maka alat dihubungkan ke komputer dan software E-Chem v.2 1.8 dibuka. Elektroda selanjutnya diinteraksikan dengan medium korosif selama 10 menit dan kemudian pemindaian dilakukan pada rentang arus 100 mA selama 200 s dengan pengaturan pemindaian seperti pada Gambar 6. Mula-mula dilakukan pemindaian anoda kemudian setelah pemindaian selesai dilanjutkan dengan pemindaian katoda. Pengujian aktivitas antikorosi senyawa inhibitor dilakukan dengan
36
metode yang sama dengan mengganti larutan uji dengan medium korosif dengan penambahan inhibitor dengan perbandingan 5:1.
Gambar 6. Pengaturan pemindaian a. katoda dan b. anoda.
7. Analisis Data
Setelah diperoleh data perbandingan beda potensial dan arus dari hasil pemindaian, selanjutnya dilakukan analisis data polarisasi potensiodinamik dengan analisis Tafel menggunakan Microsoft Office Excel sehingga diperoleh besarnya logaritma normal harga mutlak kerapatan arus korosi (ln|J|) dan
overpotensial ( ) yang selanjutnya diekstrapolasi ke bentuk grafik. Nilai ln |J|
anoda diplotkan sebagai absis untuk anoda dan katoda kemudian nilai anoda dan katoda masing masing diplotkan sebagai ordinat sehingga diperoleh perpotongan antara grafik anoda dan katoda. Nilai ln|J| di titik perpotongan tersebut
selanjutnya dieksponensialkan sehingga diperoleh nilai kerapatan arus korosi (Jcorr). Arus korosi (Icorr), laju korosi dan efisiensi inhibisi masing-masing konsentrasi inhibitor dapat ditentukan dengan Persamaan 6, 7, dan 8.
Data Tafel juga dapat digunakan untuk menentukan derajat penutupan permukaan baja( ) oleh inhibitor berdasarkan Persamaan 1 Nilai Cinhselanjutnya
dibandingkan dengan data konsentrasi inhibitor korosi dibagi dengan (Cinh/ ) dan
37
diplotkan kedalam bentuk grafik untuk mengetahui kesesuaiannya dengan
adsorbsi isotermal Langmuir dan menentukan besarnya energi bebas adsorbsinya berdasarkan Persamaan 2 dan 3.
8. Analisis Kualitatif Permukaan Baja
Setelah diperoleh masing masing senyawa inhibitor dengan konsentrasi tertinggi, selanjutnya dilakukan analisis kualitatif permukaan baja. Baja lunak direndam dalam medium korosif yang telah ditambahkan inhibitor selama 7 hari. Baja yang telah direndam selanjutnya dicuci kembali dan dikeringkan untuk dilihat
permukaanya secara kualitatif dengan mikroskop trinokuler dan dibandingkan dengan permukaan baja yang diinteraksikan dengan medium korosif tanpa penambahan inhibitor.
106
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka diperoleh simpulan sebagai berikut:
1. Sintesis senyawa trifeniltimah(IV) 2-hidroksibenzoat, trifeniltimah(IV) 3-hidroksibenzoat dan trifeniltimah(IV) 4-3-hidroksibenzoat telah berhasil
dilakukan dengan baik dan didukung dengan hasil karakterisasi menggunakan spektrofotometer IR, UV,1H dan13C NMR dan mikroanalisis unsur.
2. Mekanisme pergantian ligan dari senyawa awal trifeniltimah(IV) hidroksida dengan asam hidroksibenzoat mengikuti pola mekanisme asosiasi.
3. Pengukuran menggunakan metode gravimetri dan potensiometri menunjukan senyawa trifeniltimah(IV) hidroksibenzoat hasil sintesis memiliki
kemampuan yang baik dalam menginhibisi korosi, dengan efisiensi inhibisi tertinggi dimiliki oleh senyawa trifeniltimah(IV) 4-hidroksibenzoat.
4. Pola adsorpsi semua senyawa uji pada penelitian ini mengikuti adsobsi isotermal Langmuir dengan nilai koofisien determinasi mendekati 1. Berdasarkan nilai energi bebas adsorpsiya, adsorpsi inhibitor termasuk kedalam adsorpsi fisika.
107
5. Mekanisme penghambatan korosi senyawa trifeniltimah(IV) hidroksibenzoat cenderung mengikuti pola inhibitor anodik dengan cara teradsorpsi ke
permukaan baja melalui interaksi Van der Wals kemudian membentuk lapisan pasif pada permukaan anoda.
B. Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui aktivitas antikorosi senyawa trifeniltimah(IV) hidroksibenzoat dengan berbagai variasi pengujian seperti mengganti medium korosif yang digunakan atau penambahan variasi waktu dan kondisi pengujian pada pengujian dengan metode gravimetri.
107