BAB 2
TINJAUAN PUSTAKA
2.1 Lemak dan Minyak
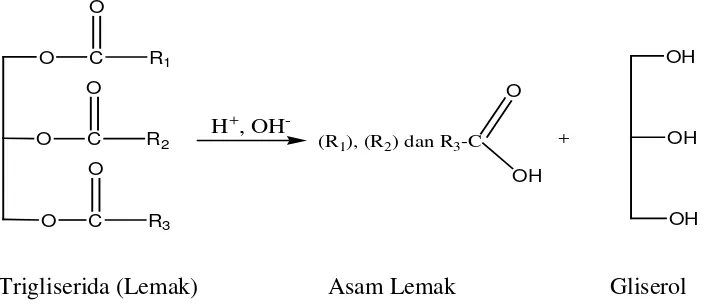
Lemak dan minyak merupakan salah satu kelompok yang termasuk golongan lipida. Satu sifat yang khas dan mencirikan golongan lipida (termasuk lemak dan minyak) adalah daya larutnya dalam pelarut organik (misalnya eter, benzen, chloroform) atau sebaliknya ketidak larutannya dalam pelarut air. Lemak dan minyak secara kimiawi adalah trigliserida yang merupakan bagian terbesar dari kelompok lipida. Trigliserida ini merupakan senyawa hasil kondensasi satu molekul gliserol dengan tiga molekul asam lemak (Sudarmadji dan Haryono, 1989).
O
O C
C O
O
R1
R2 H
+, OH
-(R1), (R2) dan R3-C +
OH
OH
OH
O C
O
R3
O
OH
Trigliserida (Lemak) Asam Lemak Gliserol
Gambar 2.1. Hasil Hidrolisis Trigliserida menjadi Asam Lemak dengan Gliserol.
(Bahl, 2004).
dalam pelarut non polar. Sebagai contoh ialah asam lemak berantai pendek (misalnya asam butirat) pada lemak susu bersifat polar cenderung larut dalam air sedangkan asam lemak berantai karbon panjang tidak larut dalam air. Sifat dan daya kelarutan ini digunakan sebagai dasar praktek pada pengujian-pengujian analitis dan ekstraksi minyak dengan pelarut. Sifat minyak dan lemak yang larut dalam pelarut tertentu dipergunakan dalam pengolahan minyak secara komersil. Daya kelarutan asam asam lemak biasanya lebih tinggi dari komponen gliseridanya dan dapat larut dalam pelarut organik yang bersifat polar dan non polar. Semakin panjang rantai karbon maka minyak dan lemak tersebut semakin sukar larut (Ketaren, 2008).
2.2 Oleokimia
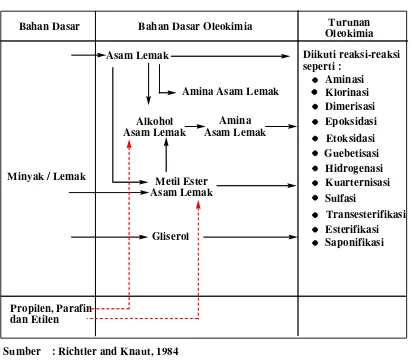
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun. Asam lemak bersama-sama dengan gliserol merupakan penyusun utama minyak nabati atau lemak dan merupakan bahan baku untuk semua lipida pada makhluk hidup. Asam lemak ini mudah dijumpai dalam minyak masak (minyak goreng), margarin atau lemak hewan dan dapat menentukan nilai gizinya. Secara alami, asam lemak bisa berbentuk bebas (karena lemak yang terhidrolisis) maupun yang terikat dari gliserida. Asam lemak merupakan salah satu dasar oleokimia (Tambun, 2006).
sekitar 15% sisanya digunakan dalam industri pembuatan ban, tekstil, kulit kertas, pelumas dan lilin (Richtler and Knaut, 1984).
Tabel 2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak atau Lemak menjadi Oleokimia dan Turunan Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan Oleokimia
Minyak / Lemak
Asam Lemak Diikuti reaksi-reaksi seperti :
Aminasi Klorinasi Dimerisasi Epoksidasi Etoksidasi Guebetisasi Hidrogenasi Kuarternisasi Sulfasi
Transesterifikasi Esterifikasi Saponifikasi Amina Asam Lemak
Alkohol Asam Lemak
Amina Asam Lemak
Metil Ester Asam Lemak
Propilen, Parafin dan Etilen
Sumber : Richtler and Knaut, 1984 : Alami
: Sintesis
Gliserol
2.3 Asam Lemak dan Turunannnya
disebut jenuh bila semua atom C dalam rantainya diikat tidak kurang daripada dua atom H, hingga dengan demikian tidak ada ikatan rangkap. Asam-asam lemak jenuh yang telah dapat diidentifikasi sebagai bagian dari lemak mempunyai atom C4 hingga
C26.
Adapun struktur umum rantai karbon dari asam lemak jenuh adalah sebagai berikut:
Asam-asam lemak yang didalamnya rantai karbonnya mengandung ikatan rangkap. Derajat ketidakjenuhan dari minyak tergantung pada jumlah rata-rata dari ikatan rangkap didalam asam lemak.Pada asam lemak tak jenuh, masih dibedakan antara asam lemak yang mempunyai bentuk “non-conjugated” yaitu ikatan rangkap dalam rantai C selalu dipisahkan oleh dua ikatan tunggal. Bentuk yang lain adalah asam yang “conjugated”, dimana antara atom-atom C tertentu terdapat ikatan tunggal dan ikatan rangkap berganti-ganti.
C
Rantai karbon dari asam lemak tak jenuh
C C
Rantai asam lemak yang “non-conjugated” Rantai asam lemak yang (tak terkonjugasi) “conjugated” (terkonjugasi)
(Sastrohamidjojo, 2005).
Hampir semua asam lemak yang terdapat dalam alam mempunyai jumlah atom karbon yang genap karena asam ini dibiosintesis dari gugus asetil berkarbon dua dalam asetil koenzim A.
dua atom karbon
jumlah atom karbon genap
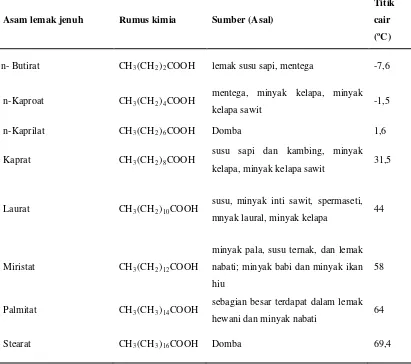
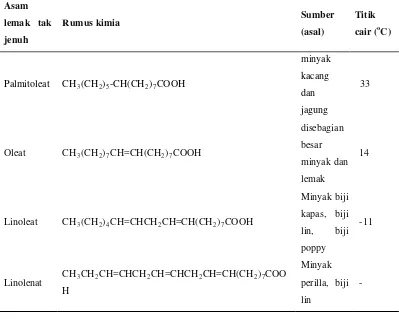
Asam lemak jenuh dan tidak jenuh yang penting, terdapat dalam minyak dan lemak dapat dilihat dalam tabel 2.2. dan 2.3 berikut:
Tabel 2.2 Asam Lemak Jenuh yang Terdapat dalam Lemak dan Minyak
Asam lemak jenuh Rumus kimia Sumber (Asal)
Titik
cair
(oC)
n- Butirat CH3(CH2)2COOH lemak susu sapi, mentega -7,6
n-Kaproat CH3(CH2)4COOH
mentega, minyak kelapa, minyak
kelapa sawit -1,5
n-Kaprilat CH3(CH2)6COOH Domba 1,6
Kaprat CH3(CH2)8COOH
susu sapi dan kambing, minyak kelapa, minyak kelapa sawit 31,5
Laurat CH3(CH2)10COOH
susu, minyak inti sawit, spermaseti, mnyak laural, minyak kelapa 44
Miristat CH3(CH2)12COOH
minyak pala, susu ternak, dan lemak nabati; minyak babi dan minyak ikan hiu
58
Palmitat CH3(CH3)14COOH
sebagian besar terdapat dalam lemak hewani dan minyak nabati 64
Stearat CH3(CH3)16COOH Domba 69,4
Tabel 2.3 Asam Lemak Tidak Jenuh yang Terdapat dalam Lemak dan Minyak
Asam lemak tak jenuh
Rumus kimia Sumber
(asal)
Titik cair (oC)
Palmitoleat CH3(CH2)5-CH(CH2)7COOH
minyak kacang dan jagung
33
Oleat CH3(CH2)7CH=CH(CH2)7COOH
disebagian
besar
minyak dan
lemak
14
Linoleat CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
Minyak biji
kapas, biji
lin, biji
poppy
-11
Linolenat CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COO H
Minyak
perilla, biji
lin
-
Sumber : Ketaren, 2008
(Ketaren, 2008).
2.3.1 Asam Oleat
Asam oleat merupakan penyusun dari lemak-lemak tanaman atau hewan. Asam oleat dapat dipisahkan dari zat tersebut dengan cara hidrolisis, sebagian asam oleat berada bersama-sama dengan asam stearat dan asam palmitat. Struktur asam oleat adalah CH3(CH2)7CH=CH(CH2)7COOH. Asam lemak yang tidak jenuh ini masing-masing
C C
H
(CH2)7COOH
H CH3(CH2)7
C C
H (CH2)7COOH
H
CH3(CH2)7
Asam oleat Asam oleat
(Asam cis-9-oktadekanoat) (Asam trans-9-oktadekanoat) (Sastrohamidjojo, 2005). Konfirmasi disekitar ikatan rangkap dalam asam lemak alamiah adalah cis, suatu konfigurasi yang menyebabkan titik leleh lemak itu rendah. Asam lemak jenuh mebentuk rantai “zig-zag” yang dapat cocok satu sama lain secara mampat, sehingga gaya tarik van der waalsnya tinggi, oleh karena itu lemak-lemak jenuh itu bersifat padat. Jika beberapa ikatan rangkap cis terdapat dalam rantai, molekul ini tak dapat membentuk kisi yang rapid dan mampat, tetapi cenderung untuk melingkar (Fessenden dan Fessenden, 1999).
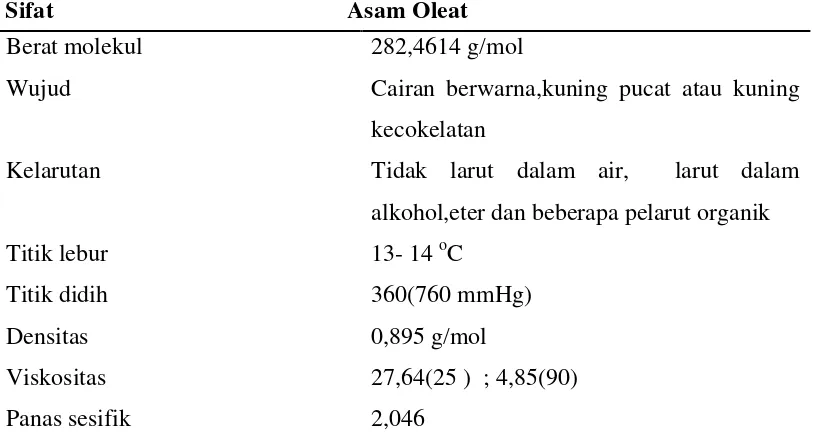
Adapun sifat fisika dan sifat kimia dari asam oleat adalah seperti pada tabel 2.4 dan 2.5 berikut :
Tabel 2.4 Sifat Fisik Asam Oleat
Sifat Asam Oleat
Berat molekul Wujud
Kelarutan
Titik lebur Titik didih Densitas Viskositas Panas sesifik
282,4614 g/mol
Cairan berwarna,kuning pucat atau kuning kecokelatan
Tidak larut dalam air, larut dalam alkohol,eter dan beberapa pelarut organik 13- 14 oC
360(760 mmHg) 0,895 g/mol
Tabel 2.5 Sifat Kimia Asam Oleat
( Sumber : www. Alifelessweet .blogspot. com).
2.3.2 Ester Asam Lemak
Ester adalah turunan asam karboksilat yang dibentuk oleh gugus alkoksi dan asil merupakan salah satu dari kelas-kelas senyawa organik yang sangat berguna, dapat diubah melalui berbagai proses menjadi aneka ragam senyawa lain (Fessenden dan Fessenden, 1999). Rumus umum ester adalah RCOOR’
Sifat Asam Oleat
, merupakan senyawa seperti garam yang berasal dari asam karboksilat. Sama dengan asamnnya, tetapi kata asam diganti nama gugus alkilnya yang menggantikan atom hidrogen dari gugus karboksilnya. Contohnya adalah metil asetat atau metil etanoat , propil asetat. Pada umumnya terdapat pada organisme hidup (Besari dkk, 1982). Ester-Ester umumnya mempunyai bau yang enak, seperti rasa buah dan wangi buah-buahan atau bagian tumbuhan yang lain yang memiliki aroma bau yang enak (Hart, 1990).
Ester asam lemak terdapat dalam bentuk ester antara gliserol dengan asam lemak ataupun dengan phospat seperti phospolipid. Disamping itu ada juga ester antara asam lemak dengan alkoholnya yang membentuk monoester terdapat pada minyak jojoba. Ester asam lemak sering dimodifikasi baik untuk bahan makan maupun untuk bahan surfaktan, aditif, detergen dan lain sebagainya (Endo et al, 1997).
Karsinogenitas Batas eksploisivitas Kereaktifan
Produk samping yang berbahaya Polimerisasi yang berbahaya
Tidak karsinogen LEL :3,3% ; UEL:19%
Reaktif terhadap kelembaban, logam alkali, amonia, agen pengoksida, peroksida
Senyawa ester dapat dibentuk dengan cara :
a. Esterifikasi yaitu reaksi antara asam karboksilat dengan alkohol menghasilkan ester dengan hasil samping air.
R C
b. Interesterifikasi yaitu reaksi antara ester yang satu dengan ester yang lain menghasilkan ester yang baru.
R C
c. Alkoholisis yaitu reaksi antara ester dengan alkohol menghasilkan suatu ester baru. d. Asidolisis yaitu reaksi pembentukan suatu ester baru antara asam karboksilat
dengan ester yang lain .
R C Ketiga reaksi yang terakhir diatas dikelompokkan menjadi reaksi transesterfikasi (Gandhi, 1997).
2.3.3 Epoksidasi Asam Lemak
Epoksida (oksirana) ialah eter siklik dengan cincin beranggota tiga yang mengandung satu atom oksigen (Hart, 1990). Senyawa oksida pada sintesa organik merupakan zat antara yang potensial dimanfaatkan untuk beragam bentuk senyawa dengan berbagai keperluan sehingga penelitian tentang epoksidasi baik kondisi reaksi, berkelanjutan hasil reaksi maupun manfaat hasil reaksi terus dikembangkan (Wisewan, 1983).
Epoksidasi terhadap ikatan rangkap adalah salah satu modifikasi kimia
terhadap senyawa yang memiliki ikatan π. Berdasarkan pada kereaktifan yang tinggi
berbagai senyawa kimia yakni alkohol, alkohol amin, senyawa karbanil, ester, bahan polimer. Minyak nabati yang memiliki kandungan asam lemak tidak jenuh merupakan sumber menarik untuk diperbaharui dalam menghasilkan produk baru yang berguna tetapi kereaktifannya perlu ditingkatkan melalui penambahan gugus fungsi kedalam molekul asam lemaknya, dengan demikian melalui berbagai reaksi kimia maupun biokimia telah dilakukan berbagai cara pengubahan menjadi produk yang lebih berharga (Charlon dan Chang, 1985).
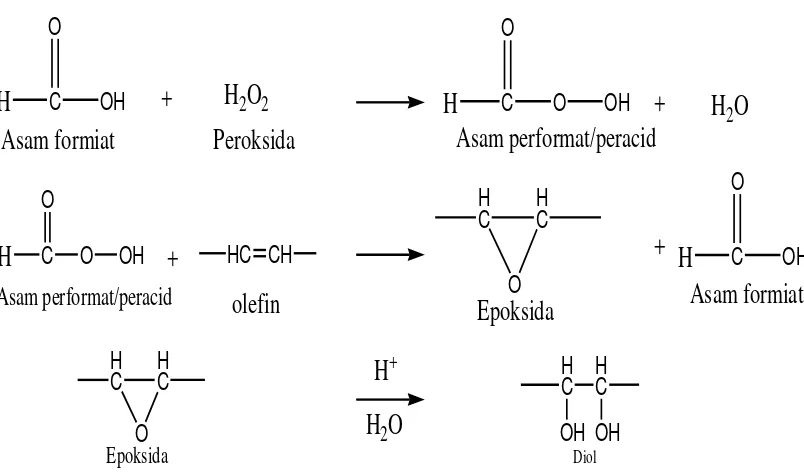
Epoksidasi dari minyak nabati merupakan hal yang penting dan sangat berguna terutama dalam hal sebagai stabilisator dan plastisasi bahan polimer. Berdasarkan pada kereaktifan yang tinggi dan cincin oksiran, epoksidasi juga dapat dipakai untuk berbagai bahan kimia yaitu alkohol, glikol, alkanolamin, senyawa karbonil, senyawa olefin dan polimer seperti poliester, poliuretan (Goud et al, 2006). Dalam proses industri, hasil epoksidasi terhadap asam lemak beserta turunanya telah umum digunakan sebagai plastizer dan stabilizer dalam pembuatan polimer (Lutz, 1980). Adapun reaksi epoksidasi terhadap gugus olefin pada senyawa alkena dan menghasilkan senyawa diol adalah sebagai berikut :
+
H
2O
2H
CGambar 2.2 Reaksi pembentukan dioldenganepoksidasi dan hidrolisis (Goud et al, 2006).
2.4 Senyawa Amina
Senyawa amina dan turunannya terdapat tersebar di alam. Metil dan etil amina terdapat pada ikan asin, tri metil amina terdapat pada tets dari gula beet disamping itu di dan tri metil amina terdapat pada ikan laut yang busuk. Sifat fisika dari amina yakni metil amina, di etil amina dan tri etil amina adalah suatu gas, sedikit larut dalam air. Metil amina baunya seperti ikan, merupakan gas yang sukar terbakar. Amina tersusun dari gugus alkil yang rantai karbonnya panjang berupa larutan padat yang sukar larut dalam air dan juga berat molekulnya (BM) tinggi (Besari dkk, 1982).
Amina dapat berstruktur primer, sekunder dan tersier. Amina adalah turunan senyawa organik dari amonia. Amina dapat disebut primer (1o), sekunder (2o) atau tersier (3o
Amoniak Amina 1o Amina 2o
Amina 3o
H N
H
H R N
H
H R N
H
R' R N
R
R " ) tergantung pada jumlah gugus R yang melekat pada nitrogen.
(Marham, 2010). Istilah primer, sekunder atau tersier disingkat 1o,2o,3o
1. Reaksi dari alkil halida dengan amoniak : atom hidrogen dalam amoniak dapat digantikan oleh kelompok alkil dengan pemanasan larutan alkohol dari amoniak dengan alkil halida. Ini adalah metode yang kurang baik karena campuran dari amina primer, sekunder, tersier dengan garam kuartener diproduksi dan reaksi ini sukar diawasi.
. Primer, sekunder dan tersier mempunyai arti yang sangat berbeda dengan alkohol. Pada alkohol jumlah gugus karbon yang melekat pada karbon pengemban fungsi hidroksil sedangkan pada amina merujuk pada jumlah gugus karbon yang melekat pada nitrogen amina (Wilbraham, 1992).
NH3 RX
HX R NH2
RX HX
R2NH RX HX
R3N RX R4NX
Amina 1o Amina 2o Amina 3o Garam kuartener
2. Reaksi dari alkohol dengan ammonia : secara umum, amina primer diperoleh dengan mereaksikan alkohol primer amina dengan bantuan katalis alumina pada suhu 350o
R OH + NH3 Al2O3 R NH2 + H2O
C.
3. Reduksi dari campuran nitro : amina primer dapat diperoleh dengan mereduksi nitro alkana dengan Sn/HCl; H2/Ni atau LiAlH
R NO2
LiAlH4
R NH2
H2/Ni
Sn/HCl atau
4.
4. Reduksi dari nitril : amina primer dapat dibentuk dengan mereduksi nitril H2/Ni atau LiAlH
R X R C N R CH2NH2
NaCN
LiAlH4
H2/Ni
4.
( Bahl, 2004).
2.4.1 Etanolamina
Etanolamina (NH2-(CH2)2-OH) merupakan cairan yang higroskopis, kental, berbau
amoniak, mampu mengabsorpsi CO2 dan larut dalam air, metanol serta aseton.
Etanolamina dikenal juga dengan nama 2-aminoetanol, monoethanolamina, etilolamina, β-Aminoetilalkohol dan β-hidroksiletillamina. Etanolamina dapat digunakan untuk menghilangkan CO2, H2S dari gas alam ataupun gas lainnya.
2.4.2 Dietanolamina
Pada umumnya, dietanolamina berbentuk cairan kental, sedikit berbau amoniak dan larut dalam air, metanol, serta aseton. Dietanolamina diproduksi bersamaan dengan monoetanolamina dan trietanolamina melalui amonolisis etilen oksida. Dietanolamina dapat digunakan sebagai emulsifier, dalam pembuatan surfaktan, agen pendispersi, dalam bidang kosmetik dan juga dalam bidang farmasi (Anonimous,1976).
Dietanolamina adalah senyawa yang terdiri dari gugus amina dan dialkohol. Dialkohol menunjukkan adanya dua gugus hidroksil pada molekulnya. Dietanolamina juga dikenal dengan nama bis-(hidroksietil)-amina, dietilolamina, hidroksidietilamina, diolamina dan 2,2-iminodietanol.
Sifat-sifat dietanolamina adalah sebagai berikut : a. Rumus molekul : C4H11NO
b. Berat molekul : 105,1364 g/mol
2
c. Densitas : 1,090 g/cm d. Titik leleh : 28ºC (1atm)
3
e. Titik didih : 268,8ºC (1atm) f. Kelarutan : H2
Dietanolamina banyak digunakan dalam produk kosmetik dan detergen karena mampu menciptakan tekstur yang lembut dan foaming agent (Wikipedia, 2007).
O, alkohol, eter
2.5Alkanolamida
Amida umumnya dibuat dengan jalan mereaksikan suatu klorida asam dengan amina, amonia, amina monosubstitusi atau amina disubstitusi. Pemberian nama senyawa amida yaitu dengan mengganti akhiran -oat atau -at dari asam karboksilat dengan amida. Jika atom nitrogen suatu amida berikatan dengan gugus alkil atau aril, maka gugus yang berikatan pada amida ditunjukkan dengan N- (Riswiyanto, 2009).
R C O
NH2 R C
O
NH R' R C
O
N R' R"
Amida Primer Amida Sekunder Amida Tersier
(Ouellette, 1994).
Amida juga dapat dibuat dari reaksi ammonia atau amina dengan turunan asam karboksilat, ester terutama metil ester dan anhidrida asam. Jika ester digunakan sebagai bahan baku, terbentuk alkohol sebagai hasil samping reaksi. Jika digunakan anhidrida asam, hasil sampingnya adalah asam karboksil (Wilbraham, 1992).
Nama amida sama dengan asamnya, dengan menghilangkan kata asam dan menambah akhiran amida atau sesuai dengan nama alkananya diberi akhiran amida.
Contohnya :
CH3 C
NH2
C2H5 C
NH2 O O
- asetamida - propionamida
- etanamida - propanamida
Sifat-sifat fisika :
- Pada umumnya berupa zat padat yang tidak berwarna, kecuali formamida (H-CO-NH2
H
3C
CH2 C CO
NH2
C Br
CH3 CH3
H
) yang berupa cair.
- Asetamida merupakan senyawa higroskopis, dapat larut dalam air - Dapat berfungsi sebagai obat penenang. Misalnya Neodorm.
Pembuatan amida antara lain :
a. Reaksi asam karboksilat dengan amoniak
HOH
b. Dalam perdagangan didapat dari garam amoniumnya dipanaskan pada temperatur 100 -200 oC
c. Dengan mereaksikan anhidrida asam dengan amoniak
H NH2
d. Dengan menghidrolisa senyawa nitril, yakni pada reaksi sebelum terbentuknya asam karboksilat, terbentuk dahulu amida sebagai salah satu hasil antara.
(Besari dkk, 1982).
2.5.1 Monoetanolamida
Monoetanolamida asam lemak memiliki banyak kegunaan khususnya dalam detergen dan kosmetik. Fungsi utama dari monoetanolamida adalah sebagai penstabil busa, meningkatkan viskositas dan emulsifier. Secara komersial metil ester asam lemak atau trigliserida dengan monoetanolamina dapat menghasilkan monoetanolamida pada temperatur dan tekanan tetentu seperti gambar 2.3 berikut (Rahman, 2003) :
+
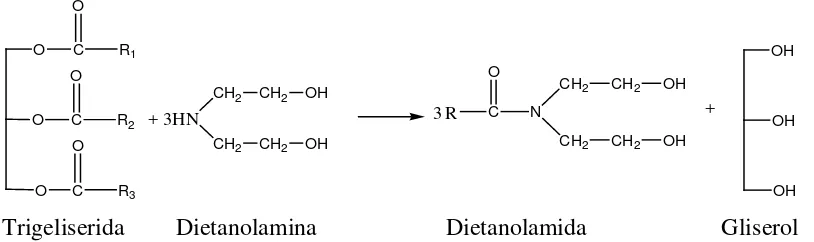
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama kritchevsky sesuai dengan nama penemunya. Bahan baku yang digunakan dalam produksi dietanolamida dapat berupa asam lemak, trigliserida atau metil ester. Dietanolamida biasanya diproduksi secara kimia konvensional pada temperatur 150o
+
C selama 6-12 jam seperti pada gambar 2.4 berikut (Herawan, 1999) :
Trigeliserida Dietanolamina Dietanolamida Gliserol
Gambar 2.4. Reaksi Pembentukan Dietanolamida.
2.6 Tegangan Permukaan dan Surfaktan
Tegangan pemukaan (η) suatu cairan dapat didefinisikan banyaknya kerja yang
dibutukan untuk memperluas permukaaan cairan persatu satuan luas. Molekul yang ada didalam cairan akan mengalami gaya tarik menarik (gaya Van Der Waals) yang sama besarnya kesegala arah. Namun molekul pada permukaaan cairan akan mengalami resultan gaya yang mengarah kedalam cairan itu sendiri karena tidak ada lagi molekul diatas permukaan dan akibatnya luas permukaan cairan cenderung untuk menyusut. Pengukuran tegangan permukaan dengan metode cincin du Nouy didasarkan atas penentuan gaya yang dibutuhkan untuk mengangkat cincin platina atau iridium dari permukaan cairan. Gaya ini diukur dengan jalan mencelupkan cincin yang digantung pada lengan neraca dan perlahan-lahan mengangkatnya sampai cincin tersebut meninggalkan cairan. Metode ini tidak hanya dapat digunakan untuk mengukur tegangan permukaan cairan udara, tetapi juga digunakan untuk mengukur tegangan antar muka cairan-cairan seperti tegangan antar muka (minyak-air, kloroform-air).. Gaya yang dibutuhkan untuk mengangkat cincin dari permukaan cairan dapat dihitung dari persamaan :
Gaya = 4πRɤ
Dengan R adalah jari-jari cincin. Keliling 2πR harus dikalikan dua mengingat bahwa ada batas dalam dan batas luar antara cairan dan kawat. Perumusan tensiometer du Nouy ditulis dalam persamaan :
skala yang terbaca
2 x keliling lingkaran
x Faktor koreksi =
η
Faktor koreksi diperoleh dengan menghitung nilai tegangan permukaan teori air (72,75 dyne/cm) dibagikan dengan tegangan permukaan air praktek (Tony, 1993).
yang bersifat terlarut dalam air namun tidak dapat larut dalam minyak, disebut bagian hidrofilik. Bagian kepala dapat berupa anion, kation atau non ionik. Bagian ”ekor” berupa rantai hidrokarbon yang bersifat larut dalam minyak namun tidak larut dalam air dan disebut sebagai bagian hidrofobik. Apabila terdapat kotoran yang mengandung minyak, surfaktan akan mengelilingi kotoran. Bagian yang bermuatan akan terdapat dipermukaan kotoran sehingga menyebabkan kotoran menjadi bermuatan (Fessenden dan Fessenden, 1999).
Surfaktan adalah senyawa yang dapat menurunkan tegangan permukaan air/larutan. Aktivitas surfaktan diperoleh karena memiliki sifat ganda dari molekulnya. Molekul surfaktan memiliki sifat polar (gugus hidrofilik) dapat dengan mudah larut didalam air dan sifat non polar (gugus hidrofobik) yang mudah larut dalam minyak. Jika proses interaksi dengan fasa air lebih kuat dibandingkan dengan fasa minyak, hal ini menunjukkan bahwa jumlah gugus hidrofiliknya lebih banyak. Sebagai akibatnya, tegangan permukaan air akan menjadi lebih rendah sehingga dengan mudah menyebar dan menjadi fasa kontinu. Demikian sebaliknya, jika interaksi dengan fasa minyak lebih kuat dibandingkan dengan fasa air, yang diakibatkan oleh jumlah gugus hidrofobik yang lebih banyak sehingga akan mengakibatkan tegangan permukaaan minyak menjadi lebih rendah dan dengan mudah menyebar dan menjadi kontinu. Bila penambahan surfaktan melebihi konsentrasi kritis tertentu, maka surfaktan akan mengalami agregasi dan mebentuk struktur misel. Penambahan surfaktan tersebut tidak akan mempengaruhi tegangan permukaan walaupun konsentrasi surfaktan terus ditingkatkan. Konsentrasi kritis terbentuknya misel ini disebut sebagai Critical Consentration Micelle (CMC). Tegangan permukaan akan menurun hingga CMC tercapai. Penambahan konsentrasi surfaktan lebih tinggi dari CMC tidak akan menurunkan tegangan permukaan, yang menunjukkan bahwa permukaan cairan telah menjadi jenuh, dimana misel tidak terbentuk dan berada dalam kesetimbangan dinamis dengan monomernya (Genaro, 1990).
Penggunaan banyaknya surfaktan yang jauh diatas harga CMC-nya mengakibatkan terjadinya emulsi balik, disamping itu juga secara ekonomis tidak menguntungkan. Cara yang umum untuk menetapkan CMC adalah dengan mengukur tegangan permukaan atau tegangan antar muka larutan surfaktan sebagai fungsi dari konsentrasi. Makin tinggi konsentrasi surfaktan menyebabkan tegangan antar muka makin rendah sampai mencapai suatu konsentrasi dimana tegangan antar muka konstan. Batas awal konsentrasi mulai konstan disebut CMC. Adsorpsi surfaktan pada permukaan tergantung konsentrasinya (Porter, 1994). Pada konsentrasi yang sangat rendah, molekul-molekul bergerak bebas dan dapat berjajar datar diatas permukaan. Dengan meningkatnya konsentrasi, maka jumlah molekul surfaktan diatas permukaan juga meningkat. Harga CMC dari surfaktan dapat dihitung dari penurunan tegangan permukaan versus log konsentrasi (Opawale dan Burges, 1998).
Berdasarkan gugus hidrofiliknya, surfaktan diklasifikasikan menjadi 4 golongan yaitu (Rosen,1978) :
a. Surfaktan anionik
- Jenis surfaktan yang paling besar
- Tidak bereaksi dengan jenis surfaktan lain
- Sensitif terhadap air sadah atau hard water. Derajat sensitifitasnya : asam karboksilat > pospat > sulfat (sulfonat).
- Rantai pendek polioksietilen antara gugus anionik dan hidrokarbon meningkatkan kemampuan untuk bereaksi terhadap garam.
- Rantai pendek polioksipropilen antara gugus anionik dan hidrokarbon meningkatkan kelarutan dalam pelarut organik.
- Jenis sulfat mudah terhidrolisa oleh asam-asam dalam proses autokatalitik. Contohnya adalah
- Sabun karboksilat RCOO
- Sulfonat RSO
-3
- Sulfat RO SO
-3
- Phospat ROPO(OH)
-2O b. Surfaktan kationik
-
- Mempunyai sifat indeks bias yang lebih tinggi dibanding surfaktan jenis lain.
- Mempunyai sifat adsorpsi permukaan yang baik Contohnya adalah
.
- Heksa decil trimetilamonium bromida CH3(CH2)15N+(CH3)3Br
- Dodecilamina hidroklorida CH
-3(CH2)11NH3+Cl c. Surfaktan non-ionik
-- Merupakan surfaktan kedua terbesar.
- Dapat bereaksi dengan semua jenis surfaktan. - Sensitif terhadap air sadah.
- Berbeda dengan surfaktan ionik, sifat fisik-kimia surfaktan ini tidak terpengaruh oleh penambahan elektrolit.
- Sifat fisik-kimia senyawa etoksilat sangat tergantug pada temperatur. Contonya adalah :
- Polioksietilen-p-tertocyl phenyleter C8H17C6H4O(CH2CH2O)10 d. Surfaktan ampoterik ( Zwitter ion)
H
Surfaktan zwitter ion mengandung muatan yang berbeda dan dapat membentuk surfaktan amfoter. Perubahan muatan terhadap pH pada surfaktan ampoterik mempengaruhi pembentukan busa, pembasahan, sifat detergen dan lainnya. Contohnya adalah :
N-Dodesil-N,N-Dimetil C12H25N+(CH3)2CH2COO
( Porter, 1994).