ABSTRACT
STUDY OF PHYSICO-CHEMICAL PROPERTIES OF SWEET POTATO FLOUR (Ipomoea batatas) LACTIC ACID FERMENTATION
MODIFIED AND APLICATION IN FRESH BREAD by
YULIZARATNA DEWI
Principles of lactic acid fermentation in modification of sweet potatoes properties is by fermentation using the LAB (Lactic Acid Bacteria) that will degrade amylose, amylopectin and branches out at the amorph which will further improve the physicochemical properties of sweet potato flour. In this study, sweet potato cubes were fermented for 7days with different starter’s condition and without fermentation as a control before being processed into flour to improve the physicochemical properties. The experimental design used was acompletely randomized design (CRD), a single factor with eight treatments consisted of sweet potato flour without fermentation as acontrol (A), with spontaneous fermentation (B), fermentation with pickle starter (C), and fermentation with cultures of L. plantarum (D) ,composite flour with 40% of control sweet potato flour as substituent (E),with 40% of spontaneous fermented flour as substituent (F), with 40% of fermented pickle flour as substituent (G), with 40% of fermented
L.plantarum flour as substituent (H).
L.plantarum (8.67); and water absorption capacity was increased on spontaneous (203.42%), pickle (211.54%), L.plantarum (256.94%). Increase levels of amylose was occurred on flours of spontaneous (27.68%), pickle (28.44%), and
L.plantarum (27.22%). Treatment of pickle fermentation produced the best physicochemical properties of flour to produce bread product. The characteristic of this bread was following: brighter bread crust color, softer bread crumb, more uniformpores, taste salty, sour aroma and highest bread specific volume development.
ABSTRAK
KAJIAN SIFAT FISIKOKIMIA TEPUNG UBI JALAR (Ipomea batatas) TERMODIFIKASI FERMENTASI ASAM LAKTAT DAN APLIKASINYA
PADA PRODUK ROTI TAWAR
Oleh
YULIZA RATNA DEWI
Prinsip fermentasi asam laktat pada ubi jalar termodifikasi adalah dengan cara fermentasi menggunakan BAL (Bakteri Asam Laktat) yang akan mendegradasi amilosa, amilopektin dan cabang-cabang luar pada bagian amorph yang selanjutnya akan memperbaiki sifat fisikokimia tepung ubi jalar. Pada penelitian ini, ubi jalar difermentasi selama 7 hari secara spontan, dengan penambahan cairan pikel ubi jalar, L.plantarum dan tanpa fermentasi sebagai kontrol sebelum diproses menjadi tepung untuk memperbaiki sifat fisikokimianya. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL), faktor tunggal dengan delapan perlakuan terdiri dari tepung ubi jalar kontrol atau tanpa fermentasi (A), fermentasi spontan (B), fermentasi pikel (C), dan fermentasi kultur Lactobacillus plantarum (D), tepung ubi jalar kontrol pensubstitusi 40% (E), fermentasi spontan pensubstitusi 40% (F), fermentasi pikel pensubstitusi 40% (G), fermentasi L.plantarum pensubstitusi 40% (H).
pada pikel (2,55%), pada L.plantarum (8,67); water absorption capacity, pada spontan (203,42%), pada pikel (211,54%), pada L.plantarum (256,94%); serta peningkatan kadar amilosa, pada spontan (27,68%), pada pikel (28,44%), pada
L.plantarum (27,22%). Perlakuan fermentasi pikel menghasilkan sifat fisikokimia terbaik sebagai aplikasi terhadap produk roti tawar dengan menghasilkan organoleptik warna crust roti tawar lebih cerah, crumb lebih lembut, pori-pori lebih seragam, rasa tidak asin, aroma tidak asam serta volume pengembangan spesifik roti tertinggi dari perlakuan lainnya.
PRODUK ROTI TAWAR
Oleh
YULIZA RATNA DEWI
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Teknologi Industri Pertanian Fakultas Pertanian Universitas Lampung
PROGRAM PASCASARJANA
MAGISTER TEKNOLOGI INDUSTRI PERTANIAN
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
LAKTAT DAN APLIKASINYA PADA
PRODUK ROTI TAWAR
(Tesis)
OLEH
YULIZA RATNA DEWI
PROGRAM PASCASARJANA
MAGISTER TEKNOLOGI INDUSTRI PERTANIAN
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Ubi jalar varietas Ciceh ... 9
2. Ikatan α 1,4 dan α 1,6 glikosida ... 12
3. Diagram alir proses fermentasi spontan ubi jalar ... 33
4. Diagram alir proses fermentasi pikel/BAL ubi jalar ... 34
5. Diagram alir proses fermentasi kultur murni (L.plantarum) ubi jalar . 35 6. Diagram alir pembuatan tepung ubi jalar secara kontrol ... 36
7. Diagram alir pembuatan tepung ubi jalar secara termodifikasi ... 37
8. Diagram alir pembuatan biang roti tawar ... 39
9. Diagram alir pembuatan roti tawar tepung ubi jalar substitusi terigu .. 40
10.Contoh kuisioner uji organoleptik ... 47
11.Hubungan perlakuan fermentasi terhadap pH tepung ubi jalar kontrol, fermentasi dan substitusinya ... 56
12.Hubungan perlakuan fermentasi terhadap Water Absorption Capacity tepung ubi jalar kontrol, fermentasi dan substitusinya ... 58
13.Hubungan perlakuan fermentasi terhadap Swelling Power tepung ubi jalar kontrol, fermentasi dan substitusinya pada suhu 60°C dan 90°C ... 60
17.Proses Pembuatan Tepung Ubi Jalar Kontrol dan Fermentasi ... 187 18.Proses Pembuatan Roti Tawar dengan Tepung Ubi Jalar Kontrol dan Fermentasi ... 190 19.Produk Roti Tawar dengan Tepung Ubi Jalar Kontrol dan Fermentasi 192 20.Produk Roti Tawar Utuh dan Irisan dengan Tepung Ubi Jalar
DAFTAR ISI
Halaman
DAFTAR TABEL ...vii
DAFTAR GAMBAR ...xi
I. PENDAHULUAN ... 1
A.Latar Belakang dan Masalah ... 1
B.Tujuan Penelitian ... ... 4
C.Kerangka Pemikiran ... 4
D.Hipotesis ... ... 8
II. TINJAUAN PUSTAKA ... ... 9
A.Ubi Jalar ... ... 9
B.Tepung ... 11
C.Fermentasi Asam Laktat ... 13
D.Modifikasi Tepung Fermentasi ... 17
E. Roti Tawar ... 18
1. Komponen Penyusun Roti Tawar ... 19
2. Proses Pembuatan Roti Tawar ... 26
III. BAHAN DAN METODE ... 30
A.Waktu dan Tempat ... 30
3. Pembuatan Tepung Ubi Jalar Kontrol dan Fermentasi ... 35
4. Pembuatan Roti Tawar Tepung Ubi Jalar Substitusi Terigu . 37 E. Pengamatan Sifat Fisikokimia Tepung Ubi Jalar Modifikasi Fermentasi ... 41
1. Analisa Proksimat Tepung Fermentasi ... 41
a) Kadar Air ... 41
b) Kadar Abu ... 41
c) Kadar Protein ... 42
d) Kadar Lemak ... 42
e) Kadar Karbohidrat ... 43
f) Kadar Serat Kasar ... 43
2. Pengamatan Sifat Fisikokimia Tepung Fermentasi ... 44
a) Nilai pH ... 44
b) Swelling Power (Kekuatan Pembengkakan Granula) dan Solubility (Kelarutan) ... 44
c) Water Absorption Capacity (Daya Serap Air) ... 45
d) Kadar Amilosa ... 45
3. Pengamatan Roti Tawar ... 47
a) Uji Organoleptik Roti Tawar ... 47
b) Volume Spesifik Pengembangan Roti Tawar ... 49
IV. HASIL DAN PEMBAHASAN ... 50
A. Analisis Proksimat Tepung Ubi Jalar Fermentasi Spontan, Pikel, L.plantarum dan Kontrol ... 50
B. Sifat Fisikokimia Tepung Ubi Jalar Fermentasi Spontan, Pikel, L.plantarum, dan Kontrol ... 54
1. Nilai pH ... 56
2. Water Absorption Capacity (Daya Serap Tepung) ... 58
3. Swelling Power (Kekuatan Pembengkakan Granula) dan Solubulity (Kelarutan) ... 59
4. Kadar Amilosa ... 63
C. Uji Organoleptik Roti Tawar ... 65
1. Warna Kulit Roti (crust) ... 65
2. Kekerasan Kulit Roti (crust) ... 66
D. Volume Spesifik Pengembangan Roti Tawar ... 75
E. Penentuan Perlakuan Terbaik ... 77
V. SIMPULAN DAN SARAN ... 78
A. Simpulan ... 78
B. Saran ... 78
DAFTAR PUSTAKA ... 79
DAFTAR TABEL
Tabel Halaman
1. Komponen gizi ubi jalar dalam 100 g bahan segar ... 11
2. Karakteristik amilosa dan amilopektin ... 13
3. Syarat mutu roti tawar ... 19
4. Komposisi tepung terigu berprotein tinggi ... 22
5. Formulasi bahan pembuatan roti tawar dengan substitusi tepung ubi jalar ... 38
6. Data analisa proksimat tepung terigu, tepung ubi jalar kontrol dan fermentasi per 100 g bahan ... ... .... 51
7. Data analisa proksimat tepung terigu, substitusi tepung ubi jalar kontrol dan fermentasi per 100 g bahan ... ... .... 52
8. Hasil uji Duncan terhadap sifat fisikokimia tepung ubi jalar kontrol, fermentasi dan substitusi ... ... .... 55
9. Hasil uji Duncan terhadap warna crust roti tawar ... 65
10. Hasil uji Duncan terhadap kekerasan crust roti tawar ... 67
11. Hasil uji Duncan terhadap keempukan pori roti tawar ... 68
12. Hasil uji Duncan terhadap keseragaman pori roti tawar ... 70
13. Hasil uji Duncan terhadap rasa roti tawar... 72
14. Hasil uji Duncan taraf terhadap aroma roti tawar ... 73
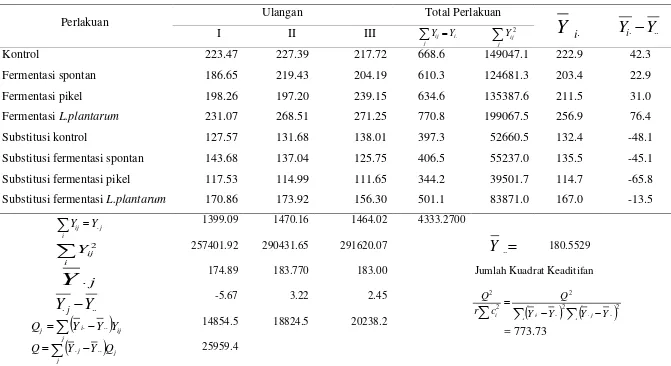
18. Data hasil perhitungan pH pada tepung ubi jalar dan substitusi ... 88 19. Uji Normalitas (Lilliefors Test) terhadap pH tepung ubi jalar
kontrol, fermentasi, dan substitusinya ... 89 20. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap pH
tepung ubi jalar kontrol, fermentasi, dan substitusinya ... 90 21. Uji keaditifan data (Tukey’s test) terhadap pH tepung ubi jalar
kontrol, fermentasi, dan substitusinya ... 92 22. Analisis ragam terhadap pH tepung ubi jalar kontrol, fermentasi
dan substitusinya ... 93 23. Uji bjnd (uji Duncan) terhadap pH tepung ubi jalar kontrol
fermentasi, dan substitusinya ... 94 24. Data hasil perhitungan water absorption capacity pada tepung ubi
jalar dan substitusi (%) ... 95 25. Uji Normalitas (Lilliefors Test) terhadap water absorption capacity
tepung ubi jalar kontrol, fermentasi, dan substitusinya ... 96 26. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
waterabsorption capacity tepung ubi jalar kontrol, fermentasi,
dan substitusinya ... 97 27. Uji keaditifan data (Tukey’s test) terhadap water absorption capacity
tepung ubi jalar kontrol fermentasi, dan substitusinya ... 99 28. Analisis ragam terhadap water absorption tepung ubi jalar kontrol,
fermentasi dan substitusinya ... 100 29. Uji bjnd (uji Duncan) terhadap water absorption capacity tepung
ubi jalar kontrol fermentasi, dan substitusinya ... 101 30. Data hasil perhitungan swelling power suhu 60°C pada tepung
ubi jalar dan substitusi (%) ... 102 31. Uji Normalitas (Lilliefors Test) terhadap swelling power tepung
ubi jalar kontrol fermentasi, dan substitusinya ... 106 34. Analisis ragam terhadap swelling power (60°C) tepung ubi jalar
kontrol, fermentasi dan substitusinya ... 107 35. Uji bjnd (uji Duncan) terhadap swelling power tepung ubi jalar
kontrol fermentasi, dan substitusinya ... 108 36. Data hasil perhitungan swelling power suhu 90°C pada tepung ubi
jalar dan substitusi (%) ... 109 37. Uji Normalitas (Lilliefors Test) terhadap swelling power suhu 90°C
tepung ubi jalar kontrol, fermentasi, dan substitusinya ... 110 38. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
swellingpower suhu 90°C tepung ubi jalar kontrol, fermentasi,
dan substitusinya ... 111 39. Uji keaditifan data (Tukey’s test) terhadap swelling power suhu
90°C tepung ubi jalar kontrol fermentasi, dan substitusinya ... 113 40. Analisis ragam terhadap swelling power (90°C) tepung ubi jalar
kontrol, fermentasi dan substitusinya ... 114 41. Uji bjnd (uji Duncan) terhadap swelling power suhu 90°C tepung
ubi jalar kontrol fermentasi, dan substitusinya ... 115 42. Data hasil perhitungan solubility suhu 60°C pada tepung ubi jalar
dan substitusi (%) ... 116 43. Uji Normalitas (Lilliefors Test) terhadap solubility suhu 60°C tepung
ubi jalar kontrol, fermentasi, dan substitusinya ... 117 44. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
solubility suhu 60°C tepung ubi jalar kontrol, fermentasi, dan
substitusinya ... 118 45. Uji keaditifan data (Tukey’s test) terhadap solubility suhu 60°C
tepung ubi jalar kontrol fermentasi, dan substitusinya ... 120 46. Analisis ragam terhadap solubility (60°C) tepung ubi jalar kontrol,
49. Uji Normalitas (Lilliefors Test) terhadap solubility suhu 90°C tepung ubi jalar kontrol fermentasi, dan substitusinya ... 124 50. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
solubility suhu 90°C tepung ubi jalar kontrol, fermentasi, dan
substitusinya ... 125 51. Uji keaditifan data (Tukey’s test) terhadap solubility suhu 90°C
tepung ubi jalar kontrol fermentasi, dan substitusinya ... 127 52. Analisis ragam terhadap solubility (90°C) tepung ubi jalar kontrol,
fermentasi dan substitusinya ... 128 53. Uji bjnd (uji Duncan) terhadap solubility suhu 90°C tepung ubi
jalar kontrol fermentasi, dan substitusinya ... 129 54. Data hasil perhitungan amilosa pada tepung ubi jalar dan
substitusi (%) ... 130 55. Uji Normalitas (Lilliefors Test) terhadap amilosa tepung ubi jalar
kontrol, fermentasi, dan substitusinya ... 131 56. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
amilosa tepung ubi jalar kontrol, fermentasi, dan substitusinya ... 132 57. Uji keaditifan data (Tukey’s test) terhadap amilosa tepung ubi
jalar kontrol fermentasi, dan substitusinya ... 134 58. Analisis ragam terhadap amilosa tepung ubi jalar kontrol,
fermentasi dan substitusinya ... 135 59. Uji bjnd (uji Duncan) terhadap amilosa tepung ubi jalar kontrol
fermentasi, dan substitusinya ... 136 60. Hasil uji organoleptik terhadap warna crust roti tawar ... 137 61. Uji Normalitas (Lilliefors Test) terhadap organoleptik warna roti
tawar substitusi tepung ubi jalar ... 138 62. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
65. Uji bjnd (uji Duncan) terhadap organoleptik warna roti tawar
substitusi tepung ubi jalar ... 142 66. Hasil uji organoleptik terhadap kekerasan crust roti tawar ... 143 67. Uji Normalitas (Lilliefors Test) terhadap organoleptik kekerasan
crust roti tawar substitusi tepung ubi jalar ... 144 68. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik kekerasan crust roti tawar substitusi tepung ubi jalar . 145 69. Uji keaditifan data (Tukey’s test) terhadap organoleptik kekerasan
crust roti tawar substitusi tepung ubi jalar ... 146 70. Analisis ragam kekerasan crust roti tawar substitsi tepung ubi jalar . 147 71. Uji bjnd (uji Duncan) terhadap organoleptik kekerasan crust roti
tawar substitusi tepung ubi jalar ... 148 72. Hasil uji organoleptik terhadap keempukan pori roti tawar ... 149 73. Uji Normalitas (Lilliefors Test) terhadap organoleptik keempukan
pori roti tawar substitusi tepung ubi jalar ... 150 74. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik keempukan pori roti tawar substitusi tepung ubi jalar 151 75. Uji keaditifan data (Tukey’s test) terhadap organoleptik keempukan
pori roti tawar substitusi tepung ubi jalar ... 152 76. Analisis ragam keempukan pori roti tawar substitsi tepung ubi jalar 153 77. Uji bjnd (uji Duncan) terhadap organoleptik keempukan pori roti
tawar substitusi tepung ubi jalar ... 154 78. Hasil uji organoleptik terhadap keseragaman pori roti tawar ... 155 79. Uji Normalitas (Lilliefors Test) terhadap organoleptik keseragaman
pori roti tawar substitusi tepung ubi jalar ... 156 80. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik keseragaman pori roti tawar substitusi tepung ubi
83. Uji bjnd (uji Duncan) terhadap organoleptik keseragaman pori roti tawar substitusi tepung ubi jalar ... 160 84. Hasil uji organoleptik terhadap rasa roti tawar ... 161 85. Uji Normalitas (Lilliefors Test) terhadap organoleptik rasa roti
tawar substitusi tepung ubi jalar ... 162 86. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik rasa rotitawar substitusi tepung ubi jalar ... 163 87. Uji keaditifan data (Tukey’s test) terhadap organoleptik rasa roti
tawar substitusi tepung ubi jalar ... 164 88. Analisis ragam rasa roti tawar substitsi tepung ubi jalar ... 165 89. Uji bjnd (uji Duncan) terhadap organoleptik rasa roti tawar
substitusi tepung ubi jalar ... 166 90. Hasil uji organoleptik terhadap aroma roti tawar ... 167 91. Uji Normalitas (Lilliefors Test) terhadap organoleptik aroma roti
tawar substitusi tepung ubi jalar ... 168 92. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik aroma rotitawar substitusi tepung ubi jalar ... 169 93. Uji keaditifan data (Tukey’s test) terhadap organoleptik aroma
roti tawar substitusi tepung ubi jalar ... 170 94. Analisis ragam aroma roti tawar substitsi tepung ubi jalar... 171 95. Uji bjnd (uji Duncan) terhadap organoleptik aroma roti tawar
substitusi tepung ubi jalar ... 172 96. Hasil uji organoleptik terhadap penerimaan keseluruhan roti tawar . 173 97. Uji Normalitas (Lilliefors Test) terhadap organoleptik penerimaan
keseluruhan roti tawar substitusi tepung ubi jalar ... 174 98. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
organoleptik penerimaan keseluruhan rotitawar substitusi
101. Uji bjnd (uji Duncan) terhadap organoleptik aroma roti tawar
substitusi tepung ubi jalar ... 178 102. Data hasil perhitungan rata-rata berat, volume dan volume
spesifik pengembangan roti tawar dalam satuan cm3/g ... 179 103. Data hasil perhitungan berat, volume, dan volume spesifik
roti pengembangan tawar ... 180 104. Data hasil perhitungan volume spesifik pengembangan roti tawar
substitusi tepung ubi jalar ... 181 105. Uji Normalitas (Lilliefors Test) terhadap volume spesifik
pengembangan roti tawar substitusi tepung ubi jalar ... 182 106. Uji kehomogenan (kesamaan) ragam (Bartlett’s test) terhadap
volume spesifik pengembangan roti tawar substitusi tepung ubi
jalar ... 183 107. Uji keaditifan data (Tukey’s test) terhadap volume spesifik
pengembangan roti tawar substitusi tepung ubi jalar ... 184 108. Analisis ragam volume spesifik pengembangan roti tawar substitusi
tepung ubi jalar ... 185 109. Uji bjnd (uji Duncan) terhadap volume spesifik pengembangan
RIWAYAT HIDUP
Penulis dilahirkan di Teluk Betung pada tanggal 04 Juli 1976, putri keempat dari delapan bersaudara dari pasangan Bapak H.M. Syamsuddin Surya, Lc., S.Ag. dan Ibu Siti Zainunah Harni. Setelah tamat di Sekolah Dasar Negeri 1 Panjang Selatan pada tahun 1989, penulis melanjutkan sekolah di Sekolah Menengah Pertama Negeri 1 Teluk Betung sampai tahun 1992. Kemudian penulis melanjutkan pendidikan ke Sekolah Menengah Atas Negeri 2 Tanjung Karang sampai tahun 1995, dan pada tahun yang sama penulis diterima sebagai mahasiswa Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung melalui UMPTN (Ujian Masuk Perguruan Tinggi Negeri) sampai tahun 2000.
Pada tahun 2012 penulis diterima sebagai mahasiswa Program Pascasarjana (S2) Teknologi Industri Pertanian Universitas Lampung. Pada tahun 2000,
penulis menikah dengan “Ir.Desmy Putra Jayasinga” dan dikaruniai dua
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan limpahan rahmat dan karunia-Nya sehingga penulis mampu menyelesaikan tesis ini. Dengan kerendahan dan ketulusan hati, penulis mengucapkan terima kasih sedalam-dalamnya kepada:
1. Ibu Ir. Neti Yuliana, M.Si., Ph.D., selaku pembimbing pertama yang telah memberikan bimbingan, meluangkan waktu, tenaga dan pikiran serta motivasi yang tinggi sehingga penulis mampu menyelesaikan tesis ini. 2. Ibu Ir. Siti Nurdjanah, M.Sc., Ph.D., selaku pembimbing kedua atas
bimbingan, pengarahan dan sarannya selama menyelesaikan tesis ini. 3. Ibu Dr. Ir. Sussi Astuti, M.Si., selaku pembahas atas kesediaannya
menguji, memberikan motivasi dan saran untuk perbaikan tesis ini.
4. Bapak Drs. Sutarman, M.M., selaku Kepala Sekolah SMKN 2 Metro, yang telah memberikan bantuan dan kesempatan kepada penulis untuk melaksanakan program pasca sarjana.
jurusan THP, atas bantuan, kesabaran, motivasi dan pengertiannya yang dalam selama penulis menyelesaikan tesis ini.
8. Rekan-rekan seperjuangan di MTA Unila 2012 (teteh Eci, Uci, Andre, Anjar, Eci, Rini, Lina, ibu Nurul, Aji, Ardi) terima kasih atas bantuan, motivasi, semangat dan kebersamaannya.
Semoga Allah memberikan limpahan rahmat dan kebaikan kepada kalian semua, Amin.
Bandar Lampung, Juli 2014 Penulis
I. PENDAHULUAN
A. Latar Belakang dan Masalah
upaya substitusi menggunakan tepung alternatif antara lain dengan tepung ubi jalar. Pengolahan ubi jalar menjadi tepung merupakan salah satu cara untuk meningkatkan daya simpan sehubungan dengan kadar air tepung yang relatif rendah dan juga dibuat menjadi tepung komposit untuk memperoleh komposisi tepung yang dikehendaki. Keuntungan penggunaan tepung ubi jalar adalah bahan baku mudah didapat, rasa lebih manis dan terdapat senyawa antioksidan seperti beta karoten dan antosianin. Kandungan vitamin A dan serat yang tinggi dalam ubi jalar juga meningkatkan nilai fungsional produk (seperti roti dan biskuit) jika menggunakan tepung campuran tersebut.
Menurut Hardoko dkk. (2010), pemanfaatan tepung ubi jalar sebagai substitusi terigu untuk produk roti tawar sekitar 15-20%, sedangkan produk roti manis 15% (Kurniawati dan Ayustaningwarno, 2012). Kapasitas gelasi tepung campuran semakin menurun dengan semakin banyaknya tepung ubi jalar yang ditambahkan (Odedeji dan Adeleke, 2010). Kualitas produk roti akan menurun dengan meningkatnya subtitusi tepung ubi jalar sehingga pengembangan roti kurang optimal, tekstur roti agak keras dan warna roti menjadi agak gelap (Ginting dan Suprapto, 2007); kulit crust roti tawar agak keras, warna roti agak coklat, tekstur agak keras (Hardoko dkk., 2010).
Modifikasi tepung ubi jalar dapat dilakukan dengan perlakuan fermentasi asam laktat seperti yang telah berhasil dilakukan pada Mocaf (Modified cassava flour). Perbaikan sifat reologi tepung yang difermentasi bakteri asam laktat diantaranya dilaporkan oleh Vogel dkk. (2002), Putri dkk. (2011), Zubaidah dan Irawati (2013), Richana dkk. (2010), dan Simsek dkk. (2014).
Prinsip fermentasi asam laktat pada ubi jalar termodifikasi adalah memodifikasi sel ubi jalar dengan cara fermentasi menggunakan Bakteri Asam Laktat (BAL). BAL memproduksi enzim dan asam organik yang mendegradasi sebagian pati menjadi polimer yang lebih pendek rantainya sehingga memperbaiki sifat fungsional tepung (Salim, 2011). Asam organik yang dihasilkan juga memperbaiki aroma dan flavour serta mempertahankan warna tepung menjadi lebih baik sehingga secara keseluruhan dapat memperbaiki sifat organoleptik produk yang dihasilkan (Vogel dkk., 2002).
modifikasi fermentasi BAL 20%, 30%, 40%, dan 50% menunjukkan bahwa semakin tinggi substitusi tepung ubi jalar, kualitas roti tawar akan menurun, namun substitusi 40% menghasilkan kualitas organoleptik yang dapat diterima.
B. Tujuan Penelitian
Penelitian ini bertujuan:
1) Mengetahui pengaruh fermentasi asam laktat secara spontan, penambahan cairan pikel ubi jalar, L.plantarum, kontrol (tanpa fermentasi) dan masing-masing substitusinya terhadap sifat fisikokimia tepung ubi jalar.
2) Mengetahui sifat organoleptik dan volume spesifik pengembangan roti tawar dengan substitusi 40% tepung ubi jalar modifikasi fermentasi spontan, penambahan cairan pikel ubi jalar, L.plantarum dan kontrol (tanpa fermentasi).
C. Kerangka Pemikiran
Tepung ubi jalar dilaporkan Odedeji dan Adeleke (2010), Hardoko dkk. (2010), Ginting dan Suprapto (2007) masih memiliki kekurangan pada sifat fisikokimianya sebagai substitusi terigu untuk produk roti tawar. Karakteristik
laktat antara lain dengan fermentasi spontan, penambahan cairan pikel, dengan kultur L.plantarum.
Fermentasi ubi jalar spontan menggunakan metode pikel yaitu fermentasi yang dilakukan tanpa penambahan inokulum, namun ditambahkan sejumlah garam (Yuliana dan Nurdjanah, 2009). Penambahan garam yang sesuai akan menghambat mikroorganisme yang tidak diinginkan dan mendukung pertumbuhan bakteri asam laktat. Fermentasi dengan penambahan kultur dapat dilakukan dengan penambahan kultur murni atau cairan fermentasi pikel. Penggunaan kultur murni atau BAL pada proses fermentasi akan mengurangi kontaminasi karena keberadaanya yang dominan di awal fermentasi akan menekan pertumbuhan mikroorganisme kontaminan. Fermentasi asam laktat dengan penambahan kultur murni atau BAL akan menghasilkan enzim amilolitik dan selulotik yang dapat menghidrolisis beberapa bagian pati menjadi gula dan polimer rantai pendek lainnya dan selanjutnya gula dikonversi menjadi asam laktat. Kombinasi asam laktat dan enzim selulase memungkinkan proses fermentasi terjadi dalam waktu lebih singkat (Zubaidah dan Irawati, 2013; Subagio, 2006).
mendegradasi amilosa, amilopektin, dan cabang-cabang luar pada bagian amorph yang menyebabkan kerusakan struktur dan integritas granula pati. Degradasi granula pati oleh BAL selama fermentasi dapat merubah porositas dan area permukaan granula sehingga akan merubah sifat pati alami (Vatanasuchart dkk., 2005). Depolimerisasi akan mengurangi resistensi kekuatan pengembangan pati (Bertolini dkk., 2001).
Fermentasi asam laktat akan menghasilkan enzim yang berperan dalam pemutusan ikatan rantai cabang amilopektin dan rantai lurus amilosa. Hal ini mempengaruhi rasio amilosa dan amilopektin, selanjutnya akan mempengaruhi sifat fisikokimia pati, misalnya pH, swelling power, solubulity dan water absorption capacity (Zubaidah dan Irawati, 2013). Parameter-parameter tersebut sangat berkaitan dengan sifat pengembangan pati fermentasi (Marcon dkk., 2006).
Sejauh ini belum diketahui jenis fermentasi asam laktat pada ubi jalar yang mempengaruhi sifat fisikokimia tepung termodifikasi dan dapat diaplikasikan untuk substitusi terigu pada pembuatan roti tawar. Oleh karena itu, perlu dilakukan penelitian untuk mengetahui pengaruh fermentasi asam laktat secara spontan, penambahan cairan pikel, dan penambahan kultur murni (Lactobacillus plantarum) terhadap karakteristik fisikokimia tepung ubi jalar termodifikasi yang dihasilkan dan aplikasinya pada roti tawar.
merupakan mikroorganisme GRASS (Generally Recognized As Safe) dan dapat berfungsi sebagai pengawet makanan karena mampu menghasilkan asam organik (Kurniadi dkk., 2011).
Beberapa penelitian seperti pada tepung jagung (Richana dkk., 2010), tepung singkong (Zubaidah dan Irawati, 2013), dan tepung sorgum (Simsek dkk., 2014) yang dimodifikasi dengan fermentasi asam laktat menunjukkan bahwa hidrolisis oleh fermentasi asam laktat akan berkontribusi terhadap pengembangan adonan pada roti. Diharapkan perlakuan fermentasi asam laktat pada ubi jalar mampu menghasilkan tepung ubi jalar termodifikasi dengan karakterisitik fisikokimia yang hampir sama dengan berbagai tepung termodifikasi tersebut. Tepung ubi jalar termodifikasi selanjutnya akan disubstitusi dengan terigu sehingga dapat menghasilkan roti tawar dengan kualitas terbaik.
1) Perlakuan fermentasi bakteri asam laktat secara spontan, penambahan cairan pikel, L.plantarum dan substitusinya dengan terigu akan memperbaiki sifat fisikokimia tepung ubi jalar.
II. TINJAUAN PUSTAKA
A. Ubi Jalar
Ubi jalar (Ipomea batatas) merupakan komoditas sumber karbohidrat utama setelah padi, jagung dan ubi kayu, serta mempunyai peranan penting dalam penyediaan bahan pangan, bahan baku industri maupun pakan ternak (Zuraida dan Suprapti, 2001). Ubi jalar dikonsumsi sebagai bahan makanan tambahan atau sampingan, kecuali Irian Jaya dan Maluku, ubi jalar digunakan sebagai bahan makanan pokok. Kandungan karbohidrat dalam ubi jalar dapat digunakan sebagai sumber karbon oleh bakteri L. plantarum (Rukmana, 1997; Panda dan Ray, 2008).
Ubi jalar Ubi jalar yang telah dikupas
Karakteristik fisik ubi jalar seperti ukuran, bentuk dan warna ubi perlu diketahui, karena berkaitan erat dengan pemanfaatannya (Aini, 2004). Ukuran ubi jalar terdiri dari tiga jenis, yaitu besar, sedang dan kecil, sedangkan bentuk dari ubi jalar berbentuk bulat sampai lonjong dengan permukaan rata sampai tidak rata (Rukmana, 1997). Warna kulit dan daging ubi jalar tidak selalu sama. Ubi jalar mempunyai warna kulit putih kotor, kuning, jingga dan ungu tua. Warna daging ubi jalar yaitu putih, krem, oranye dan jingga, tergantung jenis dan pigmen yang terdapat didalamnya (Bandech dkk., 2005). Ubi jalar berdaging kuning memiliki pigmen β-karoten dan ubi jalar berwarna ungu memiliki pigmen antosianin (Yamakawa, 1998). Jumlah kandungan β-karoten dan antosianin dalam ubi jalar
tergantung dari kepekatan warna ubi, semakin pekat warna ubi, maka jumlah pigmen dalam ubi akan semakin tinggi.
Ubi jalar dapat dimanfaatkan sebagai pengganti makanan pokok karena memiliki sumber kalori yang efisien. Ubi jalar juga mengandung komponen zat gizi yang penting, seperti protein, lemak, karbohidrat dan vitamin A (β-karoten). Jumlah
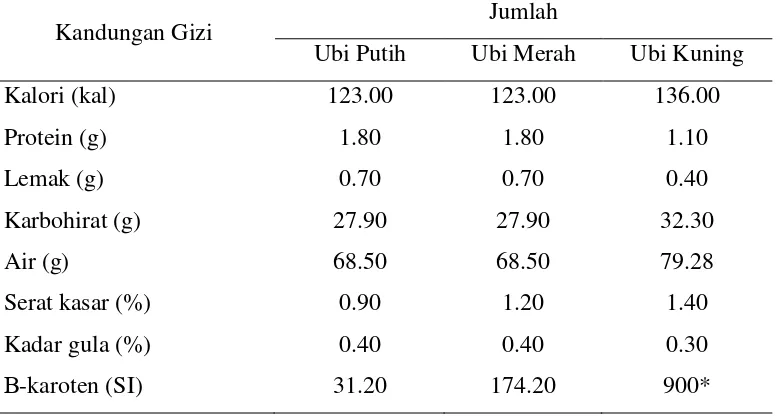
Tabel 1. Komponen gizi ubi jalar dalam 100 g bahan segar
Kandungan Gizi Jumlah
Ubi Putih Ubi Merah Ubi Kuning Kalori (kal)
Protein (g) Lemak (g) Karbohirat (g) Air (g)
Serat kasar (%) Kadar gula (%) Β-karoten (SI)
123.00 1.80 0.70 27.90 68.50 0.90 0.40 31.20
123.00 1.80 0.70 27.90 68.50 1.20 0.40 174.20
136.00 1.10 0.40 32.30 79.28 1.40 0.30 900* Sumber : Harnowo dkk. (1994), *Direktorat Gizi Depkes RI (1993)
Karbohidrat ubi jalar digolongkan ke dalam low glycemix index (LGI, 54), yang berarti cocok untuk penderita diabetes. Mengkonsumsi ubi jalar tidak secara drastis menaikkan gula darah, berbeda halnya dengan sifat karbohidrat dengan GI tinggi, seperti beras dan jagung (Lingga, 1984).
B. Tepung
jumlahnya sangat sedikit dalam suatu molekul pati, berkisar antara 4-5%. Namun, jumlah molekul dengan rantai cabang yaitu amilopektin, sangat banyak dengan DP berkisar antara 105 dan 3x106 unit glukosa (Jacobs dan Delcour, 1998).
Gambar 2. Ikatan α 1,4 dan α 1,6 glikosida
Tabel 2. Karakteristik amilosa dan amilopektin
Karakteristik Amilosa Amilopektin
Bentuk Ikatan
Berat molekul Film
Struktur gel Warna + iodin
Relatif lurus
α-(14); [beberapa α-(16)-] 50-500 juta g/mol
Kuat Kuat Biru
Bercabang α-(14) dan α-(16)
50-500 juta g/mol Lemah Lembek Coklat kemerahan Sumber: Thomas dan Atwell (1997)
C. Fermentasi Asam Laktat
Fermentasi adalah suatu aktivitas mikroorganisme terhadap senyawa molekul organik kompleks, seperti protein, karbohidrat, dan lemak yang mengubah senyawa-senyawa tersebut menjadi molekul-molekul yang lebih sederhana, mudah larut, dan kecernaan tinggi. Fermentasi dapat terjadi karena adanya aktivitas mikroba penyebab fermentasi pada substrat organik yang sesuai (Hidayat dkk., 2006). Salah satu mikroba yang berperan pada fermentasi adalah bakteri asam laktat.
alkohol dan garam yang tinggi, tumbuh pada pH 3,8-8,0 serta memfermentasi berbagai monosakarida dan disakarida (Stamer, 1979).
Menurut Salminen dan Wright (1993), berdasarkan tipe fermentasi glukosa, bakteri asam laktat dibagi menjadi tiga golongan, yaitu obligat homofermentatif, obligat heterofermentatif, dan fakultatif heterofermentatif. (1) Obligat homofermentatif, artinya gula hanya bisa difermentasi melalui jalur glikolisis. Kelompok ini tidak bisa mengkonsumsi pentosa. Hampir seluruh produk yang dihasilkan oleh kelompok bakteri ini berupa asam laktat, contoh : L.acidophillus, L.delbruckii, L.helveticus, L.salivarius. (2) Obligat heterofermentatif, artinya hanya jalur 6-phosphogluconate / phosphoketolase yang dapat digunakan untuk memfermentasi glukosa dengan hasil produk akhir berupa asam laktat, ethanol, asetat dan CO2.
mengkonsumsi heksosa dan pentosa, contohnya L.casei, L.plantarum, L.curvatus,
dan L.sake. Klasifikasi bakteri asam laktat pada tingkat genera didasarkan pada morfologi, model fermentasi gula, suhu pertumbuhan, kemampuan untuk tumbuh pada konsentrasi garam tinggi dan toleransi pada kondisi asam atau basa. Beberapa genera bakteri asam laktat meliputi Lactobacillus Spp., Lactococcus Spp., Leuconostoc Spp., Pediococcus Spp., Aerococcus Spp., Enterococcus Spp., Carnobacterium Spp., Vagococcus Spp., dan Tetra genococcus Spp. (Stamer, 1979).
Kelompok heterofermentatif memecah glukosa menjadi asam laktat, CO2, ethanol, dan kadang-kadang asam asetat, kelompok heterofermentatif menghasilkan 50% asam laktat, ethanol, asam asetat, gliserol, manitol, dan CO2. Proses fermentasi yang umum dari tipe ini :
C6H12O6 CH3CHOHCHOH + CO2 + C2H5OH
Glukosa asam laktat ethanol
Bakteri homofermentatif sering digunakan dalam pengawetan makanan karena jumlah asam yang tinggi dalam makanan dapat menghambat pertumbuhan bakteri lain. Bakteri asam laktat yang bersifat homofermentatif, misalnya Streptococcus faecalis, Streptococcus liquifaciens, Pediococcus cereviseae, dan Lactobacillus plantarum (Salminen dan Wright, 1993).
heterofermentatif misalnya Leuconostoc mesenteroides, Lactobacillus brevis dan
Lactobacillus pentoacetium (Fardiaz, 1992). Pembentukan asam selama proses fermentasi akan mengakibatkan kondisi substrat semakin asam.
Bakteri asam laktat tidak hanya berfungsi menurunkan pH media, tetapi juga menghasilkan antibiotik yang disebut bakteriosin, sehingga dapat menghambat pertumbuhan bakteri pembusuk. Selain itu, bakteri asam laktat juga memproduksi H2O2 dan produksi senyawa pembentuk aroma spesifik (Sudarmadji dkk., 1989).
Prinsip fermentasi asam laktat pada ubi jalar termodifikasi adalah memodifikasi sel ubi jalar dengan cara fermentasi menggunakan Bakteri Asam Laktat (BAL). BAL akan memproduksi enzim dan asam organik yang akan mendegradasi sebagian pati menjadi polimer yang lebih pendek rantainya sehingga memperbaiki sifat fungsional tepung (Salim, 2011). Asam organik yang dihasilkan juga akan memperbaiki aroma dan flavour serta mempertahankan warna tepung menjadi lebih baik sehingga memperbaiki sifat organoleptik produk (Vogel dkk., 2002).
bakteri asam laktat yang optimal pertumbuhannya pada kondisi aerofilik (Yuliana, 2009).
Menurut Sharpe (1979), BAL yang terlibat pada fermentasi spontan termasuk golongan heterofermentatif yang menghasilkan gas CO2 selain asam-asam organik. Larutan garam yang ditambahkan berfungsi sebagai media selektif pertumbuhan mikroorganisme, dan bakteri asam laktat osmofilik diharapkan tumbuh dan berkembang pada fermentasi spontan.
Selanjutnya fermentasi dengan penambahan cairan pikel atau kultur murni seperti
L.plantarum merupakan fermentasi secara terkontrol, karena akan mengurangi kontaminasi mikroorganisme kontaminan yang dominan di awal fermentasi (Li dan Yeh, 2001). Keuntungan penambahan cairan pikel atau kultur murni seperti
L.plantarum, selain penghambatan mikroba kontaminan juga dapat diarahkan pada starter yang mempunyai efek anti bakteri, dan bakteri asam laktat dikenal sebagai bakteri yang mempunyai kemampuan menghasilkan senyawa anti bakteri seperti bakteriosin dan nisin (Elegado dkk., 2003).
D. Modifikasi Tepung Fermentasi
ubi sedemikian rupa, sehingga terjadi pembebasan granula pati yang menyebabkan perubahan karakteristik dari tepung yang dihasilkan berupa naiknya viskositas, kemampuan gelasi, daya rehidrasi dan kemudahan melarut (Zubaidah dan Irawati, 2013)
Fermentasi sebagian pati akan mengalami hidrolisis menghasilkan monosakarida (gula) dan polimer dengan rantai yang lebih pendek kemudian menjadi asam-asam organik, terutama asam laktat. Senyawa asam ini akan bercampur dengan tepung sehingga ketika tepung tersebut diolah akan menghasilkan aroma dan cita rasa khas.
E. Roti Tawar
Roti tawar merupakan salah satu jenis makanan yang berbentuk sponge, yaitu makanan yang sebagian besar volumenya tersusun dari gelembung-gelembung gas. Produk ini terdiri dari gas sebagai fase diskontinyu dan zat padat sebagai fase kontinyu (Matz, 1962). Berdasarkan bahan pengembang yang digunakan, roti tawar termasuk dalam yeast raised goods, yaitu adonan yang mengembang karena adanya karbondioksida yang dihasilkan dari proses fermentasi gula oleh yeast (Potter, 1978).
Tabel 3. Syarat mutu roti tawar
Kriteria uji Satuan Persyaratan
Kenampakan Bau
Rasa Kadar air Kadar abu Kadar NaCl Serangga
- - - % b/b % b/b % b/b
-
Normal, tidak berjamur Normal
Normal Maksimal 40
Maksimal 1 Maksimal 2.5 Tidak boleh ada Sumber: SNI (1995)
1. Komponen Penyusun Roti Tawar
Bahan-bahan yang digunakan dalam pembuatan roti tawar adalah terigu, yeast dalam bentuk ragi instan, air, gula, garam, susu skim, dan shortening.
a) Terigu
Substansi yang ulet, elastis, dan mudah direntang yang terbentuk apabila tepung gandum dicampur dengan air atau cairan yang mengandung air tersebut disebut gluten (Sultan, 1981). Gluten merupakan protein utama dalam terigu yang terdiri dari gliadin (20-25%) dan glutenin (35-40%) yang berpengaruh terhadap daya elastisitas dalam adonan serta kekenyalan makanan atau menghasilkan sifat viskoelastis, sehingga adonan terigu dapat dibuat lembaran, digiling, dan dibuat mengembang (Pomeranz dan Shellenberger, 1971). Pada pembuatan roti tawar, glutenin menentukan waktu pencampuran dan pengembangan adonan, sedangkan gliadin menentukan volume roti. Ketika dipanggang adonan membentuk struktur seperti spons (spongy stucture) dan struktur ini disukai oleh konsumen (Jacobs, 1951).
Terigu berfungsi untuk membentuk struktur karena gluten dapat bereaksi kompleks dengan karbohidrat. Pada umumnya, standar tepung yang digunakan didasarkan pada kadar air dan kadar gluten. Menurut Rakkar (2007), semakin banyak glutennya, kecepatan absorpsi air semakin tinggi. Gluten sangat diperlukan dalam pembuatan adonan roti tawar agar menghasilkan pengembangan adonan. Berdasarkan kandungan proteinnya, tepung gandum dibedakan menjadi dua, yaitu:
(2) Hard wheat, yaitu tepung gandum yang mempunyai kandungan protein tinggi, terbuat dari biji gandum dengan karakteristik luar yang keras dan tidak mudah pecah. Gandum ini mudah digiling dan menghasilkan tepung dengan kandungan protein yang bermutu tinggi dan disebut strong flour. Adonan hasil tepungnya mempunyai daya serap tinggi dan menghasilkan adonan yang kuat, kenyal dan mempunyai daya kembang yang baik.
Sifat adonan tergantung pada jenis tepung yang digunakan. Strong flour
mengandung protein yang dapat direntang lebih lebar sebelum sobek, sedangkan
weak flour mengandung protein pembentuk gluten lebih sedikit dan film yang terbentuk lebih mudah sobek. Dalam pembuatan roti tawar digunakan terigu jenis
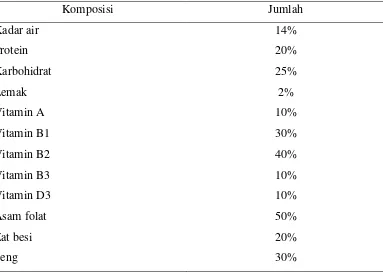
Tabel 4. Komposisi tepung terigu berprotein tinggi
Komposisi Jumlah
Kadar air Protein Karbohidrat Lemak Vitamin A Vitamin B1 Vitamin B2 Vitamin B3 Vitamin D3 Asam folat Zat besi Seng
14% 20% 25% 2% 10% 30% 40% 10% 10% 50% 20% 30% Sumber: Kemasan produk terigu “Cakra Kembar Premium”
b) Yeast
Yeast terdiri dari sel-sel hidup dari Saccharomyces cerevisiae. Yeast terdapat dalam dua bentuk, yaitu bentuk padat dan garnula-granula kecil. Yeast berperan untuk menghasilkan enzim-enzim yang mengkatalis reaksi-reaksi dalam fermentasi. Enzim-enzim yang dihasilkan oleh yeast selama proses fermentasi adalah:
(1) Invertase: mengubah sukrosa menjadi gula invert (glukosa dan fruktosa); (2) Maltase: mengubah maltosa menjadi glukosa; dan
Dengan adanya enzim-enzim tersebut, yeast mampu menggunakan substrat glukosa, fruktosa, sukrosa, dan maltosa, tetapi tidak mampu menggunakan substrat gula dari susu atau laktosa (Charley, 1982). Pada proses fermentasi, yeast menghasilkan CO2 sebagai salah satu hasil fermentasi yang kemudian diperangkap oleh gluten dan akibatnya adonan roti mengembang pada sat fermentasi (Sultan, 1981).
Kemampuan adonan untuk mengembang selama fermentasi disebabkan karena yeast mengubah gula-gula sederhana dalam adonan menjadi gas CO2, alkohol (etanol), dan asam-asam organik. Etanol dan asam organik penting dalam memberikan aroma dan flavor pada roti (Matz, 1972).
c) Air
Fungsi air dalam pembuatan adonan adalah sebagai pelarut bahan-bahan, gelatinisasi pati (Greenwood, 1979), membantu aktivitas yeast dan enzim, serta membantu membentuk adonan. Banyaknya air yang ditambahkan tergantung pada kemampuan tepung mengabsorpsi air dan sifat hasil akhir yang dikehendaki. Air yang digunakan pada pembuatan roti tawar sebanyak 64-66% (Jacobs, 1951).
Sifat polar air tersebut melemahkan ikatan hidrogen dalam komponen lain, sehingga mempercepat pencampuran dalam pembentukan adonan (Auran dan Woods, 1973).
d) Gula
Gula berfungsi memberi rasa manis, menambah rasa lembut, membantu proses penyebaran, juga pembentuk kulit roti tawar (Smith, 1972). Terbentuknya kulit roti berwarna coklat dapat disebabkan oleh terjadinya karamelisasi gula pada permukaan adonan. Warna coklat pada kulit roti juga disebabkan oleh terjadinya reaksi antara gula reduksi dengan protein yang disebut dengan reaksi Maillard. Reaksi tersebut menghasilkan senyawa berwarna coklat yang disebut melanoidin.
Daya larut yang tinggi dari gula dan kemampuan mengikat air merupakan sifat-sifat yang menyebabkan gula dipakai dalam pengawetan pangan (Buckle dkk., 1987). Menurut Damodaran dkk (2008) gula dapat membentuk flavor melalui reaksi pencoklatan. Penggunaan gula halus atau tepung gula bertujuan mempercepat pemerataan kenampakan.
e) Garam
Dalam pembuatan roti tawar, garam diperlukan dalam adonan untuk memperbaiki flavor, memperkuat gluten dan mengatur fermentasi. Dengan demikian, penggunaan garam mempunyai dua fungsi, yaitu membuat roti yang dihasilkan memiliki rasa lebih enak dan berfungsi dalam rheologi adonan dengan mendukung fungsi gluten dalam membentuk adonan (Sultan, 1981).
f) Susu
Menurut Sultan (1981), susu berperan membentuk flavor spesifik dan membantu terjadinya pencoklatan pada kulit roti tawar karena susu mengandung gula reduksi yaitu laktosa. Laktosa merupakan gula yang tidak langsung difermentasi dan selama pemanggangan akan mengalami karamelisasi, sehingga terbentuk kulit yang kecoklatan.
g) Shortening
Lemak dalam adonan berfungsi melunakkan dan memberikan kelembutan pada makanan, berperan juga sebagai pelumas dalam pencegahan pengembangan protein yang berlebihan selama pembuatan adonan.
tumbuhan atau margarin. Pada pembuatan roti tawar biasa digunakan lemak nabati (Sultan, 1981) untuk meningkatkan eating quality.
h) Pelembut
Pelembut (IF-100), mempunyai komposisi yaitu enzim amilase berfungsi menurunkan kekenyalan adonan karena adanya perubahan komposisi amilosa dan amilopektin dalam pati terigu. Penambahan enzim amilase pada adonan untuk menjaga konstannya pembentukan maltosa yang akan digunakan oleh ragi untuk membentuk gas karbondioksida dan etanol selama proses fermentasi serta mempertahankan keempukan roti tawar lebih lama, memperbaiki warna sehingga tampak lebih cerah dengan serat yang lembut, mempertahankan kadar air agar roti tidak mudah kering, memudahkan adonan untuk diolah serta menghemat waktu pengadukan karena adonan lebih mudah kalis (Winarno, 2002).
2. Proses Pembuatan Roti Tawar
Proses pembuatan roti tawar melewati tiga proses utama, yaitu pembuatan adonan, fermentasi, dan pemanggangan. Metode dalam pembuatan roti tawar ada tiga, yaitu Straight Dough,Sponge Dough dan No Time Dough.
tidak langsung) melewati dua tahap pencampuran maupun fermentasi, yaitu tahap pertama mencampur sebagian terigu, air, dan yeast, serta diragikan hingga membentuk adonan mengembang yang disebut biang (sponge), kemudian mencampur bahan-bahan yang lain bersama sponge tersebut dan difermentasikan kembali (Nur’aini, 2011).
Secara umum tahapan pembuatan roti tawar meliputi: a. Pencampuran
Dalam proses pencampuran adonan terjadi distribusi komponen-komponen bahan secara seragam dan mendehidrasi partikel-partikel tepung sehingga dihasilkan adonan yang mempunyai kadar air cukup. Selain itu, pencampuran dapat membentuk gluten yang nantinya dapat menahan gas (Scade, 1975 dalam
Sulistyaningsih 1986).
Pencampuran yang kurang akan menghasilkan adonan yang kurang elastis, volume roti sangat kurang dan roti mudah runtuh (collapse) pada saat mengembang sebelum pemanggangan. Hal ini disebabkan kemampuan gluten yang kurang dalam menahan gas dalam adonan. Sedangkan pencampuran yang berlebihan akan merusak struktur gluten. Adonan roti tawar yang terbentuk pada proses pencampuran harus bersifat elastis dan ketika direntangkan dapat kembali seperti semula (Charley, 1982).
b. Fermentasi
Fermentasi merupakan proses perubahan suatu bahan (raw material) menjadi bahan lain (produk) oleh mikrobia atau enzim yang dapat meliputi reduksi, oksidasi, transformasi, hidrolisis, polimerisasi, biosintesa kompleks, dan pembentukan sel. Proses fermentasi pada pembuatan roti tawar yaitu membiarkan adonan yang diperoleh dari proses pencampuran selama waktu tertentu untuk mendapatkan adonan yang mengembang dari CO2 yang dihasilkan oleh yeast. Fermentasi adonan roti tawar akan mengubah karbohidrat menjadi CO2 dan alkohol (Sultan, 1981).
Etanol dan asam organik akan memberikan aroma dan flavor pada roti (Matz, 1972).
c. Pemanggangan
Pemanggangan akan menyebabkan kenaikan suhu. Dalam pemanggangan terjadi pengembangan adonan, kehilangan air, pencoklatan kulit, dan bentuk roti menjadi tetap (Haryadi, 2004).
III. BAHAN DAN METODE
A. Waktu dan Tempat
Penelitian dilakukan di Laboratorium Pengolahan Pangan SMKN 2 Metro, Laboratorium Teknologi Hasil Pertanian Polinela dan Laboratorium Analisis Hasil Pertanian Universitas Lampung. Penelitian dilaksanakan pada bulan September 2012 sampai dengan Februari 2014.
B. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah ubi jalar umbi putih varietas Ciceh yang dibeli di pasar tradisional Metro, starter Lactobacillus plantarum FNCC 0123 diperoleh dari PAU Pangan dan Gizi Universitas Gajah Mada, tepung terigu (Cakra produksi Bogasari), gula putih (Gulaku), garam (Refina), ragi (Fermipan), mentega putih (Filma), susu bubuk skim, baking powder dan pelembut (IF-100). Bahan kimia yang digunakan adalah amilosa murni (SIGMA, USA), aquades, NaCl, NaOH 1 M, H2SO4, etanol 95%, dan asam asetat 1 N.
merk Hach DR/4000U, sentrifuse (Thermo Electron Corporation, Model IEC Centra CL 2, China), pH meter (Hanna Instrumen, Jerman), grinder (Miyako), oven (Hirasawa, Japan), mixer (Chung Hou Pricise, Thaiwan), loyang, dan proofer, slicer (Globe, japan)
C. Metode Penelitian
Rancangan percobaan yang digunakan dalam penelitian adalah rancangan acak lengkap (RAL), faktor tunggal dengan delapan perlakuan terdiri dari tepung ubi jalar kontrol atau tanpa fermentasi (A), fermentasi spontan (B), fermentasi pikel (C), dan fermentasi kultur Lactobacillus plantarum (D), tepung ubi jalar kontrol pensubstitusi 40% (E), fermentasi spontan pensubstitusi 40% (F), fermentasi pikel pensubstitusi 40% (G), fermentasi L.plantarum pensubstitusi 40% (H).
perlakuan. Uji lanjut menggunakan uji Duncan pada taraf 5%.
D. Pelaksanaan Penelitian
1. Penyiapan Starter Fermentasi a) Starter Pikel
Pembuatan fermentasi pikel diawali dengan penimbangan garam sebanyak 3% dan gula 1% dari volume aquadest yang digunakan (250 ml). Garam dan gula tersebut dimasukkan ke dalam Erlenmeyer 250 ml dan ditambahkan aquadest hingga tanda tera. Satu Erlenmeyer berisi larutan garam dapat digunakan untuk 2 botol berukuran 150 ml. Proses pembuatan cairan pikel ubi jalar mengikuti prosedur Yuliana dan Nurdjanah (2009). Ubi jalar dikupas kulitnya, dicuci dan dipotong dadu (1x1x1 cm). Sebanyak 40 g dimasukkan ke dalam botol 150 ml yang telah disterilisasi. Kemudian ditambahkan larutan garam yang telah disiapkan. Perbandingan ubi jalar dan larutan garam yang akan digunakan untuk fermentasi pikel adalah 40 : 110 (b/v). Larutan pikel yang akan digunakan untuk fermentasi sebanyak 10% (v/v).
b) Starter Lactobacillus plantarum
a) Persiapan Garam 3% dan Gula 1%
Gula sebanyak 89 g dan garam 267 g dilarutkan ke dalam 8,9 l aquades, diambil 4 l larutan untuk fermentasi spontan 1,5 kg ubi jalar.
b) Fermentasi Spontan
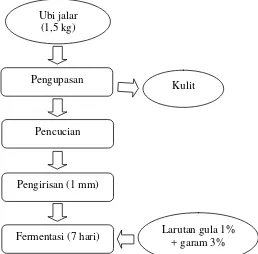
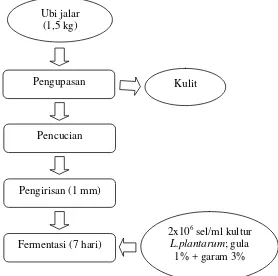
[image:58.595.224.482.415.669.2]Fermentasi spontan pada ubi jalar diawali dengan penimbangan 1,5 kg ubi jalar, kemudian dikupas dan dicuci hingga bersih. Setelah dikupas, ubi jalar diiris menggunakan slicer ukuran 1 mm, lalu difermentasi dalam larutan garam 3% (267 g) dan gula 1% (89 g) menggunakan wadah tertutup dengan volume 5 l. Proses fermentasi dilakukan selama 7 hari (Gambar 3).
Gambar 3. Diagram alir proses fermentasi spontan ubi jalar Sumber : Yuliana dan Nurdjanah (2009) yang dimodifikasi
Ubi jalar (1,5 kg)
Pengupasan
Kulit
Pencucian
Pengirisan (1 mm)
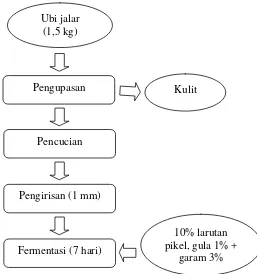
Fermentasi dengan starter pikel diawali dengan penimbangan ubi jalar sebanyak 1,5 kg, kemudian dikupas dan dicuci hingga bersih. Setelah dikupas, ubi jalar diiris dengan menggunakan slicer ukuran 1 mm lalu difermentasi dalam larutan garam 3% (267 g) dan gula 1% (89 g) menggunakan wadah tertutup dengan volume 5 l. ditambahkan larutan pikel ubi jalar sebanyak 10% (v/v). Fermentasi dilakukan selama 7 hari. Proses fermentasi pikel atau BAL dapat dilihat pada Gambar 4.
Gambar 4. Diagram alir proses fermentasi pikel / BAL ubi jalar Sumber : Yuliana dan Nurdjanah (2009) yang dimodifikasi
d) Fermentasi Starter L.plantarum
Fermentasi starter L.plantarum diawali dengan penimbangan 1,5 kg ubi jalar, kemudian dikupas dan dicuci hingga bersih. Setelah dikupas, ubi jalar diiris menggunakan slicer ukuran 1 mm, lalu difermentasi dalam larutan garam 3% (267 g) dan gula 1% (89 g) menggunakan wadah tertutup dengan volume 5 l, ditambah
Ubi jalar (1,5 kg)
Pengupasan Kulit
Pencucian
Pengirisan (1 mm)
Fermentasi (7 hari)
10% larutan pikel, gula 1% +
selanjutnya fermentasi dilakukan selama 7 hari (Gambar 5).
Gambar 5. Diagram alir proses fermentasi kultur murni (L.plantarum) ubi jalar Sumber : Yuliana dan Nurdjanah (2009) yang dimodifikasi
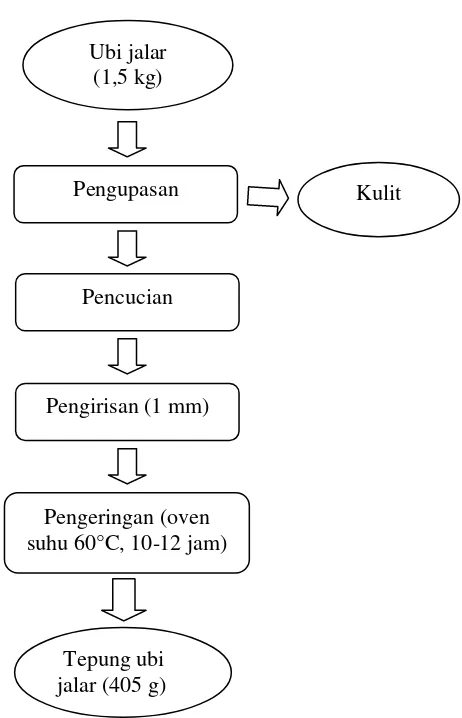
3. Pembuatan Tepung Ubi Jalar Kontrol dan Fermentasi
Pembuatan tepung ubi jalar kontrol atau tanpa fermentasi (A) diawali dengan penimbangan 1,5 kg ubi jalar, kemudian dikupas dan dicuci hingga bersih. Setelah ubi jalar bersih kemudian diiris menggunakan slicer ukuran 1 mm dan dikeringkan dengan oven suhu 60o C selama 10-12 jam sampai kadar air kisaran 6-10% (Ambarsari dkk., 2009). Proses pembuatan tepung ubi jalar kontrol dapat dilihat pada Gambar 6.
Ubi jalar (1,5 kg)
Pengupasan Kulit
Pencucian
Pengirisan (1 mm)
Fermentasi (7 hari)
2x106 sel/ml kultur
tte
Gambar 6. Diagram alir pembuatan tepung ubi jalar secara kontrol Sumber : Ambarsari dkk. (2009)
Pembuatan tepung ubi jalar fermentasi spontan (B), pikel (C) dan kultur
L.plantarum (D) diawali dengan pencucian dan penirisan ubi jalar yang telah difermentasi, dikeringkan menggunakan oven pengering dengan suhu 60oC selama 10-12 jam, kemudian dihaluskan menggunakan grinder, lalu diayak menggunakan ayakan berukuran 80 mesh. Proses pembuatan tepung ubi jalar fermentasi spontan (B), pikel (C) dan kultur L.plantaum (D) dapat dilihat pada Gambar 7.
(1,5 kg)
Pengupasan Kulit
Pencucian
Pengirisan (1 mm)
Pengeringan (oven suhu 60°C, 10-12 jam)
Gambar 7. Diagram alir pembuatan tepung ubi jalar termodifikasi Sumber : Ambarsari dkk. (2009) yang dimodifikasi
Tepung ubi jalar kontrol (A), fermentasi spontan (B), fermentasi pikel (C), dan Fermentasi kultur L.plantarum (D) disubsitusi dengan perbandingan 40% tepung ubi jalar dan 60% terigu sehingga diperoleh 8 sampel tepung yang akan diamati sifat fisikokimianya.
4. Pembuatan Roti Tawar Tepung Ubi Jalar Substitusi Terigu
Pembuatan roti tawar mengikuti prosedur Hardoko dkk. (2010) yang dimodifikasi dengan metode sponge dough, terdiri dari dua tahap pengadonan dengan formulasi bahan seperti pada Tabel 5.
Penirisan
Pengeringan (60°C, 10-12 jam)
Penepungan
Pengayakan (80 mesh)
Bahan Jumlah Tepung terigu (60%)
Tepung ubi jalar (40%) Rag instan
Gula pasir Susu skim
Pengembang (baking powder) Pelembut (IF-100)
Mentega putih (shortening) Garam halus
Air
300 g 200 g 10 g 50 g 70 g 5 g 5 g 50 g 2 g 300 ml Sumber: Hardoko dkk. (2010) yang dimodifikasi
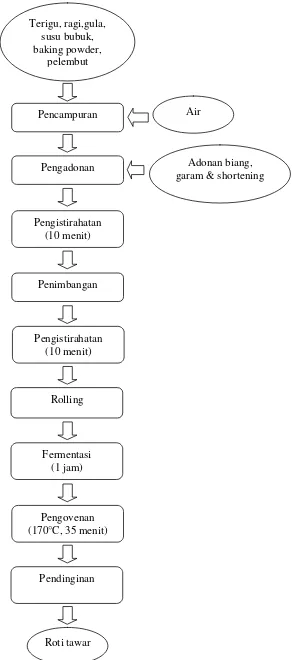
Tahap pertama adalah pembuatan biang (sponge) dengan menimbang sebanyak 200 g tepung terigu dan 5 g ragi instan yang dicampur dengan mixer hingga rata, kemudian ditambah 100 ml air sedikit demi sedikit dan diaduk hingga terbentuk adonan. Setelah adonan kalis, dilakukan fermentasi selama satu jam.
dengan rolling pin, dibalik, digulung, dan dimasukkan ke dalam loyang yang telah dioles dengan margarine, kemudian dimasukkan ke dalam proofer dan didiamkan kembali selama satu jam. Pada tahap terakhir, adonan beserta cetakannya dimasukkan ke dalam oven suhu 170°C selama 35 menit (sampai matang) dan didinginkan. Proses pembuatan biang (Gambar 8) dan roti tawar tepung ubi jalar substitusi terigu dapat dilihat pada Gambar 9.
Gambar 8. Diagram alir pembuatan biang roti tawar Sumber : Hardoko dkk. (2010) yang dimodifikasi
Tepung terigu dan ragi instan
Pencampuran Air
Pengadonan
Fermentasi (1 jam)
Gambar 9. Diagram alir pembuatan roti tawar tepung ubi jalar substitusi terigu Sumber : Hardoko dkk. (2010) yang dimodifikasi
pelembut
Pencampuran Air
Pengadonan
Pengistirahatan (10 menit)
Penimbangan
Adonan biang, garam & shortening
Pengistirahatan (10 menit)
Pendinginan Pengovenan (170°C, 35 menit)
Fermentasi (1 jam) Rolling
E. Pengamatan Sifat Fisikokimia Tepung Ubi Jalar Modifikasi Fermentasi
1. Analisa Proksimat Tepung Fermentasi
a) Kadar Air
Pengukuran kadar air berdasarkan metode AOAC (2000). Cawan kosong dikeringkan dalam oven selama 15 menit, lalu didinginkan dalam disekator dan ditimbang. Sebanyak 4-5 g sampel ditimbang dalam cawan yang telah diketahui bobot kosongnya, lalu dikeringkan dalam oven pengering pada suhu 105°C selama 6 jam. Cawan dengan isinya kemudian didinginkan dalam desikator dan ditimbang. Pengeringan dilakukan kembali hingga diperoleh berat konstan. Kadar air dihitung berdasarkan kehilangan berat yaitu selisih berat awal sampel sebelum dikeringkan dengan berat akhir setelah dikeringkan.
Kadar air (%) = (berat awal – berat akhir) x 100%
berat akhir
b) Kadar Abu
Penghitungan kadar abu berdasarkan metode AOAC (2000) Cawan porselen dipanaskan dalam oven selama 15 menit, lalu didinginkan dalam desikator dan ditimbang. Sebanyak 3-5 g sampel dimasukkan dalam cawan porselen dan ditimbang, lalu dibakar sampai tidak berasap lagi dan diabukan dalam tanur bersuhu 550°C sampai berwarna putih (semua contoh menjadi abu) dan beratnya konstan. Setelah itu, didinginkan dalam desikator dan ditimbang.
Penghitungan kadar protein berdasarkan metode AOAC (2000). Ditimbang sejumlah kecil sampel (0,2 g) dalam labu kjeldahl 30 ml. Ditambahkan 1,9 ± 0,1 g K2SO4, dan 2,0 ± 0,1 ml H2SO4 pekat. Sampel didestruksi selama 1-1,5 jam sampai cairan menjadi jernih. Cairan didinginkan, ditambahkan 8-10 ml NaOH– Na2S2O3 dan dimasukkan ke dalam alat destilasi. Di bawah kondensor alat destilasi diletakkan erlenmeyer berisi 5 ml larutan H3BO3 dan beberapa tetes indikator metil merah. Ujung selang kondensor harus terendam larutan untuk menampung hasil destilai sekitar 15 ml. Distilat dititrasi dengan HCl 0.02 N sampai terjadi warna abu-abu. Prosedur yang sama juga dilakukan terhadap blanko (tanpa sampel). Jumlah titrasi sampel (a) dan titrasi blanko (b) dinyatakan dalam ml HCl 0.02 N.
Kadar N (%) = (a-b) x N HCl x 14.007 x 100% mg sampel
Kadar protein (%) = Kadar N(%) x 6.25
d) Kadar Lemak, Metode Soxhlet
Penghitungan kadar lemak berdasarkan metode AOAC (2000). Labu lemak dikeringkan dengan oven. Sampel ditimbang sebanyak 5 g dibungkus dengan kertas saring dan ditutup kapas bebas lemak. Kertas saring berisi sampel tersebut diletakkan dalam alat ekstraksi soxhlet yang dirangkai dengan kondensor. Pelarut heksana dimasukkan ke dalam labu lemak lalu direfluks selama minimal 5 jam. Sisa pelarut dalam labu lemak dihilangkan dengan cara dipanaskan dalam oven, lalu ditimbang.
Kadar karbohidrat pada sampel dihitung secara by difference, yaitu dengan cara mengurangkan 100% dengan nilai total dari kadar air, kadar abu, kadar protein kadar lemak, dan kadar serat kasar.
Kadar karbohidrat (%) = 100% – (kadar air + kadar abu + kadar protein + kadar lemak + kadar serat kasar)
f) Kadar Serat Kasar
Penghitungn serat kasar berdasarkan metode AOAC (2000). Sampel sebanyak 1 g dimasukkan ke dalam labu Erlenmeyer 300 ml kemudian ditambah dengan H2SO4 0.3 N di bawah pendingin balik kemudian dididihkan selama 30 menit dengan kadang-kadang digoyang-goyangkan. Suspensi disaring dengan kertas saring, dan residu yang didapat dicuci dengan air mendidih hingga tidak bersifat asam lagi (diuji dengan kertas lakmus). Residu dipindahkan ke dalam erlenmeyer, sedangkan yang tertinggal di kertas saring dicuci kembali dengan 200 ml NaOH mendidih sampai semua residu masuk ke dalam erlenmeyer. Sampel dididihkan kembali selama 30 menit dan disaring sambil dicuci dengan larutan K2SO4 10%. Residu dicuci dengan 15 ml alkohol 95%, kemudian kertas saring dikeringkan pada 110°C sampai berat konstan lalu ditimbang.
Serat kasar (%)= (berat kertas saring + residu) – berat kertas saring kosong x100%
a) Nilai pH
Nilai pH diukur dengan menggunakan metode AOAC (2000). Sampel ditimbang sebanyak 5 g, dan dimasukkan ke dalam 10 ml aquades, dikocok sampai homogen. Sebelum digunakan, pH meter dinyalakan, dibiarkan stabil selama 15 sampai 30 menit dan distandarisasi dengan buffer fosfat pH 4 dan pH 7. Elektroda dibilas dengan aquades dan dikeringkan dengan kertas tisu. Setelah elektroda dicelupkan ke dalam sampel, pengukuran pH diset. Elektroda dibiarkan tercelup beberapa saat saampai diperoleh pembacaan yang stabil.
b) Swelling Power (Kekuatan pembengkakan granula)dan Solubility (Kelarutan) Pengukuran swelling power dan solubility mengikuti prosedur yang ditulis oleh Odedeji dan Adeleke (2010). Sebanyak 1 g sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 15 ml aquades, kemudian dikocok selama 15 menit dengan shaker menggunakan kecepatan rendah. Selanjutnya dipanaskan dalam water bath selama 40 menit dengan suhu 60oC dan 90oC, kemudian didinginkan selama 30 menit. Kemudian dipindahkan ke tabung sentrifus yang sudah diketahui beratnya dan dilakukan pembilasan dari tabung awal dengan menambahkan 7,5 ml aquades. Setelah itu, disentrifus pada kecepatan 2.200 rpm selama 20 menit, sehingga dihasilkan supernatan dan pelet. Supernatan dan pelet ditempatkan pada wadah yang berbeda (supernatan pada cawan porselin steril, pelet pada tabung sentrifus) untuk dikeringkan pada suhu 100°C hingga konstan. Swelling power
dihitung dengan cara sebagai berikut :
Swelling power = Berat endapan pelet
= Berat endapan supernatan x 100% Sampel awal
c) Water Absorption Capacity (Daya Serap Air)
Penghitungan daya serap air atau water absorption capacity berdasarkam metode Odedeji dan Adeleke (2010). Sebanyak 1 g sampel dimasukkan ke dalam tabung sentrifus 25 ml dan ditambahkan 15 ml aquades. Kemudian divorteks selama 2 menit dan disentrifus dengan kecepatan 4000 rpm selama 20 menit. Pelet yang dihasilkan ditimbang, sedangkan supernatan dibuang.
d) Kadar Amilosa
Pengukuran kadar amilosa dilakukan secara iodometri berdasarkan reaksi antara amilosa dengan senyawa iod yang menghasilkan warna biru (Yuan, 2007). Pertama, dilakukan pembuatan kurva standar amilosa menggunakan amilosa murni sebanyak 40 mg yang dimasukkan ke dalam tabung reaksi, kemudian ditambah 1 ml etanol 95% dan 9 ml NaOH 1 M. Campuran dipanaskan dalam air mendidih (95°C) selama 10 menit, kemudian dipindah ke dalam labu takar 100 ml. Gel ditambah dengan aquades dan dikocok, lalu ditera hingga 100 ml dengan aquades.
gelombang 620 nm, dibuat kurva hubungan antara kadar amilosa dengan serapannya.
Selanjutnya dilakukan pengukuran kadar amilosa contoh. Tepung ubi jalar sebanyak 100 mg ditempatkan dalam tabung reaksi, kemudian ditambahkan dengan 1 ml entanol 95% dan 9 ml NaOH 1 M. Campuran dipanaskan dalam air mendidih (95°C) selama 10 menit hingga terbentuk gel dan selanjutnya seluruh gel dipindahkan ke dalam labu takar 100 ml. Gel ditambahkan dengan air dan dikocok, kemudian ditempatkan hingga 100 ml dengan air. Sebanyak 5 ml larutan sampel dimasukkan ke dalam labu takar 100 ml dan ditambahkan 1 ml asam asetat 1 N, 2 ml larutan iod 0,01 N (berangsur-angsur) serta aquades sampai tanda tera dan dikocok. Panaskan dengan penangas air pada suhu 30°C selama 20 menit, lalu diukur serapannya dengan spektrofotometer UV-Vis pada panjang gelombang 620 nm. Serapan yang diperoleh diplotkan pada kurva standar untuk memperoleh konsentrasi amilosa contoh. Kadar amilosa dihitung berdasarkan persamaan kurva standar amilosa.
Kadar amilosa (%) = A x B x C x 100%
D
Keterangan :
A : Konsentrasi amilosa sampel yang diperoleh dari kurva standar B : Faktor koreksi
a) Uji Organoleptik Roti Tawar
Untuk mengetahui kriteria roti tawar dan penerimaan panelis, dilakukan pengujian produk roti tawar yang dihasilkan terhadap warna crust, kekerasan crust, rasa, aroma, keempukan dan keseragaman pori. Uji organoleptik ini melibatkan 20 orang panelis tidak terlatih (mahasiswa) untuk pengujian skoring dan hedonik (Soekarto,1981). Di bawah ini contoh kuisioner yang digunakan untuk uji organoleptik (Gambar 10).
Kuisioner yang digunakan dalam uji organoleptik
Nama panelis : ... Tanggal :... Ulangan : ... Dihadapan Saudara disajikan sampel roti tawar yag diberi kode. Anda diminta untuk menilai bagian luar roti (crust) dan bagian dalam roti (crumb) secara organoleptik terhadap warna, aroma, tekstur, rasa, crush dan crumb dengan uji skoring, nilai skor 1–7 serta penerimaan keseluruhan dengan uji hedonik (suka atau tidak suka). Jangan lupa untuk berkumur-kumur dengan air minum yang telah disajikan setelah Saudara mencicipi satu sampel sebelum beralih ke sampel berikutnya.
I. Bagian luar roti (crust)
Kode
Warna crust (kulit roti) Kekerasan crust (kulit roti) Coklat tua Coklat muda
Krem
Sangat keras Keras Tidak keras
1 2 3 4 5 6 7 1 2 3 4 5 6 7
II.Bagian dalam roti (crumb)
Kode
Rasa Aroma
Sangat asin Asin Tidak asin Sangat asam Asam Tidak asam
1 2 3 4 5 6 7 1 2 3 4 5 6 7
A B C D
Kode
Keseragaman pori Keempukan pori
Sangat tdk seragam seragam Sangat seragam
Sangat tdk empuk empuk sangat empuk
1 2 3 4 5 6 7 1 2 3 4 5 6 7
A B C D
Penerimaan Keseluruhan Kode Alasan / Keterangan
A B C D
7. Sangat suka
A= ... B= ... C= ... D= ... 6. Suka
5. Agak suka
4. Agak kurang tidak suka 3. Agak tidak suka
2. Tidak suka 1. Sangat tidak suka
Keterangan : Warna crust: 1 = coklat tua, 2 = coklat, 3 = agak coklat, 4 = agak kurang coklat, 5 = agak coklat muda, 6 = coklat muda, 7 = krem; Kekerasan crust: 1 = sangat keras, 2 = keras, 3 = agak keras, 4 = agak kurang lunak, 5 = agak lunak, 6 = lunak, 7 = tidak keras; Keempukan pori: 1 = sangat tidak empuk, 2 = tidak empuk, 3 = agak tidak empuk, 4 = agak kurang empuk, 5 = agak empuk, 6 = empuk, 7 = sangat empuk;
Keseragaman pori: 1 = sangat tidak seragam, 2 = tidak seragam, 3 = agak tidak
seragam, 4 = agak kurang seragam, 5 = agak seragam, 6 = seragam, 7 = sangat seragam; Rasa: 1 = sa