BAB II
DESKRIPSI PROSES
A. Macam-macam Proses Pembuatan Isopropanolamin
Secara umum, isopropanolamin dapat diproduksi melalui beberapa proses, yaitu:
1. Proses aqueous
Prosedur aqueous phase merupakan proses pembuatan isopropanolamin yang ekonomis dan paling aman. Proses ini tanpa menggunakan katalis, namun menggunakan air yang cukup banyak. Reaksi dijalankan pada temperatur 32°C dan tekanan 1 atm dengan rasio mol ammonia : propilen oksida = 5 : 1. Reaksi yang terjadi adalah:
NH3 + C3H6O → C3H9NO
(Amoniak) (PO) (MIPA)
C3H9NO + C3H6O → C6H15NO2
(MIPA) (PO) (DIPA)
C6H15NO2 + C3H6O → C9H21NO3
(DIPA) (PO) (TIPA)
Konversi terhadap propilen oksida adalah sebesar 98,8%, dan distribusi produk yang dihasilkan yaitu monoisopropanolamin 49,3%, diisopropanolamin 45,5%, dan triisopropanolamin 5,2%.
2. Proses anhydrous
Propilen oksida direaksikan dengan ammonia dalam fase cair dengan rasio molar 1:10 sampai 1:80 pada tekanan 40 atm sampai 200 atm dan pada temperatur antara 20°C sampai 250°C. Kondisi operasi yang disarankan dalam proses anhydrous ini adalah pada tekanan 110 atm dan temperatur 150°C, dengan rasio molar propilen oksida dan ammonia 1:40. Konversi propilen oksida sebesar 95%. Ammonia dan propilen oksida dalam storage tank dipompa ke dalam mixer untuk dicampur, kemudian dipompa menuju preheater untuk dipanaskan dari 35°C menjadi 75°C. Campuran ini kemudian diumpankan ke dalam reaktor yang berisi katalis cation exchange resin. Keluaran reaktor yang berisi campuran monoisopropanolamin, diisopropanolamin, triisopropanolamin, dan ammonia yang tidak bereaksi diumpankan ke dalam menara distilasi untuk dipisahkan.
(United States Patent, 1972)
B. Pemilihan Proses
1. Berdasarkan Tinjauan Ekonomi
Tabel 2.1. Harga bahan baku dan produk
Bahan Harga dalam $ Harga dalam Rp.
NH3(l) (Amonia) 385,81/ton 4.728.873,17 /ton MIPA(l)(Monoisopropalamin) 4.000,00/ton 49.028.000,00 /ton DIPA(l) (Diisopropalamin) 3.000,00/ton 36.771.000,00/ton TIPA(l) (Triisopropalamin) 2.100,00/ton 25.739.700,00/ton
a. Proses aqueous
Pada reaksi I menghasilkan produk MIPA Selektivitas:
- MIPA : 49,3 % - DIPA : 45,5 % - TIPA : 5,2 % Konversi PO : 98,8 %
Kapasitas produk : 15.000 ton MIPA tiap tahun
Selektivitas= Massa Produk
Massa PO yang bereaksi
Massa PO yang bereaksi=15.000 .000kg
0,493 =30.425.963kg
Konversi=Massa PO yang bereaksi
Massa PO mula−mula
Massa PO mula−mula=Massa PO yang bereaksi
Konversi =
30.425.963kg 0,988
Massa PO mula−mula=30.795 .510kg
Massa PO yang bersisa = 369.544, 115 kg
Mol PO yang bersisa = 6.371, 48 kmol
Selektivitas DIPA= Massa Produk DIPA
Massa PO yang bereaksi
Massa Produk DIPA=Massa PO yang bereaksi x Selektivitas DIPA
Massa Produk DIPA=30.425.963kg x0,455=13.843 .813kg
Mol DIPA=104.088,82kmol
Massa Produk TIPA=Massa PO yangbereaksi x Selektivitas TIPA
Massa Produk TIPA=30.425 .963kg x0,052=1.582.150kg
Mol TIPA=8.283,51kmol
Dengan reaksi I :
NH3 (l) + PO (l) → MIPA (l)
Mula 2.196.988,27 439.399,65
-Bereaksi 312.372,33 312.372,33 312.372,33
Sisa 1.884.625,94 127.027,32 312.372,33
Dengan reaksi II :
MIPA (l) + PO (l) → DIPA (l)
Mula 312.372,33 127.027,32
-Bereaksi 112.372,33 112.372,33 112.372,33
Sisa 200.000 14.654,99 112.372,33
Dengan reaksi III :
-Bereaksi 8.283,51 8.283,51 8.283,51
Sisa 104.088,82 6.371,48 8.283,51
Bahan baku yang dibutuhkan:
Mol PO = 439.399,65 kmol
Massa PO yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA = 30.795.510 kg = 30.795,51 ton
Harga PO = 2.202,00 $ /ton x 30.795,51 ton = 67.811.713,02 $
Mol NH3 mula-mula = 2.196.988,27 kmol
Massa NH3 yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA = mol NH3 x BM NH3
= 2.196.988,27 kmol x 17 kg/kmol = 37.348.971 kg = 37.348,97 ton
Harga NH3 = 385,81 $/ ton x 37.348,97 ton = 14.409.606,12 $
Jumlah harga bahan baku:
= (67.811.713,02 $ + 14.409.606,12 $) = 82.221.319,14 $
Massa produk MIPA = 15.000.000 kg = 15.000 ton
Harga produk MIPA = 4.000 $/ ton x 15.000 ton = 60.000.000 $
Massa DIPA yang dihasilkan : Mol DIPA = 104.088,82 kmol
Massa DIPA = 104.088,82 kmol x 133 kg/kmol
= 13.843.813,06 kg = 13.843,81 ton
Massa TIPA = 8.283,51 kmol x 191 kg/kmol = 1.582.150,41 kg = 1.582,15 ton
Harga produk TIPA = 2.100 $/ ton x 1.582,15 ton = 3.322.515,86 $
Jumlah harga produk:
= 60.000.000 $ + 41.531.439,18 $ + 3.322.515,86 $ = 104.853.955 $
Keuntungan per tahun = Harga Produk – Harga Reaktan
= 104.853.955 $ - 82.221.319,14 $
= 22.632.635,86 $
= Rp
282.907.948.300,-b. Proses anhydrous
Pada reaksi I menghasilkan produk MIPA Yield:
- MIPA : 92,4 % - DIPA : 7,4 % - TIPA : 0,2 % Konversi PO : 95%
Kapasitas produk : 15.000 ton MIPA tiap tahun
Mol MIPA=Massa MIPA(kapasitas)
BM
Mol MIPA=15.000 .000kg
Mol DIPA= 0,74
0,924x
(
15.000 .000
133
)
=120,43kmolMol TIPA=0,002
0,924 x
(
15.000 .000
191
)
=2,27kmolDengan reaksi I :
NH3 (l) + PO (l) → MIPA (l)
Mula A B
-Bereaksi 200.122,70 200.122,70 200.122,70 Sisa A-200.122,70 B-200.122,70 200.122,70
Dengan reaksi II :
MIPA (l) + PO (l) → DIPA (l)
Mula 200.122,70 B-200.122,70
-Bereaksi 122,70 122,70 122,70
Sisa 200.000 B-200.245,4 122,70
Dengan reaksi III :
DIPA (l) + PO (l) → TIPA (l)
Mula 122,70 B200.245,4
-Bereaksi 2,27 2,27 2,27 Sisa 120,43 B-200.247,67 2,27
Menentukan Propilen Oksida
PO sisa reaksi = (100% - 95%) x PO umpan
B-200.247,67 = 0,05 x B
0,95b = 200.247,67
Menentukan NH3 masuk reaktor
A (NH3)umpan = 40 x (PO)umpan
A = 40 x 210.787,02 kmol
A = 8.431.480,84 kmol
Bahan baku yang dibutuhkan:
Mol PO = 210.787,02 kmol
Massa PO yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA = mol PO x BM PO
= 210.787,02 kmol x 58 kg/kmol = 12.225.647,16 kg = 12.225,65 ton
Harga PO = 2.202,00 $ /ton x 12.225,65 ton = 26.920.875,05 $
Mol NH3 mula-mula = 8.431.480,84 kmol
Massa NH3 yang dibutuhkan untuk menghasilkan 200.000 kmol MIPA = mol NH3 x BM NH3
= 8.431.480,84 kmol x 17 kg/kmol = 143.335.174,3 kg = 143.335,17 ton
Harga NH3 = 385,81 $/ ton x 143.335,17 ton = 55.300.143,59 $
Jumlah harga bahan baku:
= (26.920.875,05 $ + 55.300.143,59 $$) = 82.221.018,64 $
Massa produk MIPA = 15.000.000 kg = 15.000 ton
Harga produk MIPA = 4.000 $/ ton x 15.000 ton = 60.000.000 $
Massa DIPA = 120,43 kmol x 133 kg/kmol
= 16.017,19 kg = 16,02 ton
Harga produk DIPA = 3.000 $/ ton x 16,02 ton = 48.051,57 $
Massa TIPA = 2,27 kmol x 191 kg/kmol = 433,57 kg = 0,43 ton
Harga produk TIPA = 2.100 $/ ton x 0,43 ton = 910,49 $
Jumlah harga produk:
= 60.000.000 $ + 48.051,57 $ + 910,49 $ = 60.048.962,07 $
Keuntungan per tahun = Harga Produk – Harga Reaktan
= 60.048.962,07 $ - 82.221.018,64 $
= - 22.172.056,3 $
Harga reaktan yang dibutuhkan lebih besar daripada harga produk yang dihasilkan maka dapat disimpulkan bahwa tidak ada keuntungan yang didapat (rugi).
2. Berdasarkan Tinjauan Termodinamika
Panas reaksi (∆HR)
T = 330 K Pada proses pembentukan isopropanolamin terjadi reaksi sebagai berikut:
a. Proses aqueous
Reaksi 1 :
NH3 + PO MIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.2. sebagai berikut :
∆HR = ∆H1 + ∆HRo + ∆H2
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1) ΔHRo(298oK) = ΔHfo C3H9NO(
l)- (ΔHfo C3H6O + ΔHfo NH3) = -8,38.104 – (-9,28.105+(-4,57.104))
= -6,99.105 kJ/kmol
∆H1 = ΔC pmh x Δt ΔCpmh
R NH3 ¿2,73 + (2,38.10
-2 x 301,5) + ((-1,71.10-5/3) x ((4x301,52) -(298x330))) + (( -1,19.10-8) / (298x330))
ΔCpmh
R N H3 ¿ 36 J/mol ΔCpmhNH3 = 300 J/mol K
∆ H NH3 ¿ 2097,835 J/mol = 2,098kJ/mol
ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 301,5) + ((1,71.10-5/3) x ((4x301,52) -(298x330))) + ((4,82.10-8) / (298x330)) ΔCpmh
R C3H6O ¿ 71,8 J/mol ΔCpmh C3H6O = 5,97.102 J/mol K
∆H C3H6O ¿ 4178,723 J/mol = 4,178 kJ/mol
∆H2 = ΔC pmh x Δt ΔCpmh
R C3H9NO ¿ -7,49 + (4,1.10
-01 x 301,5) + ((-2,83. 10-04/3) x (( 4 x 301,5 2) – (298 x 330)) + (8,35.10 -08)/ (298 x 330)
ΔCpmh
R C3H9NO =92,7 J/mol ΔCpmh C3H9NO = 771 J/mol K
Δ H C3H9NO=¿ -5394,96J/mol = -5,394 kJ/mol
∆HR = ∆H1 + ∆HRo + ∆H2
∆HR = 6,276 kJ/mol +( -6,99.105 kJ/kmol)+ (-5,394 kJ/mol) ∆HR = -6,99.105 kJ/mol
Reaksi 2 :
MIPA + PO DIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.3 sebagai berikut :
Tabel 2.3. Harga ΔHof Masing-Masing Komponen
Komponen Harga ΔHof (J/mol)
PO -9,28E+04
MIPA -8,38E+05
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1) ΔHRo(298oK) = ΔHfo C6H15NO(
l)- (ΔHfo C3H6O + ΔHfo C3H9NO) =-9,97.105– (-9,28.105+(-8,38.104))
= -6,55.104 kJ/kmol
∆H1 = ΔC pmh x Δt ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 301,5) + ((-1,99.10-4/3) x ((4x301,52) -(298x330))) + ((4,82.10-8) / (298x330)) ΔCpmh
R C3H6O ¿ 71,8 J/mol ΔCpmh C3H6O = 5,97.102 J/mol K
∆H C3H6O ¿ 4170,485 J/mol = 4,170 kJ/mol
ΔCpmh
R C3H9NO ¿ -7,49 + (4,1.10
-01 x 301,5) + ((-2,83. 10-04/3) x (( 4 x 301,5 2) – (298 x 330)) + (8,35.10 -08)/ (298 x 330)
ΔCpmh
R C3H9NO =92,9 J/mol ΔCpmh C3H9NO = 772 J/mol K
Δ H C3H9NO=¿ -5406,67J/mol = -5,406 kJ/mol
∆H2 = ΔC pmh x Δt ΔCpmh
R C6H15NO ¿ -18,4 + (7,16.10
-01 x 301,5) + ((-4,39. 10 -04/3) x (( 4 x 301,5 2) – (298 x 330)) + (1,09.10 -07)/ (298 x 330)
ΔCpmh
R C6H15NO =157 J/mol ΔCpmh C6H15NO = 1,31.103 J/mol K
Δ H C6H15NO=¿ -9158,46 J/mol = -9,158 kJ/mol
∆HR = ∆H1 + ∆HRo + ∆H2
∆HR =9,577 kJ/mol +( -6,99.105 kJ/kmol)+( -9,158 kJ/mol) ∆HR = -6,51.104 kJ/mol
Reaksi 3 :
DIPA + PO TIPA
Harga ΔHof masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.4. sebagai berikut :
Tabel 2.4. Harga ΔHof Masing-Masing Komponen
Komponen Harga ΔHof (J/mol)
PO -9,28E+04
DIPA -9,97E+04
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1) ΔHRo(298oK) = ΔHfo C9H21NO3(
l)-(ΔHfo C3H6O +ΔHfo C9H15NO2) =-9,97.104– (-9,28.105+(-3,87.104))
= 7,7.104 kJ/kmol
∆H1 = ΔC pmh x Δt ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 301,5) + ((-1,99.10-4/3) x ((4x301,52) -(298x330))) + ((4,82.10-8) / (298x330)) ΔCpmh
R C3H6O ¿ 71,8 J/mol ΔCpmh C3H6O = 5,97.102 J/mol K
∆H C3H6O ¿ 4170,485 J/mol = 4,170 kJ/mol
ΔCpmh
R C6H15NO ¿ -18,4 + (7,16.10
-01 x 301,5) + ((-4,39. 10 -04/3) x (( 4 x 301,5 2) – (298 x 330)) + (1,09.10 -07)/ (298 x 330)
ΔCpmh
R C6H15NO =157 J/mol ΔCpmh C6H15NO = 1,31.103 J/mol K
Δ H C6H15NO=¿ -9158,46 J/mol = -9,158 kJ/mol
∆H2 = ΔC pmh x Δt ΔCpmh
R C6H15NO2 ¿ 1,28 + (8,821.10
-01 x 301,5) + ((-4,79. 10 -04/3) x (( 4 x 301,5 2) – (298 x 330)) + (9,8.10 -08)/ (298 x 330)
ΔCpmh
R C9H21NO3 =2,24.10
2 J/mol
ΔCpmh C9H21NO3 = 1,86.103 J/mol K
Δ H C9H21NO3=¿ -13010,7J/mol = -13,01 kJ/mol
∆HR = ∆H1 + ∆HRo + ∆H2
∆HR =-13,01 kJ/mol +( -6,99.105 kJ/kmol+9,577 kJ/mol) ∆HR = -1,94.105 kJ/mol
Karena harga ΔH298.15K negatif, maka reaksi bersifat eksotermis.
b. Proses anhydrous
Reaksi 1 :
NH3 + PO MIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.5. sebagai berikut :
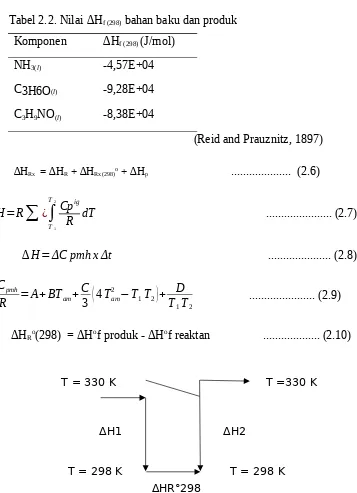
Tabel 2.5. Nilai ∆Hf (298) bahan baku dan produk Komponen ∆Hf (298) (J/mol)
T = 373K
ΔCpmh
R NH3 ¿2,73 + (2,38.10
-2 x 335,5) + ((-1,71.10-5/3) x ((4x335,52) -(298x373))) + (( -1,19.10-8) / (298x373))
ΔCpmh
R N H3 ¿ 29,24 J/mol ΔCpmhNH3 = 243,1 J/mol K
∆ H NH3 ¿ -18.232,6 J/mol = -18,23 kJ/mol
ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x ((4x335,52) -(298x373))) + ((4,82.10-8) / (298x373)) ΔCpmh
R C3H6O ¿ -30,83 J/mol ΔCpmh C3H6O = -256,34J/mol K
∆H C3H6O ¿ 19.225,5 J/mol = 19,23 kJ/mol
∆H1= ∆ H NH3 +∆ H C3H6O ∆H1 ¿ -18,23 kJ/mol + 19,23 kJ/mol ∆H1 ¿ 1 kJ/mol
∆H2 = ΔC pmh x Δt
ΔCpmh
R C3H9NO ¿ -7,49 + (4,1.10
-01 x 335,5) + ((-2,83. 10-04/3) x (( 4 x 335,5 2) – (298 x 373)) + (8,35.10 -08)/ (298 x 373)
ΔCpmh
R C3H9NO = -47,16J/mol ΔCpmh C3H9NO = -392,08 J/mol K
∆HR = ∆H1 + ∆HRo + ∆H2
∆HR = 1 kJ/mol +54,7 kJ/kmol kJ/kmol + (-58,81 kJ/mol) ∆HR = -3,11 kJ/mol
Reaksi 2 :
MIPA + PO DIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.3 sebagai berikut :
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1) ΔHRo(298oK) = ΔHfo C6H15NO2(
l)- (ΔHfo C3H6O + ΔHfo C3H9NO) =-9,97.104– (-9,28.104+(-8,38.104))
= -276290 J/kmol = -276,29 kJ/kmol
∆H1 = ΔC pmh x Δt
ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x ((4x335,52) -(298x335,5))) + ((4,82.10-8) / (298x335,5)) ΔCpmh
R C3H6O ¿ -30,83 J/mol ΔCpmh C3H6O = -256,34J/mol K
ΔCpmh
R C3H9NO ¿ --7,49 + (4,1.10
-01 x 335,5) + ((-2,83. 10-04/3) x (( 4 x 335,5 2) – (298 x 373)) + (8,35.10 -08)/ (298 x 373)
ΔCpmh
R C3H9NO = -39,25 J/mol ΔCpmh C3H9NO = -326,36 J/mol K
Δ H C3H9NO=¿ -24476,6 J/mol = -24,47 kJ/mol
∆H1= ∆ H C3H6O + ∆ H C3H9NO ∆H1 ¿ 19,23 kJ/mol + -24,47 kJ/mol ∆H1 ¿ 5,24 kJ/mol
∆H2 = ΔC pmh x Δt ΔCpmh
R C6H15NO2 ¿ -18,4 + (7,16.10
-01 x 301,5) + ((-4,39. 10 -04/3) x (( 4 x 371 2) – (298 x 448)) + (1,09.10 -07)/ (298 x 448)
ΔCpmh
R C6H15NO2 = -80,35 J/mol ΔCpmh C6H15NO2 = -668,11 J/mol K
Δ H C6H15NO2=¿ -50108/mol = -50,108 kJ/mol
∆HR = ∆H1 + ∆HRo + ∆H2
∆HR = 5,24 kJ/mol + (-276,29 kJ/kmol) + (-50,108 kJ/mol) ∆HR = -331,65 kJ/mol
DIPA + PO TIPA
Harga ΔH°f masing-masing komponen pada suhu 298,15 K dapat dilihat pada Tabel 2.3 sebagai berikut :
Sehingga panas untuk masing - masing reaksi untuk suhu T, K dapat dihitung dengan persamaan:
Dari persamaan reaksi (2.1) ΔHRo(298oK) =ΔHfo C9H21NO3(
l)-(ΔHfo C3H6O + ΔHfo C6H15NO2) =-3,87.105– (-9,28.104+(-9,96.104))
= -579670 J/kmol = -579,67 kJ/kmol
∆H1 = ΔC pmh x Δt ΔCpmh
R C3H6O ¿ -8,46 + (3,26.10
-1 x 335,5) + ((1,71.10-5/3) x ((4x335,52) -(298x335,5))) + ((4,82.10-8) / (298x335,5)) ΔCpmh
R C3H6O ¿ -30,83 J/mol ΔCpmh C3H6O = -256,34J/mol K
∆H C3H6O ¿ 19.225,5 J/mol = 19,23 kJ/mol
ΔCpmh
R C6H15NO2 ¿ -18,4 + (7,16.10
-01 x 335,5) + ((-4,39. 10 -04/3) x (( 4 x 335,5 2) – (298 x 373)) + (1,09.10 -07)/ (298 x 373)
ΔCpmh
R C6H15NO2 = -68,07 J/mol ΔCpmh C6H15NO2 = -565,95 J/mol K
∆H1= ∆ H C3H6O + ∆ H C6H15NO2
∆HR 61,63 kJ/mol + (-579,67 kJ/kmol) + (-81,7 kJ/mol) ∆HR = -599,68 kJ/mol
Karena harga ∆HR negatif, maka reaksi bersifat eksotermis.
Energi Bebas Gibbs (∆G)
Perhitungan energi bebas gibbs (∆G) digunakan untuk meramalkan arah reaksi kimia cenderung spontan atau tidak. ΔGo bernilai positif (+) menunjukkan bahwa reaksi tersebut tidak dapat berlangsung secara spontan, sehingga dibutuhkan energi tambahan dari luar yang cukup besar. Sedangkan ΔGo bernilai negatif (-) menunjukkan bahwa reaksi tersebut dapat berlangsung secara spontan dan hanya sedikit membutuhkan energi.
... (2.12)
a. Proses aqueous
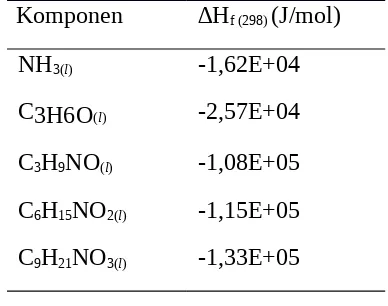
Tabel 2.6. Nilai ∆Gf (298) bahan baku dan produk Komponen ∆Hf (298) (J/mol)
NH3(l) -1,62E+04 C3H6O(l) -2,57E+04 C3H9NO(l) -1,08E+05 C6H15NO2(l) -1,15E+05 C9H21NO3(l) -1,33E+05
(Reid and Prauznitz, 1897)
Reaksi 1 :
NH3 + PO MIPA
ΔGo (298oK) = (ΔGo C3H9NO(
l) ) - (ΔGo NH3(l) + (ΔGo C3H6O(l)) = (-1,08E+05) – ((-1,62E+04) + (-2,57E+04)) = -6,61E+4 J/mol = -66,1 kJ/kmol
ΔG=(−699)−301,5x
(
(
−699+66,1298
)
+(4,73+131))
¿−40981,26 kJ/kmolReaksi 2 :
MIPA + PO DIPA
ΔGo (298oK) =(ΔGoC6H15NO2(
7,623+63,2 = (-1,33E+05) – ((-1,15E+05) + (-2,57E+04)) = -9,18E+4 J/mol = -918 kJ/kmol
−10,67+39,07 = (-1,08E+05) – ((-1,62E+04) + (-2,57E+04)) = -6,61E+4 J/mol = -66,1 kJ/kmol
ΔGo (298oK) =(ΔGoC6H15NO2(
l))-(ΔGoC3H9NO(l)+ (ΔGo C3H6O(l)) = (-1,15E+05) – ((-1,08E+05) + (-2,57E+04)) = -1,73E+5 J/mol = -173 kJ/kmol
−71,7—378,84 = (-1,33E+05) – ((-1,15E+05) + (-2,57E+04)) = -9,18E+4 J/mol = -918 kJ/kmol
−71,7—277,74 amonia dan propilen oksida dengan rasio mol 5:1dan menggunakan air sebagai katalis.
Kondisi Operasi
P = 1,3 atm T = 32 °C
P = 80 atm T = 140 °C
Konversi 98,8% 95%
Keuntungan Rp
431.305.915.400,-Mengalami kerugian karena membutuhkan ammonia yang banyak yang menyebabkan biaya bahan baku lebih besar dari produknya
Dari Tabel 2.7. dapat dilihat bahwa proses pembuatan isopropanolamin dengan metode aqueous phase adalah proses yang paling baik untuk dipilih. Kelebihan proses ini adalah:
1. Konversi terhadap Propilen Oksida tinggi.
2. Kondisi operasi sangat menguntungkan jika ditinjau dari segi keamanan dan perancangan alat. Reaktor bekerja pada suhu dan tekanan yang mudah dicapai.
3. Biaya investasi dan biaya operasi rendah.
C. Uraian Proses
Proses pembuatan monoisopropanolamin dapat dibagi dalam empat tahap yaitu :
1. Tahap penyimpanan bahan baku
Bahan baku isopropanolamin yaitu amoniak dan propilen oksida disimpan dalam fase cair.
2. Tahap penyiapan bahan baku
Amoniak dari T-01 diumpankan ke mixer (M-01) untuk dicampur dengan air yang berasal dari menara distilasi pertama dan hasil atas separator. Kemudian keluaran mixer didinginkan di HE-01 sebelum diumpankan ke reaktor (R-01). Propilen oksida dari T-02 langsung diumpankan ke dalam reaktor untuk direaksikan dengan amoniak.
3. Tahap pembentukan produk
Di dalam reaktor terjadi reaksi yang bersifat eksotermis dan irreversible sebagai berikut :
NH3 + C3H6O C3H9NO (MIPA)
C3H9NO + C3H6O C6H15NO2 (DIPA)
C6H15NO2 + C3H6O C9H21NO3 (TIPA)
Reaksi terjadi pada fase cair - cair. Amoniak terpecah dan bergabung dengan propilen oksida melalui reaksi ammonolisis membentuk MIPA, DIPA, TIPA dan besarnya konversi propilen oksida mencapai 98,8%. Karena reaksi bersifat eksotermis maka untuk mempertahankan kondisi operasi diperlukan pendingin.
4. Tahap pemurnian produk