PENENTUAN KINETIKA INHIBISI XANTINA OKSIDASE
OLEH EKSTRAK
Syzygium polyanthum
MENGGUNAKAN
ELEKTRODE TERMODIFIKASI
NANOSPHERE
MAGNETIT
GUSTRIA ERNIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penentuan Kinetika Inhibisi Xantina Oksidase oleh Ekstrak Syzygium polyanthum Menggunakan
Elektrode Termodifikasi Nanosphare Magnetit adalah benar karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Gustria Ernis
RINGKASAN
GUSTRIA ERNIS. Penentuan Kinetika Inhibisi Xantina Oksidase oleh Ekstrak
Syzygium polyanthum Menggunakan Elektrode Termodifikasi Nanosphare Magnetit.
Dibimbing oleh LATIFAH K. DARUSMAN dan DEDEN SAPRUDIN.
Xantina adalah prekursor metabolik asam urat yang dikonversi oleh xantina oksidase, dan konsentrasi xantina dalam darah dan urin dapat digunakan sebagai indikator dalam diagnosis klinis untuk xanthinuria (gangguan genetik metabolisme xantina), gagal ginjal, hiperurisemia dan asam urat. Oleh karena itu, penentuan xantina sangat diperlukan dalam diagnosis klinis termasuk mendeteksi penyakit gout, metode yang secara cepat dan akurat untuk mendeteksi suatu analit adalah biosensor. Biosensor xantina telah dikembangkan secara luas untuk mengukur kadar xantina yang menjadi indikasi kadar asam urat. Namun, kinerja biosensor xantina harus tetap ditingkatkan untuk menghasilkan aktivitas dan sensitivitas yang lebih baik untuk dapat diaplikasikan lebih luas. Salah satu nanopartikel yang sangat menarik adalah nanomagnetit (Fe3O4),
karena karakteristik khusus seperti biokompatibilitas yang baik, persiapan yang mudah, toksisitas rendah dan properti superparamagnetik. Aplikasi metode elektrokimia yang belum banyak dikembangkan adalah untuk menentukan kinetika inhibisi xantina oksidase oleh suatu senyawa bahan alam, salah satunya daun salam (Syzygium polyanthum). Suatu senyawa bahan alam yang akan digunakan sebagai calon obat perlu
ditentukan tipe kinetika inhibisinya untuk melihat mekanisme inhibisi yang terjadi. Penelitian ini bertujuan untuk menentukan kinerja analitik elektrode pada pasta karbon termodifikasi Nanosphere magnetit sebagai biosensor xantina berdasarkan
immobilisasi xantina oksidase dan membuktikan bahwa elektrode tersebut dapat digunakan untuk menentukan kinetika inhibisi enzim xantina oksidase oleh ekstrak air daun salam. Pada penelitian ini xantina oksidase diimmobilisasi secara cross-linking dengan matriks Bovine serum albumin dan glutaraldehida pada permukaan elektrode pasta karbon termodifikasi nanosphere magnetit (EPKM) dan lainnya dengan mediator 2,3-dimethoxy-5-methyl-1,4-benzoquinone (Q0) (EPKQ). Respons Surface Method
(RSM) digunakan untuk memperoleh aktivitas xantina oksidase yang optimum. Kondisi optimum yang diperoleh adalah pada konsentrasi magnetit 10%, konsentrasi xantina 1mM, pH 7 dan pada suhu 200C.
Hasil penelitian menunjukkan limit deteksi dari EPKM adalah 2x lebih rendah dari EPKQ dan 5x lebih rendah dibandingkan elektrode pasta karbon tanpa modifikasi (EPK).Sensitivitas EPKM paling tinggi dibandingkan dengan yang lainnya, 1.3× lebih tinggi dari EPKQ dan 4× lebih tinggi dari EPK. EPKM juga memberikan rentang linearitas yang lebih luas (0.01-1.00 mM) dibandingkan dengan dua elektrode lainnya, EPK dan EPKQ (0.10-1.00 mM). Dapat disimpulkan bahwa EPKM adalah elektrode terbaik yang dapat meningkatkan kinerja analitik elektrode. Hal ini menunjukkan
nanosphere magnetit berfungsi sebagai elektrokatalitik pada biosensor xantina.
Elektrode pasta karbon termodifikasi nanosphere magnetit dapat digunakan untuk menentukan kinetika inhibisi enzim xantina oksidase oleh ekstrak S. polyanthum.
Kinetika Inhibisi dari ekstrak air S. polyanthum meningkatkan nilai KM dan nilai VMAKS
yang tetap. Berdasarkan hasil, kinetika inhibisi dari daun salam terhadap xantina oksidase adalah inhibisi kompetitif.
SUMMARY
GUSTRIA ERNIS. Nanosphere magnetite-modified CPE to Determine The Inhibition Kinetics of The Xanthine Oxidase by Syzygium polyanthum extract. Supervised by
LATIFAH K. DARUSMAN and DEDEN SAPRUDIN.
Xanthine is metabolic precursors of uric acid wich converted by xanthine oxidase, and the concentration of xanthine in the blood and urine can be used as an indicator in clinical diagnosis to xanthinuria (a genetic disorder of the metabolism of xanthine), renal failure, hyperuricemia and gout. Therefore, the determination of xanthine very necessary in clinical diagnosis include detecting presence of gout disease early, fast and accurate method’s for analit detection is biosensor. Xanthine biosensor have been developed extensively to measure the concentration of xanthine which shows the concentration of uric acid. However, xanthine biosensor performance must be improved to produce biosensors with better activity and sensitivity to be widely applicable. One interesting nano-sized material is nanomagnetite (Fe3O4), because of
its special characteristics such as good biocompatibility, easy preparation, low toxicity and super paramagnetic property. Application of electrochemical method has not yet been developed determine of the inhibition kinetics of xanthine oxidase by medicinal plant, the example is bay leaf (Syzygium polyanthum). Bay leaf is one of the medicinal
plants used traditionally by society as a gout medication. A compound of natural ingredients that would be used as a drug candidate is necessary to determine the type of inhibition kinetics to look at the mechanism of inhibition that occurs.
This study aimed to determine of analytical performance the carbon paste electrodes modified magnetite nanosphere as xanthine biosensor based on immobilization of xanthine oxidase and prove that the electrode can be used to determine the inhibition kinetics of xanthine oxidase by water extract of bay leaf. Xanthine oxidase was immobilized by cross-lingking with bovine serum albumin and glutaraldehyde on the surface of carbon paste electrodes modified nanospheres magnetite (MCPE) and the other with 2,3-dimethoxy-5-methyl-1,4-benzoquinone (Q0)
(QCPE). Respons Surface Method (RSM) was used to obtaine of xanthine oxsidase
optimum activity. Optimum condition of xanthine oxidase were 10% magnetite concentration, 1mM xanthine concentration, pH 7, and at the temperature 20ºC.
The results showed MCPE had limit of detection 2× lower than QCPE and 5× lower than carbon paste electrodes without modification (CPE). MCPE was the electrode which had the highest sensitivity than others, 1.3× higher than CPE and 4× higher than QCPE. MCPE shown wider linearity range (0.01-1.00 mM) than two other electrodes, CPE and QCPE (0.10-1.00 mM). It could be concluded nanosphere
magnetite-modified carbon paste electrodes could improve analytical performance. The
modified magnetite nanospheres carbon paste electrode could be used to determine the type of inhibition kinetics of S. polyanthum toward xanthine oxidase. Inhibition
kinetics of the S. Polyanthum extract increased of KM value and VMAX (IMAX) value was
constant. Based on the result, the type of inhibition kinetics was a competitive inhibition.
Keywords: Carbon paste electrode, inhibition kinetics, magnetite nanosphere,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
PENENTUAN KINETIKA INHIBISI XANTINA OKSIDASE
OLEH EKSTRAK
Syzygium polyanthum
MENGGUNAKAN
ELEKTRODE TERMODIFIKASI
NANOSPHERE
MAGNETIT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis persembahkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2014 hingga September 2015 ini adalah biosensor, dengan judul Penetuan Kinetika Inhibisi Xantina Oksidase oleh
Syzygium polyanthum Menggunakan Elektrode Termodifikasi Nanosphere Magnetit.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Latifah K Darusman MS dan Bapak Dr Deden Saprudin MSi selaku pembimbing yang telah meluangkan banyak waktu dan menyumbangkan banyak pikiran serta dukungan moril dan materil hingga terselesaikannya tulisan ini. Bapak Dr Akhiruddin Maddu, M. Siselaku dosen penguji luar komisi. Bapak Dr Mohamad Rafi Msi, Ibu Dr Wulan Tri Wahyuni Msi, dan Ibu Prof Dr Ir Suminar S Achmadi yang telah bersedia membimbing penulisan tesis dan jurnal dari karya ilmiah ini. Ibu Prof Dr Dyah Iswantini MscAgr dan Ibu Dr Gustini Sabirin MS selaku ketua dan sekretaris program studi Pascasarjana Kimia serta seluruh dosen Pascasarjana Kimia atas segala bimbingan dan ilmu yang diberikan.
Terimakasih juga penulis persembahkan untuk DIKTI atas Beasiswa yang diberikan (BPPDN, Beasiswa Pendidikan Pascasarjana Dalam Negeri) untuk menempuh kuliah di Sekolah Pascasarjana IPB. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf Laboratorium Kimia Analitik IPB (Om eman, Pak Dede, Bu Nunung, dan Pak Kosasih), Laboratorium Pusat Studi Biofarmaka IPB (Ibu Nunuk, Mbak Wiwik, Mba Ela, Mba Ina, Mas Nio, Mas Endi), Laboratorium Bersama Kimia IPB (Bapak Wawan, Mas Eko), dan Laboratorium Kimia Anorganik (Bapak Syawal, Pak Chaca, Pak Mul) yang telah membantu selama penelitian. Terimakasih juga untuk sahabat-sahabatku, para pejuang (Dewi Pratiwi, Nurhajawarsi, Ina Ristian, Ida Ayu Suci, dan Romi Seroja), gadis bengkulu (Kristina Mulia, Safniyeti, Nola Windirah, dan Risti Novita Sari) kakak-kakak dan teman-teman di kosan alfarabi (Mba Faiqotul Himma, Mawar Afiyah, Mba Siska, Mba Ani, Mba Melva, Ayuk Ropalia, Yanti, Magfirah, Uni Mega, Mba Dika, Ilmi, Novi, dan Ismi), teman-teman dan adek-adek divisi lab kimia Analitik (Bang Yuspian Nur, Kak Era Rahmi, Ummi Zahra, Fahmi Hasyim, Hanhan, Rahma, Iffri, afifia, Arum, Afiyatina, Fellina Kumala, Annisa, Desi, Nur Chasanah, Norma, Dian, Cempaka, Yuni, dan Rina), pasca kimia (Uda Dedri, Uda Nanda, Aryani, Afif, Anom, Vita, Ning, Husna, Bang Julius, Anggra, Kak Doni, Kak fatan, dan Kak Aini) atas motivasi, dukungan, dan bantuan terselesaikannya tesis ini (diskusi dan sharing).
Ungkapan terima kasih untuk yang teristimewa yaitu ayahanda Israk, Ibunda Ernawati Khairat, Perkasa Arian, One Gismaini, Unang Erni Zahara, Kak Yaumil Jaihida, Oryadi Sudarta, atas segala doa, motivasi, bantuan baik moril atau materil dan kasih sayangnya. Ucapan terimakasih juga disampaikan kepada seluruh keluarga, rekan, dan sahabat yang tidak dapat penulis sebutkan satu persatu dan telah membantu dalam penyelesaian tesis ini. Kiranya segala bantuan yang diberikan dicatat sebagai amal jariah. Penulis juga menyampaikan permohonan maaf apabila selama studi, selama pelaksanaan penelitian maupun penulisan tesis ini terdapat tutur kata, sikap maupun perbuatan yang kurang berkenan. Semoga tesis ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Xantina dan Asam Urat 3
Biosensor dan Elektrokimia 4
Pemodifikasi dan Nanomagnetit 5
Kinetika dan Inhibisi Enzim 6
Inhibisi Kompetitif 7
Inhibisi Nonkompetitif 8
Inhibisi Unkompetitif 8
Syzygium polyanthum (Daun Salam) 9
METODE PENELITIAN 11
Bahan dan Alat 11
Prosedur Kerja 11
Sintesis dan karakterisasi nanosphere magnetit 11
Pembuatan dan karakterisasi elektrode 11
Immobilisasi enzim xantina oksidase 11
Pengukuran elektrokimia 12
Optimasi aktivitas XO dengan RSM 12
Pengujian kinerja elektrode 12
Pengujian kinetika inhibisi ekstrak terhadap XO 13
HASIL DAN PEMBAHASAN 13
Sintesis magnetit 13
Karakterisasi magnetit 14
Karakterisasi elektrode 16
Immobilisasi enzim 18
Kondisi optimum XO 19
Kinerja elektrode 22
Ekstraksi dan daya inhibisi daun salam 24
SIMPULAN DAN SARAN 28
Simpulan 28
Saran 28
DAFTAR PUSTAKA 29
LAMPIRAN 34
DAFTAR TABEL
1. Pola nilai hkl magnetit 15
2. Penentuan struktur kristal 15
3. Nilai perubahan potensial anodik dan katodik K3[Fe(CN)6] pada
3 jenis elektrode 17
4. Daya inhibisi ekstrak air daun salam terhadap XO secara elektrokimia 24 5. Daya inhibisi Allopurinol terhadap XO secara elektrokimia 25
DAFTAR GAMBAR
1. Struktur Asam Urat 3
2. Reaksi enzim xantina oksidase mengoksidasi xantina menjadi asam urat 4 3. Elemen dan pemilihan komponen untuk tipe biosensor 4
4. Grafik Michaelis-Menten 6
5. Grafik Lineweaver-Burk 7
6. Karakteristik inhibisi kompetitif 8
7. Karakteristik inhibisi nonkompetitif 8
8. Karakteristik inhibisi unkompetitif 9
9. Syzygium polyanthum kering 10
10. Difragtogram serbuk hasil sintesis dan standar magnetit 14
11. Pencirian SEM serbuk magnetit 16
12. Voltamogram siklik elektrode kerja dalam KCl dan K3[Fe(CN)6] 17
13. Voltamogram siklik pengukuran xantina 18
14. Dugaan skematis reaksi pada saat fabrikasi elektrode 19
15. Kontur optimalisasi menggunakan RSM 20
16. Voltamogram siklik pengukuran xantina pada kondisi optimum 21
17. Voltamogram siklik linearitas untuk EPKM 22
DAFTAR LAMPIRAN
1. Diagram Alir Penelitian 35
2. Hasil sintesis dan penentuan kadar Fe terendapkan 36
3. Standar magnetit JCPDS No. 19-0629 37
4. Penetuan pola hkl 38
5. Penetuan ukuran kristal hasil sintesis 39
1 PENDAHULUAN
Latar Belakang
Xantina adalah prekursor metabolik asam urat yang dikonversi oleh xantina oksidase dan konsentrasi xantina di dalam darah dan urin dapat digunakan sebagai indikator dalam diagnosis klinis untuk xanthinuria (gangguan genetik metabolisme xantina), gagal ginjal, hiperurisemia dan asam urat (Larosa et al. 2007; Arikyants et al. 2007). Kadar asam urat dalam darah adalah hasil keseimbangan antara
produksi dan ekskresi. Ketika terjadi ketidakseimbangan kedua proses tersebut, maka terjadi keadaan hiperurisemia hingga menyebabkan gout. Hiperurisemia atau gout dapat ditemukan di seluruh dunia, pada semua ras manusia yang prevalensinya cenderung memasuki usia semakin muda yaitu usia produktif yang akan berdampak pada penurunan produktivitas kerja (Sholihah 2014). Tingginya kadar asam urat akan berakibat dapat menimbulkan penyakit lain seperti batu ginjal (Shakaee2014), hipertensi (Yang et al. 2015), dan kerusakan kardiovaskuler (Ioachimescu et al.
2008; Yang et al. 2015). Oleh karena itu, penentuan xantina sangat diperlukan
dalam diagnosis klinis termasuk dalam mendeteksi penyakit gout lebih awal. Biosensor elektrokimia adalah metode yang tepat untuk mendeteksi suatu analit dengan cepat dan akurat. Biosensor elektrokimia banyak diminati karena cara pengukurannya yang sederhana, cepat dan dapat diminiaturisasi. Teknik dalam metode ini yang biasa digunakan adalah teknik voltametri siklik. Pada teknik ini yang terukur sebagai arus adalah proses transfer elektron yang dihasilkan dari proses oksidasi xantina menjadi asam urat. Teknik voltametri menggunakan tiga elektrode konvensional seperti: elektrode kerja, elektrode bantu dan elektrode referensi. Elektrode pasta karbon (EPK) adalah salah satu elektrode kerja yang sangat sederhana, murah, persiapan yang mudah, dan bahan-bahan yang mudah diperoleh. Namun, kinerja analitik dari elektrode konvensional ini masih perlu ditingkatkan dengan mempercepat transfer elektron. Sehingga penambahan modifier sangat penting untuk dapat mempercepat transfer elektron (bersifat elektro katalitik) di elektrode pasta karbon dan meningkatkan sensitivitas biosensor.
Sensitivitas suatu sensor elektrokimia ditentukan dengan kemampuannya untuk menciptakan ruang mikro bagi biomolekul atau analit untuk bertukar elektron langsung dengan elektrode (Loh et al. 2008). Dibutuhkan material yang berukuran
nano untuk menciptakan ruang mikro tersebut. Salah satu nanopartikel yang sangat menarik adalah nanomagnetit (Fe3O4). Karena karakteristik khusus seperti
biokompatibilitas yang baik, persiapan yang mudah, toksisitas rendah dan properti superparamagnetik (Wu et al. 2006; Zhuo et al. 2009). Biosensor xantina telah
dikembangkan secara luas untuk mengukur kadar xantina yang menjadi indikasi kadar asam urat. Namun, kinerja biosensor xantina harus tetap ditingkatkan untuk menghasilkan aktivitas dan sensitivitas yang lebih baik agar dapat diaplikasikan lebih luas lagi, termasuk untuk penentuan kinetika inhibisi enzim xantina oksidase oleh produk alam yang akan dijadikan obat asam urat/ gout.
Salah satu produk alam yang telah digunakan secara empiris oleh masyarakat indonesia sebagai tanaman obat untuk asam urat/ gout adalah daun salam (Syzygium polyanthum). Daun salam banyak ditemukan di Indonesia, daun salam juga murah
sebagai tanaman obat, diantaranya adalah antiobesitas (Kato F et al. 2013),
antibakteri (Sumono & Wulan 2008), antidiabetes (Suharmiati & Roosihermiatie 2012), obat berbagai macam penyakit seperti maag, hipertensi, antiinflamasi, mabuk, penyakit kulit (Sumono & Wulan 2008) termasuk asam urat (Ariyanti et al.
2007; Ngestiningsih D et al. 2011; Ngestiningsih D et al. 2012). Suatu senyawa
bahan alam yang akan digunakan sebagai calon obat perlu ditentukan tipe kinetika inhibisinya untuk melihat mekanisme inhibisi yang terjadi. Tipe kinetika inhibisi yang terbentuk selanjutnya dapat menjelaskan kekuatan ikatan antara enzim sebagai target dan senyawa calon obat.
Perumusan Masalah
Biosensor xantina telah dikembangkan secara luas untuk mengukur kadar xantina yang menjadi indikasi kadar asam urat. Namun, kinerja biosensor xantina harus tetap ditingkatkan untuk menghasilkan aktivitas dan sensitivitas yang lebih baik agar dapat diaplikasikan lebih luas, sehingga diperlukan pemodifikasi seperti magnetit yang diharapkan berfungsi sebagai elektrokatalitik. Suatu senyawa bahan alam yang akan digunakan sebagai calon obat perlu ditentukan tipe kinetika inhibisinya untuk melihat mekanisme inhibisi yang terjadi. Sehingga elektrode tersebut diaplikasikan untuk menentukan kinetika inhibisi enzim xantina oksidase oleh ekstrak S. polyanthum yang merupakan suatu senyawa bahan alam.
Tujuan Penelitian
Meningkatkan kinerja elektrode pasta karbon dengan menggunakan nanosphere magnetit sebagai pemodifikasi sehingga elektrode tersebut dapat diaplikasikan untuk menentukan tipe kinetika inhibisi ekstrak S. polyanthum
terhadap enzim xantina oksidase.
Manfaat Penelitian
Magnetit diharapkan dapat meningkatkan kinerja analitik elektrode pasta karbon sebagai biosensor xantina dan dapat diaplikasikan untuk menentukan mekanisme inhibisi ekstrak S. polyanthum sebagai inhibitor enzim xantina oksidase
sehingga dapat digunakan untuk penelitian aktivitas enzim selanjutnya.
Hipotesis
1. Magnetit dapat meningkatkan kinerja analitik elektrode pasta karbon
2. Elektrode Pasta Karbon termodifikasi magnetit dapat digunakan sebagai alat untuk menentukan tipe kinetika inhibisi ekstrak Syzygium polyanthum terhadap
Ruang Lingkup Penelitian
Penelitian ini dilakukan atas tiga tahapan utama, yaitu: Sintesis magnetit menggunakan teknik hidrotermal dan karakterisasinya menggunakan XRD (untuk mengetahui kristal hasil sintesis merupakan nanomagnetit atau tidak), SEM (untuk mengetahui morfologi kristal hasil sintesis), dan AAS (untuk mengetahui konsentrasi Fe terendapkan). Tahapan selanjutnya adalah pembuatan elektrode pasta karbon termodifikasi nanomagnetit dan pengujian kinerjanya (sensitivitas, linearitas dan limit deteksi). Kemudian penentuan kinetika inhibisi enzim xantina oksidase oleh ekstrak S. polyanthum (ekstraksi menggunakan teknik maserasi)
menggunakan elektrode termodifikasi magnetit. Diagram alir penelitian disajikan pada Lampiran 1.
2 TINJAUAN PUSTAKA
Xantina dan Asam Urat
Xantina adalah prekursor dari asam urat yang dikonversi oleh xantina oksidase dari hipoxantina dan dikonversi oleh guanin deaminase dari guanin. Asam urat (AU) adalah sebuah kristal putih yang terbentuk di dalam tubuh sebagai akibat dari hasil metabolisme protein. Meningkatnya kadar asam urat (Hiperuisemia) sering disebut penyakit asam urat. AU telah dikenal sejak abad 5 SM yang terdiri dari komponen karbon, nitrogen, oksigen dan hidrogen dengan rumus molekul C5H4N4O3. Pada pH alkali kuat, AU membentuk ion urat dua kali
lebih banyak dari pada pH asam.
Gambar 1 Struktur Asam Urat (Ringertz 1966).
Gambar 2 Reaksi enzimatis xantina oksidase mengoksidasi xantina menjadi asam
Urat (Zen et al. 2002)
Biosensor dan Elektrokimia
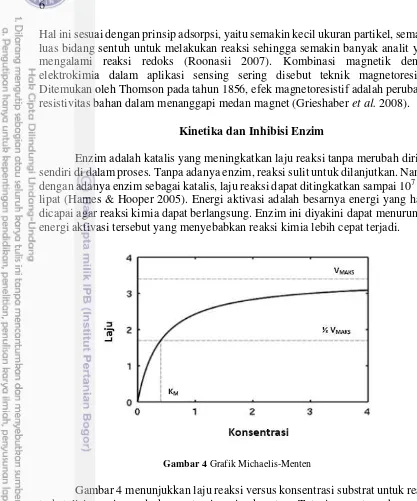
Penelitian terkait biosensor telah mengalami perkembangan lebih dari dua dekade terakhir. Biosensor umumnya didefinisikan sebagai perangkat analisis yang mengubah respons biologis menjadi sinyal yang dapat diukur. Gambar 3 menjelaskan pengenalan pengukuran biosensing dengan aspek elektronik untuk mendapatkan informasi dari sistem biologis.Bagian-bagian dari biosensor adalah: Bioreseptor (Gambar 3a) yang merupakan biomolekul yang dapat mengenali analat target; Tranduser (Gambar 3b), merupakan bagian perangkat fisika untuk mengubah sinyal yang dihasilkan menjadi sinyal yang dapat diukur dengan diperkuat oleh sebuah rangkaian detektor dengan menggunakan referensi yang sesuai (Gambar 3c) dan dikirim untuk diproses oleh perangkat lunak komputer (Gambar 3d) untuk dikonversi ke parameter fisik yang menjelaskan proses analisis. Akhirnya, hasil yang terukur akan ditampilkan dalam bentuk keluaran grafik yang dapat dibaca (Gambar 3e). Biosensors dapat diterapkan untuk berbagai macam sampel, yaitu: cairan tubuh, sampel makanan, kultur sel dan sampel lingkungan (Grieshaber et al. 2008).
Teknik deteksi elektrokimia didominasi menggunakan enzim. Hal ini dikarenakan enzim memiliki kemampuan dan aktivitas biokatalitik tertentu. Unsur
biorecognition lain misalnya: antibodi, asam nukleat, sel-sel dan mikro-organisme.
Metode yang paling umum dilakukan pada teknik biosensor seperti: voltametri siklik, kronoamperometri, kronopotensiometri, impedansi spektroskopi, dan berbagai metode yang berbasis transistor field-effect yang disajikan sepanjang
pemilihan pendekatan baru, seperti penggunaan nanowire atau magnet berbasis nanopartikel (Grieshaber 2008).
Metode yang sering digunakan adalah metode voltametri. Voltametri merupakan metode elektroanalisis yang didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik yang diterapkan pada sel elektrolisis. Sel elektrolisis terdiri atas elektrode kerja (workingelectrode) yaitu elektrode tempat
terjadinya reaksi, elektrode bantu (counter electrode) yaitu sebuah elektrode inert
yang berfungsi membawa sebagian besar arus listrik dan elektrode pembanding (reference electrode) yaitu elektrode yang memiliki nilai potensial tetap. Ketiga
elektrode ini merupakan penghantar/ sistem yang memungkinkan pengaliran elektron/ antar aksi komponen kimia tertentu dalam elektrolit sehingga dapat dilakukan pengukuran besaran potensial. Arus listrik pada elektrode kerja disebabkan oleh transfer elektron yang disebut arus faraday (Skoog et al. 1998;
Wang 2000).
Pemodifikasi dan Nanomagnetit
Peningkatan kinerja elektrode kerja dapat dilakukan dengan penambahan pemodifikasi yang akan mempercepat reaksi transfer elektron sehingga dapat meningkatkan respon analit agar dapat terukur (Wang 2000). Suatu zat yang digunakan sebagai pemodifikasi harus merupakan zat yang dapat bereaksi dengan cepat baik dengan enzim maupun electrode yang bersifat stabil, tidak bergantung kepada nilai pH, tidak bersifat toksik dan dapat diimobilisasi pada permukaan elektrode. Salah satu pemodifikasi yang dilaporkan adalah pemodifikasi 2,3-dimetoksi-5-metil-1,4-benzokuinon (Q0). Menurut hasil dari tiga zat yang
digunakan sebagai pemodifikasi, yaitu Q0, K3[Fe(SCN)6] dan Fe(C5H5)2.
Pemodifikasi Q0 terpilih untuk memediasi transfer elektron yang dihasilkan dari
reaksi oksidasi asam urat yang dikatalisis oleh enzim urikase yang diimmobilisasi pada permukaan elektrode. Hal ini terlihat dari puncak oksidasi yang dihasilkan dari transfer elektron yang dimediasi Q0 adalah yang tertinggi di antara pemodifikasi
lainnya (Iswantini et al. 2014).
Magnetit (Fe3O4) adalah suatu material yang menunjukkan sifat
kemagnetannya, dan pada ukuran tertentu seperti skala nano atau mikro, nanopartikel (NPs) memiliki domain magnetik tunggal, menghasilkan sifat superparamagnetik di atas temperatur normal (Yuan et al. 2011). Magnetit
merupakan mineral oksida Fe (II/III) yang secara natural berada di alam dan memiliki reaktivitas permukaan (Salazar-Camacho et al. 2013). Nanomagnetit
Hal ini sesuai dengan prinsip adsorpsi, yaitu semakin kecil ukuran partikel, semakin luas bidang sentuh untuk melakukan reaksi sehingga semakin banyak analit yang mengalami reaksi redoks (Roonasii 2007). Kombinasi magnetik dengan elektrokimia dalam aplikasi sensing sering disebut teknik magnetoresistif. Ditemukan oleh Thomson pada tahun 1856, efek magnetoresistif adalah perubahan resistivitas bahan dalam menanggapi medan magnet (Grieshaber et al. 2008).
Kinetika dan Inhibisi Enzim
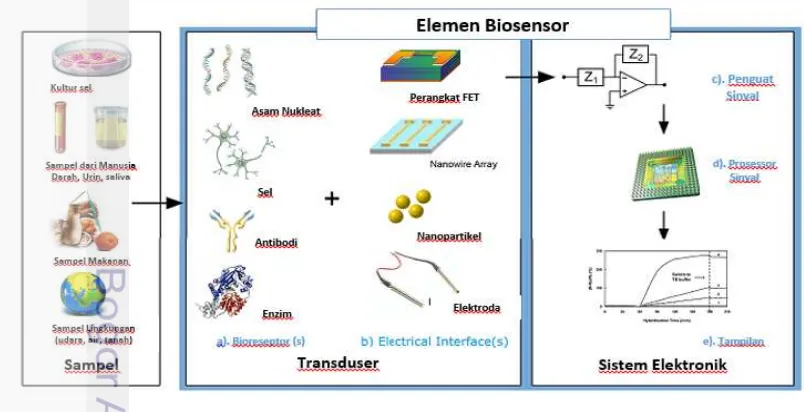
Enzim adalah katalis yang meningkatkan laju reaksi tanpa merubah dirinya sendiri di dalam proses. Tanpa adanya enzim, reaksi sulit untuk dilanjutkan. Namun dengan adanya enzim sebagai katalis, laju reaksi dapat ditingkatkan sampai 107 kali
lipat (Hames & Hooper 2005). Energi aktivasi adalah besarnya energi yang harus dicapai agar reaksi kimia dapat berlangsung. Enzim ini diyakini dapat menurunkan energi aktivasi tersebut yang menyebabkan reaksi kimia lebih cepat terjadi.
Gambar 4 Grafik Michaelis-Menten
Gambar 4 menunjukkan laju reaksi versus konsentrasi substrat untuk reaksi terkatalisis enzim pada konsentrasi enzim konstan. Tetapi penentuan harga KM
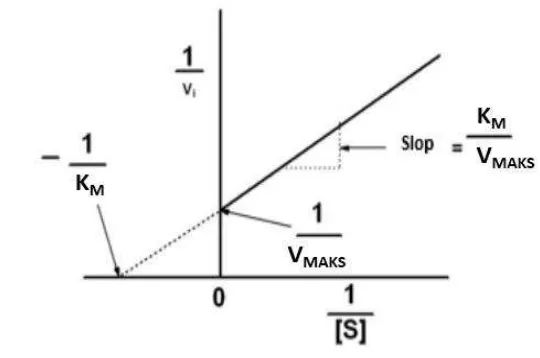
secara tepat dari sebuah grafik Michaelis-Menten sangat sulit dilakukan. Oleh karena itu, digunakan metode lain untuk menganalisis data yang ada, yaitu Grafik
Lineweaver-Burk (Gambar 5). Grafik hubungan 1/v dan 1/[S] merupakan suatu
garis lurus dengan slope KM/VMAKS dan intercept sumbu y 1/VMAKS.
1
� = (
�
�
� �)
1
[�] +
1
Gambar 5 Grafik Lineweaver-Burk
Berbagai faktor penentu laju aktivitas enzim harus dipelajari dengan seksama dan mengatur kondisinya sedemikian rupa agar diperoleh reaksi yang lebih terkendali dan murni yang melibatkan interaksi enzim-substrat. Untuk mengetahui kemampuan senyawa bioaktif sebagai obat, apakah bersifat inhibitor atau aktivator, dapat dilihat dari pola kinetikanya. Untuk melihat perubahan pola kinetikanya, terhadap lingkungan tempat reaksi enzim tersebut berlangsung ditambahkan senyawa bioaktif dengan konsentrasi tertentu dan pola kinetika yang terbentuk diperbandingkan dengan pola kinetika dasarnya (hanya interaksi enzim-substrat) (Price & Stevens 1996).
Dengan menggunakan bantuan grafik, melalui persamaan Michaelis-Menten atau melalui persamaan Lineweaver-Burk, dapat ditentukan pola kinetika enzim yang terbentuk akibat adanya inhibitor ataupun aktivator. Inhibitor enzim adalah zat yang mengubah tindakan katalis enzim yang akibatnya aktivitas enzim tersebut menjadi lambat/turun, atau dalam beberapa kasus, dapat menghentikan kerja katalis/enzim. Pola kinetika enzim yang terbentuk dapat bervariasi, tergantung pada mekanisme reaksi yang terjadi. Mekanisme inhibisi dapat berlangsung secara inhibisi kompetitif, inhibisi nonkompetitif, maupun inhibisi unkompetitif (Voet et. al. 2001).
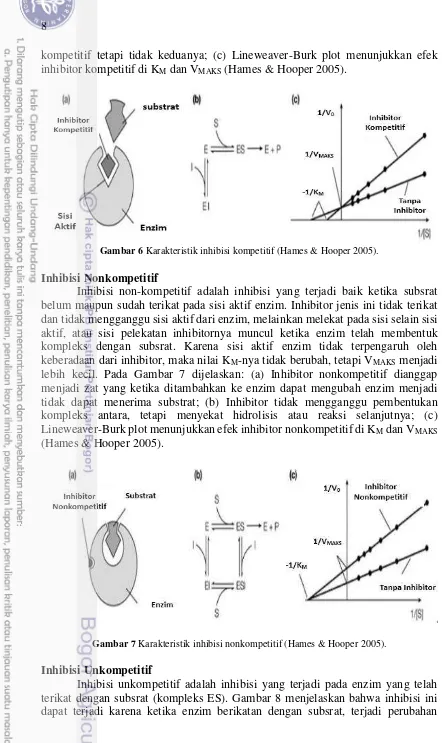
Inhibisi Kompetitif
Inhibisi kompetitif adalah inhibisi yang terjadi di bagian sisi pengikatan (binding site) dari enzim. Inhibisi ini dapat terjadi karena inhibitor kompetitif
memiliki struktur yang hamper sama atau menyerupai struktur dari substrat enzim tersebut, akibatnya jika inhibitor terlebih dahulu berikatan dengan enzim, maka substrat tidak dapat berinteraksi dengan enzim. Untuk menghilangkan efek inhibisi dari inhibitor kompetitif, maka konsentrasi subsrat perlu ditambahkan (jumlahnya harus lebih banyak dari konsentrasi inhibitor) untuk meminimalkan peluang interaksi inhibitor dengan enzim. Akibatnya, proses penjenuhan enzim oleh subsrat menjadi lebih lambat, sehingga nilai KM akhir setelah inhibisi akan menjadi lebih
besar, tapi nilai VMAKS tidak berubah karena ES tidak terganggu. Gambar 6
kompetitif tetapi tidak keduanya; (c) Lineweaver-Burk plot menunjukkan efek inhibitor kompetitif di KM dan VMAKS (Hames & Hooper 2005).
Gambar 6 Karakteristik inhibisi kompetitif (Hames & Hooper 2005).
Inhibisi Nonkompetitif
Inhibisi non-kompetitif adalah inhibisi yang terjadi baik ketika subsrat belum maupun sudah terikat pada sisi aktif enzim. Inhibitor jenis ini tidak terikat dan tidak mengganggu sisi aktif dari enzim, melainkan melekat pada sisi selain sisi aktif, atau sisi pelekatan inhibitornya muncul ketika enzim telah membentuk kompleks dengan subsrat. Karena sisi aktif enzim tidak terpengaruh oleh keberadaan dari inhibitor, maka nilai KM-nya tidak berubah, tetapi VMAKS menjadi
lebih kecil. Pada Gambar 7 dijelaskan: (a) Inhibitor nonkompetitif dianggap menjadi zat yang ketika ditambahkan ke enzim dapat mengubah enzim menjadi tidak dapat menerima substrat; (b) Inhibitor tidak mengganggu pembentukan kompleks antara, tetapi menyekat hidrolisis atau reaksi selanjutnya; (c) Lineweaver-Burk plot menunjukkan efek inhibitor nonkompetitif di KM dan VMAKS
(Hames & Hooper 2005).
Gambar 7 Karakteristik inhibisi nonkompetitif (Hames & Hooper 2005).
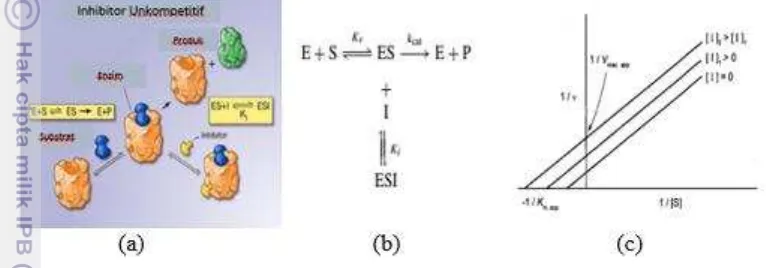
Inhibisi Unkompetitif
konformasi pada enzim yang menyebabkan munculnya sisi pengikatan untuk inhibitor. Akan tetapi inhibitor unkompetitif tidak dapat terikat pada enzim bebas.
Efek inhibisi dari inhibitor ini tidak dapat diatasi dengan penambahan konsentrasi subsrat, melainkan dengan cara menambahkan senyawa tertentu yang dapat berinteraksi dengan inhibitor sehingga inhibitor tidak dapat membentuk kompleks ESI. Semakin banyak konsentrasi subsrat ditambahkan, maka semakin banyak pula kompleks ESI yang dapat terbentuk, sehingga enzim lebih cepat jenuh oleh subsrat ketika diinhibisi, akibatnya nilai Kmakhir setelah inhibisiakan menjadi lebih kecil dari KM sebelum inhibisi, begitu pula dengan nilai VMAKS.
Gambar 8 Karakteristik inhibisi unkompetitif (a) Inhibitor unkompetitif hanya bereaksi dengan
kompleks ES, dan tidak bisa bereaksi dengan enzim bebas; (b) Reaksi yang melibatkan inhibitor unkompetitif; (c) Lineweaver-Burk plot menunjukkan efek
inhibitor unkompetitif di KM dan VMAKS (Voet et al. 2001).
Syzygium polyanthum (Daun Salam)
S. polyanthum dikenal masyarakat Indonesia sebagai bumbu masakan
yang penggunaannya banyak ditemukan pada setiap masakan. S. polyanthum
digunakan terutama sebagai rempah pengharum masakan di sejumlah negeri di Asia Tenggara. S. polyanthum tumbuh liar di hutan dan pegunungan, atau
ditanam di pekarangan dan di sekitar rumah. Tanaman ini dapat ditemukan di dataran rendah sampai 1400 mdpl. Tinggi pohon salam mencapai 25 m, batang bulat, bertajuk rimbun dan berakar tunggang. Daun tunggal, letak berhadapan, panjang tangkai daun 0.5-1 cm, jika diremas berbau harum/khas (Tjitrosoepomo 2002).
S. polyanthum diklasifikasikan ke dalam kingdom plantae, divisi
magnoliophyta, kelas magnoliopsida, suku myrtaceae, marga syzygium, dan jenis
Syzygium polyanthum. Nama asing S. polyanthum adalah Indonesian bayleaf atau
Indonesian laurel (Inggris). Nama daerah dari tanaman ini bermacam-macam, seperti di Sumatera dikenal sebagai “ubar serai dan meselangan”, di Jawa tanaman ini dikenal dengan nama “manting dan salam”, sedangkan di Madura dikenal dengan nama “salam”.
Identitas simplisia S. polyanthum (Gambar 9) adalah daun kering yang
berwarna coklat tua, tulang daun menyirip, dan menonjol pada permukaan bawah, tulang cabang halus (Farmakope Herbal Indonesia 2009).
Gambar 9Syzygium polyanthum kering (Farmakope Herbal Indonesia 2009)
Kandungan kimia yang terdapat dalam S. polyanthum adalah saponin,
triterpenoid, flavonoid, polifenol, alkaloid, tanin dan minyak atsiri yang terdiri dari sesquiterpen, lakton dan fenol (Studiawan et al. 2005; Dewanti & Wahyudi
2011), terdapat hidroksikavikol yang berlimpah (Kato E et al. 2013). Winarto
(2004) dan Sumono & Wulan (2008) juga menyatakan bahwa S. polyanthum
mempunyai kandungan kimia yaitu tanin, flavonoid, dan minyak asiri 0.05 % yang terdiri dari eugenol dan sitral. S.polyanthum diketahui mengandung flavonoid total
tidak kurang dari 0.40% dihitung sebagai kuarsetin (Farmakope Herbal Indonesia 2009).
S.polyanthum selain sebagai bumbu masakan, dapat digunakan juga sebagai
tanaman obat diantaranya sebagai antiobesitas (Kato F et al. 2013), antibakteri
(Sumono & Wulan 2008), antidiabetes (Suharmiati & Roosihermiatie 2012), kolesterol (Situmorang 2013), obat berbagai penyakit seperti: maag, hipertensi, antiinflamasi, mabuk, penyakit kulit (Sumono & Wulan 2008) hipertensi (Ismail 2013), antiproliferatif (Sulistiyani et al. 2014), termasuk asam urat (Ariyanti et al.
3 METODE
Bahan
Xantina oksidase (XO) dari bovine milk (aktivitas spesifik > 7 units/mg), xantina, dan glutaraldehide (GA) dari Sigma-Aldirch, (USA); FeCl3.6H2O, natrium
sitrat, urea, grafit, parafin cair, etanol, 2,3-dimethoxy-5-metil-1,4-benzoquinone (Q0), Bovine Serum Albumin (BSA), NaH2PO4 and Na2HPO4 dari Merk
(Germany); Syzygium polyanthum (Daun salam) yang diperoleh dari Pusat Studi
Biofarmaka, IPB.
Alat
Spektroskopi serapan atom/ AAS (Shimadzu AA-6300), difraksi sinar-X/ XRD (Shimadzu 7000), Mikroskop elektron payaran/ SEM (Zeiss), Potensiostat yang dilengkapi dengan perangkat lunak Echem v2.1.0 (eDAQ), elektrode Ag/AgCl sebagai elektrode referensi (eDAQ), elektrode platina sebagai elektrode pembantu (eDAQ), pipet mikro (Eppendorf) dan peralatan gelas yang diperlukan.
Prosedur Kerja
Sintesis dan Karakterisasi Nanosphere magnetit
Nanosphere magnetit disintesis menggunakan metode hidrotermal yang
mengacu pada Saprudin et al. (2013). Sebanyak 0.5406 g FeCl3·6H2O (2 mmol/0.05
M), 1.1764 g natrium sitrat (4 mmol/0.10 M), dan 0.3604 g urea (6 mmol/0.15 M) dilarutkan dalam 40 mL akuades, diaduk hingga larut sempurna, lalu dimasukkan ke dalam wadah teflon. Wadah tersebut dimasukkan ke dalam oven dan diatur pada suhu 200°C selama 12 jam. Setelah itu, wadah didinginkan pada suhu ruang. Endapan hitam yang terbentuk dipisahkan, dicuci dengan air dan etanol, lalu dikeringkan pada oven suhu 60°C semalam. Serbuk hasil sintesis dikarakterisasi menggunakan XRD dan SEM, sedangkan filtrat hasil sintesis diukur kadar Fe-nya menggunakan AAS.
Pembuatan dan karakterisasi elektrode pasta karbon (EPK)
Pada penelitian ini dibuat 3 jenis elektrode, elektrode pasta karbon tanpa pemodifikasi (EPK), elektrode pasta karbon dengan pemodifikasi Q0 (EPKQ) dan
elektrode pasta karbon termodifikasi Nanosphere magnetit (EPKM). EPK dibuat
sesuai prosedur Saprudin et al. 2013. Modifikasi elektrode pasta karbon dilakukan
dengan cara mencampurkan Q0 atau serbuk Nanosphere magnetit hasil sintesis
(komposisi 5%, 10% dan 15%) pada pasta karbon dengan komposisi grafit yang berkurang seiring komposisi pemodifikasi dan parafin cair yang tetap. Elektrode pasta karbon yang telah dibuat dikarakterisasi terlebih dahulu menggunakan larutan elektrolit KCl dan K3[Fe(CN)6].
Immobilisasi Enzim Xantina oksidase (Nakatani et al. 2005)
Enzim XO diimmobilisasi ke permukaan elektrode secara cross-linking
ruang. Kemudian ditutup dengan membran dialisis dan jaringan nilon yang diikat menggunakan parafilm. Akhirnya, elektrode dicuci dengan 0.05 M buffer fosfat pH 7. Saat elektrode tidak digunakan, maka disimpan dalam buffer fosfat pH 7 pada suhu 4ºC.
Pengukuran Elektrokimia (Devi et al. 2013)
Sebanyak 15 mL larutan buffer fosfat 0.05 M pH 7 ditambahkan ke dalam sel elektrokimia dan puncak arus anode yang terbentuk diamati sebagai blanko. Selanjutnya ditambahkan substrat 0.1 mL xantina (0.15 mM) ke dalam sel elektrokimia yang terdiri dari elektrode kerja, elektrode bantu, dan elektrode pembanding. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati.
Optimasi Aktivitas Xantina Oksidase dengan Respons Surface Method (Myers
et al. 2009)
Optimasi dilakukan pada suhu (10-30oC), pH (6-9), konsentrasi xantina
(0.1-1.0 mM) dan konsentrasi Nanosphere magnetit (5-15%). Metode permukaan
respons (RSM) digunakan untuk menentukan kondisi optimum aktivitas XO. Metode ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas pada perangkat lunak statistika Minitab.v.16 English.
Pengujian Kinerja Elektrode
Kinerja elektrode didentifikasi untuk 3 jenis elektrode pada kondisi optimum. Kinerja yang ditentukan adalah sensitivitas elektrode, linearitas elektrode dan limit deteksi elektrode sesuai dengan prosedur pada (Devi et al. 2013).
Penetuan Kinetika Inhibisi Enzim Xantina Oksidase oleh Ekstrak kasar S. polyanthum
Ekstraksi S.polyanthum (FHI, 2009)
Ekstraksi S. polyanthum mengacu pada Badan Farmakope Herbal
Indonesia/FHI (2009). Sampel S. polyanthum yang telah dibersihkan dan
dikeringkan kemudian dihaluskan, dan diekstraksi menggunakan metode maserasi. Serbuk S.polyanthum diekstraksi dengan pelarut etanol 70% (dengan rasio 1:10),
sampel beserta pelarut dikocok selama 6 jam menggunakan shaker, kemudian didiamkan selama 18 jam. Filtrat dipisahkan dan proses tersebut diulangi 3 kali dengan jenis dan jumlah pelarut yang sama. Semua filtrat dikumpulkan dan diuapkan dengan rotary evaporator sehingga diperoleh ekstrak kental, kemudian
dikeringkan, ditimbang dan dihitung rendemennya.
Pengukuran Aktivitas Enzim (Pengujian daya inhibisi terhadap XO dan penentuan IC50) (Thandavan et al. 2013)
Uji daya inhibisi ekstrak kasar terhadap XO dilakukan pada kondisi optimumnya. Pengukuran dilakukan pada kondisi optimum yang telah diperoleh sebelumnya sesuai dengan prosedur pengukuran elektrokimia. Akan tetapi sebelum ditambahkan substrat xantina, ke dalam sel elektrokimia ditambahkan ekstrak S.polyanthum dengan variasi konsentrasi tertentu. Nilai IC50
inhibisi dengan memasukkan nilai y=50. Kontrol positif digunakan obat komersil asam urat yaitu Allopurinol.
Pengujian kinetika inhibisi ekstrak terhadap XO
Prosedur uji kinetika inhibisi mirip dengan pelaksanaan uji penentuan daya inhibisi, hanya saja pada uji kinetika, konsentrasi substrat (xantina) divariasikan mulai dari 0.01 hingga 1.00 mM. Diuji sebagaimana penentuan daya inhibisi, dari sini akan diperoleh kinetika enzim XO dalam keadaan normal. Selanjutnya ke dalam sederetan konsentrasi substrat yang lain ditambahkan ekstrak (konsentrasi terpilih) sehingga diperoleh kinetika inhibitor enzim XO. Data yang diperoleh kemudian dikonversi dan diinterpretasikan ke dalam persamaan kinetika enzim dalam bentuk grafik. Selanjutnya dicari persamaan garis yang terbentuk dan tipe hambatannya berdasarkan perpotongan garis antara kinetika enzim normal dengan kinetika enzim setelah mendapat perlakuan ekstrak kasar.
4 HASIL DAN PEMBAHASAN
Sintesis dan Karakterisasi Magnetit
Sintesis magnetit
Magnetit disintesis menggunakan metode hidrotermal, yaitu metode yang sudah dikenal baik untuk mensintesis nanomagnetit dengan temperatur tinggi (200ºC) dan tekanan autogenous (Ramimoghadam et al. 2014). Cheng et al. 2010
berhasil mensintesis nanomagnetit dengan metode hidrotermal menggunakan 4 bahan kimia yaitu FeCl3, natrium sitrat, poliakrilamida dan urea. Namun
poliakrilamida merupakan bahan yang mahal, sehingga dilakukan sintesis nanomagnetit tanpa poliakrilamida yang telah berhasil dilakukan oleh Saprudin et al. 2013 menggunakan 3 bahan kimia yaitu FeCl3, natrium sitrat, dan urea.
Pembentukan nanomagnetit dilakukan selama 12 jam pada suhu 2000C, karena
nanomagnetit dapat terbentuk sempurna pada waktu 12 jam pemanasan (Saprudin
et al. 2013). Pembentukan magnetit menggunakan 3 bahan kimia ini diduga
mekanismenya adalah sebagai berikut: FeCl3 digunakan sebagai sumber besi yang
menyediakan Fe3+ seperti pada reaksi (1):
FeCl3 → Fe3+ + 3Cl- (1)
Natrium sitrat digunakan sebagai pereduksi Fe3+ menjadi Fe2+ (reaksi 2)
diawali dengan mengionnya natrium sitrat menjadi ion sitrat. Kemudian, ion sitrat dan Fe3+ membentuk kompleks Fe(III)-sitrat. Adanya ion H+ dalam larutan
mengakibatkan terjadinya reduksi Fe3+ menjadi Fe2+, sedangkan sitrat teroksidasi.
Fe3+ + e → a i i a , a Fe2+ (2)
Sedangkan urea sebagai pemberi suasana basa. Urea pada saat pemanasan akan terdekomposisi menjadi NH3 dan CO2 (reaksi 3) yang membuat suasana basa
dalam sistem reaksi (reaksi 4). Suasana basa ini mengakibatkan terbentuknya Fe(OH)3 (reaksi 5) dan Fe(OH)2 (reaksi 6). Sehingga Fe(OH)3 dan Fe(OH)2 akan
membentuk Fe3O4 dengan proses dehidrasi (reaksi 7).
CO(NH2)2 + H2O → 2NH3 + CO2 (3)
Hasil sintesis yang diperoleh merupakan serbuk berwarna hitam yang tertarik oleh magnet (Lampiran 2). Filtrat dari hasil sintesis diperoleh berwarna kuning jernih yang merupakan indikasi keberhasilan terbentuknya magnetit (Liang
et al. 2011). Untuk mengetahui Fe-terendapkan, di ukur kadar Fe pada filtrat hasil
sintesis menggunakan AAS. Hasil diperoleh bahwa kadar Fe yang terendapkan hanya sekitar 0.01% yang menunjukkan bahwa 99.99% Fe telah terkonversi menjadi produk.
Karakterisasi magnetit
Serbuk hitam hasil sintesis dicirikan menggunakan XRD untuk melihat derajat kristalinitas, ukuran kristal, bentuk kristal, dan pembuktian hasil sintesis dengan magnetit standar JCPDS. Dari hasil pencirian, diperoleh derajat kristalinitas hasil sintesis yaitu 76.2% dan ukuran kristal rata-rata adalah 38.21 nm yang ditentukan dari setengah lebar garis difraksi menggunakan persamaan Scherrer (perhitungan ukuran kristal pada Lampiran 5).
Gambar 10 menunjukkan puncak difraksi yang sesuai dengan standar magnetit pada JCPDS No: 19-0629, hal ini menunjukkan serbuk hasil sintesis adalah magnetit. Dari perbandingan sudut difraksi antara standar magnetit dengan serbuk hasil sintesis menunjukkan kemiripan puncak difraksi yang timbul, terutama puncak tertinggi sebagai ciri khas magnetit yaitu pada 2θμ 35.519 (pada hasil sintesis) yang mendekati standar magnetit yang timbul pada 2θμ 35.422 (JCPDS 19-0629). Hal ini menunjukkan bahwa serbuk hasil sintesis benar merupakan nanomagnetit.
Tabel 1 Pola nilai hkl magnetit
2θ hkl h2 + k2 + l2 magnetit hasil sintesis tersebut adalah kubus berpusat muka dengan menyesuaikan pada Tabel 2 dan penentuan pola hkl ini ditunjukkan pada Lampiran 4.
Tabel 2 Penentuan struktur kristal (Klug, H.P dan Alexander, L.E. 1974)
Struktur Kristal h2 + k2 + l2
Simple Cubic (SC) 1,2,3,4,5,6,7,8,9,10,....
Body Centered Cubic (BCC) 2,4,6,8,10,12,14,16,.... Face Centered Cubic (FCC) 3,4,8,11,12,16,19,20,24,27,....
Gambar 11 menunjukkan pencirian SEM untuk magnetit hasil sintesis berbentuk seperti bola yang berkumpul membentuk bulatan (spherical) yang
menandakan adanya efek magnetisasi (Cheng et al. 2010). Gaya magnet yang
terdapat dalam magnetit menyebabkan partikel-partikel magnetit tersebut saling tarik menarik membentuk bulatan (Zhao dan Asuha 2010). Gambar 11 (a) pada perbesaran 1.000× terlihat spherical magnetit yang seragam. Sedangkan pada
Gambar 11 (b) menunjukkan salah satu ukuran kumpulan spherical magnetit yang
terlihat dengan perbesaran 12.500×. Diameter partikel spherical magnetit
berukuran 121.5 nm. Pencirian SEM sesuai dengan laporan Cheng et al. (2010)
bahwa diperoleh nanomagnetit yang berbentuk bulat. Liang et al. (2011)
melaporkan berbagai bentuk pencirian SEM nanomagnetit yaitu: berbentuk memanjang seperti batang, bulat dan terbentuk aglomerasi butiran, serta bulat dengan ukuran partikel yang seragam.
Pada penelitian ini dengan tidak adanya poliakrilamida dapat menghasilkan nanomagnetit yang berbentuk bulat dan seragam, namun masih terdapat agregasi antar sperical. Hal ini dapat terjadi dikarenakan tidak adanya surfaktan seperti poliakrilamida yang dapat bersifat sebagai stabilizer ukuran nano, sehingga jika disimpan dalam waktu yang lama akan menyebabkan antar partikel atau kumpulan partikel beragregasi membentuk ukuran yang lebih besar. Berdasarkan Setyoningsih et al. 2010 yang menggunakan asam oleat sebagai stabilizer ukuran,
mampu menurunkan ukuran kristal magnetit. Penambahan asam oleat dalam suasana basa akan menghasilkan suatu surfaktan natrium oleat yang akan melapisi partikel-partikel magnetit. Ukuran kristal yang dilaporkan oleh Setyoningsih et al.
2010 lebih kecil dibandingkan pada penelitian ini yaitu sekittar 36.93 nm, sedangkan ukuran kristal yang lebih besar juga dilaporkan oleh Fauziah et al. 2012
yaitu 46.66 nm. Penggunaan teknik hidrotermal pada sintesis magnetit akan menghasilkan tekanan di atas 1 atm sehingga mampu menghasilkan ukuran kristal yang lebih kecil (Setyoningsih et al. 2012).
(a) (b)
Gambar 11 Pencirian SEM serbuk magnetit hasil sintesis a). Perbesaran 3.000×; b) perbesaran
12.500×
Berdasarkan hasil yang diperoleh, dengan melihat bentuk dan warna serbuk serta filtrat hasil sintesis, analisis AAS, analisis XRD dan SEM menunjukkan bahwa sintesis nanosphere magnetit berhasil dilakukan.
Karakterisasi Elektrode
Elektrode dibuat 3 jenis, yaitu elektrode tanpa pemodifikasi (EPK), elektrode dengan pemodifikasi Q0 (EPKQ) dan elektrode dengan pemodifikasi nanomagnetit
(EPKM). Untuk menguji elektrode tersebut baik untuk pengukuran, maka dilakukan karakterisasi dengan larutan elektrolit KCl dan K3[Fe(CN)6]. Pada KCl
diharapkan tidak menimbulkan puncak, dan pada K3[Fe(CN)6] diharapkan dapat
melihat puncak oksidasi dan reduksinya. Gambar 12 menunjukkan elektrode yang dibuat dapat mendeteksi arus yang ditimbulkan dari larutan elektrolit KCl yang tidak menimbulkan puncak dan dari larutan elektrolit K3[Fe(CN6)] yang
menimbulkan puncak pada daerah sekitar 0.5 Volt yang menunjukkan elektrode yang dibuat berfungsi dengan baik.
Dapat dilihat dari Tabel 3 bahwa K3[Fe(CN)6] mengalami oksidasi lebih awal
(pada potensial lebih rendah) pada EPKM dibandingkan pada EPKQ dan EPK, yang menunjukkan bahwa dengan adanya nanosphere magnetit dapat mempercepat laju reaksi redoks dari elektrolit K3[Fe(CN)6]. Selain itu EPKM juga memiliki ∆Ep
reaksi redoks tersebut termasuk reaksi reversibel. Ketiga elektrode tersebut tidak bersifat reversibel, karena beda potensial yang dihasilkan melebihi 54 mV, namun semakin kecil beda potensial yang dihasilkan maka semakin mendekati reversibel dan EPKM nerupakan elektrode terbaik dibandingkan dua elektrode lainnya.
Tabel 3 Nilai perubahan potensial anodik dan katodik K3[Fe(CN6)] pada 3 jenis elektrode
Potensial Jenis Elektrode
EPKM juga dapat mendeteksi puncak rata-rata oksidasi dan reduksi K3[Fe(CN)6] 1.52 and 3.27 lebih tinggi daripada EPKQ dan EPK, berturut-turut
dengan nilai Ipa/Ipc pada EPKM lebih mendekati 1 dibandingkan EPKQ dan EPK. Elektrode terbaik adalah yang memiliki nilai Ipa/Ipc mendekati 1. Dari Tabel 3 dapat dilihat pada EPK dan EPK nilai puncak anodik lebih tinggi dari puncak katodik, hal ini disebabkan karena adanya lapisan pada permukaan elektrode yang menghalangi transfer elektron. Namun dapat dilihat pada EPKM puncak katodik hampir sama tingginya dengan puncak anodik, hal ini membuktikan bahwa adanya magnetit dapat semakin memediasi reaksi redoks sehingga dapat meningkatkan puncak katodik. Hal ini menunjukkan nanosphere magnetit dapat meningkatkan laju transfer elektron pada K3[Fe(CN)6], yang membuktikan bahwa nanosphere
magnetit hasil sintesis bersifat elektrokatalitik. Proses elektrokatalitik dapat ditingkatkan dengan memperkecil ukuran partikel katalis. Sehingga penggunaan nanosphere magnetit diharapkan dapat meningkatkan sensitivitas dari elektrode.
(a) (b)
(c)
Gambar 12 Voltamogram siklik antara arus dan potensial pada (a) EPK, (b) EPKQ, (c) EPKM
10% dalam larutan elektrolit KCl (hitam) dan K3[Fe(CN)6] (merah)
Immobilisasi enzim
Enzim xantina oksidase diimmobilisasi ke permukaan elektrode dengan media immobiisasi adalah BSA (Bovine serum abumine) dan Glutaradehida dengan
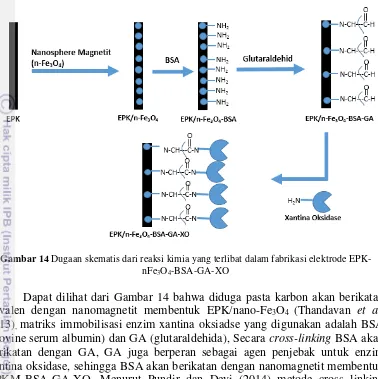
ikatan cross linking. Keberhasilan immobilisasi ditandai dengan terdeteksinya arus yang ditimbulkan dari proses antara xantina sebagai analit dengan enzim xantin oksidase yang terimmobilisasi pada permukaan elektrode yang menunjukkan timbulnya puncak pada daerah sekitar 0.5-0.6 volt (Gambar 13). Adapun skema dugaan reaksi kimia yang terjadi saat immobilisasi enzim pada elektrode kerja ditunjukkan pada (Gambar 14).
(a) (b) (c)
(d) (e)
Gambar 13 Voltamogram siklik pengukuran xantina dengan immobilisasi xantina oksidase
a,b,c,d, dan e berturut-turut untuk EPK, EPKM 5%, EPKM 10%, EPKM 15%, dan EPKQ.
Dari Gambar 13 terlihat bahwa kelima elektrode dapat mendeteksi arus oksidasi yang ditimbulkan dari transfer elektron pada reaksi dalam larutan analit (setelah ditambahkan xantina) yang dapat dibandingkan dengan arus blanko/buffer (sebelum ditambahkan xantina) seperti pada Gambar 13. Hal ini menunjukkan bahwa immobilisasi enzim secara cross linking dengan BSA dan GA berhasil
dilakukan. Namun arus reduksi tidak dapat terukur (sangat kecil), hal ini dapat disebabkan karena tidak adanya mediator yang cocok pada pengujian elektrokimia yang akan membantu proses reduksi. Sehingga diharapkan untuk penelitian
lanjutan menggunakan mediator yang cocok agar arus reduksinya juga dapat dideteksi, beberapa mediatot yang sering digunakan adalah ferrosena dan K3[Fe(CN)6].
Gambar 14 Dugaan skematis dari reaksi kimia yang terlibat dalam fabrikasi elektrode
EPK-nFe3O4-BSA-GA-XO
Dapat dilihat dari Gambar 14 bahwa diduga pasta karbon akan berikatan kovalen dengan nanomagnetit membentuk EPK/nano-Fe3O4 (Thandavan et al.
2013), matriks immobilisasi enzim xantina oksiadse yang digunakan adalah BSA
(Bovine serum albumin) dan GA (glutaraldehida), Secara cross-linking BSA akan
berikatan dengan GA, GA juga berperan sebagai agen penjebak untuk enzim xantina oksidase, sehingga BSA akan berikatan dengan nanomagnetit membentuk EPKM-BSA-GA-XO. Menurut Pundir dan Devi (2014) metode cross linking (gabungan antara ikatan kovalen dan penjebakan) adalah metode terbaik dalam mengimmobilisasikan enzim XO dibandingkan metode lainnya. Sebagian besar digunakan untuk menstabilkan penyerapan XO dan mencegah kebocorannya. Metode ini juga memberikan immobilisasi yang sangat kuat dengan enzim.
Penentuan Kondisi Optimum XO
Untuk menentukan kondisi optimum dari elektrode kerja, dilakukan optimasi elektrode secara kualitatif menggunakan Respons Surface Method (RSM)
dengan metode Central Composite Design (CCD) yang terdapat pada perangkat
lunak statistik Minitab.v.16 English. Pada metode RSM, kondisi optimum yang
diperoleh adalah memperhatikan hubungan masing-masing parameter terhadap respon dan hubungan antar-parameter terhadap respons. Berbeda dengan optimasi secara konvensional yang kondisi optimum untuk masing-masing parameternya ditentukan secara terpisah tanpa memperhatikan hubungan antar parameter dalam waktu yang sama. Parameter yang digunakan adalah suhu (10-300C), pH (6-9),
faktor-faktor peubah bebas dari keempat variabel tersebut dapat dilihat pada (Lampiran 6). Pengukuran dilakukan pada rentang -500 hingga 1500 mV dengan laju sebesar 100 mV/s. Kontur hubungan antar variabel terhadap arus oksidasi yang dihasilkan ditampilkan pada Gambar 15.
Gambar 15 Kontur hubungan 4 parameter: pH, konsentrasi xantina, konsentrasi magnetite, dan
Kontur menunjukkan perubahan arus puncak oksidasi yang tertinggi pada daerah dengan warna hijau gelap. Dari kontur ini dicari variabel yang paling berpengaruh terhadap arus. Dari P value pada output minitab, diperoleh faktor yang
berpengaruh adalah pH dengan P<0.05 (0.018) dan hubungan pH dengan [magnetit] (P= 0.038). Dari kontur yang dihasilkan (a-f) diketahui bahwa arus yang paling tinggi dihasilkan pada kontur b dan d (>9 µA). Dari kontur a dan d dapat dilihat bahwa semakin tinggi konsentrasi xantina, maka semakin tinggi pula arus yang dihasilkan, selain itu kedua kontur ditinjau dari pH sekitar 7.5, dan konsentrasi magnetit sekitar 10%. untuk menentukan optimasinya, diperlukan data optimizer yang diperoleh dari output Minitab (Lampiran 6). Dengan menggunakan optimizer, output minitab
menunjukkan kondisi optimim yang menghasilkan aktivitas enzim terbaik adalah pada pH 7, konsentrasi magnetit 10%, konsentrasi xantina 1mM dan pada suhu 20ºC.
Kondisi optimum ini digunakan untuk kondisi pengukuran analit selanjutnya. Kondisi suhu optimum yang sama juga dilaporkan oleh Iswantini and Darusman (2003)namun berbeda dengan pH dan konsentrasi xantina optimum berturut-turut yaitu 7.5 dan 0.7mM. Konsentrasi xantina yang sama juga dilaporkan oleh Iswantini
et al. (2014) dengan nilai pH dan suhu yang berbeda yaitu 7.5 dan 30ºC. Cengiz et al. (2012) melaporkan kondisi optimum aktivitas xantina oksidase yang berbeda
yaitu pada pH 9 dan suhu 37ºC. Perbedaan kondisi optimum aktivitas xantina
oksidase ini dapat terjadi karena perbedaan waktu pengukuran, alat, kondisi lingkungan, dan metode yang digunakan.
Gambar 16 Voltamogram siklik pengukuran xantina pada kondisi optimum untuk perbandingan
arus yang dihasilkan pada a). EPKM 5% (hitam), EPKM 10% (merah), EPKM 15% (hijau); b). EPK (hitam), EPKQ (merah) dan EPKM 10% (hijau)
Dari Gambar 16 (a) dapat dilihat perbandingan arus puncak oksidasi yang dihasilkan dari 3 jenis elektrode termodifikasi magnetit dengan konsentrasi bervariasi yaitu 5%, 10% dan 15%. Diperoleh Arus yang terdeteksi oleh EPKM 10% > EPKM 15% > EPKM 5%. Sehingga elektrode pasta karbon termodifikasi magnetit yang digunakan untuk pengukuran selanjutnya adalah EPKM 10%, hal ini sesuai dengan hasil optimizer dari RSM. Kemudian EPKM 10% terpilih dibandingkan dengan elektrode termodifikasi Q0 (EPKQ) dan elektrode tanpa
pemodifikasi (Gambar 16 b). Elektrode yang menghasilkan arus oksidasi paling tinggi adalah elektrode pasta karbon yang dipemodifikasi Nanosphere magnetit diikuti oleh
pasta karbon yang tidak dipemodifikasi. Dari hal ini dapat diketahui bahwa magnetit dapat meningkatkan arus oksidasi xantina menjadi asam urat dan dibandingkan dengan Q0 sebagai pemodifikasi yang sering digunakan untuk biosensor asam urat (Iswantini
et al. 2014).
Adapun reaksi yang terjadi pada elektrode tersebut hingga dihasilkan puncak oksidasi adalah seperti persamaan reaksi di bawah ini berdasarkan Devi et al. (2013):
Xantina + O2 + H2O → Asam Urat + H2O2
xantina akan teroksidasi menjadi asam urat dan peroksida, kemudian dengan diberikan potensial maka peroksida tersebut teroksidasi menghasilkan elektron dan elektron inilah yang dikonversi menjadi sinyal yang dapat terbaca sebagai puncak pada voltamogram hasil pengukuran. Pada penelitian ini peran Fe3O4 (nanosphere magnetit)
adalah mempercepat (katalisis) proses transfer elektron yang dihasilkan dari oksidasi H2O2 dengan adanya potensial menuju elektrode kerja hingga munculnya puncak.
Kinerja Elektrode
Kinerja analitik seperti sensitivitas, linearitas dan limit deteksi ditentukan untuk EPK, EPKQ dan EPKM 10%. Rentang konsentrasi xantina yang dipakai adalah 1µM hingga 1mM. Diperoleh LOD (limit deteksi) untuk EPK, EPKQ, dan EPKM 10% berturut-turut adalah 0.025 mM, 0.010 mM dan 0.005 mM. EPKM 10% menghasilkan limit deteksi terbaik diantara dua lainnya. Adapun penelitian yang melaporkan limit deteksi yang lebih besar dari EPKM 10% yaitu 0.2 mM (Villalonga et al. 2007).
Sedangkan limit deteksi yang lebih kecil untuk biosensor xantina yaitu 0.1 M (Devi
et al. 2013; Gao et al. 2009) dan 0.75 µM (Torres et al. 2013).
Gambar 17 Voltamogram siklik dari Linearitas arus yang dihasilkan dengan variasi konsentrasi
Dari Gambar 17 dapat dilihat voltamogram siklik dari EPKM 10% yang menunjukkan linearitasnya dari konsentrasi substrat xantina oksidase 0.01 mM hingga 1 mM, yang menunjukkan semakin besar konsentrasi xantina maka semakin tinggi juga arus yang dihasilkan. Perubahan arus yang diperoleh dapat diasumsikan sebagai aktivitas xantina oksidase dan kemudian di plotkan pada grafik hubungan antara aktivitas xantina oksidase dengan konsentrasi substrat, baik pada EPK, EPKQ maupun EPKM yang dapat dilihat pada Gambar 18.
Gambar 18 Persamaan regresi dan linearitas hubungan konsentrasi substrat dengan aktivitas
xantin oksidase
Grafik menunjukkan perbedaan arus yang dihasilkan dari pengukuran xantina menggunakan EPK, EPKQ, dan EPKM 10%. Dari Gambar 18 dapat diketahui sensitivitas dan linearitasnya. Linearitas dilihat dari nilai regresi linearnya (R2). R2 EPKM 10% > EPKQ > EPK dengan nilainya berturut-turut (0.01-1mM)
dengan R2=99.24%; (0.1-1mM) dengan R2=97.77%; (0.1-1.0mM) dengan
R2=94.15%. Pada dasarnya ketiga elektrode berada pada daerah yang linier, namun
EPKM 10% merupakan elektrode terbaik dilihat dari ketiga kinerja elektrode yang diamati. Linearitas EPKM 10% dapat dilihat pada voltamogram di Gambar (17). Hasil yang diperoleh untuk elektrode pasta karbon termodifikasi nanosphere magnetit lebih baik dibandingakan linearitas yang dilaporkan Iswantini et al. (2014)
pada rentang yang sama yaitu 0.01-1.00mM dengan R2 yang lebih kecil (0.978).
Penelitian lain yang melaporkan rentang linearitas yang lebih sempit adalah 0.0015-0.07mM(Dodevska et al. 2010) dan 0.1-300 µM (Devi et al. 2013).
Sensitivitas dapat dilihat dari persamaan garis yang diperoleh, EPKM adalah elektrode yang memiliki sensitivitas terbesar dibandingkan dengan kedua elektrode lainnya yaitu sebesar 5.16 µA mM-1, 1.3× lebih tinggi dibandingkan
EPKQ (3.99 µA mM-1) dan 4× lebih tinggi dibandingkan EPK (1.29 µA mM-1) .
Hasil ini berkorelasi dengan hasil karakterisasi elektrode menggunakan K3[Fe(CN)6] yang menunjukkan magnetit dapat mempercepat transfer elektron
sehingga dapat meningkatkan arus puncak oksidasi K3[Fe(CN)6] dan lebih cepat
Ekstraksi dan Daya inhibisi (IC50) dari ekstrak air S.polyanthum
Ekstraksi Syzygium polyanthum (daun salam) dilakukan secara maserasi
menggunakan pelarut air. Pemilihan pelarut ini berdasarkan hasil penelitian pendahuluan antara dua pelarut yaitu etanol dan air. Sebagai hasil, ekstrak air S. polyanthum lebih berpotensi dalam menginhibisi aktivitas xantina oksidase
dibandingkan ekstrak etanol (Gambar 19). Rendemen ekstrak air S. polyanthum
diperoleh sebesar 6.62% dengan kadar air sebesar 7.44% (perhitungan pada lampiran 7). Analisis daya inhibisi terhadap xantina oksidase oleh ekstrak air S. polyanthum dilakukan dengan konsentrasi ekstrak yang bervariasi. Tujuan
divariasikannya konsentrasi ekstrak ini adalah untuk mengetahui pengaruh penambahan konsentrasi ekstrak terhadap peningkatan inhibisi xantina oksidase. Dengan divariasikannya konsentrasi ekstrak maka akan diperoleh nilai IC50 dari
ektrak sebagai pemilihan konsentrasi untuk penetuan kinetika inhibisi enzim selanjutnya. Hubungan konsentrasi ekstrak air daun salam dengan daya inhibisinya terhadap xantina oksidase ditunjukkan pada Tabel 4 dan konsentrasi allupurinol pada Tabel 5.
Tabel 4 Daya inhibisi ekstrak S. polyanthumterhadap xantina oksidase secara elektrokimia
No [Ekstrak]
Tabel 4 menunjukkan bahwa dengan bertambahnya konsentrasi ekstrak
S. polyanthum maka bertambah pula inhibisi terhadap enzim xantina oksidase. Hal
ini juga ditunjukkan dengan berkurangnya arus yang terdeteksi oleh elektrode pasta karbon termodifikasi magnetit yang dianalogikan sebagai aktivitas enzim xantina oksidase setelah penambahan ekstrak S. polyanthum berbagai konsentrasi.
Dari Grafik (Gambar 19) diperoleh persamaan logaritmik antara % inhibisi dengan konsentrasi ekstrak S. polyanthum. Dari persamaan tersebut dapat
diketahui nilai IC50 (Konsentrasi terendah yang dapat menghambat 50% aktivitas
enzim Xantina Oksidase). Diperoleh IC50 untuk ekstrak etanol S. polyanthum
adalah 238,07 ppm sedangkan IC50 untuk ekstrak air S. polyanthum adalah 69,47
ppm. Semakin kecil nilai IC50, maka ekstrak tersebut semakin berpotensi untuk
menghambat aktivitas Xantina Oksidase. Ekstrak air S. polyanthum memiliki IC50
lebih kecil dibandingkan ekstrak etanol S. polyanthum, sehingga untuk pengujian
selanjutnya digunakan ekstrak air S. polyanthum. Menurut Thuong et al. (2006)
suatu senyawa dikatakan aktif apabila memiliki nilai IC50 kurang dari 100 ppm.
Berdasarkan hal tersebut dapat disimpulkan bahwa ekstrak air S. polyanthum aktif
Gambar 19 Hubungan antara % inhibisi dengan ekstrak S. polyanthum menggunakan pelarut a).
Etanol; b). Air
Sebagai perbandingan ekstrak air daun salam juga diuji penghambatannya terhadap enzim xantina oksidase secara spektrofotometri (Lampiran 8). Diperoleh nilai IC50 sebesar 99.566 ppm dengan persamaan garis yaitu y = 11,751ln(x) –
4,0643. Sedangkan secara elektrokimia persamaan garis yang diperoleh adalah y = 11,217ln(x) + 2,4297. Hal ini menunjukkan pengukuran secara elektrokimia memiliki sensitivitas yang lebih baik dari metode spektrofotometri, dan menghasilkan nilai IC50 ekstrak air S. polyanthum lebih kecil dibandingakan secara
spektrofotometri. Ditinjau dari penggunaan enzim xantina oksidase, metode elektrokimia jauh lebih sedikit menggunakan enzim xantina oksidase, sehingga metode elektrokimia ini lebih ekonomis dibandingkan metode spektrofotometri.
Untuk kontrol positif, digunakan allupurinol yang merupakan obat komersial asam urat dengan cara kerja menghambat enzim xantina oksidase. Pengaruh penambahan konsentrasi allupurinol terhadap xantina oksiadse ditunjukkan pada Tabel 5.
Tabel 5 Daya inhibisi allupurinol terhadap xantina oksidase
No [Allupurinol] (ppm) Aktivitas Enzim (ΔIpa) (µA) % Inhibisi
Berdasarkan Tabel 4 diperoleh regresi untuk inhibisi allupurinol adalah y = 14,97ln(x) +38,95. Berdasarkan persamaan ini diperoleh IC50 allupurinol sebesar
2.092 ppm (Gambar 20). Penelitian lainnya tentang daya inhibisi allopurinol menunjukkan IC50 allopurinol yang bervariasi di antaranya sebesar 6.10 ppm
Konsentrasi Ekstrak S. polyanthum (ppm)
ekstrak etanol
2012), 4.29 ppm (Septianingsih et al. 2012), dan 2.45 (Iswantini et al. 2014). Hal
ini menunjukkan bahwa metode elektrokimia yang dilakukan pada penelitian ini memberikan nilai IC50 yang relatif lebih kecil dibandingkan dengan metode
spektrofotometri yang dilaporkan oleh Apaya et al. (2009), Azmi et al. (2012),
Umamaheswari et al. 2009, Septianingsih et al. (2012), dan (Iswantini et al. 2014).
Sedangkan pengujian IC50 Allupurinol secara spektrofotometri pada penelitian ini
adalah sebesar 3.119 ppm (Gambar 21)
Gambar 20 Grafik hubungan antara konsentrasi Allupurinol terhadap % inhibisi enzim xantina
oksidase secara elektrokimia.
Gambar 21 Grafik hubungan antara konsentrasi Allupurinol terhadap % inhibisi enzim xantina
oksidase secara spektrofotometri.
Namun demikian penelitian lainnya juga melaporkan nilai IC50
allopurinol yang relatif lebih kecil sebesar 0.60 ppm (Wang et al. 2008). Perbedaan


![Tabel 3 Nilai perubahan potensial anodik dan katodik K3[Fe(CN6)] pada 3 jenis elektrode](https://thumb-ap.123doks.com/thumbv2/123dok/643493.445329/31.595.111.508.241.731/tabel-nilai-perubahan-potensial-anodik-katodik-jenis-elektrode.webp)