KONSTRUKSI PUSTAKA GENOM DAN SEKUENSING
GENOM TOTAL KAKAO (
Theobroma cacao
L.)
ASEP DIDI SURYADI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Konstruksi Pustaka Genom dan Sekuensing Genom Total Kakao (Theobroma cacao L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Skripsi ini disusun berdasarkan hasil penelitian pada proyek sekuensing genom kakao di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB-Biogen) Bogor tahun 2014. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Asep Didi Suryadi
ABSTRAK
ASEP DIDI SURYADI. Konstruksi Pustaka Genom dan Sekuensing Genom Total Kakao (Theobroma cacao L.). Dibimbing oleh I MADE ARTIKA dan HABIB RIJZAANI.
Tersedianya sekuen genom rujukan kakao (Theobroma cacao L.) memungkinkan seluruh potensi variasi genetik tanaman kakao lain dapat dibaca dan dimanfaatkan untuk pemuliaan melalui pembacaan menyeluruh genomnya menggunakan next generation sequencing (NGS). Penelitian ini menerangkan modifikasi metode CTAB untuk isolasi DNA genomik kakao yang mengandung polisakarida dan polifenol tinggi, konstruksi pustaka DNA genom serta sekuensing genom total kakao dengan menggunakan metode dari Illumina. DNA genomik berkualitas tinggi yang ditunjukkan dengan keutuhan molekul telah dihasilkan. Pustaka genom yang telah dikonstruksi berukuran 314-485 bp. Basa yang dihasilkan mencapai 391.93 Gbp, dengan ukuran genom mencapai 566.9 Mbp. Kualitas bacaan NGS yang dihasilkan cukup tinggi dengan 67.9-81.3% bacaan memiliki nilai kualitas di atas Q30. Kesalahan yang terjadi sebesar 0.20-1.14%. Pustaka genom yang telah dikonstruksi memiliki kualitas yang baik dan data sekuensing yang diperoleh dapat digunakan untuk analisis lanjutan.
Kata kunci: isolasi DNA, next generation sequencing, pustaka genom, Theobroma
cacao L.
ABSTRACT
ASEP DIDI SURYADI. Genomic Library Construction and Whole Genome Sequencing of Cocoa (Theobroma cacao L.). Supervised by I MADE ARTIKA and HABIB RIJZAANI.
The availability of reference genome sequence of cocoa (Theobroma cacao
L.) allows the full potential of the other cocoa plant genetic variation to be read and used for breeding through whole genome reading by next generation sequencing (NGS). This study describes a modification of CTAB method for extracting genomic DNA contains high polysaccharides and polyphenols, genomic library construction and whole genome sequencing using methods by Illumina. High quality of genomic DNA indicated by integrity of the molecule have been produced. Genomic libraries have been constructed were 314-485 bp in size. Base generated reach 391.93 Gbp, with genome size reach 566.9 Mbp. The quality of readings by NGS high enough with 67.9-81.3% of reading has quality value above Q30. Error rate occurs at 0.20-1.14%. Genomic library have been constructed possesses good quality and the data from sequencing were ready for further analysis.
Keywords: DNA extraction, genome library, next generation sequencing,
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KONSTRUKSI PUSTAKA GENOM DAN SEKUENSING
GENOM TOTAL KAKAO (
Theobroma cacao
L.)
ASEP DIDI SURYADI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Karya ilmiah dari hasil penelitian yang dilakukan sejak bulan Januari hingga Juni 2014 ini berjudul Konstruksi Pustaka Genom dan Sekuensing Genom Total Kakao
(Theobroma cacao L.).
Ucapan terima kasih penulis sampaikan kepada Bapak Dr Ir I Made Artika, MAppSc dan Bapak Habib Rijzaani, MSi sebagai pembimbing, serta Bapak Dr I Made Tasma yang telah banyak memberi saran. Penulis juga mengucapkan terima kasih kepada ayah, ibu, dan seluruh keluarga atas doa dan kasih sayang, serta kepada keluarga besar Pinus merkusii dan Biokimia 47 atas dukungan yang telah diberikan.
Semoga karya ilmiah ini bermanfaat bagi perkembangan dan kemajuan ilmu pengetahuan.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
METODE PENELITIAN 2
Bahan 2
Alat 3
Prosedur 3
HASIL 8
DNA Genom Hasil Isolasi 8
Konsentrasi dan Kemurnian DNA Selama Konstruksi Pustaka Genom 9 Hasil Klasterisasi dan Sekuensing Pustaka DNA Genom 11
PEMBAHASAN 13
DNA Genom Kakao Hasil Isolasi 13
Fragmentasi dan Modifikasi Ujung Fragmen DNA 14
Adenilasi dan Ligasi Adaptor 15
Purifikasi dan Perbanyakan Fragmen DNA 16
Validasi Pustaka DNA Genom 16
Klasterisasi Pustaka DNA Genom 17
Sekuensing DNA Genom 17
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 23
DAFTAR TABEL
Hasil pengujian konsentrasi dan kemurnian DNA kakao menggunakan spektrofotometer nanodrop
Hasil pengujian konsentrasi dsDNA kakao menggunakan fluorometer Konsentrasi dan kemurnian DNA setelah tahap fragmentasi dan modifikasi ujung fragmen
Konsentrasi dan kemurnian DNA setelah tahap adenilasi dan ligasi adaptor
Konsentrasi dan kemurnian DNA setelah tahap purifikasi dan amplifikasi
Rerata ukuran dan molaritas fragmen DNA hasil validasi pustaka DNA genom
Jumlah basa dan kualitas kaster pustaka genom Densitas dan kualitas pustaka genom hasil sekuensing Jumlah basa dan pembacaan sekuensing setiap genotipe
DAFTAR GAMBAR
Elektroforegram DNA hasil isolasi: DNA penanda (M), DR1 (1), DR2 (2), DR38 (3), NIE7 (4), PA300 (5), RCC70 (6), SD6225 (7), TSH858
(8), dan UIT1 (9) 9
Elektroforegram hasil bioanalyzer pada tahap validasi pustaka DNA genom: DNA penanda (ladder), DR1 (1), DR2 (2), NIE7 (3), SD6225
(4) 10
Elektroforegram pada tahap validasi pustaka DNA genom: DNA penanda (M), DR38 (5), PA300 (6), RCC70 (7), TSH858 (8), UIT1 (9) 10 Perkiraan ukuran genom masing-masing genotipe 12
Kesalahan berdasarkan urutan posisi basa 12
DAFTAR LAMPIRAN
Diagram alir penelitian 23
Jumlah dan densitas klaster pustaka genom serta persentase phasing
dan prephasing selama proses sekuensing 24
Panjang fragmen yang dimasukkan dalam setiap lajur selama proses
sekuensing 25
Jumlah klaster berdasarkan Q30 score 26
Distribusi kualitas setiap posisi basa 27
Histogram perkiraan ukuran fragmen 28
Perkiraan proporsi penggandaan fragmen 28
Rataan kualitas basa berdasarkan posisinya 29
Fraksi basa pada Q30 berdasarkan posisinya 29
PENDAHULUAN
Kakao (Theobroma cacao L.) merupakan salah satu komoditas yang penting bagi negara Indonesia, terutama dalam memenuhi permintaan ekspor, yaitu sebagai bahan baku pembuatan cokelat. Biji kakao digunakan sebagai bahan baku produksi cokelat karena memiliki kandungan gizi yang tinggi serta menghasilkan cokelat dengan rasa yang enak. Menurut Wahyudi et al. (2008), biji kakao mengandung sekitar 50% lemak nabati, 15% karbohidrat, dan sisanya berupa pektin, lendir, dan getah. Selain itu, biji kakao juga mengandung senyawa polifenol yang cukup tinggi, diantaranya katekin (33-42%), leukosianidin (23-25%), dan antosianin (5%) (Kusuma et al. 2013).
Menurut Pusat Penelitian Kopi dan Kakao (2007), kualitas biji kakao yang dihasilkan di Indonesia masih relatif rendah walaupun secara kuantitas mengalami peningkatan setiap tahunnya. Rendahnya produksi kakao Indonesia disebabkan oleh beberapa faktor, yaitu serangan hama, pemakaian benih yang tidak unggul, serta masalah pembungaan dan layu buah (Ditjen Perkebunan 2006). Upaya yang dapat dilakukan untuk meningkatkan produktivitas kakao adalah dengan perbaikan genetik tanaman.
Teknik perbaikan genetik tanaman kakao melibatkan prosedur isolasi DNA serta membutuhkan informasi genomik dan genetik tanaman kakao. Informasi tersebut dapat diperoleh dengan cara sekuensing genom total kakao. Penelitian mengenai sekuensing genom kakao sangat penting mengingat banyak genotipe kakao yang masih belum diketahui sekuennya. Sekuen yang telah dihasilkan kemudian dibandingkan dengan sekuen rujukan kakao yang telah diperoleh dan dapat diakses dengan mudah. Adanya sekuen rujukan tersebut dapat dimanfaatkan untuk mengidentifikasi gen-gen yang berperan dalam meningkatkan produktivitas dan ketahanan tanaman kakao (Argout et al. 2011).
Tahap yang dilakukan sebelum sekuensing DNA genom adalah isolasi DNA dan konstruksi pustaka genom. Tahap isolasi DNA dilakukan untuk memperoleh molekul DNA dari suatu organisme. Isolasi DNA meliputi tahap pemecahan dinding sel agar molekul DNA dapat dikeluarkan dari sel, deproteinasi untuk menghilangkan protein dan kontaminan lain, serta pemekatan DNA untuk memperoleh utas-utas DNA (Walker & Wilson 2000).
Konstruksi pustaka genom yang biasa dilakukan yaitu dengan menyisipkan fragmen DNA yang telah diisolasi ke dalam suatu vektor tertentu. Teknik konstruksi pustaka genom yang berkembang akhir-akhir ini melibatkan tahap fragmentasi dan modifikasi fragmen DNA dengan menempelkan adaptor ke ujung-ujung fragmen tersebut untuk membentuk suatu pustaka genom. Berdasarkan protokol dari Illumina (2010a), pustaka DNA genom yang akan disekuensing harus memiliki panjang fragmen kurang dari 800 bp dan konsentrasi minimal 2 ng/µ L. Pustaka genom yang telah dikonstruksi kemudian disekuensing untuk memperoleh urutan nukleotida secara lengkap (Illumina 2008).
2
generation sequencing (NGS) yang dapat mengurutkan genom total dan
menghasilkan sekuen dalam jumlah yang cukup banyak (Metzker 2010). Instrumen yang digunakan untuk sekuensing dalam penelitian ini adalah NGS
HiSeq2000. Instrumen ini dapat membaca suatu untai DNA sepanjang 2×100 bp
dan menghasilkan data sebesar 200 Gbp dengan akurasi mencapai 99.5% (Zhang
et al. 2011).
Beberapa tanaman perkebunan telah disekuensing dengan menggunakan
NGS HiSeq2000, contohnya kedelai (Kosasih 2012), kopi (Healey et al. 2014),
dan tiga genotipe kakao (ICCR02, ICCR04, dan SUL02) yang dilakukan oleh Tasma et al. (2012). Penelitian tersebut menyebutkan bahwa pustaka genom yang telah dikonstruksi memiliki kualitas yang ideal untuk digunakan dalam tahap sekuensing serta data sekuen yang dihasilkan dapat digunakan untuk identifikasi marka dan gen-gen yang diinginkan (Tasma et al. 2012).
Informasi mengenai konstruksi pustaka genom kakao dan hasil sekuensing genom kakao masih terbatas, sehingga usaha peningkatan produksi biji kakao juga masih mengalami hambatan. Untuk itu perlu dilakukan suatu penelitian mengenai sekuensing genom kakao. Penelitian ini bertujuan mengkonstruksi pustaka genom kakao sehingga dapat digunakan untuk membaca genom kakao dengan menggunakan next generation sequencing HiSeq2000. Hasil konstruksi pustaka genom dan sekuensing genom kakao akan memungkinkan terkumpulnya informasi genetik dan genomik tanaman kakao berbagai genotipe melalui teknik
next generation sequencing. Kualitas hasil sekuensing dan urutan DNA yang
diperoleh dapat digunakan dalam berbagai bidang, misalnya pemetaan gen dan identifikasi marka molekuler yang sangat diperlukan dalam bidang bioteknologi dan pemuliaan tanaman kakao. Koleksi marka molekuler yang digunakan untuk mengidentifikasi gen-gen yang berperan dalam pengendalian ekspresi tertentu tanaman kakao juga dapat membantu memperpendek siklus pemuliaaan tanaman kakao.
Hipotesis penelitian ini adalah konstruksi pustaka genom kakao dapat dilakukan untuk sekuensing genom total dengan menggunakan instrumen NGS
HiSeq2000. Penelitian ini diawali dengan isolasi DNA dari sampel daun kakao
yang sebelumnya telah disimpan dalam mesin pendingin, kemudian dilanjutkan dengan konstruksi pustaka genom, klasterisasi, dan sekuensing genom total.
METODE PENELITIAN
Bahan
3 100 bp, Qubitreagent, Qubit buffer, dan Qubit standard. Bahan yang digunakan untuk fragmentasi DNA adalah resuspension buffer. Bahan-bahan yang digunakan untuk modifikasi ujung fragmen DNA adalah End Repair Control dan End Repair Mix. Bahan-bahan yang digunakan untuk adenilasi ujung 3’OH adalah A-Tailing Mix dan A-Tailing Control. Bahan-bahan yang digunakan untuk ligasi adaptor adalah Ligase Mix, Ligase Control, Stop Ligase Mix, dan Adapter Index. Tahap amplifikasi atau perbanyakan fragmen DNA menggunakan PCR Master Mix dan
PCR Primer Cocktail. Setiap tahap dalam konstruksi pustaka genom melibatkan
pencucian fragmen DNA dengan menggunakan AMPure XP Beads, resuspension
buffer, dan etanol 80%. Tahap klasterisasi dan sekuensing genom dilakukan
dengan menggunakan 2 N NaOH, akuades, bufer hibridisasi, TruSeq SR Cluster
Kit v3-cBot-HS, dan TruSeq SBS Kit-HS (200cycle).
Alat
Alat-alat yang digunakan dalam penelitian ini antara lain adalah sentrifus, spektrofotometer nanodrop, fluorometer, tabung Covaris, tangki elektroforesis,
Agilent Bioanalyzer, chip DNA, PCR plate, mesin PCR, mesin qPCR, UV
transiluminator, dan magnetic stand. Tahap klasterisasi pustaka genom dilakukan
dalam Illumina cBot Cluster Generation dan tahap sekuensing dilakukan menggunakan perangkat Illumina HiSeq2000.
Prosedur
Isolasi DNA Genom (Michiels et al. 2003)
Metode isolasi DNA kakao dilakukan dengan merujuk pada metode Michiels et al. (2003) yang telah dimodifikasi. Sebanyak 0.3 gram daun kakao dihaluskan dalam nitrogen cair, kemudian dicampur dengan bufer ekstraksi yang telah dipanaskan pada suhu 60 oC sebanyak 1 mL. Sampel disentrifus pada 12000 rpm selama 1 menit, lalu supernatan dibuang. Penambahan bufer ekstraksi dan sentrifus diulangi sebanyak lima kali lagi hingga supernatan tidak berlendir. Sampel kemudian diinkubasi pada suhu 65 oC selama 45 menit. Secara berkala, tabung dibolak-balik untuk mencegah pengendapan. Sebanyak 1 volume kloroform:isoamilalkohol (24:1, v/v) ditambahkan ke dalam sampel, lalu divorteks selama 2 menit. Sampel disentrifus pada 12000 rpm selama 5 menit. Supernatan ditambah dengan 1 volume kloroform. Sampel kemudian divorteks selama 2 menit, lalu disentrifus pada 12000 rpm selama 5 menit. Penambahan kloroform diulangi satu kali lagi. Supernatan yang diperoleh kemudian ditambah dengan 0.8 volume isopropanol, lalu tabung dibolak-balik hingga larutan tercampur dan terlihat benang-benang berwarna putih. Sampel diinkubasi selama 1 jam pada suhu -20 oC, lalu disentrifus pada 16000 g selama 5 menit. Supernatan dibuang, kemudian pelet yang diperoleh dicuci dengan 1 mL alkohol 80%. Sampel kemudian disentrifus pada 16000 g selama 5 menit. Pencucian menggunakan alkohol 80% diulangi satu kali lagi. Pelet yang diperoleh dikeringkan di suhu ruang, kemudian ditambah dengan 100 µL nuclease free
4
Uji Kualitatif DNA Genom (Sambrook 2001)
Uji kualitatif DNA dilakukan untuk mengetahui kualitas molekul DNA yang telah diisolasi. Uji kualitatif tersebut dilakukan melalui elektroforesis gel agarose 1% yang dibuat dari 0.55 gram serbuk agarose yang dilarutkan dalam 55 mL bufer TAE 1×. Gel yang telah memadat dipindahkan ke dalam bak elektroforesis yang telah diisi dengan bufer TAE 1×. Sampel yang akan diuji dicampur dengan
loading buffer (loading dye, SyBrGold 100×, dan MQ Water). Campuran tersebut
kemudian dimasukkan ke dalam sumur gel agarose. Marker yang digunakan adalah 6.5 µL DNA ladder 100 bp yang telah ditambah dengan 0.5 µL SyBrGold
100×. Alat elektroforesis dijalankan pada tegangan 100 volt selama 30 menit, kemudian hasil elektroforesis diamati di bawah sinar UV.
Uji Kuantitatif DNA Genom
Uji kuantitatif DNA genom kakao dilakukan untuk mengetahui konsentrasi dan kemurnian DNA kakao yang diperoleh dari tahap isolasi. Uji tersebut dilakukan menggunakan instrumen spektrofotometer nanodrop untuk mengetahui konsentrasi keseluruhan molekul DNA dan fluorometer untuk mengetahui konsentrasi DNA utas ganda. Blanko yang digunakan untuk spektrofotometri nanodrop adalah nuclease free water (NFW), dan volume sampel yang digunakan adalah sebnyak 2 µL.
Uji kuantitatif selanjutnya adalah fluorometri. Qubit Working Solution
(QWS) dibuat terlebih dahulu, yaitu satu bagian Qubit Reagent dilarutkan dalam 199 bagian Qubit Buffer. Sebanyak 190 QWS ditambah dengan 10 µL larutan standar dalam tabung Eppendorf yang berbeda. Sebanyak 2 µL sampel ditambah dengan 198 µL QWS. Semua larutan yang telah dibuat divorteks selama 3 detik, kemudian diinkubasi pada suhu ruang selama 2 menit. Instrumen fluorometer dinyalakan, kemudian tabung berisi larutan standar dimasukkan untuk mengukur absorbansi larutan standar. Tabung berisi larutan sampel dimasukkan ke dalam instrumen flourometer untuk mengetahui konsentrasi DNA utas ganda pada sampel tersebut.
Konstruksi Pustaka Genom (Illumina 2010c)
Tahap konstruksi pustaka genom terdiri atas beberapa langkah, yaitu fragmentasi DNA, modifikasi ujung fragmen DNA, adenilasi ujung 3’OH, ligasi adaptor, purifikasi hasil ligasi, dan amplifikasi fragmen DNA. Spektrofotometri nanodrop dilakukan setelah tahap modifikasi ujung fragmen, ligasi adaptor, dan amplifikasi fragmen DNA untuk mengetahui konsentrasi dan kemurnian DNA. Volume DNA yang digunakan pada spektrofotometri nanodrop tersebut adalah sebanyak 2 µL dan bufer yang digunakan adalah resuspension buffer.
Fragmentasi DNA. Fragmentasi DNA dilakukan untuk memperoleh fragmen DNA berukuran lebih pendek, yaitu 300-400 bp atau kurang dari 800 bp (Illumina 2008). Sebanyak 130 µL sampel DNA yang telah dilarutkan dalam
resuspension buffer dimasukkan ke dalam tabung Covaris, kemudian dimasukkan
ke dalam instrumen Covaris. Instrumen Covaris diatur sebagai berikut: duty cycle
10%, intensitas 5.0, 200 burst per second, durasi pemotongan selama 200 detik,
mode frequency sweeping, daya 23 W, dan suhu 5.5-6 oC. Sebanyak 50 µL sampel
5
Modifikasi ujung fragmen DNA. Sebanyak 10 µL End Repair Control dan 40 µL End Repair Mix dicampurkan ke dalam sampel, kemudian diinkubasi pada suhu 30 oC selama 30 menit dalam thermal cycler. Sebanyak 160 µL AMPure XP
Beads dicampurkan ke dalam sampel hingga homogen. Campuran tersebut
diinkubasi selama 15 menit pada suhu ruang. PCR plate yang berisi sampel kemudian dipindahkan dalam magnetic stand selama 15 menit hingga sampel jernih. Sebanyak 127.5 µL supernatan dibuang dengan hati-hati. Tahap tersebut diulangi satu kali lagi untuk menghilangkan supernatan yang masih tersisa. Sebanyak 200 µL etanol 80% ditambahkan ke dalam plate dengan hati-hati, kemudian diinkubasi selama minimal 30 detik. Semua supernatan dalam plate
dibuang. Pencucian dengan etanol 80% tersebut diuangi satu kali lagi. Pelet yang diperoleh kemudian dikeringkan pada suhu ruang selama 15 menit. Pelet diresuspensi menggunakan resuspension buffer sebanyak 17.5 µL, kemudian diinkubasi pada suhu ruang selama 2 menit. Plate ditempatkan pada magnetic
stand selama 5 menit hingga cairan jernih. Sebanyak 15 µL supernatan
dipindahkan ke dalam PCR plate yang baru, kemudian disimpan di suhu -20 oC untuk digunakan pada tahap selanjutnya.
Adenilasi Ujung 3’OH. Sebanyak 2.5 µ L A-Tailing Control dan 12.5 µL
A-Tailing Mix dicampurkan ke dalam sampel hingga homogen. Campuran tersebut
kemudian diinkubasi pada suhu 37 oC selama 30 menit dalam thermal cycler
untuk selanjutnya digunakan pada tahap ligasi adaptor.
Ligasi Adaptor.Ligase Control, DNA Ligase Mix, dan DNA Adapter Index
masing-masing sebanyak 2.5 µL dicampurkan ke dalam sampel hingga homogen. Campuran tersebut diinkubasi pada suhu 30 oC selama 10 menit dalam thermal
cycler. Sampel kemudian ditambah dengan 5 µL Stop Ligase Mix hingga
homogen, kemudian dilakukan pencucian dengan meggunakan AMPure XP Beads
dan etanol 80%. Hasil pencucian disimpan pada suhu -20 oC untuk digunakan dalam tahap selanjutnya.
Purifikasi hasil ligasi. Pemurnian hasil ligasi dilakukan dengan elektroforesis gel agarose 2% yang dibuat dari 1.2 gram serbuk agarose yang dilarutkan dalam 60 mL bufer TAE 1×. Gel yang telah memadat dipindahkan ke dalam bak elektroforesis yang telah diisi dengan bufer TAE 1×. Bak elektroforesis kemudian disimpan di atas UV Transiluminator yang telah dilapisi dengan kaca anti radiasi. Sebanyak 20 µL sampel hasil ligasi ditambah dengan 4 µL loading dye, lalu dimasukkan ke dalam sumur bagian atas pada gel agarose. Sumur bagian bawah diisi dengan NFW sebanyak 25 µL. Marka yang digunakan adalah 12 µL
DNA ladder 100 bp. Elektroforesis dilakukan selama 1 jam pada tegangan 100
volt. Setelah proses elektroforesis selesai, cairan pada sumur bagian bawah diambil sebanyak 20 µL, lalu dimasukkan ke dalam PCR plate yang baru.
Tahap purifikasi dapat dilanjutkan dengan ekstraksi gel agarose untuk memperoleh fragmen DNA yang diinginkan jika volume cairan yang diperoleh dari tahap elektroforesis di atas tidak mencukupi atau memiliki konsentrasi DNA yang terlalu kecil. Gel hasil elektroforesis dipotong pada bagian fragmen yang diinginkan, kemudian dimasukkan ke dalam tabung 1.5 mL. Sebanyak 3 volume
QG buffer ditambahkan ke dalam tabung, kemudian diinkubasi pada suhu ruang
6
disentrifus selama 1 menit pada 17900 g atau 13000 rpm. Cairan dibuang, kemudian sebanyak 0.5 mL QG buffer ditambahkan ke dalam MinElute Column. Sampel disentrifus pada 17900 g atau 13000 rpm selama 1 menit. Cairan dibuang, kemudian sebanyak 0.75 mL bufer PE dimasukkan ke dalam MinElute Column.
µL PCR Master Mix dicampurkan ke dalam sampel hingga homogen. Campuran
tersebut dimasukkan ke dalam mesin PCR. Proses amplifikasi dilakukan dengan tahap pra denaturasi pada suhu 98 oC selama 30 detik, denaturasi pada suhu 98 oC selama 10 detik, annealing pada suhu 60 oC selama 30 detik, dan elongasi pada suhu 72 oC selama 30 detik. Tahap denaturasi hingga elongasi dilakukan sebanyak 10 siklus, kemudian dilanjutkan dengan tahap pasca elongasi pada suhu 72 oC selama 5 menit. Setelah tahap amplifikasi dalam mesin PCR selesai, sampel dicuci dengan menggunakan AMPure XP Beads dan etanol 80%, kemudian disimpan pada suhu -20 oC untuk digunakan pada tahap selanjutnya.
Validasi Pustaka Genom (Illumina 2010c)
Tahap ini dilakukan untuk mengetahui molaritas dan ukuran fragmen pustaka genom yang telah dibuat. Validasi dapat dilakukan menggunakan Agilent
Bioanalyzer dengan High Sensitivity DNA chip atau elektroforesis gel agarose dan
qPCR (quantitative PCR). Sebanyak 9 µL campuran gel dan dye dari kit Agilent
Bioanalyzer High Sensitivity dimasukkan ke dalam chip DNA. Priming station
ditutup dan plunger ditekan selama 1 menit. Setelah priming station dibuka, sebanyak 5 µL marker dimasukkan ke semua lubang. Sebanyak 1 µL DNA ladder
dimasukkan ke lubang bertanda ladder, kemudian sebanyak 1 µL sampel dimasukkan ke dalam lubang sampel. Chip DNA divorteks horizontal selama 1 menit pada 2400 rpm. Chip DNA kemudian dimasukkan ke dalam instrumen
Agilent Bioanalyzer. Teknik tersebut dapat diganti dengan elektroforesis gel
agarose biasa karena kedua teknik tersebut memiliki prinsip yang sama. Sebanyak 1.2 gram serbuk agarose dilarutkan dalam 60 mL TAE 1× untuk memperoleh gel berkonsentrasi 2%. Penanda atau marker dibuat dari 5.5 µL DNA ladder 100 bp yang dicampurkan dengan 0.5 µL SyBr Gold. Sebanyak 5 µL DNA ditambah dengan 2 µL loading dye, 0.5 µL SyBr Gold, dan 4.5 µL MQ Water. Elektroforesis dilakukan selama 45 menit pada tegangan 100 volt. Elektroforegram yang dihasilkan kemudian digunakan untuk menganalisis ukuran fragmen pada pustaka genom.
7 divorteks 10 detik. Larutan tersebut diambil sebanyak 100 µL kemudian ditambah dengan 100 µL dilution buffer untuk memperoleh pengenceran 1:4000, lalu divorteks selama 10 detik. Larutan PCR mix yang digunakan berupa 75% Kapa yang dilarutkan dalam NFW. Larutan tersebut kemudian dimasukkan ke dalam
PCR plate sebanyak 16 µL. Sebanyak 4 µL dari setiap hasil pengenceran
dimasukkan ke dalam PCR plate yang telah berisi PCR mix. Larutan standar yang digunakan dimasukkan sebanyak 4 µL ke dalam lubang lain dalam PCR plate.
Plate kemudian ditutup dengan seal adhesive kemudian dimasukkan ke dalam
instrumen qPCR. Reaksi yang terjadi dalam mesin qPCR adalah initial activation
(95 oC selama 5 menit), denaturation (95 oC selama 30 detik), dan annealing serta
extension (60 oC selama 45 detik). Tahap denaturation hingga extension
dilakukan sebanyak 35 siklus.
Klasterisasi Pustaka Genom (Illumina 2010b)
Molaritas minimal yang dibutuhkan untuk tahap klasterisasi adalah 2 nM. Sampel yang memiliki molaritas di atas 2 nM harus diencerkan terlebih dahulu dalam library buffer yang dibuat dari Tris-Cl 10 mM pH 8.5 dan 0.1% Tween 20 hingga volume 30 µL. DNA cetakan yang telah berkonsentrasi 2 nM kemudian diencerkan kembali menggunakan NaOH 0.1 N hingga mencapai konsentrasi 13 pM. Sebanyak 6.5 µL DNA cetakan yang akan digunakan ditambah dengan 6.5 µL NaOH 0.1 N, kemudian dilarutkan dalam 987 µL HT1. Campuran tersebut divorteks, kemudian diinkubasi dalam suhu ruang selama 5 menit. Sebanyak 20 µL DNA cetakan tersebut diambil, kemudian ditambahkan ke dalam 980 µL HT1. Klasterisasi dilakukan dalam instrumen cBot Cluster Generation. Sebanyak 120 µL DNA cetakan yang telah dipreparasi dimasukkan ke dalam tube, kemudian ditambah dengan 1.2 µL PhiX Library Control. Reagen yang akan digunakan dimasukkan ke dalam kompartemen dalam instrumen cBot Cluster
Generation, kemudian dilakukan pemasangan flow cell dan manifold. Tube yang
berisi DNA cetakan dimasukkan ke dalam kompartemen, kemudian instrumen
cBot Cluster Generation dijalankan.
Sekuensing Pustaka Genom (Illumina 2010a)
Tahap sekuensing DNA genom menggunakan Illumina HiSeq2000 terdiri atas beberapa tahap, yaitu persiapan reagen, pemilihan parameter untuk sekuensing, pemasangan flow cell, sekuensing, dan post-run sequencing
(maintenance wash). Reagen yang digunakan adalah SBS (Sequence by Synthesis)
reagent (TruSeq SBS kit), multiplexing reagent, dan paired-end reagent.
Reagen-reagen tersebut dimasukkan ke dalam rak dan disimpan dalam kompartemen reagen yang terdapat dalam Illumina HiSeq2000. Parameter yang diperlukan untuk sekuensing dipilih melalui HiSeq control software interface. Parameter tersebut adalah flow cell ID, experiment, user name, flow cell type, control lane,
output folder, confirm first base, keep intensity files, existing recipe, save image,
dan align lanes. Tahap selanjutnya adalah dipasangnya flow cell pada flow cell
stage. Sekuensing dilakukan selama 11 hari dengan pembacaan DNA sebanyak 2
8
HASIL
DNA Genom Hasil Isolasi
Konsentrasi DNA kakao yang dihasilkan berada pada rentang 163.3-469.4 ng/µ L, sedangkan perbandingan 260/280 dan 260/230 yang diukur menggunakan spektrofotometer nanodrop masing-masing berada pada rentang 1.78-2.06 dan 0.99-1.73 (Tabel 1). Analisis menggunakan fluorometer bertujuan mengetahui konsentrasi DNA utas ganda yang terdapat dalam sampel. Konsentrasi DNA utas ganda yang terdeteksi berada pada rentang 20.9-63.8 ng/µL (Tabel 2).
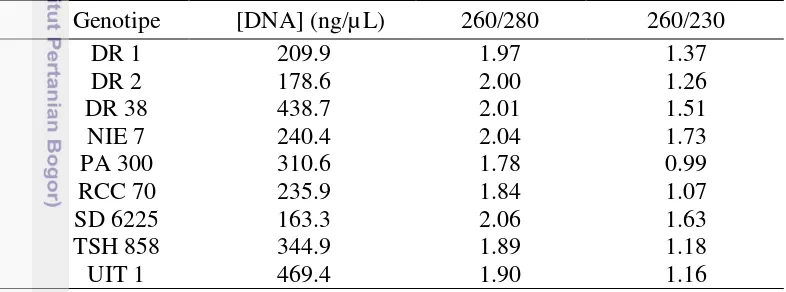
Elektroforegram hasil elektroforesis gel agarose 1% menunjukkan fragmen-fragmen DNA yang telah diisolasi berada di bagian atas dekat sumur, dan berukuran lebih besar dari 1500 bp (Gambar 1). Fragmen DNA yang dihasilkan menunjukkan bahwa DNA yang telah diisolasi merupakan DNA genom yang berukuran besar dan tidak terdegradasi.
Tabel 1 Hasil pengujian konsentrasi dan kemurnian DNA kakao menggunakan spektrofotometer nanodrop
Tabel 2 Hasil pengujian konsentrasi dsDNA kakao menggunakan fluorometer Genotipe [dsDNA] (µg/mL) Faktor
9
Gambar 1 Elektroforegram DNA hasil isolasi: DNA penanda (M), DR1 (1), DR2 (2), DR38 (3), NIE7 (4), PA300 (5), RCC70 (6), SD6225 (7), TSH858 (8), dan UIT1 (9)
Konsentrasi dan Kemurnian DNA Selama Konstruksi Pustaka Genom
Konsentrasi dan kemurnian DNA masing-masing genotipe selama proses konstruksi pustaka genom ditunjukkan pada Tabel 3, 4, dan 5. Konsentrasi setiap genotipe mengalami penurunan, sedangkan kemurniannya cenderung fluktuatif. Ukuran pustaka DNA genom ditujukkan pada elektroforegram hasil validasi pustaka DNA genom (Gambar 2 dan 3). Data yang dihasilkan dari tahap validasi pustaka genom secara ringkas ditampilkan pada Tabel 6.
Tabel 3 Konsentrasi dan kemurnian DNA setelah fragmentasi dan modifikasi ujung fragmen
Tabel 4 Konsentrasi dan kemurnian DNA setelah adenilasi dan ligasi adaptor
10
Tabel 5 Konsentrasi dan kemurnian DNA setelah purifikasi dan amplifikasi
Genotipe [DNA] (ng/µ L) 260/280 260/230
DR 1 7.5 2.18 1.63
DR 2 6.0 2.19 1.82
DR 38 9.7 1.88 2.10
NIE 7 11.5 2.01 1.60
PA 300 4.5 1.90 1.21
RCC 70 9.9 1.42 0.72
SD 6225 3.2 2.04 1.08
TSH 858 4.1 1.65 1.63
UIT 1 9.1 1.78 1.79
Gambar 2 Elektroforegram hasil bioanalyzer pada tahap validasi pustaka DNA genom: DNA penanda (ladder), DR1 (1), DR2 (2), NIE7 (3), SD6225 (4)
Gambar 3 Elektroforegram pada tahap validasi pustaka DNA genom: DNA penanda (M), DR38 (5), PA300 (6), RCC70 (7), TSH858 (8), UIT1 (9)
500 bp 300 bp
11 Tabel 6 Rerata ukuran dan molaritas fragmen DNA hasil validasi pustaka DNA
genom
Genotipe Rerata ukuran (bp) Molaritas (nM/L)
DR 1 452 10.04
Hasil Klasterisasi dan Sekuensing Pustaka DNA Genom
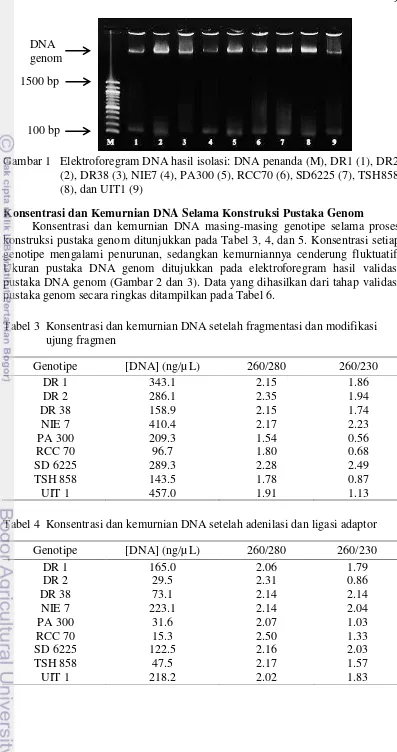
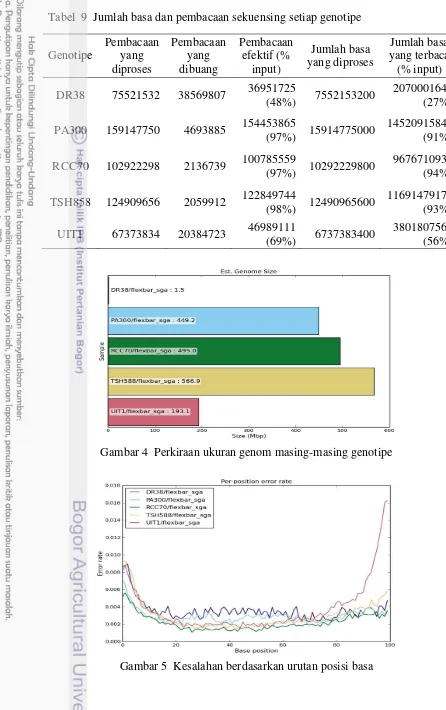
Tahap klasterisasi dilakukan untuk memperoleh klaster atau kelompok salinan pustaka DNA genom yang telah divalidasi untuk selanjutnya disekuensing. Jumlah basa yang dihasilkan pada klaster sebesar 391.93 Gbp (Tabel 7), sedangkan densitas klaster yang dihasilkan sebesar 654-763 K/mm2, dan kesalahan yang terjadi sebesar 0.20-1.14 % (Tabel 8). Jumlah basa dan pembacaan selama proses sekuensing ditampilkan pada Tabel 9. Jumlah pembacaan yang efektif dilakukan sebesar 48-98 %, dan jumlah basa yang secara efektif dibaca sebesar 27-94%.
Analisis masing-masing genotipe dilakukan setelah tahap sekuensing yang bertujuan untuk mengetahui ukuran genom serta kualitas hasil sekuensing masing-masing genotipe. Ukuran genom yang berhasil diperoleh berada pada rentang 1.5-566.9 Mbp (Gambar 4). Secara umum, kesalahan yang terjadi bernilai lebih tinggi di bagian awal dan akhir pembacaan (Gambar 5).
Tabel 7 Jumlah basa dan kualitas klaster pustaka genom Jumlah total
Tabel 8 Densitas dan kualitas pustaka genom hasil sekuensing
12
Tabel 9 Jumlah basa dan pembacaan sekuensing setiap genotipe
Genotipe DR38 75521532 38569807 36951725
(48%) 7552153200
2070001641 (27%) PA300 159147750 4693885 154453865
(97%) 15914775000
14520915847 (91%) RCC70 102922298 2136739 100785559
(97%) 10292229800
9676710935 (94%) TSH858 124909656 2059912 122849744
(98%) 12490965600
11691479170 (93%) UIT1 67373834 20384723 46989111
(69%) 6737383400
3801807562 (56%)
Gambar 4 Perkiraan ukuran genom masing-masing genotipe
13
PEMBAHASAN
DNA Genom Kakao Hasil Isolasi
Teknik isolasi DNA tanaman kakao memiliki tingkat kesulitan yang relatif lebih tinggi dibandingkan dengan tanaman lain. Hal tersebut dapat disebabkan oleh tingginya konsentrasi kontaminan berupa polisakarida serta pengotor lain seperti lendir atau getah yang terkandung dalam daun kakao (Argout et al. 2011). Sebelum melakukan isolasi dengan metode Michiels et al. (2003) yang telah dimodifikasi, isolasi dilakukan dengan menggunakan metode Michiels et al.
(2003) yang berprinsip pada penggunaan CTAB sebagai senyawa pendegradasi metabolit sekunder dalam tanaman. DNA yang diperoleh dari hasil isolasi menggunakan metode tersebut ternyata terkontaminasi oleh karbohidrat dalam jumlah yang relatif banyak. Untuk menghilangkan kontaminan karbohidrat dalam DNA yang dihasilkan dari proses isolasi, maka dilakukan modifikasi pada metode tersebut berupa penambahan bufer ekstraksi sebanyak enam kali penambahan (Fang et al. 1992).
Uji kuantitas DNA hasil isolasi dilakukan dengan menggunakan spektrofotometer nanodrop dan fluorometer. Spektrofotometer nanodrop akan mengidentifikasi sampel pada panjang gelombang 230, 260, dan 280 nm. Masing-masing panjang gelombang tersebut merupakan serapan maksimum untuk polisakarida, asam nukleat, dan protein. Kemurnian DNA dari kontaminan polisakarida dapat diketahui dengan membandingkan serapan pada panjang gelombang 260/230, sedangkan kemurnian DNA dari kontaminan protein diketahui dengan membandingkan serapan pada panjang gelombang 260/280. Kedua perbandingan tersebut diharapkan berada pada rentang 1.8-2.0. Jika DNA memiliki kemurnian kurang dari 1.8 maka DNA terkontaminasi oleh protein dan polisakarida, sedangkan jika DNA memiliki kemurnian lebih dari 2.0 maka DNA terkontaminasi oleh RNA (Walker & Wilson 2000). Hasil pengujian menggunakan spektrofotometer nanodrop menunjukkan bahwa DNA hasil isolasi memiliki nilai perbandingan 260/280 antara 1.78-2.06, nilai perbandingan 260/230 antara 0.99-1.73, serta konsentrasi antara 163.3-469.4 ng/µL (Tabel 1). Data tersebut menunjukkan bahwa DNA masih terkontaminasi oleh polisakarida, namun sudah relatif murni dari protein. Menurut penelitian yang telah dilakukan oleh Tasma et al. (2012), DNA kakao hasil isolasi memiliki konsentrasi pada rentang 198.1-303.7 ng/µL. Perbedaan konsentrasi DNA yang dihasilkan dapat disebabkan oleh adanya kontaminan serta terbuangnya DNA selama tahap isolasi (Henry 2001).
14
sebagian DNA mengalami denaturasi sehingga memiliki konformasi berupa DNA utas tunggal yang tidak dapat terbaca pada fluorometer (Beaudet et al 2007).
Pengujian kualitas DNA hasil isolasi dilakukan menggunakan elektroforesis gel agarose 1%. Prinsip pengujian tersebut adalah pemisahan molekul dalam suatu medium berupa gel dengan adanya pengaruh medan listrik. Elektroforesis digunakan karena pelaksanaannya yang relatif lebih mudah dan cepat, serta dapat memisahkan berbagai fragmen DNA yang tidak dapat dipisahkan secara tepat oleh metode lain seperti sentrifugasi gradien densitas (Walker & Wilson 2000).
SyBr Gold yang digunakan pada tahap elektroforesis merupakan suatu
pewarna atau fluoresen yang dapat mendeteksi asam nukleat (utas tunggal dan ganda) dalam gel elektroforesis. Visualisasinya dapat dilakukan dengan menggunakan UV transiluminator standar pada panjang gelombang 300 nm. Sensitivitasnya lebih tinggi (25-100 kali) dibandingkan dengan etidium bromida
dan SyBr Green yang juga biasa digunakan sebagai pewarna asam nukleat dalam
gel elektroforesis, sehingga dapat mendeteksi DNA hingga 25 pg. Komponen utama dalam SyBr Gold adalah dimetil sulfoksida atau DMSO (Molecular Probes 2001).
Pemisahan menggunakan elektroforesis gel agarose 1% menunjukkan hasil yang cukup baik (Gambar 1). Pita DNA yang berada pada bagian atas gel menunjukkan bahwa molekul DNA sampel berukuran cukup besar dan tidak terdegradasi. Ukuran molekul DNA yang besar tersebut menandakan bahwa molekul DNA yang telah diisolasi merupakan DNA genom. Molekul DNA genom tidak akan termigrasi lebih lanjut dalam gel agarose karena memiliki ukuran yang lebih besar dibandingkan dengan ukuran pori-pori gel (Sahu et al. 2012).
Fragmentasi dan Modifikasi Ujung Fragmen DNA
Fragmentasi merupakan tahap awal dalam proses konstruksi pustaka genom. Tahap fragmentasi bertujuan memperoleh fragmen-fragmen DNA berukuran lebih kecil yang akan digunakan dalam tahap sekuensing. Menurut Illumina (2008), fragmen DNA yang digunakan dalam tahap sekuensing adalah fragmen yang berukuran kurang dari 800 bp. Ukuran fragmen yang dipilih pada penelitian ini adalah 300-400 bp. Ukuran tersebut dipilih untuk memudahkan pembuatan pustaka genom yang optimum untuk tahap sekuensing (Barnum 2005).
Tahap fragmentasi pada penelitian ini dilakukan dengan metode sonikasi, yaitu dengan memajankan gelombang ultrasonik pada larutan DNA. Metode ini termasuk ke dalam teknik fragmentasi secara mekanik. Menurut Pirrung (2007), sonikasi merupakan salah satu teknik yang efektif dalam pencampuran, proses reaksi, dan pemecahan bahan dengan bantuan energi tinggi. Efek yang dihasilkan dari proses sonikasi tersebut dapat berupa efek fisik dan efek kimia. Secara fisik, sampel yang mengalami sonikasi akan teremulsi, sementara secara kimia akan terjadi interaksi antara molekul dalam sampel tersebut yang selanjutnya akan menyebabkan perubahan ikatan kimia dalam sampel (Suslick & Price 2000). Interaksi tersebut terjadi karena panjang gelombang ultrasonik lebih tinggi dibandingkan dengan panjang gelombang molekul-molekul dalam sampel (Wardiyati et al. 2004).
15 polimerase. Enzim eksonuklease akan memotong nukleotida pada ujung 3’OH yang menggantung, sedangkan enzim polimerase akan melengkapi ujung 5’P yang menggantung dengan cara mensintesis utas DNA baru yang komplemen dengan ujung 5’P tersebut (Illumina 2010c).
Hasil fragmentasi dan modifikasi ujung fragmen DNA diuji konsentrasi dan kemurniannya secara kuantitatif menggunakan spektrofotometer nanodrop. Konsentrasi DNA hasil fragmentasi dan modifikasi ujung fragmen berada pada rentang 96.7-475.0 ng/µL dengan perbandingan 260/280 sebesar 1.54-2.35 dan perbandingan 260/230 sebesar 0.56-2.49 (Tabel 3). Jika dibandingkan dengan hasil isolasi DNA pada Tabel 1, maka dapat diketahui bahwa konsentrasi DNA beberapa sampel mengalami peningkatan (DR1, DR2, NIE7, dan SD6225), dan beberapa sampel yang lain (DR38, PA300, RCC70, TSH858, dan UIT1) mengalami penurunan. Penurunan konsentrasi DNA tersebut dapat disebabkan oleh adanya fragmen DNA yang tidak terikat pada AMPure XP Beads selama proses purifikasi, sehingga fragmen DNA tersebut terbuang bersama etanol 80%.
AMPure XP Beads yang digunakan untuk tahap pencucian mengandung
butiran-butiran halus paramagnetik yang akan mengikat fragmen-fragmen DNA dan menghilangkan kelebihan pereaksi yang dapat mengganggu pada tahap selanjutnya (Agencourt Bioscience 2009).
Adenilasi dan Ligasi Adaptor
Tahap adenilasi bertujuan menambahkan nukleotida adenin ke ujung tumpul (3’OH) untuk mencegah terjadinya ligasi antar fragmen DNA selama proses ligasi adaptor berlangsung. Proses adenilasi dilakukan dengan menambahkan A-Tailing Mix yang berisi basa adenin dan A-Tailing Control ke dalam sampel hasil modifikasi ujung fragmen DNA. Inkubasi selama 30 menit pada suhu 37 oC dilakukan untuk mengoptimalkan penempelan basa adenin di ujung fragmen DNA (Illumina 2008).
Tahap selanjutnya setelah adenilasi adalah ligasi adaptor. Reagen yang ditambahkan pada tahap ini adalah Ligase Control, Ligase Mix, Adapter Index,
dan Stop Ligase Mix. Ligase Control akan mempertahankan kondisi optimal
sampel selama tahap ligasi, sedangkan Ligase Mix yang berisi enzim ligase akan menyambungkan fragmen DNA dengan adaptor melalui reaksi ligasi. Adapter
Index berisi sekumpulan sekuen nukleotida (6-7 basa) yang ditambahkan di ujung
fragmen DNA untuk mempersiapkan fragmen dalam tahap hibridisasi dalam flow cell. Salah satu ujung adaptor akan menempel pada ujung-ujung fragmen DNA yang telah mengalami adenilasi, sedangkan ujung adaptor yang lain akan menempel pada dinding flow cell. Adapter Index yang digunakan terdiri atas tiga jenis yang memiliki urutan nukleotida ACAGTG, GCCAAT, dan GTGAAA. Stop
Ligase Mix yang ditambahkan setelah inkubasi berfungsi menghentikan reaksi
ligasi (Illumina 2008).
16
panjang gelombang 260/280 berada pada rentang 2.02-2.50, sedangkan perbandingan serapan pada panjang gelombang 260/230 berada pada rentang 0.86-2.14. Data tersebut menunjukkan bahwa fragmen DNA hasil adenilasi dan ligasi adaptor mengandung kontaminan RNA. Perubahan kemurnian sampel dapat disebabkan oleh kontaminasi yang berasal dari reagen-reagen yang digunakan (Illumina 2008).
Purifikasi dan Perbanyakan Fragmen DNA
Fragmen DNA hasil adenilasi dan ligasi adaptor dimurnikan dan diamplifikasi untuk memperoleh fragmen-fragmen yang telah ditempeli oleh adaptor dalam keadaan murni dan dalam jumlah yang cukup banyak. Pemurnian fragmen DNA dilakukan dengan menggunakan elektroforesis gel agarose 1%, sedangkan amplifikasi dilakukan dalam mesin PCR. Amplifikasi menggunakan mesin PCR terdiri atas tiga tahap utama, yaitu denaturasi, annealing, dan elongasi. Tahap denaturasi merupakan proses terjadinya pemisahan utas ganda DNA menjadi utas tunggal. DNA utas tunggal tersebut kemudian ditempeli dengan primer pada tahap annealing. Tahap elongasi atau pemanjangan primer adalah proses sintesis nukleotida yang komplemen dengan sekuen nukleotida pada utas cetakan. Hasil akhir dari ketiga tahap tersebut adalah amplikon fragmen DNA yang terdiri atas satu utas DNA cetakan dan satu utas DNA hasil sintesis yang keduanya saling komplemen. Ketiga tahap tersebut dilakukan selama beberapa siklus sehingga menghasilkan fragmen DNA dalam jumlah yang bertambah secara eksponensial (Krane & Raymer 2002).
Fragmen DNA hasil purifikasi dan amplifikasi diuji konsentrasi dan kemurniannya dengan menggunakan spektrofotometer nanodrop. Konsentrasi sampel berada pada rentang 3.2-11.5 ng/µL, dengan perbandingan serapan pada panjang gelombang 260/280 berada pada rentang 1.42-2.19, dan perbandingan serapan pada panjang gelombang 260/230 berada pada rentang 0.72-2.10 (Tabel 5). Konsentrasi DNA semua genotipe pada tahap ini lebih rendah dibandingkan dengan konsentrasi DNA pada tahap sebelumnya (Tabel 4). Hal tersebut dapat disebabkan oleh terbuangnya sebagian fragmen DNA selama proses pencucian dengan menggunakan AMPure XP Beads. Perbandingan serapan pada panjang gelombang 260/230 menunjukkan bahwa fragmen DNA masih mengandung kontaminan polisakarida (Henry 2001).
Validasi Pustaka DNA Genom
Pustaka DNA genom yang telah dikonstruksi harus divalidasi untuk menentukan ukuran fragmen dan molaritas pustaka DNA genom yang diperoleh. Klaster yang memiliki densitas tinggi harus dibuat terlebih dahulu agar diperoleh data hasil sekuensing yang berkualitas baik. Oleh karena itu dilakukan tahap kuantifikasi menggunakan qPCR untuk menentukan molaritas pustaka DNA genom yang akan digunakan sebagai cetakan dalam tahap sekuensing. Elektroforesis gel agarose 2% dilakukan untuk mengetahui ukuran fragmen pustaka DNA genom yang telah dibuat (Illumina 2008).
Elektroforesis gel agarose dapat diganti dengan instrumen Agilent
Bioanalyzer untuk mengetahui ukuran dan konsentrasi fragmen DNA. Prinsip
bioanalyzer hampir sama dengan elektroforesis gel, namun dilakukan dalam suatu
17 memerlukan waktu yang lebih singkat dibandingkan dengan elektroforesis gel. Ukuran fragmen yang dihasilkan dari tahap bioanalyzer juga lebih akurat dibandingkan dengan hasil analisis elektroforegram menggunakan perangkat bioinformatika biasa (Healey et al. 2014).
Data hasil validasi pustaka DNA genom ditunjukkan pada Tabel 6. Fragmen DNA yang dihasilkan dari tahap elektroforesis gel agarose dan bioanalyzer berada pada rentang 314-485 bp. Ukuran tersebut masih berada pada rentang yang dibutuhkan untuk sekuensing pustaka DNA genom, yaitu kurang dari 800 bp. Molaritas DNA hasil konstruksi pustaka genom berada pada rentang 2.04-23.86 nM/L. Hasil tersebut cukup bagus karena berada di atas molaritas minimal yang dibutuhkan untuk tahap sekuensing yaitu 2 nM/L (Illumina 2008).
Klasterisasi Pustaka DNA Genom
Pustaka DNA genom yang telah dibuat memiliki kualitas dan kuantitas yang cukup baik dan berada dalam rentang yang diinginkan, sehingga dapat digunakan untuk tahap klasterisasi dan sekuensing. Tahap klasterisasi bertujuan membentuk klaster atau kelompok salinan pustaka genom yang akan disekuen. Proses klasterisasi tersebut dilakukan dalam sebuah flow cell dengan menggunakan instrumen cBot Cluster Generation. Pembentukan klaster pada tahap klasterisasi dapat memudahkan pembacaan atau deteksi pendaran oleh HiSeq2000. Terdapat tiga tahap yang terjadi selama proses klasterisasi, yaitu imobilisasi dan pemanjangan DNA, amplifikasi fragmen DNA dengan prinsip bridge
amplification, serta linearisasi dan hibridisasi fragmen DNA (Illumina 2010b).
Fragmen DNA utas tunggal yang telah diinjeksikan ke dalam flow cell akan menempel di dinding flow cell. Penempelan tersebut terjadi karena fragmen DNA sebelumnya telah berikatan dengan adaptor yang ditambahkan pada proses konstruksi pustaka genom. Fragmen tersebut kemudian akan dibuat komplemennya serta diamplifikasi melalui bridge amplification sehingga terbentuk salinan fragmen pada akhir proses klasterisasi (Mardis 2008).
Teknik klasterisasi yang dilakukan pada pustaka DNA genom kakao adalah
multiplexing indexes, yaitu genotipe yang ditempeli oleh jenis adaptor yang
berbeda dimasukkan ke dalam jalur yang sama dalam flow cell. Hal tersebut dilakukan karena ukuran genom kakao yang relatif lebih kecil dibandingkan dengan genom tanaman lain. Oleh karena itu dilakukan multiplexing indexes agar klaster yang dihasilkan memiliki densitas yang baik dan dapat terbaca pada instrumen HiSeq2000 (Illumina 2010b). Genotipe yang digunakan dalam tahap klasterisasi dan sekuensing adalah DR38, PA300, RCC70, TSH858, dan UIT1. Hasil yang diharapkan dari tahap klasterisasi dan sekuensing adalah berupa data kualitatif, sehingga hanya lima genotipe yang digunakan. Kelima genotipe tersebut dianggap sudah mewakili genotipe lain yang digunakan dalam penelitian ini.
Sekuensing DNA Genom
Flow cell yang berisi hasil klasterisasi pustaka genom dimasukkan ke dalam
18
yang akan menghasilkan pendaran fluoresen pada setiap nukleotida dalam masing-masing klaster. Sebelum dilakukan siklus selanjutnya, terjadi pelepasan atau pemutusan ikatan 3’OH yang telah termodifikasi dengan nukleotida yang disintesis pada siklus sebelumnya. Setelah semua siklus selesai dilakukan, setiap pendaran fluoresen pada semua siklus dikonversi atau dibaca sebagai keempat jenis nukleotida penyusun klaster pustaka genom yang telah berurutan (Illumina 2010a).
Data yang dihasilkan dari tahap klasterisasi dapat diketahui setelah proses sekuensing dilakukan (Tabel 7). Berdasarkan data tersebut, dapat diketahui bahwa secara keseluruhan telah dihasilkan basa sebanyak 391.93 Gbp. Nilai tersebut bergantung pada jenis pembacaan yang dilakukan. Terdapat empat jenis pembacaan basa pada NGS HiSeq 2000, yaitu single read, paired end, multiplexed
single read, dan multiplexed paired end. Jenis pembacaan yang dilakukan pada
penelitian ini adalah multiplexed paired end, yaitu pembacaan basa yang dilakukan pada jalur yang memiliki lebih dari satu jenis genotipe, dan pembacaan tersebut dilakukan sebanyak 2 × 107 siklus. Jenis pembacaan ini dapat membaca basa sebanyak dua kali pada suatu utas DNA (Illumina 2010a).
Jumlah basa kontrol (5.1 Gbp) yang ditunjukkan pada Tabel 7 menggambarkan jumlah basa yang berhasil melewati passing filter, yaitu suatu algoritma pada perangkat HiSeq2000 yang dapat menentukan keakuratan pembacaan pada saat sekuensing. Nilai tersebut jauh lebih kecil dibandingkan dengan jumlah total basa (391.93 Gbp), karena jumlah basa total merupakan jumlah basa dari keseluruhan genotipe yang telah disekuensing (Illumina 2009).
Klaster yang telah terbentuk dalam flow cell selama proses klasterisasi ditentukan densitas dan kualitasnya selama proses sekuensing. Densitas klaster yang ideal menurut Illumina (2009) berkisar antara 400-600 K/mm2. Densitas klaster yang dihasilkan pada penelitian ini adalah 763 dan 654 K/mm2 (Tabel 8). Nilai tersebut lebih tinggi dibandingkan dengan rentang densitas yang ideal. Nilai densitas klaster yang berada di atas rentang ideal tersebut dapat terjadi karena kesalahan penentuan konsentrasi pustaka genom yang digunakan untuk tahap klasterisasi (Quail et al. 2008).
Klaster yang terbentuk pada tahap klasterisasi juga ditentukan persentase klaster yang melalui passing filter (PF). Nilai klaster yang melewati passing filter
selama tahap sekuensing adalah 61.0% dan 87.6%, sementara persentase klaster PF yang ideal berada di atas 70% (Illumina 2009). Persentase klaster PF yang rendah dapat disebabkan oleh terlalu tingginya densitas klaster, ukuran pustaka genom yang terlalau panjang, dan tingginya persentase dephasing (phasing dan
prephasing) (Illumina 2010a). Korelasi antara densitas dan persentase klaster PF
ditunjukkan pada Tabel 8. Lajur yang terdiri atas genotipe DR38 dan PA300 memiliki densitas yang terlalu tinggi (763 K/mm2), sehingga menghasilkan persentase klaster PF yang relatif kecil, yaitu 61.0%.
Nilai phasing dan prephasing merupakan salah satu parameter yang dapat menentukan kualitas pustaka genom yang disekuensing. Persentase phasing yang dihasilkan selama proses sekuensing berada pada rentang 0.215-0.300%, sedangkan persentase prephasing berada pada rentang 0.303-0.330%. Nilai
phasing dan prephasing yang ideal menurut Illumina (2009) masing-masing
19
dan prephasing ideal, maka persentase phasing dan prephasing yang dihasilkan
memiliki kualitas yang cukup baik (Illumina 2009).
Paramater phasing dan prephasing merupakan indikator yang menunjukkan terjadinya ketidaksesuaian pembacaan basa pada urutan salinan klaster. Ketidaksesuaian tersebut menyebabkan pembacaan terjadi terlalu lambat
(phasing) atau terlalu cepat (prephasing). Terjadinya phasing dan prephasing
dapat dipengaruhi oleh aliran reagen dalam flow cell dan reaksi kimia yang terjadi selama proses sekuensing. Mekanisme phasing juga dapat terjadi karena reaksi pemutusan ikatan fluoresen yang tidak sempurna pada tahap terminasi gugus 3’OH. Sedangkan prephasing dapat terjadi karena proses pemblokiran yang tidak efektif pada saat basa menempel di gugus 3’OH. Dampak yang terjadi akibat mekanisme phasing adalah tidak terjadinya penempelan basa pada klaster, sehingga pendaran fluoresen yang terbaca bukan berasal dari siklus yang baru, melainkan berasal dari siklus sebelumnya. Sedangkan akibat yang ditimbulkan oleh mekanisme prephasing adalah menempelnya dua buah basa sekaligus dalam suatu siklus (Illumina 2009).
Nilai Q score merupakan hubungan logaritmik antara proses base calling
dengan kemungkinan tingkat kesalahan yang dihasilkan selama proses sekuensing (Lampiran 4). Base calling merupakan proses konversi data yang dihasilkan dari proses pencitraan pendaran fluoresen menjadi urutan basa-basa. Nilai Q score
yang dihasilkan pada penelitian ini merupakan Q score 30, dengan persentase sebesar 67.9% pada lajur 7 (genotipe DR38 dan PA300) dan 81.3% pada lajur 8 (genotipe RCC70, TSH858, dan UIT1), dengan jumlah basa masing-masing lajur sebesar 18 Gbp dan 26.6 Gbp. Nilai Q score 30 tersebut mencerminkan bahwa dalam setiap 1000 basa yang dibaca hanya terdapat 1 basa yang mengalami kesalahan pembacaan (Voelkerding et al. 2009). Berdasarkan penelitian yang telah dilakukan oleh Tasma et al. (2012), jumlah total basa yang dihasilkan dari sekuensing kakao dapat mencapai 52.9 Gbp dengan Q score di atas 30 sebesar 75.0%. Nilai Q score 30 dipengaruhi oleh tingginya densitas klaster yang terbentuk. Densitas klaster yang terlalu tinggi dapat menyebabkan banyaknya basa yang mengalami kesalahan pembacaan (Healey et al. 2014).
Tingkat kesalahan yang terjadi selama proses sekuensing dapat diketahui dari nilai persentase kesalahan. Nilai tersebut merupakan persentase perbandingan kesalahan pembacaan pustaka genom dengan kontrol (PhiX) yang dibaca pada beberapa siklus, yaitu siklus 35, 75, dan 100. Nilai kesalahan yang dihasilkan pada penelitian ini berkisar antara 0.20-1.14% (Tabel 8). Tingkat kesalahan maksimal yang diperbolehkan menurut Illumina (2010a) adalah 2.00%.
20
terbuang. Rendahnya persentase tersebut juga dapat terjadi karena kesalahan pada proses phasing dan dephasing yang mengakibatkan banyak basa yang tidak terbaca (Healey et al. 2014).
Perkiraan ukuran genom kakao ditunjukkan pada Gambar 4. Perkiraan ukuran genom kakao terbesar diperoleh dari genotipe TSH858 yaitu sebesar 566.9 Mbp dan perkiraan ukuran genom terkecil pada genotipe DR38 sebesar 1.5 Mbp. Menurut penelitian yang dilakukan oleh Motamayor et al. (2013) pada 28 genotipe kakao yang berbeda, ukuran genom kakao dapat mencapai 445 Mbp. Perbedaan ukuran genom tersebut dapat disebabkan oleh adanya perbedaan tingkat akumulasi pada jumlah ekson dan intron, serta panjang intron dan ekson yang berbeda secara signifikan (Suharsono 2002). Perbedaan ukuran genom juga terjadi karena basa-basa yang memiliki kualitas pembacaan yang rendah tidak diikutsertakan pada analisis hasil sekuensing, sehingga genom yang dihasilkan tersebut hanya berisi basa-basa yang memiliki kualitas pembacaan yang baik (Schuster 2008).
Kesalahan yang terjadi selama pembacaan basa masing-masing genotipe ditampilkan pada Gambar 5. Grafik tersebut menunjukkan bahwa basa-basa yang berada di posisi awal dan akhir mengalami tingkat kesalahan pembacaan yang lebih tinggi dibandingkan dengan basa-basa di posisi tengah pembacaan. Hal tersebut dapat terjadi karena pada pembacaan basa di posisi awal, instrumen yang digunakan masih menyesuaikan proses pembacaan, sedangkan kesalahan pembacaan di posisi akhir dapat terjadi karena adanya adaptor indeks yang terbaca selama sekuensing (Quail 2008).
SIMPULAN DAN SARAN
Simpulan
21
Saran
Diperlukan analisis lanjutan seperti penggunaan perangkat bioinformatika untuk menyusun sekuen genom kakao menjadi suatu urutan yang utuh. Penelitian lanjutan juga perlu dilakukan untuk mengidentifikasi gen-gen yang berperan dalam peningkatan produksi dan ketahanan tanaman kakao.
DAFTAR PUSTAKA
[PPKK] Pusat Penelitian Kopi dan Kakao. 2007. Mencari Solusi Atas Kakao. [Internet].[diunduh 2014 Mei 22]. Tersedia pada http://www.iccri.net.html Agencourt Bioscience Corp. 2009. Agencourt® AMPure® XP. Massachussets quantification of DNA and RNA. FASEB J 21: 262-263.
Fang G, et al. 1992. A quick and inexpensive method for removing polysaccharides from plant genomic DNA. Biotechniques 13: 52-54.
Healey A, Furtado A, Cooper T, Henry RJ. 2014. Protocol: a simple method for extracting next generation sequencing quality genomic DNA from recalcitrant plant species. Plant Met 10: 21-28.
Henry RJ. 2001. Plant DNA extraction. CAB: 239-250.
Illumina. 2008. Preparing Samples for Squencing Genomic DNA. San Diego (US): Illumina, Inc.
Illumina. 2009. Sequencing Analysis Software: User Guide. San Diego (US): Illumina, Inc.
Illumina. 2010a. HiSeq Sequencing System. San Diego (US): Illumina, Inc. Illumina. 2010b. cBot Quick Reference Guide. San Diego (US): Illumina, Inc. Illumina. 2010c. TruSeq DNA Sample Preparation Guide. San Diego (US):
Illumina, Inc.
Kosasih A. 2012. Konstruksi dan analisis kualitas pustaka genom kedelai (Glycine max (L.) Merr.) untuk sekuensing genom total [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Krane DE, Raymer ML. 2002. Fundamentals of Bioinformatics. San Francisco (US): Benjamin Cummings.
Kusuma YTC, et al. 2013. Pemanfaatan biji kakao inferior campuran sebagai sumber antioksidan dan antibakteri. Ilm Nas. 1 (2): 33-37.
Mardis ER. 2008. Next generation DNA sequencing methods. Ann Rev Hum Gen.
9: 387-402.
Metzker ML. 2010. Sequencing technologies the next generation. Nature Rev. 11: 31-46.
22 sequencing system. Nature Meth. 5: 1005-1010.
Sahu SK, et al. 2012. DNA extraction protocol for plants with high levels of secondary metabolites and polysaccharides without using liquid nitrogen and phenol. ISRN Mol Biol 12: 1-6.
Sambrook J. 2001. Molecular Cloning: A Laboratory Manual. Harbor (US): Cold Spring Harbor Laboratory Press.
Sanger F, Coulson AR. 1975. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol. 94 (3): 441-448. Schuster SC. 2008. Next generation sequencing transform today’s biology. Nature
Met 5: 16-18.
Suharsono. 2002. Konstruksi pustaka genom kedelai kultivar slamet. Hayati 9 (2): 67-70.
Suslick KS, Price GJ. 2000. Applications of ultrasound to meterials chemistry.
Annu Rev Mater Sci. 29: 295-326.
Tasma IM, Satyawan D, Rijzaani H, Rubiyo. 2012. Konstruksi pustaka genom kakao (Theobroma cacao L.) untuk sekuensing genom total menggunakan next generation sequencing HiSeq2000. RISTRI 3 (2): 99-108.
Voelkerding KV, et al. 2009. Next generation sequencing: from basic research to diagnostics. Clinical Chem. 55: 41-47.
Wahyudi T, et al. 2008. Panduan Lengkap Kakao. Jakarta (ID): Penebar Swadaya. Walker JM, Wilson K. 2000. Principles and Techniques of Practical Biochemistry.
Cambridge (GB): Cambridge University Press.
Wardiyati S, et al. 2004. Pemanfaatan ultrasonik dalam bidang kimia. Di dalam:
Penguasaan IPTEK Bahan untuk Meningkatkan Kualitas Produk Nasional.
Prosiding Pertemuan Ilmiah IPTEK Bahan; 2004 Sept 7; Serpong, Indonesia.
Serpong (ID): P3IB Batan. hlm 419-424.
23 Lampiran 1 Diagram alir penelitian
Isolasi DNA kakao
Konstruksi pustaka genom kakao (fragmentasi DNA, modifikasi ujung
fragmen DNA, adenilasi ujung 3’OH, ligasi
adaptor, purifikasi DNA hasil ligasi, amplifikasi DNA, validasi pustaka genom)
Klasterisasi pustaka genom
Sekuensing pustaka genom
24
Lampiran 2 Jumlah dan densitas klaster pustaka genom serta persentase phasing
25 Lampiran 3 Panjang fragmen yang dimasukkan dalam setiap lajur selama proses
sekuensing
26
28
Lampiran 6 Histogram perkiraan ukuran fragmen
29 Lampiran 8 Rataan kualitas basa berdasarkan posisinya
30
33
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang, Provinsi Banten, pada tanggal 11 Mei 1992 dari ayah Rosid dan ibu Martini. Penulis merupakan putra pertama dari tiga bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Mandirancan, Kabupaten Kuningan. Tahun 2010 juga penulis berhasil lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama masa perkuliahan, penulis pernah bergabung dalam UKM Agriaswara (2010/2011) serta aktif sebagai staf di Divisi Biologi Molekuler
Community of Research and Education in Biochemistry (CREBs) pada periode