FERMENTASI PATI RESISTEN PADA TAHU KORO
PEDANG OLEH
Clostridium butyricum
BCC B2571DAN
Eubacterium rectale
DSM 17629
LUQMANUL HAKIM
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Evaluasi Kemampuan Pati Resisten pada Tahu Koro Pedang sebagai Substrat Fermentasi Clostridium butyricumBCC B2571dan Eubacterium rectaleDSM 17629 adalah bagian dari proyek penelitian Balai Besar Pasca Panen tahun 2013. Proyek penelitian ini didanai oleh DIPA BB Pasca Panen dengan nomor dok-int-re3.2/032/2013. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
LUQMANUL HAKIM. FermentasiPati Resisten Pada Tahu Koro Pedang OlehClostridium butyricumBCC B2571 dan Eubacterium rectaleDSM 17629. Dibimbing oleh EDY DJAUHARI P K dan ENDANG YULI PURWANI.
Pati resisten merupakan jenis pati yang tidak terurai oleh enzim pendegradasi patipada pencernaan manusia namun masih dapat terfermentasi oleh bakteri kolon membentuk asam lemak rantai pendek (ALRP). Hasil fermentasi tersebut bergantung pada jenis substrat dan mikroba yang tersedia. Penelitian ini bertujuan untuk menganalisis profil ALRP yang dihasilkan dari pati resisten yang terkandung dalam tahu koro pedang yang difermentasi oleh Clostridium butyricumBCC B2571 dan Eubacterium rectaleDSM 17629 secara in vitro. Fermentasi dilakukan selama 36 jam terhadap tahu koro pedang yang mengandung 16.04-17.94% pati resisten dan dibandingkan dengan pati Hi maize. Pola produksi ALRP pada kedua jenis substrat dan bakteri memiliki kemiripan. Produksitertinggi untuk tahu koro dengan fermentasi Clostridium butyricum terbentuk pada jam ke-36 dengan konsentrasi asetat, propionat, butirat adalah 51.59, 35.57, 22.05 mM. Pada waktu fermentasi yang sama, Eubacterium rectale memproduksiasetat, propionat, dan butirat tertingginya yaitu sebesar 49.70, 34.77, 24.68 mM.
Kata kunci:asam lemak rantai pendek, Clostridium butyricum,Eubacterium rectale, pati resisten
ABSTRACT
LUQMANUL HAKIM.Fermentation of Resistant Starch from Canavalia ensiformis beancurd by Clostridium butyricumBCC B2571 and Eubacterium rectaleDSM 17629. Supervised by EDY DJAUHARIP K and ENDANG YULI PURWANI.
Resistant starch is a starch fraction which is not digested by human starch degrading enzyme and would be fermented by bacterial in the colon to produce short chain fatty acid (SCFA). Fermentation productsdependon the type of substrate and microbes available. This research was aimedto analyze the profile of SCFA produced from resistant starch in Canavalia ensiformisbean curd fermented by Clostridium butyricumBCC B2571 and Eubacterium rectaleDSM 17629. The fermentation was held in 36 hours with C. ensiformisbean curd that contain 16.04-17.94% of resistant starch and compared to hi maize starch. The results showed similiar pattern of SCFA production from the different substrate and bacteria used. The highest production with C.butyricumoccured at 36 hours fermentation with concentration of acetate, propionate, and butyrate were 51.59, 35.57, 22.05 mM. At the same time, E.rectale was produce the highest concentration of acetate, propionate, and butyrate were 49.70, 34.77, 24.68 mM.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokomia
FERMENTASI PATI RESISTEN PADA TAHU KORO
PEDANG OLEH
Clostridium butyricum
BCC B2571DAN
Eubacterium rectale
DSM 17629
LUQMANUL HAKIM
DEPARTEMENBIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi :Fermentasi Pati Resisten pada Tahu Koro OlehClostridium butyricumBCC B2571 dan Eubacterium rectaleDSM 17629 Nama : Luqmanul Hakim
NIM : G84090075
Disetujui oleh
Drs Edy Djauhari P K, MSi Pembimbing I
DrEndang Yuli P, MSi Pembimbing II
Diketahui oleh
DrIr I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Skripsi yang
berjudul “Fermentasi Pati Resisten pada Tahu Koro Pedang olehClostridium butyricumBCC B2571 dan Eubacterium rectaleDSM 17629” disusun berdasarkan penelitian yang dilakukan selama bulan Oktober 2013 hingga Mei 2014 di lab Balai Besar Pasca Panen. Penelitian ini didanai oleh Balai Besar Pasca Panen.
Terima kasih penulis ucapkan kepada Bapak Drs Edy Djauhari P K, MSi selaku dosen pembimbing dan Ibu Dr Endang Yuli P, MSi selaku pembimbing balai yang telah meluangkan waktu dan memberikan saran, kritik, dan bimbingan selama berlangsungnya penelitian dan penulisan skripsi ini. Ucapan terima kasih penulis sampaikan kepada kedua orang tua dan keluarga atas doa dan segala dukungan yang diberikan. Penulis juga mengucapkan terima kasih kepada Bapak Yudi, Bapak Wahyudi, Bapak Tri, Bapak Danu, Ibu Dini, Ibu Pia, Mba Ika, dan Mba Ratna yang telah membantu selama penelitian berlangsung. Tidak lupa penulis sampaikan terima kasih kepada Ayu, Arin, Dani, Daniel, Hutami, Refita, Tasha, Taufik, Ute, dan Zaqi yang turut membantu selama penelitian, juga kepada Eka, Happy, Alex, Sapariansyah, Puri, dan semua teman-teman biokimia atas dukungannya selama penelitian.
Demikianlah skripsi ini disusun, semoga dapat bermanfaat baik bagi penulis maupun para pembaca.
DAFTAR ISI
DAFTAR ISI vii
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur 3
Pembuatan Tahu Koro 3
Analisis Proksimat Tahu Koro (SNI 01-2891-1992) 3
Isolasi Pati Resisten (Goni 1996) 4
Analisis Pati Resistan 5
Fermentasi In vitro Tahu Koro 5
HASIL 7
Nilai Nutrisi 7
Kadar Pati Resisten 8
Profil Fermentasi 8
PEMBAHASAN 10
Nilai Nutrisi 10
Kadar Pati Resisten 11
Profil Fermentasi 12
SIMPULAN 15
SARAN 15
DAFTAR TABEL
1 Nilai nutrisi tahu yang disiapkan dengan pelarut dan koagulan berbeda 8
2 Kadar pati resisten tahu koro pedang 8
3 Kecepatan tumbuh bakteri selama proses fermentasi 9 4 Profil asam lemak rantai pendek hasil fermentasi C.butyricum BCC
B2571 10
5 Profil asam lemak rantai pendek hasil fermentasi E.rectale DSM 17629 10
DAFTAR GAMBAR
1 Tahu Koro 8
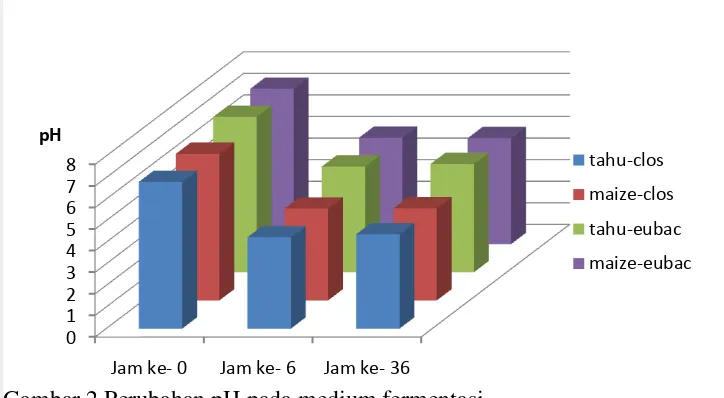
2 Perubahan pH pada medium fermentasi 9
DAFTAR LAMPIRAN
1 Bagan rancangan umum penelitian 18
2 Komposisi mediumPYG dalam 1 L 18
3 Komposisi larutan campuran mineral 18
4 Komposisi medium RCM dalam 1 L 19
5 Perubahan pH pada fermentasi oleh C.butyricum BCC B2571 19 6 Perubahan pH pada fermentasi E.rectale DSM 17629 19 7 Contoh Kromatogram Standar asam lemak rantai pendek 20
PENDAHULUAN
Kacang kedelai dikenal sebagai bahan baku pembuatan tahu. Menurut Haliza (2007), sekitar 80% kedelai nasional dimanfaatkan untuk memenuhi sektor industri tempe dan tahu sedangkan sisanya digunakan oleh berbagai macam industri seperti kecap, susu kedelai, dan sebagainya. Proses fermentasi atau penambahan asam pada proses pengolahan akan membuat kandungan protein, lemak dan polisakarida dari kedelai menjadi lebih mudah dihidrolisis sehingga meningkatkan daya cernanya (Astawan dan Mita 2003).Dengan adanya bentuk olahan kedelai tersebut, maka tingkat konsumsi masyarakat pun ikut meningkat tiap tahunnya.Namun saat ini kondisi iklim sedang mengalami anomali yang disebabkan oleh pemanasan global, sedangkan komoditas pertanian termasukdidalamnya kedelai sangat rentan dengan perubahan iklim/cuaca sehingga laju produksi pun mengalami penurunan (Balitbang Pertanian 2011). Kelangkaan menjadi salah satu penyebab tingginya harga kedelai impor di pasaran. Menyinggung hal tersebut perlu dikaji kebijakan khusus mengenai pemilihan alternatif komplemen dan subtitusi dari kacang kedelai tersebut.
Pemanfaatan kacang-kacangan lokal sebagai subtitusi kedelai dalam pembuatan produk olahan, merupakan salah satu pemecahan masalah ketersediaan kedelai. Mengingat potensi kacang-kacangan lokal masih sebatas tanaman sampingan dan belum dibudidayakan sebagai komoditi utama pertanian, cara ini diyakini mampu meningkatkan produktivitas dan mengembangkan potensinya. Beberapa jenis kacang-kacangan digolongkan sebagai kacang-kacangan potensial yaitu kacang-kacangan yang mempunyai peran strategis dalam mewujudkan ketahanan pangan nasional.Kacang-kacanganyang termasuk dalam golongan ini adalah kacang-kacangan yang berpotensi untuk dikembangkan sebagai sumber pangan di masa mendatang yaitu jenis kacang-kacangan selain kedelai, kacang tanah dan kacang hijau (Hasanuddin 2002).
Kacang-kacangan lokal yang dapat dimanfaatkan sebagai subtitusi kedelai dalam pembuatan tahu salah satunya adalah kacang koro pedang. Kacangkoro pedang (Canavalia ensiformis L.), merupakansalah satu dari 13 jenis kacang-kacangan potensial yang telah dibudidayakan.Biji koro pedang yang sudah tua dan kering dapat pula dimasak atau digunakan sebagai bahan pembuatan tahu dan tempe. Tanamankacang tersebut memiliki kandungan nutrisi yang tidak jauh berbeda dari kacang kedelai, sehingga berpotensi menjadi subtitusi kedelai dalam industri pembuatan tahu maupun tempe(Sumarjan 2004). Berbeda dengan kacang kedelai, kacang koro pedang memiliki kandungan karbohidrat total yang cukup tinggi, yaitu sebesar 45.8-65.4% (Sridhar 2006). Tingginya kadar karbohidrat tersebut menyebabkan tekstur tahu menjadi lebih kaku dan keras. Namundisamping kekurangan tersebut, ternyata kacang koro pedang juga memiliki kelebihan tersendiri. Kelebihan yang dimiliki kacang koro pedang adalah kandungan pati resisten yang cukup tinggi, yaitu sebesar 10,8 gram/ 100 gram (Sridhar 2006).
2
dalam darah(Leszczynski 2004).Selain daripada itu, pati resisten dapat pula berfungsi sebagai serat dan prebiotik sehingga membantu meningkatkan kesehatan pencernaan (Wronkowska 2002).
Pati resisten tidak dapat tercerna oleh enzim pencernaan di dalam tubuh, membuat pati tersebut mampu mencapai kolon dan difermentasi oleh bakteri flora usus. Beberapa studi menunjukkan hasil fermentasi pati resisten berupa asam lemak rantai pendek (ALRP), khususnya butirat memiliki peranan dalam menyediakan energi bagi sel kolon dan menghambat pertumbuhan sel kanker dengan menginduksi terjadinya apoptosis pada sel kanker (Kim 2005; Le-Leu 2007). Asam lemak rantai pendek merupakan regulator proses fisiologis untuk menjaga agar kolon berfungsi secara normal. Banyaknya manfaat yang didapat dengan mengkonsumsi pati resisten, menjadikan kacang koro berpotensi untuk dikembangkan sebagai pangan fungsional.
Kadar pati resisten pada suatu produk pangan dapat bertambah atau berkurang apabila telah mengalami proses pengolahan bergantung pada kadar amilosa produk pangan tersebut. Perubahan kadar pati resisten juga berpengaruh terhadap hasil fermentasinya. Kadar pati resisten dan hasil fermentasinya dapat ditentukan dengan menerapkan proses simulasi pencernaan. Prinsip perhitungan kadar pati resisten didasarkan pada pengisolasian menggunakan enzim pencernaan, yang kemudian dapat dilanjutkan dengan fermentasi anaerob menggunakan bakteri flora usus untuk mengetahui profil ALRP nya. Tingginya kadar karbohidrat total pada kacang koro pedang diharapkan dapat meningkatkan kadar pati resisten pada produk olahannya berupa tahu. Penelitian ini dilakukan bertujuan untuk menganalisis kandungan pati resisten tersebut pada kacang koro pedang yang telah dibuat menjadi tahu, serta melakukan simulasi proses fermentasi usus terhadap pati resisten tahu tersebut secara invitro dan menganalisis profil ALRP yang dihasilkan dari fermentasi tahu tersebut.Manfaat penelitian ini adalah untuk mengenalkan kelebihan kacang koro kepada masyarakat sebagai pangan fungsional.
METODE
Bahan dan Alat
Bahan utama penelitian ini adalah Canavalia ensiformis asal Jawa Tengah yang telah digiling menjadi tepung dan diperoleh dari Balai Besar Penelitian Pasca Panen, Bogor. Air biang (biang tahu) didapat dari salah satu pabrik pembuatan tahu rumahan di wilayah Bogor. Kontrol yang digunakan adalah pati resisten komersial High Maizeyang berasal dari jagung.Galur bakteri Clostridium butyricum BCC B2571 diperoleh dari Balai Besar Veteriner di Bogor, sedangkan galur bakteri Eubacterium rectale DSM 17629 diperoleh dari koleksi kultur DSM (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) di Jerman.
Bahan yang digunakan untuk pembuatan medium bakteri adalah ekstrak ragi, ekstrak daging sapi, pepton, glukosa, NaCl, CH3COONa, Cystein-HCl, tripton,
Tween 80, resazurin, CaCl2, MgSO4, KH2PO4, K2HPO4, NaHCO3, Vitamin K1,
Haemin, NaOH, Bacto-agar.Sedangkan bahan untuk analisis adalah Na2SO3,
NaK-Tartrat, asam dinitrosalisilat, fenol, campuran selen, H3BO3, HCl,
3 amiloglukosidase, heksana, standar asam asetat (Fluka), standar asam propionat (Fluka), dan standar asam butirat (Fluka).
Alat-alat yang digunakan adalah neraca analitik, sentrifus, spektrofotometer, penangas air, mikropipet, tabung reaksi, labu Kjeldahl, pipet volumetrik, tabung setrifus, cawan porselen, dan desikator. Alat yang digunakan untuk fermentasi dan analisis asam lemak rantai pendek adalah inkubator, pH-meter, dan kromatografi gas (HITACHI 263-50).
Prosedur
PembuatanTahu Koro
Penelitian dimulai dengan penyiapan sampel tahu koro pedang terlebih dahulu. Sampel yang telah jadi akan dianalisis dengan serangkaian uji. Setiap uji dilakukan sebanyak 3 kali pengulangan.
Sampel tahu dibuat dengan 4 perlakuan, yaitu kombinasi antara pelarut dan jenis koagulan. Pelarut yang digunakan adalah air dan air garam 1%, sedangkan koagulan yang digunakan adalah CaSO40.2M dan air biang25% (biang
tahu). Koagulan terlebih dahulu dilarutkan dalam akuades.Perlakuan yang digunakan antara kombinasi pelarut dan koagulan adalah air sebagai pelarut dan CaSO4 sebagai koagulan, air sebagai pelarut dan air biang sebagai koagulan, air
garam sebagai pelarut dan CaSO4sebagai koagulan, dan air garam sebagai pelarut
dan air biang sebagai koagulan
Kacang koro ditimbang sebanyak 200 gram dan diblender dalam 1 liter pelarut selama 5 – 10 menit. Sari kacang kemudian disaring sebanyak 3 kali.Filtrat yang dihasilkan kemudian dididihkan selama 10 menit, sambil diaduk perlahan. Setelah mendidih, sari kacang didinginkan hingga suhu 70-80°C dan ditambahkan koagulan dengan perbandingan volume antara sari kacang dengan koagulan adalah 2.5:1 dan sambil diaduk sebentar. Suhu setelahpenambahan koagulan dijaga konstan selama 20 menit.Endapanyang terbentuk kemudian dicetak dan dihilangkan kelebihan air nya dengan cetakan tahu yang dilapisi kain saring dan diberi pemberat selama 20 menit.Tahu yang terbentuk ditimbang dan siap digunakan untuk analisis.
Analisis ProksimatTahu Koro (SNI 01-2891-1992)
Analisis Kadar Air
Sebanyak 1-2 g sampel ditimbang dengan seksama dalam sebuah cawan porselen yang sudah diketahui bobot awalnya. Cawan kemudian dikeringkan dalam oven dengan suhu 105°C selama 3 jam. Setelah selesai, cawan dimasukkan kedalam desikator hingga mencapai suhu ruang dan ditimbang bobot akhirnya. Prosedur diulang hingga didapat bobot tetap.Pengurangan bobot dihitung untuk mendapatkan kadar air dari sampel
Analisis Kadar Abu
4
didinginkan dalam desikator hingga mencapai suhu ruang. Bobot akhir cawan ditimbang, dan pengurangan bobot dihitung untuk mendapatkan kadar abu dalam sampel.
Analisis Kadar Lemak Kasar Metode Ekstraksi Soxhlet
Sebanyak 1-2 g sampel ditimbang dalam selongsong kertas dengan kapas didalamnya. Selongsong yang berisi sampel kemudian disumbat kembali dengan kapas dan ditutup. Selongsong dimasukkan kedalam tabung alumunium yang telah diketahui bobot awalnya, kemudian ditambahkan heksana sebanyak 70 ml dan dipasangkan pada alat fat determinatoruntuk diekstraksi dengan suhu 130°C selama 3 jam. Kemudian selongsong diangkat dan heksan dalam tabung dievaporasi selama 1 jam hingga aroma pelarut hilang. Tabung kemudian didinginkan dalam desikator hingga mencapai suhu ruang dan timbang bobot akhir. Selisih bobot tabung merupakan kadar lemak dalam sampel.
Analisis Kadar Protein Kasar Metode Kjeldhal
Sebanyak 0.5 g sampel ditimbang dan dimasukkan kedalam labu kjeldahl. diletakkan dibawah kondensor.Setelah destilasi, labu Erlenmeyer dititrasi menggunakan HCl 0.1 N. Volume terpakai dihitung sebagai kadar Nitrogen bebas dalam sampel. konversi kadar nitrogen menjadi protein menggunakan rumus :
� �� � � � = �1− �2 ×�× 0.0014 × ×
�
Keterangan :
w = bobot cuplikan
V1 = volume HCl 0.001 N yang terpakai pada sampel V2 = volume HCl 0.001 N yang terpakai pada blanko N = normalitas HCl
fk = faktor konversi protein dari makanan yaitu 6.25 fp = faktor pengenceran
Analisis Kadar Karbohidrat Total (Dengan Selisih)
Karbohidrat (%) = (100% - ((protein(%) + water(%) + ash(%) + fat(%))
Isolasi Pati Resisten (Goni 1996)
5 ditambahkan kedalam campuran. Sampel dihomogenkan dan diinkubasi pada suhu 37°C selama 16 jam dalam penangas air kocok.Setelah inkubasi, sampel disentrifus (3000 rpm, 15 menit) dan supernatan dibuang. Residu dibilas menggunakan 10 ml akuades dan disentrifus kembali, supernatan dibuang. Residu hasil sentrifugasi disimpan dalam lemari pendingin untuk analisis.
Analisis Pati Resistan
HidrolisisPati Resisten (Goni 1996)
Analisis kadar pati resisten merupakan metode lanjutan dari isolasi pati resisten dengan sampel 100 mg tahu. Residu yang didapat dari metode isolasi sebelumnyadilarutkan kembali dalam3 ml akuadesdan 3 ml KOH 4 M, larutan dicampurkan perlahan selama 30 menit pada suhu ruang dengan pengocokan konstan. Sampel yang telah homogen kemudian ditambahkan 5.5 ml HCl 2 M, 3 ml bufer natrium asetat 0.4 M, pH 4.75 (pH diatur menggunakan HCl 2 M atau NaOH 0.5 M), dan 1 ml amiloglukosidase (1500 unit/ml), dihomogenkan dan diinkubasi pada suhu 60°C selama 45 menit dengan pengocokan konstan. Campuran tersebut kemudian disentrifus (3000 rpm, 15 menit), supernatan diambil untuk dianalisa berikutnya menggunakan metode pengukuran kadar glukosa.
Analisis Kadar Glukosa Metode DNS
Pereaksi DNS terlebih dahulu dibuat. Sebanyak 10 g NaOH dilarutkan dalam 600 ml akuades dan ditambahkan 10 g asam dinitrosalisilat, diaduk perlahan. Setelah ituditambahkan 182 g Na-K Tartrat, 2 g fenolyang dicairkan pada suhu 50°C dan 0.5 g Na-Metabisulfit. Volume akhir ditepatkan hingga 1 L.
Kurva standar dibuat dengan mengukur kadar D-glukosa dengan terlebih dahulu dibuat deretdari konsentrasi 50-350 mg/L dengan selang 50. Sebanyak 1 ml larutan standar dimasukkan kedalam tabung reaksi dan ditambahkan dengan 2 ml pereaksi DNS. Larutan tersebut kemudian dipanaskan dalam air mendidih selama 5 menit, dan dibiarkan dingin pada suhu ruang. Kemudian masing-masing standar diukur absorbansinya dengan spektrofotometer pada panjang gelombang 550 nm. Hasil yang didapat kemudian diplotkan pada grafik secara linier.
Penentuan kadar glukosa pada sampel dilakukan dengan metode yang sama. Sampel supernatan hasil hidrolisis enzim diencerkan terlebih dahulu. Sebanyak 1 ml sampel dilarutkan dalam 4 ml akuades dan dikocok hingga homogen. Kemudian larutan hasil pengenceran diukur kadar glukosa nya. Absorbansi yang didapat kemudian dimasukkan kedalam persamaan kurva standar dan dihitung kadarnya. Kadar glukosa yang didapat kemudian dikali 0.9 (faktor konversi untuk pati).
Fermentasi In vitro Tahu Koro
Persiapan Medium (Purwani 2009)
6
mineral dapat dilihat pada Lampiran 2 dan Lampiran 3. Semua bahan kecuali sistein-HCl, larutan haemin, dan vitamin K dicampurkan. Campuran dipanaskan hingga bahan-bahan terlarut dan didinginkan dengan penyemprotan gas CO2.
Kemudian pada medium yang telah dingin, ditambahkan vitamin K, larutan haemin, dan sistein-HCl. Medium diatur pH nya menjadi 7.2 dengan NaOH dan HCl. Komposisi untuk RCM dapat dilihat pada Lampiran 3. Semua bahan dilarutkan dalam Erlenmeyer. Untuk medium aktivasi digunakan pati hi maize, sedangkan untuk medium fermentasi digunakan sampel sebagai pengganti nya. Campuran diatur pH menjadi 6.8 dengan NH4OH atau HCl. Masing-masing
medium untuk fermentasi didistribusikan sebanyak 15 ml kedalam botol serum dan digelontorkan dengan gas CO2. Botol kemudian ditutup dengan septum butil
karet dan disterilisasi pada suhu 121°C selama 15 menit. Medium disimpan untuk pemakaian berikutnya.
Aktivasi Bakteri dan Fermentasi (Purwani 2009)
Bakteri (keadaan liofilisasi) disegarkan dengan diinokulasikan kedalam 5 ml media RCM atau PYG dan diinkubasi pada suhu 37°C selama 4 hari. Sebanyak 0.5 ml bakteri dipindah ke dalam 9.5 ml medium baru, diinkubasi kembali pada suhu 37°C selama 4 hari. Selanjutnya bakteri dipindahkan kembali sebanyak 10 ml ke dalam 40 ml medium baru dan diinkubasi pada suhu 37°C selama 4 hari. Bakteri dipindahkan untuk yang terakhir sebanyak 50 ml ke dalam 50 ml medium baru dan diinkubasi pada suhu 37°C selama 4 hari sebagai stok kultur. Setiap penginokulasian, medium digelontorkan dengan gas CO2. Stok kultur disimpan
dalam lemari pendingin sampai penggunaan selanjutnya
Media fermentasi yang berisi sampel diinokulasi dengan 1 ml kultur stok dibawah aliran gas CO2, dan diinkubasi pada suhu 37°C pada inkubator penangas.
Setiap 6, 12, 24, dan 36 jam, diambil masing-masing sampel. Sampel yang telah difermentasikan kemudian disimpan dalam lemari pendingin untuk analisis berikutnya.
Pengukuran pH(Purwani 2009)
Pengukuran pH dilakukan dengan alat pH meter sebelum dan sesudah fermentasi. Perubahan pada pH diamati dan dicatat.
Pengukuran Jumlah Bakteri Metode Tabung Bergulir(Purwani 2009)
Bakteri yang akan diukur jumlahnya diencerkan dalam larutan campuran mineral dalam tabung Eppendorf. Pengenceran berkala dilakukan hingga pengenceran 10-9 , tiga pengenceran terakhir diinokulasikan kedalam medium agar pada tabung ulir dibawah aliran gas CO2. Tabung ditutup dan diputarpada alat
tube rollerhingga agar mengeras di sekitar dinding tabung. Medium kemudian diinkubasikan pada suhu 37°C selama 4-6 hari. Koloni yang terbentuk kemudian dihitung jumlahnya dan kecepatan tumbuh nya.
Analisis Asam Lemak Rantai Pendek(Purwani 2009)
7 disaring dengan membran. Sebanyak 1 ml sampel dicampur dengan masing-standar dengan perbandingan 1:1:1:1. Sebanyak 0.2 µl masing-standar atau sampel diinjeksikan ke instrumen kromatografi gas yang dilengkapi dengan flame ionization detector (FID) dan kolom degs OP17. Gas pembawa berupa N2 dan H2
dengan laju alir 20-50 ml/menit. Suhu untuk analisa dikondisikan. Suhu kolom initial diatur menjadi 85°C dan perlahan naik hingga suhu 100°C. Suhu injektor dan detektro masing- masing adalah 200 dan 250°C. Selisih kromatogram standar dan sampel dihitung untuk mendapatkan konsentrasi sampel.Konsentrasi yang didapat kemudian dikonversi menjadi satuan mM.
HASIL
Nilai Nutrisi
Analisis proksimat dilakukan untuk mengidentifikasi kadar air, abu, protein, lemak dan karbohidrat pada tahu koro (Gambar 1). Hasil analisis ditunjukkan pada Tabel 1. Analisis dilakukan terhadap tahu dengan 4 macam perlakuan berbeda. Perlakuan yang digunakan antara kombinasi pelarut dan koagulan adalah air sebagai pelarut dan CaSO4 sebagai koagulan, air sebagai
pelarut dan air biang sebagai koagulan, air garam sebagai pelarut dan CaSO4sebagai koagulan, dan air garam sebagai pelarut dan air biang sebagai
koagulan
Kadar air untuk tahu dengan penggunaan air dan CaSO4, air dan biang tahu,
air garam dan CaSO4, dan air garam dan biang tahu berturut-turut adalah 20.83%,
18.71%, 19.44%, dan 20.96%. Tahu dengan penggunaan air garam sebagai pelarut dan air biang tahu sebagai koagulan memiliki kadar air tertinggi. Nilai kadar air yang tinggi, berpengaruh terhadap umur simpan suatu produk. Kadar air yang tinggi juga berpengaruh terhadap perubahan komposisi secara proporsional. Kadar abu pada keempat sampel berturut-turut adalah 1.69%, 0.53%, 2.92%, dan 1.04%. Tahu dengan penggunaan campuran air garam dan CaSO4 memiliki kadar abu
paling tinggi yaitu 2.92%.
Kadar lemak pada tiap perlakuan tidak berbeda nyata dengan nilai berkisar antara 1.42% - 1.69%, dengan kadar tertinggi pada tahu yang menggunakan air garam sebagai pelarut dan air biang tahu sebagai koagulan.Kadar protein tahu dengan penggunaan air dan CaSO4, air dan biang tahu, air garam dan CaSO4, dan
air garam dan biang tahu berturut-turut adalah 1.46%, 3.31%, 1.47%, dan 3.76%. Kadar protein tahu yang menggunakan pelarut air garam lebih tinggi dibanding tahu dengan pelarut air. Tahu yang menggunakan air biang tahu sebagai koagulan juga memiliki kadar protein dibandingkan dengan tahu yang menggunakan CaSO4.
Perlakuan beberapa macam metode pembuatan tahu, tidak berpengaruh nyata terhadap kadar lemak dan protein tahu.
Kadar karbohidrat pada tahu dengan penggunaan air dan CaSO4, air dan
biang tahu, air garam dan CaSO4, dan air garam dan biang tahu berturut-turut
8
Kadar Pati Resisten
Pati resisten dapat dideskripsikan sebagai sebagian kecil fraksi dari pati
yang tahan terhadap hidrolisis dengan perlakuan secara in vitro menggunakan α -amilase dan pullulanase. Pati resisten digolongkan karena tidak dapat dihidrolisis setelah melewati 120 menit masa pencernaan enzim. Kadar pati resisten pada tahu koro pedang dapat dilihat pada Tabel 2. Kadar pati resisten tahu koro berkisar antara 16.04% - 17.94%. Jenis perlakuan dengan penggunaan pelarut dan koagulan tidak berpengaruh terhadap kadar pati resisten.
Profil Fermentasi
Fermentasi in vitro dilakukan selama 36 jam dengan menggunakan C.butyricum BCC B2571 dan E.rectale DSM 17629. Sampel yang digunakan Tabel 1.Nilai nutrisi tahu yang disiapkan dengan pelarut dan koagulan berbeda
Komposisi (%) Kombinasi pelarut dan koagulan
Air &CaSO4 Air&Biang Garam&CaSO4 Garam&Biang
Air 20.83a 18.71b 19.44b 20.96a
Abu 1.69a 0.53b 2.92c 1.04b
Lemak 1.47a 1.42a 1.47a 1.69a
Protein 1.46a 3.31a 2.33a 3.76a
Karbohidrat 74.55 76.03 73.84 72.55
Angka pada baris yang sama diikuti oleh huruf berbeda menunjukkan perbedaan nyata (p<0.05) Gambar 1.Tahu Koro
Tabel 2.Kadar pati resisten tahu koro pedang Pelarut/Koagulan Kadar Pati resisten (%)
Air &CaSO4 17.94
a
Air & kecutan/biang 16.04a Air garam & CaSO4 16.20
a
Air garam & kecutan/biang 17.12a
9 adalah tahu koro dengan pelarut air garam dan koagulan air biang tahu sebagai pembanding digunakan pati komersial hi maize. Medium fermentasi mengalami penurunan pH. Penurunan pH terjadi pada jam ke 6 setelah fermentasi namun mengalami sedikit kenaikan pada jam ke 36. Hasil pengukuran pH dapat dilihat pada Gambar 1.Perubahan pH selama proses fermentasi tidak berbeda nyata antar tiap perlakuan.
Kecepatan tumbuh dan jumlah total bakteri dapat dilihat pada Tabel 3. Berdasarkan Tabel 3, diketahui bahwa kecepatan paling tinggi untuk bakteri C.butyricum BCC B2571 adalah pada medium dengan penambahan tahu koro daripada hi maize sebagai substrat fermentasi. Kecepatan tumbuh untuk E.rectaleDSM 17629 pada medium dengan penambahan tahu koro lebih lambat dibanding dengan penambahan hi maize.
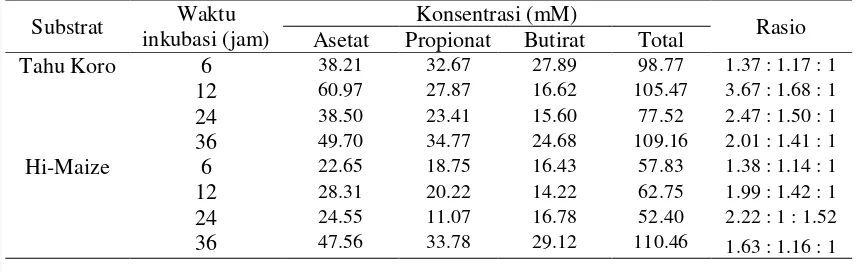
Profil ALRP tahu koro dan pati hi maize dengan dua jenis bakteri ditampilkan pada Tabel 4 dan 5.Pola produksi ALRP pada kedua jenis bakteri dan kedua jenis substrat menunjukkan kemiripan. Nilai tertinggi total ALRP pada tiap perlakuan terjadi pada jam ke 36, dengan asetat sebagai produk yang paling banyak dihasilkan dibanding dengan propionat dan butirat. Rasio komposisi ALRP mendekati nilai 3 : 1 : 1.
Gambar 2.Perubahan pH pada medium fermentasi
0
Tabel 3.Kecepatan tumbuh bakteri selama proses fermentasi
10
PEMBAHASAN
Nilai Nutrisi
Menurut Sridhar 2006, kadar air pada kacang koro pedang berkisar antara 3.8-13.5%. Kadar air untuk tahu dengan penggunaan air dan CaSO4, air dan biang
tahu, air garam dan CaSO4, dan air garam dan biang tahu berturut-turut adalah
20.83%, 18.71%, 19.44%, dan 20.96%. Proses pembuatan tahu meningkatkan kadar air karena mengalami proses penggilingan dengan penambahan air, kadar air pada tahu kedelai pun cukup tinggi yaitu 84.80% (Depkes RI 2005).Pada tabel, dapat diamati bahwa penambahan garam (garam dapur dan CaSO4) selama proses
pembuatan tahu, berpengaruh terhadap kadar air sampel. Tahu yang hanya menggunakan air sebagai pelarut dan air biang tahu sebagai koagulan memiliki kandungan air paling kecil dibandingkan dengan tahu dengan penambahan garam dapur maupun CaSO4 , hal ini dapat terjadi karena, molekul garam menarik
kandungan air dan meningkatkan kadar airpada sampel.
Penggunaan garam selama proses pembuatan tahu, berpengaruh pula terhadap kadar abu. Tahu dengan penggunaan campuran air garam dan CaSO4
memiliki kadar abu paling tinggi yaitu 2.92%. Hal ini dikarenakan unsur-unsur mineral pada garam ikut terserap dalam tahu selama proses perebusan, sehingga mampu meningkatkan kadar abu dalam tahu.
Kadar lemak kasar tahu koro yang didapat hanya sebesar 1.42-1.69%, sedangkan kadar lemak pada kacang koro pedang mentah adalah 0.2-12.1%
Tabel 4.Profil asam lemak rantai pendek hasil fermentasi C.butyricum BCC B2571 Substrat Waktu
inkubasi (jam)
Konsentrasi (mM)
Rasio Asetat Propionat Butirat Total
Tahu Koro 6 25.11 30.53 16.99 72.63 1.48 : 1.80 : 1
Tabel 5.Profil asam lemak rantai pendek hasil fermentasi E.rectaleDSM 17629 Substrat Waktu
inkubasi (jam)
Konsentrasi (mM)
Rasio Asetat Propionat Butirat Total
11 (Munip 2001, Sridhar 2006). Kadar lemak pada tahu koro lebih rendah dibandingkan dengan kadar lemak pada tahu kedelai yaitu sebesar 4.60% (Depkes RI 2005). Kandungan lemak yang rendah membuat kacang koro pedang berpotensi menjadi bahan pangan fungsional.
Penggunaan air garam sebagai pelarut berfungsi untuk membantu koagulasi protein karena kondisi garam berlebih akan mempengaruhi kelarutan protein dalam larutan, sehingga massa protein tidak terbuang bersama air dan membentuk tahu. Namun dapat dilihat pada tabel, bahwa tahu yang menggunakan air biang tahu sebagai koagulan memiliki kadar protein lebih tinggi dibandingkan dengan tahu yang menggunakan CaSO4dikarenakan air biang tahu merupakan whey atau
protein sampingan dari proses pembuatan tahu yang telah terfermentasi sehingga memiliki pH rendah.
Menurut Sridhar (2006), kadar protein kacang koro pedang adalah sekitar 22.8-35.3%. Selama proses pembuatan tahu, baik yang berbahan dasar kedelai maupun koro pedang terjadi penurunan kadar protein. Tahu kedelai memiliki kadar protein sebesar 7.80% (Depkes RI 2005).Kadar protein tahu yang didapat pada penelitian ini adalah 1.46-3.76%.
Penurunan kadar protein dapat terjadi karena denaturasi selama proses pemanasan dan pengotrolan pH. Suhu yang terlalu tinggi dapat mengubah konformasi protein, sehingga protein menjadi rusak. Menurut Gilang (2013), protein pada kacang koro pedang sebagian besar mudah terlarut dalam air sehingga metode perendaman dan perebusan tepung kacang koro dapat menurunkan kadar protein. Kondisi pH juga mempengaruhi massa protein pada tahu, sesuai dengan titik isoelektriknya yaitu 4-4.5 ( Windrati 2010). Pada kondisi tersebut kelarutan protein pada air akan menurun dan mengalami koagulasi. Nilai pH yang terlalu rendah atau terlalu tinggi, menyebabkan protein masih banyak terlarut dalam air dan ikut terbuang selama proses penyaringan.
Karbohidrat total pada kacang koro pedang adalah 45.8-65.4% (Sridhar 2006). Terjadi peningkatan kadar karbohidrattotal pada tahu koro menjadi 72.55-76.03%, namun tidak berbeda nyata antar perlakuan berbagai metode pembuatan tahu. Pada pengukuran karbohidrat total dengan metode selisih (by difference), penurunan kadar nutrisi lain dapat meningkatkan kadar karbohidrat secara proporsional. Tahu berbahan dasar kedelai lebih lembut dan kenyal karena memiliki sedikit karbohidrat dibandingkan dengan tahu koro, yaitu sebesar 1.60% (Depkes RI 2005). Namun kadar karbohidrat yang tinggi pada tahu koro menjadi nilai tambah karena berbanding lurus dengan kadar pati resistennya.
Kadar Pati Resisten
12
Kadar pati resisten pada tahu koro pedang (Tabel 2) didapat antara 16.04-17.94%. Kacang koro pedangdiketahui merupakan tanaman berkadar pati resisten tinggi, yaitu sekitar 10.8 g/100 g (Sridhar 2006). Dari hasil perhitungan pada tabel 2, dapat disimpulkan metode pembuatan tahu dapat meningkatkan kadar pati resisten pada kacang koro. Namun untuk masing-masing perlakuan tidak berbeda nyata (p<0.05) terhadap kadar pati resisten yang terbentuk. Hal ini menunjukkan bahwa jenis pelarut dan penambahan koagulan tidak mempengaruhi peningkatan kadar pati resisten.
Beberapa faktor diketahui dapat mempengaruhi kuantitas pati resisten diantaranya, jenis tanaman, sifat alami pati (rasio amilosa/amilopektin), pemrosesan makanan, dan keberadaan komponen lain (lipid, protein, serat, dan asam organik). Yang mempengaruhi peningkatan kadar pati resisten pada pemrosesan makanan adalah proses gelatinisasi-retrogradasi. Proses pemanasan dengan air dapat memicu terjadinya gelatinisasi dengan mengembangnya granula pati oleh penyerapan air karena peningkatan afinitas pati terhadap air. Pati tergelatinisasi menjadi tidak stabil dan dapat membentuk struktur kristal ketika didinginkan/dikeringkan(retrogradasi). Retrogradasi pati menghasilkan polimer rantai pendek yang tidak larut dan resisten terhadap enzim pencernaan (Wasserman 2007).
Kadar amilosa, dan kadar pati resisten memiliki korelasi positif. Kadar amilosa yang tinggi dapat mempengaruhi peningkatan terbentuknya pati resisten (Escarpa 1996). Kandungan amilosa pada kacang koro cukup tinggi, yaitusekitar 31.12% (Windrati 2010). Kristalisasi dari amilosa pada proses retrogradasi membuat pati menjadi resisten dan sulit untuk diakses oleh enzim dan mengurangi daya cerna nya (Sajilata 2006). Laju dan luasnya pati yang dapat terretrogradasi sehabis mengalami gelatinisasi bergantung pada jumlah amilosa yang ada. Proses pembuatan tahu mengalami pemanasan untuk mendapatkan sejumlah massa protein, namun hal tersebut juga memicu proses gelatinisasi pati. Tahu yang telah jadi kemudian disimpan dalam lemari pendingin untuk analisa berikutnya, hal ini pula memicu terjadinya proses retrogradasi pati.
Profil Fermentasi
Fermentasi in vitro dilakukan selama 36 jam dengan pemilihan C.butyricumBCC B2571 dan E.rectaleDSM 17629 sebagai bakteri model dikarenakan kedua bakteri tersebut merupakan bakteri yang umum dijumpai pada kolon dan mampu mendegradasikan pati serta menghasilkan asam butirat . Penggunaan substrat tahu koro dengan pelarut air garam dan koagulan air biang tahu pada fermentasi adalah karena pada analisis sebelumnya menunjukkan perlakuan beberapa metode pembuatan tahu tidak berpengaruh terhadap kadar pati resisten, sehingga diambil salah satu sampel saja untuk mewakili hasil fermentasi. Selain daripada itu, pemilihan koagulan air biang tahu, karena merupakan bahan yang umum di pakai pada industri tahu. Sebagai pembanding digunakan pati komersial hi maize. Bakteri kolon secara dominan tumbuh pada kondisi anaerob, sehingga perlu diberi perlakuan pemaparan gas CO2untuk mendukung
13 Selama proses fermentasi penurunan pH diamati. Secara umum, kondisi pH pada medium tidak hanya mempengaruhi pertumbuhan sel dan laju fermentasi, namun juga berpengaruh terhadap rendemen dan kemurnian produk. Perubahan pH juga dapat menginduksi pergeseran metabolik (Zhu 2004). Beberapa studi dilakukan untuk menentukan kondisi optimum untuk produksi asam butirat salah satunya, temperatur 35-37°C dan pH 4.5-7 (Zigova 2000). Nilai perubahan pH pada medium selama fermentasi ditunjukkan pada Gambar 1. Dapat diamati bahwa terjadi penurunan pH sehingga kondisi medium menjadi lebih asam.
Penurunan pH terjadi pada jam ke 6 setelah fermentasi namun mengalami sedikit kenaikan pada jam ke 36, penurunan pH menunjukkan bahwa fermentasi yang terjadi menghasilkan asam lemak rantai pendek. Perubahan pH selama proses fermentasi tidak berbeda nyata dikarenakan pada kisaran pH tersebut merupakan kondisi optimum pembentukan asam lemak rantai pendek (Robertfroid 2001). Menurut Sayer (2007), penurunan pH terjadi pada 3 jam sehabis fermentasi. Sayer juga mengatakan bahwa fermentasi karbohidrat menghasilkan penurunan pH dalam kolon, caecum, dan feses. Kondisi penurunan pH diyakini dapat mencegah pertumbuhan bakteri patogen dan produksi toksik berbahaya dalam kolon (Topping 2001). Penurunan nilai pH juga dapat membantu penyerapan kalsium dan magnesium.
Dilihat dari kecepatan tumbuh tersebut, kemungkinan pati resisten pada tahu koro lebih disukai oleh C.butyricumBCC B2571 dibandingkan oleh E.rectaleDSM 17629. Nilai total jumlah bakteri pada tabel menunjukkan jumlah C.butyricumBCC B2571 lebih sedikit daripada E.rectaleDSM 17629 dikarenakan menurut Dewi (2009), bakteri C.butyricum termasuk organisme rewel. Artinya bersifat sulit untuk tumbuh di lingkungan yang bukan habitat asalnya.
Pada medium C.butyricumBCC B2571 dengan penambahan 1% hi maize sebagai substrat fermentasi diketahui hanya memiliki waktu generasi40.31 jam/generasi, hal ini berbeda dengan hasil penelitian Dewi (2009) yaitu sebesar 3.62 jam/geneerasi namun dengan penambahan 2% pati hi maize. Dari hasil perbandingan tersebut, dapat disimpulkan bahwa konsentrasi penambahan substrat pati resisten berpengaruh terhadap kecepatan tumbuh bakteri. Secara umum pati resisten pada tahu koro pedang dapat dimanfaatkan dengan cukup baik sebagai sumber karbon oleh kedua jenis bakteri tersebut.
Fermentasi pati resisten oleh C.butyricumBCC B2571 dan E.rectaleDSM 17629 dalam kolon maupun dalam kondisi in vitro diketahui dapat menghasilkan asam lemak rantai pendek (ALRP). Asam lemak rantai pendek, merupakan asam lemak organik dengan 1 sampai 6 atom karbon yang muncul akibat fermentasi bakterial dari polisakarida, oligosakarida, protein, peptida, dan glikoprotein dalam kolon (Cummings 1991). Pati resisten memiliki aktifitas butirogenik, dan mampu menginduksi pembentukan butirat lebih baik daripada substrat (oligosakarida atau serat pangan) lainnya (Wang 1999).
14
sel kanker menjadi berkurang setelah diberi pakan kaya pati resisten (Le-Leu 2002).
Profil asam lemak diukur menggunakan kromatografi gas. Puncak yang muncul dalam kromatogram dilihat berdasarkan volatilitas dan perbedaan titik didih masing-masing senyawa. Produksi ALRP secara umum ditentukan oleh banyak faktor, diantaranya jumlah dan tipe mikroflora yang tersedia (Roberfroid 2005), sumber dan jenis substrat (Cook 1998), dan kondisi fermentasi (pH, waktu transit, suhu).
Pola produksi ALRP pada kedua jenis bakteri dan kedua jenis substrat menunjukkan kemiripan. Secara umum, produksi ALRP dengan susunan asetat > propionat > butirat, memiliki rasio molar mendekati 3:1:1 (Topping 2001). Berdasarkan nilai rasio yang terbentuk, hal ini sesuai dengan literatur tersebut. Kemiripan produksi ALRP pada kedua bakteri terjadi karena kedua jenis bakteri tersebut terdapat ordo yang sama, yaitu Clostrodiales dan terdapat pada klaster XIVa sehingga memiliki kemiripan gen (Mahowald 2009).
Produksi ALRP tertinggi untuk tahu koro dengan fermentasi C.butyricumBCC B2571 terbentuk pada jam ke 36 dengan jumlah asetat, propionat, butirat adalah 51.59, 35.57, 22.05 mM atau dengan rasio molar 2.34: 1.61: 1. Pada waktu fermentasi yang sama, E.rectaleDSM 17629 memproduksi ALRP tertingginya pada substrat tahu koro dengan jumlah asetat, propionat, butirat sebesar 49.70, 34.77, 24.68 atau dengan rasio 2.01: 1.41: 1. Produksi asetat tertinggi pada tahu koro terjadi pada fermentasi 24 jam dengan C.butyricumBCC B2571, yaitu sebesar 63.4395 mM. Berbeda dengan pati hi maize, asetat tertinggi (53.65 mM) diproduksi pada jam ke 36 oleh C.butyricumBCC B2571. Sedangkan produksi butirat tertinggi diproduksi oleh E. RectaleDSM 17629 dengan substrat hi maize pada 36 jam fermentasi sebesar 29.12. Perbedaan waktu fermentasi, jenis bakteri dan jenis substrat terbukti dapat mengubah jumlah produk fermentasi. Pada beberapa penelitian menunjukkan bahwa pemberian kadar glukosa yang berbeda dapat meningkatkan kadar ALRP (Devega 2011). Secara struktur, glukosa lebih mudah diakses oleh enzim bakteri dibandingkan dengan pati resisten yang lebih kompleks. Dalam tubuh glukosa yang sampai pada kolon berasal dari fermentasi selulosa, terbatas jumlahnya. Sehingga perlu asupan pati resisten untuk meningkatkan produksi ALRP dalam usus.
Kemurnian bakteri juga dapat mempengaruhi produksi ALRP. Penelitian yang dilakukan oleh zhao (2009) menggunakan pati jagung hi maize sebagai substrat dan ekstrak feses sebagai sumber inokulum menghasilkan asetat, propionat, dan butirat sebesar 4-18, 2-18, 1-16 mM. Jumlah ALRP tersebut yang dihasilkan lebih kecil dibanding dengan ALRP pada penelitian ini. Kemungkinan terjadinya kompetisi untuk mendapatkan sumber karbon berhubungan dengan kemurnian bakteri sebagai sumber inokulum.
15 jalur asetat, 2 molekul asetat diproduksi dari satu molekul glukosadan menghasilkan 2 ATP, sehingga terbentuk 4 ATP selama konversi glukosa menjadi asetat (Zhang 2009). Ketika pertumbuhan memasuki akhir fasa eksponensial, produksi asetat menurun dan sebagian dikonversi menjadi butirat Pada jalur CoA transferase. Propionat dibentuk dari glukosa dengan cara fiksasi CO2melalui jalur
suksinat atau melalui jalur akrilat.
Hasil fermentasi menunjukkan bahwa pati resisten dari tahu koro berpotensi sebagai pangan fungsional karena mampu menjadi substrat dan menstimulasi pertumbuhan dan bakteri kolon penghasil butirat. Keberadaan butirat sebagai hasil fermentasi menjadi ciri pangan fungsional yang bertujuan untuk menjaga kesehatan organ kolon. Bahan pangan yang tidak tercerna dan mampu memodifikasi komposisi mikroflora menguntungkan pada usus besar dikenal sebagai prebiotik (Gibson 1995).
SIMPULAN
Perlakuan kombinasi jenis pelarut dan koagulan tahu tidak berpengaruh terhadap kadar nutrisi dan kadar pati resisten tahu koro. Pati resisten pada tahu koro pedang dapat menjadi substrat pertumbuhan bakteri C.butyricumBCC B2571 dan E.rectaleDSM 17629 yang ditandai dengan penurunan pH dan peningkatan populasi bakteri. Produksi dan komposisi ALRP pada kedua jenis substrat dan kedua jenis bakteri memiliki kesamaan. ProduksiALRP tertinggi hasil fermentasi tahu koro dengan bakteri C.butyricumBCC B2571 danE.rectaleDSM 17629 adalah pada jam ke-36.
SARAN
Proses pembuatan tahu sebaiknya dilakukan pencampuran kacang kedelai dengan kacang koro pedang untuk meningkatkan kandungan nutrisi dan memperbaiki teksturnya. Pengontrolan pH selama proses pembuatan tahu juga perlu dilakukan untuk mencegah berkurangnya kandungan protein sehingga massa protein pada tahu dapat meningkat. Selama proses fermentasi, waktu fermentasi sebaiknya diperpanjang untuk mengetahui waktu optimum produksi asam lemak rantai pendek. Penggunaan mikroorganisme campuran dari saluran pencernaan selama proses fermentasi juga dapat digunakan untuk mensimulasikan pengaruh tahu koro terhadap produksi asam lemak rantai pendek dan perubahan komposisi mikroorganisme yang terjadi. Penelitian in vivoperlu dilakukan untuk melihat efek fisiologis tahu koro secara langsung.
DAFTAR PUSTAKA
Astawan M, dan Mita W. 2003. Teknologi Pengolahan Pangan Nabati Tepat Guna. Jakarta: Akademika Pressindo.
16
Bird AR, Brown IL, Topping DL. 2000. Starches, resistant starches, the gut microflora and human health. Curr Issues Intest Microbiol 1: 25-37.
Cook SI, Sellin JH. 1998. Review article: short chain fatty acid in health and disease. Aliment Pharmacol Ther, 12: 499-507
Cummings JH, Macfarlane GT. 1991. The controland consequences of bacterial fermentation in the human colon. J Appl Bacteriol, 70: 443-459
Depkes RI. 2005. Daftar Komposisi Bahan Makanan. Bharata Karya Aksara, Jakarta.
Devega M. 2011. Short chain fatty acid (SCFA) profile produced by Clostridium butyricum grown on medium containing type 3 resistant starch (RS 3) of sweet potato [Skripsi]. Fateta, IPB, Bogor
Dewi PP. 2009.Mempelajari pertumbuhan Clostridium butyricumpada pati resistan beras dan sagu serta profil asam lemak rantai pendek yang dihasilkannya [Skripsi]. Fateta, IPB, Bogor.
Escarpa A, Gonzalez MC, Manas E, Garcia-Diz L, and Saura-Calixto F. 1996. Resistant starch formation: standardization of a high-pressure autoclave process.J. Agri. Food Chem. 44 pp: 924-928
Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonie microbiota: introducing the concept of prebiotics. J Nutr 125: 1401-1412. Gilang R, Dian RA, Dwi I. 2013. Karakteristik fisik dan kimia tepung koro
pedang (Canavalia ensiformis) dengan variasi perlakuan pendahuluan. Jurnal Teknosains Pangan 2(3): 34-42.
Goni I, Garcia-Diz L, Manas E, Calixto FS. 1996. Analysis of resistent starch: a method for foods and food products. Food Chem Vol. 56 (4), pp. 445-449 Haliza Winda, Endang Y Purwani, dan Ridwan Thahir. 2007. Pemanfaatan
Kacang-Kacangan Lokal Sebagai Substitusi Bahan Baku Tempe dan Tahu. Buletin Teknologi Pascapanen Pertanian vol. 3: 1-8.
Hasanuddin A, J R Hidajat dan S Partohardjono. 2002. Kebijakan Program Penelitian Tanaman Kacang-kacangan Potensial dalam Pengembangan Kacang-kacangan Potensial Mendukung Ketahanan Pangan. Badan Penelitian Dan Pengembangan Pertanian. Pusat Penelitian Dan Pengembangan Tanaman Pangan. Hal : 1-12.
KimYJ, et al. 2005. Anticancer effects of oligomeric proanthocyanidins on human colorectal cancer cell line, SNU-C4. World J Gastroenterol 11: 4674-4678.
Le-Leu RK, Hu Y, Young GP. 2002. Effects of resistant starch and nonstarch polysaccharides on colonic luminal environment and genotoxin-induced apoptosis in the rat. Carcinogenesis 23: 713-719.
Leszczynski Waclaw. 2004. Resistant Starch-Classification, Structure, Production. Pol J Food Nutr Sci vol 13(54) : 37-50.
Louis P, Duncan SH, McCrae SI, Millar J, Jackson MS, and Flint HJ. 2004. Restricted distribution of the butyrate kinase pathway among butyrate-producing bacteria from the human colon. J Bacteriol 186: 2099–2106
17 Munip A. 2001. Potensi Tanaman Koro Pedang (Canavalia sp) dalam Upaya
Meningkatkan Kegiatan Agribisnis.Simposium Nasional Perhimpunan Ilmu Pemuliaan Tanaman Indonesia.Yogyakarta.
Murphy Mary M, Judith Spungen D, Anne Birkett. 2008. Resistant starch intakes in the United States. J Am Diet Assoc. Vol 108:67-78.
Purwani EY, Suhartono MT. 2009. Study on resistant starch type 3 derived from rice and sago as functional food ingredient with capability to prevent colorectal cancer (CRC) disease. Final Report. Indonesian Danone Institute Foundation, Jakarta.
Roberfroid, M. B. 2001. Prebiotics : Preferential substrates for spesific germs?. Am J. Clin Nutr 2001;73 (suppl) : 406S–9S.
Robertfroid MB. 2005. Introducing inulin-type fructans. Brit J Nutr, 93: S13-S25 Sajilata MG, Singhal RS, Kulkarni PR. 2006.Resistant starch - A review.Comp
Rev Food Sci Food Safety5:1-17.
Sayer S, Jannink J, and White PJ. 2007. Digestion residues of typical and high-α -Glucan oat flours provide substrates for in vitro fermentation. J Agri Food Chem55 : 5306 - 5311
SNI 01-2891-1992. Cara uji makanan dan minuman. Standar Nasional Indonesia Sridhar K R, S Seena. 2006. Nutritional and Antinutritional Significance of Four
Unconventional Legumes of The Genus Canavalia-A Comparative Study. Food Chemistry vol 99 : 267-288.
Sumarjan, 2004.Laporan Pengembangan Konservasi Plasma Nutfah.Koleksi Plasma Nutfah Tanaman Pangan di Nusa Tenggara Barat. Program Studi Pemuliaan Tanaman. Fakultas Pertanian. Universitas Mataram.
Topping DL, Clifton PM. 2001. Short-chain Fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol Rev, 81: 1031-1064.
Wang X. 1999. In vitro utilization of Amylopectin and High-Amylose Maize (Amylomaize) Starch Granules by human colonic bacteria.J Applied and Microbiol p. 4848-4854.
Wasserman LA, Signorelli M, Schiraldi A, Yuryev V, Boggini G, Bertini S, and Fessas S. 2007. Preparation of wheat resistant starch : treatment of gels and DSC characterization. J Therm Anal Vol 87 1 : 153 - 157
Windrati W S, Ahmad N,Puspa DA. 2010. Sifat nutrisional protein rich flour (PRF) koro pedang (Canavalia ensiformis L.). Agrotek vol 4, no. 1: 18-26. Wronkowska M, Soral-Smietana M, Bielecka M, Biedrzycka E. 2002.
Physically-modified Wheat or Potato Starches, their phsyco-chemical properties and metabolism by Bifidobacteria.Zywnose vol 4 : 74-83.
Zhang CH, Yang H, Yang F. 2009. Current progress on butyric acid production by fermentation.Curr Microbiol 59:656–663.
Zhao XH, Yang L. 2009. The impact of coupled acid or pullulanase debranching on the formation of resistant starch from maize starch with autoclaving-cooling cycles.Eur Food Res Technol 230:179-184
Zhu Y, Yang ST. 2004. Effect of pH on metabolic pathway shift in fermentation of xylose by Clostridium tyrobutyricum. J Biotechnol 110:143-157.
18
Lampiran 1. Bagan rancangan umum penelitian
Lampiran 2. Komposisi mediumPYG dalam 1 L
Bahan-bahan Jumlah
Tripton 5.0 g
Pepton 5.0 g
Yeast Extract 10.0 g
Beef Extract 5.0 g
Glukosa 5.0 g
K2HPO4 2.0 g
Tween 80 1.0 ml
Resazurin 1.0 mg
Larutan campuran mineral 40.0 ml
Larutan Haemin1 10.0 ml
Vitamin K2 0.2 ml
Cys-HCl 0.5 g
Soluble starch/sampel 10.0 g
Lampiran 3.Komposisi larutan campuran mineral
Mineral Jumlah
CaCl2 0.25 g
MgSO3 0.5 g
K2HPO4 1.0 g
KH2PO4 1.0 g
NaHCO3 10.0 g
NaCl 2.0 g
Akuades 1000 ml
Pembuatan tahu koro pedang
Fermentasi
Penentuan pH dan kadar ALRP Penentuan jumlah koloni bakteri
Analisis kadar pati resisten Uji Proksimat
19
Lampiran 4. Komposisi medium RCM dalam 1 L
Bahan-bahan Jumlah
Yeast Extract 3.0 g
Beef Extract 10.0 g
Pepton 10.0 g
Glukosa 5.0 g
Soluble stach / Sampel 10.0 g
NaCl 5.0 g
CH3COONa 3.0 g
Cys-HCl 0.5 g
Lampiran 5.Perubahan pH pada fermentasi oleh C.butyricum BCC B2571
Substrat pH jam ke-
0 6 36
Tahu koro 6.8 4.23 4.37 Pati hi maize 6.8 4.26 4.27
Lampiran 6.Perubahan pH pada fermentasi E.rectaleDSM 17629
Substrat pH jam ke-
0 6 36
20
Lampiran 7.Contoh kromatogram standar asam lemak rantai pendek
Senyawa BM (g/mol) konsentrasi (g/L) konsentrasi (mM) Luas area
Asetat 60.05 10.6 176.31 185046
Propionat 74.00 10.4 141.00 465537
Butirat 88.10 10.5 119.18 708143
Contoh perhitungan : Konsentrasi asetat(mM), Konsentrasi = 10.6 /�
60.05 /
21 Lampiran 8. Contoh perhitungan konsentrasi sampel
Kode sampel Senyawa Luas area Konsentrasi (mM)
PK12E1 Asetat 211811 25.50
Propionat 557034 27.67
Butirat 810952 17.30
Contoh perhitungan :
Konsentrasi Sampel = Luas area sampel− standar
luas area standar X konsentrasi standar
Konsentrasi asetat (mM) = (211811−185046 )
185046 X 176.31 mM= 25.50 mM
Konsentrasi propionat (mM) = (557034−465537 )
465537 X 141.00 mM= 27.67 mM
Konsentrasi butirat (mM) = (810952−708143 )
22
RIWAYAT HIDUP
Penulis memiliki nama lengkap, Luqmanul Hakim.Lahir pada tanggal 21 Agustus 1990 di Bogor dan merupakan putra tertua dari pasangan Sugiono dan Mindri Setyowati serta memiliki 4 orang adik bernama, M Syamil Hizbi, Syahidah Fathia R, M Hilmi Fakhruddin, dan M Abzari Huda. Penulis menempuh pendidikan di SDN Mekarjaya 8 (1996-2002), SMPN 3 Depok (2002-2005), dan SMAN 104 Jakarta (2005-2008). Pada tahun 2009, penulis melanjutkan pendidikan sarjana di IPB melalui jalur SNMPTN dan diterima sebagai mahasiswa Biokimia Fakultas Matematika dan IPA.
Selama masa perkuliahan, penulis beberapa kali menjadi asisten praktikum mikrobiologi dasar (2010-2012). Penulis juga aktif mengikuti berbagai macam kepanitiaan seperti Lomba Karya Ilmiah Populer (LKIP) Pesta Sains (2010 dan 2011), Seminar Kesehatan Biokimia (2010), dan IPB Deducation for Education (IDEA) (2011). Penulis melaksanakan praktik lapangan di Pusat Penelitian Biologi LIPI, Cibinong, Bogor pada tahun 2012 dengan laporan praktik berjudul