PENGGUNAAN PROTEIN NABATI
DENGAN DAN TANPA PENAMBAHAN ENZIM FITASE
SEBAGAI BAHAN BAKU PAKAN IKAN
LELE DUMBO (
Clarias
sp)
ASLINDA NUR MAZIDA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Penggunaan Protein Nabati Dengan dan Tanpa Penambahan Enzim Fitase Sebagai Bahan Baku Pakan Ikan Lele Dumbo (Clarias sp) adalah benar hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2007
Aslinda Nur Mazida
ABSTRAK
ASLINDA. Penggunaan Protein Nabati Dengan dan Tanpa Penambahan Enzim Fitase sebagai Bahan Baku Pakan Ikan Lele Dumbo (Clarias sp). Dibimbing oleh M. Agus Suprayudi dan Ing Mokoginta.
Penelitian ini bertujuan untuk mengevaluasi protein nabati dengan dan tanpa penambahan enzim fitase dalam pakan ikan Lele Dumbo (Clarias sp). Percobaan ini terdiri dari 4 (empat) perlakuan dan 3 (tiga) ulangan dimana 2 (dua) perlakuan (A1+enzim dan B1KSM+enzim) ditambahkan enzim fitase sebanyak 0,02% (1000 unit/kg pakan) dan 2 (dua) perlakuan lainnya (A1 and B1KSM) tanpa
ABSTRACT
ASLINDA. Utilization of plant protein with or without phytase enzyme supplementation as feed ingredient of catfish (Clarias sp). Under direction of M. AGUS SUPRAYUDI and ING MOKOGINTA
This experiment was aimed to evaluate plant protein with or without fitase supplementation in feed of catfish (Clarias sp). This experiment used factorial design, with two factors. The first factor are soybean meal based diet (A1) and soybean meal plus cotton seed meal diet (B1KSM), second factor are fitase supplemented and non supplemented diets. Six fish with mean body weight of 27 gram were reared in 50 x 40 x 35 cm aquarium. Fish fed three times a day to satiation for 60 days. Results of the experiment showed that fitase suplementation of 0,02 % (1000 unit kg-1 feed) to A1 and B1KSM base diet increased significantly digestibility of total feed, phosphorus and protein. However the protein retention and growth rate of fish were not increased by dietary fitase suplementation.
PENGGUNAAN PROTEIN NABATI
DENGAN DAN TANPA PENAMBAHAN ENZIM FITASE
SEBAGAI BAHAN BAKU PAKAN IKAN
LELE DUMBO (
Clarias
sp)
ASLINDA NUR MAZIDA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Penggunaan Protein Nabati Dengan dan Tanpa Penambahan Enzim Fitase sebagai Bahan Baku Pakan Ikan Lele Dumbo (Clarias sp)
Nama : Aslinda Nur Mazida
NIM : C151040181
Disetujui, Komisi Pembimbing
Dr. M. Agus Suprayudi Prof. Dr. Ing Mokoginta
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Perairan
Prof. Dr. Enang Harris Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia serta ridho-Nya penulis dapat menyelesaikan tesis yang berjudul Penggunaan Protein Nabati Dengan dan Tanpa Penambahan Enzim Fitase sebagai Bahan Baku Pakan Ikan Lele Dumbo (Clarias sp.).
Pelaksanaan penelitian dan penulisan tesis ini tidak terlepas dari bantuan dan bimbingan berbagai pihak. Pada kesempatan ini penulis menyampaikan terimakasih yang sebesar-besarnya kepada:
1. Bapak Dr. M. Agus Suprayudi, M.Si dan Ibu Prof. Dr. Ing Mokoginta, M.Si selaku komisi pembimbing atas pengarahan dan bimbingannya selama penelitian dan penulisan tesis ini sehingga dapat diselesaikan dengan baik. 2. Bapak Dr. Chairul Muluk, Bapak Dr D. Djokosetiyanto, Bapak Dr. Dedi
Jusadi dan Bapak Dr. Odang Carman atas saran, nasihat dan dukungannya selama penulis melaksanakan pendidikan dan penelitian.
3. Bapak Dekan Sekolah Pascasarjana IPB beserta staf, Bapak Dekan Fakultas Perikanan dan Ilmu Kelautan beserta staf, Bapak Ketua Ps. Ilmu Perairan dan staf, Bapak Ketua Dept. Budidaya Perairan yang telah memberikan kesempatan dan mengijinkan kepada penulis untuk mengikuti program pasca sarjana di Institut Pertanian Bogor.
4. Ketua dan staf : Laboratorium Nutrisi Ikan, Laboratorium Lingkungan Budidaya Perairan, Laboratorium Kesehatan Ikan Budidaya Perairan, Laboratorium Genetika dan Pengembangbiakan ikan Budidaya Perairan, Laboratorium Nutrisi Ternak serta Laboratorium Limnologi Manajemen Sumberdaya Perairan Institut Pertanian Bogor atas penggunaan fasilitas. 5. Bapak Wasjan, Bapak Ranta, Bapak Jajan Ruhyana, Ibu Lina Mulyani, Ibu
Desi Damayanti, Ibu Dian (Staf Lab. Nutrisi Ternak) yang telah membantu penulis dalam penyediaan fasilitas hingga terlaksannya penelitian dan penulisan tesis ini.
penulis berada di rantau untuk menyelesaikan studi, serta kakak-kakak dan adik-adiku tercinta yang selalu mendukung penulis.
7. Agus Yulianto dan keluarga yang telah banyak memberikan bantuan selama ini hingga penulis mampu menyelesaikan penelitian dengan baik.
8. Teman-teman S2 angkatan 2004 (Tarsim, Mohamad Amin, Agustina, Asprin Tamba, Yulisman, Asman Bahara, Dian Hardianto, Charles, Dodi Hermawan, Massenreng, Zainal Abidin, Moh. Hatta, dan Eva Ayuzar) dan Adi Susanto atas segala bantuan dan kerjasamanya.
9. Rekan-rekan S3 angkatan 2004, rekan-rekan S2 dan S3 angkatan 2005 atas segala bantuan dan kerjasamanya.
Semoga tesis ini bermanfaat bagi penulis dan bagi pihak yang memerlukannya.
Bogor, Maret 2007
RIWAYAT HIDUP
DAFTAR ISI
Halaman
Daftar Tabel ... ix
Daftar Gambar ... x
Daftar Lampiran ... xi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA Kebutuhan Protein Ikan Lele (Clarias sp) ... 4
Bahan Baku Pakan ... 4
Zat Anti Nutrien ... 8
BAHAN DAN METODA Pakan ... 13
Pemeliharaan Ikan dan Pengumpulan Data ... 14
Analisis Kimia ... 15
Uji Kecernaan Pakan ... 16
Histologi Hati ... 16
Total Ammonia Nitrogen (TAN) ... 16
Analisis Statistik ... 17
HASIL DAN PEMBAHASAN Hasil ... 18
Pembahasan ... 25
SIMPULAN DAN SARAN Simpulan ... 28
Saran ... 28
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Tabel Halaman
1 Daya cerna dan faktor-faktor pembatas berbagai jenis bahan nabati .... 5 2 Kandungan fosfor dan fosfor-fitat (P-fitat) pada beberapa bahan pangan 9 3 Komposisi bahan dan analisa proksimat pakan pada setiap perlakuan .. 13 4 Nilai kecernaan fosfor dan protein serta limbah P selama penelitian .... 19 5 Komposisi proksimat tubuh dan hati ... 19 6 Nilai rata-rata retensi protein (RP), retensi lemak (RL), laju pertumbuhan
DAFTAR GAMBAR
Gambar Halaman
1 Mio-inositol heksafosfat (asam fitat) ... 8 2 Struktur gossypol (polyphenol) ... 11 3 Bobot rata-rata individu ikan Lele Dumbo (Clarias sp) selama
penelitian ... 18 4 Kadar protein tubuh pada perlakuan SBM dan SBM+KSM dengan dan
tanpa penambahan enzim fitase ... 20 5 Kadar lemak tubuh pada perlakuan SBM dan SBM+KSM dengan dan
tanpa penambahan enzim fitase ... 20 6 Kadar protein hati pada perlakuan SBM dan SBM+KSM dengan dan
Tanpa penambahan enzim fitase ... 21 7 Retensi protein pada perlakuan SBM dan SBM+KSM dengan dan
tanpa penambahan enzim fitase ... 22 8 Retensi lemak pada perlakuan SBM dan SBM+KSM dengan dan
tanpa penambahan enzim fitase ... 23 9 Laju pertumbuhan harian pada perlakuan SBM dan SBM+KSM dengan
dan tanpa penambahan enzim fitase ... 23 10 Konsumsi pakan pada perlakuan SBM dan SBM+KSM dengan dan
DAFTAR LAMPIRAN
Lampiran Halaman
1 Analisis kadar air (Takeuchi, 1988) ... 33
2 Analisis kadar protein (metode Semi Micro Kjeldahl) (Takeuchi,1988) 34 3 Analisis kadar lemak (metode ether ekstraksi) (Takeuchi ,1988) ... 35
10 Data bobot individu ikan Lele Dumbo (Clarias sp) pada awal dan akhir pengamatan ... 42
11 Kecernaan P (%) setiap perlakuan ... 43
12 Fosfor (P) yang terkandung dalam tulang (%) setiap perlakuan ... 43
13 Kecernaan protein pakan (%) setiap perlakuan ... 44
14 Ekskresi total ammonia nitrogen (TAN) setiap perlakuan... 44
15 Hasil analisis proksimat tubuh awal dan akhir ikan Lele Dumbo (Clarias sp) (% bobot kering) yang dipelihara selama 60 hari ... 45
16 Analisa protein dan lemak hati ikan Lele Dumbo (Clarias sp) (% bobot kering) tiap perlakuan ... 46
23 Laju pertumbuhan harian (LPH), efisiensi pakan (EP) dan konsumsi pakan (KP) ikan lele dumbo (Clarias sp) selama 60 hari pemeliharaan 49 24 Analisis sidik ragam retensi protein ... 50
PENDAHULUAN
Latar Belakang
Penggunaan bahan-bahan nabati sebagai sumber protein pakan ikan dibatasi oleh keberadaan anti nutrien seperti protease inhibitor, fitat, saponin, tanin, lektin, gossypol, cyclopropenoid, dan lain-lain. Tepung bungkil kedelai dan tepung biji kapuk merupakan salah satu bahan nabati yang dapat digunakan sebagai sumber protein pakan ikan.
Kualitas protein tepung bungkil kedelai mempunyai profil asam amino yang terbaik dibanding semua tepung nabati. Menurut Andayani (1981), kualitas protein kedelai hampir mendekati kualitas protein hewani. Hertrampf dan Felicita (2000) mengungkapkan bahwa asam amino pembatas pada tepung bungkil kedelai adalah metionin dan sistein, sedangkan arginin dan phenilalanin mempunyai jumlah yang cukup. Selain itu tepung bungkil kedelai merupakan sumber vitamin B.
Kandungan protein kasar dari tepung biji kapuk dan kapas termasuk tinggi sedangkan serat kasarnya merupakan faktor pembatas penggunaannya dalam pakan. Asam amino pembatas dari tepung tersebut adalah lysine dan metionin. Kandungan fosfor, potasium dan besi termasuk tinggi dan merupakan sumber vitamin B yang lebih baik dari tepung bungkil kedelai. Pada hewan ruminansia kecernaan tepung biji kapuk dan kapas sekitas 61%, untuk ikan lele kecernaan nyata berkisar antara 71,2 – 90,6% sedangkan kecernaan semu pada ikan common carp antara 46,5 – 87,3% (Hertrampf dan Felicita, 2000).
nama umum dari polyphenol yang terdapat dalam jaringan tanaman yang bergenus Gossypium dan pada beberapa famili Malvaceae seperti pada tanaman kapas dan kapuk. Asam-asam phenolic yang terdapat dalam gossypol dapat membentuk senyawa komplek dengan protein serta menghambat kerja enzim proteolitik seperti trypsin dan pepsin (Morgan, 1989; Cai et al. 2004). Gossypol terdapat dalam bentuk terikat maupun bebas. Gossypol bebas sangat toksik dan dapat terakumulasi dalam hati, jantung, alat reproduksi, abomasum dan ginjal (Morgan, 1989). Gossypol menjadi tidak toksik apabila dicampur dengan ferro sulfate (FeSO4.7H2), dimana ferro sulfate berfungsi untuk menghambat efek
toksik dari gossypol bebas (Hertrampf dan Felicitas, 2000).
Untuk mencegah terjadinya beberapa kekurangan kandungan nutrien dari salah satu sumber protein nabati, dilakukan penambahan asam amino ke dalam pakan dan kombinasi penggunaan bahan nabati yang berbeda untuk memenuhi keseimbangan nutriennya (Nwanna et al., 2005). Penelitian yang telah dilakukan oleh Akiyama et al. (1995), memperlihatkan bahwa kombinasi tepung gandum dan tepung bungkil kedelai pada perbandingan 30:30 dapat memaksimalkan performa (keragaan) benih gelondongan rainbow trout pada level yang sama dengan kontrol yang menggunakan sumber protein tepung ikan yang tinggi. Penggunaan tepung biji kapas diatas 15% dapat menggantikan tepung bungkil kedelai sedangkan penggunaan diatas 30% dengan penambahan lysin dapat digunakan sebagai pakan ikan channel catfish (Robinson dan Li, 1994).
Salah satu cara yang digunakan untuk membebaskan fosfor dalam bentuk fitat yaitu dengan menggunakan enzim fitase. Fitase secara kimia dikenal dengan nama myo-inositol-hexaphosphate phosphohydrolase yang dihasilkan oleh mikroorganisme atau terdapat juga pada beberapa bahan tanaman. Selain mampu membebaskan fosfor, fitase mampu melepaskan mineral-mineral lain yang terikat pada bahan nabati yang sekaligus mereduksi polusi fosfor ke lingkungan.
Nwanna (2004) menghasilkan pertumbuhan yang tinggi secara nyata pada ikan tilapia apabila pakan diberi fitase sebesar 800 unit per kilogram pakan.
Tujuan
TINJAUAN PUSTAKA
Kebutuhan protein ikan lele (Clarias sp)
Kebutuhan protein ikan lele berkisar antara 25-40%, lemak 9,5-10%, karbohidrat 15-30%, vitamin 0,25-0,40% dan mineral 1,0%,masing-masing untuk semua ukuran (Sahwan, 1999), dengan energi 2000 kal/g sampai 3000 kal/g. Suhenda (1988) menyatakan bahwa protein 40% dan energi 3000 kal/g dapat digunakan untuk budidaya intensif ikan lele dengan bobot 1,5 gram..
Setiap spesies ikan membutuhkan kadar protein yang berbeda untuk pertumbuhannya dan dipengaruhi oleh umur/ukuran ikan, namun pada umumnya ikan membutuhkan protein sekitar 35 – 50% dalam pakannya (Hepher, 1990). Secara umum kadar protein yang paling baik untuk ikan lele (Clarias batrachus Linn) dengan bobot 1 gram sekitar 40% dengan menggunakan kasein dan gelatin sebagai sumber protein dengan kandungan protein pakan sekitar 3000 kkal/kg pakan (Nursyam, 1991). Menurut Hasan (2000) bahwa kebutuhan protein kasar Clarias batrachus sekitar 30% sedangkan Clarias gariepinus sekitar 40% dengan energi total 18,6 kJ/g dan rasio energi protein 21,5 mg/Kj.
Bahan baku pakan
Sumber protein dalam pakan berasal dari bahan murni, semi murni dan sumber alami. Budidaya pembesaran pada umumnya menggunakan sumber alami baik hewani maupun nabati sebagai sumber proteinnya, sedangkan pakan larva sering digunakan kombinasi bahan murni, semi murni dan alami sebagai pakan praktis. Beberapa sumber protein pakan yang dapat digunakan dari setiap sumber protein mempunyai kelebihan dan kekurangan masing-masing (Tabel 1).
1. Tepung ikan (fish meal/FM)
Selanjutnya Lovell (1989) mengungkapkan bahwa tepung ikan mengandung 60-80% protein yang hampir 80-95% dapat dicerna oleh ikan serta memiliki nilai lisin dan methionin yang tinggi yaitu dua asam amino yang jumlahnya sedikit pada bahan-bahan pakan yang berasal dari tumbuhan.
Kandungan enegi tepung ikan tergantung pada kandungan protein dan lemaknya. Kecernaan energi tepung ikan pada hewan akuatik dan hewan darat tidak terlalu berbeda. Pada ikan channel catfish, kecernaan energi tepung ikan sekitar 3,906 kcal/kg (Hertrampf dan Felicitas, 2000).
Tabel 1. Daya cerna dan faktor-faktor pembatas berbagai jenis bahan nabati
•Dapat dicerna oleh ikan lele 71,2 – 90,6% •Arginin dan phenilalanin
jumlahnya banyak
Kandungan mineral tinggi •AA pembatas isoleusin, methionin dan sistein
2. Tepung biji kapuk (kapook seed meal/KSM)
minyak campuran sebagai bahan baku pembuatan sabun sedangkan bungkil kapuk digunakan sebagai bahan pembuat pupuk. Selain itu, biji dan bungkil biji kapuk dapat digunakan sebagai bahan campuran pakan ternak.
Tepung biji kapuk dan tepung biji kapas memiliki kandungan anti nutrisi yaitu gossypol, cycloproprenoid acid (malvalic dan sterculic acids), phytic acid, phytoestrogen dan antivitamin (Hertrampf dan Felicitas (2000); Francis et al. (2001)). Kandungan protein kasar dari tepung biji kapuk dan kapas termasuk tinggi sedangkan serat kasarnya merupakan faktor pembatas penggunaannya dalam pakan. Untuk tingkat kecernaan energinya lebih rendah karena tingginya kandungan serat dalam bahan. Kandungan lemak yang terkandung dalam bahan tersebut sangat baik dicerna dibandingkan kecernaan karbohidratnya.
Pada hewan ruminansia kecernaan tepung biji kapuk dan kapas sekitas 61%, untuk ikan lele kecernaan nyata berkisar antara 71,2 – 90,6% sedangkan kecernaan semu pada ikan common carp antara 46,5 – 87,3%. Tepung ini memiliki kandungan asam amino lisin yang rendah, hal ini disebabkan proses pelarutan ekstraksi minyak dan adanya gossypol yang mengikat lisin.
3. Tepung bungkil kedelai (soybean meal/SBM)
Kedelai merupakan bahan baku yang sangat baik mutu proteinnya bila dibandingkan dengan tanaman kacang-kacangan lainnya. Tepung bungkil kedelai merupakan hasil sampingan (by-product) dari kacang kedelai setelah minyak kedelainya diambil. Tepung bungkil kedelai banyak digunakan sebagai salah satu sumber protein yang dapat menggantikan seluruh atau sebagian tepung ikan dalam pembuatan pakan. Selain kandungan proteinnya yang tinggi, juga ketersediaannya yang masih melimpah (Hertrampf dan Felicitas, 2000).
Francis et al. (2001) menyatakan bahwa tepung bungkil kedelai memiliki kandungan anti nutrisi yaitu protease inhibitors, lektin, phytic acid, saponin, phytoestrogen, antivitamin dan allergens. Anti nutrisi ini dapat mempengaruhi penggunaan dan pencernaan protein, penggunaan mineral, antivitamin dan bersifat racun. Selanjutnya Lovell (1989) menyatakan bahwa tepung kedelai mengandung beberapa faktor anti nutrien yaitu zat yang dapat menghambat bekerjanya enzim tripsin, tetapi dengan pemanasan pada suhu 105oC selama 10-20 menit, zat tersebut dapat rusak dan dihilangkan. Menurut Shimeno et al. (1992) bahwa pemakaian tepung kedelai yang telah dipanaskan akan memperbaiki tingkat pemanfaatan pakan dan pertumbuhan ikan rainbow trout.
Tingkat kecernaan energi tepung bungkil kedelai pada ikan umumnya berkisar antara 2,572 – 3,340 kkal/kg. Tingkat kecernaan semua protein kasar tepung bungkil kedelai lebih baik pada udang yaitu 91,1% dibanding dengan tingkat kecernaan semua ikan (84,9%), namun demikian residu lemak dari tepung bungkil kedelai dapat dicerna lebih baik oleh ikan (88,6%) dibanding udang (78,6%) (Hertrampf dan Felicitas, 2000).
4. Tepung daging dan tulang (meat and bone meal/MBM)
Tepung daging dan tulang merupakan salah satu sumber protein hewani yang memiliki komposisi kimia yang sangat bervariasi, tergantung pada kualitas bahan bakunya. Kandungan protein pada tepung daging dan tulang berkisar 41,5% – 71,4%. Isoleusin dan metionin + sistein merupakan asam amino pembatas pada tepung daging dan tulang jika dibandingkan dengan komposisi asam amino pada protein telur (Hertrampf dan Felicitas, 2000).
Kecernaan energi tepung daging dan tulang secara umum pada ikan sebesar 3000 kkal/kg. Dibandingkan dengan tepung daging (meat meal), kecernaan tepung daging dan tulang lebih rendah. Seperti yang dikemukakan oleh Wohlbier dan Tran (1977) dalam Hertrampf dan Felicitas (2000) bahwa kemampuan pepsin untuk mencerna tepung daging dan tulang sebesar 89%.
tepung daging dan tulang dapat menggantikan 25% tepung ikan pada pakan benih ikan nila tilapia (Oreochromis niloticus) tanpa menimbulkan efek negatif terhadap pertumbuhannya. Sedangkan pada benih tilapia (Oreochromis mossambicus) penggantian sebagian tepung ikan dengan tepung daging dan tulang memperlihatkan pertumbuhan yang sama dengan ikan yang diberi pakan dengan menggunakan 100% tepung ikan (kontrol), tetapi jika dilakukan penggantian total tepung ikan dengan menggunakan tepung daging dan tulang memberikan pertumbuhan yang buruk (Davies et al., 1989 dalam Hertrampf dan Felicitas, 2000). Penggunaan tepung daging dan tulang dalam pakan berkisar antara 10%-15%.
Zat anti nutrien 1. Asam fitat
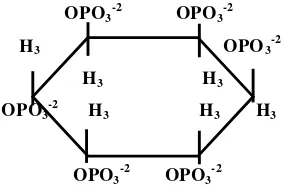
Asam fitat adalah nama umum mio-inositol heksakisfosfat (C6H18O24P6)
(Gambar 1) yang merupakan bentuk penyimpanan fosfor dalam tanaman dan akan dilepaskan oleh enzim fitase tanaman pada saat germinasi atau perkecambahan (Francis et al., 2001; Baruah et al., 2004).
Gambar 1. Mio-inositol heksakisfosfat (asam fitat) (Linder, 1992)
Tabel 2. Kandungan fosfor dan fosfor-fitat (P-fitat) pada beberapa bahan pangan Bahan pangan Total fosfat (%) Fitat fosfat (% dari total)
Tepung kedelai 0,61 (0,65) 67 (50)
Jagung 0,26 (0,33) 66 (72)
Gandum 0,30 (0,35) 67 (77)
Barley 0,35 (0,42) 56 (64)
Beberapa sifat yang terdapat pada asam fitat sehingga dikelompokkan kedalam golongan anti nutrisi yaitu 1) bergabung dengan mineral kation (potasium (K), magnesium (Mg), kalsium (Ca), seng (Zn), besi (Fe), tembaga (Cu)) yang membentuk kompleks mineral-asam fitat sehingga menjadikan bahan-bahan tersebut tidak tersedia bagi manusia dan hewan, 2) berikatan dengan protein (asam amino), vitamin, polisakarida dan menghambat aktivitas enzim-enzim pencernaan sehingga nutrien tidak tersedia bagi ikan (Han dan Wilfred, 1988; Nwanna et al., 2005; ESC, 2001). Asam fitat yang tidak tercerna dan terbuang ke dalam perairan melalui feses ikan atau ternak lainnya dapat menjadi sumber nutrien bagi mikroba sehingga menyebabkan penumpukan fosfor yang berakibat pencemaran lingkungan. Penumpukan fosfor di perairan dapat mempercepat pertumbuhan tanaman alga dan tumbuhan lainnya sehingga menyebabkan perairan tercemar (Rodecap, 2000).
Hasil penelitian yang dilakukan oleh Sajjadi dan Carter (2004) dan Denstadli et al. (2006) dengan melihat pengaruh negatif fitat dalam pakan ikan Atlantic salmon (Salmo salar L.) dimana fitat mampu mereduksi kecernaan protein serta dapat menurunkan pertumbuhan ikan tersebut. Sedangkan penelitian yang dilakukan oleh Andrews et al. (1973) dan Lovell (1978) dalam Hughes dan Soares (1998) pada ikan channel catfish (Ictalurus punctatus) menyatakan bahwa terjadi penurunan pertumbuhan ikan channel catfish (Ictalurus punctatus) yang pakannya mengandung 4 g fitat per kg pakan dan pakan yang mengandung 600 g bungkil kedelai, jagung dan gandum giling per kilogram pakan, fosfor yang diserap sebesar 54%, 25% dan 28%.
Myo-inositol-hexaphosphate phosphohydrolase. Enzim ini tidak dapat dihasilkan oleh hewan-hewan monogastrik. Satu unit fitase (FTU) didefinisikan sebagai jumlah enzim yang membebaskan satu mikromol (μm) fosfor anorganik per menit dari 0,0015 mol/L sodium fitat pada pH 5,5 dan suhu 37oC (Baruah et al., 2004).
Reddy et al. (2000) mengemukakan bahwa terdapat 2 jenis enzim fitase yaitu 1) E.C.3.1.3.8 (3-fitase) yang mengkatalisis reaksi mio-inositol 1,2,3,4,5,6 heksakisfosfat + H2O menjadi mio-inositol 1,2,3,4,5 pentakisfosfat + orthofosfat,
dimana enzim ini banyak dihasilkan oleh mikroba dan 2) E.C.3.1.3.26 (6-fitase) yang mengkatalisis reaksi mio-inositol 1,2,3,4,5,6 heksakisfosfat + H2O menjadi
mio-inositol 1,2,3,4,5 pentakisfosfat + orthofosfat dan enzim ini terutama dihasilkan dalam biji tumbuhan tingkat tinggi. Perbedaan dari kedua jenis ini yaitu tempat hidrolisis pertama molekul fitat. Pada mikroba 3-fitase pertama memotong asam fitat pada posisi 3 dan pada tumbuhan tingkat tinggi 6-fitase pertama memotong asam fitat pada posisi 6.
Menurut Simon et al., (1990) aktivitas mikrobial fitase (fitase yang dihasilkan oleh mikroba) terjadi pada pH 5,0 – 5,5 dan pH 2,5 dan dikomersilkan dalam bentuk tepung kering atau cair. Fitase lain dihasilkan dari kapang/jamur (Aspergillus niger) dan dikomersilkan dengan nama Natupos.
Beberapa penelitian yang dilakukan oleh Cain dan Garling (1995); Rodehutscord dan Pfeffer (1995); Li dan Robinson (1997); Sajjadi dan Carter (2004); Nwanna et al. (2005) dengan spesies ikan yang berbeda yang mengaplikasikan fitase ke dalam pakan dan berkesimpulan bahwa fitase mampu membebaskan P fitat sehingga P tersedia dan berguna untuk pertumbuhan ikan, selain itu fitase mempunyai kemampuan untuk meningkatkan penggunaan P fitat oleh ikan serta mampu melepaskan mineral-mineral lain yang terikat pada bahan nabati sehingga mengurangi polusi fosfor lingkungan.
2. Gossypol
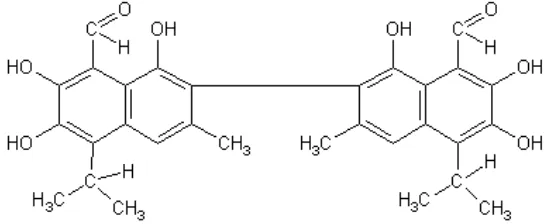
mempunyai rumus molekul C30H30O8 dengan bobot molekul 518,54 (1,1’6,6’7-
hexahidroxy -5’ 5’ – diidoprophyl -3’ 3’ dimethyl [2, 2’ -binapthalene] -8, 8’-dicarboxyaldehyde) (Gambar 2).
Gambar 2. Struktur gossypol (polyphenol) (Cai et al., 2004)
Gossypol dapat larut dalam pelarut organik, seperti metanol, aceton, ether, chloroform. Gossypol mempunyai tiga bentuk tautomer yaitu aldehyde (struktur dasar), hemiacetal dan enolic quinoid. Selain itu, gossypol memiliki 15 pigmen dan turunannya yang diekstrak dari biji kapuk, minyak biji kapuk dan bungkil biji kapuk, tetapi hanya 8 pigmen yang dapat diisolasi, yaitu gossypol (kuning), diaminogossypol (kuning), 6-methoxygossypol (kuning), 6,6’-dimethoxygossypol (kuning), gossypurpurin (ungu), gossyfulvin (orange), gossycaerullin (biru), dan gossyverdurin (hijau) (Cheeke, 1989).
Penggunaan tepung biji kapas dalam pakan ikan setiap spesies berbeda. Pada catfish, salmon dan tilapia dengan menambahkan tepung biji kapas (cottonseed meal) sebanyak 10% dan 30% dalam pakan (mengandung 40% protein) memperlihatkan tidak terjadi penurunan pertumbuhan. Robinson dan Li (1994) pada ikan Channel catfish yang dipelihara dalam kolam dengan menambahkan tepung biji kapas (cottonseed meal) sebanyak 51,25% dan lysin 0,65% dalam pakan memperlihatkan bahwa pertumbuhan dan komposisi kimia dalam dagingnya tidak berbeda dengan ikan yang diberi pakan tepung bungkil kedelai sebanyak 42%.
Gossypol menjadi tidak toksik apabila dicampur dengan ferro sulfate (FeSO4.7H2), dimana ferro sulfate akan menghambat efek toksik (Hertrampf dan
BAHAN DAN METODA
Penelitian ini dilakukan di Laboratorium Basah Nutrisi Ikan, analisa proksimat dilakukan di Laboratorium Kimia Nutrisi Ikan, analisa kualitas air di Laboratorium Lingkungan, Dept. BDP, FPIK. Analisa fosfor di Lab. Nutrisi Ternak,. FAPET, IPB. Pelaksanaan penelitian pada bulan Mei-Agustus 2006.
Pakan
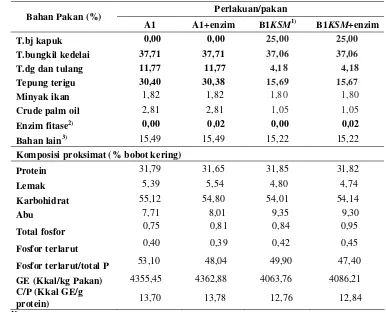
Pakan yang digunakan dalam percobaan ini berbentuk pellet dengan kadar protein dan energi yang sama. Komposisi bahan dan analisa proksimat disajikan pada Tabel 3.
Tabel 3. Komposisi bahan dan analisa proksimat pakan pada setiap perlakuan
Perlakuan/pakan 2) Enzim fitase Natuphos (5000 FTU)
Sumber protein pakan berasal dari tepung ikan (FM), tepung bungkil kedelai (SBM), tepung biji kapuk (KSM) dan tepung daging dan tulang (MBM). Sumber karbohidrat berasal dari tepung terigu, sedangkan sumber lemak berasal dari minyak ikan dan minyak kelapa sawit (CPO). Bahan lain yang ditambahkan adalah anti oksidan, vitamin mix, mineral mix dan enzim fitase. Enzim fitase yang digunakan adalah enzim fitase merek Natupos (5000 FTU). Jumlah enzim fitase yang ditambahkan pada perlakuan A1+enzim sebesar 53 mg/100 g bahan nabati (bungkil kedelai) setara dengan 265 unit enzim fitase dan perlakuan B1KSM+enzim 32 mg/100 g bahan nabati (bungkil kedelai dan biji kapuk) setara dengan 160 unit enzim fitase. Kandungan gossypol bebas dalam tepung biji kapuk (25%) sekitar 0,01%.
Proses pembuatan pakan sebagai berikut yaitu bahan-bahan yang jumlahnya sedikit diaduk sampai merata kemudian dimasukkan bahan yang jumlahnya banyak lalu diaduk lagi sampai tercampur merata. Enzim fitase dilarutkan dalam 50 ml air dengan suhu 27oC lalu dicampur ke dalam bahan pakan sampai rata. Air sebanyak 250 ml ditambahkan ke dalam campuran bahan yang sudah ditambahkan enzim fitase sampai membentuk adonan lalu dicetak menjadi pellet dan diinkubasi dalam oven pada suhu 37oC selama 6 jam. Setelah inkubasi selama 6 jam, pellet diangkat dan diletakkan pada ruang terbuka selama 6 jam kemudian disimpan dalam freezer.
Pemeliharaan ikan dan pengumpulan data
Ikan uji yang digunakan adalah ikan lele dumbo (Clarias sp) dengan bobot rata-rata 27 ± 0,5 gram, berasal dari petani ikan di Desa Babakan, Parung, Bogor. Pemeliharaan ikan dilakukan pada sistem resirkulasi dengan menggunakan akuarium yang berukuran 50 x 40 x 35 cm dan diisi air dengan ketinggian 30 cm. Sebelum perlakuan di mulai, ikan diadaptasikan terlebih dahulu terhadap lingkungan dan pakan. Perlakuan dilakukan selama 60 hari. Pemberian pakan 3 kali sehari pada pukul 06.00, 13.00 dan 20.00 WIB sampai kenyang (at satiation).
Data bobot tubuh ikan diperoleh dari hasil penimbangan masing-masing di awal dan akhir perlakuan. Bobot tubuh yang diukur merupakan bobot biomassa yang kemudian dirata-ratakan untuk mengetahui berat setiap ekor ikan (berat individu). Penimbangan dilakukan setelah ikan dipuasakan selama 24 jam. Untuk mengurangi stress pada ikan, sebelum penimbangan dilakukan pembiusan dengan menggunakan 2-phenoxy ethanol sebanyak 0,5 ml/l air. Pengukuran bobot ikan bertujuan untuk mengetahui laju pertumbuhan harian selama perlakuan berlangsung yang dihitung dengan menggunakan rumus Huisman (1976):
t
Wo
Wt= (1+0.01α) ; dengan α adalah laju pertumbuhan harian (%), Wo merupakan bobot ikan pada awal penelitian (g), Wt adalah bobot ikan pada akhir penelitian (g) dan t adalah waktu pemeliharaan (hari).
Konsumsi pakan harian ditentukan dengan menghitung jumlah pakan yang diberikan selama pemeliharaan, bertujuan untuk menentukan nilai efisiensi pakan. Nilai efisiensi pakan dihitung berdasarkan hasil bagi antara bobot ikan (awal dan akhir) dengan bobot total pakan yang dikonsumsi (EP = ((Wt + D – Wo)/ F )x 100 dengan EP adalah efisiensi pakan (%), Wt merupakan bobot ikan akhir penelitian, D merupakan bobot total ikan yang mati (g) dan F adalah jumlah total pakan yang dikonsumsi (g) (NRC, 1993).
Pengambilan sampel untuk analisa proksimat tubuh dilakukan pada awal dan akhir perlakuan setelah ikan dipuasakan selama 24 jam. Jumlah ikan uji yang digunakan sebanyak 2 ekor setiap ulangan. Untuk analisa fosfor tulang, ikan uji yang digunakan sebanyak 2 ekor. Pengambilan tulang ikan dilakukan dengan cara merendam tubuh ikan ke dalam air panas selama 5 menit, setelah itu daging ikan dilepaskan dari tulangnya kemudian tulang tersebut dibersihkan dengan air lalu dikeringkan. Setelah itu direndam dengan alkohol 70% selama 24 jam kemudian di analisa.
Analisis kimia
Analisa proksimat yang dilakukan terdiri dari protein, lemak, serat kasar, abu, bahan ekstrak tanpa nitrogen (BETN) dan kadar air. Analisa proksimat protein kasar dengan metode Kjeldhal, lemak dengan metode ekstraksi dengan menggunakan alat Soxhlet, abu dengan menggunakan pemanasan dalam tanur pada suhu 400 sampai 600 oC, serat kasar menggunakan metode pelarutan dengan asam dan basa kuat serta pemanasan dan untuk kadar air menggunakan metode pemanasan dalam oven pada suhu 105-110oC. Analisa lemak hati dengan menggunakan metode Folch et al. (Takeuchi 1988) (Lampiran 1,2 ,3 ,4 dan 5)
Analisis fosfor tulang dilakukan pada akhir penelitian, bertujuan untuk mengetahui berapa besar penyimpanan fosfor pada tulang terutama pada perlakuan yang ditambahkan enzim fitase. Analisis fosfor dari feses dilakukan pada akhir penelitian, bertujuan untuk mengetahui kecernaan fosfor. Pakan dan feses diabukan terlebih dahulu kemudian kadar fosfor dari abu di analisis dengan menggunakan spektrofotometer dengan panjang gelombang 660 nm. (Lampiran 6).
Uji kecernaan pakan
Pakan yang digunakan sama dengan pakan perlakuan tetapi ditambah Cr2O3 sebanyak 0,6%. Uji kecernaan pakan dilakukan pada akhir penelitian
selama 6 minggu. Pengumpulan feses dimulai 4 hari setelah pemberian pakan yang mengandung Cr2O3. Setelah ikan diberi pakan sampai kenyang kemudian
dilakukan pembersihan wadah. Pengumpulan feses dimulai 2 – 3 jam setelah pemberian pakan dengan cara penyiponan. Pengumpulan feses dilakukan selama 38 hari.
Histologi hati
Histologi hati dilakukan untuk mengetahui kondisi hati ikan terutama kandungan lemak dan perbedaan keadaan hepatosit pada setiap perlakuan. Histologi ini dilakukan pada akhir perlakuan. Hati yang diperoleh melalui pembedahan langsung dimasukkan dalam larutan Bouin. Pembuatan preparat histologi hati dengan metode pawarnaan hematoksilin-eosin (Lampiran 7).
Pengukuran total ammonia nitrogen (TAN)
dahulu dipuasakan selama 24 jam, sedangkan air yang digunakan diaerasi selama 24 jam. Jumlah ikan uji setiap ulangan sebanyak 4 ekor dengan 2 ulangan. Pengambilan sampel air dilakukan setelah ikan diberi pakan sampai kenyang (jam ke 0) kemudian pengambilan sampel berikutnya dilakukan setiap jam selama 5 jam berturut-turut. Selama pengukuran berlangsung, bagian atas akuarium ditutup dengan menggunakan sterofoam dan aerasi dihentikan. Koreksi konsentrasi ammonia dalam air selama pengukuran dengan menggunakan akuarium yang diisi air tanpa ikan sebagai kontrol. Pengukuran kadar TAN dalam air menggunakan metode Phenat (APHA et al. 1975) dan nilai absorbansinya dibaca dengan spektrofotometer pada panjang gelombang 630 nm.
Analisis statistik
HASIL DAN PEMBAHASAN
Hasil
Perubahan bobot rata-rata individu ikan lele dumbo selama penelitian dapat dilihat pada Gambar 3 dan Lampiran 10. Pada Gambar tersebut terlihat
Gambar 3. Bobot rata-rata individu ikan lele dumbo (Clarias sp) selama penelitian
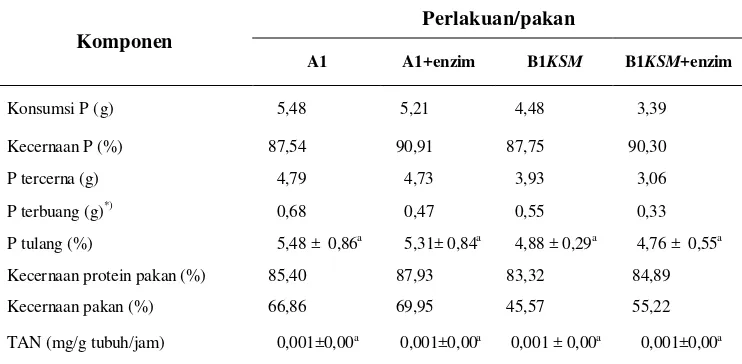
Tabel 4. Nilai kecernaan fosfor dan protein serta limbah P selama penelitian
Perlakuan/pakan Komponen
A1 A1+enzim B1KSM B1KSM+enzim
Konsumsi P (g) 5,48 5,21 4,48 3,39
Keterangan : Angka yang diikuti huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata (p>0,1), KSM: Tepung biji kapuk (kapook seed meal)
*) Berdasarkan perhitungan
Komposisi proksimat tubuh dan hati ikan lele dapat dilihat pada Tabel 5 dan data lengkap pada Lampiran 15 dan 16. Kadar abu tubuh semua perlakuan baik penambahan enzim fitase (A1+enzim dan B1KSM+enzim) maupun tanpa penambahan enzim fitase (A1 dan B1KSM) mengalami penurunan selama pemeliharaan dibandingkan dengan kadar abu tubuh di awal penelitian. Nilai abu tubuh semua perlakuan tidak berbeda nyata (P>0,1).
Tabel 5. Komposisi proksimat tubuh dan hati ikan Lele Dumbo (Clarias sp)
Perlakuan/pakan Parameter Awal
A1 A1+Enzim B1KSM B1KSM+enzim
Tubuh :
Keterangan : Angka yang diikuti huruf yang sama pada lajur yang sama menunjukkan tidak berbeda nyata (p>0,1), KSM: Tepung biji kapuk (kapook seed meal)
Kadar protein tubuh pada perlakuan B1KSM dan B1KSM+enzim
sedangkan perlakuan A1 dan A1+enzim mengalami penurunan. Nilai protein tubuh tertinggi pada perlakuan B1KSM+enzim (P<0,1). Berdasarkan Gambar 4 dan Lampiran 17 terlihat bahwa terdapat interaksi antara penggunaan bahan nabati yang berbeda (A) dengan dan tanpa penambahan enzim fitase (B) terhadap kadar protein tubuh. Dimana kadar protein tubuh lebih nyata dipengaruhi oleh penggunaan bahan SBM+KSM dengan penambahan fitase.
56,11
Gambar 4. Kadar protein tubuh pada perlakuan SBM dan SBM+KSM dengan dan tanpa penambahan enzim fitase.
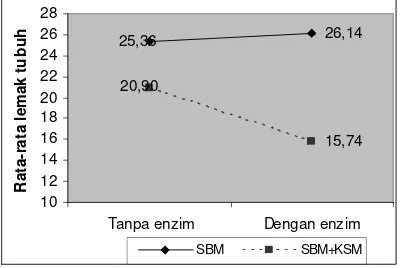
Kadar lemak tubuh pada perlakuan A1 dan A1+enzim mengalami peningkatan sejalan dengan bertambahnya bobot tubuh selama pemeliharaan dibandingkan kandungan lemak tubuh awal penelitian, sedangkan perlakuan B1 dan B1KSM+enzim mengalami penurunan (Tabel 5). Gambar 5 memperlihatkan tidak ada interaksi antara penggunaan bahan nabati dengan dan tanpa penambahan enzim fitase. Kadar lemak tubuh yang berbeda lebih dipengaruhi oleh penggunaan bahan nabati yang berbeda (A) (Lampiran 18).
26,14
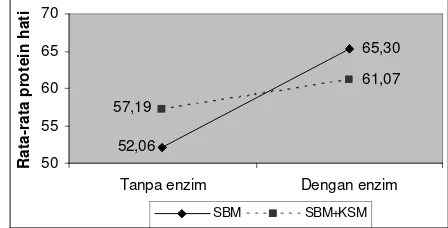
Kadar protein hati mengalami peningkatan pada perlakuan penambahan enzim fitase (P<0,1) dibandingkan dengan kandungan protein hati di awal perlakuan, sedangkan perlakuan tanpa penambahan enzim fitase mengalami penurunan (P>0,1). Gambar 6 dan Lampiran 19 memperlihatkan bahwa terdapat interaksi/pengaruh antara penggunaan bahan nabati yang berbeda (A) dengan dan tanpa penambahan enzim fitase (B) terhadap kadar protein di hati. Dimana kadar protein hati lebih nyata dipengaruhi oleh penggunaan bahan SBM tanpa
Gambar 6. Kadar protein hati pada perlakuan SBM dan SBM+KSM dengan dan tanpa penambahan enzim fitase.
Kadar lemak hati untuk semua perlakuan mengalami penurunan dibandingkan dengan kadar lemak hati di awal perlakuan. Kadar lemak hati untuk semua perlakuan tidak berbeda (P>0,1), Lampiran 20.
Tabel 6. Nilai rata-rata retensi protein (RP), retensi lemak (RL), laju pertumbuhan harian (LPH), efisiensi pakan (EP) dan konsumsi pakan yang diperoleh selama penelitian.
Perlakuan/pakan Parameter
A1 A1+Enzim B1KSM B1KSM+enzim
RP (%) 28,43 ± 2,48a 26,95 ± 2,68a 33,61 ± 5,10a 34,16 ± 4,78b berbeda nyata (p>0,1), KSM: Tepung biji kapuk (kapook seed meal)
tanpa penambahan enzim fitase. Perbedaan nilai retensi lemak dipengaruhi oleh penggunaan bahan SBM+KSM dengan penambahan enzim fitase.
82,49
Gambar 8. Retensi lemak pada perlakuan SBM dan SBM+KSM dengan dan tanpa penambahan enzim fitase.
Nilai laju pertumbuhan harian tidak berbeda pada perlakuan A1 dan A1+enzim, sedangkan pada perlakuan B1KSM dan B1KSM+enzim berbeda nyata (P<0,1). Gambar 9 dan Lampiran 26 memperlihatkan bahwa tidak ada interaksi dari laju pertumbuhan harian antara penggunaan bahan nabati (SBM dan SBM+KSM) dengan dan tanpa penambahan enzim fitase.
1,97 dengan dan tanpa penambahan enzim fitase.
642,97
Histologi hati (Gambar 11) memperlihatkan bahwa kelainan hati terjadi pada perlakuan yang ditambahkan tepung biji kapuk (B1KSM dan B1KSM+enzim) dengan terlihat adanya pigmen granulaseroit yang terdapat diantara sel-sel hati ikan Lele Dumbo (Clarias sp).
Keterangan : (tanda anak panah) menunjukkan pigmen granulaseroit yang terdapat diantara sel-sel hati.
Gambar 11. Histologi hati (kerusakan hati) ikan Lele Dumbo (Clarias sp)
A1 A1+enzim
B1KSM B1KSM+enzim
Pembahasan
Umumnya kemampuan ikan dalam mencerna bahan nabati dapat dikatakan masih kurang terutama ikan-ikan yang bersifat karnivora. Selain itu, terdapatnya zat anti nutrien yang terkandung dalam bahan nabati seperti gossypol dan asam fitat (phytic acid). Asam fitat yaitu bentuk penyimpanan fosfor yang terdapat dalam bahan nabati yang tidak dapat dimanfaatkan oleh hewan-hewan monogastrik termasuk ikan. Salah satu cara yang digunakan untuk membebaskan fosfor dalam bentuk fitat yaitu dengan menggunakan enzim fitase.
Hasil penelitian memperlihatkan bahwa penambahan enzim fitase 0,02% (53 mg/100 g bungkil kedelai setara dengan 265 unit fitase perlakuan A1+enzim dan 32 mg/100 g bungkil kedelai+biji kapuk setara dengan 160 unit fitase perlakuan B1KSM+enzim) dapat meningkatkan sedikit kecernaan P namun belum meningkatkan retensi protein, laju pertumbuhan harian (LPH) dan efisiensi pakan. Terlihat dari nilai P terlarut, rasio Pterlarut/Ppakan dan P tercerna yang tidak
berbeda antar perlakuan (Tabel 3). Hal ini menunjukkan kemungkinan aktivitas enzim fitase terjadi tetapi tidak optimum. Salah satu faktor yang mempengaruhi aktivitas enzim yaitu konsentrasi enzim dan substrat. Hasil penelitian Yulisman (2006) pada ikan Baung (Hemibagrus nemurus) memperlihatkan bahwa dosis fitase 60 mg/100 g bungkil kedelai setara dengan 300 unit fitase dalam pakan dapat meningkatkan kecernaan fosfor dan pertumbuhan ikan baung. Kecernaan P yang tinggi pada semua perlakuan diduga karena penambahan P anorganik dalam pakan dan adanya penambahan P dari bahan nabati yang digunakan. Menurut Sajjadi dan Carter (2004) fosfor yang terdapat dalam bungkil kedelai dapat dicerna oleh ikan sekitar 20 %. Sedangkan menurut Li et al. (2004) tepung biji kapas dan gandum merupakan sumber P yang baik.
dalam berbagai ruang-ruang sel yang akan mengikat dan melepas nukleotida dan metabolit-metabolit lain (Buffer intraseluler) (Linder, 1992; Wasserman, 1960 dalam NRC, 1983).
Sebagai bagian dari komponen DNA dan RNA, fosfor juga berperan dalam sintesis protein (Davis et al., 1991). Dari hasil analisa proksimat tubuh terlihat bahwa semakin tinggi kadar fosfor pakan maka kadar protein tubuh juga meningkat. Peningkatan protein tubuh berkaitan dengan menurunnya lemak tubuh. Para peneliti menduga bahwa menurunnya deposit lemak pada ikan dengan konsentrasi fosfor pada pakan yang tinggi akan meningkatkan aktivitas β-oksidasi asam lemak dan glukoneogenesis (Sakamoto dan Yone, 1978 dalam Eya et al., 1997). Pada hewan, glukoneogenesis terjadi terutama di dalam hati dan dalam jumlah sedikit terjadi di dalam korteks ginjal. Hasil penelitian Mokoginta dan Suprayudi (1993) pada ikan lele dan gurame memperlihatkan adanya pengaruh positif mineral fosfor dengan pertumbuhan ikan. Kadar fosfor pakan yang rendah atau terlalu tinggi menghasilkan laju pertumbuhan harian yang rendah. Penelitian yang dilakukan oleh Zainuddin (1998) dengan perbedaan tingkat pemberian fosfor dalam pakan menunjukkan bahwa pakan yang ditambahkan fosfor 1%, kadar lemak tubuh lebih rendah (10,28%) dibandingkan dengan penambahan fosfor 0,5 %(11,54%) dan 1,5 % (19,34%).
Walaupun ada peningkatan kecernaan fosfor namun retensi protein antara perlakuan A1 dan A1+enzim serta B1KSM dan B1KSM+enzim sama, hal ini diduga karena fosfor dalam pakan sudah tercukupi dari penambahan fosfor anorganik. Peningkatan kemampuan sintesis protein dengan naiknya kecernaan fosfor mampu meningkatkan potensi pertumbuhan pada perlakuan A1 dan
A1+enzim sedangkan perlakuan B1KSM dan B1KSM+enzim belum mampu
Herman (1970) pada ikan rainbow trout dengan menambahkan gossypol (0,029%) dalam pakan yang mengandung tepung biji kapas menyebabkan pertumbuhan yang rendah dan patologi jarigan pada ikan rainbow trout. Gossypol bebas pada level 0,012% mampu menurunkan pertumbuhan tilapia (oreocromis aureus) (Robinson et al., 1984).
Keberadaan gossypol dalam penelitian ini dapat dilihat dari histologi hati yang telah dilakukan (Gambar 11). Dimana kelainan terjadi pada perlakuan B1KSM dan B1KSM+enzim yang menggunakan campuran tepung biji kapuk dengan terlihat adanya pigmen granulaseroit diantara sel-sel hati yaitu lekosit yang dalam sitoplasmanya banyak terdapat granula dan dapat bergerak amoeboid keluar pembuluh kapiler untuk memphagosit benda asing. Francis et al. (2001) menyatakan bahwa gejala keberadaan gossypol dalam pakan ikan terlihat dengan adanya pertumbuhan yang menurun, perubahan necrotic pada sel hati, terjadinya kekentalan pada dasar membran glomerulat serta akumulasi dari pigmen granulaseroit di dalam hati. Selain itu, pakan yang mengandung 0,1 % gossypol menghasilkan perkembangan yang cepat dari degenarasi lemak yang kuat pada hati dan kerusakan ginjal yang ekstensif. Morgan (1989) menyatakan bahwa gossypol terdapat dalam bentuk terikat maupun bebas dimana gossypol bebas sangat toksik dan dapat terakumulasi dalam hati, jantung, alat reproduksi, abomasum dan ginjal.
SIMPULAN DAN SARAN
Simpulan
Penambahan enzim fitase 0,02% (1000 unit/kg pakan) yang memanfaatkan protein nabati sebagai sumber protein pakan ikan Lele Dumbo (Clarias sp) dapat meningkatkan kecernaan total pakan, fosfor dan protein, namun belum meningkatkan retensi protein dan pertumbuhan ikan.
Saran
DAFTAR PUSTAKA
Akiyama T, T Unuma, T Yamamoto, P Marcouli, S Kishi. 1995. Combinational use of malt protein flour and soybean meal as alternative protein sources of fish meal in fingerling rainbow trout diets. Fisheries Sci, 61: 828-832. Andayani ASNS. 1981. Pembuatan campuran sosis daging sapi dan tepung
kedelai. Skripsi. FATETA IPB. Bogor. 35 hal
[APHA] American Public Health Association. 1975. Standar methods for the examination of water and wastewater. American Water Works Assosiation and Water Pollution Control Federation. 14th. Ed., Washington, D.C. 1193 pp.
Baruah K, Sahu NP, Pal AK, Debnath D. 2004. Dietary phytase: an ideal approach for a cost effective and low-polluting aquafeed. NAGA, Worldfish Center Quarterly, 27 (3 & 4) : 15-19.
Cai Y, Zhang H, Zeng Y, Mo J, Bao J, Miao C, Bai J, Yann F, Chen F. 2004. An optimazed gossypol high-performance liquid chromatography assay and its application in evaluation of different gland genotypes of cotton. Journal Biosci, 29: 67-71
Cain KD, DL Garling. 1995. Pretreatment of soybean meal with phytase for salmonid diets to reduce phosphorus concentrations in hatchery effluents. Progressive Fish Culturist, 57: 114-119.
Cheeke PR. 1989. Toxicants of plant origin. CRC Press, Inc. Boca Raton. Florida. IV: 2-22.
Cheng Z, RW Hardy. 2002. Effect of microbial phytase on apparent nutrient digestibility of barley, canola meal, wheat and wheat middlings, meaured in vivo using rainbow trout (Oncorhynchus mykiss). Aquaculture Nutrition, 8: 271-288.
Davis DA, DM Gatlin III. 1991. Dietary mineral requirements of fish and shrimp, p.49-67. In: Akiyama DM and RKH Tan (eds). Proceedings of The Aquaculture Feed Processing and Nutrition Workshop. Thailand and Indonesia
Denstadli V, Skrede A, Krogdahl A, Sahlstrom, Storebakken T. 2006. Feed intake, feed conversion, digestibility, enzyme activities and intestinal structure in Atlantic salmon (Salmon salar L.) fed graded levels of phytic acid. Aquaculture, 256:365-376.
Eya JC, RT Lovell. 1997. Available phosphorus requirements of food-size channel catfish (Ictalarus punctatus) fed practical diets in ponds. Aquaculture, 154: 283-291
Francis G, Harinder PSM, K Becker. 2001. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish. Journal Aquaculture, 199:197-227.
Han YW, Wilfred AG. 1988. Phytate hydrolysis in soybean and cottonseed meals by Aspergillus ficuum phytase. J Agric. Food Chem., 336:259-262.
Hasan MR. 2000. Nutrition and feeding for sustainable aquaculture development in the third millenium. [Article]. Technical Procedings of The Conference on Aquaculture in the Third Millenium, Bangkok, Thailand. Bangkok. 36 pp.
Hepher B. 1990. Nutrition of pond fishes. Cambridge University Press. Cambridge. 388 pp.
Herman RL. 1970. Effects of gossypol on rainbow trout Salmo gairdneri Richardson. J. Fish Biol., 2: 293-303
Hertrampf JW, Felicitas P. 2000. Handbook on ingredients for aquaculture feeds. Kluwer Academic Publishers. Dordrecht/Boston/London. 573 pp.
Hughes KP, JH Soares Jr. 1998. Efficacy of phytase on phosphorus utilization in practical diets fed to striped bass Morone saxatilis. Department of Animal and Avian Scienses and Maryland Agricultural Experiment Station, University of Maryland, College Park, USA, 4: 133-140
Huisman EA. 1976. Food conversion efficiencies at maintenance and production levels for carp, Cyprinus carpio L and rainbow trout, Salmon gairdneri R. Aquaculture, 9: 259-273.
Li MH, EH Robinson. 1997. Microbial phytase can replace inorganic phosphorous supplements in channel catfish Ictalurus punctatus diets. Journal World Aquaculture Soc., 28: 402-406.
Li MH, BB Manning, EH Robinson. 2004. Summary of phytase studies for channel catfish. Mississippi Agricultural & Forestry Experiment Station, 23 (13): 1-5.
Linder MC. 1992. Biokimia nutrisi and metabolisme. Departement of Chemistry, California State University, Fullerton. Terjemahan Aminuddin Parakkasi. Penerbit Universitas Indonesia. 781 hal.
Mokoginta I, M A Suprayudi. 1993. Kebutuhan fosfor bagi ikan yang memiliki lambung dan ikan yang tidak memiliki lambung. Laporan penelitian. Pusat Antar Universitas Ilmu Hayat. IPB. 99hal.
Morgan SE. 1989. Gossypol as a toxicant in livestock, p. 251-263. In: Burrows GE (eds). The Veterinary Clinics of North America: Food Animal Practice. Philadelphia.
NRC. 1983. Nutrient requirement of warmwater fishes and shellfishes. (Edisi Revisi). National Academic of Science, Washington D.C. 102 pp.
NRC. 1993. Nutrient requirement of fish. National Academy of Science. Washington D.C. 114pp
Nursyam H. 1991. Ransum ikan lele (Clarias batrachus Linn) dari limbah ikan tuna. Tesis. Pascasarjana IPB. Bogor. 74 hal.
Nwanna LC. 2004. Effect of untreated soybean meal supplemented with phytase in practical diets on growth and mineral deposition in Nile tilapia, Oreochromis niloticus (L). J. Food and Environ, 2: 51-56.
Nwanna LC, A Fagbenro, AO Adeyo. 2005. Effects of different treatments of dietary soybean meal and phytase on the growth and mineral deposition in African catfish Clarias gariepinus. Journal of Animal and Veterinary Advances, 4 (12): 980-987.
Oderkirk A. 2001. Phytase enzyme for layers. www.gov.ns.ca. [18 Maret 2002]. Papatryphon E, JH Soares Jr. 2001. The effect of phytase on apparent digestibility
of four practical plant feedstuff fed to striped bass, Morone saxatilis. Aquaculture Nutrition, 7:161-167.
Robinson EH, Li MH. 1994. Use of plant proteins in catfish feed : replacement of soybean meal with cottonseed meal and replacement of fish meal with soybean meal and cottonseed meal. J World Aquacult. Soc., 25: 271-276. Robinson EH, Rawles SD, Oldenburg PW, Stickney R. 1984. Effects of feeding
glandless or glanded cottonseed products and gossypol to Tilapia aurea. Aquaculture, 130:219-233.
Rodecap J. 2000. Phosphorus, alga in water, human helth linked.
www.extension.aron.iastate.edu. [21 Maret 2002]
Rodehutscord M, E Pfeffer. 1995. Effects of supplemental microbial phytase on phosphorus digestibility and utilization in rainbow trout (Oncorhynchus mykiss). Water Scienci and Technology, 31(10): 141-147.
Sahwan MF. 1999. Pakan ikan dan udang. Penebar swadaya. Jakarta. 52 hal. Sajjadi M, Carter CG. 2004. Dietary phytase supplementation and the utilization
of phosphorus by Atlantic salmon (Salmon salar L.) fed a canola-meal-based diet. Aquaculture, 240:417-431.
Shimeno S, H Hosokawa, M Kumon, T Masumoto, M Ukawa. 1992. Inclution of deffated soybean meal in the diet for fingerling yellow tail. Nippon Suisan Gakkaishi, 58(7): 1319-1326.
Sugiura, SHJ Gabaudan. FM Dong, RW Hardy. 2001. Dietary microbial phytase supplementation and the utilization of phosphorus, trace minerals and protein by rainbow trout (Oncorhynchus mykiss) (Walbaum) fed soybean meal-based diets. Aquaculture Research, 32: 583-592.
Suhenda N. 1988. Pertumbuhan benih ikan lele (Clarias batrachus Linn.) yang mendapat ransum dengan kadar protein dan energi yang berbeda. Buletin Perikanan Darat. Bogor. 7(2).
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients, p.179-233 In: Fish nutrition and mariculture. Watanabe T (ed) 1988. Departement of Aquatic Biosciences. Tokyo University of Fisheries. JICA Yan W. RC Reigh, Z Xu. 2002. Effects of fungal phytase on utilization of dietary
protein and minerals and dephosphorylation of phytic acid in the alimentary tract of channel catfish (Ictalurus punctatus) fed an all plant protein diet. Journal of the Worl Aquaculture Society, 33: 10-22.
Yulisman. 2006. Penggunaan fitase dalam pakan berbasis tepung bungkil kedelai untuk ikan Baung (Hemibagrus nemurus). Tesis. Sekolah Pascasarjana. IPB. Bogor. 33 hal.
Lampiran 1. Analisis kadar air (Takeuchi, 1988)
1. cawan dipanaskan dalam oven (110oC) selama 1 jam kemudian dimasukkan ke dalam eksikator selama 30’ dan timbang (X1)
2. bahan ditimbang 2-3 gram (A)
3. cawan dan bahan dipanaskan di dalam oven (110oC) selama 4 jam kemudian dimasukkan kedalam eksikator seelama 30’ lalu ditimbang (X2)
X2 – X1
kadar air = x 100%
Lampiran 2. Analisis kadar protein (metode Semi Micro Kjeldahl) (Takeuchi, 1988)
1. sample ditimbang seberat 0.5-1.0 gram dan dimasukkan kedalam labu Kjeldahl. 2. katalis berupa K2SO45H2O dengan rasio 9 : 1 ditimbang sebanyak 3 gram, dan
dimasukkan ke dalam labu Kjeldahl.
3. selanjutnya ditambahkan 10 ml H2SO4 pekat ke dalam labu tersebut dan
kemudian labu dipanaskan selama 3 – 4 jam sampai cairan dalam labu berwarna hijau.
4. larutan didinginkan, lalu ditambahkan air destilasi 30 ml. kemudian masukkan larutan tersebut kedalam labu takar dan diencerkan dengan akuades sampai larutan tersebut mencapai volume 100 ml (larutan A)
5. labu erlemeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 – 3 tetes indicator
methylen blue atau methyl red (larutan B)
6. larutan A diambil sebanyak 5 ml dan ditambahkan sebanyak 10 ml NaOH 30% yang dimasukkan ke dalam labu Kjeldahl. Lalu dilakukan pemanasan dan kondensasi selama 10 menit mulai saat tetesan pertama pada larutan B.
7. larutan dalam labu erlemeyer dititrasi dengan 0.05 N larutan NaOH sampai terjadi perubahan warna dari merah muda menjadi hijau muda.
Lampiran 3. Analisi kadar lemak (metode ether ekstraksi, Takeuchi, 1988)
1. labu ekstraksi di panaskan didalam oven (110oC) selama 1 jam kemudian didinginkan dalam eksikator selama 30’ lalu ditimbang bobot labu tersebut (X1)
2. sample ditimbang sebanyak 1-2 gram (A) dan dimasukkan kedalam tabung filter lalu dipanaskan pada suhu 90-100oC selama 2-3 jam.
3. tabung filter ditempatkan kedalam ekstrak dari alat soxlet. Kemudian disambungkan kondensor dengan labu ekstraksi yang telah diisi 100 ml petroleum eter.
4. eter dipanaskan pada labu ekstraksi dengan menggunakan water bath pada suhu 70oC selama 16 jam.
5. labu ektraksi dipanaskan pada suhu 100oC kemudian ditimbang (X2)
X2 – X1
kadar lemak = x 100%
A
Lampiran 4. Analisis kadar abu pakan dan tubuh ikan (Takeuchi, 1988)
1. cawan dipanaskan di dalam oven (110oC) selama 1 jam kemudian dimasukkan ke dalam eksikator selama 30’ dan ditimbang (X1)\
2. bahan ditimbang 2-3 garam (A)
3. cawan dan bahan dipanaskan kedalam tanur (600oC) sampai bahan menjadi abu kemudian dimasukkan ke dalam eksikator selama 30’ lalu di timbang (X2)
X2 – X1
kadar abu = x 100%
Lampiran 5. Analisis serat kasar pakan dan tubuh ikan (Takeuchi, 1988)
1. kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC setelah itu didinginkan dalam eksikator lalu ditimbang (X1)
2. sample ditimbang sebanyak 0.5 gram (A) dan dimasukkan kedalam erlemeyer 250 ml
3. H2SO4 0.3 N sebanyak 50 ml dimasukkan kedalam erlemeyer kemudian dipanaskan selama 30’. Setelah itu NaOH 1.5 N sebanyak 25 ml dimasukkan kedalam erlemeyer lagi kemudian dipanaskan selama 30’
4. larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. larutan n bahan yang ada pada corong buchner kemudian dibilas secara
berturut-turut dengan 50 ml air panas, H2SO4 0.3 N, 50 ml air panas dan 25 ml aseton.
6. kertas saring dan isinya dimasukkan kedalam cawan porselin, lalu dikeringkan selama 1 jam kemudian didinginkan dalam eksikator dan ditimbang (X2) 7. setelah itu dipanaskan dalam tanur 600oC hingga berwarna putih, didinginkan
dalam eksikator dan ditimbang (X3)
X2 – X1 – X3
kadar Serat Kasar = x 100%
Lampiran 6. Analsis Phospor (metode spektrofotometer)
Prosedur Wet Ashing (Pengabuan)
1. Timbang ± 1 gram sample dalam erlenmeyer
2. Tambahkan HNO3 5 ml, biarkan ± 1 jam sampai bening dan tidak ada buih
3. Panaskan sampel ± 4 jam pada hot plate lalu dinginkan
4. Tambahkan 0.4 ml H2SO4 pekat (panaskan kembali jika ada letupan kecil
± 1 jam)
5. Volume sample akan berkurang pada saat ada perubahan warna, lalu teteskan larutan campuran HCLO4 : HNO3 (2 : 1) sebanyak 3 tetes,
panaskan selama ± 1 jam. Terjadi perubahan warna coklat → kuning →
bening
6. Tambahkan 2 ml aquades + 0.6 ml HCl(p)
7. Panaskan kembali sampai larut lalu dinginkan
8. Pindahkan ke dalam labu takar kemudian larutkan menjadi 100 ml.
Preparasi larutan
• Larutan A ((NH4)6Mo7O24.4H2O 10% = Amonium Molibdat 10%)
10 gram Amonium Molibdat + 60 ml Aquades
Tambahkan 28 ml H2SO4 pekat secara bertahap (panas) → reaksi
eksoterm
Buat larutan sampai 100 ml dengan menambah Aquades Dinginkan larutan tersebut dalam suhu kamar
• Larutan B (dibuat sesaat sebelum analisis)
10 ml larutan A + 60 ml Aquades + 5 gram FeSO4.7H2O
Buat larutan sampai 100 ml dengan menambah Aquades • Larutan Standard untuk P
Larutkan 4.394 gram KH2PO4 dalam aquades sampai 1 liter (untuk
Lanjutan………….. diaduk menggunakan vortex, kemudian ditambah larutan B sebanyak 2 ml. • Baca pada spektrofotometer (UV Visible) dengan panjang gelombang (λ)
660 nm. Tulang Ikan
• Larutan hasil Wet Ashing Tulang Ikan di labu takar 100 ml di pipet 1 ml kemudian dimasukkan ke tabung reaksi, lalu diencerkan dengan aquades bebas mineral menjadi 5 ml (diaduk).
• Hasil pengenceran 5 ml di pipet 0.1 ml lalu diencerkan lg dengan menggunakan aquades bebas mineral sampai 3 ml (di aduk dengan vortex) + 2 ml larutan B (diaduk).
• Larutan siap dianalisis menggunakan alat spektrofotometer dengan panjang gelombang 660 nm
Pakan
• Larutan hasil Wet Ashing Pakan di labu takar 100 ml di pipet 0.2 ml, lalu diencerkan dengan aquades bebas mineral 3 ml (diaduk) + 2 ml larutan B (diaduk).
• Larutan siap dianalisis menggunakan alat spektrofotometer dengan panjang gelombang 660 nm.
Lampiran 7. Prosedur pembuatan preparat histologi
Larutan Waktu
Bouin 24 jam
Alkohol 70%, 80%, 90%, 95% Masing-masing 24 jam
Alkohol absolut 30 menit
Xilol I, II, III 30 menit
Parafin I dan II 30 menit
Parafin III 60 menit
Penanaman dalam blok parafin 24 jam Pemotongan dengan mikrotom (5 mikron)
Xilol III dan II masing-masing 3 menit
Xilol I Masing-masing 3 menit
Alkohol III, II, I Masing-masing 2-3 menit
Air kran 5 menit
Akuades 5 – 10 menit
Pewarnaan hematoksilin 40 detik
Air kran 5 menit
Akuades 5 menit
Pewarnaan eosin 5 menit
Alkohol 70%, 80%, 90%, 95% Masing-masing 30 detik Alkohol absolute I, II, III Masing-masing 30 detik Xilol I dan II Masing-masing 5 menit
Ditutup dengan gelas penutup
Lampiran 8. Prosedur analisis ammonia (APHA-AWWA-WPCF, 1975)
1. sample sebanyak 25 ml dimasukkan kedalam gelas beker. Tambahkan 1 tetes MnSO4 0.003 M, kemudian di aduk.
2. Tambahkan 0.5 ml larutan chlorox 20% diaduk, lalu segera tambahkan 0.6 ml larutan phenate. Aduk kembali dan diamkan selama 25 menit.
3. ukur nilai absorban menggunakan spektrofotometer pada panjang gelombang 630 nm.
4. lakukan prosedur yang sama pada larutan blanko dan standar. 5. konsentrasi amoniak dihitung dengan persamaan regresi :
Y= -0.0039 + 1.3749 X Keterangan :
Y = konsentrasi amoniak sample X = nilai absorban sample
Larutan Phenat
1 gram phenol + 0.25 NaOH + 10 ml aquades lalu diaduk sampai larut.
Larutan Chlorox
Lampiran 9. Data analisa proksimat bahan (% Bobot kering)
Bahan Abu Protein Lemak Serat
Kasar BETN
Gross Energi
T. Ikan 14.40 76.00 8.93 0.37 0.30 4010
T. Biji Kapuk 7.66 32.45 9.92 23.47 26.49 4127 T. Bungkil
Kedelai 7.77 39.37 3.49 11.82 37.55 3909 T. daging &
Tulang 2.44 64.06 5.91 4.46 23.13 2696
T. Tapioka 0.07 0.91 0.09 0.27 98.66 4104.48
Lampiran 10. Data analisa asam amino essensial bahan (% protein)
B A H A N Asam Amino
Ikan 1) FM3) KSM 1) SBM 2) MBM 2)
Arginin 2.54 3.9 0.86 6.94 3.38
Histidin 4.24 1.5 0.17 2.64 1.03
Isoleusin 2.01 3.6 0.14 5.01 1.42
Leusin 3.78 5.1 0.73 7.54 2.86
Lisin 3.59 6.4 0.20 6.28 3.75
Metionin 1.84 1.8 0.21 1.38 1.01
Phenilalanin 2.27 2.6 0.38 5.03 1.63
Threonin 2.22 2.8 0.14 4.92 2.50
Tryptophan 0.42 0.7 0.08 1.18 0.24
Valin 2.42 3.5 0.92 4.72 2.18
Keterangan : 1) Hasil analisa, 2) Hetrampf dan Felicitas (2000), 3) Buwono (2000)
Lampiran 11. Kecernaan P (%) setiap perlakuan
Perlakuan/pakan P pakan Cr pakan Cr feses P feses Kecernaan P
A1 0,75 0,58 1,75 0,38 83,21
A1+enzim 0,81 0,55 1,83 0,25 90,91
B1KSM 0,84 0,43 0,79 0,19 87,75
B1KSM+enzim 0,95 0,6 1,34 0,21 90,30
Ket : KSM : Tepung biji kapuk (kapook seed meal)
Lampiran 12. Fosfor (P) yang terkandung dalam tulang (%) setiap perlakuan
Ulangan Perlakuan/pakan
1 2 3
Rata-rata
A1 6,47 5,06 4,91 5,48±0,86
A1+enzim 5,14 6,23 4,57 5,31±0,84
B1KSM 4,64 5,20 4,79 4,88±0,29
B1KSM+enzim 4,14 5,18 4,96 4,76±0,55
Lampiran 13. Kecernaan protein pakan (%) setiap perlakuan
Perlakaun/pakan Protein
pakan Cr pakan Cr feses
Protein feses
Kecernaan protein
A1 31,79 0,58 1,75 14,00 85,40
A1+enzim 31,65 0,55 1,83 12,71 87,93
B1KSM 31,85 0,43 0,79 9,76 83,32
B1KSM+enzim 31,82 0,6 1,34 10,74 84,89
Ket : KSM :Tepung biji kapuk (kapook seed meal)
Lampiran 14. Ekskresi total ammonia nitrogen (TAN) setiap perlakuan
Ulangan Rata-rata
Perlakuan/pakan
1 2
A1 0,001 0,001 0,001 ± 0,00
A1+enzim 0,001 0,001 0,001 ± 0,00
B1KSM 0,001 0,001 0,001 ± 0,00
B1KSM+enzim 0,001 0,001 0,001 ± 0,00
Lampiran 15. Hasil analisis proksimat tubuh awal dan akhir ikan Lele Dumbo (Clarias sp) (% bobot kering) yang dipelihara selama 60 hari.
Perlakuan/pakan Ulangan Abu Protein Lemak S.Kasar BETN
Awal 18,00 54,55 22,07 0,36 5,02
1 14,10 51,77 27,43 1,01 5,69
2 16,25 50,40 25,39 1,39 6,57
A1
3 15,66 52,03 23,25 1,35 7,71
Rata-rata 15,34±1,11 51,40±0,88 25,35±2,09 1,25±0,21 6,65±1,01
1 15,66 52,69 23,89 1,70 6,07
2 17,99 54,43 21,75 1,25 4,58
A1+ enzim
3 14,38 49,39 32,78 1,10 2,35
Rata-rata 16,01±1,83 52,17±2,56 26,14±5,85 1,35±0,31 4,34±1,87
1 14,09 54,66 23,05 1,52 6,68
2 16,34 56,70 19,01 1,23 6,72
B1KSM
3 19,61 56,97 20,63 1,41 1,38
Rata-rata 16,68±2,78 56,11±1,26 20,90±2,03 1,39±0,15 4,93±3,07
1 16,78 60,25 16,90 1,20 4,87
2 17,96 66,30 13,80 1,51 0,42
B1KSM+enzim
3 18,28 63,96 16,52 1,12 0,13
Rata-rata 17,67±0,79 63,50±3,05 15,74±1,69 1,28±0,21 1,81±2,66
Lampiran 16. Analisa protein dan lemak hati ikan Lele Dumbo (Clarias sp ) (% bobot kering) tiap perlakuan
Parameter
Perlakuan/pakan Ulangan Protein awal Protein akhir Lemak awal Lemak akhir
1 60,46 51,20 36,50 29,96
2 60,46 52,97 36,50 37,59
A1
3 60,46 52,00 - -
Rata-rata 60,46±0,00 52,06±0,89 36,50±0,00 33,78±5,40
1 60,46 62,04 36,50 24,96
2 60,46 65,39 36,50 32,73
A1+enzim
3 60,46 68,48 - -
Rata-rata 60,46±0,00 65,30±3,22 36,50±0,00 28,85±5,50
1 60,46 53,21 36,50 29,15
2 60,46 57,23 36,50 30,17
B1KSM
3 60,46 61,13 - -
Rata-rata 60,46±0,00 57,19±3,96 36,50±0,00 29,66±0,72
1 60,46 61,98 36,50 31,59
2 60,46 60,31 36,50 32,12
B1KSM+enzim
3 60,46 60,91 - -
Rata-rata 60,46±0,00 61,07±0,85 36,50±0,00 31,86±0,37
47
Lampiran 17. Analisis sidik ragam kadar protein tubuh
ANOVA
A : Bahan nabati (SBM dan SBM+KSM); B : Dengan dan tanpa enzim fitase; AB : Interaksi A&B
Lampiran 18. Analisis sidik ragam kadar lemak tubuh
ANOVA
A : Bahan nabati (SBM dan SBM+KSM); B : Dengan dan tanpa enzim fitase; AB : Interaksi A&B
Lampiran 19. Analisis sidik ragam kadar protein hati
ANOVA
48
Lampiran 20 Analisis sidik ragam kadar lemak hati
ANOVA
A : Bahan nabati (SBM dan SBM+KSM); B : Dengan dan tanpa enzim fitase; AB : Interaksi A&B
Lampiran 21. Retensi protein (%) setiap perlakuan
Ulangan
Ket : KSM :Tepung biji kapuk (kapook seed meal)
Lampiran 22. Retensi lemak (%) setiap perlakuan
Ulangan Perlakuan/pakan
1 2 3 Rata-rata
A1 90,26 97,34 75,83 87,81±10,96
A1+enzim 80,62 61,60 105,26 82,49±21,89
B1KSM 103,00 57,58 85,89 82,16±22,94
B1KSM+enzim 44,36 26,95 47,05 39,45±10,91