I MADE ARISUDANA PUTRA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
PROPAGASI MIKRO DAN SAMBUNG MIKRO JERUK
KEPROK GARUT (
Citrus reticulata
) HASIL MUTAGENESIS
IN
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Propagasi Mikro dan Sambung Mikro Jeruk Keprok Garut (Citrus reticulata) Hasil Mutagenesis In Vitro dengan Batang Bawah Japansche Citroen adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya saya ini kepada Institut Pertanian Bogor.
Bogor, November 2014
ABSTRAK
I MADE ARISUDANA. Propagasi Mikro dan Sambung Mikro Jeruk Keprok Garut (Citrus Reticulata) Hasil Mutagenesis In Vitro dengan Batang Bawah Japansche Citroen. Dibimbing oleh AGUS PURWITO dan MIA KOSMIATIN.
Penelitian ini bertujuan mendapatkan konsentrasi penambahan kinetin terbaik pada multiplikasi jeruk keprok garut hasil induksi mutasi, mendapatkan perlakuan perendaman GA3 terbaik untuk perkecambahan batang bawah
Japansche Citroen (JC), dan mendapatkan konsentrasi gula terbaik untuk menumbuhkan tanaman hasil sambung mikro. Penelitian dibagi menjadi tiga tahap. Pada tahap pertama, tunas hasil induksi mutasi sebagai batang atas diperbanyak dengan dipotong 2 buku dan ditanam pada media dasar dengan penambahan konsentrasi kinetin sebanyak 1 mg/L, 3 mg/L, dan 5 mg/L. Pada tahap kedua, biji JC direndam dalam larutan GA3 10 mg/L selama 1, 2, 3 jam lalu
dikecambahkan dalam media dasar sebagai batang bawah. Pada tahap ketiga, eksplan hasil tahapan 1 dan 2 disambung kemudian ditanam pada media dasar dengan penambahan gula sebesar 30g/L, 50g/L, dan 70 g/L. Konsentrasi kinetin optimal untuk pertumbuhan batang atas adalah 1 mg/l sedangkan untuk kecepatan dan jumlah tunas baru adalah 5 mg/l. Lama perendaman pada larutan GA3 10 mg/l
yang terbaik untuk memacu perkecambahan biji dan pemanjangan kecambah adalah 3 jam. Persentase keberhasilan sambung mikro tertinggi diperoleh media dengan konsentrasi gula 70 g/l.
Kata kunci: giberelin, kinetin, multiplikasi, gula
ABSTRACT
I MADE ARISUDANA. Micropropagation and Micrografting of Mandarin var. Garut (Citrus reticulata) Derived from In Vitro Mutagenesis with Japansche Citroen as Rootstock. Supervised by AGUS PURWITO and MIA KOSMIATIN.
This study aimed to get proper concentration of kinetin for multiplication of Mandarin var. Garut as derived from in vitro mutation, to determine period of immersion of Japansche citroen seed in GA3 10 mg/l solution and to get proper
concentration of sucrose concentration in agar for grafted plant. This research is consist of three steps. For the first step, shoot as derived from in vitro mutation multiplicated with 2 books cutting and planted in standard medium with kinetin 1 mg/L, 3 mg/L, 5 mg/L added. For the second step, JC seed immersed in 10 mg/L of GA3 for 1, 2, and 3 hours and planted in standard medium. For the last step,
explant from the first and second step was grafted and planted in standard medium with sucrose 30 g/L, 50 g/L, and 70 g/L. The optimal concentration of kinetin for scion growth is 1 mg/l and for multiplication is 5 mg/l. The best period for rootstock immersion in GA3 solution is 3 hours. The best percentage of success
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
PROPAGASI MIKRO DAN SAMBUNG MIKRO JERUK
KEPROK GARUT (
Citrus reticulata
) HASIL MUTAGENESIS
IN
VITRO
DENGAN BATANG BAWAH JAPANSCHE CITROEN
I MADE ARISUDANA PUTRA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Propagasi mikro dan Sambung Mikro Jeruk Keprok Garut (Citrus reticulata) Hasil Mutagenesis In Vitro dengan Batang Bawah Japansche Citroen
Nama : I Made Arisudana Putra NIM : A24100130
Disetujui oleh,
Dr Ir Agus Purwito, MScAgr Dr Mia Kosmiatin, SSi.MSi.
Dosen Pembimbing 1 Dosen Pembimbing II
Diketahui oleh
Dr Ir Agus Purwito, MScAgr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilakukan penulis berjudul Propagasi Mikro dan Sambung Mikro Jeruk Keprok Garut Hasil Mutagenesis In Vitro dengan Batang Bawah Japansche Citroen.
Penulis menyampaikan terima kasih kepada Dr Ir Agus Purwito, MSc.Agr dan Dr Mia Kosmiatin, SSi, MSi selaku dosen pembimbing skripsi. Terima kasih juga prnulis sampaikan kepada Dr. Ir Supijatno, Msi selaku dosen pembimbing akademik. Ungkapan terima kasih juga penulis sampaikan kepada I Made Utama dan Kitty Lisa yang selaku orang tua yang tidak ada habisnya menyemangati dan membantu penulis, juga teman seperjuangan Mohammad Prayogi dan Danu Kuansa, serta teman-teman Edelweiss AGH 47.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Hipotesis 2
TINJAUAN PUSTAKA 3
Jeruk Japansche Citroen 3
Jeruk Keprok Garut 3
Sambung Mikro Jeruk 4
Media Kultur Jaringan 5
Zat Pengatur Tumbuh 5
METODE PENELITIAN 7
Lokasi Penelitian dan Waktu Penelitian 7
Bahan 7
Alat 7
Prosedur Penelitian 7
Analisis Data 10
HASIL DAN PEMBAHASAN 11
Multiplikasi Jeruk Keprok Garut Hasil Mutagenesis In Vitro 11
Perkecambahan Biji Japansche Citroen (JC) 13
Sambung Mikro Batang Atas Jeruk Keprok Garut Putatif Mutan dengan Batang
Bawah JC 15
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 18
LAMPIRAN 20
DAFTAR TABEL
1 Pertumbuhan tunas jeruk keprok putatif mutan pada media multiplikasi tunas dengan penambahan kinetin 8 minggu setelah dikulturkan 10 2 Rata-rata pertambahan tinggi tunas jeruk keprok putatif mutan 10 3 Rata-rata pertambahan tinggi kecambah JC hasil perlakuan dengan GA3,
5 dan 8 minggu setelah pengkulturan 12
DAFTAR GAMBAR
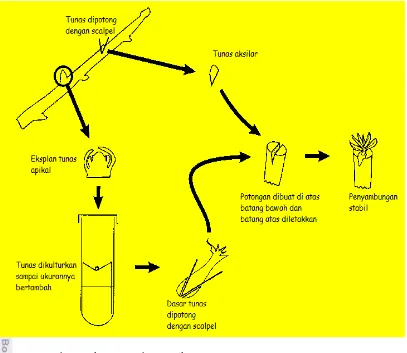
1 Skema sambung mikro menurut Navarro (1988) 5
2 Skema penyambungan mikro antara tunas putatif mutan jeruk keprok garut (batang atas) dengan jeruk JC (batang bawah) 9 3 Jumlah tunas jeruk putatif mutan per minggu pada media multiplikasi
tunas 12
4 Persentase perkecambahan benih JC setelah diberi perlakuan GA3 10
mg/l, 8 minggu setelah dikulturkan 13
5 Perkecambahan benih JC setelah diberi perlakuan GA3 10 mg/l, 8
minggu setelah dikulturkan 14
6 Persentase keberhasilan sambung mikro antara tunas jeruk keprok putatif mutan dengan batang bawah JC, 8 minggu setelah pengkulturan. 15 7 Pertumbuhan sambung mikro antara tunas jeruk keprok putatif mutan
dengan batang bawah JC pada media dengan peningkatan konsentrasi
gula 15
8 Jumlah tunas samping batang bawah 16
DAFTAR LAMPIRAN
PENDAHULUAN
membuat konsumsi jeruk di Indonesia cukup tinggi terbukti dari kebutuhan impor jeruk di Indonesia yang meningkat tajam dari 100 655 ton tahun 2006 menjadi 204 148 ton pada tahun 2010 (BPS 2010).Pemuliaan jeruk bisa dilakukan secara konvensional maupun non-konvensional. Pemuliaan secara konvensional yakni persilangan memiliki beberapa kendala yakni: tingginya kerontokan buah, rendahnya kemampuan pembentukan buah, dan viabilitas tepung sari yang rendah (Martasari 2008). Pemuliaan mutasi secara in vitro merupakan salah satu teknik non konvensional yang dapat dipilih dalam pemuliaan jeruk. Kendala yang dihadapi dalam teknik ini antara lain lambatnya regenerasi tunas dan pertumbuhan tunas putatif mutan sehingga perlu dilakukan upaya untuk mempercepat pertumbuhan tunas tersebut.
Perbanyakan tanaman jeruk bisa dilakukan secara generatif yakni dengan biji atau dengan vegetatif yakni dengan cangkok maupun sambung. Perbanyakan secara dengan biji jarang dilakukan karena fase juvenil pada jeruk yang lama (antara 3-20 tahun) (Pena et al. 2001). Lamanya fase juvenil dari jeruk memperlambat proses pembuahan jeruk di lapangan. Perbanyakan secara vegetatif yakni secara sambung atau grafting banyak dipilih karena dapat melewati masa juvenil.
Penyambungan mengombinasikan antara batang bawah dan batang atas dengan keunggulan masing-masing. Batang bawah yang dipakai umumnya memiliki perakaran yang kuat dan tahan terhadap penyakit perakaran tertentu sedangkan batang atas yang dipakai umumnya memiliki produktivitas yang tinggi (Tambing 2008). Penyambungan pada tanaman jeruk bisa dilakukan secara konvensional maupun secara in vitro Sambung konvensional memiliki masalah terutama dalam ketersediaan batang atas dan batang bawah yang lama karena harus menunggu batang atas dan bawah tumbuh sesuai dengan kriteria sambung (Khan 2007), dan dalam penanganan penyakit (Roistacher 2004).
Sambung mikro adalah teknik yang sangat berpotensi karena menggabungkan keuntungan propagasi mikro dengan pertambahan produksi hasil penyambungan batang bawah dan batang atas (Gebhardt dan Goldbach 1988). Teknik ini bebas dari penyakit karena dilakukan pada kondisi in vitro dan jaringan meristem dapat dibebaskan dari virus dan patogen lainnya (Mudge et al. 2009). Tanaman disambung pada umur yang relatif sangat muda sehingga inkompatibilitas dapat segera terlihat (Obeidy dan Smith 1991) dan pertumbuhan batang atas lebih dapat dipacu.
2
dan Lestari (1998) menyatakan bahwa untuk mendapatkan hasil yang optimum maka penggunaan media dasar dan zat pengatur tumbuh yang tepat merupakan faktor yang penting. Batang atas perlu diperbanyak terutama pertambahan tunas baru yang akan digunakan sebagai batang atas dalam sambung mikro. Penyediaan batang bawah dilakukan dengan perkecambahan yang dipacu dengan pertambahan ZPT. Zat Pengatur Tumbuh yang umum digunakan untuk menginduksi tunas baru dan perkecambahan adalah kinetin dan giberelin.
Penelitian ini bertujuan mendapatkan konsentrasi penambahan kinetin terbaik pada media multiplikasi jeruk keprok garut hasil induksi mutasi, mendapatkan lama perendaman dalam GA3 terbaik untuk perkecambahan batang
bawah Japansche Citroen (JC), dan mendapatkan konsentrasi gula terbaik untuk menumbuhkan tanaman hasil sambung mikro.
Tujuan Penelitian
1. Mendapatkan konsentrasi kinetin terbaik untuk pertumbuhan tunas pucuk jeruk keprok garut hasil induksi mutasi yang dapat dipakai sebagai batang atas.
2. Mendapatkan perlakuan perendaman terbaik pada larutan GA untuk mengecambahkan biji batang bawah bawah Japansche Citroen (JC).
3. Mendapatkan konsentrasi sukrosa terbaik untuk keberhasilan sambung mikro tunas putatif mutan dengan JC.
Hipotesis
1. Terdapat konsentrasi kinetin terbaik untuk multiplikasi jeruk keprok garut hasil induksi mutasi.
2. Terdapat perlakuan perendaman terbaik dalam larutan GA untuk mengecambahkan batang bawah JC.
3
TINJAUAN PUSTAKA
Jeruk Japansche Citroen
Menurut Hodgson (1967) tanaman jeruk yang penting secara komersial dapat dikelompokkan menjadi empat kelompok yaitu orange (jeruk manis), mandarin (jeruk keprok), pummelo (jeruk besar) dan grapefruit, serta kelompok common acid (lime, lemon, dan citron).
Taksonomi tanaman jeruk menurut Cronquist (1981), Divisio : Magnoliophyta
Japansche Citroen (Citrus limonia Osbeck) merupakan varietas hibrid hasil persilangan antara Citrus reticulata dengan Citrus medic. Japansche Citroen sebenarnya adalah Rangpur Lime berasal dari India atau Canton Lemon, di Jepang disebut Hime Lemon, dan di Brazil disebut Cravo Lemon (Swingle dan Reece 1967). Jeruk ini seringkali dijadikan batang bawah dalam grafting tanaman jeruk karena tahan kekeringan, dapat merangsang buah lebih awal, mampu menghasilkan produksi tinggi dengan kualitas baik, serta tahan terhadap serangan virus Exocortis (Sugiyanto 1994). Jeruk JC juga mempunyai daya adaptasi yang luas, kompatibel dengan berbagai varietas jeruk batang atas, dan dapat bertahan dengan baik pada kondisi lahan rawa daerah pasang surut (Dwiastuti et al. 2007, Putri 2002, Supriyanto dan Setiono 2008).
Benih JC bersifat poliembrioni yakni di dalam sebuah kantung embrio terdapat lebih dari satu embrio yaitu embrio zigotik dan atau embrio nuselar sehingga menguntungkan untuk perbanyakan batang bawah karena embrio ini bersifat seragam dengan induknya. Andriani et al. (2013) menyatakan bahwa JC memiliki 1-6 embrio yang mampu tumbuh menjadi 1-4 semaian. Tingkat kemasakan fisiologis benih JC dapat ditandai dengan indeks vigor, kecepatan tumbuh, dan daya berkecambah optimum yang diperoleh pada saat buah berwarna kuning lebih dari 90% merata dengan karakter warna kulti benih krem kecoklatan dan embrio dominan krem.
Jeruk Keprok Garut
Jeruk keprok garut merupakan salah satu buah unggulan nasional. Ciri-ciri Jeruk keprok yakni aromanya khas, menyegarkan, rasanya enak, manis, memiliki rasa asam, segar dan warna kulit kekuning-kuningan serta daging buah mudah terlepas dari kulit ari. Produktivitas jeruk keprok garut rata-rata 40–50 kg/pohon dalam satu musim.
4
tercatat pada tahun 1992 populasinya hanya tinggal 52.000 pohon. (Diperta Jabar 2011)
Sambung mikro jeruk
Grafting atau graftage adalah penggabungan buatan atau secara alami dari bagian tanaman sehingga kontinuitas vaskular terjadi di antara 2 tanaman tersebut . Hasilnya adalah individu yang secara genetik tergabung dan berfungsi sebagai satu individual tanaman. Teknik penyambungan ini melibatkan batang atas dan batang bawah. Batang bawah seringkali disebut rootstock karena umumnya batang bawah dipilih karena sifat perakarannya yang unggul. Batang atas dipilih karena karakter batangnya, daun, bunga, atau buahnya biasa disebut scion atau entres. Terdapat 3 tujuan utama dalam pemilihan batang atas yakni performa pohon (hasil, adaptasi klimatik, adaptasi panen mekanik, dan ketahanan Organisme Pengganggu Tanaman), karakteristik buah (penampakan, ukuran, PadatanTerlarut Total /Total Asam Tertitrasi (PTT/TAT), jumlah jus, rasa, seedless, maupun umur panen), dan pascapanen buah (penanganan, nilai ekonomi, kualitas prosesing, dan lama penyimpanan). Sedangkan batang bawah dipilih dengan tujuan peningkatan produktivitas, pengurangan ukuran tanaman (dwarf), adaptasi kondisi tanah maupun cekaman lingkungan, ketahanan penyakit maupun hama, peningkatan kualitas buah, dan peningkatan produksi benih (Khan 2007).
Micrografting merupakan salah satu teknik grafting yang menggabungkan keuntungan dari pertumbuhan secara cepat in vitro, karena pada perkembangbiakan secara in vitro dapat dioptimalkan lingkungan tumbuh tanaman dengan penambahan berbagai ZPT yang sesuai, dengan penambahan produktivitas dari metode grafting. 5 langkah penting yang perlu diperhatikan dalam Shoot Tip Micrografting (STG) berdasarkan Nappo Treatment Protocol (2009) adalah mendapatkan benih batang bawah dan kecambahkan secara in vitro, mendapatkan tunas muda, sambung mikro, re-graft, dan aklimatisasi.
5
Gambar 1 Skema sambung mikro menurut Navarro (1988) Media Kultur Jaringan
Pertumbuhan dan perkembangan tanaman dalam keadaan in vitro dipengaruhi oleh empat faktor yakni genetik, nutrisi, lingkungan, dan substansi organik (Pierik 1998). Di antara keempat faktor tersebut, media menyumbang faktor nutrisi dan substansi organik dalam keberhasilan kultur jaringan.
Secara umum media kultur jaringan terdiri dari makronutrien, mikronutrien, sumber karbon, vitamin, sumber asam amino, zat pengeras, dan zat pengatur tumbuh. Walaupun tidak bisa dipakai di semua tanaman, formulasi media yang paling umum digunakan adalah media Muroshige dan Skoog. Lebih dari 70% fromulasi media yang berhasil meregenerasikan baik tanaman dikotil maupun monokotil menggunakan fromulasi media MS (Evans et al. 1981). Media MS lengkap berisi makronutrien, mikronutrien, serta vitamin dan asam organik dengan komposisi yang tepat untuk mendukung pertumbuhan tanaman.
Zat Pengatur Tumbuh
6
ZPT menentukan pertumbuhan dan perkembangan seluruh bagian tumbuhan secara spesifik.
Terdapat lima kelompok ZPT yang biasa digunakan dalam kultur jaringan, yaitu: auksin, sitokonin, giberelin, asam absisat (ABA), dan etilen. Penelitian baru ini mengelompokkan brassinosteroid sebagai kelompok ZPT keenam (Bajguz dan Tretyn 2002). Sitokinin memegang peranan penting dalam pembelahan sel serta pembentukan jaringan meristem pembentuk organ. Kinetin merupakan turunan dari sitokinin yang banyak dipakai dalam propagasi mikro tanaman hias (Jain dan Ochatt 2010). Proliferasi dan multiplikasi tunas pada in vitro didasarkan pada formulasi media yang mengandung sitokinin sebagai ZPT utamanya (Mamidala dan Nanna 2009). Berbagai penelitian juga menggunakan sitokinin dalam media untuk multiplikasi tunas Rosa damascena(Kumar et al 2001). Afshin et al (2011) melakukan multiplikasi tunas Matthiola incana dengan bantuan kinetin dan melaporkan bahwa pertambahan panjang dan banyaknya node tunas berbanding lurus dengan konsentrasi kinetin yang dipakai.
Giberelin juga merupakan salah satu ZPT dalam mengatur pemanjangan sel dan membantu perkecambahan biji dengan menstimulasi molekul mRNA dalam biji untuk mengeluarkan enzim-enzim hidrolitik. Dalam jeruk sendiri GA telah dipakai dalam perkecambahan sweet oranges (Burns dan Coggins 1969) dan mandarin (Rawash et al 1980). GA3 secara umum digunakan untuk membantu
METODE PENELITIAN
Lokasi Penelitian dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium in vitro kelompok peneliti Biologi Sel dan Jaringan Balai Besar Bioteknologi dan Smber Daya Genetik serta Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini akan dilaksanakan pada April 2014 hingga Agustus 2014.
Bahan
Bahan yang digunakan sebagai eksplan dalam penelitian ini adalah tunas hasil induksi mutasi Ethyl Methyl Sulfonate (EMS) pada kalus jeruk keprok yang akan diperbanyak dan disambung mikro dengan Japansche Citroen sebagai batang bawah. Bahan kimia yang digunakan adalah formulasi media dasar MS, formulasi vitamin Morel and Wetmore (MW), Giberelin Acid (GA3), Kinetin,
bahan sterilisasi (alkohol 96%, sodium hypochlorite 30%, dan sodium hypochlorite 10%), Malt Extract, serta gula pasir.
Alat
Alat yang digunakan terdiri atas peralatan gelas (botol kultur, botol ukur, gelas piala, cawan petri, gelas ukur, dan corong gelas), kompor, otoklaf, laminar airflow cabinet, filter milipore, syringe, peralatan diseksi seperti pinset, gunting, dan scalpel, lampu spiritus, rak kultur, stirrer, pengukur pH digital, kertas label, plastik dan karet gelang. Pada saat kultur tanaman diperlukan rak dan ruang kultur bersuhu 18°C-21°C.
Prosedur Penelitian
Persiapan Alat dan Bahan
8
Percobaan terdiri dari 3 kegiatan percobaan. Percobaan 1 untuk memultiplikasi tunas batang atas jeruk keprok garut hasil induksi mutasi, percobaan 2 untuk mengecambahkan biji jeruk JC dengan perlakuan perendaman dalam GA3, dan percobaan 3 untuk menumbuhkan tanaman hasil sambung mikro.
Percobaan 1 Multiplikasi jeruk keprok putatif mutan pada media dengan penambahan kinetin
Tunas in vitro hasil induksi mutasi dipotong kira-kira 2 buku, dan disubkultur pada media perlakuan multiplikasi yaitu MS+Vitamin Mwdengan penambahan kinetin 1, 3, 5 mg/l. Pengamatan dilakukan tiap minggu terhadap tinggi tanaman, jumlah buku, dan jumlah tunas baru. Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap dengan konsentrasi kinetin sebagai faktornya. Terdapat 12 ulangan untuk masing-masing perlakuan sehingga terdapat 36 satuan percobaan. Tiap satuan percobaan terdiri dari 3 eksplan sehingga terdapat 108 satuan amatan.
Model aditif linear yang digunakan adalah
Yik = μ + αi + εik
Keterangan :
Yik = respon pengaruh konsentrasi kinetin ke-i
μ = rataan umum
αi = pengaruh konsentrasi kinetin taraf ke-i
εik = galat pada perlakuan konsentrasi kinetin taraf ke-i pada ulangan ke-k Komponen pertumbuhan tunas jeruk keprok garut putatif mutan yang diamati pada 108 tanaman. Pengamatan dilakukan sampai minggu 8 MST dikarenakan penyesuaian dengan pertumbuhan batang bawah agar berukuran diameter 1.6-2 mm.
1. Tinggi tunas
tinggi tunas diukur dari permukaan agar sampai titik tumbuh. Pengamatan dilakukan mulai dari 1 MST hingga 8 MST
2. Jumlah buku
Jumlah buku dihitung dari banyaknya ruas antar daun. Pengamatan dilakukan mulai dari 1 MST hingga 8 MST
3. Jumlah tunas
Dihitung dari jumlah tunas tumbuh pada buku. Pengamatan dilakukan mulai dari 1 MST hingga 8 MST
Percobaan 2 Perkecambahan biji Japansche Citroen (JC) dengan perlakuan GA3
Buah JC direndam dalam larutan alkohol 96% selama 1 jam dan dibilas dengan akuades steril. Biji kemudian diambil dari buah dengan bantuan pinset dan scalpel dalam laminar air flow cabinet. Biji diperlakukan dalam larutan GA3 10
9
masing-masing perlakuan sehingga terdapat 27 satuan percobaan. Tiap satuan percobaan terdiri dari 5 eksplan sehingga terdapat 135 satuan amatan perlakuan. Model aditif linear yang digunakan adalah
Yik = μ + αi + εik
Keterangan :
Yik = respon pengaruh perlakuan perendaman GA3 ke-i
μ = rataan umum
αi = pengaruh perlakuan perendaman GA3 taraf ke-i
εik = galat pada perlakuan perendaman GA3 taraf ke-i pada ulangan ke-k
Komponen perkecambahan biji jeruk JC yang telah direndam dalam larutan GA3
10 mg/L diamati pada 135 tanaman. 1. Daya berkecambah
Daya berkecambah dihitung dari banyaknya kecambah normal yang tumbuh, dengan kriteria kecambah normal yaitu munculnya dua daun pertama berwarna hijau dengan bentuk daun sempurna. Selain itu dihitung juga kecambah tidak normal dan biji tidak tumbuh. Pengamatan dilakukan pada 8 MST
2. Tinggi kecambah
Tinggi kecambah diukur dari pangkal tumbuh batang sampai titik tumbuh. pengamatan dilakukan saat biji mulai berkecambah
Percobaan 3 Optimasi pertumbuhan tanaman hasil sambung mikro jeruk keprok putatif mutan dengan JC
Tunas batang atas hasil multiplikasi dipotong pucuknya kira-kira sepanjang 2 buku sedangkan batang bawah hasil perkecambahan JC dibuang bagian tunas pucuknya menyisakan bagian hipokotil sepanjang ±3 cm. Bagian atas hipokotil batang atas dipotong membentuk seperti huruf V sedangkan pada batang bawah disayat bagian tengah sepanjang kira-kira 0.3 cm. Batang atas kemudian disambungkan/disisipkan dengan batang bawah menggunakan pinset. Tanaman hasil sambung ini kemudian ditanam dalam media MS0 yang ditambahkan gulanya sesuai perlakuan yakni 30 g/l, 50 g/l, dan 70 g/l. Pengamatan dilakukan setiap minggu sampai minggu keempat terhadap persentase keberhasilan sambung. Rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan konsentrasi gula pasir sebagai faktornya. Terdapat 7 ulangan untuk masing-masing perlakuan sehingga terdapat 21 satuan percobaan. Tiap satuan percobaan terdiri dari 2 eksplan sehingga terdapat 42 satuan amatan.
Model aditif linear yang digunakan adalah
Yik = μ + αi + εik
Keterangan :
Yik = respon pengaruh konsentrasi sukrosa ke-i
μ = rataan umum
αi = pengaruh konsentrasi sukrosa taraf ke-i
10
Komponen pertumbuhan tanaman hasil sambung mikro yang telah diamati pada 42 tanaman
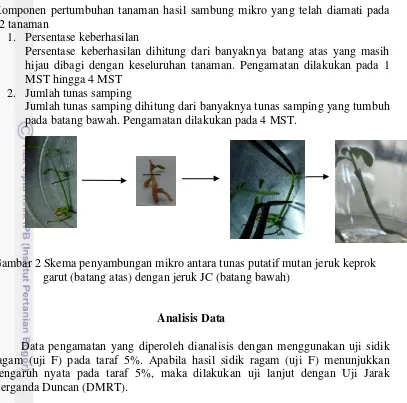
1. Persentase keberhasilan
Persentase keberhasilan dihitung dari banyaknya batang atas yang masih hijau dibagi dengan keseluruhan tanaman. Pengamatan dilakukan pada 1 MST hingga 4 MST
2. Jumlah tunas samping
Jumlah tunas samping dihitung dari banyaknya tunas samping yang tumbuh pada batang bawah. Pengamatan dilakukan pada 4 MST.
Gambar 2 Skema penyambungan mikro antara tunas putatif mutan jeruk keprok garut (batang atas) dengan jeruk JC (batang bawah)
Analisis Data
11
HASIL DAN PEMBAHASAN
Multiplikasi Jeruk Keprok Garut Hasil Mutagenesis In Vitro
Multiplikasi merupakan tahap penting dalam propagasi mikro tanaman. Hal ini bertujuan untuk memperbanyak tanaman yang memiliki sifat yang sama dengan tanaman induk. Multiplikasi dilakukan dengan menginduksi dari tunas samping atau tunas adventif. Tunas yang diperlukan dalam sambung mikro adalah tunas pucuk berukuran 1-2 cm dengan 2-3 primordia daun. Hasil pengamatan pertumbuhan tunas putatif mutan menunjukkan pertumbuhan tunas yang relatif lambat (tabel 1).
Tabel 1 Pertumbuhan tunas jeruk keprok putatif mutan pada media multiplikasi tunas dengan penambahan kinetin 8 minggu setelah dikulturkan
Media Jumlah tunas Tinggi tunas (cm) Jumlah buku
K1 1.11 ±0.64 0.39 ±0.18 1.50 ±1,12
K3 0.83 ±0.65 0.38 ±0.18 0.81 ±0,67
K5 1.45 ±1.25 0.23 ±0.10 1.11 ±0,83
Keterangan: K1=media dengan penambahan kinetin 1 mg/l, K3=media dengan penambahan kinetin 3 mg/l, K5=media dengan penambahan kinetin 5 mg/l
Tunas yang ditumbuhkan pada media dengan penambahan kinetin konsentrasi 1 mg/l menunjukkan rata-rata pertambahan tinggi dan jumlah buku yang paling besar dibandingkan dengan kedua perlakuan lain. Rata-rata pertambahan tinggi tanaman pada media kinetin 1 mg/l adalah 0.39 cm dengan pertambahan buku 1.50. Media dengan penambahan kinetin 5 mg/l menunjukkan jumlah tunas terbanyak yakni 1.45 tunas baru per eksplan, tetapi pertambahan tingginya tidak signifikan yakni hanya 0.23 cm (tabel 2). Sambung mikro memerlukan batang atas dari tunas pucuk sehingga jumlah tunas baru adalah yang terpenting, sehingga tunas yang belum membentuk tunas baru disubkultur pada media dengan penambahan kinetin 5 mg/l. Fungsi utama kinetin adalah dalam pembelahan sel sehingga jumlah yang tepat dapat menginduksi tunas baru.
Tabel 2 Rata-rata pertambahan tinggi tunas jeruk keprok putatif mutan pada media multiplikasi
Konsentrasi kinetin (mg/l) Umur (MST)
3 5 8
Angka pada kolom yang sama, diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan), KK=Koefisien Keragaman, (T)=hasil transformasi log (100 * x)
12
pada minggu ke-8 sehingga pertumbuhannya lebih tinggi daripada eksplan pada kinetin konsentrasi 3 mg/l. Media dengan penambahan kinetin konsentrasi 3 mg/l menginduksi pertumbuhan secara cepat pada awal, tetapi pertumbuhannya melambat setelah minggu ke 5. Hal ini berbeda dengan media dengan konsentrasi kinetin 1 mg/l yang menginduksi pertumbuhan lambat pada awal, tetapi nilai pertumbuhan eksplan semakin tinggi tiap minggunya. Ekplan pada media dengan konsentrasi kinetin 5 mg/l memiliki nilai pertumbuhan yang paling rendah dibandingkan dengan kedua perlakuan lain. Hal ini diduga karena konsentrasi kinetin yang berlebihan cenderung menghambat pertambahan tinggi tanaman. Kinetin selain dapat menginduksi pembelahan sel, juga dapat menginduksi pertumbuhan sel dan dapat meningkatkan tinggi tanaman (Miller et al. 1995). Nilai koefisien keragaman pada data tergolong tinggi untuk penelitian yang berbasis laboratorium. Hal ini dikarenakan eksplan yang merupakan hasil dari induksi mutasi. Eksplan hasil induksi mutasi memiliki kondisi tiap sel maupun gen yang belum stabil dan berbeda-beda sehingga respon terhadap perlakuan juga berbeda-beda.
Kinetin berperan dalam menginduksi tunas baru dan telah terbukti dalam menginduksi tunas baru pada ubi kayu (Khumaida N et al. 2011), Purwoceng (Darwati dan Roostika 2006), dan Seruni. Lestari (2011) menyatakan bahwa penggunaan zat pengatur tumbuh sitokinin (BA atau kinetin) dapat memacu pertumbuhan tunas baru. Pada tunas putatif mutan jeruk keprok, tunas baru mulai terbentuk pada minggu ketiga. Kinetin 5 mg/l menginduksi tunas baru paling banyak setiap minggunya dibandingkan dengan kinetin 1 mg/l dan 3 mg/l. Kinetin 5 mg/l menginduksi pembentukan 53 tunas baru sedangkan kinetin 1mg/l dan 3 mg/l hanya menghasilkan 38 dan 30 tunas baru pada minggu ke 8 setelah kultur. Hesar A et al. (2011) menyatakan bahwa konsentrasi kinetin berbanding lurus dengan pertambahan jumlah tunas baru, jadi dengan peningkatan konsentrasi kinetin dapat memacu pertambahan tunas.
Multiplikasi dapat dilakukan dengan memperbanyak tunas samping sehingga jumlah buku mempengaruhi berapa banyak tanaman bisa diperbanyak. Eksplan pada media dengan konsentrasi kinetin 1 mg/l menghasilkan buku terbanyak dibandingkan dengan kinetin 3 mg/l dan 5 mg/l. Rata-rata satu eksplan yang dikulturkan pada media dengan penambahan kinetin 1 mg/l menghasilkan 1.6 buku per tunas. Hasil ini lebih baik dibanding dengan kinetin 3 mg/l dan 5 mg/l yang rata-rata hanya menghasilkan 1.2 buku per eksplan dalam periode 8 minggu pengkulturan.
13
Gambar 3 Multiplikasi jeruk keprok garut putatif mutan pada media dengan penambahan kinetin 1 mg/l (a), 3 mg/l (b), dan 5 mg/l (c)
Perkecambahan Biji Japansche Citroen (JC)
GA3 berperan penting dalam perkecambahan benih. Giberelin pada benih
belum masak (berukuran kecil/muda) merangsang perkecambahan dengan menghilangkan kekangan mekanik yang berasal dari jaringan di sekitar embrio dan mengendurkan dinding sel (Ogawa et al. 2003). Giberelin endogen pada epitelium merangsang perkecambahan dengan menginduksi α-amilase sehingga cadangan makanan cepat terserap benih (Kaneko et al. 2002). Perendaman benih dalam larutan giberelin telah diketahui dapat memecahkan dormansi pada benih padi (Vieira et al. 2002). Larutan GA3 hasil perendaman dapat kembali dipakai
dengan mensterilkan larutan dengan filter milipore sehingga lebih ekonomis dibandingkan penambahan GA3 pada media, namun perlu diteliti lebih lanjut
tentang aktifitas GA3 yang yang dipakai berulang.
Benih JC yang dipakai diperoleh dari Balai Penelitian Tanaman Jeruk dan Buah Subtropika yang masih sangat muda yakni berumur 5 bulan setelah antesis dengan daya berkecambah yang kurang dari 50%, sehingga diperlukan perlakuan untuk meningkatkan daya berkecambahnya. Hasil perlakuan menunjukkan bahwa perendaman dalam larutan GA3 menunjukkan pengaruh positif dengan
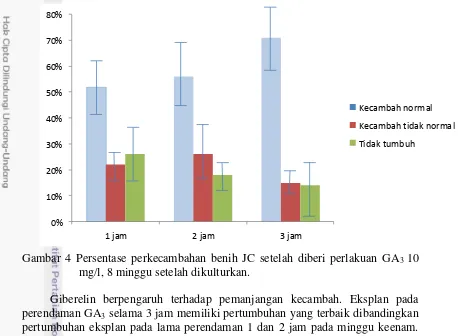
meningkatnya persentase perkecambahan. Dari gambar 4 terlihat bahwa semakin lama perendaman akan meningkatkan persentase perkecambahan benih JC. Daya berkecambah meningkat menjadi 52% pada perendaman 1 jam, 56% pada perendaman 2 jam, dan 71% pada perendaman 3 jam. Hal ini menunjukkan bahwa sampai 3 jam setelah perlakuan dalam larutan, GA3 baru bisa menembus testa.
Testa jeruk dapat disayat untuk memudahkan masuknya larutan ke dalam benih, tetapi menyayat jeruk yang baru saja dikeluarkan dari dalam buah sangat licin sehingga sulit membuat luka yang tipis. Pelukaan terlalu dalam juga dapat mengenai embrio dalam benih sehingga benih tidak dapat berkecambah.
14
Gambar 4 Persentase perkecambahan benih JC setelah diberi perlakuan GA3 10
mg/l, 8 minggu setelah dikulturkan.
Giberelin berpengaruh terhadap pemanjangan kecambah. Eksplan pada perendaman GA3 selama 3 jam memiliki pertumbuhan yang terbaik dibandingkan
pertumbuhan eksplan pada lama perendaman 1 dan 2 jam pada minggu keenam. Pada minggu kedelapan pertumbuhan eksplan pada ketiga perlakuan tidak menunjukkan perbedaan yang nyata meskipun hasil paling tinggi tetap pada eksplan dengan lama perendaman 3 jam. Little dan McDonald (2003) menyatakan bahwa giberelin dapat menstimulasi aktivitas dari meristem subapikal dan meristem apikal sehingga semakin tua umur benih maka semakin sedikit jaringan meristem sehingga efek giberelin dalam memicu pertumbuhan semakin lama akan semakin berkurang. Hal ini juga diduga karena giberelin yang diberikan hanya pada pra tanam sehingga semakin lama giberelin yang tersisa pada jaringan akan berkurang.
Tabel 3 Rata-rata pertambahan tinggi kecambah JC hasil perlakuan dengan GA3, 5
dan 8 minggu setelah pengkulturan
Lama perendaman (jam) Umur (MST)
6 8
Angka pada kolom yang sama, diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan), KK=Koefisien Keragaman.
Gambar 5 menunjukkan hasil kecambah JC setelah 8 MST. Pada perlakuan perendaman 1 jam dapat dilihat bahwa kecambah tidak banyak dan pendek. Pada perlakuan perendaman 2 jam kecambah JC tinggi meskipun masih ada yang tidak
15
berkecambah. Pada perlakuan perendaman 3 jam hampir semua biji berkecambah dengan kecambah yang tinggi.
Gambar 5 Perkecambahan benih JC setelah diberi perlakuan GA3 10 mg/l, 8
minggu setelah dikulturkan; perendaman 1 jam (a), 2 jam (b), 3 jam (c)
Sambung Mikro Batang Atas Jeruk Keprok Garut Putatif Mutan dengan Batang Bawah JC
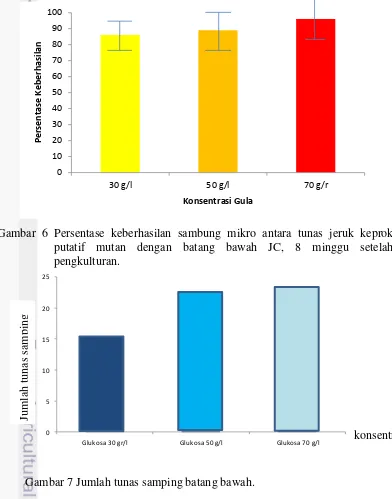
Gula merupakan salah satu faktor penting dalam keberhasilan kultur secara in vitro. Pierik (1987) menyatakan bahwa pertumbuhan dan perkembangan tanaman dalam in vitro berbanding lurus dengan konsentrasi gula sampai pada konsentrasi tertentu. Tanaman hasil sambung mikro memerlukan energi yang tinggi untuk menstimulasi pertumbuhan sel di antara jaringan yang baru disambung terutama jaringan transportasi antara kedua bagian tanaman tersebut. Hal ini menyebabkan pentingnya penambahan gula lebih tinggi dari biasanya untuk meningkatkan keberhasilan sambung mikro. Gambar 6 menunjukkan bahwa tingkat keberhasilan sambung mikro tergolong tinggi (di atas 80%). Teknik sambung mikro memiliki tingkat keberhasilan yang lebih tinggi karena jaringan eksplan berupa jaringan meristem yang masih aktif membelah sehingga lebih cepat menstimulasi pemulihan di daerah hasil sambungan (Naz et al. 2007). Tanaman hasil sambung mikro mengkonsumsi energi yang lebih tinggi dibandingkan tanaman normal karena penyatuan dua jaringan vaskuler sehingga gula pada media ditambahkan melebihi kapasitas standar yakni 30 g/l. Semakin tinggi konsentrasi gula, semakin tinggi pula keberhasilan sambung mikro. Penambahan gula konsentrasi 70 g/l memiliki persentase keberhasilan 96% sedangkan pada gula konsentrasi 50 g/l persentase keberhasilan 89% dan pada gula konsentrasi 30 g/l hanya 87%. Gambar 7 menunjukkan bahwa semakin tinggi konsentrasi gula pada media, juga menginduksi pembentukan tunas samping batang bawah sehingga apabila terlalu banyak tunas samping dapat menghambat pertumbuhan tunas sambung.
Hambatan dalam teknik sambung mikro adalah dominansi apikal yang diinduksi auksin terhenti pada batang bawah dikarenakan pucuk dipotong
b
16
sehingga memicu pertumbuhan tunas samping batang bawah. Hal ini menimbulkan terhambatnya pertumbuhan batang atas. Jumlah tunas samping batang bawah jyang muncul berbanding lurus dengan konsentrasi gula. Pada konsentrasi gula 30 g/l, jumlah tunas samping batang bawah berjumlah 15. Pada konsentrasi gula 50 g/l dan 70 g/l jumlah tunas samping batang bawah tidak terlalu berbeda jauh yakni 23 dan 24 tunas. Pada penelitian ini pertumbuhan 1 sampai 2 tunas samping tidak menghambat pertumbuhan batang atas hasil sambungan (data tidak ditampilkan). Semakin tinggi konsentrasi gula juga semakin meningkatkan pertumbuhan batang atas setelah penyambungan. Hal ini menunjukkan bahwa pertumbuhan batang atas dan keberhasilan sambungan tidak terhambat sepenuhnya dengan kemunculan tunas samping.
Gambar 6 Persentase keberhasilan sambung mikro antara tunas jeruk keprok putatif mutan dengan batang bawah JC, 8 minggu setelah pengkulturan.
Gambar 7 Jumlah tunas samping batang bawah.
0
Glukosa 30 gr/l Glukosa 50 g/l Glukosa 70 g/l konsentrasi
17
b c
a
Gambar 8 menunjukkan tanaman hasil sambung mikro 1 bulan setelah penyambungan. Pada gula konsentrasi 30 g/l batang atas terlihat menguning dan tunas samping yang sedikit. Pada gula konsentrasi 50 g/l batang atas terlihat normal dan tunas samping yang sedikit. Pada gula konsentrasi 70 g/l batang atas terlihat segar tetapi tunas samping batang bawah yang banyak.
Gambar 8 Pertumbuhan sambung mikro antara tunas jeruk keprok putatif mutan dengan batang bawah JC pada media dengan peningkatan konsentrasi gula 30 g/l (a), 50g/l (b), dan 70 g/l (c)
= batang atas, = batang bawah, = tunas samping
SIMPULAN DAN SARAN
Simpulan
Konsentrasi kinetin optimal untuk menginduksi tunas baru adalah 5 mg/l sedangkan untuk pertambahan buku kinetin 1 mg/l lebih efektif. Lama perendaman dalam GA3 10 mg/l yang terbaik untuk meningkatkan
perkecambahan benih dan pemanjangan kecambah adalah 3 jam. Persentase keberhasilan sambung mikro tertinggi pada sambung mikro yang dikulkturkan pada media dengan konsentrasi gula 70 g/l.
Saran
Perlu dilakukan penelitian untuk menguji multiplikasi batang atas jeruk keprok garut hasil mutasi dengan ZPT kelas sitokinin selain kinetin yakni Benzil Adenine atau kinetin dengan konsentrasi yang lebih kecil agar dapat memacu multiplikasi. Penelitian perlakuan GA3 perlu ditingkatkan. Pemakaian konsentrasi
GA3 lebih dari 10 ppm perlu dilakukan untuk mengetahui konsentrasi optimum
DAFTAR PUSTAKA
Afshin A, Behzad K, Alireza T, Sahar B. 2011. Effect of different concentrations of kinetin on regeneration of ten weeks (Matthiola incana). Plant Omics J. 4(5):236-238.
Andriani A, Suharsi T, Surahman M. 2013. Studi poliembrioni dan penentuan tingkat kemasakan fisiologis benih Japansche Citroen berdasarkan warna kulit buah. J.Hort. 23(3):195-202
Badan Pusat Statistika. 2010. Import Buah-Buahan Indonesia 2006-2010. tersedia pada: www.bps.go.id [diunduh pada: 2013 Mei 4]
Bajguz A, Tretyn A. 2003. The chemical characteristic and distribution of brassinosteroids in plants. Phytochemistry. 62:1027-1046
Burns R, Coggins W. 1969. Sweet orange germination and growth aided by water and gibberellin seed soak. Calif. Agri. Dec. pp. 18-19.
Cronquist A. 1981. An Integrated System of Classification in Flowering Plants. New York (US): Springer
Darwati I, Roostika I. 2006. Status penelitian purwoceng (Pimpina alpina Molk.) di Indonesia. Bul. Plasma Nutfah. 12 (1):9–15.
Dwiastuti M, Wiratno A, Sumardi. 2007. Respons ketahanan varietas batang bawah jeruk introduksi terhadap penyakit busuk pangkal batang dan akar Phytophtora sp. di lahan pasang surut. J. Hort. 3(2):59-65
Dinas Pertanian Tanaman Pangan Provinsi Jawa Barat. 2011. Sekilas Tentang Jeruk Garut. tersedia pada: www.diperta.jabarprov.go.id/index.php [diunduh pada: 2014 Desember 21]
Evans D, Sharp W, Flick C. 1981. Plant regeneration from cell to callus. Hort. Rev 3:214-314.
Gebhardt K, Goldbach H. 1988. Establishment, graft union characteristics and growth of Prunus micrografts. Phys. Plant. 72:153–159.
Hesar A, Behzad K, Alireza T, Sahar B. 2011. Effect of different concentrations of kinetin on regeneration of ten weeks (Matthiola incana). Plant Omics J. 4(5):236-238.
Jain S, Ochatt S. 2010. Protocols For In Vitro Propagation of Ornamental Plants. Springer protocols. Humana press.
Ji-Zhong X, Bao-Sheng S, Bao-kun M, Run-Fang G, Xiao-Dong L, Xian-Bin Z. 2002. Studies on the POD and IOD activities of the dwarfing stocks and the red fuji apple grafted on corresponding interstocks. China. Agric. Sci., 1(5):562–567.
Kaneko M, Itoh H, Tanaka M, Ashikari M, Matsuoka M. 2002. The α-amylase
induction in endosperm during rice seed germination is caused by gibberellin sythesized in epithelium. Plant Physiol. 128:1264-1270
Khan I. 2007. Citrus Genetics, Breeding and Biotechnology. Khan I, editor. Wallingford (GB): CABI.
19
Kumar A, Sood A, Palni UT, Gupta A, Palni L. 2001. Micropropagation of Rosa damascena Mill from mature bushes using thidiazuron. J Hortic Sci Biotechnol. 76(1):30-34.
Lestari EG. 2011. Peranan zat pengatur tumbuh dalam perbanyakan tanaman. J. Agrobiogen. 7(1):63–68.
Little C, MacDonald J. 2003. Effects of exogenous gibberellin and auxin on shoot elongation and vegetative bud development in seedlings of Pinus sylvestris and Picea glauca. Tree Physiol. 23 (2):73–83.
Mamidala P, Nanna R. 2009. Efficient in vitro plant regeneration, flowering, and fruiting of dwarf tomato cv. Micro-Msk. Plant Omics J. 2(3):98-102.
Martasari C. 2008. Teknologi Perbaikan Jeruk Tanpa Biji. tersedia pada: http://balitjestro.litbang.pertanian.go.id/id/599.html [diunduh pada: 2014 Desember 21]
Miller O, Skoog F, Saltza M, Strong F. 1955. Kinetin, a cell division factor fron deoxyribonucleic acid. J. Am. Chem. Soc. 77(5):1392-1392
Mudge K, Janick J, Scofield S, Goldschmidt E. 2009. History of Grafting. Horticultural Reviews. 35:437–493.
Naz A, Jaskani M, Abbas H, Qasim M. 2007. In vitro studies on micrografting technique in two cultivars of citrus to produce virus free plants. Pak. J. Bot. 39(5):1773-1778
Navarro L. 1988. Application of shoot-tip grafting in vitro to woody species. Acta Hortic. 227:43-55
Obeidy A, Smith M. 1991. A Versatile New Tactic for Fruit Tree Micrografting. Hort. Technology. p. 91–94.
Ogawa M, Hanada A, Yamauchi Y, Kuwahara A, Kamiya Y, Yamaguchi S. 2003. Gibberellin biosynthesis and response during Arabidopsis Seed Germination. The Plant Cell. 15:1591-1604
Pena L, Trilo M, Juarez J, Pina J, Navarro L, Zapater J. 2001. Constitutive expression of Arabidopsis Leafy or Apetala1 genes in citrus reduces their generation time. Nature Biotechnology. 19:263–267.
Pierik R. 1998. In Vitro Culture of Higher Plants. Manhattan (US): Springer. Purnamaningsih R, Lestari EG. 1998. Multiplikasi tunas temu giring melalui
kultur in vitro. Bul. Plasma Nutfah 1(5):24–27.
Putri L. 2002. Karakteristik fisiologi karakter jeruk besar Cikoneng dan Nambangan pada beberapa batang bawah [tesis]. Bogor (ID): Institut Pertanian Bogor.
Roistacher C. 2004. Diagnosis and Management of Virus and Virus Like Diseases of Citrus. Houten (NL): Springer.
Sugiyarto M. 1994. Deskripsi beberapa varietas batang bawah dan varietas jeruk komersial. Balit. Hort. Solok. p.20
Supriyanto A, Setiono. 2008. Keragaan pertumbuhan jeruk siam Banjar pada 11 varietas batang bawah di lahan pasang surut. Prosiding Seminar Nasional Jeruk. Puslitbang Hortikultura, Badan Litbang Pertanian. Jakarta. 228-34 Tambing Y. 2008. Keberhasilan pertautan sambung pucuk pada mangga dengan
waktu penyambungan dan panjang entris berbeda. J. Agro. 15(4):296–301. Vieira A, Vieira M, Fraga A, Oliveira J, Santos C. 2002. Action of gibberellic
20
LAMPIRAN
Lampiran 1. Komposisi media dasar kultur, vitamin dan komponen lainnya.
21
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Oktober 1992 dari Bapak I Made Utama dan Ibu Kitty Lisa Handojo. Penulis adalah putra kedua dari tiga bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 38 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Mandiri (UTM) dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.