FORMULASI NANOEMULSI MINYAK SAWIT DENGAN HIGH-PRESSURE HOMOGENIZER
YANDA GENAKELA MARPAUNG
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN
MENGENAI
SKRIPSI
DAN
SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Formulasi Nanoemulsi Minyak Sawit dengan High-Pressure Homogenizer adalah benar karya saya` dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YANDA GENAKELA MARPAUNG. Formulasi Nanoemulsi Minyak Sawit dengan High-Pressure Homogenizer. Dibimbing oleh TIEN R. MUCHTADI dan SRI YULIANI.
Indonesia merupakan negara penghasil minyak sawit terbesar di dunia. Salah satu produk turunan minyak sawit yang dikembangkan adalah emulsi sawit karena -karoten dalam minyak sawit memiliki kelarutan yang rendah dalam air dan mudah terdegradasi dalam proses pengolahan. Penggunaan teknologi nano dalam pembuatan larutan nanoemulsi minyak sawit ini dapat meningkatkan kelarutan dan bioavailibilitas di dalam saluran pencernaan serta meningkatkan kestabilan emulsi. Pada penelitian ini diamati pengaruh emulsifier Tween 20 dan Tween 80 sebanyak 10% dan 30% (b/b) basis
minyak serta kitosan 0%, 0.5%, dan 1% (b/b) basil emulsi, terhadap ukuran partikel dan kestabilannya. Penggunaan Tween 80 mampu menghasilkan ukuran partikel dan kestabilan -karoten yang lebih baik dibandingkan dengan penggunaan Tween 20. Penggunaan emulsifier pada konsentrasi 30% menghasilkan ukuran partikel yang lebih kecil dibandingkan dengan penggunaan konsentrasi 10%. Penggunaan kitosan hingga 1% dapat meningkatkan ukuran partikel dan mencegah terjadinya oiling off, namun dapat
mempercepat terjadinya agregasi pada emulsi, dibandingkan dengan penggunaan kitosan 0.5%. Formula yang terpilih adalah penggunaan Tween 80 30% dan kitosan 0.5%
Kata kunci : emulsifier, kitosan, nanoemulsi, ukuran partikel, -karoten.
ABSTRACT
YANDA GENAKELA MARPAUNG. Palm Oil Nanoemulsion Formulation with High-Pressure Homogenizer. Supervised by TIEN R. MUCHTADI and SRI YULIANI.
Indonesia is the largest palm oil producer in the world. One of the palm oil derivative products is palm oil emulsion as its -carotene solubility in water is low and easily degraded through processing. The use of nanotechnology in the manufacture of palm oil nano emulsion can improve its solubility in water, its bioavailibility in the digestive tract, and emulsion stability. This study observed the effect of emulsifier Tween 20 and Tween 80 as much as 10% and 30% (w/w) oil base and chitosan 0%, 0.5%, and 1% (w/v) emulsion base to the particle size and stability. The use of Tween 80 provided better particle size and stability of -carotene than the use of Tween 20. The use of an emulsifier at a concentration of 30% showed a smaller particle size compared with the use of a concentration of 10%. The use of chitosan to 1% can increase the size of the particles and prevent oiling off, but can accelerate the aggregation of the emulsion, compared to 0.5% chitosan use. The selected formula is the use of 30% Tween 80 and 0.5% chitosan.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
FORMULASI NANOEMULSI MINYAK SAWIT DENGAN HIGH-PRESSURE HOMOGENIZER
YANDA GENAKELA MARPAUNG
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Dosen Penguji
Judul Skripsi : Formulasi Nanoemulsi Minyak Sawit dengan High-Pressure Homogenizer
Nama : Yanda Genakela Marpaung NIM : F24090005
Disetujui oleh
Prof. Dr. Ir. Tien R. Muchtadi, MS Pembimbing I
Dr. Sri Yuliani, MT Pembimbing II
Diketahui oleh
Dr Ir Feri Kusnandar, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Kasih atas limpahan berkat dan rahmat-Nya sehingga dapat diselesaikannya penulisan tugas akhir ini. Penyelesaian tugas akhir ini tidak luput berkat dukungan dari semua pihak baik secara langsung maupun tidak langsung, sehingga penulis ingin menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Tien R. Muchtadi, MS dan Dr. Sri Yuliani selaku pembimbing akademik yang terus memberikan perhatian, bimbingan, dan motivasi hingga terselesaikannya penulisan tugas akhir ini. Terima kasih pula untuk semua tenaga pengajar, laboran, dan pegawai di Institut Pertanian Bogor.
2. Ayahanda Kristian Marpaung, Ibunda Julinda Silitonga, Frans Best Soma M, Lodewik Fraus Seran M, Petryako YRM, dan keluarga besar penulis, atas perhatian, doa, dan segenap usaha mereka untuk terus mendukung penulis selama masa studi di Institut Pertanian Bogor. 3. Gloria Maria FP, Nikko Dwijayasastra, Satrya Dharmawan, Ilham Gelar
S, Henry, Martha Theresia, Vini Muham, Vici Muham, Vera Linda, Citra Irene, Bayu Aji Pamungkas, Kadek DP, dan teman-teman Mikha, sebagai keluarga kecil selama di Bogor. Teman-teman seperjuangan ITP 46 Cicely N, Mutiara, Pricilia, Charles, Ardy, Iyan A, Lina S, Olga Ance, dan seluruh teman-teman sesama pengajar TOGA. Rachel Irene Simatupang dan Raki Ardi Ruhiyatman teman satu pembimbing.
4. Pihak Women International Club yang telah memberikan bantuan dana serta motivasi selama masa pendidikan di IPB.
5. Direktur Penelitian dan Pengabdian kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi Kementerian Pendidikan dan Kebudayaan RI (DIKTI), atas bantuan pembiayaan penelitian melalui Hibah Kompetensi Nomor 035/SP2H/PL/DIT.LIT ABMAS/V/2013.
6. Indofood Riset Nugraha yang juga telah memberikan bantuan pembiayaan
penelitian ini.
7. Pihak-pihak lain yang tidak dapat disebutkan satu per satu, baik yang secara langsung maupun tidak langsung telah membantu penyelesaian studi dan penulisan tugas akhir ini.
Akhir kata, penulis berharap skripsi ini dapat bermanfaat bagi seluruh pihak dan dapat berdampak terhadap pengembangan ilmu dan teknologi di masa yang akan datang.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Minyak Sawit 2
Karotenoid 3
Emulsi 4
Nanoemulsi 5
Homogenisasi 5
METODOLOGI 7
Bahan 7
Alat 7
Metode 7
Metode Analisis 9
HASIL DAN PEMBAHASAN 13
Analisis Proksimat Minyak Sawit Kasar 13
Formulasi Nanoemulsi Minyak Sawit Kasar 13
Analisis Freeze-Thaw Stability 16
Analisis -Karoten dan Warna Emulsi pada Formula Terpilih 19
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
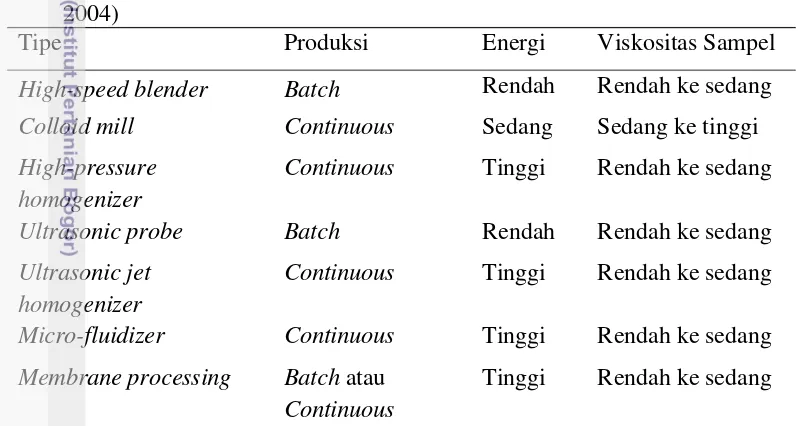
1 Perbandingan dan Perbedaan Tipe Alat Homogenisasi (McClements
2004) 6
2 Ukuran partikel emulsi dan indeks dispersi emulsi pada penggunaan
emulsifier Tween 20 dan Tween 80 14
3 Nilai %keterpisahan pada lima siklus freeze-thaw 17 4 Perubahan warna emulsi selama masa penyimpanan pada formula
terpilih 20
5 Perubahan konsentrasi -karoten selama masa penyimpanan pada
formula terpilih 19
DAFTAR GAMBAR
1 Pemisahan emulsi formula Tween 20 30% Kitosan 0.5% pada siklus
freeze-thaw stability. 18
DAFTAR LAMPIRAN
1 Diagram alir proses degumming CPO (Mas’ud β007) 25
2 Diagram Alir Formulasi Minuman Nanoemulsi 26
PENDAHULUAN
Sejak tahun 2009 Indonesia telah menjadi negara produsen minyak sawit terbesar di dunia. Pada tahun 2010 Departemen Pertanian Indonesia (Ditjenbun 2011) menyatakan bahwa produksi minyak sawit kasar Indonesia mencapai 19.85 juta ton. Komoditi ini merupakan penyumbang devisa non migas terbesar ketiga bagi negara (Sastrosayono 2009). Hingga saat ini produk hilir kelapa sawit yang dihasilkan industri berupa asam lemak, asam lemak distilat, gliserin, refined bleached deodorized (RBD), minyak goreng, margarin, shortening, sabun, kosmetika (Goenadi 2005).
Minyak sawit memiliki banyak keunggulan. Keunggulan utama minyak sawit adalah kandungan mikronutrien yang tinggi sehingga memiliki potensi untuk dikembangkan menjadi healthy oil, yang diproses dan dikendalikan sedemikian rupa sehingga kandungan nutrisinya dapat dimanfaatkan untuk kesehatan. Nilai biologis yang dapat diperoleh dari minyak sawit antara lain sebagi prekursor vitamin A, senyawa anti kanker, menanggulangi kebutaan akibat xeropthalmia, meningkatkan kekebalan tubuh, dan lain sebagainya (D’Odorico et al. 2000; Rodriguez-Amaya dan Kimura 2004, von Lintig 2010).
Minyak sawit mengandung banyak komponen antioksidan seperti karotenoid lutein, zeaxanthin, tokoferol dan tokotrienol yang berkisar antara 600– 1000 μg/g (Azlan et al. 2010). Kandungan karotenoid di dalam minyak sawit yang umumnya didominasi oleh komponen -karoten (sebanyak 60%) berkisar antara 500-γ500 μg/g (Mortensen β005). Kandungan komponen -karoten pada minyak sawit ditemukan paling tinggi dibandingkan pada bahan pangan lainnya.
Namun pencampuran -karoten di dalam bahan pangan memiliki beberapa kelemahan yang menyebabkan penggunaan bahan fungsional ini terbatas digunakan (Acosta 2009). Bahan ini memiliki kelarutan yang rendah di dalam air, serta memiliki bioavailibilitas dan stabilitas yang rendah (Qian et al. 2012). Senyawa -karoten umumnya cenderung mudah terdegradasi oleh proses pengolahan dan penyimpanan yang dipengaruhi oleh efek kimia (oksigen dan bahan pengoksida), mekanik (cahaya), dan suhu (Mao et al. 2009; Yuan et al. 2008).
Sistem nanoemulsi dapat meningkatkan bioavailibilitas di dalam saluran pencernaan karena ukuran partikel yang kecil dan rasio antara luas permukaan dan volumenya yang tinggi (Acosta 2009), mudah untuk diangkut dan diserap melewati saluran pencernaan sehingga mudah digunakan tubuh sebagai sebagai substrat dari liposom dan vesikel tubuh (Liu 2012).
Sistem emulsi dapat mengurangi degradasi -karoten. Keberadaan lapisan pada permukaan droplet yang menyelubungi emulsi dapat menjaga konsentrasi dan sifat fungsional -karoten di dalam emulsi (Acosta 2009). Aplikasi teknologi nanoemulsi pada bahan pangan dapat memodifikasi karakteristik makro bahan pangan seperti atribut sensori, meningkatkan kelarutan bahan dalam air, stabilitas termal, dan bioavailibilitas bahan fungsional pada pangan (Huang et al. 2010; McClements et al. 2009, 2007).
2
et.al (2012) menyatakan bahwa sistem nanoemulsi -karoten dengan carier minyak dengan rantai panjang dapat meningkatkan daya serap -karoten yang lebih baik dibandingkan penggunaan dengan minyak jenis lain. Penambahan kitosan pada larutan nanoemulsi teramati mampu meningkatkan kemampuan hidrofilik partikel nano dan meningkatkan translokasinya pada dinding usus (Hussain et al. 2001).
Untuk menghasilkan partikel nanoemulsi dengan ukuran minimum terdapat beberapa faktor yang perlu dikontrol. Menurut Mason (2007) faktor yang perlu diperhatikan dalam pembuatan nanoemulsi adalah pemilihan formula yang tepat (jenis pengemulsi dan konsentrasi fase kontinu), kontrol terhadap urutan penambahan bahan, dan besar gaya yang paling efektif untuk memperkecil ukuran partikel.
Pada formulasi larutan nanoemulsi minyak sawit digunakan dua jenis emulsifier yaitu Polioxyethylene sorbitan monolaurate atau Tween 20 dan Polyethylene glycol sorbitan monooleate atau Tween 80 pada konsentrasi 10% dan 30% (b/b) basis minyak. Bahan emulsifier ini merupakan bahan surfaktan yang bersifat nonionik dan memiliki nilai hidrophylic-lipophylic balance (HLB) antara 15-17 (McClements 2004) yang menunjukkan emulsifier yang digunakan sesuai untuk sistem emulsi minyak dalam air o/w.
Tujuan Penelitian
Tujuan penelitian ini adalah menentukan formulasi larutan nanoemulsi berbasis minyak sawit dengan mengkaji jenis dan konsentrasi emulsifier dengan atau tanpa bahan penstabil kitosan menggunakan alat high pressure-homogenizer.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi mengenai formulasi nanoemulsi minyak sawit yang dapat dikembangkan menjadi produk healthy drink.
TINJAUAN PUSTAKA
Minyak Sawit
3 fraksinasi untuk memisahkan fraksi padat dengan fraksi cair minyak yang dilakukan melalui proses pendinginan (Ketaren 2005).
Untuk mempertahankan warna merah pada minyak sawit serta mempertahankan kandungan -karoten di dalmamnya, maka pada proses pengolahannya minyak sawit ini tidak melalui proses bleaching atau pemucatan. Metode ekstraksi untuk memperoleh minyak sawit merah dengan kandungan karotenoid tinggi selain pengendalian proses pemucatan pada ekstraksi konvensional adalah ekstraksi dengan hydraulic pressure, distilasi molekuler, ekstraksi fluida super kritik, dan ekstraksi menggunakan pelarut yang tepat.
Warna merah yang terkandung di dalam minyak sawit tidak hanya banyak mengandung karotenoid dan tokoferol yang baik bagi kesehatan. Karotenoid dan tokoferol merupakan komponen bioaktif yang bersifat antioksidan. Karotenoid memiliki dampak bagi kesehatan karena mampu mencegah dan menjaga dari penyakit berbahaya seperti kanker, penyakit kardiovaskular, dan lain-lain (Lam et al. 2001). Selain bersifat sebagai antioksidan, karotenoid dan tokoferol di dalam minyak sawit merah secara fisiologis juga aktif sebagai vitamin A dan E. Untuk pemanfaatannya minyak sawit merah tidak dianjurkan digunakan sebagai pengganti minyak nabati dalam pengolahan pangan yang menggunakan suhu tinggi. Hal ini disebabkan oleh tidak stabilnya komponen antioksidan di dalam minyak sawit merah pada suhu tinggi yang dapat mendegradasi komponen aktif tersebut (van Buggenhout et al. 2010).
Karotenoid
Karotenoid merupakan kelompok pigmen yang berwarna kuning, jingga, merah jingga yang larut dalam senyawa nonpolar (Winarno 2004). Kemampuan karotenoid untuk dapat larut di dalam senyawa lainnya menyebabkan senyawa ini disebut senyawa lipofilik, dan larut dalam pelarut lemak lainnya. Karotenoid juga bersifat sangat peka terhadap oksidasi, otooksidasi, dan cahaya (van Buggenhout et al. 2010) walaupun bersifat tahan panas jika dalam keadaan vakum.
Komposisi karotenoid dalam minyak sawit terutama adalah -karoten (60-65%) dan α-karoten (30-35%) (Ketaren 2005). Karotenoid memiliki peran fungsional sebagai pro vitamin A. Disebut sebagai pro vitamin A karena dalam tubuh, karotenoid terutama -karoten dapat diubah menjadi vitamin A dengan bantuan enzim 15,15' -karotenoid oksigenase. Vitamin A berfungsi untuk mencegah penyakit katarak dan kebutaan, sebagai antioksidan dan anti radikal bebas, serta untuk meningkatkan imunitas tubuh (Sundram 2007).
Sundram (2007) menggolongkan karotenoid menjadi empat golongan yaitu: 1. Karotenoid hidrokarbon C40H56; yang termasuk golongan ini adalah α-, -,
-, karoten dan likopen.
2. Xantofil dan derivat karoten yang mengandung oksigen dan gugus hidroksil (C40H55OH); yang termasuk golongan ini adalah criptonxanthin, capsanthin, torularhodin, dan lutein (C40H54(OH)2).
3. Ester xantofil yaitu ester xantofil asam lemak seperti zeaxanhtin.
4
Dibandingkan dengan jenis karoten lainnya, komponen -karoten memiliki potensi relatif terhadap vitamin A yang paling tinggi dibandingkan dengan α -karoten dan -, karoten. Pada umumnya di dalam bahan pangan segar bentuk karotenoid yang paling lazim dijumpai berada pada bentuk -karoten. Di dalam buah-buahan atau sayuran karoten dijumpai dalam bentuk kompleks dengan protein atau teresterifikasi di dalam asam lemak yang menyebabkannya lebih stabil jika dibandingkan di dalam sawit mentah.
Bentuk isomer karoten memengaruhi aktivitas vitamin A. Marx et al. (2003) menyatakan bahwa bentuk trans dari -karoten memiliki derajat aktivitas yang lebih tinggi dibandingkan dengan bentuk cis. Isomerasi dalam karoten dapat berlangsung pada suhu kamar, namun reaksi yang terjadi sangat kecil dan berpengaruh kecil pada aktivitas vitamin A. Derajat isomerisasi pada beta karoten berbanding lurus terhadap peningkatan suhu dan lamanya masa simpan (Yuan et al. 2007).
Senyawa karotenoid memiliki struktur yang tersusun dari ikatan konjugasi yang mudah mengalami oksidasi secara acak pada ordo reaksi pertama. Namun senyawa ini memiliki aktivitas provitamin A dan dinyatakan sebagai nilai Retinol Equivalen (RE). Persentase -karoten yang dapat diubah menjadi vitamin A sekitar 60-70% (Bender 2006).
Emulsi
Emulsi merupakan sistem seimbang antara dua atau lebih fase yang tidak tercampur dan salah satu fase terdispersi terhadap fase yang lain. Fase yang terdispersi disebut sebagai fase internal atau fase diskontinu dan fase yang lainnya disebut sebagai fase pendispersi atau fase kontinu. Ukuran partikel emulsi umumnya berkisar antara 0.1-50 µm (Mao dan McClements 2011). Salah satu fase di dalam sistem emulsi mempunyai karakter lipofilik dan fase yang lain bersifat hidrofilik. Untuk mengimbangkan sistem tersebut dibutuhkan emulsifier sebagai senyawa yang mengandung gugus hidrofilik dan lipofilik.
Emulsi dapat diklasifikasikan berdasarkan komposisi dan morfologinya. Emulsi yang fase kontinunya adalah air dan fase terdispersinya minyak disebut sebagai emulsi o/w. Surfaktan yang digunakan pada emulsi ini harus dapat larut di dalam air dan lebih stabil pada kondisi polar. Selain itu emulsi yang fase kontinunya adalah minyak disebut sebagai emulsi w/o. Surfaktan yang digunakan pada emulsi ini harus mampu larut dan lebih stabil pada kondisi nonpolar (McClements 2004).
5 Nanoemulsi
Nanoemulsi merupakan senyawa emulsi antara senyawa minyak dan air atau sebaliknya, yang struktur ukuran partikelnya berkisar antara 30-300 nm (Silva et al. 2012). Sistem pada nanoemulsi tersusun atas fase lemak yang terdispersi fase kontinyu berupa dan dikelilingi oleh membran tipis dari surfaktan. Partikel nanoemulsi lebih stabil terhadap separasi dan agregasi karena ukuran partikelnya yang kecil (McClements 2007).
Untuk menghasilkan partikel nanoemulsi dengan ukuran minimum terdapat beberapa faktor yang perlu dikontrol. Menurut Qian dan McClements (2010) faktor-faktor tersebut antara lain adalah tipe alat homogenisasi, kondisi pengoperasian alat homogenisasi (besar energi, jumlah pengumpanan, waktu pengoperasian, dan suhu), komposisi sampel (tipe lemak yang ditambahkan, konsentrasi dalam produk), dan karakter bahan yang dicampurkan (tegangan permukaan dan viskositas). Menurut Mason (2007) faktor yang perlu diperhatikan dalam pembuatan nanoemulsi adalah pemilihan formula yang tepat (jenis pengemulsi dan konsentrasi fase kontinyu), kontrol terhadap urutan penambahan bahan, dan besar gaya yang paling efektif untuk memperkecil ukuran partikel.
Dalam melakukan analisis dan identifikasi karakteristik partikel nanoemulsi digunakan beberapa metode. Menurut Silva et al. (2012) ada tiga metode untuk melakukan identifikasi dan karakterisasi nanoemulsi yaitu teknik separasi, teknik karakterisasi sifat fisik, dan teknik pencitraan.
a. Teknik pemisahan merupakan identifikasi nanoemulsi dengan mengisolasi partikel nanoemulsi dari matriks atau makromolekul bahan pangan dan mengelusikannya pada detektor. Contoh dari teknik ini adalah metode kromatografi dan field flow fractionation.
b. Karakterisasi sifat fisik merupakan teknik yang digunakan untuk mengidentifikasi karakter nanoemulsi dari sifat fisiknya seperti ukuran partikel, distribusi partikel, potensi zeta, dan kemampuan kristalisasi nanoemulsi. Contoh metode dari teknik ini antara lain adalah Dynamic Light Scattering, Zeta Potential, Differential Scanning Calorimetry, Fourier Transform Infrared, Nuclear Magnetic Resonance, X-Ray Diffraction, dan Small-Angle X-ray Scattering.
c. Teknik Pencitraan merupakan teknik identifikasi ukuran, bentuk, dan bentuk agregasi partikel nanoemulsi menggunakan mikroskop. Jenis mikroskop yang digunakan dalam metode ini adalah Transmission Electron Microscopy dan Scanning Electron Microscopy.
Homogenisasi
6
aplikasi bergantung beberapa faktor, yaitu volume sampel yang dihomogenisasi, keluaran yang dinginkan, konsumsi energi, karakteristik komponen fasenya, dan prediksi biaya proses.
Dalam pembuatannya, sistem homogenisasi nanoemulsi digolongkan menjadi dua berdasarkan besar energi yang digunakan yaitu emulsifikasi energi tinggi dan energi rendah (Acosta 2009). Emulsifikasi energi tinggi merupakan teknologi nanoemulsi dengan energi mekanik tinggi yang memisahkan fase minyak-air dan membentuknya menjadi droplet. Teknologi nanoemulsi yang digolongkan pada emulsifikasi energi tinggi ini adalah homogenisasi dengan high-pressure valve, micro-fluidizers, dan ultrasound. Nanoemulsifikasi dengan energi rendah merupakan teknologi nanoemulsi yang didasarkan pada metode pembentukan emulsi secara spontan setelah keadaan emulsinya diubah. Contoh dari nanoemulsi energi rendah adalah emulsifikasi membran, solvent demixing, dan phase inversion (Silva et al. 2012). Perbedaan dan perbandingan beberapa alat homogenisasi yang sering digunakan dalam industri pangan dapat dilihat pada Tabel 1.
Pada penelitian ini digunakan high-pressure homogenizer sebagai alat homogenisasi dalam pembuatan produk nanoemulsi. Keuntungan yang terdapat pada alat ini dibandingkan dengan metode lain adalah besar ukuran partikel ditentukan berdasarkan besar energi yang dihasilkan dan viskositas larutan yang digunakan. Alat high-pressure homogenizer dapat menghasilkan energi tinggi dalam menghomogenisasi sampel sehingga mampu menghasilkan droplet dengan ukuran hingga kurang dari 0.1µm. Emulsi kasar yang diumpankan pada alat ini dapat diatur ukurannya dengan memvariasikan ukuran katup dan tekanannya. Tabel 1. Perbandingan dan Perbedaan Tipe Alat Homogenisasi (McClements
2004)
Tipe Produksi Energi Viskositas Sampel
High-speed blender Batch Rendah Rendah ke sedang Colloid mill Continuous Sedang Sedang ke tinggi High-pressure
homogenizer
Continuous Tinggi Rendah ke sedang Ultrasonic probe Batch Rendah Rendah ke sedang Ultrasonic jet
homogenizer
Continuous Tinggi Rendah ke sedang Micro-fluidizer Continuous Tinggi Rendah ke sedang Membrane processing Batch atau
Continuous
7
METODOLOGI
Bahan
Bahan yang digunakan dalam penelitian ini adalah minyak sawit kasar atau Crude Palm Oil (CPO), aquades, polyoxythylene sorbitan monolaurat (Tween 20), polyoxythylene sorbitan monooleate (Tween 80) (Sigma,USA), larutan buffer fosfat 10 mM, kitosan, dan asam asetat glasial.
Alat
Peralatan yang digunakan dalam penelitian ini antara lain ultra-turrax homogenizer (model L4R, Silverson Co., England), high-pressure homogenizer (model NS2002H TWP600, GEA Niro Soavi, Italia), High Performance Liquid Chromatography (HPLC) Chromameter Minolta CR 300 (Minolta Camera, Co. Japan. 82281029), mixer tangan, penangas, freezer, neraca analitik, komputer, dan alat-alat gelas.
Metode
Pada penelitian ini digunakan CPO sebagai komponen utama yang diemulsikan. CPO yang digunakan merupakan fraksi cair minyak yang sebelumnya terpisah dari bagian yang mengendap. Pada tahap awal penelitian dilakukan proses degumming pada fraksi cair CPO untuk menghilangkan getah dan logam berat pada minyak (Mas’ud β007). Sebanyak 1 L minyak sawit kasar dipanaskan pada suhu 80 C, kemudian ditambahkan asam fosfat 85% sebanyak 0.15% (v/v). Kemudian dilakukan pengadukan selama 15 menit dengan kecepatan 56 rpm, didinginkan pada suhu ruang, dipisahkan, dan dihasilkan dua produk, yaitu endapan dan minyak sawit hasil degumming (Lampiran 1). Setelah itu dilakukan analisis proksimat terhadap minyak sawit yang telah di- degumming dan dibandingkan dengan standard SNI.
Metode yang digunakan pada penelitian ini merupakan metode modifikasi terhadap penelitian pembuatan produk nanoemulsi oleh Tan dan Nakajima (2005). Tan dan Nakajima (2005) melakukan formulasi nanoemulsi menggunakan konsentrat -karoten yang dilarutkan ke dalam larutan heksana. Perbandingan bahan organik dan polar yang digunakan adalah 1:9 dan 2:8 pada tekanan 60-140 MPa dan sebanyak tiga kali pengumpanan kembali. Berdasarkan hasil penelitian tersebut diperoleh hasil bahwa perbandingan antara bahan minyak dan bahan polar yang menghasilkan ukuran droplet terkecil adalah perbandingan 1:9 (b/b).
8
pengemulsi disebabkan bahan pengemulsi ini cocok dan dapat digunakan untuk menghasilkan droplet emulsi ukuran nano pada emulsi o/w (Yuan et. al 2008). Modifikasi lain yang dilakukan adalah konsentrasi bahan pengemulsi sebesar 10% dan 30% (b/b) dari bobot minyak, dan penambahan kitosan sebagai bahan penstabil emulsi. Menurut Yuan et al. (2008) penggunaan Tween pada 10% (b/b) dari bobot minyak menghasilkan ukuran partikel terbaik pada konsentrat -karoten. Diagram alir proses formulasi dapat dilihat pada Lampiran 2.
Pada penelitian ini konsentrasi kitosan yang digunakan adalah 0%, 0.5%, dan 1% (b/v) basis emulsi total. Hal ini karena penggunaan kitosan lebih dari 1% dapat menurunkan stabilitas emulsi (Klinkesorn dan Namatsila 2008). Larutan kitosan terlebih dahulu dipersiapkan dengan melarutkannya di dalam larutan asam asetat glasial 1%. Larutan kitosan dipersiapkan secara terpisah antara 0.5% dan 1%. Larutan untuk kitosan 0.5% (Larutan Kitosan A) dipersiapkan dengan melarutkan 12.5 g kitosan pada larutan asam asetat 1% dan ditepatkan hingga 500 mL. Larutan untuk kitosan 1% (Larutan Kitosasan B) dipersiapkan dengan melarutkan 25 g kitosan pada larutan asetat 1% dan ditepatkan hingga 500 mL. Masing-masing larutan ditambahkan pada larutan emulsi sebanyak 100 mL pada basis emulsi 500 mL, sehingga diperoleh larutan kitosan akhir sebesar 0.5% dan 1% (b/v) basis emulsi.
Formulasi dilakukan dengan terlebih dahulu mencampurkan emulsifier Tween 20 dan Tween 80 pada konsentrasi 10% dan 30% (b/b) basis minyak ke dalam air buffer 10 mM kemudian menepatkan basis bobot larutan. Bahan emulsifier kemudian dilarutkan menggunakan mixer tangan selama 30 detik pada kecepatan putar 1000 rpm. Minyak sawit yang telah di-degumming kemudian dihomogenisasi dengan bahan polar secara perlahan-lahan hingga perbandingan minyak dan bahan polar sebanyak 1:9 (b/b). Pada proses homogenisasi awal digunakan ultra-turrax homogenizer (model L4R, Silverson Co., England) selama lima menit untuk membentuk emulsi kasar. Bahan emulsi kasar kemudian dihomogenisasi kembali menggunakan high-pressure homogenizer (model NS2002H TWP600, GEA Niro Soavi, Italia) untuk membentuk nanoemulsi pada tekanan 600 Bar sebanyak lima kali pengumpanan kembali.
Emulsi tersebut kemudian dicampur dengan bahan kitosan pada konsentrasi 0%, 0.5%, dan 1% (b/v) basis emulsi total. Pada basis emulsi sebanyak 500 mL, pencampuran kitosan dilakukan dengan mencampurkan larutan kitosan sebanyak 100 mL di dalam 400 mL larutan emulsi sawit pada masing-masing larutan kitosan yang telah dipersiapkan. Pencampuran dengan kitosan dilakukan secara perlahan menggunakan ultra-turrax homogenizer selama dua menit.
Dari formulasi tersebut kemudian diperoleh dua belas jenis formula yang berbeda untuk dianalisis. Analisis ukuran partikel dilakukan dengan menggunakan metode Dynamic Light Scatter (DLS) dengan alat Particle Size Analyzer (Vasco Australia). Kestabilan emulsi dianalisis dengan menggunakan metode freeze-thaw stability sebanyak lima siklus.
9 Metode Analisis
Kadar Air, Metode Oven (AOAC 1995)
Bahan yang akan diukur kadar airnya, sebanyak 1-2 g emulsi, ditimbang dalam cawan aluminium yang sudah disiapkan pada tahap sebelumnya. Bahan beserta cawan dikeringkan dalam oven selama 6 jam pada suhu 105C. Kemudian didinginkan dalam desikator dan ditimbang bobotnya.
Kadar air (g/100g basis basah) ( 1 β) 100 Keterangan:
W = bobot contoh sebelum dikeringkan (g)
W1 = bobot contoh + bobot cawan kosong sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
Kadar Abu, Metode Gravimetri (SNI 01-2891-1992)
Sebanyak 2-3 g bahan dikeringkan dengan cawan porselen yang sudah dihitung bobotnya terlebih dahulu. Bahan dimasukkan ke dalam tanur listrik pada suhu 550 C hingga pengabuan sempurna. Bahan kemudian didinginkan di dalam desikator dan ditimbang hingga diperoleh bobot tetap.
Kadar abu (g/100g basis basah) ( 1 β) 100 Keterangan:
W = bobot contoh sebelum diabukan (g)
W1 = bobot contoh + cawan sesudah diabukan (g) W2 = bobot cawan kosong (g)
Kadar Protein, Metode Kjeldahl (AOAC, 1995)
10
Kadar protein (%bb) ( l blanko) obot contoh l 14.007 FK 100 Keterangan:
FK = Faktor konversi yaitu 6.25
Kadar Lemak, Metode Soxhlet (SNI 01-2891-1992)
Labu lemak dikeringkan dalam oven bersuhu 105 C selama sekitar 15 menit, lalu didinginkan dalam desikator dan ditimbang (W2). Sebanyak 1-2 g contoh ditimbang dan dimasukkan ke dalam selongsong kertas saring yang dialasi dengan kapas (W). Setelah itu selongsong kertas yang berisi contoh disumbat dengan kapas, lalu dikeringkan dalam oven pada suhu tidak lebih dari 80 C selama ± 1 jam. Selongsong kertas yang sudah dikeringkan kemudian dimasukkan ke dalam alat soxhlet yang telah dihubungkan ke labu lemak. Lemak dalam contoh diekstrak dengan heksana selama ± 6 jam. Heksana disuling dan ekstrak lemak dikeringkan dalam oven pengering pada suhu 105 C, didinginkan pada desikator, lalu ditimbang.
Kadar lemak g/100g basis basah 1 β 100 Keterangan:
W = bobot contoh (g)
W1 = bobot labu lemak + lemak hasil ekstraksi (g) W2 = bobot labu lemak kosong (g)
Kadar Karbohidrat, Metode by difference (AOAC, 1995)
Kadar karbohidrat dihitung sebagai sisa dari kadar air, abu, lemak, dan protein. Pada analisis ini diasumsikan bahwa karbohidrat merupakan bobot sampel selain air, abu, lemak dan protein. Perhitungan kadar karbohidrat dengan metode by difference menggunakan persamaan sebagai berikut:
Kadar karbohidrat (%) 100 – (kadar air kadar abu kadar protein kadar lemak)
Analisis β-Karoten, Metode HPLC (Parker 1999)
Sebanyak 0.5-2 g sampel dimasukkan ke dalam tabung reaksi bertutup, kemudian ditambahkan 10 mL larutan KOH 5% dalam metanol kemudian divorteks. Setelah itu, gas nitrogen dihembuskan ke dalam tabung reaksi selama 30 detik lalu ditutup untuk mencegah terjadinya oksidasi -karoten. Larutan dipanaskan dalam waterbath 65 C selama 30 menit, lalu didinginkan. Setelah itu, ditambahkan 5 mL air, kemudian divorteks. Selanjutnya, ditambahkan 10 mL heksana kemudian vorteks selama 30 detik, ditunggu hingga larutan dalam tabung terpisah menjadi dua fraksi, lalu diambil larutan pada fraksi heksana (bagian atas) dan dipindahkan ke tabung reaksi lain sambil dilewatkan pada kertas saring yang telah diberi natrium sulfat anhydrous. Langkah ini dilakukan sebanyak 3 kali. Fraksi heksana yang terkumpul diuapkan dengan gas nitrogen hingga kering. Analat kering yang diperoleh dilarutkan dengan 1000 µL fase gerak untuk menghindari terjadinya tailing pada kromatogram.
11 yaitu seri pengenceran 5 kali, 10 kali, 20 kali, 50 kali, dan 100 kali dibuat dari larutan standar -karoten konsentrasi 440 µg/mL dalam basis 1000 µL. Setiap larutan standar diinjeksikan ke HPLC, minimal 2 kali volume sampel loop (20 µL), yaitu 40 µL. Hubungan antara luas peak yang terbaca dengan konsentrasi larutan yang diinjeksikan kemudian diplotkan, dimana luas peak sebagai sumbu y dan konsentrasi larutan sebagai sumbu x. Kemudian peak -karoten pada sampel diidentifikasi dengan mencocokkan waktu retensi peak sampel dengan waktu retensi standar -karoten. Luas area peak -karoten pada sampel dicatat dan dimasukkan ke dalam persamaan kurva standar untuk memperoleh konsentrasi -karoten sampel dari kurva standar (µg/mL).
Freeze-Thaw Stability (Azeem 2009)
Pada analisis freeze-thaw stability sampel sebanyak 20 mL disimpan dalam ruangan bersuhu -20 Cselama 12 jam. Setelah itu sampel kemudian dicairkan kembali pada ruangan gelap bersuhu 27 C selama 12 jam. Setelah itu tinggi keterpisahan total sampel diukur dan dilakukan hingga lima siklus freeze-thaw.
keterpisahan volume cairan yang terpisah (volume larutan emulsi ) 100
Analisis ukuran dan distribusi partikel, Metode Dynamic Light Scatter (Tan dan Nakajima 2005)
Ukuran partikel diamati dengan menganati ukuran partikel rata-rata dan distribusi rata-rata ditentukan dengan Dynamic Light Scatter (DLS) menggunakan alat Zetasizer Nano-S90 (Malvern Instrument, Worcestershire, UK). Hasil yang diberikan akan menunjukkan nilai rata-rata ± standar deviasi dari nilai yang diberikan.
Perhitungan ukuran partikel diukur melalui penyinaran cahaya monokromatik pada larutan yang mengandung partikel bulat dengan gerak Brown tertentu. Penyinaran cahaya monokromatik pada partikel akan mengubah efek Doppler pada larutan yang kemudian akan mengubah gerak Brown pada larutan, dan mengubah panjang gelombang yang terpantulkan. Pada konsentrasi yang dan suhu larutan yang sama, gerak Brown larutan akan semakin kecil seiring dengan semakin besarnya ukuran partikel (Kätzel 2007). Nilai ini akan mengikuti formula:
D
R
D merupakan nilai nilai refraktif indeks sampel, K merupakan nilai konstanta Boltzmann, T merupakan suhu larutan pada 25 C, η merupakan nilai viskositas larutan, dan R merupakan nilai diameter droplet terhitung. Perrhitungan distribusi diameter globula berdasarkan nilai rata-rata ukuran droplet yang dihitung dari nilai rata-rata permukaan terbobot (surface weighted mean) dengan simbol d32 dan rata-rata volume terbobot (volume weighted mean) dengan simbol d43 dengan rumus:
12
nilai ni adalah jumlah droplet dengan diameter di. Nilai d43 dan d32 digunakan untuk memonitor perubahan distribusi ukuran droplet. Nilai d43dan d32 ini secara otomatis akan terbaca pada hasil pengukuran pada alat ini.
Analisis Warna (Hutching 1999)
Pengukuran warna dilakukan menggunakan alat Chromameter CR 300. Pengukuran dilakukan terhadap tiga titik pada permukaan sampel sebanyak 50 mL. Hasil pengukuran dicatat dengan sistem skala L*, a*, b*. Nilai L menyatakan parameter kecerahan (0 = hitam, 100 = putih). Warna kromatik campuran warna merah-hijau ditunjukkan oleh nilai a, (a+) = 0 – 80 untuk warna merah dan (a-) = 0 – (-80) untuk warna hijau). Sementara itu, untuk warna kromatik campuran biru-kuning ditunjukkan oleh nilai b (b+) = 0 – 70 untuk warna kuning dan (b-) = 0 - (-70) untuk warna biru.
Rancangan Perlakuan
Penelitian ini menggunakan rancangan acak lengkap faktorial yang terdiri dari tiga faktor yaitu jenis emulsifier, konsentrasi emulsifier, dan konsentrasi kitosan sebagai penstabil emulsi. Berikut merupakan rancangan yang digunakan:
Yijkl μ αi j k (α )ij (α )ik ( )jk (α )ijk εijkl
Keterangan:
Yijkl = nilai pengamatan faktor tipe emulsifier (i), faktor konsentrasi emulsifier (j) pada konsentrasi kitosan (k) dan ulangan ke-l.
μ = Rataan umum.
αi = Pengaruh jenis emulsifier ke-i j = Pengaruh konsentrasi emulsifier ke-j. k = Pengaruh konsentrasi kitosan ke-k.
(α )ij = interaksi pengaruh jenis emulsifier ke-i dengan konsentrasi emulsifier ke-j.
(α )ik = interaksi pengaruh jenis emulsifier ke-i dengan konsentrasi kitosan ke-k.
( )jk = interaksi pengaruh konsentrasi emulsifier ke-j dengan konsentrasi kitosan ke-k.
(α )ijk = interaksi pengaruh jenis emulsifier ke-i, konsentrasi emulsifier ke-j dan konsentrasi kitosan ke-k.
εijkl = pengaruh galat faktor interaksi pengaruh jenis emulsifier ke-i, konsentrasi emulsifier ke-j dan konsentrasi kitosan ke-k.
13
HASIL DAN PEMBAHASAN
Analisis Proksimat Minyak Sawit Kasar
Pada penelitian ini digunakan CPO yang telah diendapkan terlebih dahulu pada suhu ruang. Bagian minyak yang digunakan sebagai bahan baku pada penelitian ini merupakan fase cair yang berwarna merah yang terdapat pada bagian atas sampel. Proses degumming merupakan proses pemisahan getah dan lendir dari minyak sawit segar yang terdiri dari fosfolipid, protein, residu, karbohidrat, air, dan resin. Pemisahan komponen mikro seperti logam, protein, air, dan komponen fosfatida tersebut penting bagi proses emulsifikasi selanjutnya. Hal ini karena komponen fosfatida dapat menghidrasi dan membentuk emulsi dengan komponen trigliserida (Kateren 2008).
Pada analisis pertama dilakukan analisis proksimat dan kadar -karoten terhadap minyak CPO yang telah melalui tahap degumming. Kadar lemak yang teramati pada lemak adalah 99.76 ± 0.09 %. Komponen lain yang dianalisis pada minyak CPO tersebut adalah kadar air, kadar total mineral, kadar protein, dan karbohidrat. Konsentrasi air yang teramati pada CPO adalah 0.16 ± 0.00 %, konsentrasi abu atau total mineral adalah 0.00 ± 0.00 %, konsentrasi proteinnya sebesar 0.00 ± 0.00 %, dan konsentrasi karbohidratnya sebesar 0.08 %. Kadar -karoten yang teramati pada produk ini adalah 290.55 ± 0.66 ppm.
Berdasarkan analisis proksimat yang dilakukan pada minyak sawit, sampel yang digunakan sesuai dengan standar yang ditetapkan oleh SNI mengenai fraksi minyak dan pengotor lain di dalam CPO. Pada SNI 01-2901-2006 (SNI 2006) mengenai standard CPO ditetapkan kadar maksimal kadar air dan pengotor (protein dan karbohidrat) adalah 0.5 %. Hal ini menunjukkan bahwa proses penghilangan gum yang dilakukan pada minyak sawit berhasil. Konsentrasi air, karbohidrat, dan protein bernilai rendah sebagai akibat reduksi gum atau getah yang umumnya mengandung protein dan logam. Komponen tersebut mampu membentuk emulsi selama proses formulasi dan menginduksi pembentukan radikal. Pada tekanan tinggi komponen protein mampu tereduksi menjadi komponen radikal bebas yang menyebabkan reduksi komponen -karoten pada emulsi (Lander et al. 2000).
Formulasi Nanoemulsi Minyak Sawit Kasar
Pada tahap ini dilakukan formulasi dengan dua jenis emulsifier yaitu Tween 20 dan Tween 80 pada konsentrasi 10% dan 30% (b/b) basis minyak serta penggunaan kitosan 0%, 0.5%, dan 1% (b/v) basis emulsi. Salah satu alasan penggunaan Tween pada penelitian ini karena bahan pengemulsi yang bersifat anionik, seperti Tween 20 dan Tween 80, lebih stabil pada pengaruh perubahan pH, dan perubahan pada kekuatan ionik, serta aman bagi kesehatan karena nilai toksisitas yang lebih rendah dibanding dengan bahan pengemulsi ionik (Azeem et al. 2009). Selain itu bahan pengemulsi bersifat anionik memiliki stabilitas yang lebih baik dalam tubuh (Kawakami et al. 2002).
14
pada sistem emulsi, konsentrasi kitosan lebih dari 1% (basis emulsi) dapat menyebabkan creaming sehingga emulsi menjadi tidak stabil.
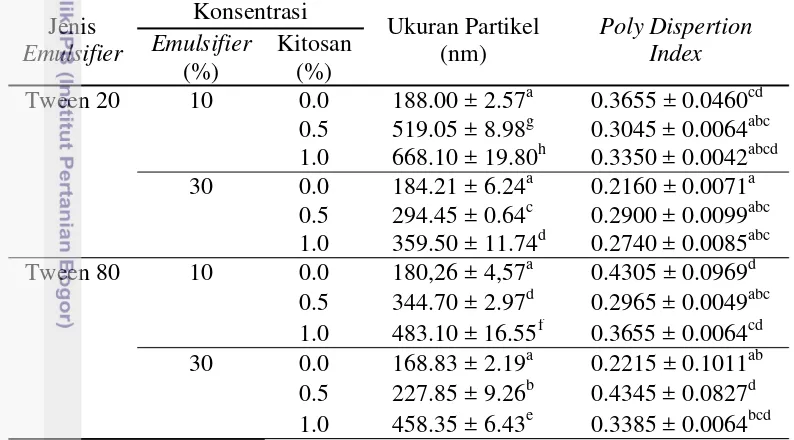
Penggunaan kitosan di dalam sistem emulsi dapat berfungsi sebagai penstabil (Klikensorn 2013). Kemampuan kitosan sebagai dan penstabil di dalam sistem emulsi disebabkan oleh strukturnya yang heterogen. Senyawa kitosan tersusun atas gugus D-glukosamin yang bersifat hidrofilik dan gugus asetil yang bersifat hidrofobik (Rodriguez et al. 2002). Di dalam sistem emulsi, kitosan mampu mengadsorbsi permukaan emulsi yang telah dilapisi oleh emulsifier dan menyelubungi emulsi dengan membentuk lapisan interfasial antara kitosan dengan emulsifier (Klinkesorn 2013). Ukuran partikel emulsi dan nilai PDI dapat dilihat pada Tabel 2
Pada pengamatan terhadap ukuran partikel emulsi, ukuran partikel pada tahap ini berkisar antara 168.83 nm hingga 668.10 nm (Tabel 2). Kelompok dengan ukuran partikel paling rendah teramati pada formula tanpa penambahan kitosan atau kitosan 0%. Hal ini menunjukkan bahwa penambahan kitosan pada formula ini dapat meningkatkan ukuran partikel droplet emulsi (p < 0.05).
Selain oleh pengaruh oleh penambahan kitosan pada Lampiran 2 ditemukan bahwa jenis dan konsentrasi emulsifier yang digunakan pada penelitian ini juga mempengaruhi ukuran partikel emulsi pada tekanan homogenisasi yang sama. Selain oleh pemilihan formula, interaksi antara jenis emulsifier, konsentrasi emulsifier, dan kitosan di dalam sistem emulsi juga berpengaruh terhadap nilai ukuran droplet emulsi.
Penggunaan Tween 80 pada penelitian ini dapat menghasilkan ukuran partikel emulsi yang lebih kecil dibanding dengan penggunaan Tween 20. Perbedaan hasil ini disebabkan oleh pengaruh nilai HLB dan karakteristik bahan yang digunakan. Nilai HLB (hidrophylic-lipohylic balance) Tween 20 dan Tween 80 secara berurutan adalah 16.7 dan 15.0. Tan dan Nakajima (2005) menunjukkan Tabel 2. Ukuran partikel emulsi dan indeks dispersi emulsi pada penggunaan
emulsifier Tween 20 dan Tween 80
Jenis
15 bahwa bahan pengemulsi dengan nilai HLB yang lebih besar mampu menghasilkan ukuran partikel yang lebih kecil pada emulsi o/w. Namun pada penelitian ini hasil ini berbeda dengan penelitian tersebut. Hal ini disebabkan oleh penggunaan minyak sawit yang umumnya didominasi oleh komponen lemak rantai panjang pada konsentrasi yang tinggi. Ukuran droplet yang lebih kecil lebih difasilitasi pada penggunaan emulsifier yang lebih larut pada komponen lemak atau nilai HLB yang sedikit lebih rendah.
Pemilihan besarnya konsentrasi emulsifier dapat mempengaruhi ukuran partikel emulsi. Namun nilai ini tidak teramati berbeda nyata pada formula kitosan 0%, walaupun ukuran partikel pada konsentrasi emulsifier 30% menunjukkan nilai yang sedikit lebih kecil dibandingkan pada konsentrasi 10%. Hal ini menunjukkan bahwa pada tekanan 60 MPa, tanpa penambahan kitosan, emulsi sudah terselubungi secara baik oleh emulsifier sehingga menyebabkan perubahan ukuran partikel yang tidak berbeda nyata. Menurut Tan dan Nakajima (2005) pada taraf tertentu penambahan emulsifier memungkinkan peningkatan luas permukaan sebagai akibat semakin kecilnya ukuran droplet emulsi. Pengecilan ukuran partikel dapat meningkatkan luas permukaan droplet emulsi, peningkatan luas permukaan ini dapat difasilitasi oleh bahan pengemulsi yang menyelubungi emulsi.
Pengamatan terhadap pengaruh konsentrasi kitosan pada ukuran partikel menunjukkan bahwa ukuran partikel emulsi mengalami peningkatan setelah dilakukan penambahan kitosan. Hal ini disebabkan oleh interaksi elektrostatik antara droplet emulsi dengan emulsifier anionik yang bermuatan negatif dengan kitosan (Klinkesorn 2013). Partikel emulsi dengan bahan emulsifier anionik seperti Tween β0 dan Tween 80 umumnya memiliki bermuatan antara ─11 hingga ─1γ m (Klinkesorn dan amatsila β008). Kitosan yang bermuatan lebih positif termati mampu berinteraksi dengan emulsifier dan meningkatkan muatan droplet emulsi menjadi lebih positif (Mun et al. 2005).
Pengaruh konsentrasi emulsifier pada formula dengan kitosan 0.5% dan 1%, menunjukkan peningkatan emulsifier berpengaruh nyata terhadap perubahan ukuran partikel yang semakin kecil. Pada peningkatan emulsifier pada jenis dan konsentrasi kitosan yang sama teramati ukuran partikel yang semakin kecil (p<0.05). Peningkatan konsentrasi bahan kitosan memungkinkan terbentuknya ukuran partikel yang lebih kecil karena tersedianya bahan pengemulsi yang memungkinkan peningkatan luas permukaan droplet (Qian dan McClements 2011). Peningkatan konsentrasi emulsi juga mampu meningkatkan kemungkinan terbentuknya kompleks emulsifier dan kitosan. Hal ini dapat memungkinkan peningkatan luas permukaan yang semakin besar dan ukuran partikel yang semakin kecil (Klinkesorn 2013).
16
Nilai PDI (PolyDispertion Index) merupakan nilai yang menunjukkan distribusi droplet partikel dengan ukuran partikel yang terukur. Semakin kecil nilai PDI emulsi, semakin baik atau semakin dekat distribusi droplet emulsi terukur (Lemarchand et al. 2003). Distribusi droplet emulsi yang ideal berkisar antara 0.09-0.40 (Mao et al. 2009). Pada formulasi emulsi ini tidak teramati perbedaan yang signifikan nilai dispersi antara formula. Hal ini menunjukkan dispersi ukuran partikel emulsi lebih dipengaruhi oleh faktor homogenisasi dan banyaknya pengumpanan dibandingkan dengan pemilihan formula yang digunakan (Tan dan Nakajima 2005). Qian et al. 2011 menunjukkan semakin banyak pengumpanan balik pada homogenisasi akan meningkatkan keseragaman ukuran partikel emulsi dan menurunkan nilai PDI.
Pada tahap ini diamati bahwa formula yang menunjukkan ukuran partikel paling kecil adalah semua formula tanpa penambahan kitosan (kitosan 0%). Hal ini disebabkan kitosan dapat berinteraksi dengan bahan emulsifier dan memperbesar ukuran partikel. Pada formula dengan penambahan kitosan formula dengan ukuran partikel yang berada di bawah 300 nm adalah penggunaan Tween 80 30% kitosan 0.5 % dan Tween 20 30% kitosan 0.5%.
Analisis Freeze-Thaw Stability
Adsorpsi kitosan oleh droplet emulsi dapat meningkatkan stabilitas emulsi dengan mengurangi kemampuan agregasi droplet melalui pembentukan lapisan tebal pada permukaan droplet. Muatan elektrik dan tebalnya lapisan kitosan yang menyelubungi permukaan droplet menghasilkan gaya tolak antar droplet. Gaya tolak antar pada droplet pada muatan yang sama ini dipengaruhi oleh konsentrasi kitosan yang digunakan (Klinkesorn dan Namatsila 2009).
Pada tahap ini diamati perubahan kestabilan emulsi pada tahap freeze-thaw. Selama tahap pembekuan, kristal es yang terbentuk mendesak droplet minyak berdekatan dengan fase pendispersinya. Ghosh dan Coupland (2008) menunjukkan pada proses pendinginan membran yang menyelubungi emulsi teramati pecah. Hal ini dapat menyebabkan terjadinya oiling off dan coalenscens sebagai akibat dari interaksi minyak pada emulsi yang rusak.
Pada tahap ini dilakukan pengamatan terhadap stabilitas emulsi melalui persen keterpisahan emulsi atau nilai % keterpisahan. Nilai ini diperoleh melalui lima siklus pemisahan emulsi. Pemisahan yang diamati pada tahap ini merupakan pemisahan total emulsi. Pada setiap siklus freeze-thaw umumnya menunjukkan perbedaan pemisahan. Pada Gambar 2 ditunjukkan terjadinya pemisahan pada lima siklus freeze-thaw.
Konsentrasi kitosan yang digunakan pada analisis ini adalah 0%, 0.5%, dan 1%. Berdasarkan data yang diperoleh ditunjukkan bahwa nilai % keterpisahan yang diperoleh tidak ada yang melebihi 15%. Perolehan nilai % keterpisahan yang masih memenuhi dapat dikategorikan sedang jika nilai % keterpisahan tidak lebih dari 20% dan dikategorikan tinggi jika nilai % keterpisahan tidak lebih dari 15% (Donsì et al. 2011). Hal ini menunjukkan bahwa pemisahan emulsi ini dikategorikan sebagai pemisahan yang sedang.
17 terdapat kitosan bebas pada fase pendispersinya sehingga dapat mengagregasi droplet emulsi dan menurunkan stabilitasnya (Klinkesorn 2013). Hal ini juga diamati pada penelitian ini, bahwa penambahan kitosan dapat menurunkan nilai % keterpisahan (p<0.05) (Lampiran 6). Dapat pula diamati bahwa penggunaan kitosan 0,5% dan 1% pada Tween 20 30% dan Tween 80 30% umumnya tidak terlalu berbeda nyata dibandingkan dengan formula lain (Tabel 3).
Pada tabel nilai % keterpisahaan emulsi ditunjukkan bahwa emulsi umumnya mengalami pemisahan terbesar yang kemudian akan diikuti oleh penurunan pemisahan. Gambar 2 yang menunjukkan gambaran pemisahan tersebut. Sebelum mencapai pemisahan tertinggi, pemisahan yang teramati merupakan pemisahan satu lapisan. Hal ini menunjukkan terjadinya agregasi pada emulsi (Gambar 2b dan 2c) sebagai akibat terjadinya pembekuan pada permukaan lapisan emulsi (Ghosh dan Coupland 2008). Nilai ini teramati pula pada peningkatan nilai keterpisahan pada Tabel 3.
Setelah melewati pemisahan terbesar pada siklus freeze-thaw terjadi pemisahan yang semakin rendah pada siklus selanjutnya. Namun, pada tahap ini pemisahan yang ditunjukkan bukan hanya pemisahan lapisan keruh namun juga pemisahan globula lemak. Pemisahan globula lemak yang teramati pada tahap ini terjadi sebagai akibat terjadinya oiling-off pada emulsi. Pada peristiwa oiling-off awal (Gambar 2d), minyak yang teramati berbentuk droplet globula lemak yang besar pada lapisan atas emulsi. Pada tahap selanjutnya (Gambar 2e dan 2f) pemisahan emulsi (berwarna keruh) yang teramati semakin kecil, namun oiling-off yang terjadi semakin besar dan lemak yang terpisah (berwarna bening) semakin besar.
Tabel 3. Nilai %keterpisahan pada lima siklus freeze-thaw
Jenis Emulsifier
18
Pada Tabel 3 ditunjukkan nilai % keterpisahan pada setiap siklus pada setiap formula yang digunakan pada penelitian ini. Formula kitosan 0% menghasilkan nilai keterpisahan emulsi yang paling tinggi dibandingkan dengan formula lain. Hal ini menunjukkan bahwa penggunaan kitosan pada formula ini dapat meningkatkan stabilitas emulsi (p<0.05) (Lampiran 6). Hal ini disebabkan oleh kemampuan kitosan yang dapat menyelubungi emulsi dan meningkatkan muatan positif droplet dan meningkatkan daya tolak antara partikel emulsi (Klinkesorn dan Namatsila 2008).
Penggunaan kitosan 1% teramati mampu mempertahankan emulsi dan memperlama proses oiling-off pada emulsi. Pada formula ini terjadinya oiling-off terjadi pada siklus ketiga dan keempat. Hal ini menunjukkan penggunaan kitosan 1% mampu memperlambat terjadinya oiling off pada perubahan kondisi emulsi. Hal tersebut dapat disebabkan oleh lapisan pada permukaan droplet yang lebih tebal pada penggunaan kitosan 1% dapat menahan destruksi permukaan droplet lebih lama sehingga dapat menahan terjadinya oiling off (Aoki et al. 2005). Namun pada penggunaan formula ini, setelah teramati pemisahan terbesar oiling off yang terjadi pada siklus selanjutnya sangat besar. Nilai ini ditunjukkan dengan pemisahan yang sangat kecil pada fase selanjutnya yang menunjukkan pemisahan yang teradi merupakan pemisahan minyak. Klinkesorn dan Namatsila (2008) menjelaskan bahwa penggunaan kitosan dalam konsentrasi besar dapat meningkatkan flokulasi pada emulsi sebagai akibat terbentuknya ikatan antar komponen kitosan pada siklus freeze-thaw yang mampu menurunkan stabilitas emulsi dan meningkatkan kemungkinan oiling off.
Selain dipengaruhi oleh konsentrasi kitosan pemisahan emulsi ini juga dipengaruhi oleh konsentrasi emulsifier yang digunakan (Lampiran 2). Penggunaan emulsi 30% mampu meningkatkan ikatan kompleks antara bahan pengemulsi dan kitosan yang mampu meningkatkan stabilitas emulsi. Berdasarkan data yang diperoleh, formula terpilih yang diperoleh pada tahap ini merupakan penggunaan Tween 20 30% Kitosan 0.5% dan Tween 80 30% Kitosan 0.5% .
Siklus 1
Siklus 0 Siklus2 Siklus 3 Siklus 4 Siklus 5 1
Gambar 1. Pemisahan emulsi formula Tween 20 30% Kitosan 0.5% pada siklus freeze-thaw stability.
19 Analisis β-Karoten dan Warna Emulsi pada Formula Terpilih
Pada tahap selanjutnya dilakukan analisis kandungan -karoten menggunakan metode HPLC pada formulasi Tween 20 30% Kitosan 0.5% dan Tween 20 30% Kitosan 0.5%. Sebagai formula terbaik berdasarkan uji stabilitas emulsi, pada analisis ini diamati perubahan konsentrasi -karoten dan perubahan warna emulsi pada waktu setelah dilakukan formulasi, 15 hari, dan 45 hari pada suhu 31 C di dalam ruang kedap cahaya.
Setelah penyimpanan selama 45 hari teramati besar perubahan -karoten tidak lebih dari 30%. Pada formula menggunakan Tween 20 30% K 0.5% besar perubahan konsentrasi -karoten teramati lebih besar dibandingkan dengan formula penggunaan Tween 80. Nilai perubahan konsentrasi -karoten ini masih jauh lebih rendah dibandingkan dengan perubahan konsentrasi -karoten oleh Yuan et al. (2008). Pada penelitian Yuan et al. (2008) ditunjukkan perubahan -karoten pada suhu 30 C berkisar antara 200-500 ppm pada penyimpanan emulsi hingga 28 hari. Hal ini menunjukkan, penambahan kitosan pada nanoemulsi sawit dapat memperlambat degradasi -karoten dibandingkan dengan formula tanpa penambahan bahan kitosan, sebagai akibat terbentuknya lapisan penyelubung yang berfungsi sebagai lapisan penghalang pada emulsi yang dapat menahan -karoten dari bahan prooksidan (Qian et al. 2012).
Hal ini juga teramati pada perubahan warna emulsi (Tabel 6). Derajat L* menunjukkan derajat kecerahan warna, reduksi pada derajat positif a* menunjukkan reduksi pada derajat kemerahan emulsi, dan reduksi pada derajat positif b* menunjukkan reduksi pada standar kuning emulsi (Mao et al. 2009). Pada penelitian ini diamati nilai perbedaan warna total dengan membandingkan warna emulsi sebelum penyimpanan dengan warna setelah penyimpanan. Perbedaan warna total (∆E*) pada penggunaan Tween 20 lebih besar dibandingkan dengan perubahan warna pada penggunaan Tween 80. Perubahan warna pada emulsi minyak sawit mengindikasikan degradasi konsentrasi -karoten relatif terhadap suhu dan waktu penyimpanan emulsi (Qian et al. 2012). Penggunaan Tween 80 sebagai emulsifier pada formula ini teramati lebih baik dibandingkan dengan penggunaan Tween 20.
Struktur -karoten yang sangat tidak jenuh (11 ikatan rangkap, 9 tidak terkonjugasi) membuat bahan ini sangat sensitif terhadap degradasi oleh suhu dan bahan pengoksidasi (Kateren 2005). Faktor yang mempengaruhi perubahan konsentrasi -karoten selama proses penyimpanan adalah turunnya nilai pH Tabel 4. Perubahan konsentrasi -karoten selama masa penyimpanan pada
formula terpilih
Formula
20
emulsi, cahaya, meningkatnya suhu selama proses penyimpanan, dan kemungkinan terbentuknya radikal bebas. Selain itu Mao et al (2009) menyatakan bahwa destruksi -karoten pada emulsi dapat disebabkan oleh reaksi yang dimediasi melalui senyawa kimia pada permukaan droplet emulsi yang menghubungkan fase pendispersi dan fase terdispersinya. Oleh sebab itu, semakin kecil ukuran partikel dapat memperkecil kemungkinan terjadinya reaksi yang dapat mendestruksi -karoten, karena semakin kecilnya kemungkinan terjadinya reaksi pada -karoten karena semakin besarnya permukaan yang dapat menahan reaksi pada droplet emulsi.
Menurut Mehnert dan Mader (2001) proses homogenisasi menggunakan high pressure homogenizer dapat menyebabkan degradasi DNA dan albumin yang dapat menginduksi terbentuknya radikal bebas. Lander et al. (2000) menunjukkan bahwa radikal bebas mulai terbentuk pada tekanan pada rentang 11.03-34.47 MPa (110.3-344.7 Bar). Namun Mehnert dan Mader (2001) menunjukkan degradasi yang diinduksi oleh tekanan tinggi selama proses homogenisasi bukan masalah yang serius pada bahan aktif, seperti -karoten. Berdasarkan uji kadar -karoten dan perubahan warna yang dilakukan, formula terpilih yang diperoleh pada tahap ini adalah Tween 80 30% Kitosan 0.5% .
SIMPULAN DAN SARAN
Simpulan
Pada analisis ukuran partikel, formula yang menghasilkan ukuran partikel tidak melebihi 300 nm setelah penambahan kitosan adalah penggunaan Tween 20 dan 80 30% serta Kitosan 0.5%. Konsentrasi emulsifier sebanyak 30% mampu menghasilkan ukuran partikel yang lebih kecil dibandingkan dengan konsentrasi 10% setelah dilakukan penambahan kitosan. Penggunaan kitosan hingga 1% mampu mengurangi kemampuan oiling off pada emulsi, namun meningkatkan ukuran partikel. Penggunaan kitosan 0.5% teramati lebih mampu meningkatkan kestabilan emulsi dibandingkan dengan kitosan 1 Formula terbaik pada analisis freeze-thaw stability adalah Tween 20 dan 80 30% serta Kitosan 0.5% sehingga Tabel 5. Perubahan warna emulsi selama masa penyimpanan pada formula
21 formula ini terpilih untuk dilakukan uji kadar -karoten dan warna. Hasil pengujian menunjukkan penggunaan Tween 80 teramati lebih sesuai digunakan pada emulsi minyak sawit dibandingkan dengan penggunaan Tween 20. Formula dengan Tween 80 30% kitosan 0.5% mampu mempertahankan konsentrasi -karoten lebih baik dibandingkan dengan formula Tween 20 30% kitosan 0.5%, sehingga formula terpilih pada penelitian ini adalah penggunaan Tween 80 30% kitosan 0.5%
Saran
Diperlukan studi lanjut mengenai pengembangan produk ini menjadi produk healthy drink, serta penyerapan dan interaksinya di dalam sistem pencernaan.
DAFTAR PUSTAKA
Acosta E. 2009. Bioavailability of nanoparticles in nutrient and nutraceutical delivery. Current Opinion in Colloid & Interface Science 14: 3–15. doi:10.1016/j.cocis.2008.01.002.
[AOAC] Association of Official Analytical Chemist. 1995. Official Methods of Analysis of The Association of Official Agriculture Chemist 16th edition. Virginia. AOAC International.
Aoki T, EA Decker, DJ McClements. 2005. Influence of environmental stresses on stability of O/W emulsions containing droplets stabilized by multilayered membranes produced by a layer-bylayer electrostatic deposition technique. Food Hydrocolloids, 19(2):209–220.
Azeem A, Mohammad R, Farhan JA, Zeenat I, Roop KK, M Aqil, Sushama Talegaonkar. 2009. Nanoemulsion Components Screening and Selection: a Technical Note. AAPS Pharma Science Technology, 10 (1): 69-77. doi: 10.1208/s12249-008-9178-x.
Azlan A, K Nagendra P, Hock EK, Nurnadia AA, Alina M, Amin I, Zulkhairi A. 2010. Comparison of fatty acids, vitamin E and physicochemical properties of Canarium odontophyllum Miq. (dabai), olive and palm oils. Journal of Food Composition and Analysis (23): 772–776.
D’Odorico A, D Martines, S Kiechl, G Egge, F Oberhollenze, P Bonviani, GC Sturniolo, R Naccaroto, J illeit. β000. igh plasma level of α and carotene are associated with lower risk of artherosclerosis: result from the Bruneck Study. Artherosclerosis (153): 9-231.
[Ditjenbun 2011] Direktorat Jenderal Perkebunan, Kemeterian Pertanian. 2011. Luas areal dan produksi perkebunan seluruh Indonesia menurut pengusahaan [internet]. [diacu 25 November 2012].Tersedia dari http://ditjenbun.deptan.go. id/cigraph/index.php/viewstat/komoditasutama/8-Kelapa%20Sawit.html. [17 Januari 2014].
22
Ghosh S, John N Coupland. 2008. Factors affecting the freeze–thaw stability of emulsions. Food Hydrocolloids, 22: 105–111. doi:10.1016/j.foodhyd.2007. 04.013.
Huang Q, Yu H, dan Ru Q. 2010. Bioavailability and delivery of nutraceuticals
using nanotechnology. Journal of Food Science,75(1): 50–57. doi:
10.1111/j.1750-3841.2009.01457.x.
Hussain N, Jaitley V, Florence AT. 2001. Recent advances in the understanding of uptake of microparticulates across the gastrointestinal lymphatics. Advanced Drug Delivery Review, 50:107–42. doi: 10.1016/S0169-409X(01)00152-1. Hutching JB. 1999. Food Color and Appearance 2nd edition A Chapman and Hall
Food Science Book. Maryland: Aspen Publition.
Ketaren S. 2005. Minyak dan Lemak Pangan. Jakarta : Ul-Press.
Kawakami K, T Yoshikawa, Y Moroto, E Kanaoka, K Takahashi, Y Nishihara, K Masuda. 2002. Microemulsion formulation for enhanced absorption of poorly soluble drugs. II. Invivo study. Journal Control Release, 81:75–82.
Klinkesorn Utai. 2013. The role of chitosan in emulsion formation and stabilization. Food Reviews International, 29: 371-393. doi: 10.1080/87559129. 2013.818013.
Klinkesorn U, Namatsila Y. 2009. Influence of chitosan and NaCl on physicochemical properties of low-acid tuna oil-in-water emulsions stabilized by non-ionic surfactant. Food Hydrocolloids, 23: 1374–1380. doi:10.1016/j.foodhyd.2008.11.002.
Lam NT, Yet HT, Hai LT, Huong PT, Ha NT, Huan TT . 2001. Effects of red palm oil supplementation on vitamin a and iron status of rural underfive children in vietnam. Di dalam: Cutting-Edge Technologies For Sustained Competitiveness Food Technology and Nutrition Conference. Proceedings 2001 PIPOC International Palm Oil Congress; Malaysia, 20-22 August 2001. Malaysia: Malaysian Palm Oil Board.
Lander R, Manger M, Scouloudis M, Ku A, Lee A. 2000. Gaulin homogenization: A mechanistic study. Biotechnology Progress, 16: 80–85.
Lemarchand C, Couvreur P, Vauthier C, Costantini D, Gref R. 2003. Study of emulsion stabilization by graft copolymers using the optical analyzer Turbiscan. International Journal of Pharmaceutics, 254: 77–82.
Liu Yuwei, Zhanqun Hou, Fei Lei, Yuanyuan Chang, Yanxiang Gao. 2012. Investigation into the bioaccessibility and microstructure changes of -caroteneemulsions during in vitro digestion. Innovative Food Science and Emerging Technologies 15 : 86–95.
Mas’ud F. β007. Optimasi Proses Deasidifikasi untuk Meminimalkan Kerusakan Karotenoid dalam Pemurnian Minyak Sawit (Elaeis guineensis, Jacq).Tesis. Program Pascasarjana IPB, Bogor.
Mason TG, JN Wilking, K Meleson, CB Chang, SM Graves. 2006. Nanoemulsions: formation, structure, and physical properties. Journal of Physics Condensed Matter (18): 635-666. doi:10.1088/0953-8984/18/41/R01. Mao L, Duoxia X, Jia Y, Fang Y, Yanxiang G, Jian Z. 2009. Effects of small and
23 Mao Y, DJ McClements. 2011. Modulation of bulk physicochemical properties of emulsions by hetero-aggregation of oppositely charged protein-coated lipid droplets. Food Hydrocolloids (25): 1201-1209.
Marx Michaela, Monika S, Andreas S, Reinhold C. 2003.Effects of thermal processing on trans–cis-isomerization of -carotene in carrot juices and carotene-containing preparations. Food Chemistry (83): 609–617.
McClements David Julian. 2004. Food Emulsion Principles, Practices, and Techniques. New York: CRC Press.
McClements David Julian, Decker EA dan Weiss J. 2007. Emulsion-based delivery systems for lipophilic bioactive components. Journal of Food Science, 72(8): 109–124.
Mehnert W, Mader K. 2001. Solid lipid nanoparticles: production, characterization and applications. Advanced Drug Delivery Reviews, 47 : 165– 196.
Mortensen A. 2005. Analysis of a complex mixture of carotenes from oil palm (Elaesis guinesis) fruit extract. Food Research International (38): 847-853. Mun S, EA Decker, DJ McClements. 2005. Influence of droplet characteristics on
the formation of oil-in-water emulsions stabilized by surfactant-chitosan layers. Langmuir, 21: 6228–6234.
Parker RS, Swanson JE, You CS, Edward AJ, Huang T. 1999. Bioavailability of carotenoids in human subjects. Proc Nutr Soc. 58: 155-162.
Qian C, DJ McClements. 2011. Formation of nanoemulsions stabilized by model food-grade emulsifiers using high-pressure homogenization: Factors affecting particle size. Food Hydrocolloids, 25: 1000-1008. doi: 10.1016/j.foodhyd. 2010.09.017.
Qian Cheng, Eric Andrew Decker, Hang Xiao, David Julian McClements. 2012. Physical and chemical stability of b-carotene-enriched nanoemulsions: Influence of pH, ionic strength, temperature, and emulsifier type. Food Chemistry, 132: 1221–1229. doi:10.1016/j.foodchem.2011.11.091.
Rodriguez MS, Albertengo LA, Agullo E. 2002. Emulsification capacity of chitosan. Carbohydr. Polym. 48: 271–276.
Rodriguez-Amaya dan M Kimura. 2004. Harvest Plus Handbook for Carotenoid Analysis. IFPRI dan CIAT, Washington DC.
Sastrosayono S. 2009. Budi Daya Kelapa Sawit. Jakarta: PT Agromedia Pustaka. Silva Hélder Daniel, Miguel Ângelo Cerqueira, António A. Vicente. 2012.
Nanoemulsions for food applications: development and characterization. Food Bioprocess Technol 5:854–867.
[SNI] Standar Nasional Indonesia. 2006. Standar Crude Palm Oil. SNI 01-2901-2006. Jakarta (ID): Badan Standardisasi Nasional.
Sundram K. 2007. Palm Oil: Chemistry and Nutrition Update. Malaysia : MPOB Takigami S.
Tan CP, Nakajima M. β005. -Carotene nanodispersions: preparation, characterization and stability evaluation. Food Chemistry 92 : 661–671.
24
von Lintig J. 2010. Colors with functions: Elucidating the biochemical and molecular basis of carotenoid metabolism. In Annual Review of Nutrition. Vol. 30: 35-56.
Winarno F.G. 2004.Kimia Pangan dan Gizi. Jakarta: PT. Gramedia.
25
Lampiran 1 Diagram alir proses degumming CPO (Mas’ud β007) CPO
Pemanasan 80oC
Pengadukan 15 menit, 56 rpm
CPO hasil
degumming
Pendinginan pada suhu ruang
Asam fosfat 85% sebanyak 0.15% (v/v)
26
Lampiran 2 Diagram Alir Formulasi Minuman Nanoemulsi
Kitosan 0%; 0,5%; 1%;
(b/b) Pencampuran
1000 rpm 30 detik
Homogenisasi 10 menit 8000 rpm
Emulsi Kasar
Homogenisasi 600 Bar, 5 Pengumpanan
Nanoemulsi Sawit
Minyak Sawit Air Buffer
10 mM
Emulsifier Tween 20;80
10%, 30% (b/b)
Homogenisasi 1 menit 8000 rpm
27 Lampiran 3 Analisis ukuran partikel dan PDI
Tests of Between-Subjects Effects
Model D_distribusi 3.352E6 12 279365.028 2990.135 .000
PdI 2.607b 12 .217 90.061 .000
Jenis_Emulsifier D_distribusi 20442.341 1 20442.341 218.801 .000
PdI .015 1 .015 6.301 .027
Konsentrasi_Emulsifier D_distribusi 79354.600 1 79354.600 849.358 .000
PdI .017 1 .017 7.208 .020
Konsentrasi_Kitosan D_distribusi 389776.938 2 194888.469 2085.955 .000
PdI .002 2 .001 .516 .610
Jenis_Emulsifier*
Konsentrasi_Emulsifier
D_distribusi 24570.880 1 24570.880 262.990 .000
PdI .003 1 .003 1.114 .312
Jenis_Emulsifier*
Konsentrasi_Kitosan
D_distribusi 12564.288 2 6282.144 67.240 .000
PdI .001 2 .001 .231 .797
Konsentrasi_Emulsifier *
Konsentrasi_Kitosan
D_distribusi 34616.387 2 17308.193 185.255 .000
PdI .058 2 .029 12.098 .001
Jenis_Emulsifier*
Konsentrasi_Emulsifier *
Konsentrasi_Kitosan
D_distribusi 21548.747 2 10774.374 115.322 .000
PdI .011 2 .006 2.339 .139
Error D_distribusi 1121.147 12 93.429
PdI .029 12 .002
Total D_distribusi 3353501.488 24
29
RIWAYAT HIDUP
Yanda Genakela Marpaung dilahirkan di Pandan pada tanggal 15 September 1991 dari ayah Kristian Marpaung dan ibu Julinda Silitonga. Penulis merupakan putra ketiga dari empat bersaudara. Pada tahun 2009, penulis lulus dari SMA Negeri 1 Sibolga. Penulis diterima di Departemen Ilmu dan Teknologi Pangan pada tahun 2009 melalui jalur Ujian Saringan Masuk (USM) IPB.
Selama menempuh pendidikan di IPB, penulis tergabung di dalam Komisi Kesenian PMK IPB dan Food Processing Club IPB. Penulis tergabung dalam beberapa panitia seperti Baur 2011, LCTIP XIX, dan tergabung sebagai tenaga penyuluh di SDN Gunung Leutik dan Cihideung Illir pada pelajaran Tumbuhan Tropis. Penulis juga aktif mengikuti seminar dan pelatihan yang diselenggarakan di IPB. Penulis merupakan penerima beasiswa PPA DIKTI, Women International Club, Indofood Riset Nugraha, dan Japan Student Services Organization (JASSO).