VALIDASI KIT EIA KOMERSIAL UNTUK
ANALISA HORMON ESTRADIOL DAN PROGESTERON
PADA KAMBING KACANG (Capra hircus) BETINA
DEDI RAHMAT SETIADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Validasi Kit EIA Komersial untuk Analisa Hormon Estradiol dan Progesteron pada Kambing Kacang (Capra hircus) Betina adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DEDI RAHMAT SETIADI. Validasi Kit EIA Komersial untuk Analisa Hormon Estradiol dan Progesteron pada Kambing Kacang (Capra hircus) Betina. Dibimbing oleh IMAN SUPRIATNA dan MUHAMMAD AGIL.
Enzyme immunosorbent assay (EIA) adalah suatu teknik yang menghubungkan spesifitas antibodi dengan kepekaan uji enzimatis atau antigen yang dilekatkan pada enzim dengan spektrofotometer biasa. Analisa dengan menggunakan teknik EIA telah terbukti cocok untuk menggantikan teknik radio immunoassay (RIA) yang memiliki berbagai kelemahan. Terdapat beberapa produk kit EIA komersial yang dapat dipergunakan untuk pengujian konsentrasi hormon, tetapi belum ada dari produk tersebut yang dapat dijadikan sebagai rujukan dalam penggunaannya untuk hewan.
Penelitian ini bertujuan untuk menentukan kelaikan kit EIA komersial estradiol dan progesteron untuk manusia yang dipergunakan untuk monitoring status reproduksi kambing kacang. Penelitian ini menggunakan tiga ekor kambing kacang betina berumur 2–3 tahun, kondisi sehat, memiliki siklus estrus reguler, fertil dan tidak bunting. Sampel darah diambil dari vena jugularis menggunakan venoject 21 G setiap dua hari sekali dan diintensifkan setiap hari menjelang fase estrus, plasma disimpan pada suhu -20ºC sampai dilakukan analisa. Ultrasonografi dipergunakan untuk memeriksa organ reproduksi betina (ovarium) pada saat pengambilan darah. Validasi hormon asai dilakukan dengan metode validasi laboratorium dan validasi biologi. Validasi laboratorium dipastikan dengan melakukan pengukuran akurasi, sensitivitas dan presisi. Validasi biologi dilakukan berdasarkan perbandingan profil hormon yang diperoleh dengan perubahan morfologi dan gambaran hasil USG pemeriksaan ovarium.
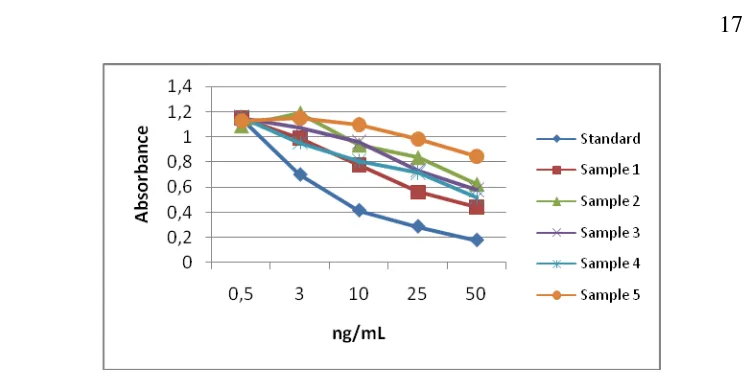
Uji paralelisme memperlihatkan bahwa kurva sampel paralel dengan kurva standar kit estradiol (E2) dan progesteron (P4) produk DRG International Inc., sedangkan tidak paralel dengan kit hormon EIA produk GBC. Konsentrasi terkecil hormon estradiol dan progesteron yang terukur pada 90% binding adalah 25 pg/mL dan 0.14 ng/mL untuk kit DRG. Koefisien variasi intra- dan interasai (%CV) pada kit DRG untuk E2 dan P4 adalah ˂ 10%. Kambing 5 dan 9 tidak menunjukkan siklus estrus dengan profil hormon tampak datar. Kambing 7 menunjukkan siklus estrus yang tidak teratur, dengan hanya ditemukannya profil progesteron dari satu siklus selama 62 hari pengamatan walaupun tidak disertai profil estradiol yang spesifik pada siklus tersebut. Konsentrasi progesteron selama fase luteal berkisar antara 3.6–42.8 ng/mL. Konsentrasi tampak meningkat signifikan pada hari ke 4 setelah ovulasi teramati dan mencapai puncaknya pada hari ke 6 sampai hari ke 14 dengan konsentrasi 19.2–42.8 ng/mL sebelum menurun drastis pada akhir siklus. Dengan demikian dapat disimpulkan bahwa kit EIA P4 DRG adalah cocok dan dapat digunakan untuk monitoring status reproduksi dengan pengujian sampel plasma kambing kacang betina, namun tidak demikian dengan EIA E2 DRG. Sedangkan kit EIA E2 serta P4 GBC tidak dapat digunakan untuk menganalisa hormon E2 dan P4 dari sampel darah kambing kacang.
SUMMARY
DEDI RAHMAT SETIADI. Validation of Commercial EIA Kit for Analysis of Hormone Estradiol and Progesterone in Female Kacang Goat (Capra hircus). Supervised by IMAN SUPRIATNA and MUHAMMAD AGIL.
Enzyme immunosorbent assay (EIA) is a technique that connects the specificity of antibodies with the enzymatic test sensitivity or antigen attached to the enzyme by regular spectrophotometer. Analysis using EIA technique has been proved suitable to replace the radio immunoassay (RIA) technique which has many weaknesses. There are several commercial EIA hormone kit products that can be used nowadays to test the concentration of the hormone, but not any of the products which can be used as a reference.
The aims of this study was to determine the feasibility of commercial EIA hormone kits for human estradiol and progesterone whether can be used or not for monitoring reproductive status of kacang goat. This study used 3 female kacang goats 2–3 years old, healthy, have regular estrous cycles, fertile and unpregnant. Blood samples were taken from the jugular vein using a 21 G venoject every two days and sample collection was intensified every day prior to heat. Blood plasma stored at -20ºC until the analyse. Ultrasound is used to check the female
reproductive organs (ovaries) during blood sampling. Hormone assay validation was conducted through laboratory validation and biologycal validation. Laboratory validation was carried out by measuring accuracy, sensitivity and precision. Comparison between hormone profile and morphologycal change and USG picture of the ovary was used as biologycal validation.
Parallelism test showed that sample curve was parallel with standard curve of E2 and P4 of DRG commercial kit, in contrast GBC commercial kit was not parallel. The lowest hormone concentration of estradiol (E2) and progesterone (P4) at 90% binding was 25 pg/mL and 0.14 ng/mL in DRG kit. Coefficient variation of intra- and interassay for both DRG EIA commercial kits were less than 10%. Goat 5 and 9 did not show estrus cycle with hormone profiles appear flat. Goat 7 showed irregular estrous cycles, with only finding of progesterone profile of one cycle during 62 days of observation, although it did not coincide with profiles of estradiol on the cycle. Progesterone concentrations during the luteal phase ranged from 3.6-42.8 ng/mL. Concentration appears to increase significantly at day 4 after ovulation was observed and reached a peak on day 6 to day 14 with a concentration of 19.2-42.8 ng / mL before decreased dramatically by the end of the cycle. It can be concluded that the P4 DRG EIA kit is suitable and can be used for monitoring the reproductive status by measuring plasma samples female kacang goat, but not compatible for E2 EIA DRG. While E2 and P4 EIA kits GBC can not be used to analyze hormones E2 and P4 from blood samples of kacang goat.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
VALIDASI KIT EIA KOMERSIAL UNTUK ANALISA
HORMON ESTRADIOL DAN PROGESTERON
PADA KAMBING KACANG (Capra hircus) BETINA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini berkaitan dengan validasi kit EIA komersial dengan menggunakan sampel darah kambing kacang berupa plasma. Sampai saat ini kit EIA komersial tersebut belum ada yang dapat dijadikan sebagai rujukan atau referensi untuk digunakan karena memiliki sensitifitas yang berbeda. Kepekaan ini penting untuk diketahui karena berhubungan erat dengan jumlah konsentrasi hormon yang dapat diketahui oleh kit EIA komersial tersebut. Karya ilmiah ini juga berisikan informasi mengenai protokol analisa hormonal untuk sampel kambing kacang serta produk kit EIA komersial yang tepat dan selanjutnya dapat dipergunakan sebagai bahan referensi untuk pemeriksaan hormon dalam sampel darah dari ternak tersebut.
Terimakasih penulis sampaikan kepada Prof Dr drh Iman Supriatna sebagai ketua komisi pembimbing dan Dr drh Muhammad Agil, MScAgr selaku anggota komisi pembimbing atas bimbingan, arahan, perhatian dan nasehat selama melakukan penelitian dan penulisan karya ilmiah ini.
Penghargaan disampaikan penulis kepada Ketua Program Studi Biologi Reproduksi Sekolah Pascasarjana Institut Pertanian Bogor, Kepala Bagian Reproduksi dan Kebidanan, seluruh staf pendidik dan kependidikan Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, FKH-IPB yang telah memberikan ijin sekolah, dukungan dan membantu kepada penulis dalam menempuh studi hingga selesainya penulisan karya ilmiah ini.
Perhargaan setinggi-tingginya penulis sampaikan kepada Dr drh Muhammad Agil,MScAgr yang telah mendorong, mendukung dan masukannya pada saat penulis akan menempuh dan mengikuti studi pada Program Studi Biologi Reproduksi. Ucapan terimakasih juga disampaikan kepada drh Santoso dan drh Andriyanto,MSi sebagai rekan kerja dan yang telah membantu selama penelitian, tak lupa kepada seluruh rekan-rekan pada Program Studi Biologi Reproduksi 2011 penulis ucapkan terimakasih.
Dengan penuh rasa hormat penulis persembahkan kepada Ayahanda (alm) Muhammad Dadjri, ibunda Rasimi dan seluruh keluarga atas doa, dukungan dan kasih sayang yang diberikan. Terimakasih disampaikan kepada seluruh pihak yang tidak dapat disebutkan satu persatu yang telah memberikan perhatian dan dukungan kepada penulis.
Karya ilmiah ini didedikasikan untuk istri tersayang ‘Yuli Yulianti’ dan anak-anakku ‘Rifaa Mufiidah Setiadi’, ‘Fahmida Shaista Setiadi’ dan ‘Muhafiz Rohail Setiadi’ yang tidak ada lelahnya mendukung selama penulis menempuh studi. Akhirnya, semoga karya ilmiah berupa tesis ini dapat memberikan informasi yang bermanfaat dan berguna.
Bogor, Maret 2014
DAFTAR ISI
Pertanyaan Saintifik yang Harus Dijawab 3
2 TINJAUAN PUSTAKA 3
Kambing Kacang 3
Taksonomi 3
Morfologi dan Biologi 4
Biosintesis Dan Metabolisme Hormon Steroid:Estradiol dan
Progesteron 4
Kit EIA Komersial 6
3 MATERI DAN METODE 8
Waktu dan Tempat Penelitian 8
Materi Penelitian 8
Metode Penelitian 9
Tahap I Monitoring Pola Siklus Estrus pada Kambing Kacang 9 Analisa Hormon Estradiol dan Progesteron selama Siklus Estrus 9 Monitoring Siklus Ovarium Menggunakan USG 9 Tahap II Validasi Beberapa Kit Komersial 10
Uji Paralelisme 10
Optimalisasi Standard Kurva Hormon Asai 10
Sensitivitas Kit EIA 11
Presisi Kit EIA 11
Intra- dan Inter-Assay Variation 11
Analisa Hormon 12
Prosedur Asai Hormon 12
Hormon Estradiol DRG Jerman (EIA-2693) 12 Hormon Progesteron DRG Jerman (EIA-1561) 12 Hormon Estradiol GBC Taiwan (4S00071) 13 Hormon Progesteron GBC Taiwan (4S00121) 13
4 HASIL DAN PEMBAHASAN 14
Validasi Kit 14
Gambaran Morfologi dan Perkembangan Struktur Fungsional Ovari
DAFTAR GAMBAR
1 Kambing kacang berwarna campuran (coklat dan putih) 4 2 Transformasi biokimia utama yang terjadi pada hormon steroid 5
3 Mekanisme kerja hormon steroid 6
4 Kurva sampel sejajar dengan kurva standar menggunakan kit EIA komersial estradiol dari produk DRG International Inc.,
Jerman 14
5 Kurva sampel sejajar dengan kurva standar menggunakan kit EIA komersial progesteron dari produk DRG international
Inc.,Jerman 15
6 Kurva sampel tidak sejajar dengan kurva standar menggunakan kit EIA komersial estradiol GBC Taiwan 16 7 Kurva sampel tidak sejajar dengan kurva standar menggunakan
kit EIA komersial progesteron GBC Taiwan 17 8 Vulva kambing kacang yang diduga estrus (a) dan tidak estrus
(b) 18
9 Pertumbuhan folikel 4.3 mm dan 4.9 mm pada ovarium kanan (a) dan CL 4.0 mm dan 4.6 mm pada ovarium kiri (b) 18 10 Ukuran ovarium kiri (a) dan kanan (b) tanda panah 19 11 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna
merah) kambing kacang 5 selama 9 minggu (62 hari) 19 12 Ukuran folikel dan CL kambing kacang 5 yang terdeteksi dengan
USG 20
13 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna merah) kambing kacang 9 selama 9 minggu (62 hari) 20 14 Ukuran folikel dan CL kambing kacang 9 yang terdeteksi dengan
USG 20
15 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna merah) kambing kacang 7 selama 9 minggu (62 hari) 21 16 Ukuran folikel dan CL kambing kacang 7 yang terdeteksi dengan
USG 22
17 Pertumbuhan dan perkembangan folikel dan CL kambing kacang
1
PENDAHULUAN
Latar Belakang
Enzyme immunosorbent assay (EIA) adalah suatu teknik yang menghubungkan spesifitas antibodi dengan kepekaan uji enzimatis dengan spektrofotometer biasa atau antigen yang dilekatkan pada enzim. Ciri utama dari teknik ini adalah dipakai indikator enzim untuk reaksi imunologi. Penggunaan reaksi antigen-antibodi sebagai alat analisa telah menimbulkan revolusi dalam berbagai ilmu–ilmu biomedis. Reaksi ini tidak hanya bermanfaat untuk mendiagnosa penyakit infeksi dengan cara mendeteksi respons antibodi, tetapi telah digunakan pula secara meluas untuk mendeteksi antigen seperti hormon.
Analisa dengan menggunakan metoda EIA telah terbukti cocok untuk menggantikan teknik radio immunoassay (RIA) yang memiliki berbagai kelemahan. Pendekatan EIA ini memiliki berbagai keunggulan dibandingkan RIA antara lain: tidak perlu menggunakan bahan radioaktif, label yang stabil sehingga dapat disimpan lebih lama, deteksi aktivitas enzim hanya memerlukan alat fotometri (Entwistle dan Ridd 1995).
Penggunaan metoda EIA dalam analisa hormon baik untuk riset maupun penerapan klinis terus mengalami peningkatan. Keunggulan yang dimiliki metoda EIA mengakibatkan teknik ini cepat populer. Di negara berkembang EIA lebih memungkinkan untuk dilakukan dibandingkan dengan RIA karena tidak membutuhkan pemakaian isotop. Berdasarkan alasan–alasan di atas maka perlu adanya suatu kajian untuk menganalisa metoda EIA untuk analisa hormon khususnya hormon reproduksi.
Kaitannya dengan hormon reproduksi, sekarang ini banyak monitoring status dan evaluasi potensi reproduksi yang telah melakukan analisa hormon reproduksi menggunakan kit EIA pada hewan domestik seperti pada domba, kambing dan sapi. Disamping itu, dewasa ini ada beberapa produk kit EIA komersial yang dapat dipergunakan untuk pengujian konsentrasi hormon, tetapi belum ada dari produk tersebut yang dapat dijadikan sebagai rujukan dalam penggunaannya untuk hewan. Sebagian besar sampel yang dipergunakan adalah darah dalam bentuk serum atau plasma.
Disamping itu pula, dewasa ini banyak sekali produk kit EIA komersial yang dapat dipergunakan untuk pengujian konsentrasi hormon, tetapi belum ada dari produk tersebut yang dapat dijadikan sebagai rujukan dalam penggunaannya, sehingga perlu adanya skrining untuk hal tersebut. Oleh karena itu, maka pengujian atau analisa ke dua hormon ini menggunakan dua kit EIA komersial berbeda yang berasal dari perusahaan produk biologis yang berbeda diantaranya progesteron dan estradiol (GBC) dari Taiwan dan progesteron dan estradiol (DRG) dari Jerman, sekaligus untuk menguji kepekaan dari kedua macam kit komersial tersebut.
2
Kerangka Pemikiran
Perkembangbiakan suatu jenis hewan tidak terlepas dari peran hormon yang berasal dari organ reproduksinya, pada betina ovarium. Ovarium disamping berfungsi sebagai kelenjar eksokrin yaitu menghasilkan sel telur, juga berfungsi sebagai kelenjar endokrin yaitu menghasilkan hormon estrogen dan progesteron. Kualitas ovarium sangat menentukan dalam menghasilkan kedua hormon tersebut.
Disamping itu pula banyak penelitian di bidang peternakan dan kedokteran melakukan pengujian hormon reproduksi berkaitan dengan siklus estrus hewan, dengan menggunakan sampel darah berupa serum atau plasma. Hal ini dilakukan untuk melihat pola siklus estrus dengan mengacu pada konsentrasi hormon yang dikandungnya.
Untuk melakukan analisa kadar konsentrasi hormon ini diperlukan suatu teknik yang akurat dan tidak berbahaya bagi lingkungan yaitu dengan teknik EIA menggunakan kit komersial. Tetapi kit komersial tersebut sampai saat ini belum ada yang dapat dijadikan sebagai rujukan atau referensi untuk digunakan dalam analisa hormon estradiol dan progesteron secara tepat, karena kit komersial tersebut memiliki sensitifitas yang berbeda. Oleh karena itu, perlu dilakukan uji kit komersial yang dimaksud terhadap sampel-sampel darah yang berasal dari ternak.
Kurangnya parameter pendukung (parameter biologi) pada saat koleksi sampel seperti tingkah laku hewan, waktu koleksi sampel (pagi, siang atau malam), perubahan eksternal (adanya lendir, kebengkakan, kemerahan) dan seterusnya, sehingga pada saat dilakukan uji validasi biologi tidak cocok dengan hasil analisa hormon yang didapat.
Pada analisa hormon dengan menggunakan metoda EIA ini, diperlukan suatu perbandingan pengenceran untuk sampel-sampel yang akan dianalisa, tetapi pada kenyataannya hal tersebut belum ada. Perbandingan pengenceran ini penting untuk mendapatkan suatu nilai konsentrasi hormon yang tidak menyimpang dari perhitungan standar sehingga nilai tersebut dapat diterima. Didapatkan kit komersial yang tepat sebagai protokol yang dapat digunakan untuk analisa hormon pada ternak
Tujuan Penelitian
3 Manfaat Penelitian
Manfaat yang diharapkan dari pelaksanaan penelitian ini adalah memberikan informasi tentang produk kit EIA komersial yang tepat untuk digunakan dalam pemeriksaan hormon reproduksi dari sampel plasma darah pada kambing kacang betina serta menghasilkan protokol analisa hormon yang dapat dijadikan referensi untuk pemeriksaan hormon reproduksi pada ternak.
Hipotesis
Antibodi terhadap analisa hormon reproduksi manusia dapat dipakai untuk mendeteksi hormon reproduksi pada ternak.
Pertanyaan Saintifik yang Harus Dijawab
Apakah kit EIA komersial estradiol dan progesteron untuk manusia dapat digunakan untuk analisa hormon yang sama pada kambing kacang betina dan apakah kit ELISA komersial dari produk yang berbeda, memiliki keakuratan atau sensitivitas yang tidak sama.
2
TINJAUAN PUSTAKA
Kambing Kacang Taksonomi
Kambing kacang merupakan salah satu plasma nutfah yang dimiliki oleh bangsa Indonesia dan belum tereksploitasi secara optimal, oleh karena itu diperlukan kegiatan eksplorasi maupun eksploitasi kambing kacang tersebut sehingga dapat dimanfaatkan untuk peningkatan produktifitasnya. Domestikasi kambing pada awalnya terjadi di daerah pegunungan asia barat sekitar tahun 8000-7000 SM. Kambing (Capra aegagrus hircus) yang dipelihara berasal dari 3 kelompok kambing liar yang telah dijinakkan yaitu kambing bezoar atau kambing liar eropa (Capra aegagrus), kambing liar India (Capra aegagrus blithy) dan kambing makhor di pegunungan Himalaya (Capra falconeri). Sebagian besar kambing yang diternakkan di Asia berasal dari keturunan bezoar (Pamungkas et al. 2009).
4
Morfologi dan Biologi
Kambing kacang merupakan kambing asli Indonesia, juga terdapat di Malaysia dan Philipina (Pamungkas et al. 2009), mempunyai bobot hidup lebih kecil dibanding kambing jenis lainnya (Mahmilia et al. 2009), jantan memiliki bobot 25 kg sedangkan betina 22 kg (Pamungkas et al. 2009). Keunggulan kambing kacang adalah mudah beradaptasi dengan lingkungan setempat dan pada umur 15–18 bulan dapat menghasilkan keturunan (Boer Indonesia 2008).
Kambing ini menyebar di seluruh wilayah Indonesia, cocok sebagai penghasil daging dan kulit dan bersifat prolifik. Menurut Sodiq dan Tawfik (2003) kambing yang paling banyak dijumpai di Indonesia adalah kambing kacang dan kambing peranakan etawah (PE). Kambing kacang memiliki ciri-ciri bulu pendek dan berwarna tunggal (putih, hitam dan coklat), ada juga campuran dari ketiga warna tersebut, kambing jantan berbulu surai panjang dan kasar sepanjang garis leher, pundak, punggung sampai ekor. Janggut selalu terdapat pada jantan, pada betina jarang ditemukan. Kambing jantan maupun betina memiliki tanduk yang berbentuk pedang, melengkung ke atas sampai ke belakang, telinga pendek dan menggantung (Pamungkas et al.2009).
Gambar 1 Kambing kacang berwarna campuran (coklat dan putih).
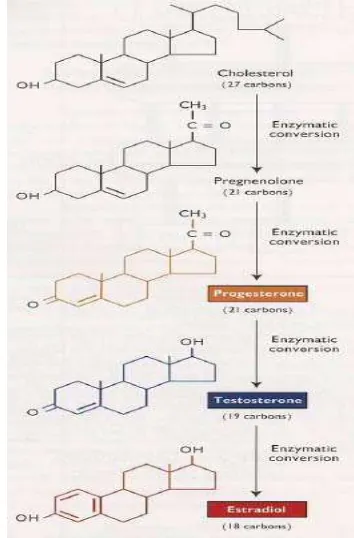
Biosintesis dan Metabolisme Hormon Steroid: Estradiol dan Progesteron Hormon steroid disekresikan oleh gonad yaitu ovarium dan testis, plasenta dan korteks adrenal mempengaruhi fungsi hipotalamus, lobus anterior hipofisis dan jaringan dari saluran reproduksi. Hormon gonad juga memulai pengembangan karakteristik seks sekunder yang menyebabkan sifat jantan atau sifat betina. Pada betina, ovarium memproduksi estrogen, progesteron, inhibin, beberapa testosteron, oksitosin dan relaksin. Pada jantan, testis menghasilkan testosteron dan androgen lainnya, inhibin dan estrogen. Hormon steroid disintesis dari kolesterol melalui serangkaian jalur kompleks dan melibatkan banyak konversi enzimatik (Senger 2003). Gambar 2 merupakan ilustrasi transformasi biokimia utama yang terjadi pada jalur hormon steroid.
5
Gambar 2 Transformasi biokimia utama yang terjadi pada hormon steroid (Senger 2003).
Jalur biosintesis dalam semua organ endokrin yang menghasilkan hormon steroid adalah sama hanya berbeda dalam sistem enzim yang dikandungnya, testis terutama mensintesis androgen, sedangkan ovarium mensintesis dua jenis yaitu estrogen dan progestin. Dalam plasma darah, hormon steroid sebagian besar terikat oleh albumin, suatu plasma protein dengan afinitas rendah dan kapasitas tinggi (Hafez et al. 2000)
Estrogen yang dihasilkan merupakan tahap akhir dari steroidogenesis dalam folikel matang dan diturunkan dari prekursor androgenik. Terdapat dua androgen sebagai sumber estrogen yaitu androstenedion dan testosteron (Agil 2007). Aromatase diinduksi oleh follicle stimulating hormone (FSH) dalam pertumbuhan sel granulosa yang bertindak mengkonversi kedua androgen menjadi estron atau estradiol. Estradiol adalah estrogen utama, dengan estron dan estriol secara metabolik mewakili estrogen aktif lainnya.
Pada ruminansia, estrogen juga memiliki efek protein anabolik untuk meningkatkan pertambahan berat badan dan pertumbuhan. Mekanisme untuk meningkatkan pertumbuhan mungkin karena kemampuan estrogen merangsang hipofisis untuk melepaskan lebih banyak hormon pertumbuhan (Hafez et al. 2000).
6
Hormon steroid dimetabolisir oleh banyak jaringan dalam tubuh termasuk hati, ginjal, otot dan darah (Schulster et al. 1976), meskipun demikian metabolisme utama terjadi di hati.
Mekanisme kerja hormon-hormon steroid (estrogen dan progesteron) berdifusi melalui plasma membran, membran sitoplasma dan inti sel dari sel target. Mengikat reseptor di inti sel yang memicu terbentuknya mRNA dan akhirnya terjadi sintesis protein baru (Gambar 3).
Gambar 3 Mekanisme kerja hormon steroid (Senger 2003). Kit EIA Komersial
7 yang diatur oleh hukum aksi massa di mana antigen tanpa label (Ag) dan antigen berlabel (Ag*) bersaing untuk pengikatan sejumlah antibodi (Ab).
Antigen yang berlabel dan antigen yang tidak berlabel saling bersaing untuk berikatan dengan antibodi yang terdapat dalam jumlah terbatas. Contoh reaksi seperti ini adalah EIA untuk mengukur progesteron, estradiol dan kortisol. Pengukuran hormon kortisol dalam saliva menggunakan teknik EIA dapat mengetahui tingkat stres yang di alami oleh organisme (Haussmann et al. 2007).
Uji EIA ini memiliki beberapa keunggulan seperti teknik pengerjaan yang relatif sederhana, ekonomis, dan memiliki sensitivitas yang cukup tinggi serta tidak menggunakan radioaktif. EIA diperkenalkan pada tahun 1971 oleh Peter Perlmann dan Eva Engvall untuk menganalisa adanya interaksi (Lequin 2005).
Enzyme immunosorbent assay secara khusus memiliki konjugat dan substrat yang menghasilkan beberapa bentuk perubahan warna yang dapat diamati untuk mengetahui kehadiran antigen atau analit. Metoda EIA terbaru seperti flurogenik, electrochemiluminescent dan real time PCR dibuat untuk mengetahui sinyal kuantitatif. Metoda ini dapat memberikan berbagai keuntungan diantaranya sensitivitas yang tinggi dan bersifat multiflexing (Leng et al. 2008).
Metoda EIA merupakan teknik kuantitatif yang sangat sensitif, penggunaannya sangat luas, memerlukan peralatan yang sedikit, reagen yang diperlukan sudah tersedia dan dijual secara komersial dan sangat mudah didapat. Pemeriksaan EIA dapat digunakan untuk mendeteksi antibodi atau hormon dalam tubuh manusia maupun hewan. Tes ini dapat dilakukan dengan kit yang sudah jadi atau dapat juga dilakukan dengan menggunakan antigen yang diracik sendiri (Setiawan 2007). Pada hewan, kit EIA ini sebagian besar digunakan untuk mengetahui kandungan kadar hormon tertentu (misalnya estradiol atau progesteron). Kandungan hormon ini biasanya berkaitan erat dengan siklus reproduksi hewan.
Ada beberapa produsen kit EIA diantaranya DRG International,Inc. Jerman, General Biological Corporation (GBC) Taiwan, ARP American Research Products (ARP), Inc. Amerika Serikat, Cosmo Bio Co, Ltd dan lain-lain. Banyak peneliti yang sudah menggunakan kit EIA untuk tujuan penelitian atau mengevaluasi kit EIA tersebut. Kit EIA komersial yang ada di Indonesia saat ini adalah DRG International Inc. dari Jerman dan GBC dari Taiwan.
8
cocok dan dapat diandalkan untuk sampel plasma kerbau. Konsentrasi steroid yang bersirkulasi bebas dianggap sebagai yang paling akurat merefleksikan fungsi dari gonad, namun pengumpulan yang tetap sampel darah bisa sulit dilakukan pada hewan non-domestik (Graham et al. 2001).
Selain kit EIA estradiol, kit EIA progesteron pun dapat digunakan untuk evaluasi, seperti untuk menentukan akurasi dari dua kit EIA yang tersedia secara komersial dalam membedakan antara tinggi dan rendahnya konsentrasi progesteron (P4) pada serum babi betina (kit EIA Progestassay, Synbiotics Corp., San Diego, California dan kit EIA Target, Biometalics, Princeton, New Jersey), dimana sasaran tes kit EIA bekerja dengan baik pada pengukuran semi kuantitatif konsentrasi progesteron (P4) serum babi (Althouse dan Hixon, 1999).
Pada penelitian lain, kandungan hormon progesteron dan estradiol dalam darah juga telah dilakukan pengujian dengan menggunakan kit EIA komersial (Fertigenix-Prog-Easia, Biosource Europe, SA dan Fertigenix-E2-Easia, Biosource Europe, SA) terhadap domba jenis akkaraman di Turki, dalam penelitian ini Risvanli et al. (2010) menunjukkan bahwa efek dosis tunggal analog PGF2α terhadap berbagai konsentrasi hormon dan tingkat kebuntingan pada domba nulipara dan domba multipara, ditemukan secara signifikan penurunan kadar progesteron pada hari penyuntikan, setelah 24 jam dan 48 jam. Selain domba, pada kambing pun telah dilakukan pengujian hormon progesteron dengan menggunakan kit EIA progesteron sapi (Progestassay, Pitman Moore, Washington Crossing, New Jersey) cepat dan tidak mahal (Sherrill et al. 1990).
3
METODE
Waktu dan Tempat Penelitian
Pengambilan dan koleksi sampel berupa darah dari kambing kacang dan pemeriksaan hormon dilakukan di Laboratorium Unit Rehabilitasi Reproduksi, Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dari bulan Nopember 2012 sampai dengan Pebruari 2013.
Materi Penelitian
Hewan percobaan yang dipergunakan adalah 3 ekor kambing kacang betina yang dipelihara dikandang percobaan Unit Rehabilitasi Reproduksi, Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi FKH-IPB, Dramaga, Bogor. Persyaratan ternak ruminansia tersebut berumur 2–3 tahun, memiliki kualifikasi tubuh yang sehat, status reproduksi memiliki siklus estrus normal, tidak bunting, pernah beranak (2 kali beranak), dan dikandangkan dalam kandang individu.
9 International Inc., Jerman dan GBC, Taiwan khusus untuk hormon estradiol dan progesteron.
Metode Penelitian
Penelitian ini merupakan penelitian eksploratif dalam penentuan profil hormon estradiol dan progesteron pada kambing kacang betina. Parameter yang diukur adalah konsentrasi estradiol dan progesteron dalam plasma darah selama 9 minggu (62 hari). Data berupa gejala klinis, konsentrasi hormon, perubahan struktur fungsional ovaria, folikel dan corpus luteum (CL) dianalisa menggunakan metoda komparatif deskriptif.
Penelitian ini terdiri atas beberapa tahap kegiatan di lapang dan di laboratorium. Kegiatan di lapang meliputi pengambilan sampel darah dan pemeriksaan USG. Kegiatan laboratorium meliputi analisis hormon yang berasal dari plasma darah.
Metode penelitian yang dilakukan adalah sebagai berikut : Tahap I. Monitoring Pola Siklus Estrus pada Kambing Kacang Analisa Hormon Estradiol dan Progesteron selama Siklus Estrus
Pengambilan sampel darah dilakukan selama 9 minggu (62 hari) melalui vena jugularis (di leher) menggunakan tabung vakum yang berantikoagulan mengandung K3 EDTA 1.8 mg/mL (Disposable Evacuated Blood Collection Tubes, Zhejiang U-REAL Medical Technology Co. Ltd) untuk pembuatan plasma yang akan dianalisa konsentrasi hormon estradiol dan progesteronnya. Rekomendasi yang disarankan oleh NCCLS (2004) bahwa konsentrasi EDTA yang digunakan sebagai antikoagulan harus mengandung 1.5–2.2 g/L, dan WHO (2002) menganjurkan menggunakan konsentrasi EDTA 1.2–2.0 mg/mL. Volume darah segar yang diambil sebanyak 5 mL. Pengambilan darah dilakukan setiap dua hari sekali dan diintensifkan menjadi setiap hari menjelang fase estrus. Darah segar disentrifugasi dengan kecepatan 1500–2000 G selama 10 menit (LT 2007), plasma yang diperoleh dituangkan ke dalam tabung microtube 2 mL, kemudian disimpan pada suhu -20ºC sampai dilakukan analisa di laboratorium.
Analisa hormon menggunakan kit EIA komersial untuk estradiol dan progesteron. Metoda analisa sesuai dengan prosedur yang diberikan oleh kit yang bersangkutan.
Monitoring Siklus Ovari Menggunakan USG
Pemeriksaan organ reproduksi primer (ovarium) dilakukan untuk mengetahui perkembangan folikel dan corpus luteum selama periode pengamatan tersebut. Pemeriksaan ini dilakukan bersamaan dengan pengambilan darah. Ultrasonografi yang dipergunakan untuk memeriksa organ reproduksi betina (ovarium) pada saat pengambilan darah adalah ALOKA model SSD-500, tegangan listrik 200–240 volt, 50/60 Hz (ALOKA Co.LTD,Tokyo, Jepang), dengan probe linear 7,5 MHz. Probe tersebut dimodifikasi dengan diberikan tambahan gagang sepanjang 30 cm di bagian pangkal sebagai pegangan pada saat pemeriksaan secara per rektal.
10
luteum. Gambaran folikel dan corpus luteum berupa foto dicetak menggunakan printer termal (Sony Up-895 MD, Jepang). Data yang diperoleh akan dicocokkan dengan konsentrasi hormon estradiol dan progesteron yang berasal dari hasil analisa sampel darah di laboratorium.
Tahap II. Validasi Kit Komersial
Validasi ini dilakukan terhadap dua kit komersial estradiol (E2) dan progesteron (P4) untuk manusia dari 2 perusahaan produk biologis yang berbeda yaitu DRG internasional Inc., Jerman dan GBC Taiwan. Validasi ini untuk membandingkan dan menentukan akurasi, sensitivitas dan presisi dari kedua kit EIA komersial dalam menganalisa hormon E2 dan P4 pada sampel plasma darah kambing kacang betina.
Validasi kit EIA komersial, dilakukan melalui prosedur dengan tahapan sebagai berikut :
Uji Paralelisme
Uji paralelisme adalah uji penentuan kemampuan (dalam kisaran tertentu) kit EIA untuk memberikan hasil yang berbanding lurus dengan konsentrasi (jumlah) dari analit dalam sampel (Ederveen 2010). Pengujian ini juga dilakukan untuk menentukan apakah kit EIA yang digunakan dapat mendeteksi keberadaan hormon tertentu yang diketahui. Disamping itu dengan uji paralelisme dapat digunakan untuk mengukur perbandingan pengenceran yang tepat pada saat akan menganalisa sampel. Hal ini sangat penting dilakukan terhadap kit EIA yang baru dan belum pernah digunakan untuk menganalisa hormon tertentu pada satu spesies. Disamping itu uji tersebut penting untuk mengetahui pengenceran sampel yang tepat digunakan untuk analisa sehingga menghasilkan angka konsentrasi hormon dalam batas nilai yang valid pada garis linear dari kurva hormon standar.
Menurut Dunn (2007), tujuan uji paralelisme adalah (1) untuk menentukan apakah dua zat memiliki kesamaan respon biologis (menunjukkan zat yang sama) dan (2) untuk menentukan apakah dua lingkungan biologis yang berbeda akan memberikan kurva respon yang mirip dengan zat yang sama. Lee (2009) menyampaikan juga bahwa paralelisme adalah uji linieritas pengenceran sampel otentik, tujuannya adalah untuk menunjukkan bahwa analit endogen dalam sampel yang tidak diketahui, yang mungkin berbeda dan/atau bervariasi dari standar menunjukkan hasil yang sama, terlepas dari pengenceran standar. Perbandingan pengenceran ini didapat dengan melihat kurva, yaitu membandingkan antara kurva standar dengan kurva sampel yang diuji, biasanya dilakukan beberapa perbandingan pengenceran (5 perbandingan bertingkat). Apabila kurva sampel yang diuji sejajar (paralel) dengan kurva standar berarti hormon asai yang digunakan dapat mendeteksi keberadaan hormon yang akan dianalisa.
Optimalisasi Standar Kurva Hormon Asai
11 (2005) batas asai adalah 20%-80%, aturan batas asai ini didasarkan pada asumsi bahwa kurva standar paling linier antara 20%-80% binding.
Sensitivitas Kit EIA
Sensitivitas adalah kemampuan untuk mendeteksi sejumlah kecil antigen (Brown et al. 2005), jumlah minimum hormon yang dapat dideteksi (Hodges et al. 2010, Hodges dan Heistermann 2011). Sensitivitas merupakan konsentrasi terendah dari antigen yang dapat dibedakan secara statistik, dan bertujuan untuk menentukan nilai dua simpangan baku (2 SD) dari respon rata-rata blank (B0) dan menentukan nilai maksimum binding 90% atau 95% (Brown et al.2005). Presisi Kit EIA
Presisi mengacu pada pengulangan nilai yang diukur atau konsistensi hasil (Brown et al.2005), di dalam dan antara pengulangan asai (Hodges et al. 2010, Hodges dan Heistermann 2011). Presisi adalah ukuran dari kesalahan acak yang didefinisikan sebagai variasi antara pengukuran ulangan dari sampel yang ditetapkan, dinyatakan sebagai koefisien variasi (%CV) yang merupakan standar deviasi/rata-rata x 100 (Brown et al. 2005). Menurut ICH (2005) menyatakan bahwa presisi biasanya dinyatakan sebagai standar deviasi (SD) atau sebagai koefisien variasi (CV) dari serangkaian pengukuran. Ederveen (2010) menyatakan bahwa beberapa jenis presisi adalah repeatability, variasi interasai dan reproducibility.
Intra-dan Inter-Assay Variation
Presisi merupakan suatu kemampuan asai untuk secara konsisten mereproduksi hasil (nilai) yang diambil dari sampel yang sama. Presisi intra-asai dan inter-asai adalah dua ukuran yang berbeda yang dapat dibuat sebagai bagian dari prosedur validasi. Rumus yang digunakan untuk perhitungan persentase koefisien variasi (% CV) sedikit berbeda dengan rumus konvensional (standar deviasi dibagi dengan rata-rata dan dikalikan dengan 100).
Reproduktifitas (kualitas yang diulang) hasil pangujian dapat dinilai dengan menghitung nilai koefisien variasi (CV) dengan membandingkan konsentrasi rata-rata untuk pengulangan sampel yang sama pada plate yang berbeda (intra-asai).
Intra-assay variation merupakan suatu pengujian untuk memeriksa variabilitas pengukuran dalam plate (asai) dan untuk mengontrol kualitas hasil coating. Pengujian ini akan mendapatkan suatu nilai yang disebut koefisien variasi (CV) yang berasal dari nilai konsentrasi quality control (QC) high dan quality control (QC) low. Nilai CV-nya harus kurang dari 10% (Brown et al. 2005).
12
Analisa Hormon
Analisa hormon dilakukan untuk mengetahui konsentrasi hormon estradiol dan progesteron yang dikandung dalam sampel darah.
Prosedur Asai Hormon
Prosedur asai hormon yang dikerjakan mengikuti prosedur yang diberikan oleh perusahaan produk biologis DRG International Inc. Jerman dan GBC Taiwan. Larutan standar estradiol dan progesteron dari DRG International Inc. mengalami modifikasi untuk mendapatkan slope kurva yang lebih baik serta ditambahkan kontrol atau QC, sedangkan GBC Taiwan tetap. Menurut Lee (2009) kit komersial untuk penelitian, QC atau kontrol sampel mungkin tidak tersedia, hal ini merupakan tanggungjawab analis untuk mengatur QC terhadap karakterisasi akurasi, presisi dan memantau kinerja asai. Prosedur asai secara keseluruhan adalah sebagai berikut :
a. Hormon Estradiol DRG Jerman (EIA-2693)
Semua reagen dan sampel harus berada di temperatur ruang. Sampel plasma darah diencerkan dalam aquabidestilata dengan perbandingan pengenceran bertingkat dimulai dari 1:0 (orisinal plasma)-1:16. Larutan standar 25 pg/mL dan 100 pg/mL dimodifikasi menjadi larutan standar baru 12.5 pg/mL dan 50 pg/mL (Tabel 1). Memasukkan masing-masing 25 µL duplo larutan standar, kontrol (konsentrasi 25 pg/mL dan 250 pg/mL sebagai kontrol 1 dan 2) dan sampel ke dalam setiap sumur terpilih. Larutan enzim konjugat sebanyak 200 µL ke dalam setiap sumur kecuali blank, kemudian ditutup dengan cling film dan dihomogenkan dengan cara digoyangkan secara perlahan selama 10 detik dan diinkubasikan selama 120 menit pada temperatur ruang. Setelah diinkubasi, setiap sumur dicuci dengan washing solution masing-masing 400 µL selama 3–4 kali pencucian, kemudian dihentak-hentakan secara perlahan diatas kertas (absorbence paper) untuk mengeluarkan cairan dalam sumur-sumur secara tuntas. Memasukkan larutan substrat 200 µL ke dalam setiap sumur-sumur kemudian ditutup dengan cling film dan diinkubasi selama 15 menit pada temperatur ruang. Reaksi enzimatis dihentikan dengan menambahkan stop solution 0.5 M H2SO4 sebanyak 100 µL ke dalam setiap sumur-sumur dan pembacaan absorbance menggunakan EIA reader otomatis dalam waktu 10 menit dengan panjang gelombang 450±10 nm.
b. Hormon Progesteron DRG Jerman (EIA-1561)
13 sumur dicuci dengan washing solution masing-masing 400 µL selama 3–4 kali pencucian, kemudian dihentak-hentakan secara perlahan diatas kertas (absorbence paper). Memasukkan larutan substrat 200 µL ke dalam setiap sumur kemudian ditutup dengan cling film dan diinkubasi selama 15 menit pada temperatur ruang. Reaksi enzimatis dihentikan dengan menambahkan stop solution 0.5 M H2SO4 sebanyak 100 µL ke dalam setiap sumur dan pembacaan absorbance menggunakan EIA reader otomatis dalam waktu 10 menit dengan panjang gelombang 450±10 nm.
c. Hormon Estradiol GBC Taiwan (4S00071)
Semua reagen dan sampel harus berada di temperatur ruang. Sampel plasma darah diencerkan dalam aquabidestilata dengan perbandingan pengenceran bertingkat dimulai dari 1:0 (orisinal plasma)-1:16. Memasukkan masing-masing 25 µL duplo larutan standar, kontrol dan sampel ke dalam sumur terpilih. Setelah itu larutan enzim konjugat sebanyak 100 µL ke dalam setiap sumur dilanjutkan dengan 50 µL rabbit anti-estradiol ke dalam setiap sumur kecuali blank, kemudian ditutup dengan cling film dan dihomogenkan dengan cara digoyangkan secara perlahan selama 30 detik dan diinkubasikan selama 90 menit pada temperatur ruang. Setelah diinkubasi, setiap sumur dicuci dengan milli-Q water masing-masing 400 µ L selama 3–4 kali pencucian, kemudian dihentak-hentakan secara perlahan diatas kertas (absorbence paper). Memasukkan larutan substrat TMB 100 µL ke dalam setiap sumur kemudian ditutup dengan cling film dan diinkubasi selama 20 menit pada temperatur ruang. Reaksi enzimatis dihentikan dengan menambahkan stop solution 1N HCl sebanyak 100 µL ke dalam setiap sumur kemudian dihomogenkan secara perlahan selama 30 detik dan pembacaan absorbance menggunakan EIA reader otomatis dalam waktu 15 menit dengan panjang gelombang 450 nm.
d. Hormon Progesteron GBC (4S00121)
14
absorbance menggunakan EIA reader otomatis dalam waktu 15 menit dengan panjang gelombang 450 nm.
Larutan standar asai yang berasal dari kit EIA komersial estradiol dan progesteron DRG mengalami modifikasi untuk mendapat slope kurva yang lebih baik (Tabel 1). Modifikasi standar estradiol dilakukan pada konsentrasi 25 pg/mL dan 100 pg/mL, masing-masing menjadi 12.5 pg/mL dan 50 pg/mL dengan quality control 1 (QC1) 25 pg/mL dan QC2 250 pg/mL. Sedangkan untuk standar progesteron pada konsentrasi 1.25 ng/mL, 15 ng/mL dan 40 ng/mL masing-masing menjadi 0.625 ng/mL, 10 ng/mL dan 20 ng/mL, dengan QC1 1.25 ng/mL dan QC2 10 ng/mL.
Tabel 1 Larutan standar dari 4 kit EIA komersial original dan modifikasi.
Standar P4 DRG (ng/mL) P4 GBC
(ng/mL)
E2 DRG (pg/mL) E2 GBC
(pg/mL)
Original Modifikasi Original Original Modifikasi Original
1 0.3 0.3 0.5 25 12.5 10
2 1.25 0.625 3 100 25 30
3 2.5 1.25 10 250 50 100
4 5 2.5 25 500 100 300
5 15 5 50 1000 250 1000
6 40 10 2000 500
7 20 1000
8 40
4
HASIL DAN PEMBAHASAN
Validasi Kit
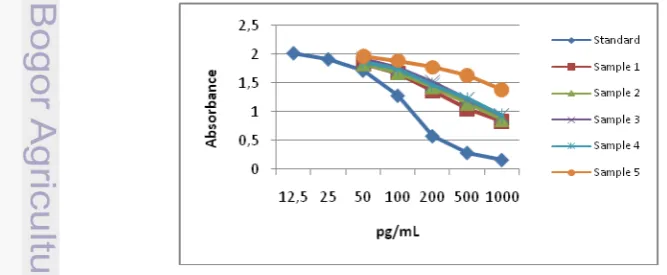
Hasil validasi kedua kit EIA komersial dengan melakukan uji paralelisme menggunakan kit EIA komersial estradiol dan progesteron dari produk DRG International Inc.,Jerman menunjukan bahwa kurva sampel sejajar dengan kurva standar (Gambar 4 dan Gambar 5). Jumlah sampel yang diambil secara acak adalah 5 sampel dari status atau fase yang berbeda dalam 62 hari pengamatan, kemudian dilakukan pengenceran bertingkat dimulai dari 1:0 (larutan orisinal tanpa pengenceran), 1:2, 1:4, 1:8, 1:16 untuk setiap sampel tersebut menggunakan pengencer aquabidestilata.
15
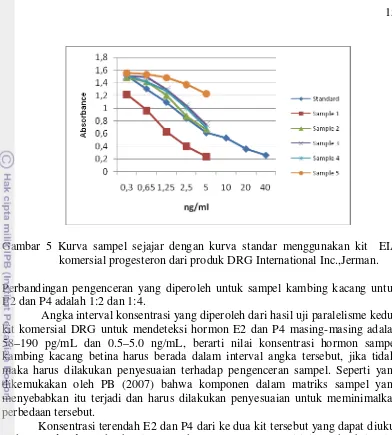
Gambar 5 Kurva sampel sejajar dengan kurva standar menggunakan kit EIA komersial progesteron dari produk DRG International Inc.,Jerman. Perbandingan pengenceran yang diperoleh untuk sampel kambing kacang untuk E2 dan P4 adalah 1:2 dan 1:4.
Angka interval konsentrasi yang diperoleh dari hasil uji paralelisme kedua kit komersial DRG untuk mendeteksi hormon E2 dan P4 masing-masing adalah 58–190 pg/mL dan 0.5–5.0 ng/mL, berarti nilai konsentrasi hormon sampel kambing kacang betina harus berada dalam interval angka tersebut, jika tidak, maka harus dilakukan penyesuaian terhadap pengenceran sampel. Seperti yang dikemukakan oleh PB (2007) bahwa komponen dalam matriks sampel yang menyebabkan itu terjadi dan harus dilakukan penyesuaian untuk meminimalkan perbedaan tersebut.
Konsentrasi terendah E2 dan P4 dari ke dua kit tersebut yang dapat diukur pada 90% binding adalah 25 pg/mL dan 0.14 ng/mL. Sensitivitas adalah jumlah minimum dari hormon yang dapat dideteksi (Hodges et al. 2010), kemampuan untuk mendeteksi sejumlah kecil antigen (Brown et al. 2005). NCCLS (2004) mengatakan bahwa sensitivitas untuk kit diagnostik sering didefinisikan sebagai limit deteksi yang merupakan jumlah terendah dari analit dalam sampel yang dapat dideteksi.
Nilai koefisien variasi (%CV) yang diperoleh untuk kit EIA komersial E2 dan P4 DRG adalah intraasai 6.81% dan 6.86% sementara untuk interasai 7.85% dan 5.46%. Variasi intraasai pada GBC tercatat 4.9% (E2) dan 7.1% (P4) sedangkan variasi interasai tidak dapat dihitung karena asai tersebut tidak digunakan untuk analisa lebih lanjut. Kedua nilai CV ini berada dibawah nilai yang ditentukan 10% (Brown et al. 2005) tidak lebih dari 15% (Ederveen 2010). Relave et al. (2007) spesifitas untuk mendeteksi tingkat hormon progesteron plasma kuda adalah lebih tinggi dari 1.0 ng/mL.
16
yang sama dari sampel yang berbeda dapat menunjukkan hasil yang berbeda walaupun pada spesies yang sama. Perez et al. (2004) mengatakan bahwa hasil uji paralelisme hormon kortisol pada sampel air liur sapi menunjukkan kurva yang paralel dengan kurva standar sementara dengan plasma sapi tidak paralel. Konsentrasi steroid yang bersirkulasi bebas dianggap sebagai yang paling akurat merefleksikan fungsi dari gonad, namun pengumpulan sampel darah sering kali sulit dilakukan pada hewan non-domestik (Graham et al. 2001).
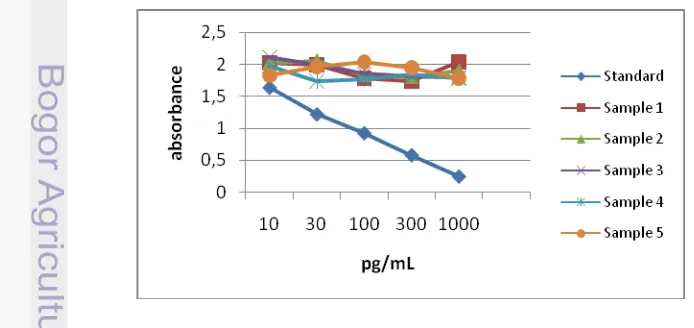
Pengujian terhadap kit EIA komersial estradiol dan progesteron dari produk GBC Taiwan menunjukkan bahwa kurva sampel tidak sejajar dengan kurva standar (Gambar 6 dan Gambar 7). Uji paralelisme pada asai hormon GBC memperlihatkan bahwa antibodi yang digunakan dalam asai tersebut tidak dapat menentukan jumlah konsentrasi hormon yang ada dalam sampel yang diukur, sehingga kedua kit asai hormon komersial tersebut tidak dapat dipergunakan untuk pengujian sampel plasma kambing kacang betina berikutnya. Tizard (1988) setiap perubahan pada struktur hapten yang mengubah bentuk keseluruhannya akan mengurangi kemampuannya untuk mengikat antibodi yang ditujukan terhadap molekul yang tidak berubah, termasuk perubahan dalam muatan listrik hapten, ukurannya atau konfigurasi permukaannya. PB (2007) mengatakan bahwa matriks sampel kemungkinan mengandung komponen yang dapat mempengaruhi respon asai berbeda dengan standar. Simontacchi et al. (1999) menyatakan jika hasil paralelisme tidak tercapai maka uji ini tidak valid dan menyiratkan bahwa baik sampel atau standar mengandung zat (antibodi) yang mempengaruhi reaksi pengikatan yang berbeda pada hormon yang ada dalam sampel dengan hormon standarnya. Plikaytis et al. (1994) tidak ada ketentuan secara umum dan banyak digunakan untuk menilai uji paralelisme dalam bioasai, dan jika tidak paralel maka antibodi tidak dapat menghitung perkiraan konsentrasi hormon dalam sampel.
Kit EIA komersial estradiol dan progesteron produk GBC tidak menunjukkan hasil yang sama dengan produk DRG, hal ini disebabkan karena adanya kemungkinan keterlibatan substansi yang mengganggu terhadap pengikatan antara antibodi dan antigen berlabel (enzim konjugat) dimana enzim konjugat tidak mampu memberikan sinyal yang dapat diukur.
17
Gambar 7 Kurva sampel tidak sejajar dengan kurva standar, menggunakan kit EIA komersial progesteron GBC Taiwan.
Menurut Bowen et al. (2010), ketika plasma yang digunakan untuk asai diagnostik, harus hati-hati didalam memilih antikoagulan yang tepat, umumnya yang dipergunakan adalah EDTA, heparin dan citrat. Antikoagulan yang ditambahkan harus dalam konsentrasi tepat untuk melindungi analit guna mencegah interferensi terhadap pengikatan atau presipitasi antigen–antibodi (Haab et al. 2005). Menurut WHO (2002) bahwa penambahan antikoagulan kemungkinan menyebabkan gangguan terhadap metode analisa atau merubah konsentrasi analit yang diukur. Plasma memiliki viskositas yang tinggi dan mengandung total protein ±4 g/L lebih tinggi dari serum karena mengandung fibrinogen dan faktor pembekuan lain (Lundblad 2005).
Kit EIA komersial estradiol dan progesteron GBC Taiwan tidak menunjukan kesejajaran disebabkan antibodi yang ada tidak dapat mendeteksi keberadaan hormon dalam sampel tersebut, dimana antibodi yang dibuat oleh perusahaan GBC Taiwan tidak dapat mendeteksi hapten yang akan diikat oleh antibodi tersebut. Tizard (1988) karena perubahan kimiawi yang teramat kecil biasanya mengakibatkan perubahan yang berarti dalam bentuk molekul dan karena itu mempengaruhi kemampuan antibodi untuk berikatan dengan hapten. Gambaran Morfologi Alat Kelamin dan Perkembangan Struktur Fungsional Ovari (Folikel dan CL)
18
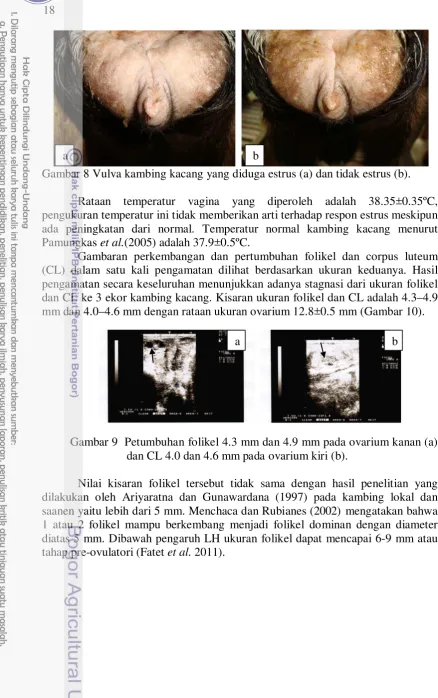
Gambar 8 Vulva kambing kacang yang diduga estrus (a) dan tidak estrus (b).
Rataan temperatur vagina yang diperoleh adalah 38.35±0.35ºC, pengukuran temperatur ini tidak memberikan arti terhadap respon estrus meskipun ada peningkatan dari normal. Temperatur normal kambing kacang menurut Pamungkas et al.(2005) adalah 37.9±0.5ºC.
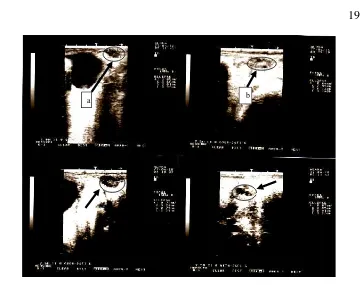
Gambaran perkembangan dan pertumbuhan folikel dan corpus luteum (CL) dalam satu kali pengamatan dilihat berdasarkan ukuran keduanya. Hasil pengamatan secara keseluruhan menunjukkan adanya stagnasi dari ukuran folikel dan CL ke 3 ekor kambing kacang. Kisaran ukuran folikel dan CL adalah 4.3–4.9 mm dan 4.0–4.6 mm dengan rataan ukuran ovarium 12.8±0.5 mm (Gambar 10).
Gambar 9 Petumbuhan folikel 4.3 mm dan 4.9 mm pada ovarium kanan (a) dan CL 4.0 dan 4.6 mm pada ovarium kiri (b).
Nilai kisaran folikel tersebut tidak sama dengan hasil penelitian yang dilakukan oleh Ariyaratna dan Gunawardana (1997) pada kambing lokal dan saanen yaitu lebih dari 5 mm. Menchaca dan Rubianes (2002) mengatakan bahwa 1 atau 2 folikel mampu berkembang menjadi folikel dominan dengan diameter diatas 5 mm. Dibawah pengaruh LH ukuran folikel dapat mencapai 6-9 mm atau tahap pre-ovulatori (Fatet et al. 2011).
b a
19
Gambar 10 Ukuran ovarium kiri (a) dan kanan (b) tanda panah. Analisa Hormon
Hasil analisa hormon kambing kacang 5 dan 9 terlihat bahwa profil hormon progesteron memiliki pola yang datar selama 9 minggu (62 hari), sehingga profil hormon yang diperoleh tidak memperlihatkan keadaan fungsi fisiologis estrus pada kedua kambing kacang tersebut (Gambar 11 dan Gambar 13). Walaupun terdapat pertumbuhan CL mencapai 6,2 mm, tetapi bukan merupakan CL yang siklik. Keadaan fisiologis yang tidak siklik ini, diperkuat dengan gambaran ukuran corpus luteum yang tetap berada pada kisaran 2.0–6.7 mm (Gambar 12 dan Gambar 14).
Gambar 11 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna merah) pada kambing kacang 5 selama pengamatan 62 hari.
20
Gambar 12 Ukuran folikel dan CL kambing kacang 5 yang terdeteksi dengan USG
Gambar 13 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna merah) kambing kacang 9 selama pengamatan 62 hari.
21 Pada penelitian ini, konsentrasi plasma P4 yang dihasilkan tetap pada pola yang datar sesuai dengan pertumbuhan dan perkembangan CL selama 62 hari pengamatan dimana CL memiliki ukuran kecil yang tidak mampu memberikan gambaran visualisasi respon estrus, sehingga kambing kacang 5 dan 9 tidak menunjukkan siklus estrus. Hal itu dibuktikan dengan tidak ditemukannya folikel yang mengalami ovulasi selama pengamatan. Ukuran folikel yang diperoleh hanya berkisar antara 3.0–5.6 mm, dimana ukuran tersebut berdasarkan perbandingan pada penelitian kambing lain termasuk kedalam folikel yang tidak bisa ovulasi. Shabankareh et al. (2009) mengkategorikan ukuran folikel pada domba sanjabi yaitu ˂ 2 mm sangat kecil, 2–3.5 mm kecil, 3.5–5 sedang dan, ≥ 5 mm besar. Menurut Menchaca dan Rubianes (2002) terdapat korelasi yang tinggi antara konsentrasi serum progesteron dengan pertumbuhan dan perkembangan folikel. Folikel antral mencapai diameter untuk ovulasi adalah 5–7 mm (Souza et al. 1998). Arashiro et al. (2010) mengatakan bahwa pada saat ovulasi, rataan diameter folikel dominan pada kambing adalah 7.4±0.1 mm, kambing serrana 7.1±0.1 mm (Simoes et al. 2006), kambing shiba 7.8±0.2 mm (Medan et al. 2005).
Gambar 15 Profil hormon E2 (pg/mL, warna biru) dan P4 (ng/mL, warna merah) kambing kacang 7 selama pengamatan 62 hari.
Profil hormon kambing kacang 7 (Gambar 15) menunjukkan pola progesteron yang datar pada hari ke 0–42. Hal tersebut dikonfirmasi dengan tidak diketemukannya perkembangan corpus luteum yang fungsional yaitu dengan ukuran hanya mencapai 1.7–6.1 mm. Kambing kacang 7 tampak mulai menunjukkan siklus estrus pada hari ke 43 saat folikel mencapai ukuran 7.3 mm kemudian diikuti dengan terjadinya ovulasi pada hari ke 44, dan dilanjutkan dengan perkembangan corpus luteum pada hari ke 47 dengan ukuran 6.2 mm. Corpus luteum terus berkembang mencapai ukuran 12.3 mm pada hari ke 58. Perkembangan corpus luteum tersebut dikonfirmasi dengan adanya peningkatan konsentrasi progesteron dari 19.2 ng/mL pada hari ke 46 dan mencapai puncaknya pada hari ke 56 dengan konsentrasi 42.8 ng/mL. Konsentrasi progesteron mulai menurun setelah hari ke 56 menjadi 20 ng/mL dan terus menurun mencapai konsentrasi terendah 4 ng/mL pada hari ke 62. Analisa estradiol menggunakan kit
22
DRG tidak dapat menggambarkan adanya peningkatan hormon estradiol selama fase folikel pada kambing kacang. Hal serupa pernah dilaporkan oleh Schwarzenberger et al. (2000) pada badak putih Afrika dimana peningkatan hormon estradiol tidak berkorelasi dengan perkembangan folikel.
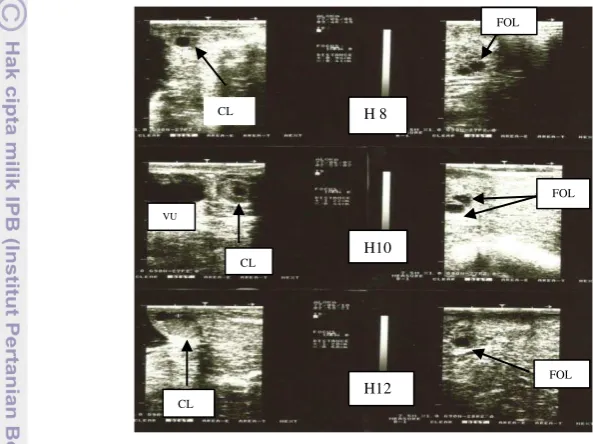
Hasil analisa hormon progesteron menunjukkan bahwa kambing kacang 7 tidak memperlihatkan siklus estrus mulai hari ke 0–42. Tingginya kenaikan konsentrasi hormon P4 yang terjadi pada hari ke 42–62 ini berkaitan erat dengan pertumbuhan CL yang ditemukan pada saat dilakukan pemeriksaan klinis ovarium, kisaran ukuran CL antara 4.5–12.3 mm, terlihat pada hari ke 44–58 (Gambar 16). Besarnya ukuran CL terbukti pada gambar hasil pemeriksaan klinis ovaria dengan USG, dimana CL pada hari ke 50–52 masih terdapat cavity dan pada hari ke 54 sudah terlihat kompak berisi sel-sel lutein (Gambar 17). Menurut Simoes et al. (2007) pada kambing serrana CL berukuran 7.1±1.8 mm terlihat pada hari ke 2.9±1.0 setelah ovulasi dan mencapai ukuran maksimum 12.5±1.6 mm pada hari ke 10.7±3.2.
Beberapa penelitian lain yang menggunakan analisa hormon estradiol dapat menggambarkan siklus estrus pada kambing, diantaranya Widiyono et al. (2011) menyatakan bahwa E2 pada plasma kambing bligon berkisar antara 211.25–247.77 pg/mL dan cenderung meningkat di sekitar fase estrus kemudian menurun pada hari ke 3–16. Konsentrasi E2 kambing dwarf meningkat 7.7±1.7 pg/mL pada hari ke 0 (Khanum et al. 2008), rataan tidak melebihi 2.18 pg/mL, dan mencapai 20.77 pg/mL 2 hari sebelum ovulasi, kemudian turun mencapai 3.97 pg/mL pada hari terjadinya ovulasi (Gorecki et al. 2004). Plasma kambing huanghuai mengandung konsentrasi estradiol 4.39±0.57 pg/mL pada saat ovulasi (Pang et al. 2010). Sedangkan kambing perah anglo nubian memiliki konsentrasi estradiol 15.3±5.04 pg/mL pada musim kawin (musim gugur) dan 12.2±3.82 pg/mL bukan musim kawin (musim semi) (Blaszczyk et al. 2004).
Gambar 16 Ukuran folikel dan CL kambing kacang 7 yang terdeteksi dengan USG
Selama siklus estrus rata-rata konsentrasi plasma progesteron kambing mencapai 9.3 ng/mL dan sangat bervariasi antara 2 dan 18 ng/mL (Bearden et al. 2004, Katongole dan Gombe, 1985). Capezzuto et al. (2006) mengatakan bahwa peningkatan konsentrasi P4 pada minggu ke 2, rataan konsentrasi tetap tinggi
23 sampai minggu ke 20 dan menurun pada minggu terakhir kebuntingan dan 2 minggu setelah lahir 0.12±0.04 ng/mL–13.10±4.29 ng/mL. Menurut Fleming et al. (1990) rataan konsentrasi P4 pada saat bunting 1.3–5.6 ng/mL dan pada saat tidak bunting 0.16–2.8 ng/mL. Samartzi et al. (1995) konsentrasi P4 plasma domba chios pada saat estrus 1.57±0.87 ng/mL. Tingkat konsentrasi P4 dalam plasma kambing pada saat terjadinya kelahiran ˂ 1.0 –2.8 ng/mL, > 5.0–7.8 ng/mL pada saat proses kelahiran tertunda (Singer et al. 2004). Widiyono et al. (2011) rataan P4 kambing bligon 0.21–0.70 ng/mL.
Gambar 17 Pertumbuhan dan perkembangan folikel dan CL kambing kacang 7 hari ke 50–54, vesica urinaria (VU).
Profil hormonal E2 pada kambing kacang 5, 7 dan 9 dalam 62 hari pengamatan tidak menggambarkan pola yang sesuai dengan perkembangan folikel, sedangkan profil hormon progesteron memperlihatkan pola yang sama dengan perkembangan corpus luteum (Gambar 12, Gambar 14 dan Gambar 16). Konsentrasi hormon estradiol tidak menunjukkan perubahan profil estrus yang jelas, namun profil progesteron menunjukkan gambaran fungsi corpus luteum yang siklik pada hari ke 40–62.
24
5
SIMPULAN
Simpulan
Hasil validasi laboratorium terlihat bahwa kit EIA komersial estradiol dan progesteron DRG International Inc., Jerman untuk manusia ini valid dan dapat digunakan untuk pengujian sampel plasma kambing kacang dengan perbandingan pengenceran masing-masing adalah 1:2 dan 1:4, sedangkan kit ELISA komersial estradiol dan progesteron GBC menunjukkan hasil tidak valid karena antibodi yang digunakan dalam asai tersebut tidak dapat menentukan jumlah konsentrasi hormon yang ada dalam sampel yang diukur.
Profil hormon yang ditampilkan pada validasi biologis menunjukkan kesesuaian profil hormon P4 dengan gambaran perubahan dinamika ovarium dalam 22 hari terakhir pada kambing kacang 7. Respon estrus secara visual pada kambing kacang tidak terlihat dengan jelas, meskipun dari hasil pemeriksaan ovarium dengan USG terdapat pertumbuhan dan perkembangan folikel sebesar 3.0 sampai dengan 7.3 mm dan corpus luteum dengan ukuran 4.3 sampai dengan 12.3 mm. Dari hasil analisis hormon dan perubahan dinamika ovarium kambing kacang 5 dan 9 menunjukkan bahwa kambing tersebut tidak bersiklus, namun kambing kacang 7 dapat menunjukkan siklus estrus yang tidak teratur.
Saran
Perlu dilakukan validasi biologis lebih lanjut pada individu-individu yang bersiklus normal dan bunting sehingga dapat menentukan panjangnya fase folikel dan fase luteal pada kambing kacang dan interval siklus estrus yang lebih komprehensif serta penentuan lama kebuntingan.
DAFTAR PUSTAKA
Agil M. 2007. Reproductive biology of the sumatran rhinoceros Dicerorhinus sumatrensis (Fisher 1814). [Disertasi]. Bogor (ID). Institut Pertanian Bogor.
Althouse GC, Hixon JE. 1999. Use of commercially available ELISAs to help determine estrous status in female swine. Swine Health Prod. 7(2): 65-68 Arashiro EKN, Viana JHM, Fonseca JF, Camargo LSA, Fernandez CAC,
Brandao FZ. 2010. Luteal dynamics in goat : morphological and endocrine features. R Bras Zootec. 39(9): 1937-1942
Ariyaratna HBS, Gunawardana VK. 1997. Morphology and morphometry of ovarian follicles in the goat. Small Ruminant Res. 26: 123-129
Bearden HJ, Fuquay JW, Willard ST. 2004. In Applied Animal Reproduction. Ed Ke 6. USA. Pearson Eddcation, Inc.
25 Boer Indonesia. 2008. Tujuh plasma nutfah kambing lokal indonesia. [26 Maret
2008]. Tersedia pada:
Bowen RAR, Hartin GL, Csako G, Otanez OH, Remaley AT. 2010. Impact of blood collection devices on clinical chemistry assays. Clin Biochem. 43: 4-25
Brown J, Walker S, Steinman K. 2005. Endocrine Manual for Reproductive Assessment of Domestic and Non-Domestics Species. Smithsonian’s National Zoological Park. Conservation & Research Center. Virginia. p17. Tersediapada:http//www.unomaha.eduendolabLibraryfilessendo_manual_s mithsonian_NZP.pdf
Cappezuto A, Chelini MOM, Fellipe ECG, Oliveira CA. 2006. Correlation between serum and fecal concentration of reproductive steroids throughout gestation in goats. Anim Reprod Sci. 103:78-86. doi 10.1016/J.animrepsci.2006.11.001
Dunn JR. 2007. Measuring Parallelism and Relative Potency : In well-Behaved and III-Behaved Cell-Base Bioassays. IIR Third Annual Cell Based Assays. Brendan Technologies Inc.
Ederveen. 2010. A Practical Approach to Biological Assay validation: Assay Validation Parameters. Progress Project Management and Engineering. p 23-33. Tersedia pada:http://www.progress-pme.nl
Entwistle KW, Ridd CAJ. 1995. Teknologi ELISA dalam diagnosis dan penelitian : Asai hormon dengan ELISA. Editor G. W. Burgess. Terjemahan : W T Artama dan E Moeljono. Yogyakarta (ID). Gajah Mada University Press.
Fatet A, Rubio MTP, Leboeuf B. 2011. Reproductive cycle of goats. Anim Reprod Sci. 124 : 211-219. doi: 10.1016/J.animreprosci.2010.08.029
Fazielawanie NMR, Siraj SS, Harmin SA, Ina-Salway MY, Nik Daud NS. 2011. Development and validation of enzyme-linked immunosorbent assay (ELISA) vitellogenin in Lates calcarifer. J Fisheries and Aquatic Sci. 6:715-727 DOI:10.3923/jfas.2011.715.727
Fleming SA, Van Camp SD, Chapin HM. 1990. Serum progesterone determination as an aid for pregnancy diagnosis in goats bred out of season. J Can Vet. Vol. 31: 104-107
Ganswindt A, Palme R, Heistermann M, Borragan S, Hodges JK. 2003. Non-invasive assessment of adrenocortical function in the male african elephant (Loxodonta africana) and its relation to musth. Gen and Comp Endocrinol. 134: 156-166
Gorecki MT, Wojtowski J, Kaczmarek P, Dankow R, Cais-sokolinska D, Nowak KW. 2004. Concentration of progesterone and 17β estradiol in blood and milk and those of natural inhibitors in milk of goats in various physiological stages. Dumerstorf Arch Tierz. 47: 90-96
Graham L, Schwarzenberger F, Mostl E, Galama W, Savage A. 2001. A Versatile enzyme immunoassay for the determination of progestogens in feces and serum. Zoo Biology. 20:227–236
26
Hafez ESE, Jainudeen MR, Rosnina Y. 2000. Hormones, growth factors and reproduction. Didalam Hafez B dan Hafez ESE, editor. Reproduction in Farm Animal. Ed ke 7. Baltimore. Lippincott Williams and Wilkins.
Haisenleder DJ, Aleisha HS, Elizabeth SM, Lisa MG, John CM. 2011. Estimation of estradiol in mouse serum samples: evaluation of commercial estradiol immunoassays. Ndicrine Society. 152(11); 444
Haussmann MF, Vleck CM, Farrar ES. 2007. A Laboratory exercise toillustrate increased salivary cortisol in response to three stressful conditions using competitive ELISA. Adv Physiol Educ. 31: 110–115
Heistermann M, Tari S, Hodges JK. 1993. Measurement of faecal steroids for monitoring ovarian function in new world primates, callitrichidae. J Reprod Fertil. 99: 243-251
Higham JP, Heistermann M, Saggau C, Agil M, Farajallah DP, Engelhardt A. 2012. Sexual signaling in female crested macaques and the evolution of primate fertility signals. BMC Evolutinary Biology. 12:89
Hodges K, Brown J, Heistermann M. 2010. Endocrine monitoring of reproduction and stress. In Kleiman DG, Thompson KV, Kirk Baer C. (Eds) Wild Mammals in Captivity: Principles and Techniques for Zoo Management. Chicago. The University of Chicago Press. Pp 447-468
Hodges K, Heistermann M. 2011. Field endocrinology: monitoring hormonal changes in free-ranging primates. In Joanna MS, deborah JC. (Ed) Field and Laboratory Methods in Primatology: A Practical Guide. Cambridge. Cambridge University Press. Pp 353-370
Honour JW. 2006. High-performance liquid chromatography for hormone. Didalam MJ Wheeler, WD Fraser dan JSM Hutchinson, editor. Methods in Molecular Biology : Hormon assay in Biological Fluids. Totowa NJ. Humana Press Inc.
[ICH] International Conference on Harmonisation. 2005. Validation of Analytical Procedures: Text and Methodology Q2 (R1). http://www.ich.org
Katongole CB, Gombe S. 1985. A study of the reproduction hormones of indigenous goats in uganda. [22 Januari 2008]. P 1-8. Terdapat pada : http://www.fao.org/wairdocs/ilri/x5464b/x5464b02.htm.
Khanum SA, Hussain M, Kausar R. 2008. Progesterone and estradiol profiles during estrous cycle and gestation in dwarf goats (Capra hircus). J Pakistan Vet. 28 (1) :1-4
Lee JW. 2009. Method validation and application of protein biomarkers; basic similarities and differences from biotherapeutics. Bioanalysis. 1(8): 1461-1474
Leng SJM, Walston J, Xie D, Fedarko N, Kuchel G. 2008. Elisa and multiplex technologies for cytokine measurement in inflammation and aging research. J Gerontol Biol Sci Med Sci. 63 (8):879–884
Lequin RM. 2005. Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA). Clinical Chemistry. 51 (12): 2415–2418 [LF] Life Technologies. 2007. Plasma and Serum Preparation. [1 Januari
27 Lundblad RL. 2005. Consideration for the use of blood plasma and serum for
proteomic analysis. Internet J Genomics and Proteomics. 2: 1-16
Ma H, Kuan JS, Sheau Ll. 2004. Study of ELISA technique. Nature and Science. 4(2); 36-37
Mahmilia F, Doloksaribu M, Nasution S, Hasibuan S. 2009. Reproduksi awal kambing kacang dan boerka-1 di loka penelitian kambing potong. Seminar Nasional Teknologi Peternakan dan Veteriner. p 367-372
Medan MS, Watanabe G, Sasaki K, Groome NP, Sharawy S, Taya K. 2005. Follicular and hormonal dynamics during the estrous cycles in goats. J Reprod and Development. 51(4) : 455-463
Menchaca A, Rubianes E. 2002. Relation between progesterone concentration during the early luteal phase and follicular dynamic in goats. Theriogenology .57 : 1411-1419
Mohle U, Heistermann M, Palme R, Hodges JK. 2002. Characterization of urinary and fecal metabolites of testeosterone and their measurement for assessing gonadal endocrine function in male nonhuman primates. Gen and Comp endocrinol. 129: 135-145
[NCCLS] National Committee for Clinical Laboratory Standard. 2004. Protocol for Determination of Limits of Detection and Limits of Quantitation; Proposed Guideline. Clinical and Laboratory Standard Institute. Document Number EP17-A.
Pamungkas FA, Batubara A, Doloksaribu M, Sihite E. 2009. Petunjuk Teknis Potensi beberapa Plasma Nutfah Kambing Lokal Indonesia. Jakarta (ID). Pusat Penelitian dan Pengembangan Peternakan. Badan Penelitian dan Pengembangan Pertanian. Departemen Pertanian.
Pamungkas FA, Elieser S, Mahmilia F. 2005. Respon fisiologis kambing boer pada kondisi iklim tropis basah. Prosiding Seminar Nasional Sosialisasi Hasil Penelitian dan Pengkajian Pertanian Sumatera Utara. 21-22 Nov 2005. p 512-516
Pang XS, Wang ZY, Zhu TG, Yin DZ, Zhang YL, Meng L, Wang F. 2010. Concentration of progesterone and estradiol in peripheral plasma during the estrous cycle and after ovariectomy in huanghuai goats of high or poor prolificacy. J Asian-Aus Anim Sci. Vol 23.2:188-196
Perez GC, Laita SGB, Illera del Portal JC, Leisa JP. 2004. Validation of an EIA technique for the determination of salivary cortisol in cattle. J Agricultural Res. 2 (1): 45-51
[PB] Pierce Biotechnology. 2007. Spike-and-Recovery and Linearity of Dilution Assessment. Thermo Fisher Scientific Inc. Rockford (USA). Tersedia pada: http://www.piercenet.com/files/TR0058-spike-and-Recovery.pdf Plikaytis BD, Holder PF, Pais LB, Maslanka SE, Gheesling LL, Carlone GM.
1994. Determination of parallelism and nonparallelism in bioassay dilution curves. J Clin Microbiol. 32 (10): 2441-2447.
Relave F, Lefebrve RC, Beaudoin S, Price C. 2007. Accuracy of rapid enzyme-linked immunosorbent assay to measure progesterone in mares. J Can Vet. 48: 823-826
28
reproductive traits in Akkaraman sheep during the breeding season. Acta Sci Vet. 38(4): 391-398
Samartzi F, Belibasaki S, Vainas E, Boscos C. 1995. Plasma progesterone concentration in relation to ovulation rate and embryo yield in chios ewes superovulated with PMSG. Anim Reprod Sci. 39:11-21. SSDI 0378-4320 (94) 01372-1
Savige JA, Paspaliaris B, Silvestrini R, Davies D, Nikoloutsopoulos T, Sturgess A, Neil J, Pollock W, Dunster K, Hendle M. 1998. A review of immunofluorescent patterns associated with antineutrophil cytoplasmic antibodies (ANCA) and their differentiation from other antibodies. J Clin Pathol. 51:568-75
Schulster D, Burstein S, Cooke BA. 1976. Molecular Endocrinology of the Steroid Hormones. London, NY, Sidney, Toronto
Senger PL. 2003. Patways to Pregnancy and Parturion. Ed ke 2. Washington. Current Conceptions, Inc.
Setiadi B, Tiesnamurti B, Subandryo, Sartika T, Adiati U, Yulistiani D, Sendouw I. 2002. Koleksi dan evaluasi karakteristik kambing kosta dan gembrong secara ex-situ. Laporan Hasil Penelitian APBN 2001. Bogor (ID). Balai Penelitian Ternak Ciawi Bogor. p 59-73
Setiawan IM. 2007. Pemeriksaan Enzyme-Linked Immunosorbent Assay (ELISA) untuk Diagnosis Leptospirosis. Ebers Papyrus
Schwarzenberger F, Rietschel W, Vahalan J, Holeckova D, Thomas P, Maltzan J, Baumgartner K, Schaftenaar W. 2000. Fecal progesterone, estrogen and androgen metabolites for non-invasive monitoring of reproductive function in the female indian rhinoceros, Rhinoceros unicornis. Gen Comp Endo. 119. 300-307. Doi : 10.1006/gcen.200.7523
Shabankareh HK, Habibizad J, Torki M. 2009. Corpus luteum function following single and double ovulation during estrous cycle in sanjabi ewes. Anim Reprod Sci. 114 :362-369. Doi : 10.1016/j.anireprosci.2008.10.011
Sherrill AF, Steven DVC, Heath MC. 1990. Serum progesterone determination as an aid for pregnancy diagnosis in goats bred out of season. J Can Vet. Vol 31: 104-107
Simontacchi C, Marinelli L, Gabai G, Bono G and Angeletti R. 1999. Accuracy in naturally occuring anabolic steroid assays in cattle and first approach to qua lity control in italy. Analyst. 124: 307-312
Simoes J, Almeida JC, Baril G, Azevedo J, fontes P, Mascarenhas R. 2007. Assessment of luteal function by ultrasonographic appearance and measurement of corpora lutea in goats. Anim Reprod Sci. 97 : 36-46. Doi:10.1016/j.anireprosci.2006.01.006
Simoes J, Potes J, Azevedo J, Almeida JC, Fontes P, Baril G, Mescarenhans R. 2005. Morfometry of ovarian structures by transrectal ultrasonography in serrana goats. Anim Reprod Sci. 85 : 263-273. Doi : 10.1016/j.anireprosci.2004.04.045
29 Sodiq, Tawfik ES. 2003. The role and breeds management systems productivity
and development strategies of goats in indonesia. A Review. J Agric Dev. Tropics Subtropics. 104: 71-89
Souza CJ, Campbell BK, Baird DT. 1998. Follicular waves and concentration of steroid and inhibin A inovarian venous blood during the luteal phase of the estrous cycle in ewes with an ovarian autotransplant. J Endocrinol. 156 : 563-572
Tizard. 1988. Pengantar Imunologi Veteriner. Airlangga University Press
Todini L, Terzano GM, Malfatti A. 2007 Validation of ELISA kits for determination of inhibin-A and estradiol 17-beta concentrations in buffalo plasma. J Anim Sci. Vol.6,(Suppl.2), 585-588
[WHO] World Health Organization. 2002. Use of Anticoagulants in Diagnostic Laboratory Investigations. Rev 2. Genewa.
Widiyono I, Putro PP, Sarmin, Astuti P, Airin CM. 2011. Kadar estradiol dan progesteron serum, tampilan vulva dan sitologi apus vagina kambing bligon selama siklus birahi. J Vet. Vol 12 (4): 263-268
30