VIRUS H5N1 ISOLAT LAPANG
ANDRIJANTO HAUFERSON ANGI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
ANDRIJANTO HAUFERSON ANGI. Neutralization Ability of Specific Antibody
of Avian Influenza H5 to Several Viruses of H5N1 Field Isolates. Under direction of I Wayan Teguh Wibawan and Sri Murtini.
Avian Influenza (AI) is well known as Avian flu, Fowl pest, Fowl plaque, or Flu burung, caused by influenza virus type A. This virus is belonged to Orthomyxoviridae and could infect many kind of species such as bird, pig, horse, cat, as well as human. Vaccination is applied to control the disease using inactivated vaccine, which induced the specific antibody against H5 antigen. Passive immunization using specific antisera against H5 antigen is thought to be usefull in controlling the disease especially in the treatment of infected host. In this experiment the neutralization ability of specific antisera against H5 were studied using various field viral isolates subtype H5N1. Antisera was developed in Cavia porcellus which vaccinated with AI subtype H5N1 in activated vaccine. The titre of antisera obtained is 28 used HI test. Four AI virus subtype H5N1 isolates from 2003 to 2006 agains viral were we as tested virus. The neutralization test showed that the sera were able to neutralizing 10 4 EID50 AI virus H5N1 with neutralization index range between 1,1–
1,3. The result indicated that the specific antisera had the neutralization potency to the field virus.
Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tampa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, menuliskan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan yang wajar IPB
KEMAMPUAN NETRALISASI ANTIBODI SPESIFIK
AVIAN INFLUENZA H5 TERHADAP BEBERAPA
VIRUS H5N1 ISOLAT LAPANG
ANDRIJANTO HAUFERSON ANGI
Tesis
Sebagai salah satu syarat memperoleh gelar Megister Sains pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Isolat Lapang
Nama : Andrijanto Hauferson Angi
NIM : B151060011
Program Studi : Sains Veteriner
Disetujui,
Komisi Pembimbing
Dr. Drh. I Wayan T. Wibawan, MS Dr. Drh. Sri Murtini, M.Si
Ketua Anggota
Diketahui,
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
Drh. Bambang Pontjo P., MS, Ph.D Prof. Dr. Ir. Khairil A. Notodiputro, MS
Tanggal Ujian : 3 September 2008 Tanggal Lulus :
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas rahmat dan
berkat-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang
berjudul Kemampuan Netralisasi Antibodi Spesifik Avian Influenza H5 Terhadap
Beberapa Virus H5N1 Isolat Lapang.
Ucapan terima kasih penulis sampaikan kepada :
1. Dr. I Wayan Teguh Wibawan, MS . selaku Ketua Komisi Pembimbing dan Dr.
Drh. Sri Murtini M.Si. selaku Anggota Komisi Pembimbing, atas waktu, saran,
nasehat, kesempatan, serta bimbingannya.
2. Drh. Bambang Pontjo P, MS, Ph.D, selaku Ketua Program Studi Sains
Veteriner.
3. Prof. Dr.Drh. Retno D.Soejoedono, MS, selaku Dosen Penguji Luar
4. Teman-teman Program Studi Sains Veteriner ( Mr. Jack, Pak Adji, Pak Agung,
Bu Ketut, Bu Sovi, Pak Muharam, Pak Nyoman, Pak Mustafa, Kalbe grup)
5. Teknisi Bagian Mikrobiologi Medis Laboratorium Virologi dan Imunologi
FKH IPB (Lukman, Wahyu, Ifan)
6. Orang tua tercinta dan keluarga atas doa serta bantuan dan motivasinya
7. Ai dan Kedua anakku tercinta (Luki dan Putri) atas doa dan kasih sayangnya
Bogor, Agustus 2008
Penulis dilahirkan di Kupang, 20 April 1972 dari ayah Drs. Ayub Angi dan
ibu Ny. Agusthina Angi-Takain. Penulis merupakan anak kelima dari sembilan
bersaudara.
Penulis menempuh pendidikan dasar sampai menengah atas di Kota Kupang
Propinsi Nusa Tenggara Timur. Penulis Menempuh Pendidikan S1 dan Pendidikan
Profesi Dokter Hewan di Fakultas Kodekteran Hewan IPB. Tahun 2000 hingga 2002
penulis bekerja di Jakarta pada PT. Hannachemia Suginra dan PT. Paeco Agung.
Bulan Desember Tahun 2002 hingga sekarang, penulis bekerja sebagai staf pengajar
di Politeknik Pertanian Negeri Kupang. Pada tahun 2006 penulis melanjutkan
pendidikan S2 pada Program Studi Sains Veteriner, Sekolah Pascasarjana, Institut
RINGKASAN
ANDRIJANTO HAUFERSON ANGI. Kemampuan Netralisasi Antibodi Spesifik Avian Influenza H5 Terhadap Beberapa Virus H5N1 Isolat Lapang. Dibimbing oleh
IWAYAN TEGUH WIBAWAN dan SRI MURTINI.
Penyakit Avian Influenza (AI) yang disebut juga Flu burung, Fowl pest, Fowl plaque, atau Avian flu adalah suatu penyakit menular yang disebabkan oleh virus influenza tipe A. Virus ini berasal dari kelompok famili Orthomyxoviridae. Di Indonesia, sejak tahun 2003 hingga tahun 2008 sudah 31 propinsi di Indonesia dari 33 propinsi terserang wabah penyakit ini, 26 di antaranya merupakan daerah endemis.
Tindakan pencegahan yang dilakukan oleh pemerintah terhadap penyakit Avian influenza melalui vaksinasi. Selain memberikan kekebalan pada hewan vaksinasi juga dapat menyebabkan tekanan terhadap virus sehingga mengurangi peluang terjadinya mutasi alami atau reassortment melalui pengurangan jumlah virus yang bersirkulasi.
Vaksinasi merupakan tindakan pengebalan secara aktif terhadap hewan atau manusia. Tindakan pengebalan selain secara aktif dapat juga dilakukan secara pasif. Pengebalan secara pasif adalah pemberian zat kebal (antibodi) secara langsung pada hewan atau inang. Pengebalan pasif dapat bertindak sebagai terapi bagi penderita suatu penyakit seperti pada kasus tetanus.
Berbagai isolat lapang yang diperoleh serta diteliti, memperlihatkan bahwa isolat virus unggas yang dikumpulkan selama wabah Avian influenza yang berlangsung tahun 2003, 2004 dan 2005 dari berbagai daerah tertular di Indonesia masih berada dalam satu cluster yang sama. Hasil pemetaan gen dapat diketahui bahwa virus H5N1 pada unggas di Indonesia selama ini belum menunjukkan indikasi mengalami mutasi yang nyata. Belum adanya perubahan genetik yang drastis (mutasi) dari virus Avian influenza H5N1 yang ada di Indonesia memberi peluang bagi dilakukannya penelitian kemampuan netralisasi antibodi anti virus H5N1 serta kemungkinan penggunaannya sebagai imun terapi bagi penyakit Avian influenza.
Penelitian ini bertujuan untuk memproduksi antibodi anti H5 (Ab anti H5) dan mengetahui kemampuan netralisasi antibodi tersebut terhadap berbagai isolat lapang. Penelitian dilaksankan dalam 4 tahap yaitu titrasi virus dengan uji Hamaglutinasi dan Uji Egg Infectious Dose50 (EID 50), produksi antibodi terhadap avian influenza H5N1
(Ab anti H5), identifikasi dan titrasi antibodi dengan uji AGP dan uji penghambatan agglutinasi serta uji Netralisasi menggunakan prosedur ß untuk mengetahui kemampuan netralisasi antibodi terhadap virus isolat lapang.
Hasil titrasi menunjukkan bahwa isolat lapang yang dimiliki FKH IPB sejak tahun 2003 –2006 mempunyai titer antara 28 - 29 HAU / 25 ul dan 10 8,3 – 10 11,8 EID
50/ml. Hasil tersebut menunjukkan bahwa virus koleksi FKH IPB memiliki titer dan
viabilitas yang tinggi sehingga layak digunakan dalam pengujian.
terbentuk cukup tinggi mencapai 29 dengan uji HI.
Hasil uji netralisasi menunjukkan Indeks Netralisasi dari Ab yang diperoleh terhadap virus isolat tahun 2003 – 2006 adalah 1,1 – 1,3. Berdasarkan hasil uji netralisasi terlihat bahwa antibodi anti H5 yang diproduksi memiliki kemampuan menetralisasi virus uji. Isolat tahun 2003 , tahun 2005 dan tahun 2006, antibodi anti H5 dapat menetralisasi 50% virus dengan titer 104 EID50 pada pengenceran 1:20,
sedangkan terhadap virus AI H5N1 isolat tahun 2004, Ab dapat menetralisasi pada pengenceran 1:13. Penelitian ini menunjukkan bahwa antibodi anti H5 (antisera) yang diproduksi dapat menetralisasi virus dengan sempurna pada titer 28 . Kemampuan Ab anti H5 asal cavia ini lebih rendah bila dibandingkan dengan kemampuan netralisasi Ab asal unggas. Laporan Riset Unggulan Insentif 2008, Wibawan et al. (2008) menyatakan bahwa IgY asal kuning telur ayam yang bertiter 24 dapat menetralisasi 100% virus isolat 2005. Perbedaan efikasi ini dapat disebabkan oleh beberapa hal yaitu adanya perbedaan konformasi dan konsentrasi antibodi mamalia (IgG) dengan antibodi unggas (IgY). IgG memiliki jumlah antibodi/minggu 200 mg IgG/darah (dalam 40 ml darah) sedangkan IgY 50-100 mg IgY/ telur. Perbedaan lain IgG memiliki jumlah antibodi spesifik 5%, sedangkan IgY hanya 2-10%. Berdasarkan penelitian ini dapat disimpulkan bahwa Ab anti H5 yang diproduksi mampu menetralkan virus H5N1 isolat lapang.
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kemampuan Netralisasi Antibodi
Spesifik Avian Influenza H5 Terhadap Beberapa Virus H5N1 Isolat Lapang adalah
karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk
apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
Andrijanto Hauferson Angi
DAFTAR ISI
...Sifat dan Patogenitas Virus Avian Influenza ……… 6
...Replikasi Virus ………. 7
...Gambaran Klinis ………... 8
...Vaksin dan Vaksinasi Terhadap Penyakit Avian Influenza ... 9
...Antibodi ... 10
...Bentuk Alami Dari Reaksi Antibodi Antigen ... 12
...Imunisasi Pasif ... 13
...Perhitungan Indeks Netralisasi prosedur 21 HASIL DAN PEMBAHASAN ...Titrasi Virus Isolat Uji…... ………. 22
...Produksi Antibodi ... ... 23
...Identifikasi Serum kebal (Antibodi Anti H5)……… 24
...Titrasi Antibodi Anti H5...……… 25
...Uji Netralisasi Virus ...………... 26
DAFTAR TABEL
Halaman
1 Perhitungan Endpoint 50% ... ... 19
2 Titer virus Isolat Koleksi dengan Uji HA... 22
3 Titer Virus dengan Uji EID50... 23
4 Waktu Vaksinasi serta Titer Ab anti H5 koleksi... 24
5 Nilai HI test terhadap Isolat Koleksi FKH IPB (Isolat Terpilih)... 25
6 Uji Netralisasi Isolat Tahun 2003 dengan Metode Reed and Muench.... 27
7 Uji Netralisasi Isolat Tahun 2004 dengan Metode Reed and Muench.... 28
8 Uji Netralisasi Isolat Tahun 2005 dengan Metode Reed and Muench.... 29
9 Uji Netralisasi Isolat Tahun 2006 dengan Metode Reed and Muench.... 30
10 Perhitungan titer endpoint 50% isolat 2003... 38
11 Perhitungan titer endpoint 50% isolat 2004... 39
12 Perhitungan titer endpoint 50% isolat 2005... 40
Halaman
1 Virus Influenza tipe A, B, C ... 4
2 Replikasi Virus Influenza ……….. 8
3 Struktur Antibodi... 11
4 Bentuk alami reaksi antibodi antigen ... 12
5 Reaksi Antibodi – Antigen ... 13
6 Skematik Sistem Imun ... 14
7 AGP ... 25
8 Reaksi aglutinasi hasil uji netralisasi untuk isolat tahun 2003 ... 27
9 Reaksi aglutinasi hasil uji netralisasi untuk isolat tahun 2004 ... 28
10 Reaksi aglutinasi hasil uji netralisasi untuk isolat tahun 2005 ... 29
DAFTAR LAMPIRAN
Halaman
1 Desain Penelitian ……… 37
PENDAHULUAN
Latar Belakang
Penyakit Avian Influenza (AI) yang disebut juga Flu burung, Fowl pest, Fowl
plaque, atau Avian flu adalah suatu penyakit menular yang disebabkan oleh virus influenza tipe A. Virus ini berasal dari kelompok famili Orthomyxoviridae, serta
dapat menginfeksi berbagai macam spesies diantaranya unggas, babi, kuda, serta
manusia (Easterday & Hinshaw 1991). Di Indonesia, sejak tahun 2003 hingga tahun
2008 sudah 31 propinsi di Indonesia dari 33 propinsi, 26 diantaranya adalah endemis.
Tindakan pencegahan dan pengendalian penyakit Avian Influenza di Indonesia
sesuai dengan rencana dan strategi nasional pengendalian Avian Influenza adalah mencegah penularan dan memutus mata rantai penyebaran virus flu burung sedini
mungkin, melakukan tindakan pengendalian virus pada daerah yang terjangkit, serta
menyediakan dan mengembangkan pembuatan obat antivirus dan vaksin dari benih
virus (seed) Indonesia (Bappenas 2005). Tindakan pencegahan penyakit Avian influenza dapat dilakukan dengan pemberian vaksin. Vaksinasi memberikan peningkatan respon kekebalan aktif. Selain vaksinasi, kekebalan dapat juga diberikan
melalui pemberian zat kebal secara langsung yang dikenal dengan respon kekebalan
pasif. Sebagai contoh pada pemberian serum kebal bagi penderita rabies. Alternatif
pengendalian penyakit yang tertuang dalam rencana strategis pengendalian Avian influenza adalah penelitian pengaruh obat bagi penderita Avian influenza. Pemberian Antibodi langsung dalam bentuk kekebalan pasif dapat dilakukan sebagai alternatif
pencegahan penyakit Avian influenza.
Secara umum, virus influenza dapat mengalami mutasi spontan pada saat
virus memperbanyak diri di dalam sel inang. Beberapa tipe virus influenza dapat
menginfeksi manusia maupun hewan, yaitu virus influenza A, B, dan C. Penggolongan virus influenza didasarkan pada perbedaan Antigenic NP dan M1 dari
masing-masing virus. Tidak seperti virus influenza B dan C, virus influenza A
2
(pergeseran genetik). Antigenic drift adalah perubahan pada satu titik dari genom virus influenza A, perubahan ini sebagai penyebab wabah flu musiman yang sering
terjadi. Antigenik drift melibatkan perubahan minor antigenik pada HA dan/atau NA,
sedangkan Antigenik shift melibatkan perubahan antigenik mayor pada HA dan/atau NA (Easterday et al. 1997). Antigenic shift adalah perubahan yang lebih besar dari genom virus, meliputi minimal 1 segmen dari 8 segmen virus influenza, perubahan
ini sebagai penyebab terjadinya wabah berkala setiap abad, seperti Pandemi influenza.
Antigenic shift yang dikenal dengan proses reassortasi (reassortment), merupakan
proses terjadinya pemilihan dan pencampuran secara genetis virus dari 2 subtipe virus
berbeda yang berasal dari 2 induk semang berbeda, sehingga terbentuk jenis subtipe
virus baru yang berbeda dengan 2 subtipe induknya (Parent viruses). Subtipe virus
baru ini (reassortant influenza virus) mampu beradaptasi pada jenis makhluk hidup
lain. Antigenic shift dalam hubungannya dengan kemunculan strain virus baru, terjadi
ketika virus membutuhkan gen HA baru (dan NA pada beberapa kasus) mengkode
sebuah protein baru yang memiliki karakteristik antigenik yang baru. Dalam subtipe
viral baru, virus mengalami evolusi di bawah tekanan selektif imunitas inang. Strain
yang mampu tumbuh dan berkembang adalah yang mampu mengakumulasi mutasi
yang cocok pada gen yang mengkode HA. Perubahan asam amino HA berhubungan
dengan perubahan minor sifat antigenik (Both & Sleigh 1981).
Vaksinasi dapat menyebabkan tekanan terhadap virus sehingga mengurangi
peluang terjadinya mutasi alami melalui pengurangan jumlah virus yang bersirkulasi.
Berbagai isolat lapang yang diperoleh serta diteliti, memperlihatkan bahwa isolat
virus unggas yang dikumpulkan selama wabah Avian influenza yang berlangsung tahun 2003, 2004 dan 2005 dari berbagai daerah tertular di Indonesia masih berada
dalam satu cluster yang sama. Studi sekuensing nukleotida menunjukkan bahwa
kebanyakan virus HPAI memiliki ciri-ciri yang sama dalam gen HA pada ayam,
sebagai penanda virulensi (Harder & Werner 2006; Neuman et al. 2003).
Hasil pemetaan gen dapat diketahui bahwa virus H5N1 pada unggas di
Indonesia selama ini belum menunjukkan indikasi mengalami mutasi yang nyata.
H5N1 yang ada di Indonesia memberi peluang bagi dilakukannya penelitian
kemampuan netralisasi antibodi anti virus H5N1 serta kemungkinan penggunaannya
sebagai imun terapi bagi penyakit Avian influenza.
Tujuan Penelitian
1. Memperoleh Ab anti H5 yang memiliki kemampuan menetralisir isolat virus
AI H5N1 asal lapang
2. Melihat dinamika virus AI H5N1 berdasarkan ekspresi biologis virus
Hipotesis
1. Virus Avian Influenza H5N1 di lapangan di Indonesia belum mengalami perubahan (mutasi) genetik yang drastis berdasarkan perbedaan ekspresi
biologisnya
2. Antibodi terhadap H5N1 yang diperoleh mampu menetralisir virus asal isolat
4
TINJAUAN PUSTAKA
Ekologi Avian Influenza
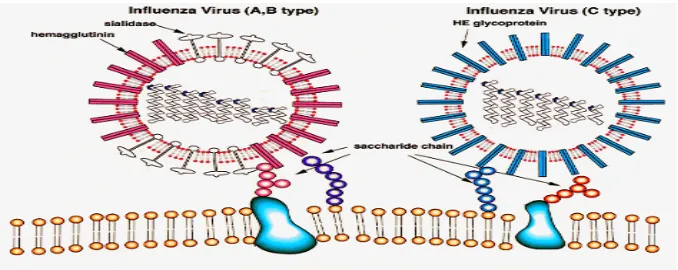
Virus influenza adalah partikel berselubung berbentuk bundar atau bulat
panjang, merupakan genom RNA rantai tunggal dengan 8 segmen, serta berpolaritas
negatif. Virus influenza termasuk famili Orthomyxoviridae dan diklasifikasikan
dalam tipe A, B atau C berdasarkan perbedaan sifat antigenik dari nukleoprotein dan
matrix proteinnya.
Gambar 1. Virus Influenza tipe A, B, C
Berdasarkan sifat antigenisitas glikoprotein, virus influenza dikelompokkan
ke dalam 16 subtipe H (H1-H16) dan 9 subtipe N (N1-N9). Kelompok-kelompok
tersebut ditetapkan berdasarkan analisis filogenetik terhadap nukleotida dan
penetapan sekuen gen-gen HA dan NA melalui cara deduksi asam amino (Fouchier et
al. 2005).
Hemaglutinin merupakan protein yang mengalami glikosilasi dan asilasi
(glycosylated and acylated protein) terdiri dari 562-566 asam amino yang terikat
dalam selubung virus. Bagian distal berbentuk bulat yang berkaitan dengan
kemampuannya melekat pada reseptor sel. Hemaglutinin terdiri dari oligosakharida
(NA), enzim bertugas melakukan aktivitas enzimatik sialolitik (sialolytic ensymatic
activity) selain itu enzim neuraminidase bertugas melepaskan progeni virus yang terjebak di permukaan sel yang terinfeksi sewaktu dilepaskan. Fungsi ini mencegah
bertumpuknya virus serta memudahkan gerakan virus dalam selaput lendir dari
jaringan epitel sasaran (Matrosivich et al. 2004). Menempelnya virus ke target infeksi
membuat neuroamidase merupakan sasaran yang menarik bagi obat antivirus
(Garman & Laver 2004). Kegiatan yang terkoordinasi dari glikoprotein HA dan NA
dari strain virus tertentu merupakan hal yang penting bagi proses pelekatan dan pelepasan virion (Wagner et al. 2002).
Virion masuk dan menyatu ke dalam sebuah ruang endosom setelah berhasil
melekat pada reseptor yang sesuai (Rust et al. 2004). Dalam ruang endosom, virus
mengalami degradasi dengan cara menyatukan membran virus dengan membran
endosom yang dimediasi oleh pemindahan proton melalui terowongan protein dari
matrix-2 (M2) virus pada nilai pH di endosom sekitar 5,0. Selanjutnya akan terjadi
serangkaian penataan ulang protein matrix-1 (M1) dan kompleks glikoprotein
homotrimerik HA. Hasilnya, terbuka (exposed) sebuah bidang (domain) yang sangat
lipofilik dan fusogenik dari setiap monomer HA yang masuk ke dalam membran
endolisomal, sehingga mulai terjadi fusi antara membran virus dengan membran
lisomal (Wagner et al. 2005). Kedelapan segmen RNA genomik dari virus, yang terbungkus dalam lapisan pelindung protein (ribonucleoprotein complex, RNP)
nukleokapsid (N), dilepaskan ke dalam sitoplasma. Di sini mereka disalurkan ke
nukleus untuk melakukan transkripsi mRNA virus dan replikasi RNA genomik
melalui proses rumit yang diatur oleh faktor virus dan faktor sel (Whitaker et al. 1996). Polimerase yang dependen terhadap RNA (RdRp) dibentuk oleh sebuah
kompleks (gabungan) dari PB1, PB2 dan protein PA virus, serta memerlukan RNA
(RNP) yang terbungkus (encapsidated RNA (RNPs)) untuk hal ini. Setelah terjadi
translasi protein virus dan perangkaian nukleokapsid yang membawa RNA genomik
yang sudah ter-replikasi, virion-virion progeni tumbuh dari membran sel yang di
dalamnya sudah dimasukkan glikoprotein virus sebelumnya. Penataan antara
6
protein matrix-1 virus (M1) yang membentuk struktur serupa cangkang tepat di
bawah pembungkus virus. Reproduksi virus di dalam sel peka bisa berlangsung
sangat cepat (kurang dari sepuluh jam). Proses ini akan efisien, apabila gen optimal
tersedia di sana (Rott et al. 1995).
Akibat aktivitas Polimerase yang dependen terhadap RNA (RdRp), virus
mudah mengalami mutasi dan siklus replikasinya cepat. Jika ada tekanan selektif
seperti antibodi penetral, ikatan reseptor yang tidak optimal, atau obat antiviral yang
bekerja selama proses replikasi virus pada inang, dapat menyebabkan terjadi mutan
dengan keunggulan selektif (mis. reseptor terlepas saat proses netralisasi serta
membentuk unit pengikat reseptor baru) dan kemudian menjadi varian yang dominan
dalam spesies virus di dalam tubuh inang. Determinan antigenik dari glikoprotein HA
dan NA yang dipengaruhi oleh mekanisme yang dipicu oleh sistem kekebalan,
prosesnya disebut sebagai Antigenic drift (Fergusson et al. 2003). Sebaliknya, Antigenic shift menunjukkan adanya perubahan mendadak dalam determinan antigenik, yaitu pertukaran subtipe H dan/atau N, dalam satu siklus tunggal replikasi.
Hal ini terjadi dalam sebuah sel yang secara bersamaan terinfeksi oleh dua atau lebih
virus influenza A dari subtipe yang berbeda. Karena distribusi segmen genomik virus
yang sudah tereplikasi ke dalam progeni yang baru tumbuh berlangsung tanpa
tergantung kepada subtipe asal dari tiap segmen, dan dapat muncul progeni yang
berkemampuan untuk bereplikasi membawa informasi genetik dari virus induk yang
berbeda-beda (disebut sebagai reassortant) (Webster & Hulse 2004, WHO 2005).
Sifat dan Patogenitas Virus Avian Influenza
Sifat virus Avian influenza antara lain mengaglutinasi sel darah merah ayam, mudah mengalami mutasi, virus mudah mati di luar sel tubuh ayam (tidak stabil di
lingkungan). Virus ini juga mudah mati oleh panas, kekeringan, sinar ultraviolet,
serta berbagai desinfektan yang umum di lapangan (deterjen, formalin, yodium,
ammonium, kuarterner, hipoklorit, klorin, serta senyawa fenol). Tingkat keganasan
bentuk yaitu Low Pathogenic AI (LPAI) dan Highly Pathogenic AI (HPAI). Kejadian
LPAI umumnya tidak menunjukkan gejala yang khas atau asimptomatik, misalnya
berupa gangguan pernapasan ringan atau gangguan reproduksi. Kasus HPAI memiliki
ciri-ciri antara lain bersifat sangat kontagius, dapat menimbulkan penyakit
multisistemik dengan mortalitas tinggi. Bentuk HPAI dapat disebakan oleh virus AI
dari beberapa suptipe H5 atau H7, namun penentuan bentuk HPAI tidak didasarkan
pada subtipe H5 atau H7 tetapi sifat keganasan penyakit. Pada setiap wabah, subtipe
H5 atau H7 mempunyai karekteristik internal gene yang mungkin bervariasi. Virus HPAI dapat berasal dari virus LPAI yang bermutasi pada protein permukaan
hemaglutinin (OIE 2005)
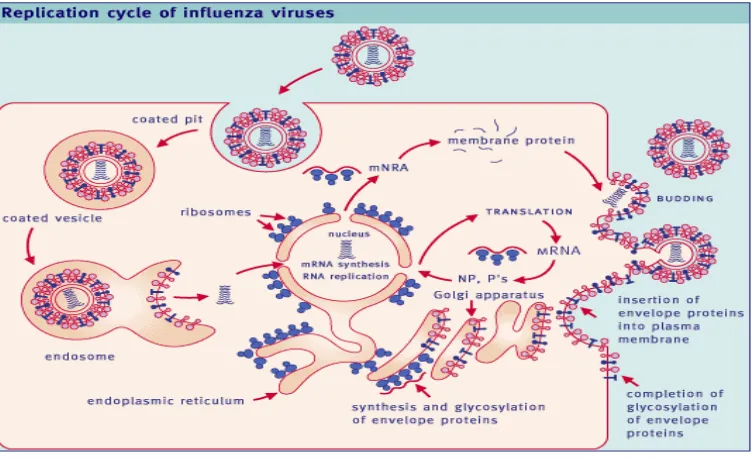
Replikasi Virus
Replikasi virus dimulai dengan adsorbsi virus ke reseptor glikoprotein yang
mengandung asam sialic pada permukaan sel. Virus kemudian memasuki sel dengan jalan endositosis melalui reseptor. Kondisi pH rendah dalam endosom, menghasilkan
perubahan konformasi dalam hemaglutinin, yang memperantarai fusi membran.
Nukleokapsid kemudian memasuki sitoplasma dan bermigrasi ke nukleus. Virus
influenza menggunakan mekanisme yang unik untuk menginisiasi transkripsi, yaitu
menggunakan viral transkriptase. Enam mRNA monosistronik dihasilkan dan
ditranslasi menjadi HA, NA, NP dan tiga polimerase (PB1, PB2, dan PA). Melalui
pembelahan mRNA untuk gen NS dan M masing-masing menjadi dua mRNA, yang
ditranslasi dalam reading frame berbeda dan menghasilkan protein NS1, NS2, M1 dan M2. Hemaglutinin dan neuraminiase diglikosilasi dalam retikulum endoplasma
kasar, dilengkapi di dalam badan golgi, ditransportasikan ke permukaan dan melekat
pada membran sel (Easterday et al. 1997).
Syarat penting protein HA dapat bekerja adalah adanya pembelahan oleh
protease sel inang menjadi HA1 dan HA2 yang dihubungkan dengan ikatan disulfida.
8
dan pemasangan protein viral dan RNA, virus keluar sel dengan jalan menguncup
dari membran plasma (Easterday et al. 1997).
Gambar 2. Replikasi Virus Influenza (Paul 2003)
Gambaran Klinis
Gambaran klinis penyakit Avian influenza (AI) pada unggas bervariasi serta gejalanya sering tidak spesifik, oleh karena itu tidak mungkin untuk menegakkan
diagnosis hanya berdasarkan gambaran klinis. Virus berkembang selama beberapa
hari, tergantung pada karakteristik isolat, dosis inokulum, spesies, dan usia unggas.
Unggas yang menderita AI dapat mengeluarkan virus dalam jumlah yang besar di
kotorannya. Virus tersebut dapat bertahan hidup di air sampai 4 hari pada suhu 22 0C dan lebih dari 30 hari dalam suhu 30 0C. Di dalam feses unggas dan dalam tubuh unggas yang sakit, virus dapat bertahan lebih lama, tetapi akan mati pada pemanasan
60 0C selama 30 menit (Soejoedono & Handharyani 2005). Gejala klinis infeksi virus AI berpatogenesis rendah tidak terlalu jelas, seperti bulu-bulu kusut, produksi telur
secara perlahan menurun, penurunan berat badan disertai gangguan pernapasan
strain H9N2 dari garis Asia virus ini telah beradaptasi sehingga menghasilkan replikasi yang efisien dalam unggas, dan menimbulkan gejala klinis yang nyata serta
mengakibatkan kematian secara signifikan. Infeksi virus AI yang patogenitasnya
tinggi, menimbulkan penyakit yang ditandai dengan serangan mendadak dan gejala
hebat serta kematian mendekati 100% dalam jangka waktu 48 jam (Swayne & Suarez
2000). Penyebaran virus dalam kelompok unggas tergantung bentuk pemeliharaannya.
Pada kelompok unggas yang dilepas di tempat kotor dan terjadi hubungan langsung
serta percampuran dengan hewan lain, penyebaran infeksi berlangsung lebih cepat
daripada yang dipelihara dalam kandang. Namun masih diperlukan beberapa hari
untuk terjadinya penularan yang sempurna (Capua et al. 2000). Infeksi virus pada peternakan unggas skala besar, terjadinya penurunan konsumsi air dan makanan yang
drastis dalam waktu singkat. Hal ini dapat menjadi tanda akan adanya penyakit
sistemik. Pada ayam petelur, terhentinya produksi telur sangat nyata. Secara
individual, ayam yang terkena HPAI sering hanya menunjukkan apatis dan imobilitas.
Pembengkakan nampak pada daerah kepala yang tidak ditumbuhi bulu, terjadi
sianosis pada jengger, gelambir dan kaki, diare dengan kotoran berwarna kehijauan,
dan susah bernafas, dapat dijumpai meskipun tidak selalu (inkonsisten). Pada ayam
petelur, awalnya telur yang dihasilkan berkulit lembek, tetapi kemudian produksi
telur berhenti secara cepat sejalan dengan perkembangan penyakit (Elbers et al. 2005).
Gejala sistem saraf termasuk tremaor, tortikolis, dan ataxia mendominasi gambaran
klinis pada spesies yang tidak begitu rentan seperti bebek, angsa, serta burung onta.
Vaksin dan Vaksinasi Terhadap Penyakit Avian Influenza
Vaksinasi bertujuan untuk memberikan perlindungan terhadap timbulnya
penyakit secara klinis. Perlindungan terhadap serangan virus yang virulen, merupakan
perlindungan terhadap ekskresi virus. Vaksinasi yang digunakan saat ini belum ada
yang secara eksperimental memenuhi persyaratan di atas (Lee & Suarez 2005).
Teknologi produksi vaksin untuk penyakit AI saat ini diarahkan ke tiga tipe
10
vaksin rekombinan homolog. Vaksin konvensional homolog H5N1, memiliki
homologi yang mirip virus lapang sehingga tidak terbentuk mutant akibat tekanan imunologis (Antigenic drift). Namun vaksinasi ini memiliki kelemahan antara lain
hingga saat ini bentuk virus H5N1 bersifat ganas sehingga pada proses produksinya
secara konvensional membahayakan. Vaksin konvensional heterolog H5N2, H5N9,
H5N1, dipakai pada vaksin konvensional karena sifatnya Low Pathogenic sehingga tidak berbahaya pada proses produksi vaksin dan dapat menghasilkan titer virus
tinggi. Namun vaksin konvensional heterolog memiliki kelemahan antara lain
antigenisitas tidak kompatibel (homologi yang mirip) sepenuhnya terhadap virus
lapang sehingga besar kemungkinan terbentuk mutant akibat tekanan imunologis (Antigenic drift). Vaksin rekombinan homolog memiliki kelebihan dapat
menginduksi imunitas seluler dan humoral, tidak menimbulkan reaksi sakit akibat
vaksinasi, tidak memerlukan adjuvan, lebih effektif dan efisien, dapat diberikan pada
anak ayam umur muda. Pembedaan antara hewan terinfeksi atau divaksinasi lebih
nyata secara klinis. Namun vaksin rekombinan homolog juga memiliki kelemahan
antara lain kemampuan bereplikasi yang rendah dan menginduksi kekebalan parsial
pada unggas, pemberian vaksin rekombinan juga berarti memaparkan vaksin atau
virus vektornya. Efek antibodi asal juga dapat mempengaruhi efikasi vaksin, sampai
saat ini efikasi vaksin perlu diteliti terlebih dahulu, serta penggunaan vaksin tersebut
harus dibatasi untuk spesies tertentu.
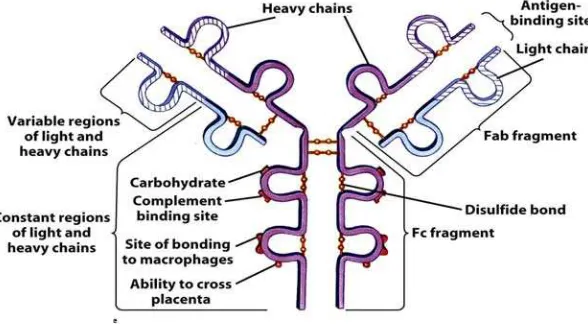
Antibodi
Hewan yang terpapar oleh suatu antigen, akan membentuk respon kekebalan
pada tubuh hewan tersebut. Respon humoral tubuh yang terinfeksi menghasilkan
antibodi. Antibodi merupakan molekul protein yang diproduksi oleh sel B dan saling
berhubungan secara spesifik dengan molekul asing (antigen).
Molekul antibodi merupakan globulin, sehingga umumnya dikenal sebagai
immunoglobulin (Ig). Dikenal 5 kelas utama imunoglobulin dalam serum, IgG, IgA,
yang identik dan 2 rantai ringan (L-chain) yang juga identik. Setiap rantai ringan
terikat pada rantai berat melalui ikatan disulfida (S – S). Fragmen Fab dengan antigen
binding site, berfungsi mengikat antigen, karena itu susunan asam amino dibagian ini berbeda antara molekul imunoglobulin satu dengan yang lain dan bervariasi sesuai
dengan variabilitas antigen yang merangsang pembentukannya. Sebaliknya fragmen
Fc merupakan fragmen yang konstan. Fragmen ini tidak mempunyai kemampuan
mengikat antigen tetapi dapat bersifat sebagai antigen (Determinan antigen).
Fragmen ini merupakan efektor sekunder dan menjadi tempat untuk melekat pada sel,
fiksasi komplemen, Ig menembus plasenta.
Gambar 3 . Struktur Antibodi (Jacquelyn 2005)
Fungsi antibodi sebagian besar ditentukan oleh spesifitas antigen binding site
dan isotype H-chain. Subkelas yang berbeda menunjukkan perbedaan pula dalam hal
kemampuan berikatan dengan reseptor Fc, komplemen dan reseptor lain . IgG, IgA
dan IgE mempunyai afinitas terhadap antigen yang lebih tinggi dibanding IgM,
walaupun hal ini juga bergantung pada pematangan (maturasi) afinitas yang
bersaingan dengan Class switching pada sel B dan tidak ada hubungannya dengan domain terminal – C. Dalam tubuh terdapat 2 bentuk imunoglobulin yang berbeda,
yaitu sebagai reseptor permukaan untuk antigen dan sebagai antibodi yang
disekresikan kedalam cairan ekstraselular. Antibodi yang disekresikan dapat
12
binding-sitenya yang spesifik. Agar terjadi proses netralisasi, antigen harus dikenal oleh antibodi. Bagian antibodi yang dikenal atau bereaksi dengan antibodi disebut
epitop, sedangkan bagian antibodi yang dapat mengenal antigen disebut paratop.
Bentuk Alami Dari Reaksi Antibodi Antigen
Studi X-ray crystallography dari interaksi antibodi antigen menunjukkan
adanya sebuah bentuk celah lewat tempat gabungan antibodi pada jaring determinan
antigen. Selanjutnya konsep reaksi antibodi antigen merupakan sebuah kunci (yaitu
antigen) yang cocok masuk dalam sebuah gembok (yaitu antibodi) (Li et al. 2000).
Ikatan antibodi antigen mempengaruhi antigen pada lokasi kombinasi semua
antibodi non-kovalen dalam bentuk alaminya, diantaraya termasuk ikatan hidrogen,
ikatan elektrostatik, kekuatan Van der waals serta ikatan hidrofobik. Banyaknya ikatan diantara antigen dan antibodi yang terjadi menyebabkan antigen menjadi
berbentuk seperti papan bagi antibodi. Sejak terjadi reaksi antibodi antigen melalui
ikatan non kovalen, maka dikatakan sebagai bentuk reversibel alami.
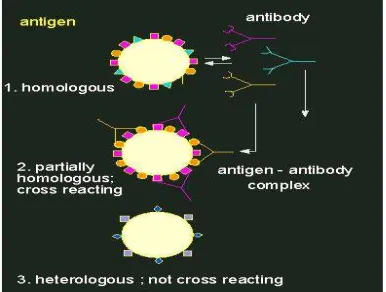
Gambar 4. Bentuk alami reaksi antibodi antigen (Li et al. 2000)
Bentuk antibodi (digambarkan dengan struktur Y) berbeda jenisnya untuk
populasi antibodi dengan antigen asing hanya terjadi, jika terdapat homologi dengan
antigen asing. Setiap antibodi mempunyai dua tempat penanda ikatan untuk
determinan antigen.
Gambar 5. Reaksi antibodi - antigen (Peter 2007)
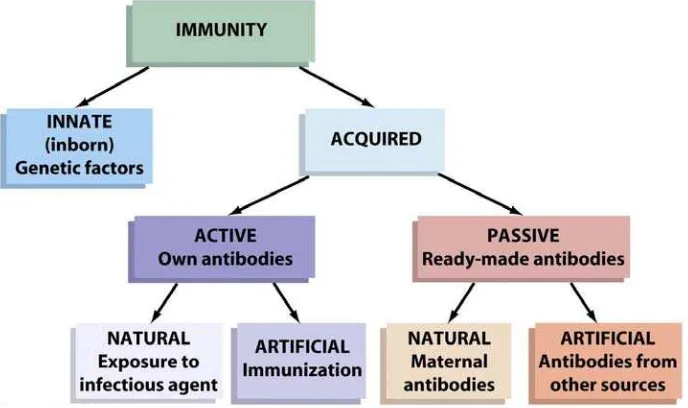
Imunisasi Pasif
Pertahanan tubuh dibagi dua, yaitu pertahanan tubuh non spesifik dan
pertahanan tubuh spesifik. Sistem pertahanan tubuh non spesifik merupakan sistem
pertahanan tubuh yang melindungi dari berbagai ancaman penyakit secara umum.
Sistem pertahanan non spesifik berupa kulit, mukosa, mukus dan silia pada saluran
pernapasan. Selain itu pertahanan non spesifik juga berupa fagositosis, sistem
komplemen dan sel pembunuh. Sistem pertahanan tubuh spesifik, berkaitan dengan
adanya respon kekebalan tubuh berperantara seluler maupun humoral.
Respon kekebalan tubuh humoral dapat bersifat aktif maupun pasif. Sistem ini
mampu mengenali antigen sebagai benda asing, mempunyai spesifitas tertentu serta
memori terhadap antigen. Respon kekebalan tubuh yang bersifat aktif dapat diperoleh
sebagai hasil vaksinasi, dan paparan materi yang berkaitan dengan respon kekebalan
humoral aktif seperti antigen. Kekebalan aktif timbul karena adanya vaksinasi oleh
karena tubuh secara aktif membentuk setelah diberikan rangsangan oleh vaksin
14
vaksinasi disebut sebagai kekebalan aktif buatan. Sementara antibodi yang terbentuk
setelah menderita suatu penyakit infeksi disebut kekebalan aktif alami
Respon kekebalan tubuh yang bersifat pasif merupakan hasil transfer atau
perolehan kekebalan asal induk. Perolehan kekebalan pasif yang didapatkan anak
ayam dari induknya biasanya tidak seragam. Kekebalan yang diperolehnya
tergantung dari titer antibodi induk dan akan habis dalam waktu relatif singkat.
Imunisasi pasif terjadi apabila tubuh diberikan zat kekebalan yang sudah jadi dari luar
berupa suntikan serum (Nadasul 2003). Pada kasus infeksi Avian influenza penting diberikan zat kekebalan yang sudah jadi untuk kasus infeksi pada ayam broiler yang
masa produksinya pendek (rata-rata umur panen 35 hari). Kasus lain penggunaan
kekebalan pasif contohnya pada penggunaan serum kuda anti rabies (SAR) yang
mengandung imunoglobulin spesifik anti rabies. Di Selandia Baru saat ini
dikembangkan penggunaan kekebalan pasif sebagai imunoterapi pasif dengan
memproduksi antibodi anti HIV, dimana antibodi terhadap HIV tersebut diambil dari
serum kambing (Daniel 2007).
Uji Netralisasi Virus
Uji netralisasi virus dapat digunakan untuk mengukur titer antibodi secara
kuantitatif. Selain itu uji netralisasi dilakukan juga dalam idetifikasi virus yang tidak
diketahui dengan menggunakan antisera yang sudah diketahui. Uji netralisasi terdiri
dari dua tahap. Tahap pertama adalah virus dengan titer tertentu direaksikan dengan
serum pada beberapa titer tertentu didalam sebuah tabung uji. Campuran virus dan
serum diinkubasi bersama pada temperatur standar untuk jangka waktu tertentu.
Tahap kedua, dilakukan pembiakan virus-virus yang tidak ternetralisasi ke sistem
indikator (media biakan). Setelah diinkubasikan dilakukan pengamatan terhadap
hasil pembiakan.
Serum yang akan diuji netralisasi harus disterilkan dahulu, bebas bahan kimia
dalam penyimpanannya (phenol, formalin dan lainnya), serta telah diinaktivasi.
Inaktivasi dilakukan dengan pemanasannya 56 0C selama 30 menit, pemanasan tersebut akan merusak substansi nonspesifik penghambatnya yang menghambat
reaksi Ab dengan virus.
Strain virus yang digunakan untuk uji netralisasi harus mempunyai titer yang
tinggi, tidak serumpun dengan virus uji, serta adaptasinya sangat baik dengan metode
yang digunakan. Virus yang digunakan juga harus murni dan bebas dari bakteri, fungi,
atau mikoplasma. Sebagai pelarut dapat digunakan media kultur sel.
Prosedur uji netralisasi yang digunakan atau dikenal saat ini yaitu prosedur uji
netralisasi- dan prosedur uji netralisasi-α (Swayne et al. 1998). Pada uji netralisasi
- , serum yang diuji diencerkan secara seri atau desimal dan virus standarnya bertiter
tetap. Uji ini memiliki keuntungan yaitu volume serum uji yang digunakan sedikit.
Pada uji netralisasi-α virus diencerkan secara serial serta diencerkan dengan serum
tetap pada titer tertentu (tampa pengencer). Campuran virus dan serum diinkubasi
dan dihitung untuk residual virus yang terkandung didalamnya yang dinyatakan
16
Titrasi Virus
Titrasi virus diperlukan untuk kepentingan diagnosis, diantaranya untuk
menghitung jumlah infektif virus dalam suatu material sampel. Ada beberapa metode
yang digunakan untuk menghitung perkiraan jumlah (kuantitatif) virus antara lain
nilai akhir pengenceran (dilution end-point), menghitung jumlah plak (Plaque counts),
atau jumlah pock (Pock plaque). Nilai akhir pengenceran (dilution end-point)
merupakan metode yang banyak digunakan. Perhitungan ini melibatkan dosis virus
yang dibutuhkan untuk menginfeksi 50% populasi inang (hewan, telur, kultur
jaringan) (Swayne et al. 1998). Titer dihitung ditandai dengan ID50 atau LD50 untuk
tingkat infeksi atau kematian melalui pengenceran serial dari virus. Pengenceran
serial ini kemudian diinokulasi pada sebuah Telur Ayam Berembrio (TAB) serta
dilakukan pengamatan jumlah respon positif dan negatif. Dari hasil uji,
dimungkinkan untuk menghitung 50% end-point dengan metode Reed and Muench.
Respon atau nilai akhir (end-point) yang digunakan akan bervariasi dengan virus
yang diuji. Namun diperlukan juga melihat kehadiran infeksi virus oleh faktor lain
misalnya adanya lesi, munculnya virus akibat pewarnaan, hemagglutinasi atau
lainnya.
Titrasi virus pada biakan jaringan biasanya dibuat dengan pengenceran virus
atau efek cytophatogenic (kematian sel-sel tampa formasi plak). Metode plak sangat penting digunakan karena satu infeksi virus memberikan satu plak, jumlah plak pada
pengenceran tertentu akan menghasilkan jumlah total partikel. Penghitungan jumlah
METODELOGI PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Terpadu Departemen Ilmu
Penyakit Hewan dan Kesehatan Masyarakat Veteriner FKH IPB, kandang hewan
percobaan FKH IPB. Penelitian dilaksanakan bulan Desember 2007 sampai dengan
bulan Juli 2008.
Metode Penelitian
Penelitian ini dilaksankan dalam beberapa tahap yaitu :
Tahap Satu : Titrasi Virus dengan Uji Haemaglutinasi (HA) mikrotitrasi dan Uji Egg Infectious Dose 50 (EID50)
Sebelum digunakan sebagai antigen penguji virus AI H5N1 isolat tahun 2003
- tahun 2006 dititrasi terlebih dahulu untuk mengetahui titer virusnya. Uji titrasi
dilakukan dengan uji HA mikrotitrasi dan EID50
Uji HA mikrotitrasi
Pada sumur pertama hingga duabelas plat mikrotiter ditambahkan 0,025 ml
PBS. Pada sumur pertama ditambahkan larutan virus yang akan diuji sebanyak 0,025
ml dan diaduk dengan mikrotiter pipet dengan menghisap dan menekannya secara
perlahan-lahan (sebanyak lima kali). Selanjutnya dari sumur pertama dipindahkan
0,025 ml ke sumur kedua dan diaduk seperti diatas dan dipindahkan ke sumur ketiga,
demikian seterusnya sampai sumur terakhir. Dengan demikian didapatkan
pengenceran seri virus kelipatan 2 (log 2). Pada setiap sumur pengenceran
ditambahkan 0,025 ml PBS, sehingga volume setiap sumur sama yaitu 0,050 ml.
18
(sdm) 0,5 %, kemudian plat digoyang secara manual digoyang dengan tangan selama
1 menit, lalu didiamkan. Hasil dibaca bila kontrol negatif (sumur tampa virus) sdm
nya telah mengendap dan kontrol positif (sumur yang berisi suspensi virus AI H5N1
yang diketahui) telah menunjukkan aktivitas hemaglutinasi sempurna sekitar dalam
waktu 30 - 45 menit. Titer HA adalah pengenceran tertinggi yang masih terjadi
hemaglutinasi sempurna.
Uji Egg Infectious Dose 50 (EID50)
Uji Egg Infectious Dose 50 (EID50) dilakukan dengan menggunakan telur
berembrio, PBS, tabung pengenceran, pipet 1 ml, isolat AI H5N1 koleksi FKH IPB
terpilih (tahun 2003-2006). Sebelum melakukan inokulasi di Telur Ayam Berembrio
(TAB) dibuat pengenceran virus secara desimal (dimulai dari 10-5 sampai 10 -12 ). Dengan teknik yang steril suspensi virus pada pengenceran 10 -5 sampai dengan 10 -12, diinokulasikan ke telur sebanyak 0,1 ml per butir dan tiap pengenceran
diinokulasikan ke 3 butir telur. Setelah inokulasi, telur diinkubasi pada suhu 37 0C selama 4 hari. Telur di candling (diamati) setiap hari dan telur yang mati setelah inkubasi dapat dilakukan pengujian terhadap cairan alantoisnya. Setelah empat hari
dilakukan uji cepat (Rapid test) pada semua telur untuk dihitung dosis infeksinya
terhadap 50% jumlah telur yang digunakan.
Perhitungan Nilai EID50
Nilai EID50 dihitung menggunakan metode Reed and Muench (Mohd et al.
2008). Tabel 1. tersaji prosedur perhitungan endpoint 50% untuk mengetahui nilai
Tabel 1. Perhitungan Endpoint 50%
I = jarak perbandingan h = faktor pengenceran
Tahap Kedua : Produksi Antibodi terhadap Avian Influenza H5N1 (Ab anti H5)
Produksi antibodi anti H5 menggunakan hewan coba marmut (Cavia
porcellus) lokal 8 ekor dengan berat kisaran 0,2 – 0,4 kg, dalam kondisi sehat. Vaksin yang digunakan produksi PT. Vaksindo berupa vaksin AI inaktif komersial H5N1
(Batch : 21666 PTP, ex. Date 2008). Produksi antibodi AI (antibodi anti H5)
dilakukan dengan menyuntik 0,3 ml suspensi vaksin secara intramuskuler dan diulang
(booster) dua minggu setelah penyuntikan pertama. Vaksinasi dilakukan sebanyak
tiga kali. Serum dikoleksi (panen) satu minggu setelah vaksinasi kedua.
Tahap Ketiga : Identifikasi dan Titrasi Antibodi
Antibodi anti H5 (antisera) yang diperoleh dari marmut diuji dan dititrasi
20
Uji Agar Gel Presipitasi (Uji AGP)
Agar gel dibuat dengan mencampur 0,4 gr Agarose, 1,2 gr Poly Ethylene
Glycol (PEG) 6000, 20 ml PBS (pH 7,6), serta 20 ml Aquades. Campuran atau
larutan ini dipanaskan dalam penangas air sampai larut dan warna larutan menjadi
bening. Kemudian larutan dipipet dengan pipet Mohr sebanyak 3,75 ml, dan
dituangkan diatas kaca objek. Agar didiamkan sampai beku. Selanjutnya agar
dilubangi dengan pelubang agar. Pada sumur tengah dimasukkan 25 ul antigen virus
AI H5N1 dan pada tepi disekelilingnya diteteskan masing-masing serum hasil
produksi pada cavia. Kaca objek ditempatkan di bak lembab yang dialasi dengan kertas buram yang lembab dan diinkubasi pada suhu ruang selama 24 – 48 jam.
Reaksi positip ditunjukkan dengan adanya garis presipitasi diantara sumur antigen
dan antibodi.
Uji HI (Haemagglutination Inhibition)
Uji HI dilakukan untuk mengetahui titer antibodi yang diperoleh dari marmut
menggunakan virus standart dari BBalitvet dan juga menggunakan virus isolat lapang
tahun 2003-2006 untuk melihat adanya perbedaan ekspresi antigen HA dari
masing-masing isolat virus yang diuji.
Pada tiap sumur plat mikrotiter dimasukkan 0,025 ml PBS. Selanjutnya 0,025
ml antibodi hasil produksi dimasukkan kedalam sumur pertama dan dihomogenkan
lalu dipindahkan 0,025 ml ke sumur kedua dan seterusnya hingga sumur ke 12. Pada
sumur terakhir diambil 0,025 ml dan dibuang. Virus atau antigen standart
ditambahkan isolat lapang sebanyak Empat HAU / 0,025 ml tiap sumur sebanyak
0,025 ml dan dibiarkan selama 30 menit pada temperatur kamar (20oC) atau 60 menit pada suhu 4oC. Selanjutnya kedalam tiap sumur ditambahkan 0,025 ml suspensi sel darah merah 0,5 %, kemudian dikocok perlahan agar homogen dan biarkan sekitar 40
lengkap 4 HAU antigen (OIE 2004). Aglutinasi dibaca dengan cara memiringkan plat.
Hanya sumur-sumur dengan kecepatan aliran sel darah merah yang sama dengan
sumur kontrol (mengandung 0,025 ml sel darah merah dan 0,025 ml PBS) yang
menunjukkan inhibisi.
Tahap Keempat : Uji SNT Prosedur -Netralisasi
Antisera (Ab anti H5) yang bertiter 29 diencerkan menjadi 28 ,27, 26, 25, 24 . Hasil dari masing-masing pengenceran diambil 1 ml kemudian ditambahkan 1 ml
titer 104 EID50 isolat lapang untuk uji netralisasi. Campuran virus dengan antibodi
anti H5 didiamkan dalam suhu kamar selama 30 menit kemudian diambil 0,2 ml
untuk diinokulasi ke TAB umur 9-11 hari (15 butir untuk masing-masing isolat uji
terpilih koleksi FKH IPB). Hari keempat dilakukan panen cairan alontoik hasil uji
netraliasi, kemudian dilakukan rapid test untuk dihitung endpoint netralisasi dan nilai
indeks netralisasi.
Interpretasi hasil; Tingkat infeksi virus dinyatakan dengan terjadi agglutinasi
dari cairan alantoik yang dipanen setelah dicampur dengan volume tertentu yang
sama dengan suspensi sel darah merah 5 %. Selanjutnya dilihat timbulnya reaksi
agglutinasi.
Perhitungan Indeks Netralisasi
Prosedur-Endpoint 50% dari netralisasi dihitung dengan metode Reed and Muench,
saat banyaknya residual virus diuji dengan banyaknya suatu respon. Indeks netralisasi
merupakan perhitungan dari nilai endpoint ini (Swayne et al. 1998). Untuk
masing-masing respon endpoint adalah pengenceran dari antibodi terhadap AI H5N1 ketika
22
HASIL DAN PEMBAHASAN
Titrasi Virus Isolat Uji
Berdasarkan hasil titrasi virus dengan uji Hemaglutinasi (HA) tampak bahwa
virus AI koleksi FKH IPB tahun 2003 – 2006 memiliki titer yang cukup tinggi (Tabel
2). Uji HA merupakan suatu uji untuk mengetahui keberadaan antigen virus yang
dapat mengaglutinasi sel darah merah (sdm) (WHO 2002). Reaksi aglutinasi ini dapat
dihalangi atau dihambat dengan antibodi spesifik terhadap antigen sehingga reaksi ini
digunakan sebagai dasar pada isolasi virus serta diferensiasi pada strain varian yang
sering muncul (Klasse & Sattentau 2002). Virus influenza mengandung dua antigen
glikoprotein pada permukaannya yaitu HA dan NA. HA secara spesifik mengandung
reseptor sialic acid pada permukaan selnya dan sebagai tempat untuk proses infeksi.
Reseptor ini hampir sama dengan reseptor permukaan yang ada pada membran
plasma sel darah merah, sehingga bilsa sel darah merah dicampur dengan virus
influenza dengan rasio sama akan dihasilkan jembatan antara sel darah merah dengan
virus sehingga terbentuk aglutinasi. Aglutinasi sempurna pada pengenceran tertinggi
dinyatakan sebagai endpoint dan memiliki titer 1 HAU (Hamaglutinasi Unit). 1 HAU
setara dengan 107 partikel virus.
Tabel 2. Titer virus Isolat Koleksi dengan Uji HA
Asal Isolat Terpilih Tahun Koleksi Titer Hasil HA Test
Bogor 2003 29
Bogor 2004 28
Tasik 2005 29
Cikole 2006 29
Uji HA menghitung jumlah virus baik yang telah mati (tidak infektif) maupun
virus yang masih hidup (infektif). Titrasi virus yang infektif dapat diukur
mampu menginfeksi 50% populasi embrio. Titer virus H5N1 dari isolat asal lapang
terpilih (Koleksi FKH IPB) dengan uji EID50 disajikan pada Tabel 3.
Tabel 3. Titer Virus dengan Uji EID50
Asal Isolat Terpilih Tahun Koleksi Log10 ID50
Bogor 2003 10 8,3 ID50/ml
Bogor 2004 10 10,8 ID50/ml
Tasik 2005 10 10,8 ID50/ml
Cikole 2006 10 11,8 ID50/ml
Uji EID50 merupakan uji titrasi virus yang dapat mengukur titer virus yang
hidup dalam suatu suspensi virus. Prinsip uji EID50 adalah menghitung dosis virus
yang dibutuhkan untuk menginfeksi 50% inang (hewan, telur, kultur jaringan)
(Swayne et al. 1998). Dosis ini ditandai dengan Infektious Dose 50 (ID50) atau Lethal
Dose 50 (LD50) untuk tingkat infeksi atau kematian, yang terjadi melalui pengenceran
virus dan diinokulasi pada telur ayam berembrio. Pengamatan atau hasil inokulasi
dilihat dengan jumlah respon positif dan negatif hasil uji cepat (Rapid test). Hasil uji
EID50 menunjukkan bahwa suspensi virus isolat terpilih FKH IPB masih hidup serta
memiliki titer yang cukup tinggi serta layak digunakan sebagai virus uji.
Produksi Antibodi
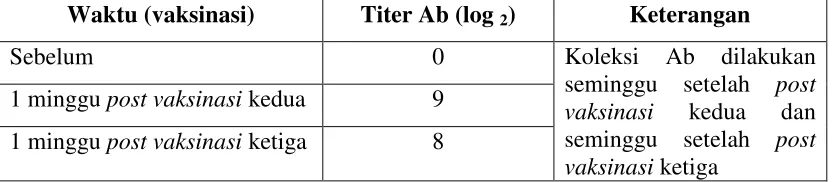
Marmut (Cavia porcellus) yang divaksinasi sudah mampu memproduksi
antibodi terhadap Avian influenza H5N1 satu minggu setelah vaksinasi kedua. Antisera anti H5 yang dikoleksi memiliki titer 29. Koleksi Antibodi terhadap H5 (antibodi anti H5) dilakukan dua kali. Koleksi kedua dilakukan seminggu setelah
re-vaksinasi ketiga. Vaksinasi kedua dilakukan setelah seminggu koleksi antibodi anti
H5. Waktu vaksinasi dan koleksi Ab anti H5 serta titer Ab anti H5 dengan uji HI
menggunakan antigen standar dari BBalitvet dari hasil produksi disajikan pada Tabel
24
Tabel 4. Waktu Vaksinasi serta Respon Titer Ab anti H5 Koleksi pada Kelompok
…………Marmut
Waktu (vaksinasi) Titer Ab (log 2) Keterangan
Sebelum 0 Koleksi Ab dilakukan
seminggu setelah post vaksinasi kedua dan seminggu setelah post vaksinasi ketiga
1 minggu post vaksinasi kedua 9
1 minggu post vaksinasi ketiga 8
Identifikasi Serum Kebal (Antibodi Anti H5)
Hasil koleksi serum kesatu marmut (Cavia porcellus) mampu menghasilkan
antibodi anti H5 (antisera anti H5) dengan titer yang tinggi yaitu 29 dengan menggunakan antigen standar H5N1 dari BBalitvet. Marmut dipilih sebagai hewan
percobaan berdasarkan referensi data dari National Institute of Health Primate
Research Centers tahun 1978, bahwa syarat utama dalam pemilihan hewan percobaan
yang sesuai dan dapat dipakai sebagai model adalah adanya kemiripin proses yang
terjadi antara manusia dengan hewan percobaan (Sulaksono 1992). Disamping itu
marmut merupakan hewan percobaan yang mudah didapat, dikembang-biakkan dan
relatif murah harganya. Hewan percobaan banyak digunakan untuk penelitian
biomedis. Percobaan biomedis dapat berupa Bio assay dari produk biologi (vaksin, sera, hormon, vitamin dan sebagainya) yang meliputi dosis efektif, efek samping
(safety test), pemeriksaan keracunan (toxicity test).
Produksi antibodi pada hewan yang divaksinasi dipengaruhi oleh beberapa
faktor, di antaranya adalah umur hewan, ukuran molekul antigen, kerumitan struktur
kimiawi antigen, konstitusi genetik, metode pemasukan antigen dan dosis yang tepat
dapat menginduksi terbentuknya antibodi yang lebih baik (Liddell & Weeks 1995).
Pengikat antara antigen dan antibodi memerlukan struktur yang cocok antara
keduanya (Kennedy 1985). Identifikasi serum kebal (antibodi anti H5) dengan uji
imunodifusi Agar Gel Presipitation (AGP) menunjukkan reaksi positif dengan Ag AI
standar, hal ini menunjukkan adanya homologi antara Ag dengan Ab yang
yang berdifusi ke agar memiliki kecocokan atau homolog dengan Ag akan berikatan
dengan Ag yang berdifusi dalam agar sehingga terlihat berupa garis presipitasi.
Gambar 7. Garis presipitasi pada uji AGPT menunjukkan adanya reaksi
………....homolog antara Ab anti H5 dengan Ag referensi BBalitvet
………Ket. 1 = Ag referensi BBalitvet, 2 = serum (Ab anti H5)
Titrasi Antibodi Anti H5
Antisera anti H5 yang diperoleh dititrasi menggunakan virus Avian influenza
H5N1 asal lapang terpilih koleksi FKH IPB tahun 2003-2006. Berdasarkan hasil
titrasi dengan uji HI tampak adanya variasi titer antibodi terhadap virus uji. Adanya
variasi titer menunjukkan bahwa terdapat perubahan struktur antigenik dari antigen
hemaglutinin masing-masing isolat. Uji HI memiliki sensitivitas tinggi karena pada
uji ini antibodi spesifik terhadap hemaglutinin virus AI tertutup oleh paratop dari
antibodi sehingga menghambat adanya aglutinasi. Nilai HI terhadap isolat koleksi
tersaji pada Tabel 5.
Tabel 5. Nilai HI test terhadap Isolat Koleksi FKH IPB (Isolat Terpilih)
Asal Isolat Terpilih Tahun Koleksi Titer Hasil HI Test
Bogor 2003 28
Bogor 2004 29
Tasik 2005 26
Cikole 2006 25
2
2 2
2 1
2 2
26
Protein hemaglutinin (HA) dan neuramidase (NA) yang terdapat pada amplop
virus menjadi tumpuan dasar yang berperan pada uji HI dalam melaksanakan
diagnosa virus AI H5N1. Kedua protein ini menjadi target awal dalam pembentukan
antibodi inang. Pada awal infeksi, protein ini akan berikatan dengan reseptor sel
inang dan melepaskan ribonukleoprotein (RNP). Akibat dari aktivasi prekursor HA
(HA0) oleh protease inang atau inang, protein akan terbelah menjadi HA1 dan HA2.
Protein HA1 akan berikatan dengan reseptor dan merupakan target utama untuk
timbulnya respon imun, sedangkan protein HA2 akan memfasilitasi fusi antara
amplop virus dengan membran endosomal inang (Suzuki & Nei 2002). Perbedaan
kepekaan protein HA virus AI terhadap protease inang akan berhubungan dengan
tingkat virulensi virus. Virus yang termasuk dalam kelompok HPAI mempunyai
hemaglutinin yang sangat peka terhadap protease endogen atau seluler inang
(Alexander 2000). Protein hemaglutinin dan neuraminidase juga dapat berubah
secara periodik akibat Antigenic drift dan Antigenic shift. Perubahan antigen permukaan ini merupakan mekanisme virus dalam menghindari respon imun inang
(Munch et al. 2001).
Uji Netralisasi Virus
Antisera meskipun memiliki titer Ab yang tinggi menjadi tidak bermanfaat
bila tidak mampu menetralisasi antigen (virus). Uji netralisasi merupakan uji untuk
identifikasi Antigen / Antibodi dan merupakan uji yang mampu melihat kemampuan
netralisasi Ab terhadap Ag. Hasil uji netralisasi antisera anti H5 terhadap berbagai
Tabel 6. Uji Netralisasi Isolat Tahun 2003 dengan Metode Reed and Muench
Pengenceran serum Tingkat
infeksi Respon Nilai akumulasi
%
Ket. a adalah jumlah terinfeksi diatas jumlah diinokulasi (jumlah percobaan)
PD = 50 – 33 = 17 = 0,25
100- 33 67
Penguraian dari 50% endpoint netralisasi = 0,25 X (-1,5 – (-1,2) – (-1,2)
= - 0,25 X 0,3 – 1,2 = - 1,275 = - 1,3
Endpoint 50% netralisasi adalah 10 -1,3 atau 1: 20. Netralisasi indeks (NI) adalah 1,3
28 27 26 25 24
Gambar 8. Reaksi agglutinasi hasil uji netralisasi untuk isolat tahun 2003
28
Tabel 7. Uji Netralisasi untuk Isolat Tahun 2004 dengan Metode Reed and Muench
Pengenceran serum Tingkat
infeksi Respon Nilai akumulasi
%
Ket. a adalah jumlah terinfeksi diatas jumlah diinokulasi (jumlah percobaan)
PD = 50 - 0 = 50 = 0,75
67 - 0 67
Penguraian dari 50% endpoint netralisasi = 0,75 X (-1,2 – (-0,9) – (-0,9)
= - 0,75 X 0,3 – 0,9 = - 1,125 = - 1,1
Endpoint 50% netralisasi adalah 10 -1,1 atau 1: 13. Netralisasi indeks (NI) adalah 1,1
28 27 26 25 24
Gambar 9. Reaksi agglutinasi hasil uji netralisasi untuk isolat tahun 2004
Tabel 8. Uji Netralisasi untuk Isolat Tahun 2005 dengan Metode Reed and Muench
Pengenceran serum Tingkat
infeksi Respon Nilai akumulasi
%
Ket. a adalah jumlah terinfeksi diatas jumlah diinokulasi (jumlah percobaan)
PD = 50 – 33 = 17 = 0,25
100- 33 67
Penguraian dari 50% endpoint netralisasi = 0,25 X (-1,5 – (-1,2) – (-1,2)
= - 0,25 X 0,3 – 1,2 = - 1,275 = - 1,3
Endpoint 50% netralisasi adalah 10 -1,3 atau 1: 20. Netralisasi indeks (NI) adalah 1,3
28 27 26 25 24
Gambar 10. Reaksi agglutinasi hasil uji netralisasi untuk isolat tahun 2005
30
Tabel 9. Uji Netralisasi untuk Isolat Tahun 2006 dengan Metode Reed and Muench
Pengenceran serum Tingkat
infeksi Respon Nilai akumulasi
%
Ket. a adalah jumlah terinfeksi diatas jumlah diinokulasi (jumlah percobaan)
PD = 50 – 33 = 17 = 0,25
100- 33 67
Penguraian dari 50% endpoint netralisasi = 0,25 X (-1,5 – (-1,2) – (-1,2)
= - 0,25 X 0,3 – 1,2 = - 1,275 = - 1,3
Endpoint 50% netralisasi adalah 10 -1,3 atau 1: 20. Netralisasi indeks (NI) adalah 1,3
28 27 26 25 24
Gambar 11. Reaksi agglutinasi hasil uji netralisasi untuk isolat tahun 2006
Netralisasi pada virus merupakan gagalnya infeksi virus secara in vitro
akibat adanya antibodi yang mengikat antigen sehingga antigen target tidak mampu
menempel pada reseptor sel. (Dimmock 1984). Pengumpulan virion oleh antigen
binding site dari Ab dapat mempengaruhi tingkat infektif, hal ini ditunjukkan dengan adanya CPE pada kultur sel sebagai media uji (Mandel 1978).
Antibodi mengikat bagian permukaan virus dan netralisasi uji atau
menghambat interaksi dengan sel inang. Antibodi menghalangi infeksi virus saat
virus menempel pada permukaan inang, penetrasi virus dalam sel serta pada saat virus
melepaskan selubung pembungkus di dalam sel inang.
Dari hasil uji netralisasi terhadap isolat tahun 2003, 2004, 2005 dan 2006
diketahui bahwa Ab yang diproduksi mampu menetralisasi namun indeks
netralisasinya rendah yaitu pada titer 28 dapat menetralisasi 100% virus dengan titer 104 EID50 , indeksnetralisasi antisera terhadap virus isolat tahun 2003, 2005 dan tahun
2006 adalah1,3, sedangkan terhadap isolat tahun 2004 indeks netralisasinya adalah
1,1. Hasil ini berbeda dengan temuan Wibawan et. al (2008) yang menyatakan bahwa Ab anti H5 dari unggas (IgY) dapat menetralisir virus dengan titer 104 EID50
secara sempurna pada titer 24. Berdasarkan rekomendasi OIE (2004) menyatakan bahwa pada unggas titer antibodi terhadap AI dikatakan protektif bila memiliki titer
lebih dari 23. Dari hasil penelitian juga menunjukkan titer antibodi mamalia (marmut) memiliki kemampuan efikasi lebih rendah dibanding antibodi asal unggas. Hal ini
mungkin disebabkan adanya perbedaan konformasi antibodi mamalia (IgG) dengan
antibodi unggas (IgY). Perbedaan utama IgG dan IgY diantaranya, IgG memiliki
jumlah antibodi/minggu 200 mg IgG/darah (dalam 40 ml darah) sedangkan IgY
50-100 mg IgY/ telur. Perbedaan lain IgG memiliki jumlah antibodi spesifik 5%,
sedangkan IgY hanya 2-10% (Wibawan et al. 2003). Perbedaan konsentrasi ini yang
32
SIMPULAN DAN SARAN
Simpulan
Serum koleksi yang diproduksi dari marmut (Cavia porcellus) lokal sebagai
antibodi anti H5 (antisera anti H5) memiliki kemampuan menetralisasi virus asal
isolat lapang dengan angka Indeks Netralisasi antara 1,1 – 1,3
Terdapat perbedaan ekspresi biologis antigen hemaglutinin (H5) virus AI
H5N1 diantara isolat lapang dari tahun 2003 sampai 2006.
Saran
Perlu dilakukan penelitian lanjutan kemampuan biologis IgG yang diperoleh
DAFTAR PUSTAKA
Alexander DJ. 2000. A review of Avian Influenza in Different Bird Species. Vet Microbiol 74 : 3-13.
[Bappenas] Badan Perencanaan Pembangunan Nasional. 2005. Strategi Nasional Kesiagan Menghadapi Pandemi Influenza. Rencana Strategis 2006-2008. Bappenas. Hal 9-22.
Both GW, Sleigh M.J. 1981. Conservation and Variation in the Hemagglutinin of the Hong Kong Subtype Influenza Virus During Antigenic Drift. Journal of Virology. Hal. 663-672. Vol. 39 No.3.
Capua I, Mutinelli F, Marangon S, Alexander DJ. 2000. H7N1 avian influenza in Italy (1999- 2000) in intensively reared chicken and turkeys. Av Pathol. 2000; 29: 537-43.
Capua I, Mutinelli F. 2001. Low pathogenicity (LPAI) and highly pathogenic (HPAI) avian influenza in turkeys and chicken. In: Capua I, Mutinelli F. (eds.), A Colour Atlas and Text on Avian Influenza, Papi Editore, Bologna, 2001. Hal. 13-20.
Dimmock NJ. (1984). Mechanisms of neutralization of animal viruses. Journal of General Virology 65, 1015–1022.
Daniel SB. 2007. Immune-Based Treatments Against HIV.
http://tpan.com/publications/pa/07_03/buzz.shtml. [28-4-.2008].
Elbers AR, Koch G, Bouma A. 2005. Performance of clinical signs in poultry for the detection of outbreaks during the avian influenza A (H7N7) epidemic in The Netherlands in 2003. Avian Pathol 2005; 34: 181-7.
Easterday, BC , Hinshaw VS. 1991. Avian Influenza. In: Diseases of Poultry 9th ed. . Iowa State University Press Ames, Iowa. USA. Hal. 532-551.
Easterday, BC, Hinshaw VS, Halvorson, DA. 1997. Influenza. Disease of Poultry. 10th ed. Iowa State University Press Ames, Iowa. USA. Hal. 532-551.
Ferguson NM, Galvani AP, Bush RM. 2003. Ecological and Immunological determinants of influenza evolution. Nature. ; 422: 428-33.
34
influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls. J Virol. 79(5):2814-22.
Garman E, Laver G. 2004. Controlling influenza by inhibiting the virus's
neuraminidase. Curr Drug Targets.5: 119-36. Abstract:
http://amedeo.com/lit.php?id=15011946. [24-3-2008].
Harder TC, Werner O. 2006. Avian Influenza. Influenza Report. In : Influenza Report. Eds : Bernd, SK, Hoffmann C, and Preiser. Flying Publiser. Paris, Cagliari, Wuppertal, Sevilla. [28-4-.2008].
Jacquelyn GB. 2005. Microbiology: Principles and Explorations. Sixth Edition. Chapter 17: Immunology I: Basic Principles of Adaptive Immunity and Immunization. Fig.17-7. Hal 6/e.
Kennedy RC. 1985. Idiotypic Networks in Hepatitis B Virus Infections. Microbiology and Immunology. Vol. 119. Spinger-Verlag Berlin. Heidelberg. Hal. 811-816.
Klasse PJ and Sattentau QJ. 2002. Occupancy and Mechanism in Antibody-mediated Neutralization of Animal Viruses. Journal of General Virology . 83: 2091– 2108.
Lee CW, Suarez DL. 2005. Avian Influenza Virus: prospects for prevention and control by vaccination. Anim Health Res Rev; 6: 1-15.
Li Y, Li H, Smith-Gill, SJ, Mariuzza RA. 2000. Ag-Ab Reactions. Biochemistry 39, 6296, 2000.
Liddell E, Weeks I. 1995. Antibody Technology. JM. Graham dan D. Billington (Ed.). BIOS Scientific Publisher Ltd, Oxford, UK.
Mandel B. 1978. Neutralization of animal viruses. Advances in Virus Research 23, 205–268.
Matrosovich MN, Matrosovich TY, Gray T, Roberts NA, Klenk HD. 2004. Neuraminidase is important for the initiation of influenza virus infection in
human airway epithelium. J Virol. 78: 12665-7. Abstract:
http://amedeo.com/lit.php?id=15070767. [28-4-.2008].
Mohd AL, Isa AK, Osman RE. 2008. Laboratory Manual. Diagnostic Virology. Http:/www.vet.upm.edu.my/~virolab/. 2008. [24-3-2008].
Nadesul H. 2003. Lawan Virus dengan Kekebalan Tubuh. http://www.freshwell.com
–. [20-3-2008].
Neuman G, Hatta M, Kawaoka Y. 2003. Reverse Genetics for the Control of Avian Influenza. Avian Diseases 47:882–887.
[OIE] Office International des Epizooties. 2004. Manual of Standards for Diagnostic Tests and Vaccines. Hal. 212- 219.
[OIE] Office International des Epizooties. 2005. Highly pathogenic avian influenza in Mongolia: in migratory birds. http://www.oie.int/eng/info/hebdo/ais_55.htm. [ 24-3-2008].
Paul H. 2003. Swine Influenza : a zoonosis [editorial]. Publised by Igitur. 2003. [24-3-2008].
Peter VS. 2007. Antigen-Antibody Reaction. Http;//www. Botani Online. [20-3-2008].
Rott R, Klenk HD, Nagai Y, Tashiro M. 1995. Influenza viruses, cell enzymes, and pathogenicity. Am J Respir Crit Care Med. 152: S16-9. Abstract: http://amedeo.com/lit.php?id=7551406. [28-4-.2008].
Rust MJ, Lakadamyali M, Zhang F, Zhuang X. 2004. Assembly of endocytic machinery round individual influenza viruses during viral entry. Nat Struct Mol Biol 2004; 11: 567-73. Abstract: http://amedeo.com/lit.php?id=15122347. [20-2-2005].
Soejoedono RD, Handharyani E. 2005. Flu Burung . Jakarta. Penebar Swadaya. Hal. 31.
Sulaksono E. 1992. Peranan, Pengelolaan dan Pengembangbiakan Hewan Percobaan. Pusat Penelitian Penyalit Menular, Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan RI. Jakarta. Cermin Dunia Kedokteran No. 75, 1992 53.
Suzuki Y, Nei. 2002. Origin and Evolution of Influenza Virus Haemagglutinin Genes. Mol Bio Evol 19: 501-509.
Swayne DE, John CR, Jackwood WM, Reed MW. 1998. Isolation and Identification of Avian Pathogens. Fourth Edition. 255-265.