DENGAN METODE IMUNOHISTOKIMIA
KUSUMA SRI HANDAYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Distribusi Virus Avian Influenza
(H5N1) pada Jaringan Tubuh Itik dengan Metode Imunohistokimia adalah karya
saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk
apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
tesis ini.
Bogor, Januari 2009
KUSUMA SRI HANDAYANI. The Distribution of Avian Influenza (H5N1)
Virus in the Duck Tissues Using Immunohistochemistry Method. Under direction
of RETNO D. SOEJOEDONO and EKOWATI HANDHARYANI.
Twelve female, four and six- month-old ducks were used in this research. The
ducks were placed individually in biosafety-level-3 cages, and devided into four
treatments groups. Control group is placed on the different place. After passed the
adaptation processed, group I were given with inactive vaccine on the third day.
Furthermore on the 6
thday, all ducks group I, II, and III are challenged with Avian
Influenza/AI virus (H5N1, 10
4EID50, FKH/IPB/Duck/NG29) for each duck. The
clinical examination indicated that on the 11
thday post infection, all ducks had
already showed clinical symptom as sinusitis, conjunctivitis and white colored
diarrhea. Necropsy procedure was performed followed by histopathological
examination by using hematoxylin and eosin stain, and continued with
immunohistochemistry method. Histopathological examination showed the
existence of varieties in
lymphocyte infiltration level especially around blood
vessel, hyperemia and congestion.
Immunohistochemistry investigation in group
I showed the existence of mildly (+) H5N1 antigen in lungs, heart, pancreas,
spleen, kidney, ovary, and isthmus. Trachea and intestines showed moderate
immunoreactivities (++). There was no H5N1 antigen was found in chest and
thigh muscles. Group II and III demonstrated that H5N1 antigen were found
within lungs, heart, pancreas, spleen, kidney, liver, chest muscle, ovary, and
isthmus in mild and moderate degrees, whereas high degree were found in trachea
and intestines. The conclusion of this research indicated that H5N1 virus can be
detect in various immunoreactivities within duck tissues. H5N1 virus is able to
spread systemically and influence many organs of ducks in various degrees.
RINGKASAN
KUSUMA SRI HANDAYANI.
Distribusi Virus Avian Influenza (H5N1) pada
Jaringan Tubuh Itik dengan Metode Imunohistokimia. Dibimbing oleh RETNO D.
SOEJOEDONO dan EKOWATI HANDHARYANI.
Penelitian ini bertujuan untuk mengetahui distribusi virus H5N1 pada
jaringan tubuh itik melalui deteksi antigen spesifik dengan menggunakan metode
imunohistokimia dan mempelajari keterkaitan antara keberadaan virus AI dengan
keamanan pangan daging itik sebagai ternak konsumsi.
Menggunakan hewan percobaan 12 ekor jenis itik tegal yang diperoleh
dari peternakan di Cirebon umur 4 bulan dan 6 bulan (telah berproduksi). Itik
dikadangkan secara individual yang dibagi dalam empat kelompok perlakuan.
Setiap perlakuan terdiri atas 3 ekor itik. Kelompok kontrol ditempatkan dalam
ruang yang berbeda dengan kelompok perlakuan lainnya. Setelah melalui proses
adaptasi, pada kelompok perlakuan I dilakukan pemberian vaksin inaktif dengan
dosis 0,5 ml/ ekor pada hari ke 3. Selanjutnya pada hari ke 6 pada kelompok
perlakuan I, II dan III semua itik ditantang dengan virus AI
(H5N1)(FKH/IPB/Duck/NG29) dengan dosis 10
4EID50 per ekor. Pada hari ke 11
semua itik telah menunjukkan gejala klinis berupa sinusitis, konjungtivitis dan
diare berwarna putih. Selanjutnya dilakukan nekropsi dan pengambilan sampel
organ trakea, paru-paru, jantung, hati, limpa, ginjal, pankreas, usus, otak, ovarium,
isthmus otot dada dan otot paha. Dimasukkan dalam buffered Neutral Formalin
(BNF) 10%. Tahap selanjutnya pembuatan blok parafin dan dilanjutkan dengan
pembuatan preparat untuk pewarnaan Hemaktosilin dan Eosin/HE dan
imunohistokimia. Hasil positif dinyatakan positif (+) apabila terdapat warna
merah kecoklatan dan negatif jika warna tersebut tidak terdeteksi, data yang
diperoleh dianalisis dengan menggunakan Kruskal Wallis.
Pada penelitian ini dari hasil pengamatan histopatologi dengan metode
HE, pada beberapa organ seperti trakea, paru-paru, limpa, hati, usus, pankreas,
ginjal, ovarium, dan isthmus menunjukkan adanya berbagai tingkatan infiltrasi
limfosit yang terutama berada disekitar pembuluh darah, hiperemia dan kongesti.
Pada pemeriksaan imunohistokimia pada kelompok perlakuan I ditemukan adanya
antigen virus H5N1 pada organ paru, jantung, pankreas, limpa, ginjal, ovarium
dan isthmus dalam derajat yang ringan (+) untuk trakea serta usus menunjukkan
adanya antigen H5N1 dalam jumlah yang sedang (++), tidak ditemukan adanya
antigen H5N1 pada organ hati, otot dada dan otot paha. Pada kelompok perlakuan
II dan III antigen virus AI H5N1 ditemukan pada organ paru, jantung, pankreas,
limpa, ginjal, ovarium dan istmus dalam derajat ringan (+) dan sedang (++)
sedangkan pada trakea serta usus berada pada derajat yang tinggi (+++). Tidak
ditemukan adanya antigen H5N1 pada organ hati, otot dada dan otot paha. Hasil
analisis statistik pada gambaran imunohistokimia dari masing-masing perlakuan
menunjukkan bahwa tidak berbeda nyata antara perlakuan I, II, dan III namun
terdapat perbedaan nyata antara 3 kelompok perlakuan lainnya dengan kelompok
kontrol.
kesehatan masyarakat veteriner, keberadaan virus pada berbagai jaringan tubuh
itik akan berkaitan dengan kemungkinan tranmisi virus menyebar ke lingkungan
dan manusia yang menangani dan mengkonsumsi produk itik dan telur dari itik
yang terinfeksi.
@ Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumber.
a.
Pengutipan hanya untuk kepentingan pendidikan, penulisan karya
ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu
masalah
b.
Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
DENGAN METODE IMUNOHISTOKIMIA
KUSUMA SRI HANDAYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Distribusi Virus Avian Influenza (H5N1) Pada Jaringan Tubuh Itik
Dengan
Metode
Imunohistokimia
Nama
: Kusuma Sri Handayani
NIM :
B054050051
Disetujui
Komisi Pembimbing
Prof. Dr. drh. Retno D. Soejoedono, MS. drh. Ekowati Handharyani, MS. Ph.D.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Kesehatan Masyarakat Veteriner
Dr. drh. Denny W. Lukman, M.Si. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan sejak bulan Februari 2008 ini adalah distribusi virus
Avian Influenza dalam tubuh itik, dengan judul Distribusi Virus Avian Influenza
(H5N1) pada Jaringan Tubuh Itik dengan Metode Imunohistokimia.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. drh. Retno D.
Soejoedono, MS. dan Ibu drh. Ekowati Handharyani, MS., Ph.D. selaku
pembimbing yang telah banyak memberi masukan dan saran dalam penulisan
karya ilmiah ini. Disamping itu, penghargaan penulis juga sampaikan kepada
Bapak Dr. drh. Denny W. Lukman, M.Si. selaku Ketua Program Studi Kesehatan
Masyarakat Veteriner (KMV) Sekolah Pascasarjana IPB. Tak lupa kepada semua
pihak yang telah membantu selama penelitian dan penulisan karya ilmiah ini
penulis mengucapkan terima kasih atas segala bantuan dan kerjasamanya.
Ungkapan terima kasih juga disampaikan kepada Ayahanda (alm), ibunda
(almh), suami dan anakku serta seluruh keluarga atas segala doa dan kasih
sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
Penulis dilahirkan di Bogor pada tanggal 21 Oktober 1973 sebagai anak
bungsu dari pasangan Soedjarmo (alm) dan Soeparti (almh). Tahun 2006 penulis
menikah dengan Arif Nindyo Kisworo dan telah dikaruniai seorang putra yang
bernama Faizan Dzaky Widyandono.
Pada tahun 1992 Penulis menamatkan sekolah menengah atas di SMAN 3
Bogor dan pada tahun yang sama penulis diterima di Fakultas Kedokteran Hewan
Universitas Airlangga Surabaya melalui jalur UMPTN (Ujian Masuk Perguruan
Tinggi Negeri).
Sejak tahun 2000 penulis bekerja sebagai Pegawai Negeri Sipil di Sekolah
Tinggi Penyuluhan Pertanian Bogor, Badan Pengembangan Sumberdaya Manusia
Pertanian, Departemen Pertanian. Kesempatan untuk melajutkan pendidikan
Program Pascasarjana IPB pada Program Studi Kesehatan Masyarakat Veteriner
diperoleh pada tahun 2006.
x
DAFTAR ISI
Halaman
DAFTAR TABEL
...
xi
DAFTAR LAMPIRAN ...
xii
PENDAHULUAN
...
1
Latar
Belakang
...
1
Tujuan
...
3
Manfaat
...
3
TINJAUAN PUSTAKA ...
4
Virus Influenza Tipe A...
4
Virus Influenza A Subtipe H5N1 ...
6
Patogenesis
...
9
Penularan dan Penyebaran Penyakit ...
11
Virus AI Pada Unggas Air ...
14
Vaksinasi AI
...
16
Imunohistokimia
...
18
MATERI DAN METODE ...
21
Waktu dan Tempat Penelitian ...
21
Materi Penelitian ...
21
Metode Penelitian ...
22
Desain
Penelitian
...
22
Prosedur
Penelitian
...
23
Pemeriksaan
Histopatologi
...
24
Rancangan dan Analisis Data ...
24
HASIL DAN PEMBAHASAN ...
25
SIMPULAN DAN SARAN ...
34
DAFTAR PUSTAKA ...
35
xi
Halaman
1.
Jumlah kumulatif kasus Avian Influensa A (H5N1) pada
manusia yang dilaporkan dan dikonfirmasi ke WHO (2008) ... 8
2. Distribusi antigen H5N1 pada organ itik dengan metode
xii
DAFTAR LAMPIRAN
Halaman
1
Gambaran dengan metode imunohistokimia dan HE pada beberapa
organ itik yang terinfeksi virus H5N1
...
42
2
Data statistik gambaran imunohistokimia pada jaringan tubuh
Latar Belakang
Kejadian Avian Influenza (AI) yang disebabkan virus H5N1 menyerang
sejumlah peternakan unggas di Indonesia menyebabkan kerugian ekonomi yang
tidak sedikit pada industri perunggasan akibat mortalitas dan morbiditasnya yang
tinggi.
Penyakit AI dapat menjadi hambatan dalam perdagangan produk asal
hewan baik nasional, regional maupun global karena produk yang dihasilkan
menjadi tidak aman bagi lingkungan budidaya ternak.
Demikian juga dampak
wabah virus AI terhadap keadaan gizi rakyat, yang memerlukan unggas dan telur
karena
kandungan nutrisi dan proteinnya yang tinggi, serta mengandung asam
amino essensial yang dibutuhkan tubuh dan berperan dalam mencerdaskan
kehidupan bangsa.
Sejak tahun 1997 infeksi virus AI dipeternakan unggas meningkat secara
signifikan dan adanya kasus penularan dari unggas ke manusia yang
menyebabkan gejala yang parah dan infeksi pada manusia yang fatal. Kehadiran
infeksi endemik oleh virus HPAI H5N1 di peternakan unggas dibeberapa negara
Asia menandakan bahwa virus ini akan mengkontaminasi lingkungan dan akan
terus menyebar luas dan menginfeksi manusia (Perdue & Swayne 2005).
Virus
Highly Pathogenic Avian Influenza
(
HPAI) tipe A (H5N1) telah
menjadi epizootik di Asia, Eropa, dan Afrika. Menginfeksi unggas peliharaan dan
telah menjadi endemik dibeberapa area serta telah menginfeksi manusia secara
sporadis melalui kontak langsung dengan unggas terinfeksi atau burung liar. Bila
hal ini terus berlangsung bisa menjadi ancaman yang penting bagi kesehatan
masyarakat (CDC 2008a).
Untuk itu berbagai upaya telah dilakukan untuk
mencegah penyebaran yang lebih meluas.
Karakteristik biologis virus AI yang mendukung kemampuannya untuk
menimbulkan penyakit pada unggas, mamalia dan juga manusia adalah karena
komposisi virus AI sangat labil yaitu mudah mengalami mutasi, dengan virulensi
dan patogenitasnya yang sangat bervariasi.
Virus ini dapat menyebabkan pandemi
karena mudahnya mereka bermutasi, baik secara
antigenic drift
ataupun
antigenic
2
H5N1 telah memperluas macam dan jumlah induk semangnya dengan
menginfeksi dan membunuh spesies mamalia dan juga manusia yang sebelumnya
dianggap resisten terinfeksi virus AI (WHO 2005a).
Semua subtipe virus AI yang teridentifikasi telah diisolasi dari
burung-burung air (Weaver 2005). Virus H5N1 telah tersebar luas pada itik piaraan di
Cina Selatan dan diduga endemik di seluruh Asia Tenggara
(Chen
et al. 2004).
Potensi unggas air sebagai sumber penularan AI perlu diwaspadai. Hewan ini
berperan sebagai tempat replikasi, adaptasi dan evolusi virus. Reassortment
genetik diantara dua virus AI yang berbeda dapat terjadi pada saluran intestinal
itik dan mensekresikan dalam jumlah yang tinggi dalam fesesnya dengan tanpa
menimbulkan gejala sakit (Hinshaw et al. 1980).
Penemuan ini menunjukkan
adanya jalur penyebaran penyakit kepada burung-burung lainnya dan
kemungkinannya juga pada manusia.
Namun dari kejadian wabah AI pada akhir tahun 2002 yang terjadi di
Hongkong pada burung-burung migrasi liar dan unggas air yang menetap
(termasuk itik) diketahui bahwa strain virus H5N1 menjadi lebih patogenik
dimana itik mengalami penyakit akut temasuk menderita disfungsi neurologis dan
kematian (Sturm-Ramirez et al. 2004).
Imunohistokimia merupakan alternatif yang sangat baik untuk digunakan
dalam mendiagnosa dan tujuan penelitian karena relatif cepat dan sensitif, dengan
cara mengkombinasikan teknik anatomi, immunologi dan biokimia untuk
mengidentifikasi komponen spesifik pada jaringan melalui reaksi Ag-Ab spesifik.
Imunohistokimia memungkinkan pula untuk menggambarkan distribusi
komponen spesifik pada permukaan sel, di dalam sel
,
ataupun jaringan
Tujuan Penelitian
1.
Mengetahui distribusi virus AI (H5N1) pada jaringan tubuh itik melalui
deteksi antigen spesifik dengan menggunakan metode imunohistokimia.
2.
Mempelajari keterkaitan antara keberadaan virus AI dengan keamanan pangan
produk itik (daging, jeroan dan telur).
Manfaat
TINJAUAN PUSTAKA
Virus Influenza Tipe A
Penyakit Avian Influensa (AI) disebabkan oleh virus influensa tipe A
yang
merupakan virus RNA dari famili
Orthomyxoviridae
dengan genus
Orthomyxovirus
. Berbentuk
spheris
atau longitudinal, asam nukleatnya berantai
tunggal dengan kutub negatif, sepanjang kurang lebih 13.588 nukleotida yang
tersusun dalam 8 segmen gen yang mengkode sekitar 10 jenis protein, yakni
HA
(Hemaglutinin), NA (Neuraminidase), NP (Protein Nukleokapsid), M1 dan M2
(Protein matriks), NS1 dan NS2 (Protein nonstruktural), PA (Polimerase protein
A), PB1 dan PB2 (Polimerase protein B1 dan B2) (Ghedin
et al.
2005).
Daerah eksternal Hemaglutinin terdiri dari oligosakharida yang
menyalurkan derivat neuroaminic, berbentuk seperti tombol dan berkaitan dengan
kemampuannya melekat pada reseptor sel
(Watowich
et al.
1994).
Neuraminidase
berperan untuk menghidrolisis ikatan antara galaktosa dan N–acetylneraminic
pada rantai ujung oligosakharida–glikoprotein. Fungsi NA ini harus berada dalam
keseimbangan dengan HA. Hal ini agar aktivitas enzimatik dalam melepaskan
asam sialat dari sel yang terinfeksi tidak menyebabkan penurunan efisiensi infeksi
sel berikutnya. Fungsi lain dari NA adalah untuk melepaskan partikel virus yang
sudah selesai replikasi dalam sel, mencegah virion yang sudah terbentuk tersebut
menempel kembali pada reseptor asam sialat melalui tonjolan HA. Oleh karena itu
efisiensi replikasi virus AI sangat tergantung pada kerjasama protein HA dan NA
dari virus (Suzuki
et al.
2000).
Polimerase RNA-RNA aktif, yang bertanggung jawab untuk replikasi dan
transkripsi, dibentuk dari PB2, PB1, dan PA. Polimerase tersebut memiliki
aktivitas endonuklease dan diikat ke RNP. Protein NS1 dan NS2 memiliki fungsi
pengaturan untuk mendorong sintesis komponen-komponen virus dalam sel
terinfeksi. (Gurtler 2006)
Protein matriks mempunyai peran dalam penyusunan virion virus AI.
Bersama dengan protein HA dan NA protein M2 menyusun struktur amplop virus
struktural virus, tetapi juga berperan pada awal infeksi dalam pemisahan protein
M1 dari RNP untuk masuk ke dalam sitoplasma sel tropisma (Reid
et al
. 2002).
Virus influensa memiliki 2 antigen utama yaitu Hemaglutinin (HA atau H)
dan Neuraminidase (NA atau N) (Horimoto & Kawaoka 2005). Subtipe virus
influensa tipe A dinamai berdasarkan kedua antigen utama tersebut (HA dan NA).
Berdasarkan sifat antigenisitas dari glikoprotein, virus influensa A telah
teridentifikasi ada 16 subtipe HA (H1-H16) dan 9 subtipe NA (N1-N9). (
CDC
2008)
.
Klasifikasi tersebut ditetapkan melalui analisis filogenetik terhadap
nukleotida dan penetapan urutan (sequences) gen-gen HA dan NA melalui cara
deduksi asam amino (
Fouchier
et al
. 2005).
Virus AI juga bersifat dinamis dan dapat berkembang secara terus
menerus. Variasi antigenik pada virus AI dapat terjadi melalui 2 cara yakni
drift
dan
shift
Pada
antigenic drift
, prosesnya terjadi secara berlahan-lahan dengan
menghasilkan sedikit perubahan pada struktur antigen permukaan HA dan atau
NA, sehingga dihasilkan virus strain baru (
CDC 2005b).
Determinan antigenik
dari glikoprotein permukaan HA dan NA dipengaruhi oleh mekanisme yang
dipicu oleh kekebalan
(Fergusson
et al
2003).
Mutasi yang menonjol di tempat
antigenik menurunkan atau menghambat ikatan antibodi-antibodi penawar
(
neutralising
antibody),
dengan demikan memudahkan subtipe baru untuk
menyebar dalam populasi yang tidak punya kekebalan.
Antigenic shift
menunjukkan adanya perubahan mendadak dan mendalam
dalam determinan antigenik, yaitu pertukaran subtipe HA dan atau NA, di dalam
satu siklus tunggal replikasi. Hal ini terjadi dalam sebuah sel yang secara
bersamaan terinfeksi oleh dua atau lebih virus influensa A dari subtipe yang
berbeda. Karena distribusi segmen genomik virus yang sudah tereplikasi ke dalam
progeni yang baru tumbuh berlangsung tanpa tergantung kepada subtipe asal dari
tiap segmen itu, dapat muncul progeni yang berkemampuan untuk bereplikasi
yang membawa informasi genetik dari virus induk yang berbeda-beda
(WHO
2005b).
6
manusia dan gen virus influensa tipe A pada hewan untuk membentuk virus
subtipe A melalui sebuah proses yang disebut
genetic reabsorbment
(CDC
2005a
).
Virus Influensa A mempunyai selubung yang mengandung glikoprotein
dan dilapisi oleh lapisan lemak ganda. Virus ini tetap hidup dalam air pada suhu
20
0C selama 4 hari, pada suhu 0
0C dapat bertahan hidup lebih dari 30 hari dan
masih tetap infektif dalam feses pada suhu 4
0C selama 30-35 jam serta mampu
hidup selama 7 hari pada suhu 20
0C. Virus AI sensitif pada panas dan mati pada
temperatur 56
0C selama tiga jam atau pada temperatur 60
0C selama 30 menit atau
lebih. Virus tahan pada kondisi pH asam, kondisi lingkungan yang kering atau
pada kondisi yang nonisotonik. Selubung virus dapat dirusak oleh deterjen dan
infektivitasnya mampu dirusak dengan cepat oleh formalin, beta-propiolakton,
agen yang bersifat oksidan, asam encer, eter, deoksikolat, hidroksilamin,
Na-dedoksisulfat dan ion-ion ammonium serta senyawa iodium
(Tabbu 2000).
Virus Influenza A Subtipe H5N1
Semua virus AI yang ada pada burung, virus H5N1 yang paling menjadi
perhatian karena pengaruhnya terhadap kesehatan manusia dengan dua alasan;
pertama, virus H5N1 sampai sejauh ini adalah penyebab paling banyak kasus
kesakitan yang sangat parah dengan sejumlah kematian yang cukup besar. Virus
ini telah menembus batas spesies untuk menginfeksi manusia; yang kedua adalah
dampak selanjutnya terhadap kesehatan manusia, dimana jika virus H5N1 diberi
kesempatan yang cukup maka akan mengembangkan karakter yang diperlukannya
untuk menyebabkan pandemi influensa (WHO 2006).
Virus H5N1 adalah subtipe dari spesies virus influensa A. Strain virus
HPAI A (H5N1) yang pertama kali diketahui telah membunuh dua flok ayam di
peternakan Skotlandia tahun 1959, tetapi strain virus tersebut sangat berbeda
dengan strain virus HPAI A yang ada saat ini. Studi AI H5N1 sejak tahun 1997
menunjukkan bahwa virus ini terus berkembang dengan mengalami perubahan
pada antigenisitas dan susunan gen internalnya sehingga terjadi peningkatan
patogenisitas dengan kemampuannya menginfeksi, menyebabkan terjadi perluasan
kucing dengan mengakibatkan infeksi sistemik dan virus ini juga dapat menjadi
lebih stabil dilingkungannya (Perdue & Swayne 2005).
Penemuan lain menunjukkan virus H5N1 menginfeksi babi di Cina dan
Vietnam, menginfeksi kucing (pada percobaan infeksi pada kucing rumah) di
Netherland, diisolasi dari kucing rumah di Jerman, Thailand, Irak dan Rusia,
menginfeksi anjing (isolasi virus H5N1 pada anjing mati di Thailand), isolasi
virus H5N1 pada harimau dan leopard di kebun binatang Thailand. Selanjutnya
virus H5N1 juga menginfeksi sejenis cerpelai di Jerman serta pada kucing liar di
Vietnam. Strain virus H5N1 terus berkembang dan dapat beradaptasi, sehingga
mamalia lain juga dapat terinfeksi (CDC 2008b).
Virus H5N1 telah bermutasi ke dalam berbagai strain dengan profil
patogenik yang berbeda. Beberapa bersifat patogen terhadap spesies tertentu,
tetapi yang lain tidak. Setiap variasi genetik spesifik yang diketahui dapat dilacak
dengan isolat virus dari kasus infeksi tertentu. Strain virus HPAI A yang dominan
pada tahun 2004, berkembang dari virus
tahun 1999 sampai 2002 untuk
menciptakan genotip Z (Perdue & Swayne 2005).
Genotip Z muncul tahun 2002 melalui pengelompokan dari genotip awal
virus HPAI H5N1 (Li
et al
. 2004) yang menginfeksi burung di china tahun 1996,
dan pertama menginfeksi manusia di Hongkong tahun 1997 (WHO 2006).
Genotip Z endemik pada burung-burung di Asia Tenggara dimana telah
membentuk sedikitnya dua
clades
yang dapat menginfeksi manusia dan telah
menyebar di dunia pada populasi burung. Mutasi yang terjadi diantara genotip ini
telah meningkatkan patogenitasnya (Chen
et al
2004).
Isolat virus H5N1 yang diperoleh dari Hongkong tahun 1997 sampai 2001
menunjukkan bahwa virus ini tidak menyebabkan gejala penyakit yang nyata pada
burung. Namun pada tahun 2002 isolat baru virus H5N1 yang muncul pada
populasi burung di Hongkong, virus ini menyebabkan penyakit akut, termasuk
disfungsi neurologis dan kematian pada itik (Sturm-Ramirez
et a
l. 2004).
8
virulensi yang dapat meningkatkan aktivitas replikasi virus H5N1 dalam sel
hospesnya
(Hatta
et al
. 2001).
M
utasi dari virus H5N1 kemungkinan besar dapat
menghasilkan varian virus H5N1 baru yang dapat mengenali reseptor spesifik
yang ada pada sel manusia (
natural human
α
2-6 glycan
), sehingga bila ini terjadi
maka penularan virus H5N1 dari manusia ke manusia dapat terjadi dengan mudah
(Stevens
et al
. 2006).
Tabel 1. Jumlah kumulatif kasus Avian Influensa A (H5N1) pada manusia yang
dilaporkan dan dikonfirmasi ke WHO
Sumber : WHO 2008
Virus H5N1 memungkinkan untuk menyebabkan lebih dari satu pandemi
influenza karena diduga terus bermutasi pada burung tanpa peduli apakah manusia
mampu mengembangkan imunitas turunan terhadap strain-strain virus yang baru
tersebut. Analisa genetik virus H5N1 menunjukkan bahwa keturunan genetiknya
Negara
2003 2004 2005 2006 2007 2008 Total
kasus mati kasus mati kasus Mati kasus mati kasus mati kasus mati kasus mati
Azerbaijan
0 0
0 0 0 0 8 5 0 0 0 0 8 5
Cambodia
0 0
0 0 4 4 2 2 1 1 0 0 7 7
China 1 1
0 0 8 5 13
8 5 3 3 3 30
20
Djibouti 0 0
0 0 0 0 1 0 0 0 0 0 1 0
Egypt 0 0
0 0 0 0 18
10
25
9 7 3 50
22
Indonesia
0 0 0 0 20
13
55
45
42
37
16
13
133
108
Iraq
0 0
0 0 0 0 3 2 0 0 0 0 3 2
Lao
People's
Democratic
Republic
0 0
0 0 0 0 0 0 2 2 0 0 2 2
Myanmar
0 0
0 0 0 0 0 0 1 0 0 0 1 0
Nigeria 0 0
0 0 0 0 0 0 1 1 0 0 1 1
Pakistan 0 0 0 0 0 0 0 0 3 1 0 0 3 1
Thailand 0 0 17 12
5
2
3
3
0
0
0
0 25 17
Turkey 0 0
0 0 0 0 12
4 0 0 0 0 12
4
Viet
Nam
3 3 29 20 61 19 0 0 8 5 5 5 106
52
dapat dengan mudah menjadi jauh lebih mematikan (Webster & Govorkova
2006).
Patogenesis
Virus AI terbagi atas dua grup berdasarkan pathogenitasnya yang terdiri
atas virus influenza unggas berpatogenitas rendah (
Low Pathogenic Avian
Influenza
, LPAI), menyebabkan penyakit yang ringan yang mungkin tidak
terdapat atau tidak menunjukkan gejala pada beberapa spesies burung ; dan yang
kedua adalah virus influensa unggas yang sangat patogen (
Highly Pathogenic
Avian Influenza
, HPAI) menyebar dengan cepat dapat menyebabkan serangan
penyakit yang serius dengan tingkat kematian yang tinggi (mencapai 90 sampai
100%)
(Swayne & Suarez 2003).
Patogenesis virus AI dipengaruhi antara lain oleh tropisme (reaksi ke arah
atau menjauhi stimulus), efektivitas replikasi dan mekanisme penghindaran
imunitas. Selain itu faktor spesifik pada tiap spesies berperan juga terhadap hasil
suatu infeksi, yang terjadi setelah penularan antar spesies
(Swayne & Suarez
2000).
Patogenesis dan virulensi virus AI ditentukan oleh beberapa faktor yang
saling berinteraksi (Behrens & Stoll 2006):
a. Faktor
hospes
:
•
Keberadaan reseptor target pada sel
hospes
•
Ketersediaan enzim-enzim pada sel
hospes
yang penting untuk
masuknya virus dan replikasi
•
Keadaan kekuatan sistem imun pada
hospes
individu
•
Imunitas spesifik terhadap
epitope
virus tertentu pada
hospes
individu
dan populasi target
•
Kemampuan sistem imun untuk mengendalikan replikasi virus yang
efektif tanpa menimbulkan kerusakan kolateral yang serius karena
respons inflamasi bagi
hospes
b. Faktor
virus
•
Kemampuan untuk berikatan dengan sel
hospes
10
•
Restriksi efek sitopatogenik untuk memberikan keseimbangan yang
cocok antara replikasi virus dan pengendalian oleh
hospes
•
Melepaskan diri dari pengawasan sistem imun dengan evolusi antigen
yang bervariasi yang digerakkan oleh tekanan selektif respon imun.
•
Melepaskan diri dari pengawasan sistem imun lewat cara rekombinasi
dengan jenis virus berbeda dari penyakit zoonotik
•
Modulasi respons imun untuk melemahkan mekanisme pertahanan
hospes yang efektif.
Biasanya virus-virus H5 dan H7 bertahan stabil dalam bentuk yang
berpatogenitas rendah dalam reservoir alaminya. Selanjutnya virus ditularkan
melalui berbagai jalan ke peternakan unggas, mengalami masa sirkulasi yang
bervariasi dan mengalami adaptasi dalam populasi unggas yang rentan seperti
ayam dan kalkun. Selanjutnya spesies unggas tersebut menjadi sebab dari
terjadinya beberapa siklus penularan. Virus influenza A subtipe H5 dan H7 dapat
pula berubah melalui mutasi insersi menjadi bentuk yang sangat patogen
(Rohm
et al.
1995).
Bentuk AI yang sangat patogen sampai saat ini secara eksklusif
ditimbulkan oleh subtipe H5 dan H7, mampu menimbulkan penyakit sistemik
yang ganas dan mematikan secara cepat, virus jenis HPAI tersebut dapat muncul
secara tidak terduga dan sebagai tipe yang sama sekali baru dalam unggas yang
terinfeksi (
Perdue & Suarez 2000).
Infeksi virus H5N1 dimulai pada saat virus memasuki sel hospes setelah
terjadi penempelan
spikes
virion virus influenza A, kemudian terjadi interaksi
antara glikoprotein Hemaglutinin dengan reseptor yang mengandung
sialic acid
lisomal (Wagner 2005). Berikutnya kedelapan segmen RNA genomik dari virus
yang terbungkus dalam lapisan pelindung dari protein nukleokapsid dilepaskan ke
dalam sitoplasma yang selanjutnya disalurkan ke nukleus untuk melakukan
transkripsi mRNA virus dan replikasi RNA genomik melalui proses yang rumit
yang diatur oleh faktor virus dan faktor sel (Whitaker
et al.
1996).
Sesungguhnya ada perbedaan antara molekul reseptor yang ada pada
manusia dengan reseptor yang ada pada unggas. Virus AI dapat mengenali dan
terikat pada reseptor yang hanya terdapat pada jenis unggas yaitu oligosakharida
yang mengandung N-acethylneuraminic acid
α
-2,3-galactose (SA
α
-2,3- Gal).
Sedangkan reseptor yang ada pada permukaan sel manusia adalah SA
α
-
2,6-galactose (SA
α
-2,6-Gal), sehingga sebenarnya virus AI yang menyerang unggas
tidak bisa menginfeksi manusia karena perbedaan reseptor spesifiknya. Tetapi bila
terjadi perubahan pada 1 asam amino saja pada konfigurasi reseptornya maka
reseptor yang ada pada manusia dapat dikenali oleh virus HPAI-H5N1
(Stevens
et
al
. 2006).
Mutasi genetik virus AI seringkali terjadi sesuai dengan kondisi dan
lingkungan replikasinya. Mutasi gen ini tidak saja untuk mempertahankan diri
akan tetapi juga dapat meningkatkan sifat patogenisitasnya (Hatta
et al
. 2001).
Virus H5N1 diketahui telah mampu menembus
barier spesies.
Diawali
pada kasus yang terjadi pada tahun 1997 di Hongkong yang menyebabkan 18
orang terinfeksi dan 6 diantaranya meninggal. Tindakan cepat dengan
memusnahkan semua ayam di wilayah Hongkong berhasil menghentikan
penyebaran virus tersebut secara sementara. Rekombinasi genetik dapat terjadi
melalui hewan perantara, seperti babi atau di dalam diri manusia sendiri ketika
terinfeksi oleh keduanya pada saat bersamaan. Akibat proses rekombinasi tersebut
bisa muncul subtipe baru yang telah berubah sifat antigeniknya sehingga mampu
dengan mudah menginfeksi manusia (Sturm-Raminez
et al
. 2004).
Penularan dan Penyebaran Penyakit
Penularan atau tranmisi virus AI secara umum dapat terjadi melalui
12
Menurut Soejoedono dan Handharyani (2005), penyakit AI dapat ditularkan dari
unggas ke unggas lain dan dari peternakan ke peternkan lainnya dengan cara :
-
kontak langsung dari unggas terinfeksi dengan hewan yang peka,
-
melalui lendir yang berasal dari hidung dan mata,
-
melalui kotoran (feses) unggas yang terserang AI,
-
melalui manusia lewat sepatu dan pakaian yang terkontaminasi dengan
virus,
-
melalui pakan, air, dan peralatan kandang yang terkontaminasi,
-
melalui udara karena memiliki peran penting pada penularan dalam satu
kandang tetapi memiliki peran terbatas dalam penularan antar kandang,
-
melalui unggas air, yang dapat berperan sebagai sumber (
reservoir
) virus
yang terdapat dalam saluran intestinal dan dilepaskan lewat kotorannya.
Virus H5N1 mudah berpindah
diantara burung yang memfasilitasi potensi
penyebaran global virus H5N1. Sementara virus ini bermutasi dan mengelompok
kembali, menciptakan variasi yang menginfeksi spesies yang belum jelas
diketahui sebagai pembawa virus (Shinya
et al
. 2006). Burung dapat menyebarkan
virus untuk waktu yang lama sebelum ia mati, hal ini memungkinkan untuk
meningkatkan kemampuannya dalam menularkan virus (Chen
et al
. 2004).
Sekali virus menginfeksi kawanan unggas, virus LPAI tidak harus
mengalami suatu fase adaptasi pada spesies unggas tersebut sebelum dikeluarkan
lagi dalam jumlah yang cukup besar untuk dapat menular secara horisontal ke
unggas lain, baik dalam kawanan sendiri ataupun ke kawanan yang lain. Demikian
pula sekali virus HPAI berkembang dari kawanan unggas yang terinfeksi virus
LPAI, ia dapat menular dengan cara yang sama. Pasar unggas yang menjual
unggas dalam jumlah besar dan unggas yang ditempatkan secara saling
berdesakan, merupakan multiplikator penyebaran penularan (Bulaga
et al.
2003).
Avian Influenza pada burung kadang kala juga memanifestasikan gejala
penyakit yang ringan dan tidak mematikan, sehingga itik liar dapat membawa
virus dalam jarak yang jauh, dan membuang virus tersebut melaui kotorannya.
Unggas yang terinfeksi oleh influenza A atau virus H5N1 dapat mengeluarkan
Melalui perdagangan internasional unggas hidup, virus AI dapat menyebar
dari satu negara ke negara lain. Jenis burung kelana, termasuk unggas air liar,
unggas laut dan unggas darat, mereka dapat membawa virus dalam jarak jauh.
Burung yang terinfeksi virus akan mengeluarkan virus ini melalui saliva (air liur),
cairan hidung, dan kotoran. Penyakit ini juga dapat menular melalui udara yang
tercemar virus H5N1 yang berasal dari kotoran atau sekreta burung/unggas yang
menderita AI. Penularan AI melalui feses ke oral adalah cara penularan yang
paling sering terjadi (CDC 2008a) Resiko Penularan dari burung liar ke unggas
peliharaan terutama terjadi kalau unggas peliharaan tersebut dibiarkan bebas
berkeliaran, menggunakan air yang juga digunakan oleh burung liar, atau makan
dan minum dari sumber yang tercemar kotoran burung liar pembawa virus
(Henzler
et al.
2003).
Burung-burung peliharaan dapat terinfeksi dengan virus AI melalui kontak
langsung dengan unggas air terinfeksi atau unggas terinfeksi lainnya melalui
kontak dengan permukaan seperti tanah, peralatan atau kandang atau bahan-bahan
(seperti air atau makanan yang terkontaminasi oleh virus). Manusia dan kendaraan
dapat menjadi vektor dari penyebaran virus AI dari satu peternkan ke peternakan
lainnya (CDC 2008a).
Kebanyakan sumber utama infeksi virus H5N1 pada manusia adalah
melalui kontak langsung dengan burung sakit yang mati, termasuk pada kegiatan
penyembelihan, penghilangan bulu, penjagalan dan proses pengolahan untuk
konsumsi dari burung yang terinfeksi. Pada sedikit kasus, kontak dengan feses
unggas disaat anak-anak bermain di area peternakan unggas merupakan salah satu
penyebab infeksi. Berenang ditempat dimana burung mati dibuang atau airnya
telah terkontaminasi feses burung atau unggas terinfeksi juga salah satu sumber
dari penularan. Pada beberapa kasus infeksi, sumber penularan belum dapat
diidentifikasi, mungkin melibatkan faktor lingkungan yang belum diketahui.
Burung peliharaan seperti merpati, kotoran unggas yang masih mentah yang
digunakan sebagai pupuk juga berperan (WHO 2006)
Virus AI dapat ditularkan terhadap manusia dengan 2 jalan. Pertama
kontaminasi langsung dari lingkungan burung terinfeksi yang mengandung virus
14
terjadi dari kotoran secara oral atau melalui saluran pernapasan. Kekhawatiran
yang muncul di kalangan para ahli genetika adalah bila terjadi rekombinasi
genetik (
genetic reassortment
) diantara virus Influenza burung dan virus influenza
manusia, sehingga dapat menular antara manusia ke manusia.
Menurut Herman & Strock (2005). Ada dua kemungkinan yang dapat
menghasilkan subtipe baru dari H5N1 yang dapat menular antara manusia ke
manusia, yaitu :
1.
virus dapat menginfeksi manusia dan mengalami mutasi sehingga virus
tersebut dapat beradaptasi untuk mengenali
linkage RNA
pada manusia, atau
virus burung tersebut mendapatkan gen dari virus influenza manusia
sehingga dapat bereplikasi secara efektif di dalam sel manusia. Subtipe baru
virus H5N1 ini bermutasi sedemikian rupa untuk membuat protein tertentu
yang dapat mengenali reseptor yang ada pada manusia, untuk jalan
masuknya ke dalam sel manusia.
2.
Kedua jenis virus, baik virus avian maupun human influenza tersebut dapat
secara bersamaan menginfeksi manusia, sehingga terjadi “mix” atau
rekombinasi genetik, sehingga menghasilkan strain virus baru yang sangat
virulen bagi manusia .
Dari hasil penelitian yang dilakukan dengan cara memberi makan binatang
seperti kucing, macan, ataupun macan tutul dengan unggas yang terinfeksi dengan
H5N1 terbukti bahwa binatang pemakan daging tersebut dapat mengalami
kelainan paru berupa pneumonia,
severe diffuse alveolar damage
, dan
menyebabkan kematian (Keawcharoen
et al
. 2004)
Virus AI Pada Unggas Air
Burung-burung air liar, terutama yang termasuk dalam golongan
Anseriformis
(itik dan angsa) dan
Charadiformis
(burung camar dan
burung-burung pantai), adalah pembawa (
carrier
) seluruh varietas subtipe dari virus
influensa A, dan menjadi sangat mungkin merupakan
reservoir
alami untuk
semua jenis virus influensa
(Krauss
et al.
2004).
Beberapa jenis burung khususnya unggas air berperan sebagai
reservoir
mengeluarkannya melalui fesesnya namun kebanyakan dari burung-burung liar
tersebut tidak menunjukkan sakit sehingga mereka dapat menyebarkan virus AI
pada burung-burung lainnya (CDC 2008a). Dalam banyak kejadian itik piara dan
itik liar (
wild waterfowl
) sering kali ditemukan tahan terhadap virus tersebut
sehingga justru menjadi pembawa (
carrier
) yang menyebarkan virus ke ayam atau
menyebarkan virus AI melintasi benua (Chen
et al.
2005).
Cara pemeliharaan unggas air di Indonesia dan dibeberapa negara Asia
Tenggara umumnya serupa, yakni : (a) dibiarkan berkeliaran di halaman
bercampur dengan unggas lain apabila jumlahnya tidak banyak, (b) dikandangkan
sementara dan dibawa ke sawah ketika musim panen padi usai, umumnya dalam
jumlah puluhan sampai ratusan, (c) terus-menerus dikandangkan dan diberi
makanan khusus, terutama untuk jenis itik unggul dalam jumlah banyak. Tipe
pemeliharaan (a) dan (b) yang mempunyai potensi tinggi untuk menyebarkan
virus AI ke daerah yang lebih luas. Di Indonesia itik piara tipe (b) kadang-kadang
dibawa dengan kendaraan roda empat ke daerah yang cukup jauh untuk mengais
sisa-sisa panen padi di sawah. Apabila diantara itik tadi membawa virus H5N1,
tinja itik dapat mencemari saluran air, petani yang memanfaatkan saluran air
tersebut untuk keperluan sehari-hari menjadi kelompok orang yang rawan tertular
virus AI. Untuk itik piara tipe (a) karena tidak dikandangkan, tinjanya dapat
mencemari kolam air di sekitar rumah dan halaman (Anonim 2002).
Dilaporkan pertama kali virus H5N1 ditemukan pada angsa terjadi di
Guangdong China tahun 1996, yang menyebar pada itik-itik di Provinsi Coastall
China Selatan dan di pasar-pasar unggas hidup di Hongkong. Dari kasus tersebut
selanjutnya dilaporkan sekitar 18 orang terinfeksi dan 6 diantaranya meninggal
(CDC 1998). 22 Desember 2003, virus AI menyerang unggas di Korea Selatan.
Kasus AI yang pertama di Korsel ini, ditemukan di peternakan itik dekat Kota
Eumseong Korea Selatan
Di Jepang virus HPAI H5N1 diisolasi dari daging itik yang diimpor dari
Provinsi Shandong China Utara (Mase
et al
. 2005).Tahun 2001 virus HPAI H5N1
diisolasi dari daging itik yang diimpor Korea dari China. Dari hasil penelitian
mengenai karakteristik dan pathogenitas dari virus AI H5N1 yang diisolasi dari
16
pada tikus. Sedangkan percobaan yang dilakukan pada itik tidak ada kematian
namun titer virus relatif tinggi ditemukan pada otot kerangka dan jaringan otak
pada itik (Tumpey
et al.
2002).
Berdasarkan penelitian, itik piara yang ditulari virus H5N1 hasil isolasi
tahun 2004 terbukti mengeluarkan atau mengekspresikan lebih banyak virus, dan
dalam tempo lebih lama lewat tinja dibandingkan dengan itik yang ditulari dengan
isolat virus tahun 2003. Disebutkan jumlah virus AI yang dikeluarkan itik piara
tersebut mendekati jumlah virus yang dikeluarkan oleh ayam yang sedang
terserang parah atau hampir mati oleh AI. Namun itik yang ditulari secara buatan
tersebut tidak menunjukkan gejala klinik (Anonim 2008b). Penemuain ini
menunjukkan bahwa adanya jalur penyebaran penyakit kepada hewan lain dan
juga ke manusia (CDC 2008a)
Pada akhir tahun 2002 dilaporkan adanya wabah yang disebabkan oleh
virus HPAI H5N1 yang menyebabkan kematian diantara burung-burung migrasi
liar dan unggas air yang menetap di suaka margasatwa Hongkong. Menyebabkan
infeksi sistemik pada itik dengan titer virus tinggi dan pathologi pada berbagai
macam organ khususnya pada otak, itik mengalami penyakit yang akut termasuk
menderita disfungsi neurologis. Virus juga diisolasi dalam titer yang tinggi pada
air minum dan juga dari peralatan yang berkontak (Sturm-Ramirez
et al
. 2004).
Laporan kejadian AI di Thailand pada tahun 2005, diawali dengan
penggembalaan itik sekitar 3000-5000 itik di area pertanian, walaupun tidak ada
kontak antara itik yang digembalakan dan ayam peliharaan, namun dua minggu
setelah kedatangan itik-itik tersebut, ayam di area tersebut banyak yang mati dan
manusia yang berkontak langsung dengan ayam yang mati, meninggal terinfeksi
virus H5N1 (Songserm
et al
. 2006).
Vaksinasi AI
Vaksinasi dalam dunia kedokteran hewan ditujukan untuk mencapai :
perlindungan terhadap timbulnya penyakit secara klinis, perlindungan terhadap
serangan virus yang virulen, perlindungan terhadap ekskresi virus, pembedaan
(dikenal sebagai
differentiantion of infected from infected from vaccinated
animals
, atau prinsip DIVA) (Lee & Suarez 2005).
Beberapa manfaat yang dapat diperoleh dengan menjalankan program
vaksinasi AI (Indartono & Slamet 2005) :
•
Mencegah dan menghindari terjadinya kerugian ekonomi akibat penyakit
tersebut, yakni kerugian akibat terjadinya kematian, penurunan produksi,
penurunan berat badan dan keterlambatan
replacement
•
Menurunkan dan menekan jumlah virus AI yang dapat disebarkan oleh
hewan terinfeksi AI
•
Menurunkan virulensi virus AI yang patogen di lapangan, menjadi lebih
rendah tingkat keganasannya
•
Mencegah dan menghindari timbulnya varian-varian baru akibat mutasi
yang dapat membahayakan kesehatan manusia
Untuk kepentingan praktikal, beberapa persyaratan harus dipenuhi pada
vaksin AI (Lee & Suarez 2004):
•
Karena berpotensi menimbulkan perubahan struktur genetis, juga pada kasus
subtipe H5 dan H7, resiko mutasi spontan yang mengakibatkan peningkatan
patogenik, vaksin tidak boleh diubah dengan replikasi kompeten virus
influenza. Oleh karena itu penggunaan vaksin dengan virus hidup tidak
dipakai lagi
•
Perlindungan terhadap HPAI pada unggas terutama tergantung kepada
antibodi yang spesifik untuk HA tertentu. Oleh karena itu virus untuk vaksin
harus berasal dari subtipe HA yang sama dengan virus liar yang ada di sana.
Kecocokan ideal antara vaksin dan badan virus yang disyaratkan bagi vaksin
untuk manusia, tidak menjadi keharusan bagi vaksin unggas. Pembangkitan
imunitas reaktif-silang homosubtipik pada unggas mungkin sudah menjadi
perlindungan yang memadai karena pada saat ini jarang dijumpai adanya
pembentukan antigen yang dipicu vaksin pada virus influenza unggas, akibat
tidak adanya upaya vaksinasi yang meluas.
•
Strategi penandaan (DIVA) harus digunakan (Suarez 2005) atau sebagai
gantinya, digunakan unggas yang tidak divaksinasi sebagai penanda untuk
18
Resiko hewan yang divaksinasi untuk terkena infeksi virus virulen dan
mengeksresikannya biasanya dapat diturunkan namun tidak sepenuhnya
mencegah. Hal ini dapat menimbulkan masalah epidemiologik yang signifikant di
daerah endemik yang sudah mendapat vaksinasi secara luas, unggas yang sudah
divaksinasi yang terlihat sehat dapat juga terkena infeksi dan mengeluarkan virus
liar dibalik perlindungan vaksin (Lee & Suarez 2004).
Prinsip dasar pemakaian vaksin AI adalah virus vaksin harus homolog
dengan sub tipe H atau subtipe H dan N virus asal lapang. Menurut regulasi OIE,
vaksin harus mempunyai komposisi genetik yang stabil, proses inaktivasi
sempurna (uji laboratorik), bebas pencemaran agen infeksius lainnya,
mengandung konsentrasi antigen yang tinggi, menggunakan adjuvant berkualitas
tinggi dan mempunyai tingkat keamanan, potensi serta efektifitas yang tinggi (uji
laboratorik dan uji lapang) (Suarez 2005)
Vaksinansi dengan strain virus homolog telah terbukti menurunkan angka
kematian dan memperpendek
viral shedding
. Utamanya ditujukan pada gen H
yang menyandi antigen yang menginduksi pembentukan antibodi netralisasi
(Asmara 2006).
Imunohistokimia
Imunohistokimia (IHC) telah ada sejak tahun 1930-an tetapi pada tahun
1940 studi tentang IHC baru dilaporkan (Anonim 2008a). Nama IHC berasal dari
kata immuno dalam hubungannya dengan antibodi yang digunakan dalam
prosedur, dan histo yang berarti jaringan. IHC adalah proses memisahkan protein
pada sel dalam suatu jaringan dengan menggunakan prinsip ikatan spesifik
antibodi pada antigen pada jaringan biologik, IHC dilakukan untuk membantu
mendiagnosa agen etiologi dari proses infeksi. Keberadaan reaksi warna (jika itu
spesifik berdasarkan pemakaian kontrol menunjukkan adanya komponen agen
infektius yang diuji (Ramos-Vara 2005).
Pada reaksi imunohistokimia ini sifatnya adalah spesifik karena bahan
yang dideteksi akan direaksikan dengan antibodi spesifik yang dilabel dengan
suatu enzym. Enzym yang digunakan untuk melabel antibodi tersebut dapat
adanya suatu reaksi enzimatik maka digunakan suatu indikator warna
(chromogen) (Sudiana 2005).
Antibodi yang digunakan untuk deteksi spesifik dapat berupa poliklonal
atau monoklonal. Antibodi monoklonal umumnya dianggap dapat menunjukkan
lebih terperinci. Antibodi monoklonal, adalah antibodi yang memiliki idiotipe dan
isotipe yang sama. Idiotipe adalah bagian antibodi yang menentukan
spesifisitasnya (
antigen binding surface
), sedangkan isotipe adalah bagian
antibodi yang menentukan kelas-sub kelas dari antibodi maupun yang menentukan
tipe-subtipe dari suatu antibodi. Dapat dikatakan bahwa antibodi monoklonal
adalah suatu antibodi yang memiliki
antigen binding surface
yang sama,
kelas-sub kelas maupun tipe-kelas-sub tipe yang sama (Sudiana 2005). Antibodi poliklonal
dibuat dengan menginjeksi hewan dengan antigen peptida, dan setelah respon
imun sekunder dirangsang selanjutnya diisolasi antibodinya dari keseluruhan
serum. Jadi antibodi poliklonal adalah pencampuran dari berbagai antibodi yang
mengenal sejumlah
epitopes.
Imunohistokimia adalah metode alternatif yang sangat baik disamping
spesifik dan sensitif, relatif cepat, tidak mahal dan sedikit menggunakan
laboratorium. IHC telah menjadi metode baik dan terpercaya untuk diagnosa rutin
dan aktifitas penelitian
(Ramos-Vara
et al.
1999).
Imunohistokimia telah menjadi tehnik yang sangat penting dan secara luas
dipakai pada laboratorium penelitian medis dan juga diagnosa klinika. Banyak
sekali metode IHC yg bisa digunakan untuk melokalisasi antigen. Pemilihan
metode yang sesuai harus didasari parameter-parameter seperti tipe spesimen yg
diselidiki, dan tingkat sensitifitas yang dibutuhkan
(
Anonim 2008a).
Terdapat dua metode dasar IHC untuk mengetahui adanya antigen pada
jaringan, yaitu : pertama, metode langsung adalah metode dengan satu tahap
pewarnaan. Melibatkan antibodi berlabel yang bereaksi dengan antigen dalam
bagian jaringan. Tehnik ini hanya menggunakan satu macam antibodi, sehingga
prosedurnya pendek dan cepat. Walaupun demikian metode ini tidak sensitif
karena hanya sedikit signal yang ditampilkan ; kedua, metode tidak langsung
melibatkan antibodi primer tidak berlabel ( lapisan 1) yang bereaksi dengan
20
antibodi primer. (Antibodi sekunder harus melawan IgG spesies hewan dimana
antibodi primer berasal).
Pada metode tidak langsung selain lebih sensitif juga
relatif lebih sedikit jumlah antibodi sekunder yang diperlukan sebagai ukuran
Penelitian ini dilaksanakan dari bulan Februari – Agustus 2008
di
laboratorium Biosafety level 3 (BSL 3) milik PT Medion, Bandung, dilanjutkan
dengan pembuatan dan pemeriksaan preparat rutin dan imunohistokimia di Bagian
Patologi Departemen Klinik Reproduksi dan Patologi. Fakultas Kedokteran
Hewan Institut Pertanian Bogor.
Materi Penelitian
Hewan percobaan
Pada penelitian ini digunakan itik sebagai hewan percobaan sebanyak 12
ekor yang dibagi dalam 4 kelompok perlakuan, itik dibeli dari peternak di
Cirebon. Itik dikandangkan secara individual yang dilengkapi dengan tempat
pakan dan minum. Makanan yang diberikan adalah pakan konsentrat komersial.
Pakan diberikan setiap pagi dan sore, air minum diberikan ad libitum.
Bahan
Virus AI isolat itik yang berasal dari Nagrak Sukabumi
(FKH/IPB/Duck/NG29), Vaksin AI inaktif (PT. Medion), Buffer Netral Formalin
(BNF) 10%, Alkohol dengan konsentrasi 70%, 80%, 95%, 96%, alkohol absolut,
Xylol, NaCl fisiologis 0,9 %, Parafin, Phosphat Buffer Saline (PBS), citrat buffer,
Destilated Water (DW), Tween 20 0,1%, H2O2 3% , Antibodi monoklonal H5N1,
antibodi sekunder yang telah dilabel dengan steptavidin biotin (DAKO
AEC/Amino Ethyl Carbazole kit), chromogen, hematoksilin, eosin, entelan, dan
glycerin.
Alat
22
Metode Penelitian
Desain penelitian
Jenis penelitian ini termasuk penelitian eksperimental murni, karena semua
variabel yang berpengaruh selain perlakuan dapat dikendalikan. Dalam penelitian
ini variabel yang berpengaruh adalah pemberian virus AI (H5N1) secara
intranasal dan pemberian Vaksin AI inaktif. Sedangkan yang menjadi variabel
kendali adalah spesies, jenis kelamin, umur, perawatan dan penetapan skor pada
preparat imunohistokimia dan yang menjadi variabel tidak bebas dalam penelitian
ini adalah gambaran imunohistokimia pada jaringan tubuh itik.
Hewan percobaan terdiri atas 12 ekor itik yang ditempatkan dalam
kandang individual dan ditempatkan sesuai dengan kelompok perlakuan. Setiap
kelompok terdiri atas 3 ekor itik. Perincian ketiga kelompok perlakuan tersebut
adalah sebagai berikut :
1.
Kelompok kontrol
: itik umur 4 bulan tidak divaksin AI dan tidak
ditantang virus AI..
2.
Kelompok perlakuan I : itik umur 4 bulan, divaksin AI (H5N1) dengan
dosis 0,5 ml/ekor pada hari ketiga dan diuji
tantang dengan virus AI (H5N1)
(FKH/IPB/Duck/NG29) secara intranasal
dengan dosis 10
4EID
50per ekor pada hari ke 6.
3.
Kelompok perlakuan II : itik umur 4 bulan, tidak divaksin AI dan diuji
tantang dengan virus AI (H5N1)
(FKH/IPB/Duck/NG29) secara intranasal
dengan dosis 10
4EID
50per ekor pada hari ke 6.
4.
Kelompok perlakuan III: itik sudah berproduksi (6 bulan) tidak divaksin
Prosedur penelitian
Pada penelitian ini kelompok kontrol diletakkan pada lokasi yang terpisah
dengan tiga kelompok lainnya. Setelah perlakuan selama 11 hari, masing-masing
kelompok itik baik kontrol maupun kelompok perlakuan dinekropsi. Kemudian
diambil jaringan trakhea, paru-paru, jantung, hati, limpa, ginjal, pankreas, usus,
otak, ovarium, isthmus, otot dada dan otot paha. Dimasukan dalam Buffered
Neutral Formalin (BNF) 10%. Tahap selanjutnya pembuatan blok parafin. Blok
parafin yang berisi sampel jaringan mula-mula dipotong 3-4µm dan dilekatkan
pada kaca obyek selanjutkan dilakukan pewarnaan Hematoksilin dan Eosin/HE
dan imunohistokimia dengan metode SAB (Streptavidin Biotin Complex) dengan
antibodi monoklonal H5N1 (Astawa et al. 2007).
Pewarnaan Hematoksilin dan Eosin/HE : Proses awal pewarnaan jaringan
pada preparat, dimulai dengan proses penarikan parafin dengan xylol III, II, I, lalu
direndam dalam alkohol absolut sampai alkohol 70% masing-masing selama 3
menit. Kemudian dicuci dengan air kran dan destilated water (DW) selama 5
menit. Selanjutnya diwarnai dengan hemaktosilin selama 1 menit lalu dicuci
dengan air kran dan DW selama 5 menit. Tahap berikutnya diwarnai dengan eosin
selama 2 menit dan dilanjutkan dengan proses dehidrasi dengan alkohol bertingkat
mulai dari alkohol 70% sampai alkohol absolut serta penjernihan dengan xylol I,
II, dan III. Kemudian di mounting dengan entelan
dan ditutup dengan kaca
penutup dan siap untuk dilakukan pengamatan. .
24
monoklonal antibodi H5N1 (Astawa et al. 2007) dalam lemari es (4
0C) selama
semalam (overnight).
Selanjutnya kaca objek dibilas dengan PBS tween 20, 0,1% 3X (@ 3 menit
kemudian diinkubasi dengan menggunakan antibodi sekunder ( DAKO AEC kit)
selama 1 jam. Selanjutnya dibilas dengan DW selama 3 menit kemudian diberi
indikator warna (chromogen) selama 30 detik kemudian dibilas kembali dengan
DW dan dilanjutkan dengan mounting
dengan glycerin serta ditutup dengan kaca
penutup, selanjutnya preparat siap untuk diamati.
Pemeriksaan histopatologi
Dari masing-masing preparat dilakukan pemeriksaan secara
semikuantitatif dengan menggunakan mikroskop cahaya. Tiap preparat dari
masing-masing kelompok diamati secara menyeluruh, baik untuk pewarnaan HE
maupun imunohistokimia. Pemeriksaan imunohistokimia dilakukan berdasarkan
intensitas warna yang dihasilkan (merah kecoklatan) sebagai suatu hasil reaksi
antara antigen-antibodi pada lima lapang pandang. Intensitas reaksi yang diamati
dikelompokkan menjadi empat kelompok, yaitu positif tinggi (+++) untuk lebih
dari 20 sel berantigen/satu lapang pandangan, positif sedang (++) untuk 11-20 sel
berantigen/satu lapang pandangan, positif ringan (+) untuk 1-10 sel
berantigen/satu lapang pandangan, dan negatif (-) tidak terdeteksi adanya sel
berantigen
Rancangan dan analisis data
Berdasarkan pengamatan terhadap gejala klinis pada semua kelompok
perlakuan, baik pada kelompok kontrol (P0) maupun pada kelompok perlakuan I,
II dan III dari hari pertama sampai pada hari keenam semua itik terlihat sehat,
tidak ditemukan adanya gejala klinis. Gejala klinis sinusitis mulai terlihat pada
hari ke 8 pada kelompok perlakuan I dan II, dua hari setelah itik ditantang dengan
virus H5N1 melalui intranasal dengan dosis 10
4EID
50per ekor, sedangkan gejala
sinusitis terlihat pada kelompok perlakuan III dihari ke 9. Pada hari ke 10 itik-itik
pada perlakuan I, II dan III terlihat mengalami gejala berupa sinusitis dan
konjungtivitis, dan pada hari ke 11 semua itik baik pada perlakuan I, II dan III
telah menunjukkan gejala berupa sinusitis, konjungtivitis dan diare berwarna putih
kecuali pada kelompok kontrol. Selanjutnya semua itik yang menjadi hewan coba
dalam penelitian ini baik pada kelompok kontrol dan pada kelompok perlakuan I,
II, dan III dilakukan nekropsi.
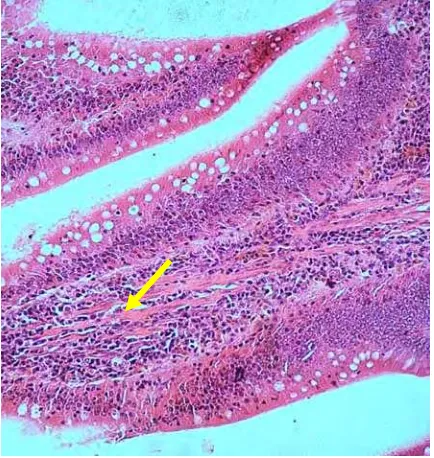
Hasil pengamatan histopatologi dengan metode HE, pada beberapa organ
seperti trakhea, paru-paru, jantung, limpa, hati, usus, pankreas, ginjal, ovarium,
dan isthmus serta otak secara umum menunjukkan adanya kongesti vena dan
nekrosis endotel buluh darah, selain itu juga terlihat adanya infiltrasi limfosit yang
terutama berada disekitar pembuluh darah. Seperti yang dikemukakan oleh Tizard
(1987), bahwa inflitrasi sel radang merupakan reaksi tanggap gebal yang terjadi di
dalam tubuh untuk mengeliminasi benda-banda asing atau antigen yang masuk,
dan sel radang ini akan menginduksi pembentukan antibodi di dalam tubuh. Pada
setiap infeksi semua jenis sel radang dilepaskan, tetapi sel radang yang dominan
dilepaskan pada setiap infeksi berbeda-beda tergantung dari agen penyebab,
apabila infeksi disebabkan oleh virus maka sel radang yang dominan muncul
adalah limfosit.
26
limfosit tersebut dihasilkan oleh pertukaran acak beberapa segmen gen, disertai
mutasi somatik, selama perkembangan limfosit (Barrett 1988).
Kemampuan gerakan amuboid yang dimiliki oleh sel-sel limfosit memiliki
kekuatan yang berbeda, mengakibatkan perbedaan dalam pencapaian wilayah
yang dapat dijangkau, sel limfosit yang memiliki keterbatasan kekuatan gerakan
amuboid akan berkumpul disekitar pembuluh darah. Selain itu infiltrasi sel
limfosit disekitar pembuluh darah, juga bisa disebabkan karena virus memang
menempati area vaskular tersebut yang menjadi mediator peradangan, dengan
adanya sel-sel atau jaringan yang rusak akan menstimulasi pengiriman limfosit ke
area tersebut (Smith & Jones 1961).
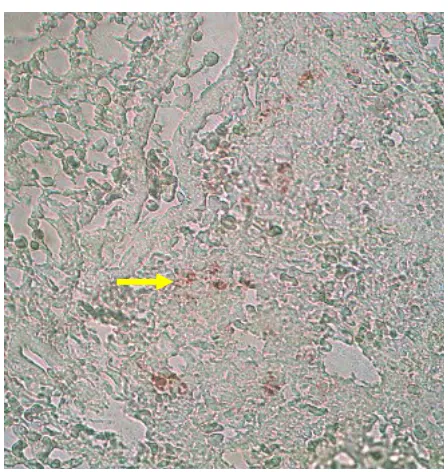
Pada pemeriksaan imunohistokimia pada kelompok perlakuan I, yaitu pada
itik yang divaksin AI inaktif dan 3 hari kemudian ditantang dengan virus AI
H5N1 dengan dosis 10
4EID
50secara intranasal. Keberadaan virus H5N1 pada
kelompok perlakuan ini ditemukan pada jaringan paru-paru, jantung, hati,
pankreas, limpa, ginjal, ovarium dan isthmus dalam derajat ringan (+), pada
jaringan otak terdapat satu yang menunjukkan positif (+) dan dua jaringan otak
lainnya tidak menunjukkan adanya antigen H5N1. Untuk jaringan trakhea serta
usus menunjukkan adanya antigen H5N1 dalam jumlah yang sedang (++). Tidak
ditemukan adanya antigen virus H5N1 pada otot dada dan otot paha.
Pada pemeriksaan imunohistokimia pada kelompok perlakuan II, yaitu itik
tidak divaksin dan ditantang dengan virus AI H5N1, virus AI H5N1 ditemukan
pada jaringan paru-paru, jantung, pankreas, hati, limpa, ginjal, ovarium dan
isthmus dalam derajat ringan (+) sampai sedang (++), sedangkan pada jaringan
otak terdapat dua ekor itik yang menunjukkan positif (+) dan hanya satu jaringan
otak yang tidak menunjukkan adanya antigen H5N1. Pada trakhea serta usus
berada pada derajat yang tinggi (+++). Sedangkan pada otot dada dan otot paha
menunjukkan reaksi yang negatif.
otak yang tidak menunjukkan adanya antigen H5N1. Keberadaan virus AI H5N1
pada jaringan trakhea serta usus pada kelompok ini menunjukkan derajat yang
tinggi (+++). Tidak ditemukan adanya antigen H5N1 pada otot dada dan otot
paha.
Tabel 2. Distribusi antigen H5N1 pada organ itik dengan metode
imunohistokimia
Organ
P0 PI
PII
PIII
1
2
3
1
2
3 1 2 3 1 2 3
Otak -
-
-
-
+
-
-
+
+
+
+
-
Trakea -
-
-
++
++
++ +++ +++
+++
++
+++
+++
Paru-paru - - -
+
+
+ + + + + + +
Usus
- - - ++
++ ++ +++ +++
+++ +++ ++ +++
Pankreas - - -
+
+
+ + + + + + +
Jantung - - -
+
+
+ + + + + + +
Ginjal
- - -
+
+
+ + + + + + +
Hati
- - -
+
+
+ + + + + + +
Limpa
- - -
+
+
+ + + + + + +
Ovarium - - -
+
+
+ + + + + + +
Isthmus - - - + + + ++ ++ ++ ++ ++ ++
Otot
dada
-
-
-
-
-
- - -
Otot
paha
-
-
-
-
-
- - -
Antigen H5N1 ditemukan dalam derajat yang tergolong sedang (++)
sampai tinggi (+++) pada organ trakhea pada semua kelompok perlakuan (PI, PII
dan PIII). Pemeriksaan dengan pewarnaan HE ditemukan adanya proses
peradangan yang ditandai dengan infiltrasi sel-sel limfosit disertai dengan
nekrosis dan juga telihat adanya kongesti.
Infeksi secara intranasal akan menyebabkan penyebaran virus pada organ
saluran pernafasan yang merupakan sasaran utama virus AI, yaitu sel-sel epitel
torak dari saluran pernafasan, sel-sel ini rentan terhadap infeksi virus. Reseptor
virus adalah penentu tropism (respons organisme terhadap stimulus luar). Pada
infeksi AI, tempat ikatan reseptor virus hemaglutinin (HA) diperlukan untuk
ikatan ke galaktosa mengikat asam sialik pada permukaan sel-sel hospes (Weis et
al.1988).
28
proses fusi, genom virus dilepaskan ke sitoplasma sel terinfeksi selanjutnya
genom akan bermigrasi ke nukleus. Di nukleus inilah terjadi trankripsi dan
replikasi virus (Cross et al., 2001). Ketika virus AI menginfeksi sel-sel epitel
pernafasan secara efisien, replikasi terjadi dalam waktu berjam-jam dan sejumlah
virion diproduksi (Behrens & Stoll 2007).
Infeksi dan replikasi virus AI dalam saluran pernafasan menimbulkan
kerusakan sel yang disebabkan oleh penurunan pengaturan sintesis protein sel
hospes dan apoptosis yang disebut juga program kematian sel, yaitu suatu rentetan
peristiwa sel yang hasil akhirnya hilangnya sel beserta isinya secara efisien
(Willey et al. 2001). Pada penelitian ini pemeriksaan dengan pewarnaan HE, pada
jaringan trakea terlihat adanya kongesti, infiltrasi limfosit dan nekrosis sel.
Pada organ paru-paru antigen virus H5N1 terdeteksi dalam derajat yang
ringan (+), virus ditemukan di dalam dan di sekitar alveoli, bagian dari paru-paru
dimana oksigen bertemu dengan darah. Sedangkan pada pewarnaan HE terlihat
adanya kongesti pada vena dan adanya infiltrasi limfosit. Keberadaan virus pada
organ ini selanjutnya dapat menyebabkan kerusakan sel sehingga akan
mengganggu fungsi kerja dari organ paru-paru. Jaringan paru yang rusak karena
infeksi AI berhubungan dengan stress oksidasi seluler, generasi spesies oksigen
reaktif (ROs), dan induksi nitric oxide synthetase-2, yang menimbulkan
pembentukan nitrogen reaktif toksik menengah (Chen et al. 2001).
Keberadaan antigen virus H5N1 pada organ jantung dalam derajat ringan
(+) yang dengan pewarnaan HE ditandai dengan adanya kongesti, turut
menjelaskan ditemukannya antigen virus AI H5N1 pada hampir semua organ.
Karena jantung merupakan bagian dari sistem kardiovaskular, yang berperan
dalam perjalanan penyakit AI sehingga virus dapat menyebar ke semua organ
viseral.
memegang peranan penting dalam melawan infeksi. Limfosit dapat dibentuk dan
mengalami pematangan di dalam pulpa putih limpa (Anonim 2008b)
Antigen AI H5N1 ditemukan juga pada organ limpa pada semua perlakuan
(PI, PII dan PIII) pada derajat ringan (+) dan dengan pewarnaan HE diantaranya
terlihat adanya kongesti, infiltrasi limfosit, penebalan dinding pembuluh darah dan
nekosis sel. Penyakit AI dapat merusak struktur dan fungsi organ limfoid
sekunder yakni diantaranya limpa yang mengakibatkan fungsi organ tersebut
berkurang dalam melawan infeksi, sehingga peningkatan resiko untuk
menyebabkan infeksi yang lebih parah hingga terjadinya kematian tidak akan
berlangsung lama.
Pankreas adalah kelenjar pencernaan yang terdiri atas 2 bagian, endokrin
dan eksokrin. Bagian eksokrin menghasilkan NaHCO3 serta enzim-enzim
pencernaan yang melalui saluran pankreas menyalurkan enzim-enzim tersebut ke
duodenum. Sedangkan pada bagian endokrin terdapat pulau-pulau Langerhans
yang menghasilkan hormon-hormon insulin dan glukagon yang akan masuk
langsung ke peredaran darah (Frandson 1992). Antigen virus H5N1 ditemukan
pada pankreas pada semua perlakuan (PI, PII, dan PIII) pada derajat ringan (+).
Dengan pewarnaan HE diantaranya tampak adanya hemoragi dan kongesti pada
vena, yang pada akhirnya dapat menyebabkan kerusakan pada sel-sel pankreas,
sehingga dapat menurunkan fungsi organ pankreas tersebut dalam menghasilkan
enzim pencernaan seperti tripsin, steapsin dan amilopsin yang dapat menyebabkan
gangguan pada proses pencernaan dan penyerapan makanan. Selain itu juga akan
menurunkan fungsi pankreas yang lain, yakni dalam menghasilkan
hormon-hormon yang berperan dalam metabolisme tubuh.
Pada penelitian ini, antigen virus H5N1 dapat dideteksi pada usus dalam
jumlah yang cukup banyak (+++). Hal ini sesuai dengan gambaran histopatologi
dengan pewarnaan HE terlihat adanya kongesti pada usus yang cukup hebat,
infiltrasi limfosit dan nekosis sel. Bila dilihat dari gejala, itik juga mengalami
gejala diare berwarna putih, hal ini dikarenakan pada itik yang terinfeksi AI akan
diikuti pula dengan adanya gangguan pada fungsi hati dan pankreasnya.
30
dengan pewarnaan HE bahwa pada organ tersebut terlihat adanya kongesti vena,
dilatasi sinusoid dan infiltrasi limfosit pada sekitar pembuluh darah serta adanya
nekrosis sel. Perdarahan yang terlihat pada sinusoid-sinusoid hati merupakan
indikasi adanya kerusakan pada pembuluh darah. Keadaan tersebut dapat
menyebabkan gangguan pada proses biokimiawi dari organ hati, yang pada
akhirnya mengakibatkan gangguan pada metabolisme karbohidrat, protein, dan
lemak pada sel. Gangguan metabolisme intraseluler ini akhirnya mengakibatkan
perubahan pada struktur sel hati (Darmawan 1994). Hati merupakan kelenjar
terbesar dalam tubuh dan sel hati mempunyai daya regenerasi yang sangat besar.
Tetapi dalam kasus AI, sel-sel hati yang mengalami kerusakan tidak dapat