PEMURNIAN DAN KARAKTERISASI
PROTEASEEKSTRASELULER
DARl ISOLAT BAKTERI TERMOFlLlK
GP-04
OLEH:
NlSA RACHMANIA MUBARIK
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan Nama Allah
,
Maha Pemurah, Maha PenyayangDia menciptakan seluruh langit dan bumi dengan suatu tujuan kekal,
dan Dia memberi kamu bentuk dan membuat bentukmu indah,
dan kepada Dia-lah akhirnya kamu kembali
Dengan ini saya menyatakan bahwa disertasi yang be judul:
PEMURNIAN DAN KARAKTERISASI PROTEASE EKSTRASELULER
DARl ISOLAT BAKTERI TERMOFlLlK GP-04
Adalah benar merupakan hasil karya saya sendiri dan belum pemah dipublikasikan.
Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan
dapat diperiksa kebenarannya.
V
PEMURNIAN DAN KARAKTERISASI
PROTEASEEKSTRASELULER
DARl ISOLAT BAKTERI TERMOFlLlK GP-04
OLEH:
NlSA RACHMANIA MUBARIK
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Biologi
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Pemumian dan Karakterisasi Protease Ekstraseluler dari lsolat Bakteri Terrnofilik GP- 04
Nama mahasiswa : Nisa Rachmania Mubarik
Nomor pokok : 975070
Program Studi : Biologi
Menyetujui,
1. Komisi Pembimbing
Prof .Dr. Ir. H. Edi Guhardia. M.Sc. A n g g h
ABSTRACT
NlSA RACHMANIA MUBARIK.
Purification and Characterization of Extracellular Proteases from Isolate GP-04, a Thermophilic Bacterium. Under the direction of MAGGY THENAWIDJAJA SUHARTONO, ANTONIUS SUWANTO, DWI ANDREAS SANTOSA, and ED1 GUHARDJA.A gram positive, rod-shaped, and aerobic therrnophilic bacterium, designated as GP-04, was isolated from Gunung Pancar hot spring, near Bogor, West Java. Based on approximately 400 bases both 5 frames regions and 3 frames ends DNA sequences of 16s-rRNA gene, the isolate is determined to be closely related 90%) to Bacillus
caldovelox. The isolate, produced significant amount of extracellular protease when grown in a modified Thermophilic Bacillus medium pH 7,O at 6s°C for 16 h in a batch mode fermentation. Crude protease was purified using 30% ammonium sulphate precipitation and column chromatography using Sephadex G-25 followed by DEAE- Sephadex A-50.
The protease activity was inhibited by chelating agent at the concentrations as follows: 1 mM, 5 mM, and 10 mM ethylenediaminetetraacetic acid (EDTA) and o-phenanthroline. The enzyme activity was enhanced by suplementation of 1 mM, 5 mM, and 10 mM CaCI2 and MgCI2. The 30% ammonium sulphate precipitate was not inactivated by 1% sodium dodecyl sulphate (SDS). Ommum enzyme activity occurred at pH 7.5 and temperature 70% -75%. Upon heat treatment at pH 7.0 and 7 0 ' ~ the enzyme was still 100
96
activity after 48 hours, and dropped to only 20% after 90 minutes heating at 80°C. Zymogram analysis revealed three translucent zones coresponding to caseinolytic actvities after 45 minutes of incubation at 7 0 ' ~ in the 0.5 M buffer Tris HCI pH 7.5. The proteolytic activities were detected at 78 kDa, 57kDa, and 44kDa. All the three molecules were not inactivated by 1 % P-metcaptoethanol and 1mM and 5 mM dithiothreitol (DTT). The 78 kDa and 57 kDa were inhibited by 5 mM EDTA. This indicated that thetwo
protein molecules was neutral-metalloproteases. Protease GP-04 was able ;to hydrolyze casein Hammarsten, bovine serum albumin, gelatin, fibrin, and mucin.Penulis dilahirkan di Bandung pada tanggal 27 Nopember 1967 sebagai anak peftama dari empat bersaudara dari Bapak Ir. H. Baryono Hardjosuwito dan Ibu almarhumah dr. Hj. Surati. Tahun 1995 penulis menikah dengan Rikrik Mubarik Ahmad, SE, dan kini mempunyai dua orang anak, Marini Adani (1995) dan Altafni Mahdia (2000). Sejak tahun 1992 penulis bekeja sebagai staf pengajar di Jurusan Biologi, FMlPA IPB, dan bertempat di Laboratorium Mikrobiologi.
Penulis menyelesaikan program sajana dari Jurusan Biologi, FMlPA Universitas lndonesia pada tahun 1991. Tahun 1992 penulis melanjutkan studi S2 di Program Studi Kimia, Subprogram Biokimia, Program Pascasa jana lnstitut Teknologi Bandung dan lulus pada tahun 1994. Tahun 1997 penulis melanjutkan studi S3 di Program Pascasajana, lnstitut Pertanian Bogor pada Program Studi Biologi, Subprogram Mikrobiologi. Beasiswa pendidikan S3 diperoleh dari Beasiswa Program Pascasarjana (BPPS) tahun 1997-2001. Biaya penelitian S3 diperoleh dari BPPS, DIP SEAMEO- BIOTROP tahun 1998-1999, dan Hibah Tim (Proyek URGE) tahun 1999-2001.
Selama mengikuti program S3, penulis menjadi anggota Perhimpunan Biologi lndonesia (PBI)
,
Perhimpunan Mikrobiologi lndonesia (Permi), dan Perhimpunan Biokimia dan Biologi Molekuler lndonesia (PBBMI), dan menjadi penelaah di Jumal Hayati (ISSN:0854-8587) Volume 7 tahun 2000. Penulis pemah menyajikan karya ilmiah bejudul lsolasi dan Karakterisasi Protease Ekstraseluler dari lsolat Bakteri Terrnofilik Ekstrim pada Seminar Nasional lndustri Ensim dan Bioteknologi II, Direktorat Bioteknologi lndustri BPPT, Jakarta pada bulan Febtuari 2000. Naskah yang disajikan tersebut dimuat dalam buku (prosiding) Mikrobiologi, Ensim, dan Bioteknologi. Dalam Perspektif Ekonomi dan lndustri (ISBN: 979-95982-0-6). Karya ilmiah yang lain be judul Pemumian dan Karakterisasi Protease Ekstraseluler dari lsolat Bakteri Termofilik GP-04 telah disajikan pada Seminar Nasional XV dan Kongres IX PBBMI di Cisarua, Bogor pada bulan Juli 2001. Karya-karya ilmiah tersebut merupakan bagian dari hasil penelitian S3 penulis.PRAKATA
Segala puji bagi Allah yang Maha Pengasih atas segala karuniaNya sehingga
disertasi ini terselesaikan. Penelitian yang be judul Pemumian dan Karakterisasi Protease Ekstraseluler dari lsolat Bakteri Termofilik GP-04 dilaksanakan dari bulan
Januari 1999 sampai dengan Juni 2001. Penelitian ini didanai dari BPPS tahun 1997-
2001, DIP SEAMEO BIOTROP tahun 1999-2000, dan Proyek Hibah Tim URGE Batch
IV tahun 1999-2001 bejudul E3ploration of the Indonesian Hyperthermophiles: Genetic
Diversity and Screening of Novel Hydrolytic Enzymes.
Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada Prof. Dr.
Ir. Maggy Thenawidjaja Suhartono, M.Sc. sebagai ketua komisi pembimbing yang telah
mencurahkan perhatian dan bimtiingan dalam penelitian dan penulisan disertasi. Suatu
kehormatan bagi penulis untuk mengungkap enzim protease termofilik bersama Ibu.
Terima kasih atas segala fasilitas yang diberikan kepada penulis untuk melakukan
penelitian di Laboratorium Mikrobiologi & Biokimia, dan kesempatan mengikuti seminar di Cisarua bulan Juli 2001.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Dr. Ir.
Antonius Suwanto, M.Sc. atas segala bimbingan dan dorongan semangat sejak penulis
mengikuti perkuliahan, penelitian, dan penulisan disertasi. Terima kasih atas
kepercayaan untuk berperan serta dalam tim penelitian ldentifikasi Enzim Prokaryot dari
Habitat Hipertermofilik, DIP SEAMEO-BlOTROP tahun 1999-2000 dan Proyek Hibah
Tim URGE tahun 1999-2001 No. Kontrak OOSMTPPAVRIRGE kepada Dr. Ir. Antonius
Suwanto, M.Sc. 'dengan dana dan fasilitas penelitian yang lengkap, serb diberikan
kesempatan mengikuti seminar di BPPT bulan Februari 2000.
Ucapan terima kasih dan penghargaan disampaikan kepada Dr. Ir. Dwi Andreas
Prof. Dr. Ir. H. Edi Guhardja, M.Sc. atas bimbingan, arahan dalam penulisan disertasi, dan penyampaian falsafah penelitian yang berharga bagi penulis.
Penulis mengucapkan terima kasih kepada: DlKTl
-
Depdiknas yang telahmemberikan beasiswa BPPS; Direktur Program Pasmsa jana lnstitut Pertanian Bogor;
Direktur PAU Bioteknologi, IPB ; dan Direktur SEAMEO-BIOTROP, Bogor; atas fasilitas yang telah diberikan selama penulis melaksanakan studi dan penelitian; dan Ketua
Jurusan dan rekan-rekan staf pengajar di Jurusan Biologi, FMIPA, IPB yang telah
memberikan dorongan semangat selama studi
S3
dan penelitian.Ucapan terima kasih disampaikan kepada Dr. Akhmaloka dan Dr. Ir. I Made Artika, M.App.Sc. selaku penguji Luar Komisi atas saran dalam penyempumaan disertasi ini.
Ucapan terima kasih disampaikan Dr. Yaya Rukayadi, Dr. Budiasih, Dr. W~bowo,
Dr. Dwi Suryanto, lrawan Tan, M.Si, rekan-rekan sesama peneliti baik yang masih akbif
maupun telah lulus di Laboratorium Mikrobiologi dan Biokimia, PAU Bioteknologi, dan
Laboratorium Biologi Molekuler, SEAMEO BIOTROP atas persahabatan, dorongan
semangat, dan bantuan dalam mencarikan jumal penelitian. Demikian pula kepada Ibu
Ika, Ibu Eni, Pak Husen, Pak Mulya, serta Fudin dan Ida yang siap menolong.
Rasa terima kasih yang tak terhingga disampaikan kepada Bapak, Ibu, almarhumah
Ibu mertua, Mbah, adik-adik, dan kerabat yang senantiasa mendoakan dan memberikan
dorongan semangat Suami yang telah memberikan waktu dan perhatian besar terutama
selama penulis melakukan studi dan penelitian. Anak-anak yang memberikan kesejukan
hati. Serta kenangan yang dalam kepada Almarhumah Ibu atas doa, motivasi, dan kasih sayang yang tulus.
Semoga ~ l l a h yang Maha Pemurah membalas segala kebaikan yang diberikan
dengan balasan yang lebih sempuma. Semoga hasil penelitian ini bermanfaat
DAFTAR IS1
Halaman
DAFTAR TABEL
...
xiiDAFTAR GAMBAR
...
xiii DAFTAR LAMPIRAN...
xivPENDAHULUAN
Latar Belakang
...
1 Tujuan Penelian...
2 Manfaat Penelitian...
3Waktu dan Tempat
...
3TINJAUAN PUSTAKA
Mikroorganisme dari Lingkungan Bersuhu Tinggi
...
...
Bacillus Termofilik
...
Enzim...
Enzim Termostabil...
Protease Mikroorganisme...
Protease Serina...
Protease Asam...
Protease Sisteina...
Metalopmtease...
Protease Termostabil Bacilius
...
Pemumian Enzim Protease...
Pemekatan Enzim...
Kromatografi Kolom...
Elektroforesis dan ZimogramBAHAN DAN METODE
...
Alat dan Bahan...
MetodePengamatan Morfologi dan Fisiologi lsolat GP-04
...
...
lsolasi DNA Total lsolat GP-04Amplifikasi dan Analisis Sekuen Gen 16s-rRNA lsolat GP-04
...
Penyiapan Mwia...
...
Media Penyimpanan lsolat' Media Pertumbuhan dan Produksi Enzim Protease Ekstra-
...
selulerPengukuran Laju Pertumbuhan dan Produksi Protease lsolat
...
G P-04...
Pengukuran AMvitas Protease...
Pengukuran Kadar Protein...
Karakterisasi AMivitas ProteaseAnalisis Elektroforesis dan Zimogram
.
:...
...
Hidrolisis Substrat ProteinHASlL DAN PEMBAHASAN
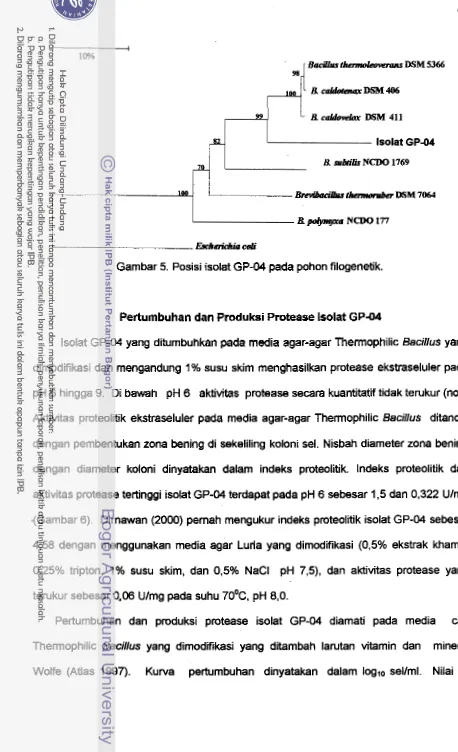
ldentifikasi lsolat GP-04
...
Ciri-ciri Morfologi dan Fisiologi (Biokimia)...
...
Analisis 16s-rRNA
Pertumbuhan dan Produksi Protease lsolat GP-04
...
...
Pemumian Protease GP-04
Analisis Berat Molekul Protein Protease GP-04
...
...
Karakterisasi Protease GP-04Penentuan Suhu dan pH Optimum Aktivitas Protease
...
Pengaruh Senyawa Penghambat...
...
Pengamh Kation...
Pengaruh DetergenPengaruh Pelanit Organik dan Senyawa yang Digunakan dalam Tahap Pemumian
...
...
Pengujian Kestabilan Protease GP-04...
Hidrolisis Substrat ProteinDAFTAR TABEL
Halaman
1
.
Nilai mol % G+C dari DNA dan 16s-rDNA dari delapan galur Bacillustermofilik
...
6 2.
Pengelompokan dan ciri-ciri protease serina mikroorganisme...
11 3.
Pengelompokan. ciri.ciri. dan contoh metaloprotease mikroorganisme...
13 4.
Homologi dan termostabilitas protease netral yang dihasilkan oleh spesiesBacillus
...
15 5.
Metode pemumian protease termostabil...
226
.
Hasil analisis elektroforesis SDS-PAGE dan zimogram protease termostabil 23 7.
Komposisi gel pemisah dan gel penahan untuk sepasang gel...
35 8.
Ciri-ciri fisiologi (biokimia) isolat GP-04...
39 9.
Perbandingan ciri-ciri morfologi dan fisiologi isolat GP-04 dengan BaallusDAFTAR GAMBAR
Halaman
1
. Hasil pewamaan endosputa isolat GP-04 pada perbesaran 1000 x
...
382
.
Penampakan isolat GP-04 umur lebih dari 48 jam dengan mikroskop elektronpayaran
...
383
.
Hasil amplifikasi dari gen penyandi 16S-rRNA dari isolat GP-04 (135 kb)....
4
.
Sebagian sekuen DNA penyandi 16s-rRNA isolat GP-04 dari hasil.
penggandaan primer 1387r (arah 5'
-,
3')...
5.
Posisi isolat GP-04 pada pohon filogenetik...
6.
Pengatuh pH media terhadap produksi protease isolat GP-04...
7
.
Pertumbuhan dan pmduksi protease isolat GP-04 pada media cairThemophitic Baci/lus yang dimodifikasi suhu 6 5 ' ~
...
8
.
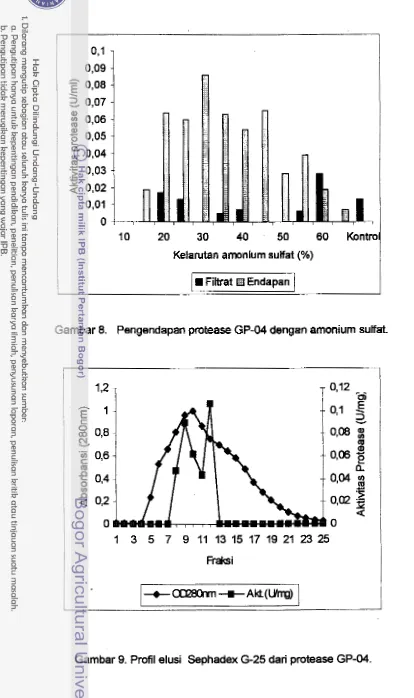
Pengendapan protease GP-04 dengan amonium sulfat...
9
.
Profil elusi Sephadex G-25 dari protease GP-04...
10.
Aktivitas protease supematan yang telah dicampur dengan matriks DEAE-Sephadex A-50 pada bebagai pH
...
11
.
Profil elusi DEAESephadex A-50 dari protease GP-04...
12
.
SDS-PAGE dan zimograrn dari tahap pernumian pmtease GP-04...
13
.
Pengaruh suhu terhadap aktivitas protease GP-04 hasil pengendapan 30% amonium sulfat dan kolom DEAE Sephadex A-50...
14
.
Pengaruh pH terhadap aktivitas protease Gp04 hasil pengendapan 30% arnonium SUM dan kolom DEAE Sephadex A-50...
15. Penga~h
senyawa penghambat protease t e h d a p aktivitas proteaseGP-04
...
.16
.
(A) Pengaruh senyawa penghambat dan detergen terhadap aktivitas protease GP-04 menggunakan zimogram.
(B) llustrasi penampakan pitaSDS-PAGE Pengaruh penambahan 5 mM EDTA pada protease GP-04
...
58 17.
Pengatuh penambahan EDTA terhadap aktivitas protease GP-04 'menggunakan (A) zimogram nondenaturasi
(native)
dan terdenaturasi18. Hipotesis mekanisme inaktivasi protease rnelalui jalur pembukaan lipatan polipeptida secara dapat balik
...
...
...
...
...
...
... :..
...
...
...
... ... ...
...
... ...
...
... .
19. Hipotesis mekanisme pembentukan produk autolisis protease GP-04 setelah penambahan 5 mM EDTA
...
... ... ...
...
... ...
...
...
...
...
...
... ...
...
...
...
...
20. Pengaruh kation terhadap aktivitas protease GP-04...
...
...
...
...
... ...
...
...
...
21. Pengaruh detergen terhadap aktivitas protease GP-04 hasil pengendapan 30% amonium sulfat
... ...
...
...
......
... ... ...
...
...
...
...
...
...
...
...
...
... ... ...
...
...
..
22. Pengaruh penambahan pelarut organik dan senyawa yang digunakan dalam tahap pernumian enzi m terhadap aktivitas protease GP-04
... ...
..
23. amogram pengaruh penambahan SDS,
p
merkaptetanol dan DTTterhadap aktivitas protease GP-04
.. .
...
. . . ... ... ...
.. . . ..
...
...
.
..
...
...
...
...
.
.. ... ..
24. P e n g a ~ h penambahan 5 mM CaCI2 terhadap aktivitas protease GP-04
pa& berbagai suhu inkubasi
... ...
... ... ...
... ... ... ... ...
...
... ...
...
...
...
...
... ...
...
25. Aktivitas protease GP-04 pada suhu 80°C
... ..
.
.
..
...
...
. ..
...
...
...
...
...
...
...
...
.
26. Aktivitas protease Gp04 pada suhu 7 0 ' ~
.
..
...
... ...
...
...
...
...
...
...
...
...
... ...
.
27. Zimogram pengaruh suhu inkubasi terhadap aktivitas protease GP-04
.
.
. .
. .
28. Kestabilan aktivitas protease GP-04 selama masa penyimpanan suhu 1 0 ' ~
29. SDS-PAGE hidrolisis protein oleh protease GP-04
...
...
...
... ...
...
... ... ... ...
...
DAFTAR LAMPIRAN
Halaman
1. Prosedur pembuatan media dan reagen yang digunakan dalam penelian
...
83
2. Hasil analisis kondisi lingkungan dan kandungan secyawa kimia dari air
panas Gunung Pancar
... ... ...
...
...
...
...
... ...
...
... ...
... ...
...
...
...
...
... ,..
...
...
...
863. Hasil analisispFASTA (versi 3.3t09 18 Mei 2001) sekuen DNA penyandi
Latar Belakang
Sumber air panas di kawasan Indonesia yang meliputi kawah, mata air panas,
solfatara dan fumarol menjadi habitat unik bagi termofil dan hipertermofil endemik.
Salah satu penelitian eksplorasi isolat-isolat mikmorganisme yang hidup pada
lingkungan bersuhu tinggi yang berasal dari Indonesia ditulis oleh Huber et at. (1992).
Mereka melaporkan telah menemukan lebih dari sepuluh genera arkaea dan bakteri
terrnofii dan hipertermofil. lsolat bakteri tennofilik ekstrim novel yang mereka temukan,
antara lain berasal dari genus Themtoga yang berasal dari sumber air panas di Pulau
Sangeang, Indonesia.
Karakteristik fisiologi dan filogenetik dari mikroorganisme yang berhabitat di
lingkungan bersuhu tinggi masih belum banyak diungkap, padahal mikroorganisme
termofil atau hipertermofil ini sangat berpotensi sebagai penghasil enzim termostabil
(stabil panas). Sebagai contoh Thermotoga berpotensi sebagai penghasil enzim:
glukosa isomerase, xilanase, a-amilase, selobiohidrolase, dan $-galaktosidase. Suhu
optimum aktivitas enzim-enzim itu berkisar 7 0 ' ~ -100'C (Leuschner & Antranikian 1995; Sunna et at. 1996 ).
Salah satu enzim yang paling banyak digunakan dalam industri adalah protease,
terutama yang bersifat termostabil. Pmtease sebagai enzim penghidrolisis protein atau
polipeptida telah mencapai
2
60% perdagangan enzim industri, dan 25% di antaranyabersifat termostabil. Protease telah dirnanfaatkan antara lain dalam industri: detergen,
pangan, farmasi, 'dan kulit (Rao et a/. 1998).
Matsuzawa et at. (1988) melaporkan telah berhasil mengisolasi protease alkalin
resisten detergen 1% sodiumdodesilsulfat (SDS). Aqualisin I tahan terhadap 1% SDS
dengan waktu pamh kurang dari 15 menit pada suhu 70°C. Cowan et a/. (1987) juga
melaporkan pmtease alkalin yang berasal dari arkaea Desutfumoccus tahan terhadap
0,1% SDS dengan waktu paruh kurang dari 112 menit pada suhu 95'~.
Pengaruh detergen pada protease yang dihasilkan Bacillus diamati oleh Horikoshi
(1971) dan Wahyuntari (2001). Protease alkalin mesofil yang berasal Bacillus No. 221
tahan terhadap 0,2% sodium lauril sulfat (SLS) (Honkashi 1971). Metaloprotease yang
berasal dari isolat Bacillus TPS2d hanya sedikit mempengaruhi aMivitas enzim dengan
sisa alctivitas sebesar 82,9% dan 88,9% masing-masing pada penambahan 0,1% SDS
dan 1% SDS pada suhu pengukuran 7 5 ' ~ (Wahyuntari 2001).
Ketahanan enzim terhadap detergen SDS sangat berguna dalam tahap pemumian
(Klingeberg et a/. 1995) dan pemanfaatan enzim dalam industri detergen. Proteinase K
yang telah dipasarkan dan diisolasi dari fungi Trititachium album diaktifkan oleh 0,5%
SDS dan 1 % Triton X-100 (Sweeney & Walker 1993).
Beberapa isolat bakteri termofilik aerobik koleksi Suwanto (1999) yang diisolasi
dari sumber air bersuhu tinggi memiliki aktivitas proteolitik ekstraseluler pada kisaran
suhu 40'C - 1 0 0 ~ ~ . Salah satunya adalah isolat GP-04 yang berhasil diisolasi dari kolam
air panas Gunung Pancar, Citeureup, Kabupaten Bogor, Jawa Barat. lsolat ini bersifat
gram positif, behentuk batang, nonmotil, aerob, dan tumbuh optimum pada suhu 6 5 ' ~
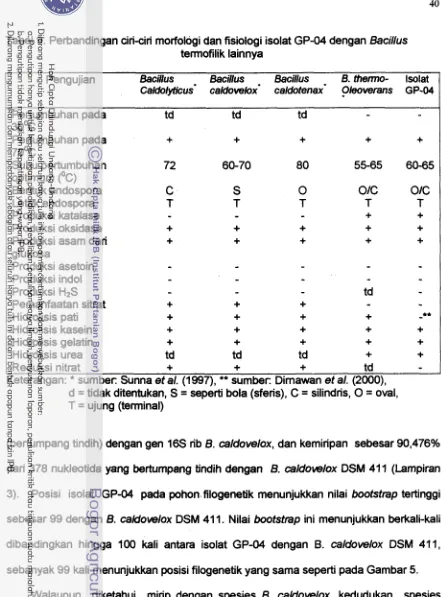
-70'C (Dimawan 2000).
Tujuan
Penelitiant
Penelitian ini bertujuan untuk melakukan pemumian dan mengungkap ciri-ciri
Manfaat Penelitian
Enzim yang berasal dari bakteri termofil biasanya bersifat stabil panas
(termostabil). Kestabilan protein dari enzim semacam ini sangat menarik bagi studi kimia
protein. Di samping itu enzim termostabil sangat diperlukan pemakaiannya sebagai
biokatalis dalam aplikasi bioteknologi.
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Biokimia, Pusat
Penelitian Bioteknologi, IPB dan di Laboratorium Biologi Molekuler SEAMEO-BIOTROP,
TINJAUAN PUSTAKA
Mikmorganisme dari Lingkungan Bersuhu Tinggi
Filogeni mikroorganisme berdasarkan sekuen nukleotida RNA ribosom mengklasifikasikan kehidupan atas tiga domain, yaitu Archaea, Bacteria, dan Eukarya. Archaea dan Bacteria yang berada dekat dengan akar pohon filogenetik hidup di lingkungan yang ekstrim, seperti anaernb, pH rendah, kadar garam tinggi, dan suhu tinggi. Sebagian besar tergolong hipertermofil yang hidup optimum di atas 90°c, seperti kondisi lingkungan awal kehidupan di bumi. Berdasarkan ha1 tersebut selumh mikroorganisme diperkirakan memiliki nenek moyang hipertermofil (Adams & Kelly 1995; Blochl et a/. 1995).
Mikroorganisme yang hidup di lingkungan bersuhu tinggi diklasifikasikan: (1) termofil, suhu optimum pertumbuhan di antara 45 OC
-
65 OC dan (2) termofil ekstrim (kaldoaktif), tumbuh di atas 65 OC-
70 OC (Steel & Walker 1991). Madigan et a/. (2000)menamakan hipertermofil bagi mikroorganisme yang tumbuh optimum pada suhu di atas 90 OC dan mati di bawah 60 OC. Hipertermofil hanya terdapat pada habitat bersuhu tinggi
sepefti mata air panas, kawah, solfatara, dan sumber air panas dasar laut.
Sebagian besar hipertermofil bersifat anaerob obligat, dan beberapa diantaranya bersifat heterotrof obligat, yaitu hanya dapat menggunakan senyawa karbohidrat atau protein kompleks sebagai sumber karbon. Ada juga hipertennofil yang tergantung pada senyawa belerang untuk pertumbuhannya, dan menghasilkan hidrogen sulfida yang bersifat korosif (Adams & Kelly 1995). Hipertermofil yang dikenali bani sejumlah 47 spesies yang dikelompokkan ke dalam 23 genera dan 10 ordo dari kelompok bakteri dan
t
arkaea. Bakteri hipertermofil yang tumbuh pada suhu tertinggi adalah Aquifex
pymphilus dan Thermotoga maritima masing-masing pada 95 OC dan 90 OC. Arkaea
yaitu pada kisaran 103-1 1 O'C , misalnya Pyrococcus, Pymbaculum, Pyrodictium, dan Methanopyms (Blochl et a/. 1995).
Sebagian besar termofil berasal dari genera pembentuk endospora, yaitu Bacillus dan Clostridium. Mikroorganisme termofilik yang lain antara lain dari kelompok aktinomiset, bakteri asam laktat, bakteri gram negatif, dan sianobakter (Stell & Walker 1991).
Bacillus tennofilik
Bacillus termofilik telah diisolasi lebih dari 100 tahun yang lalu pada kisaran perturnbuhan mesofilik dan termofilik . Mikroorganisme ini sering dijumpai sebagai kontarninan produk makanan dan juga sebagai penghasil enzim termostabil, seperti protease, amilase, pullulanase, glukosa isomerase, lipase, xilanase, dan enzim restriksi DNA. Sifat tennodurik dan kemampuan menghasilkan endospora dari Bacillus termofilik sering digunakan pula sebagai indikator keberhasilan sterilisasi uap (Rainey et a/. 1994). Taksonomi Bacillus termofilik sebagian besar berdasarkan pada bentuk fenotipik dan karakterisasi genotipik. Analisis filogenetik Bacillus termofilik berdasarkan sekuens 16s rDNA dan rRNA telah berhasil dipelajari (Tabel 1). Rainey et a/. (1994) melaporkan Bacillus termofilik memiliki rasio basa mol % G+C dari gen IS rDNA di antara 57-63. Pada mikroorganisme mesofilik mol %
G
+ C tersebut di antara 53 dan 55.Tabel 1. Nilai mol %
G+C
dari DNA dan 16s-rDNA dari delapan galur Bacillus terrnofilik (Rainey et a/. 1994)Galur Suhu opt.* pH mol %
G+C
Mol%ec)
. . opt.* DNA G+C16s-rDNA
B. tlavothermus DSM 2641 60 5,5-9,0 6 1 57
B. thermooleovemns DSM 5366 55-65 6,O-7,5 58 59
6.
caldovelox DSM 4 1 1 60-70 6,3-8,5 65 596. caldolyt~~s DSM 405 72 6,O-8,O 52,53 59
B. caldotenax DSM 406 80 7,5-8,5 65,73 59
6. thermodenitrificans DSM 466 65-70 td 49 59
6. themomber DSM 7064 45-48 td 57 57
6. thermocatenulatus DSM 730 65-70 td 69 60
Keterangan: * suhu dan pH optimum pertumbuhan, td
=
tidak ditentukanEnzim
Enzim adalah protein yang dihasilkan oleh sel hidup dan berfungsi sebagai katalis biologi yang spesifik dan efisien. Hampir seluruh reaksi fisiologi dikatalisis enzim dengan meningkatkan kecepatan reaksi 10~-10'* kali lebih cepat daripada reaksi tanpa katalis enzim. Reaksi katalitik oleh enzim pada umumnya bersifat cepat membentuk reaksi kesetimbangan tanpa disertai reaksi samping, bekerja dalam larutan encer, berlangsung pada suhu rendah, dan kondisi netral (Ottaway & Apps 1984).
Enzim berupa protein globular yang terbentuk dari rantai polipeptida yang berlipat secara kompak. Konformasi tersier protein globular merupakan bentuk yang paling stabil, karena ditunjang oleh berbagai ikatan yang menstabilkan struktur tersier protein. Jenis-jenis ikatan tersebut adalah: ikatan hidrogen yang terdapat di antara gugus R
,
Struktur protein enzim mempenganrhi aktivitas katalitiknya. Aktivitas katalitik enzim akan hilang bila te jadi denaturasi protein. Denaturasi adalah perubahan konformasi molekul protein dari bentuk berlipat menjadi bentuk tidak beriipat. Denaturasi dapat menyebabkan kehilangan aktivitas biologi, kelarutan, dan kemampuan untuk membentuk kristal. Denaturasi dapat disebabkan oleh kondisi pH ekstrim, suhu tinggi, dan pengaruh senyawa seperti: detergen ionik, pelarut organik, urea konsentrat, anion besar dari asam kuat (ClOj, CCI 3CO03, dan ion chaotropic (I-, SCN') (Ottaway & Apps 1 984).
Enzim Tennostabil
lstilah termostabil (stabil panas) didefinisikan dengan sejumlah arti dan bersifat relatif. Sebagian besar definisi termostabil bemubungan dengan sifat alami enzim dan sumber penghasilnya. Maka ada yang mendefinisikan enzim termostabil sebagai enzim yang memiliki suhu aktivitas maksimum di atas suhu pertumbuhan organisme penghasilnya. Namun pada kenyataannya, ada enzim yang dihasilkan oleh mikroorganisme yang hidup pada suhu 90°C tetapi mempunyai suhu aktivitas optimum di bawah atau di atas suhu pertumbuhannya.
memiliki waktu p a ~ h pada suhu 5 0 ' ~ yang jauh lebih lama dari pada enzim termolabil (tidak tahan panas) (Ng & Kenealy 1986).
Mikroorganisme (hiper)termofil berpotensi sebagai penghasil enzim termostabil. Enzim yang dihasilkannya memiliki nilai ekonomis, antara lain:(l) stabil selama penyimpanan akan mengurangi biaya produksi dan memudahkan untuk proses pemumian enzim, (2) reaksi berlangsung pada suhu tinggi sehingga akan mengurangi kontaminasi oleh bakteri mesofil, (3) lebih tahan terhadap pelarut, detergen, dan senyawa denaturan, (4) pada suhu tinggi proses fermentasi akan lebih cepat, karena reaksi enzim akan meningkat, dan (5) pemisahan produk yang mudah menguap akan lebih cepat (Steel &Walker 1991).
Perbandingan komparatif protein dari mesofil dan termofil menunjukkan terdapat kesamaan uri-ciri molekuler dan katalitik di antara protein yang mengatalisis reaksi yang sama dari kedua organisme tersebut (Steel & Walker 1991). Berdasarkan studi residu asam amino pada sisi katalitik enzim, protease termostabil yang berasal dari
B. steamthennophilus dan B. themopmteolyticus menunjukkan 85% homolog, dan protease termolabil (tidak tahan panas) dari B. subtilis dan B. amyloliquefaciens menunjukkan 82% homolog. Protease B. stearothermophilus hanya menunjukkan 30% homolog dengan protease B. subtilis. Sekuen dari 17 residu asam amino, termasuk residu histidina pada sisi aktif dari keempat protease netral ini bersifat sangat konservatii, dan diduga memiliki struktur tiga dimensi yang sama (Rao et al. 1998).
Sifat ketahanan terhadap panas suatu protein atau enzim dapat diinduksi dengan penambahan senyawa nonprotein atau melalui modifikasi fisiko kimia. Modifikasi kimia dilakukan dengan cara mereaksikan enzim dengan substrat, pelarut, garam, dan kation. Sebagai contoh, gliserol, sukrosa, dan etilen glikol biasa dicampurkan dengan enzim selama masa penyimpanan. Ion kalsium dapat mempertahankan kestabilan terhadap panas pada enzim protease dan amilase. Demikian pula ion magnesium, strontium, dan barium memberikan pengaruh yang sama seperti kalsium pada a -amilase Aspergillus orylae (Ng & Kenealy 1986).
Enzim termostabil yang dipasarkan ada pula yang berasal dari mesofil. Melalui teknik rekombinasi DNA, memungkinkan untuk mengklon enzim terrnofilik ke dalam inang mesofilik untuk menghasilkan enzim termostabil. lmanaka et al. (1986) melakukan mutasi terarah dengan cara mensubstitusi asam amino pada daerah yang bukan konservatif dari protease netral termostabil dan terrnolabil yang berasal dari Bacillus temyata dapat pula meningkatkan termostabilitas.
Protease Mikroorganisme
Protease atau enzim proteolitik adalah enzim yang memiliki daya katalitik terhadap ikatan peptida dari suatu molekul polipeptida atau protein. Protease dapat diisolasi dari tumbuhan (papain, bromelin), hewan (tripsin, kimotripsin, pepsin, renin), dan mikroorganisme (bakteri, kapang, dan virus). Protease merupakan enzim hidrolitik yang paling banyak diperdagangkan dalam industri ( 5 60%), sebanyak 2 40% di antaranya berasal dari mikrorganisme. lndustri yang memanfaatkan protease antara lain industri detergen, makarian, tekstil, kulit, dan farrnasi (Rao et al. 1998).
(EC 3.4). Protease diklasifikasikan berdasarkan tiga kriteria utama: (1) jenis reaksi yang dikatalisis, (2) sifat kimia sisi katalitik, dan (3) hubungan evolusi struMur enzim.
Protease terdiri dari dua kelompok utama ditinjau dari jenis reaksi yang dikatalisis yaitu eksopeptidase dan endopeptidase. Eksopeptidase memotong ikatan peptida dekat dengan ujung amino (aminopeptidase, EC 3.4.11
-
EC 3.4.14), atau ujung karboksil (karboksipeptidase, EC 3.4.16-
EC 3.4.18) dari molekul substrat. Endopeptidase (EC 3.4.21-
EC 3.4.34) memotong ikatan peptida pada bagian dalam rantai polipeptida dan jauh dari ujung amino atau karboksil molekul substrat.Endopeptidase dikelompokkan ke dalam 4 subkelompok berdasarkan mekanisme katalitik enzim, yaitu: protease serina (EC 3.4.21), pmtease sisteina (EC 3.4.22), protease asam (EC 3.4.23), dan protease logam atau metaloporotease (EC 3.4.24). Rawlings & Barret memberi kode bertunrt-turut: S, C, A, dan M untuk memudahkan penamaan keempat subkelompok tersebut. Endopeptidase yang belum diketahui mekanisme katalitiknya diberi nomor EC 3.4.99 (Rao eta/. 1998).
Penggolongan protease berdasarkan sekuen asam amino atau sekuen nukleotida penyandinya mengarah pada hubungan evolusi s t ~ k t u r enzim. Sebagai contoh, dendogram Treeview package menyeleksi sekuen asam amino dari protease yang berasal dari mikroorganisme, tumbuhan, dan hewan melalui program SWISS-PROT dan PIR. Protease ini kemudian dikelompokkan ke dalam tiga kelompok yang berbeda berdasarkan pH aktivitas enzim (Rao et a/. 1998).
- Protease Serina
Protease serina dicirikan dengan kehadiran gugus serin pada sisi aktif. Protease serin dihambat antara lain oleh senyawa 3,4-dikloroisokoumarin (3,4-DCI),
Protease serina terdiri dari dua tahap reaksi hidrolisis, yaitu asilasi dan deasilasi. Tahap asilasi ditandai dengan pembentukan senyawa antara enzim-peptida yang berikatan kovalen bersamaan dengan hilangnya fragmen asam amino atau peptida. Pada tahap deasilasi terjadi serangan nukleofilik senyawa antara oleh air yang menyebabkan hidrolisis peptida (Rao et a/. 1998).
Protease serina yang berasal dari mikroorganisme dikelompokkan oleh Morihara
ke dalam empat kelompok protease: serupa tripsin, alkalin, a-litik Myxobacter, dan stafilikokal (Tabel 2). Protease serina dari setiap kelompok menunjukkan kespesifikan yang khas pada sisi pemotongan substrat. Kelompok pertama menunjukkan kespesifikan terhadap asam amino basa, kelompok kedua terhadap residu aromatik atau hidrofobik, kelompok ketiga terhadap residu alifatik sederhana, seperti alanina, dan kelompok keeempat spesifik terhadap residu asam (aspartat atau glutamat) pada sisi karboksil dari titik pemotongan substrat sintetik atau rantai-B insulin teroksidasi (Ward 1 983).
Tabel 2. Pengelompokan dan ciri-ciri protease serina mikrorganisme (Ward 1983; Tsuchiya et a/. 1992)
-
Kelompok Contoh Mikrob Ciri-ciri Senyawa
Protease Serina Penghasil Penghambat
Serupa tripsin Streptomyces sp.
-
Aktif pada pH 8,O DFP, TLCK-
BM 20000-
pH isoelektrik 4Alkalin -Bacillus lichenifomis
-
pH optimum 8-9 DFP, PMSF (Subtitisin Carlsberg)-
BM 27277-
pH isoelektrik 9,4-Themoactinomyces
-
pH optimum 1 1,5I SP.
-
BM 25000a-litik
-
Mycobacterium-
Aktif pada pH 9,O DFPMyxobader
-
SomngiumStafilokokal Staphylococcus
-
pH optimum 4,O- DFPa u l ~ u s 7,8
Protease Asam
Protease asam atau protease asam aspartat tergantung pada kehadiran residu asam aspartat untuk aktivitas katalitik enzim. Serangan nukleofilik pada protease asam dilakukan oleh dua transfer proton: satu dari nukleofil ke diad dari dua gugus karboksil, dan yang lainnya dari diad ke karbonil oksigen substrat (mekanisme dorong-tank [push-
pulll) yang akan membentuk senyawa antara tetraherdral bermuatan netral. Bentuk tetrahedral ini akan pecah kembali dengan mekanisme dorong-tank (Polgar 1990).
Protease asam terdiri dari tiga subkelompok: pepsin, retropepsin, dan enzim yang berasal dari pararetrovirus. Sebagian besar protease asam aktif pada pH 3-4, BM 30000
-
40000, titik isoelektrik antara pH 3-
43, dihambat oleh pestatin, dan sensitif terhadap senyawa diazoketon, seperti: diazosetil-DL-norleusin metilester (DAN) dan 1,2- epoksi-3-(pnitrofenoksi)propana (EPNP) dengan kehadiran ion tembaga. Protease asam banyak dihasilkan oleh fungi, dan jarang dihasilkan bakteri (Ward 1983; Rao et a/.1998).
Protease Sisteina
Protease sisteina atau protease tiol memerlukan asam amino sisteina dan histidina untuk aktivitas katalitik enzim. Berdasarkan kespesifikan rantai samping, protease ini terdiri dari 4 subkelompok: serupa papain, serupa tripsin, spesifik untuk asam glutamat, dan lainnya (di luar ketiga subkelompok pertama). Papain mempakan protease sisteina memiliki pH optimum netral, dan sensitii terhadap senyawa sulfidril, seperti PCMB. Klostripain merupakan contoh protease sisteina yang menunjukkan kekhasan pada asam amino bash pada sisi karboksil dari titik potong, BM 50000, dan pH isolelektrik 4,8-
asil-tiol. Mekanisme reaksi protease sisteina mirip dengan protease serina, kecuali nukleofil berupa gugus tiolat bukan hidroksil (Polgar 1990).
Metaloprotease
Metaloprotease (protease logam) membutuhkan ion logam divalen untuk aktivitas enzim. Mekanisme reaksi metaloprotease agak berbeda dengan ketiga jenis protease lainnya. Pada termolisin, gugus karboksilat dari Glu 143 membantu serangan nukleofilik ikatan zink dengan molekul air pada karbon karbonil ikatan peptida. Pengelompokan protease logam berdasarkan kespesifikan reaksi terdiri dari: netral, alkalin, Myxobacter I, dan Myxobader II (Tabel 3). Keempat subkelompok ini dihambat oleh senyawa pengkhelat, seperti etilendiamintetraasetat (EDTA). Protease netral menunjukkan kespesifikan terhadap asam amino hidrofobik, protease alkalin menunjukkan kespesifikan yang sangat has, Myxobacter I spesifik pada asam amino sederhana pada kedua sisi titik potong, dan Myxobacter II spesifik pada residu lisina pada sisi amino ikatan peptida (Ward 1983; Rao et a/. 1998).
Tabel 3. Pengelompokan, ciri-ciri, dan contoh metaloprotease mikroorganisme (Ward 1983; Kubo et a/. 1988)
Kelompok Contoh Mikrob Penghasii - Ciri-ciri
1
Metaloprotease
Netrai B. steamthermophilus
-
BM 34000-
pH optimum 7,5-
dihambat oleh ImM EDTAAlkalin
-
Pseudomonas aemginosa-
BM 48000-60000-
Semtia spp.-
pH optimum 7,O-9,O-
Peka pada konsentrasi EDTA > IO-~M,
Myxobacter I
-
Sorangium sp.-
BM 14000-
Mycobacter sp.-
pH optimum 9,O-
Myxobacter I I
-
Mycobacter sp.-
BM 17000 [image:142.566.50.514.25.743.2]Protease Tennostabil Bacillus
Protease termostabil yang dihasilkan Bacillus dan telah digunakan secara komersial, antara lain subtilisin, termolisin, dan kaldolisin. Ketiga enzim ini mengikat satu atau lebih kalsium yang berguna untuk kestabilan enzim di lingkungan ekstraseluler. Protease yang berikatan dengan kalsium tidak cocok digunakan dalam industri detergen, karena detergen mengandung senyawa antara lain tripolifosfat yang dapat mengkhelat kalsium. lndustri detergen memerlukan enzim yang stabil pada pH alkalin dan denaturan kimia. Subtilisin yang bersifat alkalin telah digunakan dalam industri detergen dengan terlebih dahulu dimodifikasi. Residu 75-83 yang merupakan loop pengikatan kalsium subtilisin dihilangkan dan sisi aktii senna 221 diganti dengan sisteina. Delesi residu 75-83 menyebabkan destabilisasi protein, tetapi kemudian mereka menciptakan struktur baru untuk kestabilan enzim dengan cara mutagenesis terarah menggunakan oligonukleotida pendek. Mutan baru yang terbentuk memiliki aktivitas protease dengan 1000 kali lebih tahan terhadap senyawa pengkhelat (Strausberg et a/. 1995). Peningkatan termostabilitas subtilisin dilakukan dengan menambah ikatan disulfida menggunakan mutagenesis terarah pada AsnlO9 dan Asn21 8 dengan Ser (Rao et a/. 1998).
Kaldolisin dihasilkan oleh B. caldolyticus dan Thennus aquaticus T-351. Kaldolisin memiliki waktu paruh selama 193 jam pada suhu 7 5 ' ~ dalam 10 mM CaCI2, dan bila tanpa kalsium hanya 4,8 menit. Kaldolisin mengikat enam ion ca2' untuk setiap molekul enzim. Ada dua tipe pengikatan kalsium pada kaldolisin empat ion ca2' terikat secara lemah dan dapat dihilangkan dengan kromatografi penukar kation. Dua ion ca2'
v
lainnya terikat kuat dan menentukan kestabilan enzim (Steel & Walker 1991).
1972 dari B. cereus. Enzim ini relatif stabil terhadap suhu tinggi. Struktur kristal termolisin termostabil ekstrim yang berasal dari B. thermopmteolyticus, termostabil moderat NP-cer yang berasal dari 8. cereus terdiri, dan dari NP lainnya terdiri dari
domain N-terminal (residu 1-154) mengandung lipatan beta, dan domain C-terminal (residu 153316) mengandung alfa heliks. Termolisin mengandung satu atom zink pada sisi aktiif dan dua hingga empat ion ca2' untuk kestabilan enzim (Eijsink et a/. 1995). Spesies-spesies Bacillus yang menghasilkan enzim yang memiliki sifat termostabilitas dan homologi yang serupa dengan termolisin dengan termolisin B. thermopmteolyticus
terdapat pada Tabel 4.
Tabel 4. Homologi dan termostabilitas protease netral yang dihasilkan oleh spesies
Bacillus (Eijsink et a/. 1993).
Spesies Bacillus Nama enzim ldentik relatii (%) T50
CC)
6. thermopmteolyticus termolisin 100 82,O
B. ~ a l d ~ l y f i ~ ~ ~ NP-=I 86
76,7
B. stearothennophilus N P-ste 85 68,5
8.
cereus NP-cer 73 60,O8.
subtilis NP-sub 47 55,36. amyloliquefaciens N P-amy 47 55
[image:144.566.44.508.7.747.2]Pemumian Enzim Protease
Pemumian bertujuan untuk memisahkan enzim yang diinginkan dari senyawa yang tidak dikehendaki lainnya. Tahaptahap pemumian tergantung dari tujuan akhir, apakah untuk tujuan komersial atau tujuan riset. Enzim yang kasar atau yang dimumikan sebagian masih dapat dipakai untuk komersial, sedangkan enzim yang mumi atau hampir mumi dikehendaki dalam riset atau dipakai dalam produk analitik. Hanis (1989) menyebutkan minimal ada tiga strategi dalam pemumian enzim yang hams dipetttatikan: (1) kualitas; perlu tindakan untuk mempertahankan aktivitas protein dengan cara mengurangi proteolisis dan denaturasi, (2) kuantitas; pemakaian akhir dari protein mumi akan menentukan kuantitas enzim yang diperlukan, (3) ekonomis yang merupakan kunci penting bila akan dipakai dalam industri, atau diterapkan dalam skala laboratorium.
Pemekatan Enzim
Pemekatan protein enzim merupakan tahap awal dari prosedur pemumian enzim sebelum tahap pemumian berikutnya atau dapat pula digunakan untuk keperluan analisis enzim (Hanis 1989). Pemekatan protein dapat dilakukan dengan dua metode, yaitu analitik dan preparatif (penyiapan). Metode analitik menggunakan pengendapan asam (misalnya asam trikloroasetat), pengendapan organik (misalnya aseton atau etanol), dan imunopresipitasi dapat menyebabkan denaturasi protein. Berbeda dengan metode analitik, metode preparatif tetap mempertahankan aktivitas protein. Pemekatan protein dengan metode preparatif misalnya dengan menggunakan pengendapan dengan
1
protein yang biasa dilakukan dalam pengendapan protease adalah menggunakan garam amonium sulfat dan pelarut organik aseton.
Prinsip pengendapan dengan garam berdasarkan pada kelarutan protein yang berinteraksi polar dengan molekul air, interaksi ionik protein dengan garam, dan daya tolak menolak protein yang bermuatan sama. Kelarutan protein (pada pH dan suhu tertentu) meningkat pada kenaikan konsentrasi garam (salting in). Kenaikan kelarutan protein akan meningkatkan kekuatan ion larutan. Pada penambahan garam dengan konsentrasi tertentu kelarutan protein menurun (saking out). Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein. Peristiwa ini mengakibatkan protein sating berinteraksi, beragregasi, dan kemudian mengendap (Hanis 1989; Scopes 1987). Amonium sulfat merupakan garam yang paling sering digunakan untuk mengendapkan protein karena memiliki daya larut tinggi di dalam air, relatif tidak mahal, dan kestabilan protein di dalam larutan amonium sulfat (2M
-
3M) tahan bertahun-tahun (Scopes 1987).Pengendapan protein dengan menggunakan pelarut organik berdasarkan pada pengurangan kelarutan protein dan konstanta dielektrika pelarut. Semakin banyak pelarut organik yang ditambahkan, semakin berkurang daya solvasi air dan muatan pada permukaan molekul protein yang hidrofilik. Hal ini akan menjadikan molekul- molekul protein cenderung berinteraksi dengan sesamanya, hingga akhimya protein mengendap. Prosedur pengendapan pelarut organik dilakukan pada suhu di bawah O'C. Pada suhu di atas
loOc,
konformasi protein akan segera berubah yang memungkinkan molekul-molekul pelarut organik mendapatkan jalan masuk ke bagian dalam struktur pfotein, kemudian akan merusak interaksi hidrofobik dan akhimya akan terjadi denaturasi (Hartis 1989; Scopes 1987).pengendapan pelarut organik, tetapi pada PEG hanya perlu konsentrasi yang lebih rendah dari 20%. Berat molekul PEG yang digunakan berkisar 6000-20000.PEG adalah polimer nonionik yang tidak larut. Pengendapan enzim dengan PEG tidak mempengaruhi tahap pemumian berikutnya, misalnya dengan kromatografi penukar ion atau kromatografi afinitas (Hams 1989).
Garam yang berlebih yang terdapat di dalam larutan enzim setelah tahap fraksinasi dapat dihilangkan dengan cara dialisis. Pada tahap dialisis, protein ditempatkan di dalam kantung (membran) semipermeabel yang direndam di dalam larutan bufer tertentu. Molekul yang berukuran kecil akan ke luar melalui membran, dan molekul yang berukuran besar akan tertahan di dalam membran dialisis. Ukuran pori kantung dialisis yang terbuat dari bahan selulosa asetat ini berdiameter 1-20 nm. Ukuran ini menunjukkan berat molekul minimum yang dapat tertahan di dalam membran.
Selain dengan dialisis, penghilangan garam dapat dilakukan dengan filtrasi gel. Metode ini biasanya diterapkan untuk sampel yang sedikit, yaitu tidak melampaui 25- 30% volume kolom untuk mendapatkan resdusi yang memadai antara protein dan garam. Matriks filtrasi gel memiliki pori yang berukuran kecil , misalnya Sephadex G-25 buatan Pharmacia. Kekurangan metode ini adalah tejadi pengenceran sampel protein (Harris 1989).
Kromatografi Kolom
Pemumian enzim protease yang biasa dilakukan adalah menggunakan kromatografi kolom. Ada beberapa cara kromatografi kolom, antara lain kromatografi
I
filtrasi gel, kromatografi penukar ion, kromatografi interaksi hidrofobik, kromatografi afinitas, dan kromatografi cair berkinerja tinggi.
19
dikemas di dalam kolom dan dielusi dengan fase cair-mobil. Pori-pori matriks dapat rnenampung molekul yang berukuran lebih kecil dan memisahkannya dari molekul yang berberat molekul tinggi. Kromatografi filtrasi gel dapat digunakan pula untuk estimasi berat molekul (Scopes 1987).
Kromatografi penukar ion memanfaatkan perbedaan afinitas antara molekul berrnuatan di dalam larutan dengan senyawa yang tidak reaktii yang bermuatan beriawanan sebagai pengisi kolom. Perrnukaan protein terdiri dari muatan positif dan negatif tergantung dari rantai samping asam amino asam dan basa. pH protein dengan jumlah muatan positif dan negatif sama disebut titik isoelektrik (pl). pl sebagian besar protein di antara pH 5 dan 9. Protein yang memiliki pH di atas pl akan bermuatan negatif, sedangkan pH di bawah pl bermuatan positii.
Pengejaan kromatografi penukar ion didahului dengan mengelusi protein enzim dengan pH bufer awal yang telah diatur. Protein diharapkan terikat kuat pada kolom, dan protein lain dibiarkan terelusi lebih dahulu. Protein yang terikat pada kolom dilepaskan dengan cara mengubah pH bufer atau kekuatan ion pelarut. Matriks penukar ion mengikat secara kovafen gugus fungsional yang bermuatan negatif pada penukar kation, atau gugus fungsional yang bermuatan positif pada penukar anion. Matriks berupa polimer elastis dan mengandung senyawa resin sintetik terbuat dari bahan dekstran, selulosa, atau Sephadex Contoh matriks penukar kation dan anion masing- masing adalah karboksirnetil selulosa (CMC) dan dietilaminoetil (DEAE) selulosa (Scopes 1 987).
lebih dulu, protein yang terikat dielusi dengan menggunakan eluen yang polaritasnya diturunkan (konsentrasi garam lebih rendah) (O'Farrel 1998).
Pemisahan protein dengan kromatografi afinitas berdasarkan interaksi spesifik di antara makromolekul biologi dengan pasangannya, sebagai contoh enzim dengan substrat atau inhibitor, dan antibodi dengan antigen. Ligan akan terikat secara kovalen pada matriks. Komponen protein yang memiliki afinitas spesifik terhadap ligan akan diserap, dan komponen lainnya (protein kontaminan) yang tidak memiliki afmitas akan terelusi lebih dulu. Komponen protein yang telah diserap dapat diiepaskan dengan mengubah kondisi elusi, misalnya mengubah pH, menambahkan kofaMor atau substrat (Jack 1998).
Kromatografi cair berkinerja tinggi fase-balik (mersed-phase high performance liquid chromatography) digunakan untuk isolasi, analisis, dan elusidasi struktur molekul peptida dan protein. Mekanisme teknik kromatografi ini adalah protein akan terikat berdasarkan karakter hidrofobiknya. lnteraksi hidrof&ik tejadi antara pelarut dengan ligan hidrofobik di permukaan. Peningkatan muatan ion pelarut pada fase mobil akan mengurangi kekuatan ikatan dan akhimya senyawa akan terelusi. Teknik kromatografi ini banyak digunakan dalam bioteknologi untuk mengamati tingkat kemumian dan stabilitas protein (Neville 1998).
Elektroforesis dan Zimogram
berikatan dengan SDS yang berbentuk elips atau batang yang ukurannya sebanding dengan berat molekul protein. Protein dalam bentuk kompleks yang berrnuatan negatif ini akan dapat terpisahkan bedasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel poliakrilamida. Berat molekul protein dapat diukur dengan menggunakan protein standar yang telah diketahui berat molekulnya dengan cara membandingkan nilai mobilitas relatif (R9 (Smith 1984).
Elektroforesis gel native (nondenaturasi) memisahkan protein terlanrt yang tidak mengendap atau beragregasi selama elektroforesis. Metode ini dapat pula diterapkan untuk protein dengan kelarutan rendah, seperti protein rnernbran, dengan menambahkan detergen nonionik, misalnya 0,5% Triton X-100 ke dalam gel. Pada elektroforesis gel yang terdenaturasi, seperti pada SDS-PAGE, molekul-molekul protein yang telah terpisah dengan elektroforesis dapat kehilangan aktivitas biologi dan biokimia, tetapi pada elektroforesis nondenaturasi aktivitas tersebut masih bertahan (Dunn 1989).
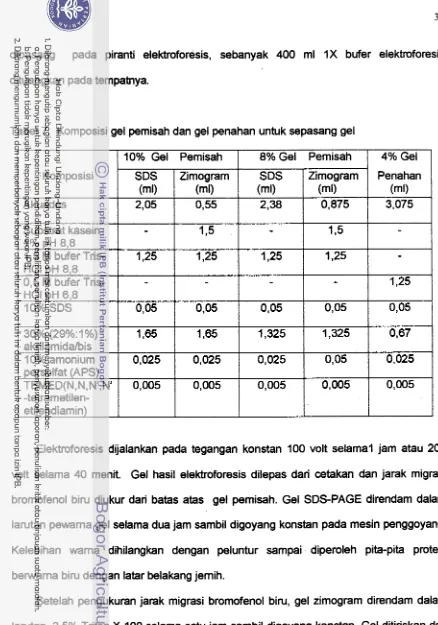
Zimografi adalah teknik elektroforesis untuk menetapkan aktivitas proteolitik. Teknik ini telah banyak digunakan untuk rneneliti enzim matrix degmding ekstrseluler, misalnya matrix metaloprotease (MMPs). Berbeda dengan SDS-PAGE, gel pemisah disisipi substrat protein (gelatin atau kasein) yang akan dihidrolisis oleh protease selama masa inkubasi. Enzirn dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi. Penambahan detergen Triton X-100 akan melepaskan SDS dan kembali te rjadi pelipatan protein (renaturasi). Gel diwamai dengan Coomassie Blue, dan molekul protein yang memiliki aktivitas proteolitik tampak sebagai pita bening. Metode zimografi bersifat mudah, bnsitif, dan kuantitatif dalam menganalisis aktivitas proteolitik (Kleiner & Stetler-Stevenson 1994; Leber & Balkwill 1997).
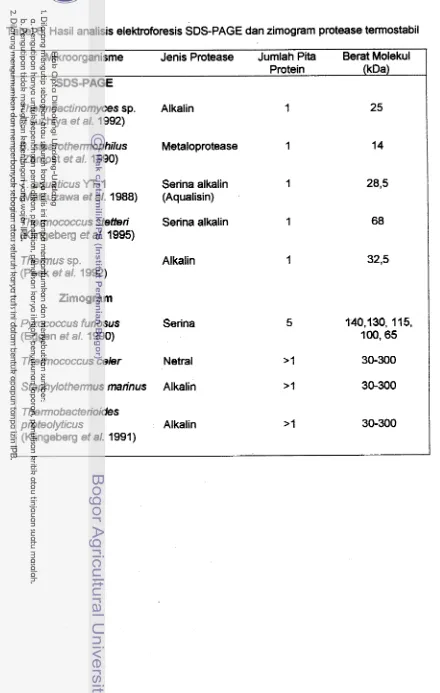
dikehendaki oleh setiap peneliti. Data hasil elektroforesis dari beberapa protease termostabil ditampilkan pada Tabel 6.
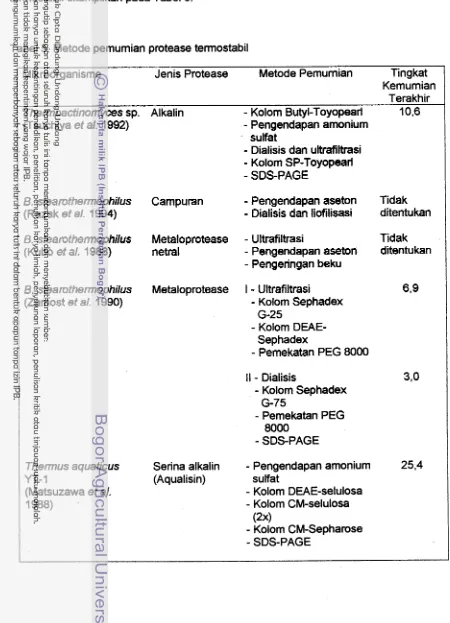
Tabel 5. Metode pemumian protease termostabil
Mikroorganisme Jenis Protease Metode Pemumian Tingkat Kemumian
Terakhir
Thermoactinomyces sp. Alkalin
-
Kolom Butyl-Toyopearl 10,6(Tsuchiya et a/. 1992)
-
Pengendapan amonium sulfat-
Dialisis dan ultrafiltrasi-
Kolom SP-Toyopearl-
SDS-PAGE8. steamthermophilus Campuran
-
Pengendapan aseton Tidak(Razak et a/. 1994)
-
Dialisis dan liofilisasi ditentukanB. steamthermophilus Metaloprotease
-
Ultrafiltrasi Tidak(Kubo et a/. 1988) netral
-
Pengendapan aseton ditentukan-
Pengeringan bekuB. steamthemophilus Metaloprotease I
-
Ultrafiltrasi 619(Zamost et a/. 1 990)
-
Kolom Sephadex G-25-
Kolom DEAE- Sephadex-
Pemekatan PEG 8000Il
-
Dialisis 3,o-
Kolom Sephadex G-75-
Pemekatan PEG 8000-
SDS-PAGETherrnus aquaticus Serina alkalin
-
Pengendapan amonium 25,4YT-1 (Aqualisin) sulfat
(Matsuzawa et a/,
-
Kolom DEAE-selulosa1988) -
-
Kolom CM-selulosa(2x1
Tabel 6. Hasil analisis elektmforesis SDS-PAGE dan zimogram protease terrnostabil
Mikrooraanisme
-
Jenis Protease Jumlah Pita Berat MolekulI
Protein (kDa)
SDS-PAGE
Thermoactinomyces sp. Alkalin (Tsuchiya et a/, 1992)
6. steamthermophilus Metaloprotease
(Zamost et a/, 1990)
T. aquaticus YT- 1 Senna alkalin
(Matsuzawa et al. 1988) (Aqualisin)
Thennococcus stetten Senna alkalin
(Klingeberg et a/. 1995)
Thermus sp. Alkalin
(Peek et al. 1 992)
Zimogram
Pymcoccus furiosus Senna
(Eggen et al. 1990)
Thermococcus
celer
NetralStaphylothermus marinus Alkalin
Thermobacterioides
pmteolyticus Alkalin
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini terdiri dari: autoklaf (Tomy SS-245, Tokyo, Jepang), inkubator (WTB Binder, Tuttlingen, Jerman), inkubator goyang (Precision Scientific, Ilinois, Chicago, USA, dan CertomatO, Melsungen, Jerman),
spektmfotometer UV-Vis (Hitachi U-2010, Jepang), spebfotometer visibel (Pharmacia LKB-Novaspec II, Swedia), inkubator (penangas) goyang (Precision Reciprocal Shaking Bath Model 50, USA, & CertomatR WR, Jerman), sentrifuge dingin (Tomy MRX-152, Tokyo, Jepang, dan Sorvall RC 5B dengan rotor Sorvall SS-34 dan GSA buatan Dupont,
Newton, Connecticut, USA), sentrifuge mikro (Beckman
Em,
UK), lemari es (Hitachi, Jepang), lemari pembeku (Super Jet Cool Refrigerator, Jepang), mesin pengering beku (Edwards, UK), mesin pembuat es (Ziegra EIS, Jerman), oven (WTB Binder, Jerman), mesin PCR (Perkin Elmer Gene ~ m PCR System 2400, USA), sekuenser DNA p ~ otomatis (ABI Prism 377 buatan PE Biosystem, Branchburg, N.J., USA), neraca (Ohaus, N.J., USA, dan Meffler, N.J.,USA), pH meter (Jenway 3020, USA), UV transiluminator (Hoefer Scientific Inst, USA), alat penggoyang (Hoefer Red Rocker, USA), piranti elektroforesis protein (Mini-PROTEAN II Biorad, USA), piranti elektroforesis asam nukleat (Biorad, USA), kamera (Polaroid DS-34, USA), alat penampung fraksi (RediFrac Pharmacia Biotech, U ppsala, Swedia), kolom kromatografi (Biorad, USA), mesin pengocok (Genie 2",uSA) , pengaduk magnetik (Heidolph MR 2000, Jerman), pompa vakum (Millipore, USA), dan pipet mikro (Gilson, USA)Pengamatan Morfologi dan Fisiologi lsolat GP-04
Morfologi dan ciri mikroskopi isolat GP-04 (Dimawan 2000) diamati dengan mikroskop pada perbesaran 1000 x, serta dilakukan pewamaan gram dan endospora. Pewamaan Gram dilakukan dengan cara: preparat olesan bakteri yang telah difiksasi panas digenangi pewarna ungu kristal selama 1 menit, dibilas dengan air, dan ditiriskan. Olesan digenangi iodium Gram selama 2 menit dan dicuci dengan 95 % etanol selama 30 detik. Setelah pewama ungu kristal tidak terbilas lagi, olesan dicuci dengan akuades, dan ditiriskan. Olesan digenangi dengan pewama safranin selama 30 detik, dibilas dengan akuades, ditiriskan, dan dikeringkan dengan kertas serap. Pada pewamaan endospora dotesan bakteri yang telah difiksasi panas digenangi dengan pewama hijau malakit, dan dipanaskan di atas pembakar bunsen selama 10 menit Kelebihan pewama dicuci dengan akuades, kemudian di atas olesan digenangi dengan safranin selama 1 menit, dibilas kembali dengan akuades, dan ditiriskan. Bakteri yang telah diwamai diamati dengan mikroskop medan terang pada perbesaran 1000 x (Cappucino &
Sherman 1983). Foto mikroskopi bakteri dengan menggunakan mikroskop elektron payaran disiapkan dan dike rjakan di Fakultas Petemakan, IPB.
Biakan yang akan diamati ciri fisiologinya ditumbuhkan pada media agar. Sebanyak
satu lup biakan disuspensikan di dalam garam fisiologis (NaCI 0,85 %). Kemudian 200 pI suspensi kultur diteteskan ke dalam sumur-sumur kit Microbact. Setelah diinkubasi semalam pada suhu 6 5 ' ~ , ke dalam setiap sumur ditetesi reagen yang sesuai uji yang dilakukan. Reaksi yang terbentuk dibandingkan dengan standar.
lsolasi DNA Total lsolat
GP44
lsolasi DNA menggunakan prosedur yang terdapat pada protokol kit IsoQuick (ORCA Research, Inc., Bathell, WA, USA). Kultur ditumbuhkan pada media LB (Luria-
Bertani broth) semalam sampai tercapai fase logaritmik (OD ,m
=
4 0,6). Kulturdisentrifugasi pada kecepatan 4000 x g
,
~ O C , selama 10 menit. Sebanyak 100 pI 50mg/ml lisozim dalam 1 x TE dicampurkan ke dalam pelet seluler dan diresuspensikan, kemudian diinkubasi pada suhu 37' C selama satu jam dan sesekali tabung dibolak- balik. Kemudian ditambahkan 100 p1 larutan lisis. Tabung dibolak-balik agar suspensi tercampur homogen. Suspensi sel yang lisis menjadi agak bening dan kental, kedalamnya ditambahkan 700 pl reagen 2 (matriks ekstraksi) dan 400 pl reagen 3 (bufer
ekstraksi), dikocok dengan mesin pengocok selama 10 detik dan disentrifugasi 10.000 x g 10 menit. Campuran membentuk dua lapisan, yaitu lapisan atas (fasa cair) yang berwama bening dan lapisan bawah. Fasa lapisan atas sebanyak 400
CJ
diambil dandipindahkan ke tabung steril yang lain, kemudian ditambahkan 0,l volume (40 pl)
2 menit. Supematan dibuang tanpa mengganggu pelet DNA. Sentrifugasi 10000 x g selama 2 menit dan diulang sampai tidak ada supematan yang tertinggal. Pelet DNA dikeringkan dengan cara vakum (15 kPa) sampai kering
&
10 menit). Pelet DNAdilarutkan dalam 20 pI reagen 5 (RNAse-bebas air) dicampur dengan cara diputar sebentar dengan sentrifige 10000 x g. Siapan DNA disimpan pada suhu 4 OC.
Amplifikasi dan Analisis Sekuen Gen 16s-rRNA lsolat GP-04
Sebanyak 70 ng total DNA isolat GP-04 diamplifikasi dengan kit Ready-To-Go PCR Beads (marmacia-Biotech, Swedia). Dua primer spesifik digunakan untuk amplifikasi sekitar 1300 bp gen 16s-rRNA, yaitu 63f (5'-CAGGCCTAACACATGCAA GTC) dan 1387r (5'
-
GGGCGGWGTGTACAAGGC) (Marchesi et a/. 1998). Campuranreaksi PCR (25 pl) mengandung 1,5 unit Taq DNA polimerase, 10mM tris HCI pH 9,0, 50 mM KCI, 1,5 mM MgC12, 200 pM dNTP, dan 5 pmol masing-masing primer. Kondisi PCR terdiri dari dari tahap: pre stad 94 OC , 2 menit, denaturasi 92 OC, 30 detik, annealing 55 OC, 30 detik, elongasi 75 OC, 1 menit, dan elongasi tambahan selama 5
P