FRAGMENTASI BUATAN DAN REPRODUKSI SEKSUAL
SPONS
Aaptos aaptos
DALAM UPAYA PERBANYAKAN STOK
KOLONI DI ALAM
MUJIZAT KAWAROE
PROGRAM STUDI ILMU KELAUTAN PROGRAM PASCA SARJANA INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Fragmentasi Buatan dan Reproduksi Seksual Spons Aaptos aaptos Dalam Upaya Perbanyakan Stok koloni Di Alam adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Oktober 2009
iii ABSTRACT
MUJIZAT KAWAROE, Artificial Fragmentation and Sexual Reproduction of
Aaptos aaptos Sponge in Multiplication Exertion of Colony Stock at Natural Habitat. Under direction of DEDI SOEDHARMA, RIDWAN AFFANDI, and ADI WINARTO.
In the present research, Aaptos aaptos sponge fragments were cultured in each periode at two sites of Pari Island, Seribu Islands, and pond at Ancol, DKI Jakarta. The parameters were measured i.e survival rate, specific growth rate, and evaluation to oocyte development by gamete maturity phase. A total of 336 sponge fragments cut and placed to vertical and horizontal (method) at frame in each location. The treatment was include wound at the body of sponge. Survival rate were high at pond compared to natural habitat. Southern part of Pari Island is apropriate place for fragmentation of Aaptos aaptos (Aa) sponge. Sponges fragments have an ability to regenerate their body and in 1 week they could attach the substrate so that after 1 month their body completely perfect same with their broodstock before fragmented. Sponges fragmented at vertical method have high survival rate compared to horizontal but their specific growth rate at horizontal better than vertical method. Specific growth rate differed significanctly per location and method but non significant per number of wound. Moon phase influence spawning frequency of Aa and spawning happen from new moon until full moon. External factor which is trigerring spawning are temperature, tide amplitude, and moon light. From in situ spawning research, Aa sponge is ovipar and fertilization is inside. Their released zygot (fertilized eggs) and soon after released zygot and embrio replicates their cell. Evaluation to oocyte development showed that gamete developed perfectly from phase I-IV for fragment at natural habitat but fragment at pond only produced gamete at phase I. Oocyte density at natural habitat lower than pond. The high survival, high specific growth rate and oocyte completely developed at phase I-IV suggest that this Aaptos aaptos sponge is a promising candidate for further mariculture development at natural habitat and pond.
iv RINGKASAN
MUJIZAT KAWAROE. Fragmentasi Buatan dan Reproduksi Seksual Spons
Aaptos aaptos Dalam Upaya Perbanyakan Stok koloni Di Alam. Dibimbing oleh DEDI SOEDHARMA, RIDWAN AFFANDI, dan ADI WINARTO
Spons laut menghasilkan banyak bahan-bahan bioaktif dengan komposisi farmasi yang sangat menjanjikan. Spons laut yang digunakan pada penelitian ini adalah Aaptos aaptos (Aa), yang telah diketahui memiliki kandungan senyawa
alkaloid dan aptamin dengan aktivitas penghambatan terhadap a-adrenoreceptor (Munro et al., 1999). Selain itu, senyawa alkaloid lain yang didapatkan dari spons
Aa memiliki aktivitas sebagai antikanker, anti- HIV dan anti-mikroba (Nakamura
et al., 1987). Pemanfaatan spons umumnya diambil secara langsung dari alam dan hanya sebagian kecil yang diperoleh dari hasil budidaya. Cara seperti ini jika dilakukan secara terus menerus diperkirakan akan mengakibatkan penurunan populasi secara signifikan bahkan dapat mengakibatkan terjadinya kepunahan. Oleh karena itu spons Aaptos aaptos (Aa) merupakan salah satu jenis spons yang perlu dipertimbangkan dalam upaya pengembangan budidaya melalui fragmentasi.
Budidaya laut (mariculture) merupakan metode yang menjanjikan untuk memproduksi biomasa spons diantara metode yang sudah pernah diujicobakan oleh beberapa peneliti. Metode yang paling banyak digunakan untuk membudidayakan spons adalah metode gantung. Metode gantung ini sudah diujicobakan pada spons mandi (bath sponge) sejak lama yang dilakukan oleh Schmidt dan Buccich di laut Mediterania, dan selanjutnya oleh Moore di Florida (Duckworth dan Battershill, 2003a). Metode gantung dilakukan dengan cara mengikat fragmen spons pada tali. Kestabilan posisi spons dibantu oleh keberadaan sistem pelampung.
Selama ini fragmentasi spons yang dilakukan oleh peneliti-peneliti sebelumnya tidak mempertimbangkan mengenai luka yang terjadi akibat dari fragmentasi tersebut. Kondisi luka pada spons baik luas maupun jumlah merupakan faktor penting yang ikut menentukan kelangsungan hidup dan selanjutnya pertumbuhan spons. Kemampuan beberapa organisme termasuk spons untuk hidup dan tumbuh kembali setelah perlukaan sangat tergantung dari ukuran dan jumlah luka (Chadwick and Loya, 1990 ; Duckworth et al., 2003), luka yang besar dan banyak seringkali menyebabkan fatal bagi spons. Jaringan yang melakukan regenerasi untuk tumbuh membutuhkan energi yang besar di luar energi yang diperlukan untuk melakukan pertumbuhan dan reproduksi yang selanjutnya menurunkan kesegaran spons. Luka yang besar dapat menyebabkan rusaknya sistem saluran spons, menurunkan efisiensi penyerapan nutrien, dan dapat menyebabkan kematian pada beberapa spesies spons.
v
berperan untuk mendukung fragmentasi spons Aa. Beberapa parameter yang mendukung pertumbuhan spons hasil fragmentasi tersebut adalah suhu air, kecepatan arus, TSS (Total Suspended Solid), salinitas, pH, TOM (Total Organic Matter), silikat, ammonia, fosfat, nitrat, COD (Chemical Oxygen Demand), DO (Disolve Oxygen).
Seksualitas pada spons Aaptos aaptos masih menjadi perdebatan dan memerlukan penelitian yang mendalam karena seksualitas ini dapat berbeda tergantung lokasi tempat tumbuhnya. Tipe dan cara reproduksi spons Aa pertama kali diungkapkan oleh Sara (1961) dalam Sara (1992) dalam bentuk tabulasi untuk membuat klasifikasi tipe dan cara reproduksi beberapa jenis spons dan sumber data berasal dari beberapa peneliti. Sumber data untuk spons Aa berasal dari penelitian yang dilakukan oleh Sara (1961). Haris (2004) juga telah menentukan tipe dan cara reproduksi spons Aa di perairan Pulau Barrang Lompo, Sulsel, Indonesia. Kedua penentuan tersebut terbatas pada analisis histologis jaringan spons dan sudah didasarkan pada pengamatan pengeluaran atau pelepasan hasil pemijahan spons Aa secara langsung di alam (in situ). Penelitian terhadap hasil pemijahan juga belum dilakukan termasuk perkembangan hasil pemijahan apakah telur, zygot, atau embrio. Hasil analisis histologis pada penelitian sebelumnya hanya memastikan bahwa gamet yang ada di jaringan mesohyl spons Aa adalah telur atau sperma berdasarkan perkembangan gamet sebelum pemijahan terjadi. Sehingga belum diketahui apakah spons Aa melakukan fertilisasi secara internal atau eksternal walaupun cara reproduksinya adalah ovipar.
Penelitian tentang pemijahan spons Aa secara langsung di alam dan pengaruh parameter lingkungan pada saat proses tersebut berlangsung masih belum pernah dilakukan sehingga belum diketahui faktor lingkungan/faktor eksternal yang menjadi pemicu terjadinya pemijahan tersebut. Proses pemijahan yang sudah sering diamati adalah yang dilakukan oleh karang (Reiswig, 1973 dalam Sidri et al., 2005). Sangat penting untuk melakukan penelitian tentang seksualitas spons Aa secara in situ dan faktor eksternal yang menjadi pemicu terjadinya spawning. Hasil yang diperoleh dari peneitian ini merupakan pendukung untuk melakukan penelitian metode fragmentasi buatan terhadap spons Aa dalam upaya perbanyakan stok di alam sehingga ketersediaannya untuk pemanfaatan selanjutnya dapat terjamin.
Tujuan penelitian ini adalah mengkaji upaya perbanyakan stok koloni spons Aaptos aaptos di alam melalui pendekatan fragmentasi buatan dan reproduksi seksual sehingga dapat dihasilkan SOP (Standar Operasi Prosedur) untuk melakukan fragmentasi terhadap spons Aa.
vi
Penelitian untuk mengetahui struktur morfologis spons Aa di alam dan tingkat kematangan dan ukuran oosit spons Aaptos aaptos secara histologis dilakukan pada tanggal 6 Maret 2007 sampai 7 Juni 2007, sedangkan untuk membandingkan yang di kolam dengan di alam dilakukan pada bulan Januari sampai April 2008. Pengawetan, pembuatan preparat histologis dan pengamatan sampel Aaptos aaptos di lakukan di Laboratorium Histologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Hasil penelitian menunjukkan bahwa Pulau Pari merupakan habitat yang sesuai untuk melakukan kegiatan fragmentasi buatan spons Aaptos aaptos karena kondisi kualitas air sangat mendukung untuk hidup dan tumbuhnya spons. Spons dapat meregenerasi jaringan tubuhnya, hal ini terlihat dari spons dapat melakukan penempelan pada tali setelah fragmen berumur 1 minggu dan spons dapat pulih kembali seperti induknya setelah berumur 4 minggu. Stasiun terbuka di selatan Pulau Pari merupakan habitat yang ideal bagi spons Aa yang difragmentasikan dibandingkan dengan stasiun tertutup di barat Pulau Pari, karena sintasan dan laju pertumbuhan spesifik spons lebih tinggi. Metode fragmentasi horisontal dapat menjamin kehidupan dan pertumbuhan spons Aa lebih baik dibandingkan dengan metoda vertikal. Fragmen spons yang dipotong sampai 4 luka pada tubuhnya tidak mempengaruhi sintasan dan laju pertumbuhan spesifik spons Aa. Sangat menguntungkan untuk dapat memanfaatkan fragmen hasil potongan sampai dengan 4 jumlah luka yang ada pada tubuhnya. Kondisi ini sangat berbeda dengan yang ditemukan oleh Duckworth et al. (2003) terhadap spons Latrunculia wellingtonensis di New Zealand, yaitu spons dengan luka kecil atau sedikit lebih mampu tumbuh dibandingkan dengan luka besar. Ukuran yang ideal untuk melakukan fragmentasi terhadap spons Aa adalah 1 cm atau lebih karena pada ukuran 1 cm terlalu kecil untuk dilewati oleh tali polyethilen sehingga tubuh spons sangat rentan mengalami kerusakan. Fragmentasi buatan terhadap ukuran 1 cm dapat dilakukan jika menggunakan kantong berlubang yang mesh size-nya lebih kecil dari 1 cm sehingga tubuh spons tidak luka oleh tali yang melewatinya.
vii
Spons Aaptos aaptos yang difragmentasi mulai bereproduksi secara seksual kembali setelah mencapai ukuran vertikal rata-rata 11,70 cm dan ukuran horisontal rata-rata 11,83 cm Spons yang tidak difragmentasi dan yang difragmentasi di alam ukuran rata-rata oosit berkembang dan memiliki tahap perkembangan lengkap dari tahap I sampai tahap IV, sedangkan oosit spons
Aaptos aaptos yang difragmentasi di kolam percobaan tidak mengalami perkembangan selama penelitian, semua spons masih berada pada tahap oosit I. Kondisi ini diduga disebabkan kurangnya asupan pakan yang mendukung kehidupan dan pertumbuhan spons sehingga untuk pemeliharaan spons setelah mencapai umur 6 bulan, fragmen spons Aa segera dikembalikan lagi ke habitat asal di alam untuk mempercepat pertumbuhan dan perkembangannya.
Proses fragmentasi terhadap spons Aa baik di alam maupun di kolam dapat dilakukan pada saat fase bulan tigaperempat (¾) yaitu saat tidak dihasilkannya telur atau oosit spons sehingga pelaksanaan fragmentasi buatan tidak mengganggu kelangsungan hidup spons melalui reproduksi seksualnya. Fase bulan mati merupakan awal perkembangan oosit spons kemudian dilanjutkan perkembangannya pada fase bulan seperempat (¼) dan akhirnya dikeluarkan pada fase bulan purnama setelah mengalami fertilisasi secara internal oleh spermatozoa.
Tidak ditemukannya sperma pada tiga tahap penelitian yang telah dilakukan baik melalui pengamatan spawning in situ maupun melalui analisis histologis. Hasil penelitian menunjukkan indikasi bahwa spons Aaptos aaptos
viii
©Hak Cipta milik Mujizat Kawaroe, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh Karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiyah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar Mujizat Kawaroe
ix
FRAGMENTASI BUATAN DAN REPRODUKSI SEKSUAL
SPONS
Aaptos aaptos
DALAM UPAYA PERBANYAKAN STOK
KOLONI DI ALAM
MUJIZAT KAWAROE
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Kelautan
PROGRAM STUDI ILMU KELAUTAN PROGRAM PASCA SARJANA INSTITUT PERTANIAN BOGOR
x
Penguji pada Ujian Tertutup : Dr. Ir. Odang Carman
Dr. Ir. Etty Riani
Penguji pada Ujian Terbuka : Prof. Dr. Ir. Dietriech G. Bengen, DEA
xi
Judul Disertasi : Fragmentasi Buatan dan Reproduksi Seksual Spons Aaptos aaptos dalam Upaya Perbanyakan Stok Koloni di Alam
Nama : Mujizat Kawaroe
NRP : C661040011
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Dedi Soedharma, DEA Ketua
Dr. Ir. Ridwan Affandi, DEA drh. Adi Winarto, Ph.D Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Kelautan
Dr. Ir. Nevity P. Zamani, M.Sc Prof.Dr.Ir. Khairil Anwar N, M.S
xii PRAKATA
Puji syukur kehadirat Allah SWT atas limpahan rahmat, hidayah, kekuatan dan semangat sehingga Disertasi dengan judul “Fragmentasi Buatan dan Reproduksi Deksual Spons Aaptos aaptos dalam Upaya Perbanyakan Stok Koloni di Alam” ini dapat diselesaikan.
Disertasi ini memuat dua bab yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Bab 4 berjudul Reproduksi Seksual Spons telah diterbitkan (Biota 13:14-20) dan dipresentasikan di 11th International Coral Reef Symposium Ford Lauderdale, Florida, USA pada 7-11 Juli 2008. Bab 3 berjudul Fragmentasi Buatan telah dipresentasikan di 1st Asian- Link Workshop for Marine Natural Products and Medicinal Plants Peking University, Beijing, China pada 20-24 Agustus 2007.
Dengan selesainya penulisan Disertasi ini, penulis ingin mengucapkan terima kasih dan rasa hormat yang setinggi-tingginya kepada :
1. Bapak Prof. Dr. Ir. Dedi Soedharma, DEA selaku ketua komisi pembimbing, Bapak Dr. Ir. Ridwan Affandi, DEA dan Bapak drh. Adi Winarto, Ph.D sebagai anggota komisi pembimbing yang telah meluangkan waktu serta dengan penuh kesabaran telah membimbing dan mengarahkan penulis dalam penyelesaian penulisan Disertasi.
2. Bapak Prof. Dr. Ir. Dedi Soedharma, DEA, selaku Ketua Tim Hibah Pasca yang telah memberikan kesempatan kepada penulis untuk menjadi bagian dalam tim tersebut untuk melakukan kegiatan penelitian ini.
3. Pimpinan beserta seluruh staf dan teknisi Laboratorium Histologi Departemen Anatomi, Fisiologi dan Farmakologi Fakultas Kedokteran Hewan – Institut Pertanian Bogor, yang telah memberikan ijin dan kesempatan kepada penulis untuk penggunaan laboratorium dalam penelitian ini.
4. Seluruh civitas akademika Institut Pertanian Bogor yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan ke jenjang S3 dan telah banyak membantu penulis baik dalam hal moril maupun materiil. Penulis menyadari dengan sesungguhnya bahwa disertasi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan adanya saran atau kritik dari semua pihak yang dapat digunakan untuk melengkapi disertasi ini. Semoga penelitian ini dapat memberikan kontribusi dan menambah wawasan pengetahuan kita dalam bidang biologi laut, khususnya mengenai spons laut.
Bogor, Oktober 2009
xiii
RIWAYAT HIDUP
Penulis dilahirkan di Donggala pada tanggal 13 Desember 1965 sebagai anak ke-5 dari pasangan Bapak H.Sahabuddin Kawaroe dan Ibu Hj. Maryam Palilati. Pendidikan sarjana ditempuh di Program Studi Manajemen Sumberdaya Perairan, Fakultas Perikanan IPB, lulus pada tahun 1988. Pada tahun 1997, penulis diterima di Program Studi Pengelolaan Sumberdaya Pesisir dan Lautan pada Program Pasca Sarjana IPB dan menamatkannya pada tahun 2000. Kesempatan untuk melanjutkan ke program doktor pada Program Studi Ilmu Kelautan, Program Pascasarjana IPB diperoleh pada tahun 2004. Beasiswa pendidikan pascasarjana diperoleh dari BPPS-DIKTI
Penulis bekerja sebagai staf pengajar di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan IPB dan peneliti di Pusat Kajian Surfaktan dan Bioenergi LPPM IPB.
xiv
Pendekatan pemecahan masalah ... 4
Sistematika penelitian ... 5
II. TINJAUAN PUSTAKA
Prosedur penelitian ... 29
Kondisi Fisika- Kimia Air di Lokasi Penelitian ... 29
Pemeliharaan fragmen spons pada rak horisontal dan vertikal ... 30
Pengaruh jumlah lu ka dan ukuran fragmen spons ... 33
Analisis data ... 35
HASIL DAN PEMBAHASAN Kondisi Kualitas Air di Lokasi Penelitian ... 38
Pemeliharaan fragmen spons pada rak horisontal dan vertikal... 42
Perkembangan fragmen ... 42
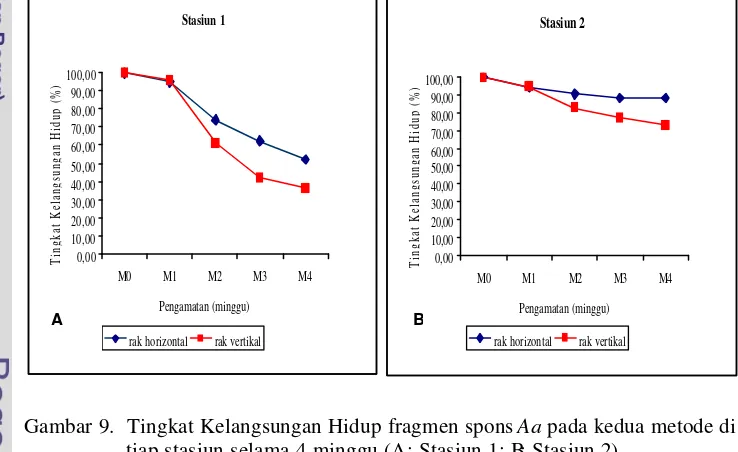
Tingkat Kelangsungan Hidup (Sintasan) ... 45
Pertumbuhan fragmen ... 49
Pengaruh jumlah luka dan ukuran fragmen spons ... 55
Perkembangan fragmen ... 55
Prosedur Penelitian ... 70
Struktur Morfologis Spons ... 70
Waktu Pemijahan Spons Aaptos aaptos (in situ) ... 71
xv
Tingkat Kematangan dan Ukuran Oosit Spons Aaptos aaptos . 73
Pengaruh Fase bulan Terhadap Tingkat Kematangan Oosit .... 73
Analisis Data ... 73
HASIL DAN PEMBAHASAN Struktur morfologis spons Aaptos aaptos ... 75
Waktu Pemijahan Spons Aaptos aaptos ( in situ) ... 77
Keterkaitan Pemijahan dan Fase bulan ... 84
Tingkat Kematangan dan Ukuran Oosit Spons Aaptos aaptos ... 88
Pengaruh Fase bulan Terhadap Tingkat Kematangan Oosit ... 98
KESIMPULAN ... 102
V. PENGARUH FRAGMENTASI BUATAN TERHADAP PERKEMBANGAN OOSIT SPONS Aptos aaptos PENDAHULUAN Latar Belakang ... 102
Tujuan ... 105
METODE PENELITIAN Waktu dan Lokasi Penelitian ... 106
Prosedur Penelitian ... 106
Fragmentasi Buatan ... 106
Perkembangan Gamet ... 109
Analisis Data ... 110
HASIL DAN PEMBAHASAN Ukuran fragmen spons pertama kali menghasilkan oosit ... 113
Tingkat Kelangsungan Hidup (Sintasan) ... 115
Pertumbuhan Fragmen ... 117
Perkembangan Gamet Spons yang difragmentasi di kolam ... 121
Tingkat Kematangan Gamet dan Ukuran Oosit ... 122
Pengaruh Fase Bulan Terhadap Ukuran Oosit Spons ... 132
KESIMPULAN ... 136
PEMBAHASAN UMUM... 137
DAFTAR PUSTAKA ... 154
xvi
DAFTAR TABEL
Halaman 1. Parameter fisik-kimia air yang diukur ... 30 2. Hasil pengukuran parameter fisika kimia air dan standar deviasi ... 38 3. Perkembangan fragmen spons Aa ... 44 4. Tingkat kelangsungan hidup (sintasan) fragmen spons Aa pada kedua metode di kedua stasiun ... 46 5. Laju pertumbuhan spesifik dan standar deviasi fragmen spons Aa tiap minggu pada kedua metode di kedua stasiun ... 52 6. Regenerasi fragmen spons Aa ... 56 7. Faktor eksternal yang mempengaruhi pemijahan spons Aa ... 84 8. Karakteristik tahap perkembangan gamet betina Neofibularia
nolitangere ... 98 9. Karakteristik tahap perkembangan oosit spons Aa di P.Pari ... 98 10. Ukuran rata-rata fragmen spons Aa setelah 177 dan 241 hari ... 114 11. Laju pertumbuhan sepsifik spons Aa yang tidak difragmentasi di alam,
yang difragmentasi di alam, dan yang difragmentasi di kolam selama 6 bulan ... 118 12. Karakteristik tahap perkembangan gamet betina Neofibularia
xvii
5. a) Penempatan tali polyetilen pada fragmen, b) Penempatan fragmen pada rak ... 32
6. Cara pengukuran fragmen spons ... 32
7. Prosedur fragmentasi spons Aa dengan lukaan ... 34
8. Perkembangan fragmen spons selama 4 minggu pada perlakuan rak horisontal dan vertical ... 44
9. Tingkat Kelangsungan Hidup fragmen spons Aa pada kedua metode di tiap stasiun selama 4 minggu ... 47
10. Perubahan ukuran fragmen spons Aa di ST1 ... 50
11. Perubahan ukuran fragmen spons Aa di ST2 ... 51
12. Laju pertumbuhan spesifik fragmen spons Aa ... 53
13. Perkembangan fragmen spons selama 4 minggu pada perlakuan jumlah luka ... 57
14. Tingkat kelangsungan hidup rata-rata spons antar perlakuan luka ... 58
15. Contoh fragmen spons Aa ukuran 1 cm2 ... 59
16. Ukuran rata-rata awal dan akhir pertumbuhan plh pada fragmen spons Aa antar perlakuan ... 60
17. Ukuran rata-rata awal dan akhir pertumbuhan plv pada fragmen spons Aa antar perlakuan luka ... 61
18. Laju pertumbuhan spesifik rata-rata plh pada fragmen spons Aa antar perlakuan jumlah luka ... 61
19. Laju pertumbuhan spesifik rata-rata plv fragmen spons Aa antar perlakuan luka ... 63
20. Pengambilan contoh spons ... 71
21. Sketsa sistem saluran air leuconoid pada spons ... 75
22. Irisan melintang tubuh spons; (A) lapisan pinacoderm, (B) saluran oskulum, (C) kantong gamet, (D) oosit, (E) mesohyl, (F) saluran air (pewarnaan Hematoksilin-Eosin) ... 76
23. Morfologi spons Aa; (A). Saluran air masuk (ostia), (B). Spikula, (C). Jalur-jalur spikula, (D). Serat Spongin (pewarnaan Hematoxylin – Eosin) ... 77
24. Sketsa pemijahan spons jenis Aa (a-c); foto pemijahan spons (d) ... 78
25. Hasil pemijahan spons Aa; a)-b) Zygot spons Aa hasil pemijahan, c)-e) Embrio hasil pemijahan, f) telur yang gagal dibuahi .... 79
26. Pemijahan pada fase bulan mati/baru... 82
27. Pemijahan pada fase bulan seperempat ... 82
28. Pemijahan pada fase bulan purnama ... 82
29. Pasang surut air laut di Pulau Pari selama 1 periode fase bulan ... 87
30. Struktur oosit spons Aaptos aaptos di alam ... 92
xviii
32. Densitas oosit berdasarkan tingkat kematangan gamet betina spons Aa
di alam pada setiap fase bulan ... 100
33. Kolam pemeliharaan spons Aa ... 108
34. Spons Aa di habitat buatan ... 108
35. Pengambilan sampel spons ... 110
36. Tingkat Kelangsungan Hidup (sintasan) spons Aa yang tidak difragmentasi dan difragmentasi di alam, dan yang difragmentasi di kolam ... 116
37. Laju pertumbuhan spesifik rata-rata plh pada fragmen spons Aa yang tidak difragmentasi, yang difragmentasi di alam dan kolam ... 119
38. Laju pertumbuhan spesifik rata-rata plv pada fragmen spons Aa tidak difragmentasi, yang difragmentasi di alam dan kolam ... 119
39. Struktur mikromorfologis oosit Aa ... 124
40. Struktur oosit spons Aa yang tidak difragmentasi di alam ... 127
41. Densitas oosit spons Aa yang difragmentasi di kolam pada setiap fase bulan; hanya ditemukan oosit tahap I ... 129
42. Densitas oosit pada spons Aa yang tidak difragmentasi ... 130
43. Densitas oosit pada spons Aa yang difragmentasi ... 131
44. Ukuran rata-rata oosit spons Aa yang difragmentasi di kolam pada setiap fase bulan ... 133
45. Ukuran rata-rata oosit Aa yang tidak difragmentasi di alam ... 134
46. Ukuran rata-rata oosit Aa yang difragmentasi di alam ... 134
xix
DAFTAR LAMPIRAN
Halaman
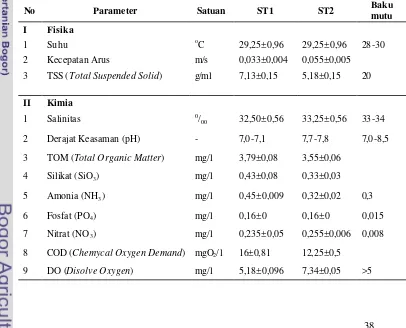
1. Baku mutu kualitas air Kep.Men 179/Men.KLH/VII/2004 ... 161
2. Nilai Parameter Fisika Kimia Perairan ... 162
3. Analisis ragam ( Anova) satu arah perlaukan rak pada tiap stasiun ... 163
4. Data Pertumbuhan Relatif Spesifik ST1 Dan ST2 ... 164
5. Analisis ragam ( Anova) satu arah perlakuan stasiun pada metode rak ... 165
6. Data Pertumbuhan Fragmen Spons Fragmentasi di Alam ... 166
7. Data Sintasan Tiap Pengamatan pada ST1 dan ST2 ... 175
8. Analisis ragam ( Anova) satu arah perlakuan stasiun penelitian dan luka 175 9. Data pertumbuhan fragmen spons plh dan plv dengan perlakuan lukaan 176 10. Analisis ragam ( Anova) satu arah laju pertumbuhan spesifik ... 178
11. Hasil uji BNT pada rata-rata laju pertumbuhan P1 dengan selang kepercayaan 95% ... 178
12. Waktu pemijahan spons Aa ... 179
13. Kisaran pasang surut air laut Pulau Pari ... 183
14. Data Pertumbuhan plh dan plv fragmen spons ... 191
15. Densitas telur spons Aaptos aaptos per mm3 pada spons yang di fragmentasi di alam ... 198
16. Densitas telur spons Aa per mm3 pada spons yang tidak di fragmentasi di alam ... 198
17. Densitas telur spons Aa per mm3 pada spons yang di fragmentasi di alam ... 198
18. Ukuran telur spons Aa pada setiap fase bulan pada fragmentasi di kolam 199 19. Ukuran telur spons Aa pada setiap fase bulan yang tidak difragmentasi di alam ... 199
1
I. PENDAHULUAN
Latar Belakang
Spons merupakan metazoa multiseluler yang tergolong ke dalam filum Porifera, dan terdiri atas 5000 jenis, yang dapat dibagi menjadi tiga kelas besar, yaitu Calcarea, Demospongiae dan Hexactinellida. Demospongiae adalah yang paling banyak ditemukan, tersebar luas dan merupakan spons yang terdiri atas jenis-jenis yang paling beragam dan telah mendapat perhatian relatif banyak dari ahli kimia dan biokimia.
Secara ekologis, spons merupakan organisme laut yang sangat penting di ekosistem terumbu karang (De Voodg, 2005). Spons merupakan komponen utama dari komunitas terumbu karang dan berperan sama baiknya dengan biota lain di perairan pesisir dan laut. Fungsi utama interaksi organisme pada ekosistem laut, berasal dari spons, karena organisme ini dapat menyaring dengan jumlah yang sangat besar bahan organik yang berasal dari perairan di sekitarnya. Setiap hari, dengan jumlah volume air yang setara dengan 20 ton (40 meter (dalam) dan 500 m2 (luas) pada kolom air) dapat disaring oleh populasi spons yang terdapat di terumbu karang (Reiswig, 1974 dalam Tomascik et al., 1997).
Peneliti dalam bidang kimia memperlihatkan perhatian yang cukup besar pada spons, karena keberadaan senyawa bahan alam yang dikandungnya. Senyawa bahan alam in i banyak dimanfaatkan dalam bidang farmasi dan harganya sangat mahal dalam katalog hasil laboratorium (Pronzato et, al., 1999). Ekstrak metabolit dari spons mengandung senyawa bioaktif yang diketahui mempunyai sifat aktivitas seperti: sitotoksik dan antitumor (Kobayashi dan Rachmaniar, 1999; Garson et, al.,
2 enzim (Soest dan Braekman, 1999) dan beberapa sifat lainnya (Uriz et, al.,1991
dalam Pronzato, 1999). Selain sebagai sumber senyawa bahan alam, spons juga memiliki manfaat yang lain, seperti: 1) Dapat digunakan sebagai indikator biologis untuk pemantauan pencemaran laut (Amir, 1991), 2) Indikator dalam interaksi komunitas biota karang (Bergquist, 1978) dan 3) Sebagai hewan penting untuk menghiasi akuarium laut (Riseley, 1971; Warren, 1982).
Pemanfaatan spons laut sekarang ini cenderung semakin meningkat, terutama untuk mencari senyawa bioaktif baru dan memproduksi senyawa bioaktif tertentu. Pengumpulan spesimen untuk pemanfaatan tersebut, pada umumnya diambil secara langsung dari alam dan belum ada yang berasal dari hasil budidaya. Cara seperti ini, jika dilakukan secara terus menerus diperkirakan dapat mengakibatkan penurunan populasi spons secara signifikan, mengingat spons memiliki penyebaran yang tidak terlalu luas dan jumlah koloni yang tidak melimpah, terutama untuk jenis-jenis tertentu yang sudah diketahui aktifitas farmakologiknya dan sulit dibuat sintesisnya. Oleh karena itu, untuk dapat dimanfaatkan secara berkesinambungan, kelestarian sumber daya ini perlu dijaga dan dipertahankan dengan mencegah dan mengendalikan hal-hal yang dapat merusak dan mengancam kelestariannya.
Eksploitasi secara langsung di alam untuk pemanfaatan sebagai sumber senyawa bioaktif baru dan memproduksi senyawa bioaktif tertentu merupakan masalah utama yang dihadapi dan perlu untuk dikendalikan agar ketersediaan stok
koloni spons tetap tersedia. Pengendalian ini dapat dilakukan jika diimbangi dengan upaya perbanyakan stok secara buatan atau budidaya. Budidaya ini diutamakan untuk pembenihan yang dapat menyediakan atau menghasilkan bibit atau anakan untuk
3 pertumbuhan yang cepat, masa pemulihan yang cepat, dan secara seksual organ reproduksinya tetap berkembang. Manfaat yang dihasilkan dapat digunakan dalam kegiatan rehabilitasi dan konservasi habitat yang diarahkan untuk mempertahankan kondisi habitat alami melalui fragmentasi buatan. Dukungan terhadap pelaksanaan kegiatan fragmentasi buatan tersebut dilakukan dengan melaksanakan penelitian tentang reproduksi seksual spons Aa yang berkaitan dengan seksualitasnya. Penelitian tentang reproduski seksual spons Aa sangat sedikit dan pertama kali dikemukakan oleh Sara (1961) dalam Sara (1992) bahwa spons ini bertipe gonokhorik dan memiliki cara reproduksi ovipar, namun tidak dijelaskan lebih lanjut bagaimana fertilisasinya terjadi, apakah internal atau eksternal. Begitu pula hasil penelitian Haris (2005) di Pulau Barrang Lompo, Sulawesi Selatan tidak mendeskripsikan mengenai fertilisasi spons Aa, sehingga penelitian tentang reproduksi seksual spons Aa perlu untuk dilakukan dan penelitian fragmentasi buatan bisa menghasilkan sintasan, laju pertumbuhan, dan kepastian tentang kondisi organ reproduksi seksual spons Aa
mengalami perkembangan.
4 kepada pengamatan perkembangan hasil pemijahan untuk menentukan fertilisasinya secara internal atau eksternal berdasarkan hasil pemijahan yang diperoleh. Selanjutnya dilakukan penelitian untuk menentukan seksualitas spons Aa baik tipe maupun cara melalui analisis histologis di laboratorium.
Tujuan Umum
Tujuan Umum dari penelitian ini adalah:
Mengkaji metode perbanyakan stok koloni spons Aa di alam melalui pendekatan fragmentasi buatan di alam dan di kolam untuk meningkatkan sintasan, laju pertumbuhan dan perkembangan oosit spons hasil fragmentasi tersebut. Sebelum difragmentasi, dilakukan penelitian pendahuluan untuk mengetahui reproduksi seksual spons Aa karena informasi yang tersedia saat ini masih sangat sedikit yang membahas secara mendalam mengenai reproduksi seksual spons Aa.
Pendekatan Pemecahan Masalah
Ketersediaan koloni spons jenis Aa di alam akibat eksploitasi untuk bahan bioaktif aaptamine merupakan permasalahan utama yang dikhawatirkan dapat mengakibatkan stok koloni berkurang atau bahkan habis, karena spons Aa potensial untuk dimanfaatkan sebagai bahan baku bioaktif karena mengandung aaptamine. Dua pendekatan yang dianggap dapat memecahkan permasalahan utama tersebut yakni fragmentasi buatan dan reproduksi seksual.
5 reproduksi seksual meliputi kajian tentang waktu pemijahan, keterkaitannya dengan fase bulan, perkembangan gamet, pemijahan dan perkembangan hasil pemijahan.
Melalui dua pendekatan ini diharapkan dapat mempercepat pembentukan koloni secara invasif dan tidak mempengaruhi perkembangan organ reproduksi seksual spons.
Sistematika Penelitian
Informasi tentang aspek reproduksi dan hasil analisis keterkaitan faktor eksternal seperti suhu air, pasang surut, dan cahaya dengan beberapa aspek reproduksi seksual spons akan digunakan dalam melakukan penelitian fragmentasi buatan spons Aa. Keberhasilan fragmentasi buatan tidak terlepas dari kondisi kualitas air dimana spons tersebut difragmentasi. Parameter kualitas air yang ditenggarai mempengaruhi fragmentasi pada spons sehingga dijadikan objek kajian pada penelitian ini ialah parameter fisika dan kimia. Selama ini, tingkat keberhasilan fragmentasi buatan hanya diukur dari sintasan dan laju pertumbuhannya saja tanpa meneliti tentang aspek reproduksinya yaitu perkembangan gamet. Perkembangan gamet ini sangat penting untuk menjamin bahwa spons yang difragmentasi tetap dapat berkembang melalui reproduksi seksual dan aseksual.
6 ualitas
Gambar 1.Kerangka Pemikiran
MASALAH PENDEKATAN
MASALAH
ASPEK KAJIAN
PARAMETER LUARAN
KETERBATASAN STOK KOLONI SPONS
Reproduksi Aseksual Reproduksi Seksual di Alam
Waktu Pemijahan
KETERSEDIAAN STOK KOLONI SPONS Hasil Pemijahan Perkembangan
hasil pemijahan
Ukuran Optimal
Metode Fragmentasi
• Metode rak
• Lukaan
• Habitat
• Sintasan
• Laju purtumbuhan spesifik
• Tingkat kematangan gonad
7
II. TINJAUAN PUSTAKA
Morfologi
8 ditutupi oleh kalsium karbonat (Warren,1982; Kozloff,1990; Harrison dan De Vos,1991; Ruppert dan Barnes,1991 dan Pechenik,1991).
Morfologi luar spons laut sangat dipengaruhi oleh faktor fisik, kimiawi, dan biologis lingkungannya. Spesimen yang berada di lingkungan yang terbuka dan berombak besar cenderung pendek pertumbuhannya atau juga merambat. Sebaliknya spesimen dari jenis yang sama di lingkungan yang terlindung atau di perairan yang lebih dalam dan berarus tenang, pertumbuhannya cenderung tegak dan tinggi. Di perairan yang lebih dalam, spons cenderung memiliki tubuh yang lebih simetris dan lebih besar sebagai akibat lingkungan yang lebih stabil apabila dibandingkan dengan jenis yang sama yang hidup di perairan yang dangkal (Bergquist, 1978; Amir dan Budiyanto, 1996).
Sumber : Koleksi pribadi
Gambar 2. Spons laut jenis Aa
Spons dapat berbentuk sederhana seperti tabung dengan dinding tipis, atau masif bentuknya dan agak tidak teratur. Salah satu bentuk spons yang masif adalah
9 garis tengahnya 0.9 m dan tebalnya 30.5 cm. Jenis-jenis spons tertentu nampak berbulu getar karena spikulanya menyembul keluar dari badannya (Romimohtarto dan Juwana, 1999).
Banyak spons berwarna putih atau abu-abu, tetapi yang lainnya berwarna kuning, oranye, merah, atau hijau. Spons yang berwarna hijau biasanya disebabkan oleh adanya alga simbiotik yang disebut zoochlorellae yang terdapat di dalamnya (Romimohtarto dan Juwana, 1999). Warna spons tersebut sebagian dipengaruhi oleh fotosintesa mikrosimbionnya. Mikrosimbion spons umumnya adalah cyanophyta (cyanobacteria dan eukariot alga seperti dinoflagellata atau zooxanthella). Beberapa spons memiliki warna yang berbeda walaupun dalam satu jenis. Beberapa koloni spons juga memiliki warna dalam tubuh yang berbeda dengan pigmentasi luar tubuhnya. Spons yang hidup di lingkungan yang gelap akan berbeda warnanya dengan spons sejenis yang hidup pada lingkungan yang cerah (Wilkinson, 1980).
Makanan dan Cara Makan
Spons adalah pemakan menyaring (filter feeder) yang menetap. Makanan spons berbentuk partikel organik renik, hidup atau tidak, seperti bakteri, mikroalga dan detritus. Menurut penelitian Reiswig (1976) dalam Brusca dan Brusca (1990) 80% bahan organik terlarut diambil oleh jenis spons Jamaika, dan 20 % dari yang dikonsumsi tersebut adalah bakteri dan dinoflagellata. Menurut Bell et al., (1999) jenis ultraplankton yang dimakan oleh spons pada umumnya adalah jenis bakteri heterotropik, Prochlorococcus spp, Synechococcus tipe cyanobakteri, dan picoeukaryotes autotropik. Makanan alami spons jenis Dysidea avara sangat hetertogen meliputi heterotropik bakteria dengan ukuran 0,3-0,5 µm,
Prochlorococcus spp, Synechococcus, protozoa, phytoplankton (diatom) dengan ukuran 0,3-70 µm dan ciliata (Ribes et al., 1999).
10 organik) ditangkap oleh archaeocytes, yang bergerak ke batas saluran pemasukan (incurrent canal), sementara partikel yang berukuran antara 0.1 – 1.5 µm (bakteri, molekul organik) ditangkap oleh flagella dari sel-sel leher (collars). Spons juga dapat mengambil bahan organik terlarut dalam air (dissolved organic matter, DOM) dalam jumlah yang signifikan secara pinositosis pada sistem saluran (Brusca dan Brusca, 1990). Gerak mengombak pada sel leher (collars) menangkap partikel makanan dan dibawa ke sel tubuh choanocytes kemudian diserap secara fagositosis atau pinositosis. Pada choanocytes juga mencerna partikel makanan, baik di sebelah maupun di dalam sel leher (collars). Sebuah vakuola makanan terbentuk dan pada vakuola ini pencernaan terjadi. Sisa makanan yang tidak tercerna dibuang ke luar dari dalam sel leher (collars). Makanan itu dipindahkan dari satu sel ke sel lain dan barangkali diedarkan dalam batas tertentu oleh sel-sel amubocytes yang terdapat di lapisan tengah. Choanocytes pada tubuh spons jumlahnya relatif besar. Menurut Schmidt (1970) dalam Brusca dan Brusca (1990) jenis Epydatia fluvialis mempunyai jumlah choanocytes sekitar 7600 per millimeter kubik tubuh spons. Setiap rongga
choanocytes dapat memompa air sekitar 1200 kali dari volume tubuhnya per hari. Spons yang lebih kompleks, tipe leuconoid mempunyai jumlah choanocytes yang lebih besar, yaitu 18.000 per millimeter kubik (Brusca dan Brusca, 1990).
Spons perlu hidup dalam air bersirkulasi, Arus air yang melewati spons akan membawa zat makanan dan membuang zat yang tidak berguna dari tubuh spons, maka penting agar air yang keluar melalui oskulum dibuang jauh dari badannya, karena air ini tidak berisi makanan lagi, tetapi mengandung asam karbon dan sampah nitrogen yang beracun bagi hewan tersebut (Romimohtarto dan Juwana, 1999).
Reproduksi
Reproduksi Seksual
11 selama hidupnya, tetapi menghasilkan gamet jantan dan gamet betinanya dalam waktu yang berbeda; (2) Gonokhorik, yaitu jenis spons yang memproduksi hanya gamet jantan atau betina saja selama hidupnya. (Reseck, 1988; Kozloff, 1990; Ruppert dan Barnes, 1991; Amir dan Budiyanto, 1996). Tipe hermaprodit ditemukan pada ordo Poecilosclerida, ordo Homosclerophorida dari famili Plakinidae dan Oscarellidae, ordo Hadromerida dari famili Clionodae, ordo Dendroceratida dari famili Halisarcidae, sedangkan tipe gonokhorik ditemukan pada ordo Astroporida dari famili Geodidae dan Stellenttidae, ordo Sphirophorida dari famili Tetillidae, ordo Hadromerida dari famili Tethydae, Chondrosiidae, Polymastiidae, ordo Axinellida dari famili Axinellidae dan Agelasidae (Sara, 1992).
Tipe hermaprodit pada spons terbagi atas: (1) hermaprodit bersamaan (contemporaneous hermaproditism), yaitu apabila spons menghasilkan gamet jantan dan gamet betina dalam waktu yang bersamaan dalam satu individu; (2) hermaprodit bergantian (successive hermaproditism), yaitu apabila spons menghasilkan gamet jantan dan gamet betina secara bergantian. Hermaprodit bersamaan (contemporaneous hermaproditism) ditemukan pada spons jenis Neofibularia nolitangere, sedangkan hermaprodit bergantian (successive hermaproditism) ditemukan pada spons jenis Polymastia mammilaris dan Suberitas massa
(Hadromerida), Hymeniacidon carincula dan Hymeniacidon heliophila
(Halichondrida) (Sara, 1992).
Seksualitas bertipe gonokhorik, khususnya dari ordo Hadromerida didapatkan pada jenis Tethya crypta, Tethya auratum, Tethya citrina (Tethydae); Chondrosia reniformis, Chondrilla nucula (Chondrosiidae); Polymastia hirsuta, Aaptos aaptos
(Polymastiidae) (Sara, 1992), Xestospongia bergquistia dan Xestospongia testudinaria (Fromont dan Bergquist, 1994). Selain itu didapatkan juga seksualitas bertipe gonokhorik labil (labile gonochorism). Seksualitas bertipe seperti ini ditemukan pada spons jenis, Suberitas carnous (Hadromerida) dan Raspailia topsenti
12 Cara Reproduksi
Cara reproduksi pada spons terbagi atas dua kategori, yaitu: ovivar dan vivivar. Kebanyakan ordo Astrophorida, Spirophorida, Hadromerida, Axinellida dari subkelas Tetractinomorpha cara reproduksinya tergolong ovipar, sedangkan ordo Homosclerophorida dari subkelas Homoscleromorpha, ordo Halichondrida, Poecilosclerida, Haplosclerida, Dictyoceratida, Dendroceratida dari subkelas Tetractinomorpha cara reproduksinya tergolong vivipar (Sara, 1992). Pada jenis spons yang ovipar, telur yang telah dibuahi diletakkan di mesohyl, selanjutnya dikeluarkan dari tubuh spons dan kemudian menetas, sedangkan pada jenis spons yang vivipar, larva spons dik eluarkan dari tubuh spons dan bergerak dengan bulu getarnya selama selang waktu tertentu sampai mendapat tempat menempel yang sesuai (Kozloff, 1990; Romimohtarto dan Juwana, 1999). Beberapa spons ovipar dari kelas Demospongiae, telur dan awal embrio tersimpan pada rangkaian gelatin yang melekat pada permukaan bagian luar induk betina spons, perkembangan tahap larva parenchymula terjadi pada pembungkus lendir ini (Brusca dan Brusca, 1990).
Tingkat Perkembangan Gamet
Spermatogonia pada spons kemungkinan berasal dari choanocytes atau
archaeocytes (amoebocytes) karena ada fakta yang menunjukkan bahwa choanocytes
mengalami transformasi ke archaeocytes (amoebocytes) atau sebaliknya (Sara, 1992), dan spermatogenesis terjadi pada spermatic cyst. Diferensiasi sperma terbagi atas tiga bentuk, yaitu: (1) semua sel pada semua cyst mungkin berkembang secara bersama-sama (synchronous) (misalnya: Polimastia mammilaris, Axinella damicornis); (2) diferensiasi sel di dalam sebuah cyst secara bersama-sama (synchronous), tetapi tahap perkembangan bervariasi pada cyst yang berbeda (misalnya: spons air tawar
Ephydatia fluviatilis); dan (3) Sel berkembang pada beberapa cyst yang berbeda (asynchronous) (Sara, 1961 dalam Harrison dan De Vos, 1991).
Spermatogenesis pada spons jenis Suberitas massa, nukleus choanocytes
13 flagellanya hilang. Nukleus bermigrasi dari choanocytes chamber dan mengumpul sebagai spermatogonial cyst. Sel-sel follikel berbentuk datar berasal dari
archaeocytes mengelilingi cyst dan mungkin memfagositosis spermatogonia yang buruk. Spermatogenesis tidak bersama-sama (asynchronous) dalam satu cyst dan pada beberapa tempat spermatogonia mungkin berkembang di dalam sel-sel dan sisanya berkembang di dalam choanocytes chamber (Harrison dan De Vos, 1992). Spermatosit primer pada Suberitas massa ukurannya meningkat, diameternya rata-rata sedikit di atas 5 µm. Kromatin berkondensasi terhadap permukaan bagian dalam pembungkus nukleus. Cytoplasma berisi sejumlah mitokondria, kelompok ribosom bebas sebagai polysomes, dan badan golgi. Badan golgi padat berisi karbohidrat homogen dan glikogen. Badan golgi terletak pada bagian tepi sitoplasma. Hilangnya nukleolus dan tidak kelihatannya penutup nukleus adalah merupakan tanda awal terjadinya meiosis, dan pada proses ini terdapat synaptonema yang kompleks. Spermatosit sekunder jarang kelihatan, kemungkinan disebabkan oleh cepatnya pembelahan, tetapi dicirikan oleh nukleus yang berisi butiran-butiran halus dan kromatin yang homogen. Selama spermiogenesis, nukleus yang berbentuk bola bermigrasi ke bagian tepi mendekati membran sel. Badan golgi terlihat pada spermatosit primer menjadi terletak pada kutub akrosom dan mungkin berfungsi pada cara yang sama. Sebuah akrosom benar tidak ada. Badan golgi kompleks tidak kelihatan. Mitokondria ukurannya meningkat, kemungkinan mengalami penggabungan untuk mencapai ukuran 1 µm dan terletak di bagian belakang dengan dua sentriole, tersusun tegak lurus antara satu dengan yang lainnya. Satu sentriole memunculkan axonema berflagella yang berisi susunan mikrotubula, dua mikrotubula terletak dibagian tengah dan sembilan pasang mikrotubula diletakkan disekitarnya (Harrison dan De Vos, 1992).
14 tetapi tidak pada Xestospongia testudinaria (Fromont, 1988 dalam Fromont dan Bergquist, 1994), tetapi penelitian lain pada jenis yang sama menunjukkan bahwa perkembangan telur sangat cepat, dan sempurna dalam waktu kira-kira 58 hari (Fromont dan Bergquist, 1994).
Material nutrisi oosit pada sebagian spons diabsorbsi secara pinositosis, fagositosis oleh pseudopodia yang bersentuhan dengan bermacam-macam tipe sel, tetapi pada umumnya diabsorbsi secara pinositosis. Pada tahap awal pertumbuhan oosit nutrien untuk asimilasi, kemungkinan berasal dari hasil absorbsi secara pinositosis yang berasal dari mesohyl. Tahap kedua, nutrien pada oosit, berasal dari fagositosit sel trophocytesnurse cells yang bermigrasi melalui sarung sel-sel folikel yang mengelilinginya dan mensintesa vitelline (Harrison dan De Vos, 1992).
Fertilisasi
15 Reproduksi Aseksual
Sejumlah proses reproduksi aseksual pada spons terjadi secara alami, yang dasarnya pada potensi perkembangan archaeocytes. Proses ini termasuk pembentukan pucuk (bud formation), penyembuhan luka (wound healing), pertumbuhan somatik (somatic growth), dan pembentukan gemmule (gemmules formation) (Harrison dan De Vos, 1991).
Kebanyakan spons, baik yang hidup di laut maupun yang hidup di air tawar, mempunyai cara reproduksi aseksual yang unik, yaitu pembentukan gemmule (Receck, 1988; Romimohtarto dan Juwana, 1999). Spons laut yang telah diketahui mengalami pembentukan gemmule adalah jenis Suberitas domuncula dan Haliclona loosanoffi. Proses perkembangan gemmule pada spons ini berbeda dengan spons air tawar. Thesocytes diperoleh dari choanocytes yang mengalami perubahan ke dalam bentuk archaeocytes peralihan, dan bentuk vitellogenesis jelas kelihatan. Pada penambahan aktifitas sintetis archaecytes, cadangan senyawa diassimilasi melalui
phagocytosis, pinocytosis dan terdapat pseudopodia berperekat atau batang sitoplasmik antara thesocytes bagian depan dan nurse cells (Harrison dan De Vos, 1991). Gemmule mengandung kapsul spongin, spikula, dan dibungkus dengan
archaeocytes yang mengandung cadangan makanan, seperti glycogen. Potongan-potongan spons yang patah (fragmentasi) dapat hidup dengan cadangan makanan yang ada di tubuhnya, kemudian beregenerasi membentuk tunas baru atau kompleks gemmule untuk menjadi spons dewasa (Bergquist, 1978).
16 untuk restocking dimana sampel/induk diberi beberapa perlakuan sehingga pertumbuhan dapat terjadi lebih cepat.
Fragmentasi spons dilakukan karena saat ini dibutuhkan suatu teknik budidaya yang dapat menghasilkan individu baru yang lebih banyak, pertumbuhan yang cepat, tingkat kelangsungan hidup yang tinggi dan masa pemulihan siklus reproduksi yang cepat.
Fragmentasi dilakukan dengan jalan melakukan pemotongan pada induk spons menggunakan pisau stainless steel, dilanjutkan dengan menanam atau menaruh fragmen tersebut pada substrat buatan di kedalaman dan lokasi tertentu yang telah ditentukan sebelumnya. Fragmentasi dapat dilakukan bila lokasi yang akan digunakan jauh dari sumber air tawar, kedalaman minimal 2-3 meter, hal ini bertujuan agar spons tidak terkena cahaya matahari berlebih yang akan meningkatkan suhu air disekitarnya juga menghindari baling-baling dari kapal yang melintas diatasnya, selain menghindarkan spons dari arus deras juga untuk memudahkan dalam bekerja. Penentuan metode yang akan diterapkan pada proses fragmentasi berdasar kepada kemampuan adaptasi spons itu sendiri terhadap perubahan kondisi terumbu dan dapat mempercepat pertumbuhan spons.
Persiapan spons untuk fragmentasi sangat menentukan bagi kelangsungan hidup dan berhasil tidaknya fragmentasi ini dilaksanakan. Proses persiapan yang tidak tepat dapat mengakibatkan rendahnya tingkat keberhasilan fragmentasi. Bila terkena udara selama 30 menit, tingkat keberhasilan fragmentasi spons akan menurun hingga hanya berkisar antara 70-90% dan spons akan mengalami stres hingga kematian. Beberapa langkah yang dapat dilakukan untuk mengurangi stres atau tingkat kematian yang tinggi ialah dengan cara memotong spons tetap didalam rendaman air, tidak menggenggam dengan terlalu kuat hingga seperti memeras, gunakan selalu alat potong yang benar-benar tajam dan tahan karat (MacMillan, 1996).
17 diujicoba secara pre-klinik dan klinik sebelum masuk ke industri obat-obatan (Newman dan Cragg, 2004). Kendala utama yang dihadapi adalah karena efek samping dari bahan beracun yang di miliki spons menjadikannya sangat jarang tersedia di alam.
Pengembangan isolasi kandungan bahan bioaktif untuk kemudahan dan kelayakan secara ekonomi sudah dilakukan oleh beberapa perusahaan obat namun banyak sumberdaya laut yang tidak dikembangkan lebih lanjut setelah komposisi kimianya di diskripsikan pada hasil penelitian (Mendola, 2003). Saat ini terlihat kecenderungan untuk melakukan uji ulang kandungan ini melalui metode alternatif untuk meningkatkan ketersediaan. Kandungan bioaktif seringkali ditemukan dengan konsentrasi yang sangat sedikit dan tersebar pada beberapa lokasi dan pada spesies yang langka. Pemanenan pada populasi alam akan menyebabkan terjadinya penurunan organisme target dan ketersediaannya dalam jangka panjang. Pemanenan spons secara kontinyu merupakan pilihan yang tepat, walaupun pertumbuhan dan pemulihan populasi merupakan proses panjang dan bukan merupakan pilihan yang tepat untuk spesies langka atau spesies yang tumbuh pada habitat yang ekstrim (van Treeck et al., 2003). Sebelum kultur spons diterapkan seharusnya diyakini bahwa produksi kandungan bahan bioaktifnya mencukupi (Duckworth and Battershill, 2003a; Hadas et al., 2005; Page et al., 2005).
Setelah diketahuinya kultur spons mandi di Mediteranean, Florida dan Kuba, pengembangan kultur spons secara komersial untuk memperoleh kandungan kimia bioaktifnya sangat jarang dilakukan (Dumdei et al., 1998; Duckworth and Battershill, 2003b; Hadas et al., 2005; Page et al., 2005). Penelitian terbaru dilakukan dengan menggunakan dua teknik pemeliharaan : teknik tali vertikal di laut terbuka dan teknik horizontal yang ditancapkan di dasar laut di area lagun (Duckworth et al., 2003; Corriero et al., 2004; van Treeck et al., 2003).
18 berlaku sebaliknya (Duckworth et al., 1997, 2003; Pronzato et al., 1999). Contohnya
Lissodendoryx sp., berhasil di kultur dengan menggunakan tali vertikal yang mengambang di dekat permukaan; spesies lain tidak dapat hidup setelah transplantasi karena ketidakmampuannya untuk menempel pada substrat. Prosedur transplantasi sangat dipengaruhi oleh morfologi dan tekstur spesies spons. Duckworth and Battershill (2003a)menyatakan bahwa spesies yang rapuh dan bentuknya seperti jari akan optimal jika dikultur pada posisi horizontal dengan menggunakan jaring, sedangkan spons dengan bentuk yang tidak beraturan dapat dikultur dengan menggunakan kabel ties. Faktor kunci yang menentukan keberhasilan kultur spons adalah kemampuan spesies spons untuk hidup dan meregenerasi jaringan spons yang hilang atau rusak yang diakibatkan oleh serangan predator, terlepas karena pergerakan air yang sangat besar akibat gelombang besar (Ayling, 1983).
Potongan spons atau fragmen yang ditransplantasi melalui fragmentasi buatan diperoleh dari spons induk dan dipindahkan lokasinya dan dikultur, sedangkan spons induk dibiarkan untuk pulih dan tumbuh kembali dari luka yang diakibatkan oleh fragmentasi buatan. Keberhasilan kultur spons bukan hanya dapat tumbuh dan memiliki sintasan yang tinggi tetapi juga memiliki kemampuan untuk melakukan regenerasi. Duckworth and Battershill (2003b) memperlihatkan bahwa fragmen spons dari beberapa spesies memperlihatkan laju pertumbuhan yang lebih tinggi atau sama dengan fragmen spons yang tidak ditransplan. Idealnya, keteraturan panen spons yang dikultur dapat meningkatkan pertumbuhan spons.
Status penelitian saat ini terhadap spons Aa terkait dengan reproduksi seksual masih merujuk kepada literatur yang ditulis oleh Sara, tahun 1992. Sedangkan penelitian untuk kandungan bahan bioaktifnya dilakukan oleh Procks et al., (1999). Di Indonesia penelitian terhadap spons Aa dilakukan oleh Haris (2003) dengan topik transplantasi yang dilakukan dengan membandingkan substrat tempat tumbuh spons antara rubble (pecahan karang) dan pasir. Hasilnya menunjukkan bahwa tidak ada perbedaan nyata pertumbuhan spons pada kedua substrat tersebut.
19 ditransplantasi di alam. Dan hasilnya menunjukkan bahwa transplantasi spons dengan ukuran fragmen 3 cm merupakan ukuran yang ideal karena menghasilkan sintasan dan pertumbuhan yang tinggi jika dibandingkan dengan fragmen yang berukuran 1 dan 5 cm.
Mekanisme yang Mengontrol Reproduksi
Faktor yang mengontrol reproduksi pada spons dikelompokkan atas dua kategori, yaitu: pengaruh internal dan pengaruh eksternal. Pengaruh internal yang penting untuk merangsang pematangan seksual pada spons antara lain adalah: kontrol genetik, senyawa yang mirip dengan hormon, keberadaan jumlah vitelline pada sel spons atau pada sejumlah besar archaeocytes segera setelah gemmule menetas dan pengaruh umur dan ukuran spons, sedangkan pengaruh eksternal antara lain adalah: suhu air, cahaya khususnya fotoperiode, dan ketersediaan makanan (Sara, 1992).
Pengaruh Internal
Hasil penelitian pada spons Axinella damicornis dan Axinella verrucosa
menunjukkan bahwa pematangan seksualnya di bawah pengaruh dan kontrol genetik. Kedua jenis spons ini mempunyai genus yang sama dan habitat yang sama tetapi memperlihatkan periode reproduksi yang sangat berbeda. Variasi siklus reproduksi ditunjukkan juga oleh jenis yang berbeda pada daerah dengan cuaca yang sama adalah argumentasi lain diferensiasi seksual yang dipengaruhi oleh kontrol genetik. Pada daerah tropis, sebagai contoh ada jenis (misalnya Hippospongia) yang reproduktif sepanjang tahun, dan pada daerah sub tropis seperti Jamaika, spons jenis
Verongiagigantea, reproduktif hanya pada musim dingin (Sara, 1992).
Penelitian penggabungan spesimen yang tidak berdiferensiasi seksual pada
Tethya serica tidak memberikan petunjuk pada kematangan seksual dan penggabungan spesimen menjadikan bercampur baurnya gamet heterolog dan mem pengaruhi satu tipe gamet pada gamet yang lainnya. Kenyataan ini terjadi pada
20 yang mirip hormon berpengaruh pada seksualitas spons, dan kelihatannya mengindikasikan sebuah dasar genetik pada diferensiasi (Sara, 1992).
Mekanisme yang mengontrol reproduksi pada spons, kelihatannya berhubungan dengan penetasan gemmule dan akan berhubungan pada banyaknya ketersediaan vitelline yang terdapat pada sel-sel spons atau sejumlah besar
archaeocytes yang tidak berdiferensiasi segera setelah gemmule menetas. Lebih umum lagi, kemungkinan sebuah hubungan terbalik antara komponen biokimia yang dialokasikan untuk memproduksi sperma dan embrio dan ini dimanfaatkan untuk pertumbuhan somatik. Mekanisme kontrol seperti ini terdapat pada spons jenis
Haliclona permolis dan Haliclona loosanoffi, yang reproduksi seksualnya diawali segera setelah germinasi gemmule (Sara, 1992).
Umur spesimen yang mungkin berkorelasi dengan ukurannya, merupakan mekanisme lain yang dapat mengontrol reproduksi pada spons. Ukuran reproduktif minimum pada Tethya serrica panjangnya kira-kira 10 cm, Hippospongia lachne
diameternya kira-kira 14 cm. Mycale sp hanya spesimen yang volume bersihnya lebih besar dari 200 ml mengalami oogenesis, sedangkan spesimen yang kecil memperlihatkan spermatogenesis. Sebaliknya, pada Suberitas ficus, oogenesis sering terjadi hanya pada spesimen yang ukurannya tidak lebih dari kira-kira 5 cm (Sara, 1992).
Pengaruh Eksternal
Suhu air umumnya dianggap sangat penting diantara faktor eksternal yang mempengaruhi gametogenesis pada spons dan hewan laut lainnya di daerah yang perubahan musimnya besar (Sara, 1992; Fromont, 1994). Faktor lain yang mungkin penting adalah cahaya, khususnya fotoperiode, dan ketersediaan makanan. Pada kenyataannya seksualitas spons dipengaruhi oleh musim, terutama suhu perairan (Sara, 1992).
21 antara Maret dan April, di Bahama antara April dan Juni, dan Di Cedar Keys (Florida) antara Juni dan Juli. Puncak reproduksi di tiga lokasi berhubungan dengan suhu air yakni pada 29 oC. Di British Honduras dan Bahama beberapa spesimen reproduktif ditemukan sepanjang tahun, di Cedar Keys reproduksi terhenti pada musim dingin dengan suhu yang turun secara drastis, reproduksi hanya terjadi antara April dan Oktober. Hubungan antara kisaran suhu dan reproduksi ditemukan pada
Haliclona loosanoffi di lokasi yang berbeda di Pantai Amerika Utara. Reproduksi terjadi pada kisaran suhu antara 20 oC dan 27 oC. Awal reproduktif terlambat pada perairan yang lebih dingin, dan oleh karena itu Haliclona loosanoffi juga mendapatkan suatu musim yang pendek untuk perkembangan hibernasi gemmule, yang merupakan fase aseksual pada siklus reproduksi jenis spons intertidal ini (Sara, 1992).
Pemilihan waktu reproduksi pada jenis Haliclona amboinensis, Haliclona cymiformis, dan Niphates nitida bertepatan dengan meningkatnya suhu perairan. Spons secara reproduktif aktif sepanjang bulan-bulan pada musim panas. Penghentian aktivitas umumnya terjadi pada saat suhu perairan turun. Aktivitas reproduksi juga bertepatan dengan peningkatan total cahaya matahari dan curah hujan. Periode utama aktivitas reproduksi pada Haliclona amboinensis terjadi antara September dan Maret ketika suhu antara 23 – 29 oC tetapi individu aktif secara reproduktif juga ditemukan pada Mei 1987 dan April 1989. Larva hanya ditemukan pada spesimen antara Desember dan Maret ketika suhu perairan di atas 29 oC. Niphates nitida mempunyai periode reproduksi paling panjang dengan individu yang matang ditemukan antara Juli ketika suhu perairannya sangat rendah (< 22 oC) dan Maret. Individu yang matang juga terdapat pada Mei dan Juni 1987 dan pada April 1989. Larva jenis ini ditemukan pada September 1986 ketika suhu 25 oC. Haliclona cymiformis
22
III. FRAGMENTASI BUATAN
PENDAHULUAN Latar Belakang
Saat ini perkembangan dibidang bioteknologi mengalami kemajuan yang
pesat khususnya dalam hal penemuan kandungan sumber daya alam yang sangat berpotensi bagi kehidupan manusia terutama dalam bidang kesehatan. Beberapa
penelitian yang telah dilakukan sampai saat ini diketahui bahwa sumber daya laut khususnya spons memiliki kandungan bioaktif yang sangat berpotensi sebagai bahan baku obat. Perkembangan ini masih terus berlanjut sebagai usaha untuk
mengidentifikasi manfaat spons bagi kehidupan manusia.
Spons laut yang digunakan pada penelitian ini adalah Aaptos aaptos (Aa), yang telah diketahui memiliki kandungan senyawa alkaloid dan aptamin dengan aktivitas penghambatan terhadap a- adrenoreceptor (Munro et al., 1999). Selain itu, senyawa alkaloid lain yang didapatkan dari spons Aa memiliki aktivitas sebagai antikanker, anti- HIV dan anti-mikroba (Nakamura et al., 1987). Oleh karena itu spons Aaptos aaptos (Aa) merupakan salah satu jenis spons yang perlu dipertimbangkan dalam upaya pengembangan budidaya melalui fragmentasi. Pemanfaatan spons umumnya diambil secara langsung dari alam dan hanya
sebagian kecil yang diperoleh dari hasil budidaya. Cara seperti ini jika dilakukan secara terus menerus diperkirakan akan mengakibatkan penurunan populasi secara signifikan bahkan dapat mengakibatkan terjadinya kepunahan.
Metode-metode untuk mencari jalan keluar dari masalah penyediaan bahan baku telah banyak diujicobakan. Metode yang paling sederhana adalah dengan
23 alami tidak dapat dibuat bahan sintetisnya karena tingginya kompleksitas struktur kimianya. Bahan-bahan bioaktif spons dapat dibuat sintetisnya pada skala laboratorium, tetapi untuk meningkatkan menjadi skala yang lebih besar menjadi
tidak layak (Munro et al., 1999).
Langkah nyata yang dapat dilakukan adalah melalui pengembangan metode fragmentasi spons. Spons memiliki kemampuan untuk dapat memperbaiki
diri dengan membangun sel-sel jaringannya yang telah mati (Sipkema et al.,
2004), walaupun pada beberapa kasus tidak berhasil dan hanya pada beberapa sel primer yang mampu berkembang (Ilan et al., 1996; De Rosa et al., 2003). Kultur jaringan spons (primmorphs) adalah metode lain yang juga telah diujicoba (Muller dan Schroder, 2000), tetapi seperti pada kultur sel, masih banyak penelitian yang perlu dilakukan. Kemungkinan lain yang masih sangat baru di bidang
bioteknologi kelautan yaitu dengan melakukan kloning pada gen yang relevan ke dalam mikroba yang dapat difermentasikan untuk menghasilkan metabolit sekunder bioaktif (Salomon et al., 2004). Kultur spons secara in vivo juga sudah diujicoba oleh beberapa peneliti (Osinga et al., 2001; Mendola, 2003).
Budidaya laut (mariculture) merupakan metode yang paling menjanjikan untuk memproduksi biomasa spons dari semua metode yang sudah pernah diujicobakan oleh beberapa peneliti. Metode yang paling banyak digunakan untuk membudidayakan spons adalah metode gantung. Metode gantung ini sudah
diujicobakan pada spons mandi (bath sponge) sejak lama yang dilakukan oleh Schmidt dan Buccich di laut Mediterania, dan selanjutnya oleh Moore di Florida (Duckworth dan Battershill, 2003a). Metode gantung dilakukan dengan cara
24 Duckworth et al., (1999); Dukworth dan Battershill (2003a) melakukan penelitian terhadap tiga teknik baru untuk budidaya spons di New Zealand sebagai sumber bahan metabolit bioaktif. Metode pertama, spons dibudidayakan pada
kantung-kantung berlubang. Keuntungan dari metode ini adalah spons tidak mengalami stress jika dibandingkan dengan metode budidaya lain; spons diletakkan di dalam kantung berlubang tanpa mengalami kerusakan secara fisik sebagai hasil dari perlengketan. Sebaliknya, organisme penempel yang tumbuh
pada lubang dapat menghalangi aliran air yang masuk ke spons. Metode kedua, peneliti mencoba untuk mengikat fragmen spons pada tali. Metode ketiga, spons digantung dengan membungkusnya pada tali yang tipis. Dua metode terakhir
tidak sesuai untuk budidaya spons, karena spons akan tumbuh dan terlepas jauh dari tali dan hilang. Spons juga dapat dibudidayakan pada kerangka (frame) yang berbentuk baki dan ditambatkan di dasar laut (Muller et al., 1999; van Treeck et al., 2003). Metode terakhir juga digunakan untuk membudidayakan invertebrata lain yang bersifat sesil seperti bryozoan Bugula neritina (Mendola, 2003). Metode fragmentasi dengan menggunakan kerangka (frame) ini diujicobakan juga pada penelitian ini di Pulau Pari, Kepulauan Seribu. Selain dengan metode rak horisontal seperti yang sudah dilakukan oleh peneliti lain, pada penelitian ini dilakukan juga dengan penambahan metode yaitu metode kerangka (frame/rak) yang diberdirikan posisinya sehingga menjadi vertikal dan fragmen spons diikatkan pada kerangka atau rak tersebut. Posisi fragmen spons berada jauh dari dasar perairan atau substrat sehingga diharapkan tidak terpengaruh dengan
pengadukan dasar perairan pada saat meningkatnya arus.
25 fragmentasi tersebut. Kondisi luka pada spons baik luas maupun jumlah merupakan faktor penting yang ikut menentukan kelangsungan hidup dan selanjutnya pertumbuhan spons. Karena kemampuan beberapa organisme
termasuk spons untuk hidup dan tumbuh kembali setelah perlukaan sangat tergantung dari ukuran dan jumlah luka (Chadwick and Loya, 1990 ; Duckworth, 2003), dimana luka yang besar dan banyak seringkali menyebabkan fatal terhadap spons. Jaringan yang melakukan regenerasi untuk tumbuh membutuhkan energi
yang besar di luar energi yang diperlukan untuk melakukan pertumbuhan dan reproduksi yang selanjutnya menurunkan kesegaran spons. Luka yang besar dapat menyebabkan rusaknya sistem saluran spons, menurunkan efisiensi penyerapan
nutrien, dan dapat menyebabkan kematian pada beberapa spesies spons.
Sebagai pengembangan metode budidaya spons, maka perlu dilakukan
suatu penelitian mengenai sintasan (tingkat kelangsungan hidup), laju pertumbuhan spesifik dan perkembangan gamet spons yang difragmentasikan dengan menggunakan metode rak horisontal dan vertikal, spons dengan beberapa
jumlah luka (1-4 luka) pada tubuhnya, serta menguji coba ukuran fragmen 1 cm sebagai ukuran terkecil pada penelitian ini. Pengukuran terhadap kondisi lingkungan di lokasi fragmentasi juga dilakukan untuk mengetahui parameter
26 Tujuan
Penelitian ini bertujuan untuk :
1. Mengkaji kelayakan kondisi kualitas air pada dua lokasi fragmentasi yang berbeda yaitu lokasi yang terlindung dan terbuka, sehingga diketahui kondisi kualitas air yang optimal mendukung pertumbuhan dan perkembangan spons Aa
2. Mengkaji metode pemeliharaan fragmen spons yang optimal melalui penempatan pada rak horisontal vs vertikal untuk mengefisienkan ruang pemeliharaan
27 METODE PENELITIAN
Waktu dan Lokasi penelitian
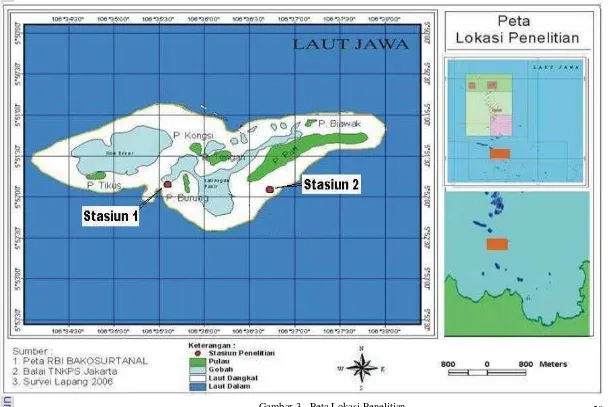
Penelitian fragmentasi buatan di alam dilakukan di Gugusan Pulau Pari, Kepulauan Seribu, DKI Jakarta dan terletak di barat Pulau Burung (ST1) (05052’05,5” LS dan 106035’71,2’’ BT), dan di selatan Pulau Pari (ST2) (05052’22,4” LS dan 106036’76,1’’ BT) perairan gugusan Pulau Pari, Kabupaten Kepulauan Seribu, Jakarta (Gambar 3). Waktu penelitian dimulai pada bulan Mei 2006 sampai bulan April 2007. Rincian waktu penelitian adalah : penelitian fragmentasi dengan metode transplantasi pada rak horisontal dan vertikal dilaksanakan pada bulan Mei 2006 sampai Juli 2006. Penelitian dengan perlakuan luka dilaksanakan pada bulan Agustus 2006 sampai April 2007.
Penelitian fragmentasi dilakukan dalam beberapa tahap yang meliputi :
1. Survei lokasi penelitian 2. Persiapan alat dan bahan
3. Pemotongan fragmen, penurunan rak dan pengikatan sampel
4. Pengukuran dan pengamatan kelangsungan hidup, laju pertumbuhan spesifik, dan pengukuran parameter fisika dan kimia air yang mendukung kehidupan spons.
29 dan arus dapat membawa makanan dan menghambat terjadinya sedimentasi. Adanya pengaruh gelombang dan arus memungkinkan kandungan oksigen terlarut yang ada lebih banyak, serta didukung oleh substrat dasar terumbu karang yang memungkinkan adanya keragaman biota dasar yang dapat bersimbiosis dalam membantu proses pertumbuhan spons.
Prosedur Penelitian
Kondisi Fisika-Kimia Air di Lokasi Penelitian
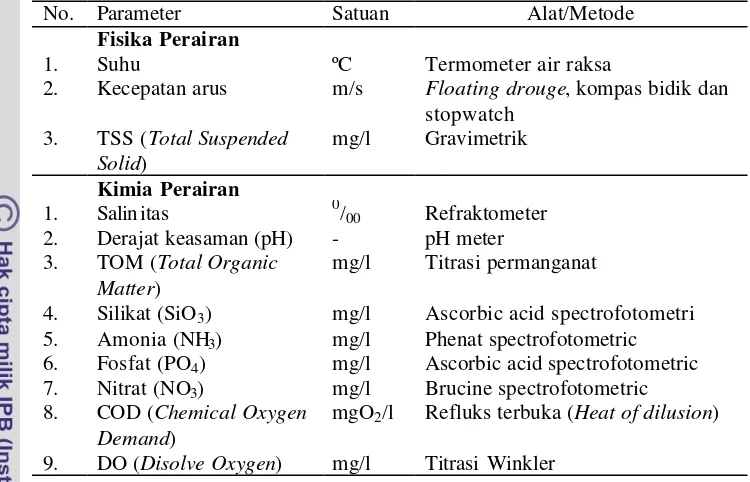
Data hasil pengukuran parameter fisika-kimia air di dua lokasi fragmentasi spons yaitu ST1 dan ST2 dianalisis. Sample air diambil setiap bulan dan bersamaan dengan saat dilakukan pengukuran pertumbuhan spons selama 6 bulan. Tujuan yang ingin dicapai adalah untuk mengetahui kelayakan kondisi kualitas air yang optimal bagi pertumbuhan fragmen spons yang difragmentasikan berdasarkan baku mutu air laut sesuai dengan (Kep.Men 179/Men.KLH/2004) (Lampiran 1). Parameter fisika dan kimia air yang diukur secara in situ meliputi suhu, salinitas, pH serta kecepatan arus. Sedangkan parameter fisika dan kimia yang diukur di Laboratorium Kimia Oseanografi dan Produktivitas Lingkungan Departemen ITK-FPIK IPB meliputi TSS (Total Suspended Solid), TOM (Total Organic Matter), silikat, amonia, fosfat, nitrat, COD (Chemical Oxygen Demand), dan DO (Disolve Oxygen)).
30 Tabel 1. Parameter fisik-kimia air yang diukur
No. Parameter Satuan Alat/Metode
Fisika Perairan
1. Suhu ºC Termometer air raksa
2. Kecepatan arus m/s Floating drouge, kompas bidik dan stopwatch
4. Silikat (SiO3) mg/l Ascorbic acid spectrofotometri 5. Amonia (NH3) mg/l Phenat spectrofotometric 6. Fosfat (PO4) mg/l Ascorbic acid spectrofotometric 7. Nitrat (NO3) mg/l Brucine spectrofotometric 8. COD (Chemical Oxygen
Demand)
mgO2/l Refluks terbuka (Heat of dilusion) 9. DO (Disolve Oxygen) mg/l Titrasi Winkler
Pemeliharaan fragmen spons pada rak horisontal dan vertikal
Induk spons diambil langsung dari alam dengan cara melakukan penyelaman menjelajahi di sekitar lokasi penelitian. Induk yang didapat diambil sekitar 25% dari total tubuhnya kemudian ditempatkan pada wadah yang terendam air laut dan selanjutnya diangkat dan dilakukan pemotongan menjadi fragmen berukuran ± 3 cm x 3 cm. Sebanyak 336 fragmen diperoleh dari hasil pemotongan tersebut dan kemudian ditempatkan pada masing-masing stasiun (ST1 dan ST2) secara merata sebanyak 168 fragmen. Masing-masing metode rak horisontal dan vertikal ditempatkan 84 fragmen. Kegiatan pemotongan dan penusukan fragmen seluruhnya dilakukan di atas kapal.
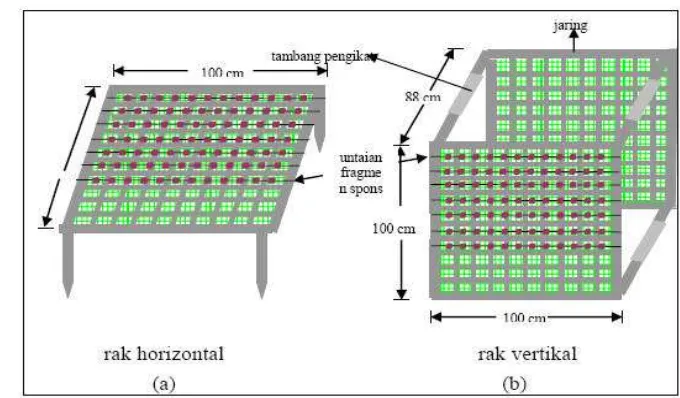
31 Metode fragmentasi spons yang digunakan pada penelitian ini adalah yang dikembangkan oleh Duckworth et al., 1999. Penelitian dilakukan dengan menggunakan dua metode yaitu rak horizontal dan rak vertikal (Gambar 4 a dan b). Rak terbuat dari bingkai besi berukuran 1 m x 1 m yang ditancapkan pada substrat. Fragmen yang telah dipotong dan diuntai diikatkan pada rak dengan posisi horisontal dan vertikal.
Gambar 4. Bentuk rak fragmentasi (a) Rak Horizontal, (b) Rak Vertikal
32
Sumber : Koleksi Pribadi
Gambar 5. a) Penempatan tali polyetilen pada fragmen, b) Penempatan fragmen pada rak.
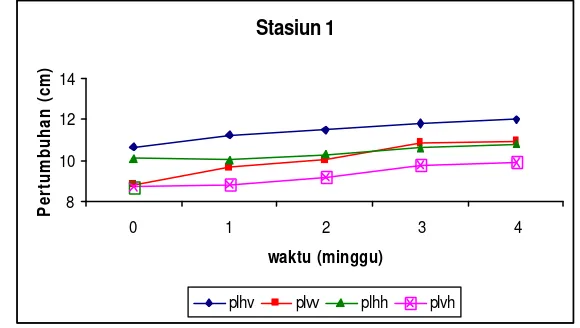
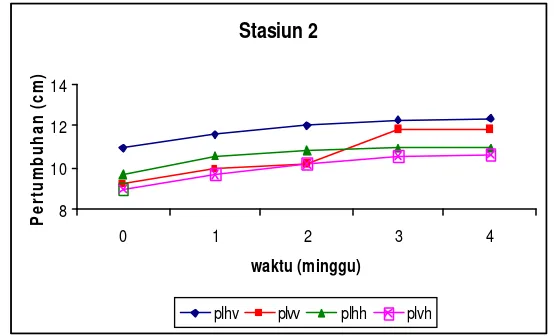
Pengukuran pertumbuhan fragmen spons dimulai setelah satu minggu fragmen diletakkan pada rak dan kondisi luka serta stress pada spons telah hilang. Pengukuran dan pengambilan data pertumbuhan dilakukan tiap akhir minggu selama 5 minggu. Pengukuran yang dilakukan adalah pengukuran pertumbuhan melingkar atau keliling dari tiap fragmen yang difragmentasi. Cara pengukurannya yaitu, 1) pengukuran panjang lingkar horisontal (plh), yaitu arah pertumbuhan fragmen yang sejajar dengan tali polyetilen dan 2) pengukuran panjang lingkar vertikal (plv), yaitu arah pertumbuhan fragmen yang tegak lurus dengan posisi tali polyetilen. Pengukuran dilakukan dengan menggunakan meteran plastik elastis dengan tujuan agar pengukuran dapat mengikuti kontur tubuh dari fragmen spons (Gambar 6).