EKSTRAKSI, KARAKTERISASI DAN PURIFIKASI ENZIM
KATEPSIN DARI IKAN PATIN (Pangasius hypophthalmus)
MUHAMMAD ZAKIYUL FIKRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul ”Ekstraksi, Karakterisasi dan Purifikasi Enzim Katepsin dari Ikan Patin (Pangasius hypophthalmus)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Muhammad Zakiyul Fikri
ABSTRACT
MUHAMMAD ZAKIYUL FIKRI. Extraction, Characterization and Purification
Enzymes Cathepsin from Catfish (Pangasius Hypophthalmus) Advised by TATI NURHAYATI and ELLA SALAMAH.
This study aims to extract the enzyme cathepsin, to characterize the crude extract and to purify the cathepsin enzyme derived from catfish. the stages of this research consists of the extraction, characterization, and purification of the enzyme cathepsin. the characteristic of crude extract from cathepsin enzyme is that it has temperature, pH and substrate optimum around 50 °C, 6, and 2%. The presence of Fe3+ , Cu2+, Ca2+,Mn2+ metal ions can inhibit enzyme activity. Purification process using ion exchange chromatography on DEAE-sephadex A-50 gives the best value on the activity of the fraction 18 is equal to 0.762 U / mL and the specific activity of 54.077 mg / mL as well as having multiple levels of purification of 59.602 times. Molecular weight of cathepsin enzyme is purely the result of SDS-PAGE and the molecular weight of 43.18 kDa enzyme has a proteolytic activity alleged in zimogram analysis is 49.93 kDa.
RINGKASAN
MUHAMMAD ZAKIYUL FIKRI. Ekstraksi, Karakterisasi dan Purifikasi Enzim
Katepsin dari Ikan Patin (Pangasius hypophthalmus). Dibimbing oleh TATI NURHAYATI dan ELLA SALAMAH.
Ikan patin (pangasius hypophthalmus) merupakan salah satu spesies di Indonesia yang memegang peranan penting dalam produksi perikanan budidaya. Ikan patin diketahui memiliki kandungan gizi yang cukup untuk memenuhi kebutuhan protein hewani. Kandungan gizi ikan patin menjadi tidak bernilai tinggi apabila tidak ditangani dengan baik setelah penangkapan atau pemanenan, karena ikan patin sebagai bahan pangan ikani sangat rentan terhadap kerusakan (highly perishabe food) atau cepat mengalami kemunduran mutu. Salah satu penyebab terjadinya proses kemunduran mutu ialah adanya aktivitas enzim proteolitik. Ladrat et al. (2006) menyatakan bahwa enzim katepsin merupakan kelompok dari enzim proteolitik yang berperan aktif dalam pelunakan daging ikan. Penelitian ini bertujuan untuk mendapatkan ezim katepsin murni dari ikan patin dan melakukan karakterisasi dari hasil enzim tersebut.
Penelitian ini diawali dengan preparasi sampel, ekstraksi enzim katepsin kasar, karakterisasi enzim katepsin kasar yang meliputi penentuan suhu, pH, substrat optimum, dan ion logam penghambat dan pemurnian enzim katepsin kasar yang terdiri dari proses presipitasi dan dialisis.
Karakteristik enzim katepsin kasar yang dihasilkan mempunyai suhu dan pH optimum 50 °C dan 6, konsentrasi substrat optimum sebesar 2% dan keberadaan ion logam Ca2+, Mn2+, Cu2+ dan Fe3+ akan mengganggu atau menghambat aktivitas enzim. Ion logam Fe3+ memberikan nilai hambatan tertinggi terhadap aktivitas enzim katepsin dari ikan patin. Enzim katepsin kasar yang diperoleh memiliki aktivitas enzim sebesar 0,278 U/ml dan aktivitas spesifiknya sebesar 0,907 U/mg. Enzim katepsin setelah dipresipitasi memiliki aktivitas enzim sebesar 0,425 U/mL dan aktivitas spesifiknya sebesar 0,276 U/mg dan setelah didialisis memiliki aktivitas enzim sebesar 1,550 U/mL dengan aktivitas spesifik sebesar 2,704 U/mg. Enzim katepsin kemudian dimurnikan dengan menggunakan kromatografi ion exchange DEAE sephadex A-50. Fraksi terbaik adalah fraksi ke 18 dengan tingkat kelipatan pemurnian sebesar 59,602 kali, memiliki aktivitas enzim sebesar 0,762 U/mL dan aktivitas spesifiknya 54,077 mg/mL. Berat molekul enzim katepsin murni hasil SDS-PAGE 43,18 kDa dan berat molekul enzim yang diduga mempunyai aktivitas proteolitik pada analisis Zymogram adalah 49,93 kDa.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
EKSTRAKSI, KARAKTERISASI DAN PURIFIKASI ENZIM
KATEPSIN DARI IKAN PATIN (Pangasius hypophthalmus)
MUHAMMAD ZAKIYUL FIKRI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar master pada Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Ekstraksi, Karakterisasi dan Purifikasi Enzim Katepsin dari Ikan Patin (Pangasius hypophthalmus)
Nama : Muhammad Zakiyul Fikri NIM : C351100091
Disetujui oleh Komisi Pembimbing
Dr Tati Nurhayati, SPi MSi Dra Ella Salamah, MSi Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana, Teknologi Hasil Perairan Institut Pertanian Bogor
Dr Tati Nurhayati, SPi MSi. Dr Ir Dahrul Syah MScAgr
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan Rahmat dan Karunia-Nya, sehingga penulis dapat menyelesaikan tesis ini dengan judul “Ekstraksi, Karakterisasi dan Purifikasi Enzim Katepsin dari Ikan Patin (Pangasius hypophthalmus)”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1. Dr Tati Nurhayati, SPi MSi selaku ketua komisi pembimbing dan Dra Ella Salamah, MSi. sebagai anggota komisi pembimbing serta
Dr Dra Pipih Suptijah, MBA sebagai dosen penguji luar komisi atas kesediaan waktu untuk membimbing, memberikan arahan dan masukan selama penyusunan tesis ini.
2. Dr Tati Nurhayati, SPi MSi selaku ketua Program Studi Teknologi Hasil Perairan.
3. Bapak dan Ibu staf pengajar, staf administrasi dan laboran Program Studi Teknologi Hasil Perairan serta laboran Mirobiologi dan Biokimia Hewan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) yang telah banyak membantu dan kerjasamanya yang baik selama penulis menempuh studi.
4. Ayahanda Muhd. Nur Anan Domo dan Ibunda Siti Kamilah dan kakanda tersayang Hilalatul Khairiyah dan Nurul Arifah beserta seluruh keluarga atas doa, motivasi dan semangat selama penulis menempuh studi.
5. Teman-teman S2 THP 2010, 2011 dan 2012 dan semua teman-teman atas kerjasama yang baik selama studi serta segala motivasi, persahabatan, sharing dan diskusi selama penulis menempuh studi, Terimakasih.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Semoga karya ilmiah ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya.
Bogor, September 2013
RIWAYAT HIDUP
Muhammad Zakiyul Fikri dilahirkan pada tanggal 23 Februari 1986 di Batusangkar Provinsi Sumatera Barat, merupakan anak ketiga dari tiga orang bersaudara dari pasangan yang berbahagia Muhd. Nur Anan Domo dan Siti Kamilah.
Penulis menyelesaikan pendidikan sekolah dasar di SDN 020 Tunggul Hitam Padang pada tahun 1998. Sekolah Madrasah Tsanawiyah di MTSs Darel Hikmah Pekanbaru tahun 2002, dan Sekolah Madrasah Aliyah di MAN 2 Model Pekanbaru pada tahun 2005.
Penulis diterima Universitas Riau melalui jalur PBUD pada tahun 2005 dan memilih Jurusan Teknologi Hasil Perikanan dan tamat pada tahun 2010. Selama di UNRI penulis aktif di organisasi Himpunan Mahasiswa Teknologi Hasil Perikanan (2007-2008). Pada tahun 2010, penulis meneruskan pendidikan pascarsajana di Institut Pertanian Bogor (IPB) dengan Program Studi Teknologi Hasil Perairan. Penulis melakukan penelitian dengan judul “Ekstraksi, Karakterisasi dan Purifikasi Enzim Katepsin dari Ikan Patin (Pangasius hypophthalmus)”. Sebagian tesis sudah di kirim ke jurnal Teknologi dan Industri
Pangan dengan judul “Ekstraksi dan Karakterisasi Crude Ekstrak Enzim Katepsin dari Ikan Patin (Pangasius hypophthalmus)”.
DAFTAR ISI
2.1 Deskripsi dan Identifikasi Ikan Patin (Pangasius hypophthalmus) 4
2.2 Enzim 5
2.3 Enzim Katepsin 6
2.4 Faktor-Faktor yang Mempengaruhi Enzim 9
2.5 Pemurnian Enzim 11
3.3.1 Ekstraksi katepsin kasar 21
3.3.2 Presipitasi dan dialisis 22
3.3.3 Pemurnian dengan kromatografi (Ustadi et al 2005) 22
3.3.4 Karakterisasi enzim katepsin 22
3.3.4.1 Penentuan suhu optimum 23
3.3.4.2 Penentuan pH optimum 23
3.3.4.3 Penentuan substrat optimum 23
3.3.4.4 Penghambatan ion logam 24
3.4 Analisis 24
3.4.1 Aktivitas katepsin (Dinu et al 2002) 24 3.4.2 Pengukuran konsentrasi protein (Bradford 1976) 25 3.4.3 Penentuan berat molekul dengan SDS-PAGE 26
4 HASIL DAN PEMBAHASAN 28
4.1 Ekstraksi Enzim Katepsin 28
4.2 Karakteristik Enzim Katepsin Ikan Patin 28
4.2.1 Derajat keasaman (pH) optimum 28
4.2.2 Suhu optimum 29
4.2.4 Pengaruh ion logam terhadap aktivitas enzim 32
4.3 Presipitasi 34
4.4 Dialisis 36
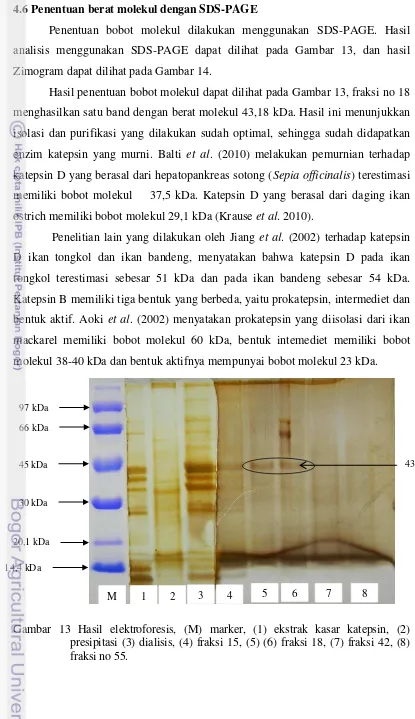
4.5 Pemurnian dengan Kromatografi Penukar Ion 37 4.6 Penentuan Berat Molekul dengan SDS-PAGE 39
5 SIMPULAN DAN SARAN 41
DAFTAR PUSTAKA 42
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Ikan patin (Pangasius hypophthalmus) 5 2 Pemurnian enzim dengan kromatografi penukar ion 15
3 Diagram alir tahapan penelitian 21
4 Pengaruh pH terhadap aktivitas enzim katepsin ikan patin 29 5 Pengaruh suhu inkubasi terhadap aktivitas enzim katepsin ikan patin 30 6 Pengaruh konsentrasi substrat terhadap aktivitas enzim katepsin 31 7 Pengaruh ion logam konsentrasi 5 mM terhadap aktivitas enzim katepsin 32 8 Pengaruh kejenuhan ammonium sulfat terhadap aktivitas enzim katepsin 35 9 Kadar protein enzim katepsin ikan patin dari pellet hasil pengendapan
ammonium sulfat 36
10 Aktivitas enzim setelah didialisis 37
11 Kadar protein enzim setelah didialisis 37
12 Kadar protein ( ) dan nilai aktivitas enzim katepsin ( ) hasil
pemurnian menggunakan kromatografi penukar ion 38 13 Hasil elektroforesis, (M) marker, (1) ekstrak kasar katepsin,
(2) presipitasi (3) dialisis, (4) fraksi 15, (5) (6) fraksi 18, (7) fraksi 42,
(8) fraksi 55 39
DAFTAR LAMPIRAN
Halaman
1 Pembuatan larutan 48
2 Kurva standar penentuan konsentrasi protein menurut metode Bradford
(1976) 49
3 Kurva standar marker elektroforesis 50
4 Komposisi gel dan perekasi untuk elektroforesis 51 5 Tabel konversi dari g (gravity) ke rpm (rotary per minute) 52
1
1. PENDAHULUAN
1.1 Latar belakang
Ikan patin (Pangasius hypophthalmus) merupakan salah satu spesies ikan budidaya di Indonesia. Ikan patin menjadi salah satu jenis ikan budidaya yang memegang peranan penting dalam produksi perikanan budidaya yang mencapai nilai produksi pada tahun 2009 sebesar 109.606 ton (KKP 2011) dan mengalami peningkatan produksi pada tahun 2010 mencapai nilai produksi 225.000 ton (Ditjen Perikanan Budidaya 2011).
Selain nilai produksi yang cukup tinggi, ikan patin juga mempunyai kandungan gizi yang cukup untuk memenuhi kebutuhan protein hewani. Thammapat et al. (2010) menginformasikan bahwa kandungan protein pada fillet patin cukup tinggi, yaitu berkisar antara 12,94–17,52% (bb), sedangkan kandungan lemaknya berkisar antara 0,89–1,23% (bb). Kandungan lemak fillet patin cukup rendah bila dibandingkan produk ikan lainnya. Ikan patin memiliki kandungan lemak yang tinggi terutama berasal dari bagian perut (belly) yaitu 54,43% (bk).
Kandungan gizi ikan patin menjadi tidak bernilai tinggi apabila tidak ditangani dengan baik setelah penangkapan atau pemanenan. Hal ini disebabkan ikan patin sebagai bahan pangan ikani sangat rentan terhadap kerusakan (highly perishable food). Kerusakan daging ikan yang terjadi pada fase rigor mortis hingga fase post rigor, ditandai dengan melemasnya daging ikan (softening). Pelemasan ini bukan disebabkan oleh terpecahnya protein aktomiosin yang telah terbentuk tetapi karena kerusakan jaringan daging ikan. Kerusakan ini disebabkan oleh aktivitas enzim-enzim proteolisis yang memecah protein menjadi molekul yang lebih sederhana (autolisis) (Clucas dan Ward 1996).
Enzim-enzim proteolisis mampu menghidrolisis protein pada daging ikan yang menyebabkan perubahan fungsional dan sifat organoleptik dari daging. Enzim-enzim tersebut antara lain kolagenase, katepsin dan kalpain. Ladrat et al.
2
Tekstur merupakan salah satu karakteristik penting dalam penentuan kualitas ikan. Masalah yang sering diamati berhubungan dengan tekstur, yaitu pelunakan daging dan gaping (terpisahnya jaringan ikat), karena sifat alami daging ikan yang bertekstur lunak. Mekanisme penentuan tekstur lunak tidak sepenuhnya diteliti, tetapi beberapa penulis menekankan peran penting enzim endogen proteolitik dalam proses perubahan ini. Lebih khusus lagi, rincian dari struktur yang miofibrillar terutama untuk aktivitas katepsin lysosomal, katepsin B (EC 3.4.22.1), katepsin L (EC 3.4.22.15) dan katepsin D (EC 3.4.23.5), yang sangat aktif dalam ikan (Ladrat et al. 2006).
Penelitian mengenai enzim katepsin pada daging ikan telah banyak dilakukan. Liu et al. (2008) melaporkan enzim katepsin yang diisolasi dari daging ikan silver carp (Hypophthalmichthys molitrix) mempunyai suhu dan pH optimum 35 oC dan 5,5 dengan berat molekul 29 kDa. Visessanguan et al. (2003) telah mengisolasi enzim katepsin L pada ikan Atheresthes stomias memiliki suhu dan pH optimum 60 oC dan 5,5 dengan berat molekul 27 kDa. Nielsen dan Nielsen (2001) melaporkan hasil isolasi enzim katepsin dari ikan Clupea harengus
memiliki pH optimum 2,5 dan berat molekul 38-39 kDa. Informasi mengenai enzim katepsin yang berasal dari ikan patin (Pangasius hypophthalmus) belum tersedia, sehingga perlu dilakukan penelitian mengenai enzim katepsin dari ikan tersebut.
1.2 Perumusan masalah
3
1.3Tujuan penelitian
Tujuan penelitian ini adalah mempelajari karakteristik enzim pada ikan patin, yang terdiri dari :
a) Memperoleh ekstrak kasar enzim katepsin dari ikan patin (Pangasius hypophthalmus).
b) Memperoleh informasi mengenai karakteristik enzim katepsin yang dihasilkan dari ekstrak kasar enzim katepsin ikan patin (Pangasius hypophthalmus). c) Memperoleh enzim katepsin murni dari ikan patin (Pangasius
hypophthalmus). 1.4. Manfaat penelitian
4
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Identifikasi Ikan Patin (Pangasius hypophthalmus)
Ikan patin merupakan salah satu jenis ikan yang bernilai ekonomis tinggi. Ikan patin memiliki banyak kelebihan dalam bidang budidaya, yaitu mudah dibudidayakan jika dibandingkan dengan ikan tawar lainnya. Ikan patin sudah bisa mencapai panjang 35-40 cm dalam waktu enam bulan, tempat pemeliharan ikan patin tidak memerlukan air yang mengalir, bahkan di perairan yang kandungan oksigennya rendah ikan ini masih dapat hidup dan berkembang. Ikan patin banyak ditemukan di sungai dan danau karena ikan ini merupakan ikan yang hidup di perairan umum (Khairuman dan Suhendra 2002).
Ikan patin berasal dari golongan famili Pangasidae yaitu jenis ikan berkumis yang hidup di muara-muara sungai yang tersebar di sebagian wilayah Sumatera dan Kalimantan. Ikan patin (Pangasius sp) berasal dari perairan umum dengan distribusi penyebarannya meliputi Thailand, Kamboja, Myanmar, Laos, Vietnam dan Indonesia. Di Indonesia dikenal dua jenis ikan patin yaitu ikan patin lokal (Pangasius sp.) dan ikan patin siam (Pangasius hypophthalmus). Salah satu jenis varietas ikan patin lokal yang telah menjadi komoditas ekspor hasil perikanan adalah ikan patin jambal (Pangasius djambal) (Djarijah 2001).
Klasifikasi ikan patin (Pangasius hypophthalmus) menurut Saanin (1984) adalah sebagai berikut :
Filum : Chordata Subfilum : Vertebrata Subkelas : Teleostei Ordo : Ostariophysi Famili : Pangasidea Genus : Pangasius
Spesies : Pangasius hypophthalmus
5
dua pasang kumis pendek yang berfungsi sebagai peraba. Karakteristik ikan patin adalah kulit halus dan memiliki dua pasang sungut yang relatif pendek sehingga sering disebut sebagai catfish serta terdapat patil di sirip punggung dan sirip dadanya (Susanto dan Amri 1997).
Gambar 1 Ikan patin (Pangasius hypophthalmus).
(Sumber: http://www.fishbase.us/photos/UploadedBy.php?autoctr=2576&win=uploaded)
Ciri khas ikan patin lainnya yaitu jari-jari sirip punggung dan sirip dada sempurna dengan tujuh jari-jari bercabang, sirip dubur panjang dan bersambung dengan sirip ekor, sedangkan sirip ekor berbentuk seperti gunting. Ukuran kepala ikan patin relatif kecil, dengan mulut terletak diujung kepala agak sebelah bawah dan pada sudut mulutnya terdapat dua pasang kumis pendek yang berfungsi sebagai peraba (Susanto dan Amri 1997). Ikan ini memiliki warna khas pada tubuhnya kelabu kehitaman, sedangkan warna perut dan sekitarnya putih (Hernowo 2001).
Ikan patin cukup potensial dibudidayakan di berbagai media pemeliharaan yang berbeda, yaitu kolam, keramba, dan jala apung. Budidaya ikan ini meliputi dua kegiatan yakni pembenihan dan pembesaran. Kegiatan pembenihan merupakan upaya untuk menghasilkan benih pada ukuran tertentu. Pembesaran merupakan kegiatan untuk menghasilkan ikan yang siap dikonsumsi, meskipun ukuran ikan yang dikonsumsi biasanya berbeda sesuai dengan kebutuhan pasar (Susanto dan Amri 1997).
2.2 Enzim
6
membuat makromolekul sel dari prekursor sederhana (Lehninger 1993). Enzim bersifat sangat aktif. Pada reaksi-reaksi tertentu hanya diperlukan beberapa molekul enzim saja untuk mengkatalisis sejumlah substrat. Hal ini dimungkinkan karena protein enzim dapat direaksikan secara berulang-ulang. Kerja enzim dimulai saat molekul enzim berikatan dengan substrat, kemudian mengubahnya menjadi produk dalam waktu yang singkat. Enzim yang telah bebas dapat dipakai untuk mengikat molekul substrat lainnya (Suhartono 1989).
2.3 Enzim katepsin
Katepsin merupakan salah satu enzim proteolitik yang ditemukan pada jaringan hewan termasuk ikan yang dapat menghidrolisis protein menjadi polipeptida. Katepsin banyak ditemukan dalam jaringan otot ikan terutama dalam organel sub seluler atau disebut lisosom dan dibagi dalam dua tempat, yakni pada serabut otot dan matriks ekstraselluler (Shahidi dan Botta 1994). Menurut pH optimumnya, enzim proteolitik dibagi menjadi tiga kelompok, yaitu protease asam, basa, dan netral (Choi et al. 2005). Banyak katepsin optimal pada pH asam walaupun beberapa diantaranya aktif pada pH netral (Haard 1994).
Katepsin B ditemukan secara luas pada lisosom. Katepsin B dapat diisolasi dari beberapa spesies mamalia dan berbagai jaringan meliputi limpa, liver, kelenjar paratiroid dan otak. Katepsin B ialah glikoprotein dengan jumlah manosa yang sangat rendah atau rendah. Katepsin H dan katepsin L ditemukan lebih banyak dibandingkan katepsin B. Ketiga enzim ini dipurifikasi bersama melalui beberapa tahap sampai mereka terpisah oleh kromatografi pertukaran ion. Metode baru yang lebih efisien, yakni kromatografi covalent affinity baru saja dikenalkan untuk mempurifikasi katepsin B. Ketiga katepsin ini sangat tidak stabil pada pH dibawah 7 (Polgar 1990).
7
Katepsin D pertama kali ditemukan pada jaringan otot daging oleh Siebert, kemudian diidentifikasikan oleh Mekino dan dan Ikeda. Katepsin D dipercaya berperan dalam pendegradasian secara signifikan pada tekstur selama penyimpanan dingin. Katepsin D juga dilaporkan merupakan salah satu katepsin penting dalam tenderisasi pada post mortem karena katepsin D menyerang secara langsung protein pada otot yang akan menghasilkan peptida yang dapat dipecah lebih lanjut oleh katepsin lainnya (Park 2005).
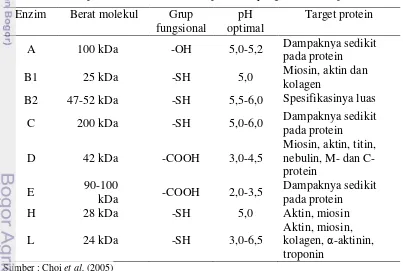
Katepsin H aktif pada pH netral, stabil terhadap panas, dan menunjukkan aktivitas molekuler dengan substrat miosin. Katepsin L merupakan jenis protease lain yang sangat aktif dalam mendegradasi protein miofibril. Aktivitas molekular dari katepsin L dengan substrat miosin adalah 10 kali lebih besar dari pada katepsin B. Katepsin L dapat mendegradasi miofibril termasuk aktin, miosin, dan tropomiosin pada pH 6,5 dan secara khusus aktif untuk troponin serta dalam pemindahan Ca dari ATPase miofibril pada pH netral (Shahidi dan Botta 1994). Tabel 1 menyajikan beberapa sifat dari proteinase.
Tabel 1 Sifat proteinase lisosomal, katepsin A-L yang ditemukan pada otot Enzim Berat molekul Grup
fungsional
8
menurunkan fleksibilitas (kekenyalan) sehingga daging ikan menjadi tidak elastis dan jaringan daging ikan melunak (Haard dan Simpson 2000). Daging yang melunak ini merupakan salah satu sumber masalah pada industri surimi karena katepsin dapat menurunkan kemampuan pembentukan gel dalam proses pembuatan surimi dari daging ikan akibat degradasi protein miofibril yang dapat mengurangi elastisitas dan kekuatan gel surimi (Jiang 2000).
Katepsin berperan penting dalam proses kemunduran mutu ikan selama masa post mortem. Ketika ikan mati (fase prerigor), maka kondisi menjadi anaerob dan ATP terurai oleh enzim yang terdapat dalam tubuh ikan dengan melepaskan energi. Proses ini kemudian diikuti dengan peristiwa glikolisis yang menguraikan glikogen menjadi asam laktat. Pembentukan asam laktat menyebabkan terjadinya penurunan pH dan jaringan otot tidak mampu mempertahankan fleksibilitasnya (kekenyalannya). Kondisi inilah yang dikenal dengan rigor mortis. Nilai pH yang semakin menurun mengakibatkan katepsin yang terdapat dalam jaringan otot menjadi aktif (Afrianto dan Liviawaty 1989).
Katepsin merupakan protease asam yang biasanya terletak di lisosom (DeDuve et al. 1955 diacu dalam Toldra 2010) dan sel fagosit tetapi juga telah ditemukan dalam reticulum sarkoplasmik dari sel otot (Allen dan Goll 2003 diacu dalam Toldra 2010). Lisosom tidak mampu menelan struktur miofibril dan tidak ada fragmen miofibril yang diidentifikasi pada lisosom. Di sisi lain, membran lisosom sangat rapuh yang mungkin disebabkan oleh penurunan suhu dan pH otot selama penyimpanan post mortem. Katepsin B mendegradasi miosin dan aktin ke tingkat yang lebih rendah, sementara katepsin D mendegradasi baik aktin dan miosin menjadi fragmen-fragmen peptida berukuran kecil (Haard 1994).
9
Tabel 2 Enzim proteolitik yang berhubungan dengan lisosom otot ikan
Enzim Famili Aktivitas Jenis Ikan
Katepsin B Sistein Endopeptidase Dimurnikan dari otot berbagai spesies ikan, identifikasi pada berbagai spesies
Katepsin H Sistein Endopeptidase Identifikasi pada otot ikan salmon
Katepsin J Sistein Endopeptidase -
Katepsin L Sistein Endopeptidase Identifikasi pada otot ikan salmon dan mackerel
Dipeptidil peptidase I (katepsin C)
Sistein Eksopeptidase Identifikasi dari otot berbagai spesies ikan
Dipeptidil peptidase II
Sistein Eksopeptidase -
Katepsin D Aspartat Endopeptidase Dimurnikan dan diidentifikasi dari otot berbagai spesies ikan
Serin Eksopeptidase Dimurnikan dari berbagai spesies ikan dan diidentifikasi pada otot dari berbagai spesies Katepsin S Sistein Eksopeptidase Diidentifikasi pada otot
mackerel Sumber : Goll et al. 1989 diacu dalam Shahidi dan Botta 1994
Pembebasan dan pengaktifan katepsin selanjutnya akan menyebabkan terjadinya penguraian protein menjadi senyawa-senyawa yang lebih sederhana. Hal ini menimbulkan terjadinya akumulasi metabolit dan pembentukan senyawa-senyawa basa volatil yang berakibat terhadap kenaikan pH dan peningkatan jumlah bakteri karena senyawa-senyawa basa tersebut merupakan media yang sangat cocok bagi pertumbuhan bakteri terutama golongan bakteri pembusuk (Lawrie 1985).
Enzim proteolitik mempunyai peran dalam mengontrol berbagai proses biologis dalam tubuh (Almeida et al. 1983). Peningkatan panas yang semakin tinggi sampai batas tertentu akan meningkatkan aktivitas enzim dalam hidrolisis protein (Siswanto dan Soedarto 2008).
2.4 Faktor-faktor yang mempengaruhi kerja enzim
10
antara lain adalah suhu, derajat keasaman (pH), zat penghambat, konsentrasi enzim, dan substrat (Abdurrahman 2008).
Suhu
Suhu sangat berpengaruh terhadap kerja enzim karena enzim terdiri atas protein. Semakin tinggi suhunya, reaksi kimia akan semakin cepat. Akan tetapi enzim akan mengalami denaturasi jika susu terlalu tinggi. Enzim yang mengalami denaturasi akan mengalami perubahan konformasi dari enzim sehingga enzim tersebut tidak aktif.
Derajat keasaman (pH)
Seperti protein, kerja enzim juga dipengaruhi oleh derajat keasaman lingkungan. Setiap enzim memiliki pH lingkungan yang khas untuk mencapai aktivitas optimumnya. Diluar pH tersebut, kerja enzim akan terganggu bahkan akan terdenaturasi.
Zat penghambat
Kerja enzim dapat dihambat oleh zat penghambat/inhibitor. Terdapat dua jenis inhibitor yaitu inhibitor kompetitif dan inhibitor non-kompetitif. Inhibitor kompetitif menghambat kerja enzim dengan cara berikatan dengan enzim pada sisi aktifnya. Inhibitor ini bersaing dengan substrat untuk menempati sisi aktif enzim. Hal ini terjadi karena inhibitor memiliki struktur yang mirip dengan substrat.
Berbeda dengan inhibitor kompetitif, inhibitor non-kompetitif tidak bersaing dengan substrat untuk berikatan dengan enzim. Inhibitor jenis ini akan berikatan dengan enzim pada sisi yang berbeda (bukan sisi aktif enzim). Jika telah terjadi ikatan enzim-inhibitor, sisi aktif enzim aka berubah sehingga substrat tidak dapat berikatan dengan enzim.
Konsentrasi enzim dan substrat
11
tetapi, setelah konsentrasi substrat dinaikkan lebih lanjut, laju reaksi akan mencapai titik jenuh dan tidak bertambah lagi.
2.5 Pemurnian Enzim
Presipitasi Protein
Penambahan senyawa yang hanya menggumpalkan protein dan tidak menggumpalkan bahan lain akan memisahkan dan lebih memurnikan protein yang dihasilkan. Tahap ini diistilahkan dengan presipitasi (Suhartono et al. 1992). Menurut Chaplin dan Bucke (1990), presipitasi protein merupakan metode yang berguna untuk pemekatan protein dan sering dilakukan pada tahap awal dari pemurnian enzim.
Presipitasi protein dapat dilakukan dengan beberapa cara antara lain perubahan pH, penambahan garam, dan penambahan pelarut organik. Protein akan mengendap jika pH larutan berada pada pH isoelektrik protein. Garam yang digunakan dalam presipitasi protein dapat berupa ammonium sulfat, sodium sulfat, dan sebagainya tergantung kepada jenis protein. Konsentrasi garam yang ditambahkan adalah konsentrasi jenuhnya (Suhartono et al. 1992). Pemekatan protein dengan menambahkan ammonium sulfat ke dalam larutan enzim merupakan cara yang banyak dilakukan.
Beberapa keuntungan menggunakan ammonium sulfat antara lain mudah larut, tidak toksik, murah, dan stabilitasnya terhadap enzim karena tidak mempengaruhi struktur protein (Webb dan Dixon 1979). Selain keuntungan yang diperoleh, penggunaan ammonium sulfat juga menimbulkan kerugian antara lain konsentrasi garam yang tertinggal dalam produk tinggi, kurang efisien dalam menghilangkan impuritis dan ammonium sulfat tidak bersifat bufer sehingga dapat membebaskan ammonia yang mengakibatkan kemungkinan penambahan nilai pH (Suhartono et al. 1992).
12
menurun (salting out). Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein. Peristiwa ini mengakibatkan protein saling berinteraksi, beragregasi, kemudian mengendap (Harris 1989; Scopes 1994).
Garam berlebih yang terdapat di dalam larutan enzim setelah tahap fraksinasi dapat dihilangkan dengan cara dialisis. Pada tahap dialisis, protein ditempatkan di dalam kantung (membran) semipermeabel yang direndam di dalam larutan bufer tertentu. Molekul yang berukuran kecil akan ke luar melalui membran, dan molekul yang berukuran besar akan tertahan di dalam membran dialisis. Ukuran pori kantung dialisis yang terbuat dari bahan selulosa asetat berdiameter 1-20 nm. Ukuran ini menunjukkan berat molekul minimum yang dapat tertahan di dalam membran. Selain dengan dialisis, penghilangan garam dapat dilakukan dengan filtrasi gel. Metode ini biasanya diterapkan untuk sampel yang sedikit, yaitu tidak melampaui 25-30% volume kolom untuk mendapatkan resolusi yang memadai antara protein dan garam. Matriks filtrasi gel memiliki pori yang berukuran kecil, misalnya Sephadex G-25 buatan Phamacia. Kekurangan metode ini adalah terjadi pengenceran sampel protein (Harris 1989).
2.6 Kromatografi
Kromatografi merupakan teknik pemisahan dengan mengadakan manipulasi atas dasar perbedaan sifat-sifat fisik dari zat-zat yang menyusun suatu campuran. Kromatografi juga termasuk teknik isolasi komponen dalam suatu campuran menggunakan medium yang mengalir pada liquid atau gas yang disebabkan perbedaan migrasi setiap komponen. Aliran tersebut biasanya menggunakan tekanan atau gravitasi. Teknik kromatografi secara mendasar terdiri dari empat kelompok, yaitu gel filtrasi, penukar ion, interaksi hidrofobik, dan kromatografi afinitas (Rosenberg 1996).
13
Kromatografi penukar ion (ion exchange chromatography) merupakan teknik pemisahan berdasarkan muatan dengan memanfaatkan sifat amfoter dari protein. Pengisi kolom merupakan senyawa polimer elastik dengan kerangka resin sintetik berupa polistirena yang dikaitkan dengan suatu gugus fungsional yang akan berinteraksi dengan molekul enzim. Dietilaminoetil (DEAE) selulosa merupakan penukar ion yang paling banyak digunakan untuk keperluan fraksinasi enzim dan merupakan penukar anion lemah yang bekerja pada kisaran pH 2-9. Penukar ion paling baik dipergunakan pada tahap awal kromatografi dengan kapasitas yang tinggi (Suhartono 1989; Rosenberg 1996).
Tabel 3 Metode kromatografi untuk fraksinasi protein Sifat protein Teknik pemisahan
Hidrofobik -Interaksi hidrofobik dan fase balik kromatografi
Ukuran dan bentuk molekul -Filtrasi gel Titik isoelektrik -Kromatofokusing
Muatan -Kromatografi penukar ion
Biospesifik terhadap ligan,inhibitor, reseptor, antibodi dll
-Kromatografi afinitas
Sumber : APB (2001)
Kromatografi penukar ion memanfaatkan perbedaan afinitas antara molekul bermuatan di dalam larutan dengan senyawa yang tidak reaktif yang bermuatan berlawanan sebagai pengisi kolom (Scopes 1994). Kromatografi penukar ion memisahkan protein berdasarkan muatan bersih protein dan kekuatan relatif dari muatan bersih protein tersebut.
14
dan akan kehilangan muatannya pada pH 9, sedangkan gugus penukar kation lemah CM- akan kehilangan muatannya di bawah pH 4,5. Penukar ion kuat dapat mempertahankan kondisi terionisasi pada rentang pH yang luas. Gugus penukar ion QAE- (penukar anion kuat) dan SP- (penukar kation kuat) dapat mempertahankan kondisi terionisasi pada rentang pH 1-10 (Coligan et al. 2003).
Kolom untuk kromatografi penukar ion biasanya tidak panjang dan memiliki diameter lebih besar dari pada kolom untuk filtrasi gel. Jumlah sampel yang dimasukkan umumnya sekitar 10-20% dari kapasitas kolom. Pembilasan dengan konsentrasi NaCl yang linier baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang tidak terlalu besar sedangkan gradien NaCl bertahap baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang besar.
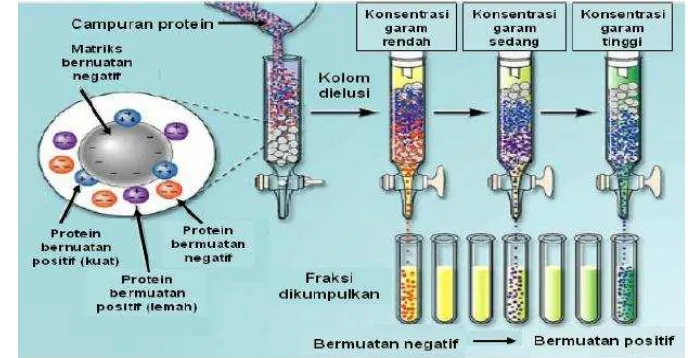
Pada dasarnya prinsip kromatografi penukar ion adalah ion bermuatan bebas dipertukarkan dengan ion yang memiliki tipe muatan yang sama. Protein yang bermuatan negatif dapat ditukar dengan ion klorida. Awalnya gugus fungsional matriks yang bermuatan negatif mengikat ion dari bufer (misalnya Na+). Pada saat sampel dimasukkan ke dalam kolom, maka protein yang bermuatan positif akan menggantikan ion Na+, sedangkan protein yang bermuatan negatif atau netral tidak akan terikat. Protein yang tidak terikat dibilas dengan menggunakan bufer (biasanya dengan konsentrasi 10-50 mM). Selanjutnya ikatan protein yang terikat gugus fungsional matriks akan terlepas setelah dibilas dengan bufer yang mengandung NaCl atau KCl secara linier atau bertahap sehingga protein yang memiliki ikatan lemah dengan matriks akan lepas terlebih dahulu dan diikuti oleh protein yang memiliki ikatan lebih kuat (Gambar 2).
15
Gambar 2 Pemurnian enzim dengan kromatografi penukar ion. (Sumber: http://voh.chem.ucla.edu/vohtar/winter99/153L/lec1.html)
Pada saat menentukan pH untuk kromatografi, kestabilan protein target pada pH yang dipilih perlu dijaga. Apabila protein stabil pada pH di atas titik isoelektriknya (pI) maka digunakan penukar anion (positif), tetapi bila protein stabil pada pH di bawah pI nya maka digunakan penukar kation (negatif). Jika protein stabil pada rentang 1 unit di atas dan di bawah pI maka kedua penukar ion dapat digunakan. Matriks yang mengikat gugus fungsional menentukan sifat aliran, ion yang dapat diikat, kestabilan mekanik dan kimia. Ada 3 kelompok matriks yang biasanya digunakan, yaitu: 1) polistiren, poliakrilik atau polifenol; 2) selulosa; dan 3) dekstran (Sephadex) atau agarosa (Sepharose). Matriks polistiren dan polifenolik lebih sering digunakan untuk memisahkan molekul-molekul kecil misalnya asam-asam amino, peptida kecil, nukleotida, nukleotida siklik, asam-asam organik.Matriks selulosa biasanya digunakan untuk memisahkan protein (termasuk enzim), polisakarida dan asam nukleat. Matriks DEAE-selulosa, CM-selulosa dan fosfoselulosa paling sering digunakan. Matriks polidekstran dan agarosa (misalnya DEAE-Sephadex, CM-Sephadex) digunakan untuk memisahkan protein, hormon, tRNA, dan polisakarida (Scopes 1994).
16
Keuntungan kromatografi penukar ion diantaranya adalah tidak merusak protein yang dimurnikan dan pada umumnya memiliki kapasitas pengikatan yang tinggi. Kelemahannya adalah protein-protein yang memiliki distribusi gugus bermuatan pada permukaannya atau memiliki pI yang sama atau mirip akan sulit dipisahkan dengan cara kromatografi penukar ion. Selain itu larutan enzim hasil kromatografi penukar ion mengandung kadar garam cukup tinggi yang harus dihilangkan untuk proses pemurnian selanjutnya (Scopes 1994).
2.7 Elektroforesis
Elektroforesis didefinisikan sebagai migrasi molekul atau partikel bermuatan di dalam larutan atau medium melalui pengaruh medan listrik (Nielsen 2003). Migrasi partikel bermuatan tersebut dapat terjadi karena perbedaan muatan total, ukuran dan bentuk partikel (Pomeranz dan Meloan 1994). Metode analisis elektroforesis protein merupakan metode analisis yang memisahkan molekul protein berdasarkan berat molekulnya (Bollag dan Edelstein 1991). Teknik elektroforesis telah banyak digunakan dalam analisis protein untuk menentukan
tingkat kemurnian sampel, berat molekul, maupun titik isoelektrik (Copeland 1994). Selain itu, teknik elektroforesis juga sering digunakan untuk
menentukan komposisi protein dari suatu produk pangan (Nielsen 2003).
Pemisahan protein berdasarkan muatannya tergantung pada karakter asam
dan basa protein. Hal ini ditentukan oleh jumlah dan jenis rantai samping (gugus R) yang dapat terionisasi dalam rantai polipeptida serta pH lingkungan.
Pada pH lingkungan yang lebih besar daripada pH isoelektriknya (pI), protein akan memiliki muatan negatif sehingga migrasi protein akan menuju anoda yang bermuatan positif. Sebaliknya, bila pH lingkungan di bawah pI, muatan protein menjadi positif yang membuatnya akan bermigrasi menuju katoda yang bermuatan negatif (Autran 1996). Hal inilah yang menjadi dasar pemisahan protein dengan elektroforesis.
Metode elektroforesis protein yang paling umum dan banyak dilakukan adalah Sodium Dodecyl Sulfate-Poly Acrylamide Gel Electrophoresis (SDS-PAGE). SDS-PAGE merupakan teknik elektroforesis dalam sistem bufer diskontinyu yang menggunakan dua tipe gel sebagai medianya, yaitu stacking gel
17
terkonsentrasi dalam stacking gel sehingga menghasilkan resolusi yang lebih baik ketika pemisahan protein terjadi di separating gel (Garfin 1990).
Gel poliakrilamid dibentuk dari hasil ko-polimerisasi monomer akrilamid (CH2=CH-CO-NH2) dengan bantuan senyawa yang bertindak sebagai crosslinking
agent yaitu N,N’-metilen-bisakrilamid (CH2=CH-CO-NH-CH2-NH-COCH=CH2). Mekanisme polimerisasi akrilamid tersebut dikatalisis oleh tetrametietilendiamin (TEMED) dan amonium persulfat (APS). TEMED akan menyebabkan pembentukan radikal bebas dari amonium persulfat yang mengakibatkan reaksi pembentukan akrilamid aktif. Akrilamid aktif ini akan bereaksi dengan akrilamid lainnya membentuk rantai polimer yang panjang. Hasil dari polimerisasi ini adalah terbentuknya gel dengan struktur jala dari rantai akrilamid. Ukuran pori dan jala gel tersebut ditentukan oleh jumlah akrilamid yang digunakan per unit volumenya dan derajat ikatan silangnya (Garfin 1990; Autran 1996).
Sodium dodecyl sulfate (SDS) adalah detergen anionik yang paling umum digunakan dalam elektroforesis. SDS memiliki dua fungsi, yaitu: (1) untuk memisahkan protein-protein yang beragregasi, hidrofobik, atau memiliki kelarutan yang rendah, misalnya membran protein; dan (2) memisahkan protein berdasarkan bentuk, ukuran dan berat molekulnya. SDS menyelimuti protein dengan muatan negatif serta mengikat protein dengan rasio yang konstan, yaitu 1,4 g SDS per gram polipeptida (Garfin 1990; Autran 1996).
Interaksi SDS dengan protein akan merusak seluruh ikatan non-kovalen protein sehingga struktur protein akan terbuka. Selanjutnya, penggunaan
reducingagent seperti 2-merkaptoetanol atau ditiothreitol akan membantu mendenaturasi protein melalui pemutusan ikatan disulfida pada protein sehingga memecahnya menjadi subunit-subunit protein. Akibatnya, mobilitas elektroforetik dari kompleks detergen polipeptida hanya merupakan fungsi dari berat molekul protein (Garfin 1990).
Elektroforesis protein dapat dilakukan dengan proses denaturasi (SDS-PAGE) dan nondenaturasi (native-PAGE). Mekanisme pada SDS-PAGE
18
atau batang yang ukurannya sebanding dengan berat molekul protein. Protein dalam bentuk kompleks yang bermuatan negatif ini akan dapat terpisahkan berdasarkan muatan dan ukurannya secara elektroforesis di dalam matriks gel poliakrilamida (Smith 1984).
Berbeda dengan SDS-PAGE, pada zimogram gel pemisah disisipi substrat yang akan dihidrolisis oleh enzim selama masa inkubasi. Zimogram merupakan cara menganalisis aktivitas kitinolitik yang sederhana, sensitif, dapat dikuantisasi dan fungsional (Leber dan Balkwil 1997). Pada dasarnya terdapat 2 model teknik zimogram. Model pertama menggunakan substrat yang terikat pada bahan penahan berupa gel, kertas saring, lembaran plastik, atau lapisan substrat langsung. Pada model kedua, indikator diikatkan secara kuat pada gel pemisah dimana enzim subjek dibuat inaktif selama elektroforesis dan diaktifkan kembali setelah elektroforesis. Substrat yang digunakan untuk zimogram harus bersifat kromogenik, kromoforik, atau hasil reaksi enzim dengannya dapat diwarnai (Paech et al. 1993).
Elektroforesis zimogram memisahkan protein terlarut yang tidak mengendap atau beragregasi selama elektroforesis. Pada elektroforesis gel yang terdenaturasi, seperti pada SDS-PAGE, molekul-molekul protein yang telah terpisah dengan elektroforesis dapat kehilangan aktivitas biologi dan biokimianya, tetapi pada elektroforesis zimogram aktivitas tersebut masih bertahan (Dunn 1989). Enzim dipisahkan dalam gel denaturasi (SDS), namun dalam kondisi tidak tereduksi.SDS dilepaskan dengan penambahan larutan renaturasi (misalnya detergen Triton X-100) dan kembali terjadi pelipatan protein. Kemudian gel diwarnai dengan pewarna yang sesuai dengan enzim yang diujikan. Metode zimogram bersifat mudah, sensitif, dan kuantitatif dalam menganalisis aktivitas enzim (Kleiner dan Stetler-Stevenson 1994; Leber dan Balkwil 1997).
19
3. METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2012 sampai Januari 2013 di Laboratorium Bahan Baku Hasil Perairan dan Laboratorium Biokimia Hasil Perairan Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Mirobiologi dan Biokimia Hewan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) Institut Pertanian Bogor.
3.2 Alat dan Bahan
Bahan yang digunakan dalam penelitian ini terdiri dari bahan baku ikan patin dalam keadaan post rigor, bahan-bahan untuk ekstraksi kasar (bufer tris HCl 0,1 M pH 7,4, akuades), presipitasi (ammonium sulfat teknis), dialisis (kantong dialisis ukuran 12 kDa, bufer tris HCl pH 7,4), uji aktivitas katepsin (hemoglobin (sigma), bufer tris 0,1 pH 7,4, tirosin (Applichem), akuades, TCA 5%, folin (merck), dan HCl 1 N), dan uji kadar protein (pereaksi Bradford, bovine serum albumin (applichem)).
Alat yang digunakan pada penelitian ini antara lain inkubator (Thermoline type 42000), sentrifuse dingin (Beckmen), spektrofotometer (Spectrophotometer UV-2500 Labomed Inc), pH meter (Thermo), tabung dialisis, kertas saring Whatman no.1, mikropipet, mikrotip, sudip, dan erlenmeyer.
3.3 Prosedur Penelitian
21
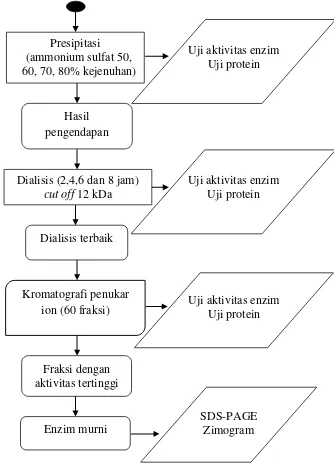
Gambar 3 Diagram alir tahapan penelitian 3.3.1 Ekstraksi katepsin kasar
Ekstraksi dilakukan untuk memperoleh ekstrak kasar katepsin dengan cara ikan dimatikan, kemudian daging ikan dipisahkan dari tulang dan kulit, kemudian dicuci untuk menghilangkan darah. Daging yang telah diambil disuspensikan dalam akuades dengan perbandingan daging ikan dan akuades 1:1 lalu dihomogenisasi pada suhu 0 °C.
Ekstrak daging hasil homogenisasi disentrifugasi pada 600xg, suhu 4 oC selama 10 menit dan supernatan yang diperoleh kemudian disentrifugasi lagi pada
Dialisis (2,4,6 dan 8 jam)
cut off 12 kDa
Dialisis terbaik
Kromatografi penukar ion (60 fraksi)
Presipitasi (ammonium sulfat 50, 60, 70, 80% kejenuhan)
Hasil pengendapan
terbaik
Uji aktivitas enzim Uji protein
Fraksi dengan aktivitas tertinggi
Enzim murni
Uji aktivitas enzim Uji protein
Uji aktivitas enzim Uji protein
22
10.000xg, suhu 4 oC selama 10 menit. Pelet yang dihasilkan dari hasil sentrifugasi kemudian dilarutkan dalam bufer tris HCl 0,1 M pH 7,4 dengan jumlah akuades yang sama dan disentrifugasi pada 4.000xg, suhu 4 oC selama 10 menit. Supernatan (ekstrak kasar katepsin) yang diperoleh merupakan protein utama dari mitokondria dan lisosom yang siap diteliti aktivitasnya lebih lanjut.
3.3.2 Presipitasi dan dialisis
Katepsin semi murni diperoleh dengan mengendapkan ekstrak kasar katepsin menggunakan ammonium sulfat dengan tingkat kejenuhan 50%, 60%, 70%, dan 80% (b/v). Pengendapan dilakukan dengan menambahkan garam ammonium sulfat ke dalam supernatan sedikit demi sedikit dan disentrifugasi pada 12.000xg, suhu 4 oC selama 30 menit.
Pelet dilarutkan dalam bufer Tris HCl 0,1 M pH 7,4. Langkah selanjutnya adalah dialisis. Dialisis dilakukan dalam bufer tris HCl 0,1 M pH 7,4 menggunakan kantong selofan berukuran 12 kDa, dengan waktu dialisis 2, 4, 6 dan 8 jam. Tahap presipitasi dan analisis ini dilakukan pada suhu ≤4 °C. Hasil yang diperoleh dari masing-masing tahap pemurnian, diuji aktivitas enzim dan kadar protein.
3.3.3 Pemurnian dengan kromatografi (Ustadi et al. 2005)
Tahap pemurnian pertama dilakukan dengan kromatografi penukar ion dengan bahan pengelusi bufer B (bufer gel pemisah, Tris-HCl 2M, pH 8,8). Sebanyak 75 mL larutan tris HCl pH 8,8 dan 4 mL larutan SDS 10% (w/v) ditambahkan dengan akuades hingga volume total 100 mL. Matriks menggunakan kolom DEAE sephadex A-50 (3,0 x 30,0 cm) dengan laju aliran 1 mL/menit. Selain itu juga digunakan NaCl bergradien 0-0,7 M. Jumlah volume tiap fraksi ditampung sebanyak 5 mL. Masing-masing fraksi diuji konsentrasi protein dengan spektrofotometer uv =280 nm dan diukur aktivitas enzimnya tiap fraksi dengan metode Dinu et al. (2002).
3.3.4 Karakterisasi enzim katepsin
23
3.3.4.1 Penentuan suhu optimum
Penentuan suhu optimum dilakukan dengan melakukan variasi suhu inkubasi pada saat pengujian aktivitas katepsin dengan suhu 40, 50, 60, dan 70 °C. Pada waktu pengujian, hemoglobin sebagai substratnya dibuat dengan konsentrasi 2% pH 2. Sebanyak 0,5 mL dari larutan substrat 0,1 mL larutan bufer tris HCl 0,1 M
pH 7,4 di inkubasi dengan 0,1 mL larutan enzim pada variasi suhu (40, 50, 60, 70 °C) selama 10 menit. Reaksi dihentikan dengan penambahan 2 mL
TCA 5% (w/v). Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah 1 mL pereaksi folin. Selanjutnya diinkubasi kembali pada suhu 37 °C selama 20 menit. Campuran kemudian diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 750 nm. Selain itu, dilakukan pula pengukuran absorbansi untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin.
3.3.4.2 Penentuan pH optimum
Penentuan pH optimum dilakukan dengan menggunakan pH substrat dan pH buffer yang sama dengan variasi pH 3, 4, 5, 6 ,7. Substrat yang digunakan adalah hemoglobin 2%. Sebanyak 0,5 mL larutan substrat; 0,1 mL larutan bufer diinkubasikan dengan 0,1 mL larutan enzim pada suhu 37 °C selama 10 menit. Reaksi dihentikan dengan penambahan 2 mL TCA 5% (w/v). Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah 1 mL pereksi folin. Selanjutnya diinkubasi kembali pada suhu 37 °C selama 20 menit. Campuran kemudian diukur dengan spektrofotometer pada panjang gelombang 750 nm. Selain itu, dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin.
3.3.4.3 Penentuan substrat optimum
24
dengan 0,1 mL larutan enzim pada suhu 37 oC selama 10 menit. Reaksi dihentikan dengan penambahan 2 mL TCA 5% (w/v). Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah 1 mL pereksi folin. Selanjutnya diinkubasi kembali pada suhu 37 °C selama 20 menit. Campuran kemudian diukur dengan spektrofotometer pada panjang gelombang 750 nm. Selain itu, dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin.
3.3.4.4 Penghambatan ion logam
Karakterisasi pengaruh ion logam dilakukan dengan menambahkan ion logam
monovalent (NaCl), bivalent (ZnCl2, CaCl2.2H2O, MgCl2, MnCl2.4H2O, Cu2SO4.5H2O) serta trivalent ( FeCl3). Pada waktu pengujian, hemoglobin sebagai substratnya dibuat dengan konsentrasi 2% pH 2. Sebanyak 0,5 mL dari larutan substrat, 0,1 mL larutan bufer Tris pH 7,4 dan 0,1 mL larutan logam (NaCl, ZnCl
-2, CaCl2.2H2O, MgCl2, MnCl2.4H2O, Cu2SO4.5H2O, FeCl3) diinkubasi dengan 0,1 mL larutan enzim pada 37 °C selama 10 menit. Reaksi dihentikan dengan
penambahan 2 mL TCA 5% (w/v). Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah dengan 1 mL pereaksi folin, selanjutnya diinkubasi kembali pada suhu 37 °C selama 20 menit. Campuran kemudian diukur dengan spektrofotometer pada panjang gelombang 750 nm. Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah 1 mL pereksi folin. Selanjutnya diinkubasi kembali pada suhu 37 °C selama 20 menit. Campuran hasil inkubasi diukur dengan spektrofotometer pada panjang gelombang 750 nm. Selain itu, dilakukan pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama seperti larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin.
3.4 Analisis
Analisis yang dilakukan meliputi aktivitas katepsin, konsentrasi protein, dan penentuan berat molekul dengan SDS-PAGE.
3.4.1 Aktivitas katepsin (Dinu et al. 2002)
25
0,1 mL larutan bufer Tris HCl 0,1 M pH 7,4 diinkubasi dengan 0,1 mL larutan enzim pada suhu 37 °C selama 10 menit. Reaksi dihentikan dengan penambahan 2 mL
TCA 5% (w/v). Campuran disaring dan 1 mL filtrat hasil penyaringan ditambah 1 mL pereksi folin. Campuran kemudian diukur dengan spektrofotometer pada
panjang gelombang 750 nm. Selain itu, dilakukan pula pengukuran untuk larutan blanko dan larutan standar dengan prosedur yang sama dengan larutan sampel hanya untuk larutan blanko dan larutan standar enzimnya digantikan dengan akuades dan tirosin. Unit aktivitas didefinisikan sebagai jumlah enzim yang dapat mengubah substrat menjadi 1 µmol tirosin dalam 1 menit.
Aktivitas enzim katepsin dapat dihitung dengan rumus berikut :
UA= A . −A .
A . −A .
x
Px
1 T
Keterangan : UA = jumlah tirosin yang dihasilkan per mL enzim permenit P = faktor pengenceran
T = waktu inkubasi
3.4.2 Pengukuran konsentrasi protein (Bradford 1976)
Konsentrasi protein ditentukan menggunakan metode Bradford dengan bovine serum albumin sebagai standar. Persiapan pereaksi Bradford dilakukan dengan cara melarutkan 5 mg coomasive brilliant blue G-250 dalam 2,5 mL etanol 95% (v/v), lalu ditambahkan dengan 5 mL asam fosfat 85% (v/v). Kemudian ditambahkan akuades hingga 250 mL dan disaring dengan kertas saring whatman no. 1 dan dilakukan pengenceran 5 kali sesaat sebelum digunakan.
Konsentrasi protein ditentukan menggunakan metode Bradford dengan cara sebanyak 0,1 mL enzim ditambah pereaksi bradford, selanjutnya dimasukkan ke dalam tabung reaksi. Campuran diinkubasi selama 5 menit dan diukur dengan spektrofotometer pada panjang gelombang 595 nm. Larutan standar diukur dengan
cara yang sama seperti larutan sampel. Larutan standar yang digunakan adalah 0,1-1,0 mg/mL. Tahap berikutnya adalah membuat kurva standar dengan absorbansi
sebagai ordinat (sumbu y) dan konsentrasi protein sebagai absis (sumbu x). berdasarkan kurva tersebut dapat ditentukan konsentrasi protein sampel. Komposisi
26
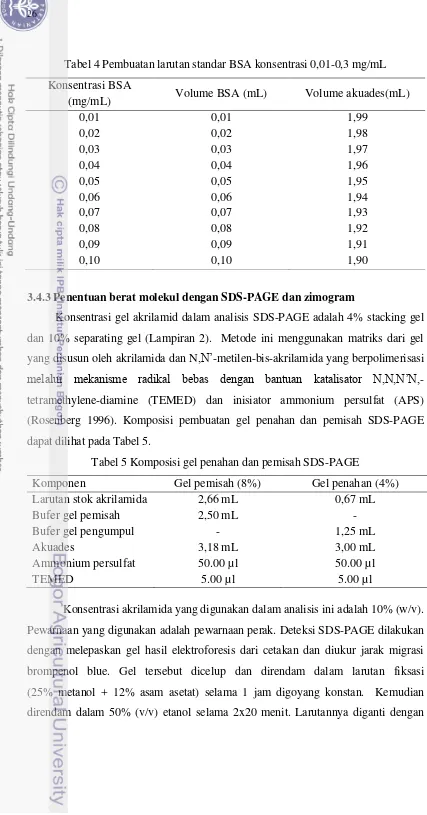
Tabel 4 Pembuatan larutan standar BSA konsentrasi 0,01-0,3 mg/mL Konsentrasi BSA
(mg/mL) Volume BSA (mL) Volume akuades(mL)
0,01 0,01 1,99
3.4.3 Penentuan berat molekul dengan SDS-PAGE dan zimogram
Konsentrasi gel akrilamid dalam analisis SDS-PAGE adalah 4% stacking gel dan 10% separating gel (Lampiran 2). Metode ini menggunakan matriks dari gel yang disusun oleh akrilamida dan N,N’-metilen-bis-akrilamida yang berpolimerisasi
melalui mekanisme radikal bebas dengan bantuan katalisator N,N,N’N, -tetramethylene-diamine (TEMED) dan inisiator ammonium persulfat (APS) (Rosenberg 1996). Komposisi pembuatan gel penahan dan pemisah SDS-PAGE dapat dilihat pada Tabel 5.
Tabel 5 Komposisi gel penahan dan pemisah SDS-PAGE
Komponen Gel pemisah (8%) Gel penahan (4%) Larutan stok akrilamida
Konsentrasi akrilamida yang digunakan dalam analisis ini adalah 10% (w/v). Pewarnaan yang digunakan adalah pewarnaan perak. Deteksi SDS-PAGE dilakukan dengan melepaskan gel hasil elektroforesis dari cetakan dan diukur jarak migrasi
brompenol blue. Gel tersebut dicelup dan direndam dalam larutan fiksasi (25% metanol + 12% asam asetat) selama 1 jam digoyang konstan. Kemudian
27
larutan pengembang kemudian dicuci dengan akuabidestilata. Setelah dicuci ditambahkan larutan perak nitrat selama 30 menit kemudian dicuci lagi dengan akuabidestilata 2x20 detik dan ditambahkan larutan campuran Na2CO3 dan formal dehida dan terakhir dengan larutan fiksasi.
28
4. HASIL DAN PEMBAHASAN
4.1 Ekstraksi enzim katepsin
Ekstrak kasar diperoleh dari daging ikan patin yang sudah memasuki tahap post rigor. Ekstrak kasar yang dihasilkan memiliki aktivitas sebesar 0,278 U/mL dengan aktivitas spesifik 0,9073 U/mg dengan kadar protein sebesar 0,3064 mg/mL. Berdasarkan hasil penelitian Nurhayati et al. (2012) diketahui bahwa ekstrak kasar katepsin yang berasal dari ikan bandeng memiliki aktivitas spesifiknya sebesar 0,8598 U/mg dengan kadar protein sebesar 0,1163 mg/mL. Pemilihan bufer tris HCl pH 7,4 dinilai sudah sesuai. Hal ini sesuai dengan pendapat dari Whitaker (1994) yang menyatakan bahwa ekstraksi enzim sebaiknya menggunakan bufer untuk mengontrol pH dekat dengan 7,5 dan kekuatan ion 0,1-0,5. Bufer diperlukan untuk melindungi enzim dari sejumlah besar asam yang dilepaskan dari vakuola pada saat sel pecah.
4.2 Karakterisasi Enzim Katepsin Ikan Patin
Karakterisasi enzim katepsin ikan patin dilakukan untuk menentukan karakteristik atau sifat-sifat enzim katepsin yang telah diekstrak. Karakterisasi meliputi penentuan derajat keasaman (pH) optimum, suhu optimum, konsentrasi substrat dan pengaruh ion logam terhadap aktivitas enzim kasar katepsin. Menurut Suhartono (1989), faktor-faktor utama yang mempengaruhi aktivitas enzim adalah konsentrasi enzim, substrat, produk, senyawa inhibitor dan aktivator, pH, jenis pelarut yang terdapat pada lingkungan, kekuatan ion, dan suhu.
4.2.1 Derajat keasaman (pH) optimum
Enzim merupakan biokatalisator yang tersusun dari protein. Enzim memiliki aktivitas yang spesifik terhadap pH. Hal ini terkait dengan sifat dasar protein yang dapat mengalami denaturasi akibat adanya pengaruh nilai pH (basa ataupun asam). Hasil pengujian aktivitas enzim pada berbagai pH disajikan pada Gambar 4.
29
yang dilakukan oleh Liu et al. (2008) menunjukkan bahwa enzim katepsin B1 yang diperoleh dari ekstrak silver carp menghasilkan aktivitas maksimum pada pH 5,5.
Gambar 4 Pengaruh pH terhadap aktivitas enzim katepsin ikan patin.
Gambar 4 menunjukkan bahwa pH optimum untuk aktivitas enzim katepsin, terdapat pada pH 6 dengan aktivitas 0,271 U/mL. Nilai aktivitas enzim katepsin meningkat dari pH 3 sampai pH 6, kemudian menurun pada pH 7. Hasil penelitian yang dilakukan oleh Liu et al. (2008) menunjukkan bahwa enzim katepsin B1 yang diperoleh dari ekstrak silver carp menghasilkan aktivitas maksimum pada pH 5,5.
Hasil penelitian lainnya yang dilakukan oleh Cunningham et al. (2010) pada ikan salmon menunjukkan bahwa nilai pH optimum katepsin B sekitar pH 4. Berdasarkan hasil penelitian ini dapat dilihat bahwa enzim katepsin yang diekstrak dari ikan patin memiliki nilai pH optimum yang sama dengan katepsin B1 ataupun katepsin B2, yaitu berkisar antara 5,5-6,0.
Semua reaksi enzim dipengaruhi oleh pH medium tempat reaksi terjadi. Setiap enzim memiliki pH optimum yang khas, yaitu pH yang menyebabkan aktivitas maksimal. Profil aktivitas pH enzim menggambarkan pH pada saat pemberi dan penerima proton yang penting pada sisi katalitik enzim berada pada tingkat ionisasi yang diinginkan. Namun pada pH tertentu (ekstrim) dapat menyebabkan enzim terdenaturasi yang menyebabkan enzim kehilangan aktivitas biologisnya (Lehninger 1993).
4.2.2 Suhu optimum
Suhu merupakan salah satu faktor yang dapat mempengaruhi aktivitas enzim, termasuk didalamnya adalah enzim katepsin. Hal ini disebabkan karena enzim
30
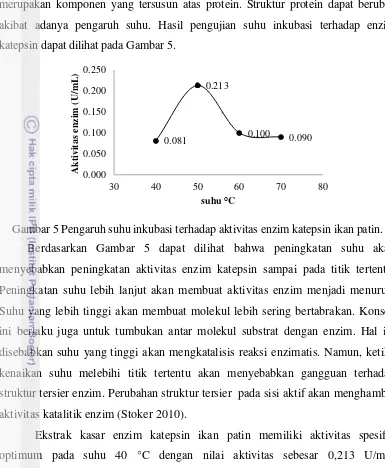
merupakan komponen yang tersusun atas protein. Struktur protein dapat berubah akibat adanya pengaruh suhu. Hasil pengujian suhu inkubasi terhadap enzim katepsin dapat dilihat pada Gambar 5.
Gambar 5 Pengaruh suhu inkubasi terhadap aktivitas enzim katepsin ikan patin. Berdasarkan Gambar 5 dapat dilihat bahwa peningkatan suhu akan menyebabkan peningkatan aktivitas enzim katepsin sampai pada titik tertentu. Peningkatan suhu lebih lanjut akan membuat aktivitas enzim menjadi menurun. Suhu yang lebih tinggi akan membuat molekul lebih sering bertabrakan. Konsep ini berlaku juga untuk tumbukan antar molekul substrat dengan enzim. Hal ini disebabkan suhu yang tinggi akan mengkatalisis reaksi enzimatis. Namun, ketika kenaikan suhu melebihi titik tertentu akan menyebabkan gangguan terhadap struktur tersier enzim. Perubahan struktur tersier pada sisi aktif akan menghambat aktivitas katalitik enzim (Stoker 2010).
Ekstrak kasar enzim katepsin ikan patin memiliki aktivitas spesifik optimum pada suhu 40 °C dengan nilai aktivitas sebesar 0,213 U/mL. Berdasarkan hasil penelitian Balti et al. (2010) terhadap enzim katepsin D yang berasal dari hepatopankreas sotong, diketahui bahwa enzim tersebut memiliki aktivitas optimum pada suhu 50 ºC. Krause et al. (2010) menyatakan bahwa enzim katepsin D yang berasal dari daging ikan ostrich memiliki aktivitas optimal pada suhu 45 ºC. Penelitian Jiang et al. (2002) terhadap katepsin D ikan tongkol dan ikan bandeng, memiliki aktivitas tertinggi pada suhu 45 °C dan 50 °C.
31
penelitian yang dilakukan oleh Cunningham et al. (2010) menunjukkan bahwa enzim katepsin B pada ikan salmon memiliki suhu optimum sebesar 45 oC.
4.2.3 Konsentrasi substrat optimum
Konsentrasi substrat merupakan salah satu faktor yang berpengaruh terhadap jumlah produk yang dihasilkan. Substrat dibutuhkan oleh enzim untuk berikatan dengan sisi aktif enzim sehingga akan terbentuk produk. Pada penelitian ini, substrat yang digunakan adalah hemoglobin. Hemoglobin merupakan kompleks protein-pigmen yang mengandung zat besi. Kompleks tersebut berwarna merah dan terdapat didalam eritrosit. Sebuah molekul hemoglobin memiliki empat gugus haeme yang mengandung besi fero dan empat rantai globin (Brooker 2001). Hemoglobin adalah protein yang kaya akan zat besi. Memiliki afinitas (daya gabung) terhadap oksigen dan dengan oksigen itu membentuk oxihemoglobin di dalam sel darah merah. Melalui fungsi ini maka oksigen dibawa dari paru-paru ke jaringan-jaringan. Pengaruh konsentrasi substrat terhadap aktivitas spesifik enzim katepsin dapat dilihat pada Gambar 6.
Gambar 6 Pengaruh konsentrasi substrat terhadap aktivitas enzim katepsin ikan patin.
32
molekul enzim sudah ditempati oleh substrat. Segera setelah produk meningkatkan sisi aktif, molekul substrat yang lain akan masuk. Pada konsentrasi substrat seperti ini, enzim itu dikatakan mengalami kejenuhan dan laju reaksi ditentukan oleh kecepatan sisi aktif mengubah substrat menjadi produk. Ketika suatu enzim telah jenuh, satu-satunya cara untuk meningkatkan produktivitas ialah dengan menambahkan lebih banyak lagi enzim (Campbell 2002).
4.2.4 Pengaruh ion logam terhadap aktivitas enzim
Aktivator dan inhibitor tidak dapat dibedakan secara kimiawi, namun dapat dibedakan setelah berinteraksi dengan enzim. Aktivator berikatan dengan enzim dan menyebabkan kenaikan kecepatan reaksi enzim, sedangkan inhibitor berikatan dengan enzim dan menyebabkan penurunan kecepatan reaksi (Suhartono 1989).
Ion logam ada yang membantu pengikatan antara enzim dengan substrat, ada yang berikatan dengan enzim secara langsung sehingga konformasi aktif enzim menjadi stabil, dan ada yang berikatan dengan inhibitor enzim sehingga mempengaruhi kerja inhibitor menghambat enzim. Ion logam yang digunakan dalam penelitian ini yaitu Na, Ca+2, Zn+2, Mn+2, Mg+2, Cu+2 dan Fe+3. Berdasarkan hasil pengujian, penambahan ion logam mempengaruhi aktivitas enzim katepsin yang bisa menurunkan nilai unit aktivitas atau menaikkan nilai aktivitas enzim. Hasil pengujian pengaruh ion logam terhadap aktivitas enzim katepsin dapat dilihat pada Gambar 7.
33
Berdasarkan Gambar 7 dapat dilihat bahwa ion logam Fe3+ memberikan nilai penghambatan yang paling besar, hal ini dapat dilihat dari nilai aktivitas enzim terkecil yaitu sebesar 0,004 U/mL, sedangkan nilai aktivitas relatif dari masing-masing ion logam terhadap kontrol dapat dilihat pada Tabel 6.
Balti et al. (2010) menyatakan bahwa katepsin D yang berasal dari hepatopankreas sotong memiliki aktivitas enzim katepsin D yang akan meningkat aktivitasnya dengan adanya ion logam Mg2+, Ni2+, Zn2+, Cu2+, Cd2+, Sr2+, dan Co2+. Keberadaan ion logam Na+, K+, dan Ca2+ tidak mempengaruhi aktivitas enzim katepsin D. Balti et al. (2010) juga melaporkan bahwa katepsin D dari hepatopankreas sotong mengalami penurunan aktivitas dengan penambahan ion logam Ba2+, Mn2+,Hg2+, dan Fe3+.
Tabel 6 Efek penambahan ion logam terhadap aktivitas enzim katepsin Konsentrasi logam (5 mM) Relatif activity (%)
Kontrol 100 tongkol dan ikan bandeng melaporkan bahwa keberadaan ion logam Na+ dan K+ akan meningkatkan aktivitas katepsin D, ion logam Mg2+, Sr2+, Fe2+ dan Hg2+ menghambat aktivitas katepsin D.
34
kestabilan aktivitasnya, ion-ion tersebut dapat bertindak sebagai inhibitor pada kosentrasi tertentu, tetapi dapat juga menjadi aktivator pada kosentrasi berbeda. Ion logam dapat membentuk suatu komplek dengan substrat dan sisi aktif enzim sehingga menggabungkan keduanya dan bentuknya menjadi aktif. Ion logam juga berfungsi sebagai senyawa penarik kuat elektron pada tahap tertentu dalam siklus katalitik (Lehninger 1993).
4.3 Presipitasi
Ekstrak kasar yang diperoleh selanjutnya dipresipitasi menggunakan ammonium sulfat. Metode presipitasi dibagi menjadi 2 grup utama, yakni (1) metode kelarutan protein dikurangi dan presipitasi dilakukan dengan mengubah beberapa sifat fisika-kimia solvent misalnya pH, konstanta dielektrik, kekuatan ionik, dan tersedianya air dan (2) Metode presipitasi protein yang disebabkan oleh interaksi diantara protein dan agen presipitasi (Sivasankar 2005).
Tiap presipitasi protein memiliki karakteristik pada konsentrasi reagen
yang berbeda, pada ammonium sulfat persen presipitasi berselang antara 20%-100%, ini dianggap cukup untuk presipitasi (Bisswanger 2004). Presipitasi
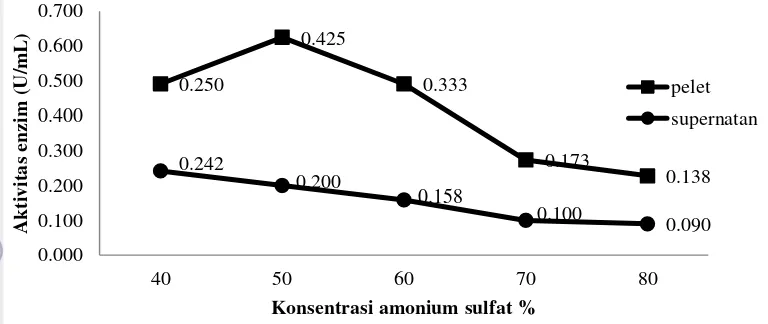
dapat dilakukan dengan penambahan garam misalnya ammonium sulfat, polimer misalnya polyethylene glycol (PEG), atau larutan organik misalnya aseton atau alkohol (Scopes 1994). Pada penelitian ini ammonium sulfat dipilih sebagai agen presipitasi, ammonium sulfat dipilih karena menurut Javois (1999) presipitasi dengan ammonium sulfat dianggap cepat dan murah. Pengaruh kejenuhan ammonium sulfat terhadap aktivitas enzim pada pelet dan supernatan setelah mengalami pengendapan disajikan pada Gambar 8.
35
Gambar 8 Pengaruh kejenuhan ammonium sulfat terhadap aktivitas enzim. Kondisi ektraksi yang optimum ditunjukkan oleh aktivitas yang paling tinggi dalam endapan (pelet). Enzim yang dihasilkan dari presipitasi 50% memiliki aktivitas sebesar 0,425 U/mL dan aktivitas spesifik sebesar 0,276 mg/mL.
Peningkatan aktivitas enzim pada endapan hingga penambahan ammonium sulfat 70% disebabkan berkurangnya pengotor, seperti non protein (karbohidrat), protein non enzim dan lain-lain (Suhartono 1989). Aktivitas kolagenase pada konsentrasi ammonium sulfat tingkat kejenuhan 80% menurun. Penurunan ini disebabkan karena ammonium sulfat tidak bersifat buffer dan dapat membebaskan ammonia, sehingga memungkinkan terjadinya kenaikan pH (Boyer 1993). Ammonium sulfat dipilih karena sifatnya yang mudah larut, murah dan umumnya tidak mempengaruhi struktur protein pada konsentrasi tertentu (Beynon dan Bond 2001). Akibatnya, aktivitas enzim menjadi menurun, karena aktivitasnya tersebut dipengaruhi oleh faktor lingkungan, seperti pH. Aktivitas enzim menurun ketika pH lingkungan enzim melebihi pH optimumnya.
Penelitian Toyohara et al. (1981) menyebutkan bahwa katepsin A yang berasal dari carp muscle pada hasil pengendapan sulfat didapatkan aktivitas spesifik sebesar 3,43 U/mg. Kelarutan protein (pada pH dan temperatur tertentu) akan meningkat sejalan dengan peningkatan konsentrasi garam (salting in).
36
Gambar 9 Kadar protein enzim katepsin ikan patin dari pelet hasil pengendapan ammonium sulfat.
Liu et al. (2006) melaporkan pelet hasil presipitasi 80% kejenuhan ammonium sulfat pada enzim katepsin L daging ikan silver carp (Hypophthalmichthys molitrix) memiliki aktivitas spesifik 0,32 U/mg. Levkovitz
et al. (1995) juga melaporkan pelet hasil presipitasi 70% kejenuhan ammonium sulfat katepsin D pada ikan Cyprinus carpio memiliki aktivitas spesifik 20,6 U/mg.
Peningkatan kelarutan protein akan meningkatkan kekuatan ion. Penambahan garam dengan konsentrasi tertentu kelarutan protein menurun (salting out). Molekul air yang berikatan dengan ion-ion garam semakin banyak yang menyebabkan penarikan selubung air yang mengelilingi permukaan protein sehingga mengakibatkan protein saling berinteraksi, beragregasi, kemudian mengendap (Harris 1989).
4.4 Dialisis
Pelet yang diperoleh dari pengendapan dengan garam ammonium sulfat
(NH4)2SO4, kemudian didialisis menggunakan membran selofan berukuran 12 kDa. Kegunaan utama dialisis ialah untuk pemekatan, pembuangan garam, dan
pemurnian bahan-bahan misalnya protein, hormon dan enzim. Zat tertahan berisi protein dengan ukuran molekul yang lebih besar dari ukuran pori Molecular Weight Cut Off (MWCO) (Sanagi 2001). Prinsip dialisis ialah aplikasi preparasi enzim ke dalam kantong dialisis yang terbuat dari membran semi-permeabel yang memungkinkan molekul berukuran kecil untuk bermigrasi (Grogan 2009).