MULTIPLIKASI TANAMAN LIDAH MERTUA
BLUE LEAF
(
Sansevieria
sp. ) MELALUI KALUS SECARA
IN VITRO
AI NURHASANAH HUSNUL IZZATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Multiplikasi Tanaman Lidah Mertua Blue Leaf (Sansevieria sp.) Melalui Kalus Secara in vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
AI NURHASANAH HUSNUL IZZATI. Multiplikasi Tanaman Lidah Mertua Blue Leaf (Sansevieria sp.) Melalui Kalus Secara in vitro. Dibimbing oleh DIAH RATNADEWI dan ARIS TJAHJOLEKSONO.
Sansevieria di Indonesia dikenal dengan nama lidah mertua merupakan tanaman hias daun. Lidah mertua blue leaf memiliki bentuk daun lebar dengan ujung runcing, sisi daun bergelombang dan daun berwarna hijau dengan sisi daun putih kemerahan. Stek daun masih belum mampu menginduksi pertunasan dan perakaran yang baik secara efisien waktu, tempat, dan bebas hama penyakit. Penelitian ini bertujuan untuk memperoleh kombinasi media dasar dan zat pengatur tumbuh (ZPT) yang tepat untuk merangsang pertunasan melalui organogenesis tak langsung (kalus) secara in vitro agar menghasilkan sejumlah tunas dengan perakaran yang baik. Penelitian ini terdiri atas 2 tahap. Tahap pertama adalah inisiasi pertunasan menggunakan media dasar (MS dan WP) dan kombinasi (5 mg/L dan 7 mg/L) BAP dan 0.5 mg/L NAA, sedangkan tahap kedua yaitu pengakaran menggunakan media ¼WP cair dengan 0.5 mg/L IBA dan campuran media kompos:zeolit:pasir malang perbandingan 4:4:1. Hasil penelitian menunjukkan bahwa perlakuan media dasar WP dengan kombinasi 5 mg/L BAP dan 0.5 mg/L NAA menghasilkan pertumbuhan tunas dan daun yang baik selama 23 minggu setelah tanam (MST). Setelah tunas yang disubkultur ke media perakaran, perlakuan media dasar ¼WP cair dengan auksin 0.5 mg/L IBA dan campuran media kompos:zeolit:pasir malang mampu menginduksi perakaran yang baik pada 8 planlet dalam 8 MST.
Kata kunci: kalus, muliplikasi in vitro, Sansevieria sp. blue leaf
ABSTRACT
AI NURHASANAH HUSNUL IZZATI. In Vitro Multiplication of Sansevieria sp. Blue Leaf Through Callus. Supervised by DIAH RATNADEWI and ARIS TJAHJOLEKSONO.
Sanseviera is a well-known ornamental plant leaves which is called lidah mertua blue leaf in Indonesia. Sansevieria sp. blue leaf has leaf width with tapered tip, wavy leaf side and green leaf with white reddish leaf side. The leaf cutting of Sansevieria sp. does not produce rooted shoots efficiently. This research was aimed to obtain an appropriate combination of basic media and plant growth regulators (PGR) to stimulate in vitro shooting and rooting through callus. Shooting was induced using two media (MS and WP) supplemented with (5mg/L and 7 mg/L) BAP in combination with 0.5 mg/L NAA. ¼WP liquid medium with 0.5 mg/L IBA and compost:zeolite:sand at a ratio of 4:4:1 were used as rooting medium. The results showed that WP with 5 mg/L BAP and 0.5 mg/L NAA is produced the best growth of the shoots and leaves for 23 week after planting (WAP). Medium ¼WP liquid with 0.5 mg/L IBA that incorporated in a mixture compost, zeolite, and sand were able to induce rooting on eight plantlets in 8 weeks after shoots were transfered into rooting.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
MULTIPLIKASI TANAMAN LIDAH MERTUA
BLUE LEAF
(
Sansevieria
sp.) MELALUI KALUS SECARA IN VITRO
AI NURHASANAH HUSNUL IZZATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Multiplikasi Tanaman Lidah Mertua Blue Leaf (Sansevieria sp.) Melalui Kalus Secara in vitro
Nama : Ai Nurhasanah Husnul Izzati NIM : G34090062
Disetujui oleh
Dr Ir Diah Ratnadewi, DEA Pembimbing I
Dr Ir Aris Tjahjoleksono, DEA Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Multiplikasi Tanaman Lidah Mertua Blue Leaf (Sansevieria sp.) Melalui Kalus Secara in vitro. Penelitian ini dilaksanakan mulai bulan Januari 2013 sampai Agustus 2013 di Laboratorium Kultur Jaringan, Departemen Biologi, FMIPA, IPB.
Terima kasih penulis ucapkan kepada Dr Ir Diah Ratnadewi, DEA dan Dr Ir Aris Tjahjoleksono, DEA atas bimbingan, saran, motivasi, dan fasilitas yang telah diberikan selama penelitian dan penyusunan karya ilmiah ini. Terima kasih pula kepada Dr Ir Dorly,MSi selaku penguji yang telah memberikan kritik dan saran dalam penulisan karya ilmiah ini.
Ungkapan terima kasih juga penulis sampaikan kepada orangtua dan seluruh keluarga tercinta yang senantiasa memberikan doa, dukungan dan semangatnya. Penulis juga mengucapkan terima kasih kepada Ibu Ucu, Ibu Dewi, Bapak Kusmayadi, Ibu Glenny atas dukungannya. Tak lupa penulis juga berterimakasih kepada teman-teman Biologi 46, khususnya teman seperjuangan di kultur jaringan (Eva dan Rizky) dan sahabat-sahabat terbaik Lilia, Irene, Childa dan GM atas semangat, perhatian, dan keceriaan yang selalu terukir selama kuliah di IPB.
Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
BAHAN DAN METODE 2
Alat 2
Bahan 3
Metode Penelitian 3
HASIL DAN PEMBAHASAN 5
Persentase Eksplan Bebas Kontaminasi 5
Pertumbuhan Kalus Lidah Mertua Blue Leaf (Sansevieria sp.) 6
Pertumbuhan Tunas 8
Fase Perakaran 12
SIMPULAN 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Kombinasi konsentrasi zat pengatur tumbuh (ZPT) pada media
pertunasan 4
2 Persentase bebas kontaminasi pada eksplan kalus lidah mertua blue leaf (Sansevieria sp.) dengan penggunaan berbagai bahan sterilisasi 5 3 Pengaruh subkultur terhadap pertumbuhan kalus lidah mertua blue
leaf (Sansevieria sp.) setelah 6 minggu (MST) 7 4 Perkembangan tunas terhadap eksplan kalus lidah mertua blue leaf
(Sansevieria sp.) 8
5 Pengaruh zat pengatur tumbuh terhadap pertumbuhan tunas pada eksplan kalus lidah mertua blue leaf (Sansevieria sp.) 10 6 Pengaruh zat pengatur tumbuh terhadap pertumbuhan daun pada
eksplan kalus lidah mertua blue leaf (Sansevieria sp.) 12 7 Pertumbuhan akar pada planlet lidah mertua blue leaf (Sansevieria
sp.) pada media perakaran 13
8 Jumlah dan ukuran daun pada planlet lidah mertua blue leaf
(Sansevieria sp.) yang berakar 13
DAFTAR GAMBAR
1 Pertumbuhan kalus lidah mertua blue leaf (Sansevieria sp.) sedikit (a),
sedang (b), dan banyak (c). 7
2 Kalus yang telah membentuk tunas mengalami browning
(pencoklatan) dan mati 9
3 Pertumbuhan tunas di media WP pada umur 3 MST (a) dan media MS
pada umur 4 MST (b) 10
4 Pertumbuhan tunas tunggal pada umur 7 MST (a) dan tunas banyak
pada umur 8 MST (b) pada media WP 11
5 Pertumbuhan akar adventif (a) dan akar lateral (b) pada planlet dari eksplan lidah mertua blue leaf (Sansevieria sp.) 13
DAFTAR LAMPIRAN
1 Komposisi media dasar MS (Murashige & Skoog 1962) dan
modifikasinya (¼MS) 17
2 Komposisi media dasar Woody Plant (WP) (Llyod & Mc. Cown 1981)
PENDAHULUAN
Latar Belakang
Sansevieria (lidah mertua) termasuk ke dalam famili Dracaenaceae, merupakan marga dari kurang lebih 60 jenis herba rimpang yang berdaun tegak, keras, tersusun dalam bentuk roset serta tidak memiliki tangkai daun (Yuzzami et al. 2010). Menurut Sastrapradja (1977), tanaman Sansevieria menyukai habitat yang terlindung (ternaungi), memiliki toleransi dan adaptasi yang tinggi, sehingga dapat tumbuh mulai dataran rendah sampai ketinggian 1000 meter dpl. Takawira (2001) menjelaskan bahwa anggota dari genus Sansevieria memiliki nilai ekonomis sebagai tanaman hias karena keindahan dari ragam jenis, bentuk, ukuran dan warna daun; sumber serat; dan sebagai obat untuk menyembuhkan beberapa penyakit tertentu. DJH (2008) melaporkan bahwa Sansevieria merupakan tanaman hias yang sedang populer di pasaran. Selain memiliki, ragam morfologi yang cukup eksotik, ternyata Sansevieria juga mampu menyerap polusi seperti karbonmonoksida dan karbondioksida atau bahan beracun seperti benzena, formaldehida, dan trikhloroetilena. Beberapa jenis Sansevieria memiliki aktivitas antioksidan. Salah satu penelitian yang dilakukan oleh Pratama (2010) menunjukkan bahwa S. cylindrica memiliki senyawa flavonoid dan tanin yang mendukung adanya aktivitas antioksidan.
Jenis Sansevieria yang termasuk langka dan menjadi salah satu koleksi favorit adalah Sansevieria pinguicula, karena bentuk mirip dengan Agave, daun tebal dengan ujung runcing, tegak, roset, warna daun hijau keputih-putihan dan sisi daun putih kemerahan, serta masih sulit diperbanyak secara konvensional (TRUBUS 2008). Sansevieria sp. yang dikenal dengan nama dagang lidah mertua blue leaf memiliki bentuk daun lebar dengan ujung runcing, sisi daun bergelombang dan daun berwarna hijau dengan sisi daun putih kemerahan. Struktur morfologi lainnya seperti daun tebal, tumbuh tegak dan bertipe roset sangat mirip dengan S. pinguicula. Dilihat dari ukuran, bentuk dan warna daun, jenis lidah mertua blue leaf juga masih langka dan sulit diperbanyak secara konvensional sehingga bisa memiliki nilai jual yang tinggi di pasaran tanaman hias.
Yusnita et al. (2011) menjelaskan bahwa perbanyakan Sansevieria melalui metode konvensional sering tidak memadai untuk memenuhi tuntutan komersial karena pertumbuhan tanaman tersebut sangat lambat. Bibit Sansevieria pada umumnya diperbanyak secara vegetatif melalui stek daun (Purwanto 2006; Yusnita et al. 2011). Namun, perbanyakan dengan stek daun membutuhkan jumlah tanaman yang banyak dan jangka waktu yang panjang untuk menghasilkan sejumlah besar tanaman. Yusnita et al. (2011) mengemukakan bahwa 2 potongan daun S. trifasciata var. Hahnii menghasilkan 6 tunas dan 5 potongan daun S. trifasciata var. Lorentii menghasilkan 15 tunas selama 2 bulan, serta setelah 4-5 bulan jumlah tunas tetap tidak ada pertambahan lagi.
2
banyak dalam waktu yang relatif lebih singkat, serta bebas dari hama dan penyakit. Salah satu pola dalam regenerasi in vitro Sansevieria adalah melalui organogenesis (Yusnita et al. 2011). Keuntungan lain dari perbanyakan in vitro adalah menghasilkan keragaman somaklonal yang bisa didapatkan melalui organogenesis secara tidak langsung atau melalui kultur kalus. Hal ini yang seringkali diharapkan menjadi nilai tambah eksotik tanaman hias.
Lestari (2011) menjelaskan bahwa perbanyakan in vitro sangat menentukan keberhasilan produksi. Semakin banyak tunas yang terbentuk akan semakin banyak bibit yang dapat dihasilkan melalui kultur jaringan. Oleh karena itu, diperlukan sitokinin atau kombinasi yang terbaik antara auksin dan sitokinin untuk memacu multiplikasi tunas yang tinggi. Beberapa penelitian telah menunjukkan bahwa multiplikasi in vitro tanaman hias Sansevieria dapat dilakukan melalui organogenesis tak langsung menggunakan zat pengatur tumbuh sitokinin atau kombinasi auksin dan sitokinin. Penggunaan potongan daun tanaman S. cylindrica melalui kultur kalus menggunakan kombinasi 5 mg/L BAP dan 2 mg/L NAA menghasilkan jumlah tunas terbanyak yaitu 17.6 ± 0.14 tunas per kultur (Shahzad et al. 2009). Multiplikasi dengan menggunakan 2 mg/L BAP menghasilkan jumlah tunas terbanyak pada S. trifasciata varietas Hahnii yaitu 7 tunas per kultur dan pada S. trifasciata varietas Lorentii dengan menggunakan 2 mg/L BAP juga menghasilkan sebanyak 8.6 tunas per kultur setelah 14 minggu ( Yusnita et al. 2011).
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan kombinasi media dasar dan zat pengatur tumbuh (ZPT) yang tepat untuk merangsang pertunasan melalui kultur kalus Sansevieria sp. secara in vitro agar menghasilkan sejumlah tunas dengan sistem perakaran yang baik.
BAHAN DAN METODE
Penelitian ini dilaksanakan pada bulan Januari 2013 sampai dengan September 2013 di Laboratorium Kultur Jaringan, Departemen Biologi, FMIPA, IPB.
Alat
3 Bahan
Bahan tanaman yang digunakan diperoleh dari Laboratorium Bioproduk dan Kultur Jaringan Tanaman, Baranangsiang, Bogor yaitu berupa kalus lidah mertua blue leaf (Sansevieria sp.) yang dipelihara dalam media MS+10 mg/L BAP+0.5 mg/L NAA dan berumur 6-7 bulan. Zat pengatur tumbuh (ZPT) auksin berupa NAA (Asam Naftalenaasetat), IBA (Indole Butyricacid) dan sitokinin berupa BAP (Benzil Amino Purin) ditambahkan dalam media MS (Murashige & Skoog) atau WP (Woody Plant). Bahan pendukung untuk sterilisasi alat dan bahan adalah alkohol 70%, antibiotik kloramfenikol 500 mg/L, akuades steril, Bayclin (senyawa aktif NaOCl2 5.25%), dan Betadine (senyawa aktif Povidone Iodine 10%).
Metode Penelitian
Sterilisasi alat, bahan dan eksplan
Sterilisasi alat diseksi, botol kultur, cawan petri, media kultur dan aquades dilakukan dengan menggunakan autoklaf pada tekanan 15 psi, suhu 121 oC. Sterilisasi alat dilakukan selama 15 menit dan sterilisasi bahan dilakukan selama 20 menit.
Pada saat pemindahan ke media kultur, jika mengalami kontaminasi dilakukan sterilisasi ringan terhadap eksplan secara bertahap yaitu eksplan direndam di dalam Bayclin 5% selama 10 menit, lalu Bayclin 2.5% selama 5 menit, kemudian larutan Betadine 2% selama 1 menit. Setiap langkah sterilisasi tersebut diikuti dengan pembilasan menggunakan aquades steril sebanyak 3 kali.
Sterilisasi juga dilakukan pada saat pemindahan ke media perakaran jika tunas mengalami kontaminasi yaitu dengan perendaman dalam Bayclin 5% selama 5 menit, kemudian Bayclin 2.5% selama 2 menit, dan dalam larutan Betadine 2% selama 1 menit. Setiap langkah sterilisasi diikuti dengan pembilasan menggunakan aquades steril sebanyak 3 kali. Selanjutnya tunas siap ditanam pada media perakaran.
Pembuatan Media Pertunasan
4
Pembuatan Media Perakaran
Media yang digunakan untuk perakaran adalah media cair ¼MS dan ¼WP ditambah masing-masing ZPT IBA, dan tanpa pemberian agar. Kemudian, campuran larutan ini dituangkan ke dalam Erlenmeyer ukuran 250 mL dan ditutup plastik tahan panas. Sebagai pengganti agar, disiapkan media padat berupa pasir malang, kompos, dan zeolit dengan perbandingan 4:4:1. Setiap botol kultur diisi campuran tersebut sebanyak 50 g, kemudian ditutup plastik tahan panas.
Sterilisasi media cair dan campuran media padat dilakukan dengan menggunakan autoklaf pada tekanan 15 psi, suhu 121 oC selama 20 menit. Media cair ¼MS dan ¼WP yang telah steril selanjutnya dituangkan ke dalam media tanam campuran pasir malang, kompos, dan zeolit yang telah steril sebanyak 1/3 tinggi botol media atau setara dengan 25 mL.
Perlakuan ZPT
Perlakuan ZPT diberikan pada dua tahap kegiatan, yaitu multiplikasi tunas dan perakaran. Sebelum dikulturkan di dalam media perlakuan ZPT, potongan kalus berukuran 1x1 cm, berwarna hijau dan teksturnya kompak dikulturkan di dalam media MS dan WPtanpa ZPT selama 2 minggu.
Perlakuan untuk mendorong pertunasan terdiri atas 2 faktor. Faktor pertama menggunakan media dasar (MS dan WP) dan faktor kedua adalah konsentrasi ZPT BAP (5 dan 7 mg/L). Pada masing-masing media ditambahkan 0.5 mg/L NAA (Tabel 1). Masing-masing perlakuan dibuat 10 ulangan botol kultur. Media untuk perakaran menggunakan ZPT 0.5 mg/L IBA.
Tabel 1 Kombinasi konsentrasi zat pengatur tumbuh (ZPT) pada media pertunasan
Media
ZPT (dalam mg/L) MS WP
BAP 5 + NAA 0.5 MH1 WH1
BAP 7 + NAA 0.5 MH2 WH2
Penanaman Eksplan dan Subkultur Tunas ke Perakaran
Penanaman dilakukan secara aseptik di dalam LAFC. Eksplan berupa potongan kalus berukuran 1x1 cm ditanam di dalam media pertunasan sebanyak 1 eksplan tiap botol media.
Tunas yang dipilih dari media pertunasan untuk yang disubkulturkan ke media perakaran adalah tunas yang berdaun sehat, berwarna hijau dan panjang daunnya ± 1.5 cm. Tunas disubklturkan ke dalam media perakaran dengan memisahkannya dari eksplan induk.
Kultur disimpan di ruangan dengan suhu ± 25 °C, intensitas cahaya sebesar 1000 lux selama 16 jam/hari.
Pengamatan dan Analisis Data
5 Pengamatan selanjutnya dilakukan seminggu sekali. Parameter yang diamati setiap minggu antara lain, persentase eksplan yang hidup, waktu muncul tunas, jumlah tunas, tinggi tunas, jumlah daun, panjang daun, jumlah tunas yang disubkultur ke media perakaran. Pada pengamatan terakhir (minggu ke-8 setelah subkultur ke media perakaran) dilakukan pengamatan terhadap persentase eksplan yang berakar, jumlah akar, panjang akar, panjang dan lebar daun di media perakaran. Analisis data dilakukan secara deskriptif, karena tingkat kematian eksplan sangat tinggi sehingga data tidak dapat dianalisis secara statistika.
HASIL DAN PEMBAHASAN
Persentase Eksplan Bebas Kontaminasi
Kondisi kalus yang ditanam pada media dasar tanpa perlakuan selama 2 minggu tidak menunjukkan adanya kontaminasi. Kontaminasi umumnya dimulai 2 minggu setelah tanam (MST) pada media WP dengan tingkat kontaminasi mencapai kisaran 70 sampai 90% pada perlakuan WH1 dan WH2 (Tabel 2). Seluruh kontaminasi yang terjadi pada media WP kemungkinan besar disebabkan oleh bakteri. Penyebab kontaminasi bakteri tersebut tidak berasal dari eksplan karena eksplan yang digunakan berasal dari kalus in vitro. Kontaminasi tersebut muncul pada bagian tepi media. Hal ini mengindikasikan bahwa kontaminasi terjadi saat penanaman ke media perlakuan dan kemungkinan kontaminan terbawa oleh sirkulasi udara di laminar (alat atau cawan petri) atau berasal dari media sebagai akibat sterilisasi yang tidak sempurna. Zulkarnain (2009) menyatakan bahwa salah satu penyebab kontaminasi adalah lingkungan kerja yang kurang steril atau pelaksanaan penanaman yang kurang hati-hati dan kurang teliti.
Tabel 2 Persentase bebas kontaminasi pada eksplan kalus lidah mertua blue leaf (Sansevieria sp.) dengan penggunaan berbagai bahan sterilisasi
Perlakuan Umur Keterangan : Sterilisasi ulang dilakukan pada eksplan WH1 dan WH2
6
perendaman kalus dalam larutan antibiotik kloramfenikol 500 mg/Lselama 15 menit. Sterilisasi lanjutan ini dilakukan setelah pembilasan terakhir dari tahapan sterilisasi ringan. Keberhasilan penggunaan kloramfenikol terlihat pada WH2; persentase bebas kontaminasinya naik sebesar 45% dari 16-23 MST. Pada perlakuan WH1 peningkatan bebas kontaminasi hanya 12.5%.
Sterilisasi ringan dengan mengulang penggunaan Bayclin, belum mampu memberikan hasil yang baik. Walaupun teknik sterilisasi telah dilakukan dengan hati-hati, kontaminasi masih tinggi. Oleh karena itu, dicoba untuk menggunakan antibiotik yang diharapkan mampu menurunkan tingkat kontaminasi bakteri hingga 100%. Penggunaan antibiotik merupakan langkah yang tepat karena prinsipnya mengarah ke penghambatan bahkan mematikan pertumbuhan mikroba bakteri. Kloramfenikol adalah salah satu jenis antibiotik berspektrum luas yang bekerja dengan cara menghambat sintesis protein bakteri (Surini 2007).
Penggunaan kloramfenikol sebelumnya telah dilakukan pada penelitian jarak pagar. Perendaman dalam larutan kloramfenikol dosis 500 mg/L dalam waktu 15 menit mampu meningkatkan persentase bebas kontaminasi sekaligus memperpanjang waktu eksplan jarak pagar dalam keadaan aseptis (Theodora 2010). Penggunaan antibiotik kloramfenikol menghasilkan persentase kontaminasi bakteri terkecil, namun menyebabkan kondisi toksik pada jaringan tanaman heliconia (Cantika 2007). Oleh karena itu, penggunaan kloramfenikol dalam penelitian ini dilakukan seperti pada penelitian Theodora (2010) yaitu dengan tidak mencampurkannya pada media tetapi diberikan sebagai tahapan sterilisasi permukaan.
Sifat toksisitas kloramfenikol tidak tampak pada perkembangan kultur (tidak menyebabkan browning) sehingga beberapa kultur berhasil tumbuh dalam keadaan aseptis sampai ke fase perakaran.
Kontaminasi pada perlakuan WH1 dan WH2 setelah 16 MST, kemungkinan disebabkan oleh adanya bakteri endofit. Bakteri endofit merupakan bakteri yang hidup bersimbiosis di dalam jaringan tanaman (Melliawati et al. 2006). Penggunaan kloramfenikol dalam penelitiaan ini belum mampu menghilangkan 100% kontaminasi. Antibiotik tersebut digunakan untuk merendam eksplan, sehingga pengaruhnya hanya untuk sterilisasi di permukaan jaringan eksplan.
Pertumbuhan Kalus Lidah Mertua Blue Leaf (Sansevieria sp.)
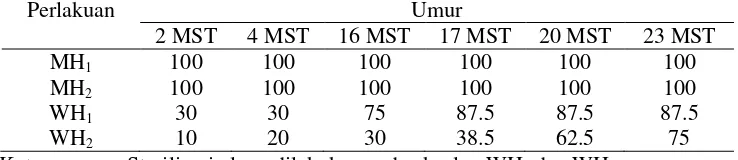
Data kualitatif dari hasil penelitian ini (Gambar 1) memperlihatkan pertumbuhan kalus yang memiliki tekstur kompak dengan warna hijau muda kekuningan hingga hijau kehitaman. Pertumbuhan kalus baru dimulai dari bagian atas eksplan yang dipotong dan terus membesar hingga 6 MST. Tabel 3 menunjukkan bahwa dari keempat perlakuan, yang memberikan respon tumbuh paling baik pada 6 MST adalah MH1; hanya perlakuan WH2 yang tidak memberikan respon pertumbuhan kalus. Laju pertumbuhan kalus yang tinggi terdapat pada media MS yang diberi 5 mg/LBAP dan 0.5 mg/L NAA (MH1), kemudian diikuti oleh pemberian 7 mg/LBAP dan 0.5 mg/L
7 tinggi dan NAA yang rendah berpengaruh lebih baik terhadap pertumbuhan kalus baru pada lidah mertua blue leaf (Sansevieria sp.) daripada media WP.
Gambar 1 Pertumbuhan kalus lidah mertua blue leaf (Sansevieria sp.) sedikit (a), sedang (b), dan banyak (c).
Tabel 3 Pengaruh subkultur terhadap pertumbuhan kalus lidah mertua blue leaf (Sansevieria sp.) setelah 6 minggu (MST)
Perlakuan Pertumbuhan
kalus Tekstur kalus Warna kalus
MH1
Akumulasi pati dalam plastida sel-sel eksplan tanaman yang dikultur secara in vitro merupakan prasyarat bagi terjadinya morfogenesis, baik pada pembentukan maupun regenerasi kalus (Saji dan Sujatha 1998). Pati dibentuk dari sukrosa dan gula lain yang ditambahkan dalam medium kultur in vitro (Thorpe et al. 1986). Pada penelitian ini, kontaminasi oleh bakteri pada semua perlakuan media WP dan sterilisasi berulang menyebabkan berkurangnya daya serap eksplan terhadap sukrosa dan zat pengatur tumbuh. Hal ini mungkin menjadi faktor penyebab hampir tidak terjadinya pertumbuhan kalus pada perlakuan WH1 dan WH2.
Penelitian Pratiwi (2009) telah menghasilkan pertumbuhan kalus
Anthurium plowmani yang semakin meningkat dengan menggunakan
sitokinin (kinetin) dalam konsentrasi yang semakin tinggi. Di lain pihak, Gamborg (1991) mengemukakan bahwa untuk mendapatkan kalus yang baik, perlu penambahan sitokinin (BA atau kinetin) yang diberikan secara bersamaan dengan auksin (2.4D atau NAA). Umumnya, semua eksplan pada Sansevieria trifasciata var. Hahnii dan Lorentii dengan menggunakan 0.25 mg/L 2.4D membentuk kalus yang baik berwarna kehijauan (Yusnita et al. 2011).
8
Hal tersebut dapat menjelaskan bahwa penambahan sitokinin dapat mendorong pembentukan klorofil pada kalus.
Pertumbuhan Tunas
Sitokinin BAP dipilih untuk tujuan multiplikasi tunas karena memiliki efektivitas yang tinggi terhadap multiplikasi tunas, mudah didapatkan dan relatif murah dibandingkan kinetin (Yusnita 2003). Sitokinin umumnya digunakan dalam proses regenerasi kultur in vitro karena zat pengatur tumbuh ini berfungsi dalam pembelahan sel dan diferensiasi tunas adventif dari kalus (Bhojwani dan Razdan 1996).
Berdasarkan hasil penelitian ini, kombinasi auksin dan sitokinin yang diberikan menunjukkan bahwa semua perlakuan mampu menumbuhkan tunas, walaupun waktu muncul tunas tidak seragam (Tabel 4). Perlakuan MH1, MH2, dan WH1 mulai menghasilkan tunas pada 2 MST. Perlakuan WH2 memberikan tunas paling lambat, yaitu pada 8 MST, namun rentang waktu tumbuh tunas paling panjang hingga 19 MST. Perlakuan MH1 dan WH1 memberikan respon rentang waktu tumbuh tunas lebih pendek, yaitu 2-8 MST dan 2-7 MST.
Tabel 4 Perkembangan tunas pada eksplan kalus lidah mertua blue leaf (Sansevieria sp.)
Perlakuan Waktu muncul tunas (MST)
Kisaran
MH1 2-8
MH2 2-11
WH1 2-7
WH2 8-19
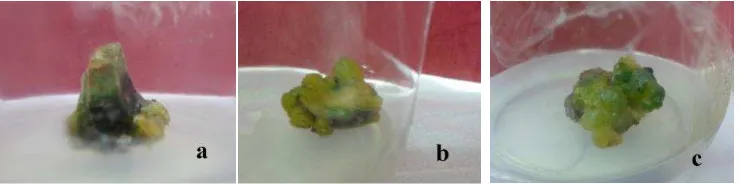
Persentase kultur yang hidup pada semua perlakuan mengalami penurunan dimulai sejak 7 MST (Tabel 5). Hal ini karena tingginya tingkat kematian kultur yang diawali dengan proses penguningan hingga pencoklatan pada kultur. Proses penguningan kultur dimulai dengan memudarnya warna hijau pada permukaan kalus secara berangsur-angsur. Warna kuning terlihat dari bagian tepi hingga akhirnya menyebar ke seluruh permukaan kalus dan tunas kemudian berubah menjadi coklat, akhirnya kering dan mati. Diikuti juga oleh kondisi media yang mengalami perubahan warna dari bening menjadi kecoklatan. Gambar 2 memperlihatkan kultur kalus yang telah membentuk tunas kemudian berubah warna menjadi coklat dan akhirnya mati.
9
Gambar 2 Kalus yang telah membentuk tunas mengalami browning (pencoklatan) dan mati
Adanya kandungan senyawa fenol pada lidah mertua blue leaf yang berlebih merupakan faktor utama terjadinya browning pada kultur. Bagian kalus yang terpotong merupakan bagian yang terluka. Hutami (2008) menyatakan bahwa pelukaan pada eksplan akan menyebabkan terjadi proses oksidasi oleh enzim oksidase yang mengubah senyawa fenol menjadi senyawa aktif quinon yang tinggi, kemudian terakumulasi di media dan menjadi toksik pada kultur. Akumulasi senyawa fenol pada kultur menyebabkan kultur mengalami pencoklatan. Hal ini merupakan respon jaringan yaitu mengeluarkan senyawa metabolit sekunder berupa senyawa fenol karena jaringan mengalami cekaman pada proses pelukaan kalus. Berdasarkan hasil penelitian ini, tingkat kematian sangat tinggi pada media MS daripada WP. Potongan eksplan sebelumnya untuk perlakuan di media MS diperoleh dari kalus yang ukurannya lebih besar, sehingga jumlah potongan kalus lebih banyak daripada WP. Dalam hal ini, diduga bahwa bagian kalus yang terluka mengalami cekaman yang lebih tinggi pada media MS daripada media WP.
Pengamatan pertumbuhan tunas dari minggu ke-7 sampai dengan minggu ke-14 menunjukkan bahwa perlakuan MH1 menghasilkan tunas banyak tertinggi dengan kisaran 0-3 tunas di minggu ke-7, diikuti oleh MH2, WH1 dan WH2 dengan 0-2 tunas. Namun, perlakuan MH1 dan MH2 belum dapat dinyatakan pengaruhnya terhadap seluruh parameter yang diamati secara kuantitatif. Hal ini dikarenakan kematian eksplan di setiap ulangan yang tinggi.
Pengamatan jumlah tunas dihitung dari tumbuhnya tunas pada kalus pada setiap ulangan, sedangkan tinggi tunas diukur dari pangkal tunas hingga ujung tunas (pucuk daun) tertinggi. Pengamatan (Tabel 5) menunjukkan bahwa jumlah tunas tidak banyak berbeda antar perlakuan WH1 dan WH2 dan tinggi tunas pada perlakuan WH1 lebih tinggi daripada WH2. Penurunan dan peningkatan kembali rerata jumlah tunas disebabkan oleh kematian beberapa tunas dan munculnya kembali tunas-tunas baru. Pada perlakuan WH2 tunas mulai memanjang pada 14 MST namun jumlah tunas tidak bertambah lagi hingga 23 MST.
10
jenuh pembelahan sel atau kemungkinan lainnya karena kultur di WH2 lebih sering disterilisasi ulang sehingga memperlambat waktu pertunasan dan pertumbuhan tunas. Pratiwi (2009) menemukan adanya titik jenuh eksplan dalam merespon sitokinin (kinetin) konsentrasi tinggi pada multiplikasi tunas Anthurium plowmanii yaitu 0.46 µM. Pada kondisi titik jenuh pembelahan sel tersebut, konsentrasi optimum sitokinin telah terlewati sehingga pembelahan sel berlangsung lambat yang kemudian menyebabkan menurunnya laju multiplikasi tunas.
Tabel 5 Pengaruh zat pengatur tumbuh terhadap pertumbuhan tunas pada kalus lidah mertua blue leaf (Sansevieria sp.)
Perlakuan Minggu
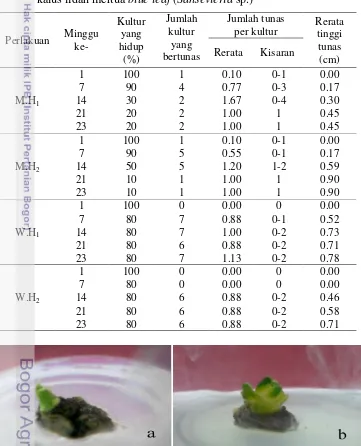
Gambar 3 Pertumbuhan tunas di media WP pada umur 3 MST (a) dan media MS pada umur 4 MST (b)
11 agak transparan, sedangkan media WP (Gambar 3b) menghasilkan warna tunas hijau muda dan tebal. Dari kedua media perlakuan WP dan MS, penampilan tunas yang lebih baik pada media WP. Perbedaan media WP dan MS terletak pada kadar garam anorganik di komposisi medianya. Kelebihan media WP dari MS terletak pada sulfat sebesar 3.79 mM, sedangkan media MS memiliki sulfat sebesar 0.67 mM. Kelebihan media MS memiliki kandungan nitrogen sebesar 32.12 mM dan kalium sebesar 7.6 mM, lebih tinggi dari media WP .
Kumar dan Kumar (2008) melaporkan bahwa sulfur berpengaruh dalam peningkatan sintesis klorofil dalam daun pisang Cavendish. Diduga sulfur bertanggung jawab untuk membentuk enzim feredoksin. Berdasarkan hasil pengamatan, hal ini diduga peranan sulfur yang berlebih pada media WP yang menjadikan tunas terlihat lebih hijau. Penurunan kandungan nitrogen dan kalium pada media WP menyebabkan tunas terlihat lebih tebal kompak, dan sehat. Hal itu didukung oleh hasil penelitian Winarto (2004) yang mengindikasikan bahwa penurunan total nitrogen (NH4NO3) lebih cepat memacu terbentuknya sel-sel yang lebih kompak dan tunas tumbuh lebih sehat pada tanaman anyelir. Di lain pihak media MS memiliki kelebihan nitrogen dan kalium yang lebih berperan dalam pembesaran sel dan jumlah daun lebih banyak tetapi menghasilkan tunas berwarna kekuningan, kurang kompak dan agak transparan. Berdasarkan penelitian Yunita (2004) disimpulkan bahwa nitrogen dan kalium lebih tinggi pada media MS lebih berperan membentuk jumlah tunas lebih banyak dibandingkan media WP.
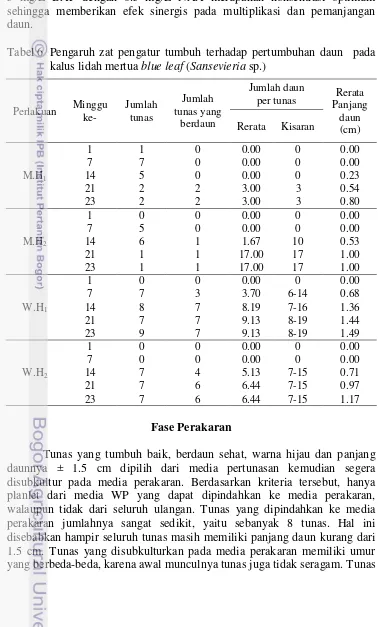
Gambar 4 Pertumbuhan tunas tunggal pada umur 7 MST (a) dan tunas banyak pada umur 8 MST (b) pada media WP
Gambar 4 a dan b memperlihatkan kalus yang bertunas tunggal dan bertunas banyak (jumlah tunas lebih dari 1 per eksplan kalus) serta masing-masing tunas telah membentuk daun dengan tipe roset.
12
jumlah daun terbanyak yaitu 9 daun dengan kisaran 8 hingga 19 daun dan daun terpanjang yaitu 1.49 cm selama 23 MST.
Perlakuan WH1 memberikan pengaruh lebih baik terhadap pertumbuhan ditunjukkan dengan jumlah daun dan panjang daun yang lebih tinggi dibandingkan WH2. Hal ini menandakan bahwa pemberian kombinasi 5 mg/L BAP dengan 0.5 mg/L NAA merupakan konsentrasi optimum sehingga memberikan efek sinergis pada multiplikasi dan pemanjangan daun.
Tabel 6 Pengaruh zat pengatur tumbuh terhadap pertumbuhan daun pada kalus lidah mertua blue leaf (Sansevieria sp.)
Perlakuan Minggu
per tunas Panjang Rerata
13 yang terkontaminasi di media pertunasan tapi sudah memenuhi persyaratan, selanjutnya disubkulturkan pada media perakaran setelah disterilisasi ulang. Semua tunas yang disubkulturkan dan dipelihara selama 8 minggu pada media perakaran menunjukkan pertumbuhan akar (Tabel 7). Gambar 5 memperlihatkan planlet yang berakar. Planlet yang berasal dari media WH1 dan WH2 menghasilkan rerata jumlah akar adventif masing-masing 1.60 dan 1.33 akar. Selanjutnya akar adventif tersebut bercabang dan disebut sebagai akar lateral. Jumlah akar lateral 2.00 dan 1.67 akar, panjang akar adventif 1.29 dan 2.22 cm, serta panjang akar lateral 0.73 dan 0.58 cm.
Dalam masa pengakaran, terlihat pertumbuhan tajuk masih berlangsung sehingga masih dilakukan pengamatan terhadap parameter pertumbuhan daun. Tabel 8 menunjukkan bahwa setelah disubkulturkan selama 8 minggu pada media perakaran, planlet yang tunasnya berasal dari media WH1 dan WH2 memiliki rerata tinggi tunas masing-masing 1.56 dan 1.93 cm, jumlah daun 13.20 dan 12.00, panjang daun 2.78 dan 2.63 cm, serta lebar daun 1.10 dan 1.03 cm.
Tabel 7 Pertumbuhan akar pada planlet lidah mertua blue leaf (Sansevieria sp.) pada media perakaran Keterangan : Pengamatan pada 8 minggu setelah subkultur ke media perakaran
Tabel 8 Jumlah dan ukuran daun pada planlet lidah mertua blue leaf Keterangan : Pengamatan pada 8 minggu setelah subkultur ke media perakaran
14
Media yang digunakan untuk perakaran adalah media beraerasi yang memiliki porositas (bersifat porous) yang dikenal dengan in vitro soil-less (IVS). Media ini sudah digunakan oleh Newel et al. (2003) untuk menginduksi akar dan pemanjangan akar tanaman Grevillea thelemanniana dan tanaman hasil persilangan Verticordia plumosa dengan Chamelaucium uncinatum menggunakan campuran media sphagnum peat, pasir sungai kasar (1-3 mm) dan perlite (Horticulture grade P500) dengan perbandingan 0.5:2:2 dan tambahan 2 g/L kapur pertanian (horticultural lime) serta seluruh campuran media tersebut dimasukkan ke dalam peat pots (Jiffy A/S, Jiffy Strip ®, #300 515 91, 4 x 5 cm). Pada penelitian ini, penggunaan media aerasi (¼WP cair dan 0.5 mg/L IBA dicampurkan ke dalam kompos; zeolit; pasir malang yang telah steril) diharapkan mampu mempermudah induksi perakaran dibandingkan dengan media agar. Media perakaran yang baik adalah media yang memiliki kelembaban cukup dengan aerasi yang baik sehingga cukup menyediakan O2 dan bebas dari mikroorganisme pengganggu, misalnya cendawan dan bakteri (Mangoendidjojo 2003). Pierik (1987) menambahkan bahwa media cair sebagai transportasi nutrien yang lebih baik.
Hasil penelitian Shahzad et al. (2009) menunjukkan bahwa eksplan Sansevieria cylindrica yang dipindahkan ke media perakaran dengan ½MS dan 5 mg/L IBA telah berhasil menginduksi perakaran dalam 8 minggu, dengan jumlah akar terbanyak 3.5 ± 0.18 akar dan akar terpanjang 6.5 ± 0.14 cm. Sebaliknya, hasil dalam penelitian ini menunjukkan bahwa penggunaan konsentrasi auksin rendah yaitu IBA 0.5 mg/L dalam media beraerasi mampu menginduksi perakaran pada kedelapan planlet yang berasal dari media WH1 dan WH2 dalam 8 minggu.
SIMPULAN
Pertumbuhan tunas dan daun yang baik diperoleh pada perlakuan media dasar WP dengan kombinasi 5 mg/L BAP dan 0.5 mg/L NAA. Pengaruh media dasar ¼WP cair dengan auksin 0.5 mg/L IBA dan campuran media kompos; zeolit; pasir malang perbandingan 4:4:1 mampu menginduksi perakaran yang baik pada tunas.
DAFTAR PUSTAKA
[DJH] Direktorat Jenderal Hortikultura. 2008. Sansevieria, booming di pasaran, tanaman hias yang penting di dunia [internet]. [Diunduh 19 November 2012]. Tersedia pada: http://hortikultura.deptan.go.id/
?q=node/183.
Bhojwani SS, Razdan MK. 1996. Plant Tissue Culture: Theory and Practice, A Revised Edition. Amsterdam (NL): Elsevier Science B.V.
15 Gamborg, OL. 1991. Callus and Cell Culture. Di dalam : Wetter LR, Constabel F, editor. Plant Tissue Culture Methods. Canada (CA): Prairie Regional Laboratory of The National Research Council of Canada. Hartmann HT, Kester DE, Davies FTJr, Geneve RL. 1997. Plant
Propagation Principle and Practises, Six Edition. New Jersey (US): Prentice Hall Incorporated.
Hutami. 2008. Masalah pencoklatan pada kultur jaringan [ulasan]. Agrobio. 4(2):83-88.
Kumar AR, Kumar N. 2008. Studies on the efficacy of sulphate of potash (SOP) on the physiological, yield and quality parameters of Banana CV. Robusta (Cavendish-AAA). EurAsia J BioSci. 2(12):102-109.
Lestari EG. 2011. Peranan zat pengatur tumbuh dalam perbanyakan tanaman melalui kultur jaringan [ulasan]. Agrobio. 7(1):63-68.
Lloyd G, Mc Cown B. 1981. Commercially feasible micropropagation of mountain laurel, Kalmia latifolia by use of shoot tip culture. Comb Proc Intl Plant Prop Soc. 30:421-427.
Mangoendidjojo W. 2003. Dasar-dasar Pemuliaan Tanaman. Jakarta (ID): Penerbit Kanisius.
Melliawati R, Widyaningrum DN, Djohan AC, Sukiman H. 2006. Pengkajian bakteri endofit penghasil senyawa bioaktif untuk proteksi tanaman. Biodiversitas. 7(3):221-224.
Murashige T, Skoog F. 1962. A reivised medium for rapid growth and bioassays with tobacco tissue culture. Physiol Plant. 15: 473.
Newell C, Growns D, McComb J. 2003. The influence of medium aeration on in vitro rooting of Australian plant microcutting. PCTOC. 75(2): 131-142.
Pierik RLM. 1987. In Vitro Culture of Higher Plants. Dordrecht (NL): Martinus Nitjhof Publisher.
Pratama R. 2010. Potensi Antioksidan dan toksisitas ekstrak daun Sansevieria cylindrica [skripsi]. Bogor (ID): Insitut Pertanian Bogor. Pratiwi 2009. Penggunaan jenis media dasar dan kinetin untuk induksi
organogenesis anthurium gelombang cinta (Anthurium plowmanii) secara in vitro [skripsi]. Bogor (ID): Insitut Pertanian Bogor.
Prihatmanti D. 2002. Penggunaan zat pengatur tumbuh NAA dan BAP serta air kelapa untuk menginduksi organogenesis tanaman anthurium (Anthurium andraeanum Linden ex Andre) [skripsi]. Bogor (ID): Insitut Pertanian Bogor.
Purwanto AW. 2006. Sansevieria Flora Cantik Penyerap Racun. Yogyakarta (ID): Kanisius.
Saji KV, Sujatha M. 1998. Embryogenesis and plant regeneration in anther culture of sunflower (Helianthus anuus L.). Euphytica. 103:1-7.
Sastrapradja S. 1977. Tanaman Hias. Bogor (ID): Lembaga Biologi Nasional, LIPI.
Shahzad A, Ahmad N, Rather MA, Husain MK, Anis M. 2009. Improved shoot regeneration system through leaf derived callus and nodule culture of Sansevieria cylindrica. Biol Plant. 53 (4):745-749.
16
Takawira R. 2001. The genus Sansevieria (family Dracaenaceae) in Zimbabwe. Act Hort . 552: 189-198.
Theodora F. 2010. Perbanyakan tanaman jarak pagar (Jatropha curcas) melalui stek buku tunggal secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Thorpe TA, Joy IVRW, Leung WM. 1986. Starch turnover in shoot-forming tobacco callus. Physiol Plant. 66:58-62.
TRUBUS. 2008. Sansevieria: 200 Jenis Spektakuler, 400 Foto. Depok (ID): PT Trubus Swadaya.
Winarto B. 2004. Modifikasi konsentrasi NH4NO3 dan CaCl2 medium MS terhadap pertumbuhan eksplan hiperhidristri anyelir. AgroSains. 6(2):45-52.
Yunita R. 2004. Multiplikasi tunas melinjo (Gnetum gnemon) secara in vitro. Sagu. 3(1):1-8.
Yusnita, Pungkastiani W, Hapsoro D. 2011. In vitro organogenesis of two Sansevieria cultivars on different concentrations of benzyladenine (BA). Agrivita 33:147-153.
Yusnita. 2003. Kultur Jaringan Tanaman: Cara Memperbenyak Tanaman secara Efisien. Jakarta (ID): Agromedia Pustaka.
Yuzzami, Witono JR, Hidayat S, Handayani T, Sugiarti, Mursidawati S, Triono T, Astuti IP, Sudarmono, Wawangningrum H. 2010. Ensiklopedia Flora Jilid I. Depok (ID): PT Kharisma Ilmu.
17
LAMPIRAN
Lampiran 1 Komposisi media dasar MS (Murashige dan Skoog 1962) dan modifikasinya (¼MS)
No. Garam Mineral Konsentrasi ¼ Konsentrasi
18
Lampiran 2 Komposisi media dasar Woody Plant (WP) (Llyod dan Mc Cown 1981) dan modifikasinya (¼WP)
No. Garam Mineral Konsentrasi ¼ Konsentrasi
19
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 4 Februari 1991 dari pasangan Bapak Bunyamin dan Ibu Siti Nurkaya. Penulis merupakan anak pertama dari dua bersaudara. Penulis menyelesaikan pendidikan menengah di SMPN 1 Cigombong pada tahun 2006 dan SMAN 1 Cigombong pada tahun 2009. Tahun 2009 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menempuh pendidikan S1 di IPB, penulis aktif dalam kepanitian sebagai staf divisi konsumsi Go Green (2010), staf infokom HIMABIO (2010/2011), staf divisi publikasi, dekorasi dan dokumentasi Go Green (2011), staf divisi konsumsi Grand Biodiversity (2011), staf divisi kestari LCTB dalam PESTA SAINS (2012), Pengalaman menjadi asisten praktikum pernah dirasakan antara lain Biologi Dasar, Fisiologi Tumbuhan Dasar, Biologi Alga dan Lumut, dan Kultur Jaringan Tanaman.
Selama menempuh studi di Departemen Biologi, penulis melakukan penelitian dalam studi lapang mengenai “Inventarisasi Meniran di Hutan Pendidikan Gunung Walat” (2011), dan praktik lapang yang berjudul “Teknik Budidaya Jamur Tiram Putih Menggunakan Media Limbah Industri Kayu di Unit Community Development SEAMEO BIOTROP Bogor” (2012). Penulis juga mendapatkan penghargaan prestasi akademik diantaranya adalah Program Kreativitas Mahasiswa di Bidang Penelitian didanai oleh DIKTI (2012) tentang “Uji Khasiat Leunca (Solanum nigrum L.) sebagai Obat Herbal Peluruh Batu Ginjal di Laboratorium Biokimia dan Kimia IPB, Bogor” dan Artikel Ilmiah didanai oleh DIKTI (2012) yang