PENAPISAN DAN IDENTIFIKASI BAKTERI RHIZOSFER
PADI PENGHASIL ASAM INDOL ASETAT
PADA KONDISI SALIN
KHARISMA PANJI RAMADHAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan dan Identifikasi Bakteri Rhizosfer Padi Penghasil Asam Indol Asetat pada Kondisi Salin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
KHARISMA PANJI RAMADHAN. Penapisan dan Identifikasi Bakteria Rhizosfer Padi Penghasil Asam Indol Asetat pada Kondisi Salin. Dibimbing oleh I MADE ARTIKA dan DWI NINGSIH SUSILOWATI.
Kenaikan muka air laut pada lahan pertanian pesisir berdampak pada gangguan keseimbangan ion, peningkatan konsentrasi etilen akar, menimbulkan kondisi hipo osmotik pada akar tanaman dan pada akhirnya menghambat pertumbuhan akar. Aplikasi rhizobakteria indigen dengan kemampuan produksi fitohormon pertumbuhan asam indol asetat (AIA) dapat menjadi salah satu solusi dari permasalahan tersebut. Penelitian ini bertujuan menyeleksi dan mengidentifikasi sejumlah rhizobakteria yang mampu memproduksi fitohormon AIA dan memiliki sifat toleran terhadap cekaman salinitas. Sebanyak 48 isolat rhizobakteria asal sawah pesisir wilayah Eretan dan Patimban, Jawa Barat telah dianalisis. Isolat dengan kode Er B1.3 dan Er B1.7a mampu tumbuh pada media minimal salt dengan kandungan NaCl 15 %. Kedua isolat tersebut masih mampu menghasilkan AIA dengan konsentrasi berturut-turut 11.55 ppm dan 3.1 ppm pada media minimal salt dengan kandungan NaCl 10 %. Hasil identifikasi gen IaaM membuktikan bahwa isolat Er B1.3 dan Er B1.7a terindikasi memproduksi AIA melalui jalur IAM. Berdasarkan hasil sekuensing gen 16S rRNA diketahui isolat Er B1.3 dan Er B1.7a masing-masing termasuk dalam genus Brevibacterium dan Aeromonas.
Kata kunci: rhizobakteria, produksi AIA, toleran salinitas
ABSTRACT
KHARISMA PANJI RAMADHAN. Screening and Identification of Indole Acetic Acid-Producing Rice Rhizobacteria in Saline Condition. Supervised by I MADE ARTIKA and DWI NINGSIH SUSILOWATI.
Increased salinity in farmland due to the rising sea level have an impact on ion balance, an increased of ethylene in roots, caused of hypo-osmotic condition in roots, and finally hinder the growth of root. Utilization of indigen rhizobacteria with ability to produce growth phytohormone indole-3-acetic acid (IAA) could become one of solution of this problem. This research aims to screening a number of rhizobacteria which have ability of producig phytohormone IAA and tolerant of salinity stress. A total of 48 rhizobacteria isolates from coastal rice field of Patimban and Eretan, west Java have been analyzed. Isolates Er B1.3 and Er B1.7a have ability to grow on minimal salt medium content with 15 % NaCl. Both isolates are still capable of producing IAA with consecutive concentrations at 11 ppm and 3.1 ppm on minimal medium salt content with 10 % NaCl. IaaM gene identification results prove that isolates Er B1.3 and Er B1.7a producing IAA through the IAM pathway. Based on the result of sequencing 16S Rrna gene known that isolate Er B1.3 and Er B1.7a belong to genus Brevibacterium and Aeromonas, respectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PENAPISAN DAN IDENTIFIKASI BAKTERI RHIZOSFER
PADI PENGHASIL ASAM INDOL ASETAT
PADA KONDISI SALIN
KHARISMA PANJI RAMADHAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penapisan dan Identifikasi Bakteri Rhizosfer Padi Penghasil Asam Indol Asetat pada Kondisi Salin
Nama : Kharisma Panji Ramadhan
NIM : G84100031
Disetujui oleh
Dr Ir I Made Artika, MappSc Pembimbing I
Dwi Ningsih Susilowati, STP MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan November 2013 ini adalah Penapisan dan Identifikasi Bakteri Rhizosfer Padi Penghasil Asam Indol Asetat pada Kondisi Salin.
Terima kasih penulis ucapkan kepada Bapak Dr Ir I Made Artika, MappSc dan Ibu Dwi Ningsih Susilowati, STP MSi selaku pembimbing yang telah banyak memberikan pengarahan dan saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Jajang, Bapak Ughi dan Ibu Aminah beserta seluruh staf Laboratorium Mikrobiologi Konservasi Mikroorganisme BB-Biogen yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada Ayah, Ibu, Adik, sahabat dekat, serta teman-teman Biokimia angkatan 47 untuk segala doa, kasih sayang dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan alat 2
Metode Penelitian 2
HASIL 6
Kemampuan Isolat Bakteri Rhizosfer dalam Produksi AIA 6 Toleransi Isolat Bakteri Rhizosfer terhadap Salinitas 7
Produksi AIA dalam Media Salin 9
Amplikon Gen IaaM 9
Isolat Bakteri Rhizosfer Hasil identifikasi 10
PEMBAHASAN 10
Kemampuan Isolat Bakteri Rhizosfer dalam Produksi AIA 10 Toleransi Salinitas dan Analisis Produksi AIA dalam Media Salin 11
Amplikon Gen IaaM 12
Isolat Bakteri Rhizosfer Hasil Identifikasi 13
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR GAMBAR
1 Isolat bakteri rhizosfer padi yang mampu tumbuh pada konsentrasi
NaCl 10 % 8
2 Isolat bakteri rhizosfer padi yang mampu tumbuh pada konsentrasi
NaCl 15 % 8
3 Produksi AIA isolat Er B1.7a dan Er B1.3 pada media salin dengan
kandungan NaCl dibandingkan dengan kontrol tanpa NaCl 9
4 Amplikon hasil PCR gen IaaM 10
5 Lintasan sintesis AIA pada sel bakteri 12
DAFTAR TABEL
1 Konsentrasi AIA yang diproduksi oleh isolat bakteri sampel 6 2 Daya tumbuh isolat bakteri sampel pada media salin 7 3 Hasil analisis sekuens 16S rRNA sampel unggul dengan
menggunakan program blast n 10
DAFTAR LAMPIRAN
1 Isolat bakteri rhizosfer yang digunakan dalam penelitian 16
2 Diagram alir penelitian 17
3 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA 18
4 Uji toleransi salinitas 23
5 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA
pada media salin 25
PENDAHULUAN
Perubahan iklim akibat pemanasan global (global warming) menjadi salah satu tantangan besar yang harus dihadapi warga bumi pada milenium ketiga ini. waktu tahun 1971 - 2010. Kenaikan total permukaan air laut yang berhasil dicatat pada abad ke-20 diperkirakan mencapai 0.17 m. Kenaikan permukaan air laut ini berdampak serius pada sektor pertanian, khususnya subsektor tanaman pangan yang ditanam di wilayah pesisir.
Pesisir pantai utara Pulau Jawa berperan sebagai salah satu lumbung padi nasional. Padi yang diproduksi di Pulau Jawa tercatat mencapai 37 juta ton dari total produksi padi nasional sebesar 71 juta ton atau berkontribusi sekitar 52.6 % terhadap produksi padi nasional (BPS 2013). Tingginya produktivitas padi di Pulau Jawa tidak lepas dari peranan kabupaten serta kota di wilayah pesisir yang bertindak sebagai sentra produksi beras seperti Indramayu, Subang, Cirebon, serta beberapa kabupaten lain di wilayah pantai utara Pulau Jawa. Peningkatan salinitas lahan pertanian pesisir tentunya akan berdampak serius pada produktivitas kabupaten serta kota yang bertindak sebagai sentra produksi beras tersebut.
Peningkatan kandungan NaCl dalam tanah mengakibatkan peningkatan konsentrasi etilen pada akar, gangguan keseimbangan ion, serta menimbulkan kondisi hipo osmotik pada akar tanaman. Dampak yang timbul pada akhirnya adalah terhambatnya pertumbuhan akar tanaman (Ahmad et al. 2013). Kandungan garam dalam tanah pertanian dapat dihilangkan dengan rehabilitasi lahan secara kimiawi, namun hal ini tidak efisien dan tidak ekonomis bila diterapkan pada lahan salin yang luas (Rajput et al. 2013). Strategi lain yang mungkin dilakukan untuk mengatasi gangguan pertumbuhan tanaman akibat cekaman lingkungan salin adalah perakitan secara genetik serta penanaman varieatas padi dengan kemampuan toleran salin, namun tentunya upaya perakitan tanaman ini membutuhkan penelitian yang lama. Solusi lain yang dapat dilakukan untuk mengatasi masalah ini salah satunya dengan pengaplikasian rhizobakteria pemacu tumbuh tanaman (Plant Growth Promoting Rhizobacteria) dengan kemampuan produksi hormon pertumbuhan asam indol asetat (AIA) serta toleran salin dari wilayah setempat (mikrob indigen) (Jha et al. 2012). Upaya pengaplikasian rhizobakteria dengan kemampuan tersebut diharapkan mampu mengurangi dampak cekaman salinitas pada tanaman dengan menstimulasi pembelahan, pembesaran, serta diferensiasi sel sehingga dapat meningkatan pertumbuhan area perakaran tanaman yang terhambat akibat cekaman kandungan NaCl yang tinggi pada tanah.
2
kontribusi bagi pertanian di lahan pesisir guna mengantisipasi dampak peningkatan muka air laut akibat perubahan iklim.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini yaitu isolat bakteri rhizosfer koleksi Biogen Culture Collection (Biogen CC) Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen) dan InaCC (Indonesian Culture Collection) Lembaga Ilmu Pengetahuan Indonesia (lampiran 1), FeCl3, air deionisasi, HClO4 35 %, larutan stok asam
indol asetat (AIA), NaCl, pepton, beef extract, KH2PO4, Na2HPO4, MgSO4·7H2O,
CaCl2·2H2O, FeSO4·7H2O, MnSO4·H2O, CuSO4·5H2O, ZnSO4·7H2O, H3BO3,
CoCl2·6H2O, Na2MoO4·H2O, H2SO4, akuades, glukosa, L-triptofan, ekstrak
khamir, kit lisis sel, primer spesifik gen IaaM (primer TMOr dan primer TMOf), DNA polymerase (Go Taq Green Master Mix-Promega), loading dye 6x, dan marker ladder 100 bp. Adapun alat-alat yang digunakan antara lain
spektrofotometer, alat-alat gelas, neraca analitik, sentrifus, pipet mikro, mesin PCR, freezer, microwave, laminar air flow, pengaduk magnetik, vortex, autoklaf, waterbath, orbital shaker, sentrifus, elektroforesis gel agarosa, dan UV-Transiluminator.
Metode Penelitian
Secara garis besar penelitian ini terbagi menjadi beberapa tahap, yaitu analisis kuantitatif produksi AIA, uji salinitas, analisis kuantitatif produksi AIA pada media salin, isolasi DNA, identifikasi gen IaaM, amplifikasi gen 16S rRNA dan identifikasi isolat.
Analisis Kuantitatif Produksi AIA (Gupta et al. 2012)
Analisis kuantitatif produksi AIA diawali dengan tahap persiapan dengan pembuatan media dan larutan yaitu media Soil Extract Agar (SEA), media Nutrient Broth M-26, larutan L-triptofan, dan media minimal salt. Setelah tahap persiapan selanjutnya dilakukan tahap analisis yang diawali dengan peremajaan isolat bakteri, pembuatan kurva standar, kemudian dilanjutkan tahap analisis kuantitatif. Prinsip analisis kuantitatif produksi AIA adalah reaksi yang terjadi antara pereaksi Salper yang mengandung FeCl3 dan HClO4 dengan asam indol
asetat sehingga terjadi perubahan warna asam indol asetat yang tidak berwarna menjadi produk reaksi yang berwarna merah muda. Nilai absorbansi pada panjang gelombang 530 nm dari produk reaksi akan berbanding lurus dengan konsentrasi asam indol asetat sehingga dapat ditentukan konsentrasi asam indol asetat dalam sampel.
Tahap Persiapan
3
Pembuatan Media Nutrient Broth M-26 (NB-M26) (Miliute dan Buzaite 2011). Sebanyak 5 g NaCl, 10 g pepton, 10 g beef extract dilarutkan dengan akuades hingga volume satu liter kemudian diaduk dengan pengaduk magnetik. Media tersebut lalu dimasukkan ke dalam botol kaca kecil dengan volume masing-masing botol kaca sebanyak 10 ml dan disterilisasi pada suhu 121 oC dan tekanan 1 Atm selama 15 menit dengan autoklaf.
Pembuatan Larutan L-Triptofan (Gupta et al. 2012). Sebanyak 10 g glukosa, satu gram L-triptofan dan 0.1 g ekstrak khamir dilarutkan dengan akuades steril hingga mencapai volume akhir 100 mL kemudian disterilkan dengan milipore 0.2 m.
Pembuatan Media Minimal Salt (Gupta et al. 2012). Seberat 1.36 g KH2PO4, 2.13 g Na2HPO4, 0.2 g MgSO4·7H2O, dan 10 ml larutan trace element
dilarutkan dengan satu liter akuades kemudian dimasukkan dalam botol kaca kecil dengan volume masing-masing 9 ml. Larutan trace element terbuat dari 700 mg CaCl2·2H2O, 300 mg FeSO4·7H20, 20 mg MnSO4·H20, 40 mg CuSO4·5H2O, 20
mg ZnSO4·7H2O, 3 mg H3BO3, 7 mg CoCl2·6H2O, 4 mg Na2MoO4·H2O, dan 1
ml H2SO4 yang dilarutkan dalam akuades hingga volume akhir tepat satu liter.
Media minimal salt yang telah dimasukkan dalam botol kaca kecil lalu disterilkan dengan autoklaf pada suhu 121 oC selama 15 menit. Setelah dingin, media minimal salt tersebut ditambahkan 1 ml larutan L-triptofan pada tiap botol kaca.
Tahap Analisis
Peremajaan Isolat Bakteri. Sebanyak satu ose isolat bakteri diambil kemudian digoreskan di atas media SEA. Kultur bakteri dalam media SEA tersebut diinkubasi pada suhu 27 oC selama 3 hari.
Pembuatan Kurva Standar. Kurva standar dibuat dengan cara melarutkan larutan stok AIA dengan akuades sehingga konsentrasi larutan stok AIA menjadi 0.2, 1, 5, 15, 25, 35, dan 45 ppm dengan volume masing-masing 2 mL. Larutan stok AIA tersebut ditambahkan 4 mL pereaksi Salper dan dikocok dengan vortex lalu diinkubasi pada suhu ruang selama 25 menit. Larutan tersebut lalu dibaca nilai absorbansinya pada panjang gelombang 530 nm kemudian dibuat persamaan hubungan antara konsentrasi AIA dengan nilai absorbansi larutan pada panjang gelombang 530 nm.
Analisis Kuantitatif. Analisis kuantitatif dilakukan dengan metode Gupta et al. (2012). Sebanyak satu ose koloni bakteri yang telah diremajakan dimasukkan dalam media NB M-26, kemudian diinkubasi di atas orbital shaker dengan kecepatan 150 rpm pada suhu ruang selama 24 jam. Sebanyak 100 L kultur bakteri tersebut selanjutnya dipipet dan dipindahkan ke media minimal salt kemudian diinkubasi di atas orbital shaker dengan kecepatan 120 rpm selama 48 jam.
Setelah melalui proses inkubasi 48 jam, kultur bakteri dalam media minimal salt tersebut diambil sebanyak 3 mL untuk dimasukkan dalam tabung Eppendorf steril dan disentrifugasi pada kecepatan 8000 rpm dengan suhu 4 oC selama 10 menit. Supernatan dari hasil sentrifugasi dipisahkan dari peletnya. Sebanyak 2 mL supernatan tersebut dipipet ke dalam tabung reaksi kemudian ditambahkan 4 mL pereaksi Salper dan dikocok dengan vortex lalu diinkubasi pada suhu ruang selama 25 menit. Pereaksi Salper dibuat dengan melarutkan 0.5 M FeCl3 dengan
50 mL HClO4 35 %. Setelah proses inkubasi selesai, campuran tersebut dibaca
4
terbaca kemudian disubstitusikan ke dalam kurva standar sehingga konsentrasi AIA dalam sampel dapat diketahui.
Uji Toleransi Salinitas (modifikasi Gupta et al. 2012)
Uji toleransi salinitas diawali dengan pembuatan media minimal salt padat dengan kandungan NaCl bervariasi, kemudian dilakukan analisis toleran salinitas dengan menumbuhkan isolat bakteri sampel pada media minimal salt tersebut.
Pembuatan Media Minimal Salt Padat (modifikasi Gupta et al. 2012).
Seberat 1.36 g KH2PO4, 2.13 g Na2HPO4, 0.2 g MgSO4·7H2O, 10 ml larutan trace
element, dan 10 g Bacto agar dilarutkan dengan akuades hingga volume akhir 1 liter kemudian dimasukkan dalam botol kaca kecil dengan volume masing-masing 9 ml. Media minimal salt ini ditambahkan NaCl dengan variasi konsentrasi 0, 10, dan 15 %. Media minimal salt tersebut kemudian disterilkan dengan autoklaf pada suhu 121 oC selama 15 menit. Sebanyak 100 mL larutan L-triptofan ditambahkan pada media minimal salt steril kemudian dikocok perlahan dan dituangkan dalam cawan Petri steril.
Analisis Toleransi Salinitas. Sebanyak satu ose koloni bakteri yang telah diremajakan pada media SEA dimasukkan dalam media NB M-26, kemudian diinkubasi di atas orbital shaker dengan kecepatan 150 rpm pada suhu ruang selama 24 jam. Sebanyak 5 L kultur bakteri tersebut selanjutnya diambil dan diteteskan ke atas media minimal salt padat berkonsentrasi 0, 10, dan 15 % kemudian diinkubasi di atas orbital shaker dengan kecepatan 120 rpm selama 48 jam. Setelah melalui proses inkubasi, dilakukan pengamatan terhadap koloni bakteri yang tumbuh di atas media minimal salt tersebut.
Analisis Produksi AIA dalam Media Salin (Modifikasi Frankenberg dan Poth 1988 dalam Gupta et al. 2012).
Pembuatan Media Minimal Salt Salin (Gupta et al. 2012). Seberat 1.36 g KH2PO4, 2.13 g Na2HPO4, 0.2 g MgSO4·7H2O, dan 10 ml larutan trace element
dilarutkan dengan akuades hingga volume akhir 1 liter. Media minimal salt ini ditambahkan NaCl dengan variasi konsentrasi 0, 10, dan 15 %. Media minimal salt tersebut kemudian disterilkan dengan autoklaf pada suhu 121 oC selama 15 menit. Setelah dingin, media minimal salt tersebut ditambahkan 1 mL larutan L-triptofan pada tiap botol kaca.
Analisis Kuantitatif AIA. Analisis kuantitatif AIA dilakukan dengan metode modifikasi Gupta et al. (2012) sesuai dengan prosedur yang telah diuraikan di atas namun media minimal salt digunakan disubstitusi dengan media minimal salt salin.
Identifikasi Gen IaaM (Kochar et al. 2009)
5 dan lisozim 10 mg/mL sebanyak 100 L kemudian diinkubasi pada suhu 37 oC selama 60 menit. Setelah diinkubasi, campuran tersebut disentrifugasi dengan kecepatan 14.000 g kemudian dibuang supernatannya. Pelet dari hasil sentrifugasi disimpan untuk tahap lisis sel.
Bakteri dengan Gram negatif langsung masuk ke tahap lisis sel. Pada tahap lisis sel baik bakteri Gram positif maupun bakteri Gram negatif diberi nuclei lysis solution sebanyak 600 L kemudian dikocok perlahan menggunakan pipet mikro. Campuran tersebut lalu diinkubasi di atas waterbath selama 5 menit pada suhu 80 oC dan didiamkan pada suhu kamar hingga suhunya mendingin. Setelah cukup dingin ditambahkan RNAse solution mix sebanyak 2 L kemudian diinkubasi kembali pada suhu 37 oC selama 30 menit untuk masuk ke tahap presipitasi protein.
Setelah diinkubasi pada suhu 37 oC selama 30 menit, campuran tersebut diberi protein precipitation solution sebanyak 200 L lalu diinkubasi di penangas es selama 5 menit kemudian disentrifugasi dengan kecepatan 14000 g selama 3 menit. Supernatan yang terbentuk pasca sentrifugasi dimasukkan ke isopropanol
absolut 600 L lalu disentrifugasi kembali dengan kecepatan 14000 g selama 2
menit dan diambil supernatannya. Supernatan tersebut ditambahkan etanol 70 %
sebanyak 600 L dan disentrifugasi pada kecepatan 14000 g selama 2 menit.
Setelah disentrifugasi, supernatan dibuang dan peletnya dikeringkan di udara selama 15 menit kemudian disuspensi kembali dengan 20 L rehydration solution dan disimpan dalam freezer (Kochar et al. 2009).
Analisis Kuantitatif DNA dengan Nanodrop. Sebanyak 2 L larutan TE dipipet ke dalam lubang ukur kemudian nanodrop ditutup dan tombol read blank pada komputer ditekan. Buffer TE yang tersisa dibersihkan dengan kertas tissue. Sampel DNA dipipet sebanyak 2 L ke dalam lubang ukur, kemudian menu read sample diklik. Hasil pengukuran berupa nilai konsentrasi DNA akan muncul dalam satuan ng/ L. Kemurnian DNA dapat dilihat berdasarkan nilai nisbah nilai absorbansi DNA pada 260 nm dengan nilai absorbansi DNA pada 280 nm (Thermo Fisher Scientific 2009).
Identifikasi Gen IaaM dengan PCR (Kochar et al. 2011). Gen IaaM diamplifikasi menggunakan primer spesifik untuk yaitu TMOf
(5’TATCTCGAGCCGTTAAAAGGTGCTGTTTCA’3) dan TMOr
(5’ATATCTAGATAGCGATAGGAGGCGTTGAT’3). Volume akhir yang digunakan untuk PCR yaitu 25 µ L. Komposisi reaksi PCR yang digunakan antara lain Go Taq DNA polimerase 12.5 µ L, primer reverse 1 µ L, primer forward 1µL, ddH2O 8.5 µL dan DNA hasil isolasi 2 µL.
6
Identifikasi Isolat (Jha et al. 2012)
Amplifikasi gen 16S rRNA. Gen penyandi 16S rRNA diamplifikasi dengan metode PCR menggunakan primer 63F (5’CAGGCCTAACACATGCAAGTC’3)
dan 1387R (5’GGGCGGWGTGTACAAGGC’3). Komposisi reaksi PCR yang
digunakan antara lain Go Taq DNA polimerase 12.5 µL, primer reverse 1 µ L, primer forward 1µL, ddH2O 8.5 µL dan DNA hasil isolasi 2 µL.
Proses amplifikasi dilakukan dengan suhu denaturasi 94 oC selama 5 menit; suhu annealing 94 oC selama 30 detik, 50 oC selama 30 detik, 72 oC selama 1 menit. Tahap annealing dilakukan sebanyak 10 siklus. Tahap ekstensi dilakukan pada suhu 94 oC selama 30 detik, 55 oC selama 30 detik, 72 oC selama 1 menit; tahap ekstensi ini dikerjakan sebanyak 30 siklus. Tahap ekstensi diakhiri pada suhu 72 oC selama 7 menit, dan 15 oC selama 5 menit. DNA hasil amplifikasi divisualisasi menggunakan elektroforesis gel agarosa 1 %. Terlihatnya pita DNA yang berukuran ±1500 pb menandakan gen 16S rRNA telah teramplifikasi (modifikasi Jha et al. 2012).
Sekuensing gen 16S rRNA. Sekuensing dilakukan melalui jasa perusahaan sekuensing 1st Base Malaysia. Sekuens DNA selanjutnya disejajarkan dengan data base dari GeneBank menggunakan blast n dari situs NCBI (National Center for Biotechnology Information) melalui http://www.ncbi.nlm.nih.gov. (modifikasi Jha et al. 2012).
HASIL
Kemampuan Isolat Bakteri Rhizosfer dalam Produksi AIA
Hasil dari analisis kuantitatif produksi AIA dari empat puluh delapan isolat bakteri rhizosfer seperti ditunjukkan pada Tabel 1. Seluruh isolat yang dianalisis mampu menghasilkan AIA dengan konsentrasi yang beragam antara 2.32 ± 0.14 ppm hingga 109 ± 0.99 ppm. Isolat dengan produksi AIA terendah yaitu isolat dengan kode Er B2.4, sedangkan isolat dengan produksi AIA tertinggi yaitu isolat dengan kode Er B2.8. Berdasarkan hasil analisis produksi AIA ini dipilih 12 isolat dengan produksi AIA tinggi untuk diuji daya tumbuhnya pada media dengan kadar garam tinggi melalui uji toleransi salinitas.
Tabel 1 Konsentrasi AIA yang diproduksi oleh isolat bakteri sampel
7
No. Kode Isolat Daya Tumbuh Pada Media Salin* 0 %NaCl 10 %NaCl 15 %NaCl
Tabel 1 Konsentrasi AIA yang diproduksi oleh isolat bakteri sampel (lanjutan)
Toleransi Isolat Bakteri Rhizosfer terhadap Salinitas
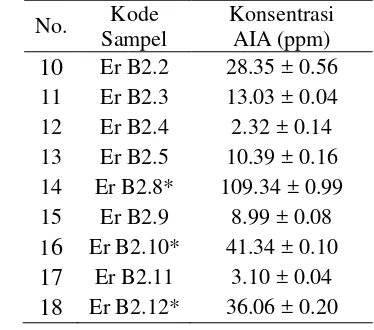
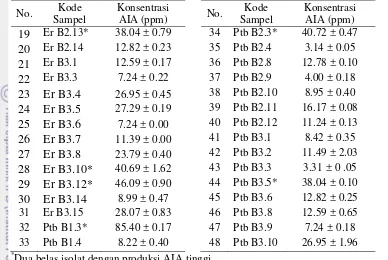
Uji toleransi salinitas dilakukan dengan menginokulasikan dua belas isolat bakteri rhizosfer di atas media padat dengan kandungan NaCl 0, 10, dan 15 %. Daya tumbuh dari isolat-isolat bakteri tersebut ditandai dengan terbentuknya koloni bakteri berwarna putih seperti yang terlihat pada Gambar 1 dan Gambar 2. Hasil uji toleransi salinitas ini disajikan pada Tabel 2. Seluruh isolat dapat tumbuh dengan subur pada media dengan konsentrasi NaCl 0 %. Media dengan konsentrasi NaCl 10 % terlihat 4 isolat bakteri yang masih mampu tumbuh dengan komposisi 2 isolat bakteri tumbuh dengan subur dan 2 isolat bakteri lain tumbuh dengan daya tumbuh sedang. Namun media dengan konsentrasi NaCl 15 % hanya 2 isolat bakteri yang tumbuh, masing-masing dengan daya tumbuh sedang dan daya tumbuh subur. Dua isolat yang masih mampu tumbuh pada media dengan kandungan NaCl 15 % inilah yang terpilih untuk dianalisis pada tahap-tahap selanjutnya.
Tabel 2 Daya tumbuh isolat bakteri sampel pada media salin *
8
No. Kode Isolat Daya Tumbuh Pada Media Salin* 0 %NaCl 10 %NaCl 15 %NaCl
7. Er B2.10 +++++ +++ -
8. Ptb B2.3 +++++ - -
9. Er B3.10 +++++ - -
10. Er B2.13 +++++ - -
11. Er B2.12 +++++ +++ -
12. Ptb B3.10 +++++ - -
Tabel 2 Daya tumbuh isolat bakteri sampel pada media salin (lanjutan)
Gambar 1 Isolat bakteri rhizosfer padi yang mampu tumbuh pada media dengan konsentrasi NaCl 10 % (keterangan: 2= Er B1.7a, 4= Er B1.3, 7= Er B2.10 11= Er B2.12)
Gambar 2 Isolat bakteri rhizosfer padi yang mampu tumbuh pada media dengan konsentrasi NaCl 15 % (keterangan: 2= Er B1.7a, 4= Er B1.3)
Koloni bakteri *
9
Produksi AIA dalam Media Salin
Tahap analisis produksi AIA dalam media salin dilakukan untuk mengetahui konsistensi isolat dalam memproduksi AIA saat tumbuh pada media salin. Berdasarkan hasil analisis pada Gambar 3, isolat Er B1.7a dan isolat Er B1.3 menghasilkan AIA dengan konsentrasi masing-masing 85.55 ppm dan 49.45 ppm. Penurunan produksi AIA secara drastis terjadi pada kedua isolat pada konsentrasi NaCl 10 % menjadi 11.55 ppm untuk isolat Er B1.7a dan 3.1 ppm untuk isolat Er B1.3. Baik isolat Er B1.7a maupun isolat Er B1.3 tidak mampu lagi menghasilkan AIA pada media dengan kadar garam 15 %.
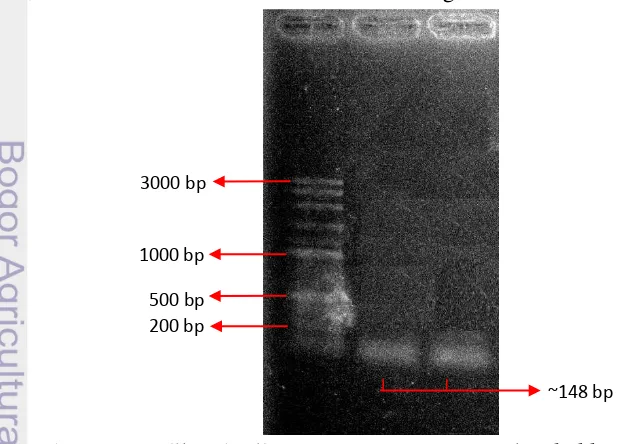
Amplikon Gen IaaM
Identifikasi gen IaaM dilakukan dengan metode PCR menggunakan primer spesifik TMOf dan TMOr. Hasil positif ditandai dengan munculnya pita tunggal DNA dengan ukuran ~148 bp. Berdasarkan elektroforegram hasil PCR pada Gambar 4, terlihat bahwa baik isolat Er B1.7a maupun isolat Er B1.3 keduanya menghasilkan pita tunggal DNA yang berukuran ~148 bp. Oleh karena itu, kedua isolat tersebut terindikasi memiliki gen IaaM.
M 1 2
Gambar 4 Amplikon hasil PCR gen IaaM (M= Marker ladder 100 bp , 1= Er 1.7a, 2= Er B1.3)
~148 bp 200 bp
3000 bp
1000 bp
500 bp
Gambar 3 Produksi AIA isolat Er B1.7a dan Er B1.3 pada media salin
49.45 85.55
11.55
3.1
10
Isolat Bakteri Rhizosfer Hasil Identifikasi
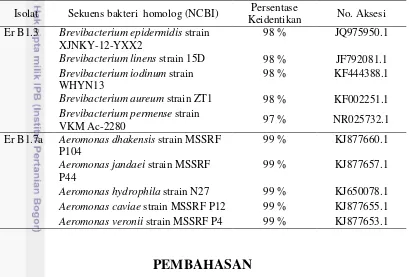
Hasil identifikasi pada Tabel 3, terlihat bahwa isolat Er B1.3 memiliki persentase keidentikan hampir 100 % dengan lima bakteri genus Brevibacterium, sedangkan isolat Er B1.7a juga memiliki persentase keidentikan hampir 100 % pula dengan lima bakteri genus Aeromonas. Berdasarkan nilai presentase keidentikan ini, maka diketahui bahwa isolat dengan kode Er B1.3 dan Er B1.7a masing-masing termasuk dalam bakteri genus Brevibacterium dan Aeromonas.
Tabel 3 Hasil identifikasi isolat Er B1.3 dan isolat Er B1.7a Isolat Sekuens bakteri homolog (NCBI) Persentase
Keidentikan No. Aksesi Er B1.3 Brevibacterium epidermidis strain
XJNKY-12-YXX2
98 % JQ975950.1
Brevibacterium linens strain 15D 98 % JF792081.1
Brevibacterium iodinum strain WHYN13
98 % KF444388.1
Brevibacterium aureum strain ZT1 98 % KF002251.1
Brevibacterium permense strain
VKM Ac-2280 97 % NR025732.1
Er B1.7a Aeromonas dhakensis strain MSSRF P104
99 % KJ877660.1
Aeromonas jandaei strain MSSRF P44
99 % KJ877657.1
Aeromonas hydrophila strain N27 99 % KJ650078.1
Aeromonas caviae strain MSSRF P12 99 % KJ877655.1
Aeromonas veronii strain MSSRF P4 99 % KJ877653.1
PEMBAHASAN
Kemampuan Isolat Bakteri Rhizosfer dalam Produksi AIA
Analisis AIA dilakukan dengan metode kolorimetri, berdasarkan perubahan warna AIA ketika ditambahkan dengan pereaksi Salper dari tidak berwarna menjadi berwarna merah muda setelah diinkubasi selama 25 menit. Analisis AIA dengan metode ini mempunyai beberapa keunggulan, yaitu mudah, cepat, dan dapat dikerjakan untuk menganalisis sampel dalam jumlah banyak. Konsentrasi AIA yang diproduksi oleh isolat bakteri sampel masih tergolong rendah bila dibandingkan dengan AIA yang dihasilkan dari Azospirillum sp. yang mencapai 160 ppm. Azospirillum sp. merupakan salah satu bakteri pemacu tumbuh tanaman yang telah dikenal dapat meningkatkan pertumbuhan serta produktivitas berbagai tanaman pertanian (Bashan 2008).
11 tanaman, lebih dari 80 % bakteri rhizosfer juga dilaporkan dapat memproduksi auksin (Khalid et al. 2004).
Bakteri rhizosfer dengan kemampuan produksi fitohormon auksin telah dilaporkan mampu meningkatkan toleransi tanaman terhadap cekaman salinitas. Lingkungan dengan salinitas tinggi akan merangsang tanaman untuk memproduksi hormon etilen (hormon pemacu stres pada tanaman) yang salah satu dampaknya akan menghambat perkembangan akar tanaman (Siddikee et al. 2010). AIA yang dihasilkan oleh bakteri rhizosfer akan meningkatkan panjang dan permukaan akar tanaman sehingga tanaman tersebut akan mendapatkan akses yang lebih baik terhadap nutrisi-nutrisi yang tersedia di tanah. Selain itu AIA tersebut juga akan melonggarkan sel-sel pada dinding akar tenaman sehingga eksudat-eksudat yang berperan sebagai nutrisi bagi bakteri rhizosfer akan lebih mudah diserap oleh bakteri rhizosfer yang berada di sekitar tanaman (Glick 2012).
Toleransi Salinitas dan Analisis Produksi AIA pada Media Salin
Uji toleransi salinitas yang dilakukan terhadap kedua belas isolat bakteri penghasil AIA dengan konsentrasi tinggi perlu dilakukan untuk mengetahui sejauh mana isolat-isolat bakteri tersebut mampu hidup pada lingkungan dengan cekaman salinitas. Berdasarkan uji toleransi salinitas yang dilakukan pada kedua belas isolat bakteri, hanya isolat bakteri dengan kode Er B1.7a dan Er B1.3 yang masih mampu hidup bahkan pada media dengan tingkat salinitas 15 % (b/v). Kemampuan tumbuh isolat bakteri tersebut ditandai dengan terbentuknya koloni berwarna putih pada permukaan media.
Isolat bakteri dengan kode Er B1.7a dan Er B1.3 yang mampu tumbuh pada media dengan salinitas 15 % tersebut dapat digolongkan menjadi bakteri halotoleran. Bakteri halotoleran adalah kelompok bakteri yang mampu tumbuh dalam media dengan cakupan konsentrasi NaCl yang luas (1 - 33 %), maupun dalam media tanpa kandungan NaCl (Siddikee et al. 2010). Bakteri dengan kemampuan tumbuh pada media dengan kandungan garam lebih dari 15 % (b/v), atau sekitar 2.5 M, termasuk bakteri halotoleran ekstrim (Shivanand dan Mugeraya 2011).
Bakteri halotoleran memiliki strategi unik untuk menjaga stabilitas tekanan osmosis di dalam sel agar tidak terjadi plasmolisis saat berada pada lingkungan salin. Bakteri halotoleran akan menstabilkan tekanan osmosis di dalam sel dengan cara mensintesis atau mengambil molekul organik compatible solute dari lingkungan. Molekul compatible solute ini antara lain poliol (gliserol, gula, dan turunannya), asam amino dan turunannya, serta quarternary amine seperti glisin betain dan ektoin (Shivanand dan Mugeraya 2011)
12
mensintesis molekul organik compatible solute demi mempertahankan tekanan osmosis di dalam sel sehingga tidak terjadi plasmolisis. Enzim-enzim yang berperan dalam produksi AIA juga tentunya akan berkurang bahkan mungkin tidak dihasilkan oleh bakteri tersebut.
Amplikon Gen IaaM
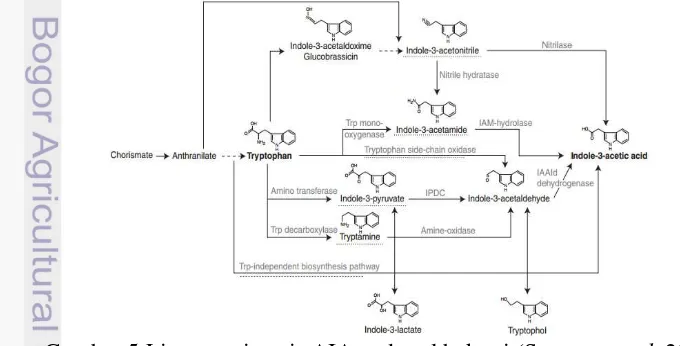
Identifikasi gen IaaM pada isolat Er B1.7a dan Er B1.3 dilakukan dengan metode PCR (Polymerase Chain Reaction). Amplifikasi gen IaaM dilakukan menggunakan primer spesifik TMOf dan TMOr dengan panjang masing-masing 29 nukleotida dan 30 nukleotida. Berdasarkan visualisasi amplikon pasca PCR, terlihat pita amplikon yang berukuran ~148 bp pada kedua isolat yang menunjukkan bahwa isolat Er B 1.7a dan isolat Er B1.3 terindikasi memiliki gen fungsional IaaM dan mensintesis AIA melalui jalur indole-3-acetamide (IAM). Biosintesis AIA melalui jalur IAM melibatkan 2 tahap. Tahap pertama adalah perubahan senyawa perkursor (triptofan) menjadi indole-3-acetamide oleh TMO (tryptophan monooxygenase) yang disandikan oleh gen IaaM dan tahap selanjutnya yaitu perubahan indole-3-acetamide menjadi asam indol-3-asetat (AIA) oleh indole-3-acetamide hydrolase yang disandikan oleh gen IaaH. Adapun enzim kunci pada biosintesis AIA melalui jalur IAM adalah enzim TMO (Spaepen et al. 2007). Gen IaaM maupun IaaH telah banyak dikarakterisasi dari bakteri yang simbion pengikat nitrogen seperti spesies Rhizobium dan Brandyrhizobium maupun bakteri patogen tanaman seperti Agrobacterium tumefaciens, P. savastanoi, dan P. agglomerans (Spaepen dan Vanderleyden 2011). Berdasarkan laporan dari Spaepan dan Vanderleyden (2013), biosintesis AIA melalui jalur IAM banyak terjadi pada bakteri patogen tanaman seperti Agrobacteria tumefaciens, Psudomonas syringae, dan E. herbicola. Rhizobakteria yang bersimbiosis dengan tanaman seperti Rhizobium fredii dan Brandyrhizobium japonicum juga dilaporkan mensintesis AIA melalui jalur IAM.
Selain melalui jalur IAM, bakteri dapat mensintesis AIA melalui beberapa jalur (Gambar 5) yaitu jalur indole-3-piruvate (IpyA), jalur tryptamine (TAM), jalur indole-3-acetonitrile (IAN), dan jalur oksidasi rantai samping triptofan (TSO) (Spaepen et al. 2007). Yang et al. (2007) melaporkan bahwa pada banyak kasus, bakteri dengan galur tertentu dapat mensintesis AIA melalui lebih dari satu jenis jalur.
13
Isolat Bakteri Rhizosfer Hasil Identifikasi
Sekuensing gen 16S rRNA isolat bakteri dilakukan untuk mengetahui informasi taksonomis isolat bakteri sampel berdasarkan basis data National Center of Biotechnology Information (NCBI). Sekuens isolat bakteri rhizosfer unggul yang diperoleh dibandingkan dengan sekuen DNA yang tersedia pada basis data NCBI melalui proses penyejajaran (alignment). Berdasarkan hasil penyejajaran menunjukkan bahwa isolat dengan kode Er B1.3 termasuk dalam genus Brevibacterium. Bakteri genus Brevibacterium hidup di berbagai habitat, khususnya habitat dengan tingkat konsentrasi garam yang tinggi. Sebagian besar bakteri genus ini tumbuh dengan baik di lingkungan dengan kadar NaCl 8 %, dan banyak pula yang dapat tumbuh di lingkungan dengan konsentrasi NaCl 15 % (Sgroy et al. 2009). Siddikee et al. (2010) melaporkan bahwa beberapa bakteri genus Brevibacterium seperti bakteri Brevibacterium iodinum dan Brevibacterium epidermidis termasuk bakteri yang memiliki sifat halotoleran. Inokulasi bakteri Brevibacterium epidermidis strain RS15 dapat meningkatkan berat kering serta perpanjangan akar tanaman canola hingga 40 % dibandingkan dengan tanaman canola tanpa inokulasi bakteri tersebut. Brevibacterium iodinum juga dilaporkan memiliki kemampuan menghasilkan AIA, memfiksasi nitrogen, mengoksidasi tiosulfat, serta memproduksi amonia.
Hasil analisis sekuens 16S rRNA isolat Er B1.7a menunjukkan bahwa isolat tersebut termasuk dalam genus Aeromonas. Bakteri dari genus Aeromonas banyak dilaporkan bertindak sebagai agen biokontrol bagi beberapa mikroorganisme patogen pada tanaman. Salah satu contohnya adalah Aeromonas caviae dengan kemampuan menghasilkan kitinase yang merupakan enzim lisis sel bagi patogen target Rhizoctonia solani yang menyerang tanaman kapas dan Sclerotium rolfsii yang menyerang tanaman buncis (Bouizgarne 2012). Berdasarkan beberapa penelitian terkini, beberapa bakteri dari genus ini juga dapat dimanfaatkan dalam bioremediasi lahan pertanian dari polutan ion-ion besi (Fe). Kemampuan bioremediasi ini terjadi karena beberapa bakteri dari genus Aeromonas dapat menghasilkan molekul siderophore yang merupakan protein yang dapat mengkelat polutan ion-ion besi yang berada di lingkungan (Khan et al. 2014). Selain kemampuan biokontrol dan bioremediasi tersebut beberapa bakteri dari genus Aeromonas, juga dilaporkan termasuk PGPR (Plant Growth Promoting Rhizobacteria) dengan kemampuan produksi beragam fitohormon seperti asam indol asetat, asam giberelin, dan sitokinin. Salah satu contohnya adalah Aeromonas veroni yang mampu menghasilkan fitohormon asam indol asetat serta sering ditemukan hidup di wilayah rhizosfer tanaman padi (Bhattacharyya dan Jha 2012).
SIMPULAN DAN SARAN
Simpulan
14
konsentrasi masing-masing 11.55 ppm dan 3.1 ppm pada media salin dengan konsentrasi NaCl 10 %. Isolat dengan kode Er B1.7a dan kode Er B1.3 tersebut terindikasi memproduksi AIA melalui jalur IAM. Hasil identifikasi gen 16S rRNA menunjukkan bahwa isolat bakteri Er B1.7a termasuk dalam genus Aeromonas sedangkan isolat bakteri Er B1.3 termasuk dalam genus Brevibacterium.
Saran
Penelitian lebih lanjut dengan menginokulasi isolat bakteri pada tanaman perlu dilakukan agar terlihat pengaruh AIA yang dihasilkan oleh isolat bakteri unggul terhadap pertumbuhan tanaman. Selain itu perlu dilakukan uji patogenisitas bakteri unggul tersebut.
DAFTAR PUSTAKA
Ahmad M, Zahir AZ, Fahreen N, Fahreeha A, M Arshad, M Khalid. 2013. Effectiveness of halo-tolerant, auxin producing Psudomonas and Rhizobium strains to improve osmotic stress tolerance in mung bean (Vigna radiata L.). Brazilian Journal of Microbiology 44: 1341-1348.
[BPS] Badan Pusat Statustik. 2013. Tabel Luas Panen, Produktifitas, Produksi Tanaman Padi Seluruh Provinsi [internet]. [diacu 2014 Agustus 20]. Tersedia dari: http://www.bps.go.id/tnmn_pgn.php?kat=3.
Bashan LE. 2008. Involvement of indole-3-acetic acid produced by the growth-promoting bacterium Azospirillum spp. in promoting growth of Chlorella vulgaris. J. Phycol 44:938-947.
Bhattacharyya PN, Jha DK. 2012. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World J Microbiol Biotechnol. 28:1327-1350.
Bouizgarne B. 2012. Bacteria in agrobiology: Disease management. New York: Springer Publishing.
Deshwal VK, P Kumar. 2013. Effect of salinity on growth and PGPR activity of Psudomonads. Journal of Academia and Industrial Research (JAIR) 2: 2278-5213.
Frankenberger Jr WT, Poth M. 1988. L-tryptophan transaminase of bacterium isolated from the rhizosphere of Festuca octoflora (Gramineae). Soil Biol Biochem 20: 299-304.
Glick BR. 2012. Plant Growth-Promoting Bacteria: Mechanisms and Applications. Kairo: Hindawi Publishing Corporation.
Gupta M, Shashi K, Arvind G, Bikram S, Rupinder T. 2012. Isolation and identification of phosphate solubilizing bacteria eble to enhance the growth and aloin-A biosynthesis of Aloe barbadensis Miller. Microbiological Research 167: 358-363.
15 Jha B, Gontia I, Anton H. 2012. The roots of halophyte Salicornia branchiata are a source of new halotolerant diazotropic bacteria with plant growth-promoting potential. Plant Soil 326: 265-277.
Khalid A, Arshad M, Zahir ZA. 2004. Screening plant growth promoting rhizobacteria for improving growth and yield of wheat. J. Appl. Microbiol. 96: 473–480.
Khan AAH, Sadguna A, Divya V, Begum S, Naseem, Siddiqui AG. 2014. Potential of microorganism in Clean-ip the environment. Int. J. of Multidiclipinary and Current research 2: 2321-3124.
Kochar M, Ashutosh U, Sheela S. 2011. Indole-3-acetic acid biosynthesis in the biocontrol strain Pseudomonas flourescens Psd and plant growth regulation by hormone overexpression. Research in Microbiology 162: 426-435.
Miliute I, O Buzaite. 2011. IAA production and other plant growth promoting traits of endophytic bacteria from apple tree. Biologija 57: P. 98-102.
Nimnoi P & Pongsilp N. 2009. Genetic diversity and plant-growth promoting ability of the indole-3-acetic Acid (IAA) synthetic bacteria isolated from agricultural soil as well as rhizospher, rhizoplane and root tissue of Ficus Religiosa L., Leucena Leucocephala and Piper Sarmentosum Roxb. Research Journal of Agriculture and Biological Science 5(1): 29-41.
Rajput L, Asma I, Fathia M, Fauzia YH. 2013. Salt-tolerant PGPR strain Planococcus rifietoensis promotes the growth and yield of wheat (Triticum aestivum L.) cultivated in saline soil. Pak. J. Bot 45(6): 1955-1962.
Sgroy V, F Cassan, O Masciarelli, MF Del Papa, A Lagares, V Luna. 2009. Isolation and characterization of endophytic plant growth-promoting (PGPB) or stress homeostasis-regulating (PSHB) bacteria associated to the halophyte Propis strombulifera. Applied Microbial Biotechnol 85:371-381.
Shiddikee MA, PS Chauhan, R Anandham, Gwang-Hyun Han, Tonfmin S. Isolation, characterization, and use for plant growth promoting under salt stress, of ACC Deaminase-producing halotolerant bacteria derived from coastal soil. J Miicrobiol Biotechnol 11:1577-1584.
Shivanand P, G Mugeraya. 2011. Halophilic bacteria and their compatible solutes-,osmoregulation and potential application. Current Science 100:10.
Spaepan S, Vanderleyden J, Roseline R. 2007. Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS Microbiol Rev 1-24.
Spaepan S, Vanderleyden J. 2013. Auxin and plant-microbe intractions. Cold Spring Harb Perspect Biol 10:1101.
Sutini. 2008. Analisis stabilitas insersi dan ekspresi fenotipik gen partenokarpi DefH9-IaaM pada T3 tanaman tomat (Lycopersicon esculentum Mill.) transgenik asal varietas opal. Skripsi. FMIPA UI.
Thermo Fisher Scientific. 2009. Nanodrop 2000/200c Spectrpphotometer V1.0 User Manual. Wilmington: Thermo Fischer Scientific.
16
17 Lampiran 2 Diagram alir penelitian
Sebanyak 48 isolat
bakteri rhizosfer Peremajaan isolat
Analisis kuantitatif produksi AIA pada
media salin
Identifikasi Gen IaaM
Uji Toleransi Salinitas
Analisis Kuantitatif Produksi AIA
Isolat lain dengan produksi AIA lebih rendah 12 Isolat dengan produksi
AIA tertinggi
Isolat yang mampu hidup di media dengan tingkat salinitas tinggi
Isolat yang tidak mampu hidup di media dengan
tingkat salinitas tinggi
Isolasi DNA bakteri Amplifikasi gen 16S rRNA
Sekuensing gen 16S rRNA
18
Lampiran 3 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA Analisis kuantitatif produksi AIA gelombang I
19 Lampiran 3 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA (Lanjutan)
Analisis kuantitatif produksi AIA gelombang III Kode
Isolat
Absorbansi
Sampel FP Sampel-Blanko
Konsentrasi
AIA (ppm) Rataan
(S) Deviasi
S1 S2 S1 S2 S1 S2
Ptb B2.8 0.414 0.410 1 0.262 0.258 12.851 12.709 12.780 0.100 Ptb B2.9 0.168 0.161 1 0.016 0.009 4.128 3.879 4.004 0.176 Ptb B2.10 0.312 0.296 1 0.160 0.144 9.234 8.667 8.950 0.401 Ptb B2.11 0.506 0.509 1 0.354 0.357 16.113 16.220 16.167 0.075 Ptb B2.12 0.371 0.366 1 0.219 0.214 11.326 11.149 11.238 0.125 Ptb B3.1 0.296 0.282 1 0.144 0.130 8.667 8.170 8.418 0.351 Ptb B3.2 0.416 0.335 1 0.264 0.183 12.992 10.050 11.486 2.031 Ptb B3.3 0.144 0.146 1 -0.008 -0.006 3.277 3.348 3.312 0.050 Ptb B3.5 0.205 0.201 1 0.053 0.049 5.440 5.298 5.369 0.100 Ptb B3.6 0.312 0.322 1 0.160 0.170 9.234 9.589 9.411 0.251 Ptb B3.8 0.711 0.698 2 0.559 0.546 46.766 45.844 46.305 0.652 Ptb B3.9 0.163 0.170 1 0.011 0.018 39.50 4.199 4.074 0.176
20
Lampiran 3 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA (Lanjutan)
Analisis kuantitatif produksi AIA gelombang IV Kode
Isolat
Absorbansi
Sampel FP Sampel-Blanko
Konsentrasi
AIA (ppm) Rataan
(S) Deviasi
S1 S2 S1 S2 S1 S2
Er B1.2 0.316 0.312 1 0.268 0.264 14.058 13.847 13.953 0.149 Er B1.3 0.521 0.520 2 0.473 0.472 49.695 49.589 49.642 0.074 Er B1.4 0.510 0.489 1 0.462 0.441 24.268 23.163 23.716 0.782 Er B1.5 0.178 0.191 1 0.130 0.143 6.795 7.479 7.137 0.484 Er B1.9 0.813 0.802 2 0.765 0.754 80.432 79.274 79.853 0.819 Er B2.2 0.580 0.595 1 0.532 0.547 27.953 28.742 28.347 0.558 Er B2.3 0.297 0.296 1 0.249 0.248 13.058 13.005 13.032 0.307 Er B3.5 0.565 0.570 1 0.517 0.522 27.163 27.426 27.295 0.186
21 Lampiran 3 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA (Lanjutan)
Analisis Kuantitatif produksi AIA gelombang V Kode
Isolat
Absorbansi
Sampel FP Sampel-Blanko
Konsentrasi
AIA (ppm) Rataan
(S) Deviasi
S1 S2 S1 S2 S1 S2
Er B2.4 0.078 0.083 1 0.037 0.042 2.220 2.420 2.320 0.141 Ptb B1.3 0.072 0.066 1 0.031 0.0252 1.980 1.740 1.860 0.170 Ptb B1.4 0.235 0.221 1 0.194 0.180 8.500 7.940 8.220 0.396
Konsentrasi (ppm) 0.2 1 5 15 25 35 45 Blanko A 530 nm 0 0 0.103 0.473 0.745 0.979 1.273 0.041
Analisis kuantitatif produksi AIA gelombang VI Kode
Isolat
Absorbansi Sampel
FP
Sampel-Blanko Konsentrasi AIA Rataan
(S) Deviasi
S1 S2 S1 S2 S1 S2
Er B3.1 0.421 0.414 1 0.33 0.323 12.714 12.470 12.592 0.172 Er B3.6 0.264 0.264 1 0.173 0.173 7.244 7.244 7.244 0.000 Er B2.8 0.690 0.682 5 0.599 0.591 110.436 110.042 109.739 0.986
22
24
Lampiran 4 Uji toleransi salinitas (Lanjutan)
25 Lampiran 5 Perhitungan konsentrasi AIA pada analisis kuantitatif produksi AIA
pada media salin
Produksi AIA pada media minimal salt dengan kandungan NaCl 0 % Kode
Produksi AIA pada media minimal salt dengan kandungan NaCl 10 % Kode
26
Lampiran 6 Konsentrasi dan kemurnian DNA isolat Er B1.7a dan isolat Er B1.3 Kode Isolat Konsentrasi DNA (ng/µL) Nisbah nilai absorbansi DNA
pada 260 nm dan 280 nm
Er B1.7a 242.8 1.94
27
28
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 25 Februari 1993 dari ayah bernama Suyatno dan ibu bernama Wrih Handayani. Penulis merupakan anak pertama dari 2 bersaudara. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 35 Jakarta dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis aktif dalam kegiatan organisasi kampus, diantaranya sebagai staff Departemen Pendamping Masyarakat (periode 2010/2011) kemudian sebagai staff Departemen Pengembangan Sumberdaya Anggota (periode 2011/2012) Lembaga Struktural Bina Desa Badan Eksekutif Mahasiswa (BEM) IPB, staff divisi Human Resource Development (HRD) Community Research and Educatioan of Biochemistry (CREB’s) IPB periode 2011/2012, dan staff Departemen Sosial dan Lingkungan Badan Eksekutif Mahasiswa (BEM) FMIPA periode 2012/2013,