PROFIL EKSPRESI GEN PENYANDI SITOKIN/KEMOKIN
PADA PBMC (
Peripheral Blood Mononuclear Cells
) MANUSIA
SEHAT YANG DIPAPAR VIRUS DENGUE
SITI WARNASIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Profil Ekspresi Gen Penyandi Sitokin/Kemokin pada PBMC (Peripheral Blood Mononuclear Cells) Manusia Sehat yang Dipapar Virus Dengue adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SITI WARNASIH. Profil Ekspresi Gen Penyandi Sitokin/Kemokin pada PBMC (Peripheral Blood Mononuclear Cells) Manusia Sehat yang Dipapar Virus Dengue. Dibimbing oleh I MADE ARTIKA dan R. TEDJO SASMONO.
Dengue merupakan salah satu penyakit arbovirus terpenting dunia. Penyakit ini disebabkan oleh virus dengue yang memiliki empat serotipe, yaitu DENV-1, DENV-2, DENV-3, dan DENV-4. Pemahaman mengenai patogenesis dengue belum sepenuhnya diketahui. Telah dilaporkan bahwa ada keterlibatan antara faktor imun pejamu dan faktor virus. Beberapa studi telah menunjukkan bahwa konsentrasi sitokin/kemokin dalam darah meningkat signifikan selama infeksi dan faktor virus terlibat pula dalam keparahan penyakit. Karakterisasi profil ekspresi gen pejamu sebagai respon terhadap infeksi serotipe virus dengue yang berbeda dapat memberikan masukan untuk pemahaman patogenesis dengue. Penelitian ini bertujuan untuk mengetahui profil ekspresi gen penyandi sitokin/kemokin sebagai protein imun yang dilepaskan oleh Peripheral Blood Mononuclear Cells (PBMC) pejamu yang telah dipapar virus dengue.
Empat serotipe virus dengue isolat Indonesia digunakan dalam penelitian ini. Keempat serotipe diwakili oleh masing-masing 3 galur virus, yang dilakukan propagasi dan pengukuran titer virusnya terlebih dahulu sebelum digunakan untuk infeksi pada sel PBMC. Sel PBMC diisolasi dari darah donor sehat dengan teknik sentrifugasi gradien ficoll. Quantitative real-time RT-PCR digunakan untuk menentukan tingkat ekspresi gen penyandi sitokin/kemokin dari sel PBMC yang terinfeksi virus dengue. Tiga gen penyandi sitokin/kemokin yaitu IP-10, IL-10, dan MIP-1 diketahui berperan dalam patogenesis penyakit dengue. Pengukuran tingkat ekspresi sitokin/kemokin menunjukkan bahwa virus dengue serotipe DENV-2 menyebabkan peningkatan ekspresi gen penyandi kemokin IP-10 dan MIP-1 pada 48 jam pasca infeksi yang lebih tinggi dibandingkan serotipe lain. Sedangkan virus dengue serotipe DENV-4 menyebabkan peningkatan ekspresi gen penyandi sitokin IL-10 dan kemokin IP-10 pada 72 jam pasca infeksi yang lebih tinggi dibandingkan serotipe lain. Ekspresi gen penyandi sitokin/kemokin lebih bergantung pada galur virus dibandingkan serotipe virus. Penelitian lebih lanjut diperlukan untuk lebih mengetahui patogenesis penyakit dengue.
SUMMARY
SITI WARNASIH. Expression Profiles of Cytokine/Chemokines-encoding Genes in PBMCs (Peripheral Blood Mononuclear Cells) of Healthy Human Infected Dengue. Supervised by I MADE ARTIKA and R. TEDJO SASMONO.
Dengue is one of the world's most important arbovirus diseases. Dengue is a disease caused by dengue virus, which have 4 serotypes i.e DENV-1, DENV-2, DENV-3, dan DENV-4. Dengue pathogenesis is not yet fully understood. It has been reported that there is involvement of the host immune factors and viral factors. Several studies have shown that concentrations of cytokines/chemokines in blood are significantly increased during infection and viral factors are also involved in disease severity. Therefore, characterization of host gene expression profiles in response to dengue virus infection of different serotypes could provide input for understanding the pathogenesis of dengue. The purpose of this research was to determine the expression profiles of the cytokines/chemokines genes (mRNA) as immune protein that are released by Peripheral Blood Mononuclear Cells (PBMCs) (host gene) upon infection of dengue viruses.
Four dengue serotypes of Indonesia isolates were used in this study. Each serotype is comprised of 3 strains. Dengue viruses were propagated and plaque assay method was used for measuring virus titer. PBMCs were isolated from blood of healthy donors by ficoll gradient centrifugation techniques. Quantitative real time RT-PCR was used to quantify expression levels of cytokine/chemokine-encoding genes from PBMCs infected with dengue virus. Three cytokine/chemokine-encoding genes i.e IP-10, IL-10, and MIP-1 known to involved in dengue pathogenesis. Measurement of the expression levels of cytokines/chemokines showed that the dengue virus serotype 2 caused an increase in the expression of IP-10 and MIP-1 genes at 48 hours post-infection, which was higher than that of other serotypes. On the other hand, dengue virus serotype 4 caused an increase in the expression of IL-10 and IP-10 genes at 72 hours post-infection, which was higher than the other serotypes. Expression of cytokine/chemokines-encoding genes is dependent of the strain of virus but not serotype-dependent. Further research is needed to better determine the pathogenesis of dengue disease.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
PROFIL EKSPRESI GEN PENYANDI SITOKIN/KEMOKIN
PADA PBMC
(
Peripheral Blood Mononuclear Cells
) MANUSIA
SEHAT YANG DIPAPAR VIRUS DENGUE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Profil Ekspresi Gen Penyandi Sitokin/Kemokin pada PMBC (Peripheral Blood Mononuclear Cells) Manusia Sehat yang Dipapar Virus Dengue
Nama : Siti Warnasih NIM : G851120041
Disetujui oleh Komisi Pembimbing
Dr Ir I Made Artika, MAppSc Ketua
R Tedjo Sasmono, PhD Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Shalawat serta salam semoga tercurah kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya hingga akhir zaman. Tesis ini berjudul : Profil Ekspresi Gen Penyandi Sitokin/Kemokin pada PBMC (Peripheral Blood Mononuclear Cells) Manusia Sehat yang Dipapar Virus Dengue. Kegiatan penelitian yang merupakan salah satu syarat memperoleh gelar Magister Sains pada Departemen Biokimia ini dilakukan dari bulan September 2013 hingga November 2014 bertempat di Laboratorium Dengue, Lembaga Biologi Molekuler Eijkman, Jakarta.
Penulis telah banyak menerima bantuan, bimbingan, dan dukungan dari berbagai pihak selama masa studi hingga penyusunan tesis ini. Pada kesempatan ini penulis ingin mengucapkan terima kasih dan penghargaan yang tak terhingga kepada:
1. Dr. Ir. I Made Artika, M.App.Sc selaku Pembimbing I dan R. Tedjo Sasmono, Ph.D sebagai Pembimbing II sekaligus Kepala Laboratorium Dengue Lembaga Eijkman atas bimbingan, waktu, tenaga yang dicurahkan kepada penulis selama masa studi, penelitian, dan penyusunan tesis.
2. Prof. Dr. drh. Maria Bintang, MS selaku Ketua Program Studi Biokimia sekaligus penguji pada ujian tesis dan Dr. Laksmi Ambarsari, MS sebagai perwakilan Program Studi Biokimia yang telah meluangkan waktu dan memberi masukan yang sangat berarti pada penulisan tesis ini.
3. Seluruh staf pengajar dan tenaga kependidikan Program Studi Biokimia yang telah memberikan banyak ilmu dan bantuan.
4. Benediktus Yohan, M.Biomed; Febrina Meutia, M.Si; Rahma Fitri Hayati, M.Si; dan dr. Winda Yulia, M.Biomed yang telah banyak memberikan bantuan dan masukan kepada penulis selama melakukan penelitian.
5. Ade Heri Mulyati, M.Si selaku Sekretaris Jurusan Kimia UNPAK yang selalu memberi motivasi agar penulis segera lulus.
6. Kedua orang tua dan keluarga atas cinta kasih dan motivasi yang selalu diberikan. Terkhusus kepada suami tercinta Fahrul Rozi, ST dan putri kesayangan kami Aqila Siti Fachrunnisa atas rasa cinta yang tulus, kesabaran, pengertian, perhatian, dan dukungan yang sepenuh hati dalam mendampingi penulis menyelesaikan pendidikan ini.
7. Teman-teman seperjuangan Biokimia 2012 atas semangat, persahabatan, silaturahmi, dan kebersamaan yang begitu indah.
8. Semua pihak yang tidak dapat penulis sebutkan satu per satu, yang secara langsung maupun tidak langsung telah memberikan bantuan kepada penulis selama melakukan penelitian dan penyusunan tesis.
Semoga karya ilmiah ini bermanfaat untuk perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 3
3 METODE 12
Bahan 12
Lokasi dan Waktu Penelitian 12
Prosedur Penelitian 13
Analisis Data 16
4 HASIL DAN PEMBAHASAN 17
5 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 29
DAFTAR PUSTAKA 29
LAMPIRAN 36
DAFTAR TABEL
1 Sekuen primer yang digunakan pada quantitative real time RT-PCR 16
2 Titer virus hasil pengukuran plaque assay 18
3 Titer virus setelah penyeragaman 21
DAFTAR GAMBAR
1 Genom virus dengue 4
2 Siklus hidup virus dengue 6
3 Patogenesis virus dengue 8
4 Galur sel yang digunakan pada penelitian 17
5 Contoh plak pada pengukuran titer virus dengan metode plaque assay 18 6 Proses isolasi PBMC dengan sentrifugasi gradien ficoll 19 7 Hasil plak uji keberadaan virus dengue pada sel PBMC 20 8 Laju pertumbuhan setiap galur virus dengue dengan uji ELISA 22 9 Laju pertumbuhan setiap serotipe virus dengue dengan uji ELISA 23
10 Deteksi gen sitokin/kemokin dengan RT-PCR 23
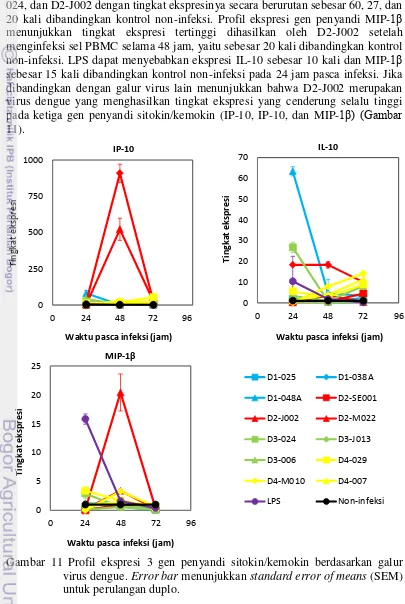
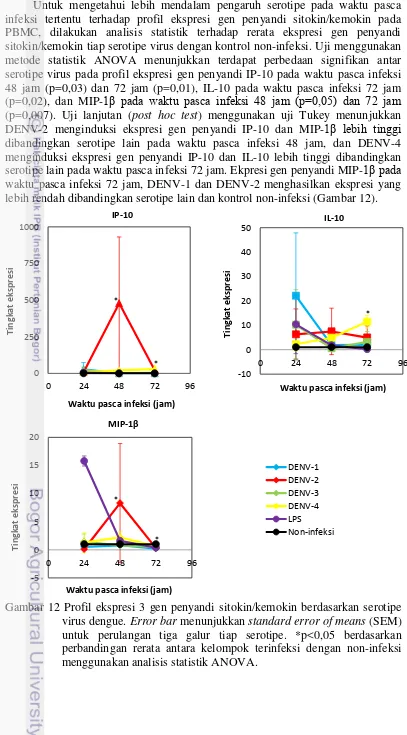
11 Profil ekspresi 3 gen sitokin/kemokin setiap galur virus dengue 25 12 Profil ekspresi 3 gen sitokin/kemokin setiap serotipe virus dengue 26
DAFTAR LAMPIRAN
1 Reaksi dan kondisi RT-PCR untuk pembuatan cDNA sel PBMC yang
dipapar virus dengue 37
2 Reaksi dan kondisi PCR untuk deteksi gen sitokin/kemokin dan -aktin 38 3 Kondisi reaksi quantitative real time RT-PCR untuk pengukuran
ekspresi gen sitokin/kemokin 39
4 Hasil pengukuran RNA total dengan Spektrofotometer Nanodrop 40 5 Volume RNA dan nuclease-free water pada reaksi RT-PCR 41 6 Nilai OD450 pada pengukuran protein NS1 dengan ELISA reader 42 7 Nilai CT dan Tm pada pengukuran dengan quantitative real time
RT-PCR 43
8 Hasil perhitungan ekspresi gen sitokin/kemokin pada PBMC yang dipapar virus dengue (berdasarkan galur virus) 48 9 Hasil perhitungan ekspresi gen sitokin/kemokin pada PBMC yang
dipapar virus dengue (berdasarkan serotipe) 49
1
1
PENDAHULUAN
Latar Belakang
Penyakit dengue ialah penyakit yang disebabkan oleh virus dengue yang ditularkan melalui gigitan nyamuk Aedes aegypti dan Aedes albopictus (Gubler 1998). Penyakit dengue merupakan penyakit yang penyebarannya paling cepat di antara penyakit dengan vektor nyamuk lainnya, dengan 50 sampai 100 juta kasus Demam Dengue (DD) dan 500.000 kasus Demam Berdarah Dengue (DBD)/ Sindrom Renjatan Dengue (SRD) setiap tahun (Savage et al. 1998; Sariol et al. 2007). Menurut data WHO diperkirakan lebih dari 50 juta kasus infeksi virus dengue terjadi tiap tahunnya dengan jumlah rawat inap sebesar 500.000 dan angka kematian lebih dari 20.000 jiwa di dunia. Tahun 2006 di Indonesia didapatkan laporan kasus dengue sebesar 106.425 orang dengan tingkat kematian 1,06 %. Di Amerika Selatan, dari awal tahun 2013 sampai bulan Juni 2013 telah terjadi 868.653 kasus dengue, 8.406 kasus dengue berat, dan 346 kematian akibat dengue (Case Fatality Rate/CFR sebesar 0,04 %) (PAHO/WHO 2013).
Masalah penyakit dengue bisa bertambah karena virus tersebut dapat masuk bersamaan dengan infeksi penyakit lain, seperti flu atau demam tifoid. Penyakit DBD disebabkan oleh virus dengue dengan serotipe DENV-1, DENV-2, DENV-3, DENV-4 (Henchal dan Putnak 1990). Dalam masing-masing serotipe, terdapat pula pembagian galur virus berdasarkan subtipe atau genotipe (Holmes dan Twiddy 2003).
Patogenesis dengue hingga kini masih belum dipahami secara menyeluruh. Hal ini dikarenakan mekanisme yang menyebabkan manifestasi klinis dengue bersifat multifaktorial. Faktor utama yang menjadi penyebab adalah faktor pejamu dan faktor virus (Halstead 2008).
Patogenesis infeksi dengue dan keterlibatan respon imun yang terjadi baik pada fungsi perlindungan maupun pada mekanisme terjadinya penyakit terbukti sangat kompleks dan sulit dipahami (Stephenson 2005). Beberapa mekanisme telah dikaitkan dengan manifestasi dengue berat meliputi penyakit kompleks imun, mediasi sel T, antibodi yang bereaksi silang dengan endotelium vaskuler, enhancing antibodies, komplemen, dan produknya, berbagai mediator terlarut termasuk sitokin, dan virulensi virus. Saat ini mekanisme yang sering dianut adalah enhancing antibodies dan sel T memori pada infeksi dengue sekunder yang berakibat terjadinya badai sitokin (Basu dan Chaturvedi 2008; Pang et al. 2007).
Beberapa studi telah menunjukkan bahwa konsentrasi sitokin dan mediator lain meningkat signifikan selama infeksi dan diasosiasikan dengan keparahan penyakit (Fink et al. 2007). Kadar plasma interleukin-1 beta (IL-1 ), IL-2, IL-4, IL-6, IL-7, IL-8 , IL-10, IL-13, IL-18, tumor growth factor-1 beta (TGF-1 ), tumor necrosis factor alpha (TNF-α), dan interferon gamma (IFN- ) telah dibuktikan meningkat pada pasien dengan infeksi dengue berat, terutama pada pasien SRD (Bozza et al. 2008; Martina et al. 2009).
2
infeksi dengue terhadap berbagai galur sel primer (primary cell lineages)maupun established cell lines (Noisakran et al. 2010). Beberapa jenis sel yaitu peripheral blood mononuclear cells (PBMC)dari pasien dengue, monosit, makrofag, sel mast, umbilical vein endothelial cells (HUVEC),dan sel human primary hepatocytes telah dipaparkan dengan virus dengue dan menunjukkan ekspresi berbagai sitokin (Avirutnan et al. 1998; Warke et al. 2003; Huang et al. 2000; Chen dan Wang 2002; King et al. 2002; Becerra et al. 2009; Dewi et al. 1998) .
Beberapa penelitian telah mengindikasikan bahwa bukan hanya faktor pejamu yang terlibat dalam patogenesis infeksi dengue, tetapi faktor virus pun menentukan hal tersebut (Rico-Hesse 1990; Rico-Hesse et al. 1997; Leitmeyer et al. 1999; Pryor et al. 2001). Namun, sebagian besar penelitian hanya difokuskan pada infeksi dengue dari pasien yang telah terinfeksi. Oleh karena itu, maka perlu melakukan penelitian secara in vitro atau ex vivo dengan melakukan infeksi berbagai galur virus terhadap kultur primer PBMC manusia sehat yang belum pernah terinfeksi virus dengue.
Pada penelitian sebelumnya, Yohan (2011) melakukan pengukuran kadar 26 sitokin/kemokin dalam supernatan galur sel A549 (sel model in vitro) yang dipapar dengan berbagai serotipe/genotipe virus dengue galur Makasar dan virus dengue galur referensi memperlihatkan peningkatan ekspresi tujuh sitokin/kemokin, yaitu: Eotaxin, G-CSF, IFN-αβ, IL-6, IL-8, IL-15, dan IP-10. Beberapa galur virus menginduksi sitokin dan kemokin dengan jumlah yang lebih rendah dibandingkan dengan galur yang lain. Hasil penelitian tersebut menunjukkan profil ekspresi sitokin/kemokin pada galur sel model A549 in vitro lebih bergantung pada galur virus daripada serotipe/genotipe tertentu.
Hasil penelitian tersebut menjadi masukan bahwa ada perbedaan ekspresi gen pejamu pada jalur in vitro. Tetapi pada penelitian itu belum dilakukan pengukuran terhadap profil ekspresi pada masing-masing sitokin/kemokin. Oleh karena itu, pada penelitian ini diteliti profil ekspresi masing-masing sitokin/kemokin yang terjadi pada jalur ex vivo dengan menggunakan PBMC yang diisolasi dari individu sehat.
Profil ekspresi sitokin/kemokin dapat dilakukan dengan mengukur tingkat protein maupun gen penyandinya (mRNA). Rathakrishnan et al. 2012 mengukur profil ekspresi sitokin pada tingkat protein dengan menggunakan uji bead berlabel fluoresensi. Pengukuran profil ekspresi sitokin pada tingkat protein pada tingkatan tertentu kurang valid, hal ini dikarenakan protein (sitokin) tertentu akan selalu naik levelnya karena akan diekspresikan secara terus menerus. Selain itu protein bersifat stabil, yaitu setelah beberapa hari masih ada sehingga sulit untuk menentukan profil ekspresinya. Oleh karena itu, pada penelitian ini diteliti profil ekspresi sitokin pada tingkat gen penyandinya (mRNA) dengan menggunakan quantitative real time RT-PCR.
3
Perumusan Masalah
Patogenesis penyakit dengue belum dapat dijelaskan dengan pasti. Berbagai hasil penelitian menunjukkan bahwa ada banyak faktor yang menyebabkan berat-ringannya penyakit diantaranya tergantung pada faktor virus dan host/pejamu.
Penggunaan sel model infeksi in vitro untuk mengkarakteristik pengaruh infeksi virus dengue terhadap respon imun telah diteliti sebelumnya. Berdasarkan penelitian tersebut disimpulkan bahwa terjadi peningkatan ekspresi sitokin/kemokin yang dapat digunakan sebagai faktor prediksi untuk menyatakan tingkat keparahan penyakit dengue. Demikian pula model infeksi pada jalur ex vivo menunjukan hasil yang sama. Berdasarkan pada penelitian-penelitian tersebut, ekspresi sitokin/kemokin kebanyakan diteliti pada tingkat protein dan belum diteliti profil ekspresi sitokin/kemokin pada tingkat mRNA. Oleh karena itu, perlu dilakukan studi untuk mempelajari pengaruh paparan berbagai serotipe virus dengue terhadap profil ekspresi mRNA sitokin/kemokin pejamu.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mengetahui pengaruh faktor virus terhadap respon imun pejamu dengan mengkarakterisasi profil ekspresi gen penyandi (mRNA) sitokin/kemokin PBMC manusia sehat yang dipapar berbagai galur virus dengue yang dapat dijadikan sebagai penanda keparahan penyakit.
Tujuan khusus penelitian adalah membandingkan kinetika profil ekspresi gen penyandi sitokin/kemokin PBMC manusia sehat antar galur dan serotipe virus dengue dan mengetahui hubungan antara laju pertumbuhan virus dengue pada PBMC dengan profil ekspresi gen penyandi sitokin/kemokinnya.
Manfaat Penelitian
Manfaat penelitian ini diharapkan dapat memberikan masukan mengenai pemahaman patogenesis penyakit dengue.
2
TINJAUAN PUSTAKA
Virus Dengue
4
Virus dengue merupakan salah satu virus yang termasuk dalam famili Flaviviridae. Virus ini memiliki empat serotipe, yaitu: DENV-1, DENV-2, DENV-3, dan DENV-4. Virion dengue merupakan partikel sferis dengan diameter nukleokapsid 30 nm dan ketebalan selubung 10 mm, sehingga diameter virion kira-kira 50 nm. Genom virus dengue terdiri atas asam ribonukleat berutas tunggal, panjangnya kira-kira 11 kilobasa. Genom Flavivirus pada Gambar 1 terdiri atas satu open reading frame (ORF) yang mengkode poliprotein tunggal
yang diapit oleh 5’ dan γ’ non-coding region (NCR). Urutan gen penyandi
poliprotein tersebut adalah 5’ -C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5-γ’. Poliprotein tunggal tersebut terdiri atas tiga protein struktural dan tujuh protein non-struktural. Tiga protein struktural tersebut yaitu C (capsid), prM/M (membrane), dan protein E (Envelope). Sementara itu, tujuh protein non-struktural terdiri atas NS1, NS2A, NS2B, NS3, NS4A, NS4B, dan NS5 (Henchal dan Putnak 1990; Gubler 1998).
Gambar 1 Genom virus dengue. Proses kotranslasi dan proteolisis menghasilkan 3 protein struktural dan 7 protein non-struktural. UTR, untranslated region. Dikutip dari Guzman et al. 2010.
Protein C merupakan protein kecil dengan berat molekul 6-12 kDa yang tersusun atas 112 sampai 127 asam amino. Protein C merupakan protein virus pertama yang disintesis selama translasi dan memiliki muatan positif kuat karena mengandung banyak residu asam amino lisin (lys) dan arginin (arg). Sifat protein C tersebut dipercaya berperan untuk menetralkan muatan negatif pada molekul RNA virus. Protein prM merupakan suatu glikoprotein dengan berat molekul 18,1-19,1 kDa dan merupakan prekursor untuk protein M. Protein M memiliki berat molekul 7-9 kDa yang tersusun atas 75 asam amino dan diduga berperan untuk mengontrol aktivitas fusi (Henchal dan Putnak 1990; Chang 1997).
Protein E yang berupa glikoprotein, merupakan komponen protein utama pada permukaan virus dan merupakan antigen determinan utama pada partikel virus. Berat molekul protein E yaitu 55-60 kDa yang tersusun atas 494-501 asam amino. Protein E mempunyai epitop penting yang berhubungan dalam beberapa aktivitas biologis, antara lain ikatan dengan reseptor, induksi antibodi spesifik untuk proses netralisasi sebagai perlindungan respon imun, hemaglutinasi eritrosit, mediasi fusi antara virus dan membran yang spesifik pada pH asam, dan perakitan virus (Chang 1997; Lindenbach et al. 2007).
5 Berdasarkan Avirutnan et al. (2007), diketahui NS1 terlarut dalam plasma yang disekresikan oleh sel yang terinfeksi akan berikatan kuat pada sel endotelial dan fibroblas yang tak terinfeksi. Antigen NS1 yang berikatan pada sel endotelial yang tidak terinfeksi tersebut menginduksi terbentuknya kompleks imun dan dihipotesiskan berperan dalam mekanisme kebocoran plasma yang terjadi selama infeksi virus dengue yang berat. Hingga saat ini, mekanisme pengikatan NS1 dengan membran plasma masih menjadi perdebatan.
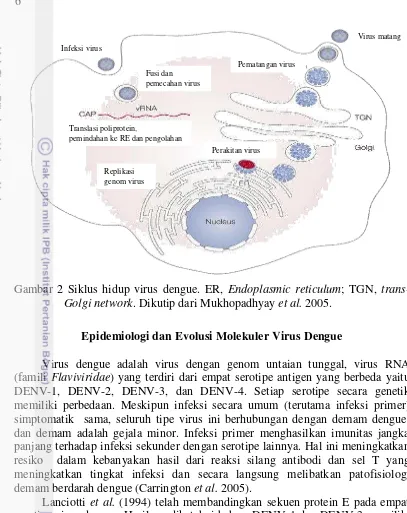
Siklus hidup virus dengue ditunjukkan pada Gambar 2, virus dengue memasuki sel inang dengan cara berikatan pada reseptor spesifik permukaan sel inang. Virus kemudian masuk ke dalam sel inang melalui proses endositosis yang dimediasi reseptor. Kondisi lingkungan yang asam pada endosom memicu dimerisasi yang bersifat irreversibel pada protein E, sehingga menghasilkan fusi antara envelope virus dan membran sel. Nukleokapsid kemudian dilepaskan ke sitoplasma dan terjadi disosiasi antara protein C dan RNA genom, serta replikasi RNA genom (Mukhopadhyay et al. 2005).
Pada saat genom dilepaskan ke sitoplasma, +ssRNA virus ditranslasi menjadi poliprotein tunggal oleh protease virus dan inang. Replikasi genom terjadi di membran intraseluler, sedangkan perakitan partikel virus terjadi di permukaan retikulum endoplasma (RE). Partikel virus yang belum matang dibentuk di dalam lumen RE. Partikel yang tersusun atas protein E dan prM, membran lipid, dan nukleokapsid tersebut tidak dapat menginduksi fusi dengan sel inang, sehingga bersifat non-infeksius karena protein prM memerlukan proses lebih lanjut. Partikel kemudian diteruskan ke trans Golgi dan terjadi pemecahan prM yang menyebabkan partikel menjadi matang dan bersifat infeksius (Qi et al. 2008).
Partikel subviral juga dibentuk di RE tetapi hanya mengandung glikoprotein dan membran, tidak memiliki protein C dan RNA genom, sehingga partikel tersebut bersifat non-infeksius. Virus yang sudah matang dan partikel subviral dilepaskan dari sel inang melalui proses eksositosis (Mukhopadhyay et al. 2005).
6
Gambar 2 Siklus hidup virus dengue. ER, Endoplasmic reticulum; TGN, trans-Golgi network. Dikutip dari Mukhopadhyay et al. 2005.
Epidemiologi dan Evolusi Molekuler Virus Dengue
Virus dengue adalah virus dengan genom untaian tunggal, virus RNA (famili Flaviviridae) yang terdiri dari empat serotipe antigen yang berbeda yaitu DENV-1, DENV-2, DENV-3, dan DENV-4. Setiap serotipe secara genetik memiliki perbedaan. Meskipun infeksi secara umum (terutama infeksi primer) simptomatik sama, seluruh tipe virus ini berhubungan dengan demam dengue, dan demam adalah gejala minor. Infeksi primer menghasilkan imunitas jangka panjang terhadap infeksi sekunder dengan serotipe lainnya. Hal ini meningkatkan resiko dalam kebanyakan hasil dari reaksi silang antibodi dan sel T yang meningkatkan tingkat infeksi dan secara langsung melibatkan patofisiologi demam berdarah dengue (Carrington et al. 2005).
Lanciotti et al. (1994) telah membandingkan sekuen protein E pada empat serotipe virus dengue. Hasilnya diketahui bahwa DENV-1 dan DENV-3 memiliki hubungan evolusi yang lebih dekat dibandingkan dengan serotipe lainnya.
Keragaman genetik bersifat lebih terbatas dalam setiap serotipe tetapi masih memungkinkan terdeteksinya kluster dari varian, yang disebut dengan genotipe (Holmes dan Twiddy 2003; Rico-Hesse et al. 1997). Keragaman genetik virus dengue menyebabkan sulit untuk mengevaluasi virulensi dan transmisi/penyebaran relatif dari setiap genotipe meskipun kedua faktor tersebut merupakan determinan penting untuk epidemiologi (Rico-Hesse 2010). Perbandingan antara genotipe virus dan informasi epidemiologi dapat mengamati hubungan antara laju transmisi yang lebih tinggi dan peningkatan insiden infeksi dengue berat (DBD dan SRD) dengan kelompok virus tertentu (Rico-Hesse et al. 1997).
Virus matang
Pematangan virus
Perakitan virus Infeksi virus
Fusi dan pemecahan virus
Replikasi genom virus Translasi poliprotein,
7 Genotipe tertentu memiliki laju transmisi yang lebih tinggi secara global di dunia dan dapat menggantikan genotipe lain pada beberapa benua. Demikian pula beberapa genotipe diasosiasikan dengan DBD sementara genotipe lain tampaknya hanya menyebabkan DD (Cologna et al. 2005).
Patogenesis Virus Dengue
Virus dengue dapat menyebabkan penyakit melalui dua mekanisme. Mekanisme pertama yaitu virus menginfeksi kemudian membunuh sel pada organ target. Infeksi virus dengue menyebabkan efek simptomatik yang mengakibatkan malfungsi organ. Mekanisme kedua yaitu virus tidak menyebabkan efek simptomatik yang parah tetapi respon imun inang terhadap virus menyebabkan malfungsi organ. Secara normal, respon imun bertujuan sebagai mekanisme proteksi inang terhadap keberadaan virus. Namun, respon imun pada kondisi dan tingkat tertentu dapat menyebabkan penyakit. Hal tersebut bergantung pada jenis organ yang terkena dampak respon imun dan tingkat respon imun. Peristiwa saat respon imun dapat menyebabkan penyakit disebut dengan imunopatogenesis (Kurane dan Ennis 1997).
Vaughn et al. (2000) membuktikan bahwa kecepatan replikasi virus dengue yang tinggi dalam tubuh pasien berkorelasi positif dengan peningkatan keparahan penyakit dengue. Virus dengue terutama akan menginfeksi sel dendritik lokal, yaitu sel Langerhans dan keratinosit setelah inokulasi ke dalam dermis (Martina et al. 2009; Fink et al. 2006). Sel Langerhans mengekspresikan DC-SIGN (dendritic cell specific ICAM3-grabbing non-integrin receptor), suatu molekul lektin yang mengikat virus dengue dengan cara berinteraksi dengan glikoprotein E virus (Navvaro-Sanchez et al. 2003). DC-SIGN memediasi proses masuknya virus dan tahapan ini memungkinkan berlangsungnya tahapan selanjutnya, yaitu infeksi dan replikasi virus, serta lepasnya virion baru dari sel. Migrasi sel Langerhans ke nodus limfatik regional juga memungkinkan presentasi antigen virus ke sel T.
Virus dengue menyebar juga melalui darah (viremia primer) dan menginfeksi makrofag jaringan pada beberapa organ, terutama makrofag pada limpa. Efisiensi replikasi virus pada sel dendritik, monosit, makrofag, sel endotelium, sel stromal bone marrow, dan sel hati secara kolektif menentukan viral load dalam darah. Viral load ini merupakan faktor resiko penting untuk pembentukan manifestasi penyakit berat (Martina et al. 2009). Infeksi virus pada makrofag, hepatosit, dan sel endotelium mempengaruhi kondisi hemostatik dan respon imun terhadap virus dengue. Sel terinfeksi sebagian besar mati melalui proses apoptosis dan sebagian kecil melalui mekanisme nekrosis. Nekrosis mengakibatkan dihasilkannya produk-produk toksik yang mengaktivasi koagulasi dan sistem fibrinolitik. Hemopoiesis juga mengalami supresi yang bergantung pada tingkat infeksi pada sel stromal bone marrow dan kadar IL-6, IL-8, IL-10, dan IL-18 (Martina et al. 2009; Nachman dan Raffi 2008).
8
menyebabkan peningkatan infeksi virus terhadap antigen presenting cells (APC) sehingga kemudian mengakibatkan peningkatan viral load. Mekanisme tersebut dikenal sebagai antibody-dependent enhancement (ADE) (Halstead dan O’Rourke 1977).
ADE terjadi ketika antibodi bersifat heterotipe dan non-netralisasi terdapat pada pejamu dan berasal dari infeksi virus primer. Antibodi ini kemudian berikatan dengan partikel virus dengue yang berasal dari infeksi sekunder oleh virus dari serotipe yang berbeda. Antibodi tersebut tidak dapat menetralisasi virus baru yang menginfeksi dan sebaliknya kompleks antara antibodi dan virus yang
terbentuk melekat ke reseptor Fc R pada monosit yang bersirkulasi. Fc R tipe I
maupun tipe II memediasi terjadinya ADE (Littaua et al. 1990). Perlekatan kompleks virus-antibodi pada Fc R memfasilitasi infeksi pada sel-sel yang semula tidak terinfeksi saat tidak adanya antibodi. Hasil akhir dari proses ini adalah terjadinya replikasi virus yang mengarah kepada potensi terbentuknya manifestasi penyakit yang lebih berat (Whitehead et al. 2007).
Viral load yang tinggi menyebabkan stimulasi berlebih terhadap sel T yang bersifat reaktif silang. Sel-sel tersebut menghambat bersihan (clearance) virus dan memproduksi sitokin dan mediator terlarut lainnya dalam jumlah besar (badai sitokin) yang mengakibatkan perubahan pada sel endotelium dan mengarahkan pada koagulopati dan kebocoran plasma (karakteristik pada SRD) seperti terlihat pada Gambar 3 (Bozza et al. 2008). Tingkat produksi sitokin dan mediator terlarut dalam serum pasien dapat dikorelasikan dengan tingkat keparahan penyakit akibat infeksi dengue (Bozza et al. 2008; Dejnirattisai et al. 2008).
Gambar 3 Patogenesis virus dengue. DENV, virus dengue; Mono/DC, monosit/sel dendritik; NK, sel Natural Killer; CTL, sel cytotoxic T lymphocyte; DIC, disseminated intravascular coagulation. Dikutip dari Bozza et al. 2008.
Profil sitokin yang diidentifikasi pada pasien dengan infeksi dengue dapat menjadi alat bermanfaat untuk karakterisasi pola respon imun dan dapat membimbing dalam identifikasi kelompok pasien dengan resiko untuk berkembang ke arah manifestasi klinis berat (Dejnirattisai et al. 2008; Srikiatkhachorn dan Green 2010). Konsentrasi berbagai sitokin dan mediator lain
9 meningkat secara signifikan selama infeksi dan diasosiasikan dengan keparahan penyakit (Fink et al. 2006).
Peripheral Blood Mononuclear Cells (PBMC)
Peripheral Blood Mononuclear Cells (PBMC) adalah sel darah putih yang memiliki inti tunggal berbentuk bulat, terdiri atas sel limfosit T, sel limfosit B, sel natural killer (NK), dan monosit (Delves et al. 2006). Sel-sel ini merupakan komponen penting dari sistem kekebalan tubuh yang terlibat dalam imunitas humoral dan seluler. Sel mononuklear banyak digunakan dalam penelitian dan aplikasi klinis seperti dalam bidang mikrobiologi, virologi, onkologi, pengembangan vaksin, transplantasi dan biologi regeneratif, dan toksikologi.
Jumlah PBMC darah vena manusia sekitar 1,27 ± 0,4 juta sel/ml darah menggunakan sentrifugasi gradien Ficoll dengan viabilitas 97,1 % ± 1,0 % (Nilsson et al. 2008). Beberapa penelitian melaporkan bahwa virus dengue dapat terdeteksi dalam kelompok sel ini (Scott et al. 1980).
Metode Pengukuran Protein NS1
Replikasi virus dengue dapat diketahui dengan mengukur konsentrasi antigen NS1. Deteksi antigen NS1 virus dengue umumnya dilakukan dengan metode enzyme-linked immunosorbent assay (ELISA) dan uji dot blot. Konsentrasi antigen NS1 yang tinggi dapat membentuk kompleks imun yang dapat dideteksi dalam serum pasien pada fase akut, baik pada infeksi primer maupun sekunder, hingga 9 hari setelah gejala awal (Shu dan Huang 2004).
ELISA merupakan metode yang umum digunakan karena mampu diaplikasikan pada jumlah sampel banyak dengan volume sampel yang sedikit, seperti pada kasus dengue (Wang 2006). Uji ELISA relatif lebih sederhana dan ekonomis. Namun, uji tersebut tidak mampu memperbanyak antigen organisme infeksius seperti pada teknik kultur, atau asam nukleat seperti pada PCR. Oleh karena itu, diagnosis dengan uji ELISA memiliki sensitifitas lebih rendah dibandingkan teknik lainnya (Campbell dan Landry 2006).
Uji ELISA merupakan teknik pengujian serologi yang didasarkan pada interaksi atau ikatan spesifik antara antigen dan antibodi. Interaksi antibodi dan antigen tersebut ditandai menggunakan suatu enzim yang terikat pada antibodi atau antigen spesifik. Uji ELISA memiliki beberapa jenis diantaranya direct ELISA, indirect ELISA, sandwich ELISA dan competitive ELISA. Namun sandwich ELISA memiliki sensitivitas tertinggi di antara jenis ELISA lainnya tetapi membutuhkan waktu dan biaya yang lebih banyak (Campbell dan Landry 2006; Wang 2006).
10
Pada sandwich ELISA mikrotiter plate diisi dengan antibodi penangkap sehingga antibodi tersebut menempel pada dinding mikrotiter yang telah dilapisi oleh polistiren atau polivinil. Antigen kemudian ditambahkan sehingga akan membentuk kompleks antibodi-antigen, lalu ditambahkan antibodi sekunder yang telah dilabel dengan enzim. Substrat organik kemudian ditambahkan sehingga akan terlihat perubahan warna substrat pada sampel yang positif mengandung antigen, tetapi tidak pada sampel negatif. Intensitas perubahan warna tersebut mengindikasikan banyaknya antigen yang terdapat pada sampel dan dikuantifikasi menggunakan spektrofotometer atau plate reader (Murphy et al. 2008; Kudesia dan Wreghitt 2009).
Sitokin/Kemokin pada Infeksi Virus Dengue
Sitokin adalah glikoprotein nonstruktural berukuran kecil yang berfungsi sebagai protein caraka (messenger proteins) antar sel dan terlibat dalam berbagai proses seperti pertumbuhan sel, diferensiasi sel, perbaikan, dan pemodelan ulang (remodeling) jaringan, dan pengaturan respon imun. Sitokin dapat berfungsi sebagai biomarker potensial untuk kesehatan dan penyakit. Perubahan kadar sitokin dapat berguna sebagai acuan untuk intervensi terapeutik. Hal tersebut menjadikan deteksi mediator terlarut ini telah menjadi perhatian dan fokus penelitian selama empat dekade belakangan (de Jager dan Rijkers 2006).
Sitokin pada awalnya disebut sebagai faktor limfosit terlarut atau limfokin. Penamaan ini berdasarkan pada asal dari faktor tersebut (limfosit) dan fungsinya (kinesis, yang berarti pergerakan atau perubahan) (Dumonde et al. 1969). Interleukin adalah suatu protein bagian dari keluarga protein sitokin dengan bobot molekul antar 4-50 kDa. Bagian dari keluarga interleukin adalah sitokin kemoatraktif (chemoattractive cytokine) atau kemokin, yang memiliki bobot molekul 4-16 kDa (de Jager dan Rijkers 2006).
Produksi sitokin yang terjadi akibat infeksi virus dengue pada sel imun memiliki kontribusi pada terjadinya manifestasi klinis penyakit. IL-10 (interleukin 10), IP-10 (interferon inducible protein 10), dan MIP-1 (macrophage inflammatory protein 1 beta) adalah sitokin/kemokin yang diduga memiliki hubungan dengan patogenesis penyakit dengue. Ketiga sitokin/kemokin ini bersumber dari sel makrofag yang merupakan bagian dari sel PBMC (Abbas et al. 2012).
Kuantifikasi sitokin pada tingkat protein kadang tidak memungkinkan karena sampel jaringan yang tersedia untuk analisis terlalu sedikit, oleh karena itu dapat dilakukan analisis messenger RNA (mRNA). Pada publikasi yang berbeda telah dijelaskan bahwa ada korelasi yang baik antara sitokin tingkat mRNA yang diukur dengan real-time PCR dan tingkat protein yang diukur dengan enzyme-linked immunosorbent assay (ELISA) (Overbergh et al. 2003).
Pengukuran mRNA sitokin dapat dilakukan dengan berbagai metode seperti Northern Blot, RNase protection assays, in situ hybridization dan quantitative reverse transcription–polymerase chain reaction (RT–PCR). RT-PCR kuantitatif (quantitative real time RT-PCR) adalah satu-satunya metode yang memberikan sensitivitas dan spesifisitas yang baik untuk mengukur ekspresi mRNA dalam jumlah yang rendah (Yin et al. 2001).
11
Quantitative Real Time RT-PCR
Quantitative real time reverse transcriptase PCR (RT-PCR), yang merupakan inovasi terbaru di bidang teknologi PCR, memberikan metode yang sensitif, reproducible, dan akurat untuk menentukan sitokin tingkat mRNA pada jaringan atau sel. Metode ini didasarkan pada deteksi sinyal fluoresensi yang diproduksi dan dipantau selama proses amplifikasi yang akan membentuk grafik, tanpa perlu adanya proses pasca-PCR (elektroforesis) (Overbergh et al. 2003).
Quantitative real time RT-PCR adalah metode pilihan untuk pengukuran ekspresi sitokin atau growth factor yang cepat dan reproducible dalam sampel kecil. Metode deteksi fluoresensi untuk memantau real time PCR yaitu dengan probe fluorogenik berlabel reporter dan quencher dye, seperti probe Taqman atau Beacons dan pewarna SYBR Green I pengikat dsDNA (Yin et al. 2001).
Cara kerja quantitative real time RT-PCR mengikuti prinsip umum reaksi PCR, utamanya adalah DNA yang telah diamplifikasi dihitung setelah diakumulasikan dalam reaksi secara real time sesudah setiap siklus amplifikasi selesai. Terdapat 2 (dua) metoda kuantifikasi yang umum digunakan antara lain : (1) menggunakan zat pewarna fluoresensi yang akan terinterkalasi dengan DNA rantai ganda (dsDNA) misalnya SYBR Green I, dan (2) probe (penanda) yang berasal dari hasil modifikasi DNA oligonukleotida yang akan berpendar (flourensensi) ketika terhibridisasi dengan DNA komplemen, misalnya probe FRET (hibridisasi) dan probe TaqMan. Dalam setiap pengamatan proses PCR, sinyal fluoresensi yang dipancarkan akan meningkat secara proporsional setiap siklus PCR telah berhasil dilakukan sejalan dengan bertambahnya produk DNA (DNA hasil amplifikasi) yang dihasilkan (Wong dan Medrano 2005, Overbergh et al. 2003).
Metoda pertama adalah metoda yang paling mudah dengan menggunakan zat pewarna yang nantinya akan berikatan dengan setiap DNA untai ganda (dsDNA) yang dihasilkan dari reaksi PCR. Zat pewarna yang umum digunakan adalah SYBR Green I. Zat pewarna ini pada kondisi bebas tidak berikatan dengan dsDNA memiliki energi/sinyal flouresensi yang rendah meskipun distimulasi oleh sinar yang ditembakkan oleh alat. Pada saat terbentuk dsDNA sebagai hasil PCR, SYBR Green I akan berikatan dengan dsDNA membentuk suatu kompleks DNA-dye dan secara simultan akan meningkatkan sinyal fluoresensi pada saat disinari cahaya oleh alat. Penggunaan SYBR Green I menjadi populer pada awalnya karena harganya relatif murah, cukup menggunakan 1 jenis primer, dan dapat digunakan untuk hampir seluruh jenis analisis. Hanya saja, saat ini penggunaan SYBR Green I semakin kurang diminati. Sebab, SYBR Green berikatan
dengan ’sembarang’ dsDNA misalnya dengan primer-dimer maupun hasil PCR yang tidak sesuai (Wong dan Medrano 2005, Overbergh et al. 2003).
12
3
METODE
Bahan
Sel PBMC manusia sehat
Sel PBMC berasal dari manusia sehat. Pengambilan darah vena dilakukan secara aseptik. Kriteria manusia sehat disini yaitu yang tidak sedang mengalami gejala penyakit dengue (tetapi pernah terinfeksi) maupun gejala penyakit lainnya, tidak memiliki riwayat penyakit autoimun, dan suhu badan diukur normal 36,5 - 37,5°C.
Virus dengue
Pada penelitian ini digunakan virus dengue isolat Indonesia dari empat serotipe virus dengue (DENV-1, DENV-2, DENV-3, DENV-4) dengan masing-masing 3 isolat yang berbeda per serotipe (Tabel 2). Virus yang digunakan merupakan perwakilan dari keseluruhan virus hasil isolasi dari serum pasien demam di beberapa Rumah Sakit di Indonesia yang berpartisipasi dalam studi epidemiologi dengue di Laboratorium Dengue, Lembaga Biologi Molekular Eijkman. Persetujuan etik untuk studi telah diperoleh dari Komisi Etik Lembaga Biologi Molekular Eijkman yang mendukung pemberian kelaikan etik. Setiap sampel telah dilengkapi dengan informed consent. Semua virus adalah koleksi Laboratorium Dengue, Lembaga Eijkman.
Bahan lain
Medium yang digunakan adalah 1X RPMI 1640 mengandung 2 mM L-glutamine dan disupplementasi 10 % (v/v) Fetal Bovine Serum/FBS, 100 U/mL Penicillin dan 100 µg/mL Streptomycin (disebut medium pertumbuhan) [Gibco-Invirogen]; 1X RPMI 1640, 2 % FBS, 1 % Penicillin/Streptomycin (disebut medium inokulasi) [Gibco-Invitrogen]; dan 1 % methyilcellulose overlay [Merck], 2 % FBS [Gibco]. Bahan lain adalah ficoll [Histopaque, Sigma Aldrich]; 1X 0,25 % Tripsin-EDTA [Gibco], 1X Dulbeccos Phosphate Buffer Saline (D-PBS) pH 7,4 tanpa CaCl2 dan MgCl2 [Gibco], LPS (lipopolisakrida); 3,7 % formalin
[AppliChem]; 1 % crystal violet [Sigma]; trypan blue [Sigma]; ELISA NS1 kit [Panbio]; Magna Pure RNA Isolation kit [Roche]; Superscript III Reverse Transcriptase [Invitrogen]; primer Oligo dT [Promega]; Taq DNA polimerase [Roche]; 1 % agarosa [Bio-Rad]; 200 ng/ml ethidium bromide [Sigma]; marka DNA 50 bp (Invitrogen); primer forward dan reverse 4 gen (tabel 1); SYBR Green select reaction mix [Applied Biosystems]; 70 % etanol [Merck]; dan 10 % bleach [Vesphene]. Galur sel yang digunakan adalah sel C6/36 dan sel BHK21 (baby hamster kidney).
Lokasi dan Waktu Penelitian
13
Prosedur Penelitian
Propagasi/perbanyakan virus dengue
Propagasi/perbanyakan virus dengue berdasarkan metode pada Yohan 2011. Perbanyakan virus menggunakan kultur sel dilakukan dengan inokulasi 200 µ L serum pada monolayer sel C6/36 dalam flask T-25 (Corning). Serum inokulan disiapkan dalam 2 mL medium 1X RPMI 1640 dengan suplementasi 2 % Fetal Bovine Serum (FBS), 2 mM l-glutamin, 100 U/mL Penisilin, dan 100 µg/mL Streptomisin kemudian ditambahkan ke monolayer sel. Setelah periode inkubasi pada suhu 28°C selama 1 jam, sel dicuci dengan 1X Dulbeccos Phosphate Buffer Saline (D-PBS) pH 7,2; tanpa kandungan ion Mg2+ dan Ca2+ dan inokulan diganti dengan medium inokulasi baru. Inkubasi dilanjutkan hingga terdeteksi cytopathic effect (CPE) atau selama 9 dan 13 hari CPE tidak terdeteksi. Dengan mikroskop cahaya perbesaran total 100X, CPE terlihat sebagai perubahan struktur sel dimana terjadi lisis sel, hilangnya kontak antar sel, atau terbentuknya sel raksasa dengan banyak inti akibat infeksi virus. Supernatan dikoleksi dan dimurnikan dari sisa sel dengan sentrifugasi pada 4000 rpm selama 10 menit.
Pengukuran titer virus dengue menggunakan metode Plaque Assay
Titer virus hasil propagasi diukur dengan menggunakan metode plaque assay yang sudah dimodifikasi (Eckels et al. 1976). Sebanyak 4 x 105 sel Mesocricetus auratus, baby hamster kidney (BHK21) ditanam dalam sumuran dari 24-well plate (Nunc) dan diinkubasi pada suhu 37°C, 5 % CO2 semalaman.
Stok virus yang akan diukur titernya kemudian diencerkan secara berseri dengan faktor pengenceran 10 kali dalam medium inokulasi (pengenceran 10-1, 10-2, 10-3, 10-4, 10-5, dan 10-6). Sebanyak 200 µ L inokulum ditambahkan ke dalam sumuran secara duplo sesuai pengenceran virus dan dilanjutkan dengan inkubasi pada 37°C, 5 % CO2 selama 1 jam. Setelah periode absorpsi virus, inokulum dibuang dan
medium diganti dengan 500 µ L 1 % methylcellulose overlay yang mengandung 2 % FBS. Plate diinkubasi pada suhu 37°C, 5 % CO2 selama 5 hari. Setelah
periode inkubasi, sel difiksasi dengan larutan formaldehida 3,7 % selama 30 menit. Plak yang terbentuk divisualisasi dengan pewarnaan crystal violet 1 % dan dihitung untuk menentukan titer virus dalam plaque forming unit/ml (PFU/mL) sesuai persamaan sebagai berikut:
PFU/mL = Jumlah plak x faktor pengenceran tertinggi x (1000/200) = Jumlah plak x faktor pengenceran tertinggi x 5
Isolasi Peripheral Blood Mononuclear Cells (PBMC)
14
(Terumo) sehingga terbentuk dua fase cairan yakni ficoll di lapisan bawah dan darah di lapisan atas. Kemudian disentrifugasi dengan kecepatan 400 x g pada suhu 20oC selama 40 menit pada alat refrigerated centrifuge tipe Universal 320R (Hettich). Bagian buffy coat yang berisi PBMC diambil dengan menggunakan pipet transfer kapasitas 3 mL (Membrane Solutions). PBMC dipindahkan ke dalam tabung sentrifugasi baru dan dilakukan pencucian menggunakan 1X D-PBS pH 7,2 sebanyak 3 kali volume buffy coat yang didapat dan disentrifugasi lagi dengan kecepatan 300 x g, 4oC selama 10 menit. Supernatan kemudian dibuang. Proses tersebut diulang hingga 2 kali. Jumlah sel PBMC dihitung dengan menggunakan haemocytometer (Improved Neubauer) dan viabilitas sel PBMC ditentukan menggunakan pewarnaan trypan blue.
Paparan berbagai serotipe virus dengue pada sel PBMC
Virus yang digunakan telah tersedia di Laboratorium Dengue di Lembaga Eijkman dan telah diketahui titernya dengan perhitungan menggunakan plaque assay, metode yang digunakan berdasarkan Yohan 2011. Sel PBMC sebanyak 1 ml yang mengandung 1,8 x 107 sel dimasukkan ke dalam tabung sentrifugasi 15 ml dalam medium 1X RPMI 1640 dengan suplementasi 10 % FBS, 2 mM l-glutamin, 100 U/mL Penisilin, dan 100 µg/mL Streptomisin diinkubasi pada suhu 37°C, 5 % CO2 selama 1 jam. Sel kemudian digunakan untuk perlakuan paparan
virus Dengue dengan multiplicity of infection (moi) 0,1 dalam medium inokulasi. Setelah periode inkubasi dan absorbsi virus pada suhu 37°C, 5 % CO2 selama 2 Sebagai pembanding digunakan kontrol non-infeksi (medium) dan lipopolysaccharide (LPS) sebagai kontrol positif induksi respon imun.
Deteksi keberadaan virus dengue saat infeksi pada sel PBMC menggunakan metode Plaque Assay
Titer virus hasil pengukuran dengan metode plaque assay sebelumnya dikonfirmasi kembali dengan metode yang sama saat diinfeksikan pada sel PBMC agar konsentrasi masing-masing virus sama saat diinfeksi. Titer virus diukur dengan menggunakan metode plaque assay yang sudah dimodifikasi (Eckels et al. 1976). Hasil pengukuran ini tercatat sebagai plaque forming unit/ml (PFU/mL). Sebanyak 1 x 106 sel BHK21 ditanam dalam sumuran dari 12-well plate (Nunc) dan diinkubasi pada suhu 37°C, 5 % CO2 semalaman. Virus dengue yang titernya
telah diseragamkan sebelumnya menjadi 600.000 PFU/mL kemudian diukur kembali titernya dengan diencerkan secara berseri dalam medium inokulasi hingga 6000 kali agar didapat konsentrasi akhir 100 PFU/mL. Hal ini dilakukan agar plak yang terbentuk tidak terlalu banyak dan dapat dihitung. Sebanyak 500 µL inokulum ditambahkan ke dalam sumuran dan dilanjutkan dengan inkubasi 37°C, 5 % CO2 selama 1 jam. Setelah periode absorbsi virus, inokulum dibuang
dan medium diganti dengan 1 mL 1 % methylcellulose overlay, 2 % FBS. Plate diinkubasi pada suhu 37°C, 5 % CO2 selama 5 hari. Setelah periode inkubasi, sel
15 divisualisasi dengan pewarnaan crystal violet 1 % dan dihitung untuk menentukan titer virus dalam PFU/mL.
Pengukuran laju pertumbuhan virus dengue dari supernatan sel PBMC yang terinfeksi virus dengue dengan menggunakan metode NS1 Enzyme-linked Immunosorbent Assay (ELISA)
Sekresi protein NS1 menjadi penanda replikasi virus dengue pada sel PBMC. Deteksi antigen NS1 pada supernatan sel PBMC yang diinfeksi virus dilakukan menggunakan ELISA NS1 kit sesuai petunjuk pembuat kit (Panbio 2011). Sebanyak 50 µL sample diluent dimasukkan ke dalam microwells (12x8 wells) yang telah dilapisi Anti-NS1 antibodi, kemudian ditambahkan masing-masing 50 µL kontrol negatif, kontrol positif, kalibrator, dan sampel (supernatan) dan dicampur rata. Microwells kemudian ditutup dan diinkubasi pada suhu 37°C selama 1 jam. Microwells kemudian dicuci menggunakan 20X wash buffer dan diulang sebanyak 6 kali menggunakan automated plate washer (Thermo Scientific). Sebanyak 100 µ L horseradish peroxidase (HRP)-conjugated Anti NS-1 monoclonal Antibody (MAb) kemudian ditambahkan pada tiap sumuran, ditutup dan diinkubasi pada suhu 37°C selama 1 jam. Dicuci sebanyak 6 kali dan ditambahkan 100 µ L dari campuran 3,3’,5,5’-tetramethylbenzidine dan hydrogen peroxide (TMB chromogen) pada tiap sumuran, diinkubasi 10 menit pada suhu ruang dan ditambahkan 1M phosphoric acid sebagai penghenti reaksi. Plate kemudian dibaca pada ELISA reader 450 nm (Thermo Scientific).
Ekstraksi RNA dari sel PMBC yang telah dipapar virus dengue
Ekstraksi RNA dari sel PBMC yang telah dipapar virus dengue dilakukan menggunakan Magna Pure LC sesuai petunjuk dari pembuat kit (Roche 2014). Sebanyak 3x106 sel PBMC ditanam dalam sumuran 24-well plate pada medium pertumbuhan yang kemudian dipapar virus dengue dengan kondisi 0,1 moi. Sel (pellet) kemudian dilarutkan dengan 200 µL lysis buffer MPLC (Roche). Kemudian dilakukan ekstraksi dengan menggunakan alat MPLC dengan penambahan berbagai macam reagent sesuai dengan petunjuk kit. Total RNA yang didapat dari masing-masing sampel dikuantifikasi menggunakan Thermo
Scientific NanoDrop™ 1000 Spektrofotometer. Kemudian segera disimpan pada suhu -80°C sampai digunakan.
Deteksi gen sitokin/kemokin menggunakan metode RT-PCR
16
extension akhir 72°C selama 10 menit (Lampiran 2). Sebagai gen normalisasi, digunakan gen endogenous/housekeeping yakni beta actin (-actin). Sekuen primer yang digunakan disajikan pada Tabel 1. Keberadaan gen sitokin/kemokin dan gen pengkode -actin terdeteksi dengan hasil positif berupa pita DNA hasil amplifikasi dengan ukuran sesuai pada Tabel 1 setelah dilakukan elektroforesis gel agarosa 1 % yang mengandung 200 ng/mL ethidium bromide .
Tabel 1. Sekuen primer yang digunakan pada reaksi real time RT-PCR
No. Gen Sekuen primer Referensi
1 β-actin, 355 bp F:5’-CATCTCTTGCTCGAAGTCCA-3’
R:5’-ATCATGTTTGAGACCTTCAACA-3’
Jia et al.
(2010)
2 IP-10, 177 bp F:5'-TTCAAGGAGTACCTCTCTCTAG-3'
R:5'-CTGGATTCAGACATCTCTTCTC-3'
Karakterisasi ekspresi gen penyandi (mRNA) sitokin/kemokin sel PBMC setelah paparan virus dengue menggunakan quantitative real time RT-PCR
Kadar gen penyandi sitokin/kemokin diukur dengan quantitative real time RT-PCR (Applied Biosystems) menggunakan SYBR Green select reaction mix (Applied Biosystems) sesuai petunjuk dari pembuat kit. Metode yang digunakan berdasarkan pada Overbergh et al. 2003 yang telah dimodifikasi. Sebelum dilakukan pengukuran, RNA hasil ekstraksi dari sel PBMC dilakukan transkripsi balik (reverse transcription). Hasil cDNA yang didapat digunakan sebagai template pada pengukuran dengan quantitative real time RT-PCR. Sebanyak 200 ng RNA digunakan sebagai cetakan untuk langkah transkripsi balik menjadi cDNA menggunakan enzim Superscript III Reverse Transcriptase dan primer Oligo dT. Kondisi reaksinya yaitu 25°C selama 5 menit, 42°C selama 60 menit, dan 70°C selama 10 menit (Lampiran 1). cDNA yang terbentuk kemudian diamplifikasi dalam quantitative real time PCR menggunakan SYBR Green select reaction mix dan sepasang primer masing-masing gen, yaitu primer forward dan primer reverse. Kondisi reaksinya adalah tahap pertama yaitu tahap awal 50°C selama 2 menit, tahap kedua yaitu denaturasi awal 95°C selama 2 menit, dan tahap ketiga yaitu denaturasi 95°C selama 15 detik dan annaeling dan extension 60°C selama 1 menit sebanyak 35 siklus (Lampiran 3). Sebagai gen normalisasi, digunakan gen endogenous/housekeeping yakni beta actin (-actin). Sekuen primer yang digunakan disajikan pada Tabel 1. Pengukuran dilakukan 2 kali ulangan dengan menyertakan kontrol tanpa template cDNA.
Analisis Data
17
4
HASIL DAN PEMBAHASAN
Hasil perhitungan titer virus dengue hasil propagasi menggunakan metode
plaque assay
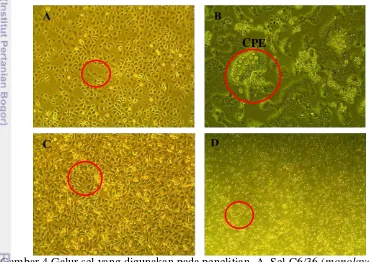
Propagasi dalam penelitian dilakukan untuk mencukupi jumlah virus yang dibutuhkan untuk diinfeksikan pada sel. Propagasi virus dengue dilakukan pada sel C6/36 (Gambar 4A) karena sel tersebut memiliki sensitivitas yang lebih tinggi terhadap virus dengue dibandingkan galur sel nyamuk dan mamalia lainnya (White 1987).
Galur sel C6/36 merupakan sel klon yang berasal dari larva nyamuk Aedes albopictus. Akira Igarashi adalah penemu dari galur sel C6/36 dan mengujinya untuk isolasi virus dengue dan chikungunya. Arti C6 adalah sel klon ke enam yang digunakan dalam isolasi virus dan menghasilkan titer virus tertinggi dibandingkan 20 sel klon lainnya. Sedangkan 36 artinya sel klon nomor 36 pada sel klon ke enam yang menunjukkan efek sitopatik dari ringan hingga berat setelah beberapa hari pasca infeksi (Igarashi 1978).
Gambar 4 Galur sel yang digunakan pada penelitian. A. Sel C6/36 (monolayer), B. Sel C6/36 terdeteksi CPE, C. Sel BHK21 (monolayer), D. Sel PBMC (suspensi)
Pemanenan virus dengue dilakukan selama 9 hari atau hingga terdeteksi cytophatic effect (CPE) (Gambar 4B) sampai 13 hari. Kemudian titer virus dengue hasil propagasi tersebut diukur menggunakan metode plaque assay (Butler 2005).
Pengukuran titer virus dengue bertujuan untuk mengetahui jumlah virus infeksius dalam sampel serum pasien atau virus hasil propagasi. Menurut Vaughn et al. (2000), pengukuran titer virus dengue bermanfaat untuk mengetahui tingkat keparahan infeksi virus dengue karena terdapat korelasi positif antara peningkatan titer virus dengue dalam serum pasien dengan tingkat keparahan infeksi virus dengue. Pemilihan metode plaque assay merupakan metode yang paling umum
18
dan standar digunakan untuk mengkuantifikasi virus infeksius, khususnya virus dengue (Matrosovich et al. 2006). Metode plaque assay memiliki sensitivitas yang tinggi karena dapat mendeteksi titer virus yang rendah, yaitu di bawah 104 PFU/ml. Plaque forming unit (PFU) didefinisikan sebagai plak yang terbentuk akibat infeksi virus tunggal pada sel inang (Butler 2005; Matrosovich et al. 2006). Plak dideteksi menggunakan pewarna crystal violet 1% yang diteteskan pada sel monolayer. Plak yang terbentuk merupakan zona atau area yang berisi sel mati dan lisis atau hancur akibat infeksi virus, sehingga tidak terwarnai dan terlihat sebagai zona bening, sedangkan sel yang masih utuh karena tidak terinfeksi virus akan terwarnai ungu oleh crystal violet (Matrosovich et al. 2006). Plak yang terbentuk kemudian dihitung dan dikonversi menggunakan rumus tertentu yang telah tertulis pada metode penelitian (Mahy dan Kangro 1996).
Gambar 5 Contoh plak yang terbentuk pada pengukuran titer virus dengue menggunakan metode plaque assay.
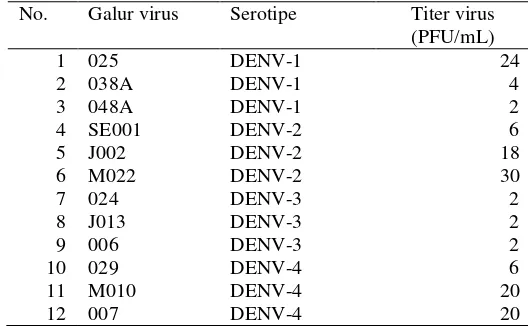
Hasil perhitungan titer virus berbagai serotipe virus dengue dapat dilihat pada Tabel 2. Sedangkan contoh plak yang terbentuk seperti pada Gambar 5.
Tabel 2 Titer virus pada pengukuran plaque assay
19 berikatan dengan substrat sehingga membentuk monolayer sel dan virus sehingga dapat membentuk plak. Hanya sel dengan kepadatan 80-100 % setelah masa inkubasi 24 jam yang akan diinfeksi. Hal tersebut bertujuan agar plak yang terbentuk dapat terlihat jelas pada sel monolayer karena ruang antar sel yang terlalu besar merupakan salah satu faktor yang menyebabkan plak yang terbentuk kurang baik (Butler 2005).
Hasil isolasi PBMC dengan metode sentrifugasi gradien ficoll
Isolasi PBMC dilakukan menggunakan metode sentrifugasi gradien ficoll (Gambar 6). Metode sentrifugasi gradien ficoll merupakan metode pemisahan berdasarkan pada perbedaan densitas. Proses sentrifugasi menghasilkan bagian cincin yang putih keruh disebut dengan buffy coat yang berisi sel PBMC. Buffy coat terletak diantara plasma dan ficoll. Eritrosit yang mempunyai densitas yang besar berada di lapisan paling bawah, sedangkan plasma yang berdensitas kecil berada di lapisan paling atas.
Gambar 6 Proses isolasi PBMC dengan menggunakan metode sentrifugasi gradien Ficoll. A. Sebelum dilakukan sentrifugasi, B. Setelah dilakukan sentrifugasi.
Sel PBMC (Gambar 4D) yang didapat dari hasil isolasi kemudian dihitung jumlah dan viabilitasnya menggunakan hemositometer dan pewarnaan trypan blue. Di dalam hemositometer terdapat 10 kamar hitung dan seluruh sel yang terdapat di dalam kamar hitung tersebut dijumlahkan. Sel yang berwarna putih merupakan sel yang hidup atau viabel, sedangkan yang berwarna biru adalah sel yang mati. Untuk mengetahui persentasi viabilitas sel, dilakukan perhitungan dengan membandingkan jumlah sel yang berwarna putih dibandingkan dengan total sel yang ada.
20
Pemahaman mengenai imunopatogenesis dengue terkadang mengalami kesulitan karena belum adanya hewan coba yang sesuai. Penggunaan sel imun seperti PBMC dalam infeksi virus secara ex vivo telah dikembangkan untuk memahami interaksi virus pejamu. Sel- sel imun monosit dan makrofag, limfosit T, sel dendritik, hepatosit, sel endotel, sel epitel dan fibroblas juga telah dilaporkan sebagai pejamu potensial untuk virus dengue (Avirutnan et al. 1998; Warke et al. 2003; Huang et al. 2000; Chen dan Wang 2002; King et al. 2002; Becerra et al. 2009; Dewi et al. 1998). Sel PBMC manusia terdiri atas 70 % sel limfosit T, 15 % limfosit B, 10 % sel natural killer (NK), 5 % monosit dan 1 % sel dendritik (Delves et al. 2006).
Hasil deteksi keberadaan virus dengue saat infeksi pada sel PBMC menggunakan metode Plaque Assay
Titer virus hasil pengukuran dengan metode plaque assay sebelumnya dikonfirmasi kembali dengan metode yang sama saat diinfeksikan pada sel PBMC agar konsentrasi masing-masing virus sama saat diinfeksi. Virus dengue yang titernya telah diseragamkan sebelumnya menjadi 600.000 PFU/mL kemudian diukur kembali titernya dengan diencerkan secara berseri dalam medium inokulasi hingga 6000 kali agar didapat konsentrasi akhir 100 PFU/mL. Hal ini dilakukan agar plak yang terbentuk tidak terlalu banyak dan dapat dihitung.
Gambar 7 Hasil plak yang dihasilkan pada uji keberadaan virus dengue saat diinfeksi pada sel PBMC dengan metode plaque assay.
21 Tabel 3 Titer virus setelah penyeragaman (600000 PFU/mL) dan
pengenceran 6000x menggunakan metode plaque assay
No. Galur virus Serotipe Titer virus
(PFU/mL)
Hasil pengukuran laju pertumbuhan virus dengue dari supernatan sel PBMC yang terinfeksi virus dengue dengan menggunakan metode NS1
Enzyme-linked Immunosorbent Assay (ELISA)
Sekresi protein NS1 menjadi penanda replikasi virus dengue pada sel PBMC. Deteksi antigen NS1 pada supernatan sel PBMC yang diinfeksi virus dilakukan secara semikuantitatif menggunakan metode sandwich ELISA dengan kit Dengue Early ELISA (Panbio) sesuai petunjuk pembuat kit. Antibodi penangkap dan pendeteksi yang digunakan adalah monoklonal antbodi (MAb) murine yang bersifat spesifik pada antigen NS1 keempat serotipe virus dengue.
Sampel dan kontrol secara langsung diinkubasi dengan konjugat selama 60 menit pada suhu 37°C pada mikroplate yang telah dilapisi MAb. Jika terdapat antigen NS1 pada sampel, maka akan terbentuk imunokompleks MAb-NS1-MAb/peroksidase. Setelah tahap pencucian, keberadaan imunokompleks tersebut diketahui dengan penambahan kromogenik substrat (Young et al. 2000). Jika terdapat imunokompleks maka akan terjadi perubahan warna substrat karena reaksi antara substrat dengan enzim. Setelah penginkubasian selama 10 menit pada suhu ruang ditambahkan larutan asam untuk menghentikan reaksi. Nilai optical density (OD) dibaca menggunakan ELISA reader pada panjang gelombang 450 nm (Alcon et al. 2002).
Uji ELISA dilakukan pada tiap titik waktu supernatan virus dengue setelah diinfeksikan pada sel PBMC. Hal tersebut dilakukan untuk melihat profil ekspresi NS1 masing-masing galur virus dari tiap serotipe pada sel PBMC, yang dapat digunakan sebagai penanda pertumbuhan (replikasi) virus dengue pada sel PBMC. Hasil dari profil ekspresi NS1 selanjutnya dapat dikorelasikan dengan ekspresi sitokin/kemokin yang dihasilkan dari sel PBMC yang terinfeksi virus dengue.
22
supernatan sel PBMC yang diinfeksi virus dengue juga masih terdeteksi sampai 72 jam pasca infeksi. Hasil ini sesuai dengan Libraty et al. (2002) yang menyatakan antigen NS1 dapat dideteksi dalam waktu 72 jam dari pasca infeksi.
Protein NS1 berstruktur heksamer merupakan satu-satunya protein non struktural virus dengue yang diekspresikan terikat pada membran sel dan secara ekstraseluler. Protein NS1 dilaporkan berperan penting dalam viabilitas virus dan berfungsi sebagai kofaktor untuk tahap awal replikasi virus dan berkorelasi dengan efisiensi replikasi (Flamand et al. 1999).
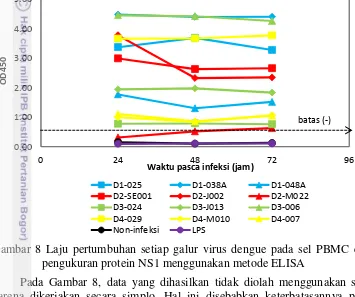
Gambar 8 Laju pertumbuhan setiap galur virus dengue pada sel PBMC dengan pengukuran protein NS1 menggunakan metode ELISA
Pada Gambar 8, data yang dihasilkan tidak diolah menggunakan statistik karena dikerjakan secara simplo. Hal ini disebabkan keterbatasannya pereaksi ELISA NS1 kit. Jika dilihat berdasarkan serotipe (Gambar 9), sel PBMC yang terinfeksi virus dengue mempunyai jumlah protein NS1 lebih tinggi dibandingkan kontrol non-infeksi dan LPS (Lipopolisakarida) yang berada di bawah batas negatif. Hal ini menandakan bahwa virus dengue dapat hidup dan bereplikasi pada sel PBMC. LPS merupakan endotoksin yang dihasilkan oleh bakteri Gram (-), sehingga jika diinfeksikan pada sel PBMC tidak akan menghasilkan protein NS1, karena protein NS1 merupakan salah satu dari 7 protein nonstruktural yang dihasilkan oleh virus dengue (Henchal dan Putnak 1990; Gubler 1998).
Berdasarkan Gambar 9, DENV-1 mempunyai laju pertumbuhan yang paling tinggi sedangkan DENV-4 laju pertumbuhannya paling rendah. Hal ini juga membuktikan setiap galur maupun serotipe virus dengue mempunyai karakteristik masing-masing. Tetapi jika diuji dengan ANOVA tidak terdapat perbedaan yang signifikan di antara keempat serotipe virus dengue dan kontrol non-infeksi.
23
Gambar 9 Laju pertumbuhan masing-masing serotipe virus dengue pada sel PBMC dengan pengukuran protein NS1 menggunakan metode ELISA. Error bar menunjukkan standard error of means (SEM) untuk perulangan 3 galur tiap serotipe.
Hasil deteksi gen sitokin/kemokin menggunakan metode RT-PCR
Sebelum dilakukan pengukuran tingkat ekspresi gen penyandi sitokin/kemokin dengan quantitative real time RT-PCR, primer-primernya dioptimasi terlebih dahulu dengan menggunakan mesin PCR. Hasil deteksi dapat dilihat pada Gambar 10. Berdasarkan hasil PCR tersebut, ke-tiga gen penyandi sitokin/kemokin (yakni IP-10, IL-10, dan MIP-1 ) dan gen pengkode β-actin berhasil diamplifikasi dan terdeteksi dengan adanya keberadaan pita-pita DNA yang ukurannya sesuai dengan referensi pada Tabel 1. Sedangkan pada kontrol negatif tidak dihasilkan pita DNA atau tidak terbentuk primer dimer. Hal ini menunjukkan bahwa primer-primer tersebut berkualitas baik dan dapat digunakan untuk mengukur ekspresi gen penyandi sitokin/kemokin menggunakan quantitative real time RT-PCR.
Gambar 10 Deteksi gen penyandi sitokin/kemokin menggunakan metode RT-PCR menghasilkan pita DNA. A. Marka DNA 50 bp (Invitrogen). B. Negatif MIP-1 . C. MIP-1 (61 bp). D. Negatif IP 10. E. IP-10 (177 bp). F. Negatif IL-10. G. IL-10 (352 bp). H. Negatif β-actin. I. β -actin (355 bp).
0.00 1.00 2.00 3.00 4.00 5.00
0 24 48 72 96
Non-infeksi LPS DENV-1
DENV-2 DENV-3 DENV-4
Waktu pasca infeksi (jam)
OD
450
batas (-)
A B C D E F G H I
350 bp
250 bp
150 bp
24
Hasil karakterisasi ekspresi gen penyandi (mRNA) sitokin/kemokin sel PBMC setelah paparan virus dengue menggunakan quantitative real time
RT-PCR
Setelah sel PBMC dipapar/diinfeksi virus dengue, kemudian sel tersebut diekstraksi untuk menghasilkan RNA (Lampiran 4) yang selanjutnya diukur kadar 3 gen penyandi sitokin/kemokin (IP-10, IL-10, dan MIP-1 ). Pada penelitian ini, two-step quantitative real-time RT-PCR digunakan untuk mendeteksi dan mengkuantifikasi gen penyandi sitokin/kemokin tersebut. RNA dari sel PBMC yang telah dipapar virus dengue diproses terlebih dahulu menggunakan mesin PCR konvensional sehingga menghasilkan cDNA (proses transkripsi balik). Selanjutnya cDNA diproses dengan mesin real time PCR untuk mengukur ekspresi gen penyandi sitokin/kemokin. Reaksi quantitative real time RT-PCR menggunakan kit SYBR Green Select dan sepasang primer (Tabel 1) dengan volume total 20 µL dilakukan dengan perulangan duplo dan menyertakan non-template control (NTC). Data yang dihasilkan berupa nilai CT (threshold cycle)
(Lampiran 7) dari masing-masing gen penyandi sitokin/kemokin dan gen endogenous/housekeeping yaitu beta actin (-actin) sebagai gen normalisasi. CT
adalah jumlah siklus yang diperlukan sinyal fluorescence untuk melewati garis batas (background level), CT juga dapat diartikan sebagai titik perpotongan antara
kurva amplifikasi dengan garis batas. Nilai CT bersifat logaritma dan dapat
digunakan untuk analisis kuantitatif baik secara langsung (metode perbandingan CT) atau tidak langsung (interpolasi pada kurva standar sehingga menghasilkan
nilai linier). Pada penelitian ini metode yang digunakan adalah metode perbandingan nilai CT (metode ∆∆CT) . Selisih nilai CT di antara masing-masing
gen penyandi sitokin/kemokin dengan gen normalisasi digunakan untuk menentukan besarnya tingkat ekspresi gen penyandi sitokin/kemokin, yang kemudian hasilnya dibandingkan dahulu dengan selisih nilai CT antara kontrol
non-infeksi dan gen normalisasi (Lampiran 10).
Sitoskeletal -actin merupakan protein sel yang banyak ditemukan pada sel mamalia yang berfungsi sebagai pergerakan organel, sitokenesis, dan motilitas sel (Weeds 1982), sehingga protein ini selalu terdapat di setiap sel mamalia. Oleh karena itu, protein ini digunakan sebagai housekeeping gene pada penelitian ini. Housekeeping gene itu sendiri merupakan sekumpulan gen yang terekspresi terus menerus yang diperlukan untuk menjaga fungsi-fungsi dasar sel. Jenis gen ini bermacam-macam salah satunya adalah -actin.
Analisis ekspresi gen penyandi sitokin/kemokin akibat pengaruh paparan berbagagi galur dan serotipe virus dengue pada sel PBMC dilakukan dengan melihat pola ekspresi gen penyandi sitokin dan kemokin yang ditampilkan pada Gambar 11 dan 12. Kemokin IP-10 dan MIP-1 cenderung memiliki pola kinetika ekspresi yang sama, yaitu pada waktu 48 jam pasca infeksi menghasilkan ekspresi tertinggi, sedangkan pada sitokin IL-10 pada waktu 48 jam pasca infeksi cenderung menghasilkan ekspresi terendah.