VIRULENSI BAKTERI
Streptococcus agalactiae
PADA IKAN
NILA (
Oreochromis niloticus
)
SRI SUPRIYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis Virulensi Bakteri Streptococcus agalactiae pada Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Sri Supriyanti
RINGKASAN
SRI SUPRIYANTI. Virulensi Bakteri Streptococcus agalactiae pada Ikan Nila (Oreochromis niloticus). Dibimbing oleh SUKENDA dan WIDANARNI.
Streptococcus agalactiae merupakan salah satu penyebab penyakit streptococcosis dan menyebabkan mortalitas yang signifikan pada berbagai jenis ikan air tawar dan laut di seluruh dunia. Di Indonesia, S. agalactiae telah menyerang budidaya ikan nila di beberapa daerah antara lain Sumatera Selatan, Jawa Tengah dan Jawa Barat.
Bakteri yang sangat virulen akan mampu menginfeksi ikan sehat dan menyebabkan sakit. Faktor virulensi bakteri berkaitan dengan kemampuan bakteri menginvasi, bereplikasi dan bertahan terhadap sistem pertahanan tubuh inang, serta kemampuan menyebabkan kerusakan sel selama perkembangan penyakit. Pengetahuan akan karakteristik virulensi bakteri S. agalactiae akan memberikan gambaran kemampuan bakteri dalam menginfeksi dan berkembang dalam tubuh ikan sehingga mampu menyebabkan penyakit pada ikan. Selanjutnya informasi terkait karakteristik faktor virulensi bakteri dan peranannya dalam patogenisitas dapat menjadi acuan dalam mengembangkan upaya-upaya pengendalian serangan
S. agalactiae terhadap budidaya ikan nila di Indonesia. Tujuan penelitian ini adalah untuk menguji virulensi S. agalactiae yang menginfeksi ikan nila dan mengkarakterisasi faktor-faktor virulensinya yang berperan dalam perkembangan penyakit.
Empat isolat bakteri (N3M, N4M, N17O dan NK1) diuji tingkat virulensinya terhadap ikan nila dengan injeksi secara intraperitoneal. Uji in vitro dilakukan untuk mengetahui karakteristik terkait virulensi, yaitu pengujian resistensi bakteri terhadap whole blood killing, complement mediated killing serta oksigen reaktif. Kemudian dilakukan deteksi gen-gen terkait virulensi yaitu suface immunogenic protein, sip; faktor CAMP, cfb; protein C-β, bac; dan fibrinogen binding protein, fbsA dengan PCR.
Hasil uji virulensi menunjukkan bahwa keempat isolat bakteri bersifat virulen. NK1 merupakan isolat paling virulen dengan dosis mematikan 50% (LD50) 104.5CFU/ml, sementara LD50 N3M 107.75 CFU/ml, N4M >108 CFU/ml, dan N17O 106.67 CFU/ml. Keempat isolat bersifat resisten terhadap aktivitas pertahanan tubuh dalam darah dan serum. Hasil uji blood survival yaitu viabilitas masing-masing bakteri uji yaitu N3M mencapai 91%, N4M mencapai 158%, N17O mencapai 178% dan NK1 mencapai 236 % dari kepadatan awalnya. Hasil uji complement mediated killing menunjukkan semua isolat bakteri uji mampu tumbuh dengan baik dan mencapai viabilitas lebih dari 100%, baik pada perlakuan serum aktif maupun serum inaktif. Viabilitas bakteri pada uji sensitivitas terhadap oksigen reaktif yaitu 38% (N3M), 25% (N4M), 35% (N17O) dan 48% (NK1). NK1 merupakan isolat yang paling resisten terhadap whole blood killing, complement mediated killing dan pemusnahan oleh oksigen reaktif. Hasil identifikasi dengan PCR menunjukkan bahwa N3M, N4M, N17O dan NK1 memiliki gen sip, fbsA dan cfb yang berperan penting dalam menentukan sifat virulensinya.
SUMMARY
SRI SUPRIYANTI. Streptococcus agalactiae Virulence in Tilapia (Oreochromis niloticus). Supervised by SUKENDA and WIDANARNI.
Streptococcus agalactiae is one of the causative agents of streptococcosis and cause significant mortality in wild and cultured fish species including both freshwater and marine animals in natural outbreaks throughout the world. In Indonesia, S. agalactiae was reported causing the disease in tilapia farming in South Sumatera, Central Java and West Java.
A virulent bacteria can infect healthy fish and cause the disease. Bacterial virulence factors are related to the invasion, replication and evasion of the host’s immune system, and cause injuries during pathogenesis of the disease. Study the virulence characteristics of S. agalactiae allow us to describe the pathogenesis of
S. agalactiae infection. The information related to the virulence characteristics and the role in the pathogenecity can be a reference in the development of control measure of streptococcosisin tilapia farm in Indonesia.. The aim of this study was to examine the virulence of S. agalactiae that infected tilapia (Oreochromis niloticus) and to characterize the virulence factors that important in pathogenesis.
Four isolates namely N3M, N4M, N17O and NK1, were tested for virulence levels in tilapia using intraperitoneal injection. In vitro assays were done to verify the characteristics associated with virulence, such as the bacterial resistance to whole blood killing, complement-mediated killing and reactive oxygen. The PCR assay was done to identify genes associated to virulence factors, such as suface immunogenic protein, sip; CAMP factor, cfb; protein C-β, bac; dan fibrinogen binding protein, fbsA.
The virulence assay showed that NK1 was the most virulent with 104.5 CFU/ml forLD50 value, while LD50 value for N17O, N3M and N4M were 106.67, 107.75 and more than 108 CFU/ml, respectively. In blood survival assay, viability of the bacteria were 91%, 158%, 178%, 236% of the initial CFU for N3M, N4M, N17O and NK1 respectively. The complement-mediated killing assay showed that all isolates were able to grow in the active or inactivated serum, and the viability were more than 100%. When exposed to reactive oxygen, the viabilitiy of the bacteria were 38%, 25%, 35% and 48% for N3M, N4M, N17O and NK1 respectively. The research shows that all isolates are virulent and the level of virulence is associated with the bacteria ability to evade the host’s immune system. NK1 isolate is the most virulent, and most resistant to whole blood killing, complement-mediated killing and reactive oxygen killing. The PCR assay shows that all isolates have sip, fbsA and
cfb genes that important for its virulence.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
VIRULENSI BAKTERI
Streptococcus agalactiae
PADA IKAN
NILA (
Oreochromis niloticus
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Mei - November 2014 ini adalah virulensi bakteri, dengan judul Virulensi Bakteri Streptococcus agalactiae pada Ikan Nila (Oreochromis niloticus).
Penulis menyampaikan terima kasih kepada Dr Ir Sukenda, MSc dan Dr Ir Widanarni, MSi selaku Komisi Pembimbing, Dr Munti Yuhana, SPi MSi selaku dosen penguji luar komisi, serta Dr Dinamella Wahjuningrum, SSi MSi yang telah memberikan arahan dan masukan dalam penyusunan dan penyempurnaan tesis ini. Di samping itu penghargaan penulis sampaikan kepada Bapak Agus Somantri dari Laboratorium Bakteriologi Fakultas Kedokteran Hewan IPB, Ibu Zakiah Widowati, MSi, Rizky Amalia, SStPi dan rekan-rekan dari Balai Uji Standar Karantina Ikan, rekan-rekan S2 Ilmu Akuakultur 2012 serta semua pihak yang telah membantu kelancaran kegiatan penelitian.
Terima kasih penulis sampaikan kepada Kepala Badan Pengembangan Sumber Daya Manusia Kementerian Kelautan Perikanan, Kepala Badan Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan dan Kepala Pusat Karantina Ikan atas kesempatan yang diberikan kepada penulis untuk melanjutkan pendidikan melalui program tugas belajar.
Ungkapan terima kasih juga disampaikan kepada suami, anak-anak, orang tua dan adik-adik yang telah memberi dukungan selama penulis menyelesaikan pendidikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
2 METODE 3
Waktu dan Tempat Penelitian 3
Penyiapan Ikan Uji 3
Penyiapan Isolat S. agalactiae 3
Uji Virulensi Isolat S. agalactiae pada Ikan Nila 4
Karakterisasi Virulensi Bakteri S. agalactiae 6
Blood Survival Assay 6
Complement-mediated Killing Assay 6
Sensitivitas S. agalactiae terhadap Oksigen Reaktif 6
Deteksi Gen Terkait Virulensi dengan PCR 7
Parameter Kualitas Air 8
Analisis Data 8
3 HASIL DAN PEMBAHASAN 8
Konfirmasi Isolat S. agalactiae 8
Virulensi Bakteri S. agalactiae pada Ikan Nila 8 Karakteristik Virulensi Bakteri S. agalactiae 13
Gen Terkait Virulensi Bakteri S. agalactiae 15
Kualitas Air Pemeliharaan 17
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 21
DAFTAR TABEL
1 Perlakuan dalam uji virulensi bakteri S. agalactiae 5 2 Primer yang digunakan untuk deteksi gen-gen virulensi S. agalactiae 7 3 Profil siklus amplifikasi DNA gen virulensi S. agalactiae 7 4 Waktu kemunculan gejala klinis dan kematian ikan nila pasca injeksi 9 5 Tingkat kematian ikan nila pasca injeksi S. agalactiae dan hasil
perhitungan dosis mematikan 50% (LD50) 12
6 Kualitas air pemeliharaan ikan nila pada uji virulensi S. agalactiae 17
DAFTAR GAMBAR
1 Perubahan pola berenang ikan pasca injeksi dengan isolat S. agalactiae 10 2 Perubahan makroskopis pada tubuh ikan pasca injeksi dengan isolat
S. agalactiae 11
3 Jumlah S. agalactiae isolat N3M, N4M, N17O dan NK1 dalam darah
ikan nila 13
4 Viabilitas S. agalactiae N3M, N4M, N17O dan NK1 terhadap serum aktif
dan inaktif ikan nila 14
5 Viabilitas S. agalactiae N3M, N4M, N17O dan NK1 terhadap oksigen
reaktif 15
6 Hasil deteksi gen virulensi S. agalactiae dengan PCR 16
DAFTAR LAMPIRAN
1 Hasil uji karakteristik morfologi dan biokimia S. agalactiae sesuai
metode deteksi pada SNI 7545.3 : 2009 21
2 Hasil uji konfirmasi isolat bakteri S. agalactiae PCR 22 3 Perkembangan gejala klinis dan kematian ikan pasca injeksi dengan
isolat S. agalactiae 23
4 Perhitungan LD50 isolat bakteri uji dengan metode Reed & Muench 27
1
1
PENDAHULUAN
Latar Belakang
Streptococcus agalactiae merupakan salah satu jenis bakteri penyebab penyakit streptococcosis dan menyebabkan mortalitas yang signifikan pada berbagai jenis ikan air tawar dan laut di seluruh dunia. Robinson dan Meyer (1966) mengungkapkan bahwa S. agalactiae pertama kali dilaporkan pada tahun 1966, menginfeksi ikan air tawar golden shiners (Notemigonus crysoleucas) di Atlanta USA. S. agalactiae telah diisolasi dari 17 spesies ikan termasuk rainbow trout,
seabream, nila, yellow fish, catfish, killfish, menhaden, mullet, dan silver pomfret
(Amal 2011). S. agalactiae termasuk Gram positif, oksidase negatif, katalase negatif dan isolat menunjukkan hasil negatif pada tes reaksi β-galactosidase, β -glucuronidase, N-acetyl-β-glucosaminidase, β-mannosidase, glycyl-tryptophane arylamidase, sorbitol, L-arabinosa, D-arabitol, glycogen, melezitos, melibiose dan hidrolisis starch (Evan et al. 2002).
Penyakit streptococcosis akibat infeksi S. agalactiae beberapa tahun belakangan ini telah menjadi perhatian karena menyebabkan kerugian pada kegiatan budidaya ikan nila di Indonesia. S. agalactiae dilaporkan telah menyerang budidaya ikan nila di beberapa daerah antara lain Sumatera Selatan, Jawa Tengah dan Jawa Barat (BKIPM 2014). Wabah penyakit streptococcosis ini dapat disebabkan oleh rendahnya ketahanan tubuh ikan, lingkungan pemeliharaan yang buruk ataupun pemberian pakan yang kurang baik. Menurut Conroy (2009), S. agalactiae menginfeksi dan lebih virulen pada kondisi lingkungan dengan suhu 24oC – 29oC. Mengingat suhu perairan di Indonesia umumnya berada pada kisaran tersebut, maka penyebaran serangan S. agalactiae dapat meningkat bila tidak segera ditanggulangi.
Pada budidaya ikan secara intensif, faktor lingkungan yang buruk dapat memicu stres dan mempengaruhi aktivitas sistem pertahanan tubuh ikan, akibatnya ketika ada patogen dapat dengan mudah terjadi wabah penyakit. Bakteri yang sangat virulen akan mampu menginfeksi ikan sehat dan menyebabkan sakit. Infeksi bakteri pada ikan akan direspon pertama kali oleh sistem pertahanan tubuh nonspesifik (Ellis 2001). Sistem pertahanan tubuh nonspesifik ikan meliputi pertahanan mekanik dan kimiawi berupa kulit, sisik, lendir dan insang, dan pertahanan seluler pada darah yaitu makrofag dan leukosit. Virulensi bakteri berkaitan dengan kemampuan bakteri menginvasi, bereplikasi dan bertahan terhadap sistem pertahanan tubuh inang, serta kemampuannya menyebabkan kerusakan sel selama perkembangan penyakit (Vilches et al. 2004). Mempelajari virulensi bakteri S.agalactiae dan patogenesisnya pada ikan dapat diawali dengan mempelajari kemampuan bakteri bertahan terhadap sistem pertahanan tubuh ikan non spesifik terutama pertahanan seluler pada darah. Buchanan et al. (2008) mengungkapkan uji resistensi S. iniae terhadap sistem pertahanan non spesifik ikan
striped bass secara in vitro dapat menggambarkan tahap perkembangan penyakit streptococcosis dan hasil uji tersebut dapat menjelaskan perbedaan karakteristik strain S. iniae.
2
S. agalactiae dapat dibagi menjadi faktor virulensi struktural dan non struktural. Faktor virulensi struktural dibentuk oleh komponen-komponen penyusun sel baik komponen permukaan maupun komponen penyusun dinding sel bakteri. Faktor virulensi tersebut antara lain adalah antigen kapsul polisakarida, antigen protein dan asam lipoteikoat. Faktor virulensi non struktural (metabolit) yang merupakan produk ekstraseluler dari bakteri ini antara lain adalah hyaluronidase, protease, hipurikase, nuclease, C5a-ase, hemolisin dan faktor CAMP (Pritchard and Lin 1993; Edwards dan Baker 1995; Takahashi et al. 1999; Lang dan Palmer 2003). Zhang et al. (2013) menguraikan bahwa gen terkait virulensi yang terdeteksi pada analisis genetik S. agalactiae yang diisolasi dari ikan nila (O. niloticus) yaitu
surface immunogenic protein, faktor CAMP, protein C-β dan fibrinogen binding protein. Sementara itu faktor virulensi C5a peptidase dan laminin-binding surface protein hanya terdeteksi pada S. agalactiae yang diisolasi dari sapi. Keberadaan faktor virulensi tersebut dapat diidentifikasi dengan teknik molekuler seperti
polymerase chain reaction (PCR). PCR telah terbukti akurat dan tepat dalam mengidentifikasi agen penyebab penyakit bakterial hingga level spesies.
Perumusan Masalah
Informasi mengenai karakteristik virulensi bakteri S. agalactiae yang menginfeksi ikan nila di Indonesia hingga saat ini masih terbatas, dan sejauh ini yang telah banyak dilakukan adalah penelitian karakteristik faktor virulensi S. agalactiae yang menginfeksi hewan terestrial dan manusia. Pengetahuan akan karakterisik virulensi bakteri S. agalactiae akan memberikan gambaran kemampuan bakteri dalam menginfeksi dan berkembang dalam tubuh ikan sehingga mampu menyebabkan penyakit pada ikan. Kejelasan karakteristik faktor virulensi bakteri dan peranannya dalam patogenisitas dapat menjadi acuan dalam mengembangkan upaya-upaya pengendalian serangan S. agalactiae terhadap budidaya ikan nila di Indonesia.
Pada penelitian ini dilakukan pengujian virulensi bakteri S. agalactiae isolat N3M, N4M, N17O, NK1 pada ikan nila dan ketahanan hidupnya terhadap komponen sistem pertahanan tubuh non spesifik ikan nila secara in vitro. Isolat bakteri direaksikan dengan darah lengkap ikan nila sebagai sumber pertahanan seluler nonspesifik, serum sebagai sumber komplemen dan oksigen reaktif yang berperan dalam pemusnahan antigen.
Kemudian untuk mengetahui faktor virulensi S. agalactiae yang berperan dalam menghindari sistem pertahanan tubuh inang dilakukan identifikasi gen-gen terkait virulensi yaitu suface immunogenic protein, sip; faktor CAMP, cfb; protein C-β, bac; dan fibrinogen binding protein, fbsA dideteksi dengan PCR.
Tujuan Penelitian
Tujuan penelitian adalah untuk menguji tingkat virulensi bakteri S. agalactiae
3 Manfaat Penelitian
Informasi terkait karakteristik virulensi berguna dalam upaya penanganan penyakit infeksi oleh S. agalactiae antara lain untuk pengendalian streptococcosis maupun untuk penelitian lanjutan terkait pengembangan vaksin yang lebih spesifik. Hal ini akan mendukung upaya pengembangan manajemen kesehatan dalam kegiatan budidaya ikan nila.
2
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada Mei – November 2014 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB, Laboratorium Bakteriologi, Fakultas Kedokteran Hewan IPB dan Laboratorium Biologi Molekuler Balai Uji Standar Karantina Ikan Kementerian Kelautan dan Perikanan.
Penyiapan Ikan Uji
Ikan uji adalah ikan nila (Oreochromis niloticus) strain NIRWANA (Nila Ras Wanayasa) dengan bobot 20.62±0.89 gr, berasal dari Balai Pengembangan Benih Ikan air Tawar (BPBIAT) Wanayasa. Sebelum diberi perlakuan, ikan uji diadaptasikan selama 14 hari untuk memastikan ikan sehat dan tidak terserang streptococcosis berdasarkan pengamatan gejala klinis dan isolasi bakteri dari organ mata, ginjal dan otak pada media BHIA tidak ditemukan S. agalactiae. Identifikasi bakteri pada organ ikan dilakukan secara konvensional berdasarkan SNI 7545.3 : 2009 (SNI 2009).
Ikan dipelihara dalam akuarium berukuran 60x40x30 cm3. Selama pemeliharaan suhu air dipertahankan pada 29oC. Ikan diberi makan secara at satiation dua kali sehari menggunakan pakan komersial. Penggantian air sebanyak 50% dilakukan dua hari sekali untuk membuang sisa pakan dan sisa metabolisme.
Penyiapan Isolat S. agalactiae
4
25 µl yang terdiri dari 12.5 µl master mix GoTaq®Green (Promega), 8.5 µl nuclease
free water, @ 1 µl primer (reverse dan forward), dan 2 µl template DNA. Primer spesifik Streptococcus agalactiae yang digunakan yaitu STRA-AgI: 5’-AAGGAA ACCTGCCATTTG-3’ dan STRA-AgII: 5’-TTAACCTAGTTTCTTTAAAACTA GAA-3’. Hasil amplifikasi diharapkan memiliki panjang 270bp. Setelah denaturasi awal pada suhu 95oC selama 15 menit, campuran sampel diamplifikasi 35 siklus, masing-masing terdiri dari denaturasi pada suhu 95oC selama 30 detik, penempelan primer pada suhu 55oC selama 30 detik, perpanjangan primer pada suhu 72oC selama 25 detik pemanjangan akhir selama 10 menit pada suhu 72oC, menggunakan T100 Thermal Cycler Biorad. Hasil amplifikasi dielektroforesis, kemudian didokumentasikan dengan menggunakan UV documentation (UVITEC).
Stok bakteri S. agalactiae ditumbuhkan pada medium brain heart infusion agar (BHIA, Merck). Sebelum bakteri digunakan untuk uji virulensi, dilakukan pasase in vitro sebanyak dua kali dan pasase in vivo sebanyak tiga kali untuk memperoleh kembali daya patogenisitasnya sesuai kondisi awalnya. Pasase in vitro
dilakukan dengan menggoreskan isolat pada media BHIA. Selanjutnya untuk pasase in vivo, disiapkan suspensi bakteri dengan mengkultur bakteri S. agalactiae
kedalam media cair Brain Heart Infusion Broth (BHIB, Merck). Satu ose biakan bakteri dari media agar dikultur ke dalam 5 ml media BHIB, diinkubasi dalam
shaker waterbath pada suhu 29-30°C dan 140 rpm selama 24 jam. Setelah 24 jam, diambil 1 ml biakan bakteri dari media kultur cair dan dimasukkan kedalam 9 ml media BHIB, dinkubasi pada shaker waterbath pada suhu 29-30°C dan 140 rpm selama 24 jam. Setelah itu bakteri siap untuk dipergunakan.
Pasase in vivo dilakukan dengan menyuntikkan suspensi bakteri isolat N3M, N4M, N17O dan NK1 pada ikan uji. Ikan uji disiapkan dalam lima akuarium dengan kepadatan lima ekor per kuarium, untuk disuntik secara intraperitoneal dengan empat suspensi isolat yang berbeda dan satu kontrol. Setelah penyuntikan, ikan diamati setiap hari sampai menunjukkan gejala klinis atau hampir mati. Ikan sakit diambil kemudian dilakukan isolasi bakteri dari organ ginjal, mata dan otak. Bakteri diinokulasi dengan metode penggoresan pada media BHIA dan diinkubasi selama 24 jam. Terhadap koloni yang tumbuh dilakukan pengamatan morfologi koloni, pewarnaan Gram dan uji karakteristik biokimia untuk memastikan bahwa bakteri yang tumbuh adalah bakteri yang disuntikkan sebelumnya. Selanjutnya bakteri S. agalactiae yang diperoleh digores kembali pada media agar, dikultur cair dan disuntikkan kembali pada ikan uji dengan perlakuan seperti di atas hingga tiga kali.
Uji Virulensi Isolat S. agalactiae pada Ikan Nila
Uji virulensi dilakukan untuk membandingkan tingkat virulensi isolat bakteri yaitu N3M, N4M, N17O dan NK1 pada ikan. Tingkat virulensi ditentukan berdasarkan kemunculan gejala klinis, tingkat kematian dan hasil perhitungan dosis bakteri yang menyebabkan kematian 50% dari jumlah ikan yang diamati (LD50) (Angka et al. 1995).
5 dipelihara selama 14 hari dalam akuarium dengan volume air 45 liter, diberi pakan komersil secara at satiation. Selama pemeliharaan suhu air dipertahankan pada 29oC. Penggantian air sebanyak 50% dilakukan dua hari sekali untuk membuang sisa pakan dan sisa metabolisme.
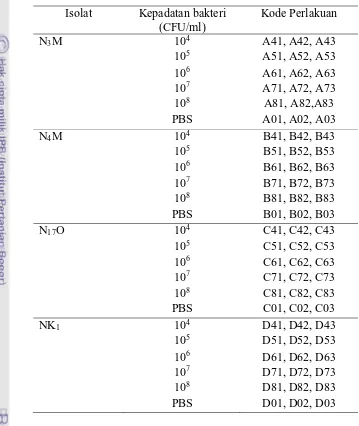
Tabel 1 Perlakuan dalam uji virulensi bakteri S. agalactiae
Isolat Kepadatan bakteri (CFU/ml)
Kode Perlakuan
N3M 104 A41, A42, A43
105 A51, A52, A53 106 A61, A62, A63 107 A71, A72, A73
108 A81, A82,A83
PBS A01, A02, A03
N4M 104 B41, B42, B43
105 B51, B52, B53 106 B61, B62, B63 107 B71, B72, B73 108 B81, B82, B83
PBS B01, B02, B03
N17O 104 C41, C42, C43
105 C51, C52, C53 106 C61, C62, C63 107 C71, C72, C73 108 C81, C82, C83
PBS C01, C02, C03
NK1 104 D41, D42, D43
105 D51, D52, D53 106 D61, D62, D63 107 D71, D72, D73 108 D81, D82, D83
PBS D01, D02, D03
Parameter yang diamati dalam uji virulensi ini antara lain:
1. Perubahan pola berenang: di permukaan, melayang atau di dasar akuarium, berenang lemah atau agresif, cara berenang berputar atau tidak beraturan. Pengamatan dilakukan selama 5 menit.
2. Perubahan yang diamati pada anatomi luar berupa kondisi mata, warna tubuh, pendarahan atau kelainan lainnya.
3. Mortalitas dicatat dan dihitung dengan rumus berikut:
6
4. Penentuan dosis yang menyebabkan kematian 50% jumlah ikan yang diamati (LD50) dihitung sesuai metode Reed & Muench (1938), yaitu:
Selang proporsi = A −A − B
Log negatif LD50 = C + selang proporsi Keterangan:
A = Kematian diatas 50% B = Kematian dibawah 50%
C = Log negatif dosis yang menyebabkan kematian di atas 50%
Karakterisasi Virulensi Bakteri S. agalactiae
Blood Survival Assay
Blood survival assay merupakan pengujian kemampuan bakteri hidup dalam darah inang. Prosedur uji dikerjakan berdasarkan Blood survival assay yang dilakukan oleh Buchanan et al. (2008), yaitu suspensi S. agalactiae 102 CFU dalam 700 µl PBS, ditambahkan ke dalam 300 µl darah ikan nila dan diinkubasi selama 1 jam pada suhu 28-30oC dengan agitasi. Setelah masa inkubasi, suspensi bakteri diencerkan dan jumlah bakteri yang hidup dihitung dengan metode cawan tuang dengan media BHIA. Perlakuan dilakukan terhadap setiap jenis bakteri dengan tiga ulangan. Sebagai kontrol, metode cawan tuang juga dilakukan pada darah tanpa penambahan bakteri maupun pada suspensi bakteri tanpa penambahan darah ikan. Complement-mediated Killing Assay
Complement-mediated killing assay merupakan pengujian untuk mengetahui kemampuan bakteri menghadapi komplemen yang terdapat dalam serum. Uji ini dikerjakan berdasarkan Complement-mediated Killing Assay yang dilakukan oleh Buchanan et al. (2008), yaitu sebanyak 3 ml darah diambil dari ikan nila, dibiarkan menggumpal, dan disimpan pada suhu 4oC selama 1 jam 30 menit, kemudian disentrifuse pada 3000 x g pada suhu 4oC selama 10 menit. Serum yang diperoleh diambil dan disentrifus kembali. Sebagian serum diinaktivasi dengan pemanasan pada suhu 60oC selama 30 menit. Suspensi bakteri 105 CFU/ml sebanyak 1 ml ditambahkan ke dalam 150 µl serum aktif maupun inaktif. Sampel divorteks, diinkubasi pada suhu 28oC selama 2 jam. Selanjutnya dilakukan perhitungan jumlah bakteri yang hidup dengan metode cawan tuang pada media BHIA.
Sensitivitas S. agalactiae terhadap Oksigen Reaktif
Pengujian sensitivitas S. agalactiae terhadap oksigen reaktif dilakukan sesuai dengan prosedur uji sensitivitas terhadap oksigen singlet yang dilakukan oleh Buchanan et al. (2008). Suspensi S. agalactiae dengan kepadatan 107 CFU/ml diinkubasi dengan 2 µg/ml methylene blue dan diletakkan 20 cm dari sumber cahaya 100 Watt. Sebagai kontrol, suspensi bakteri tanpa pemberian methylene blue
juga diletakkan 20 cm dari sumber cahaya 100W dan suspensi bakteri dengan/tanpa
7 Deteksi Gen Terkait Virulensi dengan PCR
Gen-gen terkait virulensi antara lain gen surface immunogenic protein, sip; faktor CAMP, cfb; protein C-β, bac; dan fibrinogen binding protein, fbsA di deteksi dengan PCR menggunakan primer spesifik.
Isolat bakteri yang digunakan telah dikultur selama 48 jam. Sebanyak 10-20 koloni diambil dan dimasukkan ke dalam mikrotube yang berisi 400 µl RNAse free water. Ekstraksi DNA dilakukan dengan memanaskan mikrotube yang berisi koloni bakteri dalam 400 µl RNAse free water pada suhu 98oC selama 10 menit menggunakan thermostat dan sesekali divortex. Kemudian sampel disentrifugasi pada 8000 x g selama 10 menit. Supernatan yang dihasilkan diambil sebanyak 300 µl, ditempatkan dalam mikrotube baru dan disimpan pada suhu -20oC sampai digunakan.
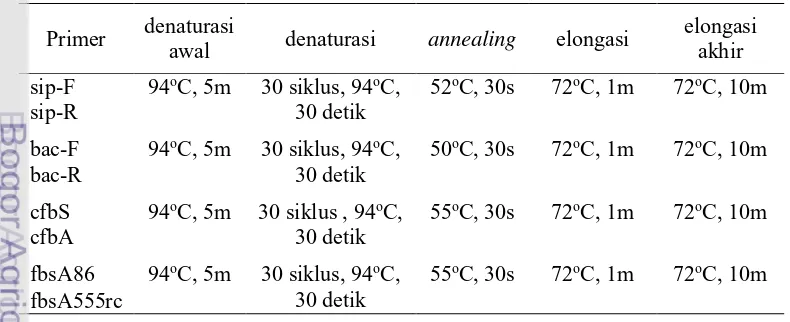
Primer yang digunakan untuk mendeteksi serta gen-gen virulensi bakteri S. agalactiae seperti pada Tabel 2.
Tabel 2 Primer yang digunakan untuk deteksi gen-gen virulensi S. agalactiae
Primer Sekuen Panjang
(bp) Referensi
sip sip-F GTTAAACCAACTCAGACGTCAG 339 Zhang et al. 2013 sip-R TTCAGGATGTGCAGCTACTGC
bac bac-F TGTAAAGGACGATAGTGTGAAGAC 530 Duarte et al. 2005 bac-R CATTTGTGATTCCCTTTTGC
cfb cfbS CGACAGCATCACACGAAAAATACA 900 Ye et al.
2011 cfbA TGACGACCTTTTGGACAAGTAGTAA
fbsA fbsA86 ATCAAGTCCTGTATCTGCTAT 420 Rosenau et
al. 2007 fbsA555rc TTCATTGCGTCTCAAACCG
Tabel 3 Profil siklus amplifikasi DNA gen virulensi S. agalactiae
Primer denaturasi
awal denaturasi annealing elongasi
elongasi
8
DNA. Proses amplifikasi dilakukan menggunakan T100 Thermal Cycler Biorad, dengan profil siklus amplifikasi seperti pada Tabel 3. Untuk mendeteksi hasil amplifikasi, 10 µl amplicon ditambah 4 µl Sybrsafe kemudian dielektroforesis pada gel agarose 1.5% dalam buffer 1x Tris-acetate-EDTA (220V selama 30 menit). Selanjutnya hasil elektroforesis diamati dan didokumentasikan dengan menggunakan UV documentation (UVITEC).
Parameter Kualitas Air
Pengukuran parameter kualitas air dilakukan untuk menjamin bahwa kualitas air pemeliharaan ikan selama uji virulensi memenuhi syarat kelayakan hidup ikan nila (SNI 7550, 2009) dan tidak mempengaruhi hasil pengamatan. Parameter yang diukur yaitu suhu, pH, oksigen terlarut dan amoniak.
Analisis Data
Data tingkat kematian ikan dan viabilitas bakteri diuji dengan analisis ragam (ANOVA) dan uji lanjut Tukey dengan signifikansi 0.05 menggunakan Minitab 16.
3
HASIL DAN PEMBAHASAN
Konfirmasi Isolat S. agalactiae
Empat isolat Streptococcus agalactiae yang digunakan dalam penelitian ini, secara fenotip memiliki memiliki ciri koloni berbentuk bulat kecil (pin point), putih, dan sedikit berlendir (lengket). Pada agar darah, keempat isolat tidak membentuk zona hemolisis (non-hemolitik). Uji Gram menunjukkan keempat isolat adalah bakteri kokus gram positif dan membentuk rantai. Keempatnya bersifat katalase/oksidasi negatif, non motil, mampu tumbuh pada media TSA+NaCl 6.5% (Lampiran 1). Hasil uji PCR menunjukkan bahwa isolat bakteri uji adalah S.
agalactiae (Lampiran 2).
Virulensi Bakteri S. agalactiae pada Ikan Nila
Uji tantang ikan dengan S. agalactiae isolat N3M, N4M, N17O dan NK1 menunjukkan bahwa keempat isolat bakteri bersifat virulen. Gejala klinis yang muncul akibat infeksi keempat isolat secara umum sama yaitu diawali dengan respon terhadap pakan yang menurun, perubahan pola berenang serta perubahan warna permukaan tubuh menghitam. Gejala yang muncul selanjutnya adalah berenang gasping (tegak, berusaha mengambil udara dibawah permukaan air),
9 pakan lambat, permukaan tubuh lebih hitam, mata mengkerut, purulen, opacity, dan eksoptalmia.
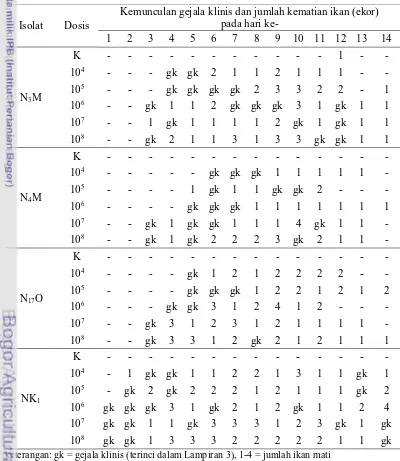
Pengamatan selama uji virulensi menunjukkan bahwa kemunculan gejala klinis dan kematian ikan yang terjadi tergantung pada jenis isolat dan dosis bakteri yang disuntikkan (Tabel 4). Hasil pengamatan gejala klinis dan kematian diuraikan pada Lampiran 3. Gejala klinis pada ikan yang diinjeksi NK1 pertama kali muncul pada hari ke-1 sampai ke-3 pasca injeksi. Gejala klinis pada ikan yang diinjeksi dengan N3M dan N4M pertama kali muncul pada hari ke-3 sampai ke-6 pasca injeksi. Sementara itu pada ikan yang diinjeksi dengan N17O, gejala klinis mulai tampak pada hari ke-3 sampai ke-5 pasca injeksi.
Tabel 4 Waktu kemunculan gejala klinis dan kematian ikan nila pasca injeksi dengan S. agalactiae
Isolat Dosis
Kemunculan gejala klinis dan jumlah kematian ikan (ekor) pada hari ke-
1 2 3 4 5 6 7 8 9 10 11 12 13 14
N3M
K - - - 1 - -
104 - - - gk gk 2 1 1 2 1 1 1 - -
105 - - - gk gk gk gk 2 3 3 2 2 - 1
106 - - gk 1 1 2 gk gk gk 3 1 gk 1 1
107 - - 1 gk 1 1 1 1 2 gk 1 gk 1 1
108 - - gk 2 1 1 3 1 3 3 gk gk 1 1
N4M
K - - - -
104 - - - - - gk gk gk 1 1 1 1 1 -
105 - - - - 1 gk 1 1 gk gk 2 - - -
106 - - - - gk gk gk 1 1 1 1 1 1 1
107 - - gk 1 gk gk 1 1 1 4 gk 1 1 -
108 - - gk 1 gk 2 2 2 3 gk 2 1 1 -
N17O
K - - - -
104 - - - - gk 1 2 1 2 2 2 2 - -
105 - - - - gk gk gk 1 2 2 1 2 1 2
106 - - - gk gk 3 1 2 4 1 2 - - -
107 - - gk 3 1 2 3 1 2 1 1 1 1 -
108 - - gk 3 3 1 2 gk 2 1 2 1 1 1
NK1
K - - - -
104 - 1 gk gk 1 1 2 2 1 3 1 1 gk 1
105 - gk 2 gk 2 2 2 1 2 1 1 1 gk 2
106 gk gk gk 3 1 gk 2 1 2 gk 1 1 2 4
107 gk gk 1 1 gk 3 3 3 1 2 3 gk 1 gk
108 gk gk 1 3 3 3 2 2 2 2 2 1 1 gk
10
Perubahan pola berenang pada ikan nila pasca injeksi S. agalactiae diawali dengan tingkah laku berenang tidak beraturan, diam di dasar atau sudut akuarium, dan diikuti dengan gasping dan whirling (Gambar 1). Perubahan pola berenang yang khas pada serangan S. agalactiae yaitu berenang whirling, mulai muncul pada hari ke-5 pasca injeksi, pada ikan yang diinjeksi isolat NK1 dengan dosis 108 CFU/ml. Gejala whirling juga dapat diamati pada ikan yang diinjeksi dengan dosis yang lebih rendah maupun pada ikan yang diinjeksi dengan isolat lainnya. Ikan yang diinjeksi isolat N17O dan N3M dengan dosis 106, 107 dan 108 CFU/ml menampakkan gejala whirling pada hari ke-6 pasca injeksi. Sementara ikan yang diinjeksi dengan isolat N4M menunjukkan gejala whirling pada hari ke-8 pasca injeksi. Ikan biasanya mati pada 12-24 jam setelah mengalami whirling. Ikan kontrol tidak menunjukkan gejala klinis tersebut.
Perubahan makroskopis pada organ luar ikan yang tampak selama pengamatan pasca injeksi S. agalactiae antara lain permukaan tubuh ikan menjadi menghitam, tubuh ikan berbentuk huruf C, mata mengalami kekeruhan (opacity), eksoptalmia dan purulens (Gambar 2). Perubahan warna tubuh mulai tampak pada
f c
a b
e
d
Gambar 1 Perubahan pola berenang ikan pasca injeksi dengan isolat S. agalactiae. (A) Ikan berenang normal. (B) Ikan berenang lemah di dasar/sudut akuarium. (C) Berenang tidak menentu dan sirip punggung mengembang. (D) Ikan berkumpul di sudut akuarium. (E) Ikan berenang gasping tepat di bawah permukaan air. (F). Ikan berenang
11 hari ke-2 pasca injeksi dengan semua jenis isolat, terutama ikan yang diinjeksi dengan dosis 103-106 CFU/ml. Sementara itu perubahan bentuk tubuh seperti huruf C, mulai tampak pada pengamatan hari ke-10 sampai ke-14 pasca injeksi. Gejala perubahan bentuk tubuh ini lebih banyak terjadi pada ikan-ikan yang diinjeksi dengan isolat NK1. Perubahan pada mata mulai terjadi pada hari ke-4 dan hampir semua ikan yang diinjeksi dengan isolat NK1, mengalami purulens dan eksoptalmia pada pengamatan hari ke-5 pasca injeksi.
Kematian pertama kali pada ikan yang diinjeksi NK1 terjadi pada hari ke-2 sampai ke-3 pasca injeksi. Kematian ikan yang diijeksi N3M dan N17O, pertama kali terjadi pada hari ke-3 sampai ke-6 pasca injeksi, sementara ikan yang diinjeksi N4M, kematian ikan pertama terjadi pada hari ke-4 sampai ke-10 pasca injeksi.
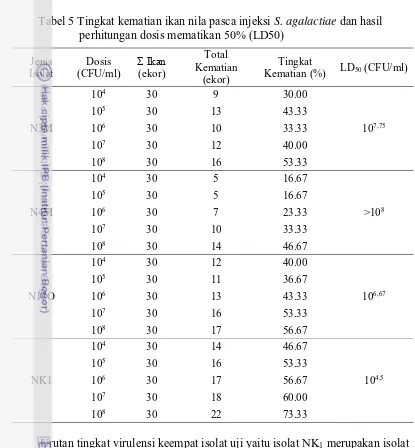
Hasil perhitungan tingkat kematian ikan dan LD50 ditunjukkan pada Tabel 5. Pada setiap perlakuan dosis injeksi, tingkat kematian ikan akibat injeksi NK1 lebih tinggi dari tiga isolat bakteri lainnya (p<0.05). Sementara itu injeksi isolat N4M menyebabkan tingkat kematian paling rendah. Nilai LD50 isolat NK1 (104.5 CFU/ml) lebih rendah dibandingkan LD50 isolat N17O (106.67 CFU/ml), N3M (107.75 CFU/ml) dan N4M (lebih dari 108 CFU/ml). Tingkat kematian kumulatif ikan tertinggi terjadi pada perlakuan dosis NK1 108 CFU/ml (75%). Isolat N4M menyebabkan tingkat kematian terendah pada hampir seluruh tingkat dosis injeksi (15-50%). Hasil analisis statistik menunjukkan bahwa tingkat kematian ikan akibat injeksi isolat NK1 pada berbagai dosis memberikan hasil berbeda nyata dengan N3M dan N4M namun tidak berbeda nyata dengan N17O isolat lainnya maupun dengan kontrol (P<0.05).
Berdasarkan kemunculan gejala klinis, tingkat kematian serta nilai LD50, keempat isolat S. agalactiae bersifat virulen dengan tingkatan yang berbeda. Nilai
a
c b
e
d f
12
LD50 isolat NK1 yang rendah menunjukkan bahwa isolat ini sangat virulen. Mian et al. (2009) menyatakan nilai LD50 yang rendah pada uji virulensi S. agalactiae
menunjukkan bahwa bakteri ini sangat infektif dan memiliki kemampuan yang tinggi untuk menghindari sistem pertahanan tubuh inang.
Tabel 5 Tingkat kematian ikan nila pasca injeksi S. agalactiae dan hasil perhitungan dosis mematikan 50% (LD50)
Jenis
13
Karakteristik Virulensi Bakteri S. agalactiae
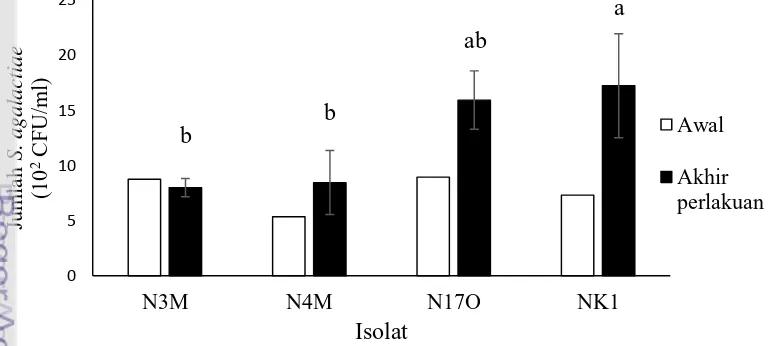
Pertahanan tubuh dalam darah merupakan kombinasi aktivitas antimikroba yang terdapat dalam serum dan sel-sel fagositik seperti netrofil atau makrofag. Dengan demikian, jumlah bakteri yang hidup dalam darah dapat menggambarkan kemampuan bakteri menghadapi mekanisme pertahanan oleh komplemen maupun sel-sel fagositik. Jumlah isolat N3M, N4M, N17O dan NK1 sebelum perlakuan masing-masing adalah 8,75x102 CFU/ml, 5,35x102 CFU/ml, 8,95x102 CFU/ml, 7,3x102 CFU/ml. Kemudian hasil blood survival assay menunjukkan viabilitas NK1 paling tinggi diantara keempat isolat dan berbeda nyata dengan N3M dan N4M, namun tidak berbeda nyata dengan N17O (p<0.05). Jumlah rata-rata isolat uji yang tumbuh setelah perlakuan yaitu N3M sebanyak 7,98 x102 CFU/ml atau 91% dari jumlah awalnya, N4M sebanyak 8,45x102 CFU/ml atau mencapai 158% dari jumlah awalnya, N17O sebanyak 1,59x103 CFU/ml atau mencapai 178% dari jumlah awalnya, dan NK1 sebanyak 1,72x103 CFU/ml atau mencapai 235% dari jumlah awalnya (Gambar 3). Hal ini menunjukkan bahwa isolat N3M, N4M, N17O dan NK1 resisten terhadap aktivitas pertahanan tubuh inang didalam darah, bahkan dapat tumbuh baik dalam darah ikan. Buchanan et al. (2008) mengungkapkan bahwa hasil uji kelangsungan hidup S. iniae dalam darah ikan hybrid-striped bass menunjukkan bahwa viabilitas S. iniae virulen sangat tinggi mencapai hampir lima kali kepadatan awalnya.
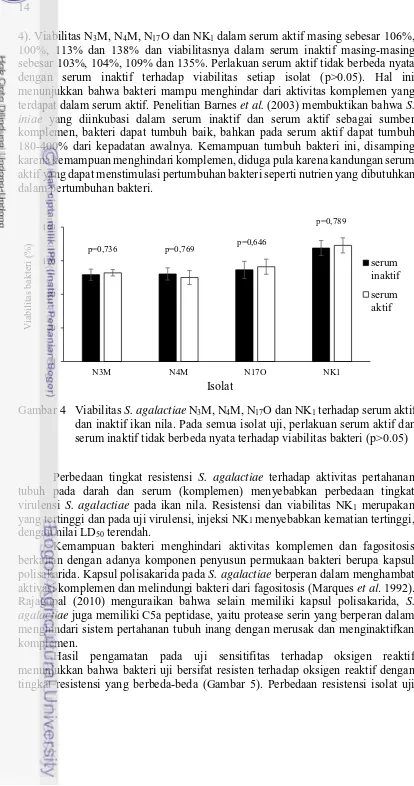
14
4). Viabilitas N3M, N4M, N17O dan NK1 dalam serum aktif masing sebesar 106%, 100%, 113% dan 138% dan viabilitasnya dalam serum inaktif masing-masing sebesar 103%, 104%, 109% dan 135%. Perlakuan serum aktif tidak berbeda nyata dengan serum inaktif terhadap viabilitas setiap isolat (p>0.05). Hal ini menunjukkan bahwa bakteri mampu menghindar dari aktivitas komplemen yang terdapat dalam serum aktif. Penelitian Barnes et al. (2003) membuktikan bahwa S. iniae yang diinkubasi dalam serum inaktif dan serum aktif sebagai sumber komplemen, bakteri dapat tumbuh baik, bahkan pada serum aktif dapat tumbuh 180-400% dari kepadatan awalnya. Kemampuan tumbuh bakteri ini, disamping karena kemampuan menghindari komplemen, diduga pula karena kandungan serum aktif yang dapat menstimulasi pertumbuhan bakteri seperti nutrien yang dibutuhkan dalam pertumbuhan bakteri.
Perbedaan tingkat resistensi S. agalactiae terhadap aktivitas pertahanan tubuh pada darah dan serum (komplemen) menyebabkan perbedaan tingkat virulensi S. agalactiae pada ikan nila. Resistensi dan viabilitas NK1 merupakan yang tertinggi dan pada uji virulensi, injeksi NK1 menyebabkan kematian tertinggi, dengan nilai LD50 terendah.
Kemampuan bakteri menghindari aktivitas komplemen dan fagositosis berkaitan dengan adanya komponen penyusun permukaan bakteri berupa kapsul polisakarida. Kapsul polisakarida pada S. agalactiae berperan dalam menghambat aktivasi komplemen dan melindungi bakteri dari fagositosis (Marques et al. 1992). Rajagopal (2010) menguraikan bahwa selain memiliki kapsul polisakarida, S. agalactiae juga memiliki C5a peptidase, yaitu protease serin yang berperan dalam menghindari sistem pertahanan tubuh inang dengan merusak dan menginaktifkan komplemen.
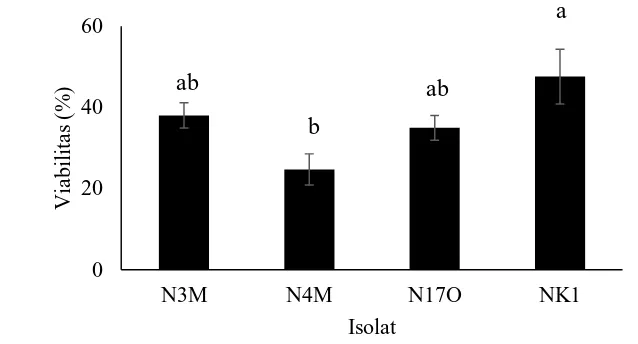
Hasil pengamatan pada uji sensitifitas terhadap oksigen reaktif menunjukkan bahwa bakteri uji bersifat resisten terhadap oksigen reaktif dengan tingkat resistensi yang berbeda-beda (Gambar 5). Perbedaan resistensi isolat uji
0
15 terhadap oksigen reaktif ditunjukkan oleh perbedaan viabilitas bakteri pada akhir pengamatan. Viabilitas NK1 memiliki tingkat kelangsungan hidup yang tertinggi yaitu sebesar 48%, sementara isolat N3M sebesar 38%, N17O sebesar 35% dan viabilitas N4M terendah sebesar 25% (p<0.05). Resistensi NK1 terhadap oksigen reaktif yang lebih tinggi dibanding tiga isolat lain ini dapat menjelaskan salah satu penyebab NK1 lebih virulen dibanding isolat N3M, N4M dan N17O pada uji virulensi bakteri terhadap ikan nila.
Oksigen reaktif berperan dalam mekanisme fagositosis intraseluler, yaitu membunuh mikroba. Sifat resisten bakteri terhadap oksigen reaktif, menyebabkan bakteri mampu hidup dalam sel inang dan memungkinkan untuk mencapai jaringan lain, peredaran darah dan sistem syaraf pusat. Menurut Liu et al. (2004), sifat virulensi beberapa bakteri termasuk S. agalactiae berkaitan erat dengan kemampuan bakteri resisten terhadap pemusnahan oleh oksigen reaktif, yang menyebabkan bakteri dapat hidup dalam sel fagosit dan mendorong patogenesis. Kemudian Buchanan et al. (2008) menyatakan bahwa resistensi S.iniae terhadap pemusnahan oleh oksigen reaktif memiliki peran yang signifikan pada kelangsungan hidup bakteri tersebut di dalam sel, resistensi terhadap pemusnahan oleh sel fagositik dan juga menentukan virulensinya.
Gen Terkait Virulensi Bakteri S. agalactiae
Deteksi gen-gen virulensi dengan PCR menggunakan primer spesifik menunjukkan bahwa tiga gen virulensi yaitu surface immunogenic protein,sip (339 bp), fibrinogen binding protein, fbsA (420 bp), dan faktor CAMP, cfb (900bp), ditemukan pada keempat isolat uji, akan tetapi beta protein C-β, bac tidak terdeteksi pada semua isolat uji (Gambar 6). Berbeda dengan hasil penelitian Zhang et al.
(2013) yang melakukan deteksi gen virulensi terhadap lebih dari 50 isolat S.
0 20 40 60
N3M N4M N17O NK1
V
iabi
li
tas
(
%
)
Isolat
Gambar 5 Viabilitas S. agalactiae N3M, N4M, N17O dan NK1 terhadap oksigen reaktif. Huruf yang berbeda pada tiap bar menunjukkan hasil uji statistik berbeda nyata (p<0.05)
ab
a
16
agalactiae yang berasal dari ikan nila yang sakit, yaitu sip, fbsA, cfb dan bac
ditemukan pada semua isolat uji. Hasil deteksi gen virulensi ini menunjukkan bahwa N3M, N4M, N17O dan NK1 memiliki potensi virulensi yang sama. Perbedaan tingkat virulensi sebagaimana pada hasil pengamatan uji virulensi diduga karena adanya perbedaan ekspresi gen-gen tersebut atau adanya gen-gen virulensi lain yang menyebabkan NK1 lebih virulen dibandingkan N3M, N4M, N17O.
17 berpotensi sebagai kandidat vaksin protein untuk pengembangan pengendalian penyakit streptococcosis akibat S. agalactiae. Brodeur et al. (2000) mengungkapkan bahwa Sip dapat teridentifikasi pada semua strain S. agalactiae
yang berasal dari manusia. Sip merupakan protein antigenik yang berada pada permukaan bakteri S.agalactiae, dan mampu meningkatkan respon antibodi inang (Khrisnaveni et al. 2014). Protein FbsA menyebabkan fibrinogen inang terikat di permukaan sel bakteri (Schubert et al. 2002). Keberadaan FbsA membuat S. agalactiae resisten terhadap fagositosis. Hal ini terbukti dari penelitian Schubert et al. (2002), yaitu perlakuan mutasi gen fbsA, menekan kemampuan S. agalactiae
untuk tumbuh pada darah, atau lebih sensitif terhadap fagositosis dibandingkan dengan S. agalactiae tanpa mutasi.
Faktor CAMP adalah protein dengan pore-forming properties yang disekresikan S. agalactiae dan berperan penting dalam patogenesis (Lang dan Palmer 2003). Bukti bahwa faktor CAMP menentukan virulensi S. agalactiae telah dilakukan melalui pengujian in vivo, yaitu faktor CAMP yang dimurnikan bersifat letal pada kelinci, dan injeksi faktor CAMP bersama sama dengan dosis S. agalactiae subletal menyebabkan septicaemia dan kematian tikus uji (Skalka et al. 1981; Jurgen et al. 1987).
Kualitas Air Pemeliharaan
Parameter kualitas air pemeliharaan selama pelaksanaan uji virulensi berada pada kisaran yang layak untuk pemeliharaan ikan nila, mengacu pada Standar Kualitas Air Pemeliharaan Ikan Nila (SNI 7550 : 2009) (Tabel 6). Kondisi ini menjamin bahwa hasil pengamatan pada uji virulensi S. agalactiae hanya dipengaruhi oleh perlakuan.
Tabel 6 Kualitas air pemeliharaan ikan nila pada uji virulensi S. agalactiae
Parameter Kualitas air penelitian
Standar kualitas air pemeliharaan ikan nila (SNI
7550 : 2009)
Suhu 28.6 – 29.1 25 – 32
pH 6.64 – 7.60 6.5 – 8.5
O2 terlarut (ppm) 4.9 – 5.8 ≥ 3
18
4
SIMPULAN DAN SARAN
Simpulan
Berdasarkan kemunculan gejala klinis, tingkat kematian dan nilai LD50 menunjukkan bahwa keempat isolat uji bersifat virulen. Urutan tingkat virulensi keempat isolat uji yaitu isolat NK1 merupakan isolat yang sangat virulen, N17O dan N3M merupakan isolat virulen sedang dan N4M adalah isolat yang kurang virulen. Tingkat virulensi keempat isolat bakteri uji berkaitan dengan tingkat resistensi S. agalactiae terhadap aktivitas komplemen, aktivitas fagositosis dan aktivitas pemusnahan oleh oksigen reaktif.
Isolat N3M, N4M, N17O dan NK1 memiliki gen sip, fbs dan cfb yang menyebabkan keempatnya bersifat virulen.
Saran
Perlu dilakukan penelitian lanjutan dengan pengujian karakteristik virulensi yang lebih lengkap dan deteksi gen-gen terkait virulensi lainnya untuk memperoleh gambaran patogenesis yang lebih detil.
DAFTAR PUSTAKA
Amal MNA, Zamri-Saad M. 2011. Streptococcosis in tilapia : a review. Pertanika J Trop Agric Sci. 34(2):195-206.
Angka SL, Lam TJ, Sin YM. 1995. Some virulence characteristics of Aeromonas hydrophila in walking catfish (Clarias gariepinus). Aquaculture. 130:103-112.
Barnes AC, Young FM, Horne MT, Ellis AE. 2003. Streptococcus iniae: serological differences, presence of capsul and resistance to immune serum killing. Dis Aquatic Org. 53:241–247.
[BKIPM] Badan Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan. 2014. Peta daerah sebar hama dan penyakit ikan karantina (HPIK) tahun 2013. Badan Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan. Kementerian Kelautan dan Perikanan.
Brodeur BR, Boyer M, Charlebois I, Hamel J, Coutute F, Rioux CR, Martin D. 2000. Identification of group B streptococcal sip protein which elicits cross protective immunity. Infect Immun. 68(10):5610-5618.
Buchanan JT, Colvin KM, Vicknair MR, Patel SK, Timmer AM, Nizet V. 2008. Strain-associated virulence factors of streptococcus iniae in hybrid-striped bass. Vet Microbiol. 131:145–153.
Conroy G. 2009. Tilapia streptococcosis: Prevalence of Streptococcus species in Latin America and their pathological manifestations. Proceedings Managing
19 Delannoy CMJ, Zadoks RN, Crumlish M, Rodgers D, Lainson FA, Ferguson HW, Turnbull, J, Fontaine, MC. 2014. Genomic comparison of virulent and non-virulent Streptococcus agalactiae in fish. J Fish Dis. 2014:2-17. doi:10.1111/jfd.12319.
Delannoy CMJ, Chrumlish M, Fontainrali MC, Pollock J, Foster G, Dagleish MP, Turnbull JF, Zadoks RN. 2013. Human Streptococcus agalactiae strains in aquatic mammals and fish. BMC Microbiology. 13:41.
Duarte RS, Bellei BC, Miranda OP, Brito MAVP, Teixeira LM. 2005. Distribution of antimicrobial resistance and virulence-related genes among Brazilian group B streptococci recovered from bovine and human sources.
Antimicrobial Agents and Chemotherapy. 49:97–103.
Edwards MS, Baker CJ. 1995. Streptococcus Agalactiae (Group B Streptococcus). In: Mandell GL, JE Bennet, R Dolin; Principle and Practice of Infectious Desease. 4th ed. (Eds). Churcill Livingstone.
Ellis AE. 2001. Innate host defense mechanisms of fish against viruses and bacteria.
Dev Comp Immunol. 25:827–839. doi:10.1016/s0145-305x(01)00038-6(8-9). Evans JJ, Klesius PH, Gilbert PM, Shoemaker CA, Al Sarawi MA, Landsberg J, Duremdez R, Al Markouk A. 2002. Characterization of b-hemolitic group B
Streptococcus agalactiae in cultured sea bream, Sparus auratus L., and wild mullet, Liza klunzingeri (Day) in Kuwait. J Fish Dis. 25:505–513.
Hardi EH, Sukenda, Harris E, Lusiastuti AM. 2011. Karakteristik dan Patogenisitas
Streptococcus Agalactiae Tipe β-hemolitik dan Non-hemolitik pada Ikan Nila. Jurnal Veteriner. 12(2):152-164.
Jurgens D, Sterzik B, Fehrenbach FJ. 1987. Unspecific binding of Group B Streptococcal cocytolysin (CAMP factor) to immunoglobulins and its possible role in pathogenicity. J Exp Med. 165:720–732.
Krisnaveni N, Isloor SK, Hedge R, Suryanarayanan VVS, Rathnma D, Veregowda BM, Nagaraja, CS, Sudareshan S. 2014. Rapid detection of virulence associated genes in streptococcal isolate from bovine mastitis. African
Journal of Microbiology Research. 8(22):2245-2254. doi:
10.5897/AJMR2013.5894.
Lang S, Palmer M. 2003. Characterization of Streptococcus agalactiae CAMP factor as a pore-forming toxin. J Biol Chem. 278(40):38167–38173. doi: 10.1074/jbc.M303544200.
Lindahl G, Stalhammar-Carlemalm M, Areschoug T. 2005. Surface proteins of
Streptococcus agalactiae and related proteins in other bacterial pathogens.
Clinical Microb Rev. 18(1):102–127. doi:10.1128/CMR.18.1.102–127.2005 Liu GY, Doran KS, Lawrence T, Turkson N, Puliti M, Tissi L, Nizet V. 2004.
Sword and shield: linked group B streptococcal b-hemolysin/cytolysin and carotenoid pigment function to subvert host phagocyte defense. Proc Natl Acad Sci. U.S.A. 101(40):14491–14496. doi:10.1073/pnas.0406143101. Marques MB, Kasper DL, Pangburn MK, Wessels MR. 1992. Prevention of C3
deposition by capsular polysaccharide is a virulence mechanism of type III group B streptococci. Infect Immun. 60(10):3986–3993.
Mian GF, Godoy DT, Leal CAG, Yuhara TY, Costa GM, Figueiredo HCP. 2009 Aspects of the natural history and virulence of Streptococcus agalactiae
20
Pritchard DG, Lin B. 1993. Group B streptococcal neuraminidase is actually a hyaluronidase. Infect Immun.61:3234-3239.
Rajagopal L. 2009. Understanding the regulation of group B streptococcal virulence factors. Future Microbiology. 4(2):201-221. doi:10.2217/17460913.4.2.201. Reed LJ, Muench H. 1938. A simple method of estimating fifty percent endpoints.
The American Journal of Hygiene. 27:493-497.
Robinson JA, Meyer FP. 1966. Streptococcal Fish Pathogen. J Bacteriol. 92(2):5- 12.
Rosenau A, Martins K, Amor S, Gannier F, Lanotte P, van der Mee-Marquet N, Mereghetti L, Quentin R. 2007. Evaluation of the ability of Streptococcus agalactiae strains isolated from genital and neonatal specimens to bind to human fibrinogen and correlation with characteristics of the fbsA and fbsB genes. Infect Immun. 75:1310–1317.
Schubert A, Zakikhany K, Schreiner M, Frank B, Spellerberg B, Eikmanns BJ, Reinscheid DJ. 2002. A fibrinogen receptor from group B Streptococcus interacts with fibrinogen by repetitive units with novel ligand binding sites.
Mol. Microbiol. 46(2):557–569.
Skalka B, Smola J. 1981. Lethal effect of CAMP-factor and UBERIS-factor – a new finding about diffusible exosubstances of Streptococcus agalactiae and
Streptococcus uberis. Zentral Bakteriol A. 249(2):190–194. doi:10.1016/s0174-3031(81)80073-X.
Standar Nasional Indonesia. 2009. Produksi ikan nila (Oreochromis niloticus
Bleeker) kelas pembesaran di kolam air tenang. Badan Standardisasi Nasional. SNI 7550 : 2009
Standar Nasional Indonesia. 2009. Metode identifikasi bakteri pada ikan secara konvensional bagian 3: Streptococcus iniae dan Streptococcus agalactiae. Badan Standardisasi Nasional. SNI 7545.3:539-546.
Takahashi S, Aoyagi Y, Adderson EE, Okuwaki G, Bohnsack JF. 1999. Capsular sialic acid limits C5a production on type III group B streptococci. Infect Immun. 67(4):1866-1870.
Vilches S, Urgell C, Merino SM, Chacon R, Soler L, Castro-Escarpulli G, Figueras MJ, Thomas, JM. 2004. Complete type III secretion system of a mesophilic
Aeromonas hydrophila strain. Appl Environ Microbiol 70(11): 6914-6919. doi.10.1128/AEM.70116914-6919.2004.
Wang B, Jian J, Cai S, Huang Y, Tang J, Wu Z. 2012. Complete genome sequence of Streptococcus agalactiae zq0910, a pathogen causing meningoencephalitis in the gift strain of nile tilapia (Oreochromis niloticus). J Bacteriol.
194(18):5132-5133. doi:10.1128/JB.01080-12.
Wongsathein D. 2012. Factors affecting experimental Streptococcus agalactiae
infection in tilapia, Oreochromis niloticus. (Disertation). Stirling: Institute of Aquaculture, University of Stirling.
Ye X, Li J, Lu M, Deng G, Jiang X, Tian Y, Quan Y, Jian, Q, 2011. Identification and molecular typing of Streptococcus agalactiae isolated from pond-cultured tilapia in China. Fisheries Science. 77:623–632. doi:10.1007/s.12562-011-0365-4.
21 Lampiran 1 Hasil uji karakteristik morfologi dan biokimia S. agalactiae sesuai
metode deteksi pada SNI 7545.3 : 2009
1. Hasil pengujian karakteristik morfologi dan biokimia S. agalactiae
Jenis Pengujian N3M N4M N17O NK1
Aktivitas Hemolitik - - - -
Pewarnaan Gram Gram + Gram + Gram + Gram +
Motilitas - - - -
Oksidatif/Fermentatif - - - -
Katalase - - - -
Oksidase - - - -
Bile Salt 40% - - - -
NaCl 6.5% + + + +
Aesculin hydrolysis - - - -
D-manitol - - - -
2. Hasil uji aktivitas hemolitik
3. Hasil uji pewarnaan Gram
N17O
NK1
N4M
N3M
22
Keterangan :
M: marker 100 bp, K: kontrol negatif
N3M, N4M, N17O dan NK1 : isolat S. agalactiae
23
Lampiran 3 Perkembangan gejala klinis dan kematian ikan pasca injeksi dengan isolat S. agalactiae
Isolat Dosis Gejala klinis dan kematian (ekor) pada pengamatan hari ke-
24
Isolat Dosis Gejala klinis /kematian (ekor) pada pengamatan hari ke-
25
Isolat Dosis Gejala klinis /kematian(ekor) pada pengamatan hari ke-
26
Isolat Dosis Gejala klinis /kematian (ekor) pada pengamatan hari ke-
1 2 3 4 5 6 7 8 9 10 11 12 13 14 Rt : berenang tidak teratur
27
Lampiran 4 Perhitungan LD50 isolat bakteri uji dengan metode Reed & Muench (1938)
1. Isolat N3M
Selang proporsi = , − ,, − , = ,
Log negatif LD50 = Log – 108 + 0,25 = -7,75 LD50 = 107,75
2. Isolat N4M
Hasil uji virulensi menunjukkan bahwa hingga akhir pengamatan, tingkat kematian pada perlakuan injeksi isolat N4M pada semua dosis tidak ada yang mencapai 50%
3. Isolat N17O
Selang proporsi = , − ,, − , = ,
Log negatif LD50 = Log – 107 + 0,25 = -6,67 LD50 = 106,67
4. Isolat NK1
Selang proporsi = , − ,, − , = ,
28
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 April 1978 sebagai anak sulung dari Bapak M. Zaenuddin dan Ibu Rini Turaeni. Penulis menempuh pendidikan sarjana pada tahun 1996 di program studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB dan menamatkannya pada tahun 2001. Penulis bekerja sebagai Pegawai Negeri Sipil di Pusat Karantina Ikan Badan Karantina Ikan, Pengendalian Mutu dan Kemanan Hasil Perikanan sejak tahun 2002 hingga saat ini. Pada tahun 2012 penulis memperoleh kesempatan melanjutkan pendidikan di Sekolah Pascasarjana Institut Pertanian Bogor pada program studi Ilmu Akuakultur melalui Program Tugas Belajar dari Badan Pengembangan Sumberdaya Manusia Kementerian Kelautan dan Perikanan.