UIN SYARIF HIDAYATULLAH JAKARTA
Pengaruh Iradiasi Gamma terhadap
Aktivitas Antibakteri Kombinasi Ekstrak Etanol
Temu Putih (
Curcuma zedoaria
(Christm.) Roscoe.) dan
Mahkota Dewa (
Phaleria macrocarpa
(Scheff) Boerl.)
pada Bakteri
Bacillus subtilis
dan
Staphylococcus aureus
SKRIPSI
MEGA ARMAYANI
108102000059
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
UIN SYARIF HIDAYATULLAH JAKARTA
Pengaruh Iradiasi Gamma terhadap
Aktivitas Antibakteri Kombinasi Ekstrak Etanol
Temu Putih (
Curcuma zedoaria
(Christm.) Roscoe.) dan
Mahkota Dewa (
Phaleria macrocarpa
(Scheff) Boerl.)
pada Bakteri
Bacillus subtilis
dan
Staphylococcus aureus
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
MEGA ARMAYANI
108102000059
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Mega Armayani
NIM : 108102000059
Tanda Tangan :
iv
HALAMAN PERSETUJUAN PEMBIMBING
Nama : MEGA ARMAYANI
NIM : 108102000059
Program Studi : Strata-1 Farmasi
Judul : Pengaruh Iradiasi Gamma terhadap Aktivitas Antibakteri Kombinasi Ekstrak Etanol Temu Putih (Curcuma zedoaria (Christm.) Roscoe.) dan Mahkota Dewa (Phaleria macrocarpa (Scheff) Boerl.) pada Bakteri Bacillus subtilis dan Staphylococcus aureus
Disetujui Oleh :
Pembimbing I Pembimbing II
Zilhadia, M.Si., Apt NIP: 19730822 200801 2 007
Drs. Nikham
NIP. 19520829 198303 1 001
Megetahui,
Ketua Program Studi
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh : Nama : Mega Armayani
NIM : 108102000059
Program Studi : Strata-1 Farmasi
Judul : Pengaruh Iradiasi Gamma terhadap Aktivitas Antibakteri Kombinasi Ekstrak Etanol Temu Putih (Curcuma zedoaria (Christm.) Roscoe.) dan Mahkota Dewa (Phaleria macrocarpa (Scheff) Boerl.) pada Bakteri Bacillus subtilis dan Staphylococcus aureus
Telah berhasil dipertahankan di hadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing I : Zilhadia, M.Si., Apt ( )
Pembimbing II : Drs. Nikham ( )
Penguji I : Ismiarni Komala, M.Sc., PhD., Apt ( )
Penguji II : Puteri Amelia, M.Si., Apt ( )
Penguji III : Lina Elfita, M.Si., Apt ( )
Ditetapkan di : Jakarta
Tanggal : 16 Januari 2013
Mengetahui,
Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN)
vi
ABSTRAK
Nama : Mega Armayani Program Studi : Strata-1 Farmasi
Judul : Pengaruh Iradiasi Gamma terhadap Aktivitas Antibakteri Kombinasi Ekstrak Etanol Temu Putih (Curcuma zedoaria (Christm.) Roscoe.) dan Mahkota Dewa (Phaleria macrocarpa (Scheff) Boerl.) pada Bakteri Bacillus subtilis dan Staphylococcus aureus
Iradiasi gamma telah digunakan oleh industri obat herbal untuk menghilangkan cemaran mikroba sebagai salah satu metode pengawetan sediaan obat. Namun, pengaruh iradiasi gamma terhadap khasiat tanaman obat belum banyak diteliti. Penelitian ini bertujuan untuk mengetahui pengaruh iradiasi gamma dosis 10 kGy terhadap khasiat antibakteri kombinasi ekstrak etanol rimpang temu putih (Curcuma zeodaria, Christm.) dan buah mahkota dewa (Phaleria macrocarpa, Boerl) dengan menggunakan metode difusi dan dilusi agar. Uji daya hambat metode difusi terhadap kombinasi ekstrak etanol rimpang temu putih dengan buah mahkota dewa hasil iradiasi dan non iradiasi menunjukkan diameter zona bening terhadap Bacillus subtilis sebesar 10-12 mm dan terhadap Staphylococcus aureus sebesar 8-10 mm. Sedangkan, uji konsentrasi hambat minimum menggunakan metode dilusi agar menujukkan bahwa kombinasi ekstrak etanol rimpang temu putih dan mahkota dewa hasil iradiasi maupun tanpa iradiasi hanya mampu menghambat kurang dari 99% pertumbahan bakteri uji. Berdasarkan uji T data berpasangan terhadap Bacillus subtilis menunjukkan terdapat perbedaan yang signifikan pada kemampuan ekstrak etanol kombinasi temu putih dan mahkota dewa untuk menghambat pertumbuhan bakteri sebelum dan setelah diiradiasi. Begitu pula Uji T yang dilakukan terhadap Staphylococcus aureus menunjukkan bahwa terdapat perbedaan yang signifikan pada kemampuan ekstrak etanol kombinasi temu putih dan mahkota dewa untuk menghambat pertumbuhan bakteri sebelum dan setelah iradiasi.
ABSTRACT
Name : Mega Armayani
Program Study : Strata-1 Farmasi
Title : Gamma Iradiation Effect of Combination Ethanol Extract Temu Putih (Curcuma zedoaria (Christm.) Roscoe.) and Mahkota Dewa (Phaleria macrocarpa (Scheff) Boerl.) to Bacillus subtilis and Staphylococcus aureus
Gamma irradiation has been used by herbal medicine industry to eliminate microbial contamination as a method to preserving the medicinal plants. However, the effect of gamma irradiation on the efficacy of medicinal plants has not been much studied. This study aimed to determine the effect of gamma irradiation dose 10 kGy on antibacterial efficacy combination of ethanol extract temu putih (Curcuma zedoaria (Christm.) Roscoe.) and mahkota dewa (Phaleria macrocarpa (Scheff) Boerl.) by using diffusion and agar dilution method. Test of inhibition by diffusion method on combination of ethanol extract temu putih and mahkota dewa with irradiated and non-irradiated, demonstrate that the inhibition zone extract to Bacillus subtilis is 10-12 mm and to Staphylococcus aureus is 8-10 mm. Meanwhile, the minimum inhibitory concentration test using agar dilution method shows that the combination of ethanol extract temu putih and mahkota dewa with irradiated and non-irradiated, inhibit less than 99% the growth of bacteria. The result of Paired Sample T-test to Bacillus subtilis shows that there are a significant differences on ability of combination of ethanol extract temu putih and mahkota dewa to inhibit bacterial growth before and after irradiated. Similarly, Paired Sample T-test to Staphylococcus aureus shows that there are significant differences on ability of combination of ethanol extract temu putih and mahkota dewa to inhibit bacterial growth before and after irradiated.
viii
KATA PENGANTAR
Segala puji dan syukur kehadirat Allah SWT yang senantiasa mencurahkan segala rahmat-Nya kepada kita semua, khususnya penulis dalam menyelesaikan
skripsi yang berjudul “Pengaruh Iradiasi Gamma terhadap Aktivitas Antibakteri Kombinasi Ekstrak Etanol Temu Putih (Curcuma zedoaria (Christm.) Roscoe.) dan Mahkota Dewa (Phaleria macrocarpa (Scheff) Boerl.) pada Bakteri Bacillus subtilis dan Staphylococcus aureus”. Shalawat dan salam senantiasa
terlimpah kepada junjungan kita Nabi Muhammad SAW, teladan bagi umat manusia dalam menjalani kehidupan.
Skripsi ini disusun berdasarkan hasil penelitian di Laboratorium Kimia dan Mikrobiologi Gedung Produk Makanan dan Kesehatan Pusat Penelitian dan Pengembangan Teknologi Isotop dan Radiasi (PATIR) Badan Tenaga Nuklir Nasional (BATAN), serta teori yang didapat dari berbagai literatur. Dalam menyelesaikan masa perkuliahan sampai penulisan skripsi ini tentu banyak berbagai kesulitan dan halangan yang menyertai, sehingga penulis tidak terlepas dari doa, bantuan dan bimbingan banyak pihak. Oleh karena itu, ucapan terima kasih penulis haturkan kepada:
1. Ibu Zilhadia, M.Sc.,Apt sebagai Pembimbing I dan Bapak Drs. Nikham sebagai Pembimbing II yang telah memberikan ilmu, nasehat, waktu, tenaga, dan pikiran selama penelitian dan penulisan skripsi.
2. Ibu Taty Erlinda selaku pembimbing teknis di Laboratorium Steril PATIR BATAN dan Bapak DR. Darmawan Darwis, Apt., selaku kepala PUSLITBANG PATIR BATAN, Ibu Lely Hardiningsih, Ibu Nani Suryani, Ibu Yesi, Ibu Yayuk, Bapak Ir. Basril Abas, kak Farah, kak Ayu beserta seluruh staf di Laboratorium Sterilisasi Bidang Proses Radiasi PATIR BATAN, yang telah memberikan bantuan selama penulis melakukan penelitian.
4. Bapak Drs. Umar Mansur,M.Sc.,Apt selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
5. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan bimbingan dan bantuan selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
6. Kedua orang tua tercinta, Ayah Armen dan Ibu Erniwati atas kasih sayang, dukungan moral, material, nasehat-nasehat, serta lantunan doa setiap waktu. 7. Kakak Deswelli, Alex Strio dan Irwansyah yang selalu memberikan arahan
dan semangat. Nugrah Reza Fahlepi dan Dafi Tarendra Chava yang selalu tersenyum memberikan keceriaan dan semangat untuk meraih cita.
8. Teman-teman di Program Studi Farmasi : Eva, Hesty, Inda, Megawati, Zulfa, serta teman-teman beta lactam tercinta dan alcoolique atas semangat dan kebersamaan kita selama perkuliahan berlangsung.
9. Teman-teman seperjuangan di Laboratorium PATIR BATAN: Deka, Fera, Anita dan Alfira atas bantuan yang telah teman-teman berikan.
10. Semua pihak yang telah membantu penulis selama melakukan penelitian dan penulisan.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah SWT. Penulis menyadari bahwa masih banyak kekurangan dalam penulisan ini, oleh karena itu kritik dan saran sangat diharapkan demi perbaikan skripsi ini. Dan semoga skripsi ini bisa bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 16 Januari 2013
x
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Mega Armayani
NIM : 108102000059
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
PENGARUH IRADIASI GAMMA TERHADAP
AKTIVITAS ANTIBAKTERI KOMBINASI EKSTRAK ETANOL TEMU PUTIH (Curcuma zedoaria (Christm.) Roscoe.) DAN
MAHKOTA DEWA (Phaleria macrocarpa (Scheff) Boerl.) PADA BAKTERI Bacillus subtilis DAN Staphylococcus aureus
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Demikian pernyataan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada tanggal : 16 Januari 2013
Yang menyatakan,
DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.3.1.1 Ekstraksi dengan menggunakan pelarut ... 7
2.3.1.2 Destilasi uap ... 9
2.3.1.3 Ekstraksi cara lainnya ... 10
2.4 Bakteri Uji ... 10
2.4.1 Bacillus subtillis ... 10
2.4.2 Staphylococcus aureus ... 10
2.5 Antibakteri ... 11
2.5.1 Definisi ... 11
2.5.2 Mekanisme Kerja Antibakteri ... 11
2.6 Metode Pengujian Antibakteri ... 13
2.6.1 Metode Difusi ... 13
xii
2.8.3 Keunggulan Pengguanaan Iradiasi ... 17
2.8.4 Legalitas Iradiasi ... 18
2.8.5 Iradiator Karet Alam ... 18
BAB 3 METODELOGI PENELITIAN 3.1 Waktu dan Tempat penelitian ... 20
3.4.5 Penapisan Fitokimia Ekstrak ... 23
DAFTAR TABEL
Tabel Halaman
2.1 Penentuan Dosis Iradiasi ... 17
4.1 Hasil Rendemen Ekstrak ... 27
4.2 Hasil Standarisasi Ekstrak ... 28
4.3 Hasil Penapisan Kandungan Senyawa Kimia ... 30
4.4 Hasil Konsentrasi Bakteri Uji ... 32
4.5 Hasil Diameter Zona Hambat terhadap Bacillus subtilis ... 33
4.6 Hasil Diameter Zona Hambat terhadap Staphylococcus aureus ... 33
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman Temu Putih Curcuma zedoaria (Christm.) Roscoe.. 4 Gambar 2. Tanaman Mahkota Dewa Phaleria macrocarpa(Scheff.)Boerl 6 Gambar 3. Rumus Bangun Kanamisin Sulfat ... 15 Gambar 4. Diagram Perbandingan Diameter Zona Hambat Kombinasi
Ekstrak Etanol Temu Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Bacillus subtilis ... 34 Gambar 5. Diagram Perbandingan Diameter Zona Hambat Kombinasi
Ekstrak Etanol Temu Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Staphylococcus aureus ... 35 Gambar 6. Grafik Persen Hambatan Kombinasi Ekstrak Etanol Temu
Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Bacillus subtilis ... 36 Gambar 7. Grafik Persen Hambatan Kombinasi Ekstrak Etanol Temu
Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Staphylococcus aureus ... 37 Gambar 8. Foto Bakteri Bacillus subtilis Pada Perbesaran 1000x ... 60 Gambar 9. Foto Bakteri Staphylococcus aureus Pada Perbesaran 1000x.. 60 Gambar 10. Uji Daya Hambat Antibakteri Ekstrak Rimpang Temu Putih
terhadap Bacillus subtilis ... 61 Gambar 11. Uji Daya Hambat Antibakteri Ekstrak Etanol Buah Mahkota
Dewa terhadap Bacillus subtilis ... 61 Gambar 12. Uji Daya Hambat Antibakteri Kombinasi Ekstrak Etanol
Rimpang Temu Putih : Buah Mahkota Dewa (1:1) terhadap Bacillus subtilis ... 62 Gambar 13. Uji Daya Hambat Antibakteri Ekstrak Rimpang Temu Putih
terhadap Staphylococcus aureus ... 63 Gambar 14. Uji Daya Hambat Antibakteri Ekstrak Buah Mahkota Dewa
terhadap Staphylococcus aureus ... 63 Gambar 15. Uji Daya Hambat Antibakteri Kombinasi Ekstrak Rimpang
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Determinasi Tanaman Rimpang Temu Putih ... 44
Lampiran 2. Hasil Determinasi Tanaman Buah Mahkota Dewa ... 45
Lampiran 3. Uji Statistik Pengaruh Iradiasi terhadap Aktivitas Antibakteri Ekstrak Etanol Kombinasi Rimpang Temu Putih dan Buah Mahkota Dewa pada Bacillus subtilis ... 46
Lampiran 4. Uji Statistik Pengaruh Iradiasi terhadap Aktivitas Antibakteri Ekstrak Etanol Kombinasi Rimpang Temu Putih dan Buah Mahkota Dewa pada Staphylococcus aureus 48 Lampiran 5. Alur Kerja ... 50
Lampiran 6. Skema Inokulum Bakteri ... 51
Lampiran 7. Perhitungan Hasil Standardisasi Ekstrak dan Rendemen Ekstrak ... 52
Lampiran 8. Perhitungan Hasil Konsentrasi Inokulum Bakteri ... 58
Lampiran 9. Hasil Identifikasi Bakteri ... 60
Lampiran 10. Uji Zona Hambat Ekstrak terhadap Bacillus subtilis ... 61
Lampiran 11. Uji Zona Hambat Ekstrak terhadap Staphylococcus aureus .. 63
Lampiran 12. Uji Konsentrasi Hambat Minumum terhadap Bacillus subtilis ... 65
Lampiran 13. Uji KonsentrasiHambat Minumum terhadap Staphylococcus aureus ... 65
Lampiran 14. Hasil Penentuan Konsentrasi Hambat Minimum Kombinasi Ekstrak Etanol Temu Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Bacillus subtilis ... 67
xvi
DAFTAR ISTILAH
KBM : Konsentrasi Bunuh Minimum
KHM : Konsentrasi Hambat Minimum
MBC : Minimum Bactericidal Concentration
MIC : Minimum Inhibitory Concentration
TPC : Total Plate Count
NA : Nutrient Agar
TSA : Triyptic Soy Agar
TSB : Tryptic Soy Broth
µg : mikro gram
g : gram
µL : mikro liter
mL : mili liter
L : liter
mm : milimeter
cm : centi meter
m : meter
Ci : curie
eV : elektron volt
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Tanaman merupakan salah satu sumber daya yang menjanjikan dalam penemuan agen antibakteri baru. Sejumlah penelitian telah dilakukan pada tanaman untuk memastikan potensi antibakteri pada obat-obatan herbal terhadap mikroorganisme (Aliahmadi et al., 2011 dan Viswanad et al., 2011). Salah satu tanaman potensial yang digunakan sebagai antibakteri adalah mahkota dewa dan temu putih.
Mahkota Dewa atau Phaleria macrocarpa (Scheff.) Boerl. telah digunakan secara tradisional di Indonesia untuk pengobatan kanker dan juga untuk menyembuhkan banyak penyakit seperti lever, jantung, diabetes, penyakit kulit, rematik, antihistamin, dan menurunkan tingkat kolesterol. Efek terapi dari bahan alam tersebut berkaitan langsung dengan senyawa kimia yang terkandung di dalamnya (Yosie et al., 2011).
Penelitian Puslitbang Farmasi dan Obat Tradisional Departemen Kesehatan, menyimpulkan bahwa kandungan zat dalam buah mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) meliputi alkaloid, tanin, saponin, flavonoid, dan polifenol (Susanti, 2009). Hendra et al., (2010) menyatakan bahwa buah mahkota dewa (P. macrocarpa) dapat berfungsi sebagai antibakteri terhadap Bacillus cereus, Bacillus subtilis, Staphylococcus aureus, Micrococcus luteus,
Klebsiella pnuomoniae, Enterobacter aerogenes, Escherichia coli dan Pseudomonas aeruginosa.
Curcuma zedoaria (Christm.) Roscoe atau dikenal dengan nama temu
putih memiliki beberapa aktivitas biologis, diantaranya sebagai antibakteri, antihepatotoksik, analgesik, antikanker, antiinflamasi, antioksidan, antijamur, serta aktivitas anti-mutagenik (Bohm, 2009 dan Harahap et al., 2008).
Curcuma zedoaria (Christm.) Roscoe. mengandung kurkuminoid, meliputi
isokurkuimenol, aerugidiol, zedoarondiol dan kurkumenon yang memberikan aktivitas biologis (Bohm, 2009). Berdasarkan hasil penelitian terdahulu ekstrak rimpang temu putih memiliki aktivitas antibakteri terhadap Salmonella typhi, Salmonella paratyphi, Escherichia coli, Shigella boydii, Shigella dysenteriae,
Shigella sonnei, dan Staphylococcus aureus (Shahriar, 2010 dan Bugno et al., 2007).
Berbagai khasiat yang dimiliki oleh tanaman sebagaimana tanaman potensial di atas, telah mendorong industri-industri herbal untuk memproduksi berbagai sediaan dalam bentuk ekstrak dengan tanaman sebagai bahan baku. Salah satunya adalah kombinasi dari ekstrak temu putih dan mahkota dewa yang dikemas dalam bentuk sediaan farmasi, dimana secara tradisional kedua tanaman ini telah dimanfaatkan sebagai antibakteri. Penggunaan tanaman sebagai bahan baku sediaan obat ini memiliki beberapa kekurangan, diantaranya masalah stabilitas karena adanya cemaran mikroba. Untuk mengatasi hal tersebut salah satu alternatif yang dapat digunakan adalah teknik iradiasi gamma. Pada dosis yang tepat, iradiasi gamma dapat mengurangi jumlah cemaran mikroba sehingga dapat mempertahankan kualitas dan keamanan bahan simplisia.
Penggunaan iradiasi gamma memiliki keunggulan, diantaranya mempunyai daya tembus besar, tidak menaikkan suhu bahan yang diproses, bahan dapat diiradiasi setelah dikemas, tidak meninggalkan residu dan ramah lingkungan. Sterilisasi menggunakan iradiasi gamma dengan dosis 5 kGy telah direkomendasikan di Cina, sedang peneliti lain menyatakan bahwa iradiasi gamma dosis < 10 kGy dapat digunakan untuk mendekontaminasi mikroba dalam sampel herbal (Winarno et al., 2010).
batang mahkota dewa tanpa menurunkan aktivitas sitotoksiknya (Winarno et al., 2010).
Beberapa industri herbal kini telah menggunakan iradiasi gamma sebagai metode pengawetan terhadap simplisia (Winarno et al., 2010) dan sebagiannya telah menggunakan iradiasi gamma untuk sterilisasi ekstrak yang telah dikombinasi. Meski iradiasi gamma telah lama digunakan pada beberapa industri herbal, namun pengaruh iradiasi terhadap aktivitas zat aktif dalam ekstrak yang dikombinasi belum banyak dipelajari. Oleh karena itu, penelitian mengenai pengaruh iradiasi gamma terhadap aktivitas antibakteri kombinasi ekstrak etanol temu putih (Curcuma zedoaria) dan mahkota dewa (Phaleria macrocarpa) ini perlu dilakukan.
1.2 Rumusan Masalah
Apakah kombinasi ekstrak etanol temu putih (Curcuma zedoaria) dan mahkota dewa (Phaleria macrocarpa) hasil iradiasi sinar gamma dosis 10 kGy masih memiliki aktivitas antibakteri terhadap Bacillus subtillis dan Staphylococcus aureus?
1.3 Tujuan Penelitian
Mengetahui pengaruh iradiasi gamma dosis 10 kGy pada aktivitas antibakteri kombonasi ekstrak etanol temu putih (Curcuma zedoaria) dan mahkota dewa (Phaleria macrocarpa) terhadap Bacillus subtillis dan Staphylococcus aureus.
1.4 Manfaat Penelitian
4
BAB 2
TINJAUAN PUSTAKA
2.1 TanamanTemu Putih
Gambar 1. Tanaman Temu Putih Curcuma zedoaria (Christm.) Roscoe. (Koleksi Pribadi)
2.1.1 Taksonomi (Hutapea et al., 1993)
Klasifikasi tanaman temu putih (Curcuma zedoaria) adalah sebagai berikut:
Kingdom : Plantarum Divisi : Spermatophyta Subdivisi : Angiospermae Class : Monocotyledonae Ordo : Zingiberales Family : Zingiberaceae Genus : Curcuma
Species : Curcuma zedoaria (Berg.) Roscoe.
2.1.2 Morfologi
bundar lonjong, punggung daun licin dan tidak berbulu. Dari pertengahan daun sampai kepangkalnya berwarna ungu. Tandan bunga keluar dari umbi batang dan berdaun pelindung yang bentuknya tumpul. Pelepah bunga berbentuk bundar telur atau melengkung seperti perahu. Pelindung bunga berwarna merah tua atau keunguan. Pelindung bunga berwarna kuning tua. Mahkota bunga berwarna kuning tua. Buahnya berbentuk bundar, kulitnya tipis dan jika pecah tidak teratur. Bijinya lonjong berselaput dan di bagian ujung berwarna putih. Akar berwarna putih dan berbentuk serabut. Rasa rimpang pahit, pedas dan tajam (Bermawie et al., 2007).
2.1.3 Kandungan Kimia
Iswantini et al., 2003 yang menyatakan bahwa ekstrak rimpang temu putih mengandung senyawa terpenoid, alkaloid dan flavonoid. Hasil isolasi Curcuma zedoaria (Christm.) Roscoe mununjukkan kandungan kurkuminoid, meliputi
kurkumin, demetoksikurkumin dan bisdemetoksikurkumin dan minyak atsiri termasuk seskuiterpene dan monoterpen. Senyawa seskuiterpen utama, termasuk dehidrokurdion, furanodien, germakron, kurdion, kurkumenol, neokurdion, isokurkuimenol, aerugidiol, zedoarondiol dan kurkumenon merupakan senyawa yang diduga memberikan aktivitas biologis (Syu et al., 1998; Yoshioka et al., 1998 dan Mau et al., 2003).
2.1.4 Manfaat Tumbuhan
Curcuma zedoaria (Christm.) Roscoe atau dikenal dengan nama temu
2.2 Tanaman Mahkota Dewa
Gambar 2. Tanaman Mahkota Dewa Phaleria macrocarpa (Scheff.) Boerl.
(Koleksi Pribadi)
2.2.1 Taksonomi
Berikut ini klasifikasi dari mahkota dewa (Inventaris Tanaman Obat Indonesia (V). 1999):
Kingdom : Plantae Subkingdom : Tracheobionta Divisi : Spermatophyta Subdivisi : Angiospermae Class : Dycotiledoneae Ordo : Thymelaeales Family : Thymelaeaceae Genus : Phaleria
Species : Phaleria macrocarpa (Scheff.) Boerl.
2.2.2 Morfologi
berkelamin ganda, benang sari melekat pada mahkota, putik keluar dan tabung mahkota, panjang 2-2,5 cm, putih. Buah mahkota dewa berbentuk bulat atau bulat telur, tunggal, panjang 4-6 cm, diameter 3-5 cm, permukaan licin, beralur dan berwarna merah. Biji bulat, keras, warna coklat. Akar tunggang, kuning kecoklatan.
2.2.3 Kandungan Kimia
Penelitian Puslitbang Farmasi dan Obat Tradisional Departemen Kesehatan, menyimpulkan bahwa kandungan zat dalam buah mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) meliputi alkaloid, tanin, saponin, flavonoid dan polifenol (Susanti, 2009). Hasil isolasi buah mahkota dewa
menunjukkan bahwa di dalamnya terdapat beberapa senyawa, antara lain : 4,4’ -dihidroksi-2-metoksibenzofenon-6-O-β-D-glukopiranosida yang selanjutnya diberi nama mahkosida A, mangiferin, kaemferol-3-O-β-D-glukosida, asam
dodekanoat, asam palmitat, etil stearat, sukrosa dan 2,4’-dihidroksi-4-metoksi benzofenon-6-O-α-D-glukopiranosida. Isomer senyawa 2,4’ -dihidroksi-4-metoksibenzofenon-6-O-α-D-glukopiranosida dalam bentuk β-D-glukopiranosida ditemukan dalam daun mahkota dewa yang selanjutnya diberi nama phalerin dan juga ditemukan dalam kulit batang mahkota dewa (Winarno et al.,. 2010).
2.2.4 Manfaat Tanaman
Mahkota dewa atau Phaleria macrocarpa (Scheff.) Boerl. telah digunakan secara tradisional di Indonesia untuk pengobatan kanker dan juga untuk menyembuhkan banyak penyakit seperti lever, jantung, diabetes, rematik, antihistamin, antibakteri dan menurunkan tingkat kolesterol. Efek terapi dari bahan alam tersebut berkaitan langsung dengan senyawa kimia yang terkandung di dalamnya (Yosie et al., 2011). Berdasarkan hasil penelitian terdahulu ekstrak rimpang temu putih memiliki aktivitas antibakteri terhadap Salmonella typhi, Salmonella paratyphi, Escherichia coli, Shigella boydii, Shigella dysenteriae,
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga dapat terpisah dari bahan yang tidak dapat larut dari pelarut cair.
Simplisia yang diekstrak mengandung senyawa aktif yang dapat larut dan
senyawa yang tidak dapat larut seperti serat, karbohidrat, protein dan lain-lain.
Senyawa aktif yang terdapat dalam simplisia dapat digolongkan ke dalam minyak
atsiri, alkaloid, flavonoid dan lain-lain. Struktur kimia yang berbeda-beda akan
mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap
pemanasan, udara, cahaya, logam berat dan derajat keasaman. Dengan
diketahuinya senyawa aktif yang terkandung dalam simplisia akan mempermudah
pemilihan pelarut dan metode ekstraksi yang tepat (Ratiasa et al. ,2000).
Menurut Farmakope Indonesia Edisi IV ekstrak adalah sediaan pekat yang
diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan masa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan.
2.3.1 Metode ekstraksi (Parameter Standar Umum Ekstrak Tumbuhan Obat. 2000)
2.3.1.1. Ekstraksi dengan menggunakan pelarut
1. Cara dingin a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya.
b. Perkolasi
temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/ penampungan ekstrak), terus menerus sampai diperoleh ekstrak (perkolat) yang jumlahnya 1-5 kali bahan.
2. Cara panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Soklet
Soklet adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50oC.
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C) selama waktu tertentu (15-20 menit).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (≥30 menit) dan
temperatur sampai titik didih air.
2.3.1.2. Destilasiuap
(senyawa kandungan menguap ikut terdestilasi) menjadi destilat air bersama senyawa kandungan yang memisah sempurna atau memisah sebagian.
2.3.1.3. Cara ekstraksi lainnya
Cara ekstraksi lainnya ialah ekstraksi berkesinambungan, superkritikal karbondioksida, ekstraksi ultrasonik, ekstraksi energi listrik.
2.4 Bakteri Uji
Pada penelitian ini digunakan 2 bakteri uji yakni Bacillus subtilis dan Staphylococus aureus. Kedua bakteri ini merupakan bakteri yang umumnya menyebabkan berbagai penyakit infeksi seperti diare, penyakit kulit dan lain-lain (Buku Ajar Mikrobiologi Kedokteran. 1994):
2.4.1 Bacillus subtilis
Klasifikasi Bacillus subtilis adalah sebagai berikut: Ordo : Eubacteriales
Family : Bacillaceae Genus : Bacillus
Spesies : Bacillus subtilis
Bacillus subtilis merupakan bakteri gram positif berbentuk batang, bersifat
aerob dan dapat membentuk spora. Bakteri ini banyak terdapat dalam tanah, air, udara dan tumbuh-tumbuhan. Bacillus subtilis dapat menyebabkan meningitis, endokarditis, infeksi mata dan lain-lainnya.
2.4.2 Staphylococcus aureus
Klasifikasi Staphylococcus aureus adalah sebagai berikut: Ordo : Eubacteriales
Family : Micrococcaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus
2.5 Antibakteri 2.5.1 Definisi
Antibakteri didefinisikan sebagai obat-obatan yang aktif terhadap pertumbuhan bakteri yang terdiri dari dua jenis: yang diproduksi oleh mikroorganisme digolongkan sebagai antibiotik dan obat-obatan sintetis. Bentuk antibiotik kelompok terbesar dan ini dapat didefinisikan sebagai zat yang diproduksi oleh mikroorganisme, menghambat pertumbuhan atau membunuh mikroorganisme lain (Departemen Farmakologi dan Terapeutik, 2009).
2.5.2 Mekanisme Kerja Antibakteri
Mekanisme penghambatan mikroorganisme oleh senyawa antibakteri dapat disebabkan oleh beberapa faktor, antara lain: (1) gangguan pada senyawa penyusun dinding sel, (2) peningkatan permeabilitas membran sel yang dapat menyebabkan kehilangan komponen penyusun sel, (3) menginaktivasi enzim dan (4) destruksi atau kerusakan fungsi material genetik. Kemampuan senyawa antibakteri untuk menghambat aktivitas pertumbuhan bakteri dalam sistem pangan dapat dipengaruhi oleh beberapa faktor diantaranya temperatur, pH (keasaman), ketersediaan oksigen dan interaksi/sinergi antara beberapa faktor tersebut.
Berdasarkan mekanisme kerjanya, antibakteri dibagi dalam lima kelompok:
1. Antibakteri yang menghambat metabolisme sel bakteri
2. Antibakteri yang menghambat sintesis dinding sel bakteri
Obat yang termasuk dalam kelompok ini ialah penisilin, sefalosporin, basitrasin, vankomisin dan sikloserin. Dinding sel bakteri terdiri dari peptidoglikan yaitu suatu kompleks polimer mukopeptida (glikopeptida). Sikloserin menghambat reaksi yang paling dini dalam proses sintesis dinding sel; diikuti berturut-turut oleh basitrasin, vankomisin dan diakhiri oleh penisilin dan sefalosporin, yang menghambat reaksi terakhir (transpeptidasi) dalam rangkaian reaksi tersebut.
3. Antibakteri yang mengganggu keutuhan membran sel bakteri
Obat yang termasuk dalam kelompok ini adalah polimiksin, golongan polien serta antibakteri kemoterapeutik, seperti antiseptik tegangan permukaan. Polimiksin sebagai senyawa ammonium kuarterner dapat merusak membran sel setelah bereaksi dengan fosfat pada fosfolipid membran sel bakteri. Polimiksin tidak efektif terhadap bakteri gram-positif karena jumlah fosfor bakteri ini rendah. Antiseptik yang mengubah tegangan permukaan (surface active agent), dapat merusak permeabilitas selektif dari membran sel bakteri. Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting dari dalam sel bakteri yaitu protein, asam nukleat, nukleotida dan lain-lain.
4. Antibakteri yang menghambat sintesis protein sel bakteri
Obat yang termasuk dalam kelompok ini ialah golongan aminoglikosida, makrolid, linkomisin, tertasiklin dan kloramfenikol. Untuk kehidupannya, sel bakteri perlu mensintesis berbagai protein. Sintesis protein berlangsung di ribosom, dengan bantuan mRNA dan tRNA. Pada bakteri, ribosom terdiri atas dua subunit, yang berdasarkan konstanta sedimentasi dinyatakan sebagai ribosom 30S dan 50S. Agar dapat berfungsi pada sintesis protein, kedua komponen ini akan bersatu pada pangkal rantai mRNA menjadi ribosom 70S.
5. Antibakteri yang menghambat sintesis asam nukleat sel bakteri
2.6 Metode Pengujian Antibakteri
Pengujian bakteri secara in vitro bertujuan untuk mengetahui senyawa antibakteri yang dapat digunakan untuk mengatasi infeksi oleh bakteri tersebut. Metode pengujian aktivitas antibakteri dibagi berdasarkan pada masing-masing prinsip yang digunakan, meliputi:
2.6.1 Metode Difusi
Zat antibakteri ditentukan aktivitasnya berdasarkan kemampuan berdifusi pada lempeng agar yang telah diinokulasi dengan bakteri uji. Pengamatan yang dilakukan adalah dengan melihat ada atau tidaknya zona hambatan (daerah bening yang tidak nampak adanya pertumbuhan bakteri) yang terbentuk di sekeliling zat antibakteri. Metode ini dapat dilakukan dengan 3 cara, yaitu:
1. Teknik cakram
Metode ini melibatkan kertas cakram yang berfungsi sebagai tempat menampung zat antibakteri. Kertas cakram ini diletakkan dipermukaan medium padat (agar) yang mengandung kultur mikroorganisme yang telah ditumbuhkan. Beberapa cakram (multidiscs) mengandung berbagai obat yang berbeda yang akan diuji dan informasi yang diperoleh dari disk tersebut tidak hanya menentukan antibiotik atau obat yang mungkin efektif terhadap infeksi tertentu, tetapi juga obat yang tidak efektif. Lempeng agar yang telah ditanami bakteri kemudian diinkubasi pada suhu 37oC selama 18-24 jam. Hambatan akan terlihat sebagai daerah yang tidak memperlihatkan adanya pertumbuhan bakteri di sekitar cakram. Lebar daerah hambatan ini tergantung pada daya resap obat ke dalam agar dan kepekaan bakteri terhadap obat tersebut.
2. Teknik parit
medium agar dan diisi dengan larutan yang akan diuji. Kemudian diinkubasi pada suhu 37oC selama 18-24 jam. Dilakukan pengamatan dengan melihat ada atau tidaknya zona hambatan di sekeliling lubang atau cawan.
2.6.2 Metode Dilusi
Metode dilusi dibagi menjadi dua, yaitu dilusi cair/broth dilution dan dilusi agar/agar dilution (Pratiwi. 2008):
1. Metode Dilusi Cair/Broth Dilution Test
Metode ini digunakan untuk menentukan nilai MIC/KHM (Minimum Inhibitory Concentration atau Kadar Hambat Minimum) dan MBC/KBM
(Minimum Bactericidal Concentration atau Kadar Bunuh Minimum). Cara yang dilakukan adalah dengan membuat seri pengenceran agen antibakteri pada medium cair yang ditambahkan dengan bakteri uji. Larutan uji agen antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri ini ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan bakteri uji ataupun agen antibakteri dan diinkubasi selama 18-24 jam. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai KBM.
2. Metode Dilusi Agar/Agar Dilution Test
Metode ini serupa dengan metode dilusi cair, namun menggunakan media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen antibakteri yang diuji dapat digunakan untuk menguji beberapa bakteri uji.
2.7 Obat Antibiotik Pembanding 2.7.1 Kanamisin
Kanamisin yang digunakan sebagai pembanding memiliki karakteristik sebagai berikut (Martindale The Extra Pharmacopoeia, thirty-six edition, 1982): 1. Sifat fisikokimia
O
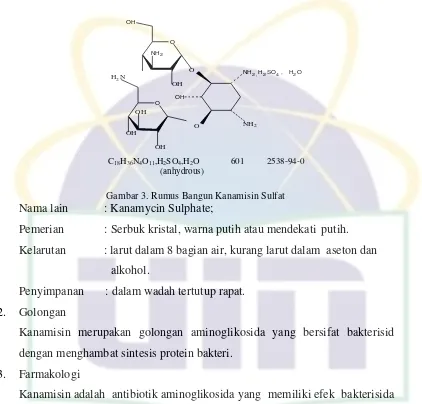
Gambar 3. Rumus Bangun Kanamisin Sulfat
Nama lain : Kanamycin Sulphate;
Pemerian : Serbuk kristal, warna putih atau mendekati putih. Kelarutan : larut dalam 8 bagian air, kurang larut dalam aseton dan
alkohol.
Penyimpanan : dalam wadah tertutup rapat. 2. Golongan
Kanamisin merupakan golongan aminoglikosida yang bersifat bakterisid dengan menghambat sintesis protein bakteri.
3. Farmakologi
Kanamisin adalah antibiotik aminoglikosida yang memiliki efek bakterisida terutama tertuju pada gram negatif aerob.
4. Mekanisme kerja
Aminoglikosida masuk ke dalam sel bakteri oleh transport aktif. Kemudian mengikat subunit 30S dan beberapa subunit 50S dari ribosom bakteri
sehingga sintesis protein terhambat dan menghasilkan kesalahan dalam
transkripsi kode genetik. Penyebab kematian sel ini masih belum diketahui
dan mekanisme lain dapat berkontribusi, termasuk efek pada permeabilitas
membran.
5. Efek samping
Semua aminoglikosida terutama pada penggunaan parenteral dapat
mengakibatkan kerusakan pada organ pendengaran dan keseimbangan
(ototoksis) terutama pada lansia, akibat kerusakan pada saraf otak kedelapan.
2.8 Iradiasi
2.8.1 Definisi Radiasi dan Iradiasi
Radiasi adalah istilah umum yang biasa digunakan untuk semua jenis energi yang dipancarkan tanpa media. Sedangkan iradiasi adalah pengunaan energi untuk penyinaran dengan menggunakan bahan dengan menggunakan sumber radiasi buatan (Winarno et al., 1980).
Berdasarkan spektrum elektromagnetnya, radiasi dibedakan menjadi: 1. Radiasi panas (Heating radation)
Radiasi panas adalah radiasi yang menggunakan sinar dengan frekuensi yang rendah atau gelombang yang panjang.
2. Radiasi Pengion (Ionizing radiation)
Radiasi pengion (ionizing radiation) adalah radiasi menggunakan sinar frekuensi yang tinggi atau gelombang yang pendek. Contoh radiasi pengion adalah radiasi sinar ultraviolet, radiasi sinar alfa, beta dan gamma. Iradiasi sinar gamma inilah yang digunakan untuk pengawetan bahan pangan. Sinar gamma ini adalah iradiasi elektromagnetik yang dikeluarkan oleh nukleus unsur-unsur 60Co (kobalt) dan 137Cs (Caesium) dan sinar ini memiliki daya tembus yang baik terhadap bahan padat dan biayanya relatif murah (Dwiloka, 2002).
2.8.2 Dosis Iradiasi
Oleh karena tingkat dan jenis perubahan yang terjadi pada materi akibat iradiasi terutama bergantung pada jumlah energi radiasi yang diserap, maka pada pengawetan bahan pangan dengan iradiasi salah satu faktor yang menentukan adalah dosis iradiasi. Agar setiap bahan dapat menerima dosis iradiasi secara tepat, maka dilakukan pengukuran dosis iradiasi dengan menggunakan sistem dosimeter (pengukur dosis).
yaitu unit energi radiasi yang terserap sebesar 1 kJ/kg bahan yang setara dengan 100 rad (Dwiloka, 2002). Berikut ini beberapa penentuan dosis radiasi dan tujuannya:
Tabel 2.1. Penentuan Dosis Iradiasi (Dwiloka, 2002)
No. Tujuan Pengawetan Dosis (kGy)
1. Pasteurisasi (radurisasi) 1-5
2. Menghilangkan mikroba patogen (radisidasi) 1-10
3. Menghilangkan serangga (disinfestasi) 0.2-0.8
4. Sterilisasi (radappertisisasi) 10-60
5. Menunda kematangan pada buah-buahan 0.10-0.12
6. Menghambat pertumbuhan tunas pada umbi-umbian 0.10-3.00
2.8.3 Keunggulan Pengguanaan Iradiasi Gamma
1. Produk yang diproses bebas bahan kimia berbahaya, karena iradiasi tidak meninggalkan residu dan tidak membuat produk menjadi radioaktif.
2. Iradiasi merupakan teknologi yang ramah lingkungan atau bebas polusi, karena tidak ada limbah proses yang terlepas atau dibuang ke lingkungan. 3. Iradiasi dapat membunuh atau mensterilkan jenis serangga dengan dosis yang
rendah dan tidak menimbulkan resistensi pada serangga, seperti yang dapat terjadi fumigasi dengan pestisida.
4. Iradiasi membutuhkan dosis yang cukup rendah, sehingga akan menguntungkan dari segi waktu, biaya dan kemungkinan perubahan mutu produk segar yang diproses.
5. Iradiasi merupakan perlakuan karantina yang berspektrum luas, karena keampuhannya tidak terbatas pada jenis serangga dan komoditas tertentu saja. 6. Bila dibandingkan dengan iradiasi menggunakan sumber lain seperti halnya
2.8.4 Legalitas Iradiasi
Bukti keamanan pangan iradiasi merupakan syarat utama bagi diterimanya proses ini secara legal oleh pemerintah di suatu negara. Dengan adanya rekomendasi dari JECFI 1980 yang menyatakan bahwa semua makanan yang diiradiasi sampai dosis 10 kGy aman untuk dikonsumsi manusia, maka kepercayaan dunia akan teknologi ini semakin nyata. Hal ini terlihat dari bertambahnya jumlah negara yang memberikan izin secara legal serta meningkatnya jumlah macam bahan makanan yang diperbolehkan untuk diiradiasi. Kalau sampai tahun 1980 baru 22 negara yang memberikan izin, maka tahun 1988 sudah menjadi 33 negara dan tahun 1991 telah meningkat lagi menjadi 36 negara, termasuk Indonesia (FAO/WHO/IAEA, 1991 dikutip dari Dwiloka, 2002).
The Joint Expert Committee on Wholesomeness of Irradiation Foods
(JECWIF) yang mewakili WHO, IAEA dan FAO mendukung sepenuhnya penyusunan peraturan makan iradiasi yang berlaku di seluruh dunia yaitu CODEX General Standard for Irradiated Foods/CODEX Alimentarius 1984-Rev./-2003
(Anonim, 2003).
Di Indonesia, izin penggunaan radiasi untuk pengawetan makanan telah dikeluarkan sejak Desember 1987. Izin tersebut dikeluarkan dalam bentuk Peraturan Menteri Kesehatan No.826/MENKES/PER/XII/1987, tertanggal 29 Desember 1987. Hal-hal pokok yang diatur dalam peraturan tersebut antara lain pengawasan iradiasi makanan dan peredaran bahan makanan iradiasi (Dwiloka, 2002).
2.8.5 Iradiator Karet Alam (IRKA)
basah dalam kolam air yang terbuat dari bahan stainless steel SUS-304 dengan ukuran panjang 5m, lebar 2m, dan dalam 7m. Air untuk kolam diolah pada Unit Pemprosesan Air (UPA) yang menggunakan sistem deonizer yang mampu menghasilkan air demineral 1 m3/jam. Di dasar kolam terdapat sebuah wadah penyimpanan sumber iradiasi (Source Storage) yang mampu menampung sampai dengan aktivitas 400,000 Ci, dibuat dari bahan timah hitam yang dibungkus dengan stainless steel SUS-304. Iradiator ini dilengkapi dengan sistem lifter yang berfungsi untuk menaikkan dan menurunkan sumber radiasi. Dengan besarnya aktivitas yang dimiliki dan modifikasi pada ruang iradiasi, memungkinkan pemanfaatan IRKA untuk iradiasi selain karet alam, yaitu untuk pengawetan dan sterilisasi produk industri.
20
BAB 3
METODELOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dimulai Mei-Desemeber 2012. Penelitian dilaksanakan di Laboratorium Kimia dan Mikrobiologi Gedung Produk Makanan dan Kesehatan Pusat Penelitian dan Pengembangan Teknologi Isotop dan Radiasi (PATIR) Badan Tenaga Nuklir Nasional (BATAN) Pasar Jum’at Jakarta Selatan dan Laborotorium Pharmacy Medicinal Chemistry (PMC) FKIK UIN Syarif Hidayatullah Jakarta.
3.2 Alat Penelitian
Alat yang digunakan meliputi Iradiator Karet Alam (IRKA), inkubator (Haereus), laminar air flow (Envair), vakum rotari evaporator (Hahnvapor), oven listrik (Hareus), mikroskop elektrik (Nikon Labophot dan Nikon HF X-DX), timbangan analitik (Sartorius), hot plate (Quebec), erlenmeyer (50 mL, 250 mL dan 500 mL), cawan petri diameter 9 mm dan 15 mm, cawan porselin, tabung reaksi (10 mL dan 20 mL), botol kaca, batang pengaduk, silinder stainless steel 6,0 mm, spatel logam, jarum ose, pinset, mikropipet eppendorf (socorex), pipet volume (1 mL, 2 mL, 5 mL dan 25 mL), lampu spiritus dan alumunium foil.
3.3 Bahan Penelitian
Bahan yang digunakan pada proses ekstraksi rimpang temu putih dan buah mahkota dewa meliputi asam alkohol, amonia encer, kloroform, pereaksi mayer, pereaksi Draggendroff, etil asetat, besi (III) klorida, asam sulfat pekat, aquadestilata, etanol 96%, minyak zaitun, kristal violet, larutan lugol dan safranin. Bahan yang digunakan pada uji aktivitas antibakteri meliputi bakteri Bacillus subtilis, Staphylococcus aereus, NA (Nutrient Agar), TSA (Triyptic Soy
3.4 Prosedur Penelitian 3.4.1 Pengambilan Sampel
Sampel yang digunakan dalam penelitian ini yakni rimpang temu putih yang diperoleh dari Balai Penelitian Tanaman Obat dan Rempah dan mahkota dewa yang diambil dari kebun yang dibudidayakan oleh BATAN.
3.4.2 Determinasi Bahan Uji
Bahan uji dideterminasi di Herbarium Bogoriense Balitbang Botani Puslitbang LIPI Cibinong.
3.4.3 Ekstraksi
Pembuatan serbuk dari sampel segar dilakukan di Balai Penelitian Tanaman Rempah dan Obat (Balittro). Sebanyak masing-masing 1300 g serbuk rimpang temu putih dan 1000 g serbuk buah mahkota dewa ditimbang dan di tempatkan dalam wadah. Masing-masing serbuk kemudian dimaserasi menggunakan etanol 96% sebanyak 1:4 b/v (serbuk rimpang temu putih 5,2 L dan serbuk buah mahkota dewa 4 L), lalu didiamkan selama sekurangnya 24 jam sambil sesekali diaduk. Maserat disaring kemudian diuapkan pada tekanan rendah dengan menggunakan vakum rotari evaporator pada suhu 50oC sehingga diperoleh ekstrak kental. Proses maserasi ini dilakukan berulang (remaserasi) sebanyak 3 kali terhadap temu putih dan sebanyak 4 kali terhadap mahkota dewa hingga diperoleh maserat yang sudah tidak berwarna.
Masing-masing ekstrak dimasukkan ke dalam wadah gelas steril, dimana masing-masing ekstrak dibagi menjadi 2 tempat yaitu untuk ekstrak non iradiasi dan ekstrak hasil iradiasi. Ekstrak diiradiasi dengan dosis 10 kGy dengan laju dosis 7 kGy/jam selama 80 menit, diIradiator Karet Alam (IRKA), Badan Tenaga Nuklir Nasional (BATAN), Pasar Jumat, Jakarta Selatan.
3.4.4 Standardisasi Ekstrak
1. Penetapan Kadar Abu
Ekstrak etanol rimpang temu putih dan mahkota dewa, masing-masing ditimbang sebanyak 2 g terhadap bahan yang telah dikeringkan di udara dan dimasukan ke dalam cawan porselin yang telah dipijarkan dan ditara kemudian diratakan. Ekstrak perlahan-lahan dipijarkan hingga suhu 675oC sampai arang habis. Jika dengan cara ini arang tidak dapat dihilangkan, ditambahkan air panas, disaring melalui kertas saring bebas abu. Residu dan kertas saring dipijarkan dalam cawan yang sama pada suhu 675oC hingga abu berwarna putih atau hampir putih. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara.
2. Penetapan Kadar Abu yang tidak larut dalam Asam
Abu yang diperoleh dari penetapan kadar abu, dididihkan dengan 25 mL asam klorida 3N selama 5 menit, bagian yang tidak larut asam dikumpulkan, disaring menggunakan kertas saring bebas abu, dicuci dengan air panas, dipijarkan hingga bobot tetap dan ditimbang. Kadar abu yang tidak larut asam dihitung terhadap bahan yang telah dikeringkan di udara.
3. Penetapan Kadar Sari yang larut dalam air
Ekstrak etanol rimpang temu putih dan buah mahkota dewa masing-masing ditimbang sebanyak 5,0 g dimasukkan ke dalam erlenmeyer dan dimaserasi selama 24 jam dengan 100 mL campuran air-kloroform (2,5 mL kloroform dalam 1L air) sambil sesekali dikocok selama 6 jam pertama dan didiamkan selama 18 jam. Sebanyak 20 mL filtrat yang telah disaring, diuapkan hingga kering di dalam cawan penguap yang telah ditara, sisa dipanaskan pada suhu 105oC hingga bobot tetap dan dihitung kadarnya dalam persen sari yang larut dalam air tehadap bahan yang telah dikeringkan di udara.
4. Pentapan Kadar Sari yang larut dalam etanol
6 jam pertama kemudian dibiarkan selama 18 jam. Sebanyak 20 mL filtrat disaring dengan cepat untuk menghindari penguapan etanol (95%), diuapkan hingga kering dalam cawan penguap yang telah ditara, sisa dipanaskan pada suhu 105oC hingga bobot tetap dan dihitung kadarnya dalam persen sari yang larut dalam etanol (95%) tehadap bahan yang telah dikeringkan di udara.
5. Uji Susut Pengeringan
Sejumlah 2 g ekstrak etanol rimpang temu putih dan buah mahkota dewa masing-masing ditimbang seksama dalam wadah yang telah dipanaskan pada suhu 105oC selama 30 menit dan telah ditara. Ekstrak diratakan dalam botol timbang dengan menggoyangkan botol, kemudian dimasukkan ke dalam oven, dibuka tutupnya dan dikeringkan pada suhu 105oC hingga bobot tetap. Sebelum setiap pengeringan, botol dibiarkan dalam keadaan tertutup mendingin dalam eksikator hingga suhu kamar. Kadar dihitung dalam persen dihitung terhadap bahan yang telah dikeringkan di udara, dengan rumus:
3.4.5 Penapisan Fitokimia Ekstrak (Gacche et al., 2011) 1. Identifikasi Golongan Alkaloid
Sejumlah 0,5 g ekstrak masing-masing dilarutkan dalam 10 mL asam alkohol, dididihkan dan disaring. Ke dalam 5 mL filtrat ditambahkan 2 mL amonia encer. Kemudian ditambahkan 5 mL kloroform dan diguncangkan dengan lembut untuk mengekstrak dasar alkaloid. Lapisan kloroform diekstraksi dengan 10 mL asam asetat. Dibagi menjadi dua bagian. Reagen Mayer ditambahkan ke dalam satu bagian dan reagen Draggendorff untuk yang lain. Pembentukan krim (dengan reagen Mayer) atau endapan coklat kemerahan (dengan reagen Draggendorff) dianggap sebagai positif adanya alkaloid.
2. Identifikasi Golongan Flavonoid
3. Identifikasi Golongan Tanin
Sejumlah 0,5 g ekstrak dididihkan dalam 10 mL air kemudian disaring. Ditambahkan beberapa tetes ferri klorida 0,1% dan diamati. Terbentuknya warna hijau kecoklatan atau biru-hitam menunjukkan adanya tanin.
4. Identifikasi Fenol
Sejumlah 0,5 g ekstrak ditambahkan 1-2 tetes FeCl3 5% maka akan terbentuk peningkatan intensitas warna hijau sampai biru menunjukkan adanya fenolik.
5. Identifikasi Terpenoid
Sejumlah masing-masing 0,5 g ekstrak ditambahkan 2 mL kloroform, kemudian ditambahkan H2S04 pekat (3 mL) dengan hati-hati untuk membentuk lapisan. Terbentuknya warna coklat kemerahan menunjukkan adanya terpenoid.
6. Identifikasi Golongan Saponin
Sejumlah 0,5 g ekstrak ditambahkam 5 mL air suling dalam tabung reaksi. Larutan diguncangkan dan diamati terbentuknya buih gigih stabil. Buih tersebut ditambahkan dengan 3 tetes minyak zaitun dan diguncangkan, kemudian diamati adanya pembentukan emulsi.
3.4.6 UjiAktivitas Antibakteri 1. Sterilisasi alat dan bahan
Alat dan bahan yang akan digunakan dalam percobaan disterilkan menurut cara yang cocok untuk masing-masing alat dan bahan. Alat-alat seperti jarum inokulasi, gelas objek, pinset disterilkan dengan api. Alat gelas seperti cawan petri, tabung reaksi, erlenmeyer yang sebelumnya telah dibungkus dengan aluminium foil disterilkan di dalam oven pada suhu 170°C selama 30 menit. Sedangkan media perbenihan dan air suling disterilkan dalam autoklaf pada suhu 121°C selama 15 menit (Farmakope Indonesia Edisi IV. 1995).
2. Pembuatan Media Pembenihan (Petunjuk Preparasi Produk) a. Nutrient Agar (NA)
yang dibalut kain kasa, lalu disterilkan dalam autoklaf pada suhu 121oC tekanan 15 lbs selama 15 menit.
b. Tryptic Soy Broth (TSB)
Sejumlah 30 gram serbuk TSB dilarutkan dalarn 1 L aquadest dalam erlenmeyer. Kemudian mulut erlenmeyer disumbat dengan kapas yang dibalut kain kasa, lalu disterilkan dalam autoklaf pada suhu 121°C pada tekanan 2 atm selama 15 menit.
c. Tryptic Soy Agar (TSA)
Sejumlah 40 gram serbuk TSB dilarutkan dalam 1 L aquades. Kemudian mulut erlenmeyer disumbat dengan kapas yang dibalut kain kasa, lalu disterilkan dalam autoklaf pada suhu 121°C pada tekanan 2 atm selama 15 menit.
3. Peremajaan Bakteri Uji
Bakteri uji dari stok kultur murni ditanam pada media agar miring NA dengan cara menggoreskan satu mata ose biakan bakteri pada permukaan agar miring, lalu diinkubasi selama 24 jam pada suhu 37oC.
4. PembuatanSuspensi Bakteri Uji
diinkubasi pada suhu 37oC selama 24 jam. Dihitung koloni yang tumbuh menggunakan koloni counter (jumlah koloni 30-300).
5. Pengukuran Diameter Zona Hambat Cara Silinder
Letakkan silinder stainless steel di atas permukaan lempeng agar yang telah ditanami bakteri. Teteskan larutan uji (ekstrak temu putih tunggal, mahkota dewa tunggal, serta kombinasi ekstrak temu putih dan mahhkota dewa 1:1) masing-masing dengan konsentrasi 20000 ppm, 2000 ppm dan 200 ppm sebanyak 50 µ L (1000µg/ring, 100µg/ring dan 10µg/ring) dan dimasukkan ke dalam silinder menggunakan mikropipet eppendrof. Lalu, diinkubasi pada suhu 37°C selama 24 jam dan diukur diameter zona hambatnya. Pengukuran diameter zona hambat ditunjukkan pada zona bening yang terbentuk di sekitar silinder. Pembacaan hasil percobaan dilakukan jika zona hambat yang terbentuk di sekitar silinder melebihi 6 mm (Devi et al., 1997).
6. Penentuan Kadar Hambat Minimum (KHM)
BAB 4
HASIL DAN PEMBAHASAN
4.1 Determinasi Tanaman Uji
Hasil determinasi menunjukkan bahwa tanaman yang digunakan pada penelitian adalah temu putih jenis Curcuma zedoaria (Christm.) Roscoe dari suku zingebericiae dan mahkota dewa jenis Phaleria macrocarpa (Scheff.) Boerl. dari suku Thymelaeaceae. Hasil determinasi dapat dilihat pada lampiran 1 dan lampiran 2.
4.2 Pembuatan Ekstrak
Hasil ekstraksi masing-masing sampel diperoleh ekstrak kental sebagai berikut:
Tabel 4.1 Rendemen Ekstrak
Ekstrak Bobot Ekstrak (g) Bobot Simplisia (g) Rendemen (%)
Temu Putih 467.21 1300 35.93
Mahkota Dewa 298.76 1000 29.88
Serbuk rimpang temu putih sebanyak 1300 g dan serbuk buah mahkota dewa sebanyak 1000 g masing-masing dimaserasi menggunakan etanol 96% hingga serbuk terendam sempurna. Proses maserasi dipilih sebagai metode ekstraksi untuk menghindari rusaknya beberapa komponen senyawa yang terkandung di dalamnya. Penggunaan etanol sebagai pelarut dikarenakan etanol merupakan pelarut polar yang memiliki toksisitas lebih rendah bila dibandingkan pelarut organik lainnya. Etanol mampu menyari senyawa non polar sampai dengan senyawa polar, sehingga diharapkan mampu menyari metabolit sekunder seperti alkaloid, flavonoid, tanin, terpenoid dan saponin yang terkandung di dalam rimpang temu putih dan buah mahkota dewa (Saifudin et al., 2011).
menggunakan vakum rotari evaporator pada suhu 50oC. Tujuannya adalah untuk memekatkan ekstrak dan memisahkan antara pelarut dengan senyawa aktif dalam rimpang temu putih dan buah mahkota dewa. Hasil ekstraksi diperoleh ekstrak etanol rimpang temu putih berwarna coklat kehitaman dan ekstrak etanol daging buah mahkota dewa berwarna kecoklatan.
Ekstrak pekat yang didapat dari rimpang temu putih sebanyak 467,21 g dari 1300 g simplisia kering (35,93%) dan ekstrak daging buah mahkota dewa sebanyak 298,76 g dari 1000 g simplisia kering (29,88%). Sebagaimana standar yang ditetapkan dalam Farmakope Herbal Indonesia yakni rendemen ekstrak daging buah mahkota dewa tidak kurang dari 29,3%. Ekstrak rimpang temu putih dan buah mahkota dewa ini kemudian di tempatkan dalam sebuah botol kaca dan di masukkan ke dalam wadah dus untuk persiapan proses iradiasi. Masing-masing ekstrak diiradiasi pada dosis 10 kGy dengan laju dosis 7 kGy/jam selama 80 menit dan disiapkan pula ekstrak yang tidak diiradiasi sebagai kontrol untuk mengetahui efektivitas antibakteri ekstrak hasil iradiasi. Tujuan dari iradiasi adalah untuk mengurangi jumlah cemaran mikroba sehingga dapat mempertahankan kualitas ekstrak.
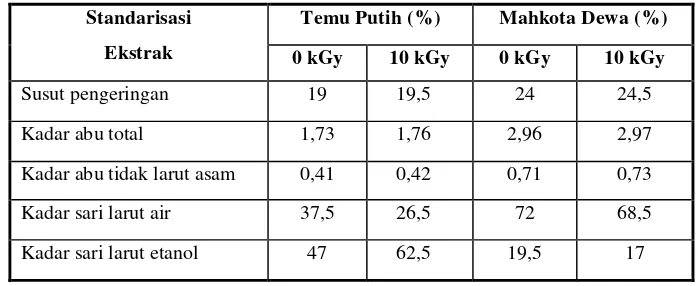
4.3 Standardisasi Ekstrak
Hasil standarisasi yang telah dilakukan terhadap ekstrak didapatkan hasil seperti terlihat pada tabel 4.2.
larut asam, kadar sari larut air dan kadar sari larut etanol. Pengujian susut pengeringan bertujuan untuk memberikan gambaran batasan besarnya senyawa yang hilang selama proses pengeringan. Hasil uji susut pengeringan menunjukkan ekstrak etanol rimpang temu putih non iradiasi sebesar 19% dan temu putih hasil iradiasi sebesar 19,5%. Sedangkan untuk mahkota dewa non iradiasi sebesar 24% dan untuk mahkota dewa hasil iradiasi sebesar 24,5%. Uji selanjutnya adalah pemeriksaan kadar abu total. Tujuan pemeriksaan ini untuk mengetahui gambaran jumlah mineral internal dan eksternal yang terbentuk dari proses awal hingga terbentuknya ekstrak. Kadar abu total ekstrak temu putih non iradiasi sebesar 1,73% dan ekstrak temu putih hasil iradiasi sebesar 1,76%. Sedangkan untuk mahkota dewa non iradiasi sebesar 2,96% dan mahkota dewa hasil iradiasi sebesar 2,97%. Hasil ini telah memenuhi standar yang ditetapkan dalam the ayurvedic pharmacopeia of india untuk ekstrak temu putih kadar abu total tidak lebih dari 7% dan untuk ekstrak mahkota dewa kadar abu total tidak lebih dari 6,8% sesuai dengan farmakope herbal indonesia. Pemeriksaan kadar abu tidak larut asam bertujuan untuk mengetahui gambaran jumlah mineral internal dan eksternal tak larut asam yang terbentuk dari proses awal hingga terbentuknya ekstrak. Kadar abu tak larut asam ekstrak temu putih non iradiasi sebesar 0,41% dan ekstrak temu putih hasil iradiasi sebesar 0,42%. Sedangkan untuk mahkota dewa non iradiasi sebesar 0,71% dan untuk mahkota dewa hasil iradiasi sebesar 0,73%. Hasil pemerikasaan tersebut juga telah memenuhi standar yakni kadar abu tak larut asam ekstrak temu putih tidak lebih dari 2% dan mahkota dewa tidak lebih dari 2,9% (Ratiasa et al., 2000).
4.4 Penapisan Fitokimia Ekstrak
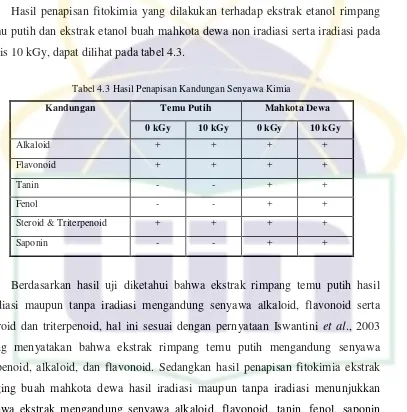
Hasil penapisan fitokimia yang dilakukan terhadap ekstrak etanol rimpang temu putih dan ekstrak etanol buah mahkota dewa non iradiasi serta iradiasi pada dosis 10 kGy, dapat dilihat pada tabel 4.3.
Tabel 4.3 Hasil Penapisan Kandungan Senyawa Kimia
Kandungan Temu Putih Mahkota Dewa
0 kGy 10 kGy 0 kGy 10 kGy
Berdasarkan hasil uji diketahui bahwa ekstrak rimpang temu putih hasil iradiasi maupun tanpa iradiasi mengandung senyawa alkaloid, flavonoid serta steroid dan triterpenoid, hal ini sesuai dengan pernyataan Iswantini et al., 2003 yang menyatakan bahwa ekstrak rimpang temu putih mengandung senyawa terpenoid, alkaloid, dan flavonoid. Sedangkan hasil penapisan fitokimia ekstrak daging buah mahkota dewa hasil iradiasi maupun tanpa iradiasi menunjukkan bahwa ekstrak mengandung senyawa alkaloid, flavonoid, tanin, fenol, saponin serta steroid dan triterpenoid, sebagaimana kandungan senyawa buah mahkota dewa yang dinyatakan oleh Penelitian Puslitbang Farmasi dan Obat Tradisional Departemen Kesehatan, yakni meliputi alkaloid, tanin, saponin, flavonoid, dan polifenol (Susanti, 2009).
4.5 Identifikasi Bakteri Uji
berbentuk bulat seperti anggur, menggerombol dan berwarna ungu. Gambar bakteri secara mikroskopik dapat dilihat dalam lampiran 9.
Bakteri yang digunakan pada uji aktivitas antibakteri adalah bakteri yang telah diinkubasi selama 24 jam pada suhu 37oC. Karena pada usia tersebut bakteri berada pada usia pertumbuhan aktif dan umumnya fase ini lebih peka terhadap antibakteri daripada saat fase istirahat (Sujudi et al., 1982). Bakteri uji terlebih dahulu identifikasi menggunakan pewarnaan gram untuk memastikan tidak adanya kontaminasi. Dari hasil pewarnaan gram tersebut diketahui bahwa Bacillus subtilis dan Staphylococcus aureus yang digunakan merupakan bakteri gram positif, yang terlihat dari hasil pewarnaan gram berwarna ungu. Dasar dari reaksi pewarnaan gram adalah perbedaan dalam struktur kimiawi permukaan bakteri. Pada saat pemberian kristal violet sebagai zat warna dasar sel bakteri akan berwarna ungu, dan ketika lugol ditambahkan maka terbentuk kompleks antara kristal violet dengan iodium di dalam sel, sehingga sel bakteri akan tetap berwarna ungu. Lalu dengan adanya penambahan alkohol dinding sel bakteri gram positif akan terdehidrasi dan pori-porinya menciut, sehingga daya rembes dinding sel dan membran menurun, akibatnya warna sel akan tetap ungu dengan adanya penambahan safranin. Sedangkan pada bakteri gram negatif penambahan alkohol akan mengakibatkan lipid terekstraksi dari dinding sel, pori-pori sel mengembang dan kompleks warna keluar dari sel, sehingga saat pemberian safranin sel menyerap warna tersebut menjadi merah (Pelczar et.al, 2008).
4.6 Pembuatan Suspensi Bakteri Uji
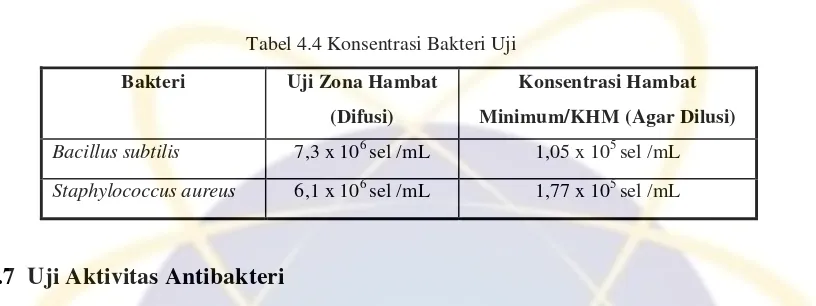
Tabel 4.4 Konsentrasi Bakteri Uji
Bakteri Uji Zona Hambat
(Difusi)
Konsentrasi Hambat
Minimum/KHM (Agar Dilusi)
Bacillus subtilis 7,3 x 106 sel /mL 1,05 x 105 sel /mL
Staphylococcus aureus 6,1 x 106 sel /mL 1,77 x 105 sel /mL
4.7 Uji Aktivitas Antibakteri
Pada penelitian ini uji aktivitas antibakteri dilakukan dengan dua metode, yaitu metode difusi dan metode dilusi agar. Metode difusi dilakukan dengan cara silinder untuk menuntukan besarnya diameter zona bening yang terbentuk di sekeliling silinder. Silinder yang digunakan terbuat dari stainless steel dengan diameter 6 mm. Adapun alasan pemilihan silinder dikarenakan kapasitasnya yang lebih besar jika dibandingkan dengan kertas cakram, sehingga jumlah larutan yang dimasukkan ke dalam silinder dapat lebih banyak. Sedangkan metode dilusi agar, digunakan untuk menentukan konsentrasi hambat minimum ekstrak. Metode ini dipilih karena setelah dilakukan penentuan nilai konsentrasi hambat minimum menggunakan metode dilusi cair cara pengenceran serial dalam tabung, kekeruhan larutan sulit diamati, dikarenakan larutan uji kombinasi ekstrak temu putih dan mahkota dewa sudah berwarna keruh karena adanya interaksi ekstrak dengan medium (Bohm, 2009).
4.7.1 Diameter Zona Hambat Cara Silinder
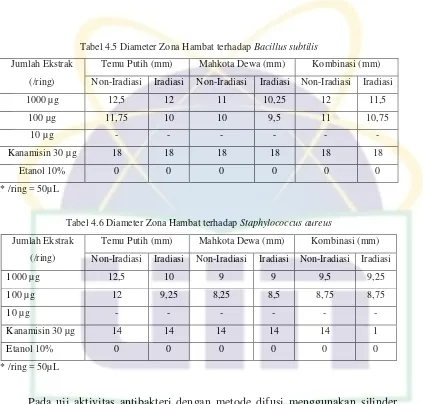
Tabel 4.5 Diameter Zona Hambat terhadap Bacillus subtilis
Jumlah Ekstrak (/ring)
Temu Putih (mm) Mahkota Dewa (mm) Kombinasi (mm) Non-Iradiasi Iradiasi Non-Iradiasi Iradiasi Non-Iradiasi Iradiasi 1000 µg 12,5 12 11 10,25 12 11,5
Tabel 4.6 Diameter Zona Hambat terhadap Staphylococcus aureus
Jumlah Ekstrak (/ring)
Temu Putih (mm) Mahkota Dewa (mm) Kombinasi (mm) Non-Iradiasi Iradiasi Non-Iradiasi Iradiasi Non-Iradiasi Iradiasi 1000 µg 12,5 10 9 9 9,5 9,25
Pada uji aktivitas antibakteri dengan metode difusi menggunakan silinder stainless steel ini sebanyak 50 µ L ekstrak etanol kombinasi temu putih dan
mahkota dewa dengan konsentrasi 20000 ppm, 2000 ppm dan 200 ppm masing-masing dimasukkan ke dalam ring yang sebelumnya telah di letakkan di atas permukaan agar, sehingga setiap ring tersebut mengandung ekstrak sebanyak 1000 µg, 100 µg dan 10 µg. Berdasarkan hasil pengamatan uji daya hambat yang dilakukan terhadap ekstrak etanol rimpang temu putih tunggal, ekstrak etanol buah mahkota dewa tunggal dan kombinasi temu putih dengan buah mahkota dewa hasil iradiasi dan non iradiasi terhadap bakteri Bacillus subtilis dan Staphylococcus aureus dengan metode difusi cara silinder, menunjukkan bahwa
Ekstrak etanol temu putih menunjukkan adanya zona hambat terhadap kedua jenis bakteri uji, dimana zona bening yang terbentuk berada pada kisaran 9-12 mm. Begitu pula ekstrak etanol mahkota dewa menunjukkan diameter zona bening yang terbentuk pada kisaran 8-11 mm. Sedangkan, kombinasi temu putih dan mahkota dewa menunjukkan hasil zona bening pada kisaran 8-12 mm. Pada penelitian ini, uji juga dilakukan terhadap etanol 10% sebagai kontrol negatif dan kanamisin sebagai kontrol positif. Etanol 10% pada penelitian ini digunakan untuk melarutkan ekstrak, sehingga perlu diuji untuk memastikan bahwa pelarut tersebut tidak mempunyai aktivitas antibakteri. Hasil uji aktivitas antibakteri menunjukkan bahwa etanol 10% tidak memiliki aktivitas antibakteri sehingga dapat digunakan sebagai pelarut. Sedangkan kanamisin digunakan sebagai kontrol positif untuk membandingkan potensi ekstrak dibandingkan dengan antibiotik pembanding. Hasil menujukkan bahwa kanamisin sensitif terhadap Bacillus subtilis dan Staphylococcus aureus.
Perbandingan peningkatan zona hambat antibakteri ekstrak iradiasi dan non iradiasi dapat dilihat pada gambar:
Gambar 4 Diagram Perbandingan Diameter Zona Hambat Kombinasi Ekstrak Etanol Temu Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Bacillus subtilis
Gambar 5 Diagram Perbandingan Diameter Zona Hambat Kombinasi Ekstrak Etanol Temu Putih dan Mahkota Dewa Non Iradiasi dan Iradiasi terhadap Staphylococcus aureus
4.7.2 Konsentrasi Hambat Minimum Metode Dilusi Agar
Hasil perbandingan hambatan ekstrak iradiasi dan non iradiasi pada kombinasi temu putih dan mahkota dewa dipaparkan pada tabel 4.7.
Tabel 4.7 Perbandingan Hambatan Kombinasi Ekstrak Etanol Temu Putih dan Mahkota Dewa Hasil Iradiasi
Konsentrasi (ppm)
% Hambatan terhadap
Bacillus subtilis
% Hambatan terhadap
Staphylococcus aureus
Non iradiasi Iradiasi Non iradiasi Iradiasi
Etanol 10% 0 0 0 0
Pada penentuan konsentrasi hambat minimum (KHM) kombinasi ekstrak etanol rimpang temu putih dan buah mahkota dewa dengan metode dilusi agar, larutan uji dibuat dalam serial konsentrasi (62,5, 125, 250, 500 dan 1000 ppm). Hal bertujuan untuk mencari konsentrasi terendah dari ekstrak iradiasi maupun