viii
UIN Syarif Hidayatullah Jakarta Nama : Fathmah Syafiqoh
Program Studi : Farmasi
Judul Skripsi : Analisis Gelatin Sapi dan Gelatin babi pada Produk
Cangkang Kapsul Keras Obat dan Vitamin Menggunakan
FTIR dan KCKT
Gelatin sering digunakan secara luas dalam industri farmasi pada pembuatan cangkang kapsul keras. Penggunaan gelatin pada cangkang kapsul keras menimbulkan kontroversi karena adanya kekhawatiran konsumen mengenai kehalalan sumber gelatin. Penelitian ini bertujuan untuk mengetahui perbedaan gelatin sapi dan gelatin babi pada cangkang kapsul keras dengan FTIR
(Fourier Transform Infared Spectroscopy) dan KCKT (Kromatografi Cair
Kinerja Tinggi). Analisis Komposisi asam amino pada cangkang kapsul keras dilakukan dengan KCKT, sampel dihidrolisis terlebih dahulu dengan HCl 6N kemudian diderivatisasi menggunakan AQC (Aminokuinolil-N-hidroksisuksini-midil karbamat). Analisis gugus fungsi pada sampel cangkang kapsul keras dilakukan dengan FTIR, sampel diekstraksi terlebih dahulu menggunakan aseton dingin pada suhu -20oC lalu dianalisis dengan alat FTIR pada panjang gelombang 4000-750cm-1. Setelah itu dilakukan analisis data menggunakanPrincipal Component Analysis(PCA) untuk mengklasifikasikan antara gelatin sapi dan babi pada cangkang kapsul keras. Berdasarkan kurva
score plotFTIR standar gelatin babi berada pada kuadran 2 dan standar gelatin
sapi berada pada kuadran 1. Pada lembar cangkang kapsul babi berada pada kuadran 3 dan lembar cangkang kapsul sapi berada pada kuadran 4. Sedangkan hasil kurva score plote KCKT standar gelatin babi dan lembar cangkang kapsul babi berada pada kuadran 2. Standar gelatin sapi dan lembar cangkang kapsul sapi berada pada kuadran 3. Hasil analisis gelatin sapi dan gelatin babi dengan metode FTIR dan KCKT dapat disimpulkan bahwa metode FTIR dan teknik kemometrik PCA dapat mengklasifikasikan antara gelatin sapi dan gelatin babi sedangkan analisis menggunakan KCKT dan teknik kemometrik PCA dapat membedakan komposisi asam amino pada standar gelatin sapi dan babi serta lembar cangkang kapsul yang dibuat sendiri, tetapi belum bisa membedakan sumber gelatin yang dipakai pada produk cangkang kapsul keras yang diambil dari pasaran.
ix
UIN Syarif Hidayatullah Jakarta Nama : Fathmah Syafiqoh
Program Studi : Farmasi
Judul Skripsi : Analysis Bovine Gelatin and porcine Gelatin in Hard Shell
Capsule Products on Drugs and Vitamin Using FTIR dan
HPLC
Gelatin was widely used in pharmaceutical industry for manufacturing of hard shell capsules. The use of gelatin in the capsule caused controversy due to consumer concerns about halal gelatin source. This study aimed to determine differences of bovine and porcine gelatin used in the hard shell capsule by FTIR and HPLC. Analysis of amino acid composition in hard shell capsule was determined by HPLC, the sample was hydrolyzed with HCl 6N and derivatization with AQC (Aminokuinolil- N- hidroksisuksini- midil carbamate). Analysis of functional groups in hard shell capsule was determined by FTIR, the samples were extracted using cold acetone at -20°C and analyzed by FTIR at a wavelength 4000-750cm-1. Analysis of the data was performed using the Principal Component Analysis (PCA) to classify between bovine and porcine gelatin in hard shell capsule. Based on the score plot curve of FTIR standard gelatin of porcine was in quadrant 2 and standard gelatin of bovine was in quadrant 1. In sheets of hard shell capsule porcine were in quadrant 3 and sheets hard shell capsule bovine were in quadrant 4. While based on the score plot curve of HPLC standard gelatin of porcine and sheets hard shell capsule porcine were in quadrant 2. Standard gelatin of bovine and sheets hard shell capsule bovine were in quadrant 3. The results of the analysis of bovine and porcine gelatin with FTIR and HPLC could be concluded that the FTIR method and technique chemometric PCA can classify between bovine and porcine gelatin whereas analysis using HPLC and techniques chemometric PCA could classify standard bovine and porcine gelatin and capsule shells self made but was not successful for classification of commercial capsule shells.
x
UIN Syarif Hidayatullah Jakarta
Alhamdulillahirabbil’alamin atas segala nikmat iman, Islam,
kesempatan, serta kekuatan yang telah diberikan Allah Subhanahuwata’ala
sehingga Penulis dapat menyelesaikan penelitian dan penulisan skripsi ini.
Shalawat serta salam untuk tuntunan dan suri tauladan Rasulullah
Shallallahu‘alaihiwasallam beserta keluarga dan sahabat beliau yang
senantiasa menjunjung tinggi nilai-nilai Islam yang sampai saat ini dapat
dinikmati oleh seluruh manusia di dunia.
Skripsi ini dibuat sebagai salah satu syarat untuk mendapat gelar sarjana
farmasi dari Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah. Judul skripsi ini adalah “uji
aktivitas antibakteri ekstrak daun sintok (Cinnamomum sintoc Blume.)
terhadap Staphylococcus aureus dan Pseudomonas aeruginosa serta analisa
komponen senyawa fraksi aktif dengan kromatografi gas – spektrometri
massa”.
Penulis menyadari bahwa keberhasilan penelitian dan penulisan skripsi
ini tidak lepas dari bantuan dan bimbingan dari banyak pihak. Oleh karena itu,
pada kesempatan kali ini penulis mengucapkan terima kasih kepada:
1. Ibu Ofa Suzanti Betha, M.Si, Apt selaku pembimbing pertama dan Ibu
Zilhadia, M.Si, Apt selaku pembimbing kedua yang senantiasa dengan
sabar tulus dan ikhlas memberikan arahan, bimbingan, dorongan,
semangat, saran dan solusi selama penelitian dan penulisan skripsi.
2. Prof. Dr. (hc) dr. M.K. Tadjudin, Sp. And. selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif
Hidayatullah Jakarta.
3. Drs. Umar Mansur, M.Sc., Apt selaku Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri
Syarif Hidayatullah Jakarta.
4. Bapak dan Ibu staf pengajar dan karyawan yang telah memberikan
UIN Syarif Hidayatullah Jakarta Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas
Islam Negeri Syarif Hidayatullah Jakarta.
5. Para laboran Farmasi UIN, Ka Liken, Ka Rahmadi, Ka Eris, Mba Rani,
Ka Lisna dan Ka Tiwi yang telah banyak membantu selama praktikum
maupun penelitian.
6. Mama yang selalu memberikan kasih sayang, semangat dan doa yang
tiada henti serta dukungan baik moral maupun materil dan almarhum
ayah yang telah mendidik dan memberi nasehat semasa beliau ada.
Kasih sayang yang kalian berikan sungguh tak ternilai.
7. Kaka dan adikku tersayang, Rahmi Asyifani yang selalu memberikan
dukungan, semangat dan doa, Rahmah Nur Sabrina yang selalu
mendukung dan memberikan bantuan setiap kali dibutuhkan.
8. Teman – teman seperjuangan dalam penelitian ini yaitu Farida
Kusumaningrum dan Afifah Nurul Izzah yang senantiasa dengan sabar
menemani, mendukung dan membantu disaat sedang dibutuhkan.
9. Teman – teman “ngocol” tersayang Amel, Zakiya, Afifah, Dita, Ipho,
Dias, Diah dan Desi Syifa, terima kasih karena kalian selalu mengerti,
membantu, mendukung dan berbagi cerita disaat senang maupun sedih,
semogaukhuwahkita akan selalu terjaga sampai kapanpun.
10. Teman – teman “Andalusia” Farmasi 2010 yang solid dan selalu
membantu satu sama lain.
Penulis menyadari bahwa skripsi ini masih banyak keterbatasan dan
kekurangan. Oleh Karena itu, dengan segala kerendahan hati, penulis sangat
mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi
ini. Penulis berharap semoga skripsi ini dapat bermanfaat dan member
sumbangan pengetahuan khususnya di Program Studi Farmasi Fakultas
Kedokteran dan Ilmu kesehatan, Universtas Islam Negeri Syarif Hidayatullah
Jakarta dan pembaca pada umumnya.
Jakarta, 1 September 2014
xi
UIN Syarif Hidayatullah Jakarta
HALAMAN JUDUL... ii
HALAMAN PERNYATAAN ORISINALITAS...iii
HALAMAN PERSETUJUAN PEMBIMBING... iv
HALAMAN PENGESAHAN ... v
ABSTRAK... vi
ABSTRACT ... vii
KATA PENGANTAR ...viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH... x
DAFTAR ISI... xi
DAFTAR TABEL... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN... xvii
DAFTAR ISTILAH...xviii
BAB 1 PENDAHULUAN... 1
1.1 Latar Belakang... 1
1.2 Rumusan Masalah... 3
1.3 Tujuan Penelitian ... 3
1.4 Manfaat penelitian ... 4
BAB 2 TINJAUAN PUSTAKA... 5
2.1 Gelatin ... 5
2.1.1 Definisi Gelatin ... 5
2.1.2 Komposisi Kimia Gelatin ... 5
2.1.3 Sifat Fisika Kimia Gelatin ... 7
2.1.4 Aplikasi Penggunaan Gelatin ... 9
2.2 Kapsul ... 9
2.2.1 Cangkang Kapsul Keras ... 10
2.2.2 Cangkang Kapsul Lunak ... 11
2.3 Protein... 12
UIN Syarif Hidayatullah Jakarta
2.3.2 Struktur Sekunder... 13
2.3.3 Struktur Tersier... 14
2.3.4 Struktur Kuartener ... 15
2.4 Asam Amino... 15
2.5 Spektroskopi FTIR ... 18
2.6 Analisis Asam Amino dengan KCKT ... 20
2.7 PCA(Principal Component Analysis)... 25
BAB 3 METODOLOGI PENELITIAN... 27
3.1 Tempat dan Waktu Penelitian... 27
3.2 Alat dan Bahan ... 27
3.2.1 Alat ... 27
3.2.2 Bahan... 27
3.3 Tahapan Penelitian ... 27
3.3.1 Pengumpulan Sampel dari Pasaran ... 27
3.3.2 Pembuatan Lembaran Cangkang Kapsul ... 27
3.3.3 Analisis Gelatin dengan FTIR ... 28
3.3.3.1 Pemisahan Titanium Dioksida ... 29
3.3.3.2 Ekstrasi Gelatin... 29
3.3.4 Analisis Profil Gelatin dengan FTIR ... ..29
3.3.5 Analisis Data menggunakan PCA ... 29
3.3.6 Analisis Gelatin dengan KCKT... ..30
3.3.6.1 Hidrolisis Asam Amino ... 30
3.3.6.2 Derivatisasi Asam Amino ... 30
3.3.7 Analisis Profil Gelatin dengan KCKT... ..30
3.3.8 Analisis Data menggunakan PCA ... ..31
BAB 4 HASIL DAN PEMBAHASAN... 32
4.1 Pengumpulan Sampel Dari Pasaran... 32
4.2 Pembuatan Lembaran Kapsul ... 32
4.3 Analisis Gelatin dengan FTIR ... 33
4.3.1 Pemisahan Titanium Dioksida... 33
4.3.2 Ekstrasi Gelatin ... 34
UIN Syarif Hidayatullah Jakarta
4.3.4 Analisis Data menggunakan PCA ... 39
4.4 Analisis Gelatin dengan KCKT ... 44
4.4.1 Hidrolisis Asam Amino... 44
4.4.2 Derivatisasi Asam Amino ... 45
4.5 Analisis Profil Asam Amino dengan KCKT ... 47
4.5.1 Analisis Standar Asam Amino ... 48
4.5.2 Analisis Asam Amino pada Standar Gelatin, Lembar Cangkang Kapsul Simulasi dan Produk Cangkang Kapsul Pasaran... 48
4.6 Analisis Data menggunakan PCA ... 49
BAB 5 PENUTUP... 54
5.1 Kesimpulan ... 54
xiv
UIN Syarif Hidayatullah Jakarta Tabel
2.1 Komposisi Asam Amino Gelatin Kulit Babi dan Sapi……….
2.2 Daftar Rantai Samping Asam Amino ……… 3.1 Formulasi Lembaran Cangkang Kapsul Keras ………. 4.1 Pengumpulan Sampel Kapsul dari Pasaran ………... 4.2 Karakteristik Serapan IR Pada Rantai Peptida ………..
4.3 Worksheet pada Penyusunan Standar Gelatin, Lembar Cangkang
Kapsul Keras Simulasi dan Produk Cangkang Kapsul dari Pasaran
………
4.4 Kontribusi Masing-Masing Variabel terhadap Nilai Komponen Utama
………...
4.5 Komposisi Asam Amino pada Standar Gelatin, Lembar Cangkang
Kapsul Keras Simulasi dan Produk Cangkang Kapsul dari Pasaran
………
4.6 Worksheet pada Penyusunan Standar Gelatin, Lembar Cangkang
Kapsul Keras Simulasi dan Produk Cangkang Kapsul keras dari
Pasaran ………..
4.7 Kontribusi Masing-Masing Variabel Terhadap Nilai Komponen
[image:14.595.117.536.66.489.2]Utama ………
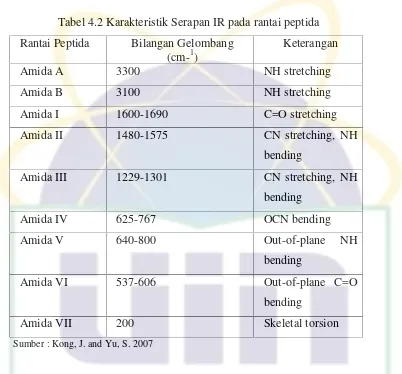
Halaman 6
18
28
32
38
40
40
48
50
xv
UIN Syarif Hidayatullah Jakarta Gambar 1 Gelatin Berbentuk Serbuk, Serbuk Kasar……….
Gambar 2 Struktur Asam Amino Kolagen dan Gelatin……….
Gambar 3 Cangkang Kapsul Keras……….
Gambar 4 Cangkang Kapsul Lunak………
Gambar 5 Tingkatan Struktur Protein……….
Gambar 6 Struktur Asam Amino………
Gambar 7 Ion Amfoter ………
Gambar 8 Asam Amino dalam Suasana Asam………..
Gambar 9 Asam Amino dalam Suasana Basa……….
Gambar 10 Skema Kerja Alat FTIR……….
Gambar 11 Skema Kerja Alat KCKT………...
Gambar 12 Lembaran Cangkang Kapsul Gelatin Keras………
Gambar 13 Endapan Gelatin diperoleh dari Hasil Ekstraksi ………
Gambar 14 Penggabungan Spektrum FTIR Standar Gelatin Babi dan Sapi…
Gambar 15 Penggabungan Spektrum FTIR Lembar Cangkang Kapsul Gelatin
Babi dan Gelatin Sapi……….
Gambar 16 Penggabungan Spektrum Gelatin yang Diperoleh dari Produk
Cangkang Kapsul yang Ada Dipasaran……….
Gambar 17 Kurva Score Plot PC1 Dan PC2 pada Standar Gelatin, Lembar
Cangkang Kapsul Keras Simulasi dan Produk Cangkang Kapsul
Pasaran ………
Gambar 18 Kurva Loading Plot PC1 Dan PC2 Pada Standar Gelatin, Lembar
Cangkang Kapsul Keras Simulasi dan Produk Cangkang Kapsul
Pasaran ………...
Gambar 19 Reaksi Derivatisasi Reagen AQC……….
Gambar 20 Profil Standar Asam Amino………
Gambar 21 Kurva Score Plot PC1 Dan PC2 pada Standar Gelatin, Lembar
Cangkang Kapsul Keras Simulasi dan Produk Cangkang Kapsul
Keras dari Pasaran ………
xvii
UIN Syarif Hidayatullah Jakarta
Lampiran 1. Alur Kerja………
Lampiran 2. Interferogram FTIR………...
Lampiran 3. Kromatogram KCKT………..
Lampiran 4.Rekaman Pengujian Asam Amino HPLC ……….
Lampiran 5. Pembuatan Larutan ………... Lampiran 6. Gambar Penelitian ………..
59
60
69
78
87
xviii
UIN Syarif Hidayatullah Jakarta
AABA :α-aminobutyric acid
AMQ : 6-aminoquinoline
AQC : 6-amino-quinolil-N-hidroksisuccinimidil karbamate
BPS : Badan Pusat Statistik
DNA :Deoxyribosa Nucleic Acid
FTIR :Fourier Transform Infrared
GMIA : Gelatin Manufacturers Institute Of America
HPLC :High Performance Liquid Chromatography
KCKT : Kromatografi Cair Kinerja Tinggi
LCMS :Liquid Chromatography Mass Spectrometry
LPPOM : Lembaga Pengkajian Pangan, Obat-obatan dan Kosmetik
MPA : 3 Mercaptopropionic Acid
MUI : Majelis Ulama Indonesia
NHS : N-hidroksisuccimid
OPA : Orto-phatalaldehyde
PC :Principal Componentatau Komponen utama
PCA :Principal Component Analysis
PCR :Polymerase Chain Reaction
PEG : Polietilen Glikol
1
UIN Syarif Hidayatullah Jakarta 1.1 Latar Belakang
Gelatin merupakan campuran heterogen dari polipeptida yang
diperoleh melalui hidrolisis kolagen dari jaringan ikat hewan (GMIA, 2012).
Gelatin memiliki sifat yang unik sehingga digunakan secara luas dalam
industri makanan dan farmasi. Dalam industri makanan, gelatin ditemukan
dalam produk seperti jelly, es krim, yogurt, ataupun marshmallow. Industri
farmasi menggunakan gelatin sebagai pembuatan kapsul keras dan lunak,
(Nhari, Ismail & Che Man, 2012).
Gelatin bersumber dari tulang hewan yang berasal dari babi dan sapi.
Gelatin yang berasal dari babi dan sapi mempunyai kualitas yang lebih baik
dibandingkan dengan sumber lainnya seperti ikan (Jamaludin et al., 2011).
Meskipun demikian, ada masalah lain yang timbul yaitu status kehalalan
produk dengan bahan baku gelatin dari babi. Gelatin umumnya diimpor dari
negara-negara non-muslim yang tidak memperhatikan kehalalan produk
karena sebagian besar bahan dasarnya bersumber dari babi. Penggunaan kulit
babi sebagai bahan baku gelatin di seluruh dunia mencapai 44,9% dari total
gelatin yang dihasilkan. Eropa Barat merupakan penghasil gelatin terbesar di
dunia yaitu 68% gelatin yang diproduksi berasal dari kulit babi. Penghasil
gelatin kedua terbesar di dunia adalah NAFTA (The North American Free
Trade Agreement), konsorsium tiga negara yaitu Amerika, kanada dan
Meksiko (Jamaludin et al., 2011).
Obat vitamin dan mineral merupakan golongan bebas yang boleh
digunakan tanpa resep dan dapat dijual bebas di warung, toko obat berizin,
supermarket, serta apotek. Sediaan obat vitamin dan mineral sebagian besar
dalam bentuk cangkang kapsul keras dan cangkang kapsul lunak (ISO, 2014).
Cangkang kapsul baik keras maupun lunak banyak menjadi perhatian terkait
status kehalalan gelatin yang digunakan, karena dipasaran banyak beredar
produk kapsul yang tidak mencantumkan label halal pada kemasan. Dalam
jurnal halal LPPOM MUI No.94 edisi Maret-April 2012 baru tiga produk
UIN Syarif Hidayatullah Jakarta adanya jaminan kehalalan mengenai sumber gelatin (Jamaludinet al., 2011).
Keberadaan gelatin babi dan sapi dalam produk pangan sangat sukar untuk
diidentifikasi karena memiliki sifat fisika dan kimia yang hampir mirip
(Nematiet al., 2004). Oleh karena itu perlu diupayakan metode yang selektif
untuk membedakan gelatin babi dan gelatin sapi.
Berbagai studi telah dilakukan dengan bermacam-macam metode
analisis untuk membedakan gelatin sapi dan babi (Nhari et al., 2012). Di
antaranya analisis berbasis DNA dengan Real Time PCR (Sahilah et al.,
2012) dan LCMS (zhang et al., 2008). Analisis perbedaan gelatin babi dan
gelatin sapi juga dilakukan dengan menggunakan FTIR (Fourier Transform
Infra Red) (Hasyim et al., 2010). FTIR (Fourier Transform Infra Red)
merupakan metode spektroskopi IR yang banyak digunakan untuk analisis
kehalalan (Rohman and Che Man, 2012). Analisis menggunakan FTIR
banyak dikembangkan karena dinilai lebih mudah, cepat, murah dan ramah
lingkungan. Selain itu, analisis perbedaan antara gelatin sapi dan gelatin babi
dapat dilakukan dengan KCKT (kromatografi cair kinerja tinggi). KCKT
merupakan metode yang banyak digunakan untuk analisis asam amino
ditunjang dengan peralatan yang baik dan modern, menggunakan kolom yang
sangat efisien di bawah tekanan yang besar, sehingga analisis asam amino
dapat dilakukan dalam waktu yang singkat dan memberikan hasil yang tepat
dan teliti (Rediatning et al., 1987). Perkembangan metode analisis
menggunakan FTIR dan HPLC sekarang telah digabungkan dengan teknik
kemometrik yaitu analisis komponen utama. PCA (Principal component
analysis) adalah teknik proyeksi data yang sangat membantu dalam
klasifikasi suatu objek (Miller & Miller, 2005).
Analisis pada produk cangkang kapsul lunak komersial telah dilakukan
menggunakan HPLC berdasarkan profil asam amino dengan metode
derivatisasi ortho-phtalaldehyde (OPA) – 2-mercaptoethanol (MCE) dengan
teknik kemometrik (Widyaninggar et al., 2012). Dari hasil penelitian
UIN Syarif Hidayatullah Jakarta
(Principal component analysis) belum bisa mengklasifikasikan produk
cangkang kapsul lunak komersial yang beredar dipasaran. Analisis perbedaan
gelatin babi dan gelatin sapi juga telah dilakukan menggunakan FTIR dan
teknik kemometrik. Hasil penelitian tersebut metode FTIR dan teknik
kemometrik komponen utama dapat mengklasifikasikan kedua sumber gelatin
(Hasyim et al.,2010). Pada penelitian ini dilakukan analisis gelatin sapi dan
gelatin babi pada produk cangkang kapsul keras obat yang mengandung
vitamin dan mineral menggunakan FTIR dan HPLC, dikarenakan belum
banyak publikasi tentang pembeda gelatin sapi dan gelatin babi pada produk
cangkang kapsul keras. Penggabungan dua metode ini diharapkan dapat
memberikan data komposisi asam amino dan gugus fungsi dari gelatin sapi
dan gelatin babi yang dapat saling melengkapi.
1.2 Rumusan Masalah
1. Apakah metode FTIR dapat digunakan untuk membedakan antara
gelatin sapi dan gelatin babi yang terdapat dalam cangkang kapsul keras
pada obat vitamin dan mineral yang beredar dipasaran?
2. Apakah metode HPLC dapat digunakan untuk membedakan antara
gelatin sapi dan gelatin babi yang terdapat dalam cangkang kapsul keras
pada obat vitamin dan mineral yang beredar dipasaran?
1.3 Tujuan Penelitian
1. Mengetahui perbedaan antara gelatin babi dan gelatin sapi pada
cangkang kapsul keras obat vitamin dan mineral dengan metode FTIR
2. Mengetahui perbedaan antara gelatin sapi dan babi yang digunakan
pada cangkang kapsul keras obat vitamin dan mineral dengan metode
UIN Syarif Hidayatullah Jakarta FTIR dan KCKT dapat digunakan dalam mendeteksi adanya gelatin babi dan
sapi, sehingga metode ini dapat diaplikasikan untuk menguji kandungan babi
dalam gelatin pada cangkang kapsul obat. Manfaat lainnya adalah
memberikan informasi kepada masyarakat tentang kehalalan cangkang kapsul
5
UIN Syarif Hidayatullah Jakarta 2.1 Gelatin
2.1.1 Definisi Gelatin
Gelatin merupakan campuran heterogen polipeptida yang diperoleh
melalui hidrolisis parsial kolagen dari jaringan ikat hewan dengan perlakuan
asam atau basa (GMIA, 2012). Gelatin adalah istilah umum untuk campuran
fraksi protein murni yang dihasilkan baik dengan hidrolisis parsial asam (tipe
A gelatin) atau dengan hidrolisis parsial basa (tipe B gelatin) dari kolagen
hewan yang diperoleh dari sapi dan tulang babi, kulit sapi (hide), kulit babi,
dan kulit ikan (Roweet al., 2009).
Istilah gelatin mulai populer sekitar tahun 1700 dan berasal dari bahasa
latin ‘gelatus’ yang berarti kuat atau kokoh. Secara fisik gelatin berbentuk
padat, kering, tidak berasa dan transparan. Ada tiga sifat yang paling
menonjol pada gelatin yaitu: kemampuan untuk membentuk gel, kekenyalan
dan kekuatan lapisan tinggi. Gelatin merupakan polimer tinggi alami yang
memiliki berat molekular dari 20.000 sampai 70.000. Gelatin ini dipersiapkan
dari bahan yang mengandung kolagen termasuk kulit, tulang dan tendon
dengan pemecahan hidrolisis melalui pendidihan dengan air atau dengan
menggunakan uap panas yang tinggi. (Perwitasari, 2008).
2.1.2 Komposisi Kimia Gelatin
Gelatin sangat kaya dengan asam amino glisin (Gly) (hampir sepertiga
dari total asam amino), prolin (Pro) dan 4-hidroksiprolin (4Hyd). Struktur
gelatin yang umum adalah: -Ala-Gly-Pro-Arg-Gly-Glu-4Hyd-Gly-Pro-.
Kandungan 4Hyd berpengaruh terhadap kekuatan gel gelatin, makin tinggi
asam amino ini, kekuatan gel juga lebih baik. Meskipun diturunkan dari
protein hewani, gelatin tergolong sebagai protein dengan nilai biologis yang
rendah dan sering juga dianggap protein tidak lengkap. Hal ini disebabkan
karena tidak adanya triptophan (Trp) yang merupakan salah satu asam amino
UIN Syarif Hidayatullah Jakarta Gelatin terutama mengandung asam amino glisin sebesar 33% , prolin 22%
dan hidroksiprolin 22 %. Gelatin komersial terdiri dari 84–90% protein,
[image:24.595.132.532.119.680.2]8-12% air dan 2-4 % adalah garam mineral.
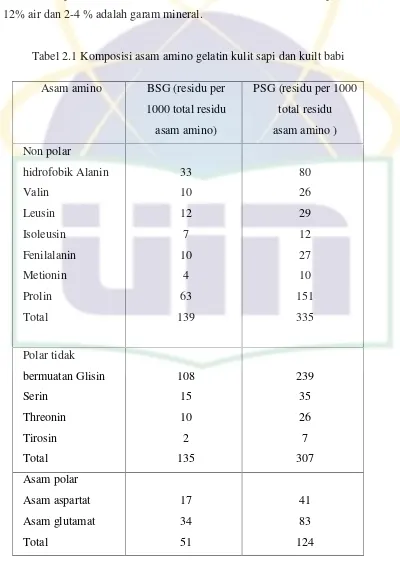
Tabel 2.1 Komposisi asam amino gelatin kulit sapi dan kuilt babi
Asam amino BSG (residu per
1000 total residu
asam amino)
PSG (residu per 1000
total residu
asam amino )
UIN Syarif Hidayatullah Jakarta
Sumber : (Nhariet al.,2011)
Komposisi asam amino mempengaruhi sifat fisika dan kimia gelatin.
Analisis asam amino gelatin menunjukkan bahwa struktur molekul gelatin
memiliki perbedaan yang terlihat pada kandungan asam amino (Nhari et al.,
2011). Gelatin memiliki kadar asam amino yang rendah pada metionin,
sistein dan tirosin. Hal ini disebabkan karena ketiga asam amino ini
mengalami kerusakan karena hidrolisis pada proses pembuatan gelatin
(Hafidz et al., 2011). Perbedaan komposisi asam amino pada gelatin kulit
sapi dan kulit babi ditunjukkan oleh tabel 2.1
Dari tabel diatas dapat dilihat bahwa komposisi asam amino
dinyatakan sebagai residu per 1000 residu asam amino. Bovine skin gelatin
(BSG) dan Porcine skin gelatin (PSG) keduanya memiliki kandungan glisin,
prolin dan arginin dalam jumlah yang tinggi. PSG mengandung jumlah asam
amino glisin, prolin dan arginin yang lebih tinggi dibandingkan dengan BSG.
Kedua gelatin memiliki jumlah tirosin yang rendah dan histidin tidak
terdeteksi pada keduanya (Nhariet al., 2011).
2.1.3 Sifat Fisika Kimia Gelatin
Fraksi protein pada gelatin hampir seluruhnya terdiri atas berbagai
macam asam amino yang bergabung melalui ikatan amida dan membentuk
polimer yang linear. Gelatin memiliki berat molekul yang bervariasi yaitu 20
kDa sampai 200 kDa. Gelatin tidak larut dalam aseton, kloroform, etanol
(95%), eter, dan methanol. Larut dalam gliserin, asam, dan basa meskipun
asam kuat atau alkalis dapat menyebabkan pengendapan (Roweet al., 2009). Basa polar
Lisin
Arginin
Histidin
Total
11
47
Tidak terdeteksi
58
27
111
Tidakterdeteksi
UIN Syarif Hidayatullah Jakarta Gelatin larut dalam air minimal pada suhu 490C, atau biasanya pada suhu 600C sampai 700C (Ward dan Court, 1997). Gelatin tidak larut dalam air dingin, tetapi hanya akan mengembang. Perendaman dalam air dingin
menjadikan gelatin lunak dan berangsur-angsur menyerap air 5 sampai 10
kali bobotnya. Gelatin larut dalam air panas. Setelah pendinginan sampai
35-40°C, membentuk gel. Pada suhu 35-40°C, berbentuk sol (Singhet al., 2002).
2.1.4 Aplikasi Penggunaan Gelatin
Gelatin banyak digunakan di berbagai industri pangan, farmasi dan
fotografi. Dalam industry pangan gelatin sebagai pembentuk gel, agen
pembentuk busa, pengental, plasticizer, emulsifier, dan memperbaiki tekstur.
Gelatin banyak digunakan dalam produk susu dan roti terutama pada es krim,
yogurt, keju dan kue. Selain itu gelatin juga digunakan dalam industri
makanan lain seperti cokelat, es krim, marshmallow, permen, permen karet,
mentega, dan sosis (Sahilahet al., 2012).
Gelatin bernilai bagi industri farmasi karena dapat dibuat dalam
berbagai formulasi. Gelatin banyak digunakan pada larutan, sirup, tablet,
tablet salut gula, inhalansia, vagina, dan topikal dan suntikan. Gelatin juga
digunakan untuk membentuk kapsul gelatin keras dan lunak sebagai
pembentuk lapisan film (Singh et al., 2002). Gelatin juga digunakan dalam
bentuk spons untuk mengobati luka dan sebagai koloid untuk menambah
plasma pada luka yang banyak kehilangan darah (Nhari et al., 2012).
Penggunaan gelatin dalam farmasi karena membantu untuk melindungi
obat-obatan terhadap pengaruh berbahaya, seperti cahaya dan oksigen. Kapsul
lunak misalnya terutama digunakan untuk bahan cairan, sedangkan kapsul
keras yang digunakan untuk bahan serbuk (Sahilahet al., 2012).
2.2 Kapsul
Kapsul berasal dari bahasa latin “capsula” yang artinya wadah kecil.
Dalam ilmu farmasi, kapsul merupakan wadah kecil untuk melindungi obat.
Kapsul termasuk bentuk sediaan padat yang dapat diisikan obat atau zat kimia
UIN Syarif Hidayatullah Jakarta komponen pembentuknya, kapsul dapat dibagi menjadi dua kategori yaitu
kapsul keras (dua cangkang) dan kapsul lunak (satu cangkang). Bahan utama
yang digunakan dalam pembuatan cangkang kapsul keras dan cangkang
kapsul lunak pada umumnya sama, yaitu gelatin, air, dan pewarna. Namun
yang membedakannya adalah bahan tambahan lainnya dan cara
pembuatannya. Selain terbuat dari gelatin, kapsul dapat terbuat dari HPMC,
PVA, danStarch. (Rabadiya, 2013).
2.2.1 Cangkang Kapsul Keras
Sebagian besar produk kapsul terbuat dari kapsul gelatin keras.
Cangkang kapsul keras gelatin harus dibuat dalam dua bagian yaitu badan
kapsul dan bagian tutupnya yang lebih pendek. Kedua bagian saling menutupi
bila dipertemukan, bagian tutup akan menyelubungi bagian tubuh secara tepat
dan ketat. Cangkang kapsul kosong terbuat dibuat dari campuran gelatin,
gula, dan air, jernih tidak berwarna dan pada dasarnya tidak berasa. Gelatin
USP dihasilkan dari hidrolisis sebagian dari kolagen yang diperoleh dari
kulit, jaringan ikat putih dan tulang binatang-binatang (Ansel, 2005)
Gelatin bersifat stabil di udara bila dalam keadaan kering, akan tetapi
mudah mengalami penguraian oleh mikroba bila menjadi lembab atau bila
disimpan dalam larutan berair. Oleh karena itu kapsul yang lunak
mengandung lebih banyak uap air daripada kapsul keras. Biasanya kapsul
keras gelatin mengandung uap air antara 9-12%. Bilamana disimpan dalam
lingkungan dengan kelembaban yang tinggi, penambahan uap air akan
diabsorbsi oleh kapsul dan kapsul keras ini akan rusak dari bentuk
kekerasannya. Sebaliknya dalam lingkungan udara yang sangat kering,
sebagian dari uap air yang terdapat dalam kapsul gelatin mungkin akan hilang
dan kapsul ini menjadi rapuh serta mungkin akan remuk bila dipegang
(Ansel, 2005). Jenis bahan untuk pengisian ke dalam kapsul gelatin keras
terdiri dari dry solid (Bubuk, pelet, butiran atau tablet), semisolid (suspensi
atau pasta), cairan (cairan non-air) (Rabadiya, 2013). Sebuah kapsul gelatin
UIN Syarif Hidayatullah Jakarta Kapsul gelatin lunak harus memiliki spesifikasi sebagai berikut :
Kekuatan Gel 150-200 Bloom, tergantung pada jenis gelatin
Viskositas (60°C/6-2/3% b / b dalam air) 2,8-4,5 MPa s, tergantung pada
tipe gelatin
Ukuran partikel yang baik untuk memungkinkan disolusi yang cepat.
Pada gelatin konsentrasi tinggi kapsul lunak bentuknya bagus dan lebih
mudah ditelan oleh pasien.
Kapsul gelatin lunak dapat digunakan untuk mengisi macam-macam
jenis bahan, bentuk cair dan kering. Cairan yang dapat dimasukkan ke
dalam kapsul gelatin lunak termasuk :
1. Tidak tersatukan dengan air, cairan yang mudah menguap dan tidak
menguap, seperti minyak nabati, hidrokarbon aromatik dan
hidrokarbon alifatik.
2. Tersatukan dengan air, cairan yang tidak menguap seperti polietilen
glikol dan surfaktan nonionik
3. Tersatukan dengan air dan kelompok kompnen yang tidak meguap
seperti propilen glikol dan isopropil alcohol (Ansel, 1989).
2.3 Protein
Protein berasal dari kata proteos yang berarti pertama atau utama.
Protein merupakan komponen penting atau komponen utama sel hewan atau
manusia. Oleh karena sel itu merupakan pembentuk tubuh kita, maka protein
yang terdapat dalam makanan berfungsi sebagai zat utama dalam
pembentukan dan pertumbuhan tubuh (Podjiadi,1994). Protein adalah polimer
dari asam amino yang dihubungkan dengan ikatan peptida. Molekul protein
mengandung unsur-unsur C, H, O, N, P, S, dan terkadang mengandung unsur
logam seperti besi dan tembaga (Winarno, 2004). Komposisi rata rata unsur
kimia yang terdapat dalam protein adalah karbon 50%, hidrogen 7%, oksigen
23%, nitrogen 16%, belerang 0–3 % dan fosfor 0–3 %. Protein mempunyai
molekul besar dengan bobot molekul bervariasi antara 5000 sampai jutaan.
Dengan cara hidrolisis oleh asam atau oleh enzim , protein akan
UIN Syarif Hidayatullah Jakarta dalam molekul protein. Asam asam amino ini terikat satu dengan lain oleh
ikatan peptida. Protein mudah dipengaruhi oleh suhu tinggi, pH dan pelarut
organik (Poedjiadi, 1994). Terdapat empat tingkatan struktur yang saling
mempengaruhi konformasi fungsional biologis dari protein, yaitu:
2.3.1 Struktur Primer
Struktur ini merupakan urutan asam amino penyusun protein yang
disebutkan dari N-terminal (kiri) ke C-terminal (kanan). Ikatan peptida
kovalen merupakan satu-satunya jenis ikatan yang terlibat pada tingkat
struktur protein ini. Penetapan struktur primer suatu polipeptida atau protein
dapat dilakukan dengan beberapa metode, salah satunya, hidrolisis protein
dengan asam kuat (misalnya HCL 6 N), yang diikuti oleh pemisahan dan
identifikasi konstituen-konstituen dari hidrolisat (produk hidrolisis). Salah
satu pereaksi yang umum dipakai untuk menetapkan asam amino N-terminal
adalah 2,4-dinitrofluorobenzena (pereaksi Sanger). Selama bereaksi, atom
fluor menjalani pergantian nukleofilik oleh gugus amino bebas. Tripeptida
termodifikasi ini kemudian dihidrolisis, produk-produknya dipisahkan, dan
asam aminonya dimodifikasi dengan 2,4-dinitroflourobenzena sehingga dapat
diidentifikasi dengan kromatografi karena berwarna kuning. Enzim
karboksipeptidase mengkatalis dengan efektif reaksi pembelahan hidrolitik
pada ujung C-terminal dari peptide tersebut. Dengan demikian asam amino
C-terminal bisa diidentifikasi dengan segera. Struktur primer akan
menentukan sifat dasar protein dan bentuk struktur sekunder serta tersier. Bila
protein mengandung banyak asam amino dengan gugus hidrofobik, daya
kelarutannya kurang dalam air dibandingkan dengan protein yang banyak
mengandung asam amino dengan gugus hidrofil (Winarno, 2004, h. 65).
2.3.2 Struktur Sekunder
Struktur sekunder protein berkaitan dengan pelipatan struktur primer.
Ikatan hidrogen antara nitrogen amida dan oksigen karbonil merupakan gaya
yang menstabilkan yang utama. Ikatan ini dapat terbentuk antara bagian yang
UIN Syarif Hidayatullah Jakarta berdampingan (Deman, 1997, h.110). Berbagai bentuk struktur sekunder
yaitu:
a. Alpha-helix, terbentuk oleh ‘backbone’ ikatan peptida yang membentuk
spiral, dinamakan alpha karena ketika dilihat tidak lurus dari atas, arah
putarannya adalah searah jarum jam menjauhi pengamat. Satu putaran
terdiri atas 3,6 residu asam amino. Struktur ini terbentuk karena adanya
ikatan hidrogen antara atom O pada gugus CO dengan atom H pada
gugus NH.
b. Beta-sheet (lempeng beta), terbentuk karena adanya ikatan hidrogen
atau ikatan tiol (S-H). Ikatan hidrogen terjadi antara dua bagian rantai
yang pararel sehingga membentuk lembaran yang berlipat-lipat.
c. Beta-turn(lekukan beta)
d. Gamma-turn(lekukan gamma)
2.3.3 Struktur Tersier
Struktur ini menggambarkan keseluruhan rantai polipeptida yang
dapat melipat atau menggulung sehingga membentuk struktur 3 dimensi yang
tepat. Pembentukan struktur tersier menyebabkan terbentuknya satuan yang
tersusun padat dan rapat dengan sebagian besar residu asam amino polar
terletak pada bagian luar dan dihidrasi. Hal ini mengakibatkan sebagian besar
rantai samping apolar berada pada bagian dalam dan sebenarnya tidak ada
hidrasi (Deman, 1997). Pelipatan dipengaruhi oleh interaksi antara gugus
samping (R) satu sama lain. Interaksi yang terlibat yaitu:
a. Ikatan ion, terjadi antara gugus samping yang bermuatan positif dan
gugus negatif.
b. Ikatan hidrogen, terjadi antar gugus samping, seperti –OH, COOH,
-CONH2, atau–NH2.
c. Jembatan Sulfida, seperti pada sistein yang memiliki gugus samping–SH
yang dapat membentuk ikatan sulfida dengan –SH sistein lainnya. Ikatan
ini berupa ikatan kovalen sehingga lebih kuat dibandingkan dengan
ikatan yang lain.
2.3.4 Struktur Polipeptida
berinteraksi dan
menggambarkan
Struktur ini berka
rantai polipeptida
yang secara biolo
G
2.4 Asam A Asam ami
yang mengikat se
dan rantai sampi
Amino.
UIN Syarif Hiday tur Kuartener
ptida yang sudah memiliki struktur tersier
dan bergabung menjadi suatu multimer. Strukt
kan pengaturan sub unit protein dalam ruang
rkaitan dengan interaksi intermolekuler dimana
ida berasosiasi secara spesifik membentuk prot
ologis aktif.
Sumber :www.sciencebiotech.net
Gambar 5. Tingkatan struktur protein
Amino
mino merupakan unit penyusun protein. Satu
t secara kovalen gugus amino, gugus karboksi
mping (gugus R), ditunjukkan pada gambar
ayatullah Jakarta sier dapat saling
truktur kuartener
ng (Styer, 2000).
ana dua atau lebih
protein oligomerik
tu atom C sentral
boksil, satu atom H
Pada umum
pelarut organik non
amino dilarutkan
sedangkan gugus
(Poedjiadi, 2009)
Dengan adanya
membentuk ion
amfoter(zwitter i
Keadaan ini ber
ditambahkan asam
dengan ion -COO
molekul protein a
G
UIN Syarif Hiday
[image:34.595.131.538.65.495.2]Sumber:www.sciencebiotech.net
Gambar 6. Struktur Asam Amino
umnya asam amino larut dalam air dan tida
k non polar seperti eter, aseton, dan kloroform
kan dalam air, gugus karboksilat akan melepa
us amina akan menerima ion H+, seperti pada , 2009)
COOH↔ COO-+ H+ NH2+ H+↔ NH3+
a kedua gugus tersebut, asam amino dalam
on yang bermuatan positif dan negatif atau di
er ion).
Sumber : Poedjiadi, 2009
Gambar 7.Ion amfoter (Zwitterion)
bergantung pada pH larutan. Jika asam am
sam, maka konsentrasi ion H+ yang tinggi m OO-sehingga membentuk gugus–COOH. Dala
n akan membentuk ion positif.
Sumber : Poedjiadi, 2009
Gambar 8. Asam amino dalam suasana asam
ayatullah Jakarta tidak larut dalam
orm. Apabila asam
elepaskan ion H+, ada reaksi berikut
lam larutan dapat
u disebut juga ion
amino dalam air
mampu berikatan
alam suasana asam
Sedangkan denga
mampu mengikat
G
Gugus fun
tetrahedral atau di
rantai samping (g
menentukan: strukt
air (Nelson, D
kecenderungan be
terdapat lima golon
1. Asam amino
gugus R alifa
dan prolin.
2. Asam amino de
air) tetapi tida
glutamin.
3. Asam amino
hidrofobik sepe
mampu meny
menentukan ka
4. Asam amino
polar mempun
seperti lisin, a
5. Asam amino
mempunyai
aspartat dan a
UIN Syarif Hiday ngan penambahan basa, konsentrasi ion –O
kat ion-ion H+pada gugus - NH3+.
Sumber : (Poedjiadi, 2009)
Gambar 9.Asam amino dalam suasana basa
fungsional pada asam amino merupakan
u dikenal sebagai C alpha (Cα). Asam amino
(gugus R) yang terikat pada Cα. Gugus R yan
struktur, ukuran, muatan elektrik, dan sifat kel
D.L., & Cox, M.M,2005). Berdasarkan
n berinteraksi dengan air pada pH biologis
olongan asam amino yaitu (Nelson, D.L., & Cox
no dengan gugus R non polar, bersifat hidrofobi
lifatik seperti glisin, alanin, valin, metionin, l
no dengan gugus R polar, bersifat hidrofilik (muda
tidak bermuatan seperti serin, threonin, sist
ino dengan gugus R aromatik, bersifat rel
k seperti fenilalanin, tirosin dan triptofan. Asam
nyerap sinar UV λ 280 nm sehingga sering di
n kadar protein.
no dengan gugus R bermuatan positif pada pH
punyai gugus yang bersifat basa pada rant
n, arginin, dan histidin.
no dengan gugus R bermuatan negatif pada
i gugus karboksil pada rantai sampingnya
n asam glutamate.
ayatullah Jakarta –OH
-yang tinggi
sa
kan atom karbon
no dibedakan pada yang berbeda-beda
elarutan di dalam
n polaritas atau
is (dekat pH 7,0)
Cox, M.M,2005):
obik dan memiliki
n, leusin, isoleusin
mudah larut dalam
sistein, asparagin,
relatif non polar,
m amino aromatik
ng digunakan untuk
pH netral, bersifat
antai sampingnya,
da pH fisiologis,
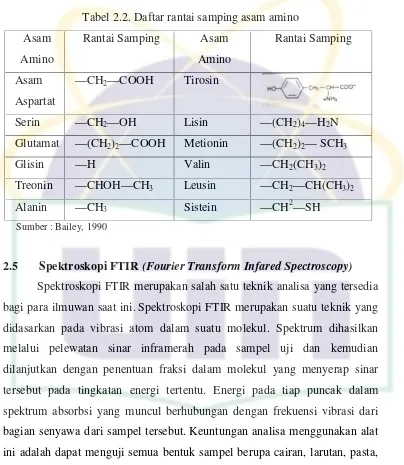
T Asam Amino R Asam Aspartat — Serin — Glutamat — Glisin — Treonin — Alanin —
Sumber : Bailey,
2.5 Spektrosk Spektroskopi
bagi para ilmuwa
didasarkan pada
melalui pelewat
dilanjutkan deng
tersebut pada tin
spektrum absorbsi
bagian senyawa d
ini adalah dapat m
serbuk ataupun ga
Infra Red
infra merah de
memberikan gam
dihasilkan dengan
lebih banyak dig
kadang juga untuk
instrument spektr
[image:36.595.132.536.75.540.2]UIN Syarif Hiday Tabel 2.2. Daftar rantai samping asam amino
Rantai Samping Asam
Amino
Ranta
—CH2—COOH Tirosin
—CH2—OH Lisin —(CH2)
—(CH2)2—COOH Metionin —(CH2)
—H Valin —CH2(C
—CHOH—CH3 Leusin —CH2—
—CH3 Sistein —CH2—
y, 1990
oskopi FTIR(Fourier Transform Infared Spe
oskopi FTIR merupakan salah satu teknik analisa
uwan saat ini. Spektroskopi FTIR merupakan sua
da vibrasi atom dalam suatu molekul. Spekt
atan sinar inframerah pada sampel uji
ngan penentuan fraksi dalam molekul yang
tingkatan energi tertentu. Energi pada tiap
bsorbsi yang muncul berhubungan dengan frekue
a dari sampel tersebut. Keuntungan analisa me
at menguji semua bentuk sampel berupa cairan,
upun gas.
ed (IR) menyangkut interaksi antara radiasi ca
dengan materi. Spektra Infra Red dari
ambaran keadaan dan struktur molekul. Spe
gan mengukur absorpsi radiasi di daerah IR. An
digunakan untuk analisa bahan-bahan organik,
untuk molekul poliatomik anorganik atau organom
ktroskopi FTIR diantaranya adalah :
ayatullah Jakarta no
ntai Samping
2)4—H2N 2)2—SCH3 (CH3)2 —CH(CH3)2 —SH
pectroscopy)
nalisa yang tersedia
suatu teknik yang
pektrum dihasilkan
uji dan kemudian
g menyerap sinar
ap puncak dalam
kuensi vibrasi dari
menggunakan alat
ran, larutan, pasta,
si cahaya di daerah
i suatu senyawa
Spektra IR biasa
. AnalisaInfra Red
nik, tetapi
1. Sumber ene
yang disebut
yang dapat
2. Interferom
encoding be
sinyal inter
3. Sampel : si
dipantulkan
yang diing
4. Detektor :
Detektor y
sinyal inter
5. Komputer
dimana F
terakhir ini
Untuk ahli
untuk mengident
Dengan adanya i
serta komputer unt
spektroskopi IR
UIN Syarif Hiday energi: energi infra merah dipancarkan dari
sebut glowing black-body. Sinar ini kemudian
pat mengontrol jumlah energi yang mengenai sa
ometer: sinar memasuki interferometer di
ng berlangsung. Sinar tersebut nantinya akan
nterferogram yang kemudian akan keluar dari int
: sinar memasuki ruang sampel, sinar ini akan
kan oleh permukaan sampel, tergantung pad
nginkan.
or : sinar diteruskan ke detektor untuk peng
or yang digunakan secara khusus dirancang unt
nterferogram khusus.
er : sinyal yang diukur didigitalkan dan dikir
Fourier transformasi berlangsung. Spektrum
ini kemudian disajikan kepada pengguna untuk i
[image:37.595.131.531.69.593.2]Sumber :www.chem.is.try.org
Gambar 10.Skema Kerja Alat FTIR
hli kimia organik, fungsi utama dari spektroskopi
dentifikasi struktur molekul khususnya gug
a interferometer dan penggunaan laser sebagai
r untuk memproses data, maka metode peng
IR berkembang dengan adanya metode ba
ayatullah Jakarta ri sebuah sumber
an melewati celah
i sampel.
dimana spectral
n diubah menjadi
interferometer.
kan diteruskan atau
pada jenis analisis
pengukuran akhir.
untuk mengukur
dikirim kekomputer
ktrum inframerah
uk interpretasi.
roskopi IR adalah
ugus fungsional.
gai sumber radiasi
pengukuran dengan
UIN Syarif Hidayatullah Jakarta
(Fourier Transform Infa Red). Dengan metode ini spektroskopi IR dapat
menyerap radiasi hingga frekuensi 4000-400 cm-1. Perbedaan antara spektroskopi FTIR dengan spektroskopi IR adalah pada pengembangan
sistem optiknya sebelum berkas sinar infra merah melewati sampel.
Hampir semua molekul menyerap sinar inframerah, kecuali molekul
diatomik homonuklear seperti O2, N2 dan H2. Spektra IR dari molekul
poliatomik relatif kompleks karena adanya beberapa kemungkinan transisi
vibrasi, adanya overtone dan perubahan pita. Namun demikian pita absorpsi
untuk beberapa gugus fungsi tertentu cukup tajam dan karakteristik.
Keseluruhan spektra IR dari satu molekul tertentu adalah karakteristik
sehingga sangat berguna untuk mengidentifikasi senyawa. Ada beberapa hal
yang harus diperhatikan agar terjadi peresapan radiasi inframerah yaitu :
1. Absorpsi terhadap radiasi inframerah dapat menyebabkan eksitasi
molekul ke tingkat energi vibrasi yang lebih tinggi.
2. Vibrasi yang normal mempunyai frekuensi sama dengan frekuensi radiasi
elektromagnetik yang diserap.
3. Proses absorpsi (spectra IR) hanya dapat terjadi apabila terdapat
perubahan baik nilai maupun arah dari momen dua kutub ikatan.
ATR adalah peralatan dimana sampel ditempatkan dipermukaan
kontak dengan elemen ATR (ZnSe kristal, 45oujung). ATR digunakan untuk sampel yang menggunakan pelarut air seperti gelatin. Kelebihan
menggunakan ATR yaitu sensitifitasnya tinggi, tidak memerlukan preparasi
sampel dan dapat meningkatkan reprodusibilitas antar sampel.
2.6 Analisis Asam Amino dengan KCKT (Kromatografi Cair Kinerja Tinggi)
Analisis asam amino merupakan metode penentuan komposisi asam
amino atau kandungan protein dan peptida. Untuk mengidentifikasi adanya
asam amino, terlebih dahulu kita perlu menghidrolisis ikatan amin dengan
sempurna untuk memperoleh asam amino dalam keadaan bebas, kemudian
UIN Syarif Hidayatullah Jakarta dilakukan pada kondisi asam dan basa yang kuat, atau menggunakan enzim
spesifik untuk memperoleh asam amino (Bailey ,1990 ).
Pada hidrolisis asam unsur yang diperlukan adalah HCl 6M, suhu 1100
C dan waktu 24 jam. Reaksinya biasanya dilakukan ditabung kaca yang
tertutup. Sementara itu pada hidrolisis basa, ikatan amida dapat diputus
dengan perlakuan terhadap peptida menggunakan NaOH 2M pada 1000C.
Hidrolisis basa menghasilkan destruksi arginin, sistein, serin dan treonin.
Selain itu adapula hidrolisis enzim. Peristiwa ini terjadi didalam tubuh. Untuk
menghancurkan makanan, perut memiliki enzim dengan kadar tertentu yang
dapat dikatalisasi untuk memotong ikatan peptida yang dikenal sebagai
peptidase. Aminopeptidase bekerja cepat dan efisien dalam hidrolisis ikatan
peptida sekaligus memotong suatu residu asam amino mulai dari ujung N.
Tahap selanjutnya, yaitu pemisahan. Pemisahan yang umum dilakukan adalah
dengan cara kromatografi. Diantara teknik kromatografi yang dapat dilakukan
untuk pemisahan yaitu kromatografi penukar ion, kromatografi kertas, dan
kromatografi cair kinerja tinggi ( Bailey ,1990 ).
Kromatografi penukar ion umumnya sangat efisien dalam memisahkan
campuran asam amino. Metode ini menggunakan kolom penukar ion secara
paralel dengan metode deteksi ninhidrin yang hasilnya reprodusibel sehingga
teknik ini sangat banyak digunakan dalam pemisahan dan analisis campuran
asam amino. Kromatografi kertas digunakan dalam pemisahan asam amino
berdasarkan fakta bahwa gugus selulosa kertas memiliki afinitas kuat
terhadap molekul air ,yang terbentuk oleh ikatan hidrogen dengan gugus OH
pada rantai polisakarida. Jika asam amino tidak dapat dipisahkan dengan
sempurna dengan kromatografi kertas sederhana,maka kromatogram dua
dimensi dapat digunakan.
Kromatografi merupakan salah satu teknik pemisahan yang dapat
memisahkan dua atau tiga komponen dalam suatu campuran. HPLC atau
biasa disebut Kromatografi Cair Kinerja Tinggi (KCKT) dikembangkan pada
akhir tahun 1960-an dan awal 1970-an. KCKT merupakan salah satu teknik
kromatografi cair-cair, yang dapat digunakan baik untuk keperluan
UIN Syarif Hidayatullah Jakarta KCKT didasarkan pada pengukuran luas/area puncak analit dalam
kromatogram, dibandingkan dengan luas/area standar. Pada prakteknya,
pembandingan kurang menghasilkan data yang akurat bila hanya melibatkan
satu standar. Oleh karena itu, maka pembandingan dilakukan dengan
menggunakan teknik kurva kalibrasi.
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan sistem
pemisahan dengan kecepatan dan efisiensi yang tinggi. Hal ini karena
didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan
tinggi, dan detektor yang sangat sensitif dan beragam. Kromatografi Cair
Kinerja Tinggi (KCKT) mampu menganalisa berbagai cuplikan secara
kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun
campuran. Kromatografi Cair Kinerja Tinggi (KCKT) merupakan teknik
pemisahan yang diterima secara luas untuk analisis dan pemurnian senyawa
tertentu dalam suatu sampel pada sejumlah bidang antara lain; farmasi,
lingkungan dan industri-industri makanan. Kegunaan umum KCKT adalah
untuk pemisahan sejumlah senyawa organik, anorganik, maupun senyawa
biologis, analisis ketidakmurnian (impurities) dan analisis senyawa-senyawa
yang tidak mudah menguap (nonvolatil). KCKT paling sering digunakan
untuk: menetapkan kadar senyawa-senyawa tertentu seperti asam-asam
amino, asam-asam nukleat dan protein-protein dalam cairan fisiologis,
menentukan kadar senyawa-senyawa aktif obat dan lain-lain.
Prinsip kerja KCKT adalah sebagai berikut dengan bantuan pompa,
fasa gerak cair dialirkan melalui kolom ke detektor, cuplikan dimasukkan ke
dalam fasa gerak dengan penyuntikan. Di dalam kolom terjadi pemisahan
senyawa-senyawa berdasarkan kepolaran, dimana terdapat fase gerak dan
fase diam. Fase gerak berupa zat cair yang disebut eluen atau pelarut,
sedangkan fase diam berupa silika gel yang mengandung hidrokarbon (Pare,
J.R.J., & Belanger, J.M.R, 1997). Instrumentasi KCKT pada dasarnya terdiri
atas delapan komponen pokok yaitu: wadah fase gerak, sistem penghantaran
fase gerak, alat untuk memasukan sampel,kolom, detektor, wadah penampung
buangan fase gerak, tabung penghubung dan suatu komputer atau integrator
UIN Syarif Hidayatullah Jakarta 4. Ideal untuk molekul besar dan ion ( Johnson dan Stevenson, 1991).
KCKT banyak digunakan untuk analisis asam amino karena analisa
memerlukan waktu yang singkat dan memberikan hasil yang tepat dan teliti.
Untuk mendeteksi asam amino dapat digunakan detektor UV atau detektor
fluoresen. Akan tetapi kebanyakan asam amino tidak mempunyai serapan
baik didaerah ultraviolet atau didaerah visibel. Dalam hal ini asam amino
harus diderivatisasi terlebih dahulu supaya membentuk derivat yang dapat
menyerap cahaya UV, tampak, atau berfluoresensi (Rediatning & Kartini
1987, h. 2-3).
Tujuan dari derivatisasi pada HPLC untuk meningkatkan deteksi,
mengubah struktur molekul atau polaritas analit sehingga akan menghasilkan
puncak kromatogram yang lebih baik, mengubah matriks sehingga diperoleh
pemisahan yang lebih baik, dan menstabilkan analit yang sensitif. Suatu
reaksi derivatisasi harus mempunyai syarat-syarat sebagai berikut, yaitu
produk yang dihasilkan harus mampu menyerap baik sinar ultraviolet atau
sinar tampak atau dapat membentuk senyawa berfluoresen sehingga dapat
dideteksi dengan spektrofotometri, proses derivatisasi harus cepat dan
menghasilkan produk yang sebesar mungkin (100%), produk hasil
derivatisasi harus stabil selama proses derivatisasi dan deteksi, serta sisa
pereaksi untuk derivatisasi tidak mengganggu ketika pemisahan pada
kromatografi ( Abdul Rohmanet al., 2007 ).
Ada dua macam derivatisasi yaitu derivatisasi pascakolom dan
derivatisasi prakolom. Beberapa metode menggunakan pacakolom
derivatisasi di mana asam amino yang dipisahkan pada kolom pertukaran ion
diikuti dengan derivatisasi dengan ninhidrin, o-phthalaldehyde. Pada
derivatisasi pascakolom, pemisahan asam amino berdasarkan pertukaran ion
antara gugus amino yang terprotonasi dengan ion Na+ dari resin penukar kation (R-SO3-NA+) pada pH rendah. Pendekatan lain adalah untuk derivatisasi asam amino sebelum pemisahan pada kolom HPLC fase terbalik
seperti fenil isothiosianat; 6-amino-quinolil-N-hidroksisuccinimidil
UIN Syarif Hidayatullah Jakarta kromatografi fase terbalik, silika non polar dimodifikasi melalui perlekatan
rantai-rantai hidrokarbon panjang berupa atom karbon 8 atau 18 dan
menggunakan pelarut polar berupa campuran air dan alkohol seperti metanol.
Senyawa-senyawa non polar dalam campuran akan cenderung membentuk
interaksi dengan gugus hidrokarbon karena adanya dispersi gaya van der
waals. Senyawa ini juga kurang larut dalam pelarut karena membutuhkan
waktu untuk pemutusan hidrogen, sehingga senyawa non polar akan tertahan
lebih lama di dalam kolom, sedangkan molekul-molekul polar akan bergerak
lebih cepat melalui kolom.
2.7 PCA(Principal Component Analysis)
Teknik menggunakan kemometri untuk menginterpretasi sejumlah
besar data yaitu PCA (Principle Component Analysis). PCA adalah teknik
untuk menentukan komponen utama yang merupakan kombinasi linier dari
variabel asli. Analisis data komponen utama menggunakan software Minitab
15. Analisis komponen utama dilakukan dengan cara menghilangkan korelasi
diantara variabel bebas melalui transformasi variabel bebas asal ke variabel
baru yang tidak berkorelasi sama sekali atau multikolinearitas. PCA juga
digunakan untuk mengurangi dimensi dari satu set data, tetapi bisa
memberikan informasi terhadap seluruh variabel asli (Miller, J.N., & Miller,
J.C. 2005). Berdasarkan Kaiser Criterion, komponen utama atau Principal
Component (PC) yang digunakan adalah PC dengan eigen value (nilai ciri
atau varians setiap komponen utama) lebih dari 1 sedangkan proporsi
keragaman yang dianggap cukup mewakili total keragaman data jika
keragaman kumulatif mencapai 70-80% (Miller, J.N., & Miller, J.C. 2005).
Komponen utama dibentuk berdasarkan urutan varians yang terbesar
hingga terkecil. Komponen utama pertama (PC1) merupakan kombinasi linier
dari seluruh variabel yang diamati dan memiliki varians terbesar. Komponen
utama kedua (PC2) merupakan kombinasi linier dari seluruh variabel yang
diamati yang bersifat ortogonal terhadap PC1 dan memiliki varians kedua
terbesar. Komponen utama ke-n (PCn) merupakan kombinasi linier dari
UIN Syarif Hidayatullah Jakarta PC(n-1) dan memiliki varians terkecil. Sebagian besar variasi (keragaman
atau informasi) dalam keseluruhan variabel cenderung berkumpul pada
komponen utama pertama, dan semakin sedikit informasi dari variabel asal
akan berkumpul pada komponen utama terakhir. Komponen utama bersifat
orthogonal (Miller, J.N., & Miller, J.C. 2005).
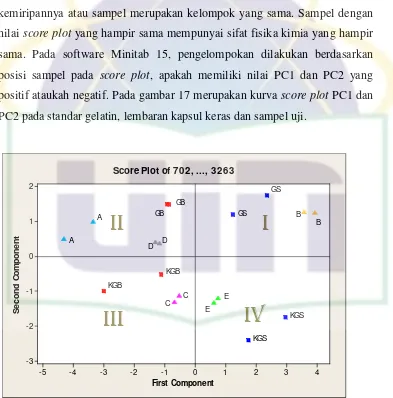
Berdasarkan kontribusi PC1 dan PC2 maka dapat dibuat kurva score
plot. Kurva score plot digunakan jika ada 2 komponen pertama merupakan
nilai terbanyak dalam variabilitas di dalam data. Komponen utama pertama
(PC1) sebagai absis sedangkan komponen utama kedua (PC2) sebagai
ordinat. Semakin dekat letak antar sampel pada score plot, maka semakin
27
UIN Syarif Hidayatullah Jakarta BAB 3
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan pada Maret-Juli 2014 di Laboratorium Product
Halal Analysis, Laboratorium Penelitian II Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta dan
Laboratorium PT. Saraswanti Indo Genetech Bogor.
3.2 Alat dan Bahan 3.2.1 Alat
Alat yang digunakan dalam penelitian ini adalah Waters 2695 HPLC,
Shimadzu FTIR, lemari pendingin (refrigerator), sentrifuge 5417R, oven,
neraca analitik, hote plat, labu ukur, erlenmeyer, kaca arloji, tabung reaksi
bertutup, mikro pipet 100-1000 ul beserta tip nya, spatula, gelas ukur, beaker
glass, vortex, pipet tetes, pinset, syringe filter, termometer, membran filter
0,45 µm ,vial, cawan porselen, batang pengaduk.
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah: standar
asam amino yaitu: asam aspartat, serin, asam glutamat, glisin,
histidin, arginin, treonin, alanin, prolin, sistein, tirosin,
L-valin, L- metionin, L- lisin, L- isoleusin, L- leusin, L- fenilalanin, triptofan,
standar gelatin sapi (sigma aldrich), standar gelatin babi (sigma aldrich),
internal standar AABA (alpha amino butiric acid), Accq-fluor borat, reagen
fluor A, HCl, asetonitril grade HPLC, aquabidest, aseton, sampel cangkang
kapsul, gliserin, titanium dioksida dan pewarna tartrazin.
3.3 Tahapan Penelitian
3.3.1 Pengumpulan Sampel dari Pasaran
Pengumpulan sampel dilakukan secara acak dengan cara mendata
UIN Syarif Hidayatullah Jakarta terdapat di dalam buku mims edisi 2014. Lalu didata semua produk vitamin
bercangkang kapsul keras dan diperoleh 25 produk vitamin bercangkang
kapsul keras. Kemudian diambil secara acak 5 produk kapsul bercangkang
keras dengan produsen yang berbeda-beda yang resmi beredar di Indonesia.
3.3.2 Pembuatan Lembaran Cangkang Kapsul Gelatin Keras Simulasi Menggunakan Gelatin Babi dan Gelatin Sapi
[image:46.595.135.534.122.471.2]Formulasi lembaran cangkang kapsul gelatin keras simulasi dapat dilihat pada
tabel berikut :
Tabel 3.1 Formulasi Lembaran Cangkang kapsul gelatin keras
Bahan Jumlah
Gelatin 50%
Gliserin 10%
Titanium dioksida 1,25%
Tartrazin 0,05%
Aquadest Ad 100%
Dibuat total sediaan : 10 mL
Sebanyak 5 g gelatin dimasukkan ke dalam becker glass 50 mL,
dibasahi dengan 5 mL aquadest. Kemudian dipanaskan pada suhu 60oC sampai membentuk larutan jernih. Lalu ditambahkan 1 mL gliserin, 0,125 g
titanium dioksida (yang telah didispersikan dalam 1 mL aquadest) dan 5 mg
pewarna tartrazin (yang telah dilarutkan dalam 1 mL aquadest) lalu di add
kan dengan aquadest hingga 10 mL. Diaduk hingga homogen. Campuran
dituangkan ke dalam cetakan untuk memperoleh lapisan tipis larutan gelatin.
Lalu disimpan di dalam desikator bersilika untuk menurunkan kandungan air
UIN Syarif Hidayatullah Jakarta 3.3.3 Analisis Gelatin dengan FTIR (Fourier Transform Infared
Spectroscopy)
3.3.3.1 Pemisahan Titanium Dioksida
Sebanyak 0,3 g lembaran cangkang kapsul keras simulasi dari standar
gelatin sapi dan babi, dan sampel uji cangkang kapsul keras dilarutkan
dengan 2 mL aquadest panas pada suhu 60oC. Campuran dimasukkan ke dalam mikrotube dan disentrifugasi selama 30 menit dengan kecepatan
10.000 rpm.
3.3.3.2 Ekstraksi Gelatin
Sebanyak 2 mL supernatan yang diperoleh dari hasil sentrifugasi pada
proses pemisahan titanium dioksida dimasukkan ke dalam mikrosentrifuge
dan ditambahkan dengan 8 mL aseton dingin dengan perbandingan 1:4. Lalu
divortex selama 5 menit sampai homogen. Diinkubasi pada suhu -20oC selama semalam kemudian disentrifuge selama 25 menit dengan kecepatan
6000 rpm. Supernatan dibuang dan endapan yang diperoleh kemudian dicuci
dengan aseton sebanyak 3 kali. Setelah itu endapan ditimbang (Fic et al.,
2010)
3.3.4 Analisis Profil Gelatin dengan FTIR
Sebanyak 0,5 g standar gelatin sapi dan babi dilarutkan dengan
aquadest 1 mL. Sebanyak 0,2 g endapan yang diperoleh dari hasil ekstraksi
lembaran cangkang kapsul keras simulasi, dan sampel uji cangkang kapsul
keras dilarutkan dengan aquadest 600 μ L pada suhu 60oC hingga homogen lalu dimasukkan ke dalam ATR (Attenuated total reflectance). Scanning
sampel dilakukan menggunakan spektroskopi FTIR pada panjang gelombang
4000-750 cm-1 (Hasyimet al.,2010 )
3.3.5 Analisa Data menggunakan PCA
Data gugus fungsi yang diperoleh selanjutnya dianalisis dengan teknik
PCA dengan cara memasukkan data absorbansi dari bilangan gelombang baik
UIN Syarif Hidayatullah Jakarta dan babi serta sampel uji cangkang kapsul keras ke dalam software Minitab
15 untuk membedakan gugus fungsi pada standar gelatin, lembaran cangkang
kapsul keras simulasi dan sampel uji cangkang kapsul keras (Miller, J.N., &
Miller, J.C. 2005).
3.3.6 Analisis Gelatin dengan KCKT (Kromatografi Cair Kinerja Tinggi)
3.3.6.1 Hidrolisis Asam Amino
Ditimbang sebanyak 0,1 gram masing-masing sampel standar gelatin
sapi dan babi, lembaran kapsul gelatin keras yang dibuat sendiri dari standar
gelatin sapi dan babi, dan produk kapsul keras yang telah dikeluarkan isinya,
ditambahkan 5 mL HCl 6 N dan dialiri gas nitrogen untuk mencegah
oksidasi. Tabung reaksi ditutup, kemudian divortex selama 5 menit.
Dihidrolisis pada suhu 1100C selama 22 jam di dalam oven. Setelah dihidrolisis, campuran didinginkan pada suhu ruang (Hafidz et al., 2011;
Fountoulakis & Lahm, 1998). Lalu dipindahkan isi tabung reaksi ke dalam
labu ukur 50 mL, ditambahkan aquabides sampai tanda batas. Disaring
dengan filter 0,45µm. Dipipet 500 µL filtrat lalu ditambahkan 40 µL larutan
standar internal (6,45 mg α-aminobutyric acid dalam 25 mL HCl 0,1M) dan
460 µL aquabides.
3.3.6.2 Derivatisasi
Dipipet 10 µL campuran larutan dari hasil hidrolisis dan larutan
standar internal, ditambahkan 70 µL AccQ.Tag Fluor borate, divortex.
Ditambahkan 20 µL reagen fluor A, divortex, diamkan selama 1 menit. Di
inkubasi selama 10 menit pada suhu 550C, lalu disuntikkan 5 µL filtrat pada HPLC (Kabelovaet al.,2009).
3.3.7 Analisis Profil Gelatin dengan KCKT (Kromatografi Cair Kinerja Tinggi)
Sebanyak 5 µL filtrat diinjeksikan ke dalam kolom HPLC dengan
kondisi : Waters AccQ•Tag kolom Nova-Pak C18, 4 μ m (3,9 x 150 mm),
UIN Syarif Hidayatullah Jakarta menggunakan sistem gradien dengan fase gerak AccQTag Eluent A (buffer
asetat-fosfat) dan Acetonitril 60% grade HPLC (campuran 60% asetonitril
dan 40% aquabidest); detektor fluoresen tipe 2475 (Waters, Milford,
Massachusetts, USA) pada panjang gelombang eksitasi 250 nm dan emisi 395
nm (Kabelovaet al.,2009).
Konsentrasi asam amino dalam sampel dihitung sebagai berikut:
( ) = ( )
( )
x 100%
3.3.8 Analisis Data menggunakan PCA
Data kromatogram yang diperoleh selanjutnya dianalisis dengan teknik
PCA dengan cara memasukkan data % height dari kromatogram baik standar
gelatin sapi dan babi, lembaran kapsul gelatin keras sapi dan babi serta pada
produk kapsul keras ke dalam software Minitab 15 untuk membedakan
komposisi asam amino pada standar gelatin, lembaran cangkang kapsul keras
32
UIN Syarif Hidayatullah Jakarta 4.1 Pengumpulan Sampel dari Pasaran
Pengumpulan sampel dilakukan secara acak terhadap 5 sampel obat
bercangkang kapsul keras dari populasi obat vitamin dan mineral dengan
produsen yang berbeda-beda yang belum teridentifikasi dengan jelas sumber
bahan baku gelatinnya. Masing-masing sampel diberi identitas sebagai
[image:50.595.134.532.128.484.2]berikut :
Tabel 4.1 Pengumpulan sampel kapsul keras dari pasaran
No Sampel Kategori
1. Kapsul merk E A
2. Kapsul merk D B
3. Kapsul merk V C
4. Kapsul merk C D
5. 5. Kapsul merk I E
4.2 Pembuatan Lembaran Cangkang Kapsul Keras Simulasi dari Standar Gelatin Sapi dan Gelatin Babi
Lembaran cangkang kapsul keras simulasi dibuat dari bahan dasar
gelatin dan air dengan penambahan gliserin, TiO2 (titanium dioksida) dan pewarna tartrazin. Tujuan penggunaan TiO2 (titanium dioksida) adalah sebagai opacifier agent. Titanium dioksida memiliki indeks bias yang tinggi
sehingga mempunyai sifat yang dapat menghamburkan cahaya dalam
penggunaannya sebagai pigmen pemutih atau pengopak (Rowe et al., 2003).
Lembaran cangkang kapsul keras simulasi yang dihasilkan berupa lapisan
tipis, bewarna kuning, opaque dan dapat digulung. Secara organoleptis dapat
dilihat bahwa lembaran cangkang kapsul keras simulasi yang dibuat dari
standar gelatin sapi memiliki warna kuning pucat atau kuning kecoklatan
sedangkan lembaran cangkang kapsul keras yang dibuat dari standar gelatin
UIN Syarif Hidayatullah Jakarta komponen lainnya. Namun demikian untuk mengkonfirmasi hal tersebut
perlu dilakukan pengujian lebih lanjut yaitu dengan optimasi preparasi
sampel karena bisa jadi bilangan gelombang ini adalah pengotor yang ikut
terbawa dalam sampel gelatin. Dari spektrum FTIR gambar 14 dan gambar 15
terlihat bahwa secara umum gelatin sapi dan gelatin babi memiliki
puncak-puncak serapan pada bilangan gelombang yang hampir identik. Namun jika
dibandingkan lebih rinci, diantara puncak-puncak serapan yang dihasilkan
(absorbansi) pada masing-masing bilangan gelombang secara kualitatif relatif
berbeda. Misalnya spektrum gelatin sapi pada daerah Amida A relatif lebih
tinggi jika dibandingkan dengan spektrum gelatin babi begitu pula pada
daerah amida I dan II (1656-1644 cm-1dan 1560-1335 cm-1).
Serapan pada daerah 3290-3280 cm-1 berkaitan dengan ikatan N-H
stretchingdan ikatan hidrogen intramolekuler pada gugus amina dalam rantai
asam amino. Absorpsi terpolarisasi paralel pada ikatan N-H, menunjukkan
adanya interaksi ikatan hidrogen pada struktur alpha heliks dalam struktur
gelatin tersebut. Puncak yang dihasilkan dapat bergeser ke frekuensi yang
lebih rendah ketika kekuatan ikatan hidrogennya meningkat (Hasyim et al.,
2010)
Ikatan rangkap stretching pada gugus karbonil C=O berinterkasi
dengan gugus N-H dari ikatan peptida (C-N), muncul pa