UIN SYARIF HIDAYATULLAH JAKARTA
ANALISA PROFIL PROTEIN GELATIN BABI DAN GELATIN SAPI CANGKANG KAPSUL LUNAK MENGGUNAKAN METODE SDS-PAGE
(SODIUM DODECYL SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
(S.Far)
CHANDRA LIDANSYAH HIDAYAT
NIM : 1110102000060
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
ANALISA PROFIL PROTEIN GELATIN BABI DAN GELATIN SAPI CANGKANG KAPSUL LUNAK MENGGUNAKAN METODE SDS-PAGE
(SODIUM DODECYL SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS)
SKRIPSI
CHANDRA LIDANSYAH HIDAYAT
NIM : 1110102000060
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Chandra Lidansyah H.
NIM : 1110102000060
Tanda Tangan :
HALAMAN PERSETUJUAN PEMBIMBING
Nama : Chandra Lidansyah Hidayat
NIM : 1110102000060
Program Studi : Farmasi
Judul Skripsi : Analisa Profil Protein Gelatin Babi dan Gelatin Sapi
Cangkang Kapsul Lunak Menggunakan Metode
SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide Gel
Electrophoresis)
Disetujui Oleh
Pembimbing 1 Pembimbing 2
Drs. Umar Mansur, M.Sc., Apt. Zilhadia, M.Si., Apt.
NIP. 197308222008012007
Mengetahui,
Kepala Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
ABSTRAK
Nama : Chandra Lidansyah Hidayat
NIM : 1110102000060
Program Studi : Farmasi
Judul : Analisa Profil Protein Gelatin Babi dan Gelatin Sapi
Cangkang Kapsul Lunak Menggunakan Metode
SDS-PAGE (Sodium Dodecyl Sulphate Poly
Acrylamide Gel Electrophoresis)
Gelatin sebagai bahan utama pembuatan kapsul lunak menjadi permasalahan dari aspek kehalalan karena sebagian besar diperoleh dari sumber non-halal. Sumber utama penghasil gelatin adalah kolagen dari kulit dan tulang sapi atau babi. Penelitian ini bertujuan untuk mengetahui profil protein gelatin babi dan gelatin
sapi menggunakan metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide
Gel Electrophoresis). Tahap awal penelitian gelatin, dilakukan hidrolisis menggunakan enzim pepsin pada pH 4,5 dengan suhu 60°C. Gelatin hidrolisat dielektroforesis masing-masing sebanyak 10µl kedalam tiap sumuran gel. Kemudian dilakukan analisis profil protein gelatin babi standar, gelatin sapi standar, simulasi cangkang kapsul lunak gelatin babi, simulasi cangkang kapsul lunak gelatin sapi, cangkang kapsul lunak Pharmaton, cangkang kapsul lunak Omepros, cangkang kapsul lunak Obipluz dan cangkang kapsul lunak Nature-E. Profil protein gelatin babi menunjukkan pita spesifik pada berat molekul 27,67 kDa, 20,65 kDa dan 10,35 kDa. Sedangkan untuk sapi 45,92 kDa dan 21,78 kDa.Dengan membandingkan profil protein sampel dan standar berdasarkan bobot molekul kolom 6 diduga bersumber dari selain kedua gelatin pembanding, sedangkan kolom 7, 8 dan 9 adalah gelatin sapi.
ABSTRACT
Name : Chandra Lidansyah Hidayat
NIM : 1110102000060
Major : Pharmacy
Title : Analysis of Protein Profile Pork Gelatin and Bovine
Soft Capsule shell by Using SDS-PAGE Method (Sodium Dodecyl Sulphate Poly Acrylamide Gel Electrophoresis)
Gelatin as an ingredient manufacture of soft capsule is still a problems of a halal aspect because obtained from non-halal sources. The Main source of producing gelatin is collagen from the skin and bones of bovine and pork. This study aims to determine the protein profile pork gelatin and bovine gelatin using SDS-PAGE (Sodium Dodecy Sulphate Poly Acrylamide Gel Electrophoresis) method. The early stage of gelatine carried hydrolyzed using by pepsin at pH 4,5 with temperature 60°C. Gelatin hydrolizate were analyzed by SDS-PAGE respectively 10 µl into well gel. Then analysis of protein profiles standard pork gelatin, bovine gelatin standard, soft capsule pork gelatin shell simulation, soft capsule bovine gelatin shell simulation, Pharmaton soft capsule shell, Omepros soft capsule shell, Obipluz soft capsule shell and Nature-E soft capsule shell. Pork gelatine protein profile showed specific band on the molecular weight 27,67 kDa, 20,65 kDa and 10,35 kDa. As for the bovine gelatin 45,92 kDa and 21,78 kDa. Compared protein profiles of sample and standard based on the molecular weigth of sixth column, asumption except for bovine gelatin and pork gelatin comparators, while seventh, eigtht and ninth column are bovine gelatin.
KATA PENGANTAR
Puji dan syukur kepada Allah SWT. Atas segala rahmat-Nya, penulis dapat menyelesaikan skripsi yang berjudul “Analisis Profil Protein Gelatin Babi dan Gelatin Sapi Cangkang Kapsul Lunak Menggunakan Metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide Gel Electrophoresis)”. Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir guna memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Secara garis besar skripsi ini berisi tentang profil protein gelatin babi, gelatin sapi, dan gelatin sampel cangkang kapsul lunak berdasarkan bobot molekulnya. Dalam penyusunan skripsi ini, penulis dibantu oleh berbagai pihak. Oleh karena itu, pada kesempatan ini, penulis mengucapkan terima kasih sedalam-dalamnya kepada:
1. Bapak Umar Mansur, M.Sc.Apt. dan Ibu Zilhadia, M.Si., Apt. selaku dosen
pembimbing 1 dan 2 yang telah memberi pengarahan, nasehat serta dukungan sehingga penulis dapat menyelesaikan skripsi ini.
2. Kedua Orang tua, (Alm) Bapak Suharna dan Ibu Rochajatin yang selalu mendoakan dan mendukung penulis.
3. Dr. H. Arif Sumantri, SKM., M. Kes. sebagai dekan Fakultas Kedokteran
dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
4. Bapak Yardi, Ph.D., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
5. Dosen-dosen program studi Farmasi dan FKIK yang telah memberikan ilmu
yang bermanfaat kepada penulis.
6. Bapak Sandra Hermanto, M.Si., pihak Laboratorium Terpadu UIN Jakarta
serta laboran laboratorium pangan (kakak prita dan kakak pipit) yang telah membantu dalam teknis penelitian.
7. Tasha Azizah Ulyanisa yang telah memberikan dukungan dan semangat
yang luar biasa besar sehingga penulis bisa menyelesaikan penelitian ini.
8. Papoy dan Ochim yang selalu menemani dan mendukung terselesainya
penelitian ini.
9. Sahabat-sahabat seperjuangan Farmasi angkatan 2010 yang sama-sama
berjuang untuk menyelesaikan pendidikan ini.
10.Sahabat penelitian Hafit Mustollah yang bersama-sama berjuang
menyelesaikan pendidikan ini.
11.Pihak-pihak lain yang terlibat langsung maupun tidak dalam penelitian ini
Penulis menyadari bahwa masih banyak terdapat kesalahan dalam penyusunan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran demi hasil yang lebih baik di lain waktu. Semoga skripsi ini dapat memberikan manfaat untuk kita semua.
Ciputat, Oktober 2015
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Chandra Lidansyah Hidayat
NIM : 1110102000060
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/ karya ilmiah saya, dengan judul :
ANALISA PROFIL PROTEIN GELATIN BABI DAN GELATIN SAPI CANGKANG KAPSUL LUNAK MENGGUNAKAN METODE SDS-PAGE
(SODIUM DODECYL SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS)
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 28 Oktober 2015
(Chandra Lidansyah H.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
LEMBAR PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PEERSETUJUAN PUBLIKASI ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 5
2.1 Kapsul ... 5
2.1.1 Jenis Kapsul ... 5
2.1.1.2 Gelatin Cangkang Kapsul Keras ... 5
2.1.1.3 Gelatin Cangkang Kapsul Lunak ... 6
2.2 Formulasi Simulasi Gelatin Cangkang Kapsul Lunak... 7
2.3.1 Komposisi Gelatin ... 9
2.3.2 Sifat Fisika Kimia Gelatin ... 10
2.3.3 Klasifikasi Gelatin ... 13
2.4 Protein ... 14
2.4.1 Penggolongan Protein ... 14
2.4.2 Struktur Protein ... 15
2.4.2.1 Struktur Protein Primer ... 16
2.4.2.2 Struktur Protein Sekunder... 17
2.4.2.3 Struktur Protein Tersier ... 17
2.4.2.4 Struktur Protein Kuartener ... 18
2.5 Asam Amino ... 18
2.5.1 Sifat-Sifat Asam Amino ... 18
2.5.2 Peptida ... 19
2.5.2.1 Sifat Peptida ... 20
2.6 Enzim ... 20
2.6.1 Aktivitas Enzim ... 21
2.7 Pepsin ... 21
2.8 Faktor yang Mempengaruhi Reaksi Enzimatik ... 22
2.8.1 Konsentrasi Enzim ... 22
2.8.2 Konsentrasi Substrat ... 23
2.8.3 Suhu ... 23
2.8.4 Pengaruh pH ... 24
2.9 SDS-PAGE ... 24
2.9.1 Medium Penyangga ... 28
2.9.2 Sampel ... 29
2.9.4 Medan Listrik... 30
BAB III METODE PENELITIAN ... 31
3.1 Lokasi dan Waktu Penelitian ... 31
3.2 Bahan Penelitian ... 31
3.3 Alat Penelitian ... 32
3.4 Tahap Penelitian ... 32
3.4.1 Pengambilan Sampel ... 32
3.4.2 Preparasi Reagent SDS-PAGE ... 32
3.4.3 Pembuatan Gel Elektroforesis ... 32
3.4.4 Pembuatan Simulasi Gelatin Cangkang Kapsul Lunak ... 33
3.4.5 Ekstraksi Gelatin ... 33
3.4.6. Hidrolisis Enzimatik Gelatin ... 34
3.5 Elektroforesis ... 34
3.6 Analisa Profil Gelatin Hasil Elektroforesis ... 35
BAB IV HASIL DAN PEMBAHASAN ... 37
4.1 Analisis Profil Protein dengan SDS-PAGE ... 37
4.2 Pembahasan ... 41
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
DAFTAR PUSTAKA ... 47
Lampiran 1 ... 51
Lampiran 2 ... 52
DAFTAR TABEL
Halaman
Tabel 1. Komposisi Asam Amino Gelatin ... 11
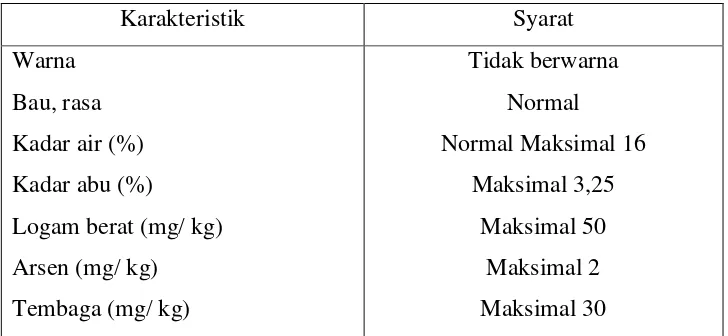
Tabel 2. Standar Mutu Gelatin di Indonesia ... 11
Tabel 3. Sifat Fisika Kimia Gelatin Komersial ... 12
Tabel 4. Persyaratan Gelatin ... 12
Tabel 5. Sifat Gelatin Tipe A dan Tipe B ... 14
Tabel 6. pH Aktivitas optinum Enzim ... 24
Tabel 7. Formula Gel Elektroforesis ... 32
Tabel 8. Nilai Log BM dan Nilai RF Marker Protein ... 40
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Primer Protein ... 17
Gambar 2. Struktur Sekunder Protein ... 17
Gambar 3 Struktur Tersier Protein ... 18
Gambar 4. Struktur Umum Asam Amino ... 18
Gambar 5. Skema Alur Elektroforesis ... 26
Gambar 6. Polimerisasi dan “crosslingking” dari Akrilamid dan N,N’-metilen-bis akrilamid ... 27
Gambar 7 Pembentukkan Ikatan Peptida ... 37
Gambar 8. Gel Hasil Elektroforesis ... 39
Gambar 9. Kurva Regresi Linear Standar Marker Protein ... 40
Gambar 10. Pemotongan Pepsin ... 42
BAB Ia PENDAHULUAN
1.1 Latar Belakang
Sediaan kapsul merupakan jenis sediaan farmasi yang sangat banyak
digunakan karena alasan kepraktisannya dan dapat menutupi rasa yang tidak
menyenangkan dari obat. Selain itu juga berfungsi untuk menjaga bahan aktif
dari pengaruh lingkungan sehingga menjaga stabilitasnya (Gadri dan Ega
Priani, 2012). Sediaan obat vitamin dan mineral sebagian besar dalam bentuk
cangkang kapsul keras dan cangkang kapsul lunak (ISO, 2014). Umumnya
cangkang kapsul terbuat dari gelatin yang kebanyakan diproduksi dari babi
sehingga diragukan kehalalannya (Gadri dan Ega Priani, 2012). Adanya
gelatin pada komponen cangkang kapsul menyebabkan obat lebih mudah
larut dalam sistem pencernaan, dan lebih banyak disukai oleh
konsumen karena bentuknya yang lunak sehingga mudah ditelan (Reich,
2001).
Gelatin merupakan polipeptida yang diperoleh melalui hidrolisis
kolagen jaringan ikat hewan. Gelatin memiliki sifat yang unik yakni dapat
membentuk gel sehingga digunakan secara luas dalam industri makanan dan
industri farmasi (Hidaka dan Liu, 2003). Industri gelatin umumnya
menggunakan kulit dan tulang babi karena selain mudah dan murah untuk
didapatkan, proses pembuatan dari kulit babi lebih cepat dan tidak
memerlukan bahan yang banyak. Hal ini dikarenakan jaringan ikat pada kulit
babi tidak terlalu kuat dibandingkan sapi, sehingga proses hidrolisis lebih
mudah dan tidak membutuhkan zat penghidrolisis, zat penetral, dan zat
pencuci yang terlalu banyak (Hana, 2009).
Produsen Gelatin Eropa pada tahun 2011 menyatakan bahwa sumber
utama gelatin diekstrak dari kulit babi sebanyak 80%, kulit sapi sebanyak
15%, dan sebanyak 5% sisanya berasal dari tulang babi, tulang sapi serta
unggas dan ikan (Jamaludin et al., 2011). Pada tahun 2012 GMIA
menyatakan sebanyak 90% gelatin komersial diperoleh dari babi (GMIA,
Penggunaan gelatin sebagai salah satu bahan baku kapsul lunak
menimbulkan kontroversi karena adanya kekhawatiran konsumen mengenai
kehalalan sumber gelatin (Jamaludin et al., 2011). Sebagai negara dengan
mayoritas penduduk muslim maka perlu dilakukan analisis terhadap sumber
gelatin pada cangkang kapsul lunak yang beredar dipasaran sebagai
perlindungan terhadap masyarakat yang menjadi konsumen produk farmasi
berbasis gelatin (Riaz dan Chaudry, 2004).
Analisis terhadap sumber gelatin sendiri telah dilakukan dengan
berbagai metode diantaranya adalah Fourier Transform Infrared
Spectroscopy (Hashim et al., 2010), Chemical precipitation (Hikada and Liu,
2003) dan Enzyme Linked Immuno Sorbent Assay (ELISA) (Venien and
Levieux, 2005). Metode diatas terbukti dapat menentukkan sumber
pembuatan gelatin, akan tetapi memerlukan hasil yang berulang dan
pengalaman karena penyiapan sampel yang sensitif dan sulit (Hermanto, et
al., 2013).
Metode SDS-PAGE merupakan salah satu metode yang mampu
menunjukkan profil protein pita yang terbentuk dari gelatin babi dengan
gelatin sapi berdasarkan tingkat migrasi molekul. Keunggulan metode ini
adalah sudah lazim digunakan untuk analisa protein, relatif murah, penyiapan
sampel sederhana dan hanya membutuhkan sedikit sampel untuk analisa.
Seperti penelitian yang telah dilakukan oleh Hermanto et al (2013), tentang
perbedaan gelatin sapi dan gelatin babi dengan metode SDS-PAGE dengan
terlebih dahulu menghidrolisis gelatin menggunakan enzim pepsin pada suhu
60°C dan pH 4,5 sebelum dianalisis. Hasil penelitian Hermanto et al (2013)
mendapati adanya pita spesifik pada gelatin babi pada bobot molekul 28,6
dan 36,8 kDa. Hasil ini dapat digunakan sebagai acuan pembeda gelatin sapi
dan gelatin babi. Namun penelitian diatas dilakukan terbatas pada gelatin
murni yang belum mengalami proses menjadi produk seperti cangkang kapsul
lunak. Berdasarkan ulasan yang telah dipaparkan diatas maka pada penelitian
digunakan metode SDS-PAGE dengan menghidrolisis sampel dengan pepsin
Dalam penelitian ini dilakukan analisis profil protein gelatin babi
dan gelatin sapi pada cangkang kapsul lunak vitamin menggunakan metode
Sodium Dodecyl Sulfat Poly Acrilamide Gel Electrophoresis.Hasil penelitian
yang didapat diharapkan dapat menjadi acuan dalam analisis produk farmasi
berbasis gelatin lainnya terutama gelatin cangkang kapsul lunak.
Gelatin sapi, gelatin babi dan sampel dihidrolisis enzimatik
menggunakan enzim pepsin. Pemilihan pepsin dikarenakan pepsin memiliki
sisi pemotongan spesifik pada ikatan peptida fenilalanin dan glutamat dimana
komposisi asam amino ini pada gelatin babi dua kali lebih banyak
dibandingkan gelatin sapi (Mohd et al., 2011). Sehingga diharapkan dapat
menghasilkan fragmen gelatin dengan bobot molekul yang relatif berbeda.
1.2 Perumusan Masalah
1. Bagaimana profil protein gelatin babi dan gelatin sapi hasil hidrolisis
pepsin dapat dibedakan dengan metode SDS-PAGE?
2. Bagaimana profil protein hidrolisat gelatin sapi, gelatin babi dan gelatin
cangkang kapsul lunak hasil analisis SDS-PAGE berdasarkan
karakteristik bobot molekulnya?
3. Apakah metode SDS-PAGE mampu menentukkan sumber gelatin pada
cangkang kapsul lunak?
1.3 Tujuan Penelitian
Mengidentifikasi sumber gelatin yang digunakan sebagai bahan
pembuatan cangkang kapsul gelatin lunak berdasarkan perbedaan bobot
molekul dihidrolisis dengan enzim pepsin.
1.4 Manfaat Penelitian
1. Hasil penelitian ini adalah informasi ilmiah pendahuluan tentang
karakteristik profil protein gelatin babi dan gelatin sapi pada cangkang
2. Informasi ilmiah yang didapat diharapkan dapat memberikan kontribusi
dan menjadi acuan dalam analisa produk farmasi berbasis gelatin
BAB II
TINJAUAN PUSTAKA
2.1 Kapsul
Kapsul adalah sediaan padat yang terdiri dari obat dalam cangkang
keras atau lunak yang dapat larut. Kapsul dapat didefinisikan sebagai bentuk
sediaan padat, dimana satu macam bahan obat atau lebih dan bahan inert
lainnya dimasukkan ke dalam cangkang atau wadah kecil yang umumnya
dibuat dari gelatin yang sesuai (Ansel, 1989).
Cangkang kapsul umumnya terbuat dari gelatin, tetapi dapat juga
dibuat dari bahan lain yang sesuai. Berdasarkan konsistensinya kapsul dapat
dibagi menjadi kapsul keras dan kapsul lunak. Kapsul gelatin keras terbuat
dari gelatin berkekuatan gel relatif tinggi dibandingkan kapsul gelatin
cangkang lunak. Berbagai jenis gelatin dapat digunakan dalam proses
pembuatan kapsul, tetapi gelatin dari campuran kulit dan tulang sering
digunakan untuk mengoptimalkan kejernihan dan kekerasan cangkang
(Departemen Kesehatan RI, 1995).
Kapsul gelatin cangkang keras yang diisi di pabrik dapat ditutup
secara sempurna dengan cara dilekatkan. Kapsul cangkang keras biasanya
diisi dengan serbuk, butiran atau granul, butiran gula inert dapat dilapisi
dengan komposisi bahan aktif dan penyalut yang dapat memberikan profil
lepas lambat (Departemen Kesehatan RI, 1995). Kebanyakan kapsul–kapsul
yang diedarkan dipasaran adalah jenis kapsul yang dapat ditelan oleh pasien
untuk keuntungan pengobatan (Ansel, 1989).
2.1.1 Jenis Kapsul
2.1.1.2 Kapsul Gelatin Cangkang Keras
Kapsul gelatin cangkang keras adalah sediaan padat yang terdiri dari
obat dalam cangkang keras atau lunak yang dapat larut (Ansel, 1989). Kapsul
gelatin cangkang keras terbuat dari gelatin berkekuatan gel relatif tinggi
dibandingkan kapsul gelatin cangkang lunak (Departemen Kesehatan RI,
Kapsul gelatin keras dibuat melalui suatu proses dengan cara
mencelupkan pin (alat pembentuk kapsul) kedalam larutan gelatin, kemudian
lapisan gelatin dikeringkan, dirapikan dan dilepaskan dari pin tersebut, bagian
induk dan tutup kapsul tersebut dilekatkan (Departemen Kesehatan RI. 1995).
Cangkang kapsul kosong dibuat dari campuran gelatin, gula dan air jernih
tidak berwarna mengandung uap air Antara 9–12% (Ansel, 1989).
Cangkang gelatin kapsul keras dibuat dalam dua bagian yaitu badan
kapsul dan bagian tutupnya yang lebih pendek. Kedua bagian ini akan saling
menutupi saat di pasangkan. Umumnya kapsul gelatin keras dipakai untuk
menampung isi 65 mg–1 gram bahan serbuk, termasuk bahan obat dan bahan
tambahan lainnya (Ansel, 1989).
Kapsul gelatin tidak tepat diisi dengan cairan berair, karena air akan
melunakkan gelatin dan menimbulkan kerusakan bentuk sediaan kapsul.
Apabila disimpan dalam lingkungan dengan kelembapan yang tinggi,
penambahan uap air akan diabsorbsi oleh kapsul dan kapsul keras ini akan
mengalami perubahan bentuk sediaan. Sebaliknya dalam lingkungan udara
yang sangat kering, sebagian dari uap air yang terdapat dalam kapsul gelatin
akan berkurang atau hilang dan mengakibatkan kapsul ini menjadi rapuh
(Ansel, 1989).
2.1.1.3 Kapsul Gelatin Cangkang Lunak
Kapsul gelatin cangkang lunak dibuat dari gelatin atau bahan lain
yang sesuai. Kapsul gelatin lunak dapat diplastisasi dengan penambahan
senyawa poliol atau plasticizer seperti sorbitol atau gliserin. Perbandingan
bahan plastisasi kering terhadap gelatin kering menentukkan kekerasan
cangkang dan dapat diubah untuk penyesuaian dengan kondisi lingkungan
dan juga sifat isi kapsul (Departemen Kesehatan RI, 1995).
Untuk pembuatan kapsul lunak dalam skala industri, dilakukan
dengan cara rotary die process, yaitu suatu metode yang dikembangkan oleh
Robert P. Scherer pada tahun 1993. Dengan metode ini cairan gelatin yang
dituangkan dari tangki yang terletak diatas, dibentuk menjadi dua buah pita
obat akan diisikan dan dimasukkan diantara kedua pita secara tepat. Ketika
itu dies membentuk kantung–kantung dari pita gelatin. Kemudian kantung–
kantung gelatin yang telah terisi, disegel dengan tekanan dan panas (Ansel,
1989).
Kapsul cangkang lunak dapat dibuat dengan berbagai macam bentuk
Antara lain, bundar, lonjong, bentuk pipa, membujur, dan lain–lainnya.
Kapsul–kapsul gelatin lunak dapat digunakan untuk mengisi macam–macam
jenis bahan, bentuk cair dan kering. Jenis cairan yang dapat dimasukkan ke
dalam kapsul gelatin lunak termasuk: Cairan yang tidak tersatukkan dengan
air, cairan yang mudah menguap dan tidak menguap, contohnya minyak
nabati, hidrokarbon aromatik dan hidrokarbon alifatik, eter, ester, alkohol,
dan asam organik. Cairan yang tersatukkan dengan air, cairan yang tidak
menguap seperti polietilen glikol dan surfaktan nonionik seperti polisorban
80. Cairan yang tersatukkan dengan air dan kelompok komponen yang tidak
menguap seperti propilen gllikol dan isopropil alkohol (Ansel, 1989).
Cairan yang mudah berpindah ke cangkang kapsul tidak dapat
dimasukkan kedalam kapsul gelatin lunak. Bahan–bahan ini termasuk air
diatas 5%, senyawa organik yang larut air dengan berat molekul rendah dan
senyawa yang mudah menguap seperti alkohol keton, asam amino dan ester–
ester (Ansel, 1989).
2.2 Formulasi Simulasi Pembuatan Cangkang Kapsul Gelatin Lunak
Pembuatan lembaran kapsul gelatin lunak dari standar gelatin sapi
dan babi dilakukan dengan tujuan untuk membuat produk kapsul lunak yang
serupa dengan produk yang beredar di pasaran sehingga hasil analisis
karakteristik protein menggunakan SDS-PAGE yang didapatkan diharapkan
tidak terlalu berbeda dengan produk yang diambil dari pasaran. Lembaran
kapsul gelatin lunak dalam penelitian ini dibuat dari gelatin, gliserin, air, dan
pewarna.
Bahan baku tipe cangkang kapsul gelatin lunak adalah gelatin,
plasticizer, dan material lainnya seperti pewarna. Plasticizer digunakan pada
Penggunaannya pada formulasi cangkang kapsul lunak berkisar antara 20–
30%. Plasticizer yang paling sering digunakan pada formulasi pembuatan
cangkang kapsul lunak adalah gliserin. Pemilihan dan jumlah plasticizer yang
digunakan mempengaruhi kekerasan kapsul. Plasticizer yang dipilih dalam
formulasi pembuatan cangkang kapsul lunak memiliki kompatibilitas dengan
bahan pengisi kapsul dan mudah proses penggunaannya (Bhatt dan Agrawal,
2007).
Gliserin ditambahkan dalam kapsul untuk mempertahankan elastisitas
selama proses pengeringan dan penyimpanan agar kapsul tidak rusak atau
rapuh. Gliserin secara umum lebih efektif daripada sorbitol. Gliserin dapat
berinteraksi secara langsung dengan gelatin membentuk gel yang stabil, akan
tetapi gliserin memberikan efek sedikit higroskopis sehingga membutuhkan
tambahan yang memberikan efek lembab secara tidak langsung. Sorbitol
merupakan plasticizer tidak langsung, bertindak sebagai agen pelembab dan
dengan adanya air akan menjadi plasticizer yang efektif (Reich, 2001).
Air berjumlah 20–30% dari formulasi gel basah dan air memiliki
peran penting untuk menjamin keberhasilan enkapsulasi. Kehilangan air
selama pengeringan akan menyebabkan gel gelatin menyusut sedikit demi
sedikit, akibatnya menjelang akhir proses pengeringan retakan mungkin
terjadi dan menyebabkan cangkang kapsul pecah. Kelebihan air akan dibuang
melalui proses pemanasan. Pengeringan dilakukan untuk menghilangkan
sebagian air dan didalam kapsul masih terdapat sekitar 5–8% air yang terikat
dalam gelatin (Bhatt et al, 2007).
Pewarna kapsul gelatin lunak digunakan untuk memberikan warna
pada kapsul gelatin lunak. Pewarna dapat berasal dari pewarna sintetik dan
alami. Pewarna dapat digunakan sebagai pelindung isi kapsul yang tidak
stabil dengan adanya cahaya (Bhatt dan Agrawal, 2007).
Kapsul gelatin cangkang lunak dapat dibentuk elips atau seperti bola.
Kapsul jenis ini dapat diisi cairan, suspensi, bahan berbentuk pasta atau
serbuk kering (Ansel, 1989). Untuk skala kecil, kapsul gelatin lunak dibuat
dengan cara proses lempeng dengan menggunakan seperangkat cetakan untuk
selembar gelatin hangat yang tidak berwarna pada permukaan cetakan bagian
bawah, kemudian selembar gelatin lainnya diletakkan diatasnya kemudian
diberi tekanan. Gaya tekan ini bertindak sebagai pembuat kapsul. Pengisian
bahan obat dan pemasangan segelnya dilakukan dalam waktu yang
bersamaan dan serentak, kemudian kapsul yang sudah dicetak dipindahkan
dan dicuci dengan pelarut yang tidak mengganggu dan merusak kapsul
(Ansel, 1989).
2.3 Gelatin
Gelatin adalah produk alami yang diperoleh dari hidrolisis parsial
kolagen. Kolagen mengandung 14% hydroxyprolin, 16% prolin dan 26%
glisin. Rantai kolagen terdiri dari tiga rangkaian polipeptida dengan urutan
glisin (gly), prolin (pro) dan hidroksiprolin (hyp). Tiga rantai peptida tersebut,
masing–masing mempunyai struktur heliks dan bersama–sama membentuk
tiga untaian heliks. Tiga untaian tersebut membentuk gulungan yang
berikatan dengan atom hidrogen. Satu unit kolagen disebut tropokolagen,
dengan berat molekul ± 30 kda dengan panjang kira–kira 280 nm dan
diameter 1,4–1,5 nm (Jannah, 2008).
Gelatin merupakan sistem koloidal padat (protein) dalam cairan (air)
sehingga pada suhu dan kadar air yang tinggi gelatin mempunyai kemampuan
cairan yang disebut fase sol atau hidrosol, sebaliknya pada suhu dan kadar air
yang rendah gelatin mempunyai kemampuan yang lebih kasar atau lebih
pekat strukturnya, yang disebut fase gel. Pemanasan dan penambahan air akan
mengubah gelatin menjadi fase sol, sebaliknya pendinginan dan pengurangan
air akan mengubah gelatin menjadi fase gel (Jannah, 2008).
2.3.1 Komposisi Gelatin
Struktur umum gelatin adalah –
Ala-Gly-Pro-Arg-Gly-Glu-4Hyp-Gly-Pro- (Jannah, 2008). Lima asam amino yang ada umumnya meliputi
glisin 26,4%-30,5%; prolin 14,8%-18%; hidroksiprolin 13,3%-14,5%; asam
glutamat 11,1%-11,7%; dan alanin 8,6%-11,3% (Grobben et al., 2004).
tinggi kandungan Hidroksiprolin kekuatan gel gelatin akan semakin kuat
(Jannah, 2008). Asam amino penyusun protein dalam gelatin lain dalam
jumlah yang sedikit meliputi arginin, asam aspartat, lisisn, serin, leusin, valin,
fenilalanin, treonin, isoleusin, hidroksilisin, histidin, metionin dan tirosin
(Grobben et al, 2004).
2.3.2 Sifat Fisika Kimia Gelatin
Gelatin hampir tidak berasa dan tidak berbau, lembaran gelatin
bersifat rapuh, padat dan jernih kekuningan, gelatin memiliki kelembaban
8-13% dan memiliki massa jenis 1,3-1,4 g/cm. Gelatin larut dalam gliserol,
propilen glikol, asam asetat, trifluoroethanol dan formamida. Gelatin tidak
larut dalam benzene, aseton, alkohol primer dan dimetilformamida (GMIA,
2012). Gelatin mengandung protein yang sangat tinggi dan rendah kadar
lemaknya. Gelatin kering dengan kadar air 8–12% mengandung protein
sekitar 84–86%, mineral 2%-4%, serta lemak dan hampir tidak ada vitamin
(Carr et al, 1995).
Gelatin dapat mengembang dalam air dingin, dapat membentuk film,
mempengaruhi viskositas suatu bahan dan dapat melindungi sistem koloid.
Pada suhu 71ºC gelatin mudah larut dalam air dan membentuk gel pada suhu
35-50ºC. Gelatin mempunyai kemampuan menyerap air 5–10 kali dan
menjadi swelling dalam air dingin. Gelatin bersifat termal reversible yaitu
setelah gel dipanaskan dan selanjutnya didinginkan dapat membentuk gel
kembali. Gelatin yang dipanaskan diatas suhu 45°C secara bertahap akan
kehilangan kemampuan untuk mengembang. Gelatin terdiri dari banyak
polipeptida atau formasi heliprolin panjang yang masing–masing terdiri dari
3000–4000 asam amino (Jannah, 2008).
Gelatin merupakan turunan kolagen yang merupakan protein dengan
komponen dasar 50,5% karbon, 6,8% hidrogen, 17% nitrogen dan 25,2%
oksigen. Gelatin merupaka protein, gelatin akan mengalami reaksi yang sama
seperti protein jika berinteraksi dengan enzim-enzim proteolitik (GMIA,
Tabel 1. Komposisi Asam Amino Gelatin (Sumber : GMIA)
Gelatin memiliki sifat amfoterik, gelatin akan menjadi kation dalam
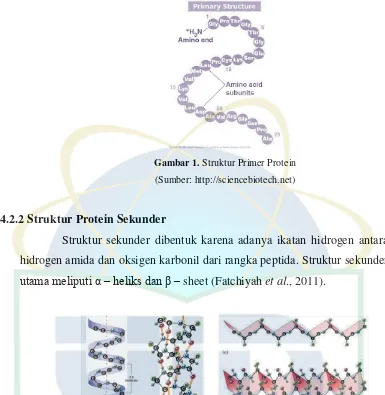
larutan asam dan menjadi anion dalam larutan basa. Gelatin tipe A memiliki
titik isoelektrik 4,7-5,4 dan gelatin tipe B memiliki titik isoelektrik 4,6-9.
Pada titik isoelektriknya partikel gelatin tidak memiliki muatan dan tidak
terjadi perpindahan partikel gelatin.
Sifat fisika, kimia dan fungsional gelatin merupakan sifat yang
sangat penting untuk menentukkan mutu gelatin. Sifat yang bisa dijadikan
parameter dalam menentukkan mutu gelatin antara lain, kekuatan gel,
viskositas dan rendemen.
Tabel 2. Standar Mutu Gelatin di Indonesia (Sumber: Jannah, 2008)
Seng (mg/ kg)
Sulfit (mg/ kg)
Maksimal 100
Maksimal 1000
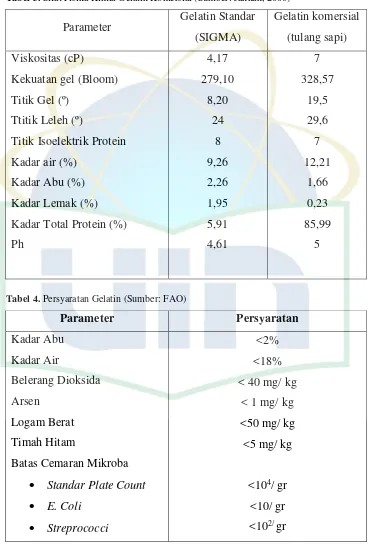
Tabel 3. Sifat Fisika Kimia Gelatin Komersial(Sumber: Jannah, 2008)
Parameter Gelatin Standar
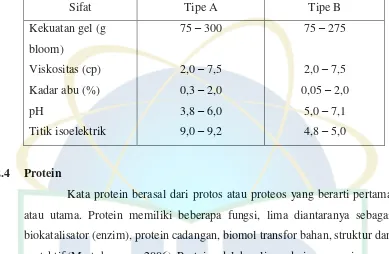
Tabel 4. Persyaratan Gelatin (Sumber: FAO)
2.3.3 Klasifikasi Gelatin
Berdasarkan proses pembuatannya (perendaman) gelatin dapat
diklasifikasikan menjadi gelatin tipe A dan gelatin tipe B. Gelatin tipe A
adalah gelatin yang dihasilkan melalui proses perendaman menggunakan
asam. Pada gelatin tipe A biasanya bahan yang digunakan adalah kulit babi
dan sapi muda. Kulit binatang tersebut tidak memiliki ikatan yang kuat. Pada
dasarnya kolagen yang berada pada kulit atau tulang direndam dengan pelarut
pada pH 4 dan kemudian dipanaskan bertahap pada suhu 50ºC sampai
mendidih untuk mendenaturasi dan melarutkan kolagen. Setelah itu kolagen
yang telah berubah sifat disaring untuk memperoleh kemurnian yang tinggi.
Peningkatan konsentrasi gelatin dilakukan dengan evaporasi vakum atau
membran ultrafiltrasi. Kemudian dilakukan proses pengeringan dengan cara
melewatkan udara kering diatas gel. Akhir proses dengan melakukan
penggilingan dan pengemasan. Gelatin yang dihasilkan mempunyai pH
isoelektrik antara 7–9 tergantung dari bahan baku dan pelarut asam yang
digunakan untuk memproses kolagen yang menyebabkan hidrolisis terbatas
pada sisi rantai asam amino asparagin dan glutamin. Penggunaan asam yang
berlebih berfungsi untuk menetralisir garam–garam yang tersisa (Jannah,
2008).
Gelatin B jika proses pembuatannya menggunakan basa. Gelatin tipe
ini diproduksi menggunakan larutan alkali seperti soda kaustik atau larutan
kapur untuk mendapatkan kolagen dengan waktu perendaman yang lama
sebelum ekstraksi gelatin. Pada proses alkali biasanya menggunakan bahan
baku kulit sapi dan babi atau sumber kolagen dari binatang lain yang sudah
tua (Cole, 2002). Proses alkali ini menghidrolisis asparagin dan glutamin
menjadi asam aspartat dan asam glutamat relatif cepat (Veis, 1964), yang
menghasilkan gelatin dengan titik isoelektrik 4,8–5,2, meskipun dengan
memperpendek waktu perendaman alkali (7 hari atau lebih sedikit) akan
menghasilkan gelatin dengan titik isoelektrik setinggi 6. Setelah proses alkali,
kolagen dicuci dengan asam untuk membebaskan alkali dan untuk
penyesuaian pH ekstraksi (yang mempunyai efek pada kekuatan gel pada
didenaturasi dan dikonversi menjadi gelatin dengan pemanasan seperti pada
proses asam (Jannah, 2008).
Tabel 5. Sifat Gelatin Tipe A dan Tipe B (Sumber: Jannah, 2008)
Sifat Tipe A Tipe B
Kata protein berasal dari protos atau proteos yang berarti pertama
atau utama. Protein memiliki beberapa fungsi, lima diantaranya sebagai
biokatalisator (enzim), protein cadangan, biomol transfor bahan, struktur dan
protektif (Martoharsono, 2006). Protein adalah polimer dari asam amino yang
dihubungkan dengan asam amino. Komposisi rata–rata unsur kimia dalam
protein adalah karbon 50%, Hidrogen 7%, oksigen 23%, nitrogen 16%,
belerang 0-3%, dan fosfor 0-3% (Poedjiadi, 1994).
Protein memiliki berat molekul bervariasi dengan cara hidrolisis
oleh asam atau oleh enzim protein akan menghasilkan asam asam amino. Ada
20 jenis asam amino yang terdapat dalam molekul protein. Asam amino ini
terikat satu sama lain oleh ikatan peptida. Beberapa faktor yang dapat
mempengaruhi protein adalah suhu tinggi, pH, dan pelarut organik (Poedjiadi,
1994).
2.4.1 Penggolongan Protein
Ditinjau dari strukturnya protein dapat dibagi dalam dua golongan
besar yaitu, golongan protein sederhana dan protein gabungan. Protein
sederhana adalah protein yang hanya terdiri atas molekul–molekul asam
dan gugus bukan protein. Gugus ini disebut dengan gugus prostetik dan terdiri
atas karbohidrat, lipid, atau asam nukleat (Poedjiadi, 1994).
Protein sederhana dapat dibagi dalam dua bagian menurut bentuk
molekulnya, yaitu protein fiber dan protein globular. Protein fiber
mempunyai bentuk molekul panjang seperti serat atau serabut, sedangkan
protein globular berbentuk bulat. Protein fiber terdiri atas beberapa rantai
polipeptida yang memanjang dan dihubungkan satu dengan yang lain oleh
beberapa ikatan silang hingga berbentuk serat atau serabut yang stabil. Sifat
umum protein fiber adalah tidak larut dalam air dan sukar diuraikan oleh
enzim (Poedjiadi, 1994).
Protein dapat diklasifikasikan berdasarkan kelarutan, bentuk fungsi
biologi atau struktur tiga dimensinya. Berdasarkan fungsi biologisnya,
protein dapat diklasifikasikan sebagai enzim (dehidrogenase kinase). Protein
penyimpanan (ferritin dan myoglobin), protein pengikat–DNA, hormon
peptida, protein struktural (kolagen dan proteoglikan), protein pelindung
(faktor pembekuan darah dan imunoglobin), protein pengangkut (hemoglobin
dan lipoprotein plasma) dan protein kontraktil atau motil (aktin dan tubulin)
(Murray et al., 2006).
2.4.2 Struktur Protein
Ada empat tingkat struktur dasar protein, yaitu struktur primer,
sekunder, tersier dan kuartener. Untuk mengetahui jumlah, jenis, dan urutan
asam amino dalam protein dapat dilakukan analisis yang terdiri dari beberapa
tahap, penentuan jumlah rantai polipeptida yang berdiri sendiri, pemecahan
ikatan antara rantai polipeptida tersebut, pemecahan masing–masing rantai
polipeptida, dan analisis urutan asam amino pada rantai polipeptida
(Poedjiadi, 1994).
Pada rantai polipeptida terdapat banyak gugus >C=O dan gugus
>N-H. Kedua gugus ini dapat berikatan satu dengan yang lain karena
terbentuknya ikatan hidrogen antara atom oksigen dari gugus >C=O dengan
gugus–gugus yang terdapat dalam satu rantai polipeptida, maka akan
terbentuk struktur heliks (Poedjiadi, 1994).
Ikatan hidrogen ini dapat pula terjadi antara dua rantai polipeptida atau lebih dan akan membentuk konfigurasi α yaitu bukan bentuk heliks tetapi rantai sejajar yang berkelok–kelok dan disebut struktur lembaran berlipat
(pleated sheet structure). Ada dua bentuk lembaran berlipat, yaitu bentuk
paralel dan bentuk anti paralel. Bentuk paralel terjadi apabila rantai
polipeptida yang berikatan melalui ikatan hidrogen itu sejajar dan searah,
sedangkan bentuk anti paralel terjadi apabila rantai polipeptida berikatan
dalam posisi sejajar tetapi berlawanan arah (Poedjiadi, 1994).
Struktur tersier, menunjukkan kecenderungan polipeptida
membentuk lipatan atau gulungan, dan dengan demikian membentuk struktur
yang lebih kompleks. Struktur ini dimantapkan dengan oleh adanya beberapa
ikatan Antara gugus R pada molekul asam amino yang membentuk protein
(Poedjiadi, 1994).
Struktur kuartener menunjukkan derajat persekutuan unit–unit
protein. Sebagian besar protein globular terdiri atas beberapa rantai
polipeptida yang terpisah. Rantai polipeptida ini saling berinteraksi
membentuk persekutuan.
2.4.2.1 Struktur Protein Primer
Struktur primer menunjukkan jumlah, jenis dan urutan asam amino
dalam molekul protein (Poedjiadi, 1994). Struktur primer protein
menggambarkan urutan linear residu asam amino dalam suatu protein. Urutan
asam amino selalu dituliskan dari gugus terminal amino ke gugus terminal
karboksil. Struktur 3 dimensi protein tersusun dari struktur sekunder, tersier
dan kuartener. Faktor yang menentukkan untuk menjaga atau menstabilkan
ketiga tingkat struktur tersebut adalah ikatan kovalen yang terdapat pada
Gambar 1. Struktur Primer Protein
(Sumber: http://sciencebiotech.net)
2.4.2.2 Struktur Protein Sekunder
Struktur sekunder dibentuk karena adanya ikatan hidrogen antara
hidrogen amida dan oksigen karbonil dari rangka peptida. Struktur sekunder utama meliputi α –heliks dan β – sheet (Fatchiyah et al., 2011).
Gambar 2. Struktur Sekunder Protein
(Sumber: http://sciencebiotech.net)
2.4.2.3 Struktur Protein Tersier
Struktur tersier menggambarkan rantai polipeptida yang mengalami
folded sempurna. Beberapa polipeptida folded terdiri terdiri dari beberapa
protein globular yang berbeda yang digabungkan oleh residu asam amino.
Unit tersebut dinamakan domain. Struktur tersier distabilkan oleh interaksi
antara gugus R yang terletak tidak bersebelahan pada rantai polipeptida.
Pembentukkan struktur tersier membuat struktur primer dan sekunder
Gambar 3. Struktur Tersier Protein
(Sumber: http://sciencebiotech.net)
2.4.2.4 Struktur Kuartener
Struktur kuartener melibatkan asosiasi dua atau lebih rantai polipeptida yang membentuk multisubunit atau protein oligomerik. Rantai
polipeptida penyusun protein oligomerik dapat berbeda atau sama (Fatchiyah,
2011).
2.5 Asam Amino
Asam amino adalah asam karboksilat yang mempunyai gugus
amino. Asam amino yang terdapat sebagai komponen protein mempunyai
gugus –NH2 pada atom karbon α dari posisi gugus –COOH. (Poedjiadi, 1994).
Gambar 4. Struktur Umum Asam Amino
(Sumber, Poedjiadi, 2009)
2.5.1 Sifat–Sifat Asam Amino
Pada umumnya asam amino larut dalam air dan tidak larut dalam
Asam karboksilat alifatik maupun aromatik yang terdiri atas beberapa atom
karbon umumnya kurang larut dalam air tetapi larut dalam pelarut organik.
Demikian pula amina pada umumnya tidak larut dalam air, tetapi larut dalam
pelarut organik (Poedjiadi, 1994).
Perbedaan sifat antara asam amino dengan asam karboksilat dan
amina terlihat pula pada titik leburnya. Asam amino mempunyai titik lebur
yang lebih tinggi bila dibandingkan dengan asam karboksilat atau amina.
Kedua sifat fisika ini menunjukkan bahwa asam amino cenderung
mempunyai struktur yang bermuatan dan mempunyai polaritas tinggi, hal ini
tampak pada sifat asam amino sebagai elektrolit (Poedjiadi, 1994).
Apabila asam amino larut dalam air, gugus karboksilat akan
melepaskan ion H+, sedangkan gugus amina akan menerima ion H+.
-COOH -COO- + H+
-NH2 + H+ -NH3+
Oleh adanya kedua gugus tersebut asam amino dalam larutan dapat
membentuk ion yang bermuatan positif dan juga bermuatan negatif (zwitter
ion) atau ion amfoter. Keadaan ion ini sangat tergantung pada pH larutan.
lain membentuk suatu senyawa yang disebut peptida. Apabila jumlah asam
amino yang berikatan tidak lebih dari sepuluh molekul disebut oligopeptida.
Peptida yang dibentuk oleh dua molekul asam amino disebut dipeptida.
Selanjutnya tripeptida dan tetrapeptida adalah peptida yang terdiri atas tiga
molekul dan empat molekul asam amino. Polipeptida adalah peptida yang
molekulnya terdiri dari banyak molekul asam amino. Protein adalah suatu
2.5.3 Sifat Peptida
Peptida diperoleh dengan cara hidrolisis protein yang tidak
sempurna. Apabila peptida yang terjadi dihidrolisis lebih lanjut, akan
dihasilkan asam–asam amino. Sifat peptida ditentukkan oleh gugus –COOH
dan gugus R. Sifat asam dan basa pada peptida ditentukkan dengan gugus –
COOH dan –NH2, namun pada peptida rantai panjang, gugus –COOH dan –
NH2 yang terletak diujung rantai tidak lagi berpengaruh. Suatu peptida juga
mempunyai titik isoelektrik seperi pada asam amino (Poedjiadi, 1994).
Untuk memperoleh informasi tentang peptida tidak cukup dengan
mengetahui jenis dan banyaknya molekul asam amino yang membentuk
peptida, tetapi diperlukan keterangan tentang urutan asam amino ini adalah
degradasi Edman yang terdiri atas dua tahap reaksi, yaitu pertama reaksi
peptida dengan fenilisotianat dan reaksi kedua adalah pemisahan asam amino
ujung yang telah bereaksi dengan fenilisotiosianat. Cara degradasi Edman
hanya digunakan untuk menentukkan peptida yang tidak terlalu panjang.
Untuk peptida yang panjang digunakan cara penguraian oleh enzim–enzim
tertentu (Poedjiadi, 1994).
2.6 Enzim
Enzim merupakan protein biokatalisator. Sejak tahun 1926
pengetahuan tentang enzim atau enzimologi berkembang dengan cepat. Hasil
penelitian para ahli biokimia ternyata banyak enzim mempunyai gugus bukan
protein, dan termasuk golongan protein majemuk. Enzim semacam ini
(holoenzim) terdiri atas protein (apoenzim) dan suatu gugus bukan protein.
Contohnya enzim katalase terdiri atas protein dan ferriprotorfirin. Ada juga
enzim yang terdiri atas protein dan logam, misalnya askorbat oksidase adalah
protein yang mengikat tembaga (Poedjiadi, 1994).
Gugus bukan protein ini dinamakan kofaktor ada yang terikat kuat
pada protein, ada pula yang tidak begitu kuat ikatannya. Gugus yang terikat
kuat pada bagian protein disebut gugus prostetik. Sedangkan yang tidak kuat
ikatannya, jadi yang mudah dipisahkan secara dialisis disebut koenzim. Baik
memungkinkan enzim bekerja terhadap substrat, yaitu zat yang akan diubah
Aktivitas biologis enzim adalah sebagai biokatalis, yang
mempermudah perubahan substrat menjadi produk. Dengan demikian,
adanya enzim akan mengurangi jumlah substrat dan bersamaan dengan itu
menambah konsentrasi produk (Sadikin, 2002).
� + � ↔ �� → � + �
Dalam reaksi ini, jumlah S (substrat) akan turun dan bersamaan
dengan itu, jumlah P (Produk) akan naik. Kecepatan perubaan ini dipengaruhi
oleh jumlah E (Enzim). Untuk mengukur laju reaksi ini, dapat dilakukan
pengukuran konsentrasi S dalam dua waktu yang berbeda. Laju reaksi juga
dapat diukur dengan dengan mengukur kenaikan konsentrasi P, juga dalam
dua waktu yang berbeda.
Satuan untuk aktivitas enzim dinamai unit. Satu unit internasional
(UI) enzim sebagai jumlah enzim yang diperlukan untuk mengubah 1 mmol
substrat stau menghasilkan 1 mmol produk dalam waktu 1 menit, dalam suhu
dan pH lingkungan yang tertentu (Sadikin, 2002).
Satuan internasional lain untuk aktivitas enzim yaitu katal (singkatan
dari katalitik). Dalam sistem SI ini, 1 katal adalah jumlah enzim yang
diperlukan untuk mengubah 1 mol substrata tau menghasilkan 1 mol produk
dalam waktu 1 detik, dalam suhu dan pH lingkungan tertentu (Sadikin, 2002).
2.7 Pepsin
Pepsin merupakan enzim golongan hidrolase. Pepsin bekerja sebagai
pemutus ikatan peptida dan disebut sebagai peptidase (Poedjiadi, 2002). Ada
memecah protein pada tempat–tempat tertentu dalam molekul protein dan
tidak mempengaruhi gugus yang terletak diujung molekul. Sebagai contoh
adalah enzim pepsin yang terdapat dalam usus halus dan papain, suatu enzim
yang terdapat dalam pepaya. Eksopeptidase bekerja pada kedua ujung
molekul protein. Karboksipeptidase dapat melepas asam amino yang
memiliki gugus –COOH bebas pada ujung molekul protein. Sedangkan
aminopeptidase dapat melepas asam amino pada ujung lain yang memiliki
gugus –NH2 bebas, dengan demikian eksopeptidase melepas asam amino
secara berurutan dimulai dari asam amino ujung pada molekul protein hingga
seluruh molekul terpecah menjadi asam amino (Poedjiadi, 1994).
Pepsin merupakan enzim yang dikeluarkan dalam bentuk prekursor
enzim berupa pepsinogen. Pepsin merupakan enzim yang berfungsi
mendegradasi protein dalam sistem pencernaan makanan. Pepsin merupakan
enzim yang memecah ikatan antara peptida hidrofobik dan asam amino
aromatik, seperti fenilalanin, triptofan dan tirosin. Pepsin diekspresikan
sebagai pepsinogen. Aktivasi pepsinogen terjadi ketika pH larutan
pepsinogen diturunkan. Penurunan pH diyakini membuka rantai samping
karboksilat pepsin yang menyebabkan kompleks memecah dan mengarah
pada pembentukkan enzim aktif (James dan Sielecki, 1986).
Pepsin akan memecah molekul protein menjadi polipeptida yang lebih
kecil dengan memutus ikatan peptida yang ada pada sisi NH2 bebas dari
asam-asam amino aromatik (fenilalanin, tirosin dan triptofan), hidrofobik (Leusin,
isoleusin dan metionin), atau dikarboksilat (glutamat dan aspartat).
2.8 Faktor yang Mempengaruhi Reaksi Enzimatik Pepsin 2.8.1 Konsentrasi Enzim
Makin besar konsentrasi enzim makin banyak pula produk yang
terbentuk dalam tiap waktu pengamatan. Pada awal pengamatan, kesan
tersebut berbanding lurus. Dengan bertambahnya waktu, pada tiap
konsentrasi enzim pertambahan jumlah produk akan menunjukkan defleksi,
tidak lagi berbanding lurus sejalan dengan berjalannya waktu tersebut, karena
sehingga dengan sendirinya produk olahan enzim akan berkurang (Sadikin,
2002).
2.8.2 Konsentrasi Substrat
Peningkatan konsentrasi substrat akan meningkatkan kecepatan
reaksi. Akan tetapi pada batas konsentrasi tertentu tidak terjadi kenaikan
kecepatan reaksi walaupun konsentrasi substrat diperbesar. Agar terjadi
kompleks enzim substrat, diperlukan adanya kontak antara enzim dengan
substrat. Kontak ini terjadi pada suatu tempat atau bagian enzim yang disebut
bagian aktif. Pada konsentrasi substrat rendah, bagian aktif enzim ini hanya
menampung substrat sedikit. Bila konsentrasi substrat diperbesar, makin
banyak substrat yang dapat berhubungan dengan enzim pada bagian aktif
tersebut. Dengan demikian konsentrasi kompleks enzim substrat makin besar
dan hal ini menyebabkan makin besarnya kecepatan reaksi. Pada suatu batas
konsentrasi substrat tertentu, semua bagian bahan aktif telah dipenuhi oleh
substrat atau telah jenuh oleh substrat. Dalam keadaan ini, bertambah
besarnya konsentrasi substrat tidak menyebabkan bertambah besarnya
konsentrasi kompleks enzim substrat, sehingga jumlah hasil reaksinya pun
tidak bertambah (Poedjiadi, 1994).
2.8.3 Suhu
Pada suhu rendah reaksi kimia berlangsung lambat, sedangkan pada
suhu yang lebih tinggi reaksi kimia berlangsung lebih cepat. Enzim adalah
suatu protein, kenaikan suhu dapat menyebabkan terjadinya proses
denaturasi, maka bagian aktif enzim akan terganggu dan dengan demikian
konsentrasi efektif enzim menjadi berkurang dan kecepatan reaksinya pun
akan menurun (Poedjiadi, 1994).
Kenaikan suhu, sebelum terjadinya proses denaturasi dapat
menaikkan kecepatan reaksi. Koefisien suhu suatu reaksi diartikan sebagai
kenaikan kecepatan reaksi sebagai akibat kenaika suhu 10ºC. Koefisien suhu
ini diberi simbol Q10. Untuk reaksi yang menggunakan enzim, Q10 ini berkisar
mengalami kenaikan 1,1 hingga 3,0 kali. Namun kenaikan suhu pada saat
mulai terjadinya proses denaturasi akan mengurangi kecepatan reaksi. Oleh
karena ada dua pengaruh yang berlawanan, maka akan terjadi suatu titik
optimum, yaitu suhu yang paling tepat bagi satu reaksi yang menggunakan
enzim tertentu (Poedjiadi, 1994).
Tiap enzim memiliki suhu optimum tertentu. Pada umumnya enzim
yang terdapat pada hewan memiliki suhu optimum antara 40ºC-50ºC,
sedangkan pada tumbuhan antara 50ºC-60ºC. Sebagian besar enzim
terdenaturasi pada suhu diatas 60ºC (Poedjiadi, 1994).
2.8.4 Pengaruh pH
Struktur ion enzim tergantung pada pH lingkungannya. Enzim dapat
berbentuk ion positif, ion negatif atau ion bermuatan ganda (zwitter ion).
Dengan demikian perubahan pH lingkungan akan berpengaruh terhadap
efektivitas bagian aktif enzim dalam membentuk kompleks enzim substrat.
Nilai pH tertentu dapat menyebabkan terjadinya proses denaturasi dan ini
akan menyebabkan terjadinya proses denaturasi dan mengakibatkan
menurunnya aktivitas enzim.
Tabel 6. Beberapa enzim dengan nilai optimum
Enzim pH Optimum
Elektroforesis merupakan suatu cara untuk memisahkan
fraksi-fraksi campuran berdasarkan atas pergerakan partikel–partikel koloid yang
digunakan untuk analisa asam nukleat, virus, enzim, dan protein (Bintang,
2010).
Elektroforesis untuk makromolekul memerlukan matriks penyangga
untuk mencegah terjadinya difusi karena timbulnya panas dari arus listrik
yang digunakan. Gel poliakrilamid merupakan matriks penyanga yang
banyak dipakai untuk memisahkan protein (Fatchiyah, 2011).
Dalam larutan, protein enzim akan bermuatan yang tergantung pada
pH larutan dan titik isoelektrik (PI) enzim. Pada titik isoelektriknya, protein
tidak akan bergerak dibawah pengaruh medan listrik. Pada keadaan pH
dibawah PI, protein bergerak sebagai kation dimana kecepatannya naik
bersamaan dengan turunnya pH, kation ini akan bergerak kearah elektroda
negatif. Pada keadaan pH diatas PI, protein akan bergerak sebagai anion dan
kecepatannya akan naik bersamaan dengan meningkatnya pH, anion ini akan
bergerak ke arah elektroda positif. Elektroforesis pada umumnya digunakan
untuk menentukkan berat molekul (BM), mendeteksi kemurnian dan
kerusakan protein atau asam nukleat, menetapkan titik isoelektrik, serta
memisahkan spesies–spesies yang berbeda secara kualitatif dan kuantitatif
(Bintang, 2010).
Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis
(SDS–PAGE) merupakan elektroforesis gel untuk memisahkan molekul
protein dengan metode two-dimensional gel electroforesis yaitu
menggunakan dua macam gel dengan masing-masing buffer yang berbeda.
Gel yang digunakan pada SDS-PAGE adalah running gel dan stacking gel
Gambar 5. Skema Alur Elektroforesis
(Sumber: www.siumed.edu)
Protein didalam larutan membawa muatan elektrik tertentu pada
semua nilai pH kecuali pada titik isoelektriknya sehingga protein dapat
bermigrasi dalam suatu daerah elektrik. Elektroforesis gel memisahkan
protein dengan lebih baik dibandingkan dibandingkan dengan elektroforesis
didalam larutan bebas. Gel tersebut memisahkan protein dengan matriks yang
mirip jala dengan variasi ukuran pori. Pemisahan dapat dioptimasi dengan
mengubah derajat cross-linking gel. Pada sebagian besar aplikasi, gel
dijalankan dengan nilai pH netral atau sedikit basa, dimana sebagian besar
protein bermigrasi kearah anoda. Sistem gel dapat meminimalisasi konveksi
dan difusi protein sehingga pita protein pada gel akan terpisah dan terlihat
jelas (Rybicki dan Purves, 2008).
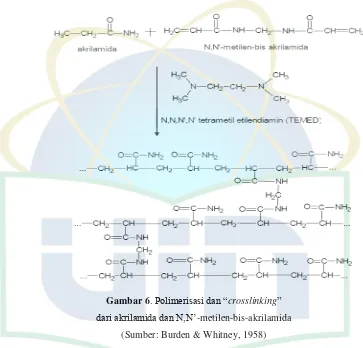
Medium penyangga dibuat dari reaksi polimerasi akrilamid dan bis–
akrilamid yang dikatalisis oleh ammonium persulfat dan tetrametilendiamin
(TEMED). SDS bersama merkaptoetanol digunakan untuk merusak struktur
tiga dimensi protein. Hal ini terjadi akibat reduksi ikatan disulfida
membentuk gugus sulfidril yang dapat mengikat SDS sehingga protein
bermuatan sangat negatif dan bergerak kearah kutub positif. Gel
poliakrilamid bersifat porous dengan ukuran lubang berkisar dari 0,6–4,0 nm
total akrilamid ditambah bis–akrilamid didalam campuran gel, serta
perbandingan relatif akrilamid dan bis–akrilamid. Migrasi protein didalam
gel poliakrilamid terutama ditentukkan oleh muatan molekul dan juga
dipengaruhi oleh ukuran molekul (Bintang, 2010).
Gambar 6. Polimerisasi dan “crosslinking”
dari akrilamida dan N,N’-metilen-bis-akrilamida (Sumber: Burden & Whitney, 1958)
Gel poliakrilamid dalam dibentuk sebagai sebagai lembaran dalam
lempengan kaca. Dalam perangkat elektroforesis, gel diletakkan diantara dua
buffer chamber sebagai sarana untuk menghubungkan kutub negatif dan
kutub positif. Banyak molekul biologi bermuatan listrik yang besarnya
tergantung pada pH dan komposisi medium dimana molekul biologi tersebut
terlarut. Bila berada dalam satu medan listrik, molekul biologi yang
bermuatan positif akan bermigrasi ke elektroda negatif, dan demikian
sebaliknya. Prinsip inilah yang dipakai dalam elektroforesis untuk
Gel poliakrilamid dapat digunakan tidak hanya untuk pemisahan
dari berbagai protein, tetapi juga untuk membandingkan berat molekulnya.
Teknik ini dapat digunakan baik untuk tujuan preparatif maupun pemisahan
analitik dari sampel protein. Teknik elektroforesis ini hanya diperlukan
beberapa mikrogram sampel saja (Bintang, 2010).
Poliakrilamid dapat memisahkan protein dengan kisaran berat 500–
250.000 bp atau polinukleotida dengan kisaran 5–2000 bp. Pori matriks ini
terbentuk dari ikatan silang Antara akrilamid dan bis–akrilamid. Ukuran pori
pada gel poliakrilamid dapat dikecilkan dengan cara meningkatkan
persentase total akrilamid (%T) atau dengan meningkatkan banyaknya ikatan
silang (%C) dengan bis – akrilamid (Fatchiyah, 2011).
Gel 20%T %%C bis berarti bahwa kandungan total akrilamid dan
bis–akrilamid sebesar 20% (w/ v) dimana kandungan bis–akrilamid 5% dari
total akrilamid dan bis–akrilamid. Pada % T yang sama, 5%C menghasilkan
ukuran pori terkecil. Diatas dan dibawah 5%C, besarnya pori bertambah.
Untuk mendapatkan hasil pemisahan protein yang diinginkan, diperlukan %T
tertentu yang sesuai. %T yang terlalu tinggi akan menghalangi bergeraknya
protein, sedangkan %T yang terlalu rendah akan menyebabkan protein
protein kurang atau tidak memisah karena protein bergerak sangat cepat pada
gel (Fatchiyah, 2011).
Polimer yang terbentuk menyebabkan gel berpori–pori. Besarnya
pori–pori dapat diatur dengan mengubah konsentrasi akrilamid dan bis–
akrilamid. Jika diameter pori gel sama dengan X, maka protein dengan ukuran
lebih kecil dari X akan mudah dan cepat bergerak kedalam gel, sedangkan
molekul berukuran lebih besar dari X juga akan bergerak tetapi lebih lambat
(Fatchiyah, 2011).
2.9.1 Medium Penyangga
Teknik elektroforesis dapat dibagi menjadi dua bagian, yaitu
elektroforesis free boundary dan elektroforesis zona. Elektroforesis free
boundary merupakan pemisahan parsial dalam tabung gelas vertikal dari
Penerapan arus listrk menghasilkan pergerakan protein, karena terjadi migrasi
dengan laju yang berbeda maka protein akan terpisah (Bintang, 2010).
Pada elektroforesis zona, dengan melakukan pemisahan pada
medium penyangga seperti gel poliakrilamid, akan diperoleh pita protein
yang lebih stabil. Konsentrasi gel harus disesuaikan agar tidak terlalu encer
dan juga tidak terlalu padat (bintang, 2010). Pada elektroforesis dalam
matriks gel poliakrilamid, protein memisah ketika protein bergerak melalui
matriks tiga dimensi dalam medan listrik. Matriks poliakrilamid berfungsi
untuk memisahkan protein berdasarkan ukuran dan menstabilkan pH buffer
agar muatan protein tidak berubah (Fatchiyah, 2011).
2.9.2 Sampel
Larutan yang dipisahkan mempengaruhi laju migrasi termasuk
muatan, ukuran, dan bentuk molekul terlarut. Muatan total akan meningkat
apabila laju migrasi meningkat, besarnya muatan biasanya tergantung pada
pH. Ukuran molekul yang lebih besar menyebabkan migrasi menurun dan
kekuatan elektrostatika disekitar larutan meningkat, sedangkan bentuk
molekul yang berbeda dengan ukuran yang sama seperti protein globular dan
fibrous dikarakteristik menghambat migrasi, karena perbedaan bentuk
molekul dapat mempengaruhi pergerakan molekul dan kekuatan elektrostatik
(Bintang, 2010).
Protein merupakan molekul amfoter karena mempunyai gugus
amino positif dan karboksil negatif. Dengan demikian, protein dapat
mengion, baik pada pH basa maupun pada pH asam. Pada pH rendah, protein
bersifat sebagai kation (bermuatan positif) yang cenderung bergerak kearah
katoda (elektroda negatif). Pada pH tinggi, protein bersifat sebagai anion
(bermuatan negatif) yang cenderung bergerak kearah anoda (elektroda
positif). Nilai diantara kedua pH tersebut dinamakan titik isoelektrik
(isoelectric point atau pI) yaitu nilai pH dimana protein menjadi tidak
bermuatan. Pada pH tersebut, jumlah muatan negatif yang dihasilkan dari
penangkapan proton. Protein yang tidak bermuatan tidak dapat bergerak pada
medan listrik (Fatchiyah, 2011).
Hampir semua protein mempunyai pH kurang dari 8,0. Oleh karena
itu, pH buffer elektroforesis yang berkisar 8–9 akan menyebabkan sebagian
besar protein bermuatan negatif yang akan bergerak ke anoda (Fatchiyah,
2011).
2.9.3 Buffer
Sistem buffer digunakan untuk mempertahankan pH didalam
reservoir dan didalam medium penyangga, disamping itu sistem buffer
berfungsi sebagai elektrolit pembawa aliran listrik. Buffer yang digunakan
harus berinteraksi dengan molekul yang dipisahkan dan pH yang digunakan
harus sesuai sehingga campuran molekul dapat dipisahkan satu sama lain
tetapi tidak mengakibatkan denaturasi. pH dipilih berdasarkan jenis campuran
yang akan dipisahkan, umumnya pemisahan maksimal dapat dicapai pada
titik isolistrik (Bintang, 2010).
2.9.4 Medan Listrik
Sumber arus listrik yang stabil diperlukan untuk menghasilkan aliran
listrik dengan voltase yang konstan. Kekuatan ionik medan listrik pada
kisaran 2–8 V/ cm sesuai untuk suhu ruang. Apabila kekuatan medan magnet
lebih besar dari 10 V/ cm, maka akan terjadi kehilangan air yang besar karena
proses penguapan akibat dari panas yang ditimbulkan. Larutan buffer
kemudian dialirkan kedalam tangki penyangga untuk menggantikan air yang
hilang, dan ini mengakibatkan pergeseran pita–pita. Pemanasan yang berlebih
menyebabkan senyawa senyawa terdenaturasi. Metode–metode pendinginan
medium pemisahan dapat dilakukan, sehingga kekuatan medan 100V/ cm
dapat digunakan. Keuntungan elektroforesis pada voltase tinggi adalah
BAB III
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Pusat Laboratorim Terpadu (PLT) UIN
Syarif Hidayatullah Jakarta, selama 4 bulan, terhitung bulan Desember
2014-Maret 2015.
3.2 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah gelatin babi
(technical) dan gelatin (technical) yang didapatkan dari PT. EMS Indonesia,
sampel kapsul lunak Pharmaton Formula, Obipluz, Omepros dan Nature E
yang didapat dari Apotek Kimia Farma, jalan Ir. H. Juanda No. 111
Situgintung-ciputat, Tangerang Selatan, Banten.
Bahan kimia yang digunakan larutan Akrilamid/ Bis (30%;
2,67%C); SDS 10% (w/ v), sampel buffer (Tris HCl 0,5 M; Glycerol; SDS dan
Bromophenol Blue), Tris HCl 0,5 M pH 6,8, gliserin, enzim pepsin (from
porchine gastric mucosa, P7000-25G Sigma-aldrich), SDS (Sodium Dodecyl
Sulphate) 10%, aquades, Bromophenol Blue, 2-merkaptoethanol, Natrium
asetat, asam asetat (glacial), Ammonium persulfate for electroforesis 98%
sigma-ald A3678-25G, Coomasie Briliant blue R250 (Bio-Rad), asam asetat
pekat, TEMED (N,N,N;,N’ –tetra metil etilen diamin) (E.Merc), HCl 6N,
protein standar (prestained broad range) catalog # 161-0317 Bio-Rad,
Larutan Running buffer (Tris basa, Glycerol dan SDS), larutan pewarna (0,1%
commasie blue dalam larutan metanol : air : asam asetat (5:5:2)), marker
protein (prestained SDS-PAGE standar broad range) dari Bio-Rad dengan
ukuran 14,5 kDa–200 kDa. larutan pembilas (metanol 30% dan asam asetat
3.3 Alat Penelitian
Alat–alat yang digunakan dalam penelitian adalah tabung eppendorf
2 mL, mikro tip, mikropipet (P2, P10, P200 dan P1000) sentrifus, timbangan
digital, votex, pH meter, Waterbath, hotplate stirer, alumunium foil, pinset,
tabung reaksi, gelas beaker (50 mL, 100 mL, dan 250 mL), lemari pendingin,
pengaduk kaca, wadah pencetak gelatin, label penanda, Printer scan Canon
PIXMA MG2920, tissue, sarung tangan, shaker, Power Supply, dan Mini
Protean Gel Electrophoresis BioRad.
3.4 Tahap Penelitian 3.4.1 Pengambilan Sampel
Pengambilan sampel diambil secara simple random sampling dari
daftar vitamin softgel yang terdapat pada ISO indonesia volume 46. Teknik
sampling didasarkan pada tujuan yang ingin dicapai, biaya yang tersedia,
jumlah sampel yang diperlukan dan kemudahan untuk memperoleh sampel
tersebut. Sampel dibeli di apotek kimia farma, jalan Ir. H. Juanda No. 111
Situgintung – ciputat, Tangerang Selatan, Banten .
3.4.2 Preparasi Reagent SDS-PAGE
Tahap preparasi reagent terdapat pada lampiran 3.
3.4.3 Pembuatan Gel Elektroforesis
Medium gel elektroforesis dibuat dengan konsentrasi stacking gel
4% dan resolving gel 12% denga formulasi seperti tabel
Tabel 7. Formula gel elektroforesis (Sumber : BioRad)
3.4.4 Pembuatan Simulasi Gelatin Cangkang Kapsul Lunak
Gelatin babi dan gelatin sapi masing-masing ditimbang sebanyak 25
g. Masing-masing gelatin dimasukkan kedalam beaker glass dan dibasahi
dengan 25 mL air hangat. Campuran gelatin dan air hangat ditambahkan
gliserin sebanyak 7mL yang berfungsi sebagai plasticizer kemudian
ditambahkan 4 tetes pewarna. Gelatin yang telah ditambahkan plasticizer dan
tetesan pewarna diaduk sampai semua gelatin larut sempurna menggunakan
pengaduk kaca. Setelah tercampur secara merata, larutan tersebut dituangkan
kedalam cetakan untuk membentuk lembaran gelatin. Larutan dikeringkan
hingga lembaran glatin terbentuk dan mengeras dan didinginkan dalam
kulkas untuk mengurangi kadar airnya (Widyaninggar et al, 2012). Berat
akhir gelatin simulasi yang terbentuk masing-masing untuk gelatin sapi 2,51
g dan berat gelatin simulasi babi 2,12 g.
3.4.5 Ekstraksi Gelatin
Sampel gelating cangkang kapsul lunak terdiri dari 4 merk berbeda.
Isi kapsul lunak dikeluarkan. Masing-masing cangkang kapsul kosong
kemudian ditimbang masing-masing. Ditimbang berat kosong cangkang
kaspul lunak pharmaton formula 0,62 gram, Obipluz 0,55 gram, 0,61 gram,
dan Nature-E 0,47 gram.
Sebanyak 500 mg masing-masing cangkang kapsul lunak dan
simulasi cangkang kapsul lunak ditimbang dan ditambahkan 5 mL aquadest
dalam taung reaksi kemudian dipanaskan dalam waterbath pada suhu 60°C.
Setelah larut kemudian simulasi dan sampel disentrifus pada 6000 rpm selama
30 menit. Supernatant yang terbentuk dipipet dan dipindahkan pada tabung
reaksibaru dan ditambahkan aseton dengan perbandingan 1:4 (v: v), gelatin
praktis tidak larut dalam aseton, supernatan akan menggumpal dengan
penambahan aseton. Kemudian simulasi dan sampel yang telah ditambahkan
aseton disentrifus kembali pada 6000 rpm selama 30 menit. Gumpalan gelatin
yang terbentuk diambil dan disimpan dalam cawan penguap dengan label dan
ditutup alumunium foil, kemudian dioven pada suhu 50 °C selama 1 jam.