UIN SYARIF HIDAYATULLAH JAKARTA
APLIKASI METODE SDS-PAGE (
SODIUM DODECYL
SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS
) UNTUK MENGIDENTIFIKASI
SUMBER GELATIN PADA KAPSUL KERAS
SKRIPSI
FAHRUR RAHMAN SAPUTRA
NIM : 1110102000011
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
APLIKASI METODE SDS-PAGE (
SODIUM DODECYL
SULPHATE POLY ACRYLAMIDE GEL
ELECTROPHORESIS
) UNTUK MENGIDENTIFIKASI
SUMBER GELATIN PADA KAPSUL KERAS
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi ( S.Far )
FAHRUR RAHMAN SAPUTRA
NIM : 1110102000011
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Fahrur Rahman Saputra
NIM : 1110102000011
Tanda tangan :
HALAMAN PERSETUJUAN PEMBIMBING
NAMA : Fahrur Rahman Saputra
NIM : 1110102000011
JUDUL : Aplikasi Metode SDS-PAGE (Sodium Dodecyl Sulphate Poly
Acrylamide Gel Electrophoresis) untuk Mengidentifikasi Sumber
Gelatin pada Kapsul Keras
Menyetujui,
Pembimbing I
Zilhadia M.Si, Apt NIP:19730822 200801 2 007
Pembimbing II
Sandra Hermanto, M.Si. NIP : 19750810 200501 1 005
Mengetahui,
Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta
HALAMAN PENGESAHAN SKRIPSI
Skripsi ini diajukan oleh:
Nama : Fahrur Rahman Saputra
NIM : 111010200011
Program Studi : Farmasi
Judul : Aplikasi Metode SDS-PAGE (Sodium Dodecyl Sulphate
Poly Acrylamide Gel Electrophoresis) untuk
Mengidentifikasi Sumber Gelatin pada Kapsul Keras
Telah berhasil dipertahankan dihadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan
Ilmu Kesehatan (FKIK) UIN Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing I : Zilhadia, M.Si., Apt ( )
Pembimbing II : Sandra Hermanto, M.Si ( )
Penguji I : Yuni Anggraeni, M.Farm., Apt ( )
Penguji II : Supandi, M.Si., Apt ( )
Ditetapkan di : Ciputat
ABSTRAK
Nama : Fahrur Rahman Saputra Program Studi : Farmasi
Judul : Aplikasi Metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide Gel Electrophoresis) untuk
Mengidentifikasi Sumber Gelatin pada Kapsul Keras
Gelatin sebagai bahan utama kapsul saat ini masih menjadi permasalahan dari aspek kehalalannya karena sebagian besar masih diperoleh dari sumber non-halal. Salah satu sumber penghasil gelatin adalah kolagen dari kulit dan tulang sapi atau babi. Penelitian ini bertujuan untuk mengetahui sumber gelatin yang digunakan pada kapsul keras dengan menggunakan metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrilamide Gel Elektrophoresis). Pada tahap awal penelitian, standar gelatin sapi dan babi dihidrolisis dengan pepsin pada pH 4,5 dan suhu 60oC selama 1 jam, 2 jam dan, 3 jam. Gelatin hasil hidrolisis dianalisis dengan SDS-PAGE untuk menentukan waktu hidrolisis optimal. Identifikasi fragmen gelatin hidrolisat dilakukan berdasarkan bobot molekulnya. Hasil optimasi waktu hidrolisis diaplikasikan untuk mengidentifikasi sumber gelatin pada sampel kapsul keras yang diperoleh dari pasaran dan dibandingkan dengan kapsul keras simulasi. Hasil penelitian menunjukkan adanya pita spesifik pada gelatin sapi dengan bobot molekul 11,4 kDa; 34 kDa; 47kDa dan pita spesifik pada gelatin babi dengan bobot molekul 28 kDa; 24,7 kDa; dan 60 kDa. Hasil yang sama diperoleh pada kapsul keras sampel dengan pita-pita fragmen protein yang identik dengan standar gelatin sapi. Berdasarkan hasil tersebut ketiga sampel yang diuji diduga merupakan kapsul yang terbuat dari gelatin sapi.
ABSTRACT
Name : Fahrur Rahman Saputra Department : Pharmacy
Title : Application of SDS-PAGE (Sodium Dodecyl Sulphate Gel electrophoresis Poly Acrylamide) Methods for Identify
The Source of Gelatins in Hard Capsules
Gelatin as the main ingredient of capsules is still a problem. From the halal aspect, gelatin remains largely derived from non-halal object. One source of gelatin is collagen from the skin and bones of bovine and pork. The objective of this study to determine the source of gelatin used in hard capsules using SDS-PAGE (Sodium Dodecyl Sulphate Gel electrophoresis Poly Acrylamide). In the early stages of research, standards bovine and pork gelatin were hydrolyzed by pepsin at pH 4.5 and 60°C for 1 hour, 2 hours, and 3 hours. Hydrolyzates gelatin were analyzed by SDS-PAGE to determine the optimal hydrolysis time. Identification of gelatin hydrolyzate fragments were carried by molecular weight. The results of hydrolysis time optimization applied to identify the source of hard gelatin capsules in the samples obtained from market and compared with the simulation of hard capsules. The results showed the presence of specific bands of bovine gelatin with a molecular weight of 11,4 kDa; 34 kDa; 47kDa and specific bands of pork gelatin with a molecular weight of 24,7 kDa; 28 kDa; and 60 kDa. Similar results were obtained on a sample of hard capsules with bands of protein fragments that were identical to the standard bovine gelatin. Based on the above results the three samples tested allegedly is a capsule made of bovine gelatin.
KATA PENGANTAR
Puji Syukur kehadirat Allah SWT yang telah memberika rahmat dan
karunia-Nya kepada penulis sehingga dapat menyelesaikan penelitian dan
penulisan skripsi dengan judul Aplikasi Metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide Gel Elektrophoresis) untuk Mengidentifikasi Sumber Gelatin pada Kapsul Keras. Shalawat serta salam selalu tercurah kepada junjungan Nabi Muhammad SAW, keluarga, para sahabat, dan
pengikutnya yang senantiasa istiqomah megikuti sunnah-Nya.
Skripsi ini disusun untuk memenuhi salah satu syarat untuk mencapai
gelar Sarjana Farmasi (S.Far) pada Program Studi Farmasi Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Keberhasilan penelitian dan peyusunan skripsi ini tidak lepas dari bantuan dan
dorogan semua pihak. Untuk itu pada kesempatan ini, perkenankanlah penulis
menyampaikan ucapan terimakasih yang sebesar-besarnya kepada:
1. Bapak Prof. DR.(hc) dr. M.K Tadjudin Sp.And, selaku Dekan Fakultas
Kedokteran dan Ilmu kesehatan UIN Syarif Hidayatullah Jakarta.
2. Bapak Drs.Umar Mansur, M.Sc., Apt. selaku Ketua Program Studi
Farmasi FKIK UIN Syarif Hidayatullah Jakarta.
3. Ibu Zilhadia, M.Si., Apt. selaku pembimbing I yang telah memberikan
waktu, ilmu dan bimbingan selama penulisan skripsi ini.
4. Bapak Sandra Hermanto, M.Si. sekalu pembimbing II yang telah
memberikan waktu semangat, ilmu, dan bimbingan selama penulisan
skripsi ini.
5. Kedua orang tua yang selalu memberi kasih sayang dan doa yang tidak
pernah putus di tiap tengadah tangan dan dukungan baik moril maupun
materil. Tiada apapun di dunia ini yang dapat membalas semua kebaikan,
cinta dan kasih sayang yang telah kalian berikan.
6. Bapak dan Ibu dosen yang telah memberikan ilmu dan pengetahuan
sehingga penulis dapat menyelesaikan studi di Program Studi Farmasi
7. Mbak Ayu, ibu Pipit, dan bapak Sabar atas bantuan, arahan, serta masukan
yang sangat bermanfaat selama masa penelitian di Lab Biologi Molekular
LAPTIAB BPPT.
8. Mbak Prita dan mbak Pipit selama masa penelitian di Lab Pangan PLT
UIN Syarif Hidayatullah Jakarta.
9. Para staf dan karyawan program studi farmasi. Staf administrasi farmasi
yang telah banyak membantu selama penelitian dan penyelesaian skripsi.
10.Afifah, Fatmah, Diah dan Rendi yang banyak memberikan masukan moril
dalam penyelesaian penelitian.
11.Teman-teman satu angkatan yang tak sempat di sebut satu- persatu atas
dukungannya selama masa studi di program studi Farmasi FKIK UIN
syarif hidayatullah Jakarta.
12.Serta semua pihak yang tidak dapat disebutkan yang turut membantu
dalam penyelesaian skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna. Oleh
karena itu kritik dan saran yang bersifat membangun sangat penulis harapkan
guna tercapainya kesempurnaan skripsi ini.
Akhirnya dengan segala kerendahan hati, penulis berharap semoga hasil
penelitian ini dapat bermanfaat baik bagi kalangan akademis, khususnya bagi
mahasiswa farmasi, masyarakat pada umumnya dan bagi dunia ilmu pengetahuan.
Jakarta, Oktober 2014
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai civitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Fahrur Rahman Saputra
NIM : 1110102000011
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan (FKIK) Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya dengan judul :
Aplikasi Metode SDS-PAGE (Sodium Dodecyl Sulphate Poly Acrylamide Gel Electrophoresis) untuk Mengidentifikasi Sumber Gelatin pada Kapsul Keras
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Ciputat
Pada tanggal : Desember 2014
Yang menyatakan,
DAFTAR ISI AKHIR UNTUK KEPENTINGAN AKADEMIS ... viii
DAFTAR ISI ... ix
2.1.2 Bahan Penyusun Kapsul ... 7
2.1.3 Karakteristik Kapsul Keras ... 7
2.2 Gelatin ... 7
2.2.1 Sifat Fisika dan Kimia Gelatin ... 8
2.2.2 Struktur Kimia Gelatin ... 10
2.3 Pepsin... 11
2.3.1 Ciri-ciri dan Kinetika Pepsin ... 12
2.3.2 Struktur dan Aktifitas Pepsin ... 13
2.4 SDS-PAGE ... 16
2.4.1 SDS ... 16
2.5.2 Prinsip Dasar... 19
BAB 3 METODE PENELITIAN ... 22
3.1 Tempat dan Waktu Penelitian... 22
3.2 Alat dan Bahan ... 22
3.2.1 Alat ... 22
3.2.2 Bahan ... 22
3.3 Tahap Penelitian ... 22
3.3.1 Pengambilan Sampel ... 22
3.3.2 Preparasi Reagent SDS-PAGE ... 22
3.3.3 Penyiapan Gel ... 23
3.3.4 Pembuatan Kapsul Simulasi ... 23
3.3.5 Ekstraksi Gelatin... 23
3.3.6 Hidrolisis Enzimatik ... 24
3.3.7 Elektroforesis ... 24
3.3.8 Analisis Data... 25
BAB 4 HASIL DAN PEMBAHASAN ... 26
4.1 Hasil ... 26
4.1.1 Optimasi Kondisi SDS PAGE ... 26
4.1.2 Analisis Protein Gelatin Sampel ... 28
4.2 Pembahasan ... 30
BAB 5 KESIMPULAN DAN SARAN ... 37
5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR GAMBAR
Gambar 2.1 Proses pembuatan kapsul keras ……… 6
Gambar 2.2 Ukuran kapsul ………..……… 7
Gambar 2.3 Proses denaturasi kolagen ………....… 10
Gambar 2.4 Struktur gelatin ………...… 11
Gambar 2.5 Struktur kristal pepsin ………..……… 14
Gambar 2.6 Proses hidrolisis polipeptida dengan enzim pepsin ….… 15 Gambar 2.7 Skema SDS PAGE ….………..……… 16
Gambar 2.8 Konformasi protein yang Setelah penambahan SDS ...… 17
Gambar 2.9 Prinsip reaksi pembentukan poliakrilamid ……….……. 18
Gambar 2.10 Pemisahan Molekul dengan SDS PAGE ……..………... 19
Gambar 2.11 Alur Kerja SDS PAGE ……….…..………. 20
Gambar 4.1 Hasil pemisahan gelatin sapi dan babi ……….………… 26
Gambar 4.2 Kurva regresi linier gel optimasi ……....…….………… 27
Gambar 4.3 Hasil pemisahan gelatin kapsul …….………..…… 28
Gambar 4.4 Kurva Regresi linier gel analisis ……..…...….………… 29
Gambar 4.5 Pemotongan pepsin ……….……… 33
Gambar 4.6 Analisis Pita pemisahan gelatin sapi dan babi …………. 34
DAFTAR TABEL
DAFTAR LAMPIRAN
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Kapsul adalah sediaan yang sangat umum dikonsumsi masyarakat
baik sebagai sediaan obat ataupun multivitamin. Kapsul menempati peran
sentral pengembangan obat karena dianggap lebih sederhana untuk
diproduksi dibandingkan dengan sediaan oral lainnya sehingga secara
keseluruhan dapat mempercepat periode pengembangan obat. Dilihat dari
frekwensi penggunaan, kapsul menempati peringkat kedua setelah tablet
kempa di antara seluruh sediaan padat lainnya hal ini bisa dianggap wajar
melihat kelebihan sediaan kapsul dibandingkan dengan sediaan oral
lainnya seperti kemampuan kapsul dalam hal menutupi rasa dan aroma
yang kurang disukai, formulasi kapsul yang sederhana dan cerderung lebih
murah serta waktu pembuatan yang lebih singkat. Selain itu dikemukakan
juga bahwa sediaan kapsul lebih mudah untuk ditelan dibandingkan
dengan sediaan oral lainnya (Guo et al., 2002).
Cangkang kapsul sendiri merupakan produk farmasi yang terbuat
dari gelatin. Umumnya gelatin komersil diproduksi dari kulit dan tulang
sapi atau babi. Namun, dalam beberapa kasus seperti wabah Bovine
Spongiform Encephalopathy (BSE) menjadi alasan perlunya pembedaan
terhadap sumber gelatin. Faktor lain adalah menyangkut kepercayaan dan
agama seperti Islam, dimana umat Islam dilarang untuk memakan
bahan-bahan yang merupakan turunan dari babi (Zhang et al., 2009).
Sebagai negara dengan mayoritas penduduk muslim permasalahan
kehalalan suatu produk merupakan permasalahan yang penting. Kapsul
yang sering digunakan dalam sediaan obat dan multivitamin dengan
gelatin sebagai bahan bakunya merupakan bahan yang diimpor, dimana
46% dari produksi gelatin dunia bersumber dari kulit babi (GME, 2008).
2
hanya sekitar 30 jenis dan tidak ada yang berbentuk kapsul. Cangkang
kapsul keras kosong sendiri banyak dijual di pasar tanpa adanya
keterangan akan kehalalannya dari lembaga resmi pemerintah (LPPOM
MUI). Hal ini membuat timbulnya kekhawatiran pada masyarakat karena
kapsul kosong ini akan digunakan pada sediaan-sediaan herbal yang sangat
mudah ditemui dimasyarakat.
Karena permasalahan kehalalan kapsul terletak pada gelatin
sebagai bahan bakunya, maka perlu dilakukan analisis terhadap sumber
gelatin pada kapsul yang beredar di pasaran. Pembedaan sumber gelatin
sendiri sudah dilakukan oleh beberapa peneliti dengan berbagai metode
seperti analisis asam amino dengan Principal component analysis (PCR)
(Nemati et al., 2004) dan Enzyme Linked Immunosorbent Assay (ELISA)
(Venien dan Levieux, 2005). Kedua metode di atas terbukti dapat
membedakan gelatin sapi dan babi, akan tetapi kedua metode ini
memerlukan hasil yang berulang dan pengalaman karena penyiapan
sampel yang sensitif dan sulit (Hermanto, et al., 2013).
Pembedaan sumber gelatin yang dilakukan oleh Hafidz et al (2011)
dengan metode SDS-PAGE dilaporkan adanya perbedaan pada pola
pemisahan protein antara gelatin sapi dan babi namun perbedaan ini tidak
spesifik. Selanjutnya pembedaan terhadap gelatin sapi dan babi dengan
metode SDS-PAGE juga dilakukan oleh Hermanto et al (2013) dengan
menghidrolisis gelatin terlebih dahulu dengan pepsin pada suhu 60oC dan
pH 4,5 sebelum dianalisis. Penelitian Hermantol et al (2013) mendapati
adanya pita spesifik pada gelatin babi pada bobot molekul 28.6 dan 36.8
kDa sehingga dapat digunakan sebagai acuan pembedaan gelatin sapi dan
babi. Namun ke dua penelitian diatas dilakukan terbatas pada gelatin
murni yang belum mengalami proses menjadi produk yang didapati di
pasar seperti kapsul keras. Dari ulasan di atas maka pada penelitian
identifikasi sumber gelatin pada kapsul keras ini metode yang digunakan
adalah metode SDS-PAGE dengan menghidrolisis sampel dengan pepsin
3
Penelitian ini bertujuan untuk membuktikan kemampuan analisis
metode SDS-PAGE terhadap sumber gelatin yang telah di proses menjadi
kapsul keras. Metode SDS-PAGE dipilih karena dirasa lebih sesuai
digunakan untuk menganalisis protein gelatin dengan ukuran molekul
yang sangat besar, faktor lain adalah kemampuan SDS-PAGE untuk
menganalisis sampel dengan baik walaupun masih didapati pewarna atau
bahan tambahan lain pada sampel yang dianalisis.
Analisis terhadap urutan asam amino berbasis keselarasan
menunjukkan bahwa urutan asam amino dari kolagen sapi dan babi
tidaklah identik (Zhang et al., 2009). Penggunaan pepsin yang memiliki
situs pemotongan spesifik dapat menghidrolisis protein gelatin menjadi
potongan-potongan rantai polipeptida dengan sebaran berat molekul yang
berbeda antara gelatin sapi dan babi di mana perbedaan ini dapat dilihat
hasil pemisahannya dari analisis SDS-PAGE. Berdasarkan pemaparan di
atas maka pada penelitian aplikasi metode SDS-PAGE untuk mengidentifikasi sumber gelatin pada kapsul keras ini dilakukan dengan menghidrolisis sampel dengan pepsin agar diperoleh fragmen yang
spesifik yang dapat dijadikan acuan untuk membedakan kedua sumber
gelatin.
Analisis terhadap sumber gelatin kapsul keras dilakukan dengan
melihat karakteristik pemisahan protein gelatin hasil hidrolisis pepsin,
dengan melakukan perhitungan bobot molekul pita-pita pemisahan protein
tersebut berdasarkan jarak perpindahannya (Rf) kemudian dibandingkan
dengan profil protein hasil pemisahan pada gelatin standar.
1.2 Rumusan Masalah
1. Apakah profil protein gelatin sapi dan babi hasil hidrolisis pepsin dapat
dibedakan dengan metode SDS-PAGE?
2. Bagaimanakah profil protein hidrolisat gelatin pada kapsul keras hasil
analisis SDS-PAGE berdasarkan karakteristik bobot molekulnya?
3. Apakah metode SDS-PAGE mampu menentukan sumber gelatin pada
4
1.3 Tujuan Penelitian
Mengidentifikasi sumber gelatin yang digunakan pada sediaan
kapsul keras berdasarkan perbedaan bobot molekul fragmen protein hasil
analisis SDS-PAGE setelah dihidrolisisi dengan pepsin.
1.4 Manfaat Penelitian
1. Memberikan kontribusi dalam penggunaan metode analisis kehalalan
sumber gelatin terutama pada produk kapsul yang banyak digunakan
dalam industri farmasi.
2. Memberikan informasi kehalalan pada sebagian produk kapsul yang
BAB 2
TINJAUAN PUSTAKA
2.1 Kapsul
Kapsul dapat didefinisikan sebagai bentuk sediaan padat, dimana
satu macam bahan obat atau lebih dan atau bahan inert dimasukkan ke
dalam cangkang atau wadah kecil yang umumnya dibuat dari gelatin yang
sesuai tergantung pada formulasinya kapsul dari gelatin bisa lunak dan
bisa keras (Ansel, 2005).
Kapsul gelatin keras diperkenalkan oleh Murdock di inggris pada
tahun 1847. Kapsul merupakan sediaan yang digunakan oleh ahli farmasi
dalam menggabungkan obat-obat secara langsung, dan di lingkungan para
pembuat sediaan farmasi dalam memproduksi kapsul umumnya.
Cangkang kapsul kosong dibuat gelatin dan air 10-15% pada dasarnya
tidak mempunyai rasa, jernih tidak berwarna namun dapat juga diberi
warna agar menarik dan dapat dibedakan dengan kapsul yang mengandung
obat yang lain (Syamsuni, 2006).
2.1.1 Pembuatan Kapsul
Kapsul dibuat dengan mencapurkan gelatin dengan dengan air dan
bahan tambahan lain kemudian dipanaskan hingga gelatin larut. Cetakan
logam pada suhu kamar dicelupkan ke dalam larutan gelatin panas
sehingga membentuk sebuah film. Film gelatin dikeringkan dan dipotong
agar sama panjang, film gelatin di lepaskan dari cetakan. Setiap bagian
kasul yang telah terbentuk akan digabungkan penutup dan badan hinga
menjadi kapsul yang utuh (Rabadiya B., dan Rabadiya P., 2013).
Kapsul gelatin keras juga ditujukan untuk kapsul yang diisi oleh
bahan–bahan dalam bentuk kering yang terdiri dari dua bagian yaitu
bagian tutup dan bagian tubuh. Biasanya cangkang kapsul ini diisi dengan
bahan padat atau serbuk, butiran atau granul. Campuran sebuk yang
6
jika di gunakan absorben seperti MgCO3 atau silicon dioksida (Syamsuni,
2006).
Gambar 2.1 Proses pembuatan kapsul keras (Sumber : Rabadiya B, 2013)
Pada kapsul gelatin keras penutupan cangkang dapat dilakukan
dengan cara memberikan lekukan khas pada bagian tutup dan tubuh dapat
juga dilakukan pemanasan langsung atau menggunakan energi ultrasonic,
sedangkan untuk membersihkan cangkang kapsul gelatin keras dapat
dilakukan dengan cara meletakkan kapsul di antara sepotong kain (linen,
wool), kemudian di gosok-gosokkan (Syamsuni, 2006).
Kapsul keras harus disimpan pada tempat yang tidak lembab dan
sebaiknya disimpan di wadah yang diberi zat pengering. Ukuran cangkang
kapsul bervariasi dari nomer paling kecil 5 sampai nomor paling besar
000, kecuali cangkang untuk hewan. Umumnya ukurang terbesar 00
merupakan ukuran yang dapat di berikan kepada pasien. Ada juga ukuran
0 yang berbentuk memanjang dikenal sebagai ukuran 0el yang
memberikan kapasitas lebih besar tanpa peningkatan diameter (Syamsuni,
7
Gambar 2.2 Ukuran kapsul (Sumber : Rabadiya B, 2013)
2.1.2 Bahan Penyusun Kapsul
Kapsul dapat dibuat dari gelatin dan bahan lain dengan konsistensi
gel dipengaruhi oleh bahan tambahan lain seperti glycerol atau sorbitol.
Bahan tambahan seperti bahan aktif permukaan, pembaur (membuat
sediaan tidak bening), pengawet, pemanis, pewarna dan perasa dapat saja
digunakan selama bahan tersebut memiliki izin dari pihak-pihak yang
berwenang (European Pharmacopoeia 5.0, 2005). Kapsul dikategorikan
sebagai kapsul keras atau lembut dipengaruhi oleh keberadaan plasticizer
seperti gliserol yang dapat membuat kapsul lembut dan elastis (B
Rabadiya dan P Rabadiya, 2013).
2.1.3 Karakteristik Kapsul Keras
Kapsul keras dikatakan ideal jika memiliki kekuatan elastisitas
permukaan 200-300 Bloom; viskositas (60°C / 6-23% b/b dalam air) 44-60
MP; pH 4,5 -6,5. Kapsul gelatin yamg digunakan manusia umumnya
digunakan untuk merangkum antara 65 mg sampai 1 gram obat dan hancur
ketika mengalami kontak dengan cairan tubuh (Rabadiya B., dan Rabadiya
P., 2013).
2.2 Gelatin
Gelatin adalah suatu zat yang diperoleh dari hidrolisis parsial
kolagen dari kulit, jaringan ikat putih dan tulang hewan. Gelatin yang
8
berasal dari prekusor yang dibasakan dikenal dengan tipe B (Farmakope
Indonesia ed IV, 1995)
Nama gelatin merupakan turunan dari Bahasa Latin “gelatus” yang berarti kaku atau beku. Gelatin pertama kali digunakan sebagai bahan
pangan pada masa Napoleon ketika digunakan sebagai sumber protein bagi
tentara Prancis selama blokade Inggris. Gelatin diproduksi secara
komersial pertama kali di Belanda tahun 1685, kemudian berlanjut di
Inggris tahun 1700 dan produksi komersial gelatin pertama kali di
Amerika Serikat adalah di Massachussettes pada tahun 1808.
Gelatin adalah protein yang diperoleh dari jaringan kolagen hewan
yang terdapat pada kulit, tulang dan jaringan ikat, merupakan suatu
polipeptida larut berasal dari kolagen, yang merupakan konstituen utama
dari kulit, tulang, dan jaringan ikat binatang. Gelatin diperoleh melalui
hidrolisis parsial dari kolagen. Ketika kolagen diperlakukan dengan asam
atau basa dan diikuti dengan panas, struktur fibrosa kolagen dipecah secara
irreversibel menghasilkan gelatin (Zhou dan Regenstein, 2004). Gelatin
diperoleh dari pelepasan ikatan cross-linking (ikatan silang) diantara rantai
polipetida pada kolagen dengan disertai sejumlah perusakan pada rantai
ikatan peptida (Yifen, 2007).
Menurut data dari SKW Biosystem INC suatu perusahaan gelatin
multinasional bahwa produk gelatin dunia pada tahun 1999 sebanyak
254.000 ton terdiri dari sumber kulit jangat sapi sebanyak 28,7 %; kulit
babi sebanyak 41,4% serta kontribusi tulang sapi sebesar 29,8 %; dan
sisanya dari ikan. Pada umumnya, gelatin yang berasal dari mamalia
banyak digunakan karena ketinggian titik lebur, titik gelasi dan
reversibilitas termalnya.
2.2.1 Sifat Fisika dan Kimia Gelatin
Gelatin hampir tidak berasa dan tidak berbau, lembaran gelatin
bersifat rapuh, padat dan jernih kekuningan, gelatin memiliki kelembaban
8-13% dan kepadatan relatif 1,3-1,4. Partikel gelatin dalam air dingin akan
menyerap air dan membesar sedangkan dalam air panas partikel akan
9
trifluoroethanol, dan formamida. Gelatin tidak larut dalam benzene,
aseton, alkohol primer dan dimetilformamida. Gelatin yang dipanaskan
diatas suhu 45oC di udara secara bertahap akan kehilangan kemampuan
untuk mengembang.
Gelatin adalah turunan dari kolagen yang merupakan perotein
dengan bahan penyusun utama 50,5% karbon, 6,8% hidrogen, 17%
nitrogen, 25,2% oksigen, karena gelatin merupakan protein maka gelatin
akan mengalami reaksi yang sama seperti protein jika berinteraksi dengan
enzim-enzim proteolitik, terhidrolisis menjadi komponen rantai
polipeptidanya atau asam-asam aminonya.
Tabel 2.1 Komposisi asam amino gelatin (Sumber : GMIA, 2012)
Gelatin memiliki sifat ampoterik yang akan menjadi kation dalam
larutan asam dan anion dalam larutan basa dengan titik isoelektrik pH
4,7-5,4 untuk gelatin tipe A dan pH 4,6-9 untuk gelatin tipe B. Nilai kekuatan
gel dari gelati adalah 50-300 bloom dan sangat dipengaruhi oleh
konsentrasi gelatin, kekuatan intrinsik, suhu, pH, dan keberadaan bahan.
Viskositas larutan gelatin 20-75 mps dimana viskositas gelati meningkat
10
2.2.2 Struktur Kimia Gelatin
Gelatin merupakan protein turunan dari kolagen dimana susunan
asam amino pada struktur primernya mirip dengan kolagen sumbernya
(Gomez et al.,2009). Stuktur gelatin merupakan susunan asam amino yang
terikat melalui ikatan peptida membentuk rantai alpha. Pada proses
hidrolisis termal struktur triple-helix kolagen terdenaturasi dengan
pemutusan ikatan kovalen cross-link menghasilkan 3 rantai alpha yang
terpisah. Pada proses hidrolisis dengan basa, basa memutus ikatan
cross-link piridinolin sehingga kolagen terdenaturasi menghasilkan rantai alpa
dalam larutan dengan bobot molekul berkisar 100-700 kda dengan IEp
(isoelectric point) 4,6-9. Pada proses ektraksi gelatin dengan metode asam,
terjadi pemutusan ikatan peptida sehingga gelatin yang dihasilkan pada
proses asam memiliki rantai alpha yang lebih pendek dengan nilai IEp
yang lebih sempit (4,5-5,4) (Gorgieva dan Kokol, 2011 ).
Gambar 2.3 Proses denaturasi kolagen (Sumber : Hikada, 2002)
Struktur gelatin terdiri atas rantai asam amino yang dihubungkan
oleh ikatan peptida. Susunan asam amino gelatin berupa Gly-X-Y dimana
X umumnya asam amino prolin dan Y umumnya asam amino
hidroksiprolin. Tidak terdapatnya triptofan pada gelatin menyebabkan
gelatin tidak dapat digolongkan sebagai protein lengkap (Grobben et al.,
11
Gambar 2.4 Struktur gelatin (Sumber : Ofori, 1999)
Rantai asam amino dominan yang terdapat dalam gelatin adalah
glysin (26-34%), prolin (10-18%) dan hidroksiprolin (7-15%). Beberapa
jenis asam amino lain terdapat pula dalam gelatin, misalnya alanin
(8-11%), arginin (8-9%), asam aspartat (6-7%), dan asam glutamat (10-12%).
Meskipun demikian, gelatin bukan merupakan protein yang lengkap. Hal
ini karena gelatin tidak mengandungasam amino triptofan dan hanya
sedikit mengandung asam amino isoleusin, treonin,metionin, sistein, dan
sistin (Gorgieva dan Kokol, 2011 ).
Gelatin terdiri dari 300 sampai 4.000 rantai asam amino terutama
glycine dan proline/ hydroxyproline. Kekhususan struktur gelatin adalah
tingginya kandungan asam amino glisin, prolin dan hidroksiprolin. Gelatin
mengandung sejumlah 18 asam amino spesifik yang berbeda dan bekerja
sama berurutan untuk membentuk rantai polipeptida dengan 1000 asam
amino setiap rantai. Sebanyak 3 rantai polipeptida terbentuk bekerja sama
sebagai spiral sisi kiri untuk memberi struktur sekunder. Dalam struktur
tersier, spiral menggulung dan melipat sendiri pada sisi kanan (
triple-helix) membentuk molekul bentuk tangkai, yang disebut protofibril
(Gorgieva dan Kokol, 2011 ).
2.3 Pepsin
Pepsin merupakan salah enzim pendegradasi protein, atau enzim
12
dalam keluarga aspartat protease. Enzim ini pertama diakui memiliki
aktifitas (dalam proses pencernaan) dan pada tahun 1825 pertama kali
diberi nama pada tahu tersebut (Gillespie, 1898). Selama proses
pencernaan, pepsin bekerja pada protein kompleks sampai menjadi peptida
dan asam amino hingga dapat benar-benar diserap oleh lapisan usus.
Pepsin dibuat dari mukosa usus atau kelenjar yang dikeringkan.
Pengolahan pepsin melibatkan aktivasi zimogen menjadi enzim aktif
dengan aktivasi terkontrol kelenjar diikuti dengan penyaringan, pemurnian
dan akhirnya dikeringkan sampai menjadi bubuk halus dalam kondisi
benar-benar dikontrol.
2.3.1 Ciri-ciri dan Kinetika Pepsin
Pepsin, bersama dengan protease aspartat lain yang umum
ditemukan di vertebrata dan tanaman, yang paling sering disintesis sebagai
zymogen tidak aktif. Pepsin zymogen ini adalah pepsinogen. Pepsinogen
memiliki struktur primer yang sama seperti pepsin ditambah 44 residu di
N-terminal dari protein. Segmen 44 residu ini sering disebut sebagai
propeptide dan pepsinogen sering disebut sebagai sebuah proenzim
(Davies, 1990). Pepsinogen propeptide berisi sembilan residu lisin, dua
residu arginin dan dua histidin residu yang membuat peptida dasar.
Propeptide membentuk heliks struktur yang distabilkan oleh gaya
elektrostatik enam dari rantai sisi dasar membentuk ion berpasangan
dengan rantai samping karboksilat pepsin (Perlmann, 1963). Propeptide
yang menghambat aktifitas enzim dengan menghalangi akses ke katalitik
aspartates di situs aktif. Hasil propeptide dihilangkan dalam aktivasi
pepsinogen menjadi pepsin (James dan Sielecki, 1986). Hilangnya struktur
heliks dari propeptide juga biasanya terjadi selama aktivasi zymogen
(Davies, 1990).
Aktivasi pepsinogen terjadi ketika pH larutan pepsinogen
diturunkan. Penurunan pH diyakini membuka rantai samping karboksilat
pepsin yang menyebabkan kompleks memecah dan mengarah pada
13
membalikkan aktivasi zymogen jika dilakukan pada waktu yang tepat.
Namun, jika pH diturunkan untuk jangka waktu lama aktivasi akan
ireversibel (James dan Sielecki, 1986).
Aktivasi pepsinogen menjadi pepsin diyakini terjadi melalui dua
jalur, baik dalam proses satu langkah atau secara berurutan. Ada juga dua
reaksi yang berbeda yang terjadi selama aktivasi. Dalam reaksi
intramolekuler pepsinogen memotong sendiri untuk membentuk pepsin
aktif, sedangkan pada reaksi antarmolekul pepsinogen dibelah oleh salah
satu molekul pepsinogen lain, dalam bentuk molekul peralihan atau pepsin
aktif. Percobaan kinetika menunjukkan bahwa reaksi intramolekul lebih
dominan pada pH lebih rendah dari 3,0 (Al-Janabi et al., 1972). Aktivasi
Satu-langkah lebih sering terjadi, tetapi tidak eksklusif, melalui Reaksi
antarmolekul (Kageyama dan Takahashi, 1983).
Baik proses satu langkah ataupun jalur bertahap diyakini terjadi
secara bersamaan selama aktivasi pepsinogen ke pepsin (Christensen et al.
1977). Reaksi intramolekul dan reaksi antarmolekul keduanya terlibat
dalam jalur satu langkah. Tampaknya seolah-olah reaksi intramolekul
merupakan bagian penting untuk aktivasi awal untuk menghasilkan
molekul pepsin aktif. Sedangkan reaksi antarmolekul penting bagi
penyelesaian aktivasi (Kageyama dan Takahashi, 1987).
2.3.2 Struktur dan Aktifitas Pepsin
Pepsin pertama dikristalkan pada tahun 1930 oleh John Northrop
dan kemudian disempurnakan oleh Sielecki et al. pada tahun 1990.
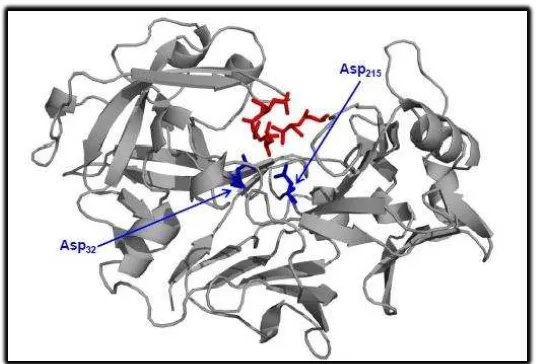
Gambar 5 menggambarkan struktur kristal dari pepsin manusia (Fujinaga
et al., 1995). Residu Asp katalitik, Asp32 dan Asp215, disorot dengan
warna biru sedangkan pepstatin pepsin inhibitor disorot dalam warna
merah. Protein dapat dibagi menjadi tiga wilayah (James dan Sielecki 1986). Wilayah pertama terdiri dari enam terdampar antiparalel β-sheet. Interdomain ini membentuk backbone dari struktur dan terletak di
14
lobus. Satu lobus adalah N-terminal yang terdiri dari 142 residu dan lobus
lainnya adalah C-terminal yang terdiri dari 123 residu.
Meskipun pola yang sama dalam sekuens asam amino mereka,
domain N-terminal dan C-terminal tidak terlalu mirip dalam struktur
sekunder atau tersiernya (Sielecki et al., 1990). Unsur-unsur lain dari
struktur kristal pepsin adalah bahwa molekul tersebut terdiri dari peptida
interdomain pendek yang terletak di sebelah sisi eksternal dari enam untai β-sheet (Sielecki et al., 1990). Ada juga dua helai yang membentuk loop β-hairpin yang sering disebut flap. Flap proyek keluar di situs sumbing aktif dari molekul (Davies, 1990). Pepsin berisi inti hidrofobik besar di
pusatnya. Ini adalah hasil dari reassembly dari tiga wilayah yang
disebutkan di atas. Faktor utama yang berkontribusi terhadap inti
thehydrophobic adalah rantai samping yang menonjol ke dalam dari enam terdampar β-sheet (Sielecki et al., 1990).
Situs katalitik dari pepsin disorot oleh dua residu asam aspartat,
Asp 32 dan Asp 215. residu Asp terletak di kedua domain N-terminal dan
C-terminal. Kedua residu Asp terletak menjelang akhir setiap domain dan
terhubung melalui jaringan ikatan hidrogen. Situs aktif cukup kaku.
Namun, lekukan yang menjorok keluar di atas situs aktif agak fleksibel.
Lekukan ini dapat menutup sekitar inhibitor yang terikat pada situs aktif,
sehingga membatasi mobilitas (James dan Sielecki, 1982).
15
Pepsin akan memecah molekul protein menjadi poliptida yang
lebih kecil dengan memutus ikatan peptida yang ada pada sisi NH2 bebas
dari asam-asam amino aromatik (fenilalanin, tirosin, triptofan), hidrofobik
(leusin, isoleusin, metionin), atau dikarboksilat (glutamat dan aspartat).
Pusat aktif pepsin mengandung dua residu asam aspartat yang merupakan
bagian dari urutan Ile-Val-Asp-Thr-Gly-Thr-Ser-Leu dan yang kedua
merupakan bagian dari urutaan Ile-Val-Asp-Thr-Gly-Ser-Ser-Asn (Al
Janabi et al., 1972).
Pepsin memiliki kemampuan untuk memutuskan secara spesifik
ikatan amida setelah terminal N dari asam amino aromatik seperti
fenilalanin, tirosin, dan triptofan sehingga residu asam amino hasil
hidrolisis dengan Pepsin diharapkan memiliki bobot molekul lebih kecil
(Hermanto et al., 2013).
Gambar 2.6 Proses hidrolisis polipeptida dengan enzim pepsin (Sumber: www.chemguide.co.uk)
Pepsin merupakan enzim yang aktifitasnya sangat tergantung pada
pH-nya. Pepsin memiliki aktifitas enzimatik optimum pada pH antara 1,8
dan 2,0. Hal ini tetap stabil, dan masih sangat aktif, ketika pH turun ke
level 1,0 (Ryle, 1970). Pepsin akan mulai kehilangan aktifitas di sekitar
pH 5 (Smith, 1991) dan menjadi ireversibel tidak aktif pada pH sekitar 7.
Namun, konsentrasi tinggi pepsin tidak akan menjadi tidak aktif sampai
pH sekitar 8 (Jones dan Landon, 2002). Kegiatan pepsin juga tergantung
pada enzim untuk rasio protein. Semakin tinggi rasio ini adalah lebih
16
2.4 SDS-PAGE
Elektroforesis adalah suatu cara untuk memisahkan fraksi-fraksi
suatu campuran berdasarkkan atas pergerakan partikel koloid yang
bermuatan dibawah pengaruh medan listrik. Cara elektroforesis telah
diigunaakan untuk analisa virus, asam nnukleat, enzim, dan protein lain,
serta molekul-molekul organik dengan berat molekul rendah seperti asam
amino. (Westermeier, 2004)
Sodium Dodecyl Sulphate Polyacrilamide Gel Elektroforesis
(SDS-PAGE) adalah teknik untuk memisahkan rantai polipeptida pada protein
berdasarkan kemampuannya untuk bergerak dalam arus listrik, yang
merupakan fungsi dari panjang rantai polipeptida atau berat molekulnya.
Hal ini dicapai dengan menambahkan deterjen SDS dan pemanasan untuk
merusak struktur tiga dimensi pada protein dengan terpecahnya ikatan
disulfide yang selanjutnya direduksi menjadi gugus sulfidhihidril. SDS
akan membentuk kompleks dengan protein dan kompleks ini bermuatan
negativ karena gugus-gugus anionic dari SDS (Hemes,1998).
Gambar 2.7 Skema SDS PAGE (Sumber: ww2.chemistry.gatech.edu)
2.4.1 SDS
SDS adalah detergen anionik yang dapat melapisi protein, sebagian
17
negatif pada semua protein dalam sampel. Protein glikosilasi mungkin
tidak bermigrasi, karena diharapkan migrasi protein lebih didasarkan pada
berat molekul dan massa rantai polipeptidanya, bukan gula yang melekat.
SDS berfungsi untuk mendenaturasi protein karena SDS bersifat sebagai
deterjen yang mengakibat ikatan dalam protein terputus membentuk
protein yang dapat terelusi dalam gel begitu juga mercaptoetanol. SDS
dapat mengganggu konformasi spesifik protein dengan cara emelarutkan
molekul hidrophobik yang ada di dalam struktur tersier polipeptida. SDS
mengubah semua molekul protein kembali ke struktur primernya (struktur
linear) dengan cara meregangkan gugus utama polipeptida. Selain itu, SDS
juga menyelubungi setiap molekul protein dengan muatan negatif.
Gambar 2.8 Konformasi protein yang Setelah penambahan SDS (Sumber: www.advansta.com)
2.5.1 Gel Poliakrilamid
Poliakrilamid merupakan polimer dari monomer akrilamid. Saat
poliakrilamid berbentuk gel, maka akan terbentuk pori-pori kecil yang
membentuk labirin atau terowongan dan saluran yang memungkinkan
molekul bergerak (migrasi). Poliakrilamid merupakan medium yang tepat
untuk memisahkan protein berdasarkan ukuran karena ukuran pori-pori
kecil yang memungkinkan untuk memperlambat gerakan molekul. Gel
poliakrilamid terbentuk dari proses polimerisasi radikal bebas akrilamid
18
Gambar 2.9 Prinsip reaksi pembentukan poliakrilamid (Sumber: Mickelson et al, 2004)
Analisis menggunakan SDS-PAGE ini gel poliakrilamid yang
digunakan terdiri dari 2 yaitu stacking gel dan resolving gel. Stacking gel
berfungsi sebagai gel tempat meletakkan sampel, tedapat beberapa well,
sedangkan resolving gel merupakan tempat dimana protein akan
bergerak/berpinadah menuju anoda. Stacking gel dan resolving gel
memilikikomposisi yang sama, yang membedakan hanya konsentrasi gel
poliakrilamid pembentuknya, dimana konsentrasi Stacking gel lebih
rendah daripada resolving gel. Komponen penting yang membentuk gel
poliakrilamida adalah :
1. Akrilamida, sebagai senyawa utama yang menyusun gel dan
merupakan senyawa karsinogenik.
2. Bis akrilamida, berfungsi sebagai cross‐linking agent yang membentuk kisi‐kisi bersama polimer akrilamida. Kisi‐kisi tersebut berfungsi sebagai saringan molekul protein. Perbandingan antara akrilamida
dengan bis akrilamida dapat diatur sesuai dengan berat molekul protein
yang dipisahkan . Semakin rendah berat molekul protein yang
dipisahkan, maka semakin tinggi konsentrasi akrilamida yang
digunakan agar kisi‐kisi yang terbentuk semakin rapat.
3. Amonium persulfat (APS), berfungsi sebagai inisiator yang
mengaktifkan akrilamida agar bereaksi dengan molekul akrilamida
yang lainnya membentuk rantai polimer yang panjang.
4. TEMED (N,N,N’,N’ tetrametilendiamin), berfungsi sebagai katalisator
reaksi polimerisasi akrilamid menjadi gel poliakrilamid sehingga dapat
19
Penggunaan poliakrilamida mempunyai keunggulan dibandingkan
dengan gel lainnya, seperti : Tidak bereaksi dengan sampel, Tidak
membentuk matriks dengan sampel, Tidak menghambat pergerakan
sampel yang memungkinkan pemisahan protein secara sempurna,
Mempunyai daya pemisahan yang cukup tinggi.
2.5.2 Prinsip Dasar
Prinsip penggunaan metode gel poliakrilamid ini adalah migrasi
komponen akrilamida dengan N.N` bisakrilamida. Kisi – kisi tersebut
berfungsi sebagai saringan molekul sehingga konsentrasi atau rasio
akrilamid dengan bisakrilamid dapat diatur untuk mengoptimalkan kondisi
migrasi komponen protein. Metode ini sering digunakan untuk
menentukan berat molekul suatu protein disamping untuk memonitor
pemurnian protein (Wilson dan Walker, 2000). SDS‐PAGE dilakukan terhadap protein tak larut dengan kekuatan ion rendah dan dapat
menentukan apakah suatu protein termasuk monomerik atau oligomerik,
menetapkan berat molekul dan jumlah rantai polipeptida sebagai subunit
atau monomer.
Gambar 2.10 Pemisahan Molekul dengan SDS PAGE (Sumber: www.imb-jena.de)
Prinsip dasar analisa dengan SDS-PAGE adalah :
1. Larutan protein yang akan dianalisis dicampur dengan SDS terlebih
dahulu, SDS merupakan detergent anionik yang apabila dilarutkan
20
Muatan negatif SDS akan mendenaturasi sebagian besar struktur
kompleks protein, dan secara kuat tertarik ke arah anoda bila
ditempatkan pada suatu medan elektrik.
2. Pada saat arus listrik diberikan, molekul bermigrasi melalui gel
poliakrilamid, menuju kutub positif (anoda), molekul yang kecil akan
bermigrasi lebih cepat daripada yang besar, sehingga akan terjadi
pemisahan.
3. Pada proses eleltroforesis dengan SDS dilakukan di dalam gel poly
acrylamide, molekul protein akan melewati pori – pori gel, sehingga
kemudahan pergerakan melalui pori tergantung pada diameter molekul.
4. Molekul yang lebih besar akan tertahan dan akibatnya bergerak lebih
lambat. Karena molekul terdenaturasi, diameternya tergantung dari
berat molekulnya. Makin besar diameter molekulnya, semakin lambat
gerakannya.
5. Dengan demikian, SDS – PAGE akan memisahkan molekul
berdasarkan BM-nya.
Gambar 2.11 Alur Kerja SDS PAGE (Sumber: en.wikipedia.org)
Untuk melihat pita komponen yang terbentuk, gel perlu diwarnai
dengan pewarna khusus, beberapa pewarna yang dapat digunakan dalam
SDS-PAGE adalah :
1. Commasie Brilliat Blue, mengikat protein secara spesifik dengan
21
2. Silver Salt Staining, memiliki sifat lebih sensitif dan akurat namun
BAB 3
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pangan Pusat
Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta dan
Laboratorium Biologi Molekular LAPTIAB BPPT mulai bulan Februari
Sampai Oktober 2014.
3.2 Alat dan Bahan
3.2.1 Alat
Seperangkat alat Elektroforesis SDS-PAGE (Mini-PROTEAN
Tetra Cell-BIO-RAD), Vortex, Hotplate stirrer, Setrifuge, Mikropipet,
Tip, Becker glass 100 ml, Beker glas 50 ml, Tube, Waterbath, Batang
pengaduk, dan Pinset.
3.2.2 Bahan
Pepsin (Sigma Aldrich catalog number 76218) Larutan
Akrilamid/Bis (30%T; 2,67%C); SDS 10% (w/v), Tris HCl 0,5 M pH 6,8;
Sample buffer (Tris HCl 0,5 M; Glycerol; SDS; dan Bromphenol Blue),
Larutan Running buffer (Tris basa, Glycerol, dan SDS), Amonium
Persulfat (APS) 10%, TEMED, Aseton, Larutan Pewarna (0.1% commasie
blue dalam larutan metanol : air : asam asetat (5:5:2)), Larutan Pembilas
(metanol 30% dan asam asetat 10%), air deionisasi.
3.3 Tahap Penelitian
3.3.1 Pengambilan Sampel
Sampel yang digunakan berupa cangkang kapsul keras yang
beredar di Pasar Pramuka, Jakarta Timur, DKI Jakarta.
3.3.2 Preparasi Reagent SDS-PAGE
23
3.3.3 Penyiapan Gel
Gel elektroforesis SDS-PAGE dibuat dengan stacking gel (4%) dan
variasi resolving gel (10 dan 12%) dengan formulasi seperti pada tabel 3.1.
Tabel 3.1 Formula gel elektroforesis (Sumber : Bio-rad)
Persen Air deionisasi Akrilamid/bis Gel buffer* 10% w/v SDS
Gel (ml) (ml) (ml) (ml)
4% 6,1 1,3 2,5 0,1
10% 4,1 3,3 2,5 0,1
12% 3,4 4,0 2,5 0,1
*Resolving Gel Buffer – 1,5M tris-HC; pH 8,8 *stacking Gel Buffer – 0,5M tris-HC; pH 6,8
3.3.4 Pembuatan Kapsul Simulasi
Seberat 5 gram gelatin ditimbang dengan kaca arloji dan dilarutkan
dalam 5 ml air panas suhu 60oC. Sebanyak 1 ml gliserin ditambahkan
dalam larutan gelatin kemudian ditambahkan pewarna sambil larutan
diaduk perlahan hingga larutan homogen. Kemudian 0,125 gram TiO2
ditimbang dalam kaca arloji dan didispersikan dalam 1ml air kemudian
dicampurkan dalam larutan gelatin. Campuran diaduk hingga TiO2
terdispersi dengan baik. Selanjutnya larutan dipindahkan dalam cetakan
dan didinginkan di suhu ruangan kemudian disimpan dalam desikator.
3.3.5 Ekstraksi Gelatin
Sebanyak 500 mg cangkang kapsul ditimbang dan dilarutkan
24
air suhu 60oC. larutan kapsul dipindahkan dalam tube 12 ml dan
disentrifuge dengan kecepatan 6000 rpm selama 30 menit. Supernatant
yang sudah jernih dipipet ke tube 12 ml lainnya. Supernatan ditambah
aseton 1:4 (v/v) kemudian divortex selama 1 menit. Kemudian tube
disetrifuge kembali untuk mengendapkan gelatin dengan kecepatan 6000
rpm selama 20 menit. Endapan diambil disimpan dalam cawan penguap
dalam oven dengan suhu 50oC selama 1 jam. Endapan ditimbang dan
disimpan dalam suasana kering (Azira et al.,2012 dengan modifikasi).
3.3.6 Hidrolisis Enzimatik
Sebanyak 100 mg gelatin dari kapsul dilarutkan dalam 5 mL
larutan buffer asetat pH 4,5 pada gelas beker 10 ml (selanjutnya disebut
larutan 1). Kemudian 2 mg enzim pepsin ditimbang dan dilarutkan dalam
1 ml buffer dalam tabung reaksi (larutan pepsin). Sebanyak 1 ml larutan 1
masing-masing dimasukkan ke dalam 3 tube 2 ml. Kemudian setiap tube
ditambahkan larutan pepsin sebanyak 20 µl dan diberi label 1 jam, 2 jam,
dan 3 jam. Selanjutnya tube diinkubasi pada suhu 60oC selama 1 jam, 2
jam, dan 3 jam sesuai dengan label tube. Sampel kontrol merupakan 1 ml
larutan 1 yang dimasukan dalam tube dan diinkubasi selama 1 jam tanpa
ditambahkan larutan pepsin. Larutan sampel yang telah diinkubasi
didinginkan pada suhu ruangan kemudian ditambahkan NaOH 0,01 M
sebanyal 200 µl. Sampel siap dielektroforesis (Hermanto et al., 2013
dengan modifikasi).
3.3.7 Elektroforesis
Larutan sampel yang telah dihidrolisis sebanyak 13 µl ditambahkan
buffer sample 1:1, kemudian dipanaskan pada suhu 85oC selama 5 menit,
kemudian 20 µl sampel dipipet dan dimasukkan ke dalam sumuran gel
akrilamid. Elektroda dipasang sesuai dengan kutubnya. Elektroforesis
dijalankan pada tegangan 200 V, 15 mA/gel selama 60 menit.
Setelah Elektrophoresis, gel diwarnai dengan 0,05% (w/v)
Coomassie blue R-250 dalam methanol 15% (v/v) dan asam asetat 5%
25
selama 60 menit. Gel dibilas dengan direndam dalam campuran metanol
30% dan asam asetat 10% diingkubasi di dalam waterbath hingga 2-3 jam.
3.3.8 Analisis Data
Analisis data dilakukan dengan perhitungan berat molekul (BM)
dari masing-masing protein yang didasarkan pada marker yang tersedia.
Perhitungan dilakukan dengan mengukur total jarak tracking dari stacking
gel ke separating gel (a), dilanjutkan dengan mengukur jarak tracking dari
stacking gel ke masing-masing pita protein yang terbentuk (b), kemudian
dicari retardation factor (Rf) dengan membagi jarak masing-masing pita
dengan jarak tracking total (b/a), selanjutnya dihitung nilai log BM dari
masing-masing Bm pita marker. Bm pita polipeptida pada sampel dihitung
dengan persamaan linier {Y = a + bX} dimana nilai Rf sebagai sumbu X
dan nilai log Bm sebagai sumbu Y. Kesimpulan ditarik dengan melihat
keberadaan pita spesifik dari gelatin sapi atau gelatin babi pada pola
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Optimasi Kondisi SDS PAGE
Optimasi dilakukan dengan menganalisis pemisahan protein gelatin
murni yang telah di hidrolisis pada kondisi pH 4,5 dan temperatur 60oC
selama 1 jam, 2 jam, dan 3 jam dengan konsentrasi gel akrilamid 12%.
Hasil optimasi dapat dilihat pada gambar 4.1.
Gambar 4.1 Hasil pemisahan gelatin sapi dan babi. Keterangan : 0 protein marker, 1 pepsin, 2 gelatin sapi sebelum dihidrolisis, 3 gelatin babi sebelum dihidrolisis, 4 gelatin sapi setelah dihidrolisis selama 1 jam, 5 gelatin babi setelah dihidrolisis 1 jam, 6 gelatin sapi setelah dihidrolisis selama 2 jam, 7 gelatin babi setelah dihidrolisis 2 jam, 8 gelatin sapi setelah dihidrolisis selama 3 jam, 9 gelatin babi setelah dihidrolisis 3 jam.
Dari hasil penelitian diperoleh kondisi optimal hidrolisis protein
dengan pepsin pada pH 4,5 dan suhu 60oC adalah hidrolisis selama 3 jam.
Kemudian pada SDS PAGE kondisi optimal diperoleh pada waktu running
60 menit dengan tegangan 200 V. Selanjutnya dilakukan perhitungan
bobot molekul terhadap pita pemisahan protein dengan menghitung
27
Table 4.1 Jarak pita dan log bobot molekul marker gel optimasi
No Bm Log Bm
Gambar 4.2 Kurva regresi linier gel optimasi
Regresi linier kurva diatas kemudian digunakan sebagai penentu
bobot molekul pita pemisahan protein gelatin seperti pada table 4.2.
28
Table 4.2 Jarak pita dan bobot molekul gel optimasi No Gelatin sapi
Analisis dilakukan dengan membandingkan pita pemisahan
protein gelatin murni dan kapsul hasil simulasi dari gelatin murni dengan
gelatin sampel pada kondisi optimum gel. Hasil analisis dapat dilihat pada
gambar 4.3.
29
Analisa diawali dengan perhitungan regresi linier berdasarkan seri
log bobot molekum pita pemisahan protein marker sebagai sumbu y dan
nilai Rf sebagai sumbu x seperti pada tabel 4.3.
Table 4.3 Jarak pita dan log bobot molekul marker gel analisis kapsul
no Bm Log
Gambar 4.4 Kurva regresi linier gel analisis kapsul
Hasil regresi linier diatas kemudian digunakan untuk menghitung
bobot molekul pita pemisahan protein gelatin seperti pada tabel 4.4.
30
Table 4.4 Jarak pita dan bobot molekul gel analisis kapsul No G. kapsul sampel 1, Sa2 kapsul sampel 2, Sa3 kapsul sampel 3.
4.2 Pembahasan
Sebelum analisis dilakukan terhadap sampel kapsul dilakukan
terlebih dahulu optimasi kondisi SDS PAGE dengan menganalisis
perbedaan pemisahan gelatin murni dari sapi dan babi yang telah
dihidrolisis dengan enzim pepsin dengan variasi waktu 1 sampai 3 jam,
variasi ini penting mengingat aktifitas pepsin tidaklah tetap (Wu et al.,
2006). Dari optimasi diperoleh pemisahan protein pada SDS PAGE
menunjukkan pemisahan yang baik setelah dihidrolisis selama 3 jam hasil
ini berbeda dengan apa yang diperoleh Hermanto et al (2013) dimana
pemisahan sudah dapat diidentifikasi setelah hidrolisis selama 1 jam.
Perbedaan durasi ini terjadi akibat penyimpanan pepsin yang lama
31
Variasi durasi hidrolisis dilakukan untuk melihat hasil pemisahan
terbaik dari hasil aktifitas pepsin terhadap protein gelatin. Karena kekuatan
aktifitas enzim tidak tetap maka perlu dilakukan percobaan terhadap
aktifitas enzim untuk melihat pemisahan yang dapat memunculkan pita
spesifik dari pemisahan protein gelatin sapi atau babi dimana pita ini
secara spesifik hanya dimiliki oleh sapi atau babi. Pada optimasi ini
diperoleh 2 pita spesifik untuk gelatin babi yang timbul setelah hidrolisis
selama 3 jam yaitu pita dengan bobot molekul 33 kDa dan 43 kDa.
Variasi terhadap konsentrasi akrilamid sebagai medium juga
dilakukan pada proses optimasi dengan konsentrsi 10% dan 12% pada
konsentrasi akrilamid 10% pemisahan protein sudah mulai terlihat hanya
saja pemisahan protein pada pita dengan bobot molekul lebih besar dari
50 kDa pita-pita yang diperoleh masih sangat rapat sehingga sangat sulit
untuk melihat perbedaannya maka dilakukan percobaan kembali dengan
gel 12% dengan harapan didapati pola pemisahan yang lebih baik. Pada
akrilamid dengan konsentrasi 12% pemisahan pita dengan bobot molekul
50 kDa sedikit lebih renggang seperti yang terlihat pada gambar 4.1
sehingga dapat lebih mudah untuk dianalisis.
Pada gambar 4.1 dapat dilihat pada kolom 2 dan 3 protein gelatin
yang tidak dihidrolisis memilik bobot molekul yang sangat besar (diatas
55 kDa untuk sapi dan diatas 70 kDa untuk gelatin babi ). Perbedaan pada
pemisahan protein sebelum dihidrolisis ini terjadi karena gelatin yang
dianalissis bukanlah merupakan gelatin yang diperoleh dengan cara
ekstraksi yang sama atau dengan tipe yang sama. Gelatin sapi merupakan
gelatin tipe B dimana pada proses ekstraksi dari kolagen asalnya
menggunakan hidrolisis basa dimana bobot molekul rata-rata gelatin ini
lebih besar dibandingkan bobot molekul rata-rata gelatin yang dipeloleh
dari proses hidrolisis asam (tipe A) sedangkan babi merupakan gelatin tipe
A (Gorgieva dan Kokol, 2011), perbedaan bobot molekul rata-rata dari
32
Walaupun secara kasat mata dapat dilihat perbedaannya namun
hasil pemisahan protein gelatin tanpa dihidrolisis tidak dapat menunjukkan
pola pemisahan yang spesifik sehingga masih sangat lemah daya
identifikasinya, pada kolom 4 sampai 9 gambar 4.1 merupakan protein
gelatin yang telah dihidrolisis oleh enzim pepsin selama selang waktu
tertentu, dapat dilihat bahwa setelah proses hidrolisis hasil SDS PAGE
menunjukkan pola pemisahan yang lebih spesifik khususnya pada protein
gelatin babi, pada kolom 5,7, dan 9 terlihat pemisahan protein gelatin babi
ada 9 pita pada pemisahan yaitu 94,6 kDa; 74 kDa; 67,6 kDa; 51,6 kDa;
43 kDa; 33 kDa; 23,7 kDa; 17.3 kDa, 12.8 kDa sedangkan pada kolom 4,
6, dan 8 merupakan protein sapi, walaupun pemisahannya belum sebaik
protein babi akan tetapi sudah mulai dapat diidentifikasi seperti pita 84
kDa, 70 kDa, 58 kD, 47 kDa, 18.5 kDa, dan 15 kDa.
Tidak seperti protein induknya yang hanya dapat dihidrolisis
dengan enzim kolagenase, gelatin dapat di hidrolisis dengan enzim-enzim
proteolitik salah satunya adalah pepsin (Gorgieva dan Kokol, 2011).
Namun hasil hidrolisis pepsin sendiri terhadap gelatin efektifitasnya
tidaklah optimal pada seluruh tipe gelatin yang ada. Hidrolisis dengan
pepsin membutuhkan kondisi asam (Al Janabi et al., 1972). Menurut
palashoff (2008) kerja pepsin akan sangat baik jika protein yang
dihidrolisis dalam keadaan terdenaturasi. Sedangkan pada penelitian ini
hidrolisis dilakukan pada pH 4,5 pada kondisi ini gelatin babi (tipe A)
tepat pada titik isoelektriknya sehingga sangat memungkinkan gelatin
tersebut dalam keadaan terdenaturasi namun tidak dengan gelatin sapi (tipe
B). sehingga pada hasil analisis SDS PAGE pola pemisahan gelatin sapi
setelah dihidrolisis tidak sebaik gelatin babi.
Selanjudnya perbedaan besar molekul kedua gelatin ini juga
mempengaruhi hasil kerja pepsin terhadap gelatin. Gelatin sapi (tipe B)
memiliki bobot molekur rata-rata lebih besar dari gelatin babi (tipe A)
(Gorgieva dan Kokol, 2011) sehingga sebaran hasil hidrolisis gelatin babi
33
terlihat jelas polanya, sebaliknya gelatin sapi yang memiliki molekul besar
walaupun setelah proses hidrolisis pita-pita pemisahan yang muncul
dengan BM < 50 kDa masih sangat buram dan hanya 4 pita. Perbedaan
pola pemisahan inilah yang terlihat pada hasil analisis dengan SDS PAGE.
Perbedaan profil pemisahan protein gelatin pada SDS PAGE
setelah dihidrolisis dapat terjadi karena urutan asam amino penyusun
protein tidak sama tergantung dari spesies asalnya (Gorgieva dan Kokol,
2011), sedangkan pepsin sebagai enzim yang di gunakan untuk memotong
protein menjadi fragmen-fragmen rantai polipetida memiliki situs-situs
spesifik pemotongan. Pepsin memotong rantai polipeptida dengan
memutus ikatan peptida yang ada pada sisi NH2 bebas dari asam-asam
amino aromatik (fenilalanin, tirosin, triptofan), hidrofobik (leusin,
isoleusin, metionin), atau dikarboksilat (glutamat dan aspartat) (Al Janabi
et al., 1972). Hasil studi terhadap literature yang ada terdapat sangat
banyak pemotongan rantai polipeptida setelah asam amino hodropobik
seperti leusin dan fenilalanin akan tetapi pemotongan sangat jarang terjadi
setelah prolin dan histidin.
34
Gambar 4.5 menunjukkan bagaimana terjadinya pemotongan
terhadap asam amino dengan panjang yang tidak sama. Hasil studi
literature menunjukkan kemungkinan terjadinya pemotongan rantai
polipeptida antara leusin dengan glutamin pada pH 4 adalah 100%
(palashoff, 2008). Jika situs ini (leusin-glutamin) kita tempatkan ada rantai
polopeptida alpha 1 dari kolagen sapi dan babi sebagai prekusor gelatin
maka akan terlihat bahwa jumlah asam amino hasil pemotongan tidak
sama jumlahnya sehingga panjang rantai polipeptida yang dihasilkan akan
berbeda antara protein gelatin sapi dan babi, hal ini secara langsung
mempengaruhi bobot molekul fragmen polipeptida yang dihasilkan seperti
yang terlihat di gambar 4.6.
Gambar 4.6 Analisis Pita pemisahan gelatin sapi dan babi. Keterangan : 0 protein marker, 1 pepsin, 2 gelatin sapi sebelum dihidrolisis, 3 gelatin babi sebelum di hidrolisis, 4 gelatin sapi setelah dihidrolisis selama 1 jam, 5 gelatin babi setelah dihidrolisis 1 jam, 6 gelatin sapi setelah dihidrolisis selama 2 jam, 7 gelatin babi setelah dihidrolisis 2 jam, 8 gelatin sapi setelah dihidrolisis selama 3 jam, 9 gelatin babi setelah dihidrolisis 3 jam.
Selanjutnya analisis terhadap gelatin dari kapsul sampel dilakukan
bersamaan dengan kapsul simulasi dari gelatin murni dan gelatin murni
tanpa diproses sebagai kapsul. Kondisi analisis disesuaikan dengan hasil
optimasi dan dihidrolisis dengan pepsin selama 3 jam. Pada tahap ini
35
dilakukan karena pita spesifik ini akan digunakan sebagai acuan
pembanding gelatin kapsul sampel untuk penentuan sumber gelatin sampel
tersebut. Pita spesifik ditentukan dengan melihat perbedaan pola
pemisahan dari kedua gelatin kemudian dilihat pita pemisahan yang timbul
di salah satu gelatin namun pita tersebut tidak timbul pada pemisahan
gelatin jenis lainnya. Pita-pita pemisahan yang muncul di kedua jenis
gelatin bukanlah pita spesifik. Pada penelitian ini diperoleh keberadaan
pita yang hanya timbul pada gelatin sapi pada bobot molekul 11,4 kDa; 34
kDa; dan 47 kDa (gambar 4.6 kolom 3) dan pita yang hanya timbul pada
gelatin babi pada bobot molekul 28 kDa; 24,7 kDa; dan 60 kDa (gambar
.4.6 kolom 4) sedangkan pita-pita hasil pemisahan yang lain didapati pada
kedua jenis gelatin. Maka pita spesifik untuk gelatin sapi adalah 11,4 kDa,
34 kDa, 47 kDa dan pita spesifik untuk gelatin babi adalah pita 28 kDa,
24,7 kDa dan 60 kDa.
Gambar 4.7 Analisis Pita Pemisahan Protein Gelatin kapsul. Keterangan : 0 protein marker,1 gelatin sapi murni, 2 gelatin babi murni, 3 kapsul simulasi gelatin sapi , 4 kapsul simulasi gelatin babi, 5 kapsul simulasi campuran gelatin sapi dan babi, 6 kapsul sampel A, 7 kapsul sampel B, 8 kapsul sampel C.
Pada kolom 5 gambar 4.7 adalah kapsul simulasi yang dibuat dari
campuran gelatin sapi dan gelatin babi, kapsul ini dibuat dan disertakan
dalam analisa untuk melihat bagaimana pemisahan yang terjadi jika
36
terkontaminasi oleh gelatin jenis lain. Pada penelitian ini diperoleh
pemisahan gelatin campuran ini tidak benar-benar identik dengan salah
satu pemisahan dari gelatin sapi maupun gelatin babi. Pada pemisahan
gelatin campuran ini pita-pita yang menjadi pita spesifik gelatin sapi sama
sekali tidak muncul akan tetapi ada 2 pita dari gelatin babi yang muncul
pada pemisahannya yaitu pita dengan bobot molekul 14 kDa dan 10 kDa
hal ini terjadi diasumsikan karena dalam proses hidrolisis yang
terhidrolisis terlebih dahulu oleh pepsin pada campuran gelatin tersebut
adalah gelatin babi seperti yang dijelaskan pada paragraf diatas. Sehingga
diasumsikan pada metode ini pemisahan dari gelatin kapsul yang
merupakan campuran gelatin sapi dan babi tidak akan memunculkan pita
spesifik gelatin sapi tetapi akan memunculkan pita gelatin babi (14 kDa
dan 10 kDa) sebagai penanda adanya kontaminasi gelatin babi pada gelatin
campuran tersebut.
Selanjutnya dilakukan analisis terhadap pita-pita pemisahan kapsul
sampel dengan membandingkan keberadaan pita-pita spesifik dari
pemisahan gelatin sapi ataupun babi dengan pemisahan protein gelatin
kapsul sampel. Dari hasil pembandingan didapati bahwa pada pemisahan
protein gelatin dari kapsul sampel 1, 2, dan 3 terdapat pita yang jelas pada
Bm 11,4 kDa; 34 kDa; dan 47 kDa yang merupakan pita spesifik pada
pemisahan protein gelatin sapi dan tidak didapati keberadaan pita spesifik
pemisahan gelatin babi sehingga dapat disimpulkan bahwa kapsul sampel
merupakan kapsul yang dibuat dari gelatin yang berasal dari sapi.
Dari hasil penelitian ini dapat dilihat bahwa SDS PAGE dapat
digunakan sebagai metode untuk membedakan gelatin sapi dan babi
melalui pola pemisahan proteinnya. SDS PAGE selanjutnya juga mampu
untuk membedakan gelatin yang telah diolah menjadi produk lain seperti
kapsul. Hanya saja SDS PAGE hanya dapat melakukan pembedaan secara
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang telah dilakukan dapat diambil
kesimpulan sebagai berikut:
1. Metode SDS PAGE dapat membedakan profil protein gelatin sapi dan
babi hasil hidrolisis.
2. Pemisahan protein gelatin kapsul keras yang berasal dari sapi memiliki
pita spesifik pada Bobot Molekul 47 kDa; 34 kDa; 11,4 kDa dan
protein gelatin kapsul keras yang berasal dari babi memiliki pita
spesifik pada Bobot Molekul 37 kDa; 28kDa; dan 14 kDa.
3. Dengan membandingkan pola pemisahan protein diperoleh bahwa
gelatin yang digunakan dalam kapsul sampel diduga adalah gelatin
sapi.
5.2 Saran
Perlu diadakan analisis lebih lanjut pada pita-pita hasil pemisahan
SDS PAGE dengan menggunakan LCMS sehingga dapat diketahui urutan