IDENTIFIKASI DAN PENCIRIAN FISIKOKIMIA GELATIN
DARI TULANG SAPI DAN BABI
MUHAMAD RIFAI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi dan Pencirian Fisikokimia Gelatin dari Tulang Sapi dan Babi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
Muhamad Rifai
ABSTRAK
MUHAMAD RIFAI. Identifikasi dan Pencirian Fisikokimia Gelatin dari Tulang Sapi dan Babi. Dibimbing oleh PURWANTININGSIH SUGITA dan LAKSMI AMBARSARI.
Gelatin merupakan produk turunan protein yang diisolasi dari jaringan kolagen tulang dan kulit hewan. Gelatin dalam penelitian ini diisolasi dari tulang femur sapi dan babi, diidentifikasi dan dicirikan sifat fisikokimianya meliputi kadar proksimat, viskositas, pH, dan kadar mineral, serta analisis gugus fungsi dan komposisi asam amino penciri. Gelatin sapi dan babi hasil isolasi tidak berwujud kristal seperti bentuk standarnya sehingga memengaruhi viskositas dan kemampuannya membentuk gel. Rendemen gelatin rendah karena masih tingginya kadar mineral fosforus yang menyebabkan proses ekstraksi kolagen tidak sempurna. Analisis gugus fungsi menunjukkan keberadaan gugus amida A (3438 cm-1), amida I (1651 cm-1), dan amida II
(1454 cm-1) yang merupakan gugus fungsi khas gelatin pada gelatin sapi hasil isolasi.
Namun, keberadaan gugus amida III (1245 cm-1) masih menunjukkan keberadaan struktur
tropokolagen yang belum terhidrolisis. Analisis komposisi asam amino penciri menunjukkan jumlah asam amino glisina lebih banyak terdapat pada gelatin sapi daripada gelatin babi.
Kata kunci: gelatin, kolagen, protein, tulang babi, tulang sapi
ABSTRACT
MUHAMAD RIFAI. Identification and Physicochemical Characterization of Gelatine from Bovine and Porcine Bones. Supervised by PURWANTININGSIH SUGITA and LAKSMI AMBARSARI.
Gelatine is a derivative product of protein isolated from collagen tissue of animal skins and bones. In this study, gelatines were isolated from bovine and porcine bones, identified and characterized for their physicochemical properties including proximate, viscosity, pH, and mineral contents, as well as functional group and characteristic amino acids composition analysis. Bovine and porcine gelatine isolates were not obtained in crystal form as their standard forms, which affected viscosity and gelling abilities of the gelatines. Low yield of gelatine isolates were due to the high remaining phosphorus content, causing incomplete collagen extraction. Functional group analysis showed the existence of amide A (3438 cm-1), amide I (1651 cm-1), and amide II (1454 cm-1)
characterizing the functional groups bovine gelatine isolate. However, the existence of amide III (1245 cm-1) still showed the structure of unhydrolized tropocollagen. Analysis
of characteristic amino acids composition showed higher glysine amount in bovine gelatine than that in porcine.
iv
IDENTIFIKASI DAN PENCIRIAN FISIKOKIMIA GELATIN
DARI TULANG SAPI DAN BABI
MUHAMAD RIFAI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Assalamualaikum Wr. Wb.
Segala puji beserta syukur ke hadirat Allah SWT penulis ucapkan atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Identifikasi dan Pencirian Fisikokimia Gelatin dari Tulang sapi dan Babi. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan April 2012 hingga Februari 2013 di Laboratorium Kimia Organik dan Laboratorium Kimia Fisik Departemen Kimia, Laboratorium Preparasi Daging INTP Fakultas Peternakan, dan Laboratorium Terpadu Baranangsiang.
Penulis mengucapkan terima kasih kepada Prof Dr Purwantiningsih Sugita, MS dan Dr Laksmi Ambarsari, MS selaku pembimbing. Terima kasih penulis ucapkan juga kepada Bapak Sabur, Ibu Yenni Karmila, Mbak Nia selaku staf Laboratorium Kimia Organik, serta kepada Bapak Farid dan Bapak Wawan untuk bimbingan konsultasinya, Mbak Dian INTP dan Mas Ian Laboratorium Terpadu atas bantuannya selama melaksanakan penelitian. Terima kasih tidak lupa penulis haturkan kepada Ibu, Ayah, Kakak, dan keluarga atas doanya.
Penelitian ini disponsori oleh Lembaga Pengkajian Pangan, Obat-obatan, dan Kosmetika, Majelis Ulama Indonesia (LPPOM MUI) melalui Hibah Kerja Sama Antarlembaga dan Perguruan Tinggi oleh Prof Dr Purwantiningsih Sugita, MS.
Semoga laporan ini dapat bermanfaat. Terima kasih
Bogor, April 2013
vi
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Kerja 3
HASIL DAN PEMBAHASAN 5
Isolat Gelatin 5
Hasil Analisis Proksimat Gelatin 7
Sifat Fisis Gelatin 8
Kadar Mineral Ca dan P 9
Identitas Gelatin 10
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR TABEL
1 Hasil uji proksimat gelatin 7
2 Viskositas dan BM relatif gelatin 8
3 pH gelatin 9
4 Puncak serapan gelatin hasil FTIR 11
5 Komposisi asam amino gelatin 13
DAFTAR GAMBAR
1 Tulang sapi yang bersih dari daging 5
2 Perubahan struktur kolagen 6
3 Kurva hubungan ηsp/C dengan C (g/dL) 9
4 Spektrum FTIR gelatin sapi (a), standar gelatin sapi (b), dan standar gelatin
babi (c) 10
5 Kromatogram standar asam amino 12
6 Struktur gelatin 12
DAFTAR LAMPIRAN
1 Perhitungan kadar air 16
2 Perhitungan kadar abu 17
3 Perhitungan kadar protein 18
4 Perhitungan BM relatif (Mv) 19
5 Perhitungan kadar Ca 21
6 Perhitugan kadar P 22
7 Waktu retensi komponen asam amino dalam standar gelatin sapi dan babi
menurut Zilhadia et al. (2012) 23
8 Perhitungan komposisi (%) asam amino (AA) 24
9 Kromatogram gelatin sapi hasil isolasi (a), gelatin babi hasil isolasi (b), standar gelatin sapi (c), dan standar gelatin babi (d) 25
PENDAHULUAN
Gelatin merupakan produk turunan protein yang diperoleh dari jaringan kolagen pada tulang dan kulit hewan. Gelatin banyak digunakan di industri makanan, farmasi, kosmetik, dan fotografi (Widyaninggar et al. 2012). Berdasarkan proses pembuatannya, gelatin dibedakan menjadi 2 jenis, yaitu tipe A dan tipe B (Schrieber dan Gareis 2007). Gelatin sapi dibuat dengan proses basa dan termasuk gelatin tipe B, sedangkan gelatin babi termasuk tipe A karena dibuat dengan proses asam (Raja et al. 2011). Produksi gelatin Eropa pada tahun 2011 sebanyak 80% berasal dari kulit babi, 15% dari kulit sapi, dan 5% dari sumber lain seperti tulang sapi, babi, unggas, dan ikan (Jamaludin et al. 2011). Tingginya produksi gelatin dari mamalia seperti sapi dan babi menjadi masalah bagi masyarakat pemeluk agama Hindu yang tidak mengonsumsi makanan dari sapi, sementara penggunaan babi menjadi masalah bagi penganut agama Islam (Martianingsih dan Atmaja 2010).
Pemanfaatan tulang sapi dan babi untuk dijadikan gelatin masih sedikit dibandingkan dengan penggunaan kulit, padahal tulang merupakan limbah yang banyak dihasilkan dan mudah didapat dari rumah pemotongan hewan atau tempat penjualan daging. Di sisi lain, pemanfaatan kulit sebagai sumber gelatin bersaing dengan produksi barang-barang dari kulit seperti tas, dompet, ikat pinggang, dan pakaian yang memiliki nilai jual lebih tinggi. Pemanfaatan tulang sebagai bahan dasar murah dan mudah didapat perlu diberdayakan dan diolah menjadi gelatin untuk meningkatkan potensi dan nilai jual (Perwitasari 2008).
Indonesia sebagai negara dengan mayoritas penduduk beragama Islam sangat memperhatikan kehalalan produk makanan yang beredar di masyarakat. Impor gelatin di Indonesia mencapai 3092 ton setiap tahunnya (Bahtiyar 2012). Gelatin impor tersebut digunakan dalam industri makanan sebagai aditif untuk es krim, yoghurt, puding, agar-agar, dan kue. Gelatin juga digunakan sebagai bahan pembuatan cangkang kapsul obat. Tingginya penggunaan gelatin menjadi perhatian karena dicurigai gelatin impor yang digunakan bersumber dari babi. Produk makanan yang menggunakan gelatin perlu diketahui kehalalannya berdasarkan sumber gelatin yang digunakan. Oleh karena itu, penelitian ini akan mengkaji perbedaan gelatin sapi dan babi berdasarkan sifat fisikokimianya.
Penelitian ini mengidentifikasi perbedaan gelatin yang diisolasi dari tulang sapi dan tulang babi melalui pencirian sifat fisik dan kimia. Analisis yang dilakukan terdiri atas analisis proksimat (kadar air, abu, dan protein), analisis sifat fisik (viskositas, pH, dan BM relatif), serta analisis mineral (Ca dan P). Pencirian gelatin meliputi analisis gugus fungsi khas menggunakan spektrofotometer inframerah transformasi Fourier (FTIR) dan penentuan komposisi asam amino penciri menggunakan HPLC.
METODE
Bahan dan Alat
Bahan yang digunakan antara lain tulang sapi dan babi bagian paha (tulang femur), HCl, H3PO4, NaOH, H2SO4, katalis campuran selen, H3BO3, boraks, indikator bromokresol hijau (BCG) dan metil merah (MM) (5:1), HNO3, HClO4, larutan standar Ca, amonium molibdat, FeSO4∙7H2O, KH2PO4, serbuk KBr, o -ftalaldehida (OPA), metanol, merkaptoetanol, Brij-30 (polioksietilenil-4-lauril eter) 30%, bufer borat 1 M pH 10.4, standar gelatin sapi dan babi dari PT Gelita Selandia Baru, dan standar asam amino Fluka dari Sigma-Aldrich, nomor katalog 061M87 10/AAS 18-5ML (asam glutamat, asam aspartat, serina, histidina, glisina, treonina, arginina, alanina, tirosina, metionina, valina, fenilalanina, isoleusina, leusina, dan lisina).
Alat yang digunakan di antaranya ialah pengering semprot Buchi-190, alat distilasi Kjeldahl automatis Kjeltec, viskometer putar TV-10, viskometer Ostwald dengan kapiler berdiameter 1 mm, dan pH-meter Eutech pH 510. Mineral Ca dianalisis dengan spektrofotometer serapan atom (AAS) Shimadzu AA-7000 dengan lampu katode Ca pada panjang gelombang 422.7 nm. Mineral P dianalisis dengan spektrofotometer ultraviolet-tampak (UV-Vis) LW Scientific UV-200-RS pada panjang gelombang 660 nm.
Analisis gugus fungsi menggunakan spektrofotometer FTIR Spectrum-One pada bilangan gelombang 400–4500 cm-1. Analisis asam amino menggunakan instrumen HPLC Shimadzu dengan kolom ODS-2 Hypersil 150 mm × 4.6 mm dan detektor fluoresens. Kondisi alat diatur pada laju alir 1 mL/menit dengan pemisahan menggunakan sistem gradien eluen. Fase gerak menggunakan eluen A, yaitu campuran natrium asetat pH 6.5, natrium etilenadiaminatetraasetat (Na-EDTA), metanol, dan tetrahidrofuran (THF), serta eluen B yang merupakan campuran metanol 95% dan air bebas-ion.
3
Prosedur Kerja
Isolasi Gelatin
Gelatin diisolasi dari tulang sapi dan babi menggunakan metode yang sama, yaitu perendaman asam (Yuniarifin et al. 2006). Tulang dibersihkan dari daging dan lemak yang menempel, lalu direndam dalam HCl 5% (proses demineralisasi) selama 10 hari. Setiap 2 hari, larutan HCl diganti dengan yang baru. Osein (tulang lunak) yang terbentuk dicuci dengan air mengalir untuk menghilangkan sisa HCl. Osein yang bersih direndam dalam H3PO4 5% selama 2 hari, lalu dicuci dari sisa asam dan dinetralkan dengan NaOH 5% sampai pH-nya berkisar 5–7.
Osein yang sudah netral dihidrolisis dengan akuades menggunakan pemanasan bertahap pada suhu 65, 75, dan 85 oC. Osein yang belum terhidrolisis pada suhu 65 oC dipisahkan untuk kembali dihidrolisis pada suhu 75 oC dan selanjutnya pada suhu 85 oC. Hidrolisat osein (larutan gelatin) larut dalam akuades, disaring dengan kertas saring, dan didinginkan dalam lemari es sebelum dikeringkan dengan pengering semprot.
Analisis Proksimat
Analisis proksimat yang dilakukan terdiri atas penentuan kadar air, abu, dan protein. Kadar air ditentukan berdasarkan metode AOAC 925.09B (2005). Kadar air dan kadar abu gelatin babi hasil isolasi tidak ditentukan karena wujudnya cairan. Cawan porselen kosong dan bersih dikeringkan dalam oven selama 1 jam pada suhu 105 oC lalu ditimbang bobot kosongnya. Gelatin ditimbang 0.5 g ke dalam cawan lalu dikeringkan dalam oven selama 5 jam pada suhu 105 oC. Setelah 5 jam, gelatin didinginkan dalam desikator dan ditimbang. Pengeringan dalam oven selama 5 jam dan penimbangan diulang hingga diperoleh bobot yang konstan. Penentuan kadar air dilakukan triplo.
Kadar abu ditentukan berdasarkan metode AOAC 900.02A (2005). Cawan porselen bersih dimasukkan ke dalam tanur dengan suhu 600 oC selama 30 menit, didinginkan, dan ditimbang bobot kosongnya. Gelatin ditimbang sebanyak 0.5 g di dalam cawan tersebut lalu dipijarkan di atas nyala api pembakar sampai tidak berasap. Setelah itu, dimasukkan ke dalam tanur selama 5 jam dengan suhu 600 oC. Setelah 5 jam, gelatin didinginkan dalam desikator. Bobot abu ditimbang lalu dimasukkan kembali ke dalam tanur. Pengabuan dan penimbangan diulangi hingga diperoleh bobot yang konstan. Penentuan kadar abu dilakukan triplo.
Kadar protein ditentukan dengan metode Kjeldahl (AOAC 955.04C 2005). Gelatin ditimbang sebanyak 0.5 g dan didestruksi dengan H2SO4 pekat dan tambahan katalis sampai berwarna hijau bening. Hasil destruksi ditambahkan 40 mL NaOH 50% dan didistilasi. Uap amonia hasil distilasi ditampung dalam 20 mL larutan H3BO3 2% yang ditambahkan 2 tetes indikator BCG:MM. Larutan tampungan H3BO3 dititrasi dengan HCl 0.1 N yang sudah distandardisasi. Penentuan kadar protein dilakukan duplo dan dilakukan juga penetapan blangko.
Kadar protein = (S−B )× N × 14.007 × 6.25
Keterangan : S = volume titran contoh (mL) Viskositas diukur menggunakan viskometer putar dengan laju putaran 60 rpm, sedangkan pH ditentukan dengan pH-meter (Schrieber dan Gareis 2007). BM relatif ditentukan dengan pengukuran waktu alir menggunakan viskometer Ostwald. Dibuat deret standar dengan konsentrasi 0.30, 0.35, 0.40, 0.45, dan 0.50 g/dL masing-masing 10 mL. Ditentukan juga waktu alir akuades sebagai pelarut (Martianingsih dan Atmaja 2010).
Analisis Mineral Ca dan P
Analisis mineral Ca dan P hanya dilakukan pada gelatin hasil isolasi. Kandungan Ca diukur dengan AAS. Gelatin dipreparasi dengan metode pengabuan basah menurut Reitz et al. (1960). Gelatin ditimbang sebanyak 1 g dalam labu erlenmeyer lalu ditambahkan 5 mL HNO3 pekat dan didiamkan dalam ruang asam selama 60 menit. Gelatin kemudian dipanaskan selama 4–6 jam dalam ruang asam dan dibiarkan semalam. Setelah semalam, ditambahkan 0.4 mL H2SO4 pekat dan gelatin kembali dipanaskan selama 60 menit. Setelah itu, ditambahkan 2–3 tetes HClO4:HNO3 (2:1) (sambil dipanaskan) sampai warna berubah dari cokelat menjadi kuning muda. Gelatin didinginkan, lalu ditambahkan 2 mL akuades dan 0.6 mL HCl, dan dipanaskan kembali selama 15 menit. Larutan disaring, diencerkan dalam labu takar 100 mL, lalu diukur absorbansnya.
Analisis P menggunakan larutan gelatin hasil pengabuan basah, dianalisis menurut metode Taussky dan Shorr (1953). Larutan standar P dibuat dari 4.394 g KH2PO4 yang dilarutkan dalam 1 L akuades, lalu dibuat deret konsentrasi 0, 2, 3, 4, dan 5 ppm. Standar ditambahkan masing-masing 2 mL larutan C dan ditera menggunakan akuades sampai volumenya 5 mL lalu dihomogenkan. Larutan C terdiri atas 10 mL larutan B dan 5 g FeSO4∙7H2O yang dilarutkan dalam 100 mL akuades, sedangkan larutan B dibuat dari amonium molibdat dan H2SO4. Demikian pula larutan gelatin hasil pengabuan basah dipipet dan ditambahkan 2 mL larutan C dan dihomogenkan. Jumlah larutan gelatin disesuaikan agar menghasilkan warna larutan contoh yang berada dalam kisaran warna standar. Contoh ditentukan absorbansnya dengan spektrofotometer UV-Vis.
Identifikasi Gelatin
Identifikasi gelatin meliputi analisis gugus fungsi dan komposisi asam amino penciri gelatin. Analisis gugus fungsi dilakukan menggunakan instrumen FTIR (Al-Saidi et al. 2012). Gelatin sebanyak 20 mg dicampurkan dengan 80 mg serbuk KBr, ditumbuk hingga halus. Campuran dimampatkan dengan cetakan menggunakan pompa hidraulik sehingga membentuk kepingan pelet tipis, yang ditentukan spektrumnya dengan menggunakan FTIR. Gelatin babi hasil isolasi tidak diuji FTIR karena wujudnya cair.
5
ditambahkan 1 mL HCl 6 N. Gas nitrogen ditambahkan ke dalam wadah tabung ulir. Gelatin selanjutnya dimasukkan ke dalam oven selama 24 jam pada suhu 110 oC. Setelah itu, gelatin didinginkan dan disaring dengan kaca masir. Larutan gelatin ditera dalam labu takar 10 mL dengan HCl 0.01 N dan disaring menggunakan saringan 0.45 mikron. Larutan gelatin dipipet sebanyak 10 μL lalu ditambahkan 10 μL larutan bufer kalium borat pH 10.4 dan 25 μL larutan stok OPA, didiamkan selama 1 menit. Setelah itu, larutan gelatin diinjeksikan ke dalam HPLC sebanyak 5 μL.
HASIL DAN PEMBAHASAN
Isolat Gelatin
Gelatin diisolasi dari kolagen tulang sapi dan babi menggunakan metode perendaman asam (Yuniarifin et al. 2006). Digunakan 1404.03 g tulang sapi dan 402.76 g tulang babi. Tahap hidrolisis menghasilkan larutan gelatin yang kemudian dikeringkan dengan pengering semprot untuk menghasilkan serbuk gelatin. Dihasilkan serbuk gelatin sapi sebanyak 65.43 g, dengan rendemen 4.3%. Rendemen gelatin babi tidak ditentukan karena larutan gelatin babi tidak dapat dikeringkan. Rendemen gelatin tulang sapi lebih rendah daripada yang dihasilkan Yuniarifin et al. (2006), yaitu 8.32%. Rendemen yang lebih rendah disebabkan banyak serpihan osein yang terbuang saat penggantian larutan HCl 5%.
Proses pembuatan gelatin terdiri atas penghilangan lemak, demineralisasi, perendaman asam, hidrolisis, dan pengeringan. Tulang dibersihkan dari sumsum dan sisa daging dan lemak yang menempel agar tidak menutupi permukaan tulang saat proses demineralisasi. Tulang yang sudah bersih dikecilkan ukurannya kurang lebih 2 cm × 10 cm untuk meningkatkan luas permukaan sehingga proses demineralisasi lebih merata (Gambar 1).
Gambar 1 Tulang sapi yang bersih dari daging
yang dikelilingi mineral dalam bentuk Ca3(PO4)2 (Yudiono 2003). Mineral dalam tulang perlu dihilangkan agar ekstraksi kolagen lebih sempurna. Selama demineralisasi dengan HCl, struktur tulang akan menggembung dan menjadi lunak (osein). Kalsium dalam tulang terurai menjadi Ca2+dan asam fosfat (1).
Ca3(PO4)2+ 6HCl → 3CaCl2 + 2H3PO4 ... (1)
Osein yang terbentuk berwarna kemerahan dan mudah terkikis sehingga banyak serpihan osein yang terbuang saat pencucian dan penggantian larutan. Hal ini mengakibatkan rendahnya rendemen yang didapat. Tahap perendaman asam dilakukan selama 3 hari menggunakan H3PO4 5%. Proses perendaman osein dalam asam akan merusak tautan-silang pada struktur unting ganda tiga kolagen sehingga strukturnya menjadi tidak stabil (Kusumawati et al. 2008). Tahap hidrolisis adalah tahap utama yang mengubah kolagen menjadi gelatin. Sebelum dihidrolisis, osein terlebih dahulu dicuci dengan air mengalir untuk membilas dan menghilangkan sisa asam (Sopian 2002). Penetralan osein dibantu dengan pencucian dengan NaOH 0.1 N. Osein setelah perendaman asam mempunyai pH 2, sedangkan setelah dinetralkan pH meningkat menjadi 6.
Osein dihidrolisis menggunakan akuades panas dengan suhu 65, 75, dan 85 oC. Penambahan akuades disesuaikan dengan jumlah osein. Jumlah akuades yang terlalu banyak (Perwitasari 2008) akan memperlama waktu penyaringan dan proses pengeringan larutan gelatin. Hidrolisis gelatin sapi menggunakan akuades sebanyak 950 mL, sedangkan hidrolisis gelatin babi 570 mL. Selama hidrolisis, struktur kolagen akan menyusut karena unting ganda tiga kolagen berubah menjadi unting tunggal berbentuk gulungan acak (coil) yang larut dalam air (Gambar 2) (Hasan 2007).
Gambar 2 Perubahan struktur kolagen
7
dapat dikeringkan menggunakan oven hingga mengeras lalu digerus untuk memperoleh serbuk gelatin.
Hasil Analisis Proksimat Gelatin
Kadar air, abu, dan protein ditentukan sebagai parameter mutu gelatin. Kadar air dan kadar abu gelatin sangat dipengaruhi oleh perlakuan saat proses isolasi. Kadar air ditentukan dari selisih bobot gelatin basah dengan gelatin kering yang dihilangkan airnya dalam oven bersuhu 105 oC. Kadar air gelatin sapi didapatkan sebesar 6.27% (Tabel 1), lebih rendah daripada standar gelatin sapi dan babi, berturut-turut 11.13% dan 11.1% (Lampiran 1). Kadar air gelatin menurut GMIA (2012) adalah sekitar 8–13%. Rendahnya kadar air gelatin sapi diduga disebabkan oleh penggunaan pengering semprot.
Tabel 1 Hasil uji proksimat gelatin
Contoh Kadar (%)
Penentuan kadar abu bertujuan memperkirakan kandungan mineral seperti kalsium dan fosforus dalam gelatin dan berhubungan dengan keberhasilan proses demineralisasi. Pemanasan di atas nyala api akan menghilangkan kandungan senyawa organik dalam gelatin. Sisa senyawa organik yang berbentuk arang selanjutnya dihilangkan dengan pemanasan pada suhu 600 oC dalam tanur sampai hanya tersisa abu gelatin. Kadar abu gelatin sapi 3.02% (Tabel 1), lebih tinggi daripada standar gelatin sapi dan babi, berturut-turut 0.45% dan 0.05% (Lampiran 2). Berdasarkan literatur, kadar abu gelatin berkisar 0–3.2% (GMIA 2012).
Tingginya kadar abu gelatin sapi menunjukkan proses demineralisasi tulang yang belum sempurna. Lapisan kalsium yang mengelilingi kolagen tidak terbuang seluruhnya. Hal ini juga mengakibatkan rendahnya rendemen gelatin karena kolagen dalam tulang tidak terekstraksi seluruhnya. Kandungan mineral gelatin yang masih tinggi diduga juga menyebabkan larutan gelatin tidak membentuk gel ketika didinginkan.
Kadar protein gelatin ditentukan dengan metode Kjeldahl. Senyawa nitrogen dalam protein diubah menjadi amonium sulfatoleh H2SO4 pekat. Amonium sulfat yang terbentuk diurai dengan NaOH 50%. Uap amonia yang dibebaskan ditampung dalam larutan H3BO3, lalu dititrasi dengan HCl. Gelatin memiliki kadar protein yang tinggi, yaitu berkisar 85–92% (GMIA 2012). Kadar protein gelatin sapi dan babi yang diperoleh 76.76% dan 4.71%, sedangkan untuk standar gelatin sapi dan babi lebih tinggi, yaitu 87.90% dan 86.45% (Lampiran 3).
asam tulang sapi dan babi dilakukan selama 72 jam sehingga sebagian kolagen terlarut dalam asam fosfat. Hal ini juga menurunkan jumlah kolagen yang terekstraksi dan karena itu, rendemen gelatin yang dihasilkan. Kadar protein gelatin babi sangat kecil disebabkan sampel masih berbentuk larutan yang banyak mengandung air.
Sifat Fisis Gelatin
Viskositas merupakan parameter sifat fisis utama pada gelatin yang menunjukkan mutu dan kemampuan gelatin dalam membentuk gel. Viskositas gelatin ditentukan dengan alat viskometer putar. Alat ini menggunakan logam yang berputar dengan kecepatan 60 rpm. Viskositas yang dihasilkan dinyatakan dalam satuan sentipoise (cP), (Tabel 2). Gelatin sapi hasil isolasi menunjukkan viskositas yang lebih tinggi daripada gelatin babi, sedangkan untuk standar diperoleh hasil sebaliknya. Viskositas gelatin dipengaruhi oleh kadar protein, rendahnya kadar protein ikut menurunkan viskositas gelatin (Yudiono 2003). Gelatin babi hasil isolasi tidak dibuat dalam konsentrasi tertentu dan langsung ditentukan viskositasnya karena sudah berwujud larutan.
Tabel 2 Viskositas dan BM relatif gelatin Contoh Viskositas
Penentuan BM relatif dilakukan menggunakan viskometer ostwald. Larutan gelatin dengan konsentrasi 0.30, 0.35, 0.40, 0.45, dan 0.50 g/dL, ditentukan waktu alirnya, yaitu waktu yang dibutuhkan oleh permukaan larutan gelatin untuk melewati 2 garis batas permukaan pada tabung viskometer. Dari pengukuran deret standar tersebut, didapat persamaan garis yang menghubungkan viskositas spesifik relatif (ηsp/C) dengan konsentrasi larutan (C). Viskositas relatif (ηrel) ialah
nisbah waktu alir larutan dan pelarut, sedangkan viskositas spesifik (ηsp) ialah
viskositas relatif dikurangi 1.
Nilai viskositas intrinsik ([η]) ialah intersep dari persamaan garis yang didapat (Gambar 3), yang jika dimasukkan ke dalam persamaan Mark-Houwink-Sakurada akan dihasilkan BM relatif (Mv). Nilai tetapan K dan α untuk gelatin
9
Gambar 3 Kurva hubungan ηsp/C dengan C (g/dL)
Derajat keasaman gelatin ditentukan pada larutan dengan konsentrasi 6.67% (b/v). Nilai pH gelatin sangat dipengaruhi oleh larutan perendam yang digunakan pada saat isolasi (Kusumawati et al. 2008). Menurut literatur, pH gelatin sapi isolasi berkisar 5–7.5, gelatin babi isolasi berkisar 3.8–5.5 dan standar gelatin berkisar 4.5–6.5 (Yudiono 2003). pH gelatin sapi dan babi hasil isolasi berturut-turut adalah 3.42 dan 2.70 (Tabel 3). Sifat asam disebabkan keduanya dibuat dengan metode perendaman asam. Meskipun demikian, pH yang terukur masih terlalu asam sehingga diduga proses penetralan osein belum berlangsung baik.
Tabel 3 pH gelatin
Contoh Hasil Yudiono (2003) Gelatin sapi isolasi 3.42 5.0–7.5 Gelatin babi isolasi 2.70 3.8–5.5 Standar gelatin sapi 5.50 4.5–6.5 Standar gelatin babi 5.42 4.5–6.5
Kadar Mineral Ca dan P
Mineral Ca dan P paling banyak jumlahnya di dalam tulang. Kadar Ca dalam gelatin sapi dan babi ditentukan dengan AAS. Deret standar Ca digunakan untuk menentukan persamaan garis dengan nilai x ialah konsentrasi larutan dan y
absorbans. Persamaan garis yang didapat adalah y = 0.0393x + 0.007 dengan R2 = 0.9994. Berdasarkan persamaan garis tersebut, kadar mineral Ca dalam gelatin sapi dan babi berturut-turut 0.2447% dan 0.0015% (Lampiran 5). Contoh gelatin yang sama ditentukan kadar mineral P-nya menggunakan spektrofotometer UV-Vis. Deret standar yang digunakan menghasilkan persamaan garis y = 0.1277x + 0.0116 dengan R2 = 0.9972. Berdasarkan persamaan garis tersebut, kadar mineral P dalam gelatin sapi sebesar 2.43% dan dalam gelatin babi 0.27% (Lampiran 6).
y= 0.1418x + 0.04
Kadar Ca dan P tulang menurut literatur berturut-turut adalah 37% dan 18.5% (Perwitasari 2008). Kadar mineral P dalam gelatin sapi masih tinggi. Dalam penelitian ini, demineralisasi dilakukan selama 10 hari dengan larutan HCl 5% yang diganti setiap 2 hari. Menurut Yuniarifin et al. (2006), larutan HCl seharusnya diganti setiap hari untuk mencegah perubahan konsentrasi HCl. Konsentrasi HCl yang menurun dari 5% akan menurunkan efektivitas HCl untuk menghilangkan mineral. Tingginya mineral P pada gelatin sapi dan babi membuktikan bahwa proses demineralisasi belum sempurna sehingga jumlah kolagen yang terekstraksi berkurang. Hal ini menyebabkan rendemen gelatin menjadi rendah.
Identitas Gelatin
Gugus Fungsi
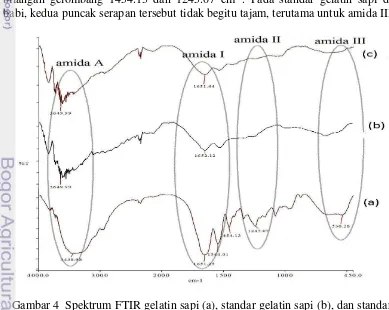
Struktur gelatin seperti umumnya protein memiliki gugus karbonil, amina, dan hidroksil (Martianingsih dan Atmaja 2010). Menurut Puspawati et al. (2012), gelatin memunculkan serapan IR khas amida A pada bilangan gelombang 3600– 2300 cm-1, amida I pada 1636–1661 cm-1, amida II pada 1560–1335 cm-1, dan amida III pada 1300–1200 cm-1. Gelatin sapi hasil isolasi, standar gelatin sapi babi memunculkan puncak serapan amida A berturut-turut pada bilangan gelombang 3438.98, 3649.99, dan 3649.99 cm-1 (Gambar 4). Gugus amida I juga terlihat pada bilangan gelombang berturut-turut 1651.25, 1652.12, dan 1651.44 cm-1. Daerah amida II dan III masih terlihat jelas pada spektrum IR gelatin sapi dengan bilangan gelombang 1454.13 dan 1245.07 cm-1. Pada standar gelatin sapi dan babi, kedua puncak serapan tersebut tidak begitu tajam, terutama untuk amida III.
11
Daerah serapan amida A ditimbulkan oleh vibrasi regangan OH dan NH, dan bentuk puncak yang melebar menunjukkan keberadaan gugus OH dari asam amino hidroksiprolina. Puncak serapan pada daerah amida I menunjukkan keberadaan residu amida dan struktur gulungan acak pada gelatin. Puncak serapan
pada daerah amida II menunjukkan struktur rantai α berpilin dan asam amino
prolina. Puncak pada daerah serapan amida III berasal dari struktur unting ganda tiga kolagen pada gelatin sapi (Tabel 4). Hal ini menunjukkan bahwa masih adanya kolagen yang belum terhidrolisis menjadi struktur unting tunggal. Standar gelatin sapi dan babi hampir tidak memiliki puncak pada daerah amida III.
Tabel 4 Puncak serapan gelatin hasil FTIR Serapan
Bilangan gelombang (cm-1)
Dugaan
Regangan NH dari gugus amida dengan ikatan hidrogen dan OH dari hidroksiprolina
Amida I 1651.25 1652.12 1651.44 Regangan C=O dengan kontribusi dari ikatan NH, dan regangan CN Amida II 1544.01
Deformasi NH dan ikatan CH2
Amida III 1245.07 - - Struktur unting ganda tiga kolagen
Komposisi Asam Amino
Komposisi (jenis dan jumlah) asam amino pada contoh gelatin ditentukan dengan HPLC berdasarkan kesamaan waktu retensi dengan literatur (Zilhadia et
al. 2012) (Lampiran 7) dan nisbah luas puncak standar asam amino (Lampiran 8). Gelatin terlebih dahulu dihidrolisis menggunakan HCl 6 N sebelum diinjeksikan ke dalam HPLC. Standar asam amino dan contoh gelatin yang telah dihidrolisis kemudian diderivatisasi menggunakan pereaksi prakolom. Asam amino akan bereaksi dengan OPA dalam merkaptoetanol membentuk turunan asam amino-OPA-merkaptoetanol yang berfluoresens (Widyaninggar et al. 2012). Sistem pemisahan yang digunakan adalah sistem gradien. Komposisi eluen B diatur 5% dari awal elusi sampai waktu 2 menit. Setelah menit ke-2 hingga menit ke-20, komposisi eluen B dinaikkan menjadi 35%. Selanjutnya komposisi eluen B kembali dinaikkan menjadi 70% pada menit ke-22 dan 90% pada menit ke-25.
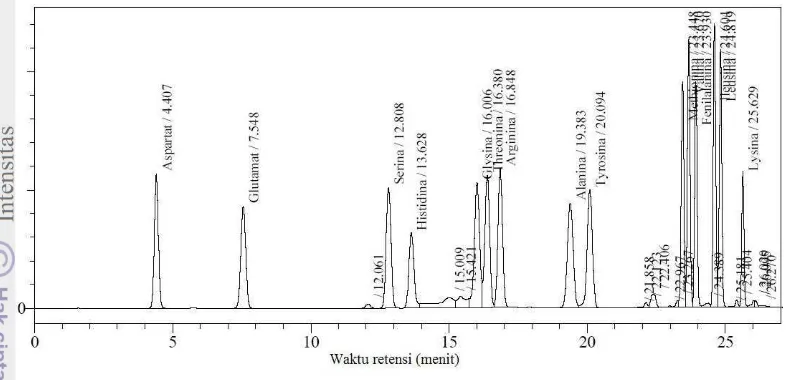
Gambar 5 Kromatogram standar asam amino
Kromatogram contoh gelatin (Lampiran 9) menunjukkan asam amino glisina paling banyak jumlahnya dengan %b/b sebesar 13.57% untuk isolat gelatin sapi, 0.51% untuk isolat gelatin babi, 15.09% untuk standar gelatin sapi, dan 15.37% untuk standar gelatin babi. Menurut Russel et al. (2007), gelatin tersusun dari ulangan deret asam amino Gly-x-y dengan glisina paling banyak jumlahnya, sedangkan x dan y sebagian besar diisi oleh asam amino prolina dan hidroksiprolina (Gambar 6). Standar asam amino yang digunakan tidak mengandung asam amino prolina dan hidroksiprolina sehingga tidak terdeteksi pada kromatogram contoh gelatin sapi dan babi hasil isolasi maupun standar.
Gambar 6 Struktur gelatin
Berdasarkan hasil penelitian Zilhadia et al. (2012), asam amino glisina terdeteksi pada waktu retensi sekitar 15.1 menit, sementara waktu retensi asam amino prolina kira-kira 23.8 menit (Lampiran 7). Keberadaan asam amino prolina pada keempat contoh gelatin tidak bisa dideteksi. Pada menit ke-23 asam amino yang muncul adalah fenilalanina (Lampiran 10). Hal ini dikarenakan kondisi alat seperti kolom dan fase gerak yang digunakan berbeda, sementara pola pemisahan asam amino sangat ditentukan oleh kolom dan komposisi fase gerak yang digunakan.
13
meskipun berasal dari spesies hewan yang sama. Komposisi asam amino selengkapnya ditunjukkan pada Tabel 5.
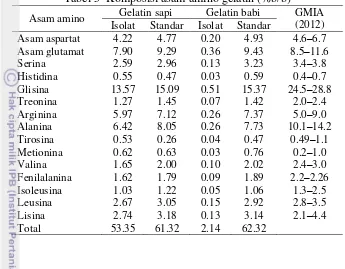
Tabel 5 Komposisi asam amino gelatin (%b/b) Asam amino Gelatin sapi Gelatin babi GMIA
(2012) Isolat Standar Isolat Standar
Asam aspartat 4.22 4.77 0.20 4.93 4.6–6.7 tahap demineralisasi yang belum sempurna, terlihat dari tingginya kadar abu gelatin (3.02%) dan kandungan mineral P (2.43% untuk gelatin sapi dan 0.27% untuk gelatin babi). Viskositas gelatin sapi hasil isolasi didapatkan sebesar 19 cP, dengan bobot molekul relatif 6.62×103 g/mol. Spektrum FTIR memiliki puncak pada daerah amida A (3600–2300 cm-1), amida I (1636–1661 cm-1) dan amida II (1560–1335 cm-1), yang merupakan serapan khas gelatin. Namun, pada daerah amida III (1300–1200 cm-1) masih muncul puncak pada gelatin sapi yang menunjukkan keberadaan struktur tropokolagen yang belum terhidrolisis. Komposisi asam amino glisina pada gelatin tulang sapi lebih banyak dibandingkan dengan gelatin tulang babi.
Saran
DAFTAR PUSTAKA
Al-Saidi GS, Al-Alawi A, Rahman MS, Guizani N. 2012. Fourier transform infrared (FTIR) spectroscopic study of extracted gelatin from shaari
(Lithirinus microdon) skin: effects of extraction conditions. IFRJ.
19(3):1167-1173.
[AOAC] Association of Official Analytical Chemists. 2005. Official Methods of
Analysis of AOAC International. Maryland (US): AOAC Int.
Bahtiyar MI. 2012. Pemanfaatan tulang sisa rumah makan, rumah potong hewan, dan rumah potong ayam sebagai bahan pembuat gelatin [karya tulis]. Yogyakarta (ID): Universitas Gajah Mada.
Fatimah D, Jannah K. 2008. Efektivitas penggunaan asam sitrat dalam pembuatan gelatin tulang ikan bandeng (Chanos-chanos forkskal) [skripsi]. Malang (ID): Universitas Islam Negeri Maulana Malik Ibrahim.
[GMIA] Gelatine Manufactures Institute of America. 2012. Gelatin Handbook. New York (US): GMIA.
Hasan. 2007. Studi ekstraksi dari pembuatan gelatin tipe B dari kulit sapi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Jamaludin MK, Zaki NM, Ramli MA, Hashim DM, Ab Rahman S. 2011. Istihalah: Analysis on the utilization of gelatin in food products. Soc Sci J. 16(17):174-178.
Karlina IR, Atmaja L. 2010. Eektraksi gelatin dari tulang rawan ikan pari
(Himantura gerrardi) pada variasi lariutan asam untuk perendaman
[skripsi]. Surabaya (ID): Institut Tekhnologi Sepuluh November.
Kusumawati R, Tazwir, Wawasto A. 2008. Pengaruh perendaman dalam asam klorida terhadap kualitas gelatin tulang kakap merah (Lutjanus sp.). JPBKP. 1(3):63-68.
Martianingsih N, Atmaja L. 2010. Analisis sifat kimia, fisik, dan termal gelatin dari ekstraksi kulit ikan pari (Himantura gerrardi) melalui variasi jenis larutan asam [skripsi]. Surabaya (ID): Institut Teknologi Sepuluh November.
Perwitasari DS. 2008. Hidrolisis tulang sapi menggunakan HCl untuk pembuatan gelatin. Di dalam: Pengolahan Sumber Daya Alam dan Energi Terbarukan.
Seminar Nasional Soemardjo Brotohardjono; 2008 Jun 18; Surabaya,
Indonesia. Surabaya (ID): UPN Veteran. hlm 1-9.
Puspawati MN, Simpen IN, Miwada INS. 2012. Isolasi gelatin dari kulit kaki ayam broiler dan analisis gugus fungsinya menggunakan spektrofotometri FTIR. J Chem. 6(1):79-87.
Raja MHRN, Yaakob CM, Amin I, Noorfaizan A. 2011. Chemical and functional properties of bovine and porcine skin gelatin. IFRJ. 18:813-817.
Reitz LL, Smith WH, Plumlee MP. 1960. A Simple Wet Ashing for Biological
Materials. Indiana (US): Purdue University West Lafayette.
Russell JD, Dolphin JM, Koppang MD. 2007. Selective analysis of secondary amino acids in gelatin using pulsed electrochemical detection. Anal Chem. 79:6615-6621.
15
Sopian I. 2002. Analisis sifat fisik, kimia, dan fungsional gelatin yang diekstrak dari kulit dan tulang ikan pari [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Taussky HH, Shorr E. 1953. A microcolorimetric method for the determination of inorganic phosphorus. J Biol Chem. 202:675-685.
Widyaninggar A, Triwahyudi, Triyana K, Rohman A. 2008. Differentiation between porcine and bovine gelatin in commercial capsule shells based on amino acid profiles and principal component analysis. J Pharm Indones.
23(2):96-101.
Yudiono H. 2003. Karakteristik fisikokimia gelatin hasil perendaman tulang sapi dalam campuran Ca(OH)2-CaCl2 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Yuniarifin H, Bintoro VP, Suwarasturi A. 2006. Pengaruh berbagai konsentrasi asam fosfat pada proses perendaman tulang sapi terhadap rendemen kadar abu dan viskositas gelatin. JITAA. 31(1):55-61.
Zilhadia, Betha OS, Bayyinah. 2012. Analisis komposisi asam amino gelatin sapi dan gelatin babi pada produk kapsul lunak simulasi menggunakan teknik kombinasi high performance liquid chromatography (HPLC) dan principal
component analysis (PCA) [skripsi]. Tangerang (ID): Universitas Islam
Lampiran 1 Perhitungan kadar air LAMPIRAN
%kadar air=bobot basah-bobot keringbobot basah ×100%
Contoh Bobot gelatin Kadar air (%)
Basah (g) Kering (g) Gelatin sapi
2.0006 1.8747 6.29
2.0003 1.8782 6.37
2.0007 1.8778 6.14
Rerata 6.27
Standar gelatin sapi
2.0009 1.7734 11.37
2.0003 1.7735 11.34
2.0005 1.7784 11.28
Rerata 11.33
Standar gelatin babi
2.0004 1.7761 11.21
2.0000 1.7944 11.06
2.0003 1.7788 11.07
Rerata 11.11
Contoh:
%kadar air= (2.0006-1.8747) g2.0006 g ×100%
%kadar air = 6.29% (ulangan 1)
%kadar air=(6.29+6.373 +6.14)%
17
Lampiran 2 Perhitungan kadar abu
%kadar abu=bobot gelatin ×100%bobot abu
Ccontoh Bobot Kadar abu (%)
Gelatin (g) Abu (g) Gelatin sapi
0.5000 0.0152 3.04
0.5000 0.0150 3.01
0.5002 0.0150 3.01
Rerata 3.02
Standar gelatin sapi
1.0002 0.0043 0.43
1.0002 0.0047 0.47
1.0001 0.0045 0.45
Rerata 0.45
Standar gelatin babi
1.0000 -0.0006 -
1.0000 0.0003 0.03
1.0002 0.0007 0.07
Rerata 0.05
Contoh:
%kadar abu=0.0152 g0.5000 g ×100%
%kadar abu= 3.04% (ulangan 1)
%kadar abu=(3.04 +3. 3 +3.01)%
Lampiran 3 Perhitungan kadar protein Contoh gelatin Bobot gelatin
19
[η] ialah viskositas intrinsik, yaitu intersep persamaan garis
21
Lampiran 5 Perhitungan kadar Ca
[Standar] (ppm) Absorbans
gelatin (g) Pengenceran Absorbans Kadar Ca (%) Gelatin sapi
Absorbans = 0.039274(Konsentrasi) + 0.0070402
%Ca = konsentrasi ×volume ×pengenceran
bobot gelatin ×100%
Gelatin sapi (ulangan 1)
Lampiran 6 Perhitugan kadar P
Absorbans = 0.1277(Konsentrasi) + 0.0116
%P = konsentrasi ×volume ×pengenceran
bobot gelatin ×100%
Gelatin sapi
0.381 = 0.1277(Konsentrasi) + 0.0116 Konsentrasi = 2.8927 ppm
0,00 1,00 2,00 3,00 4,00 5,00 6,00
Ab
23
Lampiran 7 Waktu retensi komponen asam amino dalam standar gelatin sapi dan babi menurut Zilhadia et al. (2012)
Asam amino Waktu retensi (RT)
Standar gelatin babi Standar gelatin sapi
Asam aspartat 11.878 11.881
Serina 13.171 13.177
Asam glutamat 13.999 13.997
Glisina 15.084 15.096
Histidina 15.672 15.677
Arginina 19.440 19.436
Treonina 19.994 20.002
Alanina 21.343 21.345
Prolina 23.795 23.799
Sisteina 27.283 27.283
Tirosina 27.334 27.338
Valina 28.303 28.307
Metionina 28.786 28.787
Lisina 30.941 30.947
Isoleusina 31.652 31.659
Leusina 32.098 32.105
Lampiran 8 Perhitungan komposisi (%) asam amino (AA)
%Asam amino = konsentrasi AA × Mr AA
bobot gelatin (µg) × 100%
Konsentrasi AA = luas puncak gelatin
luas puncak standar × konsentrasi standar
Contoh perhitungan konsentrasi asam aspartat gelatin sapi
Konsentrasi AA = 18052841
27939619 × 0.5 µmol/mL × 10 mL
= 0.323068 µmol
%Asam amino = 0.323068 µmol ×133.1 g/mol
10200 µg × 100%
25
Lampiran 9 Kromatogram gelatin sapi hasil isolasi (a), gelatin babi hasil isolasi (b), standar gelatin sapi (c), dan standar gelatin babi (d)
a
b
Lampiran 10 Hasil pemisahan asam amino (AA) Gelatin sapi Gelatin babi Standar gelatin
27
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 7 Desember 1989 dari Ayah Djufri Tandiassa dan Ibu Aminah Bullung. Penulis merupakan anak ke-2 dari 2 bersaudara.. Penulis lulus dari SMAN 13 Jakarta pada tahun 2008 dan diterima di Departemen Kimia Institut Pertanian Bogor.