i
UIN SYARIF HIDAYATULLAH JAKARTA
Perbandingan antara Metode
SYBR
Green
dan Metode
Hydrolysis
Probe
dalam Analisis DNA Gelatin Sapi dan
DNA Gelatin Babi dengan Menggunakan
Real
Time
PCR
SKRIPSI
AFIFAH NURUL IZZAH NIM : 1110102000014
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
Perbandingan antara Metode
SYBR
Green
dan Metode
Hydrolysis
Probe
dalam Analisis DNA Gelatin Sapi dan
DNA Gelatin Babi dengan Menggunakan
Real
Time
Polymerase Chain Reaction (PCR)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
AFIFAH NURUL IZZAH NIM : 1110102000014
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
ii UIN Syarif Hidayatullah Jakarta HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Afifah Nurul Izzah NIM : 1110102000014 Tanda Tangan :
Tanggal : 9 Oktober 2014
iii UIN Syarif Hidayatullah Jakarta HALAMAN PERSETUJUAN PEMBIMBING
Nama : Afifah Nurul Izzah
NIM : 1110102000014
Program Studi : Strata-1 Farmasi
Judul : Perbandingan antara Metode SYBR Green dan Metode
HydrolysisProbe dalam Analisis DNA Gelatin Sapi dan DNA Gelatin Babi dengan Menggunakan Real Time Polymerase Chain Reaction (PCR)
Disetujui Oleh:
Pembimbing 1 Pembimbing 2
Ofa Suzanti Betha, M.Si., Apt NIP: 19750104200912201
Zilhadia, M.Si., Apt NIP: 197308222008012007
Mengetahui,
Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
iv UIN Syarif Hidayatullah Jakarta HALAMAN PENGESAHAN SKRIPSI
Skripsi ini diajukan oleh
Nama : Afifah Nurul Izzah NIM : 1110102000014 Program Studi : Farmasi
Judul : Perbandingan antara Metode SYBR Green dan Metode Hydrolysis Probe dalam Analisis DNA Gelatin Sapi dan DNA Gelatin Babi dengan Menggunakan Real Time Polymerase Chain Reaction (PCR)
Telah berhasil dipertahankan dihadapan Dewan Penguji dan diterima sebagai bagian persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
DEWAN PENGUJI
Pembimbing I : Ofa Suzanti Betha, M.Si., Apt ( )
Pembimbing II : Zilhadia, M.Si., Apt ( )
Penguji I : Yuni Anggraeni, M.Farm., Apt ( )
Penguji II : Lina Elfita, M.Si., Apt ( )
Ditetapkan di : Ciputat
v UIN Syarif Hidayatullah Jakarta ABSTRAK
Nama : Afifah Nurul Izzah Program Studi : Farmasi
Judul Skripsi : Perbandingan antara Metode SYBR Green dan Metode
Hydrolysis Probe dalam Analisis DNA Gelatin Sapi dan DNA Gelatin Babi dengan Menggunakan Real Time Polymerase Chain Reaction (PCR)
Pemanfaatan gelatin secara luas menimbulkan kontroversi dan kekhawatiran bagi masyarakat muslim karena pada umumnya gelatin terbuat dari kulit babi dan sapi. Salah satu teknik analisis yang dapat membedakan gelatin sapi dan gelatin babi adalah Real Time PCR. Real Time PCR merupakan metode analisis berbasis DNA yang handal, efektif, dan terpecaya. Dalam analisa kualitatif dan kuantitatif, Real Time PCR membutuhkan pewarna fluoresens. Pewarna fluoresens yang umum digunakan pada Real Time PCR, yaitu SYBR Green dan Hydrolysis Probe. Telah dilakukan perbandingan antara metode SYBR Green dan Hydrolysis Probe dalam analisis DNA gelatin menggunakan Real Time PCR. DNA pada gelatin diekstraksi dan diisolasi menggunakan kit komersial. Isolat DNA gelatin sapi dan DNA gelatin
babi didapatkan sebanyak 19,38 ng/μl dan 13,63 ng/μl dengan kemurnian 1,566 dan
1,573. Isolat DNA dilakukan analisis dengan metode SYBR Green menggunakan suhu annealing 65oC untuk primer sapi dan suhu annealing 60oC untuk primer babi. Isolat DNA dianalisis dengan metode Hydrolysis Probe menggunakan suhu
annealing 60oC untuk primer babi dan primer sapi. Hasil analisis dari kedua metode menunjukkan bahwa metode Hydrolysis Probe mampu mengidentifikasi DNA pada gelatin secara spesifik dibandingkan menggunakan metode SYBR Green.
vi UIN Syarif Hidayatullah Jakarta ABSTRACT
Name : Afifah Nurul Izzah Major : Pharmacy
Title : Comparison of SYBR Green and Hydrolysis Probe methods in Analysis of Porcine Gelatin DNA and Bovine Gelatin DNA Using Real Time Polymerase Chain Reaction (PCR)
The wide usage of gelatin in various products led to continous controvercy among Muslim consumers because most of them are derived from porcine and bovine skin. One of the analytical techniques that can differentiate bovine gelatin and porcine gelatin is Real Time PCR. Real Time PCR is a DNA-based technology analysis which is a robust, effective, and reliable. In qualitative and quantitative analysis, there are two kinds methods popular of floresence dye. They are SYBR Greenand Hydrolysis Probe. In this study, we have perfomed a comparison between SYBR Green method and Hydrolysis Probe method in analysis Porcine gelatin DNA and Bovine gelatin DNA using Real Time PCR. The DNA is extracted and isolated by commercial kit. Porcine gelatine DNA and Bovine gelatin DNA obtained were 19.38 ng/μl and 13.63 ng/μl with purity were 1,566 and 1,573. Then, DNA isolates were analyzed by SYBR Green methods, with annealing temperature was 65oC using bovine primer and 60oC using porcine primer. While DNA is analyzed by Hydrolysis Probe methods, with annealing temperature was 60oC using both
porcine primer annd bovine primer. The result showed that Hydrolysis Probe is able to identify DNA of porcine and bovine gelatin with high specificity than SYBR Green.
vii UIN Syarif Hidayatullah Jakarta KATAPENGANTAR
Segala puji dan syukur kehadirat Allah SWT yang senantiasa mencurahkan segala rahmat-Nya kepada kita semua, khususnya penulis dalam menyelesaikan
skripsi yang berjudul “Perbandingan antara Metode SYBR Green dan Metode
HydrolysisProbe dalam Analisis DNA Gelatin Sapi dan DNA Gelatin Babi dengan Menggunakan Real Time PCR”. Shalawat dan salam senantiasa terlimpah kepada junjungan kita Nabi Muhammad SAW, teladan bagi umat manusia dalam menjalani kehidupan.
Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir guna mendapatkan gelar Sarjana Farmasi (S. Far) pada Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Selesainya penelitian dan penyusunan skripsi ini tidak lepas dari bantuan berbagai pihak, maka dalam kesempatan ini perkenankanlah penulis menyampaikan ucapan terimakasih yang tulus dan sebesar-besarnya, khususnya kepada:
1. Bapak Prof. Dr. (hc). Dr. MK.Tadjudin, Sp. And selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
2. Ibu Ofa Suzanti Betha, M.Si., Apt. sebagai Pembimbing I dan Ibu Zilhadia, M.Si., Apt. sebagai Pembimbing II yang sangat baik telah memberikan ilmu, nasehat, waktu, tenaga, pikiran, materi dan dukungan selama penelitian dan penulisan skripsi.
3. Bapak Drs.Umar Mansur, M.Sc., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Kedua orang tua, ayahanda tersayang Ali Mugiono dan ibunda tercinta Fahrida yang selalu ikhlas memberikan dukungan moral, material, nasehat-nasehat, serta lantunan doa yang tiada pernah putus di setiap hembusan nafas beliau hingga penulis dapat menyelesaikan studi di jurusan Farmasi FKIK UIN Syarif Hidayatullah Jakarta. Juga kepada kakakku tersayang Aini Zahra dan adikku tercinta Abdurrahman Marahimin yang selalu memberikan dukungan dan semangat
5. Bapak dan Ibu staf pengajar, serta karyawan yang telah memberikan ilmu pengetahuan, bimbingan dan bantuan selama penulis menempuh pendidikan di farmasi, FKIK UIN Jakarta
viii UIN Syarif Hidayatullah Jakarta 7. Kak Rahmadi, Kak Liken, Kak Eris, Kak Lisna, Kak Rani, Kak Tiwi, Kak Lilis, dan Kak Ai yang sangat banyak membantu penulis melakukan penelitian di laboratorium.
8. Teman-teman seperjuangan tim PCR: Yanti dan Kak Sulaiman yang selalu meluangkan waktunya untuk bekerja sama, berdiskusi, memberikan masukan, membantu penulis dalam melakukan peneltian, serta memberikan dukungan doa dan semangat kepada penulis dalam penyelesaian skripsi ini. Terimakasih atas kebersamaan yang indah ini.
9. Tim Roche Indonesia: Pak Deka, Pak Yos, dan Mbak Helen yang telah memberikan masukan dan bantuan selama penulis melakukan penelitian. 10.Sahabat tersayang “ngocol”: Dias, Zakiya, Ipho, Vicka, Diah, Amel, Dita, dan
Desi yang senantiasa mewarnai kehidupan selama dikampus. Terima kasih atas dukungan, kasih sayang, perhatian, doa dan persahabatan yang indah ini. 11. Farida, Yusna, Fahrur, Yuni, Deisy, Desti, Hanny, Liana, Delvina, Mayta,
Athiyah, Fathia, Dwikky, Hadi, Fikry, yang menginspirasi. Terimakasih atas dukungan dan semangatnya.
12. Dan kepada semua pihak yang telah membantu penulis selama ini yang tidak dapat disebutkan namanya satu persatu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah SWT. Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, saran dan kritik yang bersifat membangun akan penulis nantikan. Dan semoga skripsi ini bisa bermanfaat bagi pengembangan ilmu pengetahuan.
Jakarta, 14 Oktober 2014
ix UIN Syarif Hidayatullah Jakarta HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Afifah Nurul Izzah
NIM : 1110102000014
Program Studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
Perbandingan antara Metode SYBR Green dan Metode Hydrolysis Probe dalam Analisis DNA Gelatin Sapi dan DNA Gelatin Babi dengan
Menggunakan Real Time PCR
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada tanggal : Oktober 2014
Yang menyatakan,
x UIN Syarif Hidayatullah Jakarta
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... ix
DAFTAR ISI... x
2.1.1 Sifat Fisika Kimia Gelatin... 5
2.1.2 Struktur Kimia Gelatin... 7
2.1.3 Aplikasi dan Pemanfaatan gelatin... 7
2.2 Asam Nukleat... 8
2.2.1 DNA... 9
2.2.3.1 Struktur DNA... 9
2.2.3.2 Sifat Fisika DNA... 11
2.2.2 DNA Mitokondria... 12
2.3 Ekstraksi dan Isolasi DNA... 14
2.4 Elektroforesis Gel Agarosa... 16
xi UIN Syarif Hidayatullah Jakarta
BAB 3 Metodologi Penelitian... 26
3.1 Tempat dan Waktu Penelitian... 26
3.1.1 Tempat... 26
3.3.1 Ekstraksi dan Isolasi DNA... 27
3.3.2 Analisis Isolat DNA... 29
3.3.2.1 Analisis Isolat DNA dengan Elektroforesis Agarosa... 29
3.3.2.2 Analisis Isolat DNA dengan Spektrofotometri UV... 30
3.3.3 Uji Spesifisitas Primer dan Probe dengan Database NCBI... 31
3.3.4. Amplifikasi DNA Menggunakan Real Time PCR... 31
3.3.5.1 Amplifikasi DNA dengan Metode SYBR Green... 31
3.3.5.2 Amplifikasi DNA dengan Metode Hydrolysis Probe... 34
BAB 4 HASIL DAN PEMBAHASAN... 36
4.1 Hasil Analisis Isolat DNA... 36
4.1.1 Hasil Analisis Isolat DNA dengan Elektroforesis Agarosa... 36
4.1.2 Hasil Analisis Isolat DNA dengan Spektrofotometri UV... 37
4.2. Hasil Uji Spesifisitas Primer dan Probe dengan Database NCBI... 38
4.3 Hasil Amplifikasi DNA Gelatin Sapi dan Babi Menggunakan Real Time Polymerase Chain Reaction (PCR)... 40
4.3.1 Hasil Amplifikasi DNA Gelatin Sapi dan Babi Menggunakan Real Time PCR dengan Metode SYBR Green... 40
4.3.2 Hasil Ampifikasi DNA Gelatin Sapi dan Babi Menggunakan Real Time PCR dengan Metode Hydrolysis Probe... 46
BAB 5 KESIMPULAN DAN SARAN... 50
5.1 Kesimpulan... 50
5.2 Saran... 50
DAFTAR PUSTAKA... 51
xii UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR
Gambar 2.1 Metode Ekstraksi Gelatin dari Jaringan yang Mengandung
Kolagen... 5
Gambar 2.2 Struktur dan Asam Amino Penyusun Kolagen dan Gelatin... 6
Gambar 2.3 Komponen Asam Amino Penyusun... 7
Gambar 2.4 Struktur Nukleotida... 9
Gambar 2.5 Ikatan Fosfodiester pada DNA dan RNA... 10
Gambar 2.6 Struktur DNA... 11
Gambar 2.7 Struktur Mitokondria... 12
Gambar 2.8 Struktur DNA Mitokondria... 13
Gambar 2.9 Presipitasi DNA Setelah Penambahan Etanol Absolut... 15
Gambar 2.10 Interkalasi Etidium Bromida pada DNA... 18
Gambar 2.11 Tahapan Proses PCR... 19
Gambar 2.12 Pelipatgandaan Molekul DNA Target... 21
Gambar 2.13 Bentuk Kurva Real-TimePCR... 23
Gambar 2.14 Mekanisme Hydrolysis Probe dan SYBR Green... 25
Gambar 4.1 Hasil Elektroforesis Isolat DNA... 37
Gambar 4.2 Hasil Uji Spesifisitas Primer Babi pada Database NCBI... 39
Gambar 4.3 Hasil Uji Spesifisitas Primer Sapi pada Database NCBI... 39
Gambar 4.4 Kurva Amplifikasi dengan Metode SYBR Green Menggunakan Primer Sapi... 41
Gambar 4.5 Melting Peaks Hasil Amplifikasi dengan Metode SYBR Green Menggunakan Primer Sapi... 42
Gambar 4.6 Kurva Amplifikasi dengan Metode SYBR Green Menggunakan Primer Babi... 44
Gambar 4.7 Melting Peaks Hasil Amplifikasi dengan Metode SYBR Green Menggunakan Primer Babi... 45
Gambar 4.8 Kurva Amplifikasi dengan Metode Hydrolysis Probe Menggunakan Primer-Probe Sapi... 47
xiii UIN Syarif Hidayatullah Jakarta DAFTAR TABEL
Tabel 1 Kisaran Umum Konsentrasi Agarosa... 17
Tabel 2 Urutan Basa Primer-Probe... 27
Tabel 3 Pengaturan Program Amplifikasi dengan Metode SYBR Green... 32
Tabel 4 Pengaturan Program Amplifikasi dengan Metode Hydrolysis Probe.. 34
Tabel 5 Konsentrasi dan kemurnian DNA hasil isolasi... 38
Tabel 6 Campuran Reaksi SYBR Green Mastermix... 60
Tabel 7 Campuran Reaksi Hydrolysis Probe Mastermix... 60
xiv UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN
Lampiran 1 Kerangka Penelitian... 57
Lampiran 2 Perhitungan Pembuatan Larutan Primer dan Probe... 58
Lampiran 3 Perhitungan Tm (MeltingTemperature) Primer... 60
Lampiran 4 Campuran Reaksi Mastermix untuk Amplifikasi DNA... 61
Lampiran 5 Hasil Optimasi Suhu Annealing dengan Metode Gradien PCR. 62 Lampiran 6 Spesifikasi Kit Ekstraksi dan Isolasi DNA... 63
Lampiran 7 Hasil Kurva Amplifikasi dan Melting Peaks dengan Metode SYBR Green Menggunakan Primer Sapi dengan Suhu Annealing 20 detik dan Waktu Extension 30 detik... 69
Lampiran 13 Hasil Kurva Amplifikasi dan Melting Peaks dengan Metode SYBR Green Menggunakan Primer Babi dengan Waktu Annealing 20 detik dan Waktu Extension 25 detik... 70
Lampiran 14 Hasil Kurva Amplifikasi dengan Metode Hydrolysis Probe Menggunakan Primer Sapi... 71
Lampiran 15 Hasil Kurva Amplifikasi dengan Metode Hydrolysis Probe Menggunakan Primer Babi... 71
xv UIN Syarif Hidayatullah Jakarta DAFTAR SINGKATAN
BHQ-1 : Black Hole Quencher-1
BLAST : Basic Local Aligment Search Tool
CP : Crossing Point cyt b : Cytochrome b
dATP : Deoxyadenosine Triphosphate
dCTP : Deoxycytidine Triphosphate
dGTP : Deoxyguanosine Triphosphate
dNTP : Deoxyribonucleaside Triphosphate
dTTP : Deoxythymidine Triphosphate
DNA : Deoxyribonucleic Acid
ELISA : Enzyme-linked Immunosorbent Assay
FAM : Fluorescein Amidite
FTIR : Forier Transform Infrared Spectroscopy
LCMS : Liquid ChromatographyMass-Spectrophotometry
mtDNA : mitochondria DNA
NCBI : National Center for Biotechnology Information
NTC : No Template Control
PCR : Polymerase Chain Reaction
pb : Pasang Basa
qPCR : Quantitative Polymerase Chain Reaction
RE : Retikulum Endoplasma RNA : Ribonucleic Acid
SDS : Sodium Dodesil Sulfat
TAE : Tris-Acetate-EDTA Tm : Temperature Melting
xvi UIN Syarif Hidayatullah Jakarta DAFTAR ISTILAH
BLAST : Basic Local Aligment Search Tool merupakan program untuk menganalisis kesejajaran sekuen query (DNA atau protein) dengan sekuen DNA atau protein pada database
NCBI.
Blastn : Nucleotide Basic Local Aligment Search Tool merupakan salah satu variasi dari program BLAST untuk menganalisis kesejajaran nukleotida query dengan nukleotida pada
database di NCBI.
CP : Crossing Point merupakan siklus yang menunjukkan sinyal fluoresensi dari akumulasi amplikon telah melewati garis
threshold.
Garis Treshold : Garis penanda siklus awal dari reaksi PCR yaitu saat sinyal fluoresensi berada pada tingkat terendah ( siklus 3-15). Formasi Hairpin : Terbentuknya struktur loop/hairpin pada primer yang
disebabkan oleh interaksi intramolekular yang dapat memicu terbentuknya amplifikasi yang nonspesifik.
Melting curve : Analisis data pada Real-time PCR digunakan untuk menguji spesifisitas amplikon yanng terbentuk.
Mis-priming : Penempelan primer di luar sekuen target sehingga membentuk produk amplifikasi yang nonspesifik.
NCBI : National Center for Biotechnology Information merupakan suatu institusi milik United States National Library of Medicine yang berperan sebagai sumber informasi perkembangan biologi molekular. Situs NCBI berisi
database meliputi gene bank mengenai sekuens DNA atau protein serta memuat publikasi ilmiah.
NTC : No Template Control merupakan kontrol negatif karena well tidak dimasukkan DNA.
Primer-Dimer : Berikatannya suatu primer dengan primer sejenis atau dengan primer lainnya sehingga membentuk produk amplifikasi yang nonspesifik.
Query : Sekuen yang dimasukkan ke dalam program BLAST untuk diketahui kesejajarannya.
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1 LATAR BELAKANG
Gelatin adalah polipeptida larut air yang merupakan hasil hidrolisis
parsial kolagen dari kulit, tulang dan tulang rawan hewan (Zhang et al.,
2008). Gelatin memiliki sifat yang unik dan berbagai fungsi yaitu sebagai zat
pembentuk gel, zat pengental, zat pembentuk film, zat pengemulsi, dan zat
pensuspensi (Rowe, Sheskey & Quinn, 2009). Oleh karena itu gelatin
digunakan secara luas dalam berbagai sektor industri, misalnya sektor industri
farmasi, makanan, fotografi, kosmetik, dan produk kedokteran. Dalam
industri makanan, gelatin dapat ditemukan dalam produk ice cream, jelly,
dan marshmallow. Pada industri farmasi, gelatin digunakan dalam tablet,
cangkang kapsul keras dan lunak, tablet salut gula, enkapsulasi vitamin, dan
pensubtitusi plasma darah (Nhari, Ismail & Che Man, 2012).
Sumber gelatin yang beredar di pasaran berasal dari babi, sapi, tulang
ikan, kerang, rumput laut, dan lain-lain (Hinterwaldner, 1997; R.T. Jones,
2004). Produksi gelatin di dunia pada tahun 2007 dilaporkan bahwa 46%
berasal dari kulit babi; 29,4% dari kulit sapi; 23,1% dari campuran tulang
babi dan sapi; dan 1,5% dari tulang ikan, kerang, dan lain-lain (Guillen et al.,
2009). Pembuatan gelatin yang bersumber dari babi dan sapi lebih banyak
diminati karena gelatin yang dihasilkan memberikan kualitas yang lebih baik
dibandingkan dengan sumber lainnya seperti ikan (Hinterwaldner, 1997).
Gelatin umumnya masih diimpor dari negara-negara nonmuslim
sehingga menimbulkan kontroversi kehalalannya. Pemanfaatan gelatin dalam
berbagai bidang industri dan peningkatan kesadaran masyarakat muslim
terhadap penggunaan produk halal, menimbulkan konsekwensi perlunya
perlindungan konsumen dengan pemberian jaminan kehalalan sumber gelatin
(Jamaludin et al., 2012). Hal ini membutuhkan metode identifikasi gelatin
sapi dan gelatin babi yang handal, tepercaya, efektif, dan efisien.
UIN Syarif Hidayatullah Jakarta Keberadaan gelatin babi dan sapi pada produk pangan, kosmetik, dan
obat-obatan sangat sukar untuk diidentifikasi karena memiliki sifat fisik dan
kimia yang sangat mirip (Nemati et al., 2004). Oleh karena itu, perlu
diupayakan metode yang akurat untuk identifikasi gelatin sapi dan gelatin
babi. Metode identifikasi gelatin sapi dan gelatin babi telah banyak dilakukan
dan dikembangkan. Di antaranya dengan teknik presipitasi kimia (Hikada dan
Liu, 2003), FTIR (Hashim et al., 2010), LCMS (Zhang et al., 2008), ELISA
(Venien dan Levieux, 2005), dan analisis berbasis DNA dengan Real Time
PCR (Cai et al., 2011; Demirhan et al., 2011).
DNA merupakan molekul yang memiliki kestabilan tinggi, sehingga
analisis berbasis DNA dengan Real Time PCR dapat dilakukan pada produk
olahan. Selain itu, metode ini dapat mendeteksi campuran gelatin babi dan
gelatin sapi dengan level kontaminasi 1% (Cai et al., 2011; Demirhan et al.,
2011). Dengan metode ini, kita dapat mengamati secara langsung hasil
amplifikasi atau perbanyakan DNA fragmen. Metode ini juga dapat
menentukan konsentrasi DNA yang terdapat pada sampel dengan mengukur
peningkatan pewarna fluoresens yang berpendar ketika terikat dengan untai
ganda DNA (Arya et al., 2005). Dengan demikian, analisis kehalalan gelatin
dengan Real-Time PCR merupakan metode yang sederhana, handal dan
terpercaya (Cai et al., 2011).
Dalam mendeteksi dan identifikasi DNA pada sampel, Real Time PCR
membutuhkan pewarna fluoresens. Pewarna fluoresens yang umum
digunakan dalam Real-Time PCR adalah SYBR Green dan Hydrolysis Probe.
Pewarna fluoresens SYBR Green akan berpendar ketika terinterkalasi dengan
untai ganda DNA. Sedangkan fluoresens dari Hydrolysis Probe akan
berpendar ketika Probe, yang merupakan dua pewarna fluoresens (terdiri atas
Reporter dan Quencher), secara fisik terpisah melalui hidrolisis oleh aktivitas
nuclease (Arya et al., 2005). Dibandingkan Hydrolysis Probe, metode SYBR
Green lebih ekonomis dan mudah dalam penanganan. SYBR Green tidak
memerlukan Probe yang membutuhkan banyak biaya untuk mensintesisnya.
Namun demikian, SYBR Green sangat tergantung dari spesifisitas primer
UIN Syarif Hidayatullah Jakarta sehingga menyebabkan terbentuknya produk amplifikasi yang nonspesifik.
Sedangkan Hydrolysis Probe lebih mampu mencegah terjadinya produk
amplifikasi yang nonspesifik (Arya et al., 2005).
Pada penelitian ini akan dilakukan perbandingan antara metode SYBR
Green dan metode Hydrolysis Probe dalam analisis DNA gelatin sapi dan
DNA gelatin babi dengan menggunakan Real Time PCR.
1.2 RUMUSAN MASALAH
a. Belum diketahuinya efektivitas metode SYBR Green dan Hydrolysis
Probe dalam menganalisis DNA gelatin sapi dan gelatin babi
menggunakan Real Time PCR.
b. Belum diketahuinya apakah metode SYBR Green dan metode Hydrolysis
Probe secara spesifik dapat mengamplifikasi DNA gelatin sapi atau
gelatin babi.
1.3 TUJUAN PENELITIAN
Mengetahui perbandingan hasil analisis DNA gelatin sapi dan DNA
gelatin babi dengan metode SYBRGreen dan Hydrolisis Probe.
1.4 MANFAAT PENELITIAN
Hasil dari penelitian ini diharapkan dapat memberikan informasi
perbandingan metode SYBR Green dan metode Hydrolysis Probe dalam
analisis DNA gelatin sapi dan DNA gelatin babi, khususnya pada produk
UIN Syarif Hidayatullah Jakarta BAB 2
TINJAUAN PUSTAKA
2.1 Gelatin
Kata gelatin berawal dari bahasa latin “gelatus” yang berarti kaku
atau beku. Gelatin adalah polipeptida hasil hidrolisis parsial kolagen yang
diperoleh dari jaringan ikat, kulit, atau tulang rawan sapi dan babi. Proses
hidrolisis ini dapat dikatalisis dengan penambahan asam kuat atau basa kuat
(Rabadiya, 2013). Ketika kolagen diperlakukan dengan asam atau basa dan
diikuti dengan panas, struktur fibrosa kolagen dipecah ireversibel
menghasilkan gelatin. Gelatin dihasilkan melalui cross-linking (ikatan silang)
diantara rantai polipetida pada kolagen dengan disertai sejumlah perusakan
pada rantai ikatan peptida (Zhou dan Regenstein, 2004). Selain berasal dari
hewan mamalia, gelatin juga dapat diperoleh dari limbah tulang ikan.
Pembuatan gelatin merupakan upaya untuk mendayagunakan limbah tulang
yang biasanya tidak terpakai dan dibuang dirumah pemotongan hewan (Balti
et al., 2010).
Berdasarkan proses pembuatannya, gelatin dapat dikategorikan
dalam dua prinsip dasar (Jannah, 2008), yaitu:
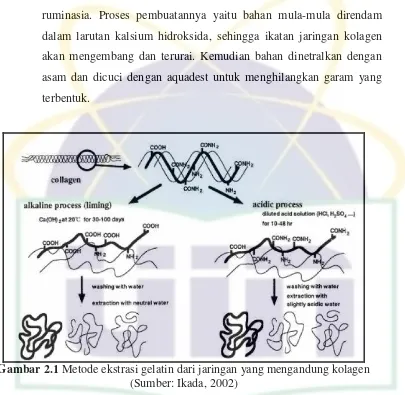
a. Gelatin Tipe A (Acid)
Gelatin ini dihasilkan dengan proses asam dari bahan baku kolagen.
Tipe A umumnya diperoleh dari kulit babi, tetapi ada juga beberapa
pabrik yang menggunakan bahan dasar tulang babi. Kulit dari babi
muda tidak memerlukan penanganan alkalis yang intensif, karena
jaringan ikatnya tidak terlalu kuat. Oleh karena itu, pada proses ini
kulit muda cukup direndam dengan asam klorida (HCl) encer selama
beberapa hari, kemudian dinetralkan dan dicuci beberapa kali dengan
aquadest agar garam yang terbentuk hilang.
b. Gelatin Tipe B (Base)
Gelatin tipe tipe ini dihasilkan melalui proses basa atau alkali. Bahan
dasar biasanya berasal dari kulit tua atau keras maupun tulang
UIN Syarif Hidayatullah Jakarta ruminasia. Proses pembuatannya yaitu bahan mula-mula direndam
dalam larutan kalsium hidroksida, sehingga ikatan jaringan kolagen
akan mengembang dan terurai. Kemudian bahan dinetralkan dengan
asam dan dicuci dengan aquadest untuk menghilangkan garam yang
terbentuk.
Gambar 2.1 Metode ekstrasi gelatin dari jaringan yang mengandung kolagen (Sumber: Ikada, 2002)
2.1.1 Sifat Fisika Kimia Gelatin
Fraksi protein pada gelatin hampir seluruhnya terdiri atas berbagai
macam asam amino yang bergabung melalui ikatan amida dan membentuk
polimer yang linear. Gelatin memiliki berat molekul yang bervariasi yaitu
20 kDa sampai 200 kDa. Kadar protein pada gelatin tinggi yaitu pada
gelatin kering (dengan kadar air 8 – 12%) mengandung protein sekitar 84 -
86% (Carr et al.,1995).
Gelatin komersial secara luas diproduksi di berbagai belahan dunia.
Di eropa, gelatin untuk pangan tersedia dalam bentuk lembaran tipis (flake),
sedangkan di Amerika Serikat gelatin dapat diperoleh dalam bentuk granul
atau serbuk. Gelatin tidak memiliki rasa dan bau. Warna serbuk granul dan
flakes pada gelatin yaitu putih agak kuning pucat. Pada bentuk lembaran,
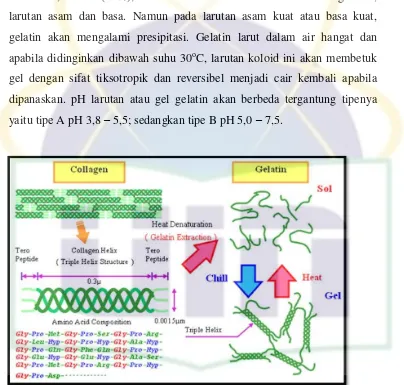
UIN Syarif Hidayatullah Jakarta Gelatin praktis tidak larut dalam pelarut organik seperti aseton,
kloroform, etanol (95%), eter dan metanol. Zat ini larut dalam gliserin,
larutan asam dan basa. Namun pada larutan asam kuat atau basa kuat,
gelatin akan mengalami presipitasi. Gelatin larut dalam air hangat dan
apabila didinginkan dibawah suhu 30oC, larutan koloid ini akan membetuk
gel dengan sifat tiksotropik dan reversibel menjadi cair kembali apabila
dipanaskan. pH larutan atau gel gelatin akan berbeda tergantung tipenya
yaitu tipe A pH 3,8 – 5,5; sedangkan tipe B pH 5,0 – 7,5.
Gambar 2.2. Struktur dan Asam Amino Penyusun Kolagen dan Gelatin (Sumber: http://www.gelatin.in)
Bloom (kekuatan gel)tergantung pada konsentrasi gelatin di dalam air,
berat molekul gelatin, dan pH gel. Bloom akan meningkat apabila
konsentrasi gelatin tinggi, berat molekul gelatin tinggi, dan pH gel yang
mendekati netral. Gelatin memiliki kekuatan Bloom yang bervariasi, yaitu
50 hingga 300. Industri gelatin umumnya mencampur bahan baku untuk
mendapatkan kekuatan gelyang diinginkan (Rabadiya, 2013).
2.1.2 Struktur Kimia Gelatin
Struktur gelatin terdiri dari 300 sampai 4.000 rantai asam amino yang
UIN Syarif Hidayatullah Jakarta amino spesifik yang berbeda dan bekerja sama berurutan untuk membentuk
rantai polipeptida dengan 1000 asam amino setiap rantai. Sebanyak 3 rantai
polipeptida terbentuk bekerja sama sebagai spiral sisi kiri untuk memberi
struktur sekunder. Dalam struktur tersier, spiral menggulung dan melipat
sendiri pada sisi kanan (triplehelix). Ini membentuk molekul berbentuk
tangkai yang disebut protofibril.
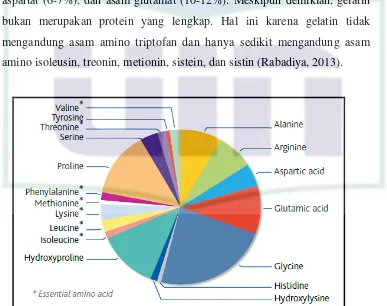
Rantai asam amino dominan yang terdapat dalam gelatin adalah glysin
(26-34%), prolin (10-18%) dan hidroksiprolin (7-15%). Jenis asam amino
lain terdapat dalam gelatin, yaitu alanin (8-11%), arginin (8-9%), asam
aspartat (6-7%), dan asam glutamat (10-12%). Meskipun demikian, gelatin
bukan merupakan protein yang lengkap. Hal ini karena gelatin tidak
mengandung asam amino triptofan dan hanya sedikit mengandung asam
amino isoleusin, treonin, metionin, sistein, dan sistin (Rabadiya, 2013).
Gambar 2.3. Komponen Asam Amino Penyusun Gelatin (Sumber: http://www.pbgelatins.com)
2.1.3 Aplikasi dan pemanfaatan gelatin
Gelatin merupakan bahan pangan yang telah lama digunakan
secara luas pada produk pangan dan farmasi. Gelatin tidak memiliki rasa
dan bau, akan tetapi gelatin memiliki sifat gel yang unik, sehingga dapat
digunakan sebagai penstabil, pengikat, dan pengemulsi dalam industri
UIN Syarif Hidayatullah Jakarta penstabil busa, yaitu dibutuhkan pada saat pembuatan permen. Bahan
pangan yang menggunakan gelatin antara lain cokelat, susu, permen, jelly,
roti, marshmallow, pada produk daging sebagai pengikat air, dan lain-lain.
Sedangkan penggunaan gelatin pada industri farmasi dan kedokteran
meliputi cangkang kapsul, salut tablet, zat pengemulsi dan penstabil dalam
pembuatan krim, mikroenkapsulasi, dan plasma pensubtitusi darah. Tidak
hanya pada industri pangan dan farmasi, gelatin juga dapat bermanfaat
pada bidang fotografi yaitu sebagai pelapis zat warna film.
Dari data SKW biosystem, penggunaan gelatin dalam industri
nonpangan sejumlah 100.000 ton, pada industri pembuatan film foto
sebanyak 27.000 ton, untuk kapsul lunak sebanyak 22.600 ton, untuk
produksi cangkang capsul keras sebanyak 20.200 ton, serta dalam dunia
farmasi dan teknis sebanyak 12.000 ton dan 6.000 ton. Penggunaan gelatin
dalam industri pangan adalah sebesar 154.000 ton, dimana penggunaan
terbesar adalah industri konfeksioneri yaitu sebesar 68.000 ton, dan produk
jelli sebanyak 36.000 ton. Pada industri daging dan susu memiliki jumlah
penggunaan gelatin yang sama yaitu 16.000 ton dan pada makanan
fungsional (food supplement) memeliki kontribusi penggunaan gelatin
yang sama yaitu sebesar 4.000 ton (LPPOM MUI, 2008).
2.2. Asam Nukleat
Asam nukleat dan protein merupakan senyawa polimer utama yang
terdapat pada sel. Asam nukleat berfungsi menyimpan dan mentransmisikan
informasi genetik dalam sel (Koolman & Roehm, 2005). Sel mempunyai
dua jenis molekul asam nukleat yaitu DNA (asam deoksiribonukleat) dan
RNA (asam ribonukleat). DNA menyimpan informasi genetik yang spesifik
untuk setiap individu dan spesies tertentu, yang akan diwariskan ke generasi
berikutnya (Gaffar, 2007). DNA ditemukan di dalam nukleus pada sel
eukariotik, dan ditemukan di sitoplasma atau nukleoid pada sel prokariotik.
Molekul RNA disintesis dari DNA template dan berperan dalam
UIN Syarif Hidayatullah Jakarta 2.2.1 DNA
2.2.1.1 Struktur DNA
DNA dan RNA merupakan polimer linier (polinukleotida) yang
tersusun dari subunit nukleotida. Nukleotida merupakan ester dari asam
fosfat dan nukleosida. Komponen penyusun nukleotida terdiri dari tiga
jenis molekul, yaitu gula pentosa (deoksiribosa pada DNA atau ribosa
pada RNA), basa nitrogen heterosiklik, dan gugus fosfat yang bermuatan
negatif (Gaffar, 2007).
Gambar 2.4. Struktur Nukleotida (Sumber: Gaffar, 2007)
Basa yang ditemukan pada nukleotida adalah basa purin (adenin =
A, guanin = G) dan basa pirimidin (cytosin = C, tymin = T, dan urasil =
U). Monomer nukleotida mempunyai gugus hidroksil pada posisi karbon
3’, gugus fosfat pada posisi karbon 5’ dan basa pada posisi karbon 1’
molekul gula. Nukleotida satu dengan yang lainnya berikatan membentuk
polinukleotida melalui ikatan fosfodiester antara gugus 5’fosfat dengan gugus 3’hidroksil. Sehingga tulang punggung molekul DNA dan RNA
terdiri dari gugus fosfat dan pentosa secara bergantian (Stansfield et al.,
2003).
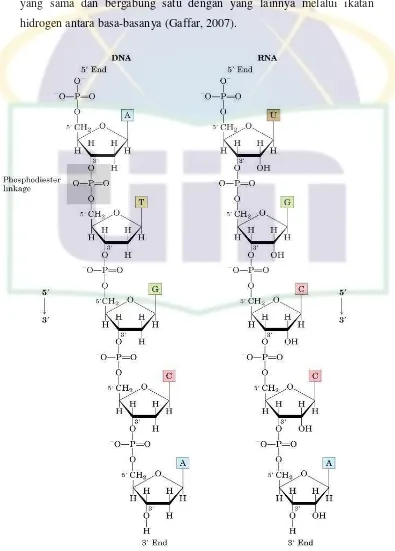
Struktur DNA mirip dengan struktur RNA. Perbedaan diantara
keduanya terdapat pada jenis gula dan basa pada monomernya serta
jumlah untai penyusunnya. DNA tidak terdapat gugus hidroksil pada
posisi karbon 2’ dari molekul gula (2-deoksiribosa) sementara pada RNA molekul gulanya adalah ribosa. Basa nitrogen yang terdapat pada DNA
UIN Syarif Hidayatullah Jakarta basanya adalah adenin, sitosin, guanin dan urasil. RNA merupakan
polinukleotida yang membentuk satu rantai/untai sedangkan DNA
merupakan polinukleotida yang membentuk 2 untai (heliks ganda) yang
memutar ke kanan. Kedua rantai polinukleotida memutar pada sumbu
yang sama dan bergabung satu dengan yang lainnya melalui ikatan
hidrogen antara basa-basanya (Gaffar, 2007).
UIN Syarif Hidayatullah Jakarta Pada DNA, basa guanin berpasangan dengan basa sitosin
membentuk tiga ikatan hidrogen, sedangkan basa adenin berpasangan
dengan basa tymin membentuk dua ikatan hidrogen. Sehingga dalam
molekul DNA jumlah basa G akan selalu sama dengan jumlah basa C,
sedangkan jumlah basa A sama dengan jumlah basa T. Kemudian jumlah
basa purin akan sama dengan jumlah basa pirimidin (Purves et al., 2004).
Gambar 2.6. Struktur DNA (Sumber: Purves et al., 2004)
Untai ganda DNA saling berkomplementasi melalui basa
penyusunnya dengan arah antiparalel (berlawanan 5’→ 3’ dan 3’→5’),
ujung yang mengandung gugus fosfat bebas disebut ujung 5’ sedangkan
pada ujung lainnya yang mengandung gugus hidroksil bebas disebut
ujung 3’. Kedua untai tersebut saling melilit satu sama lain membentuk
struktur heliks ganda. Gugus fosfat dan gula yang tersusun bergantian
menjadi tulang punggung (backbone) molekul DNA sementara pada
bagian dalam terdapat basa yang melekat pada molekul gula (Gaffar,
2007). Struktur helix ganda membentuk pilinan berjarak 3.4 nm dengan
sepuluh pasang basa setiap pilinan dan memiliki lebar sekitar 2 nm
(Stansfield, 2003).
2.2.1.2 Sifat Fisika DNA
Untai heliks DNA dapat memisah menjadi struktur untai tunggal
UIN Syarif Hidayatullah Jakarta sering dikenal dengan denaturasi. Denaturasi DNA bersifat reversible.
Proses pembentukan kembali struktur untai ganda dari keadaan
terdenaturasi disebut renaturasi. Proses renaturasi dapat berjalan jika suhu
mendekati suhu subdenaturasi (mendekati 60oC). DNA menyerap sinar
UV pada panjang gelombang 260 nm (Yuwono, 2009).
2.2.2 DNA Mitokondria
Mitokondria merupakan organel sel yang berfungsi sebagai penghasil
energi dalam bentuk ATP yang akan dipergunakan untuk aktivitas seluruh
sel-sel tubuh manusia. Mitokondria memiliki diameter sebesar 1-2 μm
(Passarge, 2007). Sel eukariotik rata-rata terdiri dari 103-104 salinan
mitokondria yaitu mencapai 25% volume sel. Mitokondria dikelilingi oleh
dua membran yaitu membran dalam dan membran luar. Membran bagian
dalam membentuk lipatan-lipatan yang disebut kristae dimana terdapat
enzim-enzim oksidase. Membran dalam juga memiliki permukaan yang
besar yang mengelilingi ruang matriks. Matriks ini mengandung DNA,
RNA, ribosom, dan berbagai enzim yang berperan dalam oksidasi zat-zat
makanan. DNA yang terdapat pada mitokondria disebut DNA mitokondria
atau disingkat menjadi mtDNA (Koolman dan Roehm, 2005).
Gambar 2.7. Sruktur Mitokondria (Koolman dan Roehm, 2005).
Umumnya, mitokondria terdiri dari 2-10 molekul DNA. mtDNA
merupakan DNA rantai ganda yang berbentuk sirkuler dengan ukuran
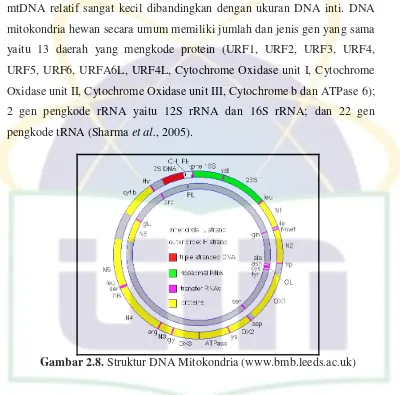
UIN Syarif Hidayatullah Jakarta mtDNA relatif sangat kecil dibandingkan dengan ukuran DNA inti. DNA
mitokondria hewan secara umum memiliki jumlah dan jenis gen yang sama
yaitu 13 daerah yang mengkode protein (URF1, URF2, URF3, URF4,
URF5, URF6, URFA6L, URF4L, Cytochrome Oxidase unit I, Cytochrome
Oxidase unit II, Cytochrome Oxidase unit III, Cytochrome b dan ATPase 6);
2 gen pengkode rRNA yaitu 12S rRNA dan 16S rRNA; dan 22 gen
pengkode tRNA (Sharma et al., 2005).
Gambar 2.8. Struktur DNA Mitokondria (www.bmb.leeds.ac.uk)
Karakteristik mtDNA dapat dijadikan alat yang signifikan untuk
keperluan analisis. mtDNA mempunyai jumlah copy yang tinggi, meskipun
di dalam sel yang tidak mengandung inti. Jumlah copy per sel yaitu sekitar
1000-10000 sehingga mtDNA dapat digunakan untuk analisis sampel
dengan jumlah DNA yang sangat terbatas, atau DNA yang mudah
terdegradasi, apabila analisis DNA inti tidak dapat dilakukan. mtDNA
manusia diturunkan secara maternal sehingga setiap individu pada garis
keturunan ibu yang sama akan mempunyai tipe mtDNA yang identik.
Ukuran DNA mitokondria relatif kecil (14-39 kb) sehingga dapat dipelajari
sebagai satu kesatuan yang utuh. mtDNA mempunyai laju polimorfisme
yang tinggi dengan laju evolusinya sekitar 5-10 kali lebih cepat dari DNA
UIN Syarif Hidayatullah Jakarta 2.3 Ekstraksi dan Isolasi DNA
Prinsip isolasi DNA adalah memisahkan DNA dari
komponen-komponen sel. Isolasi DNA dari organisme eukariotik dilakukan melalui
proses penghancuran membran sel (lisis), pemisahan DNA dari protein sel,
dan purifikasi DNA (Muladno, 2010). Berikut adalah uraian tahapan isolasi
DNA:
1. Penghancuran Membran Sel (lisis)
Untuk mendapatkan DNA, membran terlebih dahulu dilisiskan dengan
senyawa kimia seperti lisozim, EDTA, dan SDS. Lisozim merupakan
enzim yang dapat memakan dinding sel. Penggunaan Lisozim biasanya
untuk ekstraksi dan isolasi DNA dari sel tumbuhan. EDTA merupakan
zat yang dapat merusak membran sel dengan cara mengikat ion Mg2+
yang berfungsi untuk mempertahankan integritas sel maupun
mempertahankan aktivitas enzim nuklease yang merusak asam nukleat.
SDS (sodium dodesil sulfat) merupakan detergent yang dapat merusak
integritas membran sel dengan cara mengikat lipid yang terdapat pada
membran sel. Larutan pelisis sel umumnya terdiri atas satu atau lebih
detergent seperti SDS, NP-40, atau Triton X-100. Sel debris yang
ditimbulkan akibat cairan pelisis dilakukan setrifugasi sehingga hanya
tertinggal molekul nukleotida.
2. Pemisahan DNA dari Protein Sel
Protein pada sel dihancurkan dengan bantuan enzim proteinase K.
Enzim ini dapat memecahkan protein histon sehingga DNA terurai.
Untuk menghilangkan protein dari larutan, digunakan fenol (untuk
mengikat protein dan sebagian kecil RNA) dan kloroform (untuk
membersihkan protein dan polisakarida dari larutan). Umumnya
ditambahkan dengan perbandingan 1:1. Kemudian dilakukan
sentifugasi kembali untuk mengendapkan molekul yang berat, dan
dipisahkan DNA yang berada pada supernatant.
3. Purifikasi DNA
DNA yang telah dibersihkan dari protein masih tercampur dengan
UIN Syarif Hidayatullah Jakarta digunakan untuk mendegradasi molekul RNA. Dengan hilangnya
protein dan RNA, maka DNA dapat diisolasi secara utuh. Molekul
DNA yang telah diisolasi tersebut kemudian dimurnikan dengan cara
presipitasi menggunakan etanol absolut dan larutan garam. Dengan
adanya larutan garam (kation monovalen seperti Na+), pada suhu -20oC
etanol absolut dapat mengendapkan DNA dengan baik sehingga mudah
dipisahkan dengan cara sentrifugasi.
Gambar 2.9. Presipitasi DNA setelah Penambahan Etanol Absolut (Sumber: www.learn.genetics.utah.edu)
Pada umumnya isolasi DNA dengan metode konvensional yang
dijelaskan sebelumnya cukup melelahkan karena membutuhkan waktu hingga
beberapa jam bahkan beberapa hari. Selain itu, berkembang pesatnya
kebutuhan di bidang diagnostik molelular dan filogeni molekular yang
menuntut kecepatan, prosedur yang sederhana, hasil yang akurat dalam
ekstraksi DNA dari berbagai jenis sampel, menciptakan pengembangan
teknologi baru untuk pengektraksian DNA yang mudah dan lebih cepat dari
sebelumnya.
Salah satu pengembangan teknik purifikasi DNA adalah dengan
bantuan spin column yang mengandung silicon dioxide sebagai filter yang
dapat mengabsorpsi asam nukleat (Chee Tan dan Chin Yiap, 2009). Prinsip
ekstraksi dan isolasi DNA dengan metode ini adalah berdasarkan tingginya
afinitas muatan negatif dari rantai utama DNA terhadap partikel silika yang
UIN Syarif Hidayatullah Jakarta kondisi garam chaotropic seperti Guanidine-HCl. Garam ini dapat memecah
ikatan hidrogen antara ion oksigen pada DNA dengan ion hidrogen pada air.
DNA yang terabsorpsi oleh silika dapat dipisahkan dari protein dan sel debris
dengan pencucian. DNA murni kemudian dapat dielusi dari silika dengan
buffer Tris-EDTA atau Aquabidest (Gjerse et al., 2009).
2.4 Elektroforesis Gel Agarosa
Elektroforesis adalah suatu cara untuk memisahkan fraksi suatu
campuran berdasarkkan pergerakan partikel koloid yang bermuatan dibawah
pengaruh medan listrik. Cara elektroforesis telah digunakan untuk analisa
virus, asam nukleat, enzim, protein, serta molekul-molekul organik dengan
berat molekul rendah seperti asam amino (Westermeier, 2004).
Salah satu gel yang dapat digunakan pada elektroforesis adalah gel
agarosa. Agarosa digunakan untuk memisahkan, mengidentifikasi, dan
memurnikan fragmen-fragmen DNA dengan ukuran molekul lebih besar dari
100 pb dan dijalankan secara horizontal. Molekul DNA termasuk senyawa
bermuatan negatif. Sifat ini menjadikan molekul DNA yang ditempatkan
pada medan listrik akan bermigrasi menuju kutub positif
Mobilitas fragmen DNA pada gel elektroforesis sangat dipengaruhi oleh
beberapa faktor (Sambrook et al., 2001), yaitu:
1. Ukuran Molekul DNA
Migrasi DNA terutama ditentukan oleh ukuran panjang DNA.
Fragmen DNA yang berukuran kecil akan bermigrasi lebih cepat
dibandingkan dengan fragmen DNA yang berukuran lebih besar.
Sehingga elektroforesis mampu memisahkan fragmen berdasarkan
ukuran panjangnya.
2. Konsentrasi Agarosa
Migrasi molekul DNA pada gel berkonsentrasi lebih rendah lebih
cepat daripada migrasi molekul DNA yang sama pada gel
UIN Syarif Hidayatullah Jakarta Tabel 1. Kisaran umum konsentrasi agarosa (Muladno, 2010)
Konsentrasi
Konformasi atau bentuk rangkaian molekul DNA berukuran sama
akan bermigrasi dengan kecepatan yang berbeda. DNA dalam
bentuk sirkular akan lebih cepat bermigrasi dibandingkan dengan
DNA bentuk linier.
4. Voltase yang Digunakan
Kecepatan migrasi DNA sebanding dengan tingginya voltase yang
digunakan. Akan tetapi, apabila penggunaan voltase terlalu tinggi,
mobilitas molekul DNA meningkat secara tajam. Hal ini
mengakibatkan efektifitas pemisahan molekul DNA menurun
dengan meningkatnya voltase yang digunakan. Penggunaan voltase
yang ideal untuk mendapatkan separasi molekul DNA berukuran
lebih besar 2 kb adalah tidak lebih dari 5 Volt per cm.
5. Etidium Bromida
Keberadaan etidium bromida di dalam gel dapat mengakibatkan
pengurangan tingkat kecepatan migrasi molekul DNA linear sebesar
15%.
6. Komposisi Larutan Buffer
Apabila tidak ada kekuatan ion di dalam larutan, maka aliran listrik
akan sangat minimal dan migrasi DNA sangat lambat. Sementara
larutan buffer berkekuatan ion tinggi akan meningkatkan panas,
sehingga aliran listrik menjadi sangat maksimal. Ada kemungkinan
UIN Syarif Hidayatullah Jakarta Visualisasi fragment DNA dilakukan dengan penambahan larutan
etidium bromida yang akan masuk (interkalasi) di antara ikatan hidrogen pada
DNA, sehingga pita fragmen DNA akan terlihat di bawah lampu UV
Pita DNA yang berpendar pada gel agarosa menunjukkan hasil positif bahwa
terdapat DNA pada setiap lajur. Larutan etidium bromida sangat berbahaya
dan bersifat karsinogen, oleh karena itu semua larutan yang mengandung
etidium bromida harus didekontaminasi sebelum dibuang. Selain etidium
bromida, pewarnaan dapat dilakukan dengan larutan SYBR safe sebagai
penggantinya (Muladno, 2010; Sambrook dan Russel, 2001; Gaffar, 2007).
Gambar 2.10. Interkalasi Etidium Bromida pada DNA (Sumber: www.sciencemag.org)
2.5 PCR
2.5.1 Pengertian PCR
PCR (Polymerase Chain Reaction) merupakan suatu metode
amplifikasi DNA secara in vitro pada daerah spesifik yang dibatasi oleh
dua buah primer oligonukleotida dengan bantuan enzim polymerase,
dimana potongan DNA tertentu dapat dilipat gandakan (Zyskind dan
Bernstain, 1992). Metode ini paling banyak dipelajari dan digunakan
secara luas. Dalam waktu sembilan tahun sejak pertama kali dikemukakan
UIN Syarif Hidayatullah Jakarta menjadi teknik utama dalam laboratorium biologi molekuler, antara lain
untuk transkripsi in vitro dari PCR template, PCR rekombinan, DNAse I
footprinting, sequencing dengan bantuan phage promoters, dan sebagainya
(Putra, 1999).
Teknik ini memungkinkan adanya amplifikasi antara dua region
DNA yang diketahui, hanya di dalam tabung reaksi, tanpa perlu
memasukkannya ke dalam sel (in vivo). Primer yang digunakan sebagai
pembatas daerah yang diamplifikasi merupakan DNA untai tunggal yang
urutannya komplemen dengan DNA template-nya. Amplifikasi ini dapat
menghasilkan lebih dari satu kali DNA asli.
2.5.2 Tahapan PCR
Menurut Sambrook et al., (2001), tahapan yang terjadi dalam proses
amplifikasi DNA pada PCR yaitu pemisahan (denaturasi) rantai DNA
template, penempelan (annealing) pasangan primer pada DNA target dan
pemanjangan (extension) primer atau reaksi polimerisasi yang dikatalisis
oleh DNA polimerase.
Gambar 2.12. Tahapan Proses PCR (Sumber: www.bioserv.fiu.edu)
1.Denaturasi DNA template
Pada tahap ini, DNA untai ganda akan membuka menjadi dua
UIN Syarif Hidayatullah Jakarta tinggi menyebabkan putusnya ikatan hidrogen diantara basa-basa
yang komplemen. Denaturasi biasanya dilakukan antara suhu
90-95oC selama 3 menit untuk meyakinkan bahwa molekul DNA
target yang ingin dilipat gandakan jumlahnya benar-benar telah
terdenaturasi menjadi untai tunggal. Untuk denaturasi berikutnya,
waktu yang diperlukan hanya 30 detik pada suhu 95oC atau 15
detik pada suhu 97oC.
Suhu denaturasi dipengaruhi oleh sekuen DNA target. Jika
DNA target kaya akan G-C maka diperlukan suhu yang lebih
tinggi, hal ini dikarenakan ikatan hidrogen pada G-C lebih banyak
dibandingkan ikatan A-T. Selain itu, suhu denaturasi juga tidak
boleh terlalu tinggi dan waktu denaturasi yang terlalu lama, karena
dapat mengakibatkan hilangnya atau berkurangnya aktivitas enzim
Taq polymerase.
2. Penempelan Primer (annealing)
Primer akan menuju daerah yang spesifik, dimana daerah
tersebut memiliki komplemen dengan primernya. Pada proses
annealing ini, ikatan hidrogen akan terbentuk. Selanjutnya, enzim
Taq DNA polymerase akan berikatan sehingga ikatan hidrogen
tersebut akan menjadi sangat kuat dan tidak akan putus kembali.
Proses ini biasanya dilakukan pada suhu 50-60oC. Spesifisitas PCR
sangat tergantung pada suhu melting (Tm) primer, yaitu suhu
dimana separuh jumlah primer menempel pada template.
Temperatur penempelan yang digunakan biasanya 5oC di bawah
Tm, dimana formula untuk menghitung Tm = 4oC (G+C) + 2oC
(A+T). Semakin panjang ukuran primer, semakin tinggi
temperaturnya.
3. Reaksi polimerisasi (extension)
Primer yang telah menempel tadi akan mengalami
perpanjangan pada sisi 3' nya dengan penambahan dNTP yang
komplemen dengan template oleh DNA polimerase. Umumnya
UIN Syarif Hidayatullah Jakarta pada suhu 72oC karena merupakan suhu optimum Taq polymerase.
Kecepatan penyusunan nukleotida oleh enzim tersebut pada suhu
72oC diperkirakan antara 35 sampai 100 nukleotida per detik,
bergantung pada buffer, pH, konsentrasi garam, dan molekul DNA
target. Dengan demikian, untuk produk PCR sepanjang 2000
pasang basa, waktu 1 menit sudah lebih dari cukup untuk tahap
pemanjangan primer ini.
Ketiga tahapan tersebut terjadi dalam satu siklus. Produk DNA pada
siklus amplifikasi pertama akan menjadi cetakan pada siklus berikutnya.
Produk yang dihasilkan bersifat eksponensial (2n), dengan n adalah jumlah
siklus yang dilakukan (Keller dan Manak, 1989). Ini mengakibatkan PCR
sangat efektif karena dapat menghasilkan DNA dalam jumlah mikrogram
dari jumlah DNA awal dalam pikogram (Zyskind dan Bernstain, 1992).
Gambar 2.13. Pelipatgandaan Molekul DNA Target (Sumber: www.bioserv.fiu.edu)
2.5.3 Komponen PCR
Beberapa komponen penting yang dibutuhkan dalam PCR adalah
DNA template, primer, enzim Taq DNA Polymerase, deoxyribonucleaside
triphosphate (dNTP’s), dan buffer PCR. DNA template merupakan DNA
yang akan diamplifikasi, dapat berupa untai tunggal atau untai ganda.
UIN Syarif Hidayatullah Jakarta komposisi 50-60% C+G, sekuens DNA kedua primer tidak saling
berkomplemen yang akan menyebabkan terjadinya penempelan antar
primer (primer-dimer), dan sekuens DNA dalam satu primer tidak saling
berkomplemen yang akan mengakibatkan terbentuknya struktur sekunder
dan mengurangi efisiensi PCR. Deoxyribonucleaside triphosphate
(dNTP’s) merupakan bahan dasar pembentuk DNA yang terdiri dari dATP, dTTP, dGTP, dan dCTP. Taq DNA Polymerase berfungsi sebagai
katalisator terjadinya pemanjangan primer. Buffer PCR yang biasanya
terdiri atas bahan-bahan kimia untuk mengkondisikan reaksi agar berjalan
optimum dan menstabilkan enzim DNA polymerase. Ion Mg2+ yang
biasanya terdapat dalam buffer berfungsi sebagai kofaktor enzim.
Keberadaan ion ini sangat penting karena ion Mg2+ bebas akan mengikat
DNA template, primer dan membentuk kompleks terlarut dengan dNTP
untuk membuat subtrat yang akan dikenali oleh enzim Taq Polymerase
(Zyskind dan Bernstain, 1992).
2.6 Real-Time PCR
Real-Time PCR adalah suatu metoda analisa yang dikembangkan dari
reaksi PCR. Dalam ilmu biologi molekular, Real-Time PCR (juga dikenal
sebagai quantitative real time polymerase chain reaction (Q-PCR atau qPCR)
atau kinetic polymerase chain reaction) adalah suatu teknik pengerjaan PCR
di laboratorium untuk mengamplifikasi sekaligus mengkuantifikasi jumlah
target molekul DNA hasil amplifikasi tersebut.
Instrumen Real-Time PCR mendeteksi amplikon dengan mengukur
peningkatan pewarna (dye) fluorescent yang berpendar ketika terikat dengan
untai ganda DNA. Karena sifat inilah maka pertumbuhan fragment DNA
hasil amplifikasi dapat diikuti secara seketika, semakin banyak DNA yang
terbentuk semakin `tinggi pula intensitas fluorescent yang dihasilkan.
Alat ini dapat mendeteksi secara akurat konsentrasi DNA hingga
hitungan pikogram atau setara dengan sel tunggal karena sensitifitas dye yang
UIN Syarif Hidayatullah Jakarta amplifikasi yang menunjukkan tiga fasa yaitu fasa awal, fasa eksponensial
atau puncak dan fasa plateau atau stabil (Vaerman, 2004).
Gambar 2.14. Bentuk Kurva Real-Time PCR (Sumber: bio-rad.com)
2.6.1. Pewarna Fluoresensi
Real-time PCR menggunakan pewarna fluoresensi dan probe dengan
fluoresensi. Probe berupa oligonukleotida yang tersusun dari sekuen
spesifik dan akan berpasangan dengan sekuen DNA cetakan yang akan
diamplifikasi. Macam-macam fluoresensi yang umumnya digunakan
antara lain SYBR Green, Hydrolysis probes, Hybridization probes, dan
Molecular beacons. Fluoresensi akan berpendar hijau saat berikatan
dengan DNA cetakan (Kubista et al., 2006). Pewarna yang umum
digunakan adalah SYBR Green dan Hydrolysis Probe.
a. Hydrolysis Probe
Hydrolisis probe menggunakan oligonukleotida spesifik yang
berkomplemen dengan DNA target disebut Probe. Probe dilabeli
oleh dua molekul, yaitu reporter pada ujung 5’ probe yang
merupakan pewarna fluoresensi dan quencer pada ujung 3’ probe
yang merupakan molekul penerima sinyal fluoresensi. Hydrolysis probe memiliki prinsip kerja, yaitu saat probe belum
UIN Syarif Hidayatullah Jakarta mengeksitasikan sinyal fluoresensi ke molekul quencer karena
jarak antara kedua molekul berdekatan. Probe akan berkomplemen
dengan DNA target saat mencapai suhu annealing, lalu mekanisme
eksitasi sinyal fluoresensi dari reporter ke quencer terhenti karena
jarak kedua molekul berjauhan. DNA polimerase akan
mengelongasi DNA target sampai DNA polimerase dan probe
berdekatan maka 5’nuklease yang terdapat pada DNA polimerase
akan menghidrolisis molekul reporter sehingga emisi sinyal
fluoresensi dapat tertangkap oleh detektor pada Real Time PCR
(Shipley, 2007). Hydrolysis probe biasa digunakan dalam multiplex
pada qRT PCR yang menggunakan DNA target dan pasangan
primer lebih dari satu dalam satu reaksi karena probe akan
berikatan secara spesifik dengan beberapa DNA target yang
berbeda (BioRad, 2006).
b. SYBR Green
Prinsip dari SYBR Green adalah pewarna fluoresensi akan mengikat bagian minor dari untai ganda DNA sehingga menghasilkan
pendaran warna hijau pada akhir fase extension selama proses Real
Time PCR berlangsung (Shipley, 2007). Intensitas fluoresensi yang
semakin tinggi meenunjukkan peningkatan jumlah untai ganda
DNA yang terdeteksi oleh detektor. Intensitas fluoresensi yang
akan dihitung dalam analisis kualitatif maupun kuantitatif pada
qRT PCR. SYBR Green umumnya digunakan dalam singleplex
pada Real Time PCR yang menggunakan satu DNA target dan
sepasang primer. SYBR Green lebih sering digunakan dibandingkan
Hydrolisis probe karena memiliki beberapa keunggulan, yaitu
dapat digunakan untuk beberapa pengujian karena mampu bekerja
pada semua jenis primer, teknik pengujian lebih sederhana karena
tidak perlu merancang probe, dan harga pewarna fluoresensi yang
relatif lebih rendah (Shipley, 2007). SYBR Green memiliki
UIN Syarif Hidayatullah Jakarta pada bagian tidak spesifik sehingga primer-dimer juga akan diikat
oleh SYBR Green. Namun, produk tidak spesifik dapat dianalisis
keberadaannya dalam analisis melting curve (Valasek & Repa
,2005; Kubista et al., 2006).
UIN Syarif Hidayatullah Jakarta BAB 3
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian 3.1.1 Tempat
Penelitian ini dilaksanakan di Laboratorium Analisis Obat & Pangan
Halal; Laboratorium Penelitian 2; dan Laboratorium Biokimia/ Patologi
Klinis. Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri
Syarif Hidayatullah Jakarta.
3.1.2 Waktu
Waktu pelaksanaan penelitian dilakukan pada bulan Maret 2014
hingga September 2014.
3.2 Alat dan Bahan 3.2.1 Alat
Real Time PCR (Light Cycler® 480 - Roche), Multiwell Plate 96
(Roche), Sealing Foil (Roche), Mikropipet 0.5-10 μl (Biorad), Mikropipet
2-20 μl (Biorad), Mikropipet 20-200 μl (Biorad), Mikropipet 100-1000 μl
(Biorad), Microtips volume 10 μl; 200 μl; dan 1000 μl (Genfollower),
Spektrofotometri UV DNA (BioDrop), Gel Documentation (AE-6933
ATTO), satu set alat Elektroforesis Agarosa (Biorad), Digital Waterbath
(SB-100 Eyela), Vortex, Sentrifugator (5417R – Eppendorf), Filter Tube
dan Collection Tube (Kit High Pure PCR Template Preparation – Roche),
plastic wrap, alumunium foil, Microsentrifuge tube volume 1,5 ml
(Biogenix), pisau steril, kaca arloji, erlenmeyer 50 ml, dan spatula.
3.2.2 Bahan
Daging sapi segar, daging babi segar, gelatin sapi (Sigma Aldrich),
gelatin babi (Sigma Aldrich), Tris Base (SBS Genetech), asam asetat
glasial (Merck), EDTA (Merck), satu set reagen isolasi DNA meliputi
Tissue Lysis Buffer; Binding Buffer; Proteinase K; Inhibitor Removal
Buffer; Washing Buffer; dan Elution Buffer (Kit High Pure PCR Template
UIN Syarif Hidayatullah Jakarta
Preparation - Roche), Aquabidest (IKA Pharmindo), Etanol Absolut
(Merck), Isopropanol (Merck), Etidium Bromida 10 mg/ml (Bio Basic
Inc.), Agarosa (Fermentas), loading dye (Promega), SYBR Green I Master
(LC 480 - Roche), Probe Master (LC 480 - Roche), Aquadest (PCR Grade
- Roche) dan Primer-probe (Alpha DNA).
Tabel 3. Urutan Basa Primer dan Probe (Tanabe et al., 2007)
Nama Primer Runutan Basa
Babi Forward 5'-CTTGCAAATCCTAACAGGCCTG-3'
Reverse 5'-CGTTTGCATGTAGATAGCGAATAAC-3'
Probe 5'-(FAM)-ACAGCTTTCTCATCAGTTAC-(BHQ1)-3' Sapi Forward 5'-CCCGATTCTTCGCTTTCCAT-3'
Reverse 5'-CTACGTCTGAGGAAATTCCTGTTG-3'
Probe 5'-(FAM)-CATCATAGCAATTGCC-(BHQ1)-3'
3.3 Prosedur Penelitian
3.3.1 Ekstraksi dan Isolasi DNA
Proses ekstraksi dan isolasi DNA dilakukan dengan menggunakan kit
komersial High Pure PCR Template Preparation (Roche).
1. Preparasi Sampel
a. Daging Segar (Rochea, 2012; Erwanto et al., 2012)
Sebanyak 50 mg masing-masing daging sapi segar dan daging babi
segar dicincang halus dengan pisau steril. Masing masing daging
tersebut dimasukkan ke dalam microsentrifuge tube. Kemudian ke
dalam tube tersebut masing-masing ditambahkan 200 μl Tissue Lysis
Buffer dan 40 μl larutan Proteinase K. Campuran divortex selama 1
menit dan diinkubasi pada suhu 57oC selama 20 jam dalam digital
waterbath. Larutan daging yang dihasilkan selanjutnya dilakukan
proses ekstraksi dan isolasi DNA.
b. Gelatin (Rochea, 2012; Erwanto et al., 2012)
Sebanyak 50 mg masing-masing gelatin sapi dan gelatin babi
ditimbang dan dimasukkan ke dalam microsentrifuge tube. Kemudian
ke dalam tube tersebut masing-masing ditambahkan 100 μl
UIN Syarif Hidayatullah Jakarta Campuran divortex selama 1 menit dan diinkubasi pada suhu 57oC
selama 20 jam dalam digital waterbath. Larutan daging yang
dihasilkan selanjutnya dilakukan proses ekstraksi dan isolasi DNA.
2. Proses Ekstraksi dan Isolasi DNA (Rochea, 2012 dengan modifikasi)
Larutan daging sapi, daging babi, gelatin sapi dan gelatin babi yang
telah dinkubasi sebelumnya selama 20 jam, masing-masing ditambahkan
200 μl larutan Binding Buffer. Campuran divortex segera selama 10 detik dan diinkubasi kembali pada suhu ± 70oC selama 10 menit dalam digital
waterbath.
Ke dalam masing-masing tube tesebut kemudian ditambahkan 150
μl isopropanol absolut dan dihomogenkan dengan vortex selama 10 detik. Campuran dipipet dan dimasukkan ke dalam Filter Tube yang telah
dipasangkan Collection Tube. Kemudian tube ditutup dan disentrifugasi
pada kecepatan 8000 rpm selama 1 menit.
Filter tube dilepaskan dari collection tube dan cairan yang
melewati filter dibuang bersamaan collection tube. Filter tube
dipasangkan kembali dengan collection tube yang baru. Kemudian 500 μl
Inhibitor Removal Buffer ditambahkan melalui penyangga atas Filter
Tube dan disentrifugasi kembali dengan kecepatan 8000 rpm selama 1
menit. Filter tube dilepaskan dari collection tube dan cairan yang
melewati filter dibuang bersamaan collection tube. Filter tube
dipasangkan kembali dengan collection tube yang baru. Kemudian 500 μl
Washing Buffer ditambahkan dan disentrifugasi kembali pada kecepatan
8000 rpm selama 1 menit. Pencucian dengan Washing Buffer dilakukan
sekali lagi. Setelah itu, filter tube dilepaskan dari collection tube dan
cairan yang melewati filter dibuang. Filter tube dipasang kembali dengan
collection tube dan disetrifugasi kembali selama 10 detik pada kecepatan
maksimum agar semua Washing Buffer tidak tertinggal pada filter.
3. Elusi DNA (Rochea, 2012 dengan modifikasi)
Filter tube dan Collection tube yang telah disentrifugasi pada
UIN Syarif Hidayatullah Jakarta tube. Collection tube dibuang dan Filter tube tersebut kemudian
dipasangkan pada Microsentrifuge tube steril. Ke dalam filter yang
mengandung DNA daging sapi dan daging babi, masing-masing
ditambahkan 200 μl Elution Buffer hangat (70oC). Sedangkan ke dalam filter yang mengandung DNA gelatin sapi dan DNA gelatin babi,
masing-masing ditambahkan 150 μl Elution Buffer hangat (70oC).
Filter dan Microsentrifuge tube yang telah ditambahkan Elution
Buffer kemudian disetrifugasi selama 1 menit pada kecepatan 8000 rpm.
Filter tube dilepaskan dari Microsentrifuge tube. Pada Microsentrifuge
tube telah mengandung isolat DNA. Isolat DNA yang didapatkan
dianalisis keberadaannya dengan elektroforesis agarosa dan dianalisis
konsentrasi dan kemurnian DNA dengan spektrofotmetri UV.
3.3.2 Analisis Isolat DNA
3.3.2.1 Analisis Isolat DNA dengan Elektroforesis Agarosa
a. Pembuatan Buffer Elektroforesis TAE 10x, 1 liter (Biorad, 2012)
Sebanyak 48,4 g Tris Base dilarutkan dalam 800 mL aquabidest. Ke dalam larutan tersebut ditambahkan 11,4 mL asam asetat glasial dan
20 ml 0,5 M EDTA pH 8. Larutan dihomogenkan dan dimasukkan ke
dalam labu ukur 1000 ml. Kemudian ke dalam labu ukur tersebut
ditambahkan aquabidest sampai tanda batas.
b. Pembuatan Buffer Elektroforesis TAE 1x, 1 liter (Biorad, 2012)
Sebanyak 100 ml TAE 10x dimasukkan ke dalam labu ukur 1000
ml dan ditambahkan aquabidest sampai tanda batas. Larutan tersebut
kemudian dihomogenkan.
c. Pembuatan Gel Agarosa 1% (Sambrook et al., 2001)
Sebanyak 0,5 g agarosa dilarutkan dengan 50 mL TAE 1x di
dalam erlenmeyer. Erlenmeyer ditutup dengan alumunium foil,
kemudian dipanaskan di atas hot plate sampai larutan menjadi bening
dan mendidih. Larutan agarosa didiamkan hingga suhu 60oC dan
ditambahkan 2,5 μL etidium bromida 10 mg/ml, kemudian larutan