ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH
JERUK PEPAYA (Citrus medicaL varproper) DENGAN
GC-MS DANUJI ANTIOKSIDAN
MENGGUNAKAN METODE
DPPH
SKRIPSI
SUTRISNO MARSIUS
120822012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH
JERUK PEPAYA (Citrus medicaL varproper) DENGAN
GC-MS DANUJI ANTIOKSIDAN
MENGGUNAKAN METODE
DPPH
SKRIPSI
Diajukan Untuk Melengkapi Tugas Dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
SUTRISNO MARSIUS
120822012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH JERUK PEPAYA(Citrus
medica Lvar proper) DENGAN
GC-MSDANUJIANTIOKSIDANMENGGUNAKAN METODE DPPH
Kategori : SKRIPSI
Nama : SUTRISNO MARSIUS
Nomor Induk Mahasiswa : 120822012
Program : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas :MATEMATIKA DAN ILMU
PENGERTAHUANALAM (FMIPA) UNIVERSITAS SUMATERAUTARA
Disetujui di
Medan , Juni2015
Komisi Pembimbing
Pembimbing 2, Pembimbing 1,
Drs. Johannes M. Simorangkir, M.S Drs.Philippus H. Siregar, M.Si NIP. 195307141980031004NIP. 195805041986011002
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH JERUK PEPAYA (Citrus medica Lvar proper) DENGAN
GC-MS DAN UJI ANTIOKSIDAN MENGGUNAKAN METODE
DPPH
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan , Juni 2015
PENGHARGAAN
Terima Kasih yang sebesar-besarnya kepada Tuhan Yesus Kristus dimana karena berkat dan rahmatNya, penulis dapat melakukan segala hal, sehingga penulis juga dapat menyelesaikan perkuliahan dan penulisan karya ilmiah ini, yang merupakan salah satu syarat untuk menyelesaikan studi program Sarjana (S-1) Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara dengan judul “Analisis Komponen Kimia Minyak Atsiri Kulit Buah Jeruk Pepaya (Citrus Medica L var. Proper) dengan GC-MS dan Uji Antioksidan menggunakan metode DPPH”
Selesainya karya ilmiah ini tidak terlepas dari bantuan dan bimbingan dari berbagai pihak. Oleh karena itu, dengan kerendahan hati penulis mengucapkan terima kasih banyak kepada Bapak Drs.Philippus Siregar M.Si selaku Dosen Pembimbing I serta Bapak Drs.Johannes M. Simorangkir M.Si selaku Dosen Pembimbing II yang telah meluangkan waktunya memberikan arahan dan mendampingi penulis melakukan penelitian dan menyelesaikan Skripsi ini hingga selesai. Penulis juga berterima kasih kepada Ibu Dr. Rumondang Bulan, M.S selaku Ketua Departemen Kimia dan Bapak Albert Pasaribu, M.Sc selaku sekretaris Departemen Kimiakepada seluruh staff pengajar di Departemen Kimia FMIPA USU yang telah membimbing penulis selama perkuliahan, juga kepada Dekan, pembantu Dekan dan seluruh pegawai di lingkungan FMIPA USU.
Penulis juga mengucapkan terima kasih kepada Ibu tercinta Revina Sinambela yang telah memberikan dukungan baik moril maupun materil serta selalu membantu penulis didalam doa, kakak dan abang tersayang yang memberika dukungan kepada penulis, Iis Apriance Simare-mare yang selalu menyemangati penulis dalam melakukan penelitian dan penulisan skripsi serta kepada teman-teman sekalian.
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH JERUK PEPAYA (Citrus medica Lvar proper) DENGAN GC-MS DAN UJI
ANTIOKSIDANMENGGUNAKAN METODE DPPH
ABSTRAK
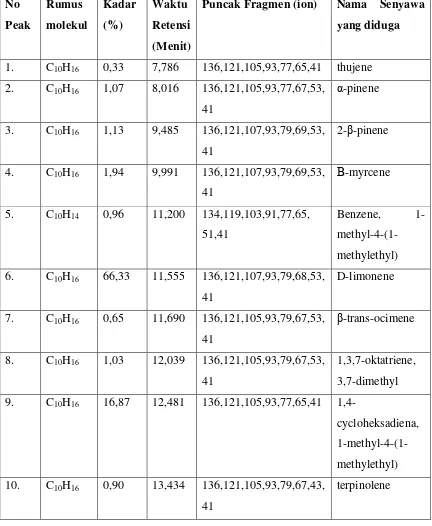
Telah dilakukan analisis komponen kimia minyak atsiri kulit buah jeruk pepaya (C. medica L var proper) dengan destilasi Stahl dan analisa GC-MS . Komponen minyak atsiri yang dominan adalah D-Limonene (66,33%), 1,4-Cycloheksadiena
(16,87%), Nerol (3,07%), β-Myrcene (1,94%), 2-β-Pinene (1,13%), α-Pinene (1,07%), 1,3,7-Octatriene (1,03%). Selanjutnya, minyak atsiri kulit buah jeruk pepaya ditentukan aktivitas antioksidannya dengan metode DPPH radikal bebas. Nilai IC50 yang diperoleh adalah 183,85��/�. Hal ini menunjukkan bahwa
minyak atsiri kulit buah jeruk pepaya memiliki sifat antioksidan.
ANALYSIS OF CHEMICAL COMPONENTS OF ESSENTIAL OIL KULIT
BUAH JERUK PEPAYA (Citrus medica L var proper) WITH GC-MS AND
ANTIOXIDANT ACTIVITY TEST USING DPPH METHOD
ABSTRACT
Had been analysis of chemical components essential oil kulit buah jeruk pepaya (C. Medica L var Proper) with Stahl distillation and GC-MS analysis. The dominant constituents of the essential oil such as D-Limonene (66,33%),
1,4-Cycloheksadiena (16,87%), Nerol (3,07%), β-Myrcene (1,94%), 2-β-Pinene (1,13%), α-Pinene (1,07%), 1,3,7-Octatriene (1,03%). Furthermore , the essential oil of kulit buah jeruk pepaya was determined antiokxidant activitesfound by the methode of radicals DPPH. IC50 values which obtained respectively is 183,85
��/�. This shows that the essential oil of kulit buah jeruk pepaya have antioxidant properties.
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
BAB I PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
1.5. Metodologi Penelitian 3
1.6. Lokasi Penelitian 4
BAB II TINJAUAN PUSTAKA
2.1. Jeruk Pepaya 5
2.1.1. Klasifikasi Tanaman Jeruk Pepaya 6
2.1.2. Manfaat Kulit Buah Jeruk Pepaya 7
7 2.2. Minyak Atsiri 7
2.2.1. Penggolongan Minyak Atsiri 9
2.2.2. Sumber Minyak Atsiri 12
2.2.3. Khasiat dan Manfaat Minyak Atsiri 14
2.2.4. Ekstraksi Minyak Atsiri 16
2.2.5. Isolasi Minyak Atsiri dengan Destilasi 17 2.2.6. Komponen Kimia Minyak Atsiri 18 2.3. Analisa Komponen Kimia Minyak Atsiri 19 2.3.1. Kromatografi Gas-Spektroskopi Massa (GC-MS) 19
2.4. Antioksidan 22
2.4.1. Pengertian Antioksidan 22
2.4.2. Uji Aktivitas Antioksidan 23
2.4.3. Metode Pengukuran Aktivitas 24 Antioksidan Dengan Metode DPPH
BAB III METODOLOGI PENELITIAN
3.1. Alat-alat 29
3.3. Prosedur Penelitian 30 3.3.1. Penyediaan Sampel 30 3.3.2. Destilasi Kulit Buah Jeruk Pepaya (Sampel) 30 3.3.3. Analisa Minyak Atsiri Kulit Buah Jeruk Pepaya 30 Dengan GC-MS
3.3.4. Uji Sifat Antioksidan Minyak Atsiri
Kulit Buah Jeruk Pepaya Dengan Metode DPPH 31
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM 31 3.3.4.2. Pembuatan Variasi Minyak Atsiri 32
Kulit Buah Jeruk Pepaya 3.3.5. Uji Aktivitas Antioksidan
3.3.5.1. Larutan Blanko 32
3.3.5.2. Uji Aktivitas Antioksidan Minyak Atsiri 32 Kulit Buah Jeruk Pepaya
3.4. Bagan Penelitian 33
3.4.1. Isolasi Minyak Atsiri Rimpang Jahe Merah 33 Dengan Destilasi Stahl
3.4.2. Uji Sifat Antioksidan Minyak Atsiri 34 Kulit Buah Jeruk PepayaDengan Metode DPPH
3.4.2.1. Pembuatan Larutan DPPH 0,3 mM 34 3.4.2.2. Pembuatan Variasi Minyak Atsiri 35
Kulit Buah Jeruk Pepaya
3.4.3. Uji Aktivitas Antioksidan 36
3.4.3.1. Uji Blanko 36
3.4.3.2. Uji Aktivitas Antioksidan Minyak Atsiri 36 Kulit Buah Jeruk Pepaya
BAB IV HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 37
4.1.1. Hasil Isolasi Minyak Atsiri Kulit Buah Jeruk Pepaya 37 4.1.2. Hasil Uji Aktivitas Minyak Atsiri 40 Kulit Buah Jeruk Pepaya
4.2. Pembahasan 41
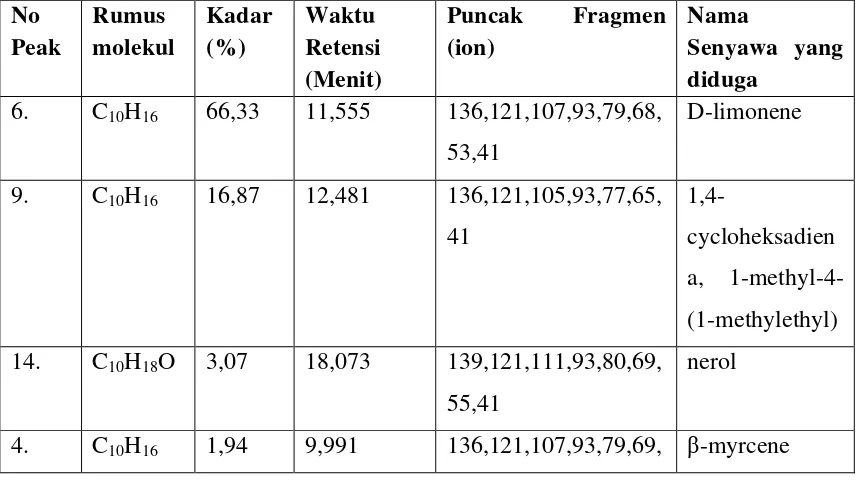
4.2.1. Minyak Atsiri Dari Hasil Destilasi Alat Stahl 41 4.2.2. Analisis Spektrum Massa Minyak Atsiri 41 Kulit Buah Jeruk Pepaya
4.2.3. Uji Aktivitas Minyak Atsiri Kulit Buah jeruk Pepaya
Dengan Metode DPPH 56
BAB V KESIMPULAN DAN SARAN
5.1. Kesimpulan 59
5.2. Saran 59
DAFTAR PUSTAKA 60
DAFTAR TABEL
Nomor Judul Halaman
Table
Tabel 2.1. Klasifikasi Senyawa Terpenoid 11
Tabel 2.2. Aktivitas Biologis Minyak Atsiri Yang Sering digunakan 15 Untuk Terapi-Aroma
Tabel 4.1. Minyak Atsiri Kulit Buah Jeruk Pepaya 37 Yang Diperoleh Dengan Metode Hidrodestilasi
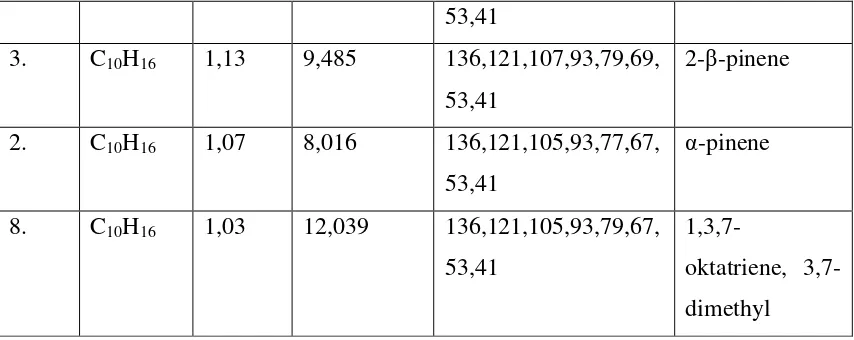
Tabel 4.2. Hasil Senyawa Analisis GC-MS Minyak Atsiri 38 Kulit Buah Jeruk Pepaya
Tabel 4.3. Senyawa Hasil Analisis GC-MS Minyak Atsiri 39 Kulit Buah Jeruk Pepaya Sesuai dengan Standart Library Tabel 4.4. Hasil pengukuran Absorbansi Minyak Atsiri 40
Kulit Buah Jeruk Pepaya
DAFTAR GAMBAR Minyak Atsiri Kulit Buah Jeruk Pepaya
Gambar 4.2. Spektrum Massa D-Limonene 42
Gambar 4.11. Pola Fragmentasi Yang Mungkin Dari Senyawa 51
β-Pinene
Gambar 4.12. Spektrum Massa α-Pinene 52
Gambar 4.13. Pola Fragmentasi Yang Mungkin Dari Senyawa 53
α-Pinene
Gambar 4.14. Spektrum Massa 1,3,7-Octatriene 54 Gambar 4.15. Pola Fragmentasi Yang Mungkin Dari Senyawa 55
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
Lampiran 1. Pembuatan Variasi Konsentrasi Sample 62 Lampiran 2. Hasil Uji Aktivitas Antioksidan 63
Lampiran 3. Perhitungan nilai IC50 64
Lampiran 4, Grafik % Peredaman Vs Konsentrasi (ppm) 66 Lampiran 5. Data Hasil GC-MS Minyak Atsiri Kulit Buah 67
Jeruk Pepaya
Lampiran 6. Data Hasil Uji Aalisa GC-MS Yang Sesuai 68 Standart Library
Lampiran 7. Gambar Alat Stahl 75
Lampiran 8. Gambar Alat UV-Visible 75
Lampiran 9. Gambar Uji Aktivitas Antioksidan 76
ANALISIS KOMPONEN KIMIA MINYAK ATSIRI KULIT BUAH JERUK PEPAYA (Citrus medica Lvar proper) DENGAN GC-MS DAN UJI
ANTIOKSIDANMENGGUNAKAN METODE DPPH
ABSTRAK
Telah dilakukan analisis komponen kimia minyak atsiri kulit buah jeruk pepaya (C. medica L var proper) dengan destilasi Stahl dan analisa GC-MS . Komponen minyak atsiri yang dominan adalah D-Limonene (66,33%), 1,4-Cycloheksadiena
(16,87%), Nerol (3,07%), β-Myrcene (1,94%), 2-β-Pinene (1,13%), α-Pinene (1,07%), 1,3,7-Octatriene (1,03%). Selanjutnya, minyak atsiri kulit buah jeruk pepaya ditentukan aktivitas antioksidannya dengan metode DPPH radikal bebas. Nilai IC50 yang diperoleh adalah 183,85��/�. Hal ini menunjukkan bahwa
minyak atsiri kulit buah jeruk pepaya memiliki sifat antioksidan.
ANALYSIS OF CHEMICAL COMPONENTS OF ESSENTIAL OIL KULIT
BUAH JERUK PEPAYA (Citrus medica L var proper) WITH GC-MS AND
ANTIOXIDANT ACTIVITY TEST USING DPPH METHOD
ABSTRACT
Had been analysis of chemical components essential oil kulit buah jeruk pepaya (C. Medica L var Proper) with Stahl distillation and GC-MS analysis. The dominant constituents of the essential oil such as D-Limonene (66,33%),
1,4-Cycloheksadiena (16,87%), Nerol (3,07%), β-Myrcene (1,94%), 2-β-Pinene (1,13%), α-Pinene (1,07%), 1,3,7-Octatriene (1,03%). Furthermore , the essential oil of kulit buah jeruk pepaya was determined antiokxidant activitesfound by the methode of radicals DPPH. IC50 values which obtained respectively is 183,85
��/�. This shows that the essential oil of kulit buah jeruk pepaya have antioxidant properties.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Indonesia merupakan negara yang cukup berpotensi dalam produksi minyak atsiri.
Penggunaan minyak atsiri dari bahan alam sebagai obat semakin diminati
masyarakat, Minyak atsiri dikenal dengan nama minyak eteris atau minyak
terbang (essential oil, volatile) yang merupakan salah satu hasil metabolisme pada
tanaman. Minyak atsiri bersifat mudah menguap pada suhu kamar, berbau wangi
sesuai dengan bau tanaman penghasilnya dan larut dalam pelarut organik dan
tidak larut dalam air. (Sudaryani dan Sugiharti, 1990).
Jeruk merupakan salah satu bahan makanan tambahan yang mengandung
minyak atsiri dan zat-zat pengatur proses dalam tubuh manusia yang setiap hari
mutlak dibutuhkan. Dalam hal ini jeruk yang mengandung minyak atsiri adalah
Citrus Medica (jeruk pepaya). Buah jeruk pepaya dikenal dengan bentuknya yang
besar seperti pepaya sehingga dikatakan jeruk pepaya. (Joesoef.M, 1993)
Buah jeruk pepaya berkulit tebal, berpori seperti jeruk namun daging
buahnya padat seperti pepaya putih. Aspek-aspek farmakologis tanaman jeruk
pepaya sangat banyak, sehingga tanaman ini dapat digunakan sebagai obat
tradisional. Daun jeruk pepaya meiliki kandungan senyawa hesperidin dan
esscense oil.Daun jeruk pepaya dapat dimakan langsung atau disajikan dengan air
panas apabila kita mengalami sakit tenggorokan atau batuk. Selain itu kulit buah
jeruk pepaya juga dapat dimanfaatkan sebagai obat sariawan. Minyak atsiri jeruk
terdiri atas banyak senyawa yang sifatnya mudah menguap. Tiap varietas jeruk
memiliki variasi komposisi kandungan senyawa yang berbeda sehingga
Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas
yang dapat menyebabkan kerusakan asam lemak tak jenuh,membran dinding sel,
pembuluh darah, basa DNA, dan jaringan lipid sehingga menimbulkan penyakit.
Suatu tanaman dapat memiliki aktivitas antioksidan apabila mengandung senyawa
yang mampu menangkal radikal bebas seperti fenol dan flavonoid (Subeki, 1998).
Uji aktivitas antioksidan minyak atsiri Kulit Buah Jeruk Cakar Harimau
(Citrus mediva L var sarcodactylus) telah dilakukan oleh Valentine (2014), hasil
penelitian menunjukkn bahwa minyak atsiri C. medica L var sarcodactylus
mempuntai aktivitas antioksidan dengan IC50 = 39,67 mg/L. Antioksidan
mempunyai peranan penting dalam proses biologi untuk mencegah kerusakan
karena adanya radikalbebas. Uji aktivitas antioksidan terhadap DPPH
(1,1-difenil-2-pikrilhidrazil) cukup sederhana dan luas digunakan untuk menentukan potensi
antioksidan ekstrak tanaman. (Apak et al. 2007).
Berdasarkan uraian yang telah dikemukan diatas maka, peneliti tertarik
untuk mengidentifikasi komponen kimia minyak atsiri kulit buah jeruk pepaya (C.
medica L var proper) dengan GC-MS serta melakukan uji antioksidan dengan
metode DPPH sehingga data yang diperoleh peneiti mampu memberikan
1.2. Permasalahan
1. Komponen senyawa kimia apakah yang terdapat pada minyak atsiri kulit
buah jeruk pepaya (C. medica L var proper).
2. Bagaimanakah aktivitas antioksidan dari minyak atsiri kulit buah jeruk
pepaya (C. medica L var proper).
1.3. Tujuan Penelitian
1. Untuk mengetahui komponen kimia minyak atsiri yang terkandung di
dalam kulit buah jeruk pepaya (C. medica L var proper) dengan GC-MS.
2. Untuk mengetahui aktivitas antioksidan dari minyak atsiri kulit jeruk
pepaya (C. medica L var proper) menggunakan metode DPPH.
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi di bidang kimia
bahan alam mengenai komposisi-komposisi senyawa kimia pada minyak atsiri
dan aktivitas antioksidan minyak atsiri kulit buah jeruk pepaya (C. medica L var
proper).
1.5. Metodologi Penelitian
Penelitian ini dilakukan melalui eksperimen laboratorium. Dimana minyak atsiri
kulit buah jeruk pepaya (C. medica L var proper) diperoleh dengan metode
hidrodestilasi menggunakan alat Stahl. Desilasi ditampung kemudian diekstrak
menggunakan dietil eter. Lapisan eter diuapkan, Kemudian ditambahkan Na2SO4
anhidrous untuk menghilangkan kandungan airnya, kemudian disaring sehingga
didapat hasil minyak atsiri..Minyak atsiri yang diperoleh dianalisa dengan metode
GC-MS untuk mengetahui komponen kimianya, serta dilakukan pengujian
1.6. Lokasi Penelitian
1. Pengekstraksian minyak atsiri dilakukan di laboratorium Kimia Bahan
Alam FMIPA USU Medan
2. Uji aktioksidan dilakukan dilaboratorium salah satu perusahaan swasta
Medan
3. Analisa GC-MS dilakukan di laboratorium Kimia Organik FMIPA UGM
BAB II
TINJAUAN PUSTAKA
2.1. Jeruk Pepaya (Citrus medica L.var.proper)
Tumbuhan Jeruk Pepaya (C. medica L var proper) secara morfologi memiliki
tinggi batang mencapai 2 m, daun berbentuk lonjong, cabang tidak teratur dan
memiliki duri tajam daun sangat aromatik bila diremas. Bunganya berwarna putih
dengan ujung bunga berwarna kuning beraroma wangi.
Buah Jeruk pepaya pada saat masih kecil buah berwarna hijau muda setelah besar
dan matang akan berubah menjadi warna kuning. Bentuknya besar dapat
mencapai 20cm dengan diameter 10cm.Walaupun bentuknya seperti pepaya,
namun ia bukan Carica papaya, tetapi suatu varietas dari jeruk C. medica L
varietas proper yang di kalangan perjerukan dikenal sebagai sukade citroen (jeruk
sukade).
Kulitnya begitu tebal sampai isinya jadi tidak berarti. Sari buahnya sedikit,
dan rasanya asam. Iris-irisannya juga banyak dipakai sebagai pengisi selai jeruk
sukade basah, untuk dijepit di antara dua belahan roti panggang. C. medica L var.
properini sudah sejak dulu muncul secara berkala di Jawa Tengah dan Jawa Barat
2.1.1. Klasifikasi Tanaman Jeruk Pepaya
Divisi : Spermatophyta
Kelas : Dicotyledoneae
Ordo : Sapindales
Famili : Rutaceae
Genus : Citrus
Species : Citrus medica Lvar proper
Nama Lokal : Jeruk Pepaya
2.1.2. Manfaat tumbuhan Kuit Jeruk Pepaya (Citrus medica L.var.proper)
Daun jeruk pepaya dapat dimakan langsung atau disajikan dengan air panas
apabila kita mengalami sakit tenggorokan atau batuk. Selain itu kulit buah jeruk
pepaya juga dapat dimanfaatkan sebagai obat sariawan. Daun jeruk pepaya meiliki
kandungan senyawa hesperidin dan esscense oil. Minyak atsiri jeruk terdiri atas
banyak senyawa yang sifatnya mudah menguap. Tiap varietas jeruk memiliki
variasi komposisi kandungan senyawa yang berbeda sehingga menyebabkan
perbedaan aroma yang ditimbulkan. Walaupun demikian, minyak atsiri jeruk
umumnya mengandung senyawa dominan yang dikenal dengan nama limonen.
Kandungan senyawa limonen bervariasi antara varietas jeruk yaitu antara 70-92%.
(Trevor, 1995).
2.2. Minyak Atsiri
Minyak atsiri adalah zat berbau yang terkandung dalam tanaman. Minyak ini
disebut juga minyak menguap , minyak eteris atau minyak esensial karena pada
suhu kamar mudah menguap diudara teruka. Dalam keadaaan segar dan murni
tanpa pencemar, minyak atsiri umumnya tidak berwarna. Namun pada
penyimpanan yang lama minyak atsiri dapat teroksidasi dan membentuk resin
serta warnanya berubah menjadi lebih tua (Gelap). Untuk mencegah supaya tidak
berubah warna, minyak atsiri harus terlindungi dari pengaruh cahaya, misalnya
disimpan dalam bejana gelap yang berwarna gelap. Bejana terseut juga diisi
sepenuh mungkin sehingga tidak memungkinkan berhuungan langsung dengan
oksigen , ditutup rapat serta disimpan ditempat yang kering dan sejuk.
Secara kimia minyak atsiri merupakan senyawa tunggal, tetapi tersusun
dari berbagai macam komponen yang secara garis besar terdiri dari kelompok
terpenoid dan fenil propana. Pengelompokan tersebut didasarkan pada awal
terjadinya minyak atsiri didalam tanaman. Melalui asal usul biosintetik, minyak
1. Turunan terpenoid yang terbentuk melalui jalur biosintesis asam asetat
mevalonat
2. Turunan fenil propanoid yang merupakan senyawa aromatik, terbentuk
melalui jalur biosintesis asam sikimat
Terpenoid berasal dari suatu unit senyawa sederhana yang diseut seagai isoprena.
Sementara fenil propana terdiri dari gaungan inti benzena (Fenil) dan propana.
Penyusun minyak atsiri dari kelompok terpenoid dapat berupa
terpena-terpena yang tidak membentuk cincin (Asiklik), bercincin satu (Monosiklik)
ataupun bercincin dua (bisiklik). Masing-masing dapat memiliki percabangan
gugus-gugus ester, fenol, oksida, aldehida, dan keton. Sementara kelompok fenil
propana juga memiliki percabangan rantai berupa gugus-gugus fenol dan eter
fenol ( Gunawan, 2010).
Minyak atsiri adalah salah satu kandungan tanaman yang sering disebut
minyak terbang. Minyak atsiri dinamakan demikian karena minyak tersebut
mudah menguap. Selain itu, minyak atsiri juga disebut essential oil (dari kata
essence) karena minyak tersebut memberikan bau pada tanaman
(Koensoemardiyah, 2010).
Minyak atsiri, minyak mudah menguap, atau minyak terbang, merupakan
campuran dari senyawa yang berwujud cairan atau padatan yang memiliki
komposisi maupun titik didih yang beragam. Minyak atsiri dibagi menjadi dua
kelompok, yaitu :
1. Minyak atsiri yang dengan mudah dapat dipisahkan menjadi
komponen-komponen atau penyusun murninya. Komponen-komponen-komponen ini dapat
menjadi bahan dasar untuk diproses menjadi produk-produk lain, contoh :
minyak sereh, minyak daun cengkeh, minyak permai, dan minyak
terpentin.
2. Minyak atsiri yang sukar dipisahkan menjadi komponen murninya, contoh
minyak atsiri tersebut langsung dapat digunakan tanpa diisolasi
komponen-komponennya sebagai pewangi berbagai produk
(Sastrohamidjojo, 2004).
Minyak atsiri memiliki kandungan komponen aktif yang disebut terpenoid
atau terpena. Jika tanaman memiliki kandungan senyawa ini, berarti tanaman
tersebut memiliki potensi untuk dijadikan minyak atsiri. Zat inilah yang
mengeluarkan aroma atau bau khas yang terdapat pada banyak tanaman (Yuliani
dan Satuhu, 2012).
2.2.1. Penggolongan Minyak Atsiri
Pada umumnya perbedaan komposisi minyak atsiri disebabkan perbedaan jenis
tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur panenan, metode
ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia
yang terbentuk dari unsur karbon (C), Hidrogen (H), dan Oksigen (O). Pada
umumnya komponen kimia minyak atsiri dibagai menjadi dua golongan, yaitu:
1. Golongan Hidrokarbon
Persenyawaan yang termasuk golongan ini terbentuk dari unsur Karbon
(C), dan Hidrogen (H). jenis Hidrokarbon yang terdapat dalam minyak atsiri
sebagian besar terdiri dari monoterpen (unit isopren), sesquiterpen (3 unit
isopren), diterpen (4 unit isopren), dan politerpen.
2. Golongan Hidrokarbon Teroksigenasi
Komponen kimia dari golongan ini terbentuk dari unsur Karbon (C),
Hidrogen (H), dan Oksigen (O). persenyawaan yang termasuk dalam golongan ini
adalah persenyawaan alkohol, aldehid, ester. Fenol. Ikatan Karbon yang terdapat
dalam molekulnya dapat terdiri dari ikatan tunggal, ikatan rangkap dua dan ikatan
rangkap tiga. Terpen mengandung ikatan tunggal dan ikatan rangkap dua.
jika disimpan dalam waktu lama akan membentuk resin. Golongan hidrokarbon
teroksigenasi merupakan senyawa yang penting dalam minyak atsiri karena
umumnya aroma yang lebih wangi. Fraksi terpen perlu dipisahkan untuk tujuan
tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri
yang bebas terpen (Ketaren, 1986).
Minyak atsiri bukan merupakan senyawa tunggal, tetapi tersusun dari
berbagai komponen kimia, seperti alkohol, fenol, keton, ester, aldehida, dan
terpena. Bau khas yang ditimbulkan nya sangat tergantung dari perbandingan
komponen penyusunnya, demikian pula khasiatnya sebagai obat. Sebagai contoh,
minyak atsiri yang banyak mengandung fenol (misalnya minyak sirih, Piper
betle)berkhasiat sebagai antiseptik. Minyak sirih ini mampu membunuh kuman
seperti halnya karbol atau lisol sehingga minyak atsiri ini sering digunakan
sebagai obat cuci hama (Gunawan, 2007).
Pada dasarnya semua minyak atsiri mengandung campuran senyawa kimia
dan biasanya campuran tersebut sangat kompleks. Beberapa tipe senyawa organik
mungkin terkandung dalam minyak atsiri, seperti hidrokarbon, alcohol, oksida,
ester, aldehida dan eter. Sangat sedikit sekali yang mengandung satu jenis
komponen kimia yang persentasenya sangat tinggi. Yang menentukan aroma
minyak atsiri biasanya komponen yang persentasenya tinggi. Walaupun begitu,
kehilangan satu komponen yang persentasenya kecil pun dapat memungkinkan
terjadinya perubahan aroma minyak atsiri tersebut (Agusta, 2000).
Berdasarkan jumlah atom karbon atau unit isopren yang membentuk
senyawa terpen/terpenoid dapat diklasifikasikan sebagai berikut (Fessenden &
Tabel 2.1. Klasifikasi Senyawa Terpenoid
No. Kelompok Jumlah Atom Karbon (C)
1.
Monoterpen merupakan kandungan utama minyak atsiri yang banyak
terdapat dalam tanaman dan berfungsi memberikan aroma. Kelompok senyawa ini
memiliki aroma dan rasa yang sangat khas dan banyak digunakan dalam industri
makanan dan kosmetik sebagai citarasa dan parfum. Monoterpen terdapat dalam
kelenjar daun tanaman serta di kulit dan kupasan buah.
Beberapa struktur kimia monoterpen dapat dilihat pada gambar 2.2.
Minyak atsiri sebagian besar terdiri dari senyawa terpena yaitu suatu
senyawa produk alami yang strukturnya dapat dibagi kedalam satuan-satuan
isoprena. Satuan-satuan isoprena (C5H8) ini terbentuk dari asetat melalui jalur
biosintesis asam mevalonat dan merupakan rantai bercabang lima satuan atom
karbon yang mengandung 2 ikatan rangkap.Senyawa yang terdiri atas 2 satuan
isoprena disebut monoterpen (C10H16), senyawa yang mengandung 3 satuan
isoprena disebut seskuiterpena (C15H24), yang mengandung 4 satuan isoprena
disebut diterpena (C20H32), mengandung 6 satuan ioprena disebut triterpen
(C30H48) dan seterusnya.
Terpena sering terdapat sebagai komponen penyusun minyak atsiri adalah
monoterpena. Monoterpena banyak ditemui dalam bentuk asiklik, monosiklik,
serta bisiklis sebagai hidrokarbon dan keturunan yang teroksidasi seperti alkohol,
aldehida, keton, fenol, oksida dan ester. Terpena dibawah monoterpena yang
berperan penting sebagai penyusun minyak atsiri adalah seskuiterpena dan
diterpena.Kelompok Besar lain dari komponen penyusun minyak atsiri adalah
senyawa golongan fenil propana. Senyawa ini mengandung cincin fenil C6 dengan
rantai samping berupa propana C3(Gunawan, 2010).
2.2.2. Sumber Minyak Atsiri
Minyak atsiri terdapat pada tumbuhan dan biasanya diperoleh dari bagian tertentu
dari tumbuhan seperti bunga, buah, akar, daun, kulit kayu, dan rimpang.
Kandungan minyak atsiri tidak akan selalu sama antara bagian satu dengan bagian
lainnya. Misalnya kandungan minyak atsiri yang terdapat pada kuntum bunga
cengkih berbeda dengan pada bagian tangkai bunga maupun daun. Berikut ini
beberapa contoh tanaman sumber minyak atsiri dan bagian tanaman yang
mengandung minyak atsiri:
• Akar : akar wangi, kemuning.
• Biji : alpukat, kasturi, lada, pala,seledri, wortel, nagasari.
• Bunga : cempaka kuning, cengkih, daun seribu, kenanga, melati, sedap malam,
srikanta, srigading.
• Daun : cemara gimbul, cemara kipas, cengkih, sereh wangi, kaki kuda,
kemuning,kunyit, selasihan, semanggi, sirih.
• Kulit kayu: kayu manis, akasia, kayu teja, selasihan.
• Ranting : cemara gimbul, cemara kipas
• Rimpang : jahe, jeringau, kencur, lengkuas, lempuyang sari, temu hitam, temu
lawak
• Seluruh bagian : akar kucing, bandotan, inggu, selasih, sudamala, trawas
(Tony,1994).
Ditinjau dari sumber alami minyak atsiri, substansi mudah menguap ini
dapat dijadikan sebagai sidik jari atau ciri khas dari suatu jenis tumbuhan karena
setiap tumbuhan menghasilkan minyak atsiri dengan aroma yang berbeda. Dengan
kata lain, setiap jenis tumbuhan menghasilkan minyak atsiri dengan aroma yang
spesifik (Agusta,2000).
Minyak atsiri dihasilkan di dalam tubuh tanaman dan kemudian disimpan
dalam berbagai organ. Penelitian menunjukkan bahwa minyak atsiri dibuat dalam
kelenjar minyak atsiri. Kelenjar minyak atsiri ada yang terdapat di dalam tanaman
(disebut kelenjar internal) dan di luar tanaman (disebut kelenjar eksternal).
Kelenjar internal terbentuk oleh masuknya minyak atsiri yang semula ada di luar
sel, yang kemudian merusak sel-sel disekitarnya sehingga terbentuklah saluran
semacam organ dengan minyak atsiri di dalamnya. Ada kemungkinan sel-sel di
sekitarnya kemudian larut dan membentuk kelompok sel yang disebut kelenjar
dan kemungkinan suatu deretan sel terlarut sehingga membentuk saluran yang
didalamnya berisi minyak atsiri. Kelenjar eksternal berupa sel-sel permukaan
(lazim disebut sel epidermis). Produk dari kelenjar (minyak atsiri) biasanya
tertimbun di antara kutikula (lapisan sel terluar) dan dinding sel antara suatu sel
dengan sel yang lain. Kutikula berupa lapisan tipis, bila kutikula pecah minyak
atsiri akan keluar sehingga bau minyak atsiri akan menyebar (Koensoemardiyah,
2.2.3. Khasiat dan Manfaat Minyak Atsiri
Kegunaan minyak atsiri sangat luas dan spesifik, khususnya dalam berbagai
bidang industri. Banyak contoh kegunaan minyak atsiri, antara lain dalam industri
kosmetik (sabun, pasta gigi, sampo, lotion), dalam industri makanan digunakan
sebagai bahan penyedap atau penambah cita rasa, dalam industri parfum sebagai
pewangi dalam berbagai produk minyak wangi, dalam industri farmasi atau
obat-obatan (antinyeri, antiinfeksi, pembunuh bakteri), dalam industri bahan pengawet
bahkan digunakan pula sebagai insektisida (Tony, 1994).
Minyak atsiri merupakan preparat antimikroba alami yang dapat bekerja
terhadap bakteri, virus, dan jamur yang telah dibuktikan secara ilmiah oleh
banyak peneliti (Yuliani dan Satuhu, 2012). Minyak daun sirih (Piper betle)
adalah salah satu minyak atsiri yang bersifat sebagai antibakteri. Minyak ini dapat
menghambat pertumbuhan beberapa jenis bakteri merugikan seperti Escherichia
coli, Salmonella sp, Staphylococcus aureus dan Pasteurella. Minyak adas,
lavender (Lavandula officinalis), dan eukaliptus (Eucalyptus globulus)dapat
digunakan sebagai antiseptik (Agusta, 2000).
Minyak gandapura, chamomil, cengkih, lavender, dan permen termasuk
jenis-jenis minyak atsiri yang mempunyai efek sebagai analgesik sehingga
minyak tersebut sering digunakan untuk menghilangkan rasa sakit karena
pegal-pegal atau sakit gigi. Sementara itu, minyak yang mengandung senyawa citronella
seperti minyak serai wangi, Cinnamomum camphora dan eucalyptus memiliki
aktivitas sebagai insektisida. Minyak atsiri yang berkhasiat sebagai antiinflamasi
(menghilangkan peradangan) adalah minyak lavender. Minyak ini biasanya hanya
digunakan untuk mengatasi inflamasi ringan, seperti luka bakar. Senyawa lain
dalam minyak yang direkomendasikan efektif untuk menghilangkan bau badan/
deodoran adalah geraniol, patchoulol, dan linalool. Senyawa-senyawa tersebut
terdapat pada minyak nilam, jahe, pala, dan serai wangi (Yuliani dan Satuhu,
Beberapa khasiat minyak atsiri yang sering digunakan untuk terapi-aroma
dapat dlihat pada tabel berikut (Agusta, 2000).
Tabel 2.2. Aktivitas biologis minyak atsiri yang sering digunakan untuk
terapi-aroma
Nama Tumbuhan Nama Daerah Khasiat
Abies alba
antipiretik, laksatif, stimulant, analgesic,
2.2.4. Ekstraksi Minyak atsiri
Ekstraksi adalah proses penarikan komponen aktif (minyak atsiri) yang
terkandung dalam tanaman menggunakan bahan pelarut yang sesuai dengan
kelarutan komponen aktifnya. Ekstraksi minyak atsiri dapat dilakukan dengan tiga
cara yaitu :
1. Ekstraksi dengan pelarut menguap (solvent extraction)
Prinsipnya sederhana yaitu minyak atsiri yang terkandung di dalam bahan
dilarutkan dalam pelarut organik yang mudah menguap. Cara kerja ekstraksi
menggunakan pelarut menguap yaitu dengan memasukkan bunga yang akan
diekstraksi ke dalam alat ekstraktor khusus, kemudian ekstraksi berlangsung pada
suhu kamar dengan menggunakan pelarut. Pelarut akan berpenetrasi ke dalam
bunga sehingga melarutkan minyak bunga beserta lilin, albumin, dan zat warna.
Hal itu mengakibatkan warna minyak yang diproses dengan cara ini akan
menghasilkan minyak dengan warna kuning kecoklatan (gelap) karena
mengandung pigmen alami yang tidak mudah menguap.
2. Ekstraksi dengan lemak dingin (enfluorasi)
Enfluorasi merupakan cara terbaik untuk menarik minyak atsiri yang
terdapat dalam bunga. Hal itu karena prosesnya dilakukan dalam suasana dingin
sehingga kandungan minyak atsirinya tidak cepat menguap. Untuk proses
enfluorasi dibutuhkan lemak dingin yang berfungsi sebagai adsorban atau
penyerap minyak atsiri dari bunga.
3. Ekstraksi dengan lemak panas (maserasi)
Maserasi merupakan salah satu proses ekstraksi yang dilakukan melalui
perendaman bahan baku dengan pelarut organik (Yuliani dan Satuhu, 2012). Cara
maserasi dapat digunakan untuk bahan yang lunak dan untuk bahan yang keras
(telah dirajang). Selama perendaman minyak atsiri yang keluar dari bahan
(sampel) akan berinteraksi dengan lemak, minyak atsiri kemudian dipisahkan.
Untuk memisahkan minyak atsiri dari lemak, diekstraksi dengan alkohol
2.2.5. Isolasi Minyak Atsiri dengan Destilasi
Destilasi dapat didefenisikan sebagai cara penguapan dari suatu zat dengan
perantara uap air dan proses pengembunan berdasarkan perbedaan titik didihnya.
Destilasi merupakan metode yang paling berfungsi untuk memisahkan dua zat
yang berbeda, tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan
uap air (berkaitan dengan perbedaan titik didihnya) dari komponen-komponen
tersebut. Destilasi melepaskan uap air pada sebuah zat yang tercampur yang kaya
dengan komponen yang mudah menguap daripada zat tersebut ( Pasto, 1992).
Minyak atsiri, minyak mudah menguap, atau minyak terbang merupakan
campuran dari senyawa yang berwujud cairan atau padatan yang memiliki
komposisi maupun titik didih yang beragam. Penyulingan dapat didefenisikan
sebagai proses pemisahan komponen-komponen suatu campuran yang terdiri atas
dua cairan atau lebih berdasarkan perbedaan titik didih komponen-komponen
senyawa tersebut.
Penyulingan suatu campuran yang berwujud cairan yang tidak saling
bercampur, hingga membentuk dua fase atau dua lapisan. Keadaan ini terjadi pada
pemisahan minyak atsiri dengan uap air. Penyulingan dengan uap air sering
disebut hidrodestilasi. Pengertian umum ini memberikan gambaran bahwa
penyulingan dapat dilakukan dengan cara mendidihkan bahan tanaman atau
minyak dengan air. Pada proses ini akan dihasilkan uap air yang dibutuhkan alat
penyuling (Sastrohamidjojo, 2004).
Dalam pengertian industri minyak atsiri dibedakan tiga tipe destilasi, yaitu:
1.Penyulingan Air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak
langsung dengan air mendidih. Bahan dapat mengapung di atas air atau terendam
secara sempurna, tergantung pada berat jenis dan jumlah bahan dan air mendidih
(Lutony, 2002).Perbandingan jumlah air perebus dan bahan baku dibuat
pendahuluan seperti perajangan dan pelayuan dimasukkan dan dipadatkan.
Selanjutnya ketel ditutup rapat agar tidak terdapat celah yang mengakibatkan uap
keluar (Armando, 2009).
2.Penyulingan Uap dan Air
Bahan tanaman yang akan diproses secara penyulingan uap dan air
ditempatkan dalam suatu tempat yang bagian bawah dan tengah berlobang-lobang
yang ditopang di atas dasar alat penyulingan. Bagian bawah alat penyulingan diisi
air sedikit di bawah dimana bahan ditempatkan. Air dipanaskan dengan api seperti
pada penyulingan air di atas. Bahan tanaman yang akan disuling hanya terkena
uap dan tidak terkena air yang mendidih (Sastrohamidjojo, 2004).
3.Penyulingan Uap
Penyulingan uap disebut juga penyulingan tak langsung. Didalam proses
penyulingan dengan uap ini, uap dialirkan melalui pipa uap berlingkar yang berpori
dan berada si bawah bahan tanaman yang akan disuling. Kemudian uap akan bergerak
menuju ke bagian atas melalui bahan yang disimpan di atas saringan (Lutony, 1994).
Sistem penyulingan ini baik untuk mengekstraksi minyak dari biji-bijian, akar dan
kayu-kayuan yang umumnya mengandung komponen minyak yang bertitik didih
tinggi dan tidak baik dilakukan terhadap bahan yang mengandung minyak atsiri yang
mudah rusak oleh pemanas dan air (Ketaren, 1985).
2.2.6. Komponen Kimia Minyak Atsiri
Pada umumnya perbedaan minyak atsiri komposisi minyak atsiri disebabkan
perbedaan jenis tanaman penghasil, kondisi iklim, tanah tempat tumbuh, umur
pemanenan, metode ekstraksi yang digunakan dan cara penyimpanan minyak.
Minyak atsiri terdiri dari berbagai campuran persenyawaan kimia yang
komponen kimia minyak atsiri dibagi menjadi dua golongan yaitu : 1) Hidrogen
yang terutama terdiri dari persenyawaan terpen dan 2) Hidrokarbon teroksigenasi.
1. Golongan hidrokarbon yang terdiri dari persenyawaan Terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur karbon (C)
dan Hidrogen (H). Jenis hidrokarbon yang terdapat dalam minyak atsiri
sebagian besar terdiri dari monoterpen ( 2 unit isoprene), sesquiterpen ( 3
unit isoprene), diterpen ( 4 unit isoprene) dasn politerpen.
2. Golongan hidrokarbon teroksigenasi
Komponen kimia dari golongan persenyawaan ini terbentuk dari unsure
Karbon (C), Hidrogen (H), dan Oksigen (O). Persenyawaan yang termasuk
dalam golongan ini adalah persenyawaan alkohol, aldehid, keton, ester,
eter dan fenol. Ikatan karbon yang terdapat dalam molekulnya dapat terdiri
dari ikatan tunggal, ikatan rangkap tiga. Terpen mengandung ikatan
tunggal dan ikatan rangkap dua (Ketaren, 1985).
2.3. Analisa Komponen Kimia Minyak Atsiri
2.3.1. Kromatografi Gas-Spektroskopi Massa (GCMS)
GCMS merupakan metode pemisahan senyawa organik yang menggunakan dua
metode analisis senyawa yaitu Kromatografi gas( GC) untuk menganalisis jumlah
senyawa secara kuantitatif dan Spektrometri Massa (MS) untuk mengetahui massa
molekul relatif dan pola fragmentasi senyawa yang dianalsis.
Kromatografi Gas merupakan salah satu tehnik analisa yang menggunakan
prinsip pemisahan migrasi komponen-komponen penyusunya. Kromatografi gas
biasa digunakan untuk mengindentifikasi suatu senyawa yang terdapat pada
campuran gas dan juga menentukan konsentrasi suatu senyawa dalam fase gas.
Spektroskopi massa adalah suatu metode untuk mendapatkan berat
muatannya diketahui dengan mengukur jari-jari orbit melingkarnya dalam medan
magnetik seragam.Penggunaan kromatografi gas dapat dipadukan dengan
spektroskopi massa. Paduan keduanya dapat menghasilkan data lebih akurat
dalam mengindentifikasi senyawa yang dilengkapi dengan struktur molekulnya
(Pavia, 2006).
Sekarang ini sistem GC-MS sebagian digunakan sebagai peran utama
untuk analisa makanan dan aroma, petroleum, petrokimia dan zat-zat kimia di
laboratorium. Kromatografi gas merupakan kunci dari suatu tehnik analitik dalam
pemisahan komponen mudah menguap, yaitu dengan mengkombinasikan secara
tepat analisa sehingga pemecahan yang tinggi mengurangi pengoperasian.
Keuntungan dari kromatografi gas adalah hasil kuantitatif yang bagus dan
harganya lebih murah. Sedangkan kerugiannya tidak dapat memberikan indentitas
atau struktur untuk setiap puncak yang dihasilkan dan saat proses karateristik
yang didefenisikan sistem tidak bagus (Mcnair, 2009).
Adapun Prinsip kerja dari alat GC-MS adalah sebagai berikut
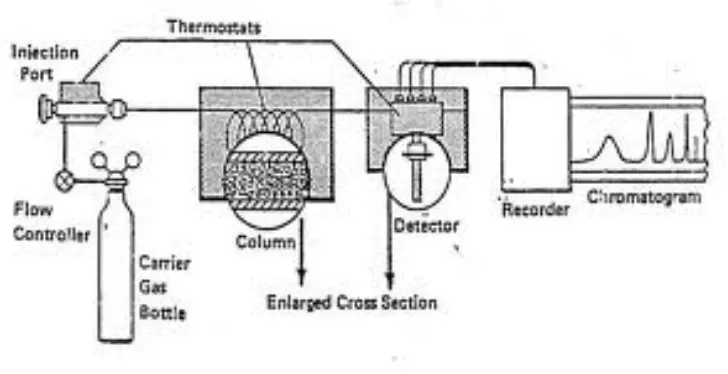
Kromatografi Gas
Kromatografi gas (GC) merupakan jenis kromatografi yang digunakan
dalam kimia organik untuk pemisahan dan analisis. Kromatografi Gas dapat
digunakan untuk menguji kemurniaan dari bahan tertentu, atau memisahkan
berbagai komponen dari campuran. Dalam beberapa situasi, GC dapat membantu
dalam mengindentifikasi sebuah senyawa kompleks. Dalam kromatografi gas,
fase yang bergerak atau mobile phase adalah sebuah operator gas, yang biasanya
gas murni seperti helium atau yang tidak reaktif seperti gas nitrogen.Fase diam
atau stationary phase merupakan tahap mikroskopis lapisan cair atau polimer
yang mendukung gas murni, di dalam bagian dari sistem pipa-pipa kaca atau
logam yang disebut kolom. Instrumen yang digunakan untuk melakukan
kromatografi gas disebut gas chromatograph (Fowlis, 1998).
Instrumentasi dari alat GC antara lain:
a.Gas Pembawa
Gas pembawa yang paling sering dipakai adalah helium (He), argon (Ar), nitrogen
(N2), hidrogen (H2), dan karbondioksida (CO2). Keuntungannya adalah karena
semua gas ini tidak reaktif dan dapat dibeli dalam keadaan murni dan kering yang
dikemas dalam tangki tekanan tinggi. Pemilihan gas pembawa tergantung pada
detektor yang dipakai. Gas pembawa harus memenuhi sejumlah persyaratan,
antara lain harus inert (tidak bereaksi dengan sampel, pelarut sampel, material
dalam kolom), murni, dan mudah diperoleh (Agusta, 2000).
b.Injeksi Sampel
Cuplikan dimasukkan ke dalam ruang suntik melalui gerbang suntik, biasanya
berupa lubang yang ditutupi dengan septum atau pemisah karet. Ruang suntik
harus dipanaskan tersendiri, terpisah dari kolom dan biasanya pada suhu 10-15ºC
lebih tinggi dari suhu maksimum. Jadi seluruh cuplikan diuapkan segera setelaj
disuntikkan dan dibawa ke kolom ( Gritter et al, 1991).
Kolom merupakan tempat terjadinya proses pemisahan karena di dalamnya
terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada
kromatografi gas (Rohman, 2009). Keberhasilan suatu proses pemisahan terutama
ditentukan oleh pemilihan kolom. Kolom dapat terbuat dari tembaga, baja tahan
karet, aluminium, atau gelas. Kolom dapat berbentuk lurus,melengkung,atau
gulungan spiral sehingga lebih menghemat ruang (Agusta, 2000).
2.4. Antioksidan
2.4.1. Pengertian Antioksidan
Antioksidan merupakan senyawa pemberi elektron (elektron donor) atau reduktan.
Senyawa ini memiliki berat molekul kecil, tetapi mampu mengaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal.
Antioksidan dapat diperoleh,
1. Dari luar tubuh (eksogen) dengan cara melalui makanan dan miuman yang
mengandung vitamin C, E atau betakaroten
2. Dari dalam tubuh (endogen) yakni dengan enzim superoksida dismutasi (SOD),
gluthatione, perxidasi dan katalase yang diperoduksi oleh tubuh sebagai
antioksidan ( Kosasih, 2004)
Senyawa antioksidan memengang peranan penting dalam pertahanan
tubuh terhadap perubahan buruk yang disebabkan radikal bebas. Radikal bebas
diketahui dapat menginduksi penyakit kanker, arteriosklerosis dan penuaan,
disebabkan oleh kerusakan jaringan karena oksidasi (Kikuzaki dan Nakatani,
1993).
Radikal bebas adalahmerupakan atom atau gugus atom apa saja yang
memiliki satu atau lebih elektron tak berpasangan. Karena jumlah elektron ganjil,
maka tidak semua elektron dapat berpasangan sehingga bersifat sangat reaktif.
Jika jumlahnya sedikit, radikal bebas dapat dinetralkan oleh sistem enzimatik
merupakan agen pengoksidasi kuat yang dapat merusak sistem pertahanan tubuh
dengan akibat kerusakan sel dan penuaan dini karena elektron yang tidak
berpasangan selalu mencari pasangan elektron dalam makromolekul biologi,
Protein lipida dan DNA dari sel manusia yang sehat lah merupakan sumber
pasangan elektron yang baik (Kosasih, 2004).
2.4.2. Uji Aktivitas Antioksidan
Menurut Benzie & Strain (1996), pengukuran aktivitas antioksidan dapat
dilakukan dengan tiga metode yaitu:
1. Metode CUPRAC
Menggunakan bis(neokuproin) tembaga(II) (Cu(Nc)22+ sebagai pereaksi
kromogenik. Pereaksi Cu(Nc) 22+ yang berwarna biru akan mengalami reduksi
menjadi Cu(Nc)2+ yang berwarna kuning dengan reaksi:
n Cu(Nc)22+ +AR(OH)n → n Cu(Nc)2+ + AR(=O)n + n H+
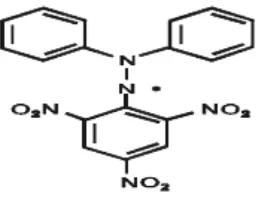
2. Metode DPPH
Menggunakan2,2difenil-1- pikrilhidrazil sebagai sumber radikal bebas. Prinsipnya
adalah reaksi penangkapan hidrogen oleh DPPH dari zat antioksidan (Apak et
al. 2007).
DPPH adalah bubuk kristal berwarna gelap terdiri dari molekul radikal
bebas yang stabil. DPPH mempunyai berat molekul 394.32 dengan rumus
molekul C18H12N5O6, larut dalam air. Penyimpanan dalam wadah tertutup baik
pada suhu -20°C (Molyneux, 2004).
3. Metode FRAP
Menggunakan Fe(TPTZ)23+ kompleks besi-
ligan2,4,6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe(TPTZ)23+ akan berfungsi sebagai zat
pengoksidasi dan akan mengalami reduksi menjadi Fe(TPTZ) 22+ yang berwarna
kuning dengan reaksi berikut:
Fe(TPTZ) 23+ + AROH → Fe(TPTZ)22++ H+ + AR=O
2.4.3. Metode Pengukuran Aktivitas Antioksidan dengan Metode DPPH
Aktivitas antioksidan dapat dilakukan beberapa cara salah satu metode
pengukuran yang sering digunakan adalah metode DPPH. DPPH merupakan suatu
radikal bebas stabil kerena mekanisme delokalisasi elektron bebas oleh
molekulnya, sehingga molekul ini tidak mengalami reaksi dimerisasi yang sering
terjadi pada sebagian besar radikal bebas lainnya. Delokalisasi juga memberikan
efek warna ungu yang dalam pada panjang gelombang 517 nm dalam pelarut
etanol. Zat ini berperan sebagai penangkap elektron atau penangkap radikal
hidrogen bebas. Hasilnya molekul yang bersifat stabil. Bila suatu senyawa
antioksidan direaksikan dengan zat ini maka senyawa antioksidan tersebut akan
menetralkan radikal bebas dari DPPH (Bintang, 2010).
Pengukuran aktivitas antioksidan dilakukan dengan inkubasi DPPH
dengan minyak atsiri antioksidan selama 30 menit sehingga menghasilkan larutan
ungu yang lebih memudar kemudian dilakukan pengukuran panjang gelombang
pada 517 nm. Aktivitas antioksidan diperoleh dari nilai absorbansi yang
selanjutnya akan digunakan untuk menghitung persentase inhibis 50% (IC50) yang
menyatakan konsentrasi senyawa antioksidan yang menyebabkan 50% dari DPPH
kehilangan karakter radikal bebasnya. Semakin tinggi kadar senyawa antioksidan
dalam sampel maka akan semakin rendah nilai IC50. Hasil yang dituliskan berupa
IC50, yang merupakan suatu konsentrasi sampel antioksidan yang diuji mampu
melakukan peredaman 50% terhadap radikal DPPH dalam jangka waktu tertentu
BAB III
Labu destilasi 2000 ml Pyrex
Pipet tetes
Spektrometer UV-Visible Perkin Elmer
3.2. Bahan-Bahan
Kulit Buah Jeruk Pepaya
Na2SO4 anhidrous p.a Merck
Eter p.a Merck
DPPH p.a Aldrich
Etanol p.a Merck
3.3. Prosedur Penelitian
3.3.1. Penyediaan Sampel
Bahan yang digunakan dalam penelitian adalah kulit buah jeruk pepaya
yang diperoleh dari Kuta Cane Kabupaten Aceh Tenggara.
3.3.2. Destilasi Kulit Buah Jeruk Pepaya (Sampel)
Kulit buah jeruk pepaya dibersihkan dan diiris-irislalu ditimbang sebanyak
500 gram. Sebanyak 500 gram sampel dimasukkan ke dalam labu alas 2000 ml,
lalu ditambahkan air secukupnya, dipasang pada alat penyuling Stahl dan
dididihkan selama ± 3 - 4 jam hingga minyak atsiri menguap sempurna. Destilat
yang diperoleh merupakan campuran minyak dengan air. Kemudian destilat
diekstrak menggunakan dietil eter. Lalu dikeringkan dengan Na2SO4 anhidrous
selanjutnya didekantasi. Kemudian filtratediuapkan pada suhu 40⁰C sampai 45⁰C
menggunakan penangas air sehingga diperoleh hasil minyak atsiri. Minyak yang
diperoleh dianalisa kandungan kimianya menggunakan alat GC-MS dan dilakukan
uji antioksidan. Perlakuan ini dilakukan sebanyak 3 kali.
3.3.3. Analisa Minyak Atsiri Kulit Buah Jeruk Pepaya dengan GC-MS
Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS.
Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini. Kemudian diamati
kromatogram yang dihasilkan oleh recorder dan mass recorder serta mass spectra
masing-masing senyawa.
Kondisi alat GC-MS yaitu
Kolom : Rastek Stabililwak R-DA
Flow Control Mode : Pressure
Pressure : 13,7 kPa
Total Flow : 80 mL/min
Coloum Flow : 0,50 mL/min
Linear Velocity : 25,9 cm/sec
Purge Flow : 0,3 mL/min
Split Ration : 158,4
Equilibrium Time : 0,5 min
GCMS-QP2010
Ion Source Temperature : 250 °C
InterfaceTemperature : 300 °C
Solvent Cut Time : 3 min
3.3.4. Uji Sifat Antioksidan Minyak Atsiri Kulit Buah Jeruk Pepaya dengan
Metode DPPH
3.3.4.1. Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 mM dibuat dengan melarutkan 11,83 mg serbuk DPPH dalam
3.3.4.2. Pembuatan Variasi Minyak Atsiri Kulit Buah Jeruk Pepaya
Minyak atsiri kulit buah jeruk pepaya dibuat larutan induk 1000 ppm , dengan
melarutkan 0,025 g minyak atsiri dengan pelarut etanol p.a dalam labu takar 25
ml. Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm. Kemudian
dari larutan 100 ppm dibuat lagi variasi konsentrasi 10, 20, 30 dan 40 ppm untuk
diuji aktivitas antioksidan.
3.3.5. Uji Aktivitas Antioksidan
3.3.5.1.Larutan Blanko
Sebanyak 1 ml larutan DPPH 0,3 mM ditambahkan 2,5 ml Etanol p.a .
Dihomogenkan dalam tabung reaksi dan dibiakan selamat 30 menit pada ruang
gelap. Setelah itu diukur absorbansi dengan panjang gelombang maksimum 515
nm.
3.3.5.2.Uji Aktivitas Antioksidan Minyak Atsiri Kulit Buah Jeruk
Pepaya
Sebanyak 1 ml larutan DPPH 0,3 mM ditambahkan 2,5 mL minyak atsiri kulit
buah jeruk pepaya dengan konsentrassi 10 ppm, dihomogenkan dalam tabung
reaksi dan dibiarkan selama 30 menit pada ruang gelap. Setelah itu diukur
absorbansi dengan panjang gelombang maksimum 515 nm. Dilakukan dengan
3.4. Bagan Penelitian
3.4.1. Isolasi Minyak Atsiri Kulit Buah Jeruk Pepaya dengan Destilasi Stahl
Dimasukkan kedalam labu Stahl 2 liter
Ditambahkan aquadest secukupnya
Dirangkai alat Stahl
Dididihkan selama ± 3-4 jam hingga
dihasilkan uap air bersama minyak
Diekstraksi dengan dietil eter
Ditambahkan Na2SO4 Anhidrous
Didekantasi
Diuapkan pada suhu 40 -45 OC diatas penangas air 500 gram Kulit Buah Jeruk Pepaya Segar yang telah di iris halus
Lapisan Minyak Lapisan Air
Minyak Atsiri
3.4.2. Uji Sifat Antioksidan Minyak Atsiri Kulit Buah Jeruk Pepaya dengan
Metode DPPH
3.4.2.1. Pembuatan Larutan DPPH 0,3mM
Dimasukkan kedalam labu takar 100 mL
Dimasukkan etanol p.a hingga garis batas
dihomogenkan 11,83 mg DPPH
3.4.2.2. Pembuatan variasi Minyak Atsiri Kulit Buah Jeruk Pepaya
Dimasukkan kedalam labu takar 25 mL
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan
Dipipet 2, 5 mL larutan induk 1000 ppm
Ditambahkan etanol p.a hingga garis batas
Dihomogenkan 0,025 g minyak atsiri
25 mL Larutan Induk 1000
25 mL Larutan Induk 100 ppm
3.4.3. Uji Aktivitas Antioksidan
3.4.3.1. Uji Blanko
Dimasukkan ke dalam tabung reaksi
Ditambahkan 2,5 mL etanol p.a
Dihomogenkan
Dibiarkan selama 30 menit pada ruang gelap
Diukur absorbansi pada panjang gelombang
maksimum 515nm
3.4.3.2. Uji Minyak Atsiri
Dimasukkan ke dalam tabung reaksi
Ditambahkan 2,5 mL minyak atsiri 10 ppm
Dihomogenkan
Dibiarkan selama 30 menit pada ruang gelap
Diukur absorbansi pada panjang gelombang
maksimum 515nm
Dilakukan perlakuan yang sama terhadap variasi konsentrasi 20, 30, dan 40 ppm 1 mL larutan DPPH 0,3 mM
Hasil
Hasil
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Isolasi Minyak Atsiri Kulit Buah Jeruk Pepaya
Minyak atsiri kulit buah jeruk pepaya segar diperoleh dengan metode
hidrodestilasi menggunakan alat Stahl. Proses ini dilakukan secara triplo.
Hasilnya seperti yang ditunjukkan pada tabel 4.1.
Tabel 4.1. Minyak Atsiri Kulit Buah Jeruk Pepaya yang diperoleh dengan
Metode Hidrodestilasi
Kemudian minyak atsiri yang diperoleh dianalisis komponen senyawa
kimianya dengan GC-MS dimana kromatogram hasil analisisa GC seperti yang
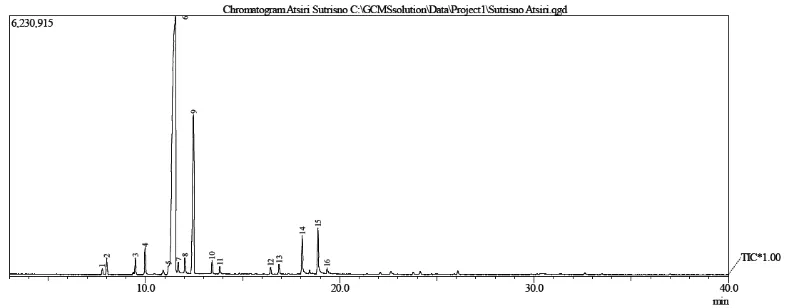
ditunjukkan pada gambar 4.1.
Gambar 4.1. Kromatogram Komponen Kimia Minyak Atsiri Kulit Buah Jeruk
Pepaya
Pada kromatogram tersebut terdapat 16 komponen senyawa kimia pada minyak
diinterpretasi secara fragmentasi massa yang disesuaikan dengan Library Wiley
229.
Tabel 4.2. Hasil Senyawa Analisis GC-MS Minyak Atsiri Kulit Buah
Jeruk Pepaya
Puncak Fragmen (ion) Nama Senyawa
yang diduga
6. C10H16 66,33 11,555 136,121,107,93,79,68,53,
41
10. C10H16 0,90 13,434 136,121,105,93,79,67,43,
41
11. C10H16 0,49 13,826 136,121,107,93,71,69,41 α-terpinolene
Dari Tabel 4.2. Kulit buah jeruk pepaya ada 16 senyawa berdasarkan standart
yang telah didapat di interprestasi hanya sebanyak 7 senyawa yang sesuai dengan
standart libarary wiley seperti pada tabel 4.3.
Tabel 4.3. Senyawa Hasil Analisa GC-MS Minyak Atsiri Kulit Buah Jeruk
Pepaya Sesuai Dengan Standart Library Wiley
53,41
4.1.2. Hasil Uji Aktivitas Antioksidan Minyak Atsiri Kulit Buah Jeruk
Pepaya
Minyak atsiri kulit buah jeruk pepaya segar dilakukan uji aktivitas antioksidan
dengan metode DPPH radikal bebas untuk diperoleh nilai IC50 dengan dilakukan
pengamatan secara spektrofotometri UV-Visible (absorbansi yang diukur
terlampir pada lampiran ) pada panjang gelombang maksimum 515 nm.
Tabel 4.4. Hasil Pengukuran Absorbansi Minyak Atsiri Kulit Buah Jeruk Pepaya
Sampel Abs. % Peredaman
4.2. Pembahasan
4.2.1. Minyak Atsiri Dari Hasil Destilasi Dengan Alat Stahl
Dari hasil penelitian yang telah dilakukan diperoleh minyak atsiri kulit
buah jeruk pepaya segar rata – rata sebanyak 0,60mL dari sebanyak 500 gram
kulit buah jeruk pepaya. Jadi kadar minyak atsiri kulit buah jeruk pepaya adalah
% (v/b) yang diperoleh dari perhitungan berikut :
% kadar minyak atsiri = ������������������
����������������� � 100%
= 0,60 ��
500 ���� � 100%
= 0,119 %
Minyak atsiri kulit buah jeruk pepaya yang diperoleh berwarna hijau kekuningan.
Kadar minyak astiri berdasarkan hasil penelitian kulit buah jeruk pepaya
didapatkan minyak atsiri sebanyak 0,119% dan minyak atsiri berwarna kuning
pucat.
4.2.2. Analisis Spektrum Massa Minyak Atsiri Kulit Buah Jeruk Pepaya
Minyak atsiri kulit buah jeruk pepaya segar yang diperoleh dari hasil penelitian
dianalisa dengan GC-MS yang disesuaikan dengan Library Wiley 229 , maka
diperoleh kandungan utama, yaitu:D-limonene (66,33%), 1,4-Cyclohexadiena
(16,87%), Nerol (3,07%), β-Myrcene (1,94%), β-pinene (1,13%), α-pinene
(1,07%), 1,3,7-Octatriene (1,03%). Berikut adalah pola fragmentasi yang mungkin
dari 7 senyawa yang ditemukan pada minyak atsiri kulit buah jeruk pepaya:
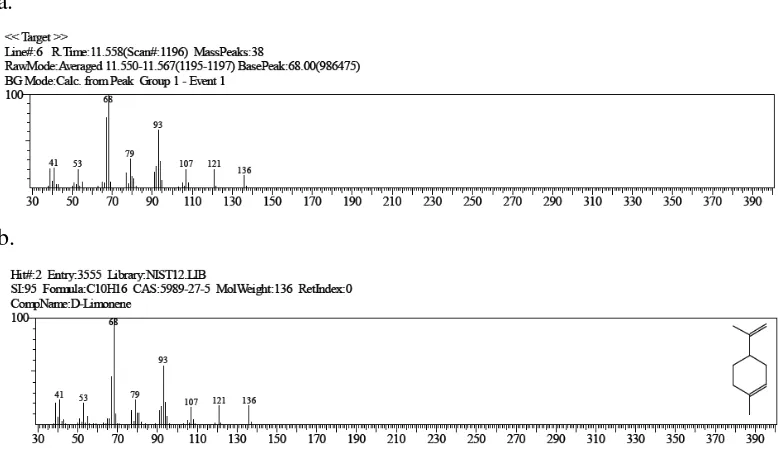
1. Spektrum massa dari D-Limonene
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
a.
b.
Gambar 4.2. Spektrum Massa D-Limonene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 11,555 merupakan senyawa
dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion molekul pada
m/e 136 diikuti frakmen- frakmen pada m/e 136,121,107,93,79,68,53 dan 41.
Dengan membandingkan spektrum yang diperoleh dengan data spektrum library,
yang lebih mendekati adalah D-Limonenel sebanyak 66,33 % .
Adapun pola fragmentasi yang mungkin dari senyawa D-Limonene
+1e
--2e
-m/e = 136 (C10H16)
-CH3(15)
-C4H5(53)
m/e = 121 (C9H13)
m/e = 68 (C5H8) m/e = 53 (C4H5)
-CH3(15)
m/e = 93 (C7H9)
D-Limonen
-C2H4(28)
-CH2(14)
m/e = 79 (C6H7)
2. Spektrum massa dari 1,4-Cyclohexadiena
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
Wiley 229 , maka spektrum 1,4-Cyclohexadiena ditunjukkan pada gambar 4.4.
a.
b.
Gambar 4.4. Spektrum Massa 1,4-Cyclohexadiena
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 12,481 merupakan senyawa
dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion molekul pada
m/e 136 diikuti frakmen- frakmen pada m/e 136,121,105,93,77,65, dan 41.
Dengan membandingkan spektrum yang diperoleh dengan data spektrum library,
yang lebih mendekati adalah 1,4-Cyclohexadiena sebanyak 16,87 % .
Adapun pola fragmentasi yang mungkin dari senyawa 1,4-cyclohexadiena
+1e
--2e
-m/e = 136 (C10H16) 1,4-Cyclohexadiena
-CH3(15)
m/e = 121 (C9H13) -C3H7(43)
m/e = 93 (C7H9)
Gambar 4.5. Pola Fragmentasi Yang Mungkin Dari Senyawa 1,4-Cyclohexadiena
3. Spektrum massa dari Nerol
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
a.
b.
Gambar 4.6. Spektrum Massa Nerol
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 18,073 merupakan senyawa
dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion molekul pada
m/e 136 diikuti frakmen- frakmen pada m/e 136,121,111,93,80,69,55 dan 41.
Dengan membandingkan spektrum yang diperoleh dengan data spektrum library,
yang lebih mendekati adalah Nerol sebanyak 3,07 % .
Adapun pola fragmentasi yang mungkin dari senyawa Nerol ditunjukkan
HO
4. Spektrum massa dari β-Myrcene
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
Wiley 229 , maka spektrum β-Myrcene ditunjukkan pada gambar 4.8.
a.
b.
Gambar 4.8. Spektrum Massa β-Myrcene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,991 merupakan senyawa
dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion molekul pada
m/e 136 diikuti frakmen- frakmen pada m/e 136,121,107,93,79,69,53 dan41.
Dengan membandingkan spektrum yang diperoleh dengan data spektrum library,
yang lebih mendekati adalah β-Myrcene sebanyak 1,94 % .
Adapun pola fragmentasi yang mungkin dari senyawa β-Myrcene
C
Gambar 4.9. Pola Fragmentasi Yang Mungkin Dari Senyawa β-Myrcene
5. Spektrum massa dari β-Pinene
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
Wiley 229 , maka spektrum β-Pinene ditunjukkan pada gambar 4.10.
b.
Gambar 4.10. Spektrum Massa β-Pinene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 9,485 menit merupakan
senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion
molekul pada m/e 136 diikuti frakmen- frakmen pada m/e
136,121,107,93,79,69,53dan 41. Dengan membandingkan spektrum yang
diperoleh dengan data spektrum library, yang lebih mendekati β-Pinene sebanyak
1,13 % .
Adapun pola fragmentasi yang mungkin dari senyawa β-pinene
CH2 H3C
H3C
+1e
--2e
-CH2 H3C
H3C
m/e = 136 (C10H16)
-CH3 (15)
H3C
m/e = 121 (C9H13) m/e = 93 (C7H9)
m/e = 79 (C6H7)
CH2
-CH2 (14)
m/e = 41 (C3H5) Beta Pinen
-C2H4 (28)
m/e = 69 (C5H9) -C4H4 (52)
-C2H4(28)
6. Spektrum massa dari α-Pinene
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
Wiley 229 , maka spektrum α-Pinene ditunjukkan pada gambar 4.12.
a.
b.
Gambar 4.12. Spektrum Massa α-Pinene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 8,016 menit merupakan
senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion
molekul pada m/e 136 diikuti frakmen- frakmen pada m/e
136,121,105,93,77,67,53 dan 41. Dengan membandingkan spektrum yang
diperoleh dengan data spektrum library, yang lebih mendekati adalah α-Pinene sebanyak 1,07 % .
Adapun pola fragmentasi yang mungkin dari senyawa α-Pinene
CH3 H3C
H3C
+1e
--2e
-CH3 H3C
H3C
m/e = 136 (C10H16)
-CH3 (15)
H3C H3C
-C2H4 (28)
m/e = 121 (C9H13) m/e = 93 (C7H9)
m/e = 77 (C6H5)
Alpa-Pinene
-CH4 (16)
Gambar 4.13. Pola Fragmentasi Yang Mungkin Dari α-Pinene
7. Spektrum massa dari 1,3,7-Octatriene
Berdasarkan hasil analisis dengan GC-MS yang telah disesuaikan dengan Library
a.
b.
Gambar 4.14. Spektrum Massa 1,3,7-Octatriene
Keterangan : a = Data spektrum massa hasil analisa GC-MS
b = Library Wiley 229 yang merupakan data pembanding
Puncak Kromatogram dengan waktu retensi 12,039 menit merupakan
senyawa dengan rumus molekul C10H16. Spektrum menunjukkan puncak ion
molekul pada m/e 136 diikuti frakmen- frakmen pada m/e
136,121,105,93,79,67,53 dan 41. Dengan membandingkan spektrum yang
diperoleh dengan data spektrum library, yang lebih mendekati adalah
1,3,7-Octatriene sebanyak 1,03 % .
Adapun pola fragmentasi yang mungkin dari senyawa
H2C C CH2 CH2 C
4.2.3. Uji Aktivitas Antioksidan Minyak Atsiri Kulit Buah Jeruk
PepayaDengan Metode DPPH
Minyak atsiri dari kulit buah jeruk pepaya segar dilakukan uji aktivitas
antioksidan dengan metode DPPH radikal bebas untuk diperoleh nilai IC
50.
Pemeriksaan aktivitas antiradikal bebas DPPH secara spektrofotometri dilakukan
dengan mereaksikan sampel dengan larutan DPPH dan diukur dengan
spektrofotometer UV-Visible pada panjang gelombang 515 nm yang berwarna
ungu. Warna akan berubah dari ungu menjadi kuning lemah apabila elektron
ganjil tersebut berpasangan dengan atom hidrogen yang disumbangkan senyawa
antioksidan. Direaksikan antara DPPH dengan atom H netral yang berasal dari
antioksidan.
Gambar 4.26. Reaksi antara DPPH dengan atom H netral
DPPH berfungsi sebagai senyawa radikal bebas stabil yang ditetapkan
secara spektrofotometri melalui persen peredaman absorbansi. Peredaman warna
ungu merah pada panjang gelombang (λ) 517 nm sebagai antiradikal bebas.
Kereaktifan dari golongan senyawa-senyawa yang berfungsi sebagai antiradikal
bebas ditentukan sebagian besar adanya gugus fungsi –OH (hidroksil) bebas dan
ikatan rangkap karbon-karbon lain dari senyawa fenol (Shivaprasad,et all., 2005)
Pada uji DPPH, peredaman radikal DPPH diikuti dengan pemantauan
penurunan absorbansi pada panjang gelombang yang terjadi karena pengurangan
dilaporkan sebagai IC50 merupakan konsentrasi antioksidan yang dibutuhkan
untuk 50% peredaman radikal DPPH pada periode waktu tertentu, 15-30 menit
(Pokornya, 2001).
. Menurut, Ionita (2003) tingkat kekuatan uji antioksidan senyawa
menggunakan metode DPPH dapat digolongkan menurut nilai IC50.
Tabel 4.5. Tingkat Kekuatan Antioksidan Dengan Metode DPPH
Intensitas Nilai IC50
Sangat kuat < 50 mg/L
Kuat 50-100 mg/L
Sedang 101-150 mg/L
Lemah >150 mg/L
Ketika minyak atsiri dipisahkan oleh destilasi uap, aktivitas
antioksidannya bagaimanapun sebagian hilang bahkan sebagian minyak atsiri
memiliki beberapa aktivitas antioksidan yang biasanya tidak terlalu tinggi
(Pokornya, 2001). Aktivitas minyak atsiri Kulit Buah Jeruk Pepaya sebagai
antioksidan sangat ditentukan oleh struktur kimia, jumlah dan posisi gugus
hidroksil serta metil pada cincin. Molekul tersubstitusi gugus hidroksil semakin
banyak semakin kuat menangkap radikal bebas DPPH karena kemampuan
mendonorkan atom hidrogen semakin besar (Yu Lin, 2009).
Pada tabel 4.4. menunjukkan telah terjadi peredaman radikal bebas DPPH
yang ditandai dengan menurunya absorbansi radikal bebas DPPH setelah
penambahan minyak atsiri Kulit Buah Jeruk Pepaya, dengan persamaan Least
squere diperoleh nilai IC50 sebesar 183,85mg/L. Hal ini menunjukkan minyak
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Berdasarkan analisa GC-MS menunjukkan hasil bahwa pada minyak atsiri
kulit buah jeruk pepaya senyawanya ada 16 senyawa. Volume minyak
atsiri yang dihasilkan 0,119 %.
2. Aktivitas antioksidan yang diperoleh dengan metode DPPH radikal bebas
dari minyak atsiri kulit buah jeruk pepaya adalah 183,85m�/� termasuk
golongan antioksidan lemah.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut:
1. Uji sifat antibakteri dari minyak atsiri kulit buah jeruk pepaya.
2. Uji sifat antioksidan dengan perbedaan konsentrasi serta diaplikasikan.