STUDI PENENTUAN KADAR Fe2O3 DALAM ALUMINA YANG
DIGUNAKAN SEBAGAI BAHAN BAKU DI PT INALUM DENGAN
METODE SPEKTROFOTOMETRI
KARYA ILMIAH
ANDRY ADHE PUTRA
072401028
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
STUDI PENENTUAN KADAR Fe2O3 DALAM ALUMINA YANG
DIGUNAKAN SEBAGAI BAHAN BAKU DI PT INALUM DENGAN
METODE SPEKTROFOTOMETRI
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh gelar
Ahli Madya
ANDRY ADHE PUTRA
072401028
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : STUDI PENENTUAN KADAR Fe2O3 DALAM ALUMINA
YANG DIGUNAKAN SEBAGAI BAHAN BAKU DI PT INALUM DENGAN METODE SPEKTROFOTOMETRI
Kategori : KARYA ILMIAH
Nama : ANDRY ADHE PUTRA
Nomor Induk : 072401028
Program Studi : D 3 KIMIA ANALIS
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERNYATAAN
STUDI PENENTUAN KADAR Fe2O3 DALAM ALUMINA YANG DIGUNAKAN SEBAGAI
BAHAN BAKU DI PT INALUM DENGAN METODE SPEKTROFOTOMETRI
KARYA ILMIAH
Saya mengakui bahwa tugas akhir ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, juni 2010
ABSTRAK
Telah dilakukan pemeriksaan kadar Fe2O3 dari empat jenis sampel alumina yang digunakan
sebagai bahan baku utama pada peleburan aluminium dengan menggunakan spektrofotometry dan standar industri yang ditetapkan sebagai pembandingnya di PT INALUM.
Hasil penelitian yang didapat kadar Fe2O3 masing-masing kode sampel adalah LM 5-003 A
(0,0041 %), LM 5-003 B (0,0047 %), KR 0914 I-A (0,0042 %), KR 0914 I-B (0,0052%). Dari
keempat jenis sampel yang diperiksa kadar Fe2O3 nya ternyata memenuhi persyaratan untuk
STUDY DETERMINATION OF RATE Fe2O3 IN USED AS BY ALUMINA IS RAW
MATERIAL IN PT INALUM WITH METHOD SPEKTROFOTOMETRI
ABSTRACT
Have been done by inspection of Fe2O3 rate from four used as by alumina sampel type is especial
raw material at forge of aluminium by using specified industry standard and spektrofotometry as its his in PT INALUM.
Result of got by research is Fe2O3 rate of is each sampel code is LM 003 A (0,0041 %), LM
5-003 B (0,0047 %), KR 0914 I-A (0,0042 %), KR 0914 I-B (0,0052%). From is fourth of checked by sampel type is its Fe2O3 rate in the reality fulfill conditions to be used standard upon which at
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Allah SWT yang maha Pengasih dan Maha
Penyayang, yang selalu memberikan rahmat dan hidayah-Nya kepada penulis seehingga dapat
menyelesaikan penulisan karya ilmiah ini. Dalam penulisan karya ilmiah ini penilis memilih
judul STUDI PENENTUAN KADAR Fe2O3 DALAM ALUMINA YANG DIGUNAKAN
SEBAGAI BAHAN BAKU DI PT INALUM DENGAN METODE
SPEKTROFOTOMETRI yang merupakn salah satu syarat untuk menyelesaikan pendidikan
Diploma III Kimia Analis.
Dalam penyusunan karya ilmiah ini penulis telah banyak mendapatkan bimbingan,
pengarahan, bantuan, dan saran serta kritik dari banyak pihak. Oleh sebab itu dengan segala
kerendahan hati, penulis mengucapkan terima kasih kepada :
1. Ibu DR. Marpongathun. M.Sc ., selaku dosen pembimbing yang telah memberikan
bimbingan dan pengarahan dalam penyelesaian karya ilmiah ini dan sekaligus sebagai
ketua Program Studi Kimia Analis Fakultas Matematika dan Ilmu Pengetahuan Alam.
2. Ibu DR. Rumondang Bulan, MS., selaku ketua Departemen Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam.
3. Orang tua tercinta Zulkifli dan Nurnina yang telah mendidik, mendoakan, dan
memberikan dukungan moril dan materil kepada penulis.
5. Staf dan karyawan pengendali mutu di PT INALUM yang telah banyak membantu
penulis dalam menyelesaikan karya ilmiah ini.
6. Serta seluruh teman-teman mahasiswa Kimia Analis stambuk 2007 yang telah banyak
membantu penulis dalam menyelesaikan karya ilmiah ini.
Dalam penulisan karya ilmiah ini masih banyak terdapat kekurangan, untuk itu penulis
mengharapkan kritik dan saran yang membangun agar karya ilmiah ini dapat lebih sempurna
lagi. Penulis berharap karya ilmiah ini dapat bermanfaat bagi pembaca pada umunya dan penulis
pada khususnya. Akhir kata penulis mengucapkan terima kasih.
Medan. April 2010
4.2 Perhitungan 27
4.2.1 perhitungan persamaan garis regresi 27
4.3 Pembahasan 32
BAB 5. KESIMPULAN DAN SARAN 33
5.1 Kesimpulan 33
5.2 Saran 34
DAFTAR PUSTAKA
ABSTRAK
Telah dilakukan pemeriksaan kadar Fe2O3 dari empat jenis sampel alumina yang digunakan
sebagai bahan baku utama pada peleburan aluminium dengan menggunakan spektrofotometry dan standar industri yang ditetapkan sebagai pembandingnya di PT INALUM.
Hasil penelitian yang didapat kadar Fe2O3 masing-masing kode sampel adalah LM 5-003 A
(0,0041 %), LM 5-003 B (0,0047 %), KR 0914 I-A (0,0042 %), KR 0914 I-B (0,0052%). Dari
keempat jenis sampel yang diperiksa kadar Fe2O3 nya ternyata memenuhi persyaratan untuk
STUDY DETERMINATION OF RATE Fe2O3 IN USED AS BY ALUMINA IS RAW
MATERIAL IN PT INALUM WITH METHOD SPEKTROFOTOMETRI
ABSTRACT
Have been done by inspection of Fe2O3 rate from four used as by alumina sampel type is especial
raw material at forge of aluminium by using specified industry standard and spektrofotometry as its his in PT INALUM.
Result of got by research is Fe2O3 rate of is each sampel code is LM 003 A (0,0041 %), LM
5-003 B (0,0047 %), KR 0914 I-A (0,0042 %), KR 0914 I-B (0,0052%). From is fourth of checked by sampel type is its Fe2O3 rate in the reality fulfill conditions to be used standard upon which at
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Satu-satunya industry peleburan aluminium di Indonesia sampai pada saat ini adalah PT.
Indonesia Asahan Aluminium (PT. INALUM) yang berlokasi mengadap selat malaka tepatnya di
daerah Kuala Tanjung, Kabupaten Asahan, Provinsi Sumatera Utara.
Pabrik peleburan aluminium PT INALUM ini mulai memproduksi aluminium untuk
dipasarkan tanggal 19 Maret 1982. Aluminium yang dihasilkan adalah aluminium primer (ingot)
yang mana merupakan bahan baku bagi industry hilir aluminium yang menghasilkan
barang-barang jadi seperti alat rumah tangga, bahan-bahan konstruksi bangunan, kabel listrik,
alat-alat transport dan lain-lain.
Pabrik peleburan aluminium disebut juga sebagai proyek “listrik dalam kaleng”, sebab listrik
yang dihasilkan oleh pembangkit listriknya, sebagian besar digunakamn untuk kepentingan
pabrik peleburan. Listrik yang dihasilkan melalui PLTA PT INALUM, yang terletak di sungai
asahan, disalurkan ke pabrik peleburan aluminium di Kuala Tanjung melalui 275 Kv jaringan
transmisi.
Proses peleburan aluminium di Kuala Tanjung dilakukan dengan system elektrolisa dengan
cara mereduksi alumina menjadi aluminium dengan menggunakan alumina, karbon, dan listrik
sebagai material utama. Pabrik ini memiliki 3 pabrik utama, yaitu pabrik karbon, pabrik reduksi,
Desain produksi aluminium ingot PT INALUM adalah 225.000 ton aluminium per tahun.
Namun dengan adanya Technology Improvement yang dilakukan oleh karyawan PT INALUM,
kini produksi PT INALUM jauh di atas desain produksinya. Tingkat efisiensi penggunaan arus
juga meningkat hingga lebih dari 92 %.
Kapasitas produksi aluminium batangan PT INALUM sangat bergantung pada jumlah listrik
yang dihasilkan oleh PLTA PT INALUM. Sedangkan PLTA PT INALUM sangat bergantung
pada kondisi permukaan air Danau Toba sebagai sumber air utama sungai Asahan.
Sebagai bahan baku utama dalam peleburan aluminium ini adalah alumina, kokas, hard pitch,
dan aluminium flourida. Alumina dielektrolisa di dalam klorit cair dengan menggunakan tenaga
listrik arus searah. Alumina yang digunakan di PT INALUM berbagai dari berbagai Negara
antara lain : Australia, Jepang, dan lain-lain.
Alumina yang dipakai biasanya mempunyai kemurnian 99.70 % dan 99.90 % dengan
pengotor Fe2O3, SiO2, Na2O, CaO, TiO2, P2O5 dan lain-lain. Semua pengotor yang terdapat di
dalam alumina tersebut akan terdapat sebagai pengotor juga dalam aluminium primer yang
dihasilkan. Tinggi rendahnya kadar masing-masing pengotor tersebut sangat bergantung pada
asal usul alumina tersebut, seperti sumber bauxite (daerahnya) di samping alat-alat yang
digunakan dan keterampilan manusia untuk mengoperasikannya. Oleh karena itu perlu dilakukan
pengontrolan terhadap mutu alumina yang digunakan sebagai bahan baku pabrik peleburan
1.2 Perumusan Masalah
- Studi perbandingan antara metode penentuan besi oksida dalam alumina yang digunakan
di PT. INALUM
1.3 Tujuan
- Untuk mengetahui kadar Fe2O3 yang terdapat pada masing-masing sampel alumina.
- Untuk mengetahui pengaruh tinggi rendahnya kadar Fe2O3 yang terdapat dalam alumina
yang digunakan sebagai bahan baku utama.
- Untuk mengetahui apakah alumina yang digunakan masih memenuhi standar industry.
1.4 Manfaat
- Untuk mengetahui zat-zat pengotor yang terdapat di dalam alumina yang digunakan
BAB 2
TINJAUAN PUSTAKA
2.1 Aluminium
Aluminium berasal dari biji aluminium alam, yang dijumpai sebagai tambang bauksit
yang mengandung kandungan utama aluminium oksida (alumina). Baksit diolah dalam dapur
listrik yang menghasilkan ingot aluminium.
Aluminium tahan karat karena di udara membentuk paduan aluminium oksida hasil
reaksi antara O2 di udara dengan permukaan logam aluminium. Lapisan aluminium ini berisi
oksida yang cukup kedap udara dan tidak dapat terhembus dan ini menghambat terjadinya
pengkaratan. Agar aluminium ini tahan terhadap karat perlu dilakukan finishing lebih lanjut
dengan meggunakan anodisasi/anodixing. Lapisan oksida aluminium terbentuk secara alami
amat tipis ini membuat daya tahan meningkat, lapisan ini dapat dipertebal dengan proses
anodisasi. Dengan cara menempatkan aluminium ke dalam larutan elektrolit yang kemudian
dialiri arus listrik. (Wargadinata, 2002)
2.2 Alumina
Satu-satunya oksida aluminium adalah alumina(Al2O3). Meskipun demikian,
kesederhanaan ini diimbangi dengan adanya bahan-bahan polimorf dan terhidrat yang sifatnya
bergantung kepada kondisi pembuatannya. Terdapat dua bentuk anhidrat Al2O3 yaitu α-Al2O3
mengkristal dalam kedua struktur yang sama. Keduanya mempunyai tatanan terkemas rapat
ion-ion oksida tetapi berbeda dalam tatanan kation-ion-kation-ionnya.
α-Al2O3 stabil pada suhu tinggi dan juga metastabil tidak terhingga pada suhu rendah. Ia
terdapat di alam sebagai mineral korundum dan dapat dibuat dengan pemanasan -Al2O3 atau
oksida anhidrat apa pun di atas 1000o. -Al2O3 diperoleh dengan dehidrasi oksida terhidrat pada
suhu rendah (~ 450o). α-Al2O3 keras dan tahan terhadap hidrasi dan penyerapan asam. -Al2O3
mudah menyerap air dan larut dalam asam; alumina yang digunakan untuk kromatografi dan
diatur kondisinya untuk berbagai kereaktifan adalah -Al2O3.
Terdapat beberapa bentuk alumina terhidrat dengan stokiometri dari AlO.OH sampai
Al(OH)3. Penambahan amoniak pada larutan mendidih garam aluminium menghasilkan suatu
bentuk AlO.OH yang dikenal sebagai bohmite. Bentuk kedua AlO.OH terdapat di alam sebagai
mineral diaspore. Hidroksida sesungguhnya Al(OH)3 diperoleh sebagai endapan Kristal putih
bilamana CO2 dialirkan ke dalam larutan basa “Aluminat”. (Max Well, 1968)
2.2.1 Proses Pengolahan Alumina
Alumina adalah bahan baku utama dalam industry peleburan aluminium. Alumina ini
berasal dari bermacam-macam bahan baku seperti : bauksit, dowsit, kaolinit, anorthosit, dan
lain-lain.
Untuk mendapatkan alumina, bahan baku tersebut dapat diekstraksi dan masing-masing
bahan baku tersebut mempunyai kandungan alumina yang berbeda-beda serta tingkat pengotoran
yang berbeda-beda pula. Akan tetapi pada umumnya bauksit merupakan bijih yang paling
suatu tambang mungkin mengandung satu atau lebih mineral aluminium yang masih bercampur
dengan bermacam-macam pengotoran.
Gibbsite megandung silika reaktif dalam jumlah yang rendah dibanding dengan boehmite
dan diaspore, sehingga ongkos untuk memproduksi alumina lebih murah karena suhu, tekanan
dan kaustik soda dalam prosesnya lebih rendah. Pengotoran-pengotoran utama yang terdapat
pada bijih bauksit adalah SiO2, Fe2O3, TiO2, MnO2, NiO2, Cr2O3, dan lain-lain.
Pada prinsipnya pembuatan alumina dari bauksit adalah proses bayer yang ditemukan
pada tahun 1888 oleh Karl Bayer seorang ahli dari Jerman. Secara garis besar proses pembuatan
alumina dari bauksit dengan metode bayer terdiri dari 4 tahap yaitu : ekstraksi, penjernihan,
pengendapan, dan kalsinasi. (www.azom.com)
2.2.2 Produksi Al2O3 dengan Proses Bayer
Mendominasi bahan baku untuk produksi aluminium adalah bauksit. ini adalah suatu
aluminium hidroksida yang tidak murni dengan Fe2O3 dan silika sebagai zat pengotor utama.
kebanyakan bauksit diperlakukan dalam proses bayer untuk produk Al2O3 murni.
Setelah solusi telah dipenuhi dengan hidroksida aluminium di dalam bagian yang dapat
larut dipindahkan oleh penyelesaian, cucian, dan filtrasi. solusi didinginkan ke suhu-kamar dan
melemahkan dengan air. ini penurunan temperatur dan pH membawa solusi itu ke dalam area
keunggulan untuk Al(OH)3. bagaimanapun, dalam rangka mempercepat hidroksida itu, menabur
calcined pada sekitar 1200 oC untuk memberi 99.5% Al2O3, dimana solusi dipusatkan oleh
penguapan dan dikembalikan ke dalam larut langkah.
Jika bauksit tadinya tanah kerikil tinggi pada bagian yang tidak dapat larut dari larut
langkah, lumpur merah, akan masih berisi sejumlah oksida aluminium pantas dipertimbangkan.
proses khusus telah dikembangkan untuk memulihkan oksida aluminium ini. Dengan begitu
lumpur yang merah mungkin calcined dengan kapur perekat dan abu soda untuk memberi
aluminat sodium dapat larut dalam air dan silikat zat kapur tidak dapat larut, yang terdahulu
dilarutkan ke luar dan trated seperti diuraikan di atas. lumpur merah yang sisanya menjadi nilai
kecil, tetapi boleh temukan beberapa penggunaan sebagai suatu bijih besi. (Rosenqvist, 1983)
2.2.3 Sifat-Sifat Alumina
Aluminium oksida adalah insulator (penghambat) panas dan listrik yang baik. Umumnya
Al2O3 terdapat dalam bentuk kristalin yang disebut dengan corondum atau α-aluminium oksida.
Aluminium oksida dipakai sebagai bahan abrasif dan sebagai komponen dalam alat pemotong,
karena sifat kekerasannya.
Aluminium oksida berperan penting dalam ketahan logam aluminium terhadap
pengkaratan dengan udara. Logam aluminium sebenarnya amat mudah bereaksi dengan oksigen
di udara. Aluminium bereaksi dengan oksigen membentuk aluminium oksida, yang terbentuk
sebagai lapisan tipis yang dengan cepat menutupi permukaan aluminium. Lapisan ini melindungi
Alumina yang dihasilkan melalui anodiasi bersifat amorf, namun beberapa proses
oksidasi seperti plasma electrolytic oxydation menghasilkan sebagian besar alumina dalam
bentuk kristalin, yang meningkatkan kekerasan.
Menjelaskan sifat-sifat aluminium oksida dapat menimbulkan kebingungan karena dapat
berada pada beberapa bentuk yang berbeda. Salah satu bentuknya sangat tidak reaktif. Ini
diketahui secara kimia sebagai α-Al2O3 dan dihasilkan pada temperatur yang tinggi. Aluminium
oksida merupakan senyawa amfoter, artinya dapat bereaksi baik sebagai basa maupun asam.
Reaksi dengan air
Aluminium oksida tidak dapat bereaksi secara sederhana dengan air seperti natrium
oksida, magnesium oksida, dan tidak dapat larut dalam air. Walaupun masih mengandung ion
oksida, tetapi terlalu kuat berada dalam kisi padatan untuk bereaksi dengan air.
Reaksi dengan asam
Aluminium oksida mengandung ion oksida, sehingga dapat bereaksi dengan asam seperti
pada natrium atau magnesium oksida. Artinya sebagai contoh, aluminium oksida dapat bereaksi
dengan asam klorida encer yang panas menghasilkan larutan aluminium klorida.
Al2O3 + 6HCl 2 AlCl3 + 3 H2O
Dalam hal ini (dan sama dalam reaksi dengan asam yang lain), aluminium oksida menunjukkan
Reaksi dengan basa
Aluminium oksida juga dapat menunjukkan sifat asamnya, dapat dilihat dalam reaksi
dengan basa seperti larutan natrium hidroksida.
Berbagai aluminat dapat terbentuk senyawa dimana aluminium ditemukan dalam ion
negatif. Hal ini menunjukkan karena aluminium memiliki kemampuan untuk membentuk ikatan
kovalen dengan oksigen
Pada contoh natrium, perbedaan elektronegativitas antara natrium dengan oksigen terlalu
besar untuk membentuk ikatan selain ikatan ionik. Elektronegativitas meningkat dalam satu
periode sehingga elektronegativitas antara aluminium dan oksigen lebih kecil. Hal ini
menyebabkan terbentuknyanikatan kovalen diantara keduanya. Dengan larutan natrium
hidroksida pekat yang panas aluminium oksida bereaksi menghasilkan larutan natrium
tetrahidroksoaluminat yang tidak bewarna.
2.2.4 Fase Alumina dan Penggunaannya
2.2.4.1 Hidrat Alumina (hidroksida alumina)
Hidrat alumina ini merupakan produksi pertama yang dipakai yang diperoleh dengan
proses Bayer dan kandungan aluminanya ± 65 %.
Variasi-variasi yang terjadi di dalam produksi ini merupakan perbedaan kandungan soda
dan besi ataupun urutan penaganan-penganan selanjutnya. Hidriksida alumina ini dipakai untuk
produk-produk bahan kimia aluminium, yang dipakai sebagai perubahan (pengubah-pengubah di
2.2.4.2 Calcined Alumina
Calcined alumina ini mempunyai kandungan alumina 99 %, yang terdiri dari 93 %
alumina aktif dan 6 % kandungan air campuran kimia. Calcined alumina ini merupakan produk
akhir utama dari proses Bayer. Calcined alumina digunakan untuk berbagai keperluan antara lain
:
1. untuk peleburan (smelting), dipakai adalah yang umum, berukuran kasar dan sedang.
2. untuk bata tahan api.
3. untuk busi kendaraan dipakai kadar sodanya yang rendah.
4. untuk pembuatan gelas dipakai ukuran sedang dan halus serta kandungan soda yang
rendah.
5. Untuk pembuatan cat
2.2.4.3 Fused Alumina
Fused alumina putih ini mempunyai kandungan alumina sebanyak 99.5 % - 99.9 %, dan
diproduksi dari calcined alumina di dalam pemanas listrik. Sedangkan fused alumina cokelat
kandungan alumina sebanyak 94 % - 97 % dan diproduksi dari calcined bauksit di dalam
pemanas listrik. Alumina-alumina fused ini secara jelas digunakan dalam industri abrasives (alat
pengempelas, penggosok, dan o bat asah).
2.2.4.4 Tabular Alumina
(2040-2300 oC) untuk mengubah alumina corundum ke dalam bentuk kristal berbentuk tablet yang amat keras dan padat. Alumina jenis ini terutama dipakai dalam refractory.
2.2.5 Pengggunaan Alumina
Setiap tahunnya, 65 juta ton alumina digunakan lebih dari 90 %-nya digunakan dalam
pruduksi logam aluminium. Aluminium oksida digunakan dalam pembuatan bahan kimia
pengelolaan air seperti aluminium sulfat, polialuminium klorida, dan natrium aluminat.
Berton-ton alumina digunakan dalam pembuatan zeolit, pelapisan pigmen titania dan pemadam api.
Aluminium oksida memiliki kekerasa 9 dalam skala Mohr. Hal ini menyebabkannya banyak
digunakan sebagai abrasif untuk menggantikan intan yang jauh lebih mahal. Beberapa jenis
ampelas, dan pembesih CD/DVD juga menggunakan aluminium oksida.
2.2.6 Proses fabrikasi alumina
Secara alami, aluminium oksida terdapat dalam bentuk kristal corundum. Batu mulia rubi
dan sapphire tersusun atas corundum dengan warna-warna khas yang disebabkan kadar
ketidakmurnian dalam struktur corundum.
Aluminium oksida atau alumina merupakan komponen utama dalam bijih bauksit
aluminium yang utama. Pabrik alumina terbesar di dunia adalah Alcoa, Alcan, dan Rusal.
Perusahaan yang memiliki spesialisasi dalam produksi aluminium oksida dan aluminium
hidroksida misalnya adalah Alcan dan Almatis. Bijih bauksit terdiri dari Al2O3, Fe2O3, dan SiO2
yang tidak murni. Campuran ini dimurnikan terlebih dahulu melalui proses Bayer :
Fe2O3 tidak larut dalam basa yang dihasilkan, sehingga bisa dipisahkan melalui penyaringan.
Sio2 larut dalam bentuk silikat Si(OH)62-. Ketika cairan yang dihasilkan didinginkan, terjadi
endapan Al(OH)3, sedangkan silikat masih larut dalam cairan tersebut. Al(OH)3 yang dihasilkan
kemudian dipanaskan.
2Al(OH)3 + panas Al2O3 + H2O
Al2O3 yang terbentuk adalah alumina.
Pada tahun 1961, perusahaan General Electric mengenbangkan lucalox, alumina
transparan yang digunakan dalam lampu natrium. Pada Agustus 2006, ilmuwan Amerika Serikat
yang bekerja untuk 3M berhasil mengembangkan teknik untuk membuat alloy dari aluminium
oksida dan unsur-unsur lantanida, untuk memproduksi kaca yang kuat, yang disebut dengan
alumina transparan. (www.chem-is-try.org)
2.3 Besi (Fe)
Besi yang murni adalah logam bewarna putih perak yang kukuh dan liat. Ia melebur pada
1535 oC. jarang terdapat besi yang komersial yang murni; biasanya besi mengandung sejumlah
kecil karbida, silisida, fosfida, dan sulfida dari besi, serta sedikit grafit. Zat-zat pencemar ini
memainkan peranan penting dalam kekuatan struktur besi. Besi dapat dimagnitkan. Asam klroda
encer atau pekat dan asam sulfat encer melarutkan besi. Pada mana dihasilkan garam-garam besi
(II) dan gas hidrogen.
Garam-garam besi (II) atau ferro diturunkan dari besi (II) oksida, FeO. Dalam larutan,
garam-garam ini mengandung kation Fe2+ dan bewarna sedikit hijau. Ion-ion gabungan dan
kompleks-kompleks sepit yang bewarna tua adalah juga umum. Ion besi (II) dapat mudah
dioksidasikan menjadi besi (III), maka merupakan zat pereduksi yang kuat. Semakin kurang
asam larutan itu, semakin nyatalah efek ini; dalam suasana netral atau basa bahkan oksigen dari
atmosfer akan mengoksidasikan ion besi (II). Maka larutan besi (II) harus sedikit asam bila
disimpan untuk waktu yang agak lama.
Garam-garam besi (III) atau ferri diturunkan dari oksida besi (III), Fe2O3. Mereka lebih
stabil daripada garam besi (II). Dalam larutannya, terdapat kation-kation Fe2+ yang bewarna
kuning muda; jika larutan mengandung klorida, warna menjadi semakin kuat. Zat-zat pereduksi
mengubah ion besi (III) menjadi besi (II). (Vogel, 1985)
2.4 Besi Oksida(Fe2O3) dalam alumina
Bauksit ditambang di Weipa, di Queensland, lalu ditumbuk dan dicuci untuk membuang
air kotoran larut. Bahan yang tersisa disovved dalam NaOH dan dipanaskan. Fe2O3 adalah oksida
kasar dan arena itu tidak larut dalam dalam ini dan dapat disaring. Seiring waktu Na3Al(OH)6
terurai menjadi Al(OH)3 (suatu spesies yang tidak larut), yang juga disaring. Ini kemudian diurai
dengan pemanasan untuk temperature di atas 1000oC untuk membberikan alumina.
Besi oksida di dalam alumina harus mempunyai skala yang lebih kecil, karena besi dapat
bersifat korosi. Apabila kadar besi dalam alumina tinggi akan mempengaruhi kualitas aluminium
yang diperoleh. Banyak paduan yang telah dikembangkan yang tujuan untuk meningkatkan
khususnya dan ketahanan korosi. Sedangkan penambahan sebuah elemenpaduan meningkatkan
kekuatan, itu mengurangi ketahanan korosi, membuat kompromi property yang diperlukan.
(Rosenqvist, 1983)
2.5 Beberapa Metode Penentuan Besi
2.5.1 Secara Kimia
2.5.1.1 secara titrasi
Penentuan besi dengan metode titrasi yaitu dengan titrasi oksidasi reduksi. Dimana
pelarutan sering dilakukan dalam asam klorida pekat; besi (III)d direduksi menjadi besi(II) lalu
ditetapka dalam larutan yang dihasilkan. Dalam titrasi ini, larutannya tidak bewarna atau sedikit
saja bewarna. Pemakaian indikator tidaklah perlu karena kalium permanganate 0,01 N sudah
member warna merah jambu-pucat. Intensitas warna dalam larutan yang encer dapat
ditingkatkan. Jika dikehendaki, dengan penambahan suatu indikator redoks tepat sebelum titik
akhir titrasi. Ini biasanya tidak diperlukan, tyetapi menguntungkan jika digunakan larutan
permanganate yang lebih encer. Larutan diasamkan dengan asam sulfat encer. Jika jon klorida
ada, akan diperoleh hasil yang tinggi, karena reaksi antara besi(II) dan permanganat mengimbas
(menginduks i) oksidasi dari asam klorida.
Suatu larutan yang mengandung besi dalam keadaan trivalent dapat juga dianalisis
dengan titrasi dengan kalium permanganat standar setelah mereduksi besi kekeadaan trivalent.
2.5.1.2 secara gravimetric
Larutan yang mengandung garam besi(III) diolah dengan larutan air ammonia yang
sedikit berlebih untuk mengendapkan oksida-terhidrasi Fe2O3xH2O. endapan tak mempunyai
komposisi stokiometric yang tetap, tetapi mengandung air dalam jumlah yang berbeda-beda,
sebagian terikat secara kimia dan sebagian teradsorpsi.
Seperti yang diharapkan dari sifatnya yang koloidal, besi(III) oksida terhidrasi
mempunyai kecenderungan yang besar untuk mengadsorpsi ion-ion yang lain yang ada. Jika
penendapan dilakukan dari larutan basa, ion-ion yang pertama-tama teradsorpsi adalah ion
hidroksida dan ion-ion ini dengan mudah menahan. Dengan adsorpsi yang kedua, ion-ion positif
yang mungkin ada. Jika terdapat ion ammonium dengan sangat berlebih dalam larutan yang
diendapkan dan dalam larutan pencuci, adsorpsi kation dapat dijaga seminimal mungkin, karna
ammonium mudah menguap jika dipijarkan.
Besi(III) oksida terhidrasi, ketika dipijarkan pada 1000o C, menghasilkan besi(III) oksida, pada temperature-temperatur yang tinggi, terbentuk tribesi teroksida dengan perlahan-lahan.
Pemijaran ini haruslah dilakukan pada kondisi-kondisi oksidasi yang baik, terutama sewaktu
pembakaran kertas saring, karena kalau tidak, dapat timbul pereduksi parsial menjadi oksida
megnetik. Produk-produk reduksi ini hanya dengan lambatdiubah menjadi besi(III) oksida
2.5.2 Secara Spektroskopi
2.5.2.1 spektrofotometri uv-visible
Banyak senyawa organik yang menyerap dalam daerah ultraviolet spektrumnya, dan pra
pengolahan hanya melibatkan pemisahan pengganggu-pengganggu. Beberapa unsur dalam tabel
berkala menyerap dengan kuat dalam daerah tampak atau ultraviolet, sekurang-kurangnya dalam
oksidasi tertentu, dan tahap-tahap pendahuluan dapat melibatkan reaksi redoks maupuin
pemisahan.
Perkembangan absorpsi dengan pertolongan reagensia anorganik kadang-kadang
dimungkinkan. Miksalnya besi dapat ditetapkan dengan memanfaatkan warna merah yang
diperoleh dengan menggunakan larutan besi (III) dengan o-fenantrolina. Sistem ini menjadi
rumit oleh kecenderungan terbentuknya kompleks yang lebih tinggi.
Kompleks bewarna yang dibentuk oleh ion logam dengan reagensia organik menawarkan
keanekaragaman metode spektrofotometri yang paling mengesankan, dan mereka teristimewa
berguna dalam bidang analisis penurut. Kebanyakan kompleks ini adalah bertipe kelat yang
dibahas lebih lengkap di tempat lain. (Underwood, 1983)
Molekul spektrofotometri uv-visible juga biasanya dilakukan dengan menggunakan
sebuah transmitansi pengukuran dengan sampel cair. Dalam hal ini suatu spesies molekul dalam
larutan adalah diukur, sehingga tidak perlu untuk melakukan langkah atomisasi yang dijelaskan
Intensitas independen warna pada kisaran pH 2-9. Kompleks ini sangat stabil dan intensitas
warna tidak berubah pada waktu yang lama.
Satu komplikasi adalah bahwa besi harus dalam keadaan besi. Dengan demikian, agen
mengurangi harus ditambahkan ke sampel untuk mengkonversi Fe3+ menjadi berbentuk
kompleks. (Basset, 1994)
2.5.2.2 spektrofotometri serapan atom (AAS)
Metode spektrofotometri serapan atom berprinsip pada absorbsi cahaya oleh atom-atom
menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya.
Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat
elektronik suatu atom. Transisi elektronik suatu unsur bersifat spesifik. Dengan absorbsi energi,
berarti lebih banyak memperoleh energi, suatu atom pada keadaan dasar dinaikan tingkat
energinya ke tingkat eksitasi.
Spektrofotometer Serapan Atom merupakan alat instrumentasi yang paling banayak di
gunakan untuk mengukur kadar unsur-unsur. Bila suatu larutan analit diaspirasikan ke dalam
nyala api maka akan terjadi suatu larutan berbentuk gas yang di sebut plasma. Plasma ini berisi
suatu partikel-partikel atom yang telah teratomisasi (telah direduksi menjadi atom-atomnya).
Pada Spektrofotometer Serapan Atom, radiasi dari suatu sumber radiasi yang sesuai (lampu
katoda cekung) di lewatkan kedalam nyala api yang telah teratomisasi maka radiasi tersebut akan
diabsorbsi oleh atom yang telah teratomisasi. Besarnya radiasi yang diabsorbsi diketahui dari
selisih radiasi asal dengan radiasi yang di teruskan (yang tidak terabsorbsi). Konsentrasi unsur
hubungan antara absorben dengan konsentrasi berbandng lurus atau liner. Untuk menentukan
konsentrasi suatu unsur dapat diketahui dengan menggunakan larutan standar untuk
mendapatkan kurva kalibrasi. Analisis yang menggunakan Spektrofotometer serapan atom
adalah analisis K, Na, Ca, Mg, Al, Fe, Cu, Zn, Mn, dan beberapa logam-logam lainnya.
(www.chem-is-try.org)
2.6 Analisis Fe2O3 dalam Alumina yang Digunakan di PT.INALUM
Analisa besi dalam alumina yang digunakan di PT.INALUM dengan menggunakan
spektrofotometer varian cary 50 uv-vis, yang dilengkapi dengan balok kisi spektrofotometer
dengan konstan 20 nm bandpass dan sebuah lampu kilat Xe intensitas tinggi digunakan sebagai
sumber untuk kedua UV dan terlihat cahaya, spektrofotometer ini digunakan di PT. INALUM
karena dapat mengambil 80 data per detik dan juga dapat mengkalibrasi absorbansi dan
menyiapkan kurva kalibrasi dengan akurat.
Di INALUM juga menggunakan metode 1,10 orto fenantrolin karena dapat bereaksi
dengan logam seperti besi untuk membentuk bewarna sangat kompleks. Property ini memberikan
metode yang sangat baik dan sensitive untuk menentukan ion logam dalam larutan tersebut.
Sebagai contoh, o-fenantrolin dapat bereaksi dengan besi membentuk kompleks bewarna merah.
Dari kompleks besi, panjang gelombang intensitas serapan maksimum pada 508 nm. Nilai ini
menunjukkan besar kompleks menyerap sangat kuat. Intensitas warna pH pada kisaran 2-9.
Kompleks ini sangat stabil dan warna tidak berubah pada jangka waktu yang panjang.
bewarna dengan besi(III) tetapi spectrum yang berbeda dari kompleks besi dan warnanya tidak
intens. Jadi seseorang tidak bias menetukan total besi ini dengan membuat pengukuran hanya
pada satu panjang gelombang. Oleh karena itu, agen mengurangi ringan akan ditambahkan
sebelum warna dikembangkan dalam rangka menyediakan ukuran masa kini total Fe dalam
larutan. Hidroksilamin, sebagai garam hidrokloridanya dapat juga digunakan. Di PT. INALUM
tidak menggunakan metode titrasi karena proses pengerjaannya membutuhkan banyak waktu
sehingga metode titrasi ini tidak digunakan dalam menganalisis bahan baku hanya dilakukan
untuk menganalisis bahan pendukung. Untuk menetukan besi dalam bentuk oksida tidak
dilakukan pengukuran dengan AAS karena AAS tidak bisa mengukur senyawa tetapi bisa
BAB 3
METODOLOGI PERCOBAAN
3.1 Pengambilan Sampel
Bahan baku alumina yang masuk ke peleburan melalui kapal yang bermuatan lebih
kurang 22.000 ton dikeluarkan (Unloading) dengan menggunakan Belt Conveyor dengan
kecepatan 100 ton/jam. Kemudian setiap 2 jam sekali alumina diambil dari ban berjalan secara
manual sebanyak lebih kurang 2 kg. lalu dimasukkan ke dalam kantong plastic dan diikat.
Sampel yang telah diikat dipindahkan dari tempat sampling ke laboratorium SQA agar dapat
dilakukan proses preparasi sampel.
3.2 Preparasi Sampel
Dari sampel yang terkumpul di bawa ke ruang preparasi, maka sampel tersebut siap untuk
dipreparasi dengan menggunakan alat devider. Devider ini berbentuk persegi panjang dimana
bagian dalamnya dibagi menjadi beberapa bagian secara berselang-seling (ruas kanan dan ruas
kiri) dan juga mempunyai penampung dari dua bagian yaitu A dan B. lalu alumina dimasukkan
ke dalam Devider, kemudian hasil tampungan sampel bagian A diambil, dan bagian B
dikumpulkan pada tempat sampel alumina. Sampel bagian A diambil dan dimasukan ke dalam
devider dan dibagi menjadi dua sehingga dihasilkan sampel homogen yang mewakili
3.3 Alat-alat
20.Botol semprot polyetilen 500 ml
21.Spektrofotometer Cary-50
23.Corong gelas
24.Kertas saring
25.Sendok sampel
3.4 Bahan-bahan
1. Na2CO3 anhidrous (special grade)
2. H3BO3 (special grade)
3. HNO3 (special grade)
4. HNO3 (1+1)
5. Larutan CH3COONa 50%
6. Larutan Hidroxilammonium Chlorida 1%
7. Larutan o-phenantroline 0,2%
8. Larutan standar Fe2O3 0,01 mg/ml
9. Air destillat
10.Sampel alumina LM 5-003 A
11.Sampel alumina LM 5-003 B
12.Sampel alumina KR 0914 I-A
3.5 Prosedur
a. Penyiapan larutan sampel
1. Setting Furnace 1000 oC dan setting sand bath
2. Ditimbang masing-masing sampel sebanyak 1gr ke dalam krusible platina 50 ml dengan
ketelitian ± 0,1, kemudian ditambahkan 5 gr Na2CO3 dan 3 gr H3BO3 sebagai pereaksi,
aduk hingga merata
3. Dipreheating di atas plate heater selama 30 menit hingga sempurna
4. Dipanaskan ke dalam Muffle Furnace dengan suhu 1000 oC selama ± 30 menit
5. Keluarkan krusible platina yang berisi sampel dari Muffle Furnace dan diputar-putar
krusible platina tersebut sehingga lelehan sampel menempel pada dinding krusible
platinum (untuk memudahkan pelarutan).
6. Ditambahkan air destilat lalu dilarutkan di atas sand bath hingga sampel larut sempurna
7. Masukkan ke dalam beaker Teflon 100 ml yang berisi 20 ml HNO3 (1:1) dibilas cawan
platina 1 ml HNO3 (1:1) dan dituangkan kembali ke beaker Teflon
8. Panaskan beaker Teflon hingga larut sempurna, lalu dinginkan dan tuangkan ke dalam
labu ukur 100 ml dan tepatkan hingga garis tanda batas dengan air destilat
9. Pipet 40 ml masing-masing larutan sampel ke dalam beaker polyetilen 100 ml
10.Ditambahkan 10 ml CH3COONa 50%
11.Buat larutan di atas menjadi pH 3-4 dengan menambahkan CH3COONa 50% atau HNO3
(1:1)
12.Tuangkan ke dalam labu ukur 100 ml
14.Tambahkan 2 ml 0-phenantroline 0,2%
15.Tepatkan hingga tanda batas, kocok dan biarkan pewarna selama 10 menit.
b. Penyiapan larutan blanko
Untuk penyiapan blanko digunakan langkah yang sama dengan penyiapan larutan
sampel, tetapi blanko tidak menggunakan sampel dan bebas dari ion.
c. Penyiapan larutan standar
1. Pipet larutan standar Fe2O3 0,01 mg/ml sebanyak 0, 3, 5, 10, 15 ml masing-masing ke
dalam beaker polyetilen 100 ml
2. Tambahkan 10 ml CH3COONa 50%
3. Buat larutan di atas menjadi pH 3-4 dengan menambahkan CH3COONa 50% dan
HNO3(1+1)
4. Tuangkan ke dalam labu ukur 100 ml
5. Tambahkan 2 ml hydroxylamine hydrochloride 1%
6. Tambahkan 2 ml o-phenantroline 0,2%
7. Tepatkan hingga tanda, kocok dan biarkan pewarna selama 10 menit.
d. Pengukuran larutan sampel
Ambil sebagian dari masing-masing larutan sampel lalu dimasukkan ke dalam kuvet,
e. Pengukuran larutan blanko dan larutan standar
Diambil sebagian dari larutan blanko dan sebagian larutan standar lalu dimasukkan ke
dalam kuvet, kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang
BAB 4
HASIL DAN PEMBAHASAN
4.1 Data
Dari hasil pengamatan yang telah dilakukan, maka diperoleh data dalam tabel berikut :
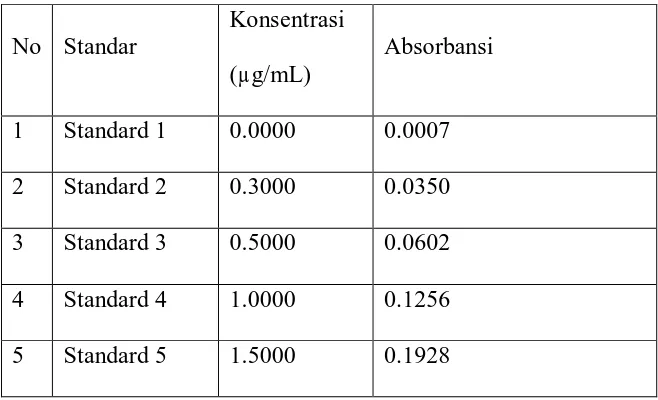
Tabel 4.1 Hasil Pengukuran Absorbansi Larutan Standar Fe2O3
No Standar
Tabel 4.2 Hasil Pengukuran Absorbansi Larutan Sampel Fe2O3 dalam Alumina
No Sampel Absorbansi
1 Alumina LM 5-003 A 0.0194
2 Alumina LM 5-003 B 0.0224
4.2 Perhitungan
4.2.1 perhitungan persamaan garis regresi
Untuk menghasilkan persamaan garis regresi dari kurva kalibrasi dapat ditentukan
dengan menggunakan metode least square sebagai berikut :
No X Y XY X2
1 0.0000 0.0007 0.0000 0.0000
2 0.3000 0.0350 0.0105 0.0900
3 0.5000 0.0602 0.0301 0.2500
4 1.0000 0.1256 0.1256 1.0000
5 1.5000 0.1928 0.2892 2.2500
n = 5 (∑X = 3.3000) (∑Y = 0.4143) (∑XY = 0.4554) (∑X2 = 3.5900)
Dimana : X = konsentrasi larutan standar
Y = absorbansi larutan standar
a =
=
= 0.1276
=
= − 0.0020
Persamaan garis regresi baru
Y = ax + b
Y1 = (0.1276)(0.0000) − 0.0020 = − 0.0020
Y2 = (0.1276)(0.3000) – 0.0020 = 0.0362
Y3 = (0.1276)(0.5000) – 0,0020 = 0.0618
Y4 = (0.1276)(1.0000) – 0.0020 = 0.1256
Y5 = (0.1276)(1.5000) – 0.0020 = 0.1894
X Y
0.0000 − 0.0020
0.3000 0.0362
0.5000 0.0618
1.0000 0.1256
Perhitungan konsentrasi Fe2O3 dalam alumina
Konsentrasi sampel dapat dihitung dengan mensubtitusikan harga Y (absorbansi) larutan
ke dalam persamaan garis regresi Y = ax + b, maka untuk sampel dapt dihitung X =
Konsentrasi Fe2O3 dalam sampel alumina LM 5-OO3 A
X =
=
= 0.1677
Konsentrasi Fe2O3 dalam sampel alumina LM 5-OO3 B
X =
=
= 0.1912
Konsentrasi Fe2O3 dalam sampel alumina KR0914 I-A
X =
= 0.1708
Konsentrasi Fe2O3 dalam sampel alumina KR0914 I-B
X =
=
= 0.2108
Kadar Fe2O3 dalam alumina sebagai berikut :
Fe2O3(%) =
Dimana :
[ ] = konsentrasi pembacaan grafik (µg/ml)
V = volume labu ukur (ml)
Fp = factor pengenceran
1. menghitung kadar Fe2O3 dalam sampel alumina LM 5-003 A
Fe2O3(%) =
=
= 0.0041 %
2. mengitung kadar Fe2O3 dalam sampel alumina LM 5-003 B
Fe2O3(%) =
=
= 0.0047 %
3. menghitung kadar Fe2O3 dalam sampel alumina KR 0914 I-A
Fe2O3(%) =
=
4. menghitung kadar Fe2O3 dalam sampel alumina KR 0914 I-B
Fe2O3(%) =
=
= 0.0052 %
4.3 Pembahasan
Dari hasil analisa yang dilakukan pada analisa kadar Fe2O3 dalam bahan baku alumina
secara spektrofotometri maka didapatkan nilai rata-rata dari hasil analisis yaitu 0.0039 % dan
0.0042 %. Berdasarkan dari hasil analisis, maka alumina dapat digunakan sebagai bahan baku
aluminium karena kadar Fe2O3 di dalam alumina masih berada dalam batas standar Fe2O3 yang
telah ditentukan yaitu 0.020 %.
Besi oksida di dalam alumina harus mempunyai skala yang lebih kecil, karena besi dapat
bersifat korosi. Apabila kadar besi dalam alumina tinggi akan mempengaruhi kualitas aluminium
yang diperoleh. Banyak paduan yang telah dikembangkan yang tujuan untuk meningkatkan
kekuatan sementara tetap mempertahankan diinginkan dari sifat aluminium, yang paling ringan
khususnya dan ketahanan korosi. Sedangkan penambahan sebuah elemenpaduan meningkatkan
kekuatan, itu mengurangi ketahanan korosi, membuat kompromi property yang diperlukan.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian ini diperoleh beberapa kesimpulan sebagai berikut :
• Kadar Fe2O3 dalam sampel alumina yang dianalisa adalah :
Alumina LM 5-003 A : 0.0041 %
Alumina LM 5-003 B : 0.0047 %
Alumina KR 0914 I-A : 0.0042 %
Alumina KR 0914 I-B : 0.0052 %
• Adanya zat-zat pengotor yang tinggi di dalam alumina menyebabkan rendahnya kualitas
produk yang dihasilkan. Seperti Fe2O3 yang terdapat pada alumina menyebabkan kualitas
produk yang rendah, dimana semakin tinggi besi yang terdapat dalam alumina semakin
rendah kualitas produk yang dihasilkan dan akan mengakibatkan korosi pada produk
tersebut. Karena sifat umum pada besi yaitu mudah terjadinya korosi. Sedangkan
maksimal besi yang terdapat pada aluminium yaitu 0.020 % dan kemurnian aluminium
yang dihasilkan yaitu 99.70 % dan 99.90 %. Jadi, kadar besi yang terdapat dalam alumina
sangat berpengaruh dengan kualitas produk yang dihasilkan.
• Alumina yang digunakan sebagai bahan baku utama masih memenuhi standar industry
5.2 Saran
• Sebaiknya menggunakan safety yang lengkap agar tidak terjadi kecelakaan yang tidak
diinginkan, seperti pada sampling, maupun dalam hal yang lain.
• Sebaiknya mencuci alat dengan bersih agar tidak terjadi kontaminasi saat menganalisa.
• Disarankan kepada bagian pengendali mutu hendaknya lebih cermat dan teliti pada setiap
DAFTAR PUSTAKA
Basset, J. 1994. Buku Ajaran Vogel Kimia Analisis Kuantitatif Anorganik. Edisi keempat.
Penerbit Buku Kedokteran.
Max Well, J.A. 1968. Rock and Mineral Analysis. Interscience Publisher : New York.
R.A. Day, Jr and A.L. Underwood. 1983. Analisa Kimia Kuantitatif. Erlangga : Jakarta.
Rosenqvist, T. 1983. Principles of Extractive Metallurgy. Second Edition. McGraw-Hill
International Book Company : London.
Vogel. 1985. Buku Teks Analisis Anorganik Kualitatif Makro dan Semimikro. Edisi kelima.
Bagian I. PT Kalman Pustaka : Jakarta.
Wargadinata.A.S. 2002. Pengetahuan Bahan. Penerbit Universitas Trisakti : Jakarta.
Lampiran : grafik kurva standar
y = 0,128x - 0,002 R² = 0,999
0,0000 0,0500 0,1000 0,1500 0,2000 0,2500
0 0,5 1 1,5 2
A
b
s
Kons
Lampiran : Sertifikat Hasil Analisis Alumina di PT INALUM
Supplier * Inalum Specification