PENENTUAN KADAR SILIKA DALAM BAHAN BAKU
ALUMINIUM FLUORIDA SECARA SPEKTROFOTOMETRI
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh gelar Ahli Madya
AZWINNATA
072401042
PROGRAM STUDI DIPLOMA III KIMIA ANALIS
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN KADAR SILIKA DALAM BAHAN BAKU ALUMINIUM FLUORIDA SECARA SPEKTROFOTOMETRI
Kategori : KARYA ILMIAH
Nama : AZWINNATA
Nomor Induk : 072401042
Program Studi : D 3 KIMIA ANALIS Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, juni 2010
Diketahui/ Disetujui Oleh
Departemen Kimia FMIPA USU Dosen Pembimbing
Ketua,
PERNYATAAN
PENENTUAN KADAR SILIKA DALAM BAHAN BAKU ALUMINIUM FLUORIDA SECARA SPEKTROFOTOMETRI
KARYA ILMIAH
Saya mengakui bahwa tugas akhir ini adalah hasil kerja saya sendiri,kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, juni 2010
PENGHARGAAN
Puji syukur penulis panjatkan kepada Allah SWT yang telah melimpakan rahmat dan karunia-Nya yaitu berupa nikmat kesehatan dan kelapangan yang tak terhingga sehingga penulis dapat menyelesaikan karya ilmiah ini tepat pada waktunya.
Karya ilmiah ini merupakan salah satu syarat bagi mahasiswa untuk menyelesaikan program studi D-3 Kimia Analis Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Penulis menyadari sepenuhnya bahwa karya ilmiah yang telah di buat masih banyak memiliki kekurangan maupun kekeliruan baik dari segi isi, makna, maupun penyusunan kata dalam pembuatan karya ilmiah ini. Oleh karena itu, penulis dengan rendah hati mengharapkan segala kritik dan saran yang membangun untuk menyempurnakan karya ilmiah ini.
Penyusunan karya ilmiah ini dilakukan berdasarkan pengamatan dan analisa penulis selama melaksanakan Praktik Kerja Lapangan ( PKL ) di PT. ASAHAN ALUMINIUM ( INALUM ), dengan judul “ PENENTUAN KADAR SILIKA DALAM BAHAN BAKU ALUMINIUM FLUORIDA SECARA SPEKTROFOTOMETRI ”
Dalam pengerjaan karya ilmiah ini, penulis banyak mendapatkan bantuan, arahan, bimbingan, informasi, pengetahuan dan wawasan yang begitu berharga sehingga memberikan manfaat yang begitu besar dalam proses pengerjaannya. Oleh karena itu penulis mengucapakan terima kasih setulus-tulusnya kepada :
1 Ayahanda Supranata dan Ibunda Yuslizar Br Sagala yang telah banyak berkorban buat penulis baik moril maupun materil yang tak terhitung nilainya serta Doa yang tulus dari hati seorang ayah dan ibu agar anaknya dapat berhasil di kemudian hari
2 Kakanda Bripda Yudi pranata dan adinda Azlina Sari yang telah memberikan doa dan dorongan sehingga penulis dapat menyelesaiKarya ilmiah ini.
3 Bapak Drs. Chairuddin,MSc selaku dosen pembimbing saya yang telah memberikan bimbingan yang begitu banyak dalam penyelesaian karya ilmiah ini
4 Para karyawan PT. INALUM yang telah memberikan bantuan dan masukan sehingga penulis dapat menyelesaikan karya ilmiah ini 5 Rekan PKL Aswin Syahputera mawan, Andre Adhe putra, yang
saling membantu selama masa PKL
7 Teman – teman seperjuangan di Kimia Analis stambuk 2007 yang telah bersama- sama selama 3 tahun yang selalu memberikan semangat sehingga saya bisa tamat tepat waktu
8 Sheila Eka Putri sebagai teman baik yang selalu memberikan semangat untuk hari tua. Semoga kita dapat berkomitmen bersama sampai tujuan kita tercapai.
Penyusun menyadari bahwa penulisan karya ilmiah ini masih jauh dari sempurna. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun untuk perbaikan karya ilmiah ini. Semoga karya lmiah ini dapat bermanfaat bagi semua pihak.
Medan juni 2010 Penulis
ABSTRAK
Telah dilakukan penentuan kadar silika pada aluminium fluorida yang digunakan sebagai bahan baku utama dalam proses peleburan aluminium di PT. INALUM. Silika telah diukur dengan menggunakan spektrofotometer UV- Vis dengan panjang gelombang 655 nm. Hasil pemeriksaan dibandingkan dengan industri japan internasional standar. Dari hasil pemeriksaan menunjukkan bahwa rata – rata kadar silika dalam aluminium fluorida adalah 0,0763 % maka memenuhi persyaratan sebagai bahan baku dalam proses elektrolisis alumina menjadi aluminium di PT. INALUM.
DETERMINATION OF CONCENTRATION SILICATE CONTENT IN ALUMINIUM FLUORIDE AS SPEKTROFOTOMETRI
ABSTRACT
Daftar Tabel
Tabel 4.1 Hasil Pengukuran Absorbansi Larutan Standar SiO2 ... 27
Tabel 4.2 Hasil Pengukuran Absorbansi Larutan Sampel AlF3 ... 27
Tabel 4.3 Data Perhitungan Persamaan garis Regresi untuk analisis SiO2 ... 28
Tabel 4.4 Harga y Baru Untuk Larutan Standar SiO2 ... 29
Daftar Lampiran
Lampiran I : Gambar Alat Spektrofotometer Cary-50
Lampiran II : Standar Penerimaan Analisa Aluminium Flourid
Lampiran III : Grafik Kurva Kalibrasi Larutan Standar SiO2
Lampiran IV : Gambar Proses Produksi Aluminium Di Pabrik Inalum
Lampiran V : Gambar Tungku Reduksi Tempat Elektrolisis Aluminium
ABSTRAK
Telah dilakukan penentuan kadar silika pada aluminium fluorida yang digunakan sebagai bahan baku utama dalam proses peleburan aluminium di PT. INALUM. Silika telah diukur dengan menggunakan spektrofotometer UV- Vis dengan panjang gelombang 655 nm. Hasil pemeriksaan dibandingkan dengan industri japan internasional standar. Dari hasil pemeriksaan menunjukkan bahwa rata – rata kadar silika dalam aluminium fluorida adalah 0,0763 % maka memenuhi persyaratan sebagai bahan baku dalam proses elektrolisis alumina menjadi aluminium di PT. INALUM.
DETERMINATION OF CONCENTRATION SILICATE CONTENT IN ALUMINIUM FLUORIDE AS SPEKTROFOTOMETRI
ABSTRACT
BAB I PENDAHULUAN
1.1 Latar Belakang
Logam aluminium pertama kali dipersiapkan pada tahun 1825 , tetapi baru
dalam jumlah sedikit sebagai logam berharga. kesulitan yang tidak teratasi sampai
waktu yang begitu lama adalah daya pengikatannya yang besar untuk elemen –
elemen oksigen.
Alumina , kokas dan aluminium fluorida merupakan bahan baku utama
untuk memproduksi aluminium secara elektrolisa , dimana alumina sebagai zat
yang akan dielektrolisis menjadi aluminium , kokas sebagai sumber karbon dan
aluminium fluorida merupakan larutan elektrolit, dimana reaksinya sebagai
berikut :
2 Al2O3 + 3 C 4 Al + 3CO2
Kriolit ( Na3AlF6 ) adalah senyawa yang digunakan sebagai larutan
elektrolit didalam proses elektrolisis alumina menjadi aluminium , namun kriolit
sangat mudah menguap menjadi natrium tetrafluoroaluminate karena kriolit
merupakan spesies garam yang paling cepat menguap. Dari asil analisis
kandungan free AlF3 dalam elektrolit dengan menggunakan alat XRD ( X-Ray
Difraksi ) maka akan didapatkan keasamaan elektrolit yang dilambangkan dengan
Sa. Keasamaan elektrolit dalam hal ini berarti kandungan free AlF3 dalam
elektrolit. Pengontrolan keasamaan ditentukan oleh pemasukan AlF3 yang
berguna untuk menetralkan Na2O yang masuk bersama alumina , sesuai reaksi
Na3AlF6 2 NaF + NaAlF4
3 Na2O + 4 AlF3 2 Na3AlF6 + Al2O3
Jika hal ini terjadi maka proses elektrolisa akan terganggu, maka perlu
ditambahkan aluminium fluorida. Keasamaan elektrolit dinyatakan dalam % ,
dimana standar keasamaan yang baik dalam tungku operasi reduksi yaitu berkisar
antara 6,3 – 6,5 %. Keasamaan elektrolit sangat mempengaruhi suhu ( temperatur
operasi ). Selama operasi normal suhu elektrolit lebih kurang 965 oC. Suhu
operasi pot atau tungku reduksi akan turun jika keasamaan elektrolit tinggi. Hal
ini yang sebenarnya harus diperhatikan karena biaya energi listrik yang
dibutuhkan tidak terlalu mahal karena suhu turun , dan sebaliknya jika keasamaan
rendah maka suhu dalam pot akan tinggi sehingga dapat menyebabkan semakin
besarnya biaya listrik dan kemungkinan pot akan meledak semakin besar. Dengan
adanya penambahan aluminium fluorida maka suhu akan terjaga dengan mengatur
keasamaan dari total aluminium fluorida.
Kemurnian aluminium fluorida yang ditambahkan harus diperhatikan
sehingga perlu dilakukan analisis terhadap senyawa senyawa pengotornya seperti
silika dan pospat. Jika kadar silika didalam aluminium fluorida yang akan
ditambahkan dalam pot terlalu tinggi maka akan menyebabkan kualitas produksi
aluminium ingot akan jelek. Kadar logam – logam pengotor seperti silika dalam
produk hasil aluminium ingot telah dibatasi sesuai dengan standar JIS ( Japan
Internasional Standar ). Semakin tinggi kadar pengotor maka semakin murah
harga jual produk aluminium ingot. Kadar silika dalam standar JIS didalam
aluminium ingot yaitu 0,04 % , sedangkan kadar silika dalam aluminium fluorida
secara signifikan akan mempengaruhi kadar silika dalam produk aluminium yang
dihasilkan.
Silika merupakan salah satu unsur yang terdapat dalam kerak bumi secara
berlimpah. Dialam , silika tidak ditemukan dalam bentuk elemen bebas ,
melainkan berikatan dengan oksigen dan elemen lain. Silika bersifat tidak larut
dalam air maupun asam dan biasanya berada
dalam bentuk koloid. Silika terdapat pada hampir semua batuan dan mudah
mengalami pelapukan. Sumber alami utama silika adalah mineral kuarsa dan
feldspar. Dalam tanah umumnya silika berbentuk asam monosilikat. Pengapuran
sering menyebabkan turunnya kadar silika dalam tanah. Konsentrasi silika larut
dalam air biasanya sangat rendah, yaitu antara 1-30 mg SiO2 / L. Asam
monosiklik dari silik dapat membentuk senyawa kompleks dengan senyawa –
senyawa organik terutama asam – asam humik dan fulvik, dimana muatan positif
pada senyawa kelat menggantikan ion – ion pada asam monosiklik untuk
membentuk ikatan asam monosklik – kelat , sehingga peristiwa ini dapat
dimanfaatkan dalam penentuan kadar silika secara spektrofotometry dengan
menggunakan pengkompleks ammonium molibdat yang akan membentuk warna
biru.
1.2 Permasalahan
Apakah kadar silika didalam aluminium fluorida yang akan dipakai sebagai
bahan baku utama dalam PT. INALUM masih memenuhi standar JIS ( Japan
1.3 Tujuan
Untuk mengetahui kadar Silika didalam aluminium fluorida yang
digunakan pada proses elektrolisis aluminium di PT. INALUM sehingga dapat
diketahui bahwa aluminium fluorida yang akan dipakai masih memenuhi standar
JIS ( Japan Internasional Standar )
1.4 Manfaat
Adapun manfaat penulisan tugas akhir ini adalah :
- Untuk memberikan informasi kepada pembaca tentang hasil analisis
kadar silika didalam aluminium fluorida yang digunakan sebagai
bahan baku utama pada proses elektolisis alumina menjadi aluminium
BAB 2
TINJAUAN PUSTAKA
2.1 Bahan Baku utama dalam proses elektrolisis aluminium 2.1.1 Alumina
Alumina ( Al2O3 ) diperoleh dari pengolahan biji bauksit dengan proses
bayer. Proses bayer terdiri dari tiga tahap yaitu :
1. Proses Ekstraksi
Al2O3. X H2O + 2 NaOH 2 NaAlO2 + ( x + 1 ) H2O …….( 1 )
2. Proses Dekomposisi
2 NaAlO2 + 4 H2O 2 NaOH + Al2O3. 3 H2O ……..( 2 )
3. Proses kalsinasi
Al2O3 . 3 H2O + kalor Al2O3 + H2O ...( 3 )
Pada proses kalsinasi akan dihasilkan jenis alumina sandy jika operasi
berlangsung pada temperature rendah dan jenis alumina floury untuk operasi pada
temperature tinggi . P.T INALUM tidak menghasilkan alumina sendiri tetapi
diperoleh dari Negara lain terutama dari Australia. ( Bagian SRC. INALUM ,
2009 )
2.1.2 Anoda Carbon
Anoda karbon berfungsi sebagai reduktor dalam proses elektrolisis
alumina menjadi aluminium.Anoda Karbon diproduksi pada pabrik karbon (
karbon plant ) komposisi karbon terdiri dari 60 % kokas minyak , 15 % hard pich
dan 20 % puntung anoda ( butt ). Sifat – sifat anoda karbon yang dipakai adalah
1.Tahan terhadap perubahan panas sehingga sulit retak saat beroperasi pada
temperature tinggi.
2. Angka muai panas yang rendah agar anoda sulit terlepas dari tangkai anoda
pada temperature tinggi.
3.Konduktivitas panas yang tinggi agar segera mencapai temperature tinggi pada
proses pemanasan. (Bagian SRC. INALUM , 2009)
2.1.3 Kriolit ( Bath )
Kriolit mengandung senyawa CaF3 dan AlF3. Aluminium fluoride
berfungsi menjaga keasamaan bath ( kriolit ) yang ditambahkan secara manual.
Fungsi utamanya adalah menurunkan temperature liquid bath , sehingga pot
tungku reduksi tempat elektrolisis aluminium biasa dioperasikan pada temperature
yang rendah. (Bagian SRC. INALUM , 2009 )
2.2 Fungsi Penambahan AlF3
Kriolit ( Na3AlF6 ) adalah pelarut utama yang tersusun atas aluminium
fluorida.AlF3 digunakan sebagai zat aditif dalam proses elektrolisis alumina
menjadi aluminium bersama dengan cryolite sehingga menurunkan titik lebur
dibawah 1000o C. Kriolit memiliki sifat yang unik, yaitu mampu melarutkan
semua oksida dengan baik. Sifat – sifat kriolit diantaranya :
• Kemampuan melarutkan alumina dengan baik
• Tegangan komposisi lebih tinggi.
• Konduktifitas elektrolitnya cukup tinggi.
• Titik lelehnya relatif rendah.
• Tidak dapat bereaksi dengan aluminium dan karbon.
• Massa jenisnya cukup rendah, bila dalam keadaan sama-sama cair.
• Tekanan uapnya relatif rendah.
Kriolit sendiri sangat mudah menguap menjadi natrium
tetrafluoroaluminate , karena kriolit merupakan spesies garam. Dari hasil analisa
kandungan free AlF3 dalam elektrolit dengan menggunakan alat instrumen x- ray
difraksi ( XRD ) maka akan diperoleh nilai keasamaan yang dilambangkan
dengan Sa. Keasamaan elektrolit dalam hal ini berarti kandungan free AlF3 dalam
elektrolit tersebut. Standart keasaman dalam tungku adalah 6,3 – 6,5 %.
Pengontrolan keasaman tersebut ditentukan oleh pemasukan aluminium fluorida
yang berguna menetralkan natrium oksida yang masuk bersama alumina.
AlF3 yang ditambahkan harus memiliki parameter – parameter yang perlu
diperhatikan, diantaranya adalah kandungan impuritisnya seperti silika yang dapat
memberikan nilai yang tidak baik sehingga aluminium ingot yang dihasilkan
kualitasnya tidak baik sehingga tidak sesuai dengan standart Jis / Japan
International Standart . ( Bagian SRC. INALUM , 2009 )
2.3 Proses Pembuatan Aluminium Fluorida
Mayoritas cara pembuatan aluminium fluorida terutama dihasilkan dengan
memperlakukan alumina dengan asam hexafluorosilicic, berdasarkan reaksi :
H2SiF6 + 2 Al2O3 2 AlF3 + H2O + SiO2 …….. ( 4 )
Dalam skala kecil aluminium fluorida juga dapat dibuat dengan mereaksikan
aluminium hidroksida. Asam hexafluorosilicic dipanaskan pada suhu 80 o C
sedangkan alumina dikeringkan untuk mengurangi kadar airnya. Asam
suhu 100 0 C dengan waktu ± selama 13 menit. Produk yang dihasilkan yaitu
silika dan aluminium fluorida, dan silika kemudian dipisahkan dengan cara
mengeluarkannya dari sistem filtrat dan dikirim ke unit crystallizer. Diunit
cristallizer temperatur dijaga 98 – 100 o C selama 4 sampai 5 jam. Kemudian
kristal yang terbentuk dipisahkan dari larutan induknya.
( Http : //
2.4 Aturan- aturan ketetapan kriolit ( Bath )
Molten cryolite merupakan suatu bahan utama dari hall- heroult elektrolit.
Zat aditif ini digunakan untuk meningkatkan mutu / kualitas bahan- bahan kimia
tersebut dan fisika juga. Zat aditif yang ideal dapat berkurang terhadap larutan
yang dihasilkan dengan proses pemanasan dan cairan dengan temperature rendah
untuk meningkatkan efesiensi faraday. Aditif seharusnya dapat meningkatkan
ataupun berkurang didalam larutan alumina. Peningkatan konduktivitas elektrik
lebih baik digunakan untuk efesiensi yang kuat, pengurangan densitas dapat
disertai dengan pemisahan yang lebih
Antara aluminium dan garam molten dan penurunan tekanan uap dapat
memminimalkan / mencegah terjadinya kehilangan fluoride. Seharusnya hal
tersebut tidak perlu diperhatikan, atau pun menyebabkan pelepasan ion dengan
potensial terendah dimana aluminium sebagai kation dan oksigen sebagai anion,
tidak ada aditif yang ideal namun AlF3 sering ditambahkan untuk meningkatkan
efesiensi faraday.
Pada tahun 1886 charles Martin Hall di USA dan Paul L.T. Heroult
diprancis menemukan banyak sekali penemuan mengenai suatu proses untuk
molten cryolite. Hall mensyahkan penemuannya tersebut diamerika dan Heroult di
prancis. Hall menyelidiki banyak sekali aditif dilaboraturium dan menemukan
kegunaan aluminium fluorida dan calsium fluorida, berikut adalah perlakuan
keduanya pada temperatur rendah untuk peningkatan efesiensi yang terjadi.
Calsium fluorida disebabkan adanya debu – debu dan karbon dari anoda menguap
dan terbakar dan yang lebih bahaya sehingga menyebabkan elektrolit terlepas.
Hall memilih suatu bath dari cryolit plus 28% AlF3 dan CaF216 % untuk sell sel
industri lainnya. Kita dapat menyimpulkan bahwa bath mempunyai suatu cairan
pada suhu 8800 Cdan 4,2 watt dengan % larutan alumina pada suhu 980 0 C. Sel
tersebut tidak akan menyebabkan terjadinya kerusakan. Alumina sekelompok
daripada larutan dengan konsentasi rendah didalam larutan tertentu dan perlakuan
tertentu.
Bath analisis digunakan untuk AlF3 yang dibutuhkan untuk dibawa keluar
menurut suatu tabel yang diperlukan, hal ini juga digunakan untuk memonitoring
campuran CaF2 yang dipercaya untuk menstabilkan komponem AlF3 itu sendiri
didalam bath. ( Warren Haupin, 1995 )
2.5 Jenis - jenis Silika
Walaupun silika bebas hanya terdapat dialam, silika tetrahedra
didominasikan dalam struktur primer dan sekunder seperti silika mineral yang
terdapat didalam kombinasi dengan aluminium ataupun dengan besi dan mangan,
jumlah ini sangat banyak terutama dalam bentuk mineral.
Silikon hanya yang kedua setelah oksigen dalam kelimpahannya dialam (
kira – kira 28 % dari kerak bumi ) dan terdapat beragam dalam mineral silikat dan
dengan reduksi silikon dengan karbon atau CaC2 dalam tungku pemanas listrik.
Silikon biasanya agak kurang reaktif. Ia diserang oleh halogen menghasilkan
tetrahalida , dan oleh basa menghasilkan larutan silikat. Ia tidak dapat diserang
oleh asam kecuali hidrofluorida, diperkirakan bahwa disini kestabilan SiF6
menyebabkan gaya dorong. Silika murni terdapat dalam dua bentuk yaitu bentuk
kuarsa dan kristobalit. Silika selalu terikat secara tetrahedral kepada empat atom
oksigen namun ikatan – ikatannya mempunyai sifat ionik yang cukup. Dalam
kristobalit atom – atom silikon ditempatkan seperti halnya atom – atom karbon
dalam intan , dengan atom – atom oksigen berada ditengah dari setiap pasangan.
Dalam kuarsa terdapat heliks , sehingga terjadi kristal enansiomorf, dan hal ini
dapat dengan mudah dikenali dan dipisahkan secara mekanik.
Silika hanya membentuk anion – anion fluoro , biasanya SiF6 dengan
tetapan pembetukan yang tinggi , di perhitungkan untuk hidrolisis tak sempurna
SiF4 dalam air. Ionnya biasanya dibuat dengan melarutkan SiO2 dalam larutan HF
dan stabil meskipun dalam larutan basa. (Cotton F. Albert , 1989 )
2.6 Metode Pengukuran Silika
Hampir kebanyakan prosedur kolorimetri untuk silikon didalam larutan
didasarkan pada bentuk kompleks dari molybdenum biru. Secara Detail
persamaan itu dapat diikuti untuk metode pengukuran phosporus.Gangguan dalam
phosporus dapat dicegah dengan mengontrol pH dan kehadiran dari oxalic atau
asam tartat.
2.6.1 Metode Molybdenum Biru
Metode ini dengan menggunakan molybdate sehingga terbentuk asam
digunakan untuk tanah dan tanaman setelah campuran dari 2 reaksi yaitu 2 bentuk
dari asam molybdosilikat yaitu β dan α dimana ini tergantung dari aciditas dan
faktor – faktor lain. Bentuk alfa merupakan hasil terbaik dengan menggunakan
sebuah reagent daripada asam stannous dan bentuk beta dengan menggunakan
asam amino – naphtol. ( Allen Stewart. E , 1985 )
2.6.2 Metode Gravimetri A. Penetapan silika dapat larut
Silika – silika yang dapat diuraikan oleh asam seperti asam klorida
dengan membentuk asam silikat dan garam – garam dari logam – logam. Silika
yang masuk dalam klasifikasi ini adalah ortosilikat – ortosilikat yang terbentuk
atas unit – unit SiO44- yang bergabung dengan hanya satu atau dua kation.
Proses penetapannya silika yaitu dengan menambahkan asam klorida 1 : 1
dan diuapakan hingga kering pada suhu 100 -1100 C. Basahi residu dengan asam
klorida pekat tambahkan air. Panaskan untuk mengekstraksi garam yang dapat
larut dan saring melalui sehelai kertas saring yang baru tetapi ukurannya lebih
kecil. Cuci dengan asam klorida encer hangat , dan akhirnya dengan sedikit air
panas. Lipat saringan yang basah dan diletakkan dalam krus platinum yangtelah
ditimbang. Keringkan kertas dengan nyala kecil, arangkan kertas dan bakar habis
karbon itu diatas nyala kecil, dijaga agar tidak ada bubuk halus keluar. Bila semua
karbon teroksidasi, tutup krus dan panaskan selama 1 jam pada temperatur meker.
Biarkan mendingin dalam desikator dan ditimbang. ( Vogel, 1994 )
B. Penetapan Silika yang tak dapat larut
Silia –silika yang tak dapat larut umunya dilebur dengan natrium karbonat
diolah dengan asam klorida. Larutan yang asam dari silikat yang telah diuraikan
diuapkan sampai kering diatas penangas air untuk memisahkan asam silikat yang
seperti gelatin, sebagai silika yang tak dapat larut residu dipanaskan pada suhu
110 -1200 C untuk menhidrasi parsial silika itu. ( Vogel , 1994 )
2.7 Spektrofotometri
Sudah lama sekali ahli kimia menggunakan warna sebagai suatu pembantu
dalam mengidentifikasi zat kimia. Spektrofotometri dapat dibayangkan sebagai
suatu perpanjangan dari penilikan visual dimana studi yang lebih terinci mengenai
pengabsorpsian energi cahayaoleh spesies kimia memungkinkan kecermatan yang
lebih besar dalam pencirian dan pengukuran kuantitatif. Dengan mengganti mata
manusia dengan detectoor – detector radiasi lain, dimungkinkan studi absorbsi
diluar daerah spektrum tampak dan seringkali eksperimen spektrofotometri
dilakukan secara automatik.
Dalam penggunaan dewasa ini istilah spektrofotometri menyiratkan
pengukuran jauhnya pengabsorpsian energi cahaya oleh suatu sistem kimia itu
sebagai fungsi dari panjang gelombang radiasi, demikian pula pengabsorpsian
yang menyendiri pada suatu panjang gelombang tertentu. Untuk memahami
spektrofotometri, memperhatikan interaksi radiasi dengan spesies kimia dengan
cara yang elemeter, dan secara umum mengurus apa kerja instrument –
instrumennya.
( Underwood. R . A, 1996 )
2.7.1 Spektrum elektromagnetik
Berbagai eksperiment dalam laboraturium fisika paling baik ditafsirkan
gelombang transversal. Dengan pengukuran yang tepat, gelombang-gelombang ini
dapat di cirikan menurut panjang gelombangnya, kecepatan, dan besaran-besaran
yang dapat digunakan untuk memberikan gerakan gelombang apa saja.
Kecepatan cahaya kira-kira adalah 3x1010 cm/detik. Berbagai satuan
digunakan untuk panjang gelombang, bergantung pada daerah spektrum : untuk
radiasi ultraviolet dan cahaya tampak, satuan amstrong dan nanometer digunakan
secara meluas. Sedangkan micrometer merupakan satuan yang lazim untuk daerah
inframerah. Satuan mikrometer, ( μm ) didefenisikan sebagai 10-6 m dan satu
nanometer ( nm ), 10-9 m atau 10-7 cm. Satu satuan amstrong ( Å ) adalah 110-10
m atau 10-8 cm. jadi 1 nm = 10 Å . Bilangan gelombang sering digunakan oleh
ahli kimia sebagai satuan frekuensi karena memiliki nilai numerik yang nyaman.
Teori gelombang dari cahaya menjelaskan gejala optis, seperti
pemantulan, pembiasan dan lenturan ( difraksi ), namun ada hasil – hasil
eksperiment seperti efek fotolistrik, yang paling baik ditafsirkan menurut gagasan
bahwa seberkas cahaya adalah aliran paket – paket energi butiran yang disebut
foton. Masing – masing partikel memiliki energi karakteristik yang dihubungkan
dengan frekuensi cahaya oleh persamaan sebagai berikut :
E = h v
Dimana h adalah tetapan planck. Cahaya dengan frekuensi tertentu ( atau panjang
gelombang tertentu ) dikaitkan dengan foton –foton, yang masing – masing
memiliki kuantitas yang terpastikan. Seperti diterangkan dibawah ini kuantitas
energi yang dimiliki foton inilah yang menetapkan apakah suatu spesies molekul
tertentu akan menyerap ataukah meneruskan cahaya dengan panjang gelombang
Disamping energi biasa dari gerakan translasi, yang tidak diperhatikan
disini , molekul memiliki energi dalam yang dapat dibagi lagi dalam tiga kelas.
Pertama molekul memiliki dapat berotasi mengelilingi berbagai sumbu dan
memiliki kuantitas energi rotasi. Kedua, atom – atom atau gugus – gugus atom
dalam molekul dapat bergetar, artinya bergerak secara berkala satu terhadap yang
lain disekitar posisi – posisi kesetimbangan mereka, dengan memberikan energi
getaran kepada molekul itu. Akhirnya, sebuah molekul memiliki energi
elektronik.
Salah satu gagasan dasar teori kuantum adalah bahwa sebuah molekul tak
boleh memiliki energi dalam dengan kuantitas sebarang apa saja, tetapi molekul
itu hanya dapat ada dalam keadaan energi diizinkan yang tertentu. Jika sebuah
molekul harus menyerap suatu energi antara tingkat – tingkat yang diperbolehkan.
Kuantisasi energi molekul ini, yang digandengkan dengan konsep bahwa poton
memiliki kuantitas enenrgi yang terpastikan, meletakkan dasar keselektifan dalam
pengabsorpsian energi radiasi oleh molekul – molekul. Bila molekul – molekul
disinari dengan banyak panjang gelombang, mereka akan mengambil dari dalam
berkas masuk, panjang – panjang gelombang yang berpadanan dengan foton –
foton yang energinya tepat untuk peralihan ( transisi ) energi molekul dan panjang
– panjang gelombang lain akan diteruskan begitu saja. ( Underwood. R . A, 1996 )
2.7.2 Spektrofotometri Ultraviolet – Cahaya Tampak ( UV – Vis )
Spektrum elektronik senyawa dalam fase uap kadang – kadang
menunjukkan struktur halus dimana sumbangan vibrasi individu dapat teramati
namun dalam fase – fase mampat, tingkat energi molekul demikian tergangu oleh
molekul dapat mengabsorpsi riadiasi dalam daerah UV – tampak karena mereka
mengandung elektron, baik sekutu maupun menyendiri, yang dapat dieksitasi
ketingkat energi yang lebih tinggi. Panjang gelombang dimana absorpsi itu terjadi,
bergantung pada berapac kuat elektron itu terikat dalam molekul tersebut.
Elektron dalam suatu ikatankovalen tunggal terikat dengan kuat dan diperlukan
radiasi berenergi tinggi atau panjang gelombang pendek untuk eksitasinya.
Misalnya , alkana yang mengandung ikatan tunggal C – H dan C-C tak
menunjukkan absorbpsi diatas 160 nm. Metana menunjukkan suatu puncak pada
122 nm yang ditandai sebagai transisi — * ini berati bahwa suatu elektron
dalam orbital ( bonding ) sigma dieksitasikan ke orbital anti – ikatan ( anti
bonding ) sigma.
Jika suatu molekul mengandung sebuah atom seperti klor yang
mempunyai pasangan elektron menyendiri, sebuah elektron tak terikat (
nonbonding ) dapat dieksitasikan ketingkat energi yang lebih tinggi, karena
elektron non bonding tak terikat terlalu kuat seperti elektron bonding – sigma,
maka absorbsinya terjadi pada panjang gelombang yang lebih panjang.
Kebanyakan penerapan spektrofotometri ultraviolet dan cahaya tampak
pada senyawaan organik yang didasarkan pada transisi n- π * atau pun π-π* dan
karenanya memerlukan hadirnya gugus kromoforat dalam molekul itu. Transisi ini
terjadi dalam daerah spektrum ( sekitar 200 hingga 700 nm ) yang praktis untuk
digunakan dalam eksperiment. Spektrofotometer UV – V15 yang komersial
biasanya beroperasi dari sekitar 175 atau 200 hingga 1000 nm. Identifikasi
kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam
Tetapi , gugus gugus fungsional tertentu seperti karbon, nitro dan sisterm
terkonjugasi menunnjukkan puncak yang karakteristik. ( Underwood. R . A, 1996
)
2.7.3 Hukum bouguer – Beer
Hubungan antara absorpsi radiasi dan panjang gelombang lintasan melewati
medium yang menyerap mula –mula dirumuskan oleh Bouger ( 1729 ), meskipun
kadang – kadang dikaitkan kepada lambert ( 1768 ). Jika dibayangkan suatu
medium pengabsorbsi yang homogen seperti suatu larutan kimia terbai dalam
lapisan lapisan imajiner yang sama tebalnya. Jika suatu berkas radiasi
monokromatis yakni radiasi dengan panjang gelombang tunggal ) diarahkan
menembus medium itu, ternyata bahwa tiap lapisan menyerap fraksi radiasi yang
sama besar.Anggaplah sebagai contoh bahwa lapisan pertama menyerap separuh
radiasi yang keluar dari lapisan kedua ini akan menjadi seperempat dari daya
aslinya dari lapisan ketiga seperdelapan dan seterusnya.
Penentuan bouguer dapat dirumuskan secara matematis sebagai berikut
dimana p0 adalah daya radiasi masuk dan P daya yang keluar dari suatu lapisan
medium sebesar b satuan.
-
= k1P
Tanda minus menandakan bahwa daya itu berkurang karena mengalami
pengabsorbsian. Berkurangnyadaya radiasi per ketebalan satuan dari medium
yang menyerap adalah berbanding lurus dengan daya radiasi itu.
Menurut Beer hubungan antara konsentrasi spesies pengabsorbsian dan
dengan hukum bouguer dalam memerikan berkurangnya secara eksponen soal
daya radiasi yang diteruskan dengan pertambahan secara aritmatik konsentrasi.
Hukum Beer dapat diterapkan benar –benar hanya untuk radiasi
monokromatik dan dimana sifat dasar spesies pengabsorpsian tak berubah
sepanjang jangka konsentrasi yang diselidiki. ( Underwood. R . A, 1996 )
2.7.4 Penyimpangan Hukum Bouguer dan Beer
Menurut hokum bouguer dan beer suatu plot absorbans vs konsentrasi
molar akan berupa garis lurus dengan arah kemiringan , tetapi seringkali
pengukuran terhadap sistem kimia riil menghasilkan plot hokum beer yang tidak
linar sepanjang seluruh rentang konsetrasi yang diminati. Kelengkungan seperti
ini menyarankan bahwa bukanlah suatu ketetapan, yang tak bergantung pada
konsentrasi, untuk sistem semacam ini, namun pemahaman yang lebih mendalam
menimbulkan suatu pandangan yang agak lebih canggih. Nilai diharapkan
bergantung pada sifat dasar spesies pengabosrpsian dalam larutan dan pada
panjang gelombang radiasi. Kebanyakan penyimpangan dari hukum beer yang
dijumpai dalam praktik. Analitis dapat dibebankan pada kegagalan atau
ketidakmampuan mengawasi kedua aspek ini, dan karena itu dapat dikatakan
sebagai penyimpangan semu karena penyimpangan ini lebih mencerminkan
kesukaran eksperiment daripada semua kekurangan dari hukum beer itu sendiri.
Penyimpangan berdasarkan instrument dapat terjadi karena karekteristik
instrument yang digunakan dalam mengukur nilai absorbansi. Dulu simpangan
semacam ini kadang – kadang diakibatkan oleh efek kelelahan detector,
energi cahaya ( radiasi )dan sebagian besar masalah ini telah dipecahkan dalam
instrument spektrofotometrik modern.( Underwood. R . A, 1996 )
2.8 Instrumentasi Spektrofotometri
Sebuah spektrofotometer adalah instrumentasi untuk mengukur transmitan
atau absorbansi suatu sampel sebagai fungsi panjang gelombang. Pengukuran
terhadap sederetan sampel pada suatu panjang gelombang tunggal dapat pula
dilakukan. Instrumentasi semacam ini dapat dikelompokkan secara manual atau
merekam atau sebagai berkas tunggal atau berkas rangkap. Dalam praktik,
instrumen berkas – tunggal biasanya dijalankan secara manual, dan instrumentasi
berkas rangkap umumnya mencirikan perekaman automatik terhadap spektra
absorbsi, namun dimungkinkan untuk merekam suatu spektrum dengan
instrumentasi berkas tunggal. ( Underwood. R . A, 1996 )
2.8.1 Sumber energi Cahaya
Sumber energi radiasi yang biasa untuk daerah tampak ( dari ) spektrum
itu maupun daerah ultraviolet dekat dan inframerah dekat adalah sebuah lampu
pijar dengan kawat rambut terbuat dari wolfram. Pada Kondisi operasi biasa,
keluaran lampu wolfram ini memadai dari sekitar 325 atau 350 nm hingga sekitar
3 μm. Energi yang dipancarkan oleh kawat yang dipanaskan itu beraneka sekali
menurut panjang gelombangnya. Distribusi energi merupakan fungsi temperatur
kawat, yang selanjutnya bergantung pada voltase yang disuplai kepada lampu.
Kenaikan temperatur operasi menaikkan energi total dan menggeser puncak
kepanjang gelombang yang lebih pendek.
Dibawah kira – kira 350 nm keluaran lampu wolfram itu – tak memadai
lazim adalah lampu tabung discas ( discharge tube ) hidrogen ( atau deuterium )
yang digunakan kira –kira 175 ke 375 atau 400 nm. Bila suatu discas antara dua
elektroda mengeksitasi pancaran cahaya oleh suatu sampel gas seperti hidrogen,
akan diperoleh suatu karakteristik spektrum garis yang taksinambung dari gas itu,
asal saja tekanannya relatif rendah. Dengan dinaikkannya tekanan hidrogen, garis
– garis itu melebar dan akhirnya tumpang tindih sampai dipancarkan spektrum
yang berkesinambungan pada tekanan yang relatif tinggi. Tekanan yang
diperlukan dalam tabung discas hidrogen lebih rendah daripada dengan gas – gas
tertentu lainnya tabung itu juga bekerja dengan lebih dingin. ( Underwood. R . A,
1996 )
2.8.2 Monokromator
Monokromator adalah piranti optis untuk mengisolasi suatu berkas radiasi
dari suatu sumber berkesinambungan, Berkas mana mempunyai kemurnian
spektral yang tinggi dengan panjang gelombang apa saja yang diinginkan.
Komponen – komponen yang hakiki dari sebuah monokromator adalah suatu
sistem celah dan suatu unsur dispersif. Radiasi dari sumber difokuskan kecelah
masuk, kemudian disejajarkan oleh sebuah lensa atau cermin sehingga suatu
berkas sejajar jatuh ke unsur pendispersi yang berupa prisma atau suatu kisi
difraksi. Dengan memutar prisma atau kisi secara mekanis aneka porsi spektrum
yang dihasilkan oleh unsur dispersi dipusatkan pada celah keluar, dari situ , lewat
jalan optis lebih jauh, porsi – porsi itu menjumpai sampel.
Kemurnian spektral dari radiasi yang keluar dari dalam monokromator itu
bergantung pada daya dispersi dari prisma dan lebar celah keluar. Tanpa berfikir
sedekat yang diinginkan dengan semata –mata mengurangi lebar celah
secukupnya namun tak demikian halnya. Akhirnya celah itu akan begitu sempit
sehingga efek – efek difraktif sampai kepinggir-pinggirnya hanya menciptakan
kehilangan daya radiasi tanpa pertambahan kemurnian spektral. Sebenarnya
sebelum batas ini didekati dalam spektrofotometer yang khas, celah yang
disempitkan itu tidak cukup melewatkan energi untuk mengaktifkan detektor.
Dengan monokromator prisma, lebar celah tertentu tidak menghasilkan
derajat kemonokroatikan yang sama sepanjang spektrum itu. Ketergantungan
panjang gelombang dalam dispersi suatu prisma adalah sedemikian rupa sehingga
panjang gelombang dalam spektrum itu tidak seragam penebarannya dan dapat
mengakibatkan ganguan kesalahan dalam analisis. Dispersi besar untuk panjang
gelombang yang lebih pendek, dan karenanya celah yang lebih lebar disini akan
mencapai derajat kemurnian spektral yang sama seperti celah yang sempit pada
panjang gelombang yang lebih panjang. ( Underwood. R . A, 1996 )
2.8.3 Sel ( Kuvet )
Kebanyakan spektrofotometri melibatkan larutan, dan karenanya
kebanyakan wadah sampel adalah sel untuk meletakkan cairan kedalam berkas
cahaya spektrofotometer. Sel itu haruslah meneruskan energi radiasi dalam daerah
spektral yang diminati. Jadi sel kaca melayani daerah tampak, sel kuarsa dan kaca
silika tinggi istimewa untuk daerah ultraviolet dan garam dapur alam untuk
inframerah. Sel –sel harus diisi sedemikian rupa sehingga berkas cahaya
menembus larutan, dengan meniskus terletak seluruhnya diatas berkas. Umumnya
dengan jepitan berpegas yang memastikan bahwa posisi tabung dalam ruang sel
dari instrumen itu reprodusibel.
Sel tampak dan ultraviolet yang khas mempunyai panjang lintasan 1 cm,
namun tersedia sel dengan ketebalan yang sangat beraneka, mulai dari lintasan
yang sangat pendek, kurang arpada 1 milimeter, sampai 10 cm atau bahkan lebih.
Dapat diperoleh mikrosel yang istimewa, dengan mana larutan dengan volume
kecil sekali dapat menghasilkan panjang lintasan yang biasa, dan juga tersedia sel
– sel yang bisa diubah –ubah sehingga panjang lintasannya variabel, terutama
untuk penelitian inframerah. ( Underwood. R . A, 1996 )
2.8.4 Detektor
Dalam sebuah detektor untuk suatu spektrofotometer, kita menginginkan
kepekaan yang tinggi dalam daerah spectral yang diminati, respons yang linear
terhadap daya radiasi, waktu respons yang cepat dapat digandakan, dan kestabilan
tinggi atau tingkat noise yang rendah, meskipun dalam praktiknya perlu untuk
mengkompromikan faktor – faktor ini. Kepekaan ysng tinggi misalnya, dapat
dicapai hanya dengan menerima noise yang meningat. Macam – macam deteksi
yang telah digunakan paling meluas, didasarkan pada perubahan fotokimia, efek
fotolistrik, dan efek termolistrik. Fotografi tidak lagi digunakan dalam
spektrofotometri biasa, secara umum, detektor fotolistrik digunakan dalam daerah
tampak dan ultraviolet dan detektor yang didasarkan pada efek termal digunakan
dalam inframerah.
Detektor fotolistrik yang paling sederhana adalah tabung foto. Ini berupa
tabung hampa udara, dengan jendela yang tembus cahaya, yang berisi sepasang
dicahayai dengan foton – foton yang energinya cukup. Elektron – elektron
dipercepat kearah eketroda positif, ketika melintasi selisih potensial itu dan
mengalirkan arus dalam rangkaian itu. Apakah elektron akan dipancarkan atau
tidak, bergantung pada daya radiasi. Tersedia aneka ragam tabung foto yang
berbeda bahan permukaan katodanya dan karenany berbeda dalam respons mereka
terhadap radiasi yang frekuensinya beragam itu. Sejumlah spektrofotometer
memungkinkan saling ditukarnya detektor itu sehingga didapat dijaga respons
yang baik sepanjang jangkauan panjang gelombang yang lebar.
Tabung pengganda foto ( photomultiplier ) lebih peka daripada tabung foto
biasa karena penggandaan yang tinggi dicapai dengan tabung itu sendiri. Tabung
semacam itu mempunyai sederatan elektroda – elektroda yang potensial positifnya
relative terhadap katoda makin besar. Geometri tabung itu sedemikian sehingga
fotoelektron primer difokuskan menjadi suatu berkas dan dipercepat kearah suatu
elektroda yang katakana 50 – 90 V lebih positif daripada katodanya.Keluaran
pengganda poto itu masih digandakan lebih lanjut dengan suatu penguat
elektronik dari luar. ( Underwood. R.A, 1999 )
BAB III
METODOLOGI PERCOBAAN
3.1 Alat –alat
1. Spektrophotometer Cary- 50
2. Krusibel platinum 50 mL
3. Neraca Analitis
4. Sendok pereaksi
5. Muffle furnace
6. Plat heater
7. Beaker Teflon 100 dan 300 mL
8. Beaker Polyethylen 100 mL
9. Beaker gelas 100 mL
10. Labu ukur gelas 100 mL
11. Labu ukur polyethylene 100 mL
12. Labu ukur polyethylene 200 mL
13. Aspirator
14. Pipet Volum 3 mL
15. Pipet Volum 5 mL
16. Pipet Volum 10 mL
17. Pipet Volum 15 mL
18. Pipet ukur 5 mL
3.2. Bahan- Bahan
1. Na2CO3 ( special grade ) 2 H3BO3 ( special grade )
3. Na2SO3 ( special grade )
4. Na2S2O5
5. Larutan HNO3 ( 1 + 2 )
6. 1-amino -2 naphtol -4- sulfonic acid
7. Larutan Amonium molibdat 10 % ( w/v )
8. Larutan standart SiO2 0,01 mg/ mL
9. Larutan Asam tartarik 10 % ( v/v )
10. Larutan Pereduksi
11. Air pH 1,2
3.3 Pembuatan larutan pereaksi
1. Larutan Ammonium molibdat 10 % ( w/v )
Sebanyak 5 gram kristal ammonium molibdat dilarutkan dalam 50 mL air
destilat, kemudian dipanaskan dengan menggunakan plat heater sampai
kristal ammonium molibdat larut.
2. Larutan pereduksi
a. Sebanyak 0,70 gram Na2SO3 dilarutkan dengan 40 mL air destilat
dalam beaker gelas 100 mL dan ditambahkan 0,15 gram
1-amino-2-naphtol-4-sulfonic acid, lalu diaduk hingga larut
b.Sebanyak 0,9 gram Na2S2O5 dilarutkan dengan 40 mL air destilat dalam
c.Kedua larutan diatas digabungkan dalam labu ukur 100 mL kemudian
ditambahkan air destilat hingga garis batas.
3. Air pH 1,2
Ditambahkan HNO3 ( 1 + 2 ) atau NaOH 20 % kedalam air destilat hingga
pH 1,2 dan air pH 1,2 ini digunakan untuk pengganti air destilat dalam
pengenceran larutan.
3.4 Prosedur Percobaan
a. penyiapan larutan sampel
Dua buah muffle furnace diset masing – masing pada suhu 800 0C dan
10000C, kemudian ditimbang sampel sebanyak 0,5 gram dalam krusibel platinum
50 mL. Ditambahkan sebanyak 3,3 gram Na2CO3 dan 1 gram H3BO3 kedalam
krusibel platinum, kemudian dicampurkan dan diaduk hingga merata, lalu
dimasukkan krusibel platinum kedalam muffle furnace dan dinaikkan suhunya
secara perlahan – lahan sampai mencapai suhu 800O C dan dibiarkan selama 2
menit, selanjutnya krusibel platinum dipindahkan kedalam muffle furnace pada
suhu 1000O C, dimana suhunya dinaikkan secara perlahan – lahan sampai
mencapai suhu 1000 O C dan dibiarkan selama 7 menit, kemudian muffle furnace
dimatikan, setelah mencapai suhu kamar, krusibel platinum tersebut diangkat.
kedalam krusibel platinum ditambahkan 27 mL HNO3 ( 1 + 2 ) secara
perlahan- lahan, kemudian krusibel platinum dipanaskan diatas platheater pada
suhu 120oC dan dibiarkan hingga semua garam – garam oksida larut. kemudian
teflon 100 mL, dibilas krusibel platinum dengan air panas dan dibiarkan pada
suhu kamar. Dipindahkan larutan yang ada dalam beaker gelas teflon kedalam
labu ukur polyetilen 100 mL kemudian ditambahkan air destilat hingga garis
batas, diaduk dan dikembalikan larutan kedalam beaker teflon 100 mL.
Diambil 10 mL larutan tersebut dan dimasukkan kedalam beaker
polyetilen
100 mL kemudian ditambahkan ± 50 ml air destilat, lalu diukur pH larutan dengan
menggunakan pH – Meter dan dijadikan pH nya menjadi 1,2 dengan
menggunakan HNO3 ( 1 + 2 ) atau NaOH 20 % , lalu dipindahkan larutan
kedalam labu ukur. Ditambahkan 2 mL larutan ammonium molibdat 10 %
kedalam labu ukur polyetilen dan dibiarkan selama 5 menit lalu ditambahkan 2
mL asam tartarik dan 2 mL zat pereduksi kemudian ditambahkan air pH 1,2
hingga tanda batas, lalu dibiarkan selama 15 menit. Dilakukan hal yang sama
sebanyak 3 kali percobaan.
b. Penyiapan Larutan Blanko
Sebanyak 8,2 gram Na2CO3 dan 2,50 gram H3BO3 dimasukkan dalam
krusibel platinum 50 mL, dicampurkan dan diaduk hingga merata.Dimasukkan
krusibel platinum kedalam muffle furnace pada suhu 800oC, dimana suhunya
dinaikkan secara perlahan – lahan sampai mencapai suhu 8000 C, lalu dibiarkan
selama 2 menit. Kemudian dipindahkan krusibel platinum kedalam muffle furnace
pada suhu 10000C dan dibiarkan selama 7 menit. Setelah mencapai suhu kamar,
krusibel platinum diangkat, Kemudian ditambahkan HNO3 ( 1 + 2 ) sebanyak 67,5
platheater pada suhu 1200C dan dibiarkan sampai garam – garam yang terbentuk
larut.
Dipindahkan larutan tersebut kedalam beaker gelas polyetilen 250 mL
dan ditambahkan air destilat hingga tanda, lalu dipersiapkan 5 mL beaker gelas
polyetilen ukuran 100 mL. Kemudian dipipet larutan standar SiO2 0,01 mg/mL
kedalam 4 buah beaker gelas polyetilen 100 mL, masing – masing sebanyak 3
mL, 5mL, 10 mL dan 15 mL sedangkan 1 beaker gelas lagi tanpa pemipetan
larutan standar SiO2 0,01 mg/mL. Ditambahkan 10 mL larutan blanko kedalam
beaker gelas polyetilen 100 mL lalu diencerkan dengan air destilat hingga menjadi
50 mL. Diukur pH larutan dengan pH- meter dan dijadikan pH nya menjadi 1,2
dengan HNO3 ( 1 + 2 ) lalu dipindahkan kedalam labu ukur 100mL. Ditambahkan
larutan tersebut dengan 2 mL ammonium molibdat 10 % kemasing – masing
dalam labu ukur polyetilen dan dibiarkan selama 5 menit, selanjutnya
ditambahkan 2 mL asam tartarik dan 2 mL zat pereduksi, lalu ditambahkan air pH
1,2 hingga garis tanda kemudian dibiarkan selama 15 menit.
c. Pengukuran Larutan Sampel dan Larutan Blanko
Diambil larutan Sampel dan Larutan Blanko, kemudian dimasukkan
kedalam kuvet, kemudian larutan diukur absorbansinya dengan spektrofotometer
BAB IV
HASIL DAN PEMBAHASAN
4.1 Data Percobaan
Dari hasil analisis pengukuran sampel dengan menggunakan spektrofotometer
maka didapatkan nilai absorbansi dari larutan standart SiO2
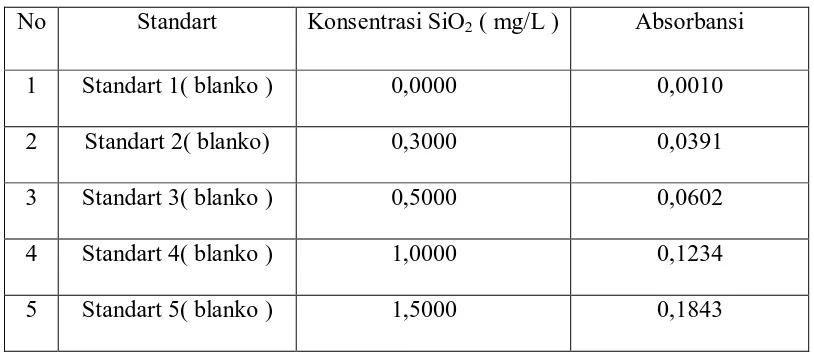
Tabel 4.1 Hasil Pengukuran Absorbansi Larutan Standar SiO2
No Standart Konsentrasi SiO2 ( mg/L ) Absorbansi
1 Standart 1( blanko ) 0,0000 0,0010
2 Standart 2( blanko) 0,3000 0,0391
3 Standart 3( blanko ) 0,5000 0,0602
4 Standart 4( blanko ) 1,0000 0,1234
5 Standart 5( blanko ) 1,5000 0,1843
Tabel 4.2 Hasil Pengukuran Absorbansi larutan sampel AlF3
No Sampel Absorbansi
1 Check sampel AlF3 ( A ) 0,0438
2 Check sampel AlF3 ( B ) 0,0493
3 Check sampel AlF3 ( C ) 0,0520
4.2 Perhitungan
4.2.1 Perhitungan persamaan garis regresi
Untuk menghasilkan persamaan garis regresi dari kurva kalibrasi dapat
Tabel 4.3 Data perhitungan persamaan garis regresi untuk analisis SiO2 dengan
menggunakan spektrofotometer UV- VIS
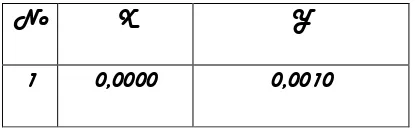
No X Y Xy x2
1 0,0000 0,0010 0,0000 0,0000
2 0,3000 0,0391 0,0117 0,0900
3 0,5000 0,0602 0,0301 0,2500
4 1,0000 0,1234 0,1234 1,0000
5 1,5000 0,1843 0,2765 2,2500
n= 5 ( =
3,3000 ( ) =
0,4080
( ) =
0,4416
( 2
=
3,5900
Dimana x = Konsentrasi larutan standar dan y = Absorbansi larutan standar
a
a
b =
b =
b = 0,0010
Sehingga didapat kan persamaan garis regresinya adalah :
y = 0,123x + 0,0010
4.2.2 Perhitungan Kurva Kalibrasi
Dengan mensubstitusikan harga – harga x, maka diperoleh harga y baru,
yaitu :
Tabel 4.4. Harga y baru untuk larutan standart SiO2
y = ax + b
y1 = 0,123 ( 0,0000 ) + 0,0010 = 0,0010
y2 = 0,123 ( 0,3000 ) + 0,0010 = 0,0379
y3 = 0,123 ( 0.5000 ) + 0,0010 = 0,0625
y4 = 0,123 ( 1,0000 ) + 0,0010 = 0,1240
y5 = 0,123 ( 1,5000) + 0,0010 = 0,1855
No X Y
2 0,3000 0,0379
3 0,5000 0,0625
4 1,0000 0,1240
5 1,5000 0,1855
Dimana : x = konsentrasi larutan standard an y = Absorbansi larutan
standar dengan menggunakan harga y ini dapat digambarkan kurva kalibrasi
absorbansi ( y ) versus konsentrasi ( x ) yang terdapat dalam tabel 4.4
4.2.3 Perhitungan Konsentrasi Sampel
Konsetrasi sampel dapat dihitung dengan mensubstitusikan harga y (absorbansi) larutan kedalam persamaan garis regresi y = ax + b, maka untuk sampel
dapat dihitung, x =
Persamaan garis regresi : y = 0,0123x + 0,0010
Konsentrasi SiO2 mg/ml dalam Check sampel A =
= 0,3454 mg /L
Konsentrasi SiO2 mg/ml dalam Check sampel B =
= 0,3890 mg /L
= 0,4116 mg /L
Jumlah kadar SiO2 dalam persen (% ) maka :
SiO2 % = 100
Dimana: [ ] adalah konsentrasi sampel dalam mg/ml
V adalah volume labu takar ( ml )
D adalah factor pengenceran
Ws adalah berat sampel ( gram )
• Untuk Check Sampel A
SiO2 % = 100
SiO2 % = 0,0690 %
• Untuk Check Sampel B
SiO2 % = 100
SiO2 % = 0,0777 %
• Untuk Check Sampel C
SiO2 % = 100
SiO2 % = 0,0822 %
No Kode sampel Kadar silika ( % )
1 Check sampel A 0,0690
2 Check sampel B 0,0777
3 Check sampel C 0,0822
4.3 Pembahasan
Dari hasil analisis yang telah dilakukan pada analisis kadar silika dalam
bahan baku aluminium fluorida secara spektrofotometri maka didapatkan nilai
rata – rata dari hasil analisis yaitu 0,0763 %. Berdasarkan dari hasil analisis itu
maka aluminium fluorida dapat ditambahkan didalam pot operasi tungku reduksi,
karena nilai kadar silika didalam aluminium fluorida masih berada dalam batas
maksimal standar japan international kadar silika yang ditentukan yaitu 0,25%.
Kriolit ( bath ) adalah senyawa yang digunakan sebagai larutan elektrolit
didalam proses elektrolisis alumina menjadi aluminium. Namun kriolit sangat
mudah menguap menjadi natrium tetrafluoroaminat jika pada saat penambahan
alumina banyak mengandung senyawa natrium oksida, akibatnya proses
elektrolisa akan terganggu, karena secara umum temperature bath ( kriolit ) akan
menurun, dampak negatif yang ditimbulkan yaitu alumina akan sulit dielektrolisis
menjadi aluminium dan biaya listrik yang dikeluarkan semakin besar. Untuk
menanggulangi hal tersebut harus ditambahkan aluminium fluoride, sehingga
natrium oksida yang masuk kedalam pot reduksi akan bereaksi membentuk kriolit.
Kriolit sendiri tersusun atas senyawa alumminium fluoride.
Aluminium fluoride berfungsi menjaga keasamaan bath ( kriolit ) dimana
dengan adanya penambahan aluminium fluoride temperature bath akan
turun,sehingga pot reduksi tempat elektrolisis aluminium dapat dioperasikan pada
temperature yang rendah. Jika hal ini terpenuhi maka akan memudahkan operasi.
Selama operasi berlangsung suhu bath lebih kurang 9650C. Suhu operasi pot
reduksi akan turun jika keasamaan elektrolit tinggi. Keasamaan elektrolit atau
Aluminum fluoride yang ditambahkan juga harus diperhatikan, maka perlu
dilakukan analisis agar aluminium ingot yang dihasilkan sesuai dengan parameter
– parameter yang diinginkan, seperti kadar silika dalam ingot batangan yang
sangat kecil kadarnya.
Kriolit banyak digunakan sebagai larutan dalam elektrolisis alumina
menjadi aluminium dikarenakan kriolit memiliki sifat – sifat yang sangat unik
yaitu mampu melarutkan semua oksida dengan baik, melarutkan alumina dengan
baik, tegangan komposisi lebih tinggi, konduktifitas elektrolitnya tinggi, titik
lelehnya relatif rendah, tidak dapat beraksi dengan aluminium dan karbon, cukup
encer sebagai pelarut, massa jenisnya cukup rendah bila dalam keadaan sama
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
• Kadar rata – rata Silika yang didapatkan pada analisis aluminium fluorida adalah sebesar 0,00763 %,dari hasil analisis ini diketahui bahwa aluminium
fluorida yang dianalisis masih memenuhi standar JIS ( japan international
standar ), maka dapat disimpulkan bahwa aluminium fluorida tersebut dapat
digunakan untuk menjaga keasamaan bath sehingga suhu bath berkisar
dibawah 10000 C
.
5.2 Saran
Pada analisis SiO2 ( silika ) di PT. INALUM sebaiknya peralatan habis
analisis material – material lain dicuci dengan menggunakan metanol terlebih
dahulu sehingga zat – zat yang masih menempel tidak akan menggangu analisa
material yang lain sehingga nilai kesalahan ( galat ) dalam analisis dapat
DAFTAR PUSTAKA
Allen, S. E. 1985. Chemical Analysis Of Ecological Materials. Second Edition.
London : Black Well Scientific Publication.
Bagian RSC. 2009. Modul Ojt Operasi Tungku Reduksi dan Pendukungnya.
PT. Inalum.
Cotton,F. A. 1989. Kimia Anorganik Dasar. Jakarta : UI-Press.
Haupin,W. 1995. Bath Properties And How They Affect Cell Operation.
Trondheim City : The International Course on Proses.
Underwood, A. L. 2002. Analisa Kimia Kuantitatif. Edisi Keenam. Jakarta :
Erlangga
Vogel, A. I. 1994. Kimia Analisis Kuantitatif Anorganik. Edisi keempat.