Lampiran 1. Data Pengamatan Persentase Terbentuknya Akar (%)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 100,00 - 0,00 - 100,00 - 0,00 200,00
2 - 0,00 100,00 100,00 - 0,00 100,00 300,00
3 100,00 0,00 - 0,00 0,00 - 0,00 100,00
4 - - 100,00 - 0,00 - - 100,00
5 - - 0,00 - 0,00 - - 0,00
6 0,00 - - 0,00 0,00 - 0,00 0,00
7 100,00 - 0,00 0,00 0,00 - - 100,00
8 100,00 - - - - 0,00 - 100,00
9 100,00 100,00 100,00 0,00 - - 100,00 400,00 10 100,00 100,00 100,00 - 0,00 0,00 100,00 400,00 11 0,00 0,00 100,00 0,00 0,00 0,00 - 100,00
12 - - 100,00 - - 0,00 100,00 200,00
13 - - 100,00 - - 0,00 - 100,00
14 - - 0,00 - - 0,00 - 0,00
Lampiran 2. Data Transformasi Persentase Terbentuknya Akar Arcsin √P
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 90,00 - 0,41 - 90,00 - 0,41 180,81
2 - 0,41 90,00 90,00 - 0,41 90,00 270,81
3 90,00 0,41 - 0,41 0,41 - 0,41 91,62
4 - - 90,00 - 0,41 - - 90,41
5 - - 0,41 - 0,41 - - 0,81
6 0,41 - - 0,41 0,41 - 0,41 1,62
7 90,00 - 0,41 0,41 0,41 - - 91,22
8 90,00 - - - - 0,41 - 90,41
9 90,00 90,00 90,00 0,41 - - 90,00 360,41
10 90,00 90,00 90,00 - 0,41 0,41 90,00 360,81
11 0,41 0,41 90,00 0,41 0,41 0,41 - 92,03
12 - - 90,00 - - 0,41 90,00 180,41
13 - - 90,00 - - 0,41 - 90,41
14 - - 0,41 - - 0,41 - 0,81
15 0,41 90,00 90,00 0,41 0,41 0,41 0,41 182,03 Total 541,22 271,22 721,62 92,43 93,24 3,24 361,62 2084,59 Rataan 60,14 45,20 60,14 13,20 10,36 0,41 45,20 234,64 Lampiran 3. Data Sidik Ragam Persentase Terbentuknya Akar (%)
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 33081,85 5513,64 0,24 2,28 TN GALAT 52,00 1172249,29 22543,26
TOTAL 58,00 1205331,14
Lampiran 4. Data Pengamatan Persentase Terbentuknya Kalus (%)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 0,00 - 100,00 - 0,00 - 0,00 100,00
2 - 0,00 0,00 100,00 - 100,00 100,00 300,00
3 0,00 0,00 - 100,00 0,00 - 0,00 100,00
4 - - 0,00 - 100,00 - - 100,00
5 - - 0,00 - 100,00 - - 100,00
6 0,00 - - 0,00 100,00 - 0,00 100,00
7 100,00 - 0,00 100,00 0,00 - - 200,00
8 0,00 - - - - 0,00 - 0,00
9 0,00 0,00 0,00 100,00 - - 100,00 200,00
10 0,00 0,00 100,00 - 100,00 100,00 0,00 300,00 11 0,00 0,00 0,00 100,00 100,00 100,00 - 300,00
12 - - 100,00 - - 100,00 0,00 200,00
13 - - 0,00 - - 100,00 - 100,00
14 - - 0,00 - - 100,00 - 100,00
Lampiran 5. Data Transformasi Persentase Terbentuknya Kalus Arcsin √P Ulangan
Perlakuan
Total A1 A2 A3 A4 A5 A6 A7
1 0,41 - 90,00 - 0,41 - 0,41 91,22
2 - 0,41 0,41 90,00 - 90,00 90,00 270,81
3 0,41 0,41 - 90,00 0,41 - 0.41 91,62
4 - - 0,41 - 90,00 - - 90,41
5 - - 0,41 - 90,00 - - 90,41
6 0,41 - - 0,41 90,00 - 0,41 91,22
7 90,00 - 0,41 90,00 0,41 - - 180,81
8 0,41 - - - - 0,41 - 0,81
9 0,41 0,41 0,41 90,00 - - 90,00 181,22
10 0,41 0,41 90,00 - 90,00 90,00 0,41 271,22 11 0,41 0,41 0,41 90,00 90,00 90,00 - 271,22
12 - - 90,00 - - 90,00 0,41 180,41
13 - - 0,41 - - 90,00 - 90,41
14 - - 0,41 - - 90,00 - 90,41
15 90,00 0,41 0,41 90,00 90,00 90,00 0,41 361,22 Total 182,84 2,43 273,65 540,41 541,22 630,41 182,43 2353,37 Rataan 20,32 0,41 22,80 77,20 60,14 78,80 22,80 282,46 Lampiran 6. Data Sidik Ragam Persentase Terbentuknya Kalus (%)
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 44187,33 7364,56 0,30 2,28 TN GALAT 52,00 1282278,36 24659,20
TOTAL 58,00 1326465,69
Lampiran 7. Data Pengamatan Umur Muncul Akar (%)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 14,00 - - - 14,00 - - 28,00
2 - - 17,00 12,00 - - 17,00 46,00
3 14,00 - - - 14,00
4 - - 17,00 - - - - 17,00
5 - - - -
6 - - - -
7 16,00 - - - 16,00
8 17,00 - - - 17,00
9 12,00 7,00 17,00 - - - 17,00 53,00
10 16,00 13,00 17,00 - - - 17,00 63,00
11 - - 12,00 - - - - 12,00
12 - - 11,00 - - - 12,00 23,00
13 - - 12,00 - - - - 12,00
14 - - - -
15 - 14,00 13,00 - - - - 27,00
Total 89,00 34,00 116,00 12,00 14,00 - 63,00 328,00 Rataan 14,83 11,33 14,50 12,00 14,00 - 15,75 82,42 Lampiran 8. Data Sidik Ragam Umur Muncul Akar (%)
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 2896,3 482,72 0,27 2,74 TN GALAT 52,00 28390 1774,4
TOTAL 58,00 31286
Lampiran 9. Data Pengamatan Umur Muncul Kalus (%)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 - - 11,00 - - - - 11,00
2 - - - 6,00 - 20,00 13,00 39,00
3 - - - 21,00 - - - 21,00
4 - - - - 17,00 - - 17,00
5 - - - - 17,00 - - 17,00
6 - - - - 13,00 - - 13,00
7 11,00 - - 17,00 - - - 28,00
8 - - - -
9 - - - 14,00 - - 13,00 27,00
10 - - 13,00 - 13,00 17,00 - 43,00
11 - - - 17,00 13,00 11,00 - 41,00
12 - - 6,00 - - 23,00 - 29,00
13 - - - 11,00 - 11,00
14 - - - 17,00 - 17,00
15 13,00 - - 17,00 17,00 17,00 - 64,00
Total 24,00 - 30,00 92,00 90,00 116,00 26,00 378,00 Rataan 12,00 - 10,00 15,33 15,00 16,57 13,00 81,90 Lampiran 10. Data Sidik Ragam Umur Muncul Kalus (%)
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 3187,19 531,20 0,29 2,63 TN GALAT 52,00 34769,81 1829,99
TOTAL 58,00 37957,00
Lampiran 11. Data Pengamatan Berat Segar Akar (gram)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 0,20 - 0,00 - 0,07 - 0,00 0,27
2 - 0,00 0,14 0,04 - 0,00 0,05 0,19
3 0,05 0,00 - 0,00 0,00 - 0,00 0,05
4 - - 0,03 - 0,00 - - 0,03
5 - - 0,00 - 0,00 - - 0,00
6 0,00 - - 0,00 0,00 - 0,00 0,00
7 0,02 - 0,00 0,00 0,00 - - 0,02
8 0,05 - - - - 0,00 - 0,05
9 0,00 0,19 0,05 0,00 - - 0,02 0,26
10 0,16 0,12 0,23 - 0,00 0,00 0,06 0,56
11 0,00 0,00 0,05 0,00 0,00 0,00 - 0,05
12 - - 0,13 - - 0,00 0,04 0,16
13 - - 0,09 - - 0,00 - 0,09
14 - - 0,00 - - 0,00 - 0,00
Lampiran 12. Data Transformasi Berat Segar Akar √x+ 0,5
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 0,84 - 0,71 - 0,75 - 0,71 3,00
2 - 0,71 0,80 0,73 - 0,71 0,74 3,69
3 0,74 0,71 - 0,71 0,71 - 0,71 3,57
4 - - 0,73 - 0,71 - - 1,44
5 - - 0,71 - 0,71 - - 1,41
6 0,71 - - 0,71 0,71 - 0,71 2,83
7 0,72 - 0,71 0,71 0,71 - - 2,84
8 0,74 - - - - 0,71 - 1,45
9 0,71 0,83 0,74 0,71 - - 0,72 3,71
10 0,81 0,79 0,85 - 0,71 0,71 0,75 4,61
11 0,71 0,71 0,74 0,71 0,71 0,71 - 4,28
12 - - 0,79 - - 0,71 0,73 2,23
13 - - 0,77 - - 0,71 - 1,48
14 - - 0,71 - - 0,71 - 1,41
15 0,71 0,76 0,83 0,71 0,71 0,71 0,71 5,12 Total 6,68 4,50 9,09 4,98 6,41 5,66 5,77 43,08 Rataan 0,74 0,75 0,76 0,71 0,71 0,71 0,72 5,10 Lampiran 13. Data Sidik Ragam Berat Segar Akar (%)
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 0,02 0,004 3,02 2,28 *
GALAT 52,00 0,07 0,001
TOTAL 58,00 0,09
Lampiran 14. Data Pengamatan Berat Segar Kalus (gram)
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 0,00 - 0,01 - 0,00 - 0,00 0,01
2 - 0,00 0,00 0,01 - 0,02 0,00 0,02
3 0,00 0,00 - 0,02 0,00 - 0,00 0,02
4 - - 0,00 - 0,02 - - 0,02
5 - - 0,00 - 0,06 - - 0,06
6 0,00 - - 0,00 0,02 - 0,00 0,02
7 0,02 - 0,00 0,01 0,00 - - 0,04
8 0,00 - - - - 0,00 - 0,00
9 0,00 0,00 0,00 0,01 - - 0,01 0,03
10 0,00 0,00 0,02 - 0,03 0,02 0,00 0,07
11 0,00 0,00 0,00 0,02 0,00 0,05 - 0,06
12 - - 0,03 - - 0,03 0,00 0,06
13 - - 0,00 - - 0,00 - 0,00
14 - - 0,00 - - 0,02 - 0,02
Lampiran 15. DataTransformasi Berat Segar Kalus √x+ 0,5
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 0,71 - 0,72 - 0,71 - 0,71 2,84
2 - 0,71 0,71 0,71 - 0,02 0,71 2,84
3 0,71 0,71 - 0,72 0,71 - 0,71 3,55
4 - - 0,71 - 0,72 - - 1,42
5 - - 0,71 - 0,75 - - 1,46
6 0,71 - - 0,71 0,72 - 0,71 2,84
7 0,72 - 0,71 0,72 0,71 - - 2,85
8 0,71 - - - - 0,71 - 1,41
9 0,71 0,71 0,71 0,72 - - 0,72 3,55
10 0,71 0,71 0,72 - 0,73 0,72 0,71 4,29
11 0,71 0,71 0,71 0,72 0,71 0,74 - 4,29
12 - - 0,73 - - 0,73 0,71 2,16
13 - - 0,71 - - 0,71 - 1,41
14 - - 0,71 - - 0,72 - 1,43
15 0,72 0,71 0,71 0,72 0,72 0,73 0,71 5,00 Total 6,39 4,24 8,53 5,02 6,47 5,06 5,67 41,37 Rataan 0,7098 0,71 0,71 0,72 0,72 0,63 0,7082 4,90 Lampiran 16. Data Sidik Ragam Berat Segar Kalus (%)
SK DB JK KT F. Hitung F. 0.05 Ket
PERLAKUAN 6,00 0,044 0,0074 0,0013 2,28 TN GALAT 52,00 283,64 5,4545
TOTAL 58,00 283,68
Lampiran 17. Data Pengamatan Jumlah Akar
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 26,00 - 0,00 - 24,00 - 0,00 50,00
2 - 0,00 2,00 15,00 - 0,00 5,00 22,00
3 2,00 0,00 - 0,00 0,00 - 0,00 2,00
4 - - 25,00 - 0,00 - - 25,00
5 - - 0,00 - 0,00 - - 0,00
6 0,00 - - 0,00 0,00 - 0,00 0,00
7 15,00 - 0,00 0,00 0,00 - - 15,00
8 17,00 - - - - 0,00 - 17,00
9 0,00 12,00 40,00 0,00 - - 25,00 77,00
10 40,00 37,00 51,00 - 0,00 0,00 20,00 148,00
11 0,00 0,00 32,00 0,00 0,00 0,00 - 32,00
12 - - 62,00 - - 0,00 22,00 84,00
13 - - 15,00 - - 0,00 - 15,00
14 - - 0,00 - - 0,00 - 0,00
Lampiran 18. Data Transformasi Jumlah Akar √x+ 0,5
Ulangan Perlakuan Total
A1 A2 A3 A4 A5 A6 A7
1 5,15 - 0,71 - 4,95 - 0,71 11,51
2 - 0,71 1,58 3,94 - 0,71 2,35 9,28
3 1,58 0,71 - 0,71 0,71 - 0,71 4,41
4 - - 5,05 - 0,71 - - 5,76
5 - - 0,71 - 0,71 - - 1,41
6 0,71 - - 0,71 0,71 - 0,71 2,83
7 3,94 - 0,71 0,71 0,71 - - 6,06
8 4,18 - - - - 0,71 - 4,89
9 0,71 3,54 6,36 0,71 - - 5,05 16,36
10 6,36 6,12 7,18 - 0,71 0,71 4,53 25,61
11 0,71 0,71 5,70 0,71 0,71 0,71 - 9,24
12 - - 7,91 - - 0,71 4,74 13,36
13 - - 3,94 - - 0,71 - 4,64
14 - - 0,71 - - 0,71 - 1,41
15 0,71 5,34 6,36 0,71 0,71 0,71 0,71 15,24 Total 24,04 17,12 46,91 8,18 10,61 5,66 19,49 132,01 Rataan 2,67 2,85 3,91 1,17 1,18 0,71 2,44 14,92 Lampiran 19. Data Sidik Ragam Jumlah Akar
SK db JK KT F. hitung F. 0.05 Ket
PERLAKUAN 6,00 74,64 12,44 3,02 2,28 * GALAT 52,00 214,51 4,13
TOTAL 58,00 289,15
Lampiran 20. Komposisi Media Murashige dan Skoog (MS)
(Sumber: Murashige and Skoog, 1962)
Bahan Kimia Konsentrasi Media (ppm)
Makro Nutrien (Stok I)
NH4 NO3 1650,000
KNO3
CaCl2.2H2O
MgSO4.7H2O
1900,000 440,000 370,000
KH2PO4 170,000
Mikro Nutrien (Stok II) MnSO4.H2O
ZnSO4.7H2O
H3BO3
6,900 8,600 6,200
KI 0,830
Na2MoO4.2H20 0,250
CuSO4.5H2O 0,025
CoCl2.6H2O
Iron (Stok III)
0,025
FeSO4.7H2O 27,800
Na2.EDTA 37,200
Vitamin (Stok IV)
Nikotinic acid 0,500
Pyridoxin HCL 0,500
Thiamine HCL 0,100
Myo-inositol 100,000
Sukrosa Agar
Lampiran 21. Bagan Penelitian
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
A5
A2 A3 A1
A2 A5 A4 A3 A2 A5 A1 A4 A7 A2 A7
A6
A7 A1 A7
A6 A4 A1 A2 A5 A3 A7 A2 A4 A5 A1
A3
A3 A2 A5
A4 A2 A3 A6 A3 A2 A6 A7 A5 A6 A6
A1
A4 A7 A6
A1 A1 A2 A7 A1 A1 A4 A6 A1 A4 A2
A7
A1 A6 A4
A3 A7 A6 A5 A4 A7 A5 A5 A6 A3 A4
A2
A5 A4 A3
A7 A3 A5 A4 A6 A4 A2 A3 A2 A7 A3
A4
A6 A5 A2
Lampiran 22. Kegiatan Penelitian
Jenis Kegiatan Minggu ke –
1 2 3 4 5 6 7 8
Sterilisasi Alat X
Pembuatan Media X
Pengambilan Bahan Tanaman X Sterilisasi Bahan Tanaman X
Persiapan Ruang Tanam X
Penanaman X
Pemeliharaan Eksplan X X X X X X X
Peubah Amatan
Persentase Terbentuknya Akar
(%) X
Persentase Terbentuknya Kalus
(%) X
Umur Munculnya Akar X
Umur Munculnya Kalus X
Warna Kalus X
Tekstur Kalus X
Berat Segar Akar (gram) X
Berat Segar Kalus (gram) X
Jumlah Akar X
Warna Kalus X
Tekstur Kalus X
Morfogenesis X
Pengukuran Kandungan β
Lampiran 23. Foto Penelitian
A1 A2
A3 A4
DAFTAR PUSTAKA
Aziz, S. A. 2013. Prosedur operasional baku budidaya bangun-bangun (Plectranthus amboinicus). Southeast Asian Food and Agricultural Science and Technology (SEAFAST) Centre Research and Community Service Institution. IPB, Bogor.
Bintang, M. 2010. Biokimia. Teknik Penelitian. Departemen Biokimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. IPB, Bogor.
Carew, D. P and R. J. Krueger. 1977. Catharathus roseus tissue culture. The Effects of Medium Modifications on Growth and Alkaloid
Production. J. Nat. Prod. 40: 326-336.
Collin, H. A. and Edwards. 1998. Plant cell culture. BIOS Sci. Publ. Ltd. 158 pp. Conger, B. V. 1980. Cloning agricultural plants via in vitro technique. CRC Press
Inc. Florida. pp. 11-22.
Damanik, R. M., H. Syarief., T. Sinaga dan T. H. Doloksaribu. 2014. Pemanfaatan daun bangun-bangun dalam pengembangan produk makanan tambahan fungsional untuk ibu menyusui. JIPI. ISSN 0853-4217. 19 (1): 38-42. Dalimoenthe, S. L. 1987. Kultur jaringan sebagai sarana untuk menghasilkan
metabolit sekunder. dalam Pramono, S., D. Gunawan dan C. J. Soegihardjo (ed.) Buku Risalah Seminar Nasional Metabolit
Sekunder 1987. Yogyakarta: PAU Bioteknologi UGM.
Darminto, A., Alimuddin dan D. Iwan. 2009. Indentifikasi senyawa metabolit sekunder potensial menghambat pertumbuhan bakteri Aeromonas hydrophyla dari kulit batang tumbuhan Aveccennia spp. J. Chemica. 10 (2): 92 – 99.
Davies, P. J. 1990. Plant hormones and their role in plant growth and development. USA: Kluwer Academic Publisher. pp. 593-613.
Fancy, S. A and K. Rumpel. 2008. GC-MS based metabolomics in methods in pharmacology and toxicology. Biomarker Methods in Drug Discovery and Development. Humana Press. Totowa. pp. 317–340.
Kaliappan N. D and P. K Viswanathan. 2008. Pharmacognostical studies on the
leaves of Plectranthus amboinicus (Lour) Spreng. Int. J. Green Pharm. 2 (3): 182-184.
Khajarern, J and S. Khajarern. 2002. The efficacy of origanum essentiqal oils in sow feed. Int. Pig Topics.
Kristina, N. N dan S. F. Syahid. 2014. Pemanfaatan tanaman kelor (Moringa oleifera) untuk meningkatkan produksi air susu ibu. Warta
Penelitian dan Pengembangan Tanaman Industri. Balitro.
Lestari, E. G 2011. Peranan zat pengatur tumbuh dalam perbanyakan tanaman melalui kultur jaringan. J. Agro Biogen. 7 (1): 63-68.
Lukhoba, C. W., M. S. J. Simmonds and A. J. Paton. 2005. Plectranthus: a preview of ethnobotanical use. J. Ethnopharmacol. 103 (1): 1-24.
Mahadi, I., S. Wulandari dan D. Trisnawati. 2013. Pemberian NAA dan kinetin terhadap pertumbuhan eksplan buah naga (Hylocereus costaricensis) melalui teknik kultur jaringan secara in vitro. Program Studi Pendidikan Biologi Jurusan FMIPA FKIP. Universitas Riau, Pekanbaru.
Mendanha, A. B. L., A. T. Roberto and B. F. Adelson. 1998. Micropropagation of rubber trees (Hevea brasiliensis Muell. Arg.). Genet. Mol. Biol. 21 (3).
Nasution, R. 2013. Isolasi dan penentuan struktur senyawa steroid dari daun tumbuhan kulu (Artocarpus camansi: sukun berbiji) yang bersifat antidiabetes. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sumatera Utara, Medan.
Nuke. 2008. Kajian berbagai komposisi media serta kondisi gelap dan terang terhadap induksi kalus tanaman jati belanda (Guazuma ulmifolia Lamk.). Skripsi. Program Studi Agronomi. Fakultas
Pertanian. Universitas Sebelas Maret.
Pandey, B. P. 2007. Taxonomy of angiosperms. S. Chand and Company Ltd. New Delhi.
Panjaitan, E. 2005. Respons pertumbuhan tanaman anggrek (Dendrobium sp.)
terhadap pemberian BAP dan NAA secara in vitro. J. Penelitian
Bidang Ilmu Pertanian. Universitas Methodist Medan, Medan. (3): 45-51.
Prakash, O. R., R. Acharya., S. K. Mishra and R. Sahoo. 2012. Patorchur (Coleus aromaticus): a review of the medicinal evidence for its
phytochemistry and pharmacology properties. IJABPT. 3 (4): 54-348.
Prasetyo, C. H. 2009. Teknik kultur jaringan Dendrobium sp. di pembudidayaan anggrek Widorokandang Yogyakarta. Program Studi Agribisnis Hotikultura dan Arsitektur Pertamanan. Fakultas Pertanian. Universitas Sebelas Maret, Surakarta.
Priyatno, T. P. 2013. Pangan tradisional Sumatera Utara berbasis budaya dan pelestarian in situ. Warta Plasma Nutfah Indonesia
Pullaiah, T. 2006. Encyclopaedia of world medicinal plants. Regency Publication. New Delhi.
Puteri, R. F. 2014. Pengaruh penambahan berbagai konsentrasi NAA (Napthalene Acetic Acid) dan BAP (Benzyl Amino Purine) terhadap
induksi kalus daun Sirsak (Annona muricata) secara in vitro. Lentera Bio. 3 (3): 154-159.
Ramachandran, K. 1967. Cytology of genus coleus. Cytologia. 32 : 474-480. Razzaque, A. and B. E. Ellis. 1977. Rosmarinic acid production in coleus cell
cultures. Planta. 137 (3): 287-291.
Reddy, P. S., R. Rodrigues and R. Rajasekharan. 2001. Shoot organogenesis and mass propagation of Coleus forskohlii from leaf derived callus. Plant Cell Tissue and Organ Culture. 66: 183-188.
Sahay, R., S. Banerjee and K. Kundu. 2011. Coleus aromaticus Benth: a nutritive medicinal plant of potential therapeutic value. IJPBS. 2 (3): 488-496. Santoso, U dan F. Nursandi. 2004. Kultur jaringan tanaman. Edisi Pertama. UMM
Press. Universitas Muhammadiyah Malang, Malang.
Shofiyani, A dan A. M. Purnawanto. 2010. Pengaruh kombinasi 2,4 D dan Benzil Amino Purin (BAP) terhadap pembentukan kalus pada eksplan daun kencur (Kaemferia galangl L.) secara in vitro. Laporan Penelitian Dosen Muda. Universitas Muhammadiyah Purwokerto.
Steel, R. G. D dan J. H. Torrie. 1995. Prinsip dan prosedur statistika. Penerjemah Bambang Sumantri. Gramedia Pustaka, Jakarta
Sugiyarto, A. D. Setyawan dan A. Pitoyo. 2006. Estimasi kemelimpahan dan distribusi Plantago major L. di Gunung Lawu. Pusat Penelitian dan Pengembangan Bioteknologi dan Biodiversitas. Lembaga Penelitian dan Pengabdian kepada Masyarakat (LPPM). Jurusan Biologi FMIPA Universitas Sebelas Maret, Surakarta.
Warsiki, E., E. Damayanthy dan R. Damanik. 2009. Karakteristik mutu sop daun torbangun (Coleus amboinicus Lour) dalam kemasan kaleng dan
perhitungan total migrasi bahan kemasan. J. Teknol. Indust. Pertan. 18: 21-24.
Wetherell, D. F. 1982. Pengantar propagasi tanaman secara in vitro. Oleh Dra. Koensoemardiyah Seri Kultur Jaringan Tanaman. Avery Publ. Group Inc. New Jersey. 110 pp.
Wetter, L. R dan F. Constabel. 1991. Metode kultur jaringan tanaman. Edisi Kedua. Penerbit ITB Bandung, Bandung.
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan UPT. Benih Induk Hortikultura Gedung Johor, Dinas Pertanian, Sumatera Utara dan Laboratorium Genetika Molekuler, Fakultas Pertanian, Universitas Sumatera Utara. Penelitian ini dimulai pada bulan April 2016 sampai dengan Juli 2016. Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah daun bangun-bangun (P.amboinicus) aksesi Medan (Krakatau) sebagai eksplan, larutan
stok media MS (Murashige and Skoog) sebagai komposisi media, NAA, 2,4 D dan kinetin sebagai zat pengatur tumbuh, agar, aquadest steril, dan aluminium foil. Bahan lain yang digunakan seperti metanol, kloroform, campuran asam asetat anhidrida, asam sulfat pekat, larutan standar, larutan blanko, larutan sampel dan bahan-bahan lainnya yang mendukung penelitian ini.
Alat-alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), botol kultur, autoklaf, waterbath, timbangan analitik, rak kultur,
hot plate dengan magnetik stirer, erlenmeyer, glassware, pipet ukur, dissecting
set, lampu bunsen, pH meter, oven, pipet tetes, dan alat-alat lainnya yang
mendukung penelitian ini. Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) non-faktorial dengan ulangan tidak sama, yaitu:
A3: MS + 3 mg/l NAA + 0,1 mg/l kinetin A4: MS + 1 mg/l 2,4 D + 0,1 mg/l kinetin A5: MS + 2 mg/l 2,4 D + 0,1 mg/l kinetin A6: MS + 3 mg/l 2,4 D + 0,1 mg/l kinetin A7: MS + 0,1 mg/l kinetin
Jumlah perlakuan : 7 Jumlah ulangan : 15 Jumlah eksplan tiap botol kultur : 1 Jumlah seluruh eksplan : 105
Adapun model liner dari sidik ragam penelitian sebagai berikut: Yijk = μ + τi + ε ij
i = 1,2,3,…7 j = 1,2,3…15
Yijk = Nilai pengamatan unit percobaan pada perlakuan zat pengatur tumbuh ke-i dan ulangan ke-j
µ = Nilai tengah umum
τi = Pengaruh zat pengatur tumbuh ke-i
ε ij = Galat percobaan pada perlakuan zat pengatur tumbuh ke-i dan ulangan ke-i
Jika perlakuan berbeda nyata dalam sidik ragam maka dilanjutkan dengan
PELAKSANAAN PENELITIAN Sterilisasi Alat
Alat-alat dissecting-set dan glassware yang akan digunakan untuk kultur in vitro dicuci dan dikeringkan. Kemudian alat-alat disterilkan dengan autoklaf
pada suhu 121oC dengn tekanan 17,5 psi selama 60 menit dan disterilkan secara kering di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
Media yang digunakan adalah media MS padat. Sebelum dilakukan pembuatan media MS, dilakukan pembuatan larutan stok ZPT NAA, 2,4 D dan kinetin. Larutan stok NAA 2,4 D dan kinetin disaring menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di LAF.
Pada pembuatan media MS, tahap pertama adalah membuat larutan stok bahan kimia hara makro dengan pembesaran 100x, hara mikro dengan pembesaran 100x, larutan iron dengan pembesaran 100x, larutan vitamin dengan pembesaran 100x, sukrosa 30 g, myo-inositol 0,1 g dan agar 7 g. Tahap berikutnya, sukrosa dimasukkan ke dalam beaker glass yang telah berisi akuades 750 ml, lalu diaduk dengan menggunakan magnetic stirrer sebagai pengaduk. Persiapan Ruang Kultur
terkontaminasi. Steril box dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Sterilisasi Eksplan
Eksplan yang digunakan untuk menginduksi kalus diambil dari daun muda (daun ke-2 atau ke-3 dari atas) tanaman P. amboinicus. Sterilisasi eksplan dilakukan dengan memberikan fungisida (dithane) yang dicampurkan dengan air. Eksplan yang telah diambil dari lapangan kemudian dicuci di bawah air bersih yang mengalir. Selanjutnya direndam dalam Bayclin 15 % yang ditambahkan Tween 20 sebanyak 2 tetes selama 10 menit, lalu dibilas 3 kali dengan akuades steril. Eksplan kembali direndam dengan alkohol 70% selama 3 menit. Dibilas lagi dengan menggunakan akuades, lalu ditiriskan dengan menggunakan kertas tisu.
Penanaman Eksplan
Pemeliharaan Eksplan
Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari disemprot dengan alkohol 96% atau dan disemprot formalin agar bebas dari organisme yang menyebabkan terjadi kontaminasi. Dalam penelitian ini suhu ruangan kultur yang digunakan +20-25°C dengan suhu optimum 180ºC dan intensitas cahaya 2000 lux serta dengan kondisi ruangan memiliki air conditioner dengan hefa yang dibersihkan selama 6 bulan sekali. Apabila mengalami kontaminasi, segera diambil dari rak kultur agar mencegah kontaminasi ke tabung lainnya.
Analisis Beta Sitosterol
Peubah Amatan
Persentase Terbentuknya Akar (%)
Persentase terbentuknya kalus dihitung pada 4 MST dengan rumus: Persentase terbentuknya kalus = Jumlah akar yang terbentuk
Jumlah seluruh eksplan yang ditanam
x 100 %
Persentase Terbentuknya Kalus (%)
Persentase terbentuknya kalus dihitung pada 4 MST dengan rumus: Persentase terbentuknya kalus = Jumlah kalus yang terbentuk
Jumlah seluruh eksplan yang ditanaman
x 100 %
Umur Munculnya Akar (HST)
Pengamatan dilakukan dengan mencatat hari saat akar pertama kali muncul. Munculnya kalus ditandai dengan adanya tonjolan-tonjolan berjejal berwarna putih kompak pada permukaan eksplan.
Umur Munculnya Kalus (HST)
Pengamatan dilakukan dengan mencatat hari saat kalus pertama kali muncul. Munculnya kalus ditandai dengan adanya tonjolan-tonjolan berjejal berwarna putih kompak pada permukaan eksplan.
Berat Segar Akar (gram)
Diukur pada akhir penelitian dengan menimbang akar. Berat Segar Kalus (gram)
Diukur pada akhir penelitian dengan menimbang kalus. Jumlah Akar
Warna kalus
Warna kalus diamati pada akhir penelitian dengan menggunakan skoring warna kalus, yaitu sebagai berikut:
1 = kalus berwarna putih kecoklatan 2 = kalus berwarna coklat muda 3 = kalus berwarna coklat 4 = kalus berwarna coklat tua
5 = kalus berwarna coklat kehitaman (Nuke, 2008).
Tekstur Kalus
Ditentukan pada akhir penelitian apakah kalus yang terbentuk kalus bertekstur kompak atau remah.
Morfogenesis
Ditentukan pada akhir penelitian apakah eksplan mengalami morfogenesis langsung atau tidak langsung.
Kandungan β-Sitosterol
Ditentukan pada akhir penelitian apakah ada atau tidak terkandung
HASIL DAN PEMBAHASAN Hasil
Dari hasil analisis data yang dilakukan, diperoleh bahwa perlakuan ZPT memberikan pengaruh nyata terhadap berat segar akar dan jumlah akar tetapi belum memberikan pengaruh nyata terhadap persentase terbentuknya akar, persentase terbentuknya kalus, umur muncul akar, umur muncul kalus, dan berat segar kalus.
Persentase Terbentuknya Akar (%)
Berdasarkan hasil pengamatan dan sidik ragam terhadap parameter persentase terbentuknya akar pada perlakuan ZPT (Lampiran 1-2) belum menunjukkan pengaruh yang berbeda nyata.
Rataan persentase terbentuknya akar dari perlakuan ZPT dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh perlakuan ZPT terhadap persentase munculnya akar (%)
Perlakuan % Terbentuk Akar
A1 66,67
A2 50,00
A3 66,67
A4 14,29
A5 11,11
A6 0,00
A7 50,00
Keterangan: Angka 0,00 menunjukkan eksplan tumbuh steril tetapi tidak terbentuk akar
[image:30.595.113.509.78.278.2]
a b Gambar 1. a. Eksplan sebelum membentuk akar
b. Eksplan setelah membentuk akar Persentase Terbentuknya Kalus (%)
Berdasarkan hasil pengamatan dan sidik ragam terhadap parameter persentase terbentuknya kalus pada perlakuan ZPT belum menunjukkan pengaruh yang berbeda nyata (Lampiran 3-4).
[image:30.595.116.522.484.617.2]Rataan persentase terbentuknya kalus dari perlakuan ZPT dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh perlakuan ZPT terhadap persentase munculnya kalus (%)
Perlakuan % Terbentuk Kalus
A1 22,22
A2 0,00
A3 25,00
A4 85,71
A5 66,67
A6 87,50
A7 25,00
Keterangan: Angka 0,00 menunjukkan eksplan tumbuh steril tetapi tidak terbentuk kalus
[image:31.595.115.512.85.263.2]
a b Gambar 2. a. Eksplan sebelum membentuk kalus
b. Eksplan setelah membentuk kalus Umur Munculnya Akar (hari)
Berdasarkan hasil pengamatan dan sidik ragam terhadap parameter umur muncul akar pada perlakuan ZPT belum menunjukkan pengaruh yang berbeda nyata (Lampiran 5-6).
[image:31.595.117.523.446.582.2]Rataan umur muncul akar dari perlakuan ZPT dapat dilihat pada Tabel 3. Tabel 3. Pengaruh perlakuan ZPT terhadap umur muncul akar (hari)
Perlakuan Umur Muncul Akar (hari)
A1 14,83
A2 11,33
A3 14,50
A4 12,00
A5 14,00
A6 -
A7 15,57
Keterangan: Tanda (-) menunjukkan eksplan tumbuh steril tetapi tidak terbentuk akar
Umur Munculnya Kalus (hari)
Berdasarkan hasil pengamatan dan sidik ragam terhadap parameter umur muncul kalus pada perlakuan ZPT belum menunjukkan pengaruh yang berbeda nyata (Lampiran 7-8).
Tabel 4. Pengaruh perlakuan ZPT terhadap umur muncul kalus (hari)
Perlakuan Umur Muncul Kalus (hari)
A1 18,00
A2 -
A3 13,33
A4 17,17
A5 15,00
A6 16,57
A7 14,50
Keterangan: Tanda (-) menunjukkan eksplan tumbuh steril tetapi tidak terbentuk kalus
Berat Segar Akar (gram)
Berdasarkan hasil pengamatan dan sidik ragam terhadap berat segar akar pada perlakuan ZPT menunjukkan pengaruh yang berbeda nyata (Lampiran 9-10).
Rataan berat segar akar dari perlakuan ZPT dapat dilihat pada Tabel 5. Tabel 5. Pengaruh perlakuan ZPT terhadap berat segar akar (g)
Perlakuan Berat Segar Akar (g)
A1 0,05c
A2 0,06b
A3 0,08a
A4 0,01d
A5 0,01d
A6 0,00d
A7 0,02d
Keterangan: -Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%
-Angka 0,00 menunjukkan eksplan tumbuh steril tetapi tidak terbentuk akar
Pada Tabel 5, memperlihatkan berat segar akar tertinggi pada perlakuan A3 (MS + 3 mg/l NAA + 0.1 mg/l kinetin) dengan rataan (0,08) dan terendah pada perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin) dengan rataan (0,00). Berat Segar Kalus (gram)
Berdasarkan hasil pengamatan dan sidik ragam terhadap berat segar kalus pada perlakuan ZPT belum menunjukkan pengaruh yang berbeda nyata (Lampiran 11-12).
[image:32.595.115.518.366.501.2]Tabel 6. Pengaruh perlakuan ZPT terhadap berat segar kalus (g)
Perlakuan Berat Segar Kalus (g)
A1 0,004
A2 0,00
A3 0,01
A4 0,01
A5 0,02
A6 0,02
A7 0,002
Keterangan: Angka 0,00 menunjukkan eksplan tumbuh steril tetapi tidak terbentuk kalus
Jumlah Akar
Berdasarkan hasil pengamatan dan sidik ragam terhadap jumlah akar pada perlakuan ZPT menunjukkan pengaruh yang berbeda nyata (Lampiran 13-14).
Rataan jumlah akar dari perlakuan ZPT dapat dilihat pada Tabel 7. Tabel 7. Pengaruh perlakuan ZPT terhadap jumlah akar (akar)
Perlakuan Jumlah Akar
A1 11,11b
A2 12,83b
A3 22,25a
A4 2,14e
A5 2,67d
A6 0,00f
A7 9,00c
Keterangan: -Angka-angka yang diikuti huruf yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%
-Angka 0,00 menunjukkan eksplan tumbuh steril tetapi tidak terbentuk akar
Pada Tabel 7, memperlihatkan jumlah akar tertinggi pada perlakuan A3 (MS + 3 mg/l NAA + 0.1 mg/l kinetin) dengan rataan (22,25) dan terendah pada perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin) dengan rataan (0,00).
Warna Kalus
[image:33.595.117.516.368.501.2]Tekstur Kalus
[image:34.595.107.524.180.294.2]Semua kalus yang terbentuk dari perlakuan ZPT adalah kalus bertekstur remah (friable).
Tabel 8. Pengaruh perlakuan ZPT terhadap tekstur kalus
Perlakuan Tekstur Kalus
A1 Remah
A2 Remah
A3 Remah
A4 Remah
A5 Remah
A6 Remah
A7 Remah
Morfogenesis
Morfogenesis pada eksplan terjadi secara langsung dan tidak langsung (melalui kalus terlebih dahulu).
a b
Gambar 3. Morfogenesis eksplan, a. Kemunculan akar langsung dari eksplan, b. Kemunculan akar tidak langsung dari eksplan
Kandungan β-Sitosterol
[image:34.595.115.510.392.565.2]Tabel 9. Pengaruh perlakuan ZPT terhadap kandungan β-sitosterol
Perlakuan
Hasil Reagen Sterol
(Liebermand-Burchard)
Keterangan Akar Kalus
A1 Coklat Coklat Tidak ada sterol
A2 Coklat - Tidak ada sterol
A3 Coklat Coklat Tidak ada sterol
A4 Coklat Coklat Tidak ada sterol
A5 Coklat Coklat Tidak ada sterol
A6 - Coklat Tidak ada sterol
A7 Coklat Coklat Tidak ada sterol
Keterangan: Coklat = tidak ada kandungan sterol; hijau = terdapat kandungan sterol; tanda (-) tidak ada biomassa
[image:35.595.168.429.271.474.2]a b
Gambar 4. a. Sebelum penambahan asam asetat anhidrida dan asam sulfat b. Sesudah penambahan asam asetat anhidrida dan asam sulfat Pembahasan
Pengaruh Zat Pengatur Tumbuh pada Eksplan Daun P. amboinicus terhadap Pertumbuhan Biomassa Secara In Vitro
Dari hasil analisis data secara statistik diketahui bahwa perlakuan ZPT memberikan pengaruh nyata terhadap berat segar akar dan jumlah akar tetapi belum memberikan pengaruh nyata terhadap peubah amatan lain.
menunjukkan bahwa bobot segar akar dipengaruhi oleh kombinasi auksin dan sitokinin jenis tertentu dalam konsentrasi tertentu. Menurut Wattimena, et al (1992) auksin berperan dalam berbagai aspek pertumbuhan dan perkembangan tanaman antara lain pembesaran sel, penghambatan mata tunas samping, aktivitas sel kambium, dan pertumbuhan akar. Auksin sintentik yang biasa digunakan dalam kultur in vitro adalah 2,4 D, NAA, dan pikloram. Sedangkan sitokinin mempengaruhi berbagai proses fisiologis di dalam tanaman terutama mendorong pembelahan sel.
Pada peubah amatan jumlah akar terdapat perlakuan A3 (MS + 3 mg/l
NAA + 0.1 mg/l kinetin) dengan rataan tertinggi (22,25) dan perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin) dengan rataan terendah (0,00).
Penambahan auksin atau sitokinin ke dalam media kultur dapat meningkatkan induksi akar eksplan daun. Penambahan 3 ppm NAA pada taraf perlakuan tertinggi pada P. amboinius berpengaruh terhadap jumlah akar. Lestari (2011) menyatakan bahwa penambahan auksin atau sitokinin dapat meningkatkan konsentrasi zat pengatur tumbuh endogen di dalam sel, sehingga menjadi faktor pemicu dalam proses tumbuh dan perkembangan jaringan. Pada penelitian Mahadi, et al (2013) menunjukkan bahwa NAA dan kinetin berpengaruh nyata terhadap jumlah akar eksplan buah Naga (Hylocereus costaricensis). Rataan jumlah akar eksplan buah naga tertinggi pada perlakuan 0,4 ppm NAA dan 4 ppm kinetin. Hal ini diduga bahwa interaksi antagonis antara auksin dan sitokinin merupakan salah satu cara tumbuhan dalam mengatur derajat pertumbuhan akar.
rataan (66,67) % dan terendah pada perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin) dengan rataan terendah (0,00). Pada pengamatan persentase tumbuh, terdapat eksplan yang mengalami browning. Browning mulai terlihat pada 2 MST yang ditandai dengan perubahan warna pada eksplan dari hijau menjadi cokelat dimulai dari tepi yang mengalami pelukaan hingga akhirnya menyebar ke seluruh bagian eksplan. Hal ini diakibatkan oleh senyawa fenolik yang berasal dari bagian tanaman yang luka dan dapat menyebabkan kematian. Menurut Wetherell (1982), browning merupakan terjadinya warna cokelat pada jaringan yang baru dipotong.
Hal ini disebabkan karena terjadinya reaksi antara senyawa fenolik yang diproduksi jaringan dengan oksigen.
Persentase terbentuknya kalus tertinggi pada perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin ) dengan rataan (87,50) % dan terendah pada perlakuan A2 (MS + 2 mg/l NAA + 0.1 mg/l kinetin ) dengan rataan terendah (0,00). Pada pengamatan 2 MST eksplan ditandai dengan perubahan warna dari hijau menjadi cokelat dimulai dari tepi yang mengalami pelukaan hingga akhirnya menyebar ke seluruh bagian eksplan. Hal ini diakibatkan oleh senyawa fenolik yang berasal dari bagian tanaman yang luka. Menurut Collin dan Edwards (1998) senyawa fenolik diproduksi sebagai respon atas kondisi stress yang dialami oleh tanaman. Senyawa ini bersifat racun dan dapat menyebabkan kematian pada jaringan tanaman.
(MS + 2 mg/l NAA + 0.1 mg/l kinetin). Hal ini disebabkan oleh beberapa faktor yang menghambat proses pertumbuhan akar eksplan. Menurut Conger (1980) faktor-faktor yang mempengaruhi keberhasilan perbanyakan dengan eksplan yaitu genotip eksplan, ukuran eksplan, jaringan asal eksplan dan umur fisiologi eksplan. Tidak semua jaringan tanaman memiliki kemampuan yang sama untuk berdiferensiasi. Wetherell (1982) menyatakan bahwa tanaman yang memiliki hubungan kekerabatan yang dekat pun belum tentu menunjukkan respon in vitro yang sama.
Dalam penelitian ini umur munculnya kalus paling lama adalah 23 hari dan umur munculnya kalus paling cepat adalah 6 hari. Umur munculnya kalus 6 hari terdapat pada perlakuan A3 (MS + 3 mg/l NAA + 0.1 mg/l kinetin). Hal ini disebabkan oleh beberapa faktor yang menghambat proses pertumbuhan kalus eksplan seperti jaringan asal eksplan dan umur fisiologi eklspan. Menurut Shofiyani dan Purnawanto (2010) kemampuan pembentukkan kalus dari jaringan tergantung dari umur fisiologi dari jaringan waktu diisolasi, musim pada waktu bahan tanaman diisolasi, bagian tanaman yang dipakai, dan jenis tanaman. Suatu sifat yang diamati dalam jaringan yang membentuk kalus adalah bahwa pembelahan sel tidak terjadi pada semua sel dalam jaringan asal, tetapi hanya sel di lapisan perisfer yang membelah terus menerus sedangkan sel-sel di tengah tetap quiscent.
Pada peubah amatan berat segar kalus terdapat perlakuan A5 (MS + 2 mg/l NAA + 0.1 mg/l kinetin) dan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l
adalah bobot yang didapat pada kalus dengan pemberian ZPT sehingga perlu kesesuaian jenis dan taraf konsentrasi dari ZPT tersebut. Puteri (2014) menyatakan bahwa perbedaan tersebut memiliki pengaruh yang berbeda terhadap eksplan yang ditanam pada media MS yang dimodifikasi dengan pemberian konsentrasi zat pengatur tumbuh yang berbeda dan terdapat sifat determinasi yang berbeda dari setiap sel eksplan. Pengaruh tersebut terlihat pada biomassa kalus yang ditimbang dari masing-masing perlakuan.
Pada kalus yang terbentuk adalah kalus bertekstur remah (friable). Kalus tumbuh menjadi fragmen-fragmen yang kecil. Hal ini diduga dipengaruhi oleh medium, keseimbangan ZPT maupun jenis tanaman. Shofiyani dan Purnawanto (2010) menyatakan beberapa kalus ada yang mengalami pembentukan lignifikasi sehingga kalus tersebut mempunyai tekstur yang keras dan kompak. Namun ada kalus yang tumbuh terpisah-pisah menjadi fragmen-fragmen yang kecil, kalus yang demikian dikenal dengan kalus remah (friable). Santoso dan Nursandi (2004) menambahkan bahwa kalus freabel dapat diperoleh dengan memanipulasi medium, misalnya dengan mengatur macam dan perbandingan zat pengatur tumbuh, dapat pula dengan pergantian medium cair dan lain sebagainya. Tentu saja semua itu sangat tergantung pada jenis tanaman, macam bahan, medium dasar dan lingkungan lain.
bermacam-macam tergantung dari jenis sumber eksplan itu diambil, seperti warna kekuning-kuningan, putih, hijau, kuning kejingga-jinggaan.
Dari berbagai jenis perlakuan terlihat adanya variasi kemunculan akar P. amboinicus yang dipengaruhi oleh ZPT ke dalam media kultur. Kemunculan
akar pada penelitian ini ada 2 macam yaitu akar yang muncul langsung dari eksplan dan akar yang muncul bukan dari eksplan. Akar yang muncul langsung dari eksplan terdapat pada perlakuan A2 (MS + 2 mg/l NAA + 0.1 mg/l kinetin) dan A5 (MS + 2 mg/l 2,4 D + 0.1 mg/l kinetin), sedangkan kemunculan akar melalui kalus terlebih dahulu (yang muncul bukan dari eksplan) yaitu kalus mengalami diferensiasi menjadi akar pada perlakuan A1 (MS + 1 mg/l NAA + 0.1 mg/l kinetin), A3 (MS + 3 mg/l NAA + 0.1 mg/l kinetin), A4 (MS + 1 mg/l 2,4 D + 0.1 mg/l kinetin) dan A7 (MS + 0,1 mg/l kinetin). Pada perlakuan A6 (MS + 3 mg/l 2,4 D + 0.1 mg/l kinetin) tidak adanya terbentuknya akar tetapi eksplan tumbuh menjadi kalus. Kemunculan akar merupakan morfogenesis dari kalus. Adanya penambahan auksin secara eksogen mengakibatkan eksplan mampu berdediferensiasi menjadi kalus atau tumbuh menjadi akar. Morfogenesis terbentuk tergantung dari rasio konsentrasi sitokinin dan auksin. Wattimena, et al
(1992) menyatakan bahwa untuk pertumbuhan akar hanya diperlukan auksin tanpa sitokinin atau sitokinin dalam konsentrasi rendah. Marlin (2005)
Penggunaan ZPT Terhadap Kandungan β-Sitosterol pada Biomassa In Vitro P. amboinicus
Berdasarkan analisis sterol menggunakan reagen Liebermand-Burchard diperoleh bahwa ekstrak akar dan kalus P. amboinicus tidak mengandung senyawa sterol/beta sitosterol. Hasil negatif ini diduga karena kandungan senyawa sterol yang sedikit, sehingga saat diekstraksi dan dianalisis tidak dapat terdeteksi dengan pendekatan reagen Liebermand-Burchard. Faktor-faktor yang mempengaruhi produksi metabolit sekunder adalah ekspresi sintesis senyawa metabolit sekunder, asal eksplan dan kondisi yang mempengaruhi kultur in vitro. Fancy dan Rumpel (2008) menyatakan bahwa sintesis senyawa metabolit sekunder dipengaruhi banyak faktor antara lain: faktor genetik, faktor di dalam kultur atau di luar kultur dan tahap perkembangan organ yang menghasilkannya.
Pada penelitian ini, ekstrak akar dan kalus P. amboinicus tidak mengandung sterol yang disebabkan tidak terlokalisasinya sterol pada bagian akar dan kalus. Hal ini diduga karena jenis eksplan yang bersumber dari daun dan perbedaan morfologi pada tanaman berpengaruh terhadap kandungan sterol secara in vitro. Pada penelitian Aminah (2016) sterol dapat terlokalisasi pada bagian
daun tanaman P. amboinicus secara konvensional, maka kemungkinan akumulasinya di dalam kultur in vitro tidak dapat terjadi karena biomassa dalam organ penyimpanannya yang berupa akar dan kalus sangat sedikit. Dalimoenthe (1987) menyatakan reserpin terlokalisasi sebagian besar pada bagian akar tanaman R. serpentina di alam, maka kemungkinan akumulasinya di dalam kultur in vitro
KESIMPULAN DAN SARAN Kesimpulan
1. Eksplan daun yang dikulturkan dalam medium MS + 3 mg/l NAA + 0,1 mg/l kinetin dapat menginduksi akar dengan memberikan hasil terbaik berdasarkan peubah amatan persentase terbentuknya akar, berat segar akar, dan jumlah akar sedangkan medium MS + 3 mg/l 2,4 D + 0,1 mg/l kinetin dapat menginduksi kalus dengan memberikan hasil terbaik berdasarkan peubah amatan persentase terbentuknya kalus dan berat segar kalus.
2. Biomassa akar dan kalus yang dihasilkan secara in vitro tidak menunjukkan adanya kandungan β-Sitosterol pada P. amboinicus
Saran
TINJAUAN PUSTAKA Botani Tanaman
Menurut Pandey (2007) tanaman bangun-bangun dapat diklasifikasikan sebagai berikut: Kingdom: Plantae; Divisio: Angiospermae; Sub Divisio: Spermatophyta; Class: Dicotyledoneae; Ordo: Lamiales; Family: Lamiaceae; Genus: Plectranthus; Spesies: Plectranthus amboinicus
(Lour.) Spreng.
Bangun–bangun mempunyai nama binomial Plectranthus amboinicus yang dulu dinamakan sebagai Coleus amboinicus, merupakan herba sukulen semi semak tahunan dengan tinggi 100-120 cm dan tidak berumbi. P. amboinicus bercabang dan mempunyai bulu-bulu tegak yang halus. Daun berukuran lebar, berbentuk bulat telur/oval, dan tebal dengan bulu-bulu yang banyak. Bunga-bunga bertangkai pendek dan berwarna keunguan. P. amboinicus termasuk ke dalam famili Lamiaceae, mempunyai bau harum seperti oregano yang menyegarkan (Aziz, 2013).
Tanaman ini berakar tunggang dan tumbuh dari ruas-ruas tanaman yang menyentuh tanah. Akarnya berkembang baik pada tanah yang gembur dan subur.
Batangnya berbentuk persegi, berkayu lunak, beruas-ruas yang dapat menempel di tanah, mudah tumbuh, dan mudah patah. Penampang batang berdiameternya ±15 mm, tengah ±10 mm, dan ujung ±5 mm. Batang yang masih muda berambut kasar. Percabangan tanaman ini simpodial, dan berwarna hijau pucat (Ramachandran, 1997).
tangkai 2,4 - 3 cm berwarna hijau atau keunguan, pertulangan menyirip dan berwarna hijau muda. Bagian bawah daun mempunyai banyak rambut glandular yang menyebabkan tampilan berkilat (Prakash et al., 2012).
Tanaman ini memiliki bunga majemuk, bentuk tandan, berambut halus, kelopak berbentuk mangkok dan setelah mekar pecah menjadi lima. Putik panjangnya ± 17 mm, kepala putik berwarna coklat, benang sarinya empat, kepala sarinya berwarna kuning, dan mahkotanya berbentuk mangkok yang berwarna keunguan (Ramachandran, 1997).
Bangun-bangun tumbuh dengan baik pada daerah bercurah hujan tinggi dan sedang antara 800-1200 mm/tahun. Tanaman ini sangat membutuhkan sinar matahari yang banyak untuk pertumbuhannya, serta mampu hidup pada ketinggian ± 100 m di atas permukaan laut hingga ± 1200 m di atas permukaan laut (Prakash et al., 2012).
Kandungan Zat Gizi Tanaman Bangun-bangun
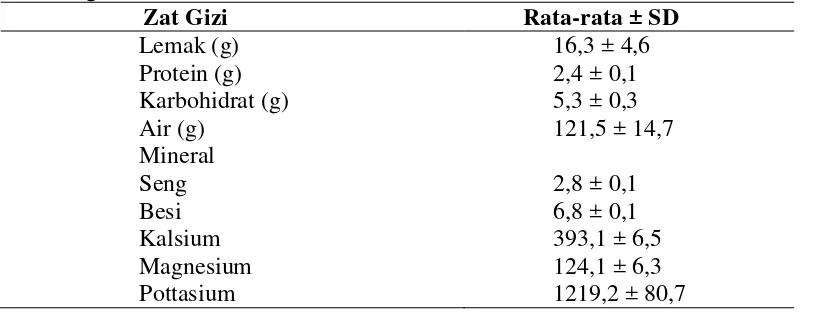
[image:45.595.113.520.553.709.2]Menurut Damanik et al., (2014) komposisi zat gizi sop daun bangun-bangun yang terkandung dalam 150 gram sebagai berikut:
Tabel 1. Kandungan zat gizi sop daun bangun-bangun yang terkandung dalam 150 gram
Zat Gizi Rata-rata ± SD
Lemak (g) 16,3 ± 4,6
Protein (g) 2,4 ± 0,1
Karbohidrat (g) 5,3 ± 0,3
Air (g) 121,5 ± 14,7
Mineral
Seng 2,8 ± 0,1
Besi 6,8 ± 0,1
Kalsium 393,1 ± 6,5
Magnesium 124,1 ± 6,3
Tanaman ini mengandung fenolik, terpenoid, nitrogen, vitamin, dan
metabolit sekunder yang berfungsi sebagai antioksidan, antimikroba, anti-inflamasi, antitumor, antimutagen, antikanker, dan diuretik. Kandungan
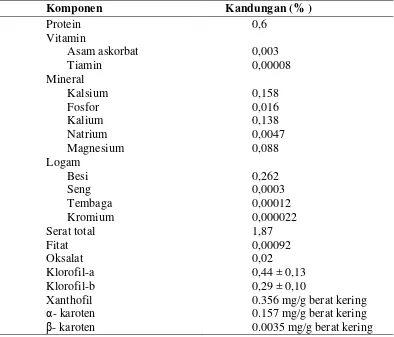
[image:46.595.115.509.210.547.2]nutrisi daun bangun-bangun menurut Sahay et al., (2011) adalah sebagai berikut: Tabel 2. Kandungan zat gizi daun bangun-bangun
Metabolit Sekunder Tanaman Bangun-bangun
Produk metabolisme detoksifikasi ini diduga akibat kemampuan tumbuhan menghasilkan senyawa kimia sebagai senjata untuk mempertahankan diri dari serangan hama dan faktor lingkungan yang terjadi pada tumbuhan. Jenis senyawa metabolit sekunder yang dimetabolisme tergantung pada faktor biogenetik tumbuhan. Senyawa kimia tersebut seperti alkaloid, flavonoid, triterpenoid, tanin,
Komponen Kandungan (% ) Protein Vitamin Asam askorbat Tiamin Mineral Kalsium Fosfor Kalium Natrium Magnesium Logam Besi Seng Tembaga Kromium Serat total Fitat Oksalat Klorofil-a Klorofil-b Xanthofil
α- karoten
β- karoten
0,6 0,003 0,00008 0,158 0,016 0,138 0,0047 0,088 0,262 0,0003 0,00012 0,000022 1,87 0,00092 0,02 0,44 ± 0,13 0,29 ± 0,10
dan saponin. Senyawa-senyawa ini berperan sebagai bahan aktif yang dapat kemungkinan dapat menghambat pertumbuhan bakteri (Darminto et al., 2009).
Konsentrasi metabolit sekunder dan komposisinya dipengaruhi oleh faktor internal (genetik, kondisi kesehatan tanaman, umur) dan faktor eksternal (lingkungan). Ekspresi sintesis senyawa metabolit sekunder tergantung pada tahap perkembangan organ yang menghasilkannya. Hal-hal yang menentukan keberhasilan produksi biomassa adalah sumber karbohidrat, suplai nitrogen, kalium, vitamin dan ZPT (Fancy dan Rumpel, 2008).
Perbedaan morfologi pada tanaman yakni ada senyawa-senyawa tertentu yang disintesis atau diakumulasikan hanya oleh organ atau jaringan tertentu. Misalnya nikotin disintesis oleh bagian akar tembakau, kemudian diangkut (ditranslokasikan) ke daun untuk disimpan. Pembentukan morfin tidak dapat terjadi, karena bentuk sel yang tidak teratur pada kultur tersebut. Tetapi ada juga senyawa-senyawa yang tidak membutuhkan organ atau jaringan khusus untuk menghasilkan metabolit sekunder, misalnya derivat shikonin, resin, opium dan lain sebagainya. Mengingat reserpin terlokalisasi sebagian besar pada bagian akar tanaman R. serpentina di alam, maka kemungkinan akumulasinya di dalam kultur in vitro tidak dapat terjadi karena organ penyimpanannya yang berupa akar tidak
tersedia di dalam kultur kalus tersebut. Perbedaan aktivitas biosintesis, perbedaan bentuk dan fungsi sel merupakan faktor lain yang juga berpengaruh terhadap sintesis metabolit sekunder (Dalimoenthe, 1987).
Daun tanaman bangun-bangun mengandung butylaniside, -caryophyllene,
carvacrol, 1-8-cineole, p-cymene, ethylsalicylate, eugenol, limonene, myrcene,
apigenin, chrysoeriol, 5,4-dihydroxy-6,7-dimethoxy-flavone (cirsimaritin),
eriodictyol, 6-methoxy-genkawanin, luteolin, quercetin, salvigenin, taxifolin,
oxaloacetic acid, crategolic, euscaphic, 2-3-dihydro-olean-12-en-28-oic, pomolic,
oleanolic, tormentic, 2α,3 α,19 α,23 α-tetrahydroxyurs-12-en-28-oic, ursolic
acids, β-sitosterol dan -D-glucoside (Pullaiah, 2006).
Bahan alam, termasuk terpenoid, dari dahulu telah dipakai di dalam bidang farmasi, pertanian, dan pemakaian komersil lain, seperti pengobatan kanker. Terpen dengan berat molekul kecil selalu digunakan untuk parfum dan pemberi rasa. Steroid dianggap berasal dari terpenoid, karena pada jalur biosintesisnya, steroid diturunkan dari squalene, yang juga merupakan senyawa pembentuk triterpene. Beta-sitosterol adalah sterol yang ditemukan pada tanaman yang merupakan subkomponen utama kelompok sterol yang dikenal sebagai pitosterol. Senyawa ini berwarna putih dan memiliki struktur kimia yang sangat mirip dengan kolesterol (Nasution, 2013).
Manfaat Bahan Aktif Tanaman Bangun-bangun
Penelitian yang dilakukan oleh Sihombing (2006) yang memberikan daun bangun-bangun pada tikus telah membuktikan bahwa tumbuhan tersebut mengandung zat besi dan karotenoid yang tinggi. Kadar FeSO4 pada daun
bangun-bangun dapat diandalkan sebagai sumber besi non-heme bagi ibu menyusui. Tanaman bangun-bangun dipercaya dapat meningkatkan dan mengembalikan stamina ibu, meningkatkan produksi ASI, serta membersihkan daerah rahim.
P. amboinicus adalah salah satu komponen farmakoseutika dalam fraksi
sterol yang mempunyai banyak manfaat yakni, mengemulsi lemak, mengurangi tingkat kolesterol dalam tubuh, mencegah kanker, menormalkan gula darah pada penderita diabetes tipe II, mencegah leukemia limfositik dan dapat meningkatkan kekebalan atlet yang sering menderita tekanan kekebalan dan mengurangi respon inflamasi selama masa latihan dan kompetisi (Nasution, 2013).
Penggunaan tanaman bangun-bangun secara tradisional telah tersebar di Indonesia dan negara tropis lainnya seperti Malaysia, India, Brazil, Kuba, dan Karibia sejak ratusan tahun yang lalu. P.amboinicus biasa digunakan untuk mengobati beragam penyakit dan gangguan kesehatan. Dalam pengobatan tradisional, P. amboinicus dan P. barbartus dapat mengobati sekitar 68% kategori penyakit dan gangguan kesehatan yang dapat diobati oleh genus Plectranthus sendiri. Beberapa kategori tersebut di antaranya berkaitan dengan pencernaan,
gangguan atau penyakit kulit, pernapasan, infeksi, demam, genito-urinary, otot-tulang, dan lain-lain. Tanaman ini juga dilaporkan digunakan sebagai bahan
P. amboinicus juga berperan sebagai komponen zat-zat gizi. Menurut
Warsiki et al., (2009) mengkonsumsi daun P. amboinicus meningkatkan mineral dalam susu, seperti zat besi, kalium, seng, magnesium dan meningkatkan berat badan bayi. Tanaman tersebut mengandung unsur mineral mikro yakni, Cu, B dan Zn yang berperan penting dalam penyusunan struktur tubuh dan proses fisiologis ternak, baik untuk pertumbuhan maupun pemeliharaan kesehatan.
Kultur Jaringan
Teknik kultur jaringan adalah teknik dimana suatu sel atau irisan jaringan tanaman yang disebut eksplan secara aseptik diletakkan dan dipelihara dalam medium padat atau cair yang cocok dan dalam keadaan steril. Dengan cara demikian sebagian sel pada permukaan irisan tersebut akan mengalami proliferasi dan membentuk kalus. Apabila kalus yang terbentuk dipindahkan ke dalam medium diferensiasi yang cocok maka akan terbentuk tanaman kecil yang disebut planlet. Dengan teknik kultur jaringan ini hanya dari satu irisan kecil suatu jaringan tanaman dapat dihasilkan kalus yang dapat menjadi planlet dalam jumlah yang besar (Panjaitan, 2005).
Konsep dasar ini adalah mutlak dalam pelaksanaan kegiatan kultur jaringan karena hanya dengan sifat totipotensi ini, sel, jaringan, organ yang digunakan akan mampu tumbuh dan berkembang sesuai arahan dan tujuan budidaya ini vitro yang dilakukan. Umumnya sifat totipotensi lebih banyak dimiliki oleh bagian tanaman yang masih juvenil, muda dan banyak dijumpai pada daerah-daerah meristem tanaman. Tetapi tidak menutup kemungkinan bagian tanaman yang sudah dewasa bila mendapat lingkungan yang cocok akan bertotipotensi hingga mampu tumbuh dan berkembang. Pada keadaan tersebut bisa terjadi karena secara in vitro tanaman mampu melakukan aktifitas dediferensiasi yaitu proses perkembangan balik dari bagian dewasa tanaman menjadi sekelompok sel yang terus menerus membelah (kalus) atau bisa pula menjadi zigot (Santoso dan Nursandi, 2004).
Teknik kultur jaringan menuntut syarat-syarat tertentu yang harus dipenuhi dalam pelaksanaannya. Syarat pokok pelaksanaan kultur jaringan adalah laboratorium dengan segala fasilitasnya. Laboratorium harus menyediakan alat-alat kerja, sarana pendukung terciptanya kondisi aseptic terkendali dan fasilitas dasar seperti, air, listrik dan bahar bakar (Prasetyo, 2009).
Zat Pengatur Tumbuh
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. Auksin berperan dalam berbagai aspek pertumbuhan dan perkembangan tanaman antara lain pembesaran sel, penghambatan mata tunas sampong, aktivitas sel kambiun, dan pertumbuhan akar. Auksin sintentik yang biasa digunakan dalam kultur in vitro adalah 2,4 D, NAA, dan pikloram (Wattimena et al., 1992). ZPT dalam
tanaman bekerja saling berinteraksi sehingga merupakan suatu sistem yang digunakan dalam perkembangan tanaman, namun pengaruhnya tidak dapat digeneralisasikan. ZPT yang umum digunakan untuk menumbuhkan organ-organ baru dalam kultur in-vitro adalah golongan auksin dan sitokinin (Shofiyani dan Purnawanto, 2010).
Pada tahap induksi kalus perlu ada penambahan ZPT seperti auksin. Menurut Yelnititis dan Komar (2010) kalus dapat diinduksi dari eksplan potongan daun yang dikulturkan pada perlakuan 2,4 D. Induksi kalus diawali dengan penebalan eksplan pada bagian potongan dan di daerah yang mengalami pelukaan. Penebalan tersebut merupakan interaksi eksplan dengan media tumbuh, zat pengatur tumbuh dan lingkungan tumbuh sehingga ekspan bertambah besar.
Auksin adalah zat pengatur tumbuh yang mempunyai sifat mampu
Asam indolasetat (IAA) menginduksi pembelahan sel, tetapi senyawa ini tidak stabil dan dapat diuraikan oleh enzim yang dibebaskan oleh sel. Baik 2,4 D maupun NAA tidak mudah terurai oleh enzim-enzim yang dikeluarkan sel dan stabil pada pemanasan dengan otoklaf (Wetter dan Constabel, 1991).
Menurut Wattimena et al. (1992), sitokinin mempengaruhi berbagai proses fisiologis di dalam tanaman terutama mendorong pembelahan sel. Peran sitokinin dalam kultur in vitro mempunyai dua peran penting yaitu merangsang pembelahan
sel serta pembentukan dan perbanyakan tunas aksilar dan tunas adventif, tetapi kadar sitokin yang optimum ini dapat menghambat pertumbuhan dan
pembentukan akar. Salah satu jenis ZPT dari golongan sitokinin yang sering dipakai dalam kultur jaringan yaitu kinetin. Kinetin bersifat tahan terhadap degradasi dan harganya lebih murah. Penelitian dengan pengaruh kinetin 1 mg/l mampu mendorong pembentukan kalus pada tanaman Cattleya sp dengan eksplan berupa daun muda (Santoso dan Nursandi, 2004).
Biomassa Akar
Biomassa yang dihasilkan pada kultur jaringan sangat tergantung pada kecepatan sel-sel tersebut membelah diri, memperbanyak diri yang dilanjutkan dengan pembesaran sel. Kecepatan sel membelah dapat dipengaruhi oleh adanya kombinasi auksin-sitokinin tertentu dalam konsentrasi yang tertentu tergantung pada tanamannya, juga faktor-faktor luar seperti intensitas cahaya dan temperatur (Wattimena et al., 1992).
(Lestari, 2011). Pada penelitian Mahadi, et al (2013) menunjukkan bahwa NAA
dan Kinetin berpengaruh nyata terhadap jumlah akar eksplan buah Naga (Hylocereus costaricensis). Rataan jumlah akar eksplan buah Naga tertinggi pada
perlakuan 0,4 ppm NAA dan 4 ppm kinetin. Hal ini diduga bahwa interaksi antagonis antara auksin dan sitokinin merupakan salah satu cara tumbuhan dalam mengatur derajat pertumbuhan akar dan tunas.
Menurut Conger (1980), terdapat faktor-faktor yang mempengaruhi keberhasilan perbanyakan dengan eksplan yaitu genotip eksplan, ukuran eksplan, jaringan asal eksplan dan umur fisiologi eksplan. Tidak semua jaringan tanaman memiliki kemampuan yang sama untuk berdiferensiasi. Wetherell (1982) menambahkan bahwa tanaman yang memiliki hubungan kekerabatan yang dekat pun belum tentu menunjukkan respon in vitro yang sama.
Biomassa Kalus
Biomassa kalus adalah bobot yang didapat pada kalus dengan pemberian zat pengatur tumbuh. Puteri (2014) menyimpulkan bahwa perbedaan tersebut memiliki pengaruh berbeda terhadap eksplan yang ditanam pada media MS yang dimodifikasi dengan pemberian konsentrasi ZPT NAA dan BAP yang berbeda dan sifat determinasi yang berbeda dari setiap sel eksplan. Pengaruh tersebut terlihat pada biomassa kalus yang ditimbang dari masing-masing perlakuan.
Beberapa kalus ada yang mengalami pembentukan lignifikasi sehingga kalus tersebut mempunyai tekstur yang keras dan kompak. Namun ada kalus yang tumbuh terpisah-pisah menjadi fragmen-fragmen yang kecil, kalus yang demikian dikenal dengan kalus remah (friable). Warna kalus dapat bermacam-macam tergantung dari jenis sumber eksplan itu diambel, seperti warna kekuning-kuningan, putih, hijau, kuning kejingga-jingaan (karena adanya pigmen antosianin ini terdapat pada kalus kortek umbi wortel) (Shofiyani dan Purnawanto, 2010).
Kalus remah dapat diperoleh dengan memanipulasi medium, misalnya dengan mengatur macam dan perbandingan zat pengatur tumbuh, dapat pula dengan pergantian medium cair dan lain sebagainya. Kalus yang terbentuk dapat menunjukkan bahwa keberadaan kalus mempunyai aktifitas pembelahan yang sangat tinggi, hal ini bisa dilihat dari penyerapan warna yang cukup tinggi. Tentu saja semua itu sangat tergantung pada jenis tanaman, macam bahan, medium dasar dan lingkungan lain (Santoso dan Nursandi, 2004).
PENDAHULUAN Latar Belakang
Tanaman bangun-bangun adalah salah satu tanaman obat yang berkhasiat dan memiliki potensial yang dapat dimanfaatkan masyarakat di Indonesia. Menurut Kaliappan dan Viswanathan (2008) tanaman ini telah terbukti sebagai anti inflamasi karena bekerja menghambat respon inflamasi yang diinduksi oleh siklooksigenase, juga terbukti sebagai anti kanker dan anti tumor. Bangun-bangun merupakan tanaman daerah tropis yang daunnya memiliki aroma yang khas sehingga dikenal sebagai tanaman aromatik. Tanaman ini banyak ditemukan di India, Ceylon, dan Afrika Selatan. Tanaman ini memiliki bunga yang bentuknya tajam dan mengandung minyak atsiri sehingga disebut juga C. aromaticus. Di India, tanaman ini telah lama dikenal sebagai obat demam malaria, hepatopati, batu ginjal, kandung kemih, batuk, asma kronik, cekukan, bronkitis, cacingan, kolik dan kejang.
Tanaman ini ditemukan hampir di seluruh wilayah di Indonesia dengan berbagai nama yang berbeda. Di Jawa Tengah disebut daun cumin, orang Sunda menyebutnya daun ajeran, di Madura disebut daun kambing, dan di Bali disebut daun iwak. Di daerah Batak Sumatera Utara sendiri disebut sebagai daun bangun-bangun atau torbangun-bangun (Priyatno, 2013).
P. amboinicus merupakan salah satu tanaman yang dapat digunakan
bahwa dengan mengkonsumsi sop daun bangun-bangun, produksi air susu ibu akan meningkat (Damanik et al., 2014).
Bangun-bangun mempunyai tiga komponen penting yaitu, komponen pertama adalah senyawa-senyawa yang bersifat laktagogue, yaitu komponen yang dapat menstimulir produksi kelenjar air susu pada induk laktasi.
Komponen kedua adalah komponen zat gizi dan komponen ke tiga adalah komponen farmakoseutika yaitu senyawa-senyawa yang bersifat buffer,
antibacterial, anti oksidan, pelumas, pelentur, pewarna dan penstabil
(Khajarern dan Khajarern, 2002).
Dengan semakin meningkatnya harga obat-obatan, akhir-akhir ini minat masyarakat untuk menggunakan jamu tradisonal maupun obat-obat berbahan dasar tumbuhan asli Indonesia semakin meningkat. Selain menunjukkan resiko efek samping yang lebih rendah dan murah, ramuan asli Indonesia ternyata cukup beragam dan handal dalam mengatasi berbagai masalah kesehatan. Hal ini menjadi dorongan untuk melakukan kegiatan penelitian tentang potensi tanaman obat asli Indonesia, baik dari segi karakter, produksi, pengolahan, uji klinis hingga pemasaran, dan keamanannya (Sugiyarto et al., 2006).
kalus. Dalam bidang farmasi, metode kultur jaringan tanaman ini menguntungkan karena dapat menghasilkan metabolit sekunder yang berguna untuk pengobatan dan kesehatan dalam jumlah besar serta tumbuh dalam waktu cepat pada lahan yang terbatas.
Media kultur dan kondisi lingkungan merupakan salah satu faktor penentu keberhasilan induksi kalus secara in vitro. Berbagai komposisi media kultur telah diformulasikan untuk mengoptimalkan pertumbuhan dan perkembangan tanaman yang dikulturkan. Tahapan induksi kalus adalah suatu tahapan penting untuk mendapatkan metabolit sekunder dalam waktu singkat (Nuke, 2008). Ada beberapa penelitian tentang mikropropagasi in vitro spesies tanaman dari genus Plectranthus, diantaranya P. esculentus, P. vetiveroides, P. madagascariensis, dan P. barbatus atau Coleus forskohlii. Eksplan awal bervariasi mulai dari pucuk,
noda, internodal, dan daun serta menghasilkan kultur pucuk juga akar. Akan tetapi, mikropropagasi in vitro yang diketahui untuk produksi kalus baru hanya dilakukan pada tanaman P. barbartus atau C. forskohlii. Induksi kalus pada tanaman ini berhasil dilakukan dari eksplan daun pada medium MS dengan penambahan kinetin 0.5 mg/L setelah 4 minggu inokulasi (Reddy et al., 2001).
Tanaman lain yang dekat dengan genus Plectranthus dan telah diketahui
protokol produksi kalusnya ialah Coleus blumei. Kombinasi 2,4-D 1,0 mg/L dan 0,1 mg/L kinetin berhasil memproduksi asam rosmarinat 11% dari berat kering sel pada kultur suspensi sel C. blumei (Razzaque dan Ellis, 1977). Menurut (Shofiyani dan Purnawanto, 2010) penambahan auksin dalam konsentrasi yang
dalam jumlah yang seimbang, sitokinin dan auksin akan mendorong pertumbuhan kalus (Davies, 1990).
Berdasarkan uraian di atas penulis tertarik untuk mengetahui pengaruh zat pengatur tumbuh pada eksplan daun P. amboinicus terhadap pertumbuhan biomassa dan kandungan β-sitosterol secara
Tujuan Penelitian
in vitro.
Untuk mengetahui pengaruh zat pengatur tumbuh terhadap pertumbuhan biomassa dan kandungan β-sitosterol P. amboinicus.
Hipotesis Penelitian
1. Ada pengaruh zat pengatur tumbuh pada eksplan daun P. amboinicus terhadap pertumbuhan biomassa secara in vitro
2. Ada pengaruh zat pengatur tumbuh pada biomassa in vitro P. amboinicus terhadap kandungan β-sitosterol
Kegunaan Penelitian
ABSTRACT
NELLA ANGELINA, 2016: The effects of growth regulators on biomass growth and β-sitosterol content of bangun-bangun in vitro (Pleranthus amboinicus (Lour.) Spreng) supervized by Luthfi A. M Siregar and Lollie Agustina P. Putri.
The aims of this research was to know the effects of growth regulators on biomass growth and β-Sitosterol content of bangun-bangun in vitro (Pleranthus amboinicus (Lour.) Spreng). The research was carried out in the Tissue Culture Laboratory, UPT. Benih Induk Hortikultura Gedung Johor, Dinas Pertanian, Sumatera Utara dan Molecular Genetics Laboratory, Faculty of Agriculture, University of Sumatera Utara, Indonesia, from April to July 2016. The research
used completely randomized design non factorial with seven treatments: MS + 1 mg/l NAA + 0,1 mg/l kinetin; MS + 2 mg/l NAA + 0,1 mg/l kinetin; MS + 3 mg