DAFTAR PUSTAKA
Ardiansyah. 2007. Hama Ulat Grayak (Spodoptera litura) Mengganas. tanggal 16 september 2015
Balitbang. 2006. Hama, Penyakit dan Masalah Hara pada Tanaman Kedelai, Identifikasi dan Pengendaliannya. Bogor.
Bernardi, E., Pinto, DM., do Nascimento, JS., Ribeiro, PB., and da Silva CI. 2006. Effect of The Entomopathogenic Fungi Metarhizium anisopliae and Beauveria bassianaon The Development of Musca domestica L. (Diptera: Muscidae) in The Laboratory. Arq. Inst. Biol. 73(1):127-129.
Bischoff J. F., Rehner S. A. Humber R. A. (2009). "A Multilocus Phylogeny Of The Metarhizium anisopliae Lineage". Mycologia 101 (4): 512–530. BPTD. 2004. Strategi Pengendalian Hama dan Penyakit Tanaman
Tembakau.BPTD PTP Nusantara II. Medan.
Brady, B.L.K. 1979. Pathogenic Fungi and Bacteria. Common Wealth Agricultural Bureaux, England.
Budi AS, AA Fandhi & Retno D Puspitarini. 2013. Patogenisitas Jamur Entomopatogen Beauveria bassiana Balsamo (Deuteromycetes: moniliales) Pada Larva Spodoptera litura Fabricius (Lepidoptera: Noctuidae).J.HPT. 1(1):1-7.
Castrillo, L.A., Roberts D. W., and Vandenberg. J. D. 2005. The Fungal Past, Presen, and Future: Germination, Ramification and Reproduction. Journal of Invertebrate Phatology 89: 46-56.
Clarkson, J. M., and A. K. Charnley.1996. New Insights Into The Mechanisms of Fungal Pathogenesis in Insects. Trends Microbiol. 4:hlm.197-203. Cloyd, R. 2003. The Entomopathogen Verticillium lecanii. Midwest Biological
Control News. University of Illinois. http://www.extension.umm. Edu/distribution/horticulture/DG7373.html [29 Agustus 2015].
Dinata, A.J. 2012. Pathogenic Fungi and Bacteria. Common wealth Agricultural Bureaux. England. 233pp.
Erwin, M.S. 2000. Hama dan Penyakit Tembakau Deli. Balai Penelitian Tembakau Deli, PTPN II. Medan.
Freimoser, F. M., S. Screen., S. Bagga., G. Hu, and R. J. St. Leger. 2003. Expressed Sequence Tag (EST) Analysis of Two Subspecies of Metarhizium anisopliae Reveals a Plethora of Secreted Proteins With Potential Activity in Insect Hosts. Microbiol. 239-247.
Gallegos, RP., Cesar A., Roger W., Anibal M., and German A. 2003. Control of the Larvae of the Beetle Phyllophaga sp. with Biological Products (Metarhizium anisopliae and Beauveria sp.) in the Blackberry Crop Rubus glaucus Benth.Ohio State University.
Gandjar, Indrawati. 2006. Mikologi Dasar dan Terapan. Jakarta : Yayasan Obor Indonesia.
Harni R., A Munif., Supramana & I Mustika. 2007. Potensi Bakteri Endofit Mengendalikan Nematoda Peluka Akar (Pratylenchus bracyurus) Pada Nilam. Hayati. J.Bio.Sci.14(1):1-12pp.
Haryani. 2005. Resistensi Hama Tembakau Cerutu. Prosiding Nasional Perlindungan Tanaman. Bandung. 12-13 Februari 2005.
Hasnah, Susanna, dan H Sably.2012. Keefektifan Jamur Beauveria bassiana Vuill Terhadap Mortalitas Kepik Hijau Nezara viridula L. Pada Stadia Nimfa dan Imago. J. Floratek 7:13-24.
Heriyanto dan Suharno. 2008. Studi Patogenitas Metarhizium anisopliae (Metch.) Hasil Perbanyakan Medium Cair Alami Terhadap Larva Oryctes rhinoceros. Jurnal Ilmu-ilmu Pertanian 4(1): 47-54.
Herlinda, S., Era, MS., Yulia, P., Suwandi, Elisa, N., dan Anung, R. 2005.Variasi Virulensi Strainstrain Beauveria bassiana (Bals.)Vuill. Terhadap Larva Plutella xylostella (L.) (Lepidoptera: Plutellidae). Agritrop 24(2):52-57.
Hughes SJ. 2014. Phycomycetes, Basidiomycetes, and Ascomycetes as Fungi Imperfecti. In: Taxonomy of Fungi Imperfecti (B. Kendrick, ed.), pp. 7-36. University of Toronto Press, Toronto.
Kalshoven. 1981. The pest of crop in Indonesia. Jakarta. PT. Inchtiar Baru Van Hooven.
Kaur, S., Harminder P.K., Kirandeep K. dan Amarjeet K. 2011. Effect of Different Concentrations of Beauveria bassiana on Development and Reproductive Potential of Spodoptera litura (Fabricius). J. Biopest. 4(2):161-168.
Kherb, W. A. A. 2014. Virulence Bio-Assay Efficiency of Beauveria bassiana and Metarhizium anisopliae for the Biological Control of Spodoptera exigua Hubner (Lepidoptera: Noctuidae) Eggs and the 1st Instar Larvae. Aust. J. Basic & Appl. Sci. 8(3): 313-323.
Krutmuang, P., and Supamit, M. 2005. Pathogenicity of Entomopathogenic Fungi Metarhizium anisopliae Against. Termites. In: Conferenceon International Agricultural Research for Development. Department of Entomology, Faculty of Agriculture, Chiang Mai University. Thailand, Oktober 11-13, 2005.
Laoh J. 2003. Kerentanan Larva Spodoptera litura F. Terhadap Virus Nuklear Polyhedrosis. Universitas Riau. Pekanbaru. J. Natur Indonesia. 5(2):145-151pp.
Mahr. S., 2003. The Entomophatogen Beauveria bassiana. University of Winconsin, Madison. Diakses dari http://www. Entomogy. Wisc. Edu/mbcn/kyF410.html. Tanggal 12 Oktober 2015.
Marwoto dan Suharsono.2008. Strategi dan Komponen Teknologi Pengendalian Ulat Grayak (Spodoptera litura Fabricius) pada Tabel Hidup Spodoptera litura Fabr. dengan Pemberian Pakan Buatan 179 Tanaman Kedelai. J. Litbang. Pertanian.27: 131-136.
M. Shepard, G. R.Carner, and P.A.C Ooi. 2007. Insects and Their Natural Enemies Associated with Vegetables and Soybean in Southeast Asia, Bugwood.org)UF/IFAS Pest Alert.
Natasha, W. 2013 Florida Department of Agriculture and Consumer Services, Bugwood.org.
Noch, I.R., A. Rahayu, A. Wahyu, dan O. Mochida. 1983. Biologi Ulat Grayak Spodoptera litura Fabricius (Lepidoptera : Noctuidae) Sebagai Salah Satu Hama Kacang-kacangan. Kongres Entomologi II. Jakarta, 24-26 Januari 1983.12 p.
Park SH, Yeon SY, JS Park, HY Choo, SD Bae, & MH Nam. 2013. Biological Control of Tobacco Cutworm Spodoptera litura Fabricius with Entomopathogenic Nematodes.Biotechnol. BioprocessEng. 6: 139-143.
Prayogo, Y. 2004. Keefektifan Lima Jenis Jamur Entomopatogen Terhadap Hama Pengisap Polong Kedelai Riptortus linearis (L.) (Hemiptera: Alydidae) dan Dampaknya Terhadap Predator Oxyopes javanus Thorell (Araneida: Oxyopidae). [Tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor. 51hlm.
Prayogo, Y. 2005. Jamur Entomopatogen Verticillium lecanii dan Paecilomyces fumosoroseus Sebagai Salah Satu Alternatif Untuk Mengendalikan Telur Hama Penghisap Polong Kedelai. Berita Puslitbangtan (32):10. Prayogo, Y., Wedanimbi, T., dan Marwoto. 2005. Prospek Jamur Entomopatogen
Metarhizium anisopliae untuk Mengendalikan Ulat Grayak Spodoptera litura Pada Kedelai.J. Litbang Pertanian, 24(1):19-26. Prayogo, Y. 2006. Upaya Mempertahankan Keefektifan Cendawan
Entomopatogen untuk Mengendalikan Hama Tanaman Pangan. J. Litbang Pertanian 24(1):19-26.
PTPN II. 2007. Budidaya Tanaman Tembakau Deli.Balai Penelitian Tembakau Deli. Medan
Rahayu M., Sudarto K., Puspadi I., Mardian. 2009. Paket Teknologi Produksi Benih Kedelai. Balitbang. Nusa Tenggara Barat.
Rachmat M, Sri N. 2009. Dinamika Agribisnis Tembakau Dunia dan Implikasinya Bagi Indonesia. Jurnal Forum Penelitian Agro Ekonomi. 27 (2) : 73-91.
Rustama, M. M., Melanie., B. Irawan. 2008. Patogenisitas Jamur Entomopatogen Metarhizium anisopliae terhadap Crocidolomia pavonana fab. dalam Kegiatan Studi Pengendalian Hama Terpadu Tanaman Kubis dengan Menggunakan Agensia Hayati. Laporan Akhir Penelitian Peneliti Muda UNPAD Sumber Dana DIPA UNPAD. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Padjadjaran.
Saleh, R. M., Rosdah. T dan Suprapti. 2000. Pengaruh Pemberian (Beuveria bassiana Vuill) Terhadap Kematian dan Perkembangan Larva (Spodoptera litura Fabricus) di Rumah Kaca. Jurnal Hama dan Penyakit Tumbuhan Tropika. Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian Universitas Sriwijaya Palembang. Palembang. Sibarani, H., S. 2015. Patogenisitas Beauveria bassiana Terhadap Spodoptera
Sintim, H.O., Tashiro, T. and Motoyama, N. 2009. Response of the Cutworm Spodoptera litura to Sesame Leaves or Crude Extracts in Diet. 13pp. J.Insect Sci. 9: 52.
Soeseno, 2015. Produksi Tembakau Siap Bangkit Harian. Diakses pada tanggal 3 Mei 2016.
Soetopo dan Indrayani, 2007.Status Teknologi dan Prospek Beauveria bassiana untuk Pengujian Serangga Hama Tanaman Perkebunan yang Ramah Lingkungan. Perspektif, 6(1): 29-46.
Suhairiyah., Isnawati., dan E. Ratnasari. 2013. The Effect of Lecanicillium on armyworms (Spodoptera litura) Mortality by In Vitro Assays. Lenterabio. (2)3 : 253-257.
Sumartini, Y. Prayogo, S.W. Indiati, dan S. Hardaningsih. 2001. Pemanfaatan Jamur Metarhizium anisopliae untuk Pengendalian Pengisap Polong (Riptortus linearis) Pada Kedelai. hlm. 154−157. Dalam S.E. Baehaki, E. Santosa, Hendarsih, S.T. Suryana, N. Widarta, dan Sukrino (Ed.). Simposium Pengendalian Hayati Serangga, Balai Penelitian Tanaman Padi Sukamandi.
Surtikanti dan Yasin, M .2009.Keefektifan Entomopatogenik Beauveria bassiana Vuill. dari Berbagai Media Tumbuh Terhadap Spodoptera litura F. (Lepidoptera:Noctuidae) di Laboratorium. Prosiding Seminar Nasional Serelia. Hlm. 358-362.
Suwarso. 2007. Peluang Penerapan Indikasi Geografis pada Tembakau di Indonesia
Tanada, Y. and H.K. Kaya. 1993. Insect pathology. Academic Press, Inc., California.666 pp.
Tenrirawe, A dan A.H Talanca. 2008. Bioekologi dan Pengendalian Hama dan Penyakit Utama Kacang Tanah. Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI PFI XIX Komisariat Daerah Sulawesi Selatan 464-471.
Thompson SR. 2006. Enhancing the Efficacy of Beauveria bassiana for Mole Cricket (Orthoptera: Gryllotalpidae) Control in Turfgrass. Australia: North Carolina State University. [Dissertation].
Trizelia, M.Y Syahrawati., dan Aina M. 2011. Patogenesitas Beberapa Isolat Jamur Entomopatogen Metarhizium sp. Terhadap Telur Spodoptera litura F (Lepidoptera:Noctuidae). Jurnal Entomologi Indonesia. 8(1): 45-54.
Tsakadze, T., Abashidze, E., Samadashvili, D., and Odikadze, K. 2003. Fungi of Genus Metarhizium as Pathogens Attacking Locust. L. Kanchaveli Georgian Plant Protection Institute.
Utomo & Pardede. 2014. Pengaruh Musim pada Hipobiose Haemonchus contortus dan Fluktuasi Populasi Nematoda Saluran Pencernaan Domba di Indramayu, Jawa Barat. hlm. 171−192. Prosiding Seminar. Nasional Hasil Penelitian Perguruan Tinggi.
Wahyudi, P .2002. Uji Patogenitas Kapang Entomopatogen Beauveria bassiana Vuill. Terhadap Ulat Grayak (Spodoptera litura). Biosfera. 19:1-5. Wahyudi. 2008. Jamur Patogen Serangga Sebagai Bahan Baku Insektisida.
Pemanfaatan Mikroba dan Parasitoid dalam Agroindustri Tanaman Rempah dan Obat. Perkembangan Teknologi Tanaman Rempah dan Obat (XII): 21−28pp.
Widiyanti, N.L.P.M., dan S. Muyadihardja. 2004. Uji Toksisitas Jamur Metarhizium anisopliae terhadap Larva Nyamuk Aedes aegypti. Media Litbang Kesehatan 14 (3): 25-30.
Wilyus Dan E. Yudiawati. 2005 Kemangkusan Beauveria bassiana (Balsamo) Vuillemin dalam Menghambat Perkembangan Spodoptera litura Fabricius (Lepidoptera: Noctuidae). Jurusan Budidaya Pertanian. Fakultas Pertanian. Universitas Jambi. Jurnal Agronomi: 9 (2): 103 Zare, R., and Gams, W. 2001. A revision of Verticillium sect. Prostrata. IV The
METODOLOGI PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium dan di Rumah kassa Fakultas Pertanian Universitas Sumatera Utara, dengan ketinggian tempat ± 25 meter di atas permukaan laut, mulai bulan Oktober 2015 sampai Februari 2016.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini antara lain, tanaman tembakau varietas Deli-4 berumur 2 bulan yang sehat sebagai tanaman inang, ulat grayak (S. litura) sebagai serangga hama, L. lecanii, M. anisopliae, dan B. bassiana sebagai jamur entomopatogen, PDA (Potato Dextrose Agar) sebagai media biakan S. litura yang terserang jamur entomopatogen, DOC-2 PDA sebagai media biakan jamur entomopatogen, Bactopeptone, CuCl2, Crystal violet, HCl,
air, kentang, dextrose, aquadest sebagai bahan pembuatan medium PDA, cling wrap, kapas, dan alumunium foil sebagai penutup larutan, kertas stensil sebagai bahan sterilisasi, aquades sebagai bahan pembuatan media, alkohol 96% sebagai bahan sterilisasi, chlorox sebagai bahan sterilisasi, polibeg ukuran 10kg sebagai wadah media tanam tembakau, kertas label sebagai penanda perlakuan.
untuk pengamatan hama terinfeksi di lapangan, autoclave sebagai alat untuk sterilisasi media dan alat, timbangan analitik sebagai alat untuk menimbang bahan pembuatan media, laminar air flow sebagai alat sterilisasi saat mengkulturkan jamur entomopatogen, haemocytometer sebagai alat untuk menghitung jumlah spora/konidia jamur, lemari pendingin sebagai alat penyimpanan PDA.
Metode Penelitian
Penelitian ini menggunakan metode Rancangan Acak Kelompok (RAK) dengan 2 faktor.Terdiri dari 9 perlakuan dan tiga ulangan. Adapun perlakuannya adalah:
Faktor 1 : Jamur entomopatogen
C1 : Jamur entomopatogen L. lecanii
C2 : Jamur entomopatogen M. anisopliae
C3 : Jamur entomopatogen B. bassiana
Faktor 2 : Kerapatan konidia Jamur K1 : Kerapatan konidia 106/ml
K2 : Kerapatan konidia 107/ml
K3 : Kerapatan konidia 108/ml
Jumlah ulangan diperoleh dengan rumus: (t-1) (r-1) ≥ 15
Ulangan yang digunakan adalah sebanyak 3 ulangan, yaitu: Total unit percobaan : 9 x 3 = 27 unit percobaan
Kombinasi perlakuan yang diperoleh adalah sebagai berikut: C1K1 C2K1 C3K1
C1K2 C2K2 C3K2
C1K3 C2K3 C3K3
Pelaksanaan Penelitian Di Laboratorium
Isolasi Jamur entomopatogen
Perbanyakan Larva Spodoptera litura F.
Dikumpulkan koloni telur S. litura dari lapangan, lalu dimasukkan ke dalam wadah plastik dengan ukuran 20x28 (diameter x tinggi) telur S.litura diperbanyak dengan cara mengembang biakkan dilaboratorium. Dimasukkan pakan segar yaitu daun tembakau. Setelah telur menetas, dipisahkan larva instar 1 ke wadah lain dan diberi pakan daun tembakau. Makanan larva diganti setelah habis atau sudah tidak segar lagi. Kotoran larva yang terkumpul di dalam wadah harus dibersihkan setiap hari. Setelah larva berganti kutikula sampai instar 2, diambil larva dan diinokulasikan pada tanaman tembakau sebanyak 5 ekor setiap tanaman.
Perbanyakan jamur Entomopatogen
Cendawan entomopatogen ditumbuhkan pada media tumbuh PDA di dalam cawan petri. Pada umur 21 hari setelah inokulasi (hsi), setiap biakan cendawan yang ada di dalam cawan petri ditambahkan air 10 ml kemudian konidia yang terbentuk diambil menggunakan kuas halus dan digerus pada bagian permukaan koloni bagian atas lalu dicampurkan kedalam media cair DOC2. Pengenceran Jamur Entomopatogen
Menghitung Kerapatan Spora
Larutan hasil pengenceran diambil menggunakan jarum suntik dan diteteskan di atas haemocytometer. Kemudian ditutup dengan deck glass. Kerapatan spora dihitung dibawah mikroskop dengan rumus :
Jumlah spora/ml = jumlah spora x 2,5 x 106 Sterilisasi Media Tanam Tembakau
Media tanam tembakau terdiri dari topsoil kompos dan pasir (2:1:1). Media tumbuh kemudian dimasukan ke dalam plastik tahan panas dan disterilisai dalam autoklaf dengan suhu 1210 C selama 1 jam.
Di Rumah Kasa
Persiapan Media Tanam
Dimasukkan media tanam yakni topsoil, kompos dan pasir yang telah steril kedalam polibeg ukuran 10 kg.
Pemupukan
Pemupukan dasar dilakukan 1minggu sebelum tanam yaitu dengan menggunakan pupuk ZA dan pupuk ZK dan TSP dengan cara ditugalkan di sekitar lubang tanam.dosis pupuk yang direkomendasikan yaitu ZA 7,85 gr/tanaman, ZK 12,15 gr/tanaman dan TSP 7,53 gr/tanaman.
Penanaman Tembakau Pada Media Tanam
disungkup dengan menggunakan kain kasa agar terhindar dari serangan opt lainnya.
Introduksi Spodoptera litura F. Pada Tanaman Tembakau
S. litura sesuai instar diintroduksikan sebanyak 5 larva/ tanaman tembakau sesuai dengan masing-masing perlakuan.
Inokulasi Jamur Entomopatogen Pada Tanaman Tembakau
Jamur entomopatogen yang telah diformulasi dalam media cair diinokulasi sebanyak 50 ml ke seluruh permukaan tanaman tembakau.
Pemeliharaan Tanaman Pengendalian OPT
OPT lain diamati dan dikendalikan secara mekanis dengan cara pengutipan langsung dan memusnahkannya.
Penyiraman Tanaman Tembakau
Peubah Amatan
Mortalitas Spodoptera litura F.
Pengamatan terhadap mortalitas S. litura dilakukan setiap hari setelah aplikasi hingga hama tersebut mati. Persentase mortalitas S. litura dihitung dengan rumus :
P = Persentase mortalitas Spodoptera litura n = Jumlah larva yang mati
N= Jumlah awal dari larva yang diuji (Laoh et al.,2003).
Gejala Spodoptera litura F. yang Terinfeksi Jamur Entomopatogen
Pengamatan dilakukan setiap hari pada sore hari sampai larva S. litura mati terinfeksi jamur entompatogen.
Intensitas Serangan
Perhitungan terhadap tingkat kerusakan tanaman tembakau dilakukan dengan menggunakan rumus:
Keterangan
IS = Intensitas serangan
n = Jumlah daun rusak tiap kategori serangan v = Nilai skala tiap kategori serangan
Z = Nilai skala tertinggi kategori serangan N = Jumlah daun yang diamati
0 = Daun sehat tidak ada serangan
1 = > 0-25 % yang terserang dari jumlah daun yang diamati 2 = > 25-50 % yang terserang dari jumlah daun yang diamati 3 = > 50-75 % yang terserang dari jumlah daun yang diamati 4 = > 75-100% yang terserang dari jumlah daun yang diamati (BPTD, 2004).
Analisis Data
HASIL DAN PEMBAHASAN Mortalitas Spodoptera litura F.
Hasil sidik ragam menunjukkan bahwa tingkat kerapatan konidia L. lecanii, M. anisopliae dan B. bassiana berpengaruh nyata terhadap persentase (%) mortalitas larva S. litura (Tabel 1 dan 2 Lampiran 4-8).
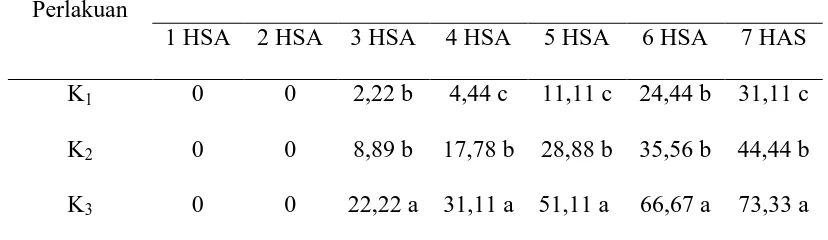
Tabel 1. Mortalitas larva Spodoptera litura pada berbagai tingkat kerapatan konidia Lecanicillium lecanii, Metarhizium anisopliae, dan Beauveria bassiana, (%) pada 1-7 hari setelah aplikasi (hsa).
Perlakuan
Mortalitas (%)
1 HSA 2 HSA 3 HSA 4 HSA 5 HSA 6 HSA 7 HAS
K1 0 0 2,22 b 4,44 c 11,11 c 24,44 b 31,11 c
K2 0 0 8,89 b 17,78 b 28,88 b 35,56 b 44,44 b
K3 0 0 22,22 a 31,11 a 51,11 a 66,67 a 73,33 a
Keterangan: Angka-angka yang diikuti notasi yang sama pada kelompok kolom yang sama menunjukkan tidak berbeda nyata pada taraf 5% menurut Duncan Multiple Range Test. hsa: hari setelah aplikasi. K1: Kerapatan spora 106/ml, K2: Kerapatan spora
107/ml, K3: Kerapatan spora 10 8
/ml
Tabel 1 menunjukkan bahwa kematian larva mulai terjadi pada 3 hsa (hari setelah aplikasi) pada K1 (kerapatan 106 konidia/ml) 2,22% hal ini tidak berbeda
nyata dengan K2 (kerapatan 107 konidia/ml) 8,89%, namun berbeda nyata pada
K3 (kerapataan 108 konidia/ml) 22,22%. Perbedaan tersebut dipengaruhi oleh
semakin banyak serta semakin tinggi daya kecambah, maka akan membuat proses infeksi berlangsung cepat, sehingga mempercepat kematian pada larva S. litura. Hasil pengamatan menunjukkan terjadinya kematian larva yang terinfeksi jamur entomopatogen dimulai dari 3 HSA. Hal ini menandakan bahwa jamur entomopatogen membutuhkan waktu untuk menginfeksi dan mematikan larva, karena konidia jamur yang menempel pada kutikula larva terlebih dahulu berkecambah membentuk hifa agar dapat menembus kutikula. Wahyudi (2002) menyatakan bahwa jamur entomopatogen ini membutuhkan waktu untuk mematikan serangg inangnya, dikarenakan konidia jamur yang menempel pada kutikula harus berkecambah membentuk hifa terlebih dahulu agar dapat menembus kutikula. Hifa mengeluarkan senyawa enzim kitinase dan protease yang dapat menghancurkan kutikula pada integumen. Lama waktu yang dibutuhkan isolat jamur entomopatogen mulai dari infeksi jamur hingga larva dapat mati berkisar 2-10 hari (Herlinda et al 2005).
Pada pengamatan 7 HSA persentase mortalitas tertinggi terdapat pada perlakukan kerapatan 108 konidia/ml 73,33%. Dapat disimpulkan bahwa semakin tinggi jumlah konsentrasi dan racun yang menempel pada permukaan tubuh larva, mengakibatkan jamur lebih cepat berpenetrasi dan mendegradasi kutikula sehingga, semakin tinggi angka kematian larva. Rustama et al., (2008) Semakin banyak konidia yang melekat pada kutikula larva serangga, maka semakin banyak pula konidia yang melakukan penetrasi terhadap kutikula. Mengakibatkan banyak larva yang mati, maka akan meningkatkan persentase tingkat kematian.
107/ml) 44,44%, dan persentase mortalitas tinggi dinyatakan pada K3 (kerapatan
konidia 108/ml) 73,33%. Hal ini dipengaruhi oleh daya tahan tubuh larva, tingkat patogenisitas jamur yang rendah, jumlah konidia yang juga rendah serta racun yang dihasilkan lebih sedikit mengakibatkan persentase kematian menjadi lebih rendah. Menurut Castrillo et al., (2005) tingkat patogenitas cendawan entomopatogen ditentukan potensi serangga inang dan lingkungan disekelilingnya. Prayogo et al., 2005 serangga juga mengembangkan sistem pertahanan diri dengan cara fagositosis atau enkapsulasi dengan membentuk granuloma. Thungrabeab et al. (2006) mengklasifikasikan tingkat patogenisitas menjadi tiga yaitu: patogenisitas tinggi dengan persentase kematian lebih dari 64,49 %, patogenisitas sedang dengan persentase kematian 64,49–30,99 % dan patogenisitas rendah dengan persentase kematian kurang dari 30,99 %.
Gambar 9. Larva instar II yang terserang jamur entomopatogen
disamping dipengaruhi oleh media tumbuh, tingkat virulensi dan frekuensi aplikasi, juga sangat ditentukan oleh umur instar serangga tersebut.
Proses infeksi jamur entomopatogen dimulai dari bagian tubuh larva yang lunak pada bagian kepala hingga torak selanjutnya miselium jamur menutupi tubuh larva dan berkembang keseluruh tubuh larva (Gambar 9). Prayogo (2005) menyatakan bahwa entomopatogen khususnya cendawan umumnya mengadakan penetrasi integumen pada bagian diantara kapsul kepala dengan torak dan diantara ruas-ruas anggota badan. Mekanisme penetrasi pathogen dimulai dengan pertumbuhan konidia pada kutikula, selanjutnya jamur mengeluarkan senyawa enzim khitinase dan lipase sehingga memudahkan dalam penetrasi kutikula.
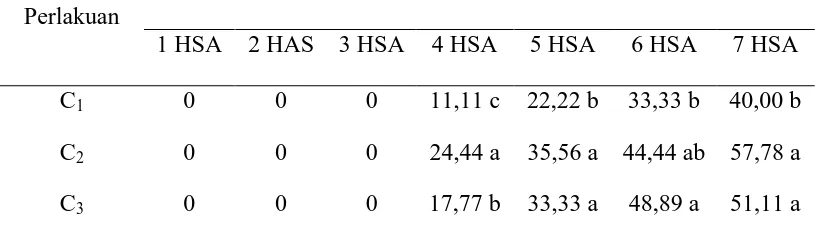
Tabel 2. Persentase mortalitas larva Spodoptera litura terhadap cendawan entomopatogen yang berbeda pada 1-7 hari setelah aplikasi (hsa).
Perlakuan
Mortalitas (%)
1 HSA 2 HAS 3 HSA 4 HSA 5 HSA 6 HSA 7 HSA C1 0 0 0 11,11 c 22,22 b 33,33 b 40,00 b
C2 0 0 0 24,44 a 35,56 a 44,44 ab 57,78 a
C3 0 0 0 17,77 b 33,33 a 48,89 a 51,11 a
Keterangan: Angka-angka yang diikuti notasi yang sama pada kelompok kolom yang sama menunjukkan tidak berbeda nyata pada taraf 5% menurut Duncan Multiple Range Test. hsa: hari setelah aplikasi. C1: Lecanicillium lecanii, C2: Metarhizium anisopliae,
C3: Beauveria bassiana.
Tabel 2 menunjukkan bahwa perlakuan C2 (M. anisopliae) pada
jamur entomopatogen sangat menentukan keberhasilan cendawan dalam proses menginfeksi inang.
Dari Tabel 2 diketahui persentase mortalitas larva pada perlakuan C2 (M. anisopliae) 57,78% lebih tinggi dibandingkan perlakuan C3 (B. bassiana)
51,11% dan C1 (L. lecanii) 40,00%. Hal ini eratkaitannya dengan beberapa jenis
toksin yang dihasilkan, kemampuan jamur M. anisopliae utnuk menginfeksi dan melakukan penetrasi pada tubuh serangga lebih cepat, menyebabkan kematian larva lebih tinggi. Menurut Widiyanti dan Muyadihardja (2004) Kematian larva S. litura terjadi karena konidia jamur M. anisopliae memiliki aktivitas membunuh larva karena menghasilkan cyclopeptida, destruxin A, B, C, D, E dan desmethyl destruxin.
Tabel 2 menunjukkan bahwa dari ketiga jenis jamur entomopatogen yang diuji terlihat bahwa jamur C1 (L. lecanii) merupakan jamur yang paling rendah
mengatasi hal tersebut ialah dengan menambahkan bahan pembawa sebagai pengaman bagi konidia ketika menempel pada integumen serangga (Prayogo 2006).
Persentase mortalitas larva S. litura terhadap cendawan entomopatogen 7 hari setelah aplikasi (HSA) menunjukkan hasil tidak berbeda nyata pada jenis jamur C2 (M. anisopliae) 57,78% dan C3 (B. bassiana) 51,.11%. Hal ini
dikarenakan bahwa kedua jenis jamur ini mampu dan berpotensi dalam mengendalikan dan menginfeksi serangga dengan mengeluarkan racun yang sama sehingga mengakibatkan serangga sakit dan mengalami kematian. Jamur menyebabkan mortalitas dengan satu atau lebih cara seperti: defisiensi nutrisi, menyerang, dan merusak jaringan, dan melepaskan toksin. Beberapa diantaranya bersifat virulen dan membunuh serangga dalam waktu yang singkat dan yang lainnya menghasilkan infeksi kronik yang lama Tanada & Kaya (1993).
Gejala Kematian Spodoptera litura F.
(a) (b)
Gambar 10. (a) Gejala serangan larva terinfeksi jamur entomopatogen yang terjadi perubahan warna menjadi kepucatan (b) larva yang bersembunyi dibalik daun
Gejala yang dialami pada serangga yang terinfeksi jamur entomopatogen yaitu nafsu makan yang berkurang, gerakan tubuh menjadi lamban, bersembunyi dibalik daun, terjadi perubahan warna pada tubuh serangga menjadi kepucatan, bahkan sama sekali sulit untuk bergerak (Gambar 10a dan 10b). Seperti yang dinyatakan Prayogo (2006) gejala yang timbul pada serangga terinfeksi jamur patogen adalah adanya miselia pada serangga. Pada infeksi awal, serangga menunjukkan gejala sakit yaitu tidak mau makan, lemah dan kurang orientasi. Seringkali serangga tersebut berubah warna dan pada kutikula terlihat bercak hitam yang menunjukkan tempat penetrasi jamur. Apabila keadaan lingkungan mendukung maka akan muncul miselia pada permukaan badan serangga yang terinfeksi.
Pada penelitian ini dapat dilihat larva S. litura yang mati terinfeksi M. anisopliae awalnya larva tidak mau makan, pergerakan lambat, mati kaku lalu kering. Setelah larva mati muncul hifa jamur berwarna putih kehijauan. Hifa dari spora M.anisoplae masuk ke rongga dalam tubuh inang karena bantuan enzim dan tekanan mekanik, seluruh tubuh serangga inang penuh dengan propagul dan bagian yang lunak dari tubuhnya akan ditembus keluar dan menampakan pertumbuhan hifa di luar tubuh serangga inang. Pertumbuhan hifa eksternal akan menghasilkan konidia, bila telah masak akan disebarkan ke lingkungan dan menginfeksi serangga hama yang sehat (Prayogo et al., 2005).
Hasil pengamatan menunjukkan bahwa larva S. litura yang terinfeksi B. bassiana terjadi melalui integumen yang merusak sistem kekebalan larva S. litura. Suspensi spora yang kontak dengan integumen segera berkecambah membentuk hifa dan menyerap nutrisi yang ada di tubuh larva serta mengeluarkan toksin yang dihasilkannya, B. bassiana menghancurkan struktur dalam tubuh larva S. litura dan mengakibatkan kematian larva tersebut. Spora jamur B. bassiana masuk ke tubuh serangga inang melalui kulit, saluran pencernaan, spirakel dan lubang lainnya. B. bassiana juga menghasilkan toksin seperti beauverisin, beauverolit, bassianalit, isorolit, dan asam oksalat yang menyebabkan terjadinya kenaikan pH, penggumpalan dan terhentinya peredaran darah serta merusak saluran pencernaan, otot, system syaraf, dan pernafasan (Mahr, 2004).
tubuh larva menciut dan mengeras (mumifikasi). Hal ini diduga sebagai akibat dari mulai bekerjanya toksin yang diproduksi oleh cendawan. Toksin tersebut merusak jaringan dan menyerap cairan sel tubuh larva, sehingga menyebabkan larva mengering dan mati. Menurut Kreb (2014) jamur hidup dan tumbuh dengan memanfaatkan cairan di dalam tubuh serangga dan menghasilkan racun yang dapat membunuh serangga. Setelah serangga mati, miselium akan tumbuh di tubuh serangga.
Hasil penelitian menunjukkan bahwa larva yang terinfeksi telah memperlihatkan adanya gejala infeksi yaitu badan menjadi kaku, berwarna hitam selanjutnya disertai tumbuhnya miselia jamur dipermukaan tubuh S. litura berwana putih seperti benang. Saleh et al., (2000) menyatakan bahwa hasil pembedahan terhadap larva yang mati, yang memperlihatkan isi saluran percernaan larva yang kering dan berwarna hitam. Kulit larva bagian dalam berwarna merah dengan warna putih di sekitarnya. Gejala-gejala ini adalah gejala yang ditunjukkan oleh zat pengurai khitin yang dikenal dengan nama Beauvericin, sebagai racun yamng dihasilkan oleh konidia jamur tersebut.
entomopatogen mulai dari infeksi jamur hingga larva dapat mati berkisar 2-10 hari (Herlinda et al 2005).
Menurut Prayogo (2012) setiap cendawan memiliki patogenitas yang berbeda beda karena toksin yang dimiliki juga berbeda. Toksin merupakan salah satu hal yang paling berperan penting dalam peningkatan mortalitas larva ulat grayak dan aktifitas makannya. Jenis toksin yang dihasilkan oleh L. lecanii adalah Cyclosporin A., dipicolinic acid, hydroxycarboxylic acid, dan cyclodepsipeptide yang berfungsi mengganggu sistem syaraf.
Dari hasil pengamatan diketahui bahwa serangga yang terinfeksi jamur entomopatogen sebagian dari nya tidak menunjukkan gejala tumbuhnya miselia diatas permukaan tubuh serangga. Hal ini diakibatkan jamur entomopatogen tidak mampu menembus integumen serangga. Menurut Prayogo et al., (2005) tidak selalu cendawan tumbuh ke luar menembus integumen serangga. Apabila keadaan kurang mendukung, perkembangan saprofit hanya berlangsung di dalam jasad serangga tanpa ke luar menembus integumen.
Intensitas Serangan (%)
Dari hasil sidik ragam dapat dilihat bahwa banyaknya suspensi larva S. litura yang terinfeksi jamur entomopatogen berpengaruh nyata terhadap intensitas serangan (%). Hal ini dapat dilihat dari Tabel 3 (Lampiran 9).
Tabel 3. Banyaknya suspensi jamur entomopatogen yang menginfeksi larva S. litura.
Perlakuan Rataan
K1 42.22 a
K2 33.06 b
K3 22.50 c
Keterangan: Angka yang diikuti oleh notasi huruf yang berada menunjukkan data berbeda nyata menurut Uji Jarak Duncan pada taraf 5%. K1: Kerapatan spora
Tabel 3. menunjukkan intensitas serangan hama S. litura tertinggi 42.22% yang menyebabkan terjadi banyak kerusakan daun tanaman (Gambar 11), hal ini dikarenakan perlakuan yang digunakan dengan perlakuan K1 (Kerapatan 106 konidia/ml) dimana semakin rendah kerapatan konidia maka semakin tinggi intensitas serangan daun dan semakin sedikit konidia yang menempel maka semakin lama nafsu makan berhenti sehingga intensitas serangan daun tinggi. Menurut Wahyudi (2008) semakin sedikit konidia yang menempel maka semakin lama nafsu makan berhenti sehingga intensitas serangan daun tinggi.
Gambar 11. Intensitas serangan tertinggi Spodoptera litura pada tanaman tembakau Deli
Tabel 3 menunjukkan intensitas serangan hama S. litura terendah 22.50% yang menyebabkan tidak terjadi banyak kerusakan daun tanaman (Gambar 12), hal ini dikarenakan perlakuan yang digunakan dengan perlakuan K3 (kerapatan
disemprot dengan konsentrasi jamur yang lebih tinggi juga dapat dilihat dari besarnya kerusakan tanaman.
Gambar 12. Intensitas serangan terendah Spodoptera litura pada tanaman tembakau Deli
KESIMPULAN DAN SARAN Kesimpulan
1. Persentase mortalitas larva tertinggi terdapat pada perlakuan K3 (kerapatan
108 konidia/ml) yaitu 73,33% dan terendah pada perlakuan K1 (kerapatan
106 konidia/ml) yaitu 31,11%.
2. Aplikasi jamur entomopatogen lebih efektif pada perlakuan C2 (M. anisopliae) 57,78% dibandingkan pada perlakuan C3 (B. bassiana)
51.11% dan perlakuan C1 (L. lecanii) 40,00%.
3. Gejala infeksi jamur entomopatogen pada larva S. litura pada umumnya menunjukkan gejala yang sama, antara lain gerakannya lamban, nafsu makannya berkurang bahkan berhenti, lama-kelamaan diam dan mati. 4. Serangga uji yang terinfeksi jamur entomopatogen M. anisopliae berwarna
putih hijau kekuningan, yang terinfeksi B. bassiana diselimuti miselia putih, dan yang terinfeksi L. lecanii diselimuti miselia putih pucat.
5. Intensitas serangan yang tertinggi 42.22% pada perlakuan K1 (kerapatan
106 konidia/ml) dan intensitas serangan terendah 22.50% pada perlakuan K3 (kerapatan 108 konidia/ml).
Saran
TINJAUAN PUSTAKA
Biologi Hama Spodoptera litura F. (Lepidoptera : Noctuidae)
Spodoptera litura merupakan serangga hama yang terdapat di banyak negara seperti Indonesia, India, Jepang, Cina, dan negara-negara lain di Asia Tenggara (Sintim et al., 2009). Ulat grayak (S. litura) bersifat polifag atau mempunyai kisaran inang yang luas sehingga berpotensi menjadi hama pada berbagai jenis tanaman pangan, sayuran, buah dan perkebunan
(Marwoto dan Suharsono, 2008).
Telur berbentuk hampir bulat dengan bagian datar daun melekat pada daun (kadang tersusun 2 lapis), warna cokelat kekuning-kuningan, berkelompok (masing-masing berisi 25-500 butir) tertutup bulu seperti beludru (Gambar 1) (Tenrirawe dan Talanca, 2008). Stadia telur berlangsung selama 3 hari (Rahayu et al., 2009).
Gambar 1. Telur Spodoptera litura .
(Balitbang, 2006). Perpindahan larva instar-1 dan instar-2 dibantu tiupan angin dan benang pintal untuk berayun (Noch et al, 1983). Masa stadia larva berlangsung selama 15-30 hari (Gambar 2) (Rahayu et al., 2009).
Ulat mempunyai warna yang bervariasi, tetapi ada ciri utama, yaitu adanya garis menyerupai kalung berwarna hitam yang melingkar pada ruas ketiga.Warna pupa coklat kemerahan dengan panjang 12,5-17,5 mm (Sheparetal,2007).
Gambar 2. Larva Spodoptera litura.
S. litura berkepompong (pupa) berwarna coklat kemerahan dengan panjang sekitar 1,6 cm dengan membentuk kokon dari butiran-butiran tanah yang disatukan (Gambar 3). Lama stadia pupa menjadi imago antara 8 hari sampai 11 hari (Ardiansyah, 2007).
Pada stadia imago sayap depan berwarna coklat atau keperakan, sayap belakang S. Litura berwarna keputihan dengan noda hitam (Gambar 4). Panjang kupu betina 14 mm sedangkan jantan 17 mm. Umur ngengat pendek, bertelur dalam 2-6 hari. Baru beberapa hari kemudian mereka tersebar mencari makanan (Shepard et al, 2007). Siklus hidup S. litura berkisar antara 30-60 hari (Ardiansyah, 2007).
[image:30.595.182.448.252.417.2]Sumber: Natasha,2013. Gambar 4. Ngengat Spodoptera litura
Gejala Serangan Spodoptera litura F.
S. litura merusak tanaman tembakau dengan cara membuat lubang pada daun tembakau, sehingga mutu daun menjadi berkurang (Gambar 5). Ulat instar 4 memakan seluruh bagian daun dan menyisakan tulang daunnya (Park et al., 2013). Serangga dewasa dari spesies ini meletakkan telurnya secara berkelompok pada permukaan bawah daun. Penyerangan ulat grayak terjadi pada malam hari, sedangkan pada siang hari ulat tersebut bersembunyi di dalam tanah yang lembab (Surtikanti dan Yasin, 2009).
(Balitbang, 2006). Larva yang masih kecil merusak daun dan menyerang secara serentak berkelompok, dengan meninggalkan sisa-sisa bagian atas epidermis daun, transparan dan tinggal tulang–tulang daun saja. Biasanya larva berada di permukaan bawah daun umumnya terjadi pada musim kemarau (Tanrirawe dan Talanca, 2008).
[image:31.595.200.447.346.471.2]Selain pada daun, ulat dewasa makan polong muda dan tulang daun muda, sedangkan pada daun yang tua, tulang-tulangnya akan tersisa. Selain menyerang kedelai, ulat grayak juga menyerang jagung, kentang, tembakau, kacang hijau, bayam dan kubis (Balitbang, 2006).
Gambar 5. Gejala serangan Spodoptera litura
Pengendalian Spodoptera litura F.
terhadap lingkungan, yakni dapat menimbulkan resistensi, resurjensi, serta mematikan musuh-musuh alami, dan pencemaran lingkungan (Budi et al., 2013). Bila tidak segera diatasi maka daun atau buah tanaman di areal pertanian akan habis (Hasnah et al., 2012).
Pengendalian hayati seperti pemanfaatan parasitoid, virus, predator dan jamur patogen mempunyai harapan besar dimasa mendatang untuk menggantikan insektisida karena tidak mempunyai dampak negatif terhadap kelestarian lingkungan. Jamur patogen merupakan salah satu komponen pengendalian yang dapat memberi peluang yang cukup baik (Surtikanti dan Yasin, 2009).
Beberapa kelebihan pemanfaatan jamur entomopatogen dalam pengendalian hama adalah mempunyai kapasitas produksi yang tinggi, siklus hidupnya pendek, dapat membentuk spora yang tahan lama di alam walaupun dalam kondisi yang tidak menguntungkan, relatif aman, bersifat selektif, relatif mudah diproduksi dan sangat kecil kemungkinan terjadi resistensi (Prayogo, 2005).
Jamur Entomopatogen Metarhizium anisopliae
Menurut Bischoff et al., (2009), sistematika M. anisopliae adalah : Divisio : Deuteromycotina
Class : Hyphomycetes Subclass : Hypocreomycetidae Ordo : Hypocreales
Family : Clavicipitaceae Genus : Metarhizium
Jamur M. anisopliae termasuk dalam kelas Hyphomycetes, ordo Moniliales dan famili Monileaceae. Jamur M. anisopliae mampu menginfeksi hama yang mempunyai tipe mulut menusuk dan mengisap (haustelata), seperti golongan Aphis sp. baik stadia nimfa maupun imago (Sumartini et al., 2001). Di samping itu, M. anisopliae juga mampu menginfeksi hama yang mempunyai tipe mulut menggigit mengunyah, seperti S. litura (Prayogo et al., 2005).
Pada awal pertumbuhan koloni jamur ini berwarna putih, kemudian akan berubah menjadi warna hijau gelap saat konidia matang Kemudian dilanjutkan dengan pembentukan spora berwarna hijau (Gambar 6a). Miselium M. anisopliae bersekat, konidiofor bersusun tegak, berlapis dan bercabang yang dipenuhi konidia Konidia bersel satu dan berbentuk bulat silinder atau lonjong (Gambar 6b) (Rustama et al, 2008).
(a) (b)
Gambar 6. (a.) Makroskopis Metarhizium anisopliae (b) Mikroskopis
Metarhizium anisopliae
Salah satu keuntungan penggunaan jamur Metarhizium spp. untuk pengendalian hayati adalah dapat digunakan untuk mengendalikan berbagai
[image:33.595.139.475.418.591.2]Jamur M. anisopliae memiliki beberapa kelebihan antara lain berkapasitas reproduksi tinggi, relatif aman, siklus hidupnya pendek, selektif, mudah diproduksi, serta dapat bertahan dalam kondisi yang tidak menguntungkan (Prayogo et al., 2005).
Jamur M. anisopliae dapat menginfeksi beberapa jenis serangga, antara
lain serangga yang berasal dari Ordo Lepidoptera dan Hemiptera (Prayogo et al., 2005), ordo Coleoptera (Gallegos et al.,2003), Isoptera
(Krutmuang dan Supamit, 2005), Thysanoptera (Thungrabeab et al.,2006), dan Orthoptera (Tsakadze et al.,2003).
Jamur M. anisopliae memiliki aktivitas membunuh larva karena menghasilkan cyclopeptida, destruxin A, B, C, D, E dan desmethyl destruxin. Destruxin telah dipertimbangkan sebagai bahan insektisida generasi baru. Efek destruxin berpengaruh pada organella sel target (mitokondria, retikulum endoplasma dan membran nukleus), menyebabkan paralisa sel dan kelainan fungsi lambung tengah, tubulus malphigi, hemocyt dan jaringan otot (Widiyanti dan Muyadihardja, 2004).
Jamur Entomopatogen Beuveria bassiana Vuill.
Menurut Hughes (2014), sistematika B. bassiana adalah : Divisio : Ascomycota
Class : Ascomycetes Subclass : Hypocreomycetidae Ordo : Hypocreales
Spesies : Beauveria bassiana Vuill.
Jamur B. bassiana juga dikenal sebagai penyakit white muscardine karena miselium dan konidium (spora) yang dihasilkan berwarna putih, bentuknya oval, dan tumbuh secara zig zag pada konidiofornya (Soetopo dan Indrayani, 2007). Pada konidia B. bassiana akan tumbuh suatu tabung yang makin lama makin panjang mirip seuntai benang dan pada suatu waktu benang itu mulai bercabang. Cabang-cabang yang timbul selalu akan tumbuh menjauhi hifa utama atau hifa yang pertama. Cabang-cabang tersebut akan saling bersentuhan. Pada titik sentuh akan terjadi lisis dinding sel (anastomosis) sehingga protoplasma akan mengalir ke semua sel hifa. Miselium yang terbentukakan makin banyak dan membentuk suatu koloni (Gandjar, 2006).
Miselium jamur B. bassiana bersekat dan bewarna putih (Gambar 7a), didalam tubuh serangga yang terinfeksi jamur terdiri atas banyak sel, dengan
diameter 4 μm, sedang diluar tubuh serangga ukurannya lebih kecil, yaitu 2 μm.
Hifa fertil terdapat pada cabang, tersusun melingkar dan biasanya menggelembung atau menebal. Konidia akan menempel pada ujung dan sisi konidiofor atau cabang-cabangnya (Utomo dan Pardede, 2014).
berikutnya, setiap saat konidia dihasilkan pada ujung hifa dan dipakai terus, selanjutnya ujungnya akan terus tumbuh (Brady, 1979).
(a) (b)
Gambar 7. (a) Makroskopis B. bassiana (b) Mikroskopis B. bassiana
B. bassiana menginfeksi serangga inang melalui kontak fisik, yaitu dengan menempelkan konidia pada. Perkecambahan konidia akan mengeluarkan enzim seperti protease, lipolitik, amilase, dan kitinase. Enzim-enzim tersebut mampu menghidrolisis kompleks protein di dalam integumen (Brady, 1979). Konidia menyerang dan menghancurkan kutikula, sehingga hifa tersebut mampu menembus dan masuk serta berkembang di dalam tubuh serangga. Mekanisme infeksi secara mekanik adalah infeksi melalui tekanan yang disebabkan oleh konidium B. bassiana yang tumbuh. Secara mekanik infeksi jamur B. bassiana berawal dari penetrasi miselium pada kutikula lalu berkecambah dan membentuk apresorium, kemudian menyerang epidermis dan hipodermis. Hifa kemudian menyerang jaringan dan hifa berkembang biak di dalam haemolymph (Clarkson dan Charnley, 1996).
dikarakterisasi secara morfologi (warna koloni, ukuran konidia, dan kerapatan hifa), serta ditinjau viabilitas setiap isolat. Selain itu, perlu diuji efektivitas setiap isolat untuk mengendalikan hama serangga sebelum diformulasi menjadi bioinsektisida (Sri et al., 2014).
Beauveria bassiana dapat diisolasi dari serangga yang mati karena terinfeksi B. bassiana (Hasyim dan Azwana, 2003), dan dari tanaman maupun tanah (Soetopo dan Indrayani, 2007). Metode yang direkomendasikan untuk mengisolasi cendawan entomopatogen dari populasi asli atau lokal adalah metode pemancingan dengan serangga (insect bait method) yang digunakan untuk mengisolasi cendawan dari tanah (Meyling, 2007).
Pada perkembangannya di dalam tubuh serangga B. bassiana akan mengeluarkan racun yang disebut beauvericin yang menyebabkan terjadinya paralisis pada anggota tubuh serangga. Paralisis menyebabkan kehilangan koordinasi sistem gerak, sehingga gerakan serangga tidak teratur dan lama-kelamaan melemah, kemudian berhenti sama sekali. Setelah lebih-kurang lima hari terjadi kelumpuhan total dan kematian. Toksin juga menyebabkan kerusakan jaringan, terutama pada saluran pencernaan, otot, sistem saraf, dan system pernafasan (Wahyudi, 2008).
Jamur Entomopatogen Lecanicillium lecanii Zimm.
Menurut Zare and Gams (2001), sistematika L.lecanii adalah : Divisio : Deuteromycotina
Family : Clavicipitaceae Genus : Lecanicillium
Spesies : Lecanicillium lecanii Zimm.
Jamur Lecanicillium lecanii Zimm. tergolong imperfect fungi atau jamur yang memiliki siklus tidak sempurna. L. lecanii merupakan jamur entomopatogen yang pertama kali ditemukan oleh Zimmermann pada tahun 1898 dengan nama Chephalosporium lecanii. Pada tahun 1939, Viegas mengubah nama menjadi Verticillium lecanii berdasarkan studi kisaran inang (Kouvelis et al., 1999).
Pengamatan lebih lanjut terhadap sifat morfologi dan analisis molekuler, jamur berubah nama menjadi L. lecanii sampai sekarang (Zare dan Gams, 2001). Jamur L. lecanii digunakan untuk mengendalikan hama terutama Hemiptera dengan tingkat mortalitas yang bervariasi (Prayogo, 2004).
(a) (b)
Gambar 8. (a) Makroskopis Lecanicillium lecanii (b) Mikroskopis Lecanicillium lecanii
5-10 konidia yang terbungkus dalam kantong lendir. Konidia berbentuk silinder hingga elips, terdiri atas satu sel tidak berwarna (hialin), berukuran 2,30-10x1-2,60μm (Tanada dan Kaya, 1993).
Jamur entomopatogen memerlukan kelembaban yang tinggi untuk tumbuh dan berkembang, hal tersebut diperlukan selama proses pembentukan tabung kecambah, sebelum terjadi penetrasi ke integumen serangga. Jamur L. lecanii tumbuh baik pada suhu 18-30 ºC dan kelembaban minimal 80%. Pada kelembaban lebih dari 90% jamur tumbuh sangat baik (Cloyd, 2003).
PENDAHULUAN
Latar Belakang
Tembakau merupakan salah satu komoditas perdagangan penting di dunia termasuk Indonesia. Produk tembakau utama yang diperdagangkan adalah daun tembakau dan rokok (Rachmat dan Sri, 2009). Tembakau yang paling terkenal di pasar dunia adalah tembakau Deli. Tembakau ini disebut tembakau Deli sesuai dengan daerah pengembangannya yang berada di daerah Deli Serdang, Sumatera Utara (Suwarso, 2007).
Menurut Soeseno (2015) tahun 2015 luas lahan Indonesia yang dipakai untuk tanaman tembakau seluas 192.525 hektar (ha) dengan jumlah produksi mencapai 163.187 ton per tahun. Padahal kebutuhan nasional adalah 300 ribu ton. Permasalahan yang sangat dirasakan pada beberapa tahun belakangan ini adalah rendahnya produktivitas tanaman Tembakau Deli meskipun berbagai usaha telah dilakukan, penyebab tidak terpenuhnya kebutuhan pasar tersebut sangat kompleks antara lain akibat serangan hama dan penyakit yang menyebabkan daun tembakau rusak dan memiliki nilai ekonomi yang sangat rendah (PTPN II, 2007).
Pengendalian ulat grayak pada tembakau ditingkat petani maupun perusahaan perkebunan kebanyakan masih menggunakan insektisida kimia. Pengendalian hama dengan insektisida kimia telah menimbulkan banyak masalah lingkungan. Salah satu alternatif untuk mengendalikan hama S. litura adalah dengan memanfaatkan agens hayati seperti jamur entomopatogen (Trizelia et al., 2011) seperti Beauveria bassiana, Metarhizium anisopliae, Hirsutella thompsonii, Paecilomyces fumosoroceus, Lecanicillium lecanii dan Spicaria sp (Prayogo, 2005).
Suhairiyah et al., (2013) menyatakan bahwa jamur entomopatogen L. lecanii sangat efektif dan berpengaruh nyata dalam mengendalikan hama S. litura dengan persentase mortalitas sebesar 80% sampai 83% di laboratorium. Selain L. lecanii, Metarhizium anisopliae efektif membunuh serangga, antara lain ordo Coleoptera (Gallegos et al.,2003), Lepidoptera (Prayogo et al., 2005), Isoptera (Krutmuang dan Supamit, 2005), Thysanoptera (Thungrabeab et al.,2006), dan Orthoptera (Tsakadze et al., 2003). Beauveria bassiana (Deuteromycetes : Moniliceae) sangat efektif dalam menekan perkembangan larva Lepidoptera (Suharto et al.,1998 ; Soetopo, 2004), Hemiptera (Herlinda et al., 2006), Homoptera (Evi, 2006), Orthoptera (Thompson, 2006) dan Diptera (Bernardi et al., 2006).
Tujuan Penelitian
Untuk menguji potensi jamur entomopatogen (L. lecanii, M. anisopliae dan B. bassiana) dalam mengendalikan hama ulat grayak (S. litura) pada tanaman tembakau di rumah kasa.
Hipotesis Penelitian
Jamur entomopatogen (L. lecanii, M. anisopliae dan B. bassiana) berpotensi dalam mengendalikan hama ulat grayak (S. litura) pada tanaman tembakau di rumah kasa.
Kegunaan Penelitian
ABSTRAK
IRNA MASYITAH “Potensi Jamur Entomopatogen Untuk Mengendalikan Hama Spodoptera litura Fabricius (Lepidoptera : Noctuidae) Pada Tanaman Tembakau di Rumah Kasa” di bawah bimbingan SUZANA FITRIANY SITEPU dan IRDA SAFNI. Spodoptera litura merupakan hama penting pada tanaman tembakau. Jamur entomopatogen merupakan jamur yang dapat menginfeksi dan menyebabkan kematian pada berbagai ordo serangga. Penelitian bertujuan untuk mengetahui potensi jamur entomopatogen pada kerapatan konidia dan jenis jamur yang berbeda terhadap larva S. litura pada tanaman tembakau. Penelitian dilakukan di Rumah Kasa, Fakultas Pertanian, Universitas Sumatera Utara mulai bulan Oktober sampai Februari 2016. Penelitian menggunakan rancangan acak kelompok (RAK) dengan 2 faktor dan tiga ulangan. Faktor pertama adalah kerapatan konidia (106, 107, 108 konidia/ml) dan faktor kedua adalah jenis jamur (Metarhizium anisopliae, Beauveria bassiana, dan Lecanicillium lecanii). Hasil penelitian menunjukkan bahwa kerapatan konidia dan jenis jamur berbeda nyata terhadap semua peubah amatan. Persentase mortalitas larva tertinggi terdapat pada kerapatan 108 konidia/ml (73,33,%). Mortalitas larva pada jenis jamur M. anisopliae (57,78%) tertinggi dibandingkan B. bassiana (51,11%) dan terendah L. lecanii (40.00%). Gejala serangan jamur entomopatogen pada larva S. litura yaitu gerakannya lamban, berubah warna menjadi kepucatan, nafsu makan berkurang, lama-kelamaan diam dan mati. Larva yang mati tubuhnya mengeras dan berwarna kehitaman. Intensitas serangan tertinggi pada kerapatan 106 konidia/ml (42,22%).
ABSTRACT
IRNA MASYITAH "Potency of entomopathogenic fungi for Controlling Pests Spodoptera litura Fabricius (Lepidoptera: Noctuidae) in Tobacco Plants at Screen House" under supervision of SUZANNA FITRIANY SITEPU and IRDA SAFNI. Spodoptera litura is an important pest in tobacco plants. Entomopathogenic fungy are fungy that can infect and cause death in various insect orders. The study aimed to determine the potential of fungal conidia and entomopathogens on different types of fungy against larvae of S. litura on tobacco. The study was conducted in screen house, Faculty of Agriculture, University of North Sumatra in October until February 2016. The study was a randomized block design (RBD) with two factors and three replications. The first factor was the conidia (106, 107, 108 conidia/ml), and the second factor was the type of fungy (Metarhizium anisopliae, Beauveria bassiana, and Lecanicillium lecanii). The results showed that the conidia and the types of fungy different significantly with all of the variables. The highest percentage of larval mortality was at concentration of 108 conidia/ml (73,33%). The highest larval mortality was on M. anisopliae (57,78%) followed by B. bassiana (51,11%) and L. lecanii (40,00%). The infected larvae of entomopathogenic S. litura showed slow movements, color changes to paleness, decreased appetite, over time silent and die. The dead larval body hardened and blackened. The highest intensity of fungal infection was at concentration of 106 conidia/ml (42.22%).
POTENSI JAMUR ENTOMOPATOGEN UNTUK MENGENDALIKAN HAMA ULAT GRAYAK (Spodoptera litura F.) (Lepidoptera : Noctuidae)
PADA TANAMAN TEMBAKAU DI RUMAH KASA
SKRIPSI
Oleh:
IRNA MASYITAH 110301007
AGROEKOTEKNOLOGI / HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
POTENSI JAMUR ENTOMOPATOGEN UNTUK MENGENDALIKAN HAMA ULAT GRAYAK (Spodoptera litura F.) (Lepidoptera : Noctuidae)
PADA TANAMAN TEMBAKAU DI RUMAH KASA
SKRIPSI
Oleh:
IRNA MASYITAH 110301007
AGROEKOTEKNOLOGI / HPT
Usulan Penelitian Sebagai Salah Syarat untuk Memperoleh Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Potensi Jamur Entomopatogen Untuk Mengendalikan Hama Ulat Grayak (Spodoptera Litura F.) (Lepidoptera : Noctuidae) Pada Tanaman Tembakau Di Rumah Kasa
Nama : Irna Masyitah Nim : 110301007
Prodi : Agroekotknologi/HPT
Disetujui Oleh: Komisi Pembimbing
(Ir. Suzanna Fitriany Sitepu, M.Si) (Irda Safni, SP.,MCP.,Ph.D )
ABSTRAK
IRNA MASYITAH “Potensi Jamur Entomopatogen Untuk Mengendalikan Hama Spodoptera litura Fabricius (Lepidoptera : Noctuidae) Pada Tanaman Tembakau di Rumah Kasa” di bawah bimbingan SUZANA FITRIANY SITEPU dan IRDA SAFNI. Spodoptera litura merupakan hama penting pada tanaman tembakau. Jamur entomopatogen merupakan jamur yang dapat menginfeksi dan menyebabkan kematian pada berbagai ordo serangga. Penelitian bertujuan untuk mengetahui potensi jamur entomopatogen pada kerapatan konidia dan jenis jamur yang berbeda terhadap larva S. litura pada tanaman tembakau. Penelitian dilakukan di Rumah Kasa, Fakultas Pertanian, Universitas Sumatera Utara mulai bulan Oktober sampai Februari 2016. Penelitian menggunakan rancangan acak kelompok (RAK) dengan 2 faktor dan tiga ulangan. Faktor pertama adalah kerapatan konidia (106, 107, 108 konidia/ml) dan faktor kedua adalah jenis jamur (Metarhizium anisopliae, Beauveria bassiana, dan Lecanicillium lecanii). Hasil penelitian menunjukkan bahwa kerapatan konidia dan jenis jamur berbeda nyata terhadap semua peubah amatan. Persentase mortalitas larva tertinggi terdapat pada kerapatan 108 konidia/ml (73,33,%). Mortalitas larva pada jenis jamur M. anisopliae (57,78%) tertinggi dibandingkan B. bassiana (51,11%) dan terendah L. lecanii (40.00%). Gejala serangan jamur entomopatogen pada larva S. litura yaitu gerakannya lamban, berubah warna menjadi kepucatan, nafsu makan berkurang, lama-kelamaan diam dan mati. Larva yang mati tubuhnya mengeras dan berwarna kehitaman. Intensitas serangan tertinggi pada kerapatan 106 konidia/ml (42,22%).
ABSTRACT
IRNA MASYITAH "Potency of entomopathogenic fungi for Controlling Pests Spodoptera litura Fabricius (Lepidoptera: Noctuidae) in Tobacco Plants at Screen House" under supervision of SUZANNA FITRIANY SITEPU and IRDA SAFNI. Spodoptera litura is an important pest in tobacco plants. Entomopathogenic fungy are fungy that can infect and cause death in various insect orders. The study aimed to determine the potential of fungal conidia and entomopathogens on different types of fungy against larvae of S. litura on tobacco. The study was conducted in screen house, Faculty of Agriculture, University of North Sumatra in October until February 2016. The study was a randomized block design (RBD) with two factors and three replications. The first factor was the conidia (106, 107, 108 conidia/ml), and the second factor was the type of fungy (Metarhizium anisopliae, Beauveria bassiana, and Lecanicillium lecanii). The results showed that the conidia and the types of fungy different significantly with all of the variables. The highest percentage of larval mortality was at concentration of 108 conidia/ml (73,33%). The highest larval mortality was on M. anisopliae (57,78%) followed by B. bassiana (51,11%) and L. lecanii (40,00%). The infected larvae of entomopathogenic S. litura showed slow movements, color changes to paleness, decreased appetite, over time silent and die. The dead larval body hardened and blackened. The highest intensity of fungal infection was at concentration of 106 conidia/ml (42.22%).
RIWAYAT HIDUP
Irna Masyitah, dilahirkan di Tebing Tinggi, Sumatera Utara, pada tanggal 30 Januari 1994 dari pasangan Ayahanda Suheri dan Ibunda Asmawati. Penulis merupakan anak ke-3 dari 4 bersaudara. Tahun 2011 lulus dari Sekolah Menengah Atas SMA N 03 Tebing Tinggi dan pada tahun yang sama diterima di Fakultas Pertanian Universitas Sumatera Utara Medan, Program Studi Agroekoteknologi melalui jalur SNMPTN Undangan.
Selama mengikuti perkuliahan, penulis aktif sebagai Anggota HIMAGROTEK (Himpunan Mahasiswa Agroekoteknologi) USU, sebagai
asisten Laboratorium Agroklimatologi dan Ekologi Tanaman, asisten Laboratorium Mikrobiologi Pertanian, dan Asisten Laboratorium Dasar
Perlindungan Tanaman di Fakultas Pertanian USU, Medan.
Penulis melaksanakan Praktek Kerja Lapangan (PKL) di PT. Surya Bratasena Plantation , Pelalawan, Riau pada tahun 2014.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmatNya lah penulis dapat menyelesaikan skripsi yang berjudul “Potensi Jamur Entomopatogen Untuk Mengendalikan Hama Ulat Grayak (Spodoptera litura Fabricius) (Lepidoptera : Noctuidae) pada Tanaman Tembakau di Rumah Kasa ”.
Penulis mengucapkan terima kasih kepada Ayahanda dan Ibunda yang telah memberikan dukungan dan doanya. Penulis juga mengucapkan terima kasih kepada Komisi Pembimbing Ir. Suzanna Fitriany Sitepu, MS selaku Ketua dan Irda Safni, SP., MCP., Ph.D selaku Anggota yang telah membimbing dan memberikan masukan berharga kepada penulis dalam menyelesaikan skripsi ini, terimakasih juga disampaikan kepada Teman teman seperjuangan di Fakultas Pertanian yang telah membantu saya dalam melaksanakan penelitian ini.
Penulis menyadari bahwa skripsi ini jauh dari kesempurnaan, oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi perbaikan skripsi ini di masa yang akan datang. Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Juni 2016
DAFTAR ISI
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesa Penelitian ... 3
Kegunaan Penelitian ... 3
TINJAUAN PUSTAKA Biologi Spodoptera litura F ... 4
Gejala Serangan Spodoptera litura F. ... 6
Pengendalian Spodoptera litura F. ... 7
Jamur Entomopatogen Metarhizium anisopliae... 8
Jamur Entomopatogen Beauveria bassiana Vuill ... 10
Jamur Entomopatogen Lecanicillium lecanii Zimm... 13
BAHAN DAN METODE Tempat dan Waktu... 16
Bahan dan Alat ... 16
Metodologi Penelitian ... 17
PELAKSANAANPENELITIAN Di Laboratorium Isolasi Jamur Entomopatogen ... 18
Perbanyakan Larva Spodoptera litura F ... 19
Perbanyakan Jamur Entomopatogen ... 19
Pengenceran Jamur Entomopatogen ... 19
Menghitung Kerapatan Spora ... 20
Di Rumah Kasa
Persiapan Media Tanam ... 20
Pemupukan ... 20
Penanaman Tembakau Pada Media Tanam ... 20
Introduksi Spodoptera litura F Pada TanamanTembakau ... 21
Inokulasi Jamur Entomopatogen Tanaman Tembakau ... 21
PemeliharaanTanaman Pengendalian OPT ... 21
Penyiraman Tanaman Tembakau ... 21
PeubahAmatan Mortalitas Spodoptera litura F ... 22
Gejala Kematian Spodoptera litura F ... 22
Intensitas Serangan ... 22
Analisis Data ... 23
HASIL DAN PEMBAHASAN Mortalitas Spodoptera litura F ... 24
Gejala Kematian Spodoptera litura F ... 29
Intensitas Serangan ... 33
KESIMPULAN DAN SARAN Kesimpulan ... 36
Saran ... 36 DAFTAR PUSTAKA
DAFTAR TABEL
No. Keterangan Hal
1. Tabel 1. Mortalitas larva S. litura pada berbagai tingkat kerapatan konidia Metarhizium anisopliae, Beauveria bassiana, Lecanicillium lecanii (%) pada 1-7 hari setelah aplikasi (hsa)…….………24 2. Tabel 2. Persentase mortalitas larva S. litura terhadap cendawan
entomopatogen yang berbeda pada 1-7 hari setelah aplikasi (hsa)……28
DAFTAR GAMBAR
No. Keterangan Hal
1. Telur Spodoptera litura ... 4
2. Larva Spodoptera litura ... 5
3. Pupa Spodoptera litura ... 5
4. Imago Spodoptera litura ... 6
5. Gejala Serangan Spodoptera litura ... 7
6. Jamur Metarhizium anisopliae ... 9
7. Jamur Beauveria bassiana ... 12
8. Jamur Lecanicillium lecanii ... 14
9. Larva yang terserang jamur entomopatogen ... 27
10. Gejala serangan larva yang terinfeksi jamur entomopatogen ... 30
11. Intensitas serangan tertinggi ... 35
DAFTAR LAMPIRAN
No. Keterangan Hal
1. Deskripsi Tembakau Deli ... 44
2. Bagan Penelitian ... 45
3. Data Mortalitas Spodoptera litura ... 46