(Atactodea striata)
CELCIUS WARANMASELEMBUN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul ”Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I dari Kerang Mas Ngur (Atactodea
striata) adalah benar hasil karya saya sendiri dan belum pernah diajukan dalam
bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2007
CELCIUS WARANMASELEMBUN. Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I dari Kerang Mas Ngur (Atactodea striata). Dibimbing oleh LINAWATI HARDJITO dan MULYONO S. BASKORO.
Inhibitor topoisomerase merupakan salah satu target molekul untuk penemuan obat kanker. Topoisomerase terdiri dari 2 tipe yaitu topoisomerase I yang berperan dalam relaksasi supercoiled DNA dan memutus single stranded DNA; dan topoisomerase II yang berperan dalam relaksasi pada pemutusan double stranded DNA. Atactodea striata telah digunakan oleh masyarakat di kepulauan Kei Maluku Tenggara sebagai obat penyakit kuning. Penelitian ini bertujuan untuk mengetahui kandungan gizi kerang Mas Ngur (Atactodea striata) dan menemukan senyawa kimia yang memiliki aktivitas inhibitor topoisomerase I.
Kerang Mas Ngur (Atactodea striata) yang digunakan dalam penelitian ini diperoleh dari pulau Kei Kecil Maluku Tenggara. Kerang kering diblender halus dan dianalisa komposisi kimianya serta asam amino, dengan metode standar (AOAC 1995). Selain itu bubuk kering diekstraksi menggunakan pelarut heksana, etil asetat dan metanol. Ekstrak yang diperoleh selanjutnya diuji aktivitasnya sebagai inhibitor topoisomerase I. Kemudian dilakukan karakterisasi ekstrak aktif, yang dilanjutkan dengan isolasi golongan senyawa kimia.
ABSTRACT
CELCIUS WARANMASELEMBUN. Chemical Composition and Topoisomerase I Inhibitor Activity of Mas Ngur Mollusk (Atactodea striata). Supervised by : LINAWATI HARDJITO and MULYONO S. BASKORO.
Topoisomerase inhibitor is one of target molecule for the invention of cancer drug. There are two type of topoisomerases, namely topoisomerase I that relaxes supercoiled DNA by introducing transient nicks in the DNA substrate and topoisomerase II that cuts DNA substrate primarily at double stranded DNA. This paper reported the screening of Atactodea striata extracts as topoisomerase I inhibitor and their chemical content. Atactodea striata is a marine mollusk that has been used by local people in Kei island, South-East Maluku as traditional medicine to cure liver disease. This research aimed to investigate the nutrition content of Mas Ngur Mollusk (Atactodea striata) and finding chemical compound as topoisomerase I inhibitor.
Mas Ngur Mollusk (Atactodea striata) was obtained from Kei Kecil island, South-East Maluku. The chemical content of Atactodea dried powder was analysed applying standard method. The powder was extracted using hexane, ethyl acetate and methanol. The extracts then was tested as topoisomerase I inhibitor. The active extract further chemically characterized.
Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB 2. pengutipan tidak merugikan kepentingan yang wajar IPB dalam bentuk
KOMPOSISI KIMIA DAN AKTIVITAS INHIBITOR
TOPOISOMERSE I DARI KERANG MAS NGUR
(Atactodea striata)
CELCIUS WARANMASELEMBUN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Celcius Waranmaselembun
NRP : C551050021
Disetujui Komisi Pembimbing
Dr. Ir. Linawati Hardjito, M.Sc. Dr. Ir. Mulyono S. Baskoro, M.Sc.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Kelautan
Prof. Dr. Ir. John Haluan, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
i
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena rahmat dan karunia-Nya penulisan tesis ini dapat diselesaikan. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Kelautan, Sekolah Pascasarjana Institut Pertanian Bogor. Adapun judul dari tesis ini adalah “Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I Dari Kerang Mas Ngur (Atactodea striata)”. Penelitian ini merupakan bagian dari Hibah Penelitian Tim Pasca (HPTP) yang didanai oleh Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Linawati Hardjito, M.Sc sebagai pembimbing I dan Bapak Dr. Ir. Mulyono S. Baskoro, M.Sc sebagai pembimbing II yang telah banyak memberikan bimbingan, arahan dan saran sehingga penelitian dan penulisan ini dapat terselesaikan. Serta terimakasih kepada Ibu Prof. Dr. drh. Maria Bintang, MS sebagai penguji luar komisi yang telah banyak memberikan masukan dalam penyempurnaan tesis ini. Tak lupa juga penulis menyampaikan terimakasih kepada :
1. Direktur Politeknik Perikanan Negeri Tual Maluku Tenggara yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi di SPs IPB Bogor.
2. Prof. Dr. Ir. John Haluan, M.Sc. Ketua Program Studi Teknologi Kelautan, atas kesempatan yang diberikan untuk mengikuti pendidikan pascasarjana.. 3. Kepada ketua tim Program Hibah Penelitian Tim Pasacasarjana-HPTP (Hibah
Pasca) dengan judul: ”Screening, Isolasi dan Identifikasi Inhibitor topoisomerase untuk target penemuan anti kanker dari organisme pesisir/laut yang telah digunakan sebagai obat tradisional” (2006-2007) yang telah mendanai penelitian ini.
4. Hasil karya ini juga penulis persembahkan kepada istri dan anak-anakku tercinta Yuliana Kopong, SPd., Paulus Pattiblile Waran, Ha nna Chantika Waran, Gutsy Godlife Waran dan Prisdy Waran atas segala pengertian, ketabahan, kesabaran serta pengorbanan yang diberikan selama penulis menjalani studi.
ii 6. Lulut Dwi Sulistyaningsih, S.Si. atas bantuannya dalam uji inhibitor enzim
topoisomerase I.
7. Ibu Heny, Erna, S.Si, Desya, S.Si, Ian, Lusy, dan Dian atas dukungan dan persahabatannya.
8. Mas Dany, Ibu Niken, Ibu Dewi, Mas Agus, dan Mas Fajar sebagai rekan-rekan penelitian Hibah Pasca 2006-2007 atas dukungan dan kerjasamanya. 9. Rekan-rekan dari Tual : Suhu Usman, Beni, Yula.
Penulis menyadari bahwa penulisan ini masih jauh dari kesempurnaannya, oleh karena itu segala saran dan kritik dalam penyempurnaannya sangatlah penulis harapkan.
iii
RIWAYAT HIDUP
Penulis dilahirkan di Geser pada tanggal 15 September 1965 dari keluarga Bapak Nikolaus Waranmaselembun dan Ibu Rosina Olingir. Penulis merupakan anak ke tujuh dari delapan bersaudara.
Penulis menyelesaikan pendidikan dasar pada SD GPM Lafa Kec. Tehoru, Maluku Tengah pada tahun 1979, Sekolah Menengah Pertama (SMP) Negeri 7 Ambon pada tahun 1982 dan Sekolah Menengah Atas (SMA) Negeri 3 Ambon pada tahun 1985. Pada tahun yang sama penulis diterima di Universitas Pattimura Ambon melalui jalur PMDK Unpatti Ambon pada Fakultas Perikanan, Jurusan Pengolahan Hasil Perikanan (PHP). Penulis memperoleh gelar Sarjana Perikanan pada tahun 1990.
(Atactodea striata)
CELCIUS WARANMASELEMBUN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul ”Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I dari Kerang Mas Ngur (Atactodea
striata) adalah benar hasil karya saya sendiri dan belum pernah diajukan dalam
bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2007
CELCIUS WARANMASELEMBUN. Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I dari Kerang Mas Ngur (Atactodea striata). Dibimbing oleh LINAWATI HARDJITO dan MULYONO S. BASKORO.
Inhibitor topoisomerase merupakan salah satu target molekul untuk penemuan obat kanker. Topoisomerase terdiri dari 2 tipe yaitu topoisomerase I yang berperan dalam relaksasi supercoiled DNA dan memutus single stranded DNA; dan topoisomerase II yang berperan dalam relaksasi pada pemutusan double stranded DNA. Atactodea striata telah digunakan oleh masyarakat di kepulauan Kei Maluku Tenggara sebagai obat penyakit kuning. Penelitian ini bertujuan untuk mengetahui kandungan gizi kerang Mas Ngur (Atactodea striata) dan menemukan senyawa kimia yang memiliki aktivitas inhibitor topoisomerase I.
Kerang Mas Ngur (Atactodea striata) yang digunakan dalam penelitian ini diperoleh dari pulau Kei Kecil Maluku Tenggara. Kerang kering diblender halus dan dianalisa komposisi kimianya serta asam amino, dengan metode standar (AOAC 1995). Selain itu bubuk kering diekstraksi menggunakan pelarut heksana, etil asetat dan metanol. Ekstrak yang diperoleh selanjutnya diuji aktivitasnya sebagai inhibitor topoisomerase I. Kemudian dilakukan karakterisasi ekstrak aktif, yang dilanjutkan dengan isolasi golongan senyawa kimia.
ABSTRACT
CELCIUS WARANMASELEMBUN. Chemical Composition and Topoisomerase I Inhibitor Activity of Mas Ngur Mollusk (Atactodea striata). Supervised by : LINAWATI HARDJITO and MULYONO S. BASKORO.
Topoisomerase inhibitor is one of target molecule for the invention of cancer drug. There are two type of topoisomerases, namely topoisomerase I that relaxes supercoiled DNA by introducing transient nicks in the DNA substrate and topoisomerase II that cuts DNA substrate primarily at double stranded DNA. This paper reported the screening of Atactodea striata extracts as topoisomerase I inhibitor and their chemical content. Atactodea striata is a marine mollusk that has been used by local people in Kei island, South-East Maluku as traditional medicine to cure liver disease. This research aimed to investigate the nutrition content of Mas Ngur Mollusk (Atactodea striata) and finding chemical compound as topoisomerase I inhibitor.
Mas Ngur Mollusk (Atactodea striata) was obtained from Kei Kecil island, South-East Maluku. The chemical content of Atactodea dried powder was analysed applying standard method. The powder was extracted using hexane, ethyl acetate and methanol. The extracts then was tested as topoisomerase I inhibitor. The active extract further chemically characterized.
Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB 2. pengutipan tidak merugikan kepentingan yang wajar IPB dalam bentuk
KOMPOSISI KIMIA DAN AKTIVITAS INHIBITOR
TOPOISOMERSE I DARI KERANG MAS NGUR
(Atactodea striata)
CELCIUS WARANMASELEMBUN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Kelautan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Celcius Waranmaselembun
NRP : C551050021
Disetujui Komisi Pembimbing
Dr. Ir. Linawati Hardjito, M.Sc. Dr. Ir. Mulyono S. Baskoro, M.Sc.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Kelautan
Prof. Dr. Ir. John Haluan, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, MS.
i
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena rahmat dan karunia-Nya penulisan tesis ini dapat diselesaikan. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Teknologi Kelautan, Sekolah Pascasarjana Institut Pertanian Bogor. Adapun judul dari tesis ini adalah “Komposisi Kimia dan Aktivitas Inhibitor Topoisomerase I Dari Kerang Mas Ngur (Atactodea striata)”. Penelitian ini merupakan bagian dari Hibah Penelitian Tim Pasca (HPTP) yang didanai oleh Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Linawati Hardjito, M.Sc sebagai pembimbing I dan Bapak Dr. Ir. Mulyono S. Baskoro, M.Sc sebagai pembimbing II yang telah banyak memberikan bimbingan, arahan dan saran sehingga penelitian dan penulisan ini dapat terselesaikan. Serta terimakasih kepada Ibu Prof. Dr. drh. Maria Bintang, MS sebagai penguji luar komisi yang telah banyak memberikan masukan dalam penyempurnaan tesis ini. Tak lupa juga penulis menyampaikan terimakasih kepada :
1. Direktur Politeknik Perikanan Negeri Tual Maluku Tenggara yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi di SPs IPB Bogor.
2. Prof. Dr. Ir. John Haluan, M.Sc. Ketua Program Studi Teknologi Kelautan, atas kesempatan yang diberikan untuk mengikuti pendidikan pascasarjana.. 3. Kepada ketua tim Program Hibah Penelitian Tim Pasacasarjana-HPTP (Hibah
Pasca) dengan judul: ”Screening, Isolasi dan Identifikasi Inhibitor topoisomerase untuk target penemuan anti kanker dari organisme pesisir/laut yang telah digunakan sebagai obat tradisional” (2006-2007) yang telah mendanai penelitian ini.
4. Hasil karya ini juga penulis persembahkan kepada istri dan anak-anakku tercinta Yuliana Kopong, SPd., Paulus Pattiblile Waran, Ha nna Chantika Waran, Gutsy Godlife Waran dan Prisdy Waran atas segala pengertian, ketabahan, kesabaran serta pengorbanan yang diberikan selama penulis menjalani studi.
ii 6. Lulut Dwi Sulistyaningsih, S.Si. atas bantuannya dalam uji inhibitor enzim
topoisomerase I.
7. Ibu Heny, Erna, S.Si, Desya, S.Si, Ian, Lusy, dan Dian atas dukungan dan persahabatannya.
8. Mas Dany, Ibu Niken, Ibu Dewi, Mas Agus, dan Mas Fajar sebagai rekan-rekan penelitian Hibah Pasca 2006-2007 atas dukungan dan kerjasamanya. 9. Rekan-rekan dari Tual : Suhu Usman, Beni, Yula.
Penulis menyadari bahwa penulisan ini masih jauh dari kesempurnaannya, oleh karena itu segala saran dan kritik dalam penyempurnaannya sangatlah penulis harapkan.
iii
RIWAYAT HIDUP
Penulis dilahirkan di Geser pada tanggal 15 September 1965 dari keluarga Bapak Nikolaus Waranmaselembun dan Ibu Rosina Olingir. Penulis merupakan anak ke tujuh dari delapan bersaudara.
Penulis menyelesaikan pendidikan dasar pada SD GPM Lafa Kec. Tehoru, Maluku Tengah pada tahun 1979, Sekolah Menengah Pertama (SMP) Negeri 7 Ambon pada tahun 1982 dan Sekolah Menengah Atas (SMA) Negeri 3 Ambon pada tahun 1985. Pada tahun yang sama penulis diterima di Universitas Pattimura Ambon melalui jalur PMDK Unpatti Ambon pada Fakultas Perikanan, Jurusan Pengolahan Hasil Perikanan (PHP). Penulis memperoleh gelar Sarjana Perikanan pada tahun 1990.
iv Halaman
DAFTAR TABEL --- vi
DAFTAR GAMBAR --- vii
DAFTAR LAMPIRAN --- viii
1 PENDAHULUAN --- 1
1.1 Latar Belakang --- 1
1.2 Perumusan Masalah --- 3
1.3 Tujuan dan Manfaat Penelitian --- 3
1.4 Hipotesis --- 3
2 TINJAUAN PUSTAKA --- 5
2.1 Deskripsi Kerang Mas Ngur (Atactodea striata) --- 5
2.1.1 Bentuk Cangkang --- 6
2.1.2 Habitat --- 7
2.1.3 Penyebaran --- 7
2.1.4 Cara Membenamkan Diri ke Dalam Pasir --- 9
2.2 Kandungan Senyawa Bioaktif Kerang Laut --- 9
2.3 Komponen Bioaktif Makanan dan Pengaruhnya Terhadap Kesehatan --- 11
2.3.1 Protein --- 12
2.3.2 Karbohidrat --- 14
2.3.3 Asam Lemak --- 16
2.4 Asam Amino --- 18
2.5 Ekstraksi Senyawa Bioaktif --- 20
2.6 DNA dan Inhibitor Topoisomerase --- 22
3 METODOLOGI --- 25
3.1 Waktu dan Tempat Penelitian --- 25
3.2 Bahan dan Peralatan --- 25
3.2.1 Bahan --- 25
3.2.2 Peralatan --- 25
v 3.3.1 Analisa Komposisi Kimia dan Asam Amino --- 26
vi Halaman 1 Komposisi kimia serbuk kering Atactodea striata
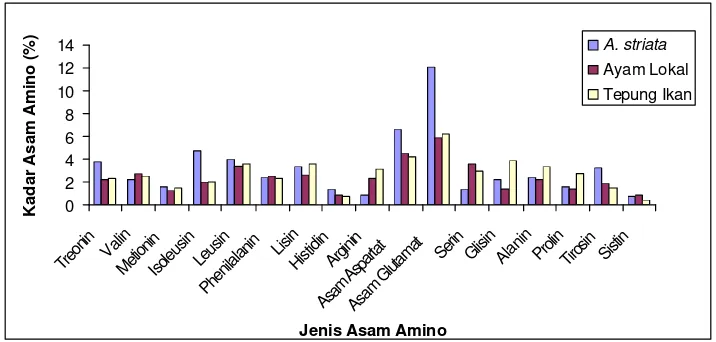
dibandingkan dengan sumber nutrisi lain --- 38 2 Kandungan asam amino Atactodea striata
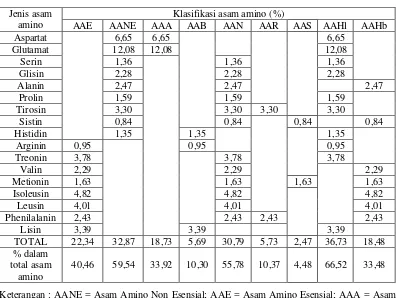
dibandingkan dengan ayam lokal dan tepung ikan --- 43 3 Klasifikasi asam amino berdasarkan sifat fisik dan kimia
dari Atactodea striata --- 48 4 Rendemen ekstrak Atactodea striata dengan metode
ekstraksi bertingkat --- 50 5 Hasil uji inhibitor topoisomerase I dari ekstrak heksana,
etil asetat dan metanol pada konsentrasi 50 µg/ml --- 51 6 Hasil uji inhibitor topoisomerase I dari ekstrak metanol
vii
DAFTAR GAMBAR
Halaman 1 Road map penelitian komposisi kimia dan aktivitas inhibitor
topoisomerase I dari Atactodea striata --- 4 2 Jenis-jenis remis --- 7 3 Bagian-bagian dari Atactodea striata --- 7 4 Penampang melintang pantai pasir pulau karang
tempat hidup remis --- 9 5 Struktur lamellarin D --- 10 6 Struktur beberapa topoisomerase poison --- 23 7 Perbedaan antara inhibitor katalitik dan poison --- 24 8 Diagram alir proses ekstraksi bahan aktif
dari Atactodea striata --- 32 9 Histogram kandungan asam amino dari A. striata,
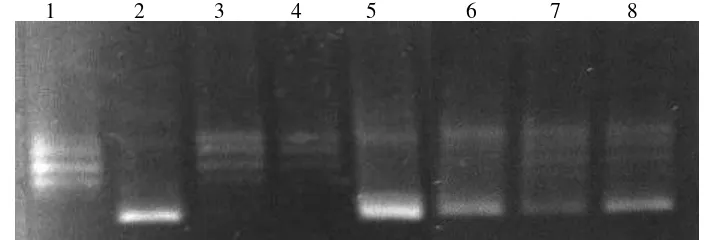
ayam lokal dan tepung ikan --- 44 10 Hasil elektroforesis uji inhibitor topoisomerase I
dari berbagai ekstrak --- 50 11 Hasil elektroforesis uji inhibitor topoisomerase I
viii Halaman 1 Peta dan foto-foto lokasi pengambilan sampel --- 69 2 Bagan alir ekstraksi alkaloid --- 70 3 Bagan alir ekstraksi steroid --- 71 4 Hasil analisa asam amino Atactodea striata dengan HPLC --- 72 5 Hasil karakterisasi ekstrak aktif Atactodea striata --- 75 6 Hasil uji senyawa ekstrak aktif Atactodea striata --- 76 7 Hasil uji isolat senyawa alkaloid bebas dari ekstrak metanol --- 77 8 Hasil uji isolat senyawa steroid bebas dari ekstrak metanol
1 PENDAHULUAN
1.1 Latar Belakang
Indonesia memiliki sumberdaya laut yang besar dengan keanekaragaman organisme laut yang tinggi merupakan penopang pengetahuan tradisional akan berbagai obat-obatan yang dimanfaatkan turun-temurun. Hal ini menunjukkan bahwa potensi alam laut Indonesia mempunyai peluang besar untuk berbagai penelitian dalam penemuan obat baru. Bhakuni dan Rawat (2005) melaporkan bahwa sampai saat ini ± 16.000 produk alam laut telah di isolasi dari organisme laut yang dilaporkan dalam ± 6.800 penerbitan. Beberapa senyawa yang di isolasi dari sumberdaya laut memperlihatkan aktivitas biologi yang kuat. Dengan demikian laut dianggap sebagai sumber bahan obat yang potensial.
Maluku Tenggara memiliki luas wilayah 103.474 km2, dengan luas laut 93.100 km2 (89,97 %) yang terdiri 123 pulau, mempunyai potensi sumberdaya laut dan keanaekaragaman hayati yang tinggi sebagaimana ciri dari ekosistem daerah tropis. Berdasarkan data statistik Dinas Perikanan dan Kelautan Kabupaten Maluku Tenggara (2004) jumlah produksi perikanan pada tahun 2003 sebesar 94.599,3 ton, terdiri dari komoditas perikanan tuna, pelagis besar, pelagis kecil, demersal dan komoditas perikanan lainnya. Keanekaragaman hayati perairan pesisir pada tingkat spesies terdiri atas filum moluska : 160 spesies (kelas gastropoda), kelas bivalvia (41 spesies), kelas holothuridae (8 spesies), kelas echinoidea (3 spesies), 9 spesies ekinodermata, 14 spesies alga, 256 spesies ikan karang, 69 spesies terumbu karang.
Keanekaragaman hayati yang kaya tersebut merupakan karunia Tuhan yang harus dikelola secara arif sehingga memberikan nilai manfaat bagi manusia. Salah satu bentuk pemanfaatan sumberdaya hayati tersebut adalah penggunaan kerang Atactodea striata sebagai obat. Kerang ini sudah sejak dahulu kala digunakan oleh
Oleh karena kerang ini digunakan sebagai obat penyakit kuning maka diduga memiliki senyawa bioaktif (metabolit primer dan sekunder). Metabolisme merupakan proses sintesis substansi kimia dan degradasi oleh organisme dengan sistem enzimatik. Jalur-jalur biosintetik (biosynthetic pathways) digunakan oleh semua makhluk hidup dalam memproduksi metabolit yang esensial untuk kelangsungan hidup dan pertahanan dirinya. Metabolit primer digunakan untuk pertumbuhan dan kelangsungan hidup seperti lemak, DNA, protein dan karbohidrat. Sedangkan metabolit sekunder diproduksi oleh organisme sebagai respon terhadap lingkungannya (Murniasih 2005). Kerang mas ngur (Atactodea striata) diduga memiliki metabolit sekunder karena secara tradisional telah
terbukti kemanjurannya, sehingga dapat dimanfaatkan sebagai substansi aktif dalam bidang obat-obatan.
Beberapa penelitian telah dilakukan untuk mengetahui senyawa bioaktif dari kerang mas ngur (Atactodea striata). Makkasau (2001) menemukan lima jenis asam lemak yang terdapat pada kerang Atactodea striata yaitu asam 9-oktadekenoat (asam oleat); asam 9-9-oktadekenoat-12 asetil oksi, metil ester; asam heksadekanoat (asam palmitat); asam 11-oktadekenoat, metil ester (metil-11-oktadekenoat); dan asam oktadekanoat (asam stearat). Selaian itu, Feri (2003) melaporkan bahwa ekstrak metanol, kloroform, diklorometana dan etil asetat Atactodea striata mampu menghambat pertumbuhan bakteri Staphylococcus
aureus. Ekstrak diklorometana dan n-heksana mampu menghambat pertumbuhan
bakteri Diplococcus pneumonia, fraksi A, B, C, D, F, G, H ekstrak diklorometana mampu menghambat bakteri S. aureus, fraksi B, D, F, G ekstrak diklorometana mempunyai kandungan kimia terpenoid. Selanjutnya, Yang et al. (2003) menemukan glutathione S-transferase (GST) isoenzim baru dari cytosol hepatopankreas Atactodea striata dengan berat molekul 24 kDa - 48 kDa. Enzim yang dipurifikasi, memperlihatkan aktivitas yang tinggi terhadap 1-chloro-2,4-dinitrobenzene (CDNB), 7-chloro-4-nitrobenzo-2-oxa-1,3-diazole (NBD-CL).
3
untuk penemuan obat kanker. Topoisomerase terdiri dari 2 tipe yaitu topoisomerase I yang berperan dalam relaksasi supercoiled DNA dan memutus single stranded DNA; dan topoisomerase II yang berperan dalam relaksasi pada
pemutusan double stranded DNA (TopoGen 2006).
Mengingat inhibitor topoisomerase sebagai salah satu target molekul antikanker terutama dalam pencarian obat kanker maka penelitian ini diharapkan dapat menemukan obat antikanker yang dapat disediakan dalam bentuk “nutraceutical” karena kerang memiliki nilai gizi tinggi. Adapun road map penelitian kerang mas ngur (Atactodea striata) dapat dilihat pada Gambar 1. 1.2 Perumusan Masalah
Salah satu obat tradisional yang telah lama dikenal oleh masyarakat di Kei Maluku Tenggara sebagai obat penyakit kuning adalah kerang mas ngur (Atactodea striata). Namun komposisi kimia dan aktivitas biologis bahan yang dikandung kerang ini belum diketahui, sehingga perlu dilakukan penelitian komposisi kimia dan aktivitas inhibitor topoisomerase I dari kerang mas ngur (Atactodea striata).
1.3 Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengetahui kandungan gizi kerang mas ngur (Atactodea striata) dan menemukan senyawa kimia yang memiliki aktivitas inhibitor topoisomerase I. Hasil penelitian ini dapat memberikan kontribusi pada bidang perikanan khususnya eksploitasi sumber daya laut non ikan sebagai produk nutraceutical.
1.4 Hipotesis
Gambar 1. Road map penelitian komposisi kimia dan aktivitas inhibitor topoisomerase I dari Atactodea striata
Mas ngur (Atactodea striata)
Waranmaselembun (2007) Komposis Kimia dan Aktivitas Inhibitor Topoisomarase I Kepah Atactodea striata
Makkasau (2001) Asam Lemak Utama
Atactodea striata
Tude Bombang (Atactodea striata) Fery (2003)
Aktivitas Antibakteri
Atactodea striata
Yang et al. (2003) Glutathione S-transferase (GST)
Analisa Komposisi Kimia : - Air - Lemak - Abu - Serat Kasar - Protein - Karbohidrat
Ekstraksi
Heksana E. Asetat Metanol
Analisa asam amino
Uji inhibitor topo I Ekstrak kasar
Karakterisasi : - Uji Ninhidrin - Uji Molish
- Uji Lieberman Burchard - Uji Bradford
Ekstrak aktif
Isolasi senyawa ekstrak aktif
Uji senyawa kimia : - Alkaloid
- Steroid - Terpenoid - Saponin
2 TINJAUAN PUSTAKA
2.1 Deskripsi Kerang Mas Ngur (Atactodea striata)
Menurut Deker dan Orlin (2000), klasifikasi kerang mas ngur (Atactodea striata) sebagai berikut :
Kingdom : Animal
Filum : Molusca
Klas : Bivalvia (bivalves and clams) Subklas : Heterodonta
Ordo : Veneroida
Sub Famili : Mactroidea
Famili : Mesodesmatidae
Genus : Atactodea
Spesies : Atactodea striata (Gmelin 1791)
Bivalvia umumnya berbentuk simetris bilateral dan pipih lateral. Cangkang terdiri atas 2 katup, satu pada tiap sisinya. Kedua katup tersebut dihubungkan oleh ligamen di bagian dorsal, terkunci satu sama lainnya dengan gigi engsel dan ditutup oleh otot eduktor. Tubuhnya diselubungi oleh dua cuping mantel yang berbentuk cangkang. Bagian kepala tidak jelas, tidak mempunyai mata atau sungut (Matsuura et al. 2000).
Menurut Sunarto (2001), ada 6 jenis kerang yang biasa dijumpai di pasir pantai pulau-pulau karang di Indonesia, yaitu Latona faba (Gmelin, 1791), Gafrarium tumidum (Roding, 1798), Asaphis violascens (Forskal, 1775),
Atactodea glabrata (Gmelin), Atactodea striata (Gmelin) dan Davila plana
(Hanley). Dari ke enam jenis kerang tersebut di atas, tiga jenis yang disebutkan terakhir adalah jenis kerang yang biasa disebut dengan nama "remis" dan termasuk dalam Suku Mesodesmatidae (Moluska: Pelecypoda).
Atactodea striata merupakan salah satu jenis kerang-kerangan yang
membenamkan diri. Kerang memiliki pelindung tubuh yang lunak berupa cangkang yang mengandung zat kapur. Tubuh biasanya tersimpan dalam cangkang sehingga tidak tampak dari luar. Dalam keadaan aman, tubuhnya dijulurkan keluar dan bagian tubuh yang pertama kali tampak adalah kakinya yang digunakan untuk berjalan (merayap) atau berenang. Kerang ini disebut juga bivalis karena kedua cangkangnya menyatu. Cangkangnya tipis, keras, berwarna putih kekuning-kuningan dengan ukuran antara 1 sampai 3,5 cm (Moka 1982).
Menurut Moka (1982), kerang laut Atactodea striata memiliki nama daerah sebagai berikut : kepah (Indonesia), tude bombang (Makasar), kasii (Bima), seasea (Mandar), baje bombang (Bugis). Sedangkan di daerah Kei Maluku Tenggara dikenal dengan nama mas ngur.
2.1.1 Bentuk Cangkang
Bentuk cangkang kerang biasanya erat hubungannya dengan tempat hidup/substrat di mana kerang tersebut hidup. Pada umumnya cangkang yang berbentuk segitiga dan bagian depan (anterior) lancip akan lebih mudah menembus atau membenamkan diri ke dalam substrat (Sunarto 2001).
7
Gambar 2 Jenis-jenis remis (Sunarto 2001)
2.1.2 Habitat
Habitat remis adalah pasir putih yang terdapat di pantai sekeliling pulau-pulau karang. Biasanya pantai pulau-pulau-pulau-pulau karang mempunyai lebar antara 2 dan 8 meter dan mempunyai kemiringan antara 5° dan 10°. Pantai berpasir ini pada umumnya terendam air pada waktu pasang dan terkena sinar matahari pada waktu air surut di siang hari. Pada waktu panas matahari terik dan air surut, suhu pasir di pantai pulau-pulau karang ini cukup tinggi, dapat mencapai 35°C. Inilah suatu keistimewaan remis, mereka hidup dan berkembang biak dengan baik pada habitat yang bersuhu cukup tinggi dan kekeringan selama air surut (Sunarto 2001).
2.1.3 Penyebaran
Menurut Sunarto (2001), remis di pasir pantai pulau-pulau karang dapat dibagi menjadi tiga penyebaran, yaitu penyebaran horizontal (penyebaran
memanjang pantai), penyebaran lateral (penyebaran melintang pantai) dan penyebaran vertikal (penyebaran kedalaman).
(1) Penyebaran memanjang pantai (Penyebaran horizontal)
Penyebaran memanjang pantai ialah penyebaran yang dilihat dari potongan memanjang suatu garis pantai (sepanjang pantai yang mengelilingi suatu pulau). Dari penyebaran ini terlihat bahwa remis menyebar tidak merata sepanjang pantai. Ada daerah yang padat populasinya dan ada daerah yang rendah populasinya. Ini mungkin erat kaitannya dengan banyak atau sedikitnya makanan di sepanjang pantai tersebut.
(2) Penyebaran melintang pantai (Penyebaran lateral)
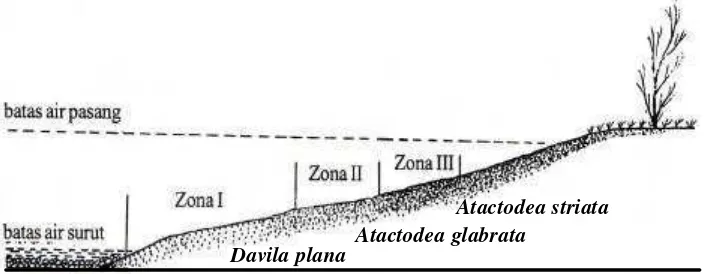
Penyebaran melintang ialah penyebaran dari batas air pada waktu surut sampai dengan pasir yang berbatasan dengan semak. Dilihat dari susunan pasir dan besarnya butiran pasir, pantai pulau karang dapat dibagi menjadi 3 zona, yaitu zona I adalah daerah berpasir kasar yang susunan pasirnya tidak padat dan berbatasan dengan air laut pada waktu air surut; zona II adalah daerah di atas zona I, berpasir relatif lebih halus dan susunan pasirnya lebih padat dari pada zona I; dan zona III adalah daerah di atas zona II sampai dengan berbatasan dengan semak, berpasir halus dan susunan pasirnya padat sehingga agak keras untuk ditembus (Gambar 4).
Masing-masing jenis kerang menempati zona yang sesuai dengan bentuk cangkangnya. Davila plana yang mempunyai bentuk anterior lebih pendek menempati zona I, Atactodea glabrata menempati zona II dan ada juga yang menempati zona I terutama yang masih kecil-kecil. Hal ini mungkin disebabkan karena kemampuan mereka untuk menembus substrat masih kurang kuat sehingga memilih hidup di zona I. Atactodea striata yang cangkang lebih tipis dan mempunyai garis-garis konsentris lebih dalam menempati zona III.
(3) Penyebaran kedalaman (Penyebaran vertikal).
9
glabrata dan Atactodea striata yang menghuni zona yang susunan pasirnya padat
rata-rata dapat membenamkan diri antara 0-4 cm.
2.1.4 Cara Membenamkan Diri ke Dalam Pasir
Remis membenamkan diri ke dalam pasir dengan menggunakan otot kaki. Bila remis tersebut diambil dari dalam pasir dan diletakkan di atas pasir, maka tidak lama kemudian remis tersebut akan berusaha untuk masuk kembali (membenamkan diri) ke dalam pasir. Mula-mula kakinya dikeluarkan dari dalam cangkang, lalu kaki tersebut berusaha untuk menggapai pasir yang ada di bawahnya. Setelah kaki tersebut masuk ke dalam pasir, dengan membengkokkan dan mengerutkan ujung kakinya yang berada di dalam pasir, kerang tersebut berusaha untuk tegak. Setelah tegak, kakinya dimasukkan lagi lebih dalam ke dalam pasir dan mengulang gerakan-gerakan seperti yang disebutkan di atas sehingga seluruh cangkangnya masuk ke dalam pasir. Untuk mempermudah pekerjaan tersebut, remis biasanya menunggu air laut pasang karena pada waktu air pasang kepadatan pasir relatif lebih gembur. Karena cangkangnya yang pipih dan bentuknya segi-tiga, kerang dari Suku Mesodesmatidae ini dapat membenamkan diri lebih cepat dibandingkan dengan kerang dari suku yang lain (Sunarto 2001).
2.2 Kandungan Senyawa Bioaktif Kerang Laut
Invertebrata laut yang mempunyai struktur pergerakan fisik lebih terbatas dibanding dengan vertebrata laut, mampu mengembangkan sistem pertahanan diri dengan memproduksi senyawa kimia (chemical defense). Lingkungan laut sangat mempengaruhi keaktifan dari metabolit sekunder yang dihasilkan oleh biotanya.
Gambar 4 Penampang melintang pantai pasir pulau karang tempat hidup remis (Sunarto 2001)
Davila plana Atactodea glabrata
Hubungan ekologi dengan keaktifan senyawa yang dihasilkannya dapat dibuktikan dengan melihat kecenderungan bahwa sumber terbesar substansi bioaktif berasal dari organisme laut di daerah tropik, khususnya daerah Indo Pasifik (Paul 1992).
Invertebrata laut merupakan produsen senyawa bioaktif terbesar diantara biota lainnya. Biota yang kaya dengan senyawa bioaktif adalah spons, cnidarians, bryozoa, tunicates dan algae (Ireland et al. 1988). Beberapa metabolit sekunder yang diproduksi oleh invertebrata laut dan mikroorganisme simbion, mempunyai prospek sebagai zat aktif untuk obat berbagai penyakit seperti infeksi, neurologi (parkinsons, alzheimer’s), penyakit jantung, immunologi, anti-inflammatory, antivirus dan antikanker (Murniasih 2005). Moluska laut merupakan sumber potensial dari senyawa-senyawa yang berperan untuk pengembangan agen-agen antimikroba baru (Benckendorff 2001) misalnya kahalalide F diisolasi dari moluska jenis Elysia rubefescens yang memiliki aktivitas sebagai antikanker usus dan prostat (Hamman et al. 1996).
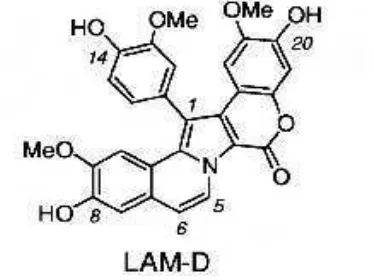
Facompre et al. (2003) melaporkan telah mengidentifikasi dan mengkarakterisasi potensi inhibitor topoisomerase I yang baru yang diberi nama lamellarin D (Gambar 5). Lamellarin D (LAM-D) diisolasi dari moluska laut subklas Prosobranchia yaitu Lamellaria sp dan merupakan senyawa alkaloid. Alkaloid ini diketahui memiliki aktivitas terhadap sel lestari tumor yang resisten terhadap berbagai obat dan sitotoksik yang sangat tinggi terhadap sel kanker prostat.
11
Yang et al. (2003) telah menemukan glutathione S-transferase (GST) isoenzim baru dari cytosol hepatopankreas Atactodea striata dengan berat molekul dari enzim yang dideterminasi dengan SDS-PAGE electrophoresis adalah sebesar 24 kDa dan dengan kromatografi gel sebesar 48 kDa. Enzim yang dipurifikasi memperlihatkan aktivitas yang tinggi terhadap 1-chloro-2,4-dinitrobenzene (CDNB) dan 7-chloro-4-nitrobenzo-2-oxa-1,3-diazole (NBD-CL). Fungsi penting GST adalah sebagai pelindung dalam mereduksi racun dari bahan organik hidroperoksida (Edwards et al. 2000).
Makkasau (2001), beberapa penelitian telah berhasil mengisolasi peptida bioaktif dari kerang Elysia rufescens yaitu kahalalida A, B, C, D, E, F, dan G. Beberapa dari kahalalida tersebut memiliki aktivitas biologi seperti, kahalalida A menunjukkan aktivitas dalam melawan virus herpes simpleks II (HSV II), kahalalida E menunjukkan aktivitas melawan HSV II pada konsentrasi 5 µg/ml, kahalalida F menunjukkan aktivitas terhadap AIDS.
Makkasau (2001) melaporkan bahwa kerang Atactodea striata mengandung senyawa steroid kelompok sterol yaitu β-Sitosterol. Selanjutnya hasil uji identifikasi kimia ekstrak metanol dan kloroform dari Atactodea striata positif mengandung alkaloid, saponin, steroid, dan terpenoid. Sedangka n ekstrak etil asetat positif mengandung alkaloid dan saponin, serta ekstrak n-heksana positif mengandung alkaloid dan steroid (Feri 2003).
2.3.1 Protein
Protein adalah sumber asam amino yang mengandung unsur-unsur C, H, O, dan N yang tidak dimiliki oleh lemak atau karbohidrat. Molekul protein juga mengandung fosfor, belerang, dan unsur logam seperti besi dan tembaga (Winarno 1997).
Protein merupakan makromolekul yang paling melimpah di dalam sel dan menyusun lebih dari setengah berat kering pada hampir semua organisme (Lehninger 1993). Protein merupakan polipeptida dengan berat molekul berkisar antara kurang lebih 5.000 hingga 1 x 106. Beberapa protein dapat larut dalam air; sedangkan lainnya memerlukan larutan garam encer sebagai pelarutnya; dan lainnya, seperti keratin rambut dan kulit tidak dapat larut dalam semua sistem berair. Banyak protein telah dipecah dan dimurnikan berdasar atas ukuran molekul dan kelarutannya (Montgomery et al. 1993).
Fungsi utama protein bagi tubuh yaitu membentuk jaringan baru dan mempertahankan jaringan yang sudah ada. Secara garis besar fungsi protein yaitu sebagai enzim, alat pengangkut dan penyimpan, pengatur pergerakan, penunjang mekanis, pembangun sel-sel jaringan tubuh, pertahanan tubuh, bahan bakar dan pemberi tenaga, menjaga asam basa cairan tubuh, membuat protein darah, dan media perambatan impuls saraf (Nasoetion et al. 1994).
Protein adalah komponen yang sangat reaktif. Sisi rantai yang berupa asam-asam yang terikat dalam protein dapat bereaksi dengan gula pereduksi, polifenol, senyawa hasil oksidasi lemak, serta bahan yang ditambahkan, misalnya alkali (Muchtadi 1992).
Banyak protein yang telah diisolasi dalam bentuk kristal. Hidrolisis protein dengan asam atau basa menghasilkan suatu campuran asam amino bebas, unit pembangunnya. Tiap jenis protein menghasilkan campuran atau proporsi jenis-jenis asam amino yang khas setelah hidrolisis tersebut. Tidak semua protein memiliki ke 20 asam amino dalam jumlah yang sama , beberapa asam amino mungkin terdapat hanya satu kali per molekul di dalam protein tertentu dan yang lain mungkin terdapat dalam jumlah yang besar (Lehninger 1993).
13
keduanya yang dapat mengakibatkan kegagalan pertumbuhan ringan sampai suatu sindrom klinis berat yang spesifik. Keadaan tersebut tidak hanya dipengaruhi oleh intake makanan, tetapi juga oleh keadaan lingkungan seperti pemukiman, sanitasi
dan higiene, serta infeksi berulang yang pernah dialami tubuh (Effendi 2002). Kelebihan protein bisa menyebabkan obesitas karena makanan yang tinggi protein biasanya tinggi lemak. Selain itu, kelebihan protein menyebabkan asidosis, dehidrasi, diare, kenaikan amoniak darah, kenaikan urea darah, dan demam. Asam amino yang berlebihan akan memberatkan kerja ginjal dan hati yang harus memetabolisme dan mengeluarkan kelebihan nitrogen (Almatsier 2002).
Pembatasan konsumsi protein pada penderita penyakit hati dilakukan apabila pasien mengalami intoleransi protein. Kondisi ini biasanya ditemukan pada pasien koma hepatik. Konsumsi sumber protein selain daging, seperti sayuran dan produk susu, sangat dianjurkan. Sayuran dan produk susu mengandung amonia, metionin, dan asam amino aromatik (AAA) yang lebih rendah serta asam amino rantai cabang (BCAA) yang lebih tinggi dibandingkan dengan daging (Nelson et al. 1994).
Protein pangan adalah sumber utama asam amino yang dikonsumsi, baik sebagai protein atau sebagai asam amino bebas. Selama proses pengolahan, protein dapat berubah menjadi asam amino bebas yang selanjutnya menjadi senyawa amin. Jadi, senyawa amin merupakan komponen minor dalam makanan yang tersedia secara alamiah atau terbentuk selama proses pengolahan. Sebagian senyawa amin tersebut aktif secara fisiologis sehingga sering disebut amin bioaktif (bioactive amine). Pada umumnya, amin bioaktif terdapat di dalam bahan makanan dalam jumlah kecil dan biasanya tidak beracun. Tetapi, dalam makanan tertentu, terutama yang diolah dengan proses fermentasi, konsentrasi beberapa amin bioaktif meningkat sehingga dapat bersifat toksik jika dikonsumsi (Silalahi 2002).
amin bioaktif dapat terjadi apabila kadar amin toksik meningkat dalam makanan yang dikonsumsi dan efeknya dapat dipengaruhi oleh zat lain dan obat tertentu (Silalahi 1994). Pada kondisi normal, dalam tubuh tersedia suatu sistem penawar efek senyawa amin (detoksikasi amin), yaitu enzim-enzim monoamin oksidase (MAO), diaminoksidase (DAO), histamin metil transferase (HMT), dan histaminase dalam hati serta dinding usus. Enzim-enzim ini akan mengubah amin toksis menjadi bentuk yang tidak aktif. Tetapi, karena pengaruh zat lain atau kondisi seseorang, sistem detoksikasi tidak berfungsi, maka kepekaan orang tersebut meningkat dan keracunan amin toksis dapat terjadi (Silalahi 1997). 2.3.2 Karbohidrat
Serat pangan atau dietary fiber adalah karbohidrat dan lignin yang tidak dapat dihidrolisis (dicerna) oleh enzim percernaan manusia, dan akan sampai di usus besar (kolon) dalam keadaan utuh sehingga akan menjadi substrat untuk fermentasi bakteri yang hidup di kolon. Serat pangan dapat diklasifikasikan berdasarkan struktur molekul dan kelarutannya. Kebanyakan jenis karbohidrat yang sampai ke kolon tanpa terhidrolisis meliputi polisakarida yang bukan pati (non-starch polysaccharides/NSP), pati yang resisten (resistant starch/RS), dan karbohidrat rantai pendek (short chain carbohydrates/SC). Serat pangan yang larut sangat mudah difermentasikan dan mempengaruhi metabolisme karbohidrat serta lipida, sedangkan serat pangan yang tidak larut akan memperbesar volume feses dan akan mengurangi waktu transitnya (bersifat laksatif lemah). Monomer dari serat pangan (NSP) adalah gula netral dan gula asam, sedangkan lignin terdiri dari monomer aromatik. Gula-gula yang membentuk serat pangan yakni glukosa, galaktosa, xylosa, mannosa, arabinosa, rhamnosa, dan gula asam seperti mannuronat, galakturonat, glukoronat, serta 4-O-metil-glukoronat (Muir 1999).
15
mengurangi waktu transit isi kolon. Serat terlarut (seperti, xylosa dan arabinosa dari hemiselulosa) terfermentasikan hanya sedikit mempengaruhi volume feses di kolon. Serat terlarut mengurangi kadar gula sesudah makan dan memperbaiki profil insulin. Serat terlarut bersifat hipoglikemik melalui beberapa mekanisme. Peningkatan viskositas dalam saluran pencernaan dianggap sebagai faktor utama yang mempengaruhi kecepatan penyerapan glukosa. Dengan memperlambat waktu transit dari lambung ke usus halus, berarti mengurangi absorpsi zat gizi, yang juga terjadi karena tidak tersedianya pati dan gula akibat terjerat (Kritchevsky 1999).
Oligosakarida adalah karbohidrat sederhana, banyak dikonsumsi dalam bentuk minuman ringan, biskuit, gula-gula/bonbon, dan produk susu. Oligosakarida fungsional adalah polisakarida pendek dengan struktur kimia yang unik sehingga tidak dapat dicerna oleh enzim-enzim pada percernaan manusia. Jadi, seperti serat pangan, akhirnya akan sampai di dalam usus besar. Dengan demikian, akan merupakan media yang baik untuk pertumbuhan bakteri bifidobacteria yang menguntungkan di dalam usus besar (kolon), sehingga oligosakarida disebut sebagai probiotik (Tomomatsu 1994). Manfaat dari konsumsi oligosakarida ialah karena oligosakarida dapat meningkatkan populasi bifidobacteria dalam kolon. Dengan peningkatan jumlah bakteri ini, akan menekan pertumbuhan bakteri pembusuk yang merugikan, yakni Escherichia coli dan Streptococcus faecalis. Efek yang sama juga dapat dicapai dengan mengkonsumsi produk makanan yang mengandung bakteri asam laktat dalam keadaan hidup seperti yogurt, yang disebut probiotik. Bakteri asam laktat dan sejenisnya tahan terhadap asam lambung sehingga dapat sampai di kolon, dan selanjutnya akan menekan pertumbuhan bakteri yang merugikan (Muir 1999).
Oligosakarida yang dikonsumsi akan meningkatkan jumlah bakteri bifidobacteria. Selanjutnya, akan mencegah pertumbuhan bakteri patogen yang
oligosakarida (Bird 1999). Dengan terbentuknya zat-zat antibakteri dan asam maka pertumbuhan bakteri patogen seperti Salmonella dan E. coli akan dihambat. Bifidin, suatu antibiotik ya ng dihasilkan oleh Bifidobacteria bifidum, sangat efektif melawan Shigella dysenteria, Salmonella typhosa, Staphylococcus aureus, E. coli, dan bakteri lainnya (Topping 1999).
Konsumsi produk makanan yang mengandung bifidobacteria seperti yogurt (disebut sebagai probiotik), dapat menekan pertumbuhan bakteri patogen. Melalui pembentukan asam lemak pendek dalam jumlah yang tinggi dari oligosakarida oleh bifidobacteria, juga mencegah konstipasi dengan merangsang peristaltik usus melalui peningkatan kandungan air feses akibat adanya tekanan osmosis. Penurunan metabolit toksik oleh oligosakarida atau konsumsi bifidobacteria (probiotik) akan meringankan beban bahan toksis dalam hati yang berarti melindungi hati (Muir 1999). Bird (1999) melaporkan bahwa suplementasi oligosakarida sebanyak 4 gram per hari selama 25 hari akan mengurangi risiko kanker.
2.3.3 Asam Lemak
Asam lemak essensial terdiri dari asam lemak linoleat (LA) (18:2 n-6) dan linolenat (LNA) (18:3 n-3) yang juga termasuk omega-3. Omega-3 berantai panjang yang tidak essensial yakni asam lemak yang biasanya memiliki ikatan rangkap lebih dari dua (poly unsaturated fatty acid/PUFA) dan ikatan rangkap yang paling terakhir terdapat pada atom karbon ketiga dari ujung rantai asam lemak tersebut. Karena itu, sering disebut poly unsaturated fatty acids omega-3 (PUFA n-3) (Silalahi 2000a).
17
eicosapentaenoic acid (EPA) (20:5 n-3) dan docosahexaenoic acid (DHA) (22:6
n-3) (Johnson 2000).
Defisiensi asam lemak essensial LA atau AA (omega-6) akan menyebabkan gejala-gejala kulit bersisik, rambut rontok, diare, dan penyembuhan luka yang lama. Oleh karena itu, Food and Drug Administration (FDA) menganjurkan supaya formula makanan bayi harus mengand ung paling tidak 300 mg LA per 100 kalori, atau 2,7% dari total kalori sebagai LA. Air susu ibu (ASI) mengandung asam lemak essensial LA, LNA, dan non-esensial AA serta DHA. Dalam jaringan otak dan jaringan syaraf lain pada bayi yang berumur beberapa bulan pertama, terdapat akumulasi DHA. Hal ini diyakini bahwa anak yang diberi ASI akan lebih pintar dari pada yang tidak diberi ASI. Keseimbangan antara LA dan LNA pada bayi sangat menentukan untuk mengoptimalkan fungsi penglihatan dan pertumbuhan bayi (Johnson 2000).
Eicosapentaenoic acid (EPA) dan asam arahidonat (AA/omega-6) di dalam
menurunkan sintesa very low density lipoprotein (VLDL), walaupun tidak konsisten menurunkan kolesterol. Tetapi, konsumsi dalam jumlah yang tinggi (20 g/hari) omega-3 akan menurunkan kolesterol darah tanpa menurunkan high density lipoprotein (HDL). Sebaliknya, omega-6 akan menurunkan kolesterol
HDL (Simopoulos 1994).
2.4 Asam Amino
Setelah protein diubah menjadi asam-asam amino, maka dengan proses absorpsi melalui dinding usus, asam amino tersebut sampai ke dalam pembuluh darah. Proses absorpsi ini ialah proses transpor aktif yang memerlukan energi. asam-asam amino dikarboksilat atau asam diamino diabsorpsi lebih lamb at dari pada asam amino netral (Poedjiadi dan Supriyanti 2006). Tingkat penyerapan relatif masing-masing asam amino adalah asam amino rantai bercabang (valin, leusin, isoleusin) dan metionin lebih mudah diserap dari asam amino esensial lainnya. Asam amino esensial lainnya lebih mudah diserap dari asam amino nonesensial. Asam amino glutamat dan aspartat adalah yang paling lambat terserap (Linder 2006).
Asam amino merupakan komponen utama penyusun protein, dan dibagi dalam dua kelompok yaitu asam amino esensial dan non-esensial. Asam amino esensial tidak dapat diproduksi dalam tubuh sehingga sering harus ditambahkan dalam bentuk makanan, sedangkan asam amino non-esensial dapat diproduksi dalam tubuh. Asam amino umumnya berbentuk serbuk dan mudah larut dalam air, namun tidak larut dalam pelarut organik nonpolar (Suharsono 1970 dalam Sitompul 2004). Asam amino esensial merupakan pembangun protein tubuh yang harus berasal dari makanan atau tidak dapat dibentuk di dalam tubuh. Kelengkapan komposisi asam amino esensial merupakan parameter penting penciri kualitas protein (Astawa 2007).
19
Asam-asam amino esensial yang dibutuhkan oleh tubuh manusia ialah histidin, isoleusin, leusin, lisin, metionin, arginin, phenilalanin, treonin, triptofan, valin. Asam-asam amino esensial tersebut bagi anak-anak relatif besar dari pada orang dewasa (Poedjiadi dan Supriyanti 2006). Dari asam-asam ami no esensial tersebut banyak kebutuhan metionin yang dapat disubstitusi dengan sistin dan phenilalanin dengan tirosin atau sebaliknya, karena lintasan pembentukannya dari satu ke yang lain ada dalam tubuh manusia (Linder 2006).
Beberapa fungsi khusus asam amino diantaranya, triptofan merupakan pemula vitamin niasin, dan serotonin-metionin donor gugus metil untuk sintesis beberapa senyawa seperti kolin dan kreatin. Phenilalanin merupakan pemula tirosin dan keduanya membentuk tiroksin dan epinefrin, arginin, ornitin, sitrulin yang ikut berperan dalam sintesis urea dalam hati. Glisin dapat bersenyawa dengan bahan-bahan toksik dan menghasilkan senyawa tidak beracun untuk kemudian diekskresi. Glisin juga berperan pada sintesis porfirin dari hemoglobin dan juga merupakan konstituen asam glikolat. Histidin penting untuk sintesis histamin. Kreatin yang dibentuk dari arginin, glisin dan metionin, dengan fosfat membentuk kreatin fosfat. Glutamin dan asparagin yang merupakan cadangan gugus amino masing-masing dihasilkan oleh asam glutamat dan asam aspartat (Poedjiadi dan Supriyanti 2006).
Menurut Linder (2006), beberapa fungsi asam amino disamping untuk sintesis protein dan produksi energi adalah alanin berfungsi sebagai prekusor glukogenik, pembawa N dari jaringan permukaan untuk ekskresi N. Aspartat berfungsi untuk biosintesis urea, prekusor glikogenik dan pirimidin. Glutamat berfungsi sebagai produksi-antara dalam reaksi interkonversi asam amino, prekusor prolin, ornitin, arginin, poliamin, neurotransmiter α-aminobutirat (GABA), sumber NH3. Glisin merupakan prekusor biosintesis purin,
neurotransmiter. Histidin merupakan prekusor histamin. Lisin berfungsi untuk
crosslinking protein (seperti dalam kolagen dan elastin) biosintesis karnitin.
prekusor serotonin dan nikotinamid (vitamin B). Tirosin merupakan prekusor tirosin katekolamin, melanin dan tiroksin.
2.5 Ekstraksi Senyawa Biokatif
Prinsip ekstraksi suatu komponen dengan menggunakan pelarut adalah dengan sistem kepolarannya. Senyawa polar akan larut dalam pelarut polar, demikian juga senyawa non polar akan larut dalam pelarut non polar. Dalam suatu proses ekstraksi yang baik, pemilihan pelarut berdasarkan pada kemampuannya untuk mengekstraksi komponen yang diinginkan dalam jumlah besar dan melarutkan sesedikit mungkin komponen lain yang tidak diinginkan.
Metode ekstraksi tergantung pada polaritas senyawa yang akan diekstrak. Suatu senyawa menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda. Hasil ekstraksi yang diperoleh akan tergantung pada kandungan komponen yang terdapat pada sampel dan jenis pelarut yang dipakai. Prinsip kelarutan yang dipakai dalam metode ekstraksi ini adalah like dissolve like artinya pelarut polar akan melarutkan senyawa polar, sedangkan pelarut nonpolar akan melarutkan senyawa nonpolar (Khopkar 1990).
Proses ekstraksi yang umum digunakan ada tiga macam yaitu maserasi, refluks dan perkolasi. Pada dasarnya prinsip refluks disamakan dengan cara soxhlet karena menggunakan sistem pemanasan pada suhu tertentu. Ekstraksi dapat dilakukan menggunakan pelarut non polar (heksana, sikloheksana dan toluen), pelarut semi polar (kloroform, diklorometana, dietil eter dan etil asetat) dan dengan pelarut polar (metanol, etanol dan air). Ekstraksi dapat dilakukan secara bertahap dengan menggunakan satu jenis pelarut atau kombinasi beberapa pelarut (Houghton dan Rahman 1998 dalam Heryani 2002).
Pemilihan pelarut untuk proses ekstraksi tergantung dari sifat komponen yang akan diekstrak. Salah satu sifat yang penting adalah polaritas suatu senyawa. Suatu senyawa polar diekstrak dengan menggunakan pelarut polar, demikian juga untuk senyawa semi polar dan non polar. Derajad polaritas bergantung pada besarnya tetapan dielektrik, makin besar tetapan dielektrik makin polar pelarut tersebut (Houghton dan Rahman 1998 dalam Heryani 2002).
21
pelarut. Ketaren (1987) menyatakan bahwa jenis dan mutu pelarut yang digunakan sangat menentukan keberhasilan proses ekstraksi. Pelarut yang digunakan harus memenuhi persyaratan sebagai berikut : harus dapat melarutkan zat yang diinginkan, mempunyai titik didih yang cukup rendah, titik didihnya seragam, murah, tidak toksik dan tidak mudah terbakar.
Secara umum ekstraksi bertingkat dilakukan berturut-turut dimulai dengan pelarut nonpolar (kloroform atau heksana), lalu dengan pelarut yang kepolarannya menengah (etil asetat), kemudian dengan pelarut polar (metanol atau etanol). Dengan demikian akan diperoleh ekstrak awal (crude extract) yang mengandung berturut-turut senyawa nonpolar, kepolaran menengah dan polar (Hostettmann et al. 1997).
Alkaloid pada umumnya sebagai basa tidak larut atau larut sebagian dalam air, larut dalam pelarut non polar (heksana, tolue n dan sikloheksana), pelarut organik yang agak polar (kloroform, dietil eter, etil asetat) dan dalam larutan hidroalkohol. Sedangkan alkaloid dalam bentuk garam umumnya larut dalam air (polar) dan alkohol tetapi tidak larut dalam pelarut organik (Bruneton 1993).
Alkaloid lebih mudah diekstraksi oleh pelarut polar seperti air yang diasamkan, atau pada kondisi basa menggunakan natrium karbonat dan basa bebas. Filtrat yang diperoleh selanjutnya diekstraksi dengan pelarut organik seperti eter dan pelarut yang bersifat polar (Robinson 1995).
Steroid dan alkaloid terpenoid memiliki sifat sama seperti alkaloid lainnya, lebih mudah larut dalam pelarut polar (metanol, etanol) dalam suasana basa dari pada dalam suasana asam. Sebagian besar terpenoid dan steroid merupakan senyawa nonpolar dan karena itu dapat diekstraksi dari komponennya yang polar dengan menggunakan pelarut seperti benzena, eter, dietil eter, etil asetat yang bersifat semi polar (Robinson 1995).
2.6 DNA dan Inhibitor Topoisomerase
DNA Topoisomerase mempunyai fungsi penting dalam metabolisme DNA, kedua Topoisomerase I dan II secara luas berhubungan dengan kemoterapi kanker. Sejak tahun 1980-an enzim DNA Topoisome rase digunakan sebagai molekul target untuk pencarian dan penemuan obat antikanker yang rasional dan lebih selektif. Cara ini sangat baik untuk mengevaluasi senyawa bioaktif antikanker, bahan yang positif sebagai inhibitor topoisomerase menunjukkan aktivitas antikanker pada pengujian in-vivo (Cumming and Smith 1991; Pommier 1993).
Alasan enzim topoisomerase digunakan sebagai molekul target, antara lain : enzim DNA Topoisomerase adalah enzim yang mempunyai fungsi cukup penting dalam proses intraseluler dari sel kanker, antara lain berperan dalam proses replikasi, transkripsi, rekombinasi DNA dan proses proliferasi dari sel kanker (Pommier 1993). Umumnya mekanisme kerja antikanker berdasarkan atas gangguan pada salah satu proses esensial yang dapat menekan pertumbuhan atau proliferasi sel dengan mengganggu metabolisme sel kanker.
Enzim DNA topoisimerase (topo) I dan II adalah target molekuler dari beberapa zat antikanker yang potensial, dengan demikian inhibitor dari enzim ini potensial untuk obat antikanker. Pertumbuhan tumor dapat dihambat dan dijinakkan ke tahap dorman melalui pemblokiran proses angiogenesisnya. Angiogenesis adalah proses terbentuknya pembuluh darah baru dari pembuluh darah yang telah ada. Komponen antiangiogenesis mampu menurunkan laju pertumbuhan tumor/kanker. Dengan dihambatnya aktivitas enzim DNA topoisomerase oleh senyawa inhibitor, maka proses terjadinya ikatan antara enzim dengan DNA sel kanker semakin lama, sehingga akan terbentuk Protein Linked DNA Breaks (PLDB). Hal ini akan mengakibatkan terjadinya kerusakan DNA sel
kanker dan selanjutnya berpengaruh terhadap proses dalam sel khususnya proses replikasi, serta diakhiri dengan kematian sel kanker (Hsiang 1989 ; Joseph 1989).
23
flavonoid jenis lain seperti metiltrisetin mampu menghambat aktivitas enzim DNA topoisomerase sel kanker (Abdellatif 1996).
Enzim topoisomerase adalah enzim yang berperan dalam proses replikasi, transkripsi dan rekombinasi DNA dan juga proses proliferasi dan diferensiasi sel normal dan sel kanker. Enzim ini merupakan target bahan bioaktif yang me miliki aktivitas antikanker, karena dengan dihambatnya enzim DNA topoisomerase maka proses dalam sel akan terhenti dan akhirnya akan terjadi kematian sel tersebut (Andreas et al. 1995).
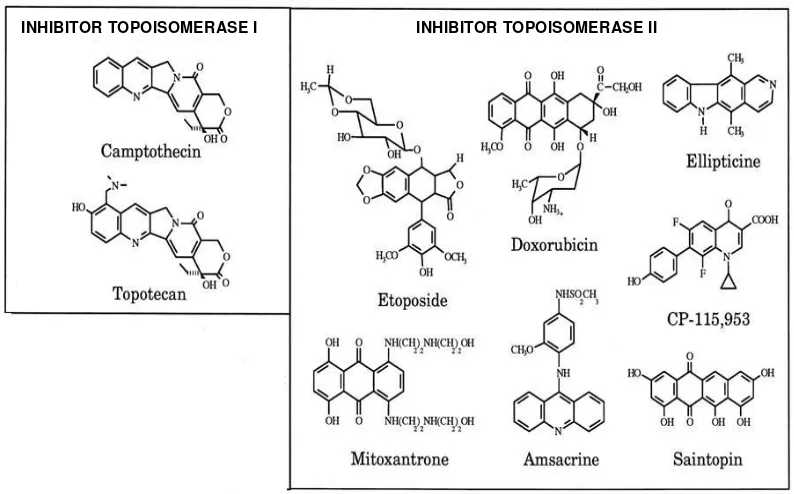
Menurut Ammon dan Osheroff (1995), bahan alam yang diisolasi dan bersifat antikanker serta memiliki molekul target enzim DNA topoisomerase antara lain camptothecin dari tanaman Camptotheca acuminata (Famili Nyssaceae), andriamycin, doxorubicin, mitoxantron dan etoposide VP-16),
teniposide (V-26) (Gambar 6).
Gambar 6 Struktur beberapa topoisomerase poison (Ammon dan Osheroff 1995)
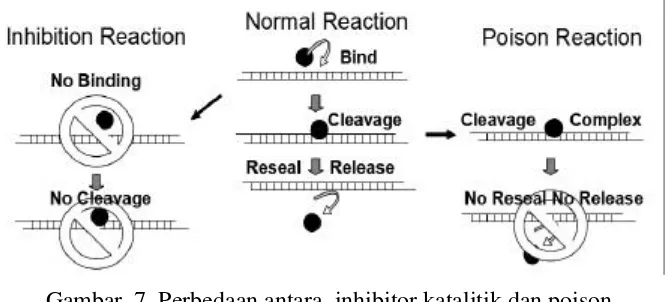
Aktivitas inhibisi terhadap kerja dari enzim DNA topoisomerase sebagai target obat antikanker melalui dua mekanisme yaitu penghambatan katalitik (catalytic inhibitor) dan poison (cleavable complex). Perbedaan mekanisme keduanya ditunjukkan pada Gambar 7.
Gambar 7 Perbedaan antara inhibitor katalitik dan poison (Topogen 2006).
Gambar 7 merupakan reaksi normal sekuen (diagram tengah) yang melibatkan pengikatan DNA dan diikuti oleh pembelahan DNA (untai tunggal maupun ganda) serta pelekatan kembali dan pelepasan enzim. Inhibitor (diagram kiri) memblokir tahap pengikatan awal atau dengan kata lain mengganggu kemampuan enzim untuk menggunakan DNA dalam pembelahan. Dalam hal ini, tidak ada relaksasi DNA atau dekantanasi DNA (hanya topo 2) ketika aktivitas katalitik diblok oleh obat. Topo poison (diagram kanan) bekerja pada tahap pembelahan yang menstabilkan kompleks pembelahan dan menghambat tahap pelekatan kembali. Dengan kata lain agen ini bertujuan “meracuni” reaksi melalui penstabilan pembelahan intermediet dan pemanjangan umur dari kompleks pembelahan (normalnya sangat pendek).
3 METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Desember 2006 sampai Juli 2007, bertempat di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan IPB, serta Laboratorium Kimia Pangan, Departemen ITP, IPB dan Laboratorium Balai Besar Penelitian dan Pengembangan Pascapanen Bogor. Sedangkan peta dan lokasi pengambilan sampel dapat dilihat pada Lampiran 1.
3.2 Bahan dan Peralatan
3.2.1 Bahan
Bahan-bahan yang digunakan dalam penelitian ini terdiri atas :
• Bahan baku yaitu kerang mas ngur (Atactodea striata) kering yang berasal dari Desa Ohoililir Kecamatan Kei Kecil Kabupaten Maluku Tenggara. • Bahan kimia untuk ekstraksi yaitu heksana, etil asetat, metanol, H2SO4 2M,
kloroform, KOH 10%, etanol (EtOH), dietil eter (Et2O), H2O, HCL 2N,
NaHCO3 jenuh, NaCl jenuh, Na2SO4, CHCl3, EtOAc, n-butanol.
• Bahan untuk uji inhibitor topoisomerase I yaitu drug screening kit topoisomerase I dari TopoGen dengan camptotechin sebagai kontrol positif. • Bahan untuk uji kelompok senyawa kimia (alkaloid, steroid, flavonoid, dan
saponin) yaitu amoniak, metanol 30%, etanol 30%, eter, pereaksi Lieberman Burchard, H2SO4 pekat, air. (protein, asam amino bebas, steroid dan
karbohidrat) yaitu pereaksi bradford, larutan ninhidrin, pereaksi Molish, asam sulfat pekat, kloroform, asam asetat anhidrid.
3.2.2 Peralatan
3.3 Metode Penelitian
Penelitian ini terdiri atas dua tahap. Tahap I meliputi analisa komposisi kimia, analisa asam amino, dan ekstraksi senyawa bioaktif dari kerang mas ngur (Atactodea striata). Tahap II meliputi pengujian inhibitor topoisomerase I, penentuan MIC ekstrak aktif, pengujian kelompok senyawa kimia (protein, asam amino bebas, karbohidrat, alkaloid, steroid, terpenoid dan saponin), isolasi golongan senyawa aktif inhibitor topoisomerase I.
3.3.1 Analisa Komposisi Kimia dan Asam Amino (AOAC 1995)
3.3.1.1 Analisa Komposisi Kimia Atactodea striata
Analisa komposisi kimia yang dilakukan meliputi kadar air, abu, lemak, protein, serat kasar, dan karbohidrat. Analisa komposisi kimia dilakukan di Laboratorium Kimia Pangan, Departemen ITP, IPB Bogor.
Analisa kadar air dilakukan dengan terlebih dulu memanaskan cawan (bersih) dalam oven pada suhu 102oC – 105oC selama 10-12 jam, kemudian dikeluarkan dan didinginkan dalam desikator selama 30 menit, lalu ditimbang (A). Selanjutnya, kedalam cawan dimasukkan 1-4 gram kerang Atactodea striata kering yang telah dihaluskan (diblender) lalu ditimbang (B). Kemudian dikeringkan dalam oven pada suhu 102oC - 105oC sampai beratnya konstan. Setelah itu, dikeluarkan dari oven dan didinginkan dalam desikator dan selanjutnya ditimbang (C). Kadar air dapat dihitung dengan rumus :
%
27
dihitung dengan rumus :
%
Analisa kadar lemak dilakukan dengan terlebih dulu labu soxhlet kosong (bersih) dikeringkan dalam oven selama 30 menit, didinginkan dalam desikator kemudian ditimbang (B). Sebanyak 2 gram (A) kerang Atactodea striata kering yang telah dihaluskan (diblender), dikeringkan dalam oven (105°C) terlebih dahulu selama ± 2 jam di atas kertas saring bebas lemak, Selanjutnya contoh yang sudah kering dibungkus dengan kertas saring kemudian diekstraksi. Lemak diekstrak menggunakan pelarut heksana selama 6 jam. Pemanasan labu soxhlet dilakukan dengan penangas air bersuhu 70°C - 80°C. Setelah waktu ekstraksi cukup, heksana yang tersisa dalam labu soxhlet diuapkan sampai habis di dalam oven 100°C, lalu didinginkan dalam desikator dan segera ditimbang hingga diperoleh berat konstan (C). Kadar lemak dapat dihitung dengan rumus :
%
Analisa kadar protein kerang Atactodea striata kering dilakukan dengan perhitungan total nitrogen secara semi-mikro Kjeldahl dan dikalikan dengan 6,25 (faktor konversi protein-nitrogen). Kerang Atactodea striata kering yang telah dihaluskan (diblender), ditimbang sebanyak 2 g kemudian dimasukkan ke dalam labu Kjeldhal 100 ml, dan ditambahkan tablet Kjeldahl 2 buah. Selanjutnya ditambahkan 15 ml H2SO4 lalu didestruksi selama ± 30 menit sampai diperoleh
cairan yang berwarna hijau jernih. Cairan didinginkan, kemudian ditambah akuades 5 ml dan dipindahkan ke tabung destilasi dengan hati-hati, lalu dibilas dengan akuades 5-10 ml. Selanjutnya ke dalam tabung destilasi ditambahkan sebanyak 10 - 12 ml larutan NaOH (60 g NaOH + 5 g Na2S2O35H2O dalam 100 ml akuades) sampai
ditampung dengan gelas erlenmeyer 125 ml yang berisi 10 ml larutan H3BO4 dan 2-3
tetes indikator campuran metil merah dan metil biru. Hasil destilasi kemudian dititrasi dengan larutan HCl 0,02 N sampai larutan berubah menjadi merah muda. Analisis blanko dilakukan seperti prosedur di atas tanpa menggunakan bahan yang dianalisa. Kadar protein dapat dihitung dengan rumus :
%
a = volume (ml) HCl untuk titrasi larutan contoh b = volume (ml) HCl untuk titrasi larutan blanko N = normalitas larutan HCl
14,007 = berat atom nitrogen
6,25 = faktor konversi protein-nitrogen untuk ikan dan produk sampingannya Perhitungan kadar serat kasar dilakukan dengan melarutkan sampel kering sebanyak 1 gram dengan 100 ml H2SO4 1,25%, kemudian dipanaskan hingga
mendidih dan di destruksi selama 30 menit. Selanjutnya disaring menggunakan kertas saring Whatman dan dengan bantuan corong Buchner. Residu hasil saringan dibilas dengan 20-30 ml air mendidih kemudian dengan 25 ml air sebanyak 3 kali. Residu didestruksi kembali dengan 100 ml NaOH 1,25% selama 30 menit. Lalu disaring dengan cara seperti di atas dan dibilas berturut-turut dengan 25 ml H2SO4 1,25% mendidih, 2,5 ml air sebanyak tiga kali dan 25 ml
alkohol. Residu berserta kertas saring dipindahkan ke cawan poselin dan dikeringkan dalam oven 130°C selama 2 jam. Setelah dingin residu beserta cawan porselin ditimbang (A), lalu dimasukkan dalam tanur 600°C selama 30 menit, didinginkan dan ditimbang kembali (B). Kadar serat kasar dapat dihitung dengan rumus :
W3 = bobot residu sebelum dibakar dalam tanur
29
Perhitungan kadar karbohidrat dilakukan menggunakan metode by difference, yaitu pengurangan 100 % dengan jumlah dari hasil analisis kadar air,
abu, protein, lemak, serat kasar. Perhitungannya adalah sebagai berikut :
3.3.1.2.Analisa Asam Amino Atactodea striata
Analisa asam amino meliputi asam amino esensial dan non esensial. Analisa asam amino ini dilakukan di Laboratorium Balai Besar Penelitian dan Pengembangan Pascapanen Bogor.
Sampel kerang Atactodea striata kering dianalisis lebih lanjut dengan metode High Performance Liquid Cromatography (HPLC). Sebelum digunakan, perangkat HPLC harus dibilas dulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan juga harus dibilas dengan aquades. Analisa asam amino dengan menggunakan HPLC terdiri atas 4 tahap, yaitu: (1) tahap pembuatan hidrolisat protein ; (2) tahap pengeringan; (3) tahap derivatisasi; (4) tahap injeksi serta analisis asam amino.
(1) Tahap pembuatan hidrolisat protein
Untuk preparasi sampel yaitu tahap pembuatan hidrolisat protein, sampel ditimbang sebanyak 0,1 g dan dihancurkan. Selanjutnya ditambahkan dengan HCl 6 N sebanyak 5-10 ml, kemudian dipanaskan dalam oven pada suhu 100 oC selama 24 jam. Selanjutnya dilakukan peni upan dengan gas nitrogen (N) untuk menghilangkan gas O2 sebelum diekstraksi. Hal ini
dimaksudkan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu kromatogram yang dihasilkan. Proses pemanasan dilakukan untuk mempercepat reaksi hidrolisis. Setelah pemanasan selesai, hidrolisat protein disaring dengan menggunakan milipore berukuran 45 mikron.
(2) Tahap pengeringan
Hasil saringan diambil sebanyak 10 µl dan ditambahkan dengan 30 µl larutan pengering. Larutan pengering dibuat dari campuran antara metanol, natrium asetat, dan trietilamin dengan perbandingan 2:2:1. Setelah Kadar karbohidrat (%) = 100% - % kadar (air + abu + protein + lemak +
100%
ditambahkan larutan pengering, dilakukan pengeringan dengan pompa vakum untuk mempercepat pengeringan dan mencegah oksidasi.
(3) Tahap derivatisasi
Larutan derivatisasi sebanyak 30 µl ditambahkan pada hasil pengeringan. Larutan derivatisasi dibuat dari campuran antar larutan metanol, pikoiotiosianat, dan trimetilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel. Selanjutnya dilakukan pengenceran dengan cara menambahkan 10 ml asetonitril 60% dan natrium asetat 1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali dengan menggunakan milipore berukuran 0,45 mikron.
(4) Injeksi ke HPLC
Hasil saringan diambil sebanyak 20 µl untuk diinjeksikan ke dalam HPLC. Untuk perhitungan konsentrasi asam amino pada bahan, dilakukan pembuatan kromatogram standar dengan menggunakan asam amino standar yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel. Kondisi alat HPLC saat berlangsungnya analisis asam amino :
Temperatur Kolom : 38oC
Jenis kolom : Pico tag 3.9 x 150 nm coulomb Kecepatan alir eluen : Sistem linier gradien (1 ml/menit)
Program : Gradien
Tekanan : 3000 psi
Fase gerak : Asetonitril 60 % dan Natrium asetat 1 M 40 %
Detektor : UV, 254 nm
Merk : Waters
Kandungan asam amino pada bahan dapat dihitung dengan rumus yaitu presentase asam amino dalam 100 g sampel :
31
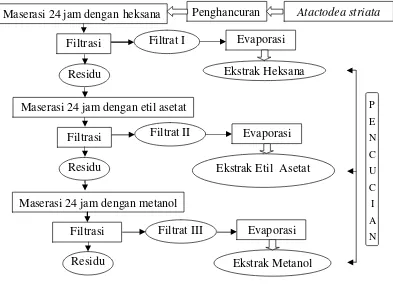
3.3.2 Ekstraksi Senyawa Bioaktif Atactodea striata (Harborne 1987)
Ekstraksi dilakukan dengan metode ekstraksi bertingkat yang dimodifikasi. Pelarut yang digunakan adalah heksana (non polar), etil asetat (semi polar) dan metanol (polar). Serbuk kerang mas ngur (Atactodea striata) ditimbang 50 gr, dimasukkan ke dalam erlenmeyer selanjutnya ditambah pelarut he ksana 100 ml, ditutup dengan alumunium foil agar pelarut tidak menguap, kemudian dimaserasi selama 24 jam. Setelah itu disaring dengan menggunakan kertas saring. Residu ditambah pelarut etil asetat 100 ml, ditutup alumunium foil, dimaserasi selama 24 jam, setelah itu disaring dengan menggunakan kertas saring. Residu ditambah pelarut metanol 100 ml, ditutup alumunium foil, dimaserasi selama 24 jam.
Masing-masing filtrat yang dihasilkan, dievaporasi dengan suhu yang sesuai dengan pelarut yang digunakan (± 40o
C) sampai terbentuk ekstrak yang berupa pasta. Selanjutnya ekstrak dari masing-masing pelarut disebut ekstrak he ksana, ekstrak etil asetat dan ekstrak metanol. Masing-masing ekstrak yang terbentuk kemudian dicuci dengan menggunakan masing-masing pelarut (he ksana, etil asetat, metanol) sebagai berikut :
1) Pelarut heksana ditambahkan pada ekstrak heksana, pelarut etil asetat pada ekstrak etil asetat, dan pelarut metanol pada ekstrak metanol. Perbandingan volume pelarut dan ekstrak adalah 2 : 1. Selanjutnya campuran dishaker selama 1 jam dan didiamkan selama 24 jam pada suhu 4oC.
2) Bila terdapat endapan maka lapisan atasnya di pipet. Selanjutnya di evaporasi sampai berbentuk pasta. Ekstrak dilarutkan dengan masing-masing pelarut kemudian didiamkan selama 24 jam pada suhu 4oC. Bila masih terdapat endapan maka di pipet lapisan atasnya dan di evaporasi, kemudian ditambahkan pelarut dan didiamkan 24 jam pada suhu 4oC. Proses pencucian ini dilakukan sampai tidak terdapat endapan, dengan demikian ekstrak yang diperoleh benar-benar telah bebas dari komponen-komponen lain yang ikut pada saat ekstraksi.