PENGARUH PENAMBAHAN NATRIUM SELENIT
TERHADAP KADAR SELENIUM DALAM KHAMIR
TERSELEKSI DARI TANAH VULKANIS
KEVIN YOGATAMA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
KEVIN YOGATAMA. Pengaruh Penambahan Natrium Selenit Terhadap Kadar
Selenium Dalam Khamir Terseleksi Dari Tanah Vulkanis. Dibimbing oleh ANNA
P.ROSWIEM, NOVIK NURHIDAYAT, ANA EDY PERSULESSY.
Selenium (Se) adalah suatu mikromineral essens ial, Se sangat berperan dalam
bidang medis karena dapat melindungi sel dari radikal bebas. Tanah pada daerah
pegunungan vulkanis mengandung unsur mineral tinggi berupa Se dan Sulfur (S).
Senyawa Se yang umum terdapat dalam tanah adalah dalam bentuk anorganiknya
yaitu selenat (SeO
4-2) dan selenit (SeO
3-2). Khamir yang hidup dalam tanah kaya
Se mempunyai kemampuan untuk mengakumulasi Se. Penelitian ini bertujuan
mengisolasi sel khamir tanah vulkanis Rinjani dan Kerinci, menentukan kadar Se
serta mengetahui pe ngaruh penambahan 1,0027 ppm natrium selenit (Na
2SeO
3)
terhadap kadar selenium yang terkandung dalam khamir.
Isolat-isolat hasil isolasi kemudian diseleksi dengan uji resistensi SeO
20,1 %
(b/v). Isolat terseleksi ditumbuhkan dan diperbanyak biomassanya dalam media
YM mengandung1 ,0027 ppm natrium selenit (Na
2SeO
3). Biomassa khamir
dipanen menggunakan metode sentrifugasi dan kandungan seleniumnya
ditentukan dengan metode
Graphite Furnace Atomic Absorption Spectrometry
(GF-AAS).
Sebanyak 10 isolat dapat diisolasi dari 10 sampel tanah vulkanis Rinjani dan
Kerinci. Empat isolat terseleksi dari 10 isolat karena dapat tumbuh baik pada uji
resistensi terhadap SeO
20,1 % (b/v). Keempat isolat tersebut adalah kode 15 dan
25s (berasal dari sampel tanah Kerinci) serta kode 39 4.3 dan 41b (berasal dari
sampel tanah TN.Rinjani) dengan kadar Se berturut-turut 2,2532 µ g; 2,1992 µ g;
0,4762 µ g; 0,6197 µ g. Uji ANOVA dan uji lanjut Duncan menunjukkan bahwa
penambahan Na
2SeO
31,0027 ppm memberikan pengaruh yang nyata terhadap
ABSTRACT
KEVIN YOGATAMA. Effect of Sodium Selenite Addition to Selenium
Compound In Selected Yeast Isolated From Volcanic Soil. Under direction of
ANNA P.ROSWIEM, NOVIK NURHIDAYAT, and ANA EDY PERSULESSY.
Selenium (Se) is an essential microelement such as to protect cell from free
radicals. Volcanic soil contain Sulfur (S) and Se. The inorganic selenium
compound most frequently found in water and soils are selenate (SeO
4-2) and
selenite (SeO
3-2). Yeast that grows in the soil containing Se has ability to uptake
Se. This work dealt with yeast isolation from Rinjani and Kerinci volcanic soil,
determination of Se compound. Moreover, addition of 1,0027 ppm sodium
selenite (Na
2SeO
3) to the yeast culture was also studied.
Ten yeast were isolated and purified from ten volcanic soil samples. These
isolates were subjects to SeO
2resistant test. Yeast biomass was harvested by
centrifugation method and processed to Se determination using
Graphite Furnace
Atomic Absorption Spectrometry
GF-AAS.
Four selected isolates were able to grow in the medium containing 0,1 % (w/v)
SeO
2. However, their Se contain were vary. Isolate number 15 yield the highest
Se compound (2,2532 µ g) while isolate number 39 4.3 only yield 0,4762 µ g Se.
Analysis of Variance (ANOVA) and Duncan Test conclude that Na
2SeO
3PENGARUH PENAMBAHAN NATRIUM SELENIT
TERHADAP KADAR SELENIUM DALAM KHAMIR
TERSELEKSI DARI TANAH VULKANIS
KEVIN YOGATAMA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Pengaruh Penambahan Natrium Selenit Terhadap Kadar Selenium
Dalam Khamir Terseleksi Dari Tanah Vulkanis
Nama
: Kevin Yogatama
NIM
: G44101018
Disetujui
Komisi P embimbing
Dr. Anna Priangani Roswiem, M.S.
Ketua
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131 473 999
Tanggal Lulus :
Dr. Novik Nurhidayat
Anggota
PRAKATA
Alhamdullilah, puji syukur penulis haturkan kepada Allah SWT yang telah
memberi rahmat, karunia dan petunjuk-Nya dalam menyelesaikan penelitian yang
berjudul Pengaruh Penambahan Natrium Selenit Terhadap Kadar Selenium Dalam
Khamir Terseleksi Dari Tanah Vulkanis.
Penulis ingin mengucapkan terima kasih kepada Ibu Dr. Anna P.Roeswim
M.S, Bapak Dr. Novik Nurhidayat dan Bapak Ana Edy Persulessy M.Eng yang
telah membimbing selama penelitian dan penulisan skripsi. Selain itu penulis juga
ingin mengucapkan terima kasih kepada Puslit Mikrobiologi Kebun Raya Bogor
dan Puslit Kimia Bandung yang telah memberikan tempat dan biaya penelitian,
Teh Ratih, Ibu Hartin, Pak Indarto, Ibu Fitri, Mas Oman, Pak Effendi, Teh Tina,
Ibu Linar, Teh Indah, Teh Rina, Ibu Yayah sekeluarga, Bang Jay, Mas Arif dan
Rental, Heru, Woro, Esti, Datasena, Aji, Syeda serta rekan-rekan biokimia 38 dan
39 seperjuangan yang tak bisa disebut satu persatu. Keluargaku, Ibu dan Bapak
tercinta, adikku Susan tersayang, atas segala bentuk perhatian, doa, dorongan dan
kasih sayang yang selalu diberikan setiap waktu.
Akhirnya penulis berharap semoga karya ilmiah ini dapat memberikan
kontribusi, informasi dalam bidang ilmu pengetahuan dan untuk acuan penelitian
selanjutnya. Amin
Bogor, April 2006
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada 22 Desember 1982 dari Bapak
Rinto Pamudji dan Ibu Suheni Tri Panulu. Penulis merupakan putra pertama dari
dua bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 5 Semarang dan pada tahun
yang sama diterima lulus seleksi IPB melalui jalur Undangan Seleksi Masuk IPB
pada Departemen Biokimia, Fakultas Matematika dan Ilmu Pengeta huan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ...
ix
DAFTAR GAMBAR ...
ix
DAFTAR LAMPIRAN ...
x
PENDAHULUAN...
1
TINJAUAN PUSTAKA
Khamir ...
1
Selenium ...
2
Metabolisme Se lenium ...
3
Spektrofotometri Serapan Atom (AAS) ...
4
Graphite Furnace AAS (GF-AAS) ...
5
Kelebihan Teknik GF-AAS ...
6
Modifier Kimia ...
6
Destruksi Sampel ...
6
BAHAN DAN METODE
Alat dan Bahan ...
6
Metode ...
6
HASIL DAN PEMBAHASAN
Isolasi dan Pemurnian Khamir ... 9
Uji Resistensi SeO
2... 9
Penentuan Waktu Inkubasi Terbaik... 9
Produksi dan Panen Biomassa Sel... 11
Penentuan Kurva Standar ... 11
Penentuan Kadar Selenium ... 12
SIMPULAN DAN SARAN
Simpula n... 14
Saran ... 14
DAFTAR PUSTAKA ... 14
DAFTAR TABEL
Halaman
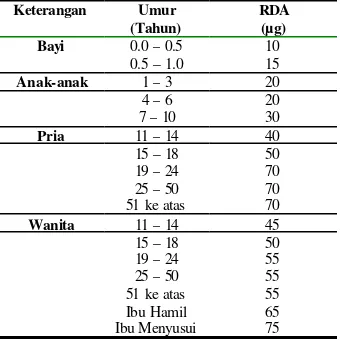
1 Dosis Asupan Se pada Manusia ... 3
2 Data Penentuan Kadar Se Media YM ... 14
DAFTAR GAMBAR
Halaman
1 Kurva pertumbuhan khamir ... 2
2 Metabolisme selenit, selenat, selenometionin ... 4
3 Skema blok GF-AAS ... 5
4
Hollow Cathode Lamp
(HCL)... 5
5 Bentuk
Graphite Tube
... 5
6 Monokromator ... 6
7 Absorbansi uji resistensi SeO
20,1 % ... 10
8 Morfologi mikroskopis khamir ... 10
9 Kurva pertumbuhan isolat 15 ... 10
10 Kurva pertumbuhan isolat 25s ... 10
11 Kurva pertumbuhan isolat 39 4.3 ... 10
12 Kurva pertumbuhan isolat 41b ... 11
13 Biomassa khamir ... 11
14 Biomassa kering pelet ... 12
15 Persentase penurunan biomassa ... 12
16 Konsentrasi Se ...
13
DAFTAR LAMPIRAN
Halaman
1 Tahap penelitian ... 17
2 Sampel tanah Kerinci dan Rinjani... 18
3 Tahap isolasi khamir ... 18
4 Hasil isolasi khamir ... 19
5 Tahap uji resistensi SeO
20,1 % ... 19
6 Absorbansi uji resistensi SeO
20,1 % ... 20
7 Isolat terseleksi uji resiste nsi SeO
20,1 % ... 20
8 Optimasi GF-AAS... 20
9 Kondisi GF-AAS... 21
10 Penentuan kadar Se ...
22
11 Kurva standar dan analisis media YM ... 23
12 Kurva standar penentuan kadar Se ... 24
13 Kurva standar penentuan kadar Se pengenceran 2 ... 24
14 Perhitungan-perhitungan ... 25
PENDAHULUAN
Penyakit kanker telah banyak menjangkiti sebagian besar penduduk dunia, jumlah penderita kanker dunia terus bertambah 6,25 juta orang setiap tahunnya (Laksmi 2001). Selenium (Se) adalah suatu mikromineral essensial, bermanfaat dalam dosis rendah namun bersifat toksik pada dosis tinggi, Se sangat berperan dalam bidang medis karena dapat tergabung dalam protein untuk membentuk selenoprotein yaitu suatu enzim antioksidan. Kemampuan antioksidan ini dapat melindungi sel dari radikal bebas yang menyebabkan penyakit kronis seperti kanker, penyakit jantung dan lain -lain. Se juga berperan dalam sistem pertahanan tubuh (Slavica 2004).
Kandungan Se dalam tubuh sebanding dengan asupannya dalam makanan (Slavica 2004). Asupan Se didapat dari bahan makanan berprotein seperti daging, ikan; bahan makanan nabati seperti sereal, biji-bijian; bawang putih, bawang merah, brokoli dan jamur (mushroom). Kandungan Se dalam bahan makanan nabati bervariasi ses uai dengan jenis lahan tanamnya (Linder 1992). Salah satu sumber asupan Se yang sedang berkembang dan banyak diteliti adalah khamir yang diperkaya Se (Lobinski 2000; Spallholz 2001; Combs dalam Dumont 2006).
Fungi unisel atau lebih dikenal sebagai khamir merupakan salah satu mikroorganisme sumber mineral Se. Khamir dapat mengakumulasi Se seperti halnya tanaman dengan menggantikan unsur sulfur (S) (Dumont 2006). Sejumlah besar senyawa Se
organik yang t elah diidentifikasi pada khamir yaitu selenometionin, selenosistein , Se-metilselenosistein (seleno asam amino
dimana gugus S digantikan dengan Se); senyawa Se anorganik berupa selenat dan selenit (Lobinski. 2000). Khamir yang hidup dalam tanah kaya Se mempunyai kemampuan untuk menyerap dan mengakumulasi Se (Beatriz 1997) . Senyawa Se yang umum terdapat dalam tanah adalah dalam bentuk anorganiknya seperti selenat (SeO4-2) dan
selenit (SeO3-2) (Pyrzynska 1998). Kadar Se
dalam tanah pada umumnya mencapai 0.02 – 2.5 mg/kg (Dumont 2006). Jenis tanah berkadar mineral tinggi terutama Se dan S adalah tanah yang berasal dari pegununga n vulkanis. Natrium selenit (N a2SeO3)
ditambahkan dalam media tumbuh khamir sesuai dengan kandungan alami senyawa Se dalam tanah (Ponce dalam Dumont 2006). Khamir yang diisolasi dari tanah vulkanis
diasumsikan dapat lebih banyak mengakumulasi Se dari habitatnya.
Kawasan Taman Nasional Rinjani dan Kerinci merupakan contoh daerah pegunungan vulkanis tertinggi di Indonesia, memiliki potensi pariwisata, riset dan pengembangan Ilmu Pengetahuan dan Teknologi (IPTEK). Fungsi pokok Taman Nasional (TN) berdasarkan UU no. 5 tahun 1990 tentang konservasi Sumber Daya Alam (SDA) hayati dan ekosistem adalah sebagai perlindungan sistem penyangga kehidupan, pengawetan keanekaragaman tumbuhan, satwa beserta ekosistemnya, pemanfaatan secara lestari SDA hayati dan ekosistemnya (Sutedi 2003). Tanah pada daerah pegunungan vulkanis yang mengandung unsur mineral tinggi berupa Se dan S akan berpengaruh terhadap organisme hidup dalam media tanah tersebut.
Beberapa fakta tersebut di atas mendasari pemikiran untuk dilakukan isolasi sel khamir yang berasal dari sampel tanah pegunungan vulkanis Rinjani dan Kerinci sehingga didapatkan isolat khamir vulkanis yang secara alami telah mengandung Se yang tinggi.
Telah dikenal beberapa metode dalam penentuan kadar Se, antara lain fluorometri, polarografi dan voltametri, hydride generation
(HG), graphite furnace atomic absorption spectrophotometry (GAAS) . T eknik G F-AAS memiliki limit deteksi rendah (1 ng) dan telah banyak digunakan untuk berbagai jenis sampel (Pohl 1991; Pyrzynska 1998).
Penelitian ini bertujuan mengisolasi, menyeleksi sel khamir tanah vulkanis Rinjani dan Kerinci, menentukan kadar Se serta mengetahui pengaruh penambahan Na2SeO3
terhadap kadar Se dalam khamir terseleksi . Hipotesis penelitian ini adalah sel khamir dapat diisolasi dari tanah vulkanis Rinjani dan Kerinci dan penambahan Na2SeO3 mampu
meningkatkan kadar Se dalam khamir terseleksi.
TINJAUAN PUSTAKA
Khamir
Khamir termasuk dalam golongan fungi unisel, bersama dengan jamur (mushroom)
2
lebih besar daripada kebanyakan bakteri, ukurannya berkisar lebar 1-5 µm dengan panjang hingga 5-30 µm, memiliki beraneka macam bentuk seperti telur (ovoid), bola (spheroid), silinder (cylindrical), lengkung (ogival), segitiga (triangular), botol (flask shapped), dan elips. Khamir tidak dilengkapi
flagellum maupun alat gerak lain (Pelczar 1986).
Khamir dapat lebih bertahan hidup pada keadaan lingkungan yang kurang menguntungkan jika dibandingkan mikroorganisme lain. Sebagai contoh khamir dan kapang dapat tumbuh dalam suatu substrat/medium mengandung konsentrasi gula tinggi yang dapat menghambat pertumbuhan kebanyakan bakteri. Khamir dan kapang umumnya dapat bertahan pada lingkungan yang lebih asam. Khamir bersifat fakultatif, artinya mampu hidup baik dalam keadaan aerobik maupun anaerobik meskipun kebanyakan khamir bersifat aerobik. Suhu optimum pertum buhan khamir berkisar antara 20–30 °C dengan pH optimum 4,5 -6,5 (Pelczar 1986).
Spesies khamir banyak terdapat pada kelas endomycetales (Ascomycetes), blastomycetes (Basidiomycetes) dan
ustomycetes (Deuteromycetes). Khamir yang merupakan fungi unisel memiliki banyak kegunaan untuk menghasilkan produk berupa asam organik, alkohol, antibiotik, pigmen, vitamin, enzim, aditif pada pembuatan bahan pangan seperti roti, kue, dan keju. Khamir juga dapat berperan sebagai penghasil prot ein sel tunggal (PST) yang bisa dikonsumsi manusia dan sebagai pakan ternak (Kurtzman 1998; Landecker 1996).
Jenis khamir yang digunakan dalam penelitian ini adalah khamir yang diisolasi dari tanah vulkanis yang kaya mineral Se dan S. Khamir yang hidup pada tanah kaya Se mempunyai kemampuan untuk menyerap dan mengakumulasi Se (Beatriz 1997). Senyawa Se yang umum terdapat dalam tanah adalah dalam bentuk anorganiknya yaitu selenat (SeO4-2) dan selenit (SeO3-2). Kadar Se dalam
tanah pada umumnya mencapai 40 mg/kg (Dilaga 1992). Penelitian ini menguji kemampuan khamir sebagai akumulator mineral Se. Mikroorganisme yang hidup di tanah kaya Se akan mengabsorbsi dan mengakumulasi Se (Beatriz 1997).
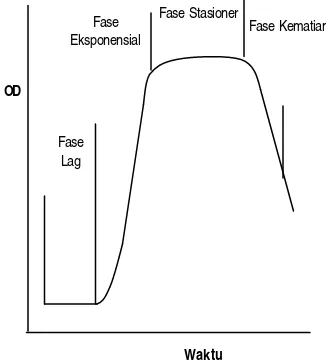
Kurva pertumbuhan khamir (Gambar 1) terbagi menjadi 4 fase yaitu fase lambat (lag), fase eksponensial (log), fase stationer dan fase kematian (Pelczar 1986). Fase Lag terjadi sebagai periode awal dari tingkat
pertumbuhan khamir secara eksponensial. Lama dan pola dari fase lag dipengaruhi oleh jenis khamir yang diidentifikasi, umur dari sel khamir sebelum diinokulasi dan komposisi medium. Pada fase ini terdapat dua periode adaptasi sel khamir terhadap lingkungannya yang baru dan periode persiapan sel untuk melakukan pembelahan.
Fase log merupakan kelanjutan dari fase lag ketika jumlah sel khamir meningkat secara eksponensial. Lama fase eksponensial dipengaruhi oleh komposisi media, temperatur inkubasi dan jumlah sel per unit volume.
Fase stasioner merupakan fase ketika jumlah sel relatif tetap. Hal ini disebabkan oleh dua faktor yaitu mulai menipisnya nutrisi dan akumulasi produk akhir yang cenderung bersifat toksik. Selama fase ini khamir cenderung membentuk spora dibandingkan dengan membentuk tunas yang membutuhkan energi lebih banyak. Fase kematian merupakan fase penurunan jumlah sel dikarenakan habisnya nutrisi dalam media tumbuhnya (Fiechter dalam Noviandi 2002).
Selenium
Selenium (Se) (dalam bahasa Yunani berarti dewi bulan : Selene) adalah senyawa kimia dalam sistem periodik unsur dengan nomor atom 34, terletak antara unsur sulfur (S) dan tellurium (Te) di golongan IVA dan antara arsen (As) dan brom (Br) di periode 4. Memiliki sifat-sifat kimia mirip unsur S dengan massa atom relatif 78,96; titik lebur 220,5 ºC dan titik didih 684,9 ºC. Unsur Se ditemukan pertama kali oleh Kimiawan Swedia Jons Jacob Berzelius tahun 1817 (Slavica 2004).
3
Selenium banyak terdapat di air, tanah serta makanan. Senyawa Se secara alami terdapat dalam berbagai tingkat oksidasi dan dibedakan menjadi dua yaitu senyawa Se anorganik dan senyawa Se organik. Bentuk
anorganik banyak terdapat dalam tanah dan air seperti selenat (SeO4-2) dan selenit
(SeO3-2). Beberapa bentuk senyawa Se
organik yang terdapat pada hewan, tumbuhan dan mikroorganisme yang langsung berikatan dengan karbon (C-Se) antara lain senyawa Se termetilasi (monometil selenol, dimetil
selenida, ion trimetil selenonium), seleno asam amino (selenosistein dan
selenometionin), enzim selenoprotein. (Pyrznska 1998).
Se berperan penting sebagai komponen pembentuk sisi aktif, selenol group (-SeH ) dari Glutation Peroksidase (GPx), Thioredoksin Reduktase (TR) dan selenoenzim lain. Efek pencegahan kanker sangat nyata terdapat pada garam Se anorganik, seleno asam amino, dan berbagai organo selenium sintetik (Lobinski 2000). Sejak tahun 1980 banyak dilaporkan bukti-bukti bahwa asupan Se yang ideal berupa selenit, selenat dan selenometionin dalam tubuh dapat mencegah pertumbuhan sel kanker (Spallholz 2001).
Sumber mineral Se terdapat pada makanan nabati seperti bulir padi, kacang-kacangan, dan bawang putih (Allium sativum); ikan, daging, ayam, telur. K andungan Se dalam makanan nabati tergantung pada kandungan Se yang terdapat dalam tanah lahan t anamnya (Linder 1992).
Se merupakan unsur khas yang bersifat toksik pada tingkat asupan tinggi dan menyebabkan gejala defisiensi bila asupan terlalu rendah. Terdapat tiga penyakit spesifik yang berkaitan dengan defiensi Se yaitu,
Keshan Disease (mengakibatkan turunnya fungsi hati dan jantung pada penderita anak-anak, Kashin Beck Disease (mengakibatkan osteoarthropaty), Myxedematous Endemic Cretinism (mengakibatkan lemah mental) (Cassaret 1986). Jumlah asupan Se disarankan rata-rata sebesar 40 µg per hari untuk dewasa (Combs dalam Dummont 2006). Perincian asupan Se (Tabel 1) yang dianjurkan oleh
World Health Organization (WHO) dalam
Recommended Dietary Allowance (RDA) untuk bayi, anak-anak, pria dan wanita adalah sebesar 10 – 75µg Se per hari (Dumont 2006). Kelebihan asupan Se juga akan berdampak buruk pada kesehatan yaitu menimbulkan kondisi yang disebut selenosis.
Tabel 1 Dosis asupan Se pada m anusia
Keterangan Umur (Tahun)
RDA (µg) Bayi 0.0 – 0.5 10
0.5 – 1.0 15
Anak-anak 1 – 3 20
4 – 6 20 7 – 10 30
Pria 11 – 14 40 15 – 18 50 19 – 24 70 25 – 50 70 51 ke atas 70
Wanita 11 – 14 45
15 – 18 50 19 – 24 55 25 – 50 55 51 ke atas 55 Ibu Hamil 65 Ibu Menyusui 75
Selenosis akan timbul pada daerah-daerah yang mengandung kadar Se tinggi dalam tanah (lebih dari 84 mg Se/kg) dan juga bila asupan per hari melebihi 400 µ g Se. Gejala-gejala selenosis diantaranya kerontokan rambut, kuku lepas, bercak-bercak putih pada kuku, nafas bau bawang put ih, kelelahan, iritabilitas, dan kerusakan syaraf ringan. (Dumont 2006 ).
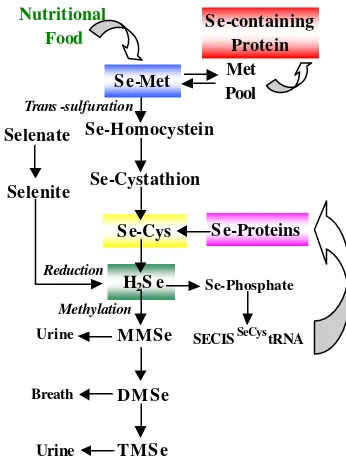
Metabolisme Se
Metabolisme Se tergantung pada bentuk struktur kimianya. Asupan senyawa Se anorganik berupa Na2SeO3 maupun Na2SeO4 mengalami siklus yang sama (Gambar 2). Selenit merupakan bentuk reaktif senyawa Se anorganik sehingga bila diberikan asupan Na2SeO4 maka akan direduksi terlebih dahulu
menjadi Na2SeO3. Selenit yang terbentuk bereaksi dengan Glutation (GSH) yang merupakan substrat utama enzim antioksidan GPx menjadi selenodiglutation (GSSeSG) dan direduksi oleh enzim glutation reduktase menjadi glutationilselenol (GSSeH). Kedua senyawa intermediet ini merupakan perantara konversi selenit menjadi hidrogen selenida (H2Se).
Senyawa Se organik berupa seleno asam amino juga akan dikonversi menjadi hidrogen selenida (H2Se). Selenometionin dapat
4
Gambar 2 Metabolisme selenit, s elenat, selenometionin (Dumont 2006)
menjadi selenosistein melalui serangkaian reaksi. Selenometionin diubah menjadi selenohomosistein kemudian selenocystation dan membentuk selenosistein. Selenometionin juga dapat langsung dikonversi menjadi monometil selenol (MMSe) melalui kerja enzim ?-liase. Selenosistein dikonversi menjadi H2Se melalui kerja enzim selenosistein ß-liase.
Dari penjelasan di atas dapat disimpulkan bahwa senyawa hidrogen selenida (H2Se)
merupakan kunci senyawa intermediet dalam proses metilasi oleh S-adenosil metionin (SAM) sebagai donor metil. Proses metilasi ini tak lain adalah proses detoksifikasi Se dalam hati. Tiga bentuk utama hasil proses metilasi adalah monometilselenol dan trimetilselenonium (TMSe) yang diekskresi via urin serta dimetilselenol (DMSe) via nafas (Nakamuro 2000; Slavica 2004). Senyawa hidrogen selenida (H2Se) juga dapat
dimetabolisme membentuk selenofosfat (prekursor selenosistein) sehingga dapat diubah kembali menjadi selenosistein (Slavica 2004).
Senyawa intermediet Se yang paling efektif sebagai chemoprevention agent adalah bentuk monometilselenol (MMSe) atau disebut anion metilselenida (CH3Se-). Se
berperan penting sebagai komponen pembentuk sisi aktif, gugus selenol (R-SeH ) terutama enzim Glutation Peroksidase (GPx) (Lobinski 2000; Spallholz 2001).
Menurut (Febtiana 2003), enzim antioksidan GPx adalah selenoenzim yang mengkatalisis reduksi hidroperoksida (ROOH) (Persamaan 1) dan hidrogen peroksida (H2O2) (Persamaan 2) dengan
kehadiran glutathion (GSH) sebagai substrat utamanya. GPx berbentuk tetramer dengan bobot molekul sebesar 94-100 KD dan memiliki 4 sisi aktif. GPx merupakan enzim antioksidan yang dapat mereduksi senyawa radikal bebas dengan mengoksidasi GSH menjadi glutation disulfida (GSSG) (Persamaan 3). Pada reaksi ini terbentuk ikatan antara GSH dengan sisi aktif GPx (R-SeH). Adanya NADPH dan enzim glutathion peroksidase mengakibatkan GSSG direduksi kembali menjadi GSH dapat bereaksi kembali menetralkan efek radikal bebas dalam tubuh. Reaksi reduksi senyawa radikal bebas oleh GPx, ditulis :
R-SeH + ROOH R -SeOH + ROH (1) R-SeH + H2O2 R -SeOH + H2O (2)
R-SeOH + GSH R-Se-SG + H2O
R-Se-SG + GSH R-SeH + GSSG (3) Reaksi totalnya ditulis :
ROOH + 2 GSH ROH + H2O + GSSG
GSSG +NADPH 2GSH + NADP+
Spektro fotometri Serapan Atom (AAS)
Spektrofotometri atom adalah suatu teknik analisis kadar logam dan metaloid pada sampel-sampel biologis yang telah banyak digunakan karena mudah dan akurat berdasarkan absorpsi, emisi maupun fluoresensi radiasi cahaya λ tertentu (Price 1972). Spektro fotometri atom dibagi menjadi 3 jenis yaitu; serapan atom (AAS), emisi atom (AES) dan fluoresensi (AFS).
Sejarah spektrofotometri atom diawali oleh Herschel (1823) dan Talbot (1825) yang menemukan teknik emisi atom ketika atom tertentu diaspirasikan dalam nyala api. Pada tahun 1955, Walsh menggunakan lampu katoda untuk memberikan cahaya emisi λ tertentu dan mulai menggunakan nyala api untuk menghasilkan atom bebas (proses eksitasi). Instrumentasi dan aplikasi AAS terus berkembang sejak dekade 1950an (Slavin 1978).
AAS merupakan salah satu teknik spektrofotometri atom yang menggunakan prinsip penyerapan radiasi cahaya pada λ tertentu oleh atom-atom bebas logam yang akan dianalisis. Logam-logam dalam analit
Selenite
Selenate Se-Homocystein
H2S e
MMSe DMSe TMSe S e-Cys Se-Cystathion Se-Phosphate
5
1 2 3
7
4 5
6 Keterangan :
1. Sumber Cahaya (HCL) 2. Tempat Sampel 3. Monokromator 4. Detektor 5. Penguat Signal 6. Monitor 7. Pengolah Data
diberikan energi kalor (dengan metode Flame AAS atau Electrothermal AAS) sehingga membentuk atom bebas yang terkumpul menjadi uap atom (atomic vapor). Ketika cahaya pada ? yang sesuai berbenturan dengan atom bebas, atom akan menyerap cahaya dan kemudian tereksitasi dari keadaan energi dasarnya. Mekanisme inilah yang mendasari teknik AAS (Beaty 1993).
Graphite Furnace AAS (GF-AAS)
Pada penjelasan sebelumnya disebutkan bahwa dalam proses konversi logam analit ke bentuk atom bebasnya (atomisasi) dapat melalui Flame AAS (FAAS) dan Graphite Furnace AAS (GF-AAS). Teknik GF-AAS sering digunakan untuk analisis unsur-unsur logam dengan sensitivitas dan batas pendeteksian 20 sampai 1000 kali lebih baik dari pada teknik FAAS. Teknik GF-AAS menggunakan proses electrothermal heating
karena menggunakan pemanasan sampel terprogram dengan energi listrik berdasar pada prinsip yang sama seperti atomisasi nyala. Perbedaanya hanya terletak pada tempat pembakar sampel (burner) dalam nyala api digantikan dengan atomizer atau furnace yang dipanaskan dengan listrik. Dalam system pemanasan tersebut terdapat power supply dan
controller yang dapat diatur sedemikian rupa sehingga mengendalikan perubahan temperatur dalam atomizer tersebut (Programmed Heating Process) (Fuller 1977).
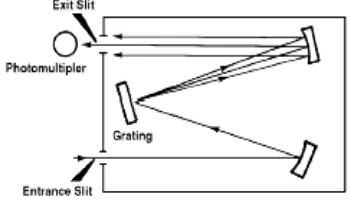
Menurut (Beaty 1993; Fuller 1977) terdapat tiga bagian utama dalam teknik GF-AAS yaitu sumber cahaya, tempat sampel dan alat pendeteksi serapan (Gambar 3).
Sumber cahaya yang digunakan dapat menggunakan Hollow Cathode Lamp (HCL) atau Electrodeless discharge lamp (EDL). Pada penelitian ini GF -AAS menggunakan HCL (Gambar 4). HCL adalah sumber cahaya yang memiliki garis spektrum terang dan jelas
Gambar 3 Skema blok GF-A A S
untuk setiap jenis unsur logam. Katoda lampu umumnya adalah Hollowed-out Cylinder
terbuat dari logam spesifik tempat penghasilan spektrum cahaya. Anoda dan Katoda terlapisi di dalam silinder kaca yang berisi gas neon atau argon bertekanan rendah. Pada ujung HCL terdapat jendela (Window) untuk memancarkan radiasi.
Tempat sampel dapat berupa burner
maupun atomizer. Dalam GF-AAS tempat sampel menggunakan atomizer (Gambar 5) yang merupakan tempat proses pembentukan atom (atomisasi) terbuat dari karbon grafit berbentuk tabung (graphite tube), dialiri gas inert seperti argon (Ar) sehingga tidak bereaksi terhadap atom -atom sampel. Ukurannya sangat kecil mempunyai panjang 3 cm diameter dalam 4 -6 mm (Fuller 1977).
Bagian kelompok pembacaan serapan terdiri dari monokromator, detektor, penguat signal (amplifier), CPU (untuk t ampilan signal serapan dan penyimpanan data). Cahaya dari sumber lampu harus terfokus pada sampel dan diarahkan pada monokromator (Gambar 6) dimana ? lampu akan dihamburkan dan melalui grating (terali pemisah) sehingga ? yang diinginkan saja yang difokuskan ke detektor. Sebelum masuk ke detektor spektrum garis spesifik dari monokromator diperkuat oleh amplifier terkebih dahulu. Pembacaan sinyal absorpsi akan dideteksi oleh detekt or dan ditampilkan pada monitor CPU untuk kemudian dilakukan analisis data (Beaty 1993).
Gambar 4 Hollow Cathode Lamp (HCL)
6
Kelebihan Teknik GF-AAS
Analisis GF-AAS memiliki beberapa kelebihan dibandingkan FAAS di antaranya yaitu memiliki kepekaan yang tinggi untuk analisis sampel yang minim kuantitasnya, teknik GF-AAS lebih tepat daripada FAAS karena dapat dilakukan dengan berat dan volume sampel yang kecil (analisis mikro), analisis dapat dilakukan tanpa preparasi sampel, sehingga injeksi sampel dapat langsung dilakukan ke dalam atomizer untuk sampel cair yang kental (viscous) termasuk urine, serum, darah, plasma, bahan makanan cair (susu) (Slavin 1978; Fuller 1977).
Modifier Kimia
Menurut Beaty tahun 1993, GF-AAS lebih dipengaruhi oleh senyawa pengganggu dibandingkan dengan metode FAAS. Untuk menekan adanya senyawa pengganggu, diperlukan penambahan reagen spesifik yang telah banyak dipelajari yaitu modifier kimia yang merupakan zat tambahan pada larutan stan dar dan sampel berfungsi untuk merubah analit ke bentuk yang lebih stabil terhadap panas (analyte modifier) atau merubah matriks contoh atau komponen ke bentuk yang lebih mudah menguap (matrix modifier).
Destruksi Sampel
Untuk melakukan analisis logam atau mineral dalam sampel-sampel biologis dan bahan organik lainnya, salah satu cara yang bisa dipakai adalah melarutkan (mendestruksi) sampel lebih dahulu.
Pada proses destruksi kering, sampel dipanaskan secara bertahap di udara terbuka untuk menguapkan air, menguraikan dan mengoksidasi contoh, dimana akhirnya contoh diabukan dalam tanur pada suhu maksimum yang berkisar antara 450 – 700 oC, tergantung dari pada jenis logam dalam sampel. Dalam proses ini kadang-kadang digunakan bahan pembantu pengabuan atau “ashing aids” yang
Gambar 6. Monokromator
berupa bahan kimia seperti asam nitrat, asam sulfat, magnesium nitrat, yang bertujuan untuk mempercepat proses oksidasi dan untuk mencegah kehilangan unsur -unsur analit yang akan diukur.
Destruksi basah disebut juga oksidasi basah. Cara ini biasanya digunakan untuk penentuan logam dengan kadar rendah dan logam beracun. Cara yang paling lazim digunakan dalam destruksi basah dengan menggunakan asam nitrat sebagai pengoksidasi atau dengan dikombinasi dengan asam lain seperti asam sulfat, asam perklorat, dan hidrogen peroksida.
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan adalah Hitachi GF-AAS Z-5000, Mili-Q Plus 185, oven Memmert, pemanas listrik Fisher, incubator shaker, otoklaf, neraca analitik, cawan porselen, laminar air flow, centrifuge 5415C,
Eppendorf tube, botol nalgene, mikropipet, mikroskop, inkubator, vortex, kuvet, spektrofotometer BJC313, alat-alat gelas.
Bahan yang digunakan adalah sampel tanah Rinjani dan Kerinci, ekstrak yeast, ekstrak malt, glukosa, bacto peptone, bacto agar, larutan kristal violet (campuran 2 g bubuk kristal violet dalam 20 m L etanol 95 % dan 0,8 g ammonium oksalat dalam 80 m L akuades), Stok Se 10000 ppm Delta Scientific Labs Ontario, NaCl 0,85 %, SeO2 0,1 %,
Na2SeO3, asam askorbat, palladium klorida,
HN03 60 % pa, HCl 37 % pa, H2O2 30 % pa, HN03 0.2 N, streptomycin, air bebas mineral
(aquamilipore).
Metode
Isolasi Khamir (Genhardt 1994)
Media yang digunakan untuk isolasi khamir ialah media ekstrak malt dan yeast
(media YM) dengan komposisi campuran 3 g ekstrak malt, 20 g bacto agar, 5 g bacto peptone, 3 g ekstrak ragi, 10 g
glukosa dan 0.05 g antibakteri streptomysin yang dilarutkan dalam 1000 mL akuades. Media disterilisasi basah dengan otoklaf 121 °C pada tekanan 2 atm selama 15 menit. Setelah didinginkan media dituang ke dalam cawan petri steril.
7
steril dengan vortex. Setelah terjadi endapan, 1 m L supernatan diencerkan menjadi 10-2, 10- 3, 10-4. Sebanyak 100 µL dari tabung
pengenceran 10- 3 dan 10-4 ditumbuhkan dalam petri dengan metode cawan sebar, kemudian diinkubasi selama 2 hari. Koloni yang berbeda ditumbuhkan kembali pada media YM baru yang ditambahkan streptomysin dengan metode cawan gores.
Pengamat an Mikroskopis (Genhardt 1994) Sebanyak satu ose isolat terpilih disuspensikan dalam satu tetes akuades di atas kaca objek, kemudian difiksasi dengan cara dilewatkan di atas api bunsen. Preparat diwarnai dengan larutan kristal violet dan diamati di bawah mikroskop dengan perbesaran 100 kali dengan penambahan minyak imersi.
Pemurnian, Peremajaan dan Preservasi Khamir Terseleksi (Genhardt 1994)
Isolat khamir terseleksi dimurnikan dalam media YM dengan metode kuadran dalam cawan petri. Isolat tunggal yang terpisah diamati di bawah mikroskop kemudian dipindahkan dalam media YM dalam tabung reaksi metode agar miring. Inkubasi dilakukan selama 2 hari dan setelah tumbuh, isolat diremajakan dalam media yang sama serta disimpan pada suhu 4 °C sebagai stok biakan.
Uji Resistensi SeO2 0,1 %
Sebanyak 2 ose masing-masing isolat khamir terseleksi hasil p eremajaan ditumbuhkan dalam 5 mL media YM cair ditambah streptomysin dan dishaker selama 2 hari inkubasi sebagai starter sebelum diberikan perlakuan. Sebanyak 50 µL biakan dimasukkan dalam media YM cair mengandung SeO2 0,1 % (b/v). Pengamatan
laju pertumbuhan dilakukan dengan pengukuran Optical Density (OD) metode spektrofotometri UV-Vis dengan λ 600 nm setiap hari selama 4 hari.
Penentuan Waktu Inkubasi Terbaik Khamir Terseleksi
Sebanyak 2 ose isolat terseleksi hasil uji toksisitas diremajakan kembali dalam 50 mL media YM baru sebagai starter dan diinkubasi selama 1 hari. Dilakukan pengenceran menggunakan larutan NaCl 0, 85 % untuk menyamakan OD metode spektro UV-Vis
λ 600 nm hingga berkisar 0,5 – 1,0. Sebanyak 0,5 mL starter diinkubasi dan digojok 2 hari
dalam 50 mL media YM baru (tanpa dan dengan penambahan Na2SeO3 1,0027 ppm)
untuk kemudian diamati OD masing-masing isolat.
Produksi dan Panen Biomassa Khami r
Sebanyak 2 ose isolat terseleksi diremajakan dalam 50 m L media YM baru sebagai starter dan diinkubasi sesuai dengan wakt u optimum yang diperoleh dari kurva pertumbuhan s etelah diketahui waktu optimal inkubasi. Dilakukan pengamatan dan penyamaan OD kembali hingga mencapai 0,5-1,0 melalui spektro UV-Vis λ 600 nm. Sebanyak 1,25 mL starter diinkubasi dan digojok selama 2 hari dalam 125 mL YM cair (tanpa dan dengan penambahan Na2SeO3
1,0027 ppm ).
Biomassa khamir didapat dengan metode
sentrifugasi 10000 rpm; suhu 4 oC selama 10 menit. Pelet dan supernatan dipisahkan.
Pelet dipindahkan menggunakan sudip bersih ke dalam gelas piala 50 mL, kemudian ditutup dengan kertas sampul coklat yang dilubangi. Selanjutnya didiamkan pada suhu ruang selama 10 hari untuk menguapkan supernatan yang tertinggal sehingga didapat biomassa kering sel khamir. Supernatan dipindahkan dalam botol-botol kaca berikut kontrol media YM. Kedua jenis sampel (pelet dan supernatan) dianalisis kadar Se menggunakan GF-A AS.
Pembuatan Pereaksi
Alat-alat sebelum digunakan direndam dengan asam nitrat 2 % (v/v) sekurang-kurangnya satu malam kemudian dibilas dengan aquamilipore. Sesudah pemakaian alat-alat dibilas dengan air destilasi, selanjutnya dibilas dengan aquamilipore dan direndam asam nitrat 2 % (v/v) sekurang-kurangnya satu malam.
Pereaksi yang digunakan dalam penelitian ini adalah larutan HNO3 0,2 N; larutan
Na2SeO3 1,0027 ppm, larutan standar Se untuk penentuan kurva standar, larutan matriks modifier. Pereaksi dibuat dengan metode penimbangan (gravimetri) dan volumetrik.
Larutan HNO3 0,2 N dibuat dengan
pengenceran 15, 22 mL HNO3 60 % (v/v) pa
khusus AAS dalam labu takar 1000 m L menggunakan aquamilipore.
Larutan Na2SeO3 1000 ppm dibuat dengan
8
dengan memipet 0,125 mL larutan Na2SeO3 1002,6680 ppm dan diencerkan dengan
aquamilipore dalam labu takar 100 m L dan 25 mL. Larutan Na2SeO3 1,0027 ppm dalam
labu takar 100 mL dan 25 m L langsung digunakan untuk melarutkan media YM. Larutan kerja Se 4000 ppb untuk penentuan kurva standar pada analisis GF -AAS dibuat melalui serangkaian pengenceran larutan stok Se 10000 ppm menggunakan larutan HNO3
0,2 N.
Larut an matriks modifier merupakan campuran larutan PdCl2 2000 ppm dan asam
askorbat 2 % (b/v). Sebanyak 0,02 g PdCl2
diencerkan dalam labu takar 10 m L dengan penambahan 1,5 mL HNO3 13.141 N dan
1 m L HCl pekat 37 % ditepatkan dengan
aquamilipore. Sebanyak 0,2 g asam askorbat diencerkan dalam labu takar 10 m L dengan
aquamilipore. Dari kedua larutan tersebut dicampur masing-masing 5 mL larutan PdCl2
2000 ppm dan asam askorbat 2 % (b/v). Larutan matriks modifier disimpan dalam tempat yang tertutup dan terlindung dari sinar matahari.
Komposisi bahan penyusun media YM sama dengan komposisi yang digunakan pada tahap isolasi. Takaran disesuaikan dengan volume media YM cair yang ingin dibuat. Media YM pada tahap analisis Se total dibuat menjadi 3 kelompok yaitu; kontrol (tanpa isolat), perlakuan (tanpa dan dengan panambahan Na2SeO3 1,0027 ppm ).
Pengukuran Kadar Se Metode GF-AAS
Dilakukan optimasi pada suhu pengabuan (pyrolysis stage) dan aliran gas inert Argon (Ar) sebagai gas pembawa pada tahap atomisasi. Kondisi lain mengikuti Manual GF-AAS Operation Book.
Terdapat dua tahap pendahuluan sebelum analisis utama menggunakan GF-AAS yaitu; penentuan kurva standar dan proses destruksi sampel. Penentuan kurva standar dilakukan menggunakan larutan stok Se yang telah dibuat sebelumnya dan melalui serangkaian pengenceran hingga mendapat larutan kerja Se dengan konsentrasi 10, 20, 30, 40, 50 ppb dengan blanko menggunakan larutan HNO3
0,2 N. Keseluruhan larutan kerja Se berikut matriks modifier diinjeksikan dalam alat AAS mengikuti kondisi optimum GF-AAS yang telah ditentukan sebelumnya. Kurva standar yang diperoleh digunakan sebagai acuan perhitungan konsentrasi sampel. Pembuatan larutan kerja Se tidak dapat disimpan sehingga
dibuat hanya jika preparasi sampel telah selesai dan sampel siap diukur.
Destruksi sampel dilakukan dengan metode destruksi kering. Sebanyak kurang lebih 1 g sampel (pelet dan supernatan)
ditimbang dalam cawan porselen. Sebanyak 3 tetes matriks modifier PdCl2 ditambahkan
pada sampel sebelum diarangkan pada hot plate selama kurang lebih 1 jam. Sampel kemudian dimasukkan dalam tanur yang bersuhu 600 oC selama 5 hari 4 malam hingga menjadi abu putih. Cawan porselen berisi sampel kembali dipanaskan hingga bergelembung secara bertahap di atas hot plate sesuai urutan pereaksi yang ditambah-kan. Urutan pereaksi yang ditambahkan adalah 2 mL HNO3 60 % pa, 2 mL HCl pekat
37 %, H2O2 30 %. Pada setiap pemanasan
setelah penambahan pereaksi larutan segera dip indahkan dalam gelas kimia 50 m L. Pada akhir proses ditambahkan 2 mL HNO3 60 %
pa sebagai larutan pembilas tanpa dipanaskan. Total volume pada gelas kimia kurang lebih 8 mL. Gelas kimia dipanaskan kembali hingga bersisa kurang lebih 0, 5 m L untuk pemekatan sampel. Sampel kemudian diencerkan menjadi 5 mL menggunakan HNO3 0,2 N. Sebanyak
20 µL sampel siap diinjeksikan bersama penambahan 10 µL matriks modifier PdCl2
dalam AAS sesuai kondisi optimalnya. Pengenceran dapat dilakukan kembali bila absorban terbaca pada alat melebihi rentang kerja kurva st andar.
Untuk memastikan tidak adanya Se dalam media selain dilakukan pengukuran pada blanko media (tanpa dan dengan penambahan Na2SeO3 1,0027 ppm) juga dilakukan
pengukuran kadar Se setiap bahan penyusun media.
Analisis Statistik
Data hasil analisis Konsentrasi Se dan Kadar Se akan dilihat homogenitasnya. Dilakukan uji ANOVA dengan tingkat kepercayaan 95 % (a = 0,05) dan uji lanjut Duncan bila terdapat perbedaan nyata. Kedua uji ini menggunakan software Statistik SAS.
Uji ANOVA yang dilakukan dengan metode Rancangan Acak Lengkap (RAL) Faktorial (2 faktor). Model Statistik untuk uji ini adalah :
Yijk = µ + aik + ßj k + a ßijk + eijk
Keterangan :
Y = Respon pada jenis sampel ke -i, perlakuan ke-j dan ulangan ke-k µ = Nilai tengah
9
ßjk = Perlakuan ke-j pada ulangan ke-k a ßi j k = Interaksi jenis sampel ke-i,
perlakuan ke-j dan ulangan ke-k eijk = Galat jenis sampel ke-i, perlakuan
ke-j dan ulangan ke-k
HASIL DAN PEMBAHASAN
Isolasi dan Pemurnian Khamir
Khamir merupakan mikrob yang cepat tumbuh dengan waktu in kubasi hanya 2 hari. Isolasi khamir dilakukan terhadap 7 sampel tanah dari berbagai lokasi di Gunung Kerinci dan 3 sampel tanah dari berbagai lokasi di TN.Rinjani.
Tahap isolasi menggunakan metode cawan sebar (Genhardt 1994). Tahap pemurnian menggunakan metode cawan sebar diikuti dengan metode kuadran untuk memisahkan koloni-koloni khamir yang terbentuk (Genhardt 1994). Media tumbuh khamir yang optimal dipengaruhi oleh beberapa faktor yaitu harus mengandung semua nutrisi yang diperlukan oleh khamir, mempunyai nilai pH yang sesuai, tidak mengandung senyawa yang dapat mengham -bat pertumbuhan dan harus dibuat dalam kondisi steril melalui sterilisasi basah menggunakan otoklaf. Media yang digunakan adalah Yeast-Malt (YM). Media YM terbuat dari yeast extract dan malt extract yang banyak mengandung nitrogen organik dan senyawa-senyawa karbon sehingga dapat memacu pertumbuhan khamir (Pelczar, 1986). Penambahan streptomycin pada tahap isolasi dimaksudkan untuk mencegah tumbuhnya bakteri-bakteri tanah yang tidak diinginkan. Koloni-koloni yang tumbuh diamati di bawah mikroskop untuk melihat morfologinya. Koloni khamir yang terbentuk berwarna putih susu kecuali isolat kode 25s dan 25q dengan konsistensi lengket.
Khamir yang terisolasi berjumlah 10 isolat terdiri dari 6 isolat dari 2 s ampel tanah di gunung Kerinci yaitu Ulu jernih gunung tujuh (Kode 14K) dan gaosakti
Sumurup (Kode 25K) serta 4 isolat dari 2 sampel tanah TN.Rinjani yaitu Pos II
TN.Rinjani (Kode 39) dan Danau Segara Anak ( Kode 41).
Isolat-isolat tersebut diremajakan terlebih dahulu sebelum dilakukan tahap analisis selanjutnya. Peremajaan ini bertujuan agar sel khamir tetap berada di fase eksponensial sehingga produktif dalam mengakumulasi Se yang nantinya akan ditambahkan dalam media tumbuhnya. Isolat -isolat tersebut juga
disimpan dalam lemari es suhu 10 oC dalam media YM padat miring sebagai stok biakan.
Uji Resistensi Senyawa SeO2 0,1 %
Uji resistensi dilakukan untuk melihat ketahanan 10 isolat khamir terhadap senyawa SeO2 yang memiliki toksisitas tinggi seperti (Sax, 1998). Sebanyak 0,1 % (b/v) SeO2
ditambahkan dalam media tumbuh dengan dilakukan inkubasi khamir selama 4 hari. Nilai absorbansi atau Optical Density (OD) λ 600 nm diamati setiap hari sekali meng-gunakan metode spektrofotometri U V-Vis.
Isolat yang memiliki ketahanan terhadap senyawa SeO2 diasumsikan dapat lebih
bertahan tumbuh di media YM mengandung senyawa Se anorganik (N a2SeO3)yang juga
terdapat secara alami di habitat aslinya dalam tanah.
Daya tahan tumbuh kesepuluh isolat terhadap SeO2 ditunjukkan oleh tingginya
nilai OD (Gambar 7). Nilai OD sebanding dengan jumlah sel dalam media YM cair. Semakin keruh media YM cair maka semakin tinggi OD dan juga berarti semakin banyak sel yang tumbuh. Data OD menunjukkan isolat-isolat tertentu y ang memiliki daya tahan tumbuh terhadap toksisitas SeO2. Seleksi
berdasar uji resistensi mengacu pada data nilai OD selama 2 hari inkubasi (waktu inkubasi normal khamir), uji dilanjutkan hingga 4 hari inkubasi untuk melihat fluktuasi nilai OD yang terjadi.
Isolat-isolat dengan kode 15 dan 25s (berasal dari sampel tanah Kerinci) serta kode 39 4.3 dan 41b (berasal dari sampel tanah TN.Rinjani) menunjukkan nilai OD relatif tinggi pada hari kedua inkubasi jika dibandingkan isolat -isolat lain meski pernah terjadi penurunan nilai OD. Penurunan nilai OD pada isolat kode 39 4.3 dan 15 adalah bentuk adaptasi terhadap penambahan SeO2.
Keempat isolat (G ambar 8) tersebut merupakan isolat-isolat terseleksi berdasarkan uji resistensi SeO2.
Penentuan Waktu Inkubasi Terbaik
10
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08
0 1 2 3 4 5
Waktu I nkubasi (Hari)
A
b
so
rb
a
ns
i
(U
ni
t)
Gambar 7 Absorbansi p ertumbuhan khamir terhadap t oksisitas SeO2 0,1 %
Isolat 25s Isolat 39 4.3
Isolat 41b Isolat 15b
Gambar 8 Morfologi mikroskopis khamir (100x perbesaran)
Pada fase eksponensial terjadi kenaikan populasi sel. Dengan demikian metabolisme di dalam sel masih aktif bekerja sehingga daya akumulasi Se anorganik (Na2SeO3) yang
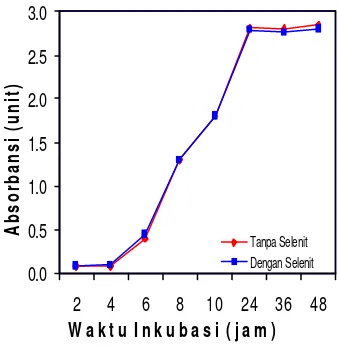
ditambahkan dalam media masih cukup tinggi. Daya akumulasi Se yang tinggi akan meningkatkan kadar Se dalam sel khamir. Kurva pertumbuhan 4 isolat khamir terseleksi (Gambar 9 – 12) tanpa dan dengan penambahan 1,0027 ppm N a2SeO3 dalam
50 mL YM cair dibuat dan diamati OD masing-m asing isolat pada λ 600 nm setelah 2, 4, 6, 8, 10, 24, 36, 48 jam inkubasi. Sehingga total terdap at 8 kali pengamatan.
0.0 0.5 1.0 1.5 2.0 2.5 3.0
2 4 6 8 10 24 36 48
W a k t u I n k u b a s i ( j a m )
Absorbansi (unit)
Tanpa Selenit Dengan Selenit
Gambar 9 Kurva pertumbuhan isolat 15
0.0 0.5 1.0 1.5 2.0 2.5 3.0
2 4 6 8 10 24 36 48
W a k t u I n k u b a s i ( j a m )
Absorbansi (unit)
Tanpa Selenit Dengan Selenit
Gambar 10 Kurva p ertumbuhan isolat 25s
0.0
0.5
1.0
1.5
2.0
2.5
3.0
2
4
6
8
10 24 36 48
W a k t u I n k u b a s i ( j a m )
Absorbansi (unit)
Tanpa Selenit Dengan Selenit
Gambar 11 Kurva p ertumbuhan isolat 39 4.3 25 s
39 4.3
11 0.0 0.5 1.0 1.5 2.0 2.5 3.0
2 4 6 8 10 24 36 48
W a k t u I n k u b a s I ( j a m )
Absorbansi (unit)
Tanpa Selenit Dengan Selenit
Gambar 12 Kurva pertumbuhan isolat 41b
Kurva pertumbuhan khamir baik tanpa maupun dengan penambahan N a2SeO3 1,0027
ppm menunjukkan nilai OD di atas 0,5 pada 10 jam inkubasi. Dengan demikian waktu inkubasi terbaik khamir sebagai biakan starter
adalah 10 jam. Pada gambar 10 terlihat bahwa penambahan N a2SeO3 1,0027 ppm dapat
menghambat pertumbuhan khamir meski secara keseluruhan tidak menunjukkan pengaruh yang berarti dilihat dari berhimpitnya kedua kurva pada 3 isolat lainnya. Hal ini menunjukan bahwa senyawa Na2SeO3 juga bersifat toksik namun dalam
dosis yang aman
Produksi dan Panen Biomassa Sel
Tahap produksi biomassa sama dengan tahap penentuan kurva pertumbuhan. Hanya berbeda dalam hal waktu inkubasi yaitu selama 10 jam (sesuai dengan waktu terbaik dari kurva pertumbuhan) dan diawali dengan tahap penyamaan OD.
Tujuan penyamaan OD adalah untuk menseragamkan jumlah sel dalam sejumlah volume inokulan starter. Tahap penyamaan OD dilakukan melalui pengenceran dengan menggunakan NaCl 0,85 % (larutan NaCl fisiologis). Penggunaan larutan NaCl fisiologis ini untuk menghindari lisis sel. Produksi biomassa khamir dilakukan dalam 125 m L media YM cair (tanpa dan dengan penambahan N a2SeO3 1,0027 ppm) dengan
volume inokulan starter (yang telah diseragamkan nilai OD) sebanyak 1,25 mL. Inkubasi shaker dilakukan selama 2 hari dengan tujuan agar suplai oksigen dapat merata ke seluruh media. Biomassa khamir akan mengendap dikarenakan berat jenis (BJ) sel lebih besar dari BJ air dan juga karena
ukuran sel khamir yang lebih besar dari bakteri pada umumnya (1-5 µm).
Panen biomassa dilakukan dengan teknik sentrifugasi untuk memisahkan komponen dalam suatu larutan berdasarkan BJ nya. Pemilihan kecepatan 10000 rpm karena pada kecepatan tersebut secara umum sel akan terpisah dari larutan. Suhu sentrifugasi berkisar 4 – 8 oC adalah untuk membuat biomassa lebih terendapkan karena terjadi sedikit pembekuan. Biomassa yang terkumpul (Gambar 13) didiamkan selama 10 hari untuk menguapkan media yang terendap bersama biomassa (proses pengeringan) sehingga dihasilkan biomassa keringnya (Gambar 14) .
(a) (b)
Gambar 13 Biomassa (a) sebelum sentrifuse, (b) setelah sentrifuse
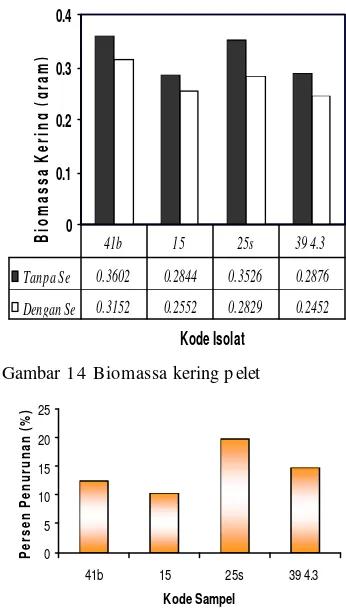
Biomassa yang dihasilkan keempat isolat (Gambar 14 dan 15) tanpa penambahan Na2SeO3 lebih tinggi dibandingkan dengan
penambahan Na2SeO3. Penurunan jumlah
biomassa akibat penambahan Na2SeO3 sesuai
dengan pernyataan (Ponce dalam Dumont 2006) yaitu semakin banyak senyawa Se yang ditambahkan dalam media tumbuh khamir maka pertumbuhannya akan terhambat. Namun akan meningkatkan kadar Se dalam sel. Pada G ambar 14 dan 15 menunjukkan biomassa kering terbanyak diperoleh pada isolat kode 41b yaitu 0,3602 g (tanpa penambahan Se) dan 0,3152 g (dengan penambahan Se). Persentase penurunan bobot biomassa kering akibat penambahan Na2SeO3
1,0027 ppm bervariasi, isolat 25s mengalami penurunan terbesar yaitu 19,77 %, isolat 39 4.3 sebesar 14,74 %; isolat 41b sebesar 12,49 %; dan isolat 15 dengan persentase penurunan terkecil yaitu 10,27 % .
Biomassa kering yang dihasilkan masih relatif rendah sehingga perlu dilakukan optimasi. Kontrol terhadap pH, suhu, aerasi dapat dilakukan agar diperoleh pertumbuhan optimal dan biomassa tertinggi.
Penentuan Kurva Standar
12 0 0.1 0.2 0.3 0.4 Kode Isolat
Biomassa Kering (gram)
Tanpa Se 0.3602 0.2844 0.3526 0.2876 Dengan Se 0.3152 0.2552 0.2829 0.2452 41b 15 25s 39 4.3
Gambar 14 Biomassa kering p elet
0 5 10 15 20 25
41b 15 25s 39 4.3
Kode Sampel
Persen Penurunan (%)
Gambar 15 Persentase p enurunan biomassa
dengan pembuatan larutan kerja Se 0, 10, 20, 30, 40, 50 ppb dengan larutan HNO3 0,2 N
sebagai blanko. Pembuatan larutan standar kerja Se dilakukan melalui pengenceran berkala menggunakan teknik gravimetri (penimbangan) larutan stok Se 10000 ppm dari Delta Scientific Labs Ontario
menggunakan HNO3 0,2 N menjadi 200 ppm, 4000 ppb dengan 50 kali pengenceran pada setiap tahap. Larutan stok 4000 ppb diencerkan sebanyak 40 kali menjadi 100 ppb dan diencerkan kembali masing-masing hingga menghasilkan larutan kerja Se 0, 10, 20, 30, 40, 50 ppb. Pembuatan larutan kerja Se ini harus dilakukan pada waktu yang sama dengan analisis sampel karena kestabilan larutan kerja dalam tingkat ppb sangat kecil. Penyimpanan larutan kerja tingkat ppb dapat menurunkan keakuratan hasil pengukuran.
Teknik penimbangan pada saat sekarang ini telah banyak digunakan karena lebih baik daripada teknik volumetri (pemipetan). Teknik penimbangan memiliki akurasi tinggi karena kesalahan atau galat lebih kecil dan dapat dikoreksi balik menjadi konsentrasi yang sebenarnya. Teknik penimbangan tidak
dipengaruhi oleh temperatur sebagaimana terjadi pada teknik volumetri.
Kurva standar juga dapat digunakan untuk mengetahui Limit of Detection (LOD) yaitu konsentrasi terendah suatu analit dalam sampel yang dapat terdeteksi oleh alat (dalam hal ini GF-AAS) , walaupun tidak selalu dikuantifikasi. LOD diukur dari standar deviasi (SD) respon dan slope (S) dari kurva kalibrasi menurut persamaan :
LOD = 3(Sy/x/slope)
Kurva standar Se memberikan persamaan sbb:
y = ax + b
y sebagai absorban terbaca alat,
x sebagai konsentrasi Se terbaca alat,
a sebagai slope (kemiringan garis regresi),
b sebagai intercept
Analisis regresi penentuan konsentrasi Se pelet dan supernatan pada pengenceran pertama menghasilkan persamaan:
y = 0,0015x + 0,0077 r = 0, 9942
LOD = 6, 80 ppb
Analisis regresi penentuan konsentrasi Se pelet dan supernatan pengenceran kedua menghasilkan persamaan :
y = 0,0018 x + 0,0070 r = 0, 9963
LOD = 5, 33 ppb
Analisis regresi penentuan konsentrasi Se pada kontrol media YM menghasilkan persamaan :
y = 0,0016 x + 0,0059 r = 0, 9962
LOD = 5, 625 ppb
Syarat linieritas kurva standar ditentukan dari koefisien korelasi (r) yang mendekati nilai 1. Dari kurva standar yang dibuat menghasilkan nilai koefisien korelasi (r) diatas 0,9 sehingga menunjukkan kelinieran kurva standar Se dan korelasi antara konsentrasi standar Se dengan absorbansi yang terbaca. sehingga diharapkan dapat menghasilkan hasil analisis yang akurat.
Nilai LOD berkisar antara 5 – 7 ppb. Nilai ini menunjukkan batas respon keakuratan hasil pengukuran. Jika nilai Kadar Se sampel yang terbaca di bawah LOD berarti tidak memberikan respon yang akurat.
Penentuan Kadar Se
13
adalah destruksi kering. Kelebihan dari metode destruksi kering dibandingkan dengan metode destruksi basah adalah tidak memerlukan reagen atau larutan pereaksi yang banyak. Proses destruksi ditempuh dengan memanaskan sampel di cawan porselen dalam tungku (furnace) sampai seluruh bahan organik habis teroksidasi sehingga diperoleh abu yang berwarna putih. Pada penentuan kadar Se digunakan suhu pengabuan 600 oC
selama 5 hari. Ditambahkan 3 tetes PdCl2 – askorbat sebagai chemical modifiers
untuk menstabilkan Se agar tidak menguap pada suhu tinggi karena Se bersifat volatil dan menguap pada suhu 684,9 oC. Hal ini dimungkinkan karena penggunaan Pd yang memiliki titik didih tinggi hingga 1500 oC akan mengakibatkan terbentuknya alloy
(campuran logam) yang stabil terhadap suhu tinggi sehingga dapat meningkatkan ashing temperature.
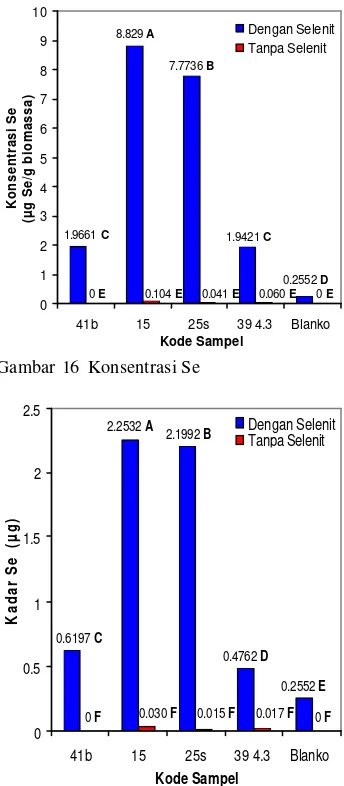
Hasil perhitungan konsentrasi Se (µg Se/g biomassa) dihitung dari konsentrasi Se pembacaan alat dikalikan dengan faktor pengenceran total. Hasil perhitungan hubungan antara konsentrasi Se dengan bobot biomassa kering merupakan kadar Se khamir per biomassa ( µg) (Gambar 16 – 17).
Berdasarkan gambar 14, 15, 16 dan 17 secara umum biomassa keempat isolat mengalami penurunan akibat asupan Na2SeO3
1,0027 ppm pada media tumbuhnya. Isolat kode 41b meski menghasilkan biomassa tertinggi sebesar 0,3152 g dengan persentase penurunan biomassa sebesar 14,29 %, namun daya akumulasi Se dalam selnya paling rendah yaitu hanya 0,6197 µg. Isolat kode 25s memiliki persentase penurunan biomassa tertinggi sebesar 19,77 % dengan daya akumulasi Se yang tinggi yaitu sebesar 2,1992 µg Se. Isolat kode 39 4.3 menghasilkan biomassa dan daya akumulasi Se terkecil yaitu berturut-turut 0,2452 g dan 0,4762 µg Se dengan persentase penurunan biomassa 14,74 %; isolat kode 15 memiliki persentase penurunan biomassa terkecil sebesar 10,27 % dan memiliki daya akumulasi Se tertinggi yaitu 2,2532 µg Se.
Dengan demikian isolat kode 15 dan isolat kode 25s merupakan isolat -isolat terbaik karena memiliki Kadar Se tinggi berturut-turut sebesar 2,2532 µg Se dan 2,1992 µg Se. Kedua isolat ini diisolasi dari tanah vulkanis Gunung Kerinci.
Analisis statistik yaitu uji ANOVA menghasilkan nilai peluang F sebesar 0,0001 yang lebih kecil dari nilai (a = 0,05). Dengan demikian dapat disimpulkan terdapat
perbedaan nyata antara sampel dan di dalam sampel itu sendiri. Adanya perbedaan nyata mendasari dilakukannya uji lanjut Duncan untuk melihat secara spesifik sampel-sampel yang menunjukkan perbedaan nyata dalam hasil analisis konsentrasi maupun kadar Se. Berdasarkan perbedaan huruf di belakang nilai konsentrasi dan kadar Se maka dari Gambar 16 dapat diketahui bahwa dengan penambahan Se menghasilkan konsentrasi Se berbeda nyata pada blanko dan keempat isolat kecuali isolat 41b dan 39 4.3. Untuk perlakuan normal (tanpa penambahan Se) tidak terdapat perbedaan nyata pada blanko dan keempat isolat. Gambar 17 juga menunjukkan bahwa kadar Se berbeda nyata pada blanko dan keempat isolat dengan penambahan Se. Untuk perlakuan tanpa penambahan Se kembali menunjukkan tidak ada perbedaan nyata pada blanko dan keempat isolat.
1.9421 C
1.9661 C
7.7736 B
8.829 A
0.2552 D
0 E 0.104 E 0.041 E 0.060 E 0 E
0 1 2 3 4 5 6 7 8 9 10
41b 15 25s 39 4.3 Blanko
Kode Sampel
Konsentrasi Se
(µ
g Se/g biomassa)
Dengan Selenit Tanpa Selenit
Gambar 16 Konsentrasi Se
0.2552 E
0.4762 D
0.6197 C
2.1992 B
2.2532 A
0 F
0 F 0.030 F 0.015 F 0.017 F
0 0.5 1 1.5 2 2.5
41b 15 25s 39 4.3 Blanko
Kode Sampel
Kadar Se (µ
g)
Dengan Selenit Tanpa Selenit
14
Tabel 2 Data penentuan kadar Se media YM
Jenis Sampel Kadar Se
Rata-rata (µg Se/g larutan )
Media Yeast Ekstrak Tak terdeteksi Malt Ekstrak Tak terdeteksi Peptone Tak terdeteksi Kontrol
YM
+ Se 1.3076 Tanpa Se Tak terdeteksi
Tidak terbacanya nilai konsentrasi Se pada supernatan baik tanpa maupun dengan penambahan Se, memberikan informasi bahwa seluruh senyawa Se dalam media tumbuh khamir dapat terakumulasi dalam biomassanya. Tingginya kadar Se yang diperoleh menunjukkan kemampuan khamir dalam mengakumulasi Se anorganik dalam media meski dapat menghambat pertumbuhan sel khamir.
Untuk memastikan bahwa di dalam kontrol tanpa Se benar-benar tidak terdapat senyawa Se, dilakukan analisis Konsentrasi Se pula pada setiap bahan penyusun media YM cair (yeast extract, malt extract dan bacto peptone) serta analisis media YM cair. Semua analisis dilakukan tanpa destruksi/ pengukuran langsung (direct measurement) (Tabel 2).
Hasil analisis menunjukkan bahan -bahan penyusun media YM tidak mengandung senyawa-senyawa Se. Sedangkan Konsentrasi Se kontrol YM cair dengan asupan N a2SeO3
1,0027 ppm memberikan hasil 1.3076 µg Se/g larutan. Sedangkan hasil analisis kontrol YM + Na2SeO3 1,0027 ppm dengan destruksi
kering sebesar 0.2552 µg Se/g larutan. Perbedaan yang cukup signifikan pada hasil Konsentrasi Se kontrol YM + Na2SeO3
1,0027 ppm dengan ada tidaknya destruksi sampel sebelum analisis menunjukkan adanya pengaruh cara destruksi yang menyebabkan hilangnya senyawa Se selama pengabuan dalam tanur bersuhu tinggi.
SIMPULAN DAN SARAN
Simpulan
Sebanyak 10 isolat khamir berhasil diisolasi dari 10 sampel tanah vulkanis gunung Kerinci dan TN.Rinjani. Terseleksi 4 isolat dengan kode 15 dan 25s (berasal dari sampel tanah Kerinci) serta kode 39 4.3 dan 41b (berasal dari sampel tanah TN.Rinjani) yang tahan terhadap toksisitas SeO2. Kadar Se
tertinggi dihasilkan oleh isolat kode 15 yaitu
2,2532 µg dan diikuti oleh isolat kode 25s yaitu 2,1992 µg. Perbedaan nyata hasil analisis konsentrasi dan Kadar Se melalui Uji ANOVA dan uji lanjut Duncan memberikan informasi bahwa penambahan Na2SeO3
1,0027 ppm memberikan efek signifikan terhadap peningkatan Kadar Se yang terakumulasi dalam sel khamir.
Saran
Khamir terseleksi yang diisolasi dari tanah vulkanis TN.Rinjani dan Gunung Kerinci merupakan sumber mikromineral Se yang potensial untuk dibudidayakan karena mengandung kadar Se cukup tinggi . Dengan kemampuan khamir mengakumulasi Se maka kadar Se alami dalam selnya dapat ditingkatkan dengan menumbuhkan dalam media mengandung Se. Khamir dapat difungsikan sebagai suplemen makanan berkadar Se tinggi dalam bentuk ekstrak khamir, maup un untuk bahan baku roti. Untuk mendapatkan biomassa khamir yang optimal perlu dilakukan fermentasi terkontrol dan perlu dicoba teknik pemisahan lain sehingga pelet dapat terpisah sempurna dari supernatan tanpa ada residu media yang ikut terendap bersama biomassa sel. Perlu dilakukan optimasi dan validasi metode penentuan kadar Se dengan beberapa ulangan sehingga kadar Se yang benar-benar terakumulasi dapat terdeteksi akurat dan teliti. Perlu dilakukan isolasi selenometionin dan identifikasi lanjut jenis sel khamir
DAFTAR PUSTAKA
Beatriz M, et al. 1997. Determination of selenomethionine in wheat samples.
J. AAS 12 : 1041-1046.
Beaty R, Jack DK. 1993. Concepts,
Instrumentation, Technique in AAS,
2nd edition. Norwalk USA: Perkin- Elmer Corporation.
Casarett LJ, John D. 1986. Toxicology: Basic Science of Poisons. 3th Ed. Curtis DK, Mary OA, John D, editor. New York : M c-Millan Publishing.
Day RA, AL Underwood. 1986. Analisis
15
Dilaga SH. 1992. Nutrisi Mineral pada Ternak. Kajian Khusus Unsur Selenium. Jakarta: Akademika Presindo.
Dummont E, 2006. Hypenated techniques for speciation of Se in biological matrices. [Thesis]. Bellegem : Department of Analytical Chemistry Universiteit Gent
Elizabeth M, Landecker. 1996. Fundamentals of The Fungi, 4th Ed. New Jersey : Prentice Hall.
Febtiana. 2003. Analisis aktivitas glutation peroxidase dalam daun benalu teh
Scurrula artropurpurea yang difermentasi oleh Acetobacter -Saccharomyces. [Skripsi]. Bogor : Fakultas Matematika dan Ilmu Pengetahuan Alam Jurusan Kimia Institut Pertanian Bogor.
Fuller CW, 1977. Electrothermal Atomization for Atomic Absorption Spectrometry.
London : IBM Pr.
Genhardt P. 1994. Methods for General and Molecular Bacteriology. RGE Murray, Willis A, Wood, Noel R Krieg, editor. Washington DC: American Society for Microbiology.
Kurtzman PC. 1998. The Yeast, A Taxonomic Study. 4th edition. Amsterdam,
Lausanne, NY, Oxfort, Singapore, Tokyo: Elsevier.
Laksmi. Oktober 2001. Waspadai serangan leukimia. Plasa.com: 149.
Linder M. 1992. Biokimia Nutrisi dan Metabolisme Dengan Pemakaian Secara Klinis. Jakarta: UI-Pr.
Lobinski R, Edmonds JS, Suzuki KT, Uden PC. 2000. Species -selective determination of selenium compounds in biological material.
Pure Appl Chem. 72(3): 447-461.
Nakamuro K, Okuno T, Hasegawa T. 2000. Metabolism of s elenoaminoacids and contribution of selenium methylation to their t oxicity. J Health Sci 46(6): 418-421.
Noviandi M, 2002. Pengaturan waktu ekstraksi taoge dan konsentrasi glukosa pada pertumbuhan khamir
Torula sp untuk produksi selenium minimum. [Skripsi]. Bogor : Fakultas Matematika dan Ilmu Pengetahuan Alam Jurusan Kimia Institut Pertanian Bogor.
Pelczar MJ, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Volume ke-1,2. Hadieutomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta : UI Pr. Terjemahan dari : Elements of Microbiology.
Pohl D, et al. 1991. Determination of normal levels of Se in blood serum by G F-AAS. Instrument At Work AA-103.
Price W.J, 1972. Analytical Atomic Absorption Spectrometry. London : Heyden & Son.
Sax NI, Lewia RJ. 1998. Dangerous Properties of Industrial Materials.
Volume ke-3. 7th Ed.. New York: Van Nostrand Rein Hold.
Schrauzer G, et al. 2002. The selenium story.
Feeding Times 7(2) .
Slavica D, Ivana C. 2004. The fact and controverses about selenium. Acta Pharm 54 : 216 – 276.
Slavin Morris, 1978. Atomic Absorption Spectrometry, 2nd edition. New York : John Wiley and Sons.
Spallholz JE. 2001. Selenium and The Prevention of Cancer Part 1&2. The Bulletin of Selenium -Tellurium Development Association.
16
17
Lampiran 1 Tahap penelitian
Sampel Tanah Vulkanis
Isolasi Khamir
Pemurnian Isolat Khamir
Perlakuan Penambahan Na2SeO3
Seleksi Toksisitas SeO2 0.1%
Metode Spektrofotometri UV-Vis
Pengukuran Kadar Selenium Metode
GF-AAS Peremajaan
18
Lampiran 2 Sampel tanah Kerinci dan Rinjani
Kode
Tanah
Asal Daerah Ketinggian
(m dpl)
Suhu
(ºC)
14 k
Kerinci, Ulu Jernih, Gunung tujuh
1495 28 – 30
16 k 1690 28 – 30
17 k 1700 28 – 30
18 k 1790 28 – 30
21 k 1900 28 – 30
23 k Kerinci, Ulu Jernih, Puncak Gunung tujuh 2100 28 – 30
25 k Kerinci, Gaosakti, Sumurup 815 28 – 30
14 Puncak Plawangan Senaru TN Rinjani 2590 28 – 30
39 Pos II TN Rinjani 1500 28 – 30
41 Danau Segara Anak TN Rinjani 2170 28 – 30
Lampiran 3 Tahap isolasi khamir
1 g tanah homogenkan
dalam 9 m L akuades steril
divortex
Sampel Tanah Vulkanis
Suspensi tanah
Pengenceran 10-2, 10-3, 10- 4
Media YM Padat + streptomisin Metode Cawan Sebar
Seleksi Pertumbuhan
Tahap Pemurnian dan Peremajaaan Preservasi Metode Agar Miring
19
Lampiran 4 Hasil isolasi khamir
Kode Isolat
Kode Tanah Asal Isolat
Asal Sampel
Nama Daerah Ketinggian
(m dpl)
13 14 k Ulu jernih Gunung Tujuh Gn.Kerinci 1495
15 17
25 s 25 k Gaosakti Sumurup Gn.Kerinci 815
25 q 53
39 4.1 39 Pos II Taman Nasional (TN) Rinjani 1500 39 4.3
41 a 41 Danau Segara Anak TN Rinjani 2170
41 b
Lampiran 5 Tahap Uji Resistensi SeO2 0,1 %
100 µL biakan
Pengenceran dengan
2,9 mL akuades
Isolat dalam media YM cair + 0.1 % (b/v) SeO2 + streptomisin
Dihomogenkan
Kalibrasi spektro dengan akuades
20
Lampiran 6 Absorbansi uji resistensi SeO2 0,1 %
0 0 .0 1 0.02 0.03 0.04 0.05 0.06 0.07 0.08
0 1 2 3 4 5
W akt u I nkubasi (Har i)
A
b
s
o
r
b
a
n
s
i
(U
n
it
)
13 15 17 25 s 25 q 53
39 4.1 39 4.3 41 a 41 b
Lampiran 7 Isolat terseleksi uji resistensi SeO2 0,1 %
Kode Isolat Kode Tanah
Asal Isolat
Asal Sampel
Nama Daerah Ketinggian
(m dpl)
15 14 k Ulu jernih Gunung
T ujuh Gn.Kerinci
1495
25 s 25 k Gaosakti Sumurup
Gn.Kerinci
815
39 4.3 39 Pos II Taman
Nasional (TN) Rinjani
1500
41 b 41 Danau Segara Anak
TN Rinjani
2170
Lampiran 8 Optimasi GF-A A S
N o Ashing
Temperature
(oC)
Atomization Gas Flow (m L/menit)
Abs orbans Rata-rata
R S D Jum Lah Ulangan
Keterangan
1. 800 30 0.0342 2.63 3 Standar Se
yang digunakan
20 ppb
2. 900 30 0.0345 1.16 2
3. 1000 30 0.0338 3.55 2
4. 1100 30 0.0354 1.69 2
5. 1200 30 0.0357 5.88 2
6. 1300 30 0.0351 3.42 2
21
Lampiran 9 Kondisi GF-AAS
GF-AAS Methode
Analisis name : Selenium (Se)
Instrument
1-Se
Signal mode : BKG Corr
Measurement Mode : Integral Slicing Height (%) :
Wave Length (nm) : 196
Determine the W.L : Auto
Slit Width (nm) : 1.3
Time Constant (s) : 0.1 Lamp Current (mA) : 12.5
PMT Voltage (V) : 500
Analytical Methode
1-Se Injection Volume (µl) : 20
Cuvette Type : Tube A
Temperature Control : optical
Temperature Program
Step Start/ End Temp
(oC)
Ramp/ Hold Time (s) Gas Flow (mL/min)
Dry 80/140 40/0 200
Ash 1200/1200 20/0 200
Atom 2600/2600 0/5 30
25
Lampiran 10 Penentuan Kadar Selenium
Jenis Sampel
Kode Massa Isi (g)
Faktor Pengenceran
(FP)
FP Total
Absorbansi Konsentrasi
Terbaca Alat (ppb)
Konsentrasi Se (µg Se/g biomassa)
Kadar Se Rata-rata
(µg)
FP 1 FP 2 A1 A2 1 2 1 2
Rata-rata
Pelet (P) Cair (C)
Tanpa
asupan Na2SeO3
41 P1 0.3602 13.9073 - 13.9073 0.0065 0.0065 0 0 0 0 0 0
41 C1 0.9908 5.0568 - 5.0568 0.0034 0.0032 0 0 0 0 0 0
15 P1 0.2844 17.6143 - 17.6143 0.0187 0.0144 7.3333 4.4667 0.1292 0.0787 0.1040 0.0296
15 C1 1.0017 4.9956 - 4.9956 0.0029 0.0034 0 0 0 0 0 0
25 P1 0.3526 14.1784 - 14.1784 0.0123 0.0118 3.0667 2.7333 0.0435 0.0388 0.0412 0.0145
25 C1 1.0010 4.9983 - 4.9983 0.0044 0.0046 0 0 0 0 0 0
39 P1 0.2876 17.3988 - 17.3988 0.0133 0.0125 3.7333 3.2000 0.0650 0.0557 0.0604 0.0174
39 C1 1.0015 5.0004 - 5.0004 0.0046 0.0048 0 0 0 0 0 0
BL 1 1.0016 4.9924 - 4.9924 0.0054 0.0063 0 0 0 0 0 0
Pelet (P) Cair (C)
Dengan
asupan Na2SeO3
41 P2 0.3152 15.9017 5.9745 95.0047 0.0458 0.0427 21.5556 19.8333 2.0479 1.8843 1.9661 0.6197
41 C2 1.0020 4.9911 - 4.9911 0.0060 0.0062 0 0 0 0 0 0
15 P2 0.2552 19.6364 9.9978 196.3208 0.0876 0.0883 44.7778 45.1667 8.7908 8.8672 8.8290 2.2532
15 C