PENCARIAN KONDISI PEMBENTUKAN SENYAWA
KOMPLEKS Cr(III & VI) DENGAN PEREAKSI
KROMOGENIK CAMPURAN
MIRAH SUMINAR
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MIRAH SUMINAR. Pencarian Kondisi Pembentukan Senyawa Kompleks Cr(III & VI)
dengan Pereaksi Kromogenik Campuran. Dibimbing oleh ETI ROHAETI dan
MOHAMAD RAFI.
Kromium adalah suatu logam yang unik, karena dalam bentuk Cr(III) diperlukan
untuk kesehatan manusia, sedangkan dalam bentuk Cr(VI) dikenal sebagai suatu zat yang
bersifat karsinogen. Saat ini kromium masih digunakan secara luas dalam industri baja
dan penyamakan kulit sehingga dengan semakin banyaknya penggunaan kromium dalam
bidang industri akan meningkatkan jumlah kromium yang terbuang ke lingkungan. Oleh
karena itu penentuan secara simultan Cr(III) dan Cr(VI) yang selektif dan sensitif
diperlukan untuk mengetahui jumlah kromium yang terkandung dalam limbah industri
tersebut. Penelitian ini menggunakan pereaksi kromogenik campuran untuk
mengkompleks Cr(III) dan Cr(VI). Pereaksi kromogenik untuk Cr(III) adalah
2-hidroksibenzaldiminoglisin (HBIG) dan Cr(VI) adalah bromopirogalol merah (BPR).
Penggunaan pereaksi kromogenik campuran ini bertujuan menentukan secara simultan
kedua bentuk oksidasi kromium dengan UV-VIS spektrofotometri.
Panjang gelombang terbaik pengukuran senyawa kompleks Cr(III)-HBIG adalah
576.4 nm, sedangkan untuk senyawa kompleks Cr(VI)-BPR adalah 635 nm. Pemilihan
larutan bufer pH 6.0 menunjukkan larutan bufer asetat lebih baik dibandingkan dengan
larutan bufer fosfat dengan waktu inkubasi terbaik 60 menit pada suhu kamar. Pengaruh
beberapa pereaksi menunjukkan bahwa kehadiran pereaksi BPR tidak berpengaruh pada
bentuk spektrum serapan Cr(III)-HBIG, demikian juga pereaksi HBIG tidak berpengaruh
pada bentuk spektrum serapan Cr(VI)-BPR. Kehadiran surfaktan setiltrimetilamonium
bromida (CTAB) tidak berpengaruh pada bentuk spektrum serapan Cr(III)-HBIG, tetapi
pada pengukuran Cr(VI)-BPR kehadiran CTAB sangat diperlukan karena mempunyai
efek katalis. Linearitas terbaik pada penentuan kurva standar Cr(III) dan Cr(VI)
masing-masing adalah 0.9929 pada kisaran konsentrasi 40-100
µ
g/ml untuk Cr(III) dan 0.25-0.29
ABSTRACT
MIRAH SUMINAR. Determination Cr(III & VI) Complex Compound Formation
Condition using Mixed Chromogenic Reagent. Under the direction of ETI ROHAETI and
MOHAMAD RAFI.
Chromium is a unique metal, because Cr(III) form, chromium is needed for human
health, while Cr(VI) is known as a carcinogenic agent. Until now chromium is still
widely used in steel and leather tanning industries, which means that the more chromium
used in industries the more chromium disposed to the environment. Therefore a sensitive
and selective simultaneous determination of Cr(III) and Cr(VI) is needed to monitor the
effluent of industries mentioned above. In this study, mixed chromogenic reagents used to
complex Cr(III) and Cr(VI). For Cr(III) the chromogenic reagent were
2-hydroxybenzaldiminoglycine (HBIG) and Cr(VI) were bromopyrogallol red (BPR). The
mixed chromogenic reagent used for simultaneous determination of the two oxidation
states of chromium by UV-VIS spectrophotometry.
PENCARIAN KONDISI PEMBENTUKAN SENYAWA
KOMPLEKS Cr(III & VI) DENGAN PEREAKSI
KROMOGENIK CAMPURAN
MIRAH SUMINAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Pencarian Kondisi Pembentukan Senyawa Kompleks Cr(III & VI) dengan
Pereaksi Kromogenik Campuran
Nama : Mirah Suminar
NIM : G44202038
Menyetujui:
Pembimbing I,
Pembimbing II,
Dr. Eti Rohaeti, M.S.
Mohamad Rafi, S.Si
NIP 131663015
NIP 132321454
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Puji
dan syukur penulis panjatkan Kehadirat Allah SWT atas segala rahmat dan
karunia-Nya sehinga penulis dapat menyelesaikan karya ilmiah ini.
Tema yang dipilih
dalam penelitian ini adalah Cr(III) dan Cr(VI) dengan judul Pencarian Kondisi
Pembentukan Senyawa Kompleks Cr(III & VI) dengan Pereaksi Kromogenik Campuran.
Terima kasih penulis ucapkan kepada Ibu Dr. Eti Rohaeti, M.S dan Mohamad Rafi,
S.Si selaku pembimbing yang telah memberikan bimbingan dan pengarahan dalam
penulisan karya ilmiah ini. Penghargaan penulis sampaikan kepada
Om
Eman, Bapak
Ridwan, Bapak Manta, Ibu Nunung, Bapak Kosasih, Bapak Dede beserta staf
Laboratorium Kimia Analitik,
Mbak
Siti Rachma,
Mbak
Ii,
Mbak
Dewi beserta staf
Laboratorium Terpadu IPB,
Mas
Heri,
Kak
Budi, serta Bapak Farid atas sarannya. Selain
itu ucapan terima kasih kepada Steven, Nita, Miranti, Karin, Cherry, Yudi PH, Ari, Intan,
Kak
Akbar, dan rekan-rekan Kimia 39 atas kebersamaannya yang indah. Ungkapan
terima kasih juga penulis sampaikan kepada ibunda tercinta, kakak dan kedua adikku,
serta seluruh keluarga atas segala doa, semangat, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 November 1983 dari ayah (Alm) Oey
Ho Goan dan ibu Titing Sumarsih. Penulis merupakan putri satu-satunya dari empat
bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 2 Bogor dan pada tahun yang sama
lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih
Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kromium... 2
Kromium(III) ... 2
Kromium(VI)... 3
Spektrofotometri ... 3
Analisis Multikomponen ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Penentuan
λmaks... 7Pengaruh Larutan Bufer pH 6.0... 8
Pengaruh Waktu Pengukuran ... 8
Pengaruh Beberapa Pereaksi... 9
Penentuan Kurva Standar Cr(III) dan Cr(VI) ... 11
Pengujian Kadar Cr(III) dan Cr(VI) dalam Campuran Sintetik... 11
SIMPULAN DAN SARAN
Simpulan... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Spektrum serapan dua zat yang tercampur terpisah sempurna, bertumpang tindih
sebagian, dan bertumpang tindih sempurna...4
2 Struktur HBIG...6
3 Struktur BPR...6
4 Spektrum serapan senyawa kompleks Cr(III)-HBIG...7
5 Spektrum serapan senyawa kompleks Cr(VI)-BPR...8
6 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan larutan bufer pH 6.0
asetat dan fosfat...8
7
Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan larutan bufer pH 6.0
fosfat dan asetat...8
8 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan
CTAB dan tanpa penambahan CTAB
.... 9
9 Spektrum serapan tunggal BPR dan spektrum serapan senyawa kompleks
Cr(VI)-BPR tanpa penambahan CTAB.
......9
10 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan pengaruh BPR
dan tanpa pengaruh BPR... ...10
11 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan pengaruh HBIG
dan tanpa pengaruh HBIG...10
12 Spektrum serapan senyawa kompleks Cr(III)-BPR dan spektrum serapan
larutan stok standar Cr(III)...10
13 Spektrum serapan senyawa kompleks Cr(VI)-BPR dan Cr(VI)-HBIG...10
14 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan
Cr(VI) dan tanpa penambahan Cr(VI)...11
15 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan penambahan
Cr(III) dan tanpa penambahan Cr(III)...11
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2 Perhitungan preparasi larutan stok standar Cr(III) dan Cr(VI) ... 17
3 Penentuan konsentrasi HBIG... 18
4 Hubungan serapan larutan Cr(III)-HBIG (bufer asetat) dengan waktu
pengukuran (menit) ... 19
5 Hubungan serapan larutan Cr(III)-HBIG (bufer fosfat) dengan waktu
pengukuran (menit)...19
6 Hubungan serapan larutan Cr(VI)-BPR (bufer fosfat) dengan waktu
pengukuran (menit)...20
7 Hubungan serapan larutan Cr(VI)-BPR (bufer asetat) dengan waktu
pengukuran (menit)...20
8 Kurva standar Cr(III) dan Cr(VI)...21
9 Pengaruh penambahan larutan stok standar kromium terhadap linearitas kurva
standar Cr(III) dan Cr(VI)...22
PENCARIAN KONDISI PEMBENTUKAN SENYAWA
KOMPLEKS Cr(III & VI) DENGAN PEREAKSI
KROMOGENIK CAMPURAN
MIRAH SUMINAR
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MIRAH SUMINAR. Pencarian Kondisi Pembentukan Senyawa Kompleks Cr(III & VI)
dengan Pereaksi Kromogenik Campuran. Dibimbing oleh ETI ROHAETI dan
MOHAMAD RAFI.
Kromium adalah suatu logam yang unik, karena dalam bentuk Cr(III) diperlukan
untuk kesehatan manusia, sedangkan dalam bentuk Cr(VI) dikenal sebagai suatu zat yang
bersifat karsinogen. Saat ini kromium masih digunakan secara luas dalam industri baja
dan penyamakan kulit sehingga dengan semakin banyaknya penggunaan kromium dalam
bidang industri akan meningkatkan jumlah kromium yang terbuang ke lingkungan. Oleh
karena itu penentuan secara simultan Cr(III) dan Cr(VI) yang selektif dan sensitif
diperlukan untuk mengetahui jumlah kromium yang terkandung dalam limbah industri
tersebut. Penelitian ini menggunakan pereaksi kromogenik campuran untuk
mengkompleks Cr(III) dan Cr(VI). Pereaksi kromogenik untuk Cr(III) adalah
2-hidroksibenzaldiminoglisin (HBIG) dan Cr(VI) adalah bromopirogalol merah (BPR).
Penggunaan pereaksi kromogenik campuran ini bertujuan menentukan secara simultan
kedua bentuk oksidasi kromium dengan UV-VIS spektrofotometri.
Panjang gelombang terbaik pengukuran senyawa kompleks Cr(III)-HBIG adalah
576.4 nm, sedangkan untuk senyawa kompleks Cr(VI)-BPR adalah 635 nm. Pemilihan
larutan bufer pH 6.0 menunjukkan larutan bufer asetat lebih baik dibandingkan dengan
larutan bufer fosfat dengan waktu inkubasi terbaik 60 menit pada suhu kamar. Pengaruh
beberapa pereaksi menunjukkan bahwa kehadiran pereaksi BPR tidak berpengaruh pada
bentuk spektrum serapan Cr(III)-HBIG, demikian juga pereaksi HBIG tidak berpengaruh
pada bentuk spektrum serapan Cr(VI)-BPR. Kehadiran surfaktan setiltrimetilamonium
bromida (CTAB) tidak berpengaruh pada bentuk spektrum serapan Cr(III)-HBIG, tetapi
pada pengukuran Cr(VI)-BPR kehadiran CTAB sangat diperlukan karena mempunyai
efek katalis. Linearitas terbaik pada penentuan kurva standar Cr(III) dan Cr(VI)
masing-masing adalah 0.9929 pada kisaran konsentrasi 40-100
µ
g/ml untuk Cr(III) dan 0.25-0.29
ABSTRACT
MIRAH SUMINAR. Determination Cr(III & VI) Complex Compound Formation
Condition using Mixed Chromogenic Reagent. Under the direction of ETI ROHAETI and
MOHAMAD RAFI.
Chromium is a unique metal, because Cr(III) form, chromium is needed for human
health, while Cr(VI) is known as a carcinogenic agent. Until now chromium is still
widely used in steel and leather tanning industries, which means that the more chromium
used in industries the more chromium disposed to the environment. Therefore a sensitive
and selective simultaneous determination of Cr(III) and Cr(VI) is needed to monitor the
effluent of industries mentioned above. In this study, mixed chromogenic reagents used to
complex Cr(III) and Cr(VI). For Cr(III) the chromogenic reagent were
2-hydroxybenzaldiminoglycine (HBIG) and Cr(VI) were bromopyrogallol red (BPR). The
mixed chromogenic reagent used for simultaneous determination of the two oxidation
states of chromium by UV-VIS spectrophotometry.
PENCARIAN KONDISI PEMBENTUKAN SENYAWA
KOMPLEKS Cr(III & VI) DENGAN PEREAKSI
KROMOGENIK CAMPURAN
MIRAH SUMINAR
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Pencarian Kondisi Pembentukan Senyawa Kompleks Cr(III & VI) dengan
Pereaksi Kromogenik Campuran
Nama : Mirah Suminar
NIM : G44202038
Menyetujui:
Pembimbing I,
Pembimbing II,
Dr. Eti Rohaeti, M.S.
Mohamad Rafi, S.Si
NIP 131663015
NIP 132321454
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
PRAKATA
Puji
dan syukur penulis panjatkan Kehadirat Allah SWT atas segala rahmat dan
karunia-Nya sehinga penulis dapat menyelesaikan karya ilmiah ini.
Tema yang dipilih
dalam penelitian ini adalah Cr(III) dan Cr(VI) dengan judul Pencarian Kondisi
Pembentukan Senyawa Kompleks Cr(III & VI) dengan Pereaksi Kromogenik Campuran.
Terima kasih penulis ucapkan kepada Ibu Dr. Eti Rohaeti, M.S dan Mohamad Rafi,
S.Si selaku pembimbing yang telah memberikan bimbingan dan pengarahan dalam
penulisan karya ilmiah ini. Penghargaan penulis sampaikan kepada
Om
Eman, Bapak
Ridwan, Bapak Manta, Ibu Nunung, Bapak Kosasih, Bapak Dede beserta staf
Laboratorium Kimia Analitik,
Mbak
Siti Rachma,
Mbak
Ii,
Mbak
Dewi beserta staf
Laboratorium Terpadu IPB,
Mas
Heri,
Kak
Budi, serta Bapak Farid atas sarannya. Selain
itu ucapan terima kasih kepada Steven, Nita, Miranti, Karin, Cherry, Yudi PH, Ari, Intan,
Kak
Akbar, dan rekan-rekan Kimia 39 atas kebersamaannya yang indah. Ungkapan
terima kasih juga penulis sampaikan kepada ibunda tercinta, kakak dan kedua adikku,
serta seluruh keluarga atas segala doa, semangat, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 26 November 1983 dari ayah (Alm) Oey
Ho Goan dan ibu Titing Sumarsih. Penulis merupakan putri satu-satunya dari empat
bersaudara.
Tahun 2002 penulis lulus dari SMU Negeri 2 Bogor dan pada tahun yang sama
lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih
Program Studi Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kromium... 2
Kromium(III) ... 2
Kromium(VI)... 3
Spektrofotometri ... 3
Analisis Multikomponen ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode ... 5
HASIL DAN PEMBAHASAN
Penentuan
λmaks... 7Pengaruh Larutan Bufer pH 6.0... 8
Pengaruh Waktu Pengukuran ... 8
Pengaruh Beberapa Pereaksi... 9
Penentuan Kurva Standar Cr(III) dan Cr(VI) ... 11
Pengujian Kadar Cr(III) dan Cr(VI) dalam Campuran Sintetik... 11
SIMPULAN DAN SARAN
Simpulan... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Spektrum serapan dua zat yang tercampur terpisah sempurna, bertumpang tindih
sebagian, dan bertumpang tindih sempurna...4
2 Struktur HBIG...6
3 Struktur BPR...6
4 Spektrum serapan senyawa kompleks Cr(III)-HBIG...7
5 Spektrum serapan senyawa kompleks Cr(VI)-BPR...8
6 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan larutan bufer pH 6.0
asetat dan fosfat...8
7
Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan larutan bufer pH 6.0
fosfat dan asetat...8
8 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan
CTAB dan tanpa penambahan CTAB
.... 9
9 Spektrum serapan tunggal BPR dan spektrum serapan senyawa kompleks
Cr(VI)-BPR tanpa penambahan CTAB.
......9
10 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan pengaruh BPR
dan tanpa pengaruh BPR... ...10
11 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan pengaruh HBIG
dan tanpa pengaruh HBIG...10
12 Spektrum serapan senyawa kompleks Cr(III)-BPR dan spektrum serapan
larutan stok standar Cr(III)...10
13 Spektrum serapan senyawa kompleks Cr(VI)-BPR dan Cr(VI)-HBIG...10
14 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan
Cr(VI) dan tanpa penambahan Cr(VI)...11
15 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan penambahan
Cr(III) dan tanpa penambahan Cr(III)...11
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian ... 16
2 Perhitungan preparasi larutan stok standar Cr(III) dan Cr(VI) ... 17
3 Penentuan konsentrasi HBIG... 18
4 Hubungan serapan larutan Cr(III)-HBIG (bufer asetat) dengan waktu
pengukuran (menit) ... 19
5 Hubungan serapan larutan Cr(III)-HBIG (bufer fosfat) dengan waktu
pengukuran (menit)...19
6 Hubungan serapan larutan Cr(VI)-BPR (bufer fosfat) dengan waktu
pengukuran (menit)...20
7 Hubungan serapan larutan Cr(VI)-BPR (bufer asetat) dengan waktu
pengukuran (menit)...20
8 Kurva standar Cr(III) dan Cr(VI)...21
9 Pengaruh penambahan larutan stok standar kromium terhadap linearitas kurva
standar Cr(III) dan Cr(VI)...22
PENDAHULUAN
Kromium merupakan salah satu logam berat yang berada pada golongan VIB dan periode keempat, dengan nomor atom 24 dan nomor massa 52. Bentuk kromium yang stabil di alam adalah kromium trivalen (Cr(III)) dan kromium heksavalen (Cr(VI)). Kromium trivalen memiliki tingkat toksisitas yang lebih
rendah dibandingkan dengan kromium
heksavalen. Kromium trivalen dalam
konsentrasi yang rendah berguna untuk metabolisme karbohidrat pada mamalia dan mengaktifkan insulin, selain itu apabila terjadi kekurangan Cr(III) maka akan mengganggu pertumbuhan dan metabolisme lemak dan protein. Namun pada konsentrasi yang lebih tinggi Cr(III) dapat menimbulkan keracunan baik secara akut maupun kronis. Kromium heksavalen merupakan bentuk komersial yang lebih penting karena sering digunakan dalam industri. Hampir semua kromium yang bervalensi +6 ada di dalam lingkungan kegiatan manusia yang berasal dari oksidasi industri, tambang kromium, pembakaran minyak bumi, kertas, dan kayu. Kromium heksavalen biasanya stabil di udara dan air, tetapi kestabilannya akan berkurang jika terjadi kontak dengan bahan organik lainnya (Kusnoputranto 1996).
Saat ini penggunaan kromium dalam bidang industri semakin meningkat, sehingga secara langsung akan meningkatkan pula jumlah kromium yang terbuang ke dalam lingkungan. Kromium banyak ditemukan dalam limbah industri pelapisan logam (elektroplating), penghambat korosi besi, penyamakan kulit, dan sebagainya. Air limbah yang tercemar kromium ini merupakan racun yang berbahaya bagi kehidupan organisme. Kromium bila masuk ke dalam tubuh manusia dapat menyebabkan gangguan dalam sistem saraf pusat, sistem koordinasi otot, cacat lahir, dan kanker. Menghirup kromium dalam jangka waktu yang lama dapat menyebabkan penyakit asma, ginjal, alergi kulit bahkan kanker paru-paru (Bobrowski et al. 2004). Oleh karena itu sangat penting melakukan kontrol dengan mengukur jumlah kedua spesi kromium dibandingkan dengan hanya mengukur kromium total pada limbah industri dan sumber air minum.
Beberapa teknik analisis telah
dikembangkan untuk penetapan kadar Cr(III) dan Cr(VI) pada suatu contoh secara individu maupun simultan. Spektrofotometri sinar tampak dan spektrofotometri serapan atom (AAS) merupakan teknik yang paling umum
digunakan untuk penetapan logam tersebut (Yalcin & Apak 2004).
Selain spektrofotometri sinar tampak dan AAS, ada beberapa teknik lain yang
digunakan seiring dengan kemajuan
instrumentasi seperti Inductively Coupled Plasma-Atomic Emission Spectrometry (ICP-AES) (Zhu et al. 2002, Sumida et al. 2006),
Inductively Coupled Plasma-Mass Spectrometry (ICP-MS) (Stewart & Olesik
2000), High Performance Liquid
Chromatography (HPLC) yang digabungkan dengan sistem detektor seperti pada AAS
(Lintschinger et al. 1995), LC-ICP-MS
(Chang & Jiang 2001), HPLC-ICP-MS (Seby
et al. 2003), kromatografi ion dengan detektor UV (Michalski 2004), elektroda ion selektif (Singh et al. 2004, Hassan et al. 2005), dan elektroforesis kapiler (Himeno et al. 1998). Namun untuk menentukan kadar kedua spesi kromium, yaitu Cr(III) dan Cr(VI)
teknik-teknik ini tetap memerlukan tahapan
prekonsentrasi maupun separasi.
Analisis kromium dengan
menggunakan spektrofotometri sinar tampak dapat dilakukan berdasarkan kemampuan ion
kromium dalam membentuk senyawa
kompleks berwarna dengan beberapa pereaksi
pembentuk warna (kromogenik). Ada
beberapa pereaksi kromogenik yang dapat digunakan untuk menganalisis kromium, tetapi tidak semuanya memberikan hasil yang sesuai dengan yang diharapkan karena di antara pereaksi kromogenik tersebut dapat juga membentuk kompleks dengan ion logam lain, contohnya saja reaksi kromium dengan 1,5-difenilkarbazida (DPC). Pereaksi ini tidak hanya bereaksi dengan kromium tetapi juga dapat bereaksi dengan logam transisi seperti merkuri, molibdenum, vanadium, dan besi yang mungkin dapat mengganggu pengukuran
kromium jika logam tersebut berada
spesi kromium. Kumar & Muthuselvi (2006) telah melakukan analisis Cr(III) dengan
pereaksi 2-hidroksibenzaldiminoglisin
(HBIG), sementara Huang et al. (1997) telah melakukan analisis Cr(VI) dengan pereaksi bromopirogalol merah (BPR). Kedua pereaksi kromogenik tersebut digunakan juga dalam penelitian ini dan diharapkan tidak saling
berinteraksi satu sama lain, sehingga
pengukuran kadar kromium dapat menjadi lebih akurat. Ion kompleks yang terbentuk akan memiliki konstanta kestabilan yang berbeda-beda tergantung pada kuat lemahnya ligan yang bergabung dengan ion tersebut. Oleh karena itu pengujian terhadap beberapa pereaksi yang dapat mempengaruhi bentuk
spektrum serapan senyawa kompleks
kromium dan penetapan kondisi seperti waktu pengukuran dan larutan bufer perlu dilakukan. Penelitian ini bertujuan menetapkan kondisi terbaik pengukuran simultan Cr(III) dan Cr(VI) dalam pereaksi kromogenik
campuran (HBIG dan BPR) dengan
mempelajari pengaruh beberapa pereaksi, waktu pengukuran, dan larutan bufer melalui metode spektrofotometri sinar tampak.
TINJAUAN PUSTAKA
KromiumKromium merupakan salah satu logam berat yang termasuk ke dalam unsur transisi golongan VIB dan berada pada periode 4 dalam daftar periodik. Kromium merupakan logam yang mengkilap dengan massa jenis 7.9 g/cm3, memiliki titik didih tinggi (2658 oC), dan titik leleh 1875 oC. Kromium ditemukan di alam sebagai tiga bentuk stabil, yaitu kromium metal/logam, kromium(III), dan
kromium(VI). Kromium metal/logam
merupakan unsur dengan nomor atom 24 dalam tabel periodik, terbentuk secara luas dalam penambangan kromit, dan sangat resisten terhadap bahan kimia (korosif dan oksidatif), sehingga menjadi pertimbangan untuk digunakan dalam baja tahan karat dan
pelapisan kromium. Kromium(III) dan
kromium(VI) adalah bentuk-bentuk krom yang bergabung dengan unsur-unsur lain untuk membentuk senyawa (Kusnoputranto 1996).
Kromium merupakan zat yang unik,
karena disatu pihak dibutuhkan untuk
kesehatan manusia dalam bentuk tertentu (Cr(III)), tetapi dilain pihak merupakan zat yang dapat menyebabkan kanker paru-paru dalam bentuk yang lain (Cr(VI)). Logam berat
ini berada dalam urutan kedua setelah benzena sebagai penyusun utama pencemar udara toksik (Kusnoputranto 1996).
Kromium(III)
Kromium(III) atau kromium trivalen adalah bentuk yang paling penting berada di lingkungan, karena bentuknya lebih stabil
dibandingkan kromium logam dan
kromium(VI). Kromium trivalen hampir semuanya berbentuk kationik atau netral, cenderung membentuk senyawaan kompleks stabil dengan spesi organik ataupun anorganik yang bermuatan negatif. Sebagai contoh, Cr(III) akan membentuk senyawaan kompleks kuat dengan amina dan akan teradsorbsi oleh mineral tanah. (U.S Department of Commerce
1980 diacu dalam Yanto 2004).
Kromium(III) dibutuhkan untuk
kesehatan manusia, yaitu bersama-sama
dengan insulin dapat menjaga kadar gula darah yang sesuai (glucose tolerance). Glucose tolerance adalah waktu yang diperlukan agar gula dalam darah kembali pada kadar normal bila manusia yang puasa mengkonsumsi gula. Waktu yang normal sekitar 2.5 jam. Bila lebih dari waktu tersebut
dianggap glucose tolerance-nya akan
terganggu, dan dengan pemberian kromium dapat diperbaiki. Kromium banyak dikandung dalam keju, biji-bijian, krim kacang, daging, dan ragi (Winarno 1997).
Kromium dapat masuk ke dalam tubuh bergantung pada sifat kimia dan sifat fisiknya. Bentuk Cr(III) berada di dalam pencernaan makanan dengan tingkat penyerapan kira-kira 3-6%, setelah terjadi penyerapan, kromium akan dikeluarkan bersama dengan urin sebesar 0.5-1.5 µg. Krom trivalen juga secara bebas terdapat di udara dan dapat masuk ke dalam jaringan paru-paru jika terhirup oleh manusia, selanjutnya akan masuk ke bagian dalam saluran pernafasan dan konsentrasinya akan semakin bertambah karena kromium akan terakumulasi.
Metode analisis yang telah ada untuk menentukan kadar Cr(III) secara langsung berdasarkan pembentukan kompleks dengan
spektrofotometer masih sangat sedikit.
Beberapa metode yang telah ada selalu dilakukan pemanasan dengan cara refluks yang disebabkan oleh lambatnya reaksi
pembentukan kompleks Cr(III) dengan
Holland 1971), kalium heksasianoferat(II) (Malik & Bembi 1975), EDTA (Rengasamy & Oades 1977), tropolon (Rizvi 1983), senyawa turunan tiazolilazo seperti 4-(-2-tiazolilazo) resorsinol (Carvalho et al. 2004), HBIG (Kumar & Muthuselvi 2006), dan α-benzoin oksim (Ghaedi et al. 2006).
Kromium(VI)
Kromium(VI) atau kromium
heksavalen merupakan bentuk yang paling berbahaya dan dapat menimbulkan efek yang merugikan kesehatan manusia. Kromium heksavalen hampir semuanya berbentuk senyawaan anionik, sangat larut dalam
perairan dan relatif stabil meskipun
senyawaan ini merupakan zat pengoksidasi yang kuat di dalam larutan asam, selain itu juga Cr(VI) tidak berada dalam bentuk senyawaan koordinasi tetapi ditemukan dalam material biologis, dan memiliki afinitas terhadap sel darah merah.
Senyawaan Cr(VI) di dalam
lingkungan berasal dari limbah industri, tambang kromium, pembakaran minyak bumi, kertas dan kayu. Sampah padat yang mengandung Cr(VI) dapat menjadi suatu bahaya jika dibuang ke dalam penimbunan sampah berlapis (landfill) karena bentuk dari kromium tersebut sangat mudah bergerak di dalam air tanah (Kusnoputranto 1996).
Kromium heksavalen dapat
menyebabkan kerusakan hati dan ginjal, pendarahan di dalam tubuh, dermatitis, kerusakan saluran pernafasan, dan kanker paru-paru. Namun kasus dermatitis akibat
keracunan Cr(VI) relatif sudah jarang
ditemukan. Bahaya jangka panjang terhadap
saluran pernafasan dan kulit dapat
menyebabkan peradangan rongga hidung, pendarahan hidung, dan kerusakan jaringan kulit. Respon yang lebih umum terjadi adalah reaksi alergi kulit terhadap produk yang mengandung kromium seperti kulit, semen, ragi bir, pengawet kayu, cat, lem, dan pewarna
kayu. Reaksi-reaksi tersebut dapat
disembuhkan dengan krim hidrokortison atau larutan asam askorbat (vitamin C).
United States Environmental Protection Agency (USEPA) telah menempatkan Cr(VI) sebagai senyawa yang
karsinogenik. Percobaan laboratorium
membuktikan bahwa senyawa-senyawa
Cr(VI) atau hasil-hasil reaksi antaranya di dalam sel dapat menyebabkan kerusakan pada materi genetik. Studi lain pada binatang
percobaan menunjukkan bahwa bentuk
kromium tersebut dapat menyebabkan
masalah reproduksi. Efek yang sangat
berbahaya dari Cr(VI) menyebabkan
pemerintah memasukkan Cr(VI) dalam
kriteria nilai baku mutu air. Kementerian
Negara Lingkungan Hidup Republik
Indonesia telah menetapkan bahwa
konsentrasi kromium total sebesar 2 µg/ml sebagai batas maksimum yang diperbolehkan untuk limbah industri sedangkan untuk air minum konsentrasi Cr(VI) sebesar 0.05
µg/ml. Kromium heksavalen banyak
dimanfaatkan juga untuk produksi zat kimia kromium, pigmen untuk cat dan tekstil, penyamakan kulit, bahan pengawet kayu, serta dapat digunakan dalam pendingin pembangkit tenaga listrik untuk mencegah karat. Namun harus tetap diperhatikan juga bahwa meskipun Cr(VI) dapat membawa manfaat tetapi limbah industrinya dapat menyebabkan pencemaran.
Penentuan kadar Cr(VI) secara
spektrofotometer sinar tampak dengan
pereaksi DPC merupakan metode yang paling umum, akan tetapi gangguan dari Fe(III),
Mo(VI), Cu(II), dan Hg(II) sangat
mempengaruhi hasil yang diperoleh dan hanya membentuk kompleks yang stabil selama 30 menit dengan adanya bufer fosfat. Pereaksi lain juga telah diteliti untuk digunakan dalam menentukan kadar Cr(VI), yaitu ferpenazin (Mohamed & El-Shahat 2000), asam sitrazinat
(Revanasiddappa & Kumar 2001),
trifluoroperazin hidroklorida (Revanasiddappa & Kumar 2002),
2-[2-(4-metoksi-fenilamino)-vinil]-1,3,3-trimetil-3H-indolium klorida
(Andruch et al. 2003), BPR (Huang et al. 1997), dan variamin biru (Narayana & Cherian 2005).
Spektrofotometri
Dasar teknik spektrofotometri adalah interaksi antara radiasi elektromagnetik dengan bahan yang akan dianalisis. Yang dimaksud radiasi elektromagnetik adalah suatu bentuk dari energi yang diteruskan melalui ruang dengan kecepatan sebesar 2.99792 x 1010 cm/detik dalam ruang vakum.
Besar energi radiasi bergantung pada
dilihat sebagai penyerapan radiasi oleh bahan dan merupakan dasar dari spektroskopi (Adijuwana & Nur 1989).
Spektrofotometer adalah alat yang terdiri dari spektrometer dan fotometer.
Spektrometer menghasilkan sinar dari
spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diserap.
Jadi spektrofotometer digunakan untuk
mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan, atau diemisikan sebagai fungsi dari panjang gelombang. Pengukuran absorbansi atau
transmitansi dalam spektrofotometer
ultraviolet dan sinar tampak digunakan untuk analisis kualitatif dan kuantitatif spesies kimia
(Khopkar 2003). Spektrum ultraviolet
terentang dari 100 hingga 400 nm, sedangkan spektrum sinar tampak terentang dari 400 hingga 750 nm (Fessenden RJ & JS Fessenden
1980). Komponen-komponen utama
spektrofotometer adalah sumber radiasi, monokromator, wadah untuk larutan contoh, detektor, dan peralatan pembacaan hasil (Hargis 1988).
Spektrum serapan pada
spektrofotometri sinar tampak dan ultraviolet diukur dalam bentuk larutan, oleh karena itu apabila analat tersedia dalam bentuk padatan
maka harus beri perlakuan yang
memungkinkan untuk mendapatkan larutan komponen yang dapat diukur. Analat yang dapat diukur dengan spektrofotometri sinar tampak adalah analat yang berwarna atau dapat dibuat berwarna. Oksidasi merupakan salah satu proses yang digunakan untuk membuat analat tertentu menjadi berwarna. Proses lainnya yang dapat digunakan adalah
pembentukan senyawa kompleks. Suatu
kompleks selalu terjadi dari sebuah ion logam yang dinamakan ion pusat dan komponen-komponen lain yang berupa ion negatif atau molekul yang dinamakan ligan. Jumlah ligan dalam sebuah kompleks berbeda-beda. Jumlah
ikatan dengan ligan disebut bilangan
koordinasi (Harjadi 1986).
Analisis Multikomponen
Suatu analat kadang-kadang
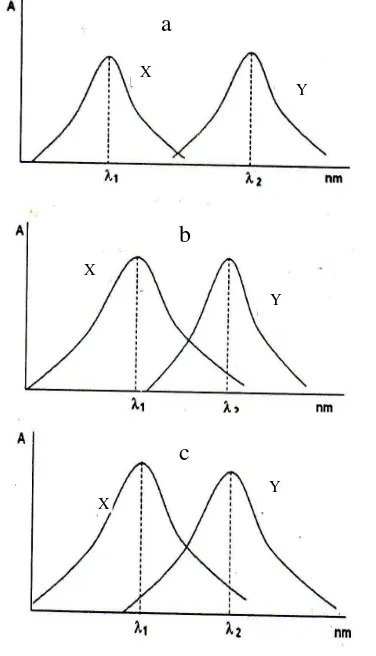
mengandung lebih dari satu komponen yang bisa diukur dengan cara spektrofotometri. Penentuan komposisi campuran tersebut perlu diketahui terlebih dahulu spektrum serapan dari masing-masing komponennya. Pada dasarnya ada tiga kemungkinan spektrum serapan dua zat yang tercampur, yaitu terpisah sempurna, bertumpang tindih sebagian, dan
bertumpang tindih sempurna. Spektrum
terpisah sempurna artinya sinar pada panjang gelombang maksimum (λmaks) yang diserap
komponen 1 (misalnya komponen X) tidak
diserap oleh komponen 2 (misalnya
komponen Y) dan sebaliknya komponen Y tidak menyerap sinar pada λmaks komponen X.
Spektrum bertumpang tindih sebagian artinya sinar pada λmaks yang diserap oleh komponen
X tidak dapat diserap oleh komponen Y. Sementara sinar pada λmaks yang diserap oleh
komponen Y dapat diserap oleh komponen X. Spektrum bertumpang tindih sempurna artinya sinar pada λmaks yang diserap oleh komponen
X dapat diserap pula oleh komponen Y dan sebaliknya sinar pada λmaks yang diserap oleh
komponen Y dapat diserap pula oleh komponen X. Spektrum serapan dua zat tersebut akan menentukan berapa kurva standar yang harus dibuat dalam penentuan kadar kedua zat tersebut.
Campuran yang spektrum serapannya terpisah sempurna (Gambar 1a), bila dibaca serapannya pada λ1 maka serapan (A1) yang
terukur hanya disebabkan oleh komponen X, dan bila dibaca pada λ2 maka serapan (A2)
yang terukur hanya disebabkan oleh
komponen Y. Berapapun besarnya komponen Y tidak mengubah serapan pada λ1, begitu
pula sebaliknya. Sehingga apabila dimasukkan ke dalam persamaan Lambert-Beer menjadi A1 = k1.Cx dan A2 = k2.Cy. Nilai Cx dan Cy
dapat dihitung jika nilai k1 dan k2 diketahui.
Kedua tetapan tersebut dapat diketahui dari kurva standar X pada λ1 dan Y pada λ2,
sehingga diperlukan dua kurva standar. Sedangkan bila X dan Y mempunyai spektrum serapan bertumpang tindih sebagian
seperti pada Gambar 1b, maka A1
menunjukkan serapan yang hanya disebabkan oleh X, sedangkan A2 disebabkan oleh X dan
Y sehingga persamaan Lambert-Beer menjadi A1 = k1x.Cx dan A2 = k2x.Cx + k2y.Cy. Nilai k1x
tidak sama dengan k2x karena panjang
gelombangnya berbeda dan k2x tidak sama
dengan k2y karena zatnya berbeda. Pada kasus
ini ketiga nilai k diperoleh dari kurva standar X pada λ1 dan λ2 dan Y hanya pada λ2. Dua
komponen yang mempunyai spektrum serapan bertumpang tindih sempurna (Gambar 1c) persamaan Lambert-Beer-nya adalah A1 =
k1x.Cx + k1y.Cy dan A2 = k2x.Cx + k2y.Cy.
Keempat tetapan tersebut diperoleh dari kurva standar masing-masing senyawa pada λ1 dan λ2.
Beberapa contoh pemakaian metode ini adalah pada analisis kromium dan mangan dari sampel baja tanpa melakukan pemisahan
terlebih dahulu. Oksidasi mangan
menghasilkan KMnO4 yang memiliki serapan
maksimum pada 545 nm sedangkan kromium
menghasilkan K2Cr2O7 dengan serapan
maksimum 440 nm. Penentuan konsentrasi paladium dan platinum juga dapat ditentukan secara simultan dengan spektrofotometri. Keduanya membentuk kompleks dengan SnCl2 dalam media HClO4 dan mempunyai
serapan maksimum pada 635 nm dan 405 nm (Khopkar 2003).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan antara lain CrCl3.6H2O sebagai sumber Cr(III),
K2Cr2O7 sebagai sumber Cr(VI), glisin, KOH,
salisilaldehida, etanol 99%, BPR, CTAB,
bufer fosfat pH 6.0, bufer asetat pH 6.0, dan air destilata bebas ion.
Alat-alat yang digunakan antara lain spektrofotometer UV-VIS Shimadzu 1700 PC dengan perangkat lunak UV-probe versi 2.21, kuvet kuarsa dengan tebal 1 cm, hot plate, pengaduk bermagnet, termometer, neraca analitik, pH meter, dan peralatan kaca.
Metode
Penelitian terdiri atas beberapa
tahapan, yaitu pembuatan spektrum serapan untuk penentuan λmaks senyawa kompleks
Cr(III)-HBIG dan Cr(VI)-BPR, pengujian pengaruh larutan bufer asetat dan fosfat pH 6.0 terhadap λmaks, pengujian pengaruh waktu
pengukuran terhadap intensitas warna
kompleks untuk mengetahui kestabilan warna
larutan senyawa kompleks, pengujian
pengaruh beberapa pereaksi, yaitu CTAB, BPR, dan HBIG terhadap bentuk spektrum serapan dari senyawa kompleks kromium yang terbentuk, penentuan kurva standar Cr(III) dan Cr(VI) serta pengujian kadar Cr(III) dan Cr(VI) dalam campuran sintetik (Lampiran 1).
Preparasi Larutan Stok Standar Cr(III) dan Cr(VI)
Larutan stok standar Cr(III) dan Cr(VI) dengan konsentrasi 750 µg/ml dan 5 µg/ml disiapkan dengan cara sebanyak 0.3844 g Cr(III) dan 0.0056 g Cr(VI) ditimbang dari
masing-masing garamnya kemudian
dilarutkan dengan air destilata bebas ion pada labu takar 100 ml (Lampiran 2).
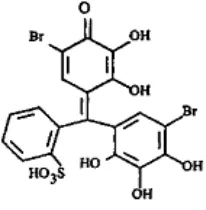
Preparasi Larutan 2-Hidroksibenzaldimino glisin (HBIG) (Kumar & Muthuselvi 2006)
Berikut ini adalah struktur dari HBIG:
Gambar 2 Struktur HBIG.
Preparasi Larutan Bromopirogalol Merah (BPR) 9x10-4 M (Huang et al. 1997)
Pereaksi ini dibuat dengan cara sebanyak 0.0130 g BPR ditimbang dan dilarutkan dengan air destilata bebas ion hingga 25 ml. Selanjutnya pereaksi ini dapat digunakan sebagai pereaksi kromogenik untuk Cr(VI). Berikut ini adalah struktur dari BPR:
Gambar 3 Struktur BPR.
Preparasi Larutan Bufer pH 6.0
Larutan bufer fosfat disiapkan dengan cara 12.8 ml larutan dinatrium hidrogen ortofosfat (Na2HPO4) 0.01 M dicampurkan
dengan 87 ml larutan natrium dihidrogen ortofosfat (NaH2PO4) 0.01 M. Sedangkan
larutan bufer asetat disiapkan dengan cara 4.4 ml larutan asam asetat 0.1 M dicampurkan dengan 90 ml larutan natrium asetat 0.1 M.
Penentuan λλλλmaks Senyawa Kompleks Cr(III)-HBIG dan Cr(VI)-BPR
Senyawa kompleks Cr(III) dengan pereaksi kromogenik HBIG selanjutnya ditulis Cr(III)-HBIG disiapkan dengan cara sebanyak 2 ml larutan bufer asetat pH 6.0 dipipet dan dimasukkan ke dalam labu takar 25 ml kemudian ditambahkan 2.5 ml larutan Cr(III) 750 µg/ml, 3.5 ml larutan HBIG 9.9219x10-4 M, dan 0.2 ml larutan CTAB 2.7x10-3 M. Larutan tersebut kemudian ditera dengan air destilata bebas ion, dikocok, dan didiamkan selama 60 menit. Serapan larutan diukur pada kisaran panjang gelombang 450-800 nm dengan larutan blanko yang berisi 3.5 ml larutan HBIG 9.9219x10-4 M dan 0.2 ml
larutan CTAB 2.7x10-3 M lalu ditera hingga 25 ml. Berdasarkan data yang diperoleh kemudian dibuat kurva hubungan serapan larutan terhadap panjang gelombang.
Senyawa kompleks Cr(VI) dengan pereaksi kromogenik BPR selanjutnya ditulis Cr(VI)-BPR disiapkan dengan cara sebanyak 4 ml larutan bufer asetat pH 6.0 dipipet dan dimasukkan ke dalam labu takar 25 ml kemudian ditambahkan 1.35 ml larutan Cr(VI) 5 µg/ml, 1 ml larutan BPR 9x10-4 M, dan 1 ml larutan CTAB 2.7x10-3 M. Larutan tersebut kemudian ditera dengan air destilata bebas ion, dikocok, dan didiamkan selama 60 menit. Serapan larutan diukur pada kisaran panjang gelombang 450-800 nm dengan larutan blanko yang berisi 1 ml larutan BPR 9x10-4 M, dan 1 ml larutan CTAB 2.7x10-3 M lalu ditera hingga 25 ml. Berdasarkan data yang diperoleh kemudian dibuat kurva hubungan serapan larutan terhadap panjang gelombang.
Pengaruh Larutan Bufer pH 6.0 terhadap λ
λ λ
λmaks Cr(III)-HBIG dan Cr(VI)-BPR serta Pengaruh Waktu Pengukuran Terhadap Intensitas Warna Kompleks
Persiapan larutan untuk pengukuran pengaruh larutan bufer pH 6.0 sama seperti persiapan larutan untuk penentuan λmaks,
kemudian disiapkan larutan lain yang serupa hanya saja dengan mengganti larutan bufer asetat dengan larutan bufer fosfat. Keempat larutan diukur setelah didiamkan selama 60 menit untuk melihat pengaruh larutan bufer asetat dan fosfat. Sementara untuk melihat pengaruh waktu pengukuran, keempat larutan tersebut diukur setiap 20 menit hingga menit ke-120.
Pengaruh Beberapa Pereaksi (CTAB, BPR, HBIG, dan larutan stok standar kromium) Terhadap Bentuk Spektrum Serapan dari Senyawa Kompleks Cr(III) dan Cr(VI)
Disiapkan larutan Cr(III)-HBIG
dengan cara yang sama seperti larutan untuk penentuan λmaks (larutan 1). Serapan larutan
serapan Cr(III)-HBIG maka disiapkan larutan yang sama dengan larutan (1) hanya saja pada larutan kemudian ditambahkan 0.25 ml larutan Cr(VI) 5 µg/ml.
Disiapkan larutan Cr(VI)-BPR dengan cara yang sama seperti larutan untuk penentuan λmaks (larutan 2). Serapan larutan
ini dibandingkan dengan larutan Cr(VI)-BPR lain yang disiapkan dengan cara yang sama tetapi tanpa penambahan pereaksi CTAB untuk melihat pengaruh penambahan CTAB terhadap bentuk spektrum serapan Cr(VI)-BPR. Kemudian untuk melihat pengaruh pereaksi HBIG terhadap kompleks Cr(VI)-BPR maka disiapkan larutan seperti larutan (2) yang ditambahkan HBIG sebanyak 3.5 ml, dan untuk melihat pengaruh larutan stok standar Cr(III) terhadap bentuk spektrum serapan Cr(VI)-BPR maka disiapkan larutan yang sama dengan larutan (2) hanya saja pada larutan kemudian ditambahkan 2.5 ml larutan Cr(III) 750 µg/ml.
Penentuan Kurva Standar Cr(III) dan Cr(VI)
Sejumlah larutan kromium disiapkan dengan cara yang sama seperti pada larutan (1) hanya saja dengan mengganti 2.5 ml volume larutan stok standar Cr(III) dengan masing-masing volume 1.3 ml; 1.7 ml; 2.0 ml; 2.3 ml; 2.7 ml; 3.0 ml; dan 3.3 ml larutan Cr(III) 750 µg/ml pada masing-masing labu takar. Pengaruh larutan Cr(VI) terhadap linearitas kurva standar Cr(III) dilakukan dengan cara yang sama tetapi dengan penambahan 0.25 ml larutan Cr(VI) 5 µg/ml pada masing-masing labu takar. Larutan tersebut kemudian diukur pada λmaks
Cr(III)-HBIG.
Sejumlah larutan kromium disiapkan dengan cara yang sama seperti pada larutan (2) hanya saja dengan mengganti 1.35 ml volume larutan stok standar Cr(VI) dengan masing-masing volume 1.25 ml; 1.30 ml; 1.35 ml; 1.40; dan 1.45 ml larutan Cr(VI) 5 µg/ml pada masing-masing labu takar. Pengaruh larutan Cr(III) terhadap linearitas kurva standar Cr(VI) dilakukan dengan cara yang sama tetapi dengan penambahan 2.5 ml larutan Cr(III) 750 µg/ml pada masing-masing labu takar. Larutan tersebut kemudian diukur pada λmaks Cr(VI)-BPR.
Pengujian Kadar Cr(III) dan Cr(VI) dalam Campuran Sintetik
Sebanyak 6 ml larutan bufer asetat pH 6.0 dipipet dan dimasukkan ke dalam labu takar
25 ml kemudian ditambahkan 2.3 ml larutan Cr(III) 750 µg/ml, 3.5 ml larutan HBIG 9.9219x10-4 M, 1.35 ml larutan Cr(VI) 5 µg/ml, 1 ml larutan BPR 9x10-4 M, dan 1 ml larutan CTAB 2.7x10-3 M. Larutan tersebut kemudian ditera dengan air destilata bebas ion, dikocok, didiamkan selama 60 menit dan diukur serapannya pada dua λmaks. Pembuatan
dan pengukuran larutan dilakukan sebanyak sepuluh kali ulangan. Larutan blanko yang digunakan berisi 3.5 ml larutan HBIG 9.9219x10-4 M, 1 ml larutan BPR 9x10-4 M, dan 1 ml larutan CTAB 2.7x10-3 M lalu ditera hingga 25 ml.
HASIL DAN PEMBAHASAN
Penentuan λλλλmaks Senyawa Kompleks Cr(III)dan Cr(VI)
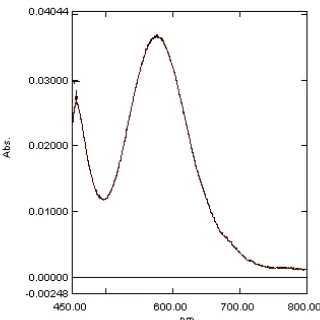
Senyawa kompleks Cr(III)-HBIG
menunjukkan serapan maksimum pada 576.4
nm (Gambar 4), sedangkan senyawa
kompleks Cr(VI)-BPR memberikan serapan maksimum pada 635 nm (Gambar 5),
sehingga pengukuran selanjutnya hanya
dilakukan pada kedua λmaks tersebut. Tujuan
pengukuran serapan larutan pada λmaks adalah
untuk mengurangi kesalahan atau
meningkatkan ketelitian dan kepekaan dalam menentukan konsentrasi suatu senyawa secara spektofotometri.
Gambar 5 Spektrum serapan senyawa kompleks Cr(VI)-BPR.
Pengaruh Larutan Bufer pH 6.0 Terhadap λ
λλ
λmaks Cr(III)-HBIG dan Cr(VI)-BPR
Larutan bufer memiliki peranan yang
penting dalam pembentukan kestabilan
senyawa kompleks kromium. Larutan bufer yang digunakan adalah larutan bufer fosfat dan larutan bufer asetat. Kumar & Muthuselvi (2006) telah mempelajari reaksi kompleks Cr(III)-HBIG pada larutan bufer fosfat pH 1.0-10.0. Mereka melaporkan bahwa nilai
serapan yang konstan dan maksimum
diperoleh pada kisaran pH 7.0-8.0, dan kestabilan kompleks Cr(III)-HBIG konstan hingga 5 jam. Sementara itu Huang et al. (1997) telah mempelajari reaksi kompleks Cr(VI)-BPR pada larutan bufer asetat pH 5.4-6.0. Nilai pH di atas 6.5 tidak dapat digunakan karena kestabilan BPR akan menurun. Oleh karena itu dipilih larutan bufer dengan pH 6.0. Berdasarkan Gambar 6 dan 7, kompleks Cr(III)-HBIG dan Cr(VI)-BPR pada larutan
bufer fosfat maupun asetat pH 6.0
memperlihatkan bentuk spektrum yang sama dan tidak mempengaruhi λmaks-nya, sehingga
larutan bufer fosfat dan asetat pH 6.0 keduanya dapat digunakan.
Gambar 6 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan larutan bufer pH 6.0 asetat (a) dan fosfat (b).
Gambar 7 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan larutan bufer pH 6.0 fosfat (a) dan asetat (b).
Pengaruh Waktu Pengukuran Terhadap Intensitas Warna Kompleks
Warna larutan senyawa kompleks Cr(III)-HBIG yang diperoleh adalah hijau
kekuningan sedangkan untuk senyawa
kompleks Cr(VI)-BPR adalah ungu kebiruan. Intensitas warna larutan ini tidak dapat ditentukan secara kasat mata saja tetapi juga
perlu dilakukan pengukuran serapannya
dengan spektrofotometer. Senyawa kompleks Cr(III)-HBIG memiliki kestabilan warna yang cukup baik dengan bufer asetat pH 6.0 setelah 60 menit. Hal ini terlihat dari serapan senyawa kompleks Cr(III)-HBIG yang mulai konstan sejak menit ke-60 hingga menit ke-120
a b
a
(Lampiran 4) sedangkan senyawa kompleks Cr(III)-HBIG dengan larutan bufer fosfat pH 6.0 memiliki kestabilan warna yang kurang baik, hal ini terlihat dari nilai serapannya yang tidak konstan (Lampiran 5). Sementara itu, intensitas warna senyawa kompleks Cr(VI)-BPR dalam larutan bufer fosfat maupun asetat pH 6.0 memiliki nilai serapan yang optimum pada menit ke-60 (Lampiran 6 & 7). Sehingga
untuk pengukuran Cr(III) dan Cr(VI)
selanjutnya digunakan larutan bufer asetat pH 6.0 dengan waktu pengukuran 60 menit setelah diinkubasi pada suhu kamar.
Pengujian pengaruh waktu terhadap intensitas warna larutan dilakukan dalam penelitian ini karena dalam proses analisis dengan spektrofotometer diperlukan rentang waktu untuk pembuatan, pewarnaan, dan pengukuran serapan larutan. Apabila senyawa
kompleks yang terbentuk mengalami
perubahan warna beberapa waktu setelah
pewarnaan dilakukan tentu saja akan
menyebabkan hasil pengukuran menjadi tidak akurat.
Pengaruh Beberapa Pereaksi (CTAB, BPR, HBIG, dan Larutan Stok Standar Kromium) Terhadap Bentuk Spektrum Serapan dari Senyawa Kompleks
Cr(III)-HBIG dan Cr(VI)-BPR
Pengujian pengaruh beberapa pereaksi, yaitu CTAB, HBIG, BPR, dan larutan stok standar kromium terhadap pembentukan senyawa kompleks kromium dilakukan dalam penelitian ini guna mengetahui ada tidaknya interaksi di antara pereaksi-pereaksi tersebut terhadap senyawa kompleks kromium yang
terbentuk. Pengujian ini dapat dilihat
berdasarkan bentuk spektrum serapannya. Bentuk spektrum serapan dari senyawa kompleks Cr(III)-HBIG dengan penambahan larutan CTAB ternyata tidak mengubah λmaks
-nya. Hal ini berarti bahwa larutan CTAB tidak mempengaruhi proses pengukuran senyawa kompleks Cr(III)-HBIG (Gambar 8).
Gambar 8 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan CTAB (a) dan tanpa penambahan CTAB (b).
Larutan CTAB merupakan jenis
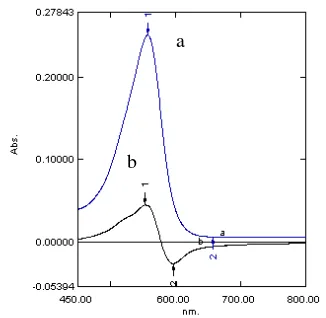
surfaktan kationik yang dapat mempercepat proses pembentukan kompleks Cr(VI)-BPR. Menurut Huang et al. (1997) larutan CTAB merupakan katalis yang lebih baik apabila dibandingkan dengan sodium dodesilsulfat (SDS), selain itu peranan CTAB juga dapat digantikan dengan proses pemanasan Cr(VI)-BPR pada suhu 100 oC, namun apabila proses tersebut dilakukan maka Cr(III) yang berada dalam campuran dapat ikut bereaksi dengan BPR. Apabila senyawa kompleks Cr(VI)-BPR tidak ditambahkan dengan katalis CTAB, maka proses pembentukan kompleksnya akan berlangsung lama. Hal ini dapat dilihat dari bentuk spektrum yang sama antara spektrum tunggal BPR dengan spektrum Cr(VI)-BPR tanpa penambahan CTAB, yaitu pada panjang gelombang 557 nm (Gambar 9).
Gambar 9 Spektrum serapan tunggal BPR (a) dan spektrum serapan senyawa
kompleks Cr(VI)-BPR tanpa
penambahan CTAB (b). a
a
b
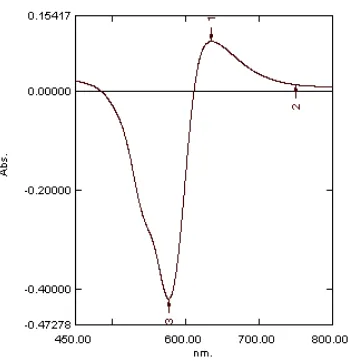
Penambahan pereaksi BPR terhadap
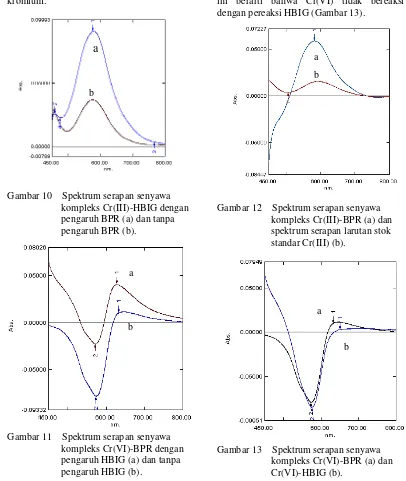
senyawa kompleks Cr(III)-HBIG
menunjukkan bentuk spektrum serapan yang tidak berbeda dibandingkan dengan spektrum serapan Cr(III)-HBIG tanpa penambahan BPR (Gambar 10). Hal ini menunjukkan bahwa kehadiran BPR tidak berpengaruh terhadap
bentuk spektrum serapan Cr(III)-HBIG.
[image:30.595.106.512.263.744.2]Demikian juga penambahan pereaksi HBIG terhadap senyawa kompleks Cr(VI)-BPR menunjukkan spektrum serapan yang sama dengan spektrum serapan Cr(VI)-BPR tanpa penambahan HBIG (Gambar 11). Hal ini berarti bahwa kedua pereaksi kromogenik tersebut selektif untuk masing-masing spesi kromium.
[image:30.595.122.277.281.432.2]Gambar 10 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan pengaruh BPR (a) dan tanpa pengaruh BPR (b).
Gambar 11 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan pengaruh HBIG (a) dan tanpa pengaruh HBIG (b).
Reaksi antara senyawa Cr(III)-BPR memperlihatkan bentuk spektrum yang sama dengan larutan stok standar Cr(III) 75 µg/ml (Gambar 12). Ini berarti bahwa Cr(III) dengan pereaksi BPR tidak membentuk kompleks. Hasil ini sesuai dengan pernyataan Huang et al. (1997) yang mengatakan bahwa Cr(III) dengan pereaksi BPR tidak membentuk kompleks pada suhu ruang meskipun dengan penambahan CTAB, kecuali bila dipanaskan pada suhu 100 oC. Sementara itu bentuk spektrum Cr(VI) dengan pereaksi HBIG tidak memperlihatkan serapan maksimum pada
daerah 600-800 nm (bentuk spektrum
cenderung datar dengan sedikit serapan), hal ini berarti bahwa Cr(VI) tidak bereaksi dengan pereaksi HBIG (Gambar 13).
[image:30.595.331.506.288.719.2]
Gambar 12 Spektrum serapan senyawa kompleks Cr(III)-BPR (a) dan spektrum serapan larutan stok standar Cr(III) (b).
Gambar 13 Spektrum serapan senyawa kompleks Cr(VI)-BPR (a) dan Cr(VI)-HBIG (b).
a
b
a
b
b
a
a
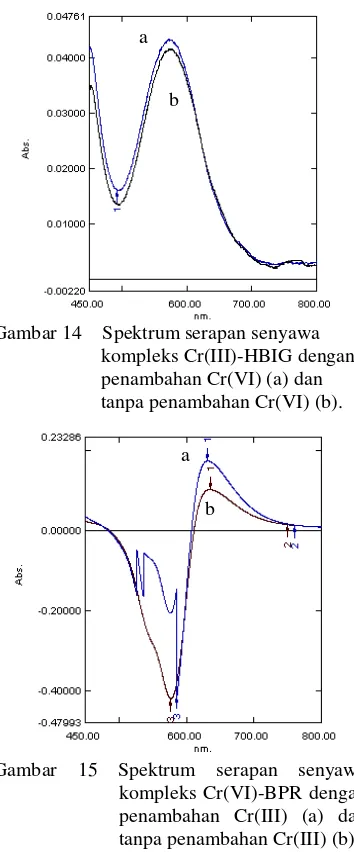
Penambahan larutan Cr(VI) terhadap
senyawa kompleks Cr(III)-HBIG dan
penambahan larutan Cr(III) terhadap senyawa
kompleks Cr(VI)-BPR memperlihatkan
[image:31.595.117.294.189.623.2]bentuk spektrum yang sama. (Gambar 14 & 15). Hal ini berarti bahwa dalam bentuk campuran masing-masing spesi kromium tersebut tidak akan saling mengganggu senyawa kompleks yang terbentuk.
Gambar 14 Spektrum serapan senyawa kompleks Cr(III)-HBIG dengan penambahan Cr(VI) (a) dan tanpa penambahan Cr(VI) (b).
Gambar 15 Spektrum serapan senyawa kompleks Cr(VI)-BPR dengan penambahan Cr(III) (a) dan tanpa penambahan Cr(III) (b).
Penentuan Kurva Standar dan Pengujian Kadar Cr(III) dan Cr(VI) dalam Campuran Sintetik
Analisis Cr(III) dengan pereaksi
kromogenik HBIG memberikan linearitas terbaik pada rentang konsentrasi 40-100
µg/ml dengan nilai r sebesar 0.9929
sedangkan linearitas dari senyawa kompleks Cr(VI)-BPR terentang dari konsentrasi 0.25-0.29 µg/ml dengan nilai r sebesar 0.9929
(Lampiran 8a & 8b). Penambahan larutan Cr(VI) terhadap senyawa kompleks Cr(III)-HBIG sedikit mempengaruhi serapan Cr(III) hal ini terlihat dari nilai linearitas yang lebih rendah yaitu 0.9796 sedangkan pengaruh larutan Cr(III) terhadap kurva standar Cr(VI)
menyebabkan nilai liniearitasnya turun
menjadi 0.8810 (Lampiran 9a & 9b).
Analisis simultan Cr(III) dan Cr(VI) dengan pereaksi kromogenik campuran dapat dilakukan pada dua λmaks, asalkan
masing-masing komponen tidak saling mengganggu. Berdasarkan Gambar 16, senyawa kompleks Cr(III) dan Cr(VI) mempunyai bentuk spektrum serapan dua zat yang tercampur bertumpang tindih sebagian, artinya serapan Cr(III) dapat dibaca pada λmaks Cr(III)(λ1 576.4
nm) dan λmaks Cr(VI)(λ2 635 nm), sedangkan
serapan Cr(VI) hanya dibaca pada λmaks
Cr(VI) saja, yaitu 635 nm, sehingga persamaan Lambert-Beer yang berlaku adalah A1 = k1x.Cx dan A2 = k2x.Cx + k2y.Cy dengan
x= Cr(III) dan y= Cr(VI). Nilai tetapan (k) diperoleh dari ketiga kurva standarnya (Lampiran 8).
Gambar 16 Spektrum serapan senyawa kompleks Cr(III) 70 µg/ml dan Cr(VI) 0.27 µg/ml.
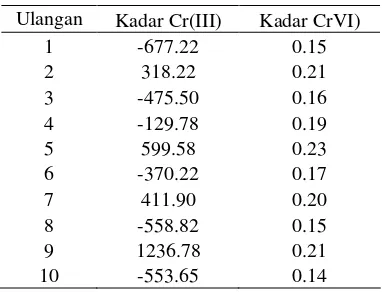
Pengujian kadar Cr(III) dan Cr(VI) dalam campuran sintetik dilakukan sebanyak 10 kali ulangan dan hasil pengukuran serapan campuran yang dibaca pada dua λmaks serta
kadarnya dapat di lihat pada Tabel 1.
a
b
a
[image:31.595.323.504.394.578.2]Tabel 1 Hasil penentuan kadar Cr(III) dan Cr(VI) dalam campuran sintetik
Ulangan Kadar Cr(III) Kadar CrVI)
1 -677.22 0.15
2 318.22 0.21
3 -475.50 0.16
4 -129.78 0.19
5 599.58 0.23
6 -370.22 0.17
7 411.90 0.20
8 -558.82 0.15
9 1236.78 0.21
10 -553.65 0.14
Berdasarkan perhitungan (Lampiran 10), kadar Cr(VI) dalam campuran sintetik berkisar dari konsentrasi 0.14-0.23 µg/ml sedangkan Cr(III) belum dapat ditentukan kadarnya karena hasil yang diperoleh tidak
sesuai dengan kadar Cr(III) yang
ditambahkan. Hal ini dikarenakan pereaksi HBIG yang digunakan sebagai pereaksi kromogenik Cr(III) dalam campuran sintetik memiliki kesensitifan yang lebih rendah dibandingkan dengan pereaksi BPR sebagai pereaksi kromogenik Cr(VI).
SIMPULAN DAN SARAN
SimpulanAnalisis Cr(III) dan Cr(VI) dengan masing-masing pereaksi kromogenik, yaitu HBIG bagi Cr(III) dan BPR bagi Cr(VI) memberikan nilai serapan maksimum pada panjang gelombang 576.4 nm dan 635 nm.
Kondisi terbaik pengukuran kromium
menggunakan larutan bufer asetat pH 6.0 dengan waktu pengukuran 60 menit setelah diinkubasi pada suhu kamar. Beberapa pereaksi, yaitu CTAB, HBIG, dan BPR tidak mempengaruhi bentuk spektrum serapan kompleks kromium.
Linearitas terbaik hubungan serapan larutan terhadap konsentrasi diperoleh pada kisaran konsentrasi 40-100 µg/ml untuk Cr(III)-HBIG dan 0.25-0.29 µg/ml untuk Cr(VI)-BPR dengan masing-masing nilai r adalah 0.9929. Pengujian kadar Cr(III) dan Cr(VI) dalam campuran sintetik dihitung berdasarkan serapan keduanya pada λmaks
dengan bentuk spektrum serapan bertumpang tindih sebagian. Kadar Cr(VI) yang diperoleh
dalam campuran sintetik berkisar dari
konsentrasi 0.14-0.23 µg/ml sedangkan kadar Cr(III) belum dapat ditentukan.
Saran
Penentuan kadar Cr(III) dan Cr(VI) dalam campuran sintetik pada penelitian ini masih belum dapat ditentukan secara akurat. Oleh karena itu perlu dilakukan optimasi terhadap parameter lain pada penelitian selanjutnya, seperti ragam suhu inkubasi, ragam pH, pencarian konsentrasi optimum dari pereaksi CTAB, BPR, dan HBIG, serta pencarian rasio konsentrasi Cr(III) dan Cr(VI) dalam campuran sintetik.
DAFTAR PUSTAKA
Adijuwana H, Nur MA. 1989. Teknik
Spektroskopi dalam Analisis Biologi. Bogor: IPB-Press.
Andruch V, Telepcakova M, Balogh IS, Urbanova N. 2003. Investigation of 2-[2- (4-Methoxy-phenylamino)-vinyl]-1,3,3-trimethyl-3H-indolium chloride as a new
reagent for the determination of
chromium(VI). Microchim Acta 142:
109-113.
Bobrowski A et al. 2004. Metrological
characteristrics and comparison of
analitical methods for determination of chromium traces in water samples. Acta Chim Slov 51:77-93.
Carvalho LS de, Costa ACS, Ferreira SLC, Teixeira LSG. 2004. Spectrophotometric determination of chromium in steel with 4-(2-thiazolylazo)-resorcinol (TAR) using microwave radiation. J Braz Chem Soc
15:153-157.
Chang YL, Jiang SJ. 2001. Determination of Chromium species in water samples by liquid chromatography & inductively
coupled plasma-dynamic reaction
cell-mass spectrometry. J Anal Spectrom
16: 858-862.
Department of Commerce. 1980. Ambient
Water Quality Criteria for Chromium.
United State: National Technical
Information Service.
Fessenden RJ, Fessenden JS. 1986. Kimia Organik Jilid 2. Ed ke-3. AH
Pudjaatmaka, penerjemah. Jakarta:
Erlangga. Terjemahan dari: Organic
Chemistry.
Ghaedi M, Asadpour E, Vafaie A. 2006.
Sensitized spectrophotometric
[image:32.595.112.303.117.263.2]using alpha-benzoin oxime. Spectrochim Acta 63:182-188.
Hargis LG. 1989. Analytical Chemistry
Principal and Technique. New York: Prentice Hall International.
Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hassan SSM, El-Shahawi MS, Othman AM, Mosaad MA. 2005. A potentiometric rhodamine B based membrane sensor for the selective determination of chromium ions in waste water. Anal Sci 21:673-678. Himeno S, Nakashima Y, Sano KI. 1998.
Simultaneous determination of
chromium(VI) and chromium(III) by
capillary electrophoresis. Anal Sci
14:369-373.
Huang X et al. 1997. Chromogenic reaction of
bromopyrogallol red with tri and
hexavalent chromium in the present of cetyltrimethylammonium bromide and its application in Cr speciation. Microchim Acta 126:329-333.
Johnston JR, Holland WJ. 1971.
Spectrophotometric determination of
chromium(III) with
3-thianaphthenoyltrifluoro acetone.
Microchim Acta 60:321-325.
Khopkar SM. 1990. Konsep Dasar Kimia Analitik. A. Saptorahardjo, penerjemah. Jakarta: UI-Press. Terjemahan dari: Basic Concepts of Analytical Chemistry.
Kumar KG, Muthuselvi R. 2006.
Spectrophotometric detemination of
chromium(III) with
2-hydroxybenzaldiminoglycine. J Anal
Chem 61:28-31.
Kusnoputranto H. 1996. Toksikologi
Lingkungan Logam Toksik dan B-3. Jakarta: UI-Press.
Lintschinger J, Kalcher K, Gossler W, Kolbl
G, Novic M. 1995. Simultaneous
determination of chromium(III) and chromium(VI) by reversed-phase ion-pair HPLC with chromium specific detection.
Anal Bioanal Chem 351:604-609.
Malik WU, Bembi R. 1975.
Spectrophotometric determination of
chromium(III) using potassium
hexacyanoferrate(II). Microchim Acta
63:681-684.
Michalski R. 2004. Simultaneous
determination of Cr(III) and Cr(VI) ion in µg L-1 range using ion chromatography with UV detection. Chem Anal (Warsaw)
49:213.
Mohamed AA & El-Shahat MF. 2000. A
Spectrophotometric determination of
chromium and vanadium. Anal Sci
16:151-154.
Narayana B & Cherian T. 2005. Rapid
Spectrophotometric determination of
trace amounts of chromium using variamine blue as chromogenic reagent. J Braz Chem Soc 16:197-201.
Rengasamy P, Oades JM. 1977.
Spectrophotometric determination of
monomeric plus oligomeric and
polymeric hydroxy species of
chromium(III) in aqueous solutions. Aust J Chem 30:1383-1385.
Revanasiddappa HD & Kumar TNK. 2001.
Spectrophotometric determination of
trace amounts of chromium with
citrazinic acid. J Anal Chem 56:1084-1088.
Revanasiddappa HD & Kumar TNK. 2002. Rapid spectrophotometric determination of chromium with trifluoropherazine
hydrochloride. Chem Anal (Warsaw)
47:311.
Rizvi GH. 1983. A sensitive and selective
spectrophotometric method for the
determination of chromium(III).
Microchim Acta 81:21-27.
Seby F, Charles S, Gagean M, Garraud H, Donard OFX. 2003. Chromium speciation by hyphenation of high performance liquid chromatography to inductively coupled plasma mass spectrometry study of the influence of interfering ions. J Anal Spectrom 18:1386-1390.
Singh AK, Singh R, Saxena P. 2004.
Tetraazacyclohexadeca macrocyclic
ligands as a neutral carrier in a Cr ion-selective electrode. Sensors 4:187-195. Stewart LL, Olesik JW. 2000. Investigation of
Cr(III) hydrolytic polymerisation
products by capillary electrophoresis
inductively coupled plasma mass
Sumida T, Sabarudin A, Oshima M,
Motomizu S. 2006. Speciation of
chromium in seawater by ICP-AES with dual mini coulomns containing chelating resin. Anal Sci 22:161-164.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Yanto DHY. 2004. Validasi Metode Analisis Krom Heksavalen dan Krom Total Secara Spektrofotometri serta Aplikasinya pada
Air Sungai Cisadane di Bogor dan
Tangerang. [Skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yalcin S, Apak R. 2004. Chromium(III, VI) Speciation analysis with preconcentration on a maleic acid functionalized XAD sorbent. Anal Chim Acta 505:25-35. Zhu X, Hu B, Jiang Z, Wu Y, Xiong S. 2002.
Speciation of chromium(III) and
chromium(VI) by in situ separation
and sequential determination with
electrothermal vaporization inductively
coupled plasma atomic emission
Lampiran 1 Bagan alir penelitian
Penentuan λmaks
Cr(III) dan Cr(VI)
Senyawa Kompleks Kromium
Pengujian Pengaruh Larutan Bufer pH 6.0
Pengujian Pengaruh Beberapa Pereaksi (CTAB,
HBIG, dan BPR)
Pengujian Pengaruh Waktu Pengukuran
Penentuan Kurva Standar Pengujian Kadar Cr(III) dan Cr(VI)
dalam Campuran Sintetik
Lampiran 2 Perhitungan preparasi larutan stok standar Cr(III) dan Cr(VI)
Larutan standar Cr(III) 750 µg/ml =
g 52 mol 1 x g 10 g 1 x l 1 ml 1000 x ml g 750 6µ µ
= 0.0144 M mol Cr(III) ∼ mol CrCl3.6H2O
Konsentrasi Cr(III) (M) = x1000
) ml ( volume ) III ( Cr mol
0.0144 M =
) ml ( volume 1000 x O H 6 . CrCl BM O H 6 . CrCl Bobot 2 3 2 3
0.0144 M =
ml 100 1000 x mol / g 5 . 266 O H 6 . CrCl
Bobot 3 2
Bobot CrCl3.6H2O = 0.3844 g
Larutan standar Cr(VI) 5 µg/ml =
g 52 mol 1 x g 10 g 1 x l 1 ml 1000 x ml g 5 6µ µ
= 9.6154x10-5 M
Konsentrasi Cr(VI) (M) =
) ml ( volume ) VI ( Cr mol x 1000
9.6154x10-5 M = mol Cr(VI)x
ml 100
1000
mol Cr(VI) = 9.6154x10-6 mol
mol Cr(VI) ∼½mol K2Cr2O7
mol K2Cr2O7 = 2 x mol Cr(VI)
= 2 x 9.6154x10-6 mol = 1.9231x10-5 mol
Bobot K2Cr2O7 = mol K2Cr2O7 x BM K2Cr2O7
Lampiran 3 Penentuan konsentrasi HBIG
mol larutan glisin =
sin gli BM sin gli bobot = mol / g 07 . 75 g 0753 . 0
= 1.0031x10-3 mol bobot salisilaldehida = 98% (b/v) x 1.1 ml
= x1.1ml ml 100
g 98
= 1.0780 g mol salisilaldehida =
ehida salisilald BM ehida salisilald bobot = mol / g 122 g 0780 . 1
= 8.8361x10-3 mol
glisin + salisilaldehida HBIG awal 1.0031x10-3 mol 8.8361x10-3 mol
bereaksi -1.0031x10-3 mol -1.0031x10-3 mol +1.0031x10-3 mol sisa 0 7.8330x10-3 mol +1.0031x10-3 mol
Konsentrasi HBIG (M) = x1000
) ml ( total volume HBIG mol
= x1000 ml 1 . 101 mol 10 x 0031 .
1 −3
= 9.9219x10-3 M
Konsentrasi HBIG yang digunakan = 9.9219x10-3 M x fp = 9.9219x10-3 M x
0.031 0.032 0.033 0.034 0.035 0.036 0.037 0.038
0 20 40 60 80 100 120 140
w aktu pengukuran (menit)
S
e
ra
p
a
n
la
ru
ta
n
0.013
0.0135
0.014
0.0145
0.015
0.0155
0
20
40
60
80
100
120
140
Waktu pengukuran (menit)
S
e
ra
p
a
n
la
ru
ta
n
Lampiran 4 Hubungan serapan larutan Cr(III)-HBIG (bufer asetat) dengan waktu pengukuran (menit)
0
0.002
0.004
0.006
0.008
0.01
0.012
0.014
0
20
40
60
80
100
120
Waktu pengukuran (menit)
S
e
ra
p
a
n
la
ru
ta
n
0
0.002
0.004
0.006
0.008
0.01
0.012
0
20
40
60
80
100
120
Waktu pengukuran (menit)
S
e
ra
p
a
n
la
ru
ta
n
Lampiran 6 Hubungan serapan larutan Cr(VI)-BPR (bufer fosfat) dengan waktu pengukuran (menit)
y = 0.0004x + 0.0042 r=0.9929
0 0.01 0.02 0.03 0.04 0.05 0.06
0 20 40 60 80 100 120
Konsentrasi Cr(III) ppm
S
e
ra
p
a
n
la
ru
ta
n
y = 0.9095x - 0.1411 r=0.9929
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14
0.24 0.25 0.26 0.27 0.28 0.29 0.3
Konsentrasi Cr(VI) ppm
S
e
ra
p
a
n
la
ru
ta
n
Lampiran 8 Kurva standar Cr(III) dan Cr(VI)
a. Kurva standar Cr(III)-HBIG diukur pada λ1
b. Kurva standar Cr(VI)-BPR diukur pada λ2