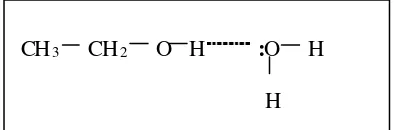OPTIMASI PROSES MASERASI PANILI (Vanilla planifolia A)
HASIL MODIFIKASI PROSES KURING
Oleh
MELAWATI
F34101129
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
OPTIMASI PROSES MASERASI PANILI (Vanilla planifolia A)
HASIL MODIFIKASI PROSES KURING
Oleh
MELAWATI
F34101129
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
OPTIMASI PROSES MASERASI PANILI (Vanilla planifolia A)
HASIL MODIFIKASI PROSES KURING
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
MELAWATI
F34101129
Dilahirkan pada tanggal 5 April 1982 Di Cilacap
Tanggal lulus : 23 Januari 2006
Disetujui
Tanggal : 6 Februari 2006
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “OPTIMASI PROSES MASERASI PANILI (Vanilla planifolia A) HASIL MODIFIKASI PROSES KURING” adalah karya asli saya sendiri dengan arahan dosen pembimbing akademik, kecuali dengan jelas ditunjukan rujukannya.
Bogor, 23 Januari 2006 Yang Membuat Pernyataan,
Melawati. F34101129. Optimasi Proses Maserasi Panili (Vanilla planifolia A) Hasil Modifikasi Proses Kuring. Dibawah Bimbingan Dwi Setyaningsih. 2006.
RINGKASAN
Ekstrak panili alami adalah flavouring agent yang paling mahal di industri dan merupakan salah satu flavor yang terpopuler di dunia (www.joyofbaking.com). Kualitas ekstrak panili dipengaruhi oleh sejumlah faktor yaitu umur panen, penanganan dan penyimpanan buah sebelum diekstrak, kualitas panili kering, metode dan kondisi ekstraksi, serta waktu penuaan untuk menyempurnakan perkembangan flavor (Purseglove et al, 1981). Perbaikan kualitas panili kering telah dilakukan dengan cara modifikasi atau perbaikan teknologi proses kuring, yang dilengkapi dengan analisis komposisi senyawa glikosida yang dihidrolisis oleh enzim endogenus panili. Penelitian tersebut menghasilkan peningkatan kadar vanillin pada pengeringan hari ke-5 (2.8%, standar 1.2%) dengan kadar air sekitar 70% (Setyaningsih et al, 2003). Pada penelitian yang penulis lakukan, panili kering hasil modifikasi proses kuring diolah menjadi produk turunan panili yaitu ekstrak panili yang diproduksi dengan metode maserasi. Tujuan dari penelitian ini adalah untuk mendapatkan cara maserasi, mendapatkan jenis bahan yang memiliki kadar vanillin tertinggi, mendapatkan komposisi pelarut (etanol : air ) yang sesuai dengan jenis bahan yang akan diekstrak, mengetahui pengaruh waktu maserasi, sukrosa dan gliserin terhadap kadar vanillin dalam ekstrak panili, mendapatkan variabel yang dapat mengoptimumkan kadar vanillin, serta mengetahui karakteristik ekstrak dari buah panili setengah kering.
Penelitian dilakukan dua tahap yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan dilakukan untuk memilih cara maserasi, memilih bahan, memilih komposisi pelarut (etanol : air), dan mengetahui pengaruh waktu maserasi, sukrosa dan gliserin terhadap kadar vanillin ekstrak. Cara maserasi yang dicobakan adalah cara maserasi satu tahap, maserasi dua tahap dengan satu kali penyaringan, dan maserasi dua tahap dengan dua kali penyaringan. Bahan yang dipilih adalah panili setengah kering, panili kering 1, dan panili kering 2. Sedangkan komposisi etanol : air yang dicoba mulai dari 5:5 sampai dengan 8:2. Waktu maserasi dicoba dari 1-16 hari. Konsentrasi sukrosa dicoba dari 0.5-8 g. Sedangkan konsentrasi gliserin dicoba dari 1-16 ml.
Penelitian utama terdiri dari tiga proses optimasi. Optimasi menggunakan metode respon surface dengan 22 faktorial dan 23 faktorial. Optimasi satu adalah optimasi dengan variabel waktu maserasi dan konsentrasi sukrosa. Level rendah (-1) untuk variabel waktu maserasi adalah 7 hari, level tinggi (+1) 21 hari, dan titik tengah (0) 14 hari. Level rendah (-1) untuk variabel sukrosa adalah 3.5 g, level tinggi (+1) 10.5 g dan titik tengah (0) 7 g. Optimasi dua adalah optimasi dengan variabel waktu maserasi dan konsentrasi gliserin. Level rendah (-1) waktu maserasi adalah 7 hari, level tinggi (+1) 21 hari, dan titik tengah (0) 14 hari. Level rendah untuk gliserin adalah 7 ml, level tinggi (+1) adalah 21 ml, dan titik tengah (0) 14 ml. Optimasi tiga adalah optimasi dengan variabel waktu maserasi, sukrosa dan gliserin. Level rendah (-1) untuk waktu maserasi adalah 8 hari, level tinggi (+1) 16 hari, dan titik tengah (0) 12 hari. Level rendah (-1) untuk konsentrasi sukrosa adalah 4 g, level tinggi (+1) 10 g, dan titik tengah (0) 7 g. level rendah (-1) untuk gliserin adalah 2 ml, level tinggi (+1) 6 ml, dan titik tengah (0) 4 ml.
Hasil optimasi menunjukan bahwa, optimasi satu optimum pada waktu maserasi 15.9 hari dan sukrosa sebanyak 7.3 g dengan kadar vanillin sebesar 4.5 g/l (1.5 kali lebih tinggi dibandingkan Balitro II). Optimasi dua belum mencapai titik optimum. Nilai kadar vanillin maksimal sebesar 3.7 g/l (1.2 kali lebih tinggi dibandingkan Balitro II) dicapai dari perlakuan waktu ekstraksi 22 hari dan gliserin sebanyak 19.9 ml. Optimasi tiga mencapai titik optimum pada waktu maserasi 12 hari, sukrosa 7 g, dan gliserin 4,7 ml dengan kadar vanillin 3.4 g/l (1.1 kali lebih tinggi dibandingkan Balitro II).
Karakteristik ekstrak dari buah panili sete ngah kering adalah kadar vanillin 3.4-4.5 g/l, total asam 380– 410 ml 0.1 N NaOH/l, kadar abu 1.33–3.42 g/l, abu terlarut 0.81– 2.91 g/l, alkalinitas abu total 462.6-536.7 ml 0.1 N HCl/l, alkalinitas abu terlarut 139.1–216.5 ml 0.1 N HCl/l, dan lead numb er berkisar antara 4.5-4.6. Sebagian besar dari nilai tersebut memenuhi syarat ekstrak panili yang ditetapkan oleh FDA.
Melawati. F34101129. Optimization of Vanilla (Vanilla planifolia A) Maceration Process from Vanilla Modified Curing. Supervised by Dwi Setyaningsih. 2006.
SUMMARY
Natural vanilla extract is the most expensive flavouring agent in industry and one of the most popular in the world (www.joyofbaking.com). The quality of a vanilla extract is depend upon a number of factors which include careful handling and storage of the beans prior to extraction, appropiate selection and blending of beans, the degree of comminution of the beans, the method and condition of extraction, and proper ageing of the extract to permit full flavor development (Purseglove et al, 1981). Improvement of cured vanilla quality had been done by curing process modification which was completed with glycoside composition analysis that has been hydrolyzed by vanilla endogenous enzyme. That modification increased vanillin content on the fifth days of curing (2.8%, standard 1.2%) with water content was about 70% (Setyaningsih et al, 2003). On this research, modified cured vanilla was processed to vanilla extract by maceration method. The aim of this research were to get maceration method, to get kind of material which has the highest vanillin content, to get suitable solvent composition with the kind of material, to get variabels that could optimize vanillin content and to know the characteristic of vanilla extract from half dried cured maceration.
In this reserach, there were the preliminary research and the main research. The preliminary research was to prefer the best maceration method, to prefer kind of material and solvent composition, and to analyze the influence of maceration time, sucrose, and glycerol concentration. Maceration method were one stage maceration, two stage maceration with once filtration, and two stage maceration with twice filtration. The ratio of ethanol-water was 5:5 to 8:2. The kind of cured vanilla were half dried cured vanilla, cured vanilla 1, and cured vanilla 2. Maceration time were 1-16 days. Sucroce and glycerol concentration were 0.5-8 g and 1-16 ml, respectively.
One stage maceration could extract vanillin (average 2.3 g/l) much more than two stage maceration (average 2.1 g/l) . Half dried cured vanilla vanillin content (average 0.98 g/l) has higher than cured vanilla 1 and cured vanilla 2 (average 0.41 g/l and 0.32 g/l). The suitable ethanol-water composition for half dried cured vanilla was 7:3 (vanillin content 1.78 g/l). Increasing of maceration time (1-16 days), sucrose (0.5-8 g) and glycerol (1-16 ml) concentration could increase vanillin content (3.1 g/l to 3.9 g/l).
variables such as maceration time, sucrose concentration and glycerol concentration. Low level and high level for each variables were 8 days and 16 days, 7 g and 10 g, 2 ml and 6 ml, respectively.
The maximum vanillin content of first optimation was 4.5 g/l at maceration time 15.9 days and sucrose concentration 7.3 g. The maximum vanillin content of second optimation was 3.8 g/l at maceration time 22 days and glycerol concentration 19.9 ml. The maximum vanillin content of third optimation was 3. 4 g/l at maceration time 12 days sucrose concentration 7 g, and glycerol concentration 4.7 ml.
DAFTAR RIWAYAT HIDUP
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang bersemayam di Arasy, yang telah memberi petunjuk kepada penulis dengan ilmu-Nya sehingga penulis mampu menyelesaikan skripsi ini. Skripsi ini disusun berdasarkan hasil penelitian yang penulis lakukan di Laboratorium Kimia Pangan Seafast, Laboratorium Pengawasan Mutu, dan LDIT. Penelitian ini dilakukan selama sepuluh bulan, sejak bulan Maret sampai dengan Desember 2005.
Penelitian dan penulisan skripsi ini tidak akan terlaksana dengan baik tanpa bantuan dari berbagai pihak. Oleh karena itu, penulis menyampaikan ucapan terima kasih kepada :
1. Dr. Ir. Dwi Setyaningsih, MSi selaku dosen pembimbing yang telah memberikan bimbingan, perhatian dan kasih sayang selama masa pembimbingan di tengah kesibukan beliau.
2. Prof. Dr. Ir. A. Aziz Darwis, MSc selaku dosen penguji yang telah mengajarkan keberanian untuk menerima konsekuensi dari setiap keputusan yang diambil dan mengajarkan pentingnya pengetahuan dasar sebagai landasan dari setiap pekerjaan yang dilakukan.
3. Ir. Indah Yuliasih, MSi selaku dosen penguji yang telah memberikan masukan perbaikan penulisan skripsi, mengajarkan ketelitian, dan memberikan nasehat tentang kejujuran.
4. Seluruh dosen, karyawan Departemen Teknologi Industri Pertanian atas segala budi baik yang telah diberikan selama masa studi.
5. Andryanto dan Ekawati selaku kedua orang tua penulis yang telah memberikan dukungan dengan doa dan seluruh kasih sayangnya. Beliau adalah semangat bagi penulis untuk terus berjuang menuju kehidupan yang lebih baik.
7. Dwi Lestari Rahayu dan Nurmalia Mulyati yang telah bekerja bersama -sama selama penelitian.
8. Maya, Yeni, Hevy, Johar, dan semua teman-teman TIN angkatan 38.
Penulis telah menyusun skripsi ini berdasarkan hasil penelitan yang dilaksanakan dengan sungguh-sungguh. Oleh karena itu, penulis berharap skripsi ini dapat memperka ya khasanah ilmu pengetahuan tentang ekstraksi panili di Indonesia dan khususnya di IPB.
Bogor 23 Januari 2006
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 3
II. TINJAUAN PUSTAKA A. BOTANI PANILI ... 4
B. KOMPOSISI KIMIA BUAH PANILI ... 5
C. MODIFIKASI PROSES KURING ... 6
D. EKSTRAK PANILI ... 7
E. METODE EKSTRAKSI PANILI ... 8
F. TINJAUAN PATEN EKSTRAK PANILI ... 11
G. METODE RESPON SURFACE ... 12
III. BAHAN DAN METODE A. BAHAN DAN ALAT ... 14
B. METODE PENELITIAN ...14
C. RANCANGAN PERCOBAAN ... 16
IV. HASIL DAN PEMBAHASAN A. PENELITIAN PENDAHULUAN 1. PENENTUAN CARA MASERASI ... 18
2. PENENTUAN JENIS BAHAN DAN KOMPOSISI PELARUT ... 21
3. PENGARUH WAKTU SERTA PENAMBAHAN SUKROSA DAN GLISERIN... 24
2. OPTIMASI DUA ... 29
3. OPTIMASI TIGA ... 32
4. ANALISIS EKSTRAK DARI BUAH SETENGAH KERING SELAIN VANILLIN ... 35
V. KESIMPULAN DAN SARAN A. KESIMPULAN ... 43
B. SARAN ... 44
DAFTAR PUSTAKA ... 44
DAFTAR TABEL
Halaman
Tabel 1. Komposisi Kimia Buah Panili Segar ... 5
Tabel 2. Polaritas Pelarut Organik ... 9
Tabel 3. Variabel Independen yang Digunakan dalam Model Statistik 1 ... 16
Tabel 4. Variabel Independen yang Digunakan dalam Model Statistik 2 ... 16
Tabel 5. Variabel Independen yang Digunakan dalam Model Statistik 3 ... 16
Tabel 6. Matrik Orde Pertama Proses Optimasi Satu ... 27
Tabel 7. Analisis Varian untuk Orde Pertama Proses Optimasi Satu ... 27
Tabel 8. Matrik Orde Kedua Proses Optimasi Satu ... 27
Tabel 9. Matrik Orde Pertama Proses Optimasi Dua ... 30
Tabel 10. Analisis Varian untuk Orde Pertama Proses Optimasi Dua ... 30
Tabel 11. Matrik Orde Kedua Proses Optimasi Dua ... 30
Tabel 12. Matrik Orde Pertama Proses Optimasi Tiga ... 33
Tabel 13. Analisis Varian untuk Orde Pertama Proses Optimasi Tiga ... 33
Tabel 14. Karakteristik Ekstrak... 39
DAFTAR GAMBAR
Halaman
Gambar 1. Bagan alir Disain Eksperimen ... 17
Gambar 2. Perbandingan Kadar Vanillin Tiga Cara Maserasi ... 18
Gambar 3. Ikatan Hidrogen Etanol dan Air ... 19
Gambar 4. Proses Melarutnya Vanillin dalam Etanol ... 20
Gambar 5. Mekanisme Perpindahan Massa ... 21
Gambar 6. Kadar Vanillin Masing-Masing Jenis Bahan ... 22
Gambar 7. Pengaruh Waktu dan Sukrosa ... 24
Gambar 8. Pengaruh Waktu dan Gliserin ... 25
Gambar 9. Surface Optimasi Satu ... 28
Gambar 10. Kontur Optimasi Satu ... 29
Gambar 11. Surface Optimasi Dua ... 32
Gambar 12. Kontur Optimasi Dua ... 32
Gambar 13. Surface Optimasi Tiga ... 34
Gambar 14. Surface Optimasi Tiga ... 34
Gambar 15. Kontur Optimasi Tiga ... 34
Gambar 16. Kontur Optimasi Tiga ... 35
Gambar 17. Reaksi Oksidasi Alkohol ... 36
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Maserasi Satu Tahap... 48
Lampiran 2. Maserasi Dua Tahap dengan Satu Kali Penyaringan ... 48
Lampiran 3. Maserasi Dua Tahap dengan Dua Kali Penyaringan ... 49
Lampiran 4. Proses Kuring ... 50
Lampiran 5. Proses Optimasi Satu ... 51
Lampiran 6. Proses Optimasi Dua ... 51
Lampiran 7. Proses Optimasi Tiga ... 52
Lampiran 8. Prosedur Analisis ... 53
Lampiran 9. Data Pemilihan Cara Maserasi ... 58
Lampiran 10. Data Penentuan Jenis Bahan dan Komposisi Pelarut ... 60
Lampiran 11. Data Pengaruh Waktu Maserasi dan Sukrosa ... 62
Lampiran 12. Data Pengaruh Waktu Maserasi dan Gliserin ... 63
Lampiran 13. Data Optimasi Satu ... 64
Lampiran 14. Hasil Running SAS untuk Optimasi Satu ... 65
Lampiran 15. Data Optimasi Dua ... 69
Lampiran 16. Hasil Running SAS untuk Optimasi Dua ... 70
Lampiran 17. Data Perbandingan Kadar Vanillin Hasil Analisis HPLC dan Spektrofotometer ...74
Lampiran 18. Kromatrogram Hasil Ana lisis HPLC ... 75
Lampiran 19. Data Total Asam ... 78
Lampiran 20. Data Lead Number ... 78
Lampiran 21. Data Kadar Abu ... 79
Lampiran 22. Data Abu Terlarut dan Tidak Terlarut ... 80
Lampiran 23. Data Alkalinitas Abu ... 81
Lampiran 24. Rancangan Metode S teepest Ascent ... 82
I.
PENDAHULUAN
A. LATAR BELAKANG
Panili (Vanilla planifolia Andrews) merupakan tanaman yang memiliki nilai ekonomis tinggi. Luas areal perkebunan panili di Indonesia pada tahun 2003 adalah 15.922 ha dengan jumlah produksi 2.375 ton (Departemen Pertanian, 2004). Luas perkebunan panili bertambah 781 ha per tahun dan produktifitas meningkat rata-rata sebesar 99.6 ton per tahun (Sajuti et al, 2002). Harga panili basah diperdagangkan pada kisaran Rp 80.000– 300.000 per kilogram pada bulan Februari 2005. Harga panili kering ditingkat pedagang pengumpul pada bulan Maret 2005 adalah Rp 1.400.000 per kilogram. Sedangkan harga ekstrak panili pada bulan November 2005 adalah US$ 30-60 per galon. Harga ekstrak panili alami memang jauh lebih mahal dibandingkan dengan panili sintetik yang hanya US$ 10-15 per galon (Schultz, 2005). Namun demikian, menurut Dignum (2002), penggunaan panili sintetik tidak dapat menggantikan ekstrak alami karena ekstrak panili alami memiliki lebih dari 100 komponen volatil yang membuat flavor ekstraknya sangat komplek.
Ekstrak panili alami adalah flavouring agent yang paling mahal di industri dan merupakan salah satu flavor yang terpopuler di dunia. Kualitas ekstrak panili dipengaruhi oleh sejumlah faktor yaitu umur panen buah, penanganan dan penyimpanan buah sebelum diekstrak, kualitas panili kering, metode dan kondisi ekstraksi, serta waktu penuaan untuk menyempurnakan perkembangan flavor (Purseglove et al, 1981).
dilengkapi dengan analisis komposisi senyawa glikosida yang dihidrolisis oleh enzim endogenus panili yang dipelajari pada Penelitian Dasar 2002.
Hasil penelitian tersebut menunjukkan peningkatan aktivitas enzim â-glukosidase pada pembentukkan flavor panili dalam menghidrolisis glikosida khususnya glukovanillin menjadi senyawa volatil yang memiliki aktivitas flavor. Aktivitas enzim â-glukosidase dijumpai sampai pengeringan hari ke-5, sementara kadar vanillin terus meningkat selama proses pengeringan. Suhu optimum kerja enzim adalah 40oC (Setyaningsih et al, 2003)
Perlakuan perendaman buah segar dalam aktivator enzim yaitu butanol 0.3 M dan sistein 0.001 M selama 2 jam menghasilkan aktivitas enzim, kadar vanillin, dan kadar gula yang lebih tinggi dibandingkan pengeringan standar (Metode Balitro II). Peningkatan kadar vanillin tertinggi terjadi pada pengeringan hari ke -5 (2.8%, standar 1.2%) dengan kadar air sekitar 70% (Setyaningsih et al, 2003)
Pada penelitian ini, panili kering hasil modifikasi proses kuring diolah menjadi produk turunan panili yaitu ekstrak panili yang diproduksi dengan metode maserasi. Peningkatan kualitas panili kering hasil modifikasi proses kuring diharapkan dapat meningkatkan kua litas produk turunannya.
B. TUJUAN
Tujuan dari penelitian ini adalah : 1. Mendapatkan cara maserasi.
2. Mendapatkan jenis bahan panili yang memiliki kadar vanillin tertinggi. 3. Mendapatkan komposisi pelarut (etanol : air) yang sesuai dengan jenis
bahan yang akan die kstrak.
4. Mengetahui pengaruh waktu maserasi, konsentrasi sukrosa, dan gliserin terhadap kadar vanillin.
5. Mendapatkan variabel yang mampu mengoptimumkan kadar vanillin dalam ekstrak panili.
C. MANFAAT
Petani dapat mengolah buah panili segar (usia 6-9 bulan) dengan metode kuring yang telah dimodifikasi oleh Setyaningsih (2003). Sebelum prose scalding pada suhu 40oC selama 30 menit, buah panili disayat dengan menggunakan jarum kemudian direndam da lam larutan butanol 0,3 M dan sistein 1mM selama dua jam. Pengeringan I dilakukan pada suhu 40oC selama 3 jam perhari dan pengeringan II dilakukan pada suhu 60oC selama 3 jam perhari. Pemeraman dilakukan pada kotak peram dengan suhu 38-40 oC. Dengan cara ini, petani dapat memperoleh buah panili kering dengan kadar vanillin 2-2.3 kali lebih besar dibandingkan kadar vanillin dari buah panili kering hasil pengolahan metode standar. Petani dapat memperoleh harga jual yang lebih tinggi karena mutu polong yang dihasilkan lebih baik.
II.
TINJAUAN PUSTAKA
A. BOTANI PANILI
Tanaman panili termasuk dalam famili Orchidaceae yang mempunyai 700 genus dan 20.000 spesies. Diantara spesies tersebut, terdapat tiga spesies yang mempunyai nilai ekonomis yang tinggi yaitu Vanilla planifolia Andrews, Vanilla tahitensis J.W. Moore, dan Vanilla pompona Sciede (Purseglove at al, 1981).
Panili berasal dari Meksiko dan Amerika Tengah namun sekarang telah menyebar ke berbagai daerah di Asia dan Afrika. Panili tumbuh baik di daerah yang memiliki ketinggian 600 meter di atas permukaan laut. Suhu optimum pertumbuhannya adalah 21-32 oC dengan rata-rata 27oC (Purseglove at al, 1981).
Panili adalah tanaman monokotil. Perakarannya serabut dan mendatar. Akar panili terdiri dari akar perekat, akar gantung dan akar tanah. Akar perekat dan akar gantung tumbuh disetiap ruas batang. Batang panili disebut juga sulur yang berfungsi membantu tanaman untuk menjalar. Panjang batang mencapai 100 cm. Tanaman panili berdaun tunggal dan letaknya berselang-seling. Panjang daun 9-22 cm dan lebarnya 3-7 cm dengan tulang sejajar (Rismunandar dan Sukma, 2003).
Bentuk bunga panili mirip bunga cattleya, warnanya kuning kehijauan, tidak bertangkai dan agak harum. Bunga tumbuh di ruas bagian atas cabang dan membentuk malai yang terdiri atas 15-20 bunga atau lebih. Tanaman panili tidak dapat menyerbuk sendiri. Rostellum harus diangkat sehingga kepala putik yang berlendir terbuka dan siap menerima serbuk sari (Rismunandar dan Sukma, 2003).
B. KOMPOSISI KIMIA BUAH PANILI
Secara fisik, buah panili tersusun oleh bagian pusat yang mengandung biji dan plasenta yang dibungkus oleh bagian luar yang berdaging. Komposisi kimia buah panili segar dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia buah segar Komponen kimia Kandungan (%)
Air 78-82
Karbohidrat 8-20
Lemak 4-15
Kalium 0.005
Kalsium 0.003
Klor 0.0024
Nitrogen 0.004
Magnesium 0.0015
Sumber : (Purseglove at al, 1981).
Buah panili yang baru dipanen mengandung air sekitar 80% yang dikeringkan menjadi sekitar 20% pada saat proses kuring. Per 100 g buah kira-kira mengandung 20 g air, 3-5 g protein, 11 g lemak, 7-9 g gula, 15-20 g serat, 5-10 g abu, 1.5-3 g vanillin, 2 g resin, dan asam vanillin (Guzman dan Siemonsma, 1999).
Flavor panili yang kaya dan lengkap mengandung lebih dari 250 senyawa volatil dan kebanyakan dari senyawa tersebut berperan dalam sifat organoleptik secara keseluruhan. Sebanyak 26 senyawa ditemukan dalam
konsentrasi lebih dari 1 ppm. Senyawa yang paling penting adalah 4-hidroksi-3-metoksi benzaldehid (vanillin) 0.3-3.0 %, 4-hidroksi-3-metoksi
asam benzoat 0.1%, p-hidroksi asam benzoat 0.02%, dan p-hidroksi benzaldehid 0.12-0.15 % (Leong dan Derbesy, 1989).
C. MODIFIKASI PROSES KURING
Herman et al (1990) telah mengidentifikasi unsur -unsur aroma panili dari panili Indonesia dan panili Bourbon. Berdasarkan hasil analisis tersebut diketahui bahwa, panili-panili Indonesia tidak ada yang memiliki unsur-unsur aroma selengkap Bourbon. Perbedaan ini disebabkan karena perbedaan spesies, cara kuring, dan mutu polong.
Setyaningsih et al (2003) melakukan modifikasi atau perbaikan dalam teknologi proses kuring untuk meningkatkan kualitas panili kering Indonesia. Modifikasi yang dilakukan adalah penambahan perlakuan pada buah panili sebelum proses scalding meliputi penyayatan buah (scratching), perendaman buah segar dalam aktivator enzim yaitu butanol 0.3 M dan sistein 1 mM selama dua jam, atau perendaman dalam dithioteriol 1 mM dan sistein 1 mM selama satu jam. Selain itu, scalding dilakukan pada suhu 40oC selama 30 menit. Pengeringan I dilakukan pada suhu 40oC selama 3 jam per hari. Hasil dari modifikasi ini adalah peningkatan aktivitas enzim, kadar vanillin, dan kadar gula dibandingkan metode standar (Balitro II). Secara garis besar, modifikasi proses kuring terdiri dari enam tahap yaitu scratching, perendaman dalam aktivator, scalding, sweating, drying, dan conditioning.
Vanillin adalah senyawa aromatik dominan yang terdapat pada buah panili dan merupakan komponen yang menentukan kelas mutu buah panili. Hidrolisis glukovanillin (prekursor vanillin) oleh enzim β-glukosidase menghasilkan vanillin dan satu molekul β-D-glukosa. Enzim β-glukosidase terdapat pada bagian sitoplasma atau periplasma sel mesokrap dan endokrap buah panili. Substrat glukovanilin terdapat pada bagian jaringan plasenta di sekitar biji (Setyaningsih, 2006). Glukosida vanillin teridentifikasi berada dalam ekstrak buah segar (Dignum et al, 2002). Proses drying menyebabkan dinding sel enzim pecah sehingga enzim dapat berdifusi dan berikatan dengan substrat (Purseglove, 1981).
hidrogen. Glukosa melalui reaksi transglikosilasi membentuk ikatan 1-butyl
β-D-glukopiranosida. Gugus hidroksil pada butanol menyebabkan butanol dapat larut dalam air melalui sistem kopelarut satu fase. Sistem kopelarut adalah sistem yang melarutkan pelarut organik (butanol) pada larutan penyangga yaitu air dalam satu fase sehingga enzim masih dapat mengikat air. Adanya air menyebabkan struktur enzim menjadi lebih fleksibel sehingga lebih mudah berikatan dengan substrat (Setyaningsih, 2006). Sistein memiliki gugus SH yang membantu kestabilan struktur enzim. Gugus SH adalah gugus yang mudah teroksidasi. Ketika ada reaksi oksidasi, gugus SH akan diserang lebih dulu sehingga enzim dapat terlindungi. Menurut hasil penelitian Dignum et al (2001), konsentrasi glukovanillin tetap tinggi (2000 ppm) 16 hari setelah proses scalding pada suhu 80oC selama 20 menit. Hal ini mengindikasikan bahwa proses scalding pada suhu tersebut menyebabkan non-spesifik glukosida tidak aktif. Pada modifikasi proses kuring, scalding dilakukan pada suhu 40oC selama 30 menit. Suhu 40oC adalah suhu optimum kerja enzim.
D. EKSTRAK PANILI
Ekstrak panili adalah larutan hidroalkohol yang mengandung aroma dan flavor terekstrak dari buah panili dan dapat juga ditambah zat pemanis atau pengental seperti gula dan gliserin. Ekstrak panili minimal mengandung alkohol 35% dan zat terekstrak lainnya dari 1 bagian buah per 10 bagian pelarut (Purseglove et al, 1981).
Peraturan pemerintah Amerika Serikat mensyaratkan ekstrak panili harus mengandung alkohol minimum 35%, 3.79 liter ekstrak dibuat dari 377.8 g buah panili dengan kadar air 25%. Bahan pengisi yang diizinkan adalah air, gliserin, propilen glikol, gula, dekstros, atau sirup jagung. Ekstrak seperti ini disebut ekstrak single fold. Jika buah panili yang digunakan dua kali lebih banyak maka disebut ekstrak two fold (Purseglove et al, 1981).
g/kg, kekuatan two fold, kadar vanillin 1.1-3.5 g/l, abu 2.2-4.32 g/l, abu terlarut 1.79-3.57 g/l, lead number 4.0-7.4, alkalinitas abu total 300-540 ml 0.1 asam/l, alkalinitas abu terlarut 220-400 ml 0.1 N asam/l, total asam 300-520 ml 0.1 N basa/l, dan keasaman selain vanillin 140-420 ml 0.1 N basa/l (Heath, 1978).
Fold adalah ukuran kekuatan ekstraksi (www.nielsenmassey.com). Menurut Cowley (1973), single fold adalah ekstrak dari 1 bagian buah dalam 10 bagian pelarut dengan kadar air buah 25%. Menurut Sofiah et al (1986), single fold adalah ekstrak yang diperoleh dari 12 g buah panili dalam 100 ml pelarut alkohol 35%. Sedangkan menurut Heath (1978), ekstrak single fold dibuat dari 10 g buah dengan kadar air 25% per 100 ml pelarut atau 7.5 g buah moisture-free basis per 100 ml. Pada prakteknya, banyak perusahaan menggunakan 452.8 g panili untuk membuat 3.79 liter ekstrak (mendekati 12 g dalam 100 ml).
Gliserin dan gula biasa ditambahkan dalam proses ekstraksi untuk meningkatkan viskositas, membantu mengekstrak senyawa aromatik, dan meningkatkan warna. Sebanyak 3.79 liter ekstrak two fold umumnya ditambah 0.45 kg gula dan 0.2274 liter (6% v/v) gliserin (Purseglove et al, 1981). Gula, gliserin, dan dekstr in ditambahkan untuk menghambat penguapan alkohol dan menahan aroma vanillin di dalam ekstrak (Ruhnayat, 2001). Secara tradisional keaslian ekstrak panili ditentukan berdasarkan kadar etanol, vanillin dan resin, warna, serta lead number. Metode yang lebih baru untuk memperbaiki uji secara tradisional telah ditetapkan dalam Association of Official Analitycal Chemists (Purseglove et al, 1981).
Profil akhir ekstrak panili dipengaruhi oleh sejumlah faktor, yaitu asal negara buah panili, tingkat kematangan buah, metode kuring, metode ekstraksi, dan waktu penuaan ekstrak (www.nielsenmassey.com).
E. METODE EKSTRAKSI PANILI
pelarut yang melibatkan perpindahan zat terlarut ke dalam pelarut (Aguilera, 1999). Pelarut yang digunakan merupakan pelarut organik yang mempunyai titik didih rendah, tidak beracun, dan tidak mudah terbakar (Ma’mun dan Laksamanahardja, 1998). Kelarutan zat dalam pelarut tergantung dari ikatan polar dan nonpolar. Zat yang polar hanya larut dalam pelarut polar, sedangkan zat nonpolar hanya larut dalam pe larut nonpolar (Winarno, 1973).
Pelarut organik yang umum digunakan untuk memproduksi konsentrat, ekstrak, absolut atau minyak atsiri dari bunga, daun, biji, akar, dan bagian lain dari tanaman adalah etil asetat, heks an, petroleum eter, benzen, toluen, etanol, isopropanol, aseton, dan air (Mukhopadhyay, 2002). Nilai polaritas beberapa pelarut tersebut dapat dilihat pada Tabel 2.
Tabel 2. Polaritas pelarut organik
Buah yang diekstrak sebaiknya dipotong 0.2-2 cm. Daya ekstraksi akan semakin meningkat dengan semakin kecilnya ukuran bahan, karena kontak antara bahan dan pelarut merupakan proses osmosis yang berjalan lambat. Namun demikian, bahan yang terlalu halus dapat membentuk suspensi dengan pelarut dan dapat terjadi penguapan senyawa volatil yang berlebihan sebelum proses ekstraksi (Ketaren dan Suastawa, 1994).
terekstraknya gum sehingga mempersulit penyaringan. Penggunaan alkohol dengan konsentrasi lebih dari 70% akan menghasilkan ekstrak dengan kandungan fixed oil tinggi, yang akan mengendap pada bagian bawah ekstrak (Purseglove et al, 1981). Berdasarkan hasil penelitian Sofiah et al (1986), konsentrasi etanol terbaik adalah 50-60 %.
Metode ekstraksi panili terdiri dari maserasi dan perkolasi. Maserasi adalah metode ekstraksi tradisional. Bahan direndam dalam tangki maserasi selama satu tahun. Metode ini dapat menghasilkan ekstrak dengan flavor yang baik namun kualitasnya tidak memenuhi standar, bisa terjadi kebocoran dan terjadi penguapan. Maserator modern terbuat dari stainless steel atau gelas dilengkapi dengan agitator. Konsentrasi alkohol yang digunakan 60%. Maserator ini mampu menghasilkan ekstrak dengan kualitas yang baik dalam waktu 1-3 bulan (Purseglove et al, 1981).
Balai Besar Industri Agro memiliki alat ekstraksi yang berupa rangkaian alat yang terdiri dari bak ekstraksi, penangas air, bak penampung larutan atau cairan ekstrak I dan II, serta pompa. Alat ini bisa digunakan untuk proses maserasi atau perkolasi (Suwandi dan Yuni, 2004). Namun menurut pembuat prototipe alat ekstraksi panili ini, Sofiah et al (1986), hasil ekstrak terbaik diperoleh dengan cara maserasi pada suhu 50oC.
Arvilla l (2001) menuliskan cara membuat ekstrak panili di http://www.cyber -kichen.com. Ekstrak panili dibuat dari buah kering yang dipotong-potong dengan panjang 0.5 cm. Potongan tersebut ditempatkan di dalam jar dan ditambah dengan etanol, gula dan air. Jar disimpan ditempat yang gelap dan dibiarkan selama 2-3 minggu. Sesekali jar tersebut dikocok. Setelah itu ekstrak disaring dengan menggunakan penyaring. Hasil ekstrak ditambah dengan sirup gula dan dikocok sampai merata. Untuk hasil yang baik, ekstrak harus disimpan selama minimal satu bulan sebelum digunakan.
F. TINJAUAN PATEN EKSTRAK PANILI
Proses ekstraksi dilakukan pada suhu 50oC, agitasi selama 4-36 jam, dan pelarut ditambah dengan 20–30 % larutan sodium laktat 50% . Cara ekstraksi ini dilakukan untuk menghasilkan ekstrak yang memiliki flavor yang tajam dan bebas dari bau buah segar (Takeji dan Thosie, 2000).
Buah panili diekstrak dengan air dan atau pelarut organik (etanol, propilen glikol, dan atau gliserin) dala m persen alkali atau garam alkali (alkali hidroksida, alkali metal karbonat). Pelarut lebih baik berupa campuran air dan pelarut organik. Garam alkali yang digunakan sekitar 0.2%. pH ekstrak 7 atau lebih kecil. Sorbitol dapat ditambahkan untuk mencegah penguapan selama masa penyimpanan (Satoru et al, 1996).
i=1 i=1 i<j
Sedangkan menurut paten milik Mitsuhiro et al (1983), ekstraksi dilakukan dengan cara buah panili yang telah dipotong dicampur dengan arginin hidroklorid dan atau lisin, satu atau lebih sakarida seperti glioxal, gliserinaldehid, maltosa, glukosa dan sebagainya, dan dipanaskan dengan pelarut seperti air, etanol, propilen glikol dan sebagainya pada suhu 40– 150 o
C selama 5 menit sampai 48 jam kemudian ekstraknya disaring. Sebagai metode alternatif, ekstrak panili dicampur dengan asam amino dan komponen karbonil. Campuran tersebut dipanaskan untuk mendapatkan flavor panili yang diinginkan. Menurut Reineccius (1994), reaksi antara karbonil dan amin disebut dengan reaksi maillard. Reaksi maillard menghasilkan melanoid dan senyawa nonvolatil yang signifikan terhadap flavor.
G. METODE RESPON SURFACE
Respon surface methodology atau RSM adalah kumpulan teknik matematik dan statistik yang digunakan untuk membentuk model dan menganalisis masalah dalam suatu respon yang dipengaruhi oleh beberapa peubah da n bertujuan untuk mengoptimalisasi respon ini (Box et al, 1978).
Dalam banyak masalah RSM, bentuk hubungan antara respon dan peubah bebasnya tidak diketahui. Jadi langkah pertama adalah mendapatkan suatu pendugaan yang cocok untuk fungsi yang sebenarnya antara y dan himpunan bebasnya. Untuk pendugaan ini biasanya digunakan suatu polinominal orde rendah. Jika respon telah dimodelkan dengan baik oleh fungsi linier dari peubah bebasnya, maka fungsi yang diduga adalah model ordo pertama.
Y = âo + âixi + â2x2 + … + âkxk + ε
Jika ada lengkungan dalam sistem, maka polinominal dengan ordo yang lebih tinggi harus digunakan, seperti model ordo kedua.
Y = âo + âixi + âax2+ … + âkxk + ε
III.
BAHAN DAN METODE
A. BAHAN DAN ALAT
1. Bahan Baku
Bahan baku yang digunakan adalah buah panili segar (Vanilla planifolia Andrews) yang berumur 6-8 bula n. Buah tersebut diperoleh dari Sulawesi dan Lampung.
2. Bahan Kimia
Bahan kimia yang digunakan adalah larutan butanol 0.3 M dan sistein 0.001 M, gliserin murni 96%, larutan gliserin 48%, sukrosa, vanillin standar, 0.1 N NaOH, 0.1 N HCl, 0.025 N Na2EDTA, 0.1 N NaCH3COO, 0.1 N CH3COOH, Pb(CH3COO)2, xylenol orange, indikator PP, indikator methyl orange, etanol p.a, etanol teknis 60%, metanol p.a, air bebas ion HPLC grade, dan asam asetat glasial p.a.
3. Alat
Bak perendam, rak penirisan, kain hitam, kotak peram ya ng dilengkapi lampu putih 18 watt, termometer, waterbath, oven, pipet 200 µl, pipet 1000 µl, pipet 10 ml, spektrofotometer (Simadzu), HPLC, GC-MS, pH meter, neraca analitik, milipore 0.45 µm, cawan alumunium, cawan porselin, tanur, destilasi alkohol, desikator, filter flask, pompa vakum, buret, pisau, botol 100 ml, jar dan peralatan gelas.
B. METODE PENELITIAN
1. Penelitian Pendahuluan
yaitu panili setengah kering, panili kering 1, dan panili kering 2 serta pemilihan komposisi pelarut (etanol : air). Panili setengah kering adalah panili yang diperoleh dari hasil pengeringan hari ke -5 (pengeringan selama lima hari pada suhu 40oC, 3 jam per hari), panili kering 1 adalah panili yang diperoleh dari hasil pengeringan hari ke-10 (pengeringan pertama pada suhu 40oC, 3 jam perhari selama 5 hari dan pengeringan kedua pada suhu 60oC, tiga jam per hari selama 5 hari). Sedangkan panili kering 2 adalah panili kering yang diperoleh dari hasil pengeringan hari ke -8 (pengeringan pertama pada suhu 40oC, 3 jam per hari selama 5 hari dan pengeringan kedua pada suhu 60oC, 6 jam perhari selama 3 hari). Ketiga bahan tersebut dikeringkan dengan metode kuring yang telah dimodifikasi. Cara untuk mendapatkan jenis bahan dapat dilihat pada Lampiran 4. Pada penelitian pendahuluan juga dicari pengaruh waktu, penambahan gliserin dan sukrosa terhadap kadar vanillin ekstrak yang hasilnya akan digunakan untuk panduan awal melakukan optimasi satu dan dua.
2. Penelitian Utama
Penelitian utama adalah mencari variabel optimum (waktu maserasi, sukrosa, dan gliserin) yang dapat memaksimalkan kadar vanillin dalam ekstrak panili single fold. Pencarian variabel optimum ini menggunakan metode respone surface dengan rancangan percobaan 22 faktorial da n 23 faktorial. Proses optimasi dapat dilihat pada Lampiran 5-7.
3. Prosedur Pengujian
k k
i=1 i=1 i<j
C. RANCANGAN PERCOBAAN
Penelitian ini terdiri dari tiga proses optimasi. Rancangan yang digunakan adalah 22 faktorial dan 23 faktorial. Variabel pada proses optimasi satu adalah waktu maserasi dan konsentrasi sukrosa. Variabel proses optimasi dua adalah waktu maserasi dan gliserin. Variabel pada proses optimasi tiga adalah waktu maserasi, sukrosa dan gliserin. Setiap variabel divariasikan pada dua level yaitu level rendah (-1), dan level tinggi (+1). Interval variabel dapat dilihat pada Tabel 3, Tabel 4, dan Tabel 5. Tabel 3. Var iabel independen yang digunakan dalam model statistik 1
Optimasi maserasi dengan
Tabel 4. Variabel independen yang digunakan dalam model statistik 2 Optimasi maserasi dengan
Tabel 5. Variabel independen yang digunakan dalam model statistik 3 Optimasi maserasi dengan
Model orde kedua yang bisa digunakan adalah sebagai berikut : Y = âo + âixi + âi ix2 + âi jxixj + ε
Dimana :
Y : Respon âij : Interaction term âii : Squared term
âo : Offset term xi : Coded level untuk faktor i
No
Yes
Tujuan penelitian : Optimasi proses
maserasi panili
Memilih respon : Kadar vanillin
Memilih variabel : Waktu maserasi Konsentrasi sukrosa Konsentrasi gliserin
Memilih interval untuk variabel independen : Tabel 3, Tabel 4 dan Tabel 5
Desain 22 dan 23 faktorial
Random experimental order
Model kuadratik
Lack of fit ANOVA
F hitung
Ada lack of fit ?
Hasil
optimum End
Ubah variabel dan atau respon.
Gambar 2. Perbandingan kadar vanillin tiga cara
Berdasarkan Gambar 2 diketahui bahwa , cara maserasi satu tahap mampu mengekstrak vanillin lebih tinggi (rata-rata 2.3 g/l) dibandingkan cara maserasi dua tahap dengan satu kali penyaringan (rata-rata 2.2 g/l) dan cara maserasi dua tahap dengan dua kali penyaringan (rata-rata 2.0 g/l). Maserasi satu tahap mampu mengekstrak vanillin lebih banyak dibandingkan maserasi dua tahap karena pada maserasi satu tahap etanol dan air ditambahkan secara bersama-sama. Dengan cara ini, penetrasi pelarut ke dalam bahan akan berjalan sempurna. Kelebihan lain maserasi satu tahap adalah mampu menghasilkan rendemen yang lebih tinggi dibandingkan dengan maserasi dua tahap karena pada maserasi satu tahap penyaringan dilakukan satu kali. Volume ekstrak akan berpengaruh terhadap perhitungan kadar vanillin yang dinyatakan dalam µg/g berat kering. Volume ekstrak berbanding lurus dengan kadar vanillin. Maserasi satu tahap juga mampu mencegah pertumbuhan jamur pada saat proses maserasi. Di lingkungan yang kurang bersih, jamur dapat tumbuh pada saat maserasi dengan pelarut 100% air. Jamur ini menimbulkan aroma buah busuk dan menyebabkan tidak terekstraknya vanillin. Berdasarkan kelebihan tersebut, cara maserasi satu tahap akan digunakan pada penelitian utama.
Etanol larut sempurna dalam air melalui ikatan hidrogen membentuk satu larutan. Ikatan hidrogen adalah ikatan yang terjadi antara atom H dari suatu molekul dengan atom N, O, atau F dari molekul lain membentuk satu molekul yang lebih besar. Larutan adalah campuran lebih dari satu komponen yang membentuk satu fase (Saeni, 1989). Menurut Keenan et al (1984), larutan adalah campuran homogen dari molekul, atom atau ion dari dua zat atau lebih. Bentuk ikatan hidrogen antara etanol dan air dapat dilihat pada Gambar 3.
Gambar 3. Ikatan hidrogen antara etanol dan air CH3 CH2 O H :O H
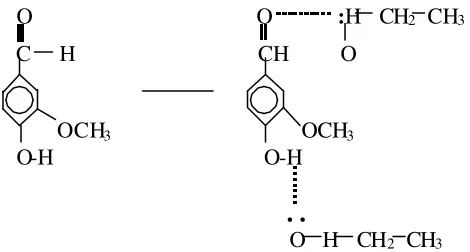
Pelarut akan melarutkan vanillin yang terdapat di dalam buah panili. Pemecahan ikatan suatu senyawa untuk berikatan dengan pelarut disebut dengan proses melarut (Winarno et al, 1973). Proses melarut disebabkan oleh gaya tarik menarik antar partikel larutan dan pelarut yang menghasilkan bentuk partikel terlarut. Gugus hidroksil (-O-H) dan gugus aldehid (H -C=O) merupakan daerah di mana terdapat gaya tarik menarik yang kuat untuk molekul-molekul pelarut. Molekul etanol akan mengatur diri disekitar permukaan kristal vanillin sedemikian rupa sehingga bagian positif dan negatif molekul etanol menarik bagian molekul vanillin yang memiliki muatan berlawanan. Molekul vanillin meninggalkan permukaan kristal dan masuk ke dalam larutan. Molekul etanol dan molekul vanillin saling menarik berdasarkan ikatan hidrogen. Lapisan molekul pelarut yang terikat pada permukaan partikel zat terlarut membantu menjaga ion-ion atau molekul-molekul itu agar tetap terpisah. Pemisahan ini menghalangi rekristalisasi (pengkristalan kembali) sehingga membantu proses pelarutan (Keenan et al, 1984). Proses melarutnya vanillin dalam etanol dapat dilihat pada Gambar 4.
O O :H CH2 CH3 C H CH O
OCH3 OCH3
O-H O-H
. .
O H CH2 CH3 Gambar 4. Proses melarutnya vanillin dalam etanol
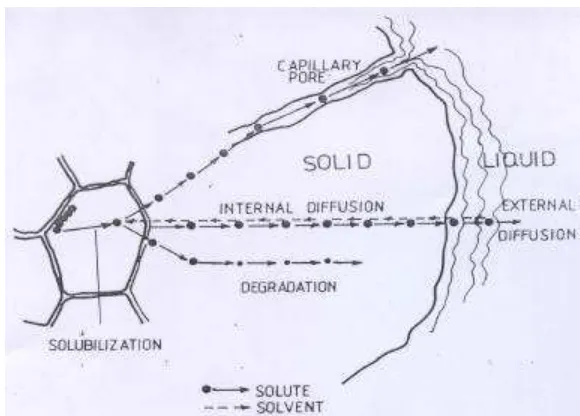
(swelling), selanjutnya terjadi proses difusi sehingga senyawa yang terekstrak keluar dari dinding sel tanaman (Aguilera, 1999). Mekanisme perpindahan massa zat terlarut ke dalam larutan dapat dilihat pada Gambar 5.
Gambar 5. Mekanisme perpindahan massa (Aguilera, 1999)
2. PENENTUAN JENIS BAHAN DAN KOMPOSISI PELARUT
kering 2 adalah panili kering yang diperoleh dari hasil pengeringan selama 7-8 hari (pengeringan lima hari pertama pada suhu 40oC selama tiga jam per hari dan pengeringan kedua pada suhu 60oC, enam jam per hari selama 2-3 hari). Jenis bahan ketiga ini memiliki kadar air 18-20%, berwarna hitam mengkilat, berminyak, agak kaku, aroma khas panili, bentuk polong utuh, berisi, dan panjang antara 12-19 cm.
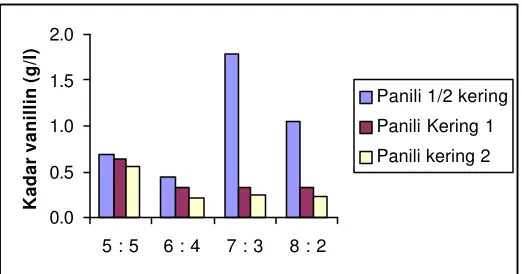
Masing-masing jenis bahan akan dimaserasi selama enam hari pada suhu ruang dengan cara maserasi satu tahap. Bahan dimaserasi dengan komposisi pelarut (etanol : air) dicoba mulai dari 5:5, 6:4, 7:3 sampai 8:2. Grafik kadar vanillin hasil maserasi masing-masing jenis bahan pada beberapa komposisi pelarut dapat dilihat pada Gambar 6.
Gambar 6. Kadar vanillin masing-masing jenis bahan
Dari Gambar 6 diketahui bahwa, panili setengah kering mampu menghasilkan kadar vanillin yang lebih tinggi (rata -rata 0.98 g/l) dibandingkan panili kering 1 rata 0.41 g/l) dan panili kering 2 (rata-rata 0.32 g/l). Hal ini sesuai dengan hasil penelitian yang dilakukan oleh Setyaningsih et al (2003) yaitu perlakuan perendaman buah panili segar dalam aktivator enzim butanol 0.3 M dan sistein 1 mM selama dua jam sebelum proses scalding menghasilkan kadar vanillin maksimal pada pengeringan hari ke -5. Komposisi etanol : air yang terbaik untuk bahan satu adalah 7:3 (kadar vanillin 1.79 g/l), sedangkan untuk bahan dua dan tiga komposisi terbaik adalah 5:5 (kadar vanillin 0.64 g/l dan 0.56 g/l). Buah kering memiliki kadar vanillin yang lebih rendah dibandingkan buah setengah kering. Hal ini disebabkan karena proses pengeringan
berpengaruh terhadap penurunan kadar vanillin. Selama proses pengeringan, sebagian vanillin akan dioksidasi oleh enzim peroksidase menjadi senyawa vanillin teroksidasi seperti asam benzoat, asam vanillin dan alkohol. Vanillin teroksidasi kemudian akan dioksidasi oleh enzim polifenolase membentuk pigmen yang stabil. Sebagian vanillin teroksidasi juga akan mengalami oksidasi nonenzimatis membentuk derivat aroma vanillin yang akan memperkaya aroma ekstrak panili. Kadar vanillin ekstrak pada penelitian pendahuluan dua ini lebih rendah jika dibandingkan dengan kadar vanilin ekstrak pada penelitian pendahuluan satu (penentuan cara maserasi). Hal ini disebabkan karena perbedaan varietas dan usia buah panili. Pada penelitian pendahuluan satu, buah panili yang digunakan berasal dari Lampung dengan usia buah sekitar 6-8 bulan. Sedangkan pada penelitian pendahuluan dua, buah panili yang digunakan berasal dari Sula wesi dengan usia buah kurang dari 6 bulan. Konsentrasi glukovanillin pada buah muda masih rendah dan selama proses pengolahan, buah muda akan mudah terserang jamur sehingga kadar vanillinnya rendah.
Kandungan air dalam buah juga akan berpengaruh terhadap kesempurnaan proses ekstraksi. Pada buah setengah kering, sel-sel buah berada dalam keadaan turgor. Permeabilitas sel rendah sehingga proses osmosis berjalan lebih sempurna. Sedangkan pada buah kering, sel banyak kehilangan air sehingga sel menyusut dan pe rmeabilitas sel tinggi. Proses osmosis akan berjalan lebih lambat. Vanillin terletak disekitar plasenta dan biji. Jika permeabilitas sel rendah maka pelarut akan lebih mudah berdifusi ke dalam sel. Semakin banyak pelarut kontak dengan vanillin maka akan semakin banyak vanillin yang tereksrak.
terekstraknya klorofil sehingga ekstrak akan berwarna coklat kehija u-hijauan. Klorofl sulit dipisahkan dari ekstrak. Selain fixed oil, zat yang mungkin terekstrak dalam ekstrak panili adalah gum, resin, gula, dan wax. Menurut Purseglove et al (1981), dalam jumlah yang sedikit, keberadaan zat tersebut dapat memperkaya aroma panili. Namun jika jumlahnya terlalu banyak, zat tersebut dapat menimbulkan flavor woody dan rasa pahit yang tidak dikehendaki dalam ekstrak. Data kadar vanillin hasil perlakuan jenis bahan dan komposisi pelarut dapat dilihat pada Lampiran 10.
3. PENGARUH WAKTU SERTA PENAMBAHAN SUKROSA DAN
GLISERIN
Menurut Purseglove et al (1981), sukrosa dan gliserin biasa ditambahkan pada saat proses ekstraksi panili. Penambahan sukrosa 11% (b/v) dan gliserin 6% (v/v) dapat membantu proses ekstraksi senyawa-senyawa penting yang terdapat dalam buah panili, meningkatkan kekentalan, mencegah penguapan etanol, dan meningkatkan warna ekstrak. Pengaruh waktu serta penambahan sukrosa dan gliserin dapat dilihat pada Gambar 7 dan 8.
Keterangan :
S1 : waktu maserasi 1 hari, sukrosa 0.5 g S5 : waktu maserasi 5 hari, sukrosa 2.5 g S9 : waktu maserasi 9 hari, sukrosa 4.5 g S16 : waktu maserasi 16 hari, sukrosa 8 g Gambar 7. Pengaruh waktu dan sukrosa
3.000 3.200 3.400 3.600 3.800 4.000 4.200
S1 S5 S9 S16
Keterangan :
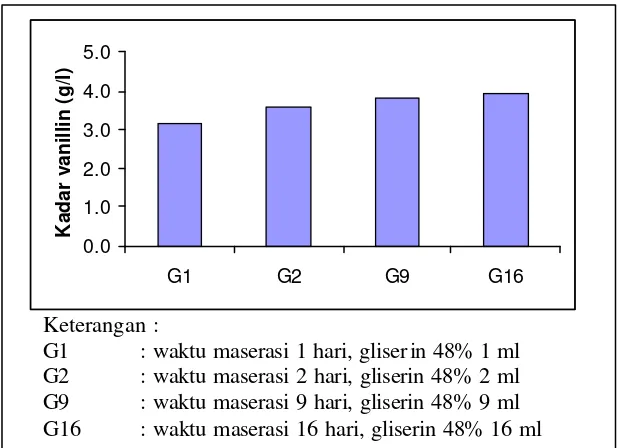
G1 : waktu maserasi 1 hari, gliser in 48% 1 ml G2 : waktu maserasi 2 hari, gliserin 48% 2 ml G9 : waktu maserasi 9 hari, gliserin 48% 9 ml G16 : waktu maserasi 16 hari, gliserin 48% 16 ml
Gambar 8. Pengaruh waktu dan gliserin
Pada penelitian pendahuluan ini, maserasi dicoba dari 1-16 hari. Waktu maserasi 1-16 hari dipilih untuk mengetahui kecenderungan kadar vanillin yang terekstrak seiring dengan bertambahnya waktu maserasi. Rentang waktu yang dipilih berada dalam rentang waktu maserasi yang dilakukan oleh Arvillal (2001). Sukrosa yang ditambahkan dicoba dari konsentrasi 0.5-8 % (b/v). Sedangkan gliserin yang ditambahkan dicoba dari 1-16 % (v/v). Sebelum ditambahkan, gliserin murni sebanyak 250 ml dengan konsentrasi 96% dicampur dengan air sa mpai dengan 500 ml sehingga didapat larutan gliserin dengan konsentrasi 48%. Tujuan pengenceran adalah agar gliserin tidak terlalu kental sehingga mempermudah pengukuran.
Berdasarkan Gambar 7 dan 8 di atas dapat diketahui bahwa, kadar vanillin yang terekstrak meningkat (dari 3.1 g/l sampai dengan 3.9 g/l) seiring dengan bertambahnya waktu maserasi (1-16 hari), konsentrasi sukrosa (0.5-8 g) dan konsentrasi gliserin (1-16 ml). Penambahan sukrosa dan gliserin terbukti mampu meningkatkan kelarutan vanillin. Hal ini dapat dilihat dari tingginya kadar vanillin yang terekstrak jika dibandingkan dengan hasil ekstraksi tanpa penambahan sukrosa dan gliserin (Gambar 2 dan 6). Sukrosa dan gliserin memiliki gugus hidroksil
0.0 1.0 2.0 3.0 4.0 5.0
G1 G2 G9 G16
sehingga dapat meningkatkan kelarutan vanillin. Berdasarkan hasil analisis regresi menggunakan Minitab, waktu maserasi berpengaruh positif terhadap kadar vanillin. Hal ini berarti bertambahnya waktu maserasi mampu meningkatkan kadar vanillin yang terekstrak. Sedangkan sukrosa dan gliserin berpengaruh ne gatif. Hal ini berarti penambahan sukrosa dan gliserin yang berlebih akan mengakibatkan penurunan kadar vanillin yang terekstrak. Penambahan sukrosa dan gliserin yang berlebih dapat meningkatkan viskositas larutan sehingga menurunkan resistensi larutan untuk berdifusi ke dalam sel. Data kadar vanillin hasil perlakuan waktu maserasi, sukrosa dan gliserin dapat dilihat pada Lampiran 11 dan 12.
B. PENELITIAN UTAMA
1. OPTIMASI SATU
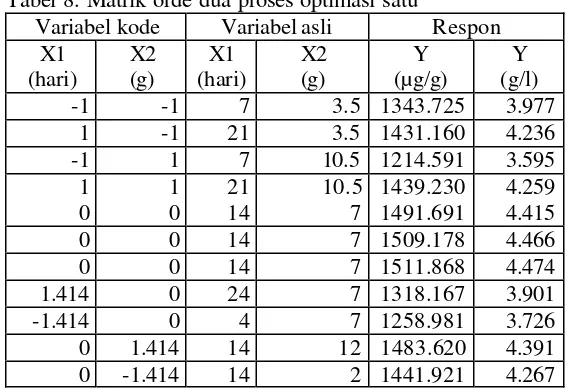
Optimasi satu adalah optimasi proses maserasi dengan penambahan sukrosa. Variabel pada optimasi ini adalah waktu maserasi dan banyaknya sukrosa yang ditambahkan. Rentang variabel dipilih berdasarkan penelitian pendahuluan (Gambar 7). Sampai hari ke -16, kadar vanillin terus menunjukan peningkatan. Waktu maserasi berpengaruh positif terhadap kadar vanillin. Hal ini berarti ada kemungkinan dengan ditambahnya waktu maserasi maka kadar vanillin yang terekstrak akan terus meningkat. Karena pada penelitian pendahuluan waktu maserasi hanya dicoba sampai 16 hari maka, penetuan level tinggi waktu maserasi mengacu pada waktu maserasi Arvillal (2001) yaitu 21 hari. Sedangkan level rendah waktu maserasi adalah 7 hari dan titik tengah waktu maserasi 14 hari. Level tinggi untuk variabel sukrosa adalah 10.5 g, level rendah adalah 3.5 g dan titik tengah 7 g. Matrik orde pertama optimasi satu dapat dilihat pada Tabel 6. Analisis varian orde pertama dapat dilihat pada Tabel 7. Model orde pertama dari variabel kode untuk optimasi satu adalah sebagai berikut :
Tabel 6. Matrik orde pertama proses optimasi satu Variabel kode Variabel asli Respon
X1
Tabel 7. Analisis varian untuk orde pertama proses optimasi satu
Regression Degrees of Crossproduct 1 4706.234404 0.0672 308.9 0.0246 Total
Regress
4 69797 0.9966 145.4 0.0068
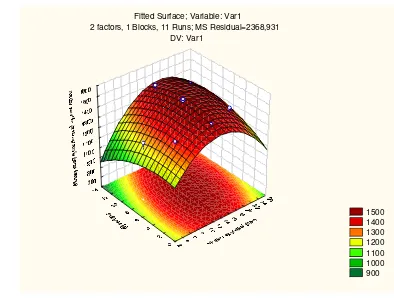
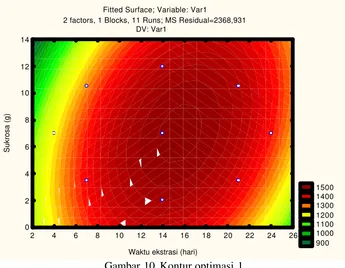
Berdasarkan analisis varian diketahui bahwa, efek kuadratik lebih signifikan dibanding efek linier dengan F hitung sebesar 308.9. Hal ini mengindikasikan bahwa interval variabel yang dipilih telah mendekati titik optimum. Empat titik observasi (central composite design) perlu ditambahkan untuk mendapatkan lokasi titik optimum yang tepat. Matrik orde kedua proses optimasi satu dapat dilihat pada Tabel 8. Grafik permukaan respon dan kontur hasil dari optimasi satu dapat dilihat pada Gambar 9 dan 10.
Tabel 8. Matrik orde dua proses optimasi satu
Berdasarkan analisis varian (ANOVA) orde dua, Pengaruh kuadratik signifikan pada tingkat kepercayaan 95% dengan nilai signifikan sebesar 99.62%. X1 dan X12 signifikan dengan nilai signifikan sebesar 99.66% dan 99.86%. X2 dan interaksi antara X1X2 tidak signifikan dengan nilai sigifikan sebesar 86.75% dan 89.12%.
Dengan memperhatikan bentuk kontur yang memusat, dapat diketahui bahwa titik optimum sudah dicapai. Berdasarkan hasil running program SAS dapat diketahui bahw a, titik optimum diperoleh dari respon waktu maserasi 15.9 hari dan sukrosa sebanyak 7.3 g dengan kadar vanillin rata -rata yang terekstrak sebanyak 1509.075097 mikrogram/g berat kering atau sama dengan 4.5 g/l. Kadar vanillin ekstrak hasil optimasi satu 1. 5 kali lebih tinggi dibandingkan kadar vanillin ekstrak dari buah hasil pengeringan Balitro II tanpa penambahan sukrosa (Kontrol). Data kadar vanillin ekstrak hasil optimasi satu dapat dilihat pada Lampiran 13. Hasil running SAS dapat dilihat pada Lampiran 14.
Fitted Surface; Variable: Var1
2 factors, 1 Blocks, 11 Runs; MS Residual=2368,931 DV: Var1
1500 1400 1300 1200 1100 1000 900
Fitted Surface; Variable: Var1
2 factors, 1 Blocks, 11 Runs; MS Residual=2368,931 DV: Var1 Persamaan matematis untuk optimasi satu adalah :
Y = 1014.069771 + 60.466625X1 + 7.187069X2 - 2.259138X12 + 1.400041X1X2 - 2.068691X22
Dimana :
Y = kadar vanillin (mikrogram/ml) X1 = waktu maserasi (hari)
X2 = banyaknya sukrosa yang ditambahkan (g). R2 = 89.04%
2. OPTIMASI DUA
Tabel 9. Matrik orde pertama proses optimasi dua Variabel kode Variabel asli Respon
X1
Tabe l 10. Analisis varian orde pertama proses optimasi dua
Regression Degrees of Crossproduct 1 6955.393201 0.2298 961.2 0.0010 Total
Regress
4 30248 0.9995 1045.0 0.0010
Berdasarkan analisis varian di atas, diketahui bahwa efek linier lebih signifikan dibandingkan efek kuadratik dengan nilai F hitung sebesar 1266.5. Hal ini mengindikasikan bahwa interval variabel yang dipilih belum mendekati titik optimum. Matrik orde kedua proses optimasi dua dapat dilihat pada Tabel 11. Grafik permukaan respon dan kontur optimasi dua dapat dilihat pada Gambar 11 dan 12.
Tabel 11. Matrik orde dua proses optimasi dua
Variabel kode Variabel asli Respon X1
pengaruh kuadratik dengan nilai signifikan 96.03%. Model linier yang diperoleh dari variabel kode adalah sebagai berikut :
Y = 1260.33 - 28.9205X1 + 61.2040X2 Dimana :
Y = kadar vanillin (mikrogram/ml) X1= gliserin (ml)
X2= waktu maserasi (hari) R2= 99.95%
Fitted Surface; Variable: Var1
2 factors, 1 Blocks, 11 Runs; MS Residual=1533,119 DV: Var1
2 factors, 1 Blocks, 11 Runs; MS Residual=1533,119 DV: Var1
tinggi variabel sukrosa dan gliserin ditentukan berdasarkan tinjauan pustaka (Purseglove et al, 1981). Gliserin digunakan dalam bentuk larutan murni 99.6%. Kadar vanillin diukur dengan menggunakan HPLC. Matrik orde pertama optimasi tiga dapat dilihat pada Tabel 12. Analisis Varian orde pertama dapat dilihat pada Tabel 13.
Tabel 12. Matrik orde pertama proses optimasi tiga Variabel Kode Variabel Asli Tabel 13. Analisis varian orde pertama proses optimasi tiga
Source DF Seq SS Adj SS Adj MS F P
2920
Dengan bantuan Minitab diketahui bahwa titik variabel optimum berada pada waktu maserasi 12 hari, sukrosa 7 g, dan gliserin 4,7 ml dengan kadar vanillin yang terekstrak sebanyak 3449.592 ppm atau sama dengan 3.4 g/l. Variabel sukrosa optimum pada konsentrasi 7% (b/v). Hal ini sesuai dengan hasil optimasi satu. Variabel gliserin optimum pada konsentrasi 4,7% (v/v). Hal ini juga mendukung hasil optimasi dua. Penambahan gliserin yang terlalu banyak dapat memperlambat proses ekstraksi. Penambahan sukrosa dan gliserin secara bersama-sama dalam jumlah yang tepat dapat mempercepat waktu ekstraksi.
Faktor yang perlu diperhatikan untuk scale up maserasi panili adalah kadar air bahan, komposisi pelarut (etanol : air), Konsentrasi sukrosa, konsentrasi gliserin, dan dimensi tangki ekstraktor. Bagian tangki ekstraktor yang kontak langsung dengan bahan dan pelarut harus terbuat dari stainless steal atau gelas. Tangki ekstraktor dapat dilengkapi dengan agitator untuk mengatur pergerakan pelarut disekitar bahan.
4. ANALISIS EKSTRAK DARI BUAH SETENGAH KERING SELAIN
VANILLIN
a. TOTAL ASAM
adalah banyaknya H+ yang bereakasi dengan OH- membentuk H2O (Harjadi, 1993).
H+ + OH- H 2O
Adanya asam organik dapat digunakan untuk identifikasi keaslian ekstrak panili karena asam-asam organik merupakan unsur yang terkandung dalam panili yang terbentuk selama proses curing. (Herman et al, 1990). Sebagian senyawa vanillin akan mengalami oksidasi enzimatik (enzim peroksidase) mengasilkan asam organik seperti asam benzoat dan asam vanillin. Senyawa golongan asam karboksilat juga dapat terbentuk dari reaksi oksidasi alkohol. Reaksi oksidasi alkohol dapat dilihat pada Gambar 17. Asam-asam organik seperti asam asetat, asam ferulat, dan asam malat juga dapat terbentuk dari hasil fermentasi glukosa yang ada dalam buah panili. Menurut Civolani et al (1999), asam ferulat dapat terbentuk melalui proses biokonversi dari asam vanillin oleh Pseudomonas flourescens. Menurut Purseglove et al (1981), ekstrak panili sedikitnya mengandung 20 asam organik. Berdasarkan hasil analisis GC-MS acetic acid adalah yang komponen asam yang paling dominan. Ekstrak panili dari buah panili setengah kering memiliki nilai total asam 380-410 ml 0.1 N NaOH/l. Nilai ini sesuai dengan standar yang dibuat oleh FDA. Data nilai total asam dapat dilihat pada Lampiran 19.
Gambar 17. Reaksi oksidasi alkohol
b. LEAD NUMBER
Prinsip analisis lead number adalah asam organik dari panili diendapkan dengan Pb(CH3COO)2, garam Pb yang tidak larut dirubah,
[O]
RCH RCH2OH
dan kelebihan Pb ditentukan dengan titrasi chelometric dengan Na2EDTA. Menurut Harjadi (1993), EDTA merupakan asam berbasa empat. Bentuk sederhananya adalah H4Y. Sebagai asam lemah, EDTA mengalami pengionan bertahap melepaskan ion hidrogen satu per satu. EDTA mampu membentuk kompleks dengan ion logam dan memiliki konstanta ke stabilan yang besar sehingga reaksi berjalan sempurna. Pembentukan kelat logam dengan EDTA dapat ditulis secara umum sebagai berikut:
Mn+ + Y4- MYn-4
Lead number sering digunakan untuk menentukan asam organik dalam ekstrak secara cepat. Lead number ekstrak dari buah panili setengah kering adalah 4,5-4,6. Nilai lead number ini memenuhi persyaratan FDA yaitu sebesar 4.0-7.4. Lead number dan total asam adalah dua metode yang digunakan untuk mendeteksi adanya senyawa organik yang ada dalam ekstrak panili. Ekstrak panili alami mengandung senyawa organik yang terbentuk dari oksidasi senyawa vanillin selama proses curing dan dari hasil proses oksidasi alkohol selama proses conditioning. Kandungan senyawa organik yang rendah mengindikasikan adanya pencampuran. Data lead number dapat dilihat pada Lampiran 20.
panili sintetik yang dibuat dari lignin, eugenol atau guaiacol (Peter, 2004).
c. KADAR ABU
Abu berasal dari mineral-mineral yang dikandung dalam buah panili seperti kalium, kalsium, klor, dan magnesium. Kandungan mineral pada buah panili segar sekitar 0.02%. Kadar abu total ekstrak dari buah panili setengah kering adalah 1.33-3.34 g/l. Syarat minimal abu total yang ditetapkan oleh FDA adalah sebesar 2.20– 4.32 g/l. Ekstrak panili yang disaring dua kali memiliki kadar abu sebesar 1.33 g/l. Nilai ini lebih rendah dari persyarat FDA. Penyaringan dapat mempengaruhi perhitungan kadar abu karena sebagian senyawa anorganik yang tidak larut akan tertinggal dikertas saring whatman. Namun demikian, nilai ini 12 kali lebih besar jika dibandingkan dengan kadar abu ekstrak panili sintetik (0.1 g/l). Nilai abu total sangat penting untuk identifikasi kemurniaan ekstrak panili. Panili sintetik biasanya hanya mengandung vanillin atau etil vanillin. Panili sintetik biasanya hampir bebas dari abu. Data kadar abu dapat dilihat pada Lampiran 21.
d. ABU TERLARUT
Abu terlarut dihitung berdasarkan banyaknya abu yang larut dalam air panas. Abu terlarut ekstrak dari buah panili setengah kering adalah 0.8-2.9 g/l. Persyaratan FDA untuk abu terlarut adalah sebesar 1.79–3.57 g/l. Ekstrak yang memiliki nilai abu total rendah juga akan memiliki nilai abu terlarut rendah. Menurut Reineccius (1994) lebih dari 80% abu total larut di dalam air. Data abu terlarut dapat dilihat pada Lampiran 22.
e. ALKALINITAS ABU TERLARUT
oleh FDA yaitu 220– 400 ml 0.1 N asam/l. Data alkalinitas abu terlarut dapat dilihat pada Lampiran 23.
f. ALKALINITAS ABU TOTAL
Alkalinitas abu total dihitung berdasarkan alkalinitas abu terlarut dan alkalinitas abu tidak terlarut. Nilai alkalinitas abu total ekstrak dari buah panili setengah kering adalah 462.6-536.7 ml 0.1 N HCl/l. Alkalinitas menunjukan adanya unsur logam yang dapat membentuk basa seperti natrium, kalium, kalsium dan magnesium. Unsur-unsur logam ini berasal dari unsur mineral yang ada di dalam buah panili. Alkalinitas merupakan pertahanan larutan terhadap keasaman. Oleh karena itu, alkalinitas akan berhubungan dengan pH ekstrak, nilai total asam dan lead number. Data alkalinitas abu total dapat dilihat pada Lampiran 23.
Perbandingan karakteristik ekstrak dari buah setengah kering, kontrol (ekstrak dari buah kering yang dikeringkan dengan metode Balitro II tanpa penambahan sukrosa dan gliserin), dan standar FDA dapat dilihat pada Tabel 14.
Tabel 14. Perbandingan karakteristik ekstrak Karakteristik Ekstrak dari buah
setengah kering
Tabel 15. Analisis senyawa volatil
Formic acid 3.022 301248 1988638 1711099 1849869 Pungent
Acetic acid 3.251 2726508 5407973 5953784 5680879 Sour, vinegar, pungent
Oxalic acid 4.936 38162 38162 Pungnt 3-hydroxy butanoic acid 7.275 39020 39020 Rancid Fatty acid
Decanoic acid 40.740 39466 Oily/fatty Aliphatic alcohols
2-propyn-1-ol 4.118 109487
2,3-butanediol 4.611 50367 Floral, oily 1-acetoxy-2-propanol 5.382 15820 29965 22893
2-furanmenthol 5.567 62459 192843 280413 236628
Furaneol 11.683 23698 23698 Fruit, burnt, sugar Maltol 12.494 392493 397882 395188 Cotton candy, sweet Aliphatic esters and lactones
Methyl acrylate 4.313 291343 291343 Methyl glycoate 4.033 109256 109256 Methyl pyruvate 4.821 380012 878139 629076 2-acetyl—2-hydroxy- gamma
butyrolactone
14.114 116092 161158 282774 221966 Coconut-like
Alkanes
Propyl isopropyl ether 4.486 103864
Methyl vanillylether 23.324 149902 208097 179000 Aromatic ketones
1-hydroxy-2-propanone 3.461 771428 4256057 2940313 3598185
3-hydroxy-2-butanone 4.108 22810 282480 152645 Buttery 1-penten-3-one 4.467 220608 220608
1-hydroxy-2-propanone 4.282 187347
2,3-pentadione 4.473 161584 161584 Sweet 1-hydroxy-2-butanone 4.621 185151 185151 1-(acetyloxy)-2-propanone 6.046 13009 13009 Dihydro-2(3H)-furanone 6.821 28282 64303 64303 Caprolactone 7.051 64162 64162 2-hydroxycyclopent-2-en-1-one 7.390 162745 162745 Cyclohexanone 7.152 93603
5-methyl-2(3H)-furanone 7.299 16049 1-(acetyloxy)-2-propanone 8.475 8966
2,3-dihydro-3,5-dihydroxy-6-methyl-4H-pyran-4-one
14.354 565627 935386 1528709 1232048
2-pentadecanone 33.132 138938 138938 Buttary Aromatic aldehydes
Benzaldehyde 22.670 21370 Vanilla-like, Vanillin 23.520 2693470 5320194 6095183 5707689 Vanilla, sweet Heterocyclics
Furfural 4.733 254094
5-(hydroxymethyl)-2-furfural 17.890 2334317 7369951 Aliphatic hydrocarbon
1,1-diethoxyethane 4.808 72354 72354 2,4-dimethy-1,3-dioxane 8.630 115557 78113 78113 3-hydroxy tetrahydrofuran 9.694 756808 756808
Pada ekstrak yang diperoleh dari buah panili hasil pengeringan metode Balitro II (kontrol) diperoleh 17 puncak. Sedangkan pada ekstrak dari buah setengah kering ulangan 1 diperoleh 28 puncak dan dari ulangan 2 diperoleh 24 puncak. Senyawa yang terdeteksi pada kontrol tetapi tidak terdeteksi pada ekstrak dari buah panili setengah kering adalah 2 -propyn-ol, 1-hydroxy -2-propanone, 2,3 butanediol, propyl isopropyl ether, dan cyclohexanone. Sedangkan senyawa yang terdeteksi pada ekstrak buah panili setengah kering tetapi tidak terdeteksi pada kontrol adalah 3-hidroxy-2-butanone, methyl acrylate, methyl glycolate, methyl pyruvate, penten-3-one, 2,3 pentadione, hydroxy-2-butanone, furfural, 1,diethoxyethene, oxalic acid, 1-acetoxy-2 -propanol, 1-(acetyloxy)-propanone, caprolacton, 2-hydroxycyclopent-2 -en-1-one, 3-hydroxy butanoic acid, 5-methyl-2(3H) -furanone, 1-(acetyloxy)-2-propanone, 3-hydroxy tetrahydrofuran, furaneol, maltol, 5-(hydroxymethyl)-2 -furfural, methyl vanillyether, 2-pentadecanone, hexadecanal, dan decanoic acid. Senyawa golongan heterosiklik seperti furfural dan 5-(hydroxymethyl)-2-furfural yang terdapat pada ekstrak buah panili setengah kering diduga berasal dari hasil reaksi maillard. Reaksi ini dapat terjadi karena pada saat proses ekstraksi ditambahkan sukrosa. Komponen flavor yang terbentuk dari reaksi maillard dapat dilihat pada Gambar 18.
Reducing sugar and α-amino acid (Maillard Reaction)
N-glycosylamines or N-fruktosylamines Furfural
1-amino-1-deoxy-2-ketose or 1-amino-2-deoxy-2-aldos (Amadori and Heyns intermediates)
Reduction and dehydroreduction Hydroxymethyl-5-furfural
3-furanones Hydroxyacetone Glyoxal Aldehides + α-aminoketones
4-pyranones Cyclotene Pyruvaldehyde (+ methianal from methionine) Pyrroles Dihydroxyacetone Glycolaldehyde ( + H2S and NH3 from cystein) Thiophenes Hidroxyacetyl Glyceraldehyde
Acetan
Heterocyclization Pyridines Thiazoles
Pyrazine Pyroles Oxazoles Imidazoles Gambar 18. Pembentukan komponen flavor melalui nonenzimatik browning
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Cara maserasi yang dapat digunakan untuk proses optimasi adalah cara maserasi satu tahap. Cara ini mampu mengekstrak vanillin (rata-rata 2.3 g/l) lebih tinggi dibandingkan cara maserasi dua tahap (rata-rata 2.2 g/l). Jenis bahan yang mampu menghasilkan ekstrak dengan kadar vanillin tinggi adalah buah panili setengah kering. Kadar vanillin bahan ini (rata-rata 0.98 g/l) lebih tinggi dibandingkan kadar vanillin buah panili kering 1 dan 2 (rata-rata 0.41 g/l dan 0.32 g/l). Komposisi etanol : air yang paling tepat untuk maserasi buah panili setengah kering adalah 7:3 (kadar vanillin 1.78 g/l). Peningkatan waktu ekstraksi dari 1-16 hari, sukrosa dari 0.5-8 g, dan gliserin dari 1-16 ml berpengaruh terhadap penin gkatan kadar vanillin dari 3.1-3.9 g/l. Waktu maserasi berpengaruh positif terhadap kadar vanillin. Sedangkan sukrosa dan gliserin berpengaruh negatif sehingga perlu dicari konsentrasi sukrosa dan gliserin yang tepat yang mampu meningkatkan kelarutan vanillin dalam ekstrak panili.
Proses optimasi satu telah mencapai titik optimum. Variabel yang dapat mengoptimumkan kadar vanillin pada proses optimasi satu adalah waktu maserasi (15.9 hari) dan sukrosa (7.3 g) dengan kadar vanillin 1509. 075097 mikrogram/g berat kering atau sama dengan 4.5 g/l (1.5 kali lebih tinggi dibandingkan kontrol). Proses optimasi dua belum mencapai titik optimum. Nilai kadar vanillin maksimal sebesar 1290.932563 mikrogram/g berat kering atau sama dengan 3.8 g/l (1.2 kali lebih tinggi dibandingkan kontrol) dicapai dari variabel waktu ekstraksi 22 hari dan gliserin 48% sebanyak 19.9 ml. Optimasi tiga sudah mencapai titik optimum. Variabel yang mampu mengoptimumkan kadar vanillin pada proses optimasi tiga adalah waktu maserasi (12 hari), sukrosa (7 g,) dan gliserin 96% (4.3 ml) dengan kadar vanillin ekstrak sebesar 3.4 g/l.
3.42 g/l, abu terlarut 0.81– 2.91 g/l, alkalinitas abu total 462.6-536.7 ml 0.1 N HCl/l, alkalinitas abu terlarut 139.1– 216.5 ml 0.1 N HCl/l, dan lead number 4.5-4.9. Sebagaian besar nilai tersebut memenuhi syarat ekstrak panili yang ditetapkan oleh FDA.
B. SARAN
1. Pada optimasi dua perlu dilakukan metode steepest ascent untuk mendapatkan rentang variabel X1 dan X2 yang baru yang dapat memberikan respon yang mendekati titik optimum. Rancangan untuk melakukan steepest ascent dapat dilihat pada Lampiran 24.
2. Perlu dilakukan penelitian tentang cara maserasi bertahap dengan pelarut etanol-air yang ditambahkan secara bersama -sama pada setiap tahap maserasi. Cara maserasi ini merupakan saran perbaikan untuk cara maserasi dua tahap yang telah dilakukan pada penelitian ini. Diagram alir cara maserasi bertahap dapat dilihat pada Lampiran 25. 3. Perlu dilakukan penelitian optimasi dengan metode perkolasi sebagai