SINTESIS ESTER GLUKOSA STEARAT
MELALUI REAKSI INTERESTERIFIKASI DENGAN
METODE BEBAS PELARUT
IKA SARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
IKA SARI. Sintesis Ester Glukosa Stearat melalui Reaksi Interesterifikasi dengan Metode Bebas Pelarut. Dibimbing oleh BETTY MARITA SOEBRATA dan TUN TEDJA IRAWADI.
Ester karbohidrat-asam lemak merupakan jenis surfaktan nonionik yang banyak digunakan pada industri kosmetik, farmasi, detergen, dan makanan. Umumnya ester karbohidrat-asam lemak disintesis menggunakan pelarut beracun, seperti dimetilasetamida, dimetilformamida, dan dimetilsulfoksida sehingga produk yang dihasilkan memiliki keterbatasan sebagai bahan tambahan pada industri makanan. Penelitian ini dilakukan melalui 4 tahapan, yaitu (1) sintesis glukosa pentaasetat (GPA) melalui reaksi antara glukosa dan anhidrida asetat, (2) sintesis metil stearat melalui reaksi antara asam stearat dan metanol, (3) sintesis ester glukosa stearat melalui reaksi antara GPA dan metil stearat (nisbah mol 1:1, 1:2, dan 1:3) dengan katalis zeolit, dan (4) pemisahan hasil sintesis ester glukosa stearat dari metil stearat dan GPA yang tidak bereaksi. Persentase hasil GPA dan metil stearat yang diperoleh masing-masing sebesar 45.52 dan 84.60%. Persentase hasil ester glukosa stearat tiap nisbah mol GPA dan metil stearat 1:1, 1:2, dan 1:3 secara berturut-turut 76.24, 38.30, dan 9.98%. Spektrum fourier transform infrared ester glukosa stearat menghasilkan ciri pita serapan pada bilangan gelombang 2800–3000 cm-1 yang menunjukkan vibrasi ulur C–H dari CH3, –CH2– rantai
alifatik jenuh.
ABSTRACT
IKA SARI. Synthesis of Glucose Stearate Ester through Interesterification Reaction by Solvent-Free Method. Under the direction of BETTY MARITA SOEBRATA and TUN TEDJA IRAWADI.
Carbohydrate fatty acid esters are nonionic surfactants which have attracted attention from cosmetic, pharmaceutical, detergent, and food industries. Commonly the carbohydrate fatty acid esters is synthesized using toxic solvent, such as dimethylacetamide, dimethylformamide, and dimethylsulfoxide so that the produced carbohydrate fatty acid esters have limited function as an additive in food industries. This research has been done in 4 steps, i.e (1) synthesis of glucose pentaacetate (GPA) through a reaction between glucose and acetic anhydride, (2) synthesis of methyl stearate through a reaction between stearic acid and methanol, (3) synthesis of glucose stearate ester through a reaction between GPA and methyl stearate (mol ratio 1:1, 1:2, and 1:2) with zeolite as catalyst, and (4) separation of the glucose stearate ester product from unreacted methyl stearate and GPA. The yields of GPA and methyl stearate were 45.52 and 84.60%, respectively. The yields of glucose stearate ester with mol ratio of 1:1, 1:2, and 1:3 were 76.24, 38.30, and 9.98%, respectively. The fourier transform infrared spectra of glucose stearate ester peak was seen at 2800–3000 cm-1 wave number for C–H from CH3, –CH2–
SINTESIS ESTER GLUKOSA STEARAT
MELALUI REAKSI INTERESTERIFIKASI DENGAN
METODE BEBAS PELARUT
IKA SARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis Ester Glukosa Stearat melalui Reaksi Interesterifikasi dengan Metode Bebas Pelarut
Nama : Ika Sari
NIM : G44201067
Menyetujui:
Pembimbing I, Pembimbing II,
Betty Marita Soebrata, S.Si., M.Si. Prof. Dr. Ir. Tun Tedja Irawadi, MS NIP 131 694 523 NIP 130 536 664
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Ir. Yonny Koesmaryono, MS NIP 131 473 999
PRAKATA
Bismillahirrahmanirrahim…
Alhamdulillah, segala puji bagi Allah SWT karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Sintesis Ester Glukosa Stearat melalui Reaksi Interesterifikasi dengan Metode Bebas Pelarut, yang merupakan hasil penelitian yang dilaksanakan sejak bulan Juli 2005 sampai Februari 2006 di Laboratorium Kimia Organik, Departemen Kimia IPB. Penelitian ini didanai oleh Program Hibah Kompetisi A2, Departemen Kimia IPB.
Penulis mengucapkan terima kasih kepada berbagai pihak yang telah membantu terselesaikannya karya ilmiah ini, di antaranya Ibu Betty Marita Soebrata, S.Si., M.Si. dan Ibu Prof. Dr. Ir. Tun Tedja Irawadi, MS selaku pembimbing yang telah banyak memberikan masukan dan pengarahan kepada penulis. Ungkapan terima kasih juga disampaikan kepada Kak Budi Arifin, S.Si., Kak Muhammad Khotib, S.Si., Bapak Drs. Muhammad Farid, Bapak Drs. Komar Sutriah, MS, dan Ibu Henny P. Suyuti, S.Si., M.Si., atas diskusi berharga yang berkaitan dengan penelitian ini. Terima kasih kepada Ibu Prof. Dr. Suminar S. Achmadi, semua dosen dan staf di lingkungan Departemen Kimia IPB, Keluarga Besar Laboratorium Kimia Organik, Laboratorium Terpadu, dan Pusat Studi Biofarmaka atas bantuannya selama penelitian berlangsung.
Ungkapan terima kasih yang terdalam dihaturkan kepada Bapak, Ibu, dan Adikku Dian atas segala do’a, nasihat, dorongan semangat, dan kasih sayangnya kepada penulis. Ucapan terima kasih juga disampaikan kepada Keluarga Cinta (Antie, Atiek, Ayu, Ega, Etta, Santi, Tri, Tyas) dan Maya yang telah menjadi sahabat-sahabat terbaikku di saat suka maupun duka. Terima kasih kepada Tim Surfaktan (Kak Ib, Agung, Ega, Rini, dan Sekar,) untuk semua bantuan dan kebersamaan selama menjalani hari-hari “berat” penelitian. Tidak lupa ucapan terima kasih disampaikan kepada rekan-rekan Kimia 38 dan Keluarga Besar Madela (Kak Yana, Mbak Yessie, Oppie, Monceu, Qqonk, dan adik-adikku: Lusi, Mita, Viny, Rinsu, Lisa, Cici, Yanah, Kiki, Rinceu, dan Ade) atas canda tawa dan semangat yang diberikan kepada penulis.
Semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Bogor, Mei 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 2 Oktober 1983 dari ayah Narto dan ibu Sri Suwarsih. Penulis merupakan putri pertama dari dua bersaudara.
Tahun 2001, penulis lulus dari SMU Negeri 47 Jakarta dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN) sebagai mahasiswi di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Tahun 2004, penulis mengikuti kegiatan Praktik Lapangan di Pusat Penelitian dan Pengembangan Teknologi Isotop dan Radiasi-Badan Tenaga Atom Nasional (P3TIR-Batan), Pasar Jumat, dengan judul Pemantauan Pencemaran Fenol di Teluk Jakarta.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Glukosa... 1
Asam Stearat... 2
Ester Karbohidrat Asam Lemak ... 2
Zeolit... 3
BAHAN DAN METODE Bahan dan Alat ... 4
Metode ... 4
HASIL DAN PEMBAHASAN Sintesis GPA... 5
Sintesis Metil Stearat ... 6
Sintesis Ester Glukosa Stearat ... 8
SIMPULAN DAN SARAN Simpulan... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR GAMBAR
Halaman
1 Konformasi α-glukosa... 1
2 Reaksi esterifikasi sintesis GPA ... 2
3 Struktur asam stearat... 2
4 Reaksi esterifikasi ... 2
5 Reaksi interesterifikasi sintesis ester glukosa asam lemak ... 3
6 Sisi aktif dari zeolit ... 3
7 GPA hasil sintesis ... 5
8 Spektrum FTIR glukosa murni dan GPA hasil sintesis ... 6
9 Asam stearat murni (a) dan metil stearat hasil sintesis (b) ... 6
10 Reaksi esterifikasi sintesis metil stearat... 7
11 Spektrum FTIR asam stearat murni dan metil stearat hasil sintesis... 8
12 Ester glukosa stearat hasil sintesis ... 8
13 Reaksi interesterifikasi sintesis ester glukosa stearat... 9
14 Spektrum FTIR ester glukosa stearat dan GPA hasil sintesis nisbah mol 1:1 10
15 Spektrum FTIR ester glukosa stearat dan GPA hasil sintesis nisbah mol 1:2 10
16 Spektrum FTIR ester glukosa stearat dan GPA hasil sintesis nisbah mol 1:3 11
DAFTAR LAMPIRAN
Halaman 1 Diagram alir penelitian ... 142 Diagram alir sintesis GPA ... 15
3 Penentuan kadar air dan kadar asetil GPA... 16
4 Diagram alir sintesis metil stearat... 17
5 Penentuan asam lemak bebas atau free fatty acid (FFA) metil stearat ... 18
6 Diagram alir sintesis dan pemisahan ester gukosa stearat ... 19
7 Data persentase hasil dan titik leleh GPA... 20
8 (a) Data kadar air GPA, (b) Data kadar asetil GPA, (c) Perhitungan kadar asetil maksimum GPA secara teoretis... 21
9 Data persentase hasil dan titik leleh metil stearat ... 22
10 Data nilai FFA metil stearat ... 23
PENDAHULUAN
Surfaktan adalah suatu senyawa aktif permukaan yang memiliki gugus hidrofobik dan hidrofilik (Holmberg et al. 2003). Umumnya surfaktan disintesis dari turunan minyak bumi sehingga dihasilkan surfaktan yang sukar terurai secara biologis. Produksi minyak bumi yang semakin menurun dan sifatnya yang tidak dapat diperbaharui, menuntut untuk mencari bahan pengganti. Minyak nabati, salah satunya adalah minyak sawit, telah diketahui memiliki potensi sebagai bahan baku surfaktan. Keuntungan minyak nabati dibandingkan minyak bumi adalah mudah terurai secara biologis sehingga tidak mencemari lingkungan dan tidak perlu dikhawatirkan kesinambungan pengadaannya karena minyak nabati merupakan sumber daya alam yang dapat diperbaharui.
Produk turunan minyak sawit yang banyak dimanfaatkan adalah asam lemak. Asam lemak jika direaksikan dengan karbohidrat akan menghasilkan ester karbohidrat asam lemak. Ester karbohidrat asam lemak merupakan jenis surfaktan nonionik yang banyak digunakan pada industri kosmetik, farmasi, detergen, dan makanan. Ester tersebut bersifat tidak beracun, tidak berbau, tidak berasa, tidak mengiritasi kulit, dan mudah terurai secara biologis (Obaje 2005). Umumnya ester karbohidrat asam lemak disintesis menggunakan pelarut beracun, seperti dimetilasetamida, dimetilformamida, dan dimetilsulfoksida. Penelitian mengenai sintesis ester karbohidrat asam lemak dengan metode bebas pelarut pernah dilakukan sebelumnya oleh Feuge et al. (1970) melalui reaksi esterifikasi antara sukrosa dan asam lemak. Akoh dan Swanson (1990) mensintesis ester karbohidrat asam lemak melalui reaksi interesterifikasi antara sukrosa oktaasetat dan metil ester asam lemak dengan katalis logam Na. Kuang et al. (2000) memodifikasi metode sintesis yang dilakukan oleh Akoh dan Swanson, yaitu melalui reaksi interesterifikasi antara glukosa pentaasetat (GPA) dan metil ester asam lemak dari minyak inti sawit dengan katalis logam Na.
Penelitian ini mensintesis ester karbohidrat asam lemak dengan katalis zeolit sintetik tanpa penambahan suatu pelarut. Metode bebas pelarut memungkinkan produk yang dihasilkan dapat digunakan pada industri makanan. Zeolit digunakan sebagai katalis karena memiliki ukuran yang mikrostruktur sehingga dapat berperan sebagai pengganti
pelarut. Asam lemak yang digunakan pada penelitian ini adalah asam stearat (C18), sedangkan karbohidrat yang digunakan adalah glukosa. Menurut Gunstone et al. (1997), rantai C18 paling sering digunakan karena dapat menghasilkan sifat detergensi dan emulsi yang baik. Glukosa adalah karbohidrat yang umum digunakan pada sintesis ester karbohidrat asam lemak, selain sukrosa.
Penelitian ini bertujuan mensintesis ester glukosa stearat melalui reaksi interesterifikasi dengan metode bebas pelarut antara GPA dan metil stearat dengan katalis zeolit. Penelitian ini diharapkan mampu mensintesis ester glukosa stearat yang dapat digunakan sebagai bahan tambahan dalam berbagai industri.
TINJAUAN PUSTAKA
Glukosa
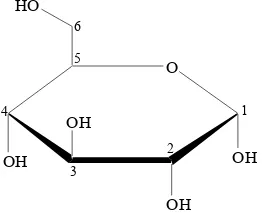
Glukosa adalah salah satu karbohidrat terpenting yang digunakan sebagai sumber tenaga bagi hewan dan tumbuhan. Proses respirasi memerlukan glukosa, sedangkan fotosintesis menghasilkan glukosa. Glukosa berwujud padatan berwarna putih dan meleleh pada suhu 146 °C (Wikipedia 2005). Struktur glukosa umumnya berbentuk kursi siklik dan hanya 0.02% berbentuk rantai lurus. Hal ini dikarenakan karbohidrat memiliki gugus fungsi alkohol dan aldehida atau keton sehingga struktur rantai lurus mudah berkonversi menjadi bentuk struktur kursi siklik atau struktur cincin hemiasetal (Ophardt 2003).
Struktur cincin hemiasetal dapat terbentuk melalui dua cara yang berbeda, yaitu yang menghasilkan glukosa-α (alfa) dan -β (beta). Secara struktural, glukosa-α dan -β berbeda pada gugus hidroksil yang terikat pada karbon pertama. Bentuk α gugus hidroksilnya berada di bawah hidrogennya (Gambar 1), sedangkan bentuk β gugus hidroksilnya berada di atas hidrogennya.
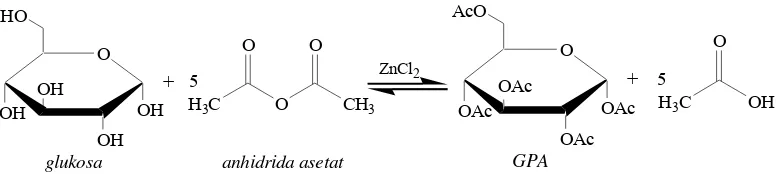
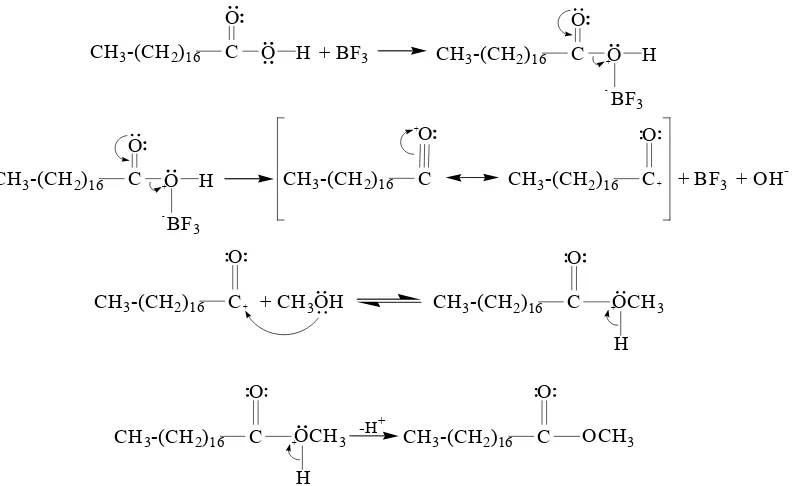
Glukosa memiliki gugus-gugus hidroksil sehingga dapat mengalami reaksi esterifikasi, yaitu asetilasi glukosa dengan menggunakan anhidrida asetat. Reaksi tersebut dapat dipercepat dengan kehadiran suatu katalis asam Lewis, misalnya ZnCl2. Reaksi esterifikasi sintesis GPA tertera pada Gambar 2. Proses asetilasi bertujuan mensubstitusi gugus hidroksil dari glukosa dengan gugus asetil dari anhidrida asetat sehingga terbentuk glukosa pentaasetat (GPA). Reaksi asetilasi adalah reaksi eksoterm sehingga suhu harus dijaga tetap rendah supaya tidak terjadi karamelisasi glukosa. GPA yang dihasilkan merupakan ester glukosa berupa padatan berwarna putih, titik leleh 112–113 °C, tidak larut dalam air, dan mudah larut dalam etanol dan kloroform.
Asam Stearat
Asam stearat (C18H36O2) atau asam oktadekanoat (Gambar 3) adalah satu dari tiga asam lemak jenuh yang tersebar luas di alam, selain asam laurat dan asam palmitat. Kandungan asam stearat pada minyak sawit kasar dan minyak inti sawit berturut-turut sebesar 3.6–4.7% dan 1–2.5% (Ketaren 1986). Asam stearat berbentuk padatan berwarna putih, titik leleh 71.2 °C, dan titik didih 360 °C. Asam stearat larut dalam dietil eter, aseton, dan kloroform.
Asam stearat merupakan asam karboksilat yang dapat diubah menjadi bentuk ester
melalui reaksi esterifikasi (Gambar 4). Suatu ester asam karboksilat adalah suatu senyawa yang mengandung gugus –COOR dengan R dapat berbentuk alkil maupun aril. Katalis yang digunakan pada reaksi tersebut dapat berupa katalis asam, misalnya BF3, H2SO4, atau HCl, maupun basa, misalnya NaOH (Scrimgeour 2005). Metil stearat merupakan ester asam stearat yang berbentuk padatan berwarna putih, titik leleh 38–39 °C, dan titik didih 214–215 °C. Metil stearat larut dalam alkohol dan eter, tetapi tidak larut dalam air.
Ester Karbohidrat Asam Lemak
Ester karbohidrat asam lemak merupakan suatu surfaktan nonionik yang memiliki kemampuan yang baik dalam mengaktifkan permukaan dan memiliki sifat yang mudah terurai secara biologis (Kasori et al. 1999). Senyawa tersebut dapat disintesis melalui reaksi esterifikasi, tetapi seringkali dibutuhkan suhu yang tinggi dan pelarut beracun, seperti dimetilasetamida, dimetilformamida, dan dimetilsulfoksida. Menurut Rizzi dan Taylor (1987), pelarut beracun digunakan untuk membentuk larutan yang homogen agar menghasilkan produk yang jumlahnya banyak. Akan tetapi, produk yang dihasilkan melalui proses tersebut memiliki keterbatasan sebagai bahan tambahan pada pembuatan makanan. Feuge et al. (1970) melakukan reaksi esterifikasi antara sukrosa dan asam lemak tanpa menggunakan pelarut dengan katalis litium, natrium, dan kalium pada suhu 170– 187 °C. Reaksi ini terbatas dengan adanya kecenderungan terjadi karamelisasi glukosa pada suhu lebih besar dari 185 °C.
H3C OH
O
Gambar 3 Struktur asam stearat.
O
glukosa anhidrida asetat GPA
Gambar 2 Reaksi esterifikasi sintesis GPA.
Gambar 4 Reaksi esterifikasi.
R OH
asam karboksilat suatu ester
Gugus asetil pada sukrosa oktaasetat (SOA) adalah gugus pergi yang baik sekaligus gugus pelindung untuk menghindari proses degradasi dan karamelisasi sukrosa selama sintesis sehingga produk hasil reaksi meningkat. Akoh dan Swanson (1990) melaporkan optimalisasi sintesis ester karbohidrat asam lemak melalui metode bebas pelarut dengan mencampurkan SOA, metil ester asam lemak, dan 1–2% katalis logam Na pada suhu 105 °C selama 2 jam dengan tekanan 0–5 mmHg. Persentase hasil yang diperoleh adalah 99.6–99.8%.
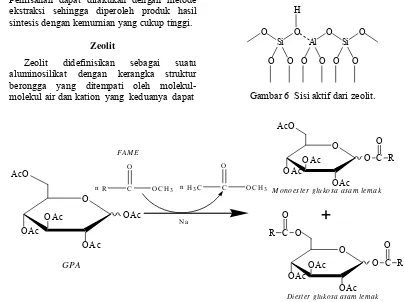
Kuang et al. (2000) mensintesis ester karbohidrat asam lemak melalui reaksi interesterifikasi antara GPA dan metil ester asam lemak dari minyak inti sawit dengan katalis logam Na pada suhu 80–100 °C selama 4–6 jam (Gambar 5). Produk utama yang dihasilkan adalah mono- dan di-ester glukosa asam lemak, masing-masing sebesar 60.5 dan 20.2%. Berdasarkan nilai hydrophyl-lipophyl balance (HLB), produk tersebut memiliki ciri sebagai surfaktan.
Menurut Obaje (2005), reaksi pembentukan ester karbohidrat asam lemak dapat menghasilkan metil ester asam lemak dan GPA yang tidak bereaksi sehingga perlu dilakukan pemisahan produk hasil sintesis. Pemisahan dapat dilakukan dengan metode ekstraksi sehingga diperoleh produk hasil sintesis dengan kemurnian yang cukup tinggi.
Zeolit
Zeolit didefinisikan sebagai suatu aluminosilikat dengan kerangka struktur berongga yang ditempati oleh molekul-molekul air dan kation yang keduanya dapat
bergerak bebas sehingga memungkinkan terjadinya pertukaran ion tanpa merusak struktur zeolit (Ming dan Mumpton 1989).
Berdasarkan sumbernya, zeolit dibedakan atas dua macam, yaitu zeolit alam dan sintetik. Zeolit alam berasal dari pelapukan alami dari abu vulkanik, proses perkolasi air permukaan melalui sedimentasi yang tepat, dan perkolasi air hujan melalui batuan basal, sedangkan zeolit sintetik dibuat di laboratorium (Othmer 1995).
Zeolit banyak digunakan sebagai katalis karena memiliki ukuran mikrostruktrur (diameter <1.2 nm) sehingga mudah masuk ke permukaan internal yang luas dan rongga pada strukturnya dapat mempertinggi aktivitas katalitik dan kemampuan adsorpsinya. Proses katalitik terjadi di ruang kosong dalam kristal zeolit (Othmer 1995).
Jembatan gugus OH yang menghubungkan atom Si dan Al dalam kerangka struktur zeolit bertanggung jawab untuk keasaman Bronsted dan aktivitas katalitik, sedangkan ligan okso dari aluminium berperan sebagai basa Lewis. Interaksi antara atom oksigen dari gugus hidroksil dan aluminium akan memperlemah ikatan hidrogen-oksigen tetapi meningkatkan keasaman dan kebasaan ligan okso dari aluminium (Gambar 6).
Gambar 6 Sisi aktif dari zeolit.
Gambar 5 Reaksi interesterifikasi sintesis ester glukosa asam lemak. O CH3
M onoester glukosa asam lem ak
Diester glukosa asam lem ak
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah asam stearat, glukosa, heksana, etanol, metanol, anhidrida asetat, BF3 16%, NaOH, NaCl jenuh, ZnCl2 anhidrat, NaHCO3, Na2SO4 anhidrat, katalis zeolit sintetik, Na2CO3, asam oksalat, kertas saring, indikator pH universal, fenolftalein, jingga metil, dan air suling. Alat-alat yang digunakan adalah labu bulat, kondensor, penangas, Erlenmeyer, termometer, hot plate, pengaduk magnet, batu didih, pompa vakum, neraca analitik, buret, gelas piala, gelas ukur, corong, pipet tetes, pipet volumetrik, dan spektrofotometer fourier transform infrared (FTIR) Bruker jenis Tentor 37.
Metode
Penelitian ini dilakukan melalui 4 tahapan; (1) Sintesis glukosa pentaasetat (GPA)
melalui reaksi antara glukosa dan anhidrida asetat.
(2) Sintesis metil stearat melalui reaksi antara asam stearat dan metanol.
(3) Sintesis ester glukosa stearat melalui reaksi antara GPA dan metil stearat (nisbah mol 1:1, 1:2, dan 1:3) dengan katalis zeolit.
(4) Pemisahan hasil sintesis ester glukosa stearat dari metil stearat dan GPA yang tidak bereaksi.
Diagram alir penelitian tertera pada Lampiran 1.
Sintesis GPA (Furniss et al. 1978)
Sebanyak 2 g ZnCl2 anhidrat dan 50 mL anhidrida asetat dimasukkan ke dalam labu bulat berleher dua yang dilengkapi dengan termometer, pendingin, dan pengaduk magnet, kemudian dipanaskan dalam penangas air pada suhu 80–100 °C selama 5–10 menit sambil diaduk. Larutan tersebut ditambahkan 10 g glukosa secara perlahan-lahan, diaduk secara kuat selama penambahan glukosa, kemudian dipanaskan kembali selama 1 jam. Setelah itu, campuran reaksi tersebut dipindahkan ke dalam air es sambil diaduk, lalu didinginkan sampai terbentuk endapan putih yang tidak larut. Endapan disaring dan dicuci dengan air es sampai pH netral (bau asam menghilang), lalu direkristalisasi dengan metanol sehingga diperoleh padatan GPA yang berwarna putih (Lampiran 2). Selanjutnya hasil sintesis ditentukan nilai
persentase hasil, titik leleh, kadar air dan kadar asetil (Lampiran 3), serta ciri spektrumnya melalui FTIR.
Sintesis Metil Stearat (AOAC 1999)
Sebanyak 10 g asam stearat dan 35 mL larutan NaOH dalam metanol 1 N dimasukkan ke dalam labu bulat berleher dua yang dilengkapi dengan termometer, pendingin, dan pengaduk magnet, kemudian dipanaskan dalam penangas air pada suhu 80–100 °C selama 20 menit sambil diaduk. Setelah itu ditambahkan larutan BF3 16% sebanyak 2 kali volume NaOH dalam metanol dan dipanaskan kembali selama 20 menit. Pemisahan campuran reaksi dilakukan dengan penambahan NaCl jenuh dan heksana. Lapisan heksana dipisahkan dari campuran reaksi dan dihilangkan kandungan airnya dengan Na2SO4 anhidrat. Lapisan tersebut diuapkan sehingga diperoleh padatan metil stearat yang berwarna putih (Lampiran 4). Selanjutnya hasil sintesis ditentukan nilai persentase hasil, titik leleh, asam lemak bebas atau free fatty acid (FFA) (Lampiran 5), dan ciri spektrumnya melalui FTIR.
Sintesis Ester Glukosa Stearat (Modifikasi Kuang et al. 2000)
Sintesis dilakukan dengan variasi nisbah mol antara GPA dan metil stearat, yaitu 1:1, 1:2, dan 1:3. Sintesis ini dimulai dari GPA, metil stearat, dan katalis zeolit sebanyak 10% dari bobot total reaktan, dimasukkan ke dalam labu bulat berleher dua yang dilengkapi dengan termometer, pendingin, dan pengaduk magnet, kemudian dipanaskan dalam penangas air pada suhu 80–100 °C selama 6 jam sambil diaduk (Lampiran 6).
P e m i s a h a n E s t e r G l u k o s a S t e a r a t (Modifikasi Obaje 2005)
etanol hangat lalu didinginkan pada suhu -4–0 °C (di dalam lemari pembeku). Larutan etanol tersebut disaring, endapan yang diperoleh dari endapan B dan A, masing-masing adalah GPA yang tidak bereaksi dan katalis zeolit. Pelarut etanol pada filtrat dihilangkan dengan cara diuapkan sehingga diperoleh padatan ester glukosa stearat (Lampiran 6). Selanjutnya ester glukosa stearat ditentukan nilai persentase hasil, titik leleh, dan ciri spektrumnya melalui FTIR.
HASIL DAN PEMBAHASAN
Sintesis GPA
Berdasarkan hasil percobaan, GPA dapat disintesis melalui reaksi esterifikasi antara glukosa dan anhidrida asetat dengan katalis ZnCl2 pada suhu 60–70 °C selama 80 menit. GPA yang diperoleh berupa padatan berwarna putih (Gambar 7) dan memiliki kisaran titik leleh 109–112 °C.
Sintesis GPA diawali dengan memanaskan ZnCl2 dan anhidrida asetat selama 20 menit. Dalam hal ini, ZnCl2 berfungsi sebagai katalis yang dapat mempercepat reaksi esterifikasi. ZnCl2 bersifat akseptor elektron, yang akan mengaktifkan gugus asetil dari anhidrida asetat sehingga dapat diserang oleh nukleofilik, yaitu gugus hidroksil dari glukosa. Reaksi esterifikasi bersifat dapat balik dengan kehadiran molekul air sehingga digunakan anhidrida asetat supaya reaksi tidak menghasilkan produk samping berupa air. Setelah 20 menit, campuran reaksi ditambahkan glukosa secara perlahan-lahan dan dipanaskan kembali selama 1 jam. Reaksi esterifikasi yang terjadi berupa penggantian gugus hidroksil dari glukosa dengan gugus asetil dari anhidrida asetat sehingga terbentuk GPA. Reaksi ini dapat juga disebut asetilasi.
Awalnya, sintesis GPA dilakukan pada suhu 80–100 °C. Tetapi, saat ditambahkan glukosa, larutan berubah warna menjadi coklat pekat. Hal ini dikarenakan glukosa
telah membentuk karamel pada suhu tinggi akibat degradasi glukosa dan ada kemungkinan anhidrida asetat yang digunakan telah terkontaminasi oleh uap air. Padatan GPA yang dihasilkan pun tidak berwarna putih jernih, melainkan berwarna putih kekuningan dan memiliki kisaran titik leleh 98–104 °C. Menurut Furniss et al. (1978), kisaran titik leleh GPA adalah 112–113 °C. Berdasarkan hal tersebut, maka sintesis GPA selanjutnya dilakukan pada suhu yang lebih rendah, yaitu 60–70 °C.
Reaksi sintesis GPA menghasilkan produk samping berupa asam asetat. Oleh karena itu, GPA harus dicuci dengan air dingin sampai netral. Pencucian dengan es menghasilkan GPA lebih banyak dibandingkan tanpa es. Persentase hasil yang diperoleh pada sintesis GPA adalah rerata hasil dari 3 kali sintesis, yaitu sebesar 45.52% (Lampiran 7). Rendahnya nilai persentase hasil diduga karena air es yang digunakan untuk mencuci GPA kurang banyak dan kurang dingin sehingga hanya sedikit GPA yang terbentuk.
GPA yang digunakan pada penelitian ini ditentukan kadar airnya. Pengeringan dilakukan pada suhu 60 °C supaya tidak terjadi kerusakan struktur kimia dari GPA, yaitu meleleh. Penentuan kadar air dilakukan untuk menentukan kadar asetil GPA. Kadar air GPA sebesar 0.26% (Lampiran 8a).Hal ini berarti GPA yang dihasilkan mengandung sedikit uap air dan tidak bersifat higroskopis sehingga tidak perlu dikhawatirkan tentang masa simpannya. Nilai kadar air yang sangat kecil diduga karena penyaringan vakum yang lama dan dilakukannya rekristalisasi dengan metanol pada tahap akhir pencucian.
Kadar asetil GPA diperoleh sebesar 84.81% (Lampiran 8b). Nilai tersebut melebihi kadar asetil maksimum GPA secara teoretis, yaitu sebesar 55.17% (Lampiran 8c). Kadar asetil GPA maksimum menggambarkan jumlah atau persentase gugus asetil (dari unit anhidrida asetat) maksimum yang dapat tersubstitusi ke dalam molekul glukosa. Kadar asetil yang sangat jauh berbeda diduga karena GPA masih bersifat asam akibat adanya asam asetat yang masih terperangkap di dalam GPA dan belum ternetralisasi oleh air. Hal tersebut didukung oleh kisaran titik leleh yang cukup lebar (109–112 °C), yang diduga GPA hasil sintesis kurang murni dengan adanya pengotor atau senyawa lain di dalam GPA. Jika dibandingkan dengan titik leleh glukosa (146 °C), titik leleh GPA hasil sintesis jauh berbeda. Hal ini membuktikan bahwa sudah tidak terdapat glukosa pada GPA.
Bilangan gelombang (cm-1)
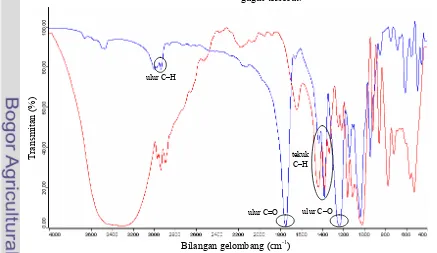
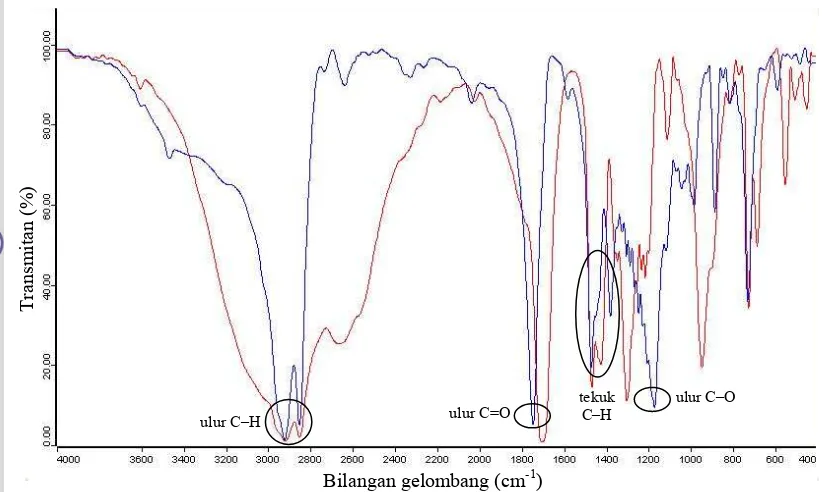
Spektrum FTIR glukosa murni dan GPA hasil sintesis tertera pada Gambar 8. Hasil analisis FTIR memperlihatkan bahwa gugus hidroksil dari glukosa telah tersubstitusi oleh gugus asetil dari anhidrida asetat melalui reaksi asetilasi. Hal ini didasarkan pada lemahnya serapan pita lebar pada bilangan gelombang 3200–3600 cm-1 yang menunjuk- kan vibrasi ulur O–H dari glukosa pada spektrum FTIR GPA hasil sintesis. Perbedaan kedua spektrum FTIR ini terletak juga pada bilangan gelombang 2800–3000 cm-1 dan 1370–1450 cm-1 yang menunjukkan berturut-turut vibrasi ulur C–H dari –CH3, –CH2– rantai alkil dan vibrasi tekuk C–H dari CH3C=O (Silverstein et al. 1981). Selain itu, pita serapan yang sangat tajam pada 1735– 1750 cm-1 dan 1200–1270 cm-1 menunjukkan adanya serapan dari vibrasi ulur C=O dan C– O ester akibat substitusi gugus hidroksil dari glukosa oleh gugus asetil dari anhidrida asetat. Pita serapan tersebut tidak terdapat pada spektrum FTIR glukosa murni. Berdasarkan hasil analisis FTIR diduga bahwa produk yang dihasilkan adalah senyawa GPA.
Sintesis Metil Stearat
Berdasarkan hasil percobaan, metil stearat dapat disintesis melalui reaksi esterifikasi antara asam stearat dan metanol pada suhu 80–100 °C selama 40 menit. Metil stearat yang diperoleh berupa padatan berwarna putih (Gambar 9) dan memiliki kisaran titik leleh 39–41 °C.
Reaksi esterifikasi berlangsung melalui serangkaian tahap protonasi dan deprotonasi. Tahap pertama, metanolisis pada suasana basa, diawali dengan memanaskan asam stearat dan NaOH dalam metanol selama 20 menit. Gugus metil pada metanol diaktifkan terlebih dahulu dengan NaOH sehingga membentuk ion metoksida. Ion metoksida tersebut bersifat nukleofilik sehingga dapat menyerang gugus karbonil ester dari asam stearat dan menghasilkan metil stearat. Tahap kedua, metanolisis pada suasana asam, terjadi ketika asam stearat yang belum bereaksi pada tahap pertama direaksikan dengan larutan BF3 dalam metanol dan dipanaskan kembali selama 20 menit. Metanolisis tahap kedua dimaksudkan untuk menyempurnakan reaksi sehingga akan meningkatkan jumlah metil stearat yang terbentuk. Gugus karbonil dari asam stearat bukan elektrofil yang cukup kuat untuk bereaksi dengan metanol sehingga perlu dilakukan protonasi untuk mengaktifkan gugus tersebut.
a b
O
Gambar 10 Reaksi esterifikasi sintesis metil stearat.
Reaksi sintesis metil stearat tercantum pada Gambar 10. Protonasi dilakukan dengan penambahan suatu asam yang dapat mengubahnya menjadi elektrofil yang kuat. Reaksi yang terjadi adalah protonisasi dengan BF3 sebagai asam Lewis. Atom boron pada BF3 berikatan dengan salah satu elektron bebas pada C–O. Sepasang elektron pada gugus karbonil mengalami delokalisasi sehingga atom karbon bersifat lebih positif. Hal tersebut mengakibatkan serangan nukleofilik terhadap atom karbon semakin mudah. Karbon yang bermuatan positif diserang oleh salah satu elektron bebas oksigen pada metanol. Langkah selanjutnya adalah deprotonisasi atau penghilangan ion H+ sehingga terbentuk metil stearat. Reaksi tersebut bersifat dapat balik sehingga dalam sintesis digunakan metanol berlebih agar reaksi kesetimbangan bergeser ke arah pembentukan produk ester.
Campuran reaksi tersebut kemudian ditambahkan NaCl jenuh dan heksana. NaCl jenuh yang ditambahkan akan membentuk suatu ‘awan putih’ sehingga pemisahan antara fase heksana dan air lebih mudah dilakukan. Pelarut heksana ditambahkan untuk memisahkan metil stearat dari molekul air sebagai produk samping. Metil stearat memiliki rantai hidrokarbon yang panjang sehingga cenderung bersifat nonpolar. Hal tersebut menyebabkan metil stearat dapat larut dalam pelarut heksana yang bersifat nonpolar juga. Reaksi sintesis metil stearat menghasil-
kan molekul air sebagai produk samping. Hal ini tentu saja dapat mengganggu reaksi esterifikasi karena dapat terjadi hidrolisis. Oleh sebab itu, pada lapisan heksana ditambahkan Na2SO4 anhidrat untuk menarik air yang mungkin terambil saat pemisahan.
Persentase hasil yang diperoleh pada sintesis metil stearat adalah rerata hasil dari 4 kali sintesis, yaitu sebesar 84.60% (Lampiran 9). Jika dibandingkan dengan pustaka (38–39 °C), metil stearat yang dihasilkan memiliki kisaran titik leleh yang cukup lebar (39–41 °C). Hal tersebut diduga karena metil stearat yang dihasilkan kurang murni, yang dapat disebabkan masih adanya asam stearat yang tidak diubah menjadi bentuk metil stearat. Oleh karena itu, perlu dilakukan penentuan jumlah asam lemak bebas (FFA) untuk mengetahui banyaknya asam stearat yang tidak berubah menjadi metil stearat. Nilai FFA yang diperoleh adalah 1.36% (Lampiran 10). Nilai ini cukup kecil sehingga dapat diartikan hanya 1.36% asam stearat yang tidak bereaksi yang terdapat dalam 2.5 g metil stearat.
Bilangan gelombang (cm-1)
Gambar 11 Spektrum FTIR asam stearat murni (–) dan metil stearat hasil sintesis (–).
Tran
smitan (%
)
bahwa metil ester asam lemak rantai panjang memiliki tiga pita serapan dan serapan yang kuat ditunjukkan pada bilangan gelombang sekitar 1175 cm-1. Hasil analisis FTIR juga memperlihatkan bahwa gugus hidroksil dari asam stearat telah tersubstitusi oleh gugus metil dari metanol melalui reaksi esterifikasi. Hal ini didasarkan tidak adanya serapan pita lebar pada spektrum FTIR metil stearat hasil sintesis pada bilangan gelombang 3000–3400 cm-1 yang disebabkan oleh gugus hidroksil dari asam stearat. Pita serapan ini lebih sempit dibandingkan dengan gugus hidroksil pada spektrum FTIR asam stearat murni. Hal ini turut didukung oleh bergesernya bilangan gelombang C=O metil stearat menjadi lebih besar dibandingkan C=O asam stearat. Berdasarkan hasil analisis FTIR diduga bahwa produk yang dihasilkan adalah senyawa metil stearat.
Sintesis Ester Glukosa Stearat
Berdasarkan hasil percobaan, ester glukosa stearat dapat disintesis melalui reaksi interesterifikasi antara GPA dan metil stearat dengan katalis zeolit pada suhu 80–100 °C selama 6 jam. Ester glukosa stearat yang diperoleh berupa padatan berwarna putih dan memiliki kisaran titik leleh 96–112 °C. Gambar 12 menunjukkan ester glukosa stearat hasil sintesis dengan nisbah GPA dan metil stearat 1:3, 1:2, dan 1:1.
Reaksi interesterifikasi diawali dengan memanaskan GPA, metil stearat, dan zeolit pada suhu 80–100 °C selama 6 jam. Metode yang diterapkan adalah metode bebas pelarut agar produk yang dihasilkan dapat dimanfaatkan pada berbagai industri, baik makanan maupun kosmetik. Zeolit tidak hanya berperan sebagai katalis yang dapat mempercepat reaksi interesterifikasi, tetapi juga dapat meratakan panas sehingga reaktan (GPA dan metil stearat) akan mudah larut dan homogen. Katalis zeolit berfungsi sebagai mediator bagi kedua reaktan yang berbeda kepolaran sehingga dapat bercampur. Menurut Othmer (1995), proses katalitik pada zeolit terjadi di ruang kosong di dalam kristal. Katalis zeolit yang ditambahkan sebesar 10% dari bobot total reaktan. Menurut Parker et al. (1976), penambahan konsentrasi katalis yang berlebihan tidak akan menguntungkan, dan konsentrasi katalis di atas 20% tidak diperkenankan digunakan.
1:3 1:2 1:1
OCH3
GPA Metil stearat Ester glukosa stearat
+ +
Gambar 13 Reaksi interesterifikasi sintesis ester glukosa stearat. Mekanisme terjadinya percepatan reaksi
interesterifikasi antara GPA dan metil stearat dengan katalis zeolit, yaitu katalis dapat menurunkan energi aktivasi. Energi aktivasi merupakan energi yang dibutuhkan untuk mereaksikan substrat dalam transformasi kimia untuk membentuk produk. Semakin menurun energi aktivasi, semakin meningkat tumbukan-tumbukan reaktan sehingga dapat mempercepat reaksi. Reaksi interesterifikasi yang terjadi berupa pertukaran gugus asetil dari GPA dengan gugus asil dari metil stearat (Gambar 13).
Tabel 1 Data persentase hasil ester glukosa stearat
Tabel 1 menampilkan persentase hasil yang diperoleh tiap nisbah mol GPA dan metil stearat 1:1, 1:2, dan 1:3 secara berturut-turut 76.24, 38.30, dan 9.98%. Perhitungan tersebut adalah rerata hasil dari 2 kali sintesis. Persentase hasil ester glukosa stearat tiap ulangan (Lampiran 11) agak jauh berbeda. Hal tersebut diduga akibat baik atau tidaknya reaktan membentuk larutan homogen dan pemisahan reaktan yang tidak bereaksi. Selama sintesis, suhu harus selalu diperhatikan. Jika suhu reaksi di bawah 80– 100 ºC, reaktan tidak akan bercampur menjadi larutan yang homogen. Hal ini mengakibatkan hanya sedikit reaktan yang bereaksi sehingga produk yang dihasilkan tidak maksimal.
Tabel 1 menunjukkan bahwa semakin besar mol metil stearat, semakin kecil persentase hasil yang diperoleh. Asumsi tersebut diperkuat dengan banyaknya jumlah metil stearat tidak bereaksi yang diperoleh jika mol metil stearat diperbesar (Lampiran 11). Hal tersebut diduga karena adanya kompetisi gugus alkil rantai panjang dari metil
stearat untuk menggantikan gugus asetil dari GPA. Metil stearat merupakan turunan asam lemak jenuh yang menyebabkan gugus alkil dari metil stearat memiliki bentuk kaku dan panjang sehingga sulit untuk melakukan substitusi dengan gugus asetil dari GPA. Prihanjani (2006) mensintesis ester glukosa miristat dengan metode yang sama. Persentase hasil terbesar diperoleh pada nisbah mol reaktan 1:1, yaitu 87.27%. Hal ini mendukung asumsi bahwa semakin besar mol suatu metil ester asam lemak jenuh, semakin kecil peluangnya untuk menggantikan gugus asetil. Lain halnya jika metil ester asam lemak yang digunakan adalah turunan dari asam lemak tak jenuh. Nugraha (2006) mensintesis ester glukosa oleat dengan metode yang sama. Persentase hasil terbesar diperoleh pada nisbah mol reaktan 1:3, yaitu 70.64%. Hal ini diduga karena struktur rantai alkil dari metil oleat memiliki ikatan ganda cis pada karbon ke-9 yang mengakibatkan gugus alkil dari metil oleat lebih mudah menyerang gugus asetil dari GPA.
Tran
smitan (%
)
ulur C–H
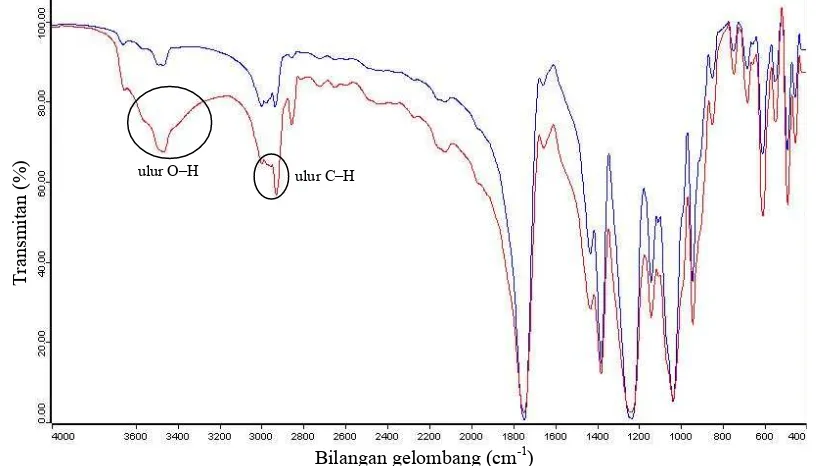
Gambar 14 Spektrum FTIR ester glukosa stearat (–) dan GPA hasil sintesis (–) nisbah mol 1:1. Bilangan gelombang (cm-1)
ulur O–H
ulur C–H
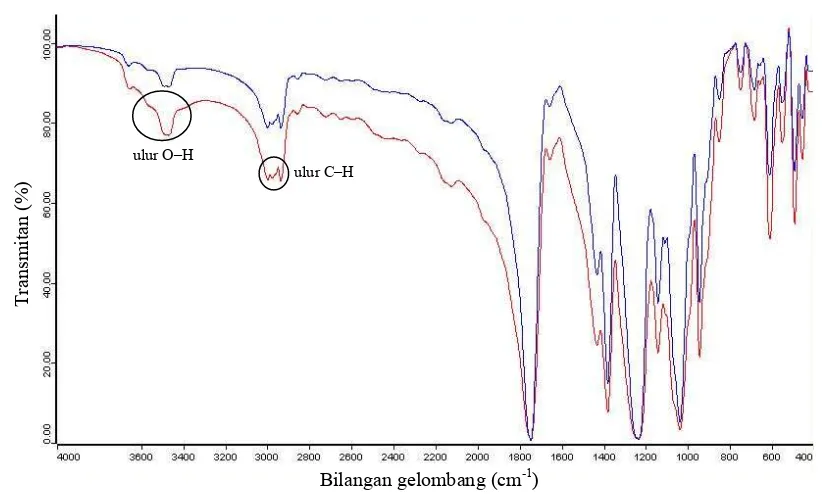
Gambar 15 Spektrum FTIR ester glukosa stearat (–) dan GPA hasil sintesis (–) nisbah mol 1:2. Bilangan gelombang (cm-1)
Tran
smitan (%
)
ulur O–H
Spektrum FTIR ester glukosa stearat dan GPA hasil sintesis tiap perbandingan tertera pada Gambar 14, 15, dan 16. Senyawa ester glukosa stearat dihasilkan melalui tersubstitusinya gugus asetil dari GPA dengan gugus asil (CH3-(CH2)16C=O) dari metil stearat. Hal tersebut menyebabkan spektrum FTIR ester glukosa stearat dan GPA hasil sintesis berbeda hanya pada serapan pada bilangan gelombang 2800–3000 cm-1 yang menunjukkan vibrasi ulur C–H dari CH3,
ulur C–H
Gambar 16 Spektrum FTIR ester glukosa stearat (–) dan GPA hasil sintesis (–) nisbah mol 1:3. ulur O–H
Tran
smitan (%
)
Bilangan gelombang (cm-1)
alkil. Intensitas yang tinggi memperlihatkan panjang rantai alkil metil ester asam lemak. Adanya pita serapan lebar pada bilangan gelombang 3200–3600 cm-1 menunjukkan vibrasi ulur O–H. Hal tersebut dapat disebabkan terhidrolisisnya ester gluksa stearat sehingga gugus asil yang telah tersubstitusi ataupun gugus asetil yang tidak tersubstitusi akhirnya lepas. Berdasarkan hasil analisis FTIR diduga bahwa produk yang dihasilkan adalah senyawa ester glukosa stearat.
SIMPULAN DAN SARAN
Simpulan
Persentase hasil GPA dan metil stearat yang diperoleh masing-masing sebesar 45.52 dan 84.60%. Ester glukosa stearat dapat disintesis melalui reaksi interesterifikasi dengan metode bebas pelarut antara GPA dan metil stearat dengan katalis zeolit sintetik pada suhu 80–100 °C selama 6 jam. Persentase hasil ester glukosa stearat yang diperoleh tiap nisbah mol GPA dan metil stearat 1:1, 1:2, dan 1:3 secara berturut-turut 76.24, 38.30, dan 9.98%. Spektrum FTIR ester glukosa stearat menghasilkan ciri pita serapan pada bilangan gelombang 2800–3000 cm-1 yang menunjukkan vibrasi ulur C–H dari CH3, –CH2– rantai alifatik jenuh. Berdasarkan hasil analisis FTIR diduga bahwa produk yang
dihasilkan adalah senyawa ester glukosa stearat.
Saran
Penelitian lebih lanjut mengenai optimalisasi metode sintesis dan pemisahan ester glukosa stearat perlu dilakukan untuk mendapatkan persentase hasil yang lebih besar. Selain itu, perlu dilakukan pencirian surfaktan terhadap produk ester glukosa stearat untuk mengetahui sifat aktif permukaannya.
DAFTAR PUSTAKA
[AOAC]. Cunnif P, editor. 1999. Official Methods of Analysis of AOAC International. Ed ke-5. Volume ke-2. Maryland: AOAC International.
[ASTM]. 1991. ASTM D871: Standard Test Methods of Testing Cellulose Acetate. Philadelphia: American Society for Testing and Materials.
Akoh CC, Swanson BG. 1990. Carbohydrate Fatty Acid Esters. New York: Marcell Dekker.
Furniss BS, Hannaford AJ, Rogers V, Smith PWG, Tatchell AR. 1978. Vogel’s Textbook of Practical Organic Chemistry. Ed ke-4. Essex: Longman.
Gunstone FD, Padley FB. 1997. Lipid Technologies and Applications. New York: Marcell Dekker.
Holmberg K, Jonsson B, Kronberg B, Lindman B. 2003. Surfactants and Polymers in Aqueous Solution. West Sussex: J Wiley & Sons.
Kasori Y, Kashiwa K, penemu; Mitsubishi Chemical Coorporation. 1 Jun 1999. Method for producing a sucrose fatty acid ester. US patent 5 908 922.
Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Pr.
Kuang D, Obaje OJ, Ali AM. 2000. Synthesis and characterization of acetylated glucose fatty esters from palm and palm kernel oil fatty methyl esters. J Oil Palm Res 12(2): 14–19.
Ming W, Mumpton FA. 1989. Zeolites in soils. Di dalam: Dixon JB, Weed SB, editor. Mineral in Soil Environments. Wisconsin: Soil Science Society of America. hlm 873–911.
Nugraha A. 2006. Sintesis Ester Glukosa Oleat dari Glukosa Pentaasetat dan Metil Oleat [skripsi]. Bogor: Fakultas Matematika dan Ilmu pengetahuan Alam, Institut pertanian Bogor.
Obaje OJ, penemu; URAH Resources Ltd. 25 Jan 2005. Trans-acidolysis process for the preparation of carbohydrate fatty-acid esters. US patent 6 846 916.
Ophardt CE. 2003. Virtual chembook. [terhubung berkala]. http://www. elmhurst.edu [24 Mar 2005].
Othmer K. 1995. Encyclopedia of Chemical Technology. Ed ke-4. New York: J Wiley & Sons.
Parker KJ, RA Khan, KS Mufti, penemu. 1976. Process of making sucroses esters. US patent 3 996 206.
Prihanjani M. 2006. Sintesis Ester Glukosa Miristat melalui Interesterifikasi antara Metil Miristat dan Glukosa Pentaasetat [skripsi]. Bogor: Fakultas Matematika dan Ilmu pengetahuan Alam, Institut pertanian Bogor.
Rizzi GP, Taylor HM. 1987. A solvent-free synthesis of sucrose polyesters. Am J Oil Chem Soc 55:398.
Scrimgeour C. 2005. Chemistry of Fatty Acid. Dundee: Scottish Crop Research Institute.
Silverstein RM, Bassler GC, Morrill TC. 1981. Spectrometric Identification of Organic Compounds. Singapore: J Wiley & Sons.
Lampiran 1 Diagram alir penelitian
Sintesis GPA Sintesis metil stearat
Sintesis ester glukosa stearat
Pemisahan ester glukosa stearat
Penentuan persentase hasil,
titik leleh, dan nilai FFA Penentuan
persentase hasil, titik leleh, kadar air,
dan kadar asetil
Analisis FTIR Analisis FTIR
Analisis FTIR Penentuan persentase hasil
+ 10 g glukosa secara perlahan-lahan sambil diaduk
Lampiran 2 Diagram alir sintesis GPA (Furniss et al. 1978)
2 g ZnCl2 anhidrat
50 mL anhidrida asetat
Endapan dicuci kembali dengan air es sampai bau dari asam hilang Dipanaskan dalam penangas
air selama 5–10 menit Dimasukkan dalam labu bulat
Endapan dikeringkan dan direkristalisasi dengan metanol
Dipindahkan ke air es sambil diaduk, lalu didinginkan Dipanaskan kembali selama 1 jam
Disaring
Lampiran 3 Penentuan kadar air dan kadar asetil GPA
Penentuan kadar air dilakukan dengan modifikasi prosedur AOAC (1999). Erlenmeyer kosong dikeringkan selama 1 jam pada suhu ±60 °C dalam oven, lalu didinginkan di dalam desikator, setelah itu ditimbang bobotnya dengan teliti (W1). Sebanyak ±0.5 gram
GPA ditimbang teliti (W2) di dalam Erlenmeyer tersebut, lalu dikeringkan pada suhu yang
sama selama 3 jam. Bobot (GPA+Erlenmeyer) ditetapkan setiap interval 24 jam, setelah didinginkan di dalam desikator. Setelah dicapai bobot konstan (W3), kadar air dapat
dihitung dengan persamaan berikut:
100%
Penentuan kadar asetil dilakukan dengan modifikasi prosedur ASTM (1991). Sebanyak 20 mL etanol 75% (v/v) dimasukkan ke dalam Erlenmeyer, lalu dipanaskan di penangas air bersuhu (55±3) °C selama 30 menit. Erlenmeyer dikeluarkan dari penangas, kemudian dimasukkan 40 mL NaOH 0.5 N ke dalamnya. Erlenmeyer dipanaskan kembali selama 15 menit pada suhu yang sama. Selanjutnya Erlenmeyer ditutup rapat dengan lembaran aluminium dan dibiarkan selama 72 jam pada suhu ruang.
Setelah itu, sisa NaOH dititrasi dengan HCl 0.5 N menggunakan indikator fenolftalein (pp) sampai lenyapnya warna merah muda. Sebanyak 1 mL titran dilebihkan dari titik akhir itu, lalu Erlenmeyer ditutup rapat kembali dan dibiarkan selama 24 jam pada suhu ruang. Kemudian sisa HCl dititrasi dengan NaOH 0.5 N sampai muncul warna merah muda permanen pertama kali. Titrasi dilakukan dengan hati-hati karena titrat tidak tanwarna setelah penetapan kadar air. Penetapan blangko dilakukan bersamaan dengan contoh, tetapi tanpa menggunakan GPA. Kadar asetil GPA dapat dihitung dari persamaan sebagai berikut:
dengan A = volume NaOH untuk titrasi contoh (mL), B = volume NaOH untuk titrasi blangko (mL), Nb = konsentrasi NaOH (N); C = volume HCl untuk titrasi
contoh (mL), D = volume HCl untuk titrasi blangko (mL), Na = konsentrasi
HCl (N); dan M = kadar air GPA (%), W = bobot GPA (g).
Standardisasi NaOH 0.5 N. Sebanyak 3.1518 g asam oksalat dihidrat [(COOH)2 ·
2H2O] (bobot molekul 126.07 g/mol) dilarutkan dalam labu ukur 100 mL dengan air
suling, kemudian isinya ditepatkan sampai tanda tera, dan dihomogenkan. Sebanyak 10 mL larutan tersebut dimasukkan ke dalam labu Erlenmeyer 100 mL. Setelah itu, dilakukan titrasi dengan NaOH 0.5 N menggunakan indikator pp sampai terbentuk warna merah muda permanen pertama kali. Normalitas NaOH ialah 5/(VNaOH), dan diambil
rerata dari 3 ulangan.
Standardisasi HCl 0.5 N. Sebanyak 2.6498 g natrium karbonat (Na2CO3) (bobot
molekul 105.99 g/mol) dilarutkan dalam labu ukur 100 mL dengan air suling, kemudian isinya ditepatkan sampai tanda tera, dan dihomogenkan. Sebanyak 10 mL larutan tersebut dimasukkan ke dalam labu Erlenmeyer 100 mL. Setelah itu, dilakukan titrasi dengan HCl 0.5 N menggunakan indikator jingga metil (jm) sampai warna tepat berubah dari jingga menjadi merah permanen. Normalitas HCl ialah 5/(VHCl), dan diambil rerata dari 3
+ 35 mL NaOH dalam metanol 1 N
+ 70 mL BF3 16%
+ NaCl jenuh + Heksana
+ Na2SO4 anhidrat
Lampiran 4 Diagram alir sintesis metil stearat (AOAC 1999)
10 g asam stearat
Dipanaskan dalam penangas air selama 20 menit
Dipanaskan kembali dalam penangas air selama 20 menit
Dikocok
Diuapkan
Lapisan heksana dipisahkan
Metil stearat
Lampiran 5 Penentuan asam lemak bebas atau free fatty Acid (FFA) metil stearat
Sebanyak 2.5 gram metil stearat dimasukkan ke dalam Erlenmeyer, kemudian ditambahkan 25 mL etanol netral. Setelah dicampur, lalu dikocok dan dididihkan. Selagi panas dititar dengan NaOH 0.1N sampai timbul warna kemerahan yang tetap selama 10 menit.
Etanol dinetralkan dengan cara dididihkan selama 5 menit, lalu ditambahkan beberapa tetes indikator pp, kemudian dalam keadaan panas dititar dengan larutan NaOH 0.1 N sampai berwarna kemerahan.
FFA metil stearat dapat dihitung melalui persamaan berikut:
100% (mg)
stearat metil Bobot
stearat asam BM N
(mL) V
%FFA = NaOH × NaOH× ×
Standardisasi NaOH 0.1 N. Sebanyak 0.6304 g asam oksalat dihidrat [(COOH)2 ·
2H2O] (bobot molekul 126.07 g/mol) dilarutkan dalam labu ukur 100 mL dengan air
suling, kemudian isinya ditepatkan sampai tanda tera, dan dihomogenkan. Sebanyak 10 mL larutan tersebut dimasukkan ke dalam labu Erlenmeyer 100 mL. Setelah itu, dilakukan titrasi dengan NaOH 0.1 N menggunakan indikator pp sampai terbentuk warna merah muda permanen pertama kali. Normalitas NaOH ialah 5/(VNaOH), dan diambil
+ Etanol hangat + GPA + Zeolit
disaring
diuapkan + Etanol
hangat disaring
diuapkan + Etanol hangat
Lampiran 6 Diagram alir sintesis dan pemisahan ester glukosa stearat (modifikasi Kuang et al. 2000 dan Obaje 2005)
Metil stearat
pH larutan diperiksa, jika asam dinetralkan dengan NaHCO31 M
Dimasukkan dalam labu bulat
Dipanaskan dalam penangas air selama 6 jam
Saring hangat Campuran reaksi
Endapan A
Diuapkan
Diekstraksi dengan heksana
Didinginkan T = -4–0 °C
Endapan (GPA yang tidak bereaksi)
Ester glukosa stearat (a) Metil stearat
yang tidak bereaksi
Lapisan heksana Endapan B Filtrat
Endapan B
Diuapkan
Filtrat
Diekstraksi dengan heksana
Didinginkan T = -4–0 °C
Endapan (Zeolit)
Ester glukosa stearat (b) Metil stearat
yang tidak bereaksi
Lapisan heksana Endapan A
Diuapkan
Lampiran 7 Data persentase hasil dan titik leleh GPA
No.
Bobot glukosa
(g)
Volume anhidrida asetat
(mL)
Bobot GPA (g)
Bobot teoretis GPA
(g)
Hasil (%)
Rerata hasil
(%)
Titik leleh (°C)
1 10.0376 50 10.6945 21.7330 49.21
2 20.0025 100 19.9091 43.3490 45.93
3 40.0014 200 35.8952 86.6591 41.42
45.52 109–112
Contoh perhitungan persentase hasil GPA, untuk no. 1:
Glukosa + 5 Anhidrida asetat GPA + 5 Asam asetat
Mula-mula 0.0557 mol 0.5301 mol – –
Bereaksi 0.0557 mol 0.2785 mol 0.0557 mol 0.2785 mol
Sisa – 0.2516 mol 0.0557 mol 0.2785 mol
Keterangan: BM glukosa = 180.0954 g/mol Densitas anhidrida asetat = 1.082 g/mL BM anhidrida asetat = 102.0488 g/mol BM GPA = 390.1804 g/mol
Bobot teoretis GPA = 0.0557 mol × 390.1804 g/mol = 21.7330 g
49.21% 100%
g 21.7330
g 10.6945 100%
etis Bobot teor
sintesis hasil
GPA Bobot (%)
Hasil = × = × =
45.52% 3
41.42% 45.93%
49.21% (%)
hasil
Lampiran 8 (a) Data kadar air GPA; (b) Data kadar asetil GPA; (c) Perhitungan kadar
Rerata kadar air (%) 1 66.4599 0.5009 66.9598 0.20 2 66.8475 0.5041 67.3499 0.34 3 67.0793 0.5027 67.5808 0.24
0.26
aArti lambang-lambang yang digunakan dijelaskan pada Lampiran 3.
(b) Data kadar asetil GPA
Ulangan W
Rerata kadar asetil (%) 1 0.5009 0.20 22.00 0.5726 0.85 0.4924 85.02
2 0.5041 0.34 21.90 0.5726 0.70 0.4924 84.46 3 0.5027 0.24 22.00 0.5726 0.90 0.4924 84.96
84.81
aArti lambang-lambang yang digunakan dijelaskan pada Lampiran 3.
Keterangan: mL HCl untuk titrasi blangko: 39.50 mL dan mL NaOH untuk titrasi blangko: 1.15 mL
Contoh perhitungan, untuk ulangan 1:
0.20%
(c) Perhitungan kadar asetil maksimum GPA secara teoretis
Lampiran 9 Data persentase hasil dan titik leleh metil stearat
No.
Bobot asam stearat
(g)
Volume metanol (mL)
Bobot metil stearat
(g)
Bobot teoretis metil stearat
(g)
Hasil (%)
Rerata hasil
(%)
Titik leleh (°C)
1 9.0723 85.00 7.6644 9.5164 80.54
2 10.0100 94.00 8.7482 10.5008 83.31
3 20.0214 188.00 17.9816 21.0017 85.62
4 20.0369 188.00 18.7063 21.0315 88.94
84.60 39–41
Contoh perhitungan persentase hasil metil stearat, untuk no. 1:
Asam stearat + Metanol Metil stearat + H2O
Mula-mula 0.0319 mol 2.0958 mol – –
Bereaksi 0.0319 mol 0.0319 mol 0.0319 mol 0.0319 mol
Sisa – 2.0639 mol 0.0319 mol 0.0319 mol
Keterangan: BM asam stearat = 284.3022 g/mol Densitas metanol = 0.79 g/mL BM metanol = 32.04 g/mol BM metil stearat = 298.3191 g/mol
Bobot teoretis metil stearat = 0.0319 mol × 298.3191 g/mol = 9.5164 g
80.54% 100%
g 9.5164
g 7.6644 100%
etis Bobot teor
sintesis hasil stearat metil Bobot (%)
Hasil = × = × =
84.60% 4
88.94% 85.62%
83.31% 80.54%
(%) hasil
Lampiran 10 Data nilai FFA metil stearat
Ulangan Bobot metil stearat (g)
Konsentrasi NaOH (N)
Volume NaOH (mL)
FFA (%)
Rerata FFA (%)
1 2.5090 0.1017 1.10 1.27
2 2.5316 0.1017 1.25 1.43
3 2.5014 0.1017 1.20 1.38
1.36
Keterangan: BM asam stearat = 284.3022 g/mol
Contoh perhitungan, untuk ulangan 1:
1.27% 100%
mg 2509.0
g/mol 284.3022 N
0.1017 mL
1.10 (%)
FFA = × × × =
1.36% 3
1.39% 1.42%
1.27% (%)
FFA
Lampiran 11 Data persentase hasil dan titik leleh ester glukosa stearat
a b Arti lambang-lambang yang digunakan dijelaskan pada Lampiran 6.
Contoh perhitungan persen hasil ester glukosa stearat, untuk perbandingan mol reaktan 1:1, ulangan 1: BM metil stearat = 298.3191 g/mol BM ester glukosa stearat = 1511.5324 g/mol
Bobot teoretis ester glukosa stearat = 0.0020 mol × 1511.5324 g/mol = 3.0231 g