PERFORMAN DAN HISTOPATOLOGI USUS HALUS
BROILER YANG DIBERI PAKAN SILASE DAN
DITANTANG
Salmonella typhimurium
FIRSTEA OCTA MERRYANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
FIRSTEA OCTA MERRYANA. Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium. Dibimbing oleh Nahrowi, M. Ridla dan Agus Setiyono.
Aplikasi mengenai teknologi pengolahan pakan berupa silase dapat menjamin ketahanan pakan dan juga dapat menggantikan antibiotik melalui kandungan bakteri asam laktat (BAL) dan asam organik yang dimiliki oleh produk silase. Tujuan penelitian ini adalah untuk mempelajari pengaruh pakan dalam bentuk silase terhadap performa dan perkembangan bakteri Salmonella di dalam usus halus broiler.
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap dengan menggunakan 168 ekor broiler yang dibagi dalam 21 petak kemudian diberi salah satu dari 7 macam perlakuan ransum, yaitu : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L. Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 + antibiotik + infeksi Salmonella typhi.). Data yang diperoleh dianalisa dengan sidik ragam (Analysis of Variance / ANOVA) dan jika berbeda nyata diuji dengan menggunakan uji Kontras Orthogonal. Data tingkat kerusakan usus halus diolah dengan menggunakan Kruskal-Wallis.
Produk silase yang dihasilkan sangat baik, ditunjukkan dengan pH yang rendah yaitu 4.28 dan tingginya bakteri asam laktat yang dihasilkan yaitu 9.16 x 108. Ransum silase nyata (P<0.05) mengurangi kerusakan pada vili-vili ileum broiler yang ditantang dengan Salmonella typhimurium. Selain itu, silase juga dapat menekan pertumbuhan Salmonella di dalam sekum broiler. Hasil penelitian ini menunjukkan bahwa ransum silase dapat digunakan sebagai bahan pakan yang dapat menekan pertumbuhan Salmonella typhimurium di dalam usus halus broiler.
Silase ransum dalam penelitian ini tidak memberikan pengaruh negatif terhadap konsumsi, pertambahan bobot badan, bobot badan akhir, dan konversi ransum, yang ditandai dengan tidak ada perbedaan nyata antara perlakuan yang menggunakan silase ransum dengan perlakuan yang menggunakan ransum basal. Begitu juga halnya untuk silase yang diberikan pada broiler yang ditantang Salmonella typhimurium menunjukkan hasil akhir yang cukup baik. Silase ransum komplit dapat digunakan sebagai pakan alternatif ransum komersial dan juga dapat berperan sebagai alternatif antibiotik tanpa memberikan pengaruh negatif terhadap performan broiler.
ABSTRACT
FIRSTEA OCTA MERRYANA. Performance and Histopathology of Small Intestine of Broiler Treated with Silage Diet and Challenged by Salmonella thypimurium. Under the direction of Nahrowi, M. Ridla and Agus Setiyono.
Application of silage technology can guarantee the availability of feed and may substitute antibiotic through the lactic acid bacterium (BAL) and organic acid contents. The aim of this research were to examine the effect of feeding silage on the performance and inhibit the growth of bacteri Salmonella in small intestine of broiler challenged with Salmonella.
Completely Randomized design with 7 treatments and 3 replications were used. 168 broilers which are devided into 21 groups were given one of the seven kinds of ration i.e. S1 (silage ration), B1 (basal ration), L1(B1 + L. Plantarum), S2 (S1 + Salmonella typhimurium), B2 (B1 + Salmonella typhimurium), L2 (L1 + Salmonella typhimurium) and A (B1 + antibiotic + Salmonella typhimurium). Data obtained were analysed with Analysis of Variance (ANOVA) and the orthogonal contrast test for comparing differences of treatments. Data due to small intestine damage were analysed by using Kruskal-Wallis.
Silage products were very good in term of having low pH (4.28) and increasing number of lactic acid bacteries (9.16 x 108). Silage ration significantly decreased (P<0.05) the damage of ileum villus of broiler chalenged by Salmonella typhimurium. Silage could also depress the growth of Salmonella in broiler’s caecum. The result of this research show silage ration can be used as feed substance which could depress the growth of Salmonella typhimurium in broiler’s small intestine.
Silage ration could not give nagative influence to consumption, body weight gain, last body weight and ration convertion wich marked by there was not significant difference between silage ration and basal ration. It can be concluded silage ration can be used as alternative commercial ration without influencing performance of broiler.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
PERFORMAN DAN HISTOPATOLOGI USUS HALUS
BROILER YANG DIBERI PAKAN SILASE DAN
DITANTANG
Salmonella typhimurium
FIRSTEA OCTA MERRYANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium
Nama : Firstea Octa Merryana
NRP : D051040141
Disetujui Komisi Pembimbing
Dr. Ir. Nahrowi, M.Sc Ketua
Dr.Ir. Muhammad Ridla, M.Agr Dr.drh. Agus Setiyono, MS Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Ternak Dekan Sekolah Pascasarjana
Dr. Ir. Nahrowi, M.Sc Prof. Dr.Ir. Khairil Anwar Notodiputro, MS
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga Tesis ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2006 ialah Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada : Dr. Ir. Nahrowi, M.Sc, selaku dosen pembimbing utama, Dr.Ir. Muhammad Ridla, M.Agr dan Dr.drh. Agus Setiyono, MS yang telah banyak meluangkan banyak waktu, tenaga dan pikiran serta memberikan arahan, bimbingan dan saran selama penulis melaksanakan penelitian dan penulisan tesis. Terima kasih juga penulis ucapkan pada Dr. Ir. Sumiati, M.Sc yang telah bersedia sebagai dosen penguji luar komisi dan banyak memberikan masukan dalam penyempurnaan tesis ini.
Terima kasih tak terhingga dan penuh hormat penulis ucapkan pada Ayah Ir. Muryono dan Mami Fatmawati, S.Pd tercinta yang selalu mengasuh, mendidik dan membimbing dengan penuh kasih sayang serta senantiasa mendo’akan dan memberikan dorongan penuh baik moril maupun materil sampai saat ini. Adek Puspita Maya Margaretha, terima kasih selalu memberi kakak semangat, warna dalam senyum cerianya. Deyusma, S.Pt, terima kasih atas kesabaran dan pengertian yang diberikan selama ini serta pelajaran tentang hidup dan kedewasaan. Keluarga besar Situbondo dan Keluarga besar Bapak Iip Sukandar, terima kasih telah memberikan perhatian, bimbingan dan keceriaan selama ini. Teh Nelly, teh Nia, teh Yati dan Mami Carolina, terima kasih atas arahan dan bantuan selama penulis berada di Bogor.
yang tidak dapat disebutkan satupersatu yang telah membantu penulis baik selama pelaksanaan penelitian maupun dalam penulisan tesis ini.
Penulis berharap tesis ini dapat bermanfaat bagi semua pihak yang memerlukan dan dapat memberikan masukan bagi dunia peternakan Indonesia.
Bogor, April 2007
Firstea Octa M
RIWAYAT HIDUP
Penulis dilahirkan di Situbondo pada Tanggal 31 Oktober 1981 dari ayah Ir. Muryono dan ibu Fatmawati, S.Pd. penulis merupakan putri pertama dari dua bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesa ... 2
TINJAUAN PUSTAKA ... 3
Silase ... 3
Bakteri Asam Laktat ... 5
Asam Organik ... 8
Pemanfaatan Bakteri Asam Laktat pada Unggas ... 10
Penggunaan Antibiotika ... 11
Salmonellosis pada Unggas ... 11
Organ Vital dan Usus Halus ... 14
Organ Vital ... 14 Usus Halus ... 14
MATERI DAN METODE ... 19
Tempat dan Waktu ... 19
Materi ... 19
Ternak ... 19
Kandang dan Perlengkapan ... 19
Ransum ... 19
Bakteri dan Additive ... 19
Vitamin dan Vaksin ... 21
Metode ... 21
Rancangan Percobaan dan Analisis Data ... 21
Pembuatan Ransum Silase Komplit ... 22
PERFORMAN DAN HISTOPATOLOGI USUS HALUS
BROILER YANG DIBERI PAKAN SILASE DAN
DITANTANG
Salmonella typhimurium
FIRSTEA OCTA MERRYANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRAK
FIRSTEA OCTA MERRYANA. Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium. Dibimbing oleh Nahrowi, M. Ridla dan Agus Setiyono.
Aplikasi mengenai teknologi pengolahan pakan berupa silase dapat menjamin ketahanan pakan dan juga dapat menggantikan antibiotik melalui kandungan bakteri asam laktat (BAL) dan asam organik yang dimiliki oleh produk silase. Tujuan penelitian ini adalah untuk mempelajari pengaruh pakan dalam bentuk silase terhadap performa dan perkembangan bakteri Salmonella di dalam usus halus broiler.
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap dengan menggunakan 168 ekor broiler yang dibagi dalam 21 petak kemudian diberi salah satu dari 7 macam perlakuan ransum, yaitu : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L. Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 + antibiotik + infeksi Salmonella typhi.). Data yang diperoleh dianalisa dengan sidik ragam (Analysis of Variance / ANOVA) dan jika berbeda nyata diuji dengan menggunakan uji Kontras Orthogonal. Data tingkat kerusakan usus halus diolah dengan menggunakan Kruskal-Wallis.
Produk silase yang dihasilkan sangat baik, ditunjukkan dengan pH yang rendah yaitu 4.28 dan tingginya bakteri asam laktat yang dihasilkan yaitu 9.16 x 108. Ransum silase nyata (P<0.05) mengurangi kerusakan pada vili-vili ileum broiler yang ditantang dengan Salmonella typhimurium. Selain itu, silase juga dapat menekan pertumbuhan Salmonella di dalam sekum broiler. Hasil penelitian ini menunjukkan bahwa ransum silase dapat digunakan sebagai bahan pakan yang dapat menekan pertumbuhan Salmonella typhimurium di dalam usus halus broiler.
Silase ransum dalam penelitian ini tidak memberikan pengaruh negatif terhadap konsumsi, pertambahan bobot badan, bobot badan akhir, dan konversi ransum, yang ditandai dengan tidak ada perbedaan nyata antara perlakuan yang menggunakan silase ransum dengan perlakuan yang menggunakan ransum basal. Begitu juga halnya untuk silase yang diberikan pada broiler yang ditantang Salmonella typhimurium menunjukkan hasil akhir yang cukup baik. Silase ransum komplit dapat digunakan sebagai pakan alternatif ransum komersial dan juga dapat berperan sebagai alternatif antibiotik tanpa memberikan pengaruh negatif terhadap performan broiler.
ABSTRACT
FIRSTEA OCTA MERRYANA. Performance and Histopathology of Small Intestine of Broiler Treated with Silage Diet and Challenged by Salmonella thypimurium. Under the direction of Nahrowi, M. Ridla and Agus Setiyono.
Application of silage technology can guarantee the availability of feed and may substitute antibiotic through the lactic acid bacterium (BAL) and organic acid contents. The aim of this research were to examine the effect of feeding silage on the performance and inhibit the growth of bacteri Salmonella in small intestine of broiler challenged with Salmonella.
Completely Randomized design with 7 treatments and 3 replications were used. 168 broilers which are devided into 21 groups were given one of the seven kinds of ration i.e. S1 (silage ration), B1 (basal ration), L1(B1 + L. Plantarum), S2 (S1 + Salmonella typhimurium), B2 (B1 + Salmonella typhimurium), L2 (L1 + Salmonella typhimurium) and A (B1 + antibiotic + Salmonella typhimurium). Data obtained were analysed with Analysis of Variance (ANOVA) and the orthogonal contrast test for comparing differences of treatments. Data due to small intestine damage were analysed by using Kruskal-Wallis.
Silage products were very good in term of having low pH (4.28) and increasing number of lactic acid bacteries (9.16 x 108). Silage ration significantly decreased (P<0.05) the damage of ileum villus of broiler chalenged by Salmonella typhimurium. Silage could also depress the growth of Salmonella in broiler’s caecum. The result of this research show silage ration can be used as feed substance which could depress the growth of Salmonella typhimurium in broiler’s small intestine.
Silage ration could not give nagative influence to consumption, body weight gain, last body weight and ration convertion wich marked by there was not significant difference between silage ration and basal ration. It can be concluded silage ration can be used as alternative commercial ration without influencing performance of broiler.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007
Hak cipta dilindungi
PERFORMAN DAN HISTOPATOLOGI USUS HALUS
BROILER YANG DIBERI PAKAN SILASE DAN
DITANTANG
Salmonella typhimurium
FIRSTEA OCTA MERRYANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Ternak
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium
Nama : Firstea Octa Merryana
NRP : D051040141
Disetujui Komisi Pembimbing
Dr. Ir. Nahrowi, M.Sc Ketua
Dr.Ir. Muhammad Ridla, M.Agr Dr.drh. Agus Setiyono, MS Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Ternak Dekan Sekolah Pascasarjana
Dr. Ir. Nahrowi, M.Sc Prof. Dr.Ir. Khairil Anwar Notodiputro, MS
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga Tesis ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2006 ialah Performan dan Histopatologi Usus Halus Broiler yang Diberi Pakan Silase dan Ditantang Salmonella typhimurium.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada : Dr. Ir. Nahrowi, M.Sc, selaku dosen pembimbing utama, Dr.Ir. Muhammad Ridla, M.Agr dan Dr.drh. Agus Setiyono, MS yang telah banyak meluangkan banyak waktu, tenaga dan pikiran serta memberikan arahan, bimbingan dan saran selama penulis melaksanakan penelitian dan penulisan tesis. Terima kasih juga penulis ucapkan pada Dr. Ir. Sumiati, M.Sc yang telah bersedia sebagai dosen penguji luar komisi dan banyak memberikan masukan dalam penyempurnaan tesis ini.
Terima kasih tak terhingga dan penuh hormat penulis ucapkan pada Ayah Ir. Muryono dan Mami Fatmawati, S.Pd tercinta yang selalu mengasuh, mendidik dan membimbing dengan penuh kasih sayang serta senantiasa mendo’akan dan memberikan dorongan penuh baik moril maupun materil sampai saat ini. Adek Puspita Maya Margaretha, terima kasih selalu memberi kakak semangat, warna dalam senyum cerianya. Deyusma, S.Pt, terima kasih atas kesabaran dan pengertian yang diberikan selama ini serta pelajaran tentang hidup dan kedewasaan. Keluarga besar Situbondo dan Keluarga besar Bapak Iip Sukandar, terima kasih telah memberikan perhatian, bimbingan dan keceriaan selama ini. Teh Nelly, teh Nia, teh Yati dan Mami Carolina, terima kasih atas arahan dan bantuan selama penulis berada di Bogor.
yang tidak dapat disebutkan satupersatu yang telah membantu penulis baik selama pelaksanaan penelitian maupun dalam penulisan tesis ini.
Penulis berharap tesis ini dapat bermanfaat bagi semua pihak yang memerlukan dan dapat memberikan masukan bagi dunia peternakan Indonesia.
Bogor, April 2007
Firstea Octa M
RIWAYAT HIDUP
Penulis dilahirkan di Situbondo pada Tanggal 31 Oktober 1981 dari ayah Ir. Muryono dan ibu Fatmawati, S.Pd. penulis merupakan putri pertama dari dua bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Hipotesa ... 2
TINJAUAN PUSTAKA ... 3
Silase ... 3
Bakteri Asam Laktat ... 5
Asam Organik ... 8
Pemanfaatan Bakteri Asam Laktat pada Unggas ... 10
Penggunaan Antibiotika ... 11
Salmonellosis pada Unggas ... 11
Organ Vital dan Usus Halus ... 14
Organ Vital ... 14 Usus Halus ... 14
MATERI DAN METODE ... 19
Tempat dan Waktu ... 19
Materi ... 19
Ternak ... 19
Kandang dan Perlengkapan ... 19
Ransum ... 19
Bakteri dan Additive ... 19
Vitamin dan Vaksin ... 21
Metode ... 21
Rancangan Percobaan dan Analisis Data ... 21
Pembuatan Ransum Silase Komplit ... 22
Analisis Kimia dan Histopatologi ... 23
Kualitas Silase ... 23
Jumlah Koloni Salmonella ... 23
Pengamatan Histopatologi Usus Halus ... 23
Peubah yang Diamati ... 25
Prosedur Pelaksanaan ... 25
HASIL DAN PEMBAHASAN ... 26
Silase Ransum ... 26
Kualitas Silase Ransum dan Ransum Kering selama Penyimpanan .... 27
Performa Broiler yang Diberi Ransum Perlakuan dan Ditantang Salmonella typhimurium ... 28
Konsumsi... 29
Pertambahan Bobot Badan ... 30
Bobot Badan Akhir ... 32
Konversi Ransum ... 32
Organ Dalam Broiler ... 35
Hati ... 35
Empedu ... 36
Limpa ... 37
Jumlah Koloni Salmonella ... 39
Histopatologi Usus Halus ... 41
SIMPULAN DAN SARAN ... 51
DAFTAR PUSTAKA ... 52
DAFTAR TABEL
Tabel Halaman
1. Enam fase dari fermentasi silase dan penyimpanannya ... 4 2. Susunan dan kandungan zat makanan dalam ransum penelitian ... 20 3. Koloni bakteri asam laktat (BAL) dan pH silase ransum pada minggu
ke 0, 3 dan 6 ... 26 4. Kualitas pakan silase dan pakan kering yang disimpan pada minggu
ke 0, 3 dan 6 ... 27 5. Rata-rata konsumsi pakan, pertambahan bobot badan (PBB), bobot
DAFTAR GAMBAR
Gambar Halaman
1. Pembentukan laktat oleh bakteri homofermentatif ... 5 2. Pembentukan laktat oleh bakteri heterofermentatif ... 6 3. Kerja asam organik pada bakteri yang sensitif (Coliform,
Clostridis, Salmonella, Listeria spp) terhadap perubahan pH ... 9 4. Kerja asam organik pada bakteri yang tidak sensitif (Bakteri Asam
Laktat, Bifidobakteria) terhadap perubahan pH ... 10 5. Infeksi pada mukosa usus oleh bakteri Salmonella ... 13 6. pH organ dan saluran pencernaan broiler ... 16 7. Gambaran mikroskopis usus halus normal broiler ... 17 8. Proses pembuatan ransum silase komplit ... 22 9. Proses pembuatan sediaan preparat histopatologi usus halus ... 24 10. Pertambahan bobot badan broiler selama 6 minggu pemeliharaan ... 31 11. Konversi pakan broiler yang dipelihara selama 6 minggu ... 33 12. Persentase hati broiler yang dipelihara selama 6 minggu ... 36 13. Persentase empedu broiler yang dipelihara selama 6 minggu ... 37 14. Persentase limpa broiler yang dipelihara selama 6 minggu ... 38 15. Skema pelepasan proton H+ oleh asam organik ... 40 16. Gambaran mikroskopis usus halus normal broiler umur 9 hari;
pewarnaan Haematoxylin Eosin (HE) (pembesaran obyektif 40x) ... 42 17. Gambaran mikroskopis usus halus broiler yang mengalami koyakan
pada permukaan vili-vilinya pewarnaan Haematoxylin Eosin (HE) (pembesaran obyektif 40x) ... 43 18. Ileum broiler yang diberi pakan silase ... 44 19. Ileum broiler yang diberi pakan ransum kering ... 45 20. Ileum broiler yang diberi pakan L. Plantarum melalui air minum ... 45 21. Ileum broiler yang diinfeksi Salmonella dan diberi pakan silase ... 46 22. Ileum broiler yang diinfeksi Salmonella dan diberi ransum basal ... 47 23. Ileum broiler yang diinfeksi Salmonella dan diberi L. Plantarum
DAFTAR LAMPIRAN
Lampiran Halaman
1. Cara Pewarnaan Haematoxyllin dan Eosin ... 57 2. Analisis ragam (ANOVA) konsumsi broiler umur 6 minggu ... 58 3. Analisis ragam (ANOVA) pertambahan bobot badan broiler
umur 6 minggu ... 58 4. Analisis ragam (ANOVA) bobot badan akhir broiler
umur 6 minggu ... 58 5. Analisis ragam (ANOVA) konversi pakan broiler umur
6 minggu ... 59 6. Analisis ragam (ANOVA) konversi pakan broiler umur
0-3 minggu ... 59 7. Analisis ragam (ANOVA) konversi pakan broiler umur
PENDAHULUAN
Latar Belakang
Kondisi pemeliharaan unggas khususnya broiler di Indonesia masih kurang baik. Hal ini telah menyebabkan penyakit sangat mudah menjangkiti ternak. Salah satu penyakit yang sulit dikendalikan adalah Salmonellosis (penyakit yang disebabkan oleh bakteri Salmonella).
Permasalahan lain peternakan khususnya unggas adalah ketersediaan pakan dan daya tahan pakan dalam penyimpanannya, sehingga teknologi pengawetan dalam bentuk silase merupakan salah satu jalan tepat untuk diterapkan dalam rangka menanggulangi permasalahan tersebut di atas.
Saat ini teknologi pengawetan berupa fermentasi anaerob lebih banyak digunakan pada ternak ruminansia khususnya sapi perah, dan masih sangat terbatas dilaporkan penggunaan silase pada unggas. Kajian awal mengenai penggunaan silase pada broiler menunjukkan bahwa broiler umur 1 minggu dapat menerima silase ransum komplit tanpa ada pengaruh negatif terhadap bobot badan yang dihasilkan maupun terhadap organ vital (Tonnedy 2006).
Aplikasi teknologi silase pada unggas selain dapat menjamin ketersediaan pakan, juga dapat digunakan sebagai sumber bakteri asam laktat (BAL) dan asam organik. BAL dapat berperan sebagai feed additive alternatif antibiotik dan begitu juga halnya dengan asam organik. Asam organik di Eropa telah diklaim dapat digunakan sebagai growth promotor disamping sebagai bahan yang dapat memperpanjang umur simpan bahan pakan.
Tujuan
1.Mempelajari pengaruh penggunaan silase ransum terhadap performan, organ dalam dan jumlah koloni Salmonella dalam sekum broiler yang diinfeksi bakteri Salmonella typhimurium.
2.Mempelajari histopatologi jaringan usus halus broiler yang diberi silase ransum setelah broiler tersebut diinfeksi dengan bakteri Salmonella typhimurium.
Hipotesis
1.Pemberian silase ransum pada broiler dapat menekan jumlah Salmonella typhimurium di dalam usus halus, sehingga secara tidak langsung dapat meningkatkan bobot badan.
TINJAUAN PUSTAKA
Silase
Silase merupakan makanan ternak yang dihasilkan melalui proses fermentasi bahan pakan dengan kandungan kadar air tinggi. Tujuan pembuatan silase ini adalah memaksimalkan nutrient yang dapat diawetkan (Sapienza dan Keith 1993) dan pakan dapat lebih tahan lama dalam penyimpanan.
Untuk meningkatkan kualitas silase sering ditambahkan bahan aditif yang pada dasarnya dibagi menjadi 2 yaitu : 1. sebagai stimulan fermentasi dan 2. sebagai inhibitor fermentasi. Zat aditif stimulan fermentasi bekerja membantu pertumbuhan bakteri asam laktat sehingga kondisi asam dapat segera tercapai. Sedangkan inhibitor fermentasi digunakan untuk menghambat pertumbuhan mikroorganisme pembusuk seperti clostridia agar pakan dapat lebih awet.
Keberhasilan pembuatan silase adalah memaksimalkan nutrien yang dapat diawetkan. Silase yang baik diperoleh dengan menekan berbagai aktivitas enzim yang berada dalam bahan baku yang tidak dikehendaki, dan dapat mendorong berkembangnya bakteri penghasil asam laktat (Sapienza dan Keith 1993). Selain menghasilkan asam laktat, bakteri ini juga mampu menghasilkan berbagai substansi antimikroba yang potensial seperti asam organik, hidrogen peroksida, diasetil, dan bakteriosin (Cintas et al. 1995). Bakteriosin merupakan substansi protein yang memiliki berat molekul kecil dan memiliki efek antagonis sebagai bakterisidal atau bakteriostatik terhadap pertumbuhan bakteri patogen (Suarsana et al. 2001). Bakteriosin akan terbentuk setelah 10 jam sampai 26 jam selama ensilase, bakteriosin ini memiliki aktivitas optimum pada pH 6, bersifat termostabil pada pH 3-5 dengan pemanasan 121oC selama 15 menit (Suarsana 2001). Namun mekanisme antimikroba dari bakteriosin secara detail masih belum diketahui.
menyebabkan bakteri clostridial menjadi stabil (McDonald et al. 1991). Asam laktat dapat menekan pertumbuhan jamur meskipun tidak seefektif asam asetat. Secara keseluruhan, semakin besar tingkat fermentasi asam laktat dan asam asetat maka silase tersebut akan semakin stabil dari kondisi aerob.
Secara garis besar proses pembuatan silase terdiri dari empat fase : (1). Fase aerob (2). Fase fermentasi (3). Fase stabil dan (4). Fase pengeluaran untuk diberikan pada ternak. Untuk lebih detail mengenai fase, aktivitas dan produksi dalam fermentasi silase dapat dilihat pada Tabel 1.
Tabel 1. Enam fase dari fermentasi silase dan penyimpanannya Fase Umur Silase
(hari) Aktivitas
Suhu
(oC) pH Produksi
I 0-2
Respirasi sel; produksi CO2, panas dan air
15.5 - 32.2 6.5 - 6.0
II 2-3
Produksi asam asetat dan etanol asam laktat
32.2 - 27.7 6.0 - 5.0
Asam asetat dan bakteri asam laktat
III 3-4 Pembentukan asam
laktat 32.2 - 27.7 5.0 - 4.0
Bakteri asam laktat
IV 4-21 Pembentukan asam
laktat 27.7 4.0
Bakteri asam laktat
V 21 Penyimpanan
materi 27.7 4.0
VI Dekomposisi aerobik terhadap produksi oksigen 27.7 4.0-7.0 Pembentukan dan aktivitas jamur Sumber : Schroeder (2004)
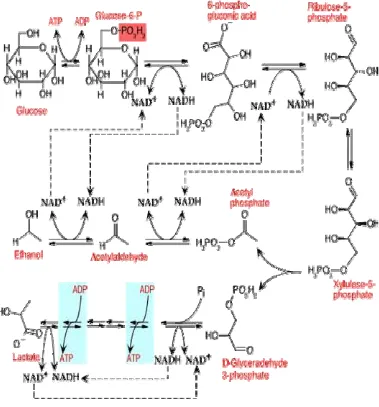
Bakteri Asam Laktat
Bakteri asam laktat yang umum digunakan dalam proses fermentasi adalah kelompok Lactobacillus, Pediococcus, Leuconostoc, Enterococcus, Lactococcus and Streptococcus (Stefanie et al. 2000). Bakteri penghasil asam laktat akan memfermentasi gula menjadi asam laktat yang disertai dengan produksi asam asetat, etanol, karbondioksida dan lain-lain. Bakteri ini terbagi kedalam dua ketegori, yaitu yang homofermentatif dan heterofermentatif. Bakteri penghasil asam laktat yang homofermentatif hanya menghasilkan asam laktat dari fermentasi gula, seperti yang terlihat pada Gambar 1.
Fermentasi heterofermentatif, selain menghasilkan asam laktat juga menghasilkan etanol, asam asetat dan karbondioksida, seperti yang terlihat pada Gambar 2.
Sumber : http://www.bact.wisc.edu/Microtextbook (1999) Gambar 2. Pembentukan laktat oleh bakteri heterofermentatif
Bakteri asam laktat merupakan golongan mikroorganisme yang bermanfaat karena sifatnya tidak toksik bagi inang dan mampu menghasilkan senyawa yang dapat membunuh mikroorganisme patogen. Sesuai dengan namanya bakteri asam laktat ini menghasilkan asam laktat sebagai hasil metabolismenya yang sangat bermanfaat dalam menghambat pertumbuhan mikroorganisme lain yang merugikan bagi tubuh. Bakteri asam laktat ini juga memproduksi metabolit sekunder seperti asam hidroksi peroksida, diasetil, amonia, asam lemak dan bakteriosin (Lopez 2000). Produksi bakteriosin ini dapat menghambat perkembangan bakteri patogen (Wiryawan dan Anita 2001).
Mekanisme kerja bakteri asam laktat yang dikemukakan oleh Lopez (2000), yaitu menekan kemampuan hidup mikroorganisme patogen karena mampu memproduksi komponen antibakteria seperti hidroksi peroksida dan asam-asam organik seperti asam laktat. Asam laktat yang dihasilkan tersebut berguna untuk menurunkan pH. Ada beberapa mekanisme kerja yang dilakukan oleh asam laktat sebagai probiotik, yaitu : (1) Berkompetisi dengan mikroorganisme patogen untuk mendapat nutrisi dan tempat tinggal (2) Menjaga keseimbangan ekosistem melalui penjagaan pH lingkungan agar tetap berada dalam kondisi asam, sehingga perkembangan bakteri patogen dapat terhambat (3) Menyediakan kebutuhan enzim-enzim yang mampu mencerna serat kasar, protein, lemak dan karbohidrat (4) Mendetoksifikasi zat beracun dalam tubuh (5) Mampu menstimulasi kekebalan tubuh dengan cara meningkatkan konsentrasi dari antibodi imunoglobulin (Lopez 2000).
Bakteri asam laktat dalam pengawetan bahan pakan digunakan dalam proses ensilase yang akan menghasilkan suatu produk yaitu silase. Silase ini dapat dikategorikan sebagai probiotik yang bermanfaat sebagai feed additive dengan beberapa kelebihan sebagai berikut : dapat meningkatkan ketersediaan lemak dan protein bagi ternak, mempertahankan konversi pakan, meningkatkan pertumbuhan berat badan, mampu memperbaiki resistensi penyakit akibat stimulasi dan peningkatan natural immunity, selain itu juga dapat meningkatkan kandungan vitamin B komplek melalui proses fermentasi (McDonald et al. 1991).
Lactobacillus dan Carnobacterium (Nettles dan Barefoot 1993). Berdasarkan proses metabolisme gula, BAL dibagai dalam 3 kelompok, yaitu : 1. obligat homofermentatif (Pediococcus damnosus dan Lactobacillus ruminis), 2. fakultatif heterofermentatif (Lactobacillus plantarum, L. pentosus, Pediococcus acidilactici, P. pentosaceus dan Enterococcus faecium), 3. obligat heterofermentatif (Leuconostoc, dan beberapa Lactobacillus spp., seperti Lactobacillus brevis dan Lactobacillus buchneri). Obligat homofermentatif menghasilkan lebih dari 85% asam laktat dari heksosa (C6) seperti glukosa, tapi tidak dapat memecah pentosa (C5) seperti xylosa. Fakultatif heterofermentatif menghasilkan produk utama asam laktat dari heksosa dan dalam jumlah kecil dapat memecah pentosa menjadi asam laktat dan asam asetat atau etanol. Obligat heterofermentatif dapat memecah heksosa dan pentosa, namun berbeda dengan homofermentatif mereka memecah heksosa menjadi sejumlah equimolar dari asam laktat, CO2 dan asam asetat atau
etanol (McDonald et al. 1991).
Habitat dari bakteri asam laktat (BAL) sangat beragam dan bertoleran baik terhadap pH, suhu dan udara. BAL bisa bertahan hidup pada kondisi pH yang beragam mulai dari pH 4.0 - 6.8. BAL dari spesies Streptococcus umumnya bertahan pada pH sekitar 4.5 – 5.0. sedangkan untuk spesies Lactobacillus akan tumbuh subur pada media asam mulai dari pH 4.5 – 6.4. Kisaran suhu hidup BAL sangat luas dan beragam mulai dari 5oC – 50oC. Suhu optimal bakteri asam laktat adalah 30oC (untuk strain L. plantarum) dan 37oC (untuk strain L. paracasei) (Koenen et al. 2004).
Asam Organik
Asam-asam karboksilat tersebut umumnya dapat diproduksi oleh mahluk hidup melalui proses metabolisme tubuh. Asam organik dalam saluran pencernaan dapat melakukan proses ionisasi dengan mudah yaitu dengan cara melepaskan ion hidrogen. Peningkatan jumlah ion hidrogen tersebut akan menurunkan pH saluran pencernaan sehingga mikroorganisme yang tidak tahan terhadap kondisi asam akan terhambat pertumbuhannya (Hardy 2003). Pada bakteri yang sensitif terhadap perubahan pH, asam organik menembus dinding sel bakteri sehingga asam organik akan terurai (H+ dan RCOO-), mengakibatkan pH dalam sel akan turun. Pada kondisi tersebut bakteri berusaha melepaskan H+ dari dalam sel agar pH dalam sel menjadi normal, namun proses ini membutuhkan energi yang besar sehingga mengakibatkan bakteri akan berhenti tumbuh dan mati. Proses ini dapat dilihat pada Gambar 3.
Gambar 3. Kerja asam organik pada bakteri yang sensitif (Coliform, Clostridis, Salmonella, Listeria spp) terhadap perubahan pH (Gauthier 2002).
Gambar 4. Kerja asam organik pada bakteri yang tidak sensitif (bakteri asam laktat, bifidobakteria) terhadap perubahan pH (Gauthier 2002).
Pemanfaatan Bakteri Asam Laktat pada Unggas
Bakteri asam laktat (BAL) mampu menghasilkan asam laktat, hidrogen peroksida, antimikroba dan hasil metabolisme lain yang memberikan pengaruh positif bagi produktivitas ternak. BAL yang selama ini digunakan terbukti dapat meningkatkan produktivitas ternak. Pemberian BAL sebagai supplemen diharapkan dapat mengembalikan keseimbangan bakteri (rasio antara bakteri patogen dan nonpatogen) dalam saluran pencernaan ternak terutama dalam usus. BAL adalah pakan imbuhan dalam bentuk mikroorganisme hidup yang berpengaruh positif pada hewan inang dan dapat meningkatkan keseimbangan mikroflora dalam saluran pencernaan unggas.
Penggunaan Antibiotika pada Unggas
Broiler mampu mengolah makanannya dengan cepat begitu makanan dikonsumsi. Tingkah laku makan yang seperti ini menyebabkan broiler memiliki laju pertumbuhan yang sangat cepat, selain dipengaruhi oleh genetik, cepatnya laju pertumbuhan juga dipicu oleh adanya growth promotor yang umunya menggunakan senyawa antibiotika. Selain sabagai growth promotor, senyawa antibiotika ini juga dapat meningkatkan efisiensi pakan, alternatif pengobatan dan juga dapat meningkatkan reproduksi ternak. Namun akhir-akhir ini penggunaan antibiotika mulai mengalami penurunan yang sangat drastis, bahkan di beberapa negara telah dilarang penggunaannya sebagai aditif, yaitu : Virginamycin, Tylosin, Spiramycin dan Zinc bacitracyn (Bouliane 2003).
Penurunan penggunaan antibiotika ini disebabkan oleh 2 hal utama, yaitu : (1). Antibiotik dapat meninggalkan residu dalam jangka panjang, sehingga dapat membahayakan kesehatan konsumen, (2). Antibiotik menyebabkan mikroorganisme yang berada dalam tubuh manusia ataupun hewan menjadi resisten, terutama bakteri patogen seperti Salmonellae sp, Escherichia coli, dan Clostridium sp. Sehingga penggunaan probiotik sebagai bahan aditif menggantikan antibiotik dalam pakan sebagai growth promotor menjadi suatu pilihan yang tepat.
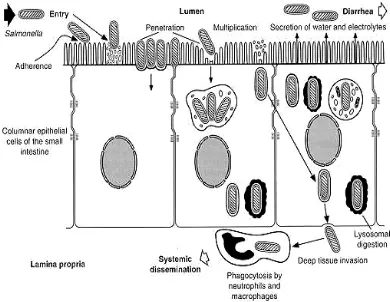
Salmonellosis pada Unggas
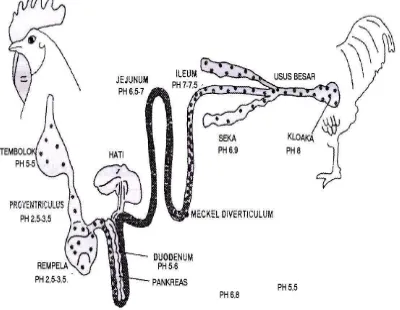
Salmonellosis merupakan penyakit yang disebabkan oleh bakteri Salmonella, dapat terjadi pada ternak maupun manusia. Serotipe bakteri ini potensial bersifat patogen, juga merupakan kontaminan bagi produk ternak seperti daging, telur, dan susu. Salmonellosis merupakan penyakit zoonose ini juga disebut “Food Borne Disease” karena penularannya terjadi melalui makanan dan minuman. Salmonella sp. banyak ditemukan pada saluran pencernaan vertebrata maupun invertebrata, dan juga terdapat pada feses ternak. Bakteri ini juga terdapat pada tembolok broiler sehingga dapat mengkontaminasi karkas (Lee 2000).
pada temperatur 37.0 – 37.5oC (Shivaprasad 1997). Di alam bakteri Salmonella tidak tahan hidup lama, terutama bila keadaan sekitarnya kering. Sumber infeksi Salmonella yang paling sering terjadi pada flock unggas diduga berasal dari pakan. Cox et al. (1996) melaporkan bahwa tempat penetasan merupakan sumber penularan Salmonella yang dominan pada peternakan ayam broiler.
Infeksi Salmonella terjadi melalui 3 cara yaitu kongenital, oral dan aerogen (Ressang 1984). Secara kongenital yaitu penularan melalui telur, sehingga anak ayam yang menetas melalui telur tersebut akan terinfeksi Salmonella. Infeksi secara oral terjadi melalui pakan dan air minum yang tercemari Salmonella. Sedang aerogen adalah infeksi yang terjadi di dalam mesin penetas telur dimana masa tunas penyakit berkisar antara 1 minggu. Penularan melalui vektor juga lazim terjadi, penyebaran ini terjadi melalui hewan-hewan kecil seperti tikus, lalat, burung liar dan peralatan yang mengandung bakteri Salmonella yang digunakan di dalam kandang (Cox et al. 1996).
Daging dan telur unggas merupakan sumber utama tertularnya Salmonella pada manusia. Banyak cara organisme tersebut dapat masuk, menyebar, dan bertahan di dalam tubuh unggas yang pada akhirnya produk yang dihasilkan oleh unggas juga akan terinfeksi oleh Salmonella. Baik perusahaan kecil maupun besar telah menggalakkan kebijakan kontrol dalam mengurangi berkembangnya bakteri Salmonella, jika gagal kemungkinan terinfeksi bakteri Salmonella akan lebih besar. Peningkatan monitoring dan kontrol di dalam kawasan peternakan lebih di fokuskan pada bagian breeding, umumnya lebih menekan berkembangnya S. Enteritidis dan S. Typhimurium. Kawasan breeding, pabrik pakan dan kawasan hatcheries merupakan kawasan utama terjadinya kontaminasi Salmonella. Kontaminasi pada kawasan tersebut umumnya melalui sistem ventilasi (Davis dan Breslin 2004).
per ml dan leukosit akan meningkat dari 18 000 menjadi 240 000 per ml (Tabbu 2000).
Pada ayam muda yang mengalami pullorum akan menunjukkan peradangan dan pendarahan pada hati, paru-paru dan ginjal. Demikian pula dengan sekum pada ayam muda ini akan mengalami nekrosis pada mukosa dan submukosa dengan akumulasi nekrosis debris dengan campuran fibrin dan heterofil dalam lumen (Shivaprasad 1997). Perubahan yang terjadi pada kasus fowl paratyphoid adalah adanya pendarahan dan infiltrasi heterofil pada berbagai jaringan seperti hati, limpa, ginjal, usus dan paru-paru (Tabbu 2000).
[image:37.612.130.520.278.580.2]Mekanisme infeksi Salmonella di dalam usus dapat dilihat pada Gambar 5.
dihambat pertumbuhannya oleh sel-sel limfosit, namun jika sel-sel limfosit tidak dapat menghambat pertumbuhan Salmonella maka Salmonella ini akan masuk ke dalam pembuluh darah.
Organ Vital dan Usus Halus
Organ Vital
Organ vital ayam terdiri dari hati, empedu, limpa, jantung, dan bursa fabrisius (North dan Bell 1990). Hati merupakan organ yang berperan dalam sekresi empedu, metabolisme lemak, karbohidrat, zat besi, fungsi detoksifikasi serta berperan dalam metabolisme dan penyerapan vitamin (Ressang 1984). Gejala-gejala klinis pada jaringan hati tidak selalu dapat ditemui, karena hati memiliki kemampuan yang sangat tinggi dalam regenerasi jaringan hati. Persentase hati ayam berkisar antara 1.7–2.8 % dari berat hidup (Putnam 1991).
Limpa merupakan organ tubuh komplek dengan banyak fungsi. Fungsi limpa yang utama adalah sebagai penyaring darah dan penyimpanan zat besi untuk dimanfaatkan kembali dalam sintesis hemoglobin (Dellman dan Brown 1989). Selain menyimpan darah, limpa bersama hati dan sumsum tulang berperan dalam pembinasaan eritrosit-eritrosit tua dan ikut serta dalam metabolisme sel limfosit yang berhubungan dengan pembentukan antibodi (Ressang 1984). Ukuran limpa bervariasi dari waktu ke waktu tergantung banyaknya darah di dalam tubuh. Persentase berat limpa ayam normal berkisar antara 0.18–0.23 % dari bobot hidup (Putnam 1991).
Pada unggas terdapat dua saluran empedu yang berfungsi untuk menyalurkan isi empedu dari hati ke usus. Fungsi utama empedu adalah mensekresikan kolesterol dan emulsi lemak dengan bantuan asam-asam empedu yang disekresikan oleh hati (Ressang 1984).
Usus Halus
aliran pakan dalam usus juga untuk meningkatkan penyerapan sari makanan (Akoso 1993).
Pada usus halus terjadi gerakan peristaltik yang berperan mencampur digesta dengan cairan pankreas dan empedu. Usus halus bagian kripta lieberkuhn menghasilkan enzim amilase, protease, dan lipase yang berfungsi memecah zat makanan menjadi bentuk yang lebih sederhana sehingga dapat diserap tubuh (Moran 1985), selain itu usus halus juga melaksanakan pencernaan kimiawi serta memegang peranan penting dalam transfer material nutrisi dari lumen ke dalam pembuluh darah dan limfe.
Peristiwa pencernaan serta penyerapan dalam usus halus ditunjang oleh bentuk-bentuk khusus. Efisiensi penyerapan dapat ditingkatkan oleh tiga bentuk khusus yang memperluas areal penyerapan terhadap isi usus: (1) dua pertiga bagian depan usus halus memiliki plika sirkularis yang menjulur kearah lumen setinggi dua pertiganya. Pada ruminansia, lipatan ini bersifat permanen, tetapi pada hampir semua hewan piaraan lain tampak pada usus yang sedang istirahat (kosong) dan hilang bila usus mengembang. (2) permukaan selaput lendir menunjukkan penjuluran berbentuk jari yang disebut vili. Tinggi vili ini bervariasi (1.5–1.0 µm), tergantung pada daerah serta jenis hewannya. Pada karnivora, vili langsing dan panjang, sedang pada sapi vili pendek dan lebar. (3) permukaan penyebaran ditingkatkan oleh mikrovili. Mikrovili merupakan penjuluran sitoplasma pada permukaan bebas epitel vili (Dellmann dan Brown 1992).
Permukaan bagian dalam dari usus halus adalah membran mukosa yang terdiri dari sel epitel kolumnar, beberapa diantaranya akan mengalami modifikasi dan membentuk sel goblet guna produksi mukosa. Luar permukaan membran mukosa yang menyelimuti usus halus meningkat oleh adanya vili yang berguna untuk absorpsi zat makanan (Frandson 1996). Dalam keadaan normal selaput lendir usus terlapisi oleh isi usus yang bercampur dengan getah usus, getah pankreas, empedu, lendir usus dan flora kuman-kuman.
dalam usus menyebabkan banyak perubahan anatomis. Umumnya usus halus ayam yang mengandung flora bakteria yang normal lebih panjang dan lebih berat dari pada usus halus ayam yang bebas dari flora bakteri (Wahju 1997). Keberadaan mikroflora dalam usus ini juga didukung dengan kondisi pH usus broiler yang memang cenderung netral, seperti yang terlihat pada Gambar 6. Sehingga sangat mendukung perkembangan berbagai jenis mikroba di dalam usus halus.
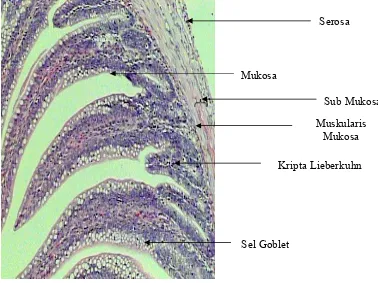
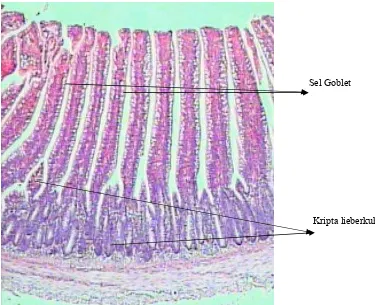
Kripta Lieberkuhn Serosa
Mukosa
Sub Mukosa Muskularis
Mukosa
Sel Goblet
[image:41.612.132.510.210.493.2]Vili hanya terdapat pada usus halus yang berfungsi untuk memperluas permukaan penyerapan, sedang mekanisme penyerapan dilakukan oleh sel-sel penyerap. Resorpsi lemak ditampung dalam pembuluh limfa dan sisanya dalam pembuluh darah.Vili merupakan penjuluran selaput lendir yang menjorok ke dalam lumen usus halus. Pada tiap vili terdapat 3 unsur, yaitu pembuluh limfa, pembuluh darah dan syaraf (Hartono 1982).
Gambar 7. Gambaran mikroskopis usus halus normal broiler
Sel goblet melekat dan tersebar secara tidak teratur diantara sel penyerap. Sel goblet akan mengeluarkan mukus yang berfungsi untuk mengusir bakteri patogen yang masuk ke dalam usus. Sel goblet akan semakin banyak jumlahnya di dalam usus halus bagian belakang (Hartono 1982).
Kripta lieberkuhn terdapat di dalam tunika propia mulai dari duodenum sampai anus. Kripta lieberkuhn menghasilkan lendir (mukus) dan beberapa enzim yang memecah peptida, lemak dan hidrat arang (Hartono 1982).
MATERI DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan selama 6 bulan di Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB, Laboratorium Histopatologi FKH IPB, Kandang Fakultas Peternakan IPB. Pemeliharaan ayam dilakukan selama 6 minggu yaitu pada tanggal 11 Oktober – 15 November 2006.
Materi
Ternak
Pada penelitian ini digunakan 168 ekor broiler strain Lohman yang dipelihara sejak umur sehari (Day Old Chick) sampai umur 6 minggu dengan rata-rata bobot DOC adalah 41.76 gram. DOC diperoleh dari poultry shop Bogor. Kandang dan Perlengkapan
Kandang yang digunakan adalah kandang litter sebanyak 21 petak berukuran 1 m x 1 m untuk diisi 10 ekor ayam. Setiap petak dilengkapi dengan tempat pakan dan tempat minum. Peralatan lain yang digunakan adalah timbangan, plastik ransum, tong, karet, nomor sayap dan ember.
Ransum
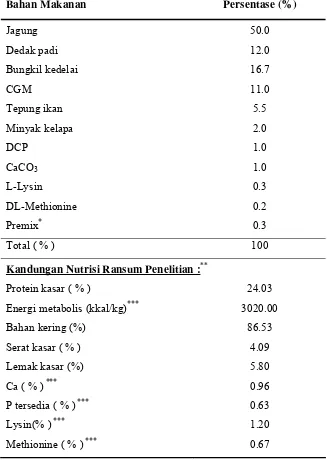
Ransum yang digunakan adalah ransum kering komplit dan ransum silase baik yang diberi perlakuan uji tantang Salmonella ataupun tanpa uji tantang. Ransum yang digunakan tersusun atas : jagung, dedak padi, bungkil kedelai, CGM, tepung ikan, minyak kelapa, CaCO3, DCP, L-Lysin, DL-Methionine dan
premix. Ransum disusun atas rekomendasi Scott et al. (1982). Adapun susunan dan kandungan nutrisi ransum basal yang digunakan dalam penelitian ini dapat dilihat pada Tabel 2.
Bakteri dan Additive
IPB. Additive yang digunakan adalah antibiotika jenis Bambermicin sebesar 0.02 ppm.
Tabel 2. Susunan dan kandungan zat makanan dalam ransum penelitian
Bahan Makanan Persentase (%)
Jagung 50.0
Dedak padi 12.0
Bungkil kedelai 16.7
CGM 11.0
Tepung ikan 5.5
Minyak kelapa 2.0
DCP 1.0
CaCO3 1.0
L-Lysin 0.3 DL-Methionine 0.2
Premix* 0.3
Total ( % ) 100
Kandungan Nutrisi Ransum Penelitian :**
Protein kasar ( % ) 24.03
Energi metabolis (kkal/kg)*** 3020.00
Bahan kering (%) 86.53
Serat kasar ( % ) 4.09
Lemak kasar (%) 5.80
Ca ( % ) *** 0.96
P tersedia ( % ) *** 0.63
Lysin(% ) *** 1.20
Methionine ( % ) *** 0.67
* Dalam 1 kg premix mengandung Vit A 4000.000 IU, Vit D3 800.000 IU, Vit E 4.500 mg, Vit K3 450 mg, Vit B1 450 mg, Vit B2 1.350 mg, Vit B6 480 mg, Vit B12 6 mg, Ca-d-P 2.400 mg, As folat 270 mg, As nikotinat 7.200 mg, kolin klorida 28.000 mg, DL-Met 28.000 mg, L-Lys 50.000mg, Fe 8.500 mg, Cu 700 mg, Mg 18.500 mg, Zn 14.000 mg, Co 50 mg, I 70 mg, Se 35 mg, dan antioksidan.
Vitamin dan Vaksin
Vitamin yang digunakan adalah Vita Stress, sedangkan vaksin yang digunakan adalah vaksin ND l (Newcastle Disease) diberikan pada ayam umur 3 hari yaitu melalui tetes mata, ND ll (Newcastle Disease) diberikan pada ayam umur 21 hari dengan cara suntik, dan vaksin Gumboro digunakan pada saat ayam berumur 10 hari secara oral.
Metode Penelitian
Rancangan Percobaan dan Analisis Data
Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap dengan menggunakan 168 ekor broiler yang dibagi dalam 21 petak kemudian diberi salah satu dari 7 macam perlakuan ransum. Perlakuan ransum tersebut yaitu:
S1 = Ransum silase B1 = Ransum basal
L1 = Ransum basal + L. plantarum S2 = S1 + infeksi Salmonella typhimurium B2 = B1 + infeksi Salmonella typhimurium L2 = L1 + infeksi Salmonella typhimurium
A = B1 + antibiotik + infeksi Salmonella typhimurium
Model matematik yang digunakan dari rancangan percobaan ini adalah sebagai berikut (Steel dan Torrie 1991) :
Keterangan :
Yij = pengaruh percobaan pada perlakuan ke-i dan ulangan ke-j
µ = rataan umum
τi = pengaruh perlakuan ke-i
εij = galat percobaan pada pelakuan ke-i dan ulangan ke-j
Data yang diperoleh dianalisa dengan sidik ragam (Analysis of Variance / ANOVA) dan jika berbeda nyata diuji dengan menggunakan uji Kontras
Orthogonal. Data untuk tingkat kerusakan pada usus halus diolah dengan menggunakan Kruskal-Wallis.
Pembuatan Ransum Silase Komplit
Ransum silase berkadar air 40% dibuat dari ransum basal dengan menambahkan air dan bakteri Lactobacillus plantarum kemudian disimpan dalam kantong plastik kedap udara berukuran 5 kg, selanjutnya disimpan di dalam tong selama 6 minggu (Gambar 8). Untuk setiap pembuatan 100 kg ransum silase berkadar air 40% dibutuhkan starter bakteri Lactobacillus plantarum sebanyak 2 x 106 CFU/gram yang telah dilarutkan dalam air sebanyak 117.5 liter.
Gambar 8. Proses pembuatan ransum silase komplit
Pada penyimpanan minggu ke-3 dan minggu ke-6, dilakukan pengamatan terhadap kandungan nutrient, energi, pH dan bahan kering ransum yang bertujuan untuk melihat kualitas silase ransum.
Air +Lactobacillus plantarum
Ransum
Ransum basal + LP
Kemas di dalam kantong plastik dan tutup rapat
Simpan dalam tong selama 6 minggu
Silase Ransum Komplit
Uji Tantang
Infeksi Salmonella dilakukan pada broiler umur 7 hari secara oral. Jenis Salmonella yang digunakan adalah Salmonella typhimurium ganas dari biakan cair ≈ 1 x 107 CFU untuk tiap ekor ayam.
Analisis Kimia dan Histopatologi
Kualitas Silase
pH silase diukur dengan menggunakan pH meter (Oakton). Kadar air dan abu masing-masing diukur dengan menggunakan oven dan tanur (AOAC 1984). Penghitungan koloni BAL dilakukan dengan metode Total Plate Count (Capucino 2000).
Jumlah Koloni Salmonella
Uji tantang terhadap Salmonella typhimurium pada ayam dilakukan secara oral pada saat ayam berumur 7 hari. Jumlah koloni Salmonella typhimurium yang diberikan ini sebanyak 108 CFU (Leeuwen et al. 2004). Pengamatan terhadap jumlah koloni Salmonella typhimurium dilakukan pada hari ke 9, 18, dan 35 setelah dilakukan uji tantang, yaitu pada saat broiler berumur 16, 25 dan 31 hari. Setiap pengamatan menggunakan 1 ekor ayam yang diambil secara acak. Sampel yang diperoleh dilakukan prekultur terlebih dahulu dengan menginkubasi sampel (isi usus halus) pada 10 ml Triypticase Soy Broth pada suhu 37oC selama 24 jam. Selanjutnya diambil sampel sebanyak 0.1 ml dan dilakukan kultur pada cawan dengan menggunakan media agar deoxycholate hydrogensulfida lactose (DHL) dan diinkubasi pada suhu 37oC selama 24 jam. Identifikasi terhadap Salmonella pada media agar DHL dilakukan dengan uji aglutinasi dengan antiserum terhadap Salmonella typhimurium.
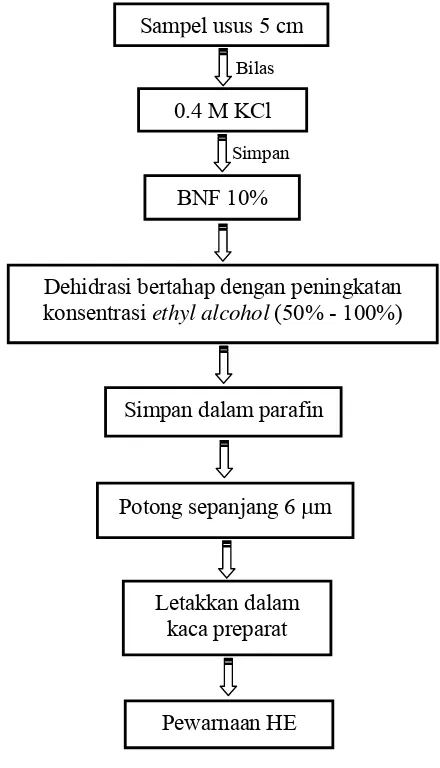
Pengamatan Histopatologi Usus Halus
membersihkan isinya, kelebihan lemak yang terdapat di usus diambil dan kelebihan air pada sampel akan dikeringkan dengan tissue. Sampel usus dengan panjang 5 cm diambil dari bagian usus (illeum). Semua sampel tersebut pertama dibilas dengan larutan 0.4 M KCl dan kemudian disimpan dalan larutan buffer neutral formaline (BNF) 10% (pada pH 7.2 – 7.4). Semua sampel secara bertahap didehidrasi dengan peningkatan konsentrasi ethyl alcohol (50% - 100%). Sampel pertama ini disimpan dalam parafin dan dipotong sepanjang 6 μm dengan menggunakan mikrotom, kemudian dilakukan pewarnaan dengan hematoxylin dan eosin (prosedur teknis proses pewarnaan tercantum pada Lampiran 1).
Gambar 9. Proses pembuatan sediaan preparat histopatologi usus halus BNF 10%
0.4 M KCl Sampel usus 5 cm
Dehidrasi bertahap dengan peningkatan konsentrasi ethyl alcohol (50% - 100%)
Simpan dalam parafin
Potong sepanjang 6 μm
Pewarnaan HE Letakkan dalam
kaca preparat
Bilas
Peubah yang Diamati
Peubah yang diamati dalam penelitian ini meliputi :
1. Koloni bakteri asam laktat (BAL) dan pH silase pada minggu ke 0, 3 dan 6.
2. Kualitas silase ransum dan ransum kering yang disimpan pada minggu ke 0 dan 6.
3. Penampilan umum ternak (konsumsi ransum, pertambahan bobot badan, bobot badan akhir dan konversi ransum).
4. Persentase bobot hati, empedu dan limpa terhadap bobot tubuh. 5. Jumlah koloni Salmonellathypimurium di dalam sekum. 6. Histopatologi usus halus bagian ileum.
Prosedur Pelaksanaan
Persiapan kandang dan ayam dilakukan dua minggu sebelum penelitian dilaksanakan. Jumlah ayam yang digunakan pada penelitian ini adalah sejumlah seratus enam puluh delapan ekor DOC yang dipelihara sejak hari pertama. Ransum penelitian dan air minum diberikan ad libitum. Ransum perlakuan yang terdiri atas S1, B1, L1, S2, B2, L2 dan A diberikan pada broiler umur 7 hari. Tempat pakan dan tempat air minum diletakkan di atas sekam di dalam kandang sekat.
Tiap unit kandang dilengkapi dengan lampu sebesar 100 watt yang berfungsi sebagai penghangat tubuh DOC. Tempat pakan dan tempat air minum digantung sejajar dengan punggung ayam agar pakan dan air minum tidak mudah kotor oleh ekskreta ataupun sekam. Kontrol kebersihan kandang, tempat minum dan pakan dilakukan setiap hari. Selama penelitian dilakukan, suhu dan kelembaban udara pada ruang kandang akan tetap diperhatikan.
HASIL DAN PEMBAHASAN
Kualitas Ransum
Silase Ransum
Jumlah koloni bakteri asam laktat (BAL) dan pH silase pada penelitian ini dapat dilihat pada Tabel 3. Kualitas silase dicapai ketika asam laktat dominan diproduksi dan menunjukkan terjadinya penurunan pH yang cepat, karena semakin cepat pH turun maka akan semakin banyak nutrisi yang dapat dipertahankan (Schroeder 2004).
Tabel 3. Koloni bakteri asam laktat (BAL) dan pH silase pada minggu ke 0, 3 dan 6.
Peubah Minggu ke-0 Minggu ke-3 Minggu ke-6
Koloni BAL (CFU/g)1 2 x 106 6.55 x 108 9.16 x 108
pH 6.75 4.88 4.28
1.Hasil analisa Laboratorium Bioteknologi Lembaga Ilmu Pengetahuan Indonesia (LIPI),
Cibinong-Bogor (2006).
Jumlah koloni bakteri asam laktat (BAL) dan pH silase pada minggu ke-3 dan ke-6 tidak banyak terjadi perubahan. Namun jika dibandingkan dengan kontrol (minggu ke-0), jumlah koloni BAL silase menjadi meningkat pada minggu ke-3 dan minggu ke-6 masing-masing dari 2 x 106 CFU/g menjadi 6.55 x 108 CFU/g dan 9.16 x 108 CFU/g. Kualitas silase yang dihasilkan pada penelitian ini sangat baik yang ditandai dengan adanya jumlah koloni BAL sebesar 9.16 x 108 CFU/g dengan pH 4.28. Jumlah ini sesuai dengan yang dikatakan Lien et al. (2005) bahwa kandungan Lactobacillus plantarum sebesar 1.05 x 108 CFU/g silase dapat menghasilkan kualitas silase yang sangat baik karena dapat menurunkan pH dari 7 menjadi 4.05 pada saat ensilase umur 3 hari.
seperti hidroksi peroksida dan asam-asam organik seperti asam laktat (Lopez 2000). Asam laktat yang dihasilkan tersebut berperan dalam penurunan pH.
Dalam pembuatan silase, peningkatan jumlah koloni BAL akan diikuti dengan penurunan pH seiring dengan fase-fase yang terjadi selama ensilase. Penurunan pH silase di minggu ke-3 (dari 6.75 menjadi 4.88) pada penelitian ini menunjukkan bahwa penyimpanan pada minggu ke-3 berada dalam fase ke-2 fermentasi. Di dalam fase ini akan terbentuk produksi asam asetat, asam laktat dan etanol oleh bakteri asam asetat dan asam laktat dengan pH yang dicapai adalah 5 (Schroeder 2004). Kondisi stabil pembuatan silase pada penelitian ini dicapai setelah penyimpanan 6 minggu dengan pH sebesar 4.28. Minggu ke-6 ini berada pada fase 4 yaitu merupakan fase stabil penyimpanan yang didominasi oleh BAL dengan pH 3.5-4.5 dan dapat disimpan dalam waktu lama jika disimpan dalam silo kedap udara. Namun jika terdapat udara yang masuk ke dalam silo maka jamur dapat tumbuh dengan baik dan hal tersebut dapat merusak kualitas silase (Kunkle et al. 2000).
Kualitas Silase Ransum dan Ransum Kering selama Penyimpanan
Kualitas silase ransum dan ransum kering setelah disimpan selama 6 minggu disajikan pada tabel 4.
Tabel 4. Kualitas silase ransum dan ransum kering yang disimpan pada minggu ke 0 dan 6
Minggu ke-0 Minggu ke-6
Kandungan zat
makanan* Silase Ransum
kering
Silase Ransum kering
Bahan kering (%) 60.00 86.53 59.38 83.62
Bahan organik (%BK) 86.85 80.52 86.89 75.73 Protein kasar (%BK) 24.12 24.03 24.08 22.19
* Hasil analisa Laboratorium Ilmu dan Teknologi Pakan, Fakultas Peternakan, IPB (2006).
kadar air disebabkan oleh adanya kegiatan respirasi pada fase aerob yang berlangsung selama proses awal ensilase. Sapienza (1993) melaporkan bahwa secara garis besar pembuatan silase terdiri dari 4 fase, yaitu : 1. fase aerob, 2. fase fermentasi, 3. fase stabil dan 4. fase pengeluaran untuk diberikan pada ternak. Terjadinya peningkatan bahan organik silase pada minggu ke-6 sampai 0.04% diduga karena terbentuknya asam laktat dan asam organik serta produk sekunder lainnya selama ensilase berlangsung. Penurunan protein silase ransum sebesar 0.16% masih dapat ditolerir. Bahan kering, bahan organik dan protein yang terkandung dalam ransum kering yang disimpan telah mengalami penurunan pada minggu ke-6 masing-masing sebesar 3.36%, 5.95% dan 7.65%. Penurunan ketiga kandungan zat makanan pada ransum kering tersebut memudahkan terjadinya penurunan kualitas pakan.
Jika diamati secara keseluruhan, maka kualitas silase ransum lebih baik jika dibandingkan dengan ransum kering selama penyimpanan 6 minggu, karena penyusutan zat makanan pada silase ransum lebih kecil persentasenya jika dibandingkan dengan penyusutan zat makanan yang terjadi pada ransum kering.
Performan Broiler yang Diberi Ransum Perlakuan dan Ditantang Salmonella typhimurium
Performan broiler selama 6 minggu pemeliharaan yang dihasilkan dalam penelitian ini dapat dilihat pada Tabel 5.
Tabel 5. Rata-rata konsumsi pakan, pertambahan bobot badan (PBB), bobot badan akhir (BBA) dan konversi ransum broiler 6 minggu
Peubah Perlakuan Konsumsi
(g/ekor) PBB (g/ekor) BBA (g/ekor) Konversi Ransum S11) 2090.74 ± 55.40 1060.46 ± 3.52a 1356.3 ± 108.5a2) 1.97 ± 0.08a3)
B1 2165.60 ± 60.15 1114.26 ± 10.06a 1452.3 ± 99.3a 1.95 ± 0.08a L1 2041.70 ± 46.80 1001.01 ± 6.14b 1211.0 ± 97.2b 2.04 ± 0.12b S2 2119.11 ± 23.61 900.69 ± 23.00d 1109.5 ± 13.0b 2.35 ± 0.02c B2 2182.00 ± 116.96 1000.23 ± 10.67b 1444.7 ± 30.3a 2.18 ± 0.05b L2 2076.19 ± 175.50 972.24 ± 2.26c 1315.4 ±105.4a 2.14 ± 0.20b A 2166.46 ± 100.45 961.87 ± 11.09c 1279.6 ± 93.7a 2.25 ± 0.06b
1. Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.
Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi
Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 +
antibiotik + infeksi Salmonella typhi.)
2. Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0.05)
3. Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0.01)
Konsumsi
Perlakuan tidak nyata mempengaruhi konsumsi broiler yang dipelihara selama 6 minggu. Hal ini menunjukkan bahwa infeksi Salmonella tidak mempengaruhi jumlah konsumsi, meskipun broiler telah terinfeksi Salmonella yang ditandai dengan adanya Pullorum (berak kapur) yaitu penyakit yang disebabkan oleh bakteri Salmonella. Sesuai dengan yang dikemukakan oleh Shivaprasad (1997) bahwa broiler yang terserang bakteri Salmonella akan mengalami pullorum dan akan menunjukkan peradangan pada hati, paru-paru dan ginjal.
menyebabkan kondisi dimana laju kecepatan untuk memperbaiki sel-sel yang rusak menjadi lebih cepat dibandingkan dengan peluruhan sel-sel akibat Salmonella. Selain itu broiler diduga telah terinfeksi oleh bakteri Salmonella sejak broiler berada di kawasan penetasan, yang menyebabkan tingkat resistensi broiler terhadap bakteri patogen sangat besar.
Pertambahan Bobot Badan (PBB)
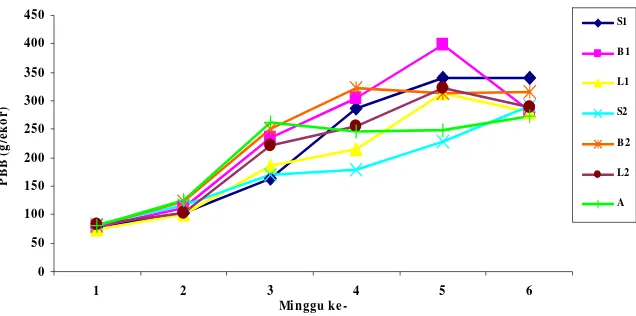
Pertambahan bobot badan (PBB) pada perlakuan S2 nyata (P<0.01) lebih rendah dibanding dengan perlakuan S1, B1, L1, B2, L2 dan A. Grafik pergerakan PBB dari minggu pertama sampai minggu ke enam disajikan pada Gambar 10.
Perlakuan S1 dan B1 memiliki PBB yang sama, hal ini menunjukkan bahwa pada dasarnya pemberian ransum dalam bentuk silase tidak memberikan pengaruh negatif terhadap performan broiler.
Perlakuan S2 memiliki rata-rata PPB yang paling rendah yaitu 900.69 g/ekor, namun peningkatan PBB jelas terlihat pada perlakuan S2 (ayam diberi silase ransum dan diinfeksi Salmonella) sejak minggu ke-4. Bahan aktif yang dihasilkan dalam silase diduga mampu merespon kehadiran Salmonella, sehingga bahan aktif tersebut yang seharusnya dipakai untuk memacu pertumbuhan telah digunakan untuk menetralisir keberadaan racun (Salmonella) dalam tubuh, fenomena ini terjadi sejak awal pemeliharaan sampai minggu ke-4 dan pada saat memasuki minggu ke-5 pemeliharaan, bahan aktif tersebut mulai dapat digunakan sebagai pemicu pertumbuhan. Sebaliknya yang terjadi pada perlakuan L1, B2, L2 dan A, penurunan bobot badan mulai terlihat sejak minggu ke-5. Hal ini mengindikasikan bahwa perlakuan L1, B2, L2 dan A tidak mampu menetralisir keberdaan Salmonella sehingga mengakibatkan penurunan bobot badan.
0
50
100
150
200
250
300
350
400
450
1
2
3
4
5
6
Minggu ke
-P
BB (
g
/e
k
o
r
)
S1
B 1
L1
S2
B 2
L2
A
[image:55.792.81.717.83.399.2]Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L. Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 + antibiotik+infeksi Salmonella typhi.)
Bobot Badan Akhir (BBA)
Bobot badan akhir yang dihasilkan dalam penelitian ini berkisar antara 1109.50–1452.30 gram/ekor. Bobot badan akhir yang dihasilkan dalam setiap pemeliharaan broiler, selain dipengaruhi oleh konsumsi juga dipengaruhi oleh sirkulasi udara dan suhu di sekitar kawasan pemeliharaan serta kepadatan kandang.
Bobot badan akhir pada perlakuan S1, B1, B2, L2 dan A nyata (P<0.05) lebih tinggi dibanding dengan perlakuan L1 dan S2. Bobot badan akhir yang sama pada perlakuan S1 dan B1 mengindikasikan bahwa ransum silase dapat diterima oleh ayam tanpa mempengaruhi bobot badan yang dihasilkan. Selain itu, ransum silase memiliki beberapa kelebihan yaitu : ransum dapat disimpan lebih lama, persiapan lebih mudah karena bahan baku yang akan dijadikan silase tidak harus melewati masa pengeringan sehingga biaya pembuatan ransum juga dapat ditekan. Bobot badan akhir perlakuan silase yang diinfeksi Salmonella (S2) nyata (P<0.05) lebih rendah dibanding perlakuan B2, L2 dan A. Salmonella diduga menjadi salah satu penyebab, nutrisi dalam pakan silase yang seharusnya digunakan untuk menghasilkan bobot badan terlebih dahulu digunakan untuk merespon kehadiran Salmonella dengan cara menetralisir keberadaan Salmonella dalam usus halus. Namun kondisi tersebut masih perlu dikaji lebih lanjut, mengingat pada perlakuan S2 tidak ditemukan jumlah koloni Salmonella di dalam sekum ayam pada umur 31 hari (Tabel 7). Jumlah koloni Salmonella banyak ditemukan pada perlakuan L2, B2 dan A pada saat ayam berumur 31 hari.
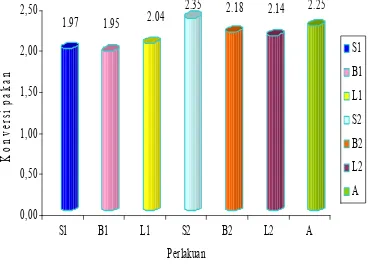
Konversi Ransum
1.97
1.95
2.04
2.35
2.18
2.14
2.25
0,00
0,50
1,00
1,50
2,00
2,50
K
o
nve
rs
i
p
ak
an
S1
B1
L1
S2
B2
L2
A
Perlakuan
S1
B1
L1
S2
B2
L2
A
Tidak terjadi perbedaan konversi ransum antara perlakuan S1 (broiler yang diberi pakan ransum silase) dengan perlakuan B1 (broiler yang diberi pakan ransum basal). Hal ini menunjukkan bahwa ransum silase efisien digunakan sebagai pakan tanpa memberikan pengaruh negatif terhadap tingkat konversi ransum broiler.Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.
Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 +
infeksi Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.),
[image:57.612.136.505.181.446.2]A (B1 + antibiotik + infeksi Salmonella typhi.)
Gambar 11. Konversi ransum broiler yang dipelihara selama 6 minggu
konversi ransum lebih tinggi jika dibandingkan dengan perlakuan lain. Namun jika dikaji lebih lanjut mengenai konversi ransum broiler pada 3 minggu pertama pemeliharaan (Tabel 6), maka terlihat adanya perbedaan konversi ransum broiler pada minggu ke 0-3 dibandingkan dengan konversi ransum broiler pada minggu ke 4-6.
Tabel 6. Rata-rata konversi ransum broiler umur 0-3 minggu dan 4 – 6 minggu Konversi ransum
Perlakuan
0-3 minggu 4-6 minggu S11) 1.45 + 1.10 1.98 + 0.31a2)
B1 1.16 + 0.27 1.99 + 0.35 a
L1 1.44 + 0.49 2.11 + 0.09 b
S2 1.62 + 1.26 2.04 + 0.38 a
B2 1.32 + 0.26 2.33 + 0.11 b
L2 1.36 + 0.34 2.28 + 0.42 b
A 1.42 + 0.36 2.52 + 0.21 b
1. Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.
Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi
Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 +
antibiotik + infeksi Salmonella typhi.)
2. Superskrip yang berbeda pada kolom yang sama menunjukkan berbeda nyata (P<0.05)
Pada Tabel 6 terlihat bahwa konversi ransum untuk perlakuan S2 pada minggu ke 4-6 tidak berbeda nyata dengan perlakuan S1 dan B1. Fenomena ini sesuai dengan yang terjadi pada Gambar 10 yang menggambarkan bahwa PBB pada minggu ke 4-6 untuk perlakuan S2 menunjukkan peningkatan yang cukup signifikan jika dibandingkan dengan PBB pada minggu ke 0-3.
diperoleh nyata (P<0.05) lebih rendah dibandingkan dengan perlakuan L1, B2, L2 dan A (Tabel6). Implikasi dari hal ini menunjukkan bahwa pemakaian silase akan lebih baik jika diberikan pada broiler umur 3 minggu ke atas.
Pada Tabel 6 juga terlihat bahwa semakin lama pemeliharaan maka konversi ransum yang dihasilkan khususnya pada perlakuan L1, B2, L2 dan A menunjukkan adanya peningkatan yang lebih besar dibandingkan dengan perlakuan S1, B1 dan S2. Diduga adanya infeksi Salmonella menjadi salah satu penyebabnya.
Berbeda dengan perlakuan S2, perlakuan L1, B2, L2 dan A tidak dapat menghambat perkembangan Salmonella di dalam tubuhnya. Hal ini sesuai dengan pengamatan jumlah koloni bakteri Salmonella di dalam sekum (Tabel 7) yang menunjukkan bahwa semakin lama pemeliharaan maka jumlah koloni Salmonella di dalam sekum pada perlakuan L1, B2, L2 dan A juga semakin meningkat, sedangkan pada perlakuan S2 tidak ditemukan adanya koloni Salmonella di dalam sekum broiler sampai hari terakhir pengamatan.
Organ Dalam Broiler
Perlakuan berupa jenis pakan yang berbeda dan infeksi Salmonella tidak nyata mempengaruhi persentase hati, namun nyata (P<0.05) mempengaruhi persentase empedu dan limpa.
Hati
Hati merupakan organ yang berperan dalam sekresi empedu, metabolisme lemak, karbohidrat, zat besi, fungsi detoksifikasi serta berperan dalam metabolisme dan penyerapan vitamin. Gejala-gejala klinis pada jaringan hati tidak selalu dapat ditemui, karena hati memiliki kemampuan yang sangat tinggi dalam regenerasi jaringan hati (Ressang 1984).
2.19
2.57
2.57
2.37
2.64
2.57
2.52
0,00
0,50
1,00
1,50
2,00
2,50
3,00
P
e
rs
e
n
ta
se
(%
)
S1
B1
L1
S2
B2
L2
A
Perlakuan
S1
B1
L1
S2
B2
L2
A
kembali secara sempurna (North dan Bell 1990). Demikian juga halnya yang terjadi pada penelitian ini.Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.
Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 + infeksi
Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A (B1 +
antibiotik + infeksi Salmonella typhi.)
Gambar 12. Persentase hati broiler yang dipelihara selama 6 minggu
Empedu
Berbeda dengan hati, persentase empedu nyata (P<0.05) dipengaruhi oleh perlakuan. Empedu dalam sistem organ berperan dalam mensekresikan cairan asam empedu dan garam empedu yang digunakan dalam metabolisme hati. Persentase bobot empedu yang dihasilkan dalam penelitian ini berkisar antara 0.08% – 0.71% dari bobot hidup broiler.
0.70
0.62
0.71
0.16
0.09
0.08
0.09
0,00
0,10
0,20
0,30
0,40
0,50
0,60
0,70
0,80
P
ers
en
ta
se
(%
)
S1
B1
L1
S2
B2
L2
A
Perlakuan
S1
B1
L1
S2
B2
L2
A
yang ada di dalamnya tidak dapat terdeposit lama di dalam empedu (Wahju 1997). Sesuai dengan fungsinya, empedu merupakan alat eksresi kolesterol yang disekresikan ke hati dengan bantuan asam-asam empedu yang dikeluarkan oleh hati (Ressang 1984).Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.
Plantarum), S2 (S1 + infeksi Salmonella typhi.), B2 (B1 +
infeksi Salmonella typhi.), L2 (L1 + infeksi Salmonella typhi.), A
(B1 + antibiotik + infeksi Salmonella typhi.)
Gambar 13. Persentase empedu broiler yang dipelihara selama 6 minggu
Limpa
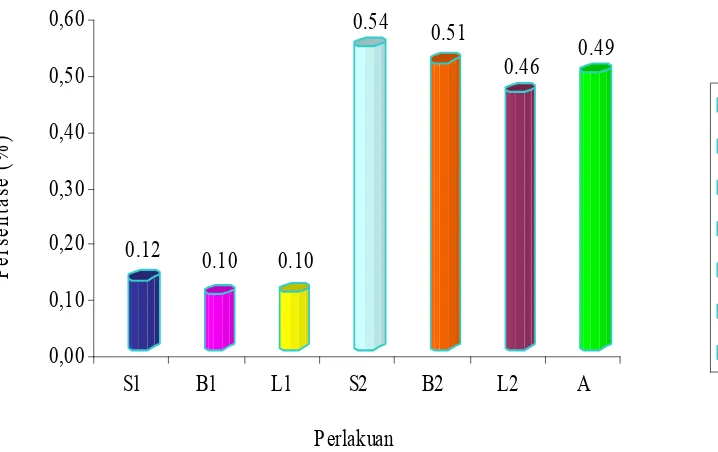
0.12 0.10 0.10 0.54 0.51 0.46 0.49 0,00 0,10 0,20 0,30 0,40 0,50 0,60 Pers en ta se (% )
S1 B1 L1 S2 B2 L2 A
Perlakuan S1 B1 L1 S2 B2 L2 A
Keterangan : S1 (Ransum silase), B1 (Ransum basal), L1 (Ransum basal + L.