PENGARUH pH DAN PENGGOYANGAN MEDIA
TERHADAP PERTUMBUHAN
Botryodiplodia
sp. DAN UJI
PATOGENISITAS
Botryodiplodia
sp. PADA BIBIT JABON
PUTRI ARSHINTA
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh pH dan Penggoyangan Media terhadap Pertumbuhan Botryodiplodia sp. dan Uji Patogenisitas Botryodiplodia sp. pada Bibit Jabon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juni 2013
Putri Arshinta
ABSTRAK
PUTRI ARSHINTA. Pengaruh pH dan Penggoyangan Media terhadap Pertumbuhan Botryodiplodia sp. dan Uji Patogenisitas Botryodiplodia sp. pada Bibit Jabon. Dibimbing oleh ACHMAD.
Penyakit mati pucuk pada bibit jabon disebabkan oleh fungi patogen dari genus Botryodiplodia. Penelitian ini bertujuan mempelajari pengaruh pH dan tingkat penggoyangan media terhadap pertumbuhan Botryodiplodia sp., serta mempelajari kejadian penyakit dan tingkat keparahan penyakit mati pucuk pada bibit jabon. Hasil penelitian menunujukan pemberian pH, penggoyangan media dan uji patogenisitas memberikan pengaruh yang beragam terhadap pertumbuhan
Botryodiplodia sp. Pada media PDA (Potato Dextrose Agar) dan media PDB (Potato Dextrose Broth), Botryodiplodia sp. tumbuh pada kisaran pH 4-8. Pertumbuhan terbaik pada media PDA adalah pH 4 dan pada media PDB adalah pH 6. Bobot biomassa, tumbuh optimum pada media PDB dengan kecepatan penggoyangan 50 rpm. Seluruh tanaman dengan inokulasi patogen menunjukkan gejala penyakit. Tingkat keparahan tertinggi mencapai 61% yaitu pada bibit berumur 3 bulan. Bibit tanpa inokulasi patogen tidak menunjukkan adanya gejala penyakit hingga akhir pengamatan.
Kata kunci: Botryodiplodia sp., jabon, penggoyangan media, pH, uji patogenisitas
ABSTRACT
PUTRI ARSHINTA. The Influence of pH and Shaking Media On The Growth of
Botryodiplodia sp. and Pathogenicity Testing of Botryodiplodia sp. on Jabon Seedling. Supervised by ACHMAD.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
PENGARUH pH DAN PENGGOYANGAN MEDIA
TERHADAP PERTUMBUHAN
Botryodiplodia
sp. DAN UJI
PATOGENISITAS
Botryodiplodia
sp. PADA BIBIT JABON
PUTRI ARSHINTA
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh pH dan Penggoyangan Media terhadap Pertumbuhan
Botryodiplodia sp. dan Uji Patogenisitas Botryodilodia sp. pada Bibit Jabon
Nama : Putri Arshinta
NIM : E44080057
Disetujui oleh
Dr Ir Achmad, MS Pembimbing
Diketahui oleh
Prof Dr Ir Nurheni Wijayanto, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli sampai Desember 2012 ini ialah fungi, dengan judul Pengaruh pH dan Penggoyangan Media terhadap Pertumbuhan Botryodiplodia sp. dan Uji Patogenisitas Botryodilodia sp. pada Bibit Jabon.
Terima kasih penulis sampaikan kepada Bapak Dr Ir Achmnad, MS selaku dosen pembimbing, serta Ai Rosah S.Hut yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada para staf Laboratorium Patologi Departemen Silvikultur Fakultas Kehutanan IPB, Laboratorium Bioteknologi Kehutanan Pusat Antar Universitas (PAU) Bioteknologi IPB, Laboratorium Mikoriza Puslitbang Kehutanan Bogor, dan Laboratorium Mikologi Departemen Proteksi Tanaman Fakultas Pertanian IPB yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada papa, mama, dan seluruh keluarga serta teman-teman Silvikultur 45, khususnya Icha dan Imun, juga teman-teman Winning Eleven yang telah memberikan dorongan moril dan semangat kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 2
Hipotesis Penelitian 2
TINJAUAN PUSTAKA 2
Jabon (Anthocephalus cadamba Miq.) 2
Hama dan Penyakit Jabon 3
Patogenisitas 4
Botryodiplodia sp. 4
Sifat-sifat umum Botryodiplodia sp. 4
Taksonomi dan Morfologi Botryodiplodia sp. 4
Bioekologi dan Nilai Ekonomi 5
Gejala Penyakit dan Kisaran Inang 5
METODE PENELITIAN 6
Waktu dan Tempat Penelitian 6
Alat dan Bahan Penelitian 6
Metode Pelaksanaan Penelitian 7
Tahap Persiapan 7
Pembuatan media PDA (Potato Dextrose Agar) 7 Pembuatan media PDB (Potato Dextrose Broth) 7
Penyediaan isolat fungi patogen 7
Pemurnian dan peremajaan 7
Sterilisasi bahan, peralatan, dan ruang inokulasi 8
Penyediaan bibit 8
Tahap Pelaksanaan 8
Uji pertumbuhan in vitro diameter koloni Botryodiplodia sp.
pada media PDA dengan berbagai tingkatan pH 8 Uji pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan pH 9 Uji pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan penggoyangan 9
Uji patogenisitas 10
Analisis data 11
HASIL DAN PEMBAHASAN 12
Hasil 12
Pertumbuhan in vitro diameter koloni Botryodiplodia sp.
DAFTAR ISI
Pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan pH 13 Pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan penggoyangan 14 Patogenisitas Botryodiplodia sp. 15
Pembahasan 16
Pertumbuhan in vitro diameter koloni Botryodiplodia sp.
pada media PDA dengan berbagai tingkatan pH 16 Pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan pH 18 Pertumbuhan in vitro biomassa Botryodiplodia sp.
pada media PDB dengan berbagai tingkatan penggoyangan 18
Patogenisitas Botryodiplodia sp. 19
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 24
DAFTAR TABEL
1 Keparahan dan nilai numerik penyakit mati pucuk pada bibit jabon 10 2 Hasil uji Duncan pengaruh pemberian tingkatan pH terhadap
biomassa miselia Botryodiplodia sp. 14
3 Hasil uji Duncan pengaruh pemberian tingkatan shaker terhadap
biomassa miselia Botryodiplodia sp. 14
4 Hasil uji Duncan pengaruh inokulasi patogen terhadap
gejala penyakit 16
5 Hasil uji Duncan nilai keparahan penyakit mati pucuk pada
bibit jabon 16
DAFTAR GAMBAR
1 Pertumbuhan diameter koloni Botryodiplodia sp. pada media PDA
dengan berbagai tingkatan pH 12
2 Pertumbuhan miselium Botryodiplodia sp. pada media PDA 12 3 Pertumbuhan miselium Botryodiplodia sp. pada media PDA dengan
berbagai tingkatan pH setelah 3 hst 13
4 Konidia Botryodiplodia sp. 13
5 Miselia Botryodiplodia sp. pada media PDB dengan berbagai
tingkatan pH 14 6 Miselia Botryodiplodia sp. pada media PDB dengan
7 Gejala penyakit mati pucuk pada bibit jabon 15
DAFTAR LAMPIRAN
1 Komposisi media pertumbuhan Botryodiplodia sp. 24 2 Pertumbuhan diameter Botryodiplodia sp. pada media PDA
dengan berbagai tingkatan pH 24
3 Biomassa miselia Botryodiplodia sp. dengan perlakuan
pH kontrol (6.25) pada media PDB 24
4 Biomassa miselia Botryodiplodia sp. dengan perlakuan
pH 2 pada media PDB 25
5 Biomassa miselia Botryodiplodia sp. dengan perlakuan
pH 4 pada media PDB 25
6 Biomassa miselia Botryodiplodia sp. dengan perlakuan
pH 6 pada media PDB 25
7 Biomassa miselia Botryodiplodia sp. dengan perlakuan
pH 8 pada media PDB 25
8 Biomassa miselia Botryodiplodia sp. tanpa perlakuan
penggoyangan (0 rpm) pada media PDB 25 9 Biomassa miselia Botryodiplodia sp. dengan perlakuan
penggoyangan 50 rpm pada media PDB 25 10 Biomassa miselia Botryodiplodia sp. dengan perlakuan
penggoyangan 100 rpm pada media PDB 26 11 Biomassa miselia Botryodiplodia sp. dengan perlakuan
penggoyangan 150 rpm pada media PDB 26 12 Rekapitulasi bibit jabon yang terserang penyakit mati pucuk pada
akhir pengamatan 26
13 Tingkat keparahan mati pucuk pada bibit jabon
hingga akhir pengamatan 26
14 Perkembangan penyakit mati pucuk pada bibit jabon 27
1
PENDAHULUAN
Latar Belakang
Pembangunan hutan tanaman, baik Hutan Tanaman Industri (HTI) maupun hutan rakyat merupakan jawaban atas tuntutan pembangunan akibat berkurangnya hutan alam serta untuk meningkatkan produktivitas lahan dan kualitas lingkungan hidup. Pemilihan jenis pohon yang akan dikembangkan pada pembangunan HTI harus memperhatikan beberapa faktor, antara lain tidak memerlukan syarat-syarat tumbuh yang tinggi, cepat tumbuh dan dapat dimanfaatkan untuk industri olahan kayu yang memiliki pasar yang luas.
Jabon (Anthocephalus cadamba Miq.) merupakan salah satu jenis tumbuhan lokal Indonesia yang berpotensi untuk dikembangkan dalam pembangunan hutan tanaman maupun untuk tujuan lainnya, seperti reklamasi lahan bekas tambang, penghijauan dan pohon peneduh (Mansur dan Tuheteru 2010). Tanaman ini termasuk fast growing species, bahkan oleh pemerintah mulai diprogramkan untuk dikembangkan sebagai salah satu komoditas HTI yang menjanjikan.
Permintaan pasar yang tinggi dalam skala luas, menuntut ketersediaan bibit jabon yang berkualitas dalam jumlah yang cukup. Sejauh ini pertumbuhan jabon di lapangan tidak terlalu banyak gangguan, namun tidak demikian pada masa pembibitan di persemaian. Sebagaimana diketahui bahwa karakteristik semai pada umumnya rentan terhadap serangan patogen. Serangan patogen ini merupakan salah satu penyebab utama berkurangnya jumlah bibit dan menurunkan kualitas semai jabon.
Gejala yang terjadi pada bibit jabon yang terserang patogen, mula-mula daun menguning dan batang berwarna kecoklatan kemudian lama-kelamaan akan menjadi hitam. Setelah dilakukan pengamatan secara makroskopis dan mikroskopis, patogen yang teridentifikasi adalah berupa fungi dari genus
Botryodiplodia yang mengakibatkan penyakit mati pucuk pada bibit jabon.
Botryodiplodia sp. merupakan patogen yang memiliki kisaran inang yang luas. Patogen ini merupakan parasit lemah yang melakukan infeksinya melalui luka-luka mekanis seperti akibat pemangkasan atau luka akibat serangga (Semangun 2007). Pada awalnya, daun yang paling dekat dengan ranting yang terserang akan berwarna kuning, kemudian kerusakan akan terus meluas sepanjang cabang dan mencapai batang utama lalu tanaman akan mati dengan cepat. Bagian dalam ranting dan cabang akan mengalami perubahan warna menjadi coklat di bagian pembuluh (Mbenoun et al. 2008). Botryodiplodia theobromae dapat menyebabkan mati pucuk, busuk buah, dan kanker batang (Semangun 2000).
Tujuan Penelitian
2
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menambah pengetahuan baru tentang penyebab penyakit pada bibit jabon, mengetahui pengaruh penyakit yang disebabkan oleh patogen terhadap kelangsungan hidup bibit jabon, dan dapat memberikan informasi mengenai respon pertumbuhan diameter koloni serta bobot miselia Botryodiplodia sp. terhadap pemberian perlakuan pH dan tingkat penggoyangan media. Dengan diketahuinya penyebab penyakit mati pucuk pada bibit jabon, maka hasil tersebut dapat dimanfaatkan sebagai alternatif dan bahan rekomendasi dalam pengendaliannya.
Hipotesis Penelitian
Hipotesis yang diajukan pada penelitian ini adalah sebagai berikut:
1. Secara in vitro, perlakuan perbedaan pH dan tingkat penggoyangan media mempengaruhi pertumbuhan fungi patogen Botryodiplodiasp.
2. Kejadian penyakit dan keparahan penyakit mati pucuk pada bibit jabon akibat serangan Botryodiplodia sp. dipengaruhi oleh umur semai jabon.
TINJAUAN PUSTAKA
Jabon (Anthocephalus cadamba Miq.)
Jabon merupakan pohon yang dapat mencapai tinggi sampai 45 meter, mempunyai batang yang lurus dan silindris dengan tinggi bebas cabang lebih dari 25 meter. Diameter batang dapat mencapai 100-160 cm. Di hutan tanaman, kecepatan tumbuh diameter jabon ialah 2-3 cm/tahun dan tinggi 2-3 m/tahun (Lembaga Biologi Nasional 1980). Menurut Heyne (1987), kayu Jabon merupakan kelas awet V, kelas kuat III-IV dengan berat jenis 0.42 (0.29-0.56). Kayunya lunak dengan nilai penyusutan dari keadaan basah sampai kering tanur sebesar 3% (radial) dan 6.9% (tangensial).
Jabon termasuk ke dalam jenis intoleran yang menghendaki adanya cahaya penuh selama periode hidupnya. Karakteristik habitat alami jabon adalah dengan ketinggian tempat tumbuh 300-800 m dpl, dengan suhu optimum 23 ˚C, curah hujan rata-rata 1500-5000 mm/tahun, dan dapat hidup pada berbagai tipe tanah. Namun, dalam menunjang produktivitasnya jabon tumbuh optimal pada ketinggian kurang dari 500 m dpl. Kondisi lingkungan tumbuh yang baik untuk jabon yaitu tanah lempung, podsolik cokelat, dan aluvial lembab yang biasanya terdapat di daerah pinggir sungai, daerah peralihan antara tanah dan rawa, dan tanah kering yang kadang tergenang air. Umumnya, jabon ditemukan di hutan sekunder dataran rendah, dasar lembah, sepanjang sungai dan punggung-punggung bukit (Mansur dan Tuheteru 2010).
3 beralur dangkal, kadangkala dengan punggung-punggung kecil, sering retak dan agak kasar. Cabang-cabang mendatar dengan ujung menjuntai, pemangkasan cabang terjadi secara alami. Bentuk daun bulat telur hingga lonjong dengan ukuran panjang 15-50 cm dan lebar 8-25 cm. Bagian pangkal berbentuk menyerupai jantung, bagian ujung lancip (Sutisna et al. 1998). Jabon mempunyai daun tunggal dengan ujung daun berbentuk runcing sampai meruncing serta berdaun penumpu, penumpu antar tangkai berbentuk segitiga sempit dan mudah rontok (Soerianegara dan Lemmens 1993).
Perbanyakan tanaman jabon untuk memenuhi permintaan yang cukup tinggi, dapat dilakukan dengan cara generatif dan vegetatif. Cara generatif dilakukan dengan mengecambahkan bijinya sedangkan cara vegetatif dilakukan dengan cara stek pucuk maupun stek batang (Khaerudin 1994). Buah jabon merupakan buah majemuk dengan bentuk bulat dan bertekstur lunak. Jabon berbuah setahun sekali pada musim berbunganya, yakni pada bulan Januari-Juni dan akan masak pada bulan Maret-Juni. Buah jabon merupakan buah majemuk, berbentuk bulat dengan ukuran berkisar 4.5-6 cm, memiliki ruang-ruang biji yang sangat banyak dengan bagian tengah padat dikelilingi oleh ruang-ruang biji (Mansur dan Tuheteru 2010).
Jabon ditanam sebagai ornamen, pohon penaung, dan dapat digunakan untuk reforestasi dan aforestasi (Soerianegara dan Lemmens 1993). Menurut Tantra (1980) kayu jabon merupakan kayu ringan yang digunakan untuk papan, peti, tripleks, dan korek api. Selain itu di industri perkayuan, jabon kerap dimanfaatkan untuk pembuatan kayu lapis (plywood), papan blok (laminated board, block board), papan serat (fiber block), dan papan partikel (particle board) (Mansur dan Tuheteru 2010). Kulit kayu yang telah kering berguna untuk mengobati demam dan sebagai obat kuat, ekstraksi dari daun digunakan untuk obat kumur, daun muda dapat dijadikan sebagai makanan ternak (fodder), getah kuning dari kulit akar dapat digunakan sebagai bahan celupan untuk barang kerajinan tangan (Kapisa dan Sapulata 1994).
Hama dan Penyakit Jabon
Tanaman jabon secara umum tidak memiliki hama dan penyakit yang serius. Namun, hama yang sering menyerang semai atau kecambah di persemaian antara lain semut, bekicot dan penyakit dumping off oleh cendawan Fusarium spp.,
Rhizoctonia spp., dan Phytium spp. (Mansur dan Tuheteru 2010).
4
Patogenisitas
Patogenisitas adalah kemampuan patogen dalam menyebabkan penyakit, berbeda dengan virulensi. Virulensi merupakan keberhasilan ekspresi dari patogenisitas. Suatu patogen dikatakan avirulen apabila gagal menimbulkan penyakit (Bilgrami dan Dube 1976).
Menurut Agrios (1988), patogen dapat mengakibatkan penyakit tanaman melalui berbagai cara, antara lain:
a. Melemahkan inang melalui penyerapan makanan dari
sel-sel inang secara terus menerus untuk dimanfaatkan oleh patogen.
b. Membunuh atau mengganggu metabolisme dari sel-sel inang dengan racun, enzim, atau pengaturan bahan-bahan untuk pertumbuhan yang mereka sekresikan.
c. Menghentikan transportasi makanan, nutrisi mineral, dan air melalui jaringan-jaringan yang konduktif pada inang.
d. Mengkonsumsi kandungan sel-sel inang melalui suatu penghubung.
Botryodiplodia sp.
Sifat-sifat Umum Botryodiplodia sp.
Botryosphariaceae merupakan kelompok cendawan yang memuat sejumlah species yang tersebar pada beberapa genus anamorp, diantaranya yang paling dikenal adalah Diplodia, Lasiodiplodia, Neofusicoccum, Pseudofusicoccum,
Dothiorella, dan Sphaeropsis (Henuk 2010). Anggota Botryosphaeriaceae mempunyai distribusi yang sangat luas dan terjadi dalam varietas yang luas pada berbagai tanaman inang termasuk monokotiledon, dikotiledon, gymnospermae, dan angiospermae, dimana anggota-anggota Botryosphaeriaceae ini dapat berperan sebagai saprofit, parasit, dan endofit (Begoude et al. 2009). Von Arx (1987) melaporkan bahwa spesies-spesies Botryosphaeriaceae telah lama dikenal sebagai patogen penting pada beberapa tanaman. Tanaman yang terinfeksi menunjukkan gejala yang beragam, misalnya mati pucuk, kanker, hawar, dan busuk pada seluruh organ tanaman bagian atas.
Taksonomi dan Morfologi Botryodiplodia sp.
Klasifikasi Botryodiplodia sp. menurut Alexopoulos (1996) adalah sebagai berikut :
Kingdom : Fungi
Phylum : Deuteromycota Kelas : Deuteromycetes Ordo : Sphaeropsidales Famili : Sphaeropsidaceae Genus : Botryodiplodia
Punithalingam (1976) menyebutkan bahwa karakter morfologi
5 halus atau kapas dan miselium udara berlimpah. Koloni mula-mula berwarna sepia, berubah menjadi abu-abu dan kemudian menjadi hitam. Piknidia sederhana, bergerombol, sering agregat, stromatik, ostiolate, lebar sampai dengan 5 mm. Konidia awalnya uniseluler, hialin, granulosa, subovoid sampai ellipsoid-oblong, berdinding tebal, memotong seperti sekat; konidia matang uniseptate, coklat seperti warna kayu manis, berukuran 20-30 µm x 10-15 µm.
Bioekologi dan Nilai Ekonomi
B. theobromae merupakan cendawan yang memiliki kisaran inang yang luas. Patogen ini merupakan parasit lemah yang melakukan infeksinya melalui luka-luka mekanis seperti akibat pemangkasan atau luka akibat serangga (Semangun 2007).
Patogen dapat membentuk struktur bertahan pada kondisi lingkungan yang tidak menguntungkan untuk berkembang. Kondisi lingkungan yang mendukung, dimana kelembaban, nutrisi dan suhu tinggi, patogen akan segera berkecambah dan kemudian melakukan penetrasi ke dalam jaringan tanaman. Kondisi suhu lingkungan yang berbeda sangat tinggi antara siang dan malam terutama musim kemarau merupakan lingkungan yang mempermudah perkembangan patogen ini. Kondisi tanaman yang lemah didukung oleh kelembaban yang tinggi akan mendukung terjadinya penetrasi pada jaringan tanaman inang baru. Penetrasi yang sudah berhasil selanjutnya akan terjadi kolonisasi, patogen akan tumbuh dan memperbanyak dalam jaringan tanaman inang. Fase-fase kritis patogen adalah pada saat sebelum terjadi penetrasi, pada fase ini pengendalian akan lebih efektif dibanding apabila sudah lanjut (Henuk 2010)
Botryodiplodia sp. ditemukan terdapat di berbagai belahan dunia diantaranya, di Amerika bagian utara dan selatan, Eropa, Afrika, Asia, dan Oceania (Urbez-Torres et al. 2008). Sejak akhir 1980 area perkebunan kakao di Kamerun mengalami kejadian penyakit mati pucuk yang luar biasa yang disebabkan oleh B. theobromae. Pada beberapa perkebunan di Kamerun, penyakit ini dapat merugikan tanaman kakao sampai 100%, hal ini menjadi pembatas produksi kakao di Kamerun (Mbenoun et al. 2008). Tahun 1998, B. theobromae
ditemukan pada pohon karet di Vietnam dan menyebabkan mati pucuk pada pembibitan, patogen terus berkembang dan menyebabkan kerusakan yang serius sehingga menekan produksi perkebunan di Dau Tieng Rubber Company (Pha et al. 2009). Menurut Rustini (2010) di Denpasar, Bali, hampir 53,24% dari buah pisang yang dijual mengalami pembusukan akibat cendawan B. theobromae, hal ini menyebabkan tidak terpenuhinya kebutuhan pasar karena permintaan pisang di Bali cukup tinggi untuk berbagai upacara keagamaan.
Gejala Penyakit dan Kisaran Inang
6 yang terserang akan berwarna kuning, kemudian kerusakan akan terus meluas sepanjang cabang dan mencapai batang utama lalu tanaman akan mati dengan cepat. Bagian dalam ranting dan cabang akan mengalami perubahan warna menjadi cokelat di bagian pembuluh. Juga terdapat eksudat berwarna putih atau kekuningan yang keluar dari batang utama (Mbenoun et al. 2008).
B. theobromae pada tanaman karet dapat menyebabkan penyakit mati pucuk. Gejalanya timbul pustul yang berukuran 3-5 mm pada batang kemudian kulit menjadi busuk disertai keluarnya lateks atau getah pada tanaman muda berumur 1-2 tahun. Serangan yang berat dapat menyebabkan retak dan gummosis. Selain itu, patogen ini dapat menekan pertumbuhan tanaman, menyebabkan produksi lateks rendah, dan untuk varietas yang rentan seluruh pohon mati dalam waktu 3-4 minggu (Pha et al. 2009).
Serangan B. theobromae dapat menyebabkan busuk buah pada manggis. Gejala yang ditunjukkan pada awalnya kulit buah manggis akan berubah warna menjadi kehitaman dan mengkilat, kemudian warnanya menjadi lebih suram karena membentuk banyak piknidia yang menghasilkan konidium. Biasanya gejala dimulai dekat dengan tangkai kemudian dengan cepat akan meluas ke seluruh buah (Semangun 2007).
Penyakit busuk buah merupakan penyakit pasca panen pada pisang yang disebabkan oleh B. theobromae. Patogen ini menyebabkan busuk ujung buah (tip rot), busuk telapak, dan busuk pangkal. Buah menjadi lunak dan berair, serta mengeluarkan bau yang khas. B. theobromae pada pisang hidup pada bagian tanaman yang membusuk, infeksinya hanya melalui luka-luka. Spora cendawan sudah terdapat pada permukaan buah di lapang (Semangun 2007).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Juli 2012 sampai dengan bulan Desember 2012, di Laboratorium Patologi Departemen Silvikultur Fakultas Kehutanan IPB, Laboratorium Bioteknologi Kehutanan Pusat Antar Universitas (PAU) Bioteknologi IPB, Laboratorium Mikoriza Puslitbang Kehutanan Bogor, dan Laboratorium Mikologi Departemen Proteksi Tanaman Fakultas Pertanian IPB.
Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini ialah cawan petri, labu erlenmeyer, autoclave, laminar, lampu bunsen, cork borer, sudip, mikroskop, oven, alat shaker, timbangan digital, pH meter, pisau, alat penyiram/sprayer, alat tulis, laptop, dan kamera.
Bahan yang digunakan dalam penelitian ialah bibit Anthocepalus cadamba
7 merupakan koleksi Laboratorium Patologi Departemen Silvikultur Fakultas Kehutanan IPB, media PDA, media PDB, alkohol 70%, aquades, NaOH pro analisis, HCl 37%, kertas saring, alumunium foil, plastik wrap, tissue, kapas, kentang, agar putih, chlorampenicol, dan spirtus.
Metode Pelaksanaan Penelitian
Tahap Persiapan
Pembuatan Media PDA (Potato Dextrose Agar)
Satu liter PDA memerlukan 200 gram kentang yang telah dipotong dadu dan 1 liter aquades kemudian direbus hingga kentang menjadi empuk. Air ekstrak kentang dipisahkan dan ditambahkan aquades sampai larutan menjadi 1 liter. Larutan dituang kedalam wadah yang berisi dekstrosa/glukosa 20 gram dan agar sebanyak 15 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer, ditambahkan chlorampenicol dan diaduk hingga merata. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 °C selama 15 menit.
Pembuatan media PDA pada berbagai tingkatan pH menggunakan bahan dan alat yang sama. Namun, dekstrosa dan agar ditambahkan setelah masing-masing larutan dalam labu erlenmeyerdititrasi dengan HCl dan NaOH 1% untuk mengatur pH media menjadi 2, 4, 6, dan 8. Dekstrosa dan agar akan tercampur saat media disterilkan dengan menggunakan autoclave.
Pembuatan Media PDB (Potato Dextrose Broth)
Satu liter PDB memerlukan 200 gram kentang yang telah dipotong dadu dan 1 liter aquades, kemudian direbus hingga kentang menjadi empuk. Air ekstrak kentang dipisahkan dan ditambahkan dextrose 20 gram. Sebelum larutan dipindahkan ke dalam labu erlenmeyer, ditambahkan chlorampenicol dan diaduk hingga merata. Media disterilkan menggunakan autoclave pada tekanan 1 atm dengan suhu 121 °C selama 15 menit.
Pembuatan media PDB pada berbagai tingkatan pH menggunakan bahan dan alat yang sama. Namun, larutan dalam labu erlenmeyer dititrasi dengan HCl dan NaOH 1% untuk mengatur pH media menjadi 2, 4, 6, dan 8 sebelum media disterilkan dengan menggunakan autoclave.
Penyediaan Isolat Fungi Patogen
8
Pemurnian dan Peremajaan Biakan
Pemurnian dan peremajaan biakan dilakukan sehingga diperoleh biakan yang homogen, bebas dari kontaminasi dan memiliki viabilitas yang cukup tinggi.
Sterilisai Bahan, Peralatan dan Ruang Inokulasi
Sterilisasi bahan seperti media PDA dan PDB, dilakukan pada waktu pembuatan media dengan menggunakan autoclave selama 15 menit pada suhu 121 oC dan tekanan 1 atm.
Peralatan yang akan digunakan seperti cawan petri disterilkan dengan cara memasukkan ke dalam oven selama 24 jam pada suhu 60-80 °C, sedangkan untuk sterilisasi cork borer dan sudip dilakukan dalam laminer air flow pada saat pelaksanaan inokulasi dengan cara dibakar pada api bunsen hingga membara.
Kebersihan lingkungan kerja dijaga dengan membatasi orang orang yang memasuki ruangan isolasi serta membersihkan ruangan dengan desinfektan. Strerilisasi ruang inokulasi (laminar air flow) dilakukan menggunakan larutan alkohol 70% yang disemprotkan sebelum dan sesudah inokulasi kemudian dibersihkan dengan menggunakan tisu. Blower atau peniup udara pada laminar air flow dinyalakan sebelum dan selama pemakaian untuk menghindari kontaminan. Selain itu sebelum digunakan dan setelah disemprot dengan alkohol 70%, laminar air flow dapat disterilisasi dengan menggunakan lampu UV yang dinyalakan selama beberapa menit.
Penyediaan Bibit
Bibit jabon diperoleh dari persemaian Karya Barokah dengan umur bibit yaitu 3 bulan, 4 bulan, dan 5 bulan. Setiap tingkatan umur, bibit dipilih yang berukuran seragam dan dalam kondisi yang baik. Setelah dilakukan pengangkutan dari persemaian, bibit tidak langsung diberi perlakuan melainkan diberi tenggang waktu selama 3 hari sebelum diberi perlakuan. Hal ini dimaksudkan agar bibit tidak mengalami stres akibat perbedaan lingkungan tumbuh. Penyiraman bibit dilakukan dua kali sehari selama penelitian.
Tahap Pelaksanaan
Uji Pertumbuhan In Vitro Diameter Koloni Botryodiplodia sp. pada Media PDA dengan Berbagai Tingkatan pH
Penelitian disusun dalam rancangan acak lengkap (RAL) diulang tiga kali. Satuan percobaan berupa biakan Botryodiplodia sp. dalam cawan petri dan perlakuannya berupa pengaturan tingkatan pH pada media PDA.
Satu potong koloni Botryodiplodia sp. dipotong dalam laminar air flow
menggunakan cork borer (Ø 0.8 cm) ditanam tepat di tengah cawan petri yang berdiameter 9.0 cm berisi media PDA dengan lima tingkatan pH, yaitu kontrol (A0) dengan pH 6.8, pH 2 (A1), pH 4 (A2), pH 6 (A3), dan pH 8 (A4). Pengamatan
dilakukan setiap 24 jam dengan mengukur diameter koloni arah radial sampai miselia memenuhi cawan petri.
9
Diameter arah radial = Ø x + Ø y 2
Keterangan:
Ø x = diameter sumbu X Ø y = diameter sumbu Y
Uji Pertumbuhan In Vitro Biomassa Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan pH
Penelitian disusun dalam rancangan acak lengkap (RAL) diulang tiga kali. Satuan percobaan berupa biakan Botryodiplodia sp. dalam labu erlenmeyer dan perlakuannya berupa pengaturan tingkatan pH pada media PDB.
Satu potong koloni Botryodiplodia sp. dipotong dalam laminar air flow
menggunakan cork borer (Ø 0.8 cm) kemudian dimasukkan kedalam labu erlenmeyer yang berisi media PDB dengan lima tingkatan pH yang berbeda, yaitu kontrol (B0) dengan pH 6.25, pH 2 (B1), pH 4 (B2), pH 6 (B3), dan pH 8 (B4).
Biakan patogen dibiarkan tumbuh selama enam hari.
Setelah enam hari, miselia Botryodiplodia sp. dipisahkan dari media PDB dengan menyaring miselia Botryodiplodia sp. dari media tumbuhnya. Penyaringan dilakukan menggunakan kertas saring yang telah dioven selama 24 jam pada suhu 60 °C dan telah diketahui berat keringnya. Miselia Botryodiplodia sp. pada kertas saring dioven selama 24 jam pada suhu 60 °C, sehingga akan didapatkan bobot kering miselia Botryodiplodia sp. dan kertas saring. Biomassa miselia dihitung menggunakan rumus sebagai berikut:
Biomassa miselia = (BK kertas saring + BK miselia) – BK kertas saring Keterangan:
BK = berat kering (gram)
Uji Pertumbuhan In Vitro Biomassa Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan Penggoyangan
Penelitian disusun dalam rancangan acak lengkap (RAL) diulang tiga kali. Satuan percobaan berupa biakan Botryodiplodia sp. dalam labu erlenmeyer dan perlakuannya berupa pengaturan tingkat penggoyangan media PDB.
Satu potong koloni Botryodiplodia sp. dipotong dalam laminar air flow
menggunakan cork borer (Ø 0.8 cm) kemudian dimasukkan kedalam labu erlenmeyer yang berisi media PDB. Penggoyangan media dilakukan menggunakan shaker dengan empat tingkatan penggoyangan, yaitu 0 rpm (C1) ,
50 rpm (C2), 100 rpm (C3), dan 150 rpm (C4).
Setelah diinkubasi selama enam hari, miselia Botryodiplodia sp. dipisahkan dari media PDB dengan menyaring miselia Botryodiplodia sp. dari media tumbuhnya. Penyaringan dilakukan menggunakan kertas saring yang telah dioven selama 24 jam pada suhu 60 °C dan telah diketahui berat keringnya. Miselia
10
Botryodiplodia sp. pada kertas saring dioven selama 24 jam pada suhu 60 °C, sehingga akan didapatkan bobot kering miselia Botryodiplodia sp. dan kertas saring. Biomassa miselia dihitung menggunakan rumus sebagai berikut:
Biomassa miselia = (BK kertas saring + BK miselia) – BK kertas saring Keterangan:
BK = berat kering (gram)
Uji Patogenisitas
Metode yang digunakan dalam uji patogenisitas menggunakan metode penempelan. Batang jabon sehat disemprot dengan alkohol untuk menghilangkan kontaminan yang mungkin menempel pada permukaan kulit batang yang akan di inokulasi. Batang dilukai dengan pisau steril kemudian potongan patogen
Botryodiplodia sp. ditempel pada batang yang telah dilukai. Batang ditutup alumunium foil untuk menjamin potongan patogen tidak terlepas.
Pengamatan dilakukan terhadap insiden dan keparahan penyakit mati pucuk pada setiap tingkatan umur. Insidensi penyakit atau kejadian penyakit merupakan persentase jumlah tanaman yang terserang patogen (n) dari total tanaman yang diamati (N) tanpa melihat tingkat keparahan penyakitnya. Rumus yang digunakan adalah :
Pengamatan keparahan penyakit (Disease Severity) yang disebabkan oleh cendawan atau fungi yang menyerang tanaman dihitung menggunakan metode Townsend dan Heuberger dengan rumus sebagai berikut:
Keparahan penyakit = Keterangan:
n = jumlah tanaman dalam setiap kategori V = nilai numerik dari kategori serangan
Z = kategori serangan dengan nilai numerik tertinggi N = jumlah seluruh tanaman yang diamati
Tabel 1 menyajikan keparahan dan nilai numerik penyakit yang digunakan: Tabel 1 Keparahan dan nilai numerik penyakit mati pucuk pada bibit jabon
Skor Keterangan
0 Tidak ada gejala
1 ≥ 10-20% bagian tanaman terserang
2 ≥ 21-60 % bagian tanaman terserang
3 ≥ 61-100% bagian tanaman terserang
11 patogen Botryodiplodia sp. sedang anak petak adalah umur semai jabon. Satuan percobaannya adalah sepuluh semai jabon yang masing-masing ditanam dalam
polybag terpisah. Faktor inokulasi fungi patogen terdiri atas dua taraf, yaitu: P0
(kontrol, tanpa inokulasi fungi patogen) dan P1 (diinokulasi Botryodiplodia sp.).
Faktor umur bibit terdiri atas tiga taraf, yaitu: U1 (bibit umur 3 bulan), U2 (bibit
umur 4 bulan), dan U3 (bibit umur 5 bulan).
Analisis Data
Rancangan Data hasil pengukuran dianalisis dengan menggunakan analisis sidik ragam. Untuk mengetahui pengaruh perlakuan yang diberikan terhadap peubah yang diamati, maka dilakukan analisis data menggunakan software SAS 9.1.3. Apabila hasil analisis menunjukkan berbeda nyata, maka dilanjutkan
dengan uji jarak berganda Duncan (Duncan’s multiple range test–DMRT).
Pengujian pH dan penggoyangan media menggunakan pola RAL dengan model linier aditif sebagai berikut (Mattjik et al. 2002):
Yij = μ + αi + ij Keterangan:
Yij : Nilai respon pertumbuhan diameter koloni Botryodiplodia sp.
pada masing-masing percobaan (pH dan penggoyangan media) ke-i dan ulangan ke-j
μ : Nilai rata-rata umum
αi : Perlakuan (pH dan penggoyangan media) ke-i
ij : Galat percobaan perlakuan konsentrasi (pH dan penggoyangan media) ke-i dan ulangan ke-j
Uji patogenesitas disusun dalam rancangan petak terbagi (Split Plot Design) dalam pola RAL diulang tiga kali, model yang digunakan adalah sebagai berikut:
Yijk = µ + αi + ik + βj + (αβ)ij + ijk
Keterangan:
Yijk : Intensitas serangan pada ulangan ke-k yang memperoleh taraf
ke-i dari faktor inokulasi dan taraf ke-j dari faktor umur µ : Nilai rata-rata intensitas serangan sesungguhnya
αi : Pengaruh utama dari taraf ke-i faktor inokulasi
ik : Pengaruh galat yang muncul pada taraf ke-i dari faktor inokulasi
dalam ulangan ke-k (galat petak utama)
βj : Pengaruh utama dari taraf ke-j faktor umur
(αβ)ij : Pengaruh interaksi taraf ke-i dengan faktor inokulasi dan taraf
ke-j faktor umur
ijk : Pengaruh galat pada ulangan ke-k yang memperoleh taraf ke-i
12
HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan In Vitro Diameter Koloni Botryodiplodia sp. pada Media PDA dengan Berbagai Tingkatan pH
Hasil pertumbuhan in vitro Botryodiplodia sp. pada media PDA menunjukkan bahwa pada pH 2 fungi tersebut tidak tumbuh. Hal ini ditunjukkan dengan tidak adanya pertumbuhan miselia. Selain itu pada pH 2, media PDA tidak berbentuk padat (Gambar 2). Pertumbuhan miselia Botryodiplodia sp. pada pH 4, 6, 8, dan kontrol (pH 6.8) sama-sama memenuhi cawan petri pada 3 hst (hari setelah tanam), selengkapnya dapat dilihat pada Gambar 1.
Gambar 1 Pertumbuhan diameter koloni Botryodiplodia sp. pada media PDA dengan berbagai tingkatan pH
Pertumbuhan diameter koloni Botryodiplodia sp. meski sama-sama memenuhi cawan petri pada 3 hst namun pertambahan panjang diameternya berbeda antara pH yang satu dengan yang lain. Pertumbuhan pertambahan panjang diameter paling maksimal adalah pada media PDA dengan pH 4, yaitu sebesar 4.93 cm kemudian pH 6, pH kontrol (6.8), dan pH 8 dengan nilai pertambahan panjang masing-masing sebesar 4.60 cm, 4.53 cm, dan 4.08 cm. Sedangkan untuk pH 2 tidak mengalami pertumbuhan.
Pertumbuhan Botryodiplodia sp. pada media PDA, mula-mula terlihat adanya koloni yang tumbuh seperti benang atau rambut halus berwarna putih keabu-abuan. Koloni yang dimaksud merupakan kumpulan dari miselia (miselium) yang berkembang. Hari berikutnya miselium berubah warna menjadi abu-abu keruh, semakin lama miselium semakin tebal dan berubah warna menjadi hitam. Pertumbuhan miselium terhitung cepat, karena dalam waktu 3 hst telah memenuhi cawan petri (Gambar 2).
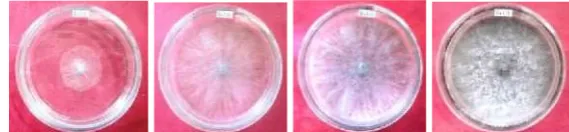
13 Pertumbuhan diameter koloni Botryodiplodia sp. pada beberapa tingkatan pH, secara visual lebih baik pada media PDA dengan pH kontrol (6.8). Pada media ini, miselium yang tumbuh terlihat halus, kompak dan paling tebal, serta pertumbuhannya menyebar secara merata bila dibandingkan dengan pertumbuhan diameter koloni pada media PDA dengan pH yang lain. Selengkapnya dapat dilihat pada Gambar 3.
Gambar 3 Pertumbuhan miselium Botryodiplodia sp. pada media PDA dengan berbagai
tingkatan pH setelah 3 hst: (a) pH 2, (b) pH 4, (c) pH 6, (d) pH 8, dan (e) pH kontrol (6.8)
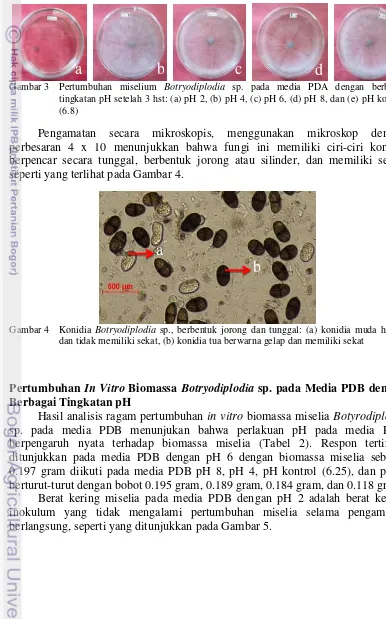
Pengamatan secara mikroskopis, menggunakan mikroskop dengan perbesaran 4 x 10 menunjukkan bahwa fungi ini memiliki ciri-ciri konidia berpencar secara tunggal, berbentuk jorong atau silinder, dan memiliki sekat, seperti yang terlihat pada Gambar 4.
Gambar 4 Konidia Botryodiplodia sp., berbentuk jorong dan tunggal: (a) konidia muda hyalin dan tidak memiliki sekat, (b) konidia tua berwarna gelap dan memiliki sekat
Pertumbuhan In Vitro Biomassa Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan pH
Hasil analisis ragam pertumbuhan in vitro biomassa miselia Botyrodiplodia
sp. pada media PDB menunjukan bahwa perlakuan pH pada media PDB berpengaruh nyata terhadap biomassa miselia (Tabel 2). Respon tertinggi ditunjukkan pada media PDB dengan pH 6 dengan biomassa miselia sebesar 0.197 gram diikuti pada media PDB pH 8, pH 4, pH kontrol (6.25), dan pH 2 berturut-turut dengan bobot 0.195 gram, 0.189 gram, 0.184 gram, dan 0.118 gram. Berat kering miselia pada media PDB dengan pH 2 adalah berat kering inokulum yang tidak mengalami pertumbuhan miselia selama pengamatan berlangsung, seperti yang ditunjukkan pada Gambar 5.
a
b
14 Tabel 2 Hasil uji Duncan pengaruh pemberian pH terhadap biomassa miselia
Botryodiplodia sp.
pH media Rata-rata biomassa (g)1
Kontrol (6.25) 0.184a
2 0.118b
4 0.189a
6 0.197a
8 0.195a
1) Angka yang diikuti huruf yang berbeda menyatakan berbeda nyata pada selang kepercayaan 95% berdasarkan uji jarak berganda Duncan
Gambar 5 Miselia Botryodiplodia sp. pada media PDB dengan berbagai tingkatan pH setelah di
inkubasi selama 6 hari: (a) pH 2, (b) pH 4, (c) pH 6, (d) pH 8, dan (e) pH kontrol (6.25)
Pertumbuhan In Vitro Biomassa Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan Penggoyangan
Hasil analisis ragam pertumbuhan in vitro biomassa miselia Botyrodiplodia
sp. di media PDB menunjukan bahwa perlakuan penggoyangan pada media PDB berpengaruh nyata terhadap biomassa miselia (Tabel 3).
Tabel 3 Hasil uji Duncan pengaruh pemberian tingkatan shaker terhadap biomassa miselia Botryodiplodia sp.
Tingkatan shaker (rpm) Rata-rata biomassa (g)1
Kontrol (0) 0.085b
50 0.233a
100 0.209a
150 0.092b
Pada tingkat penggoyangan media menggunakan shaker 50 rpm menunjukkan biomassa miselia tertinggi dengan nilai 0.233 gram. Selanjutnya biomassa miselia tertinggi yaitu pada tingkat penggoyangan 100 rpm, 150 rpm, dan 0 rpm (tanpa penggoyangan) dengan nilai berturut-turut yaitu 0.209 gram, 0.092 gram, dan 0.085 gram. Biomassa miselia Botryodiplodia sp. yang tercatat pada media PDB dengan tingkatan shaker 0 rpm adalah berat kering inokulum yang tidak mengalami pertumbuhan miselia selama pengamatan berlangsung (Gambar 6).
a
a
a
e
d
d
e
b
c
c
b
b
d
15
Gambar 6 Miselia Botryodiplodia sp. pada media PDB dengan berbagai tingkatan penggoyangan
media setelah di inkubasi selama 6 hari. Pada kecepatan 0 rpm, miselia tidak mengalami pertumbuhan seperti yang ditunjukkan dengan anak panah
Patogenisitas Botryodiplodia sp.
Kejadian penyakit dapat diamati dari gejala yang timbul pada tanaman yang terserang. Berdasarkan hasil pengamatan selama 14 hari, serangan penyakit mati pucuk hanya terjadi pada tanaman jabon dengan inokulasi fungi patogen. Seluruh tanaman yang di inokulasi fungi patogen, baik yang berumur 3, 4, maupun 5 bulan menunjukkan gejala penyakit. Tanaman jabon tanpa inokulasi fungi patogen sama sekali tidak menunjukkan gejala penyakit.
Gejala penyakit mati pucuk yang dijumpai pada saat pengamatan, awalnya menyerang daun yang paling dekat dengan batang yang diinokulasi fungi patogen. Daun akan berubah warna, dari kekuningan sampai kecoklatan kemudian kerusakan akan terus meluas ke bagian tangkai dan helai daun yang terdekat sehingga tulang daun menjadi hitam, layu dan kadang-kadang rontok. Penyebaran infeksi pada pucuk dan batang, mengakibatkan seluruh bagian tanaman menghitam dan mati sampai pada pangkal batang. Bagian luar dan dalam batang juga mengalami perubahan warna menjadi cokelat (Lampiran 1). Gejala penyakit mati pucuk pada bibit jabon dapat dilihat pada Gambar 7.
Gambar 7 Gejala yang nampak pada bibit jabon yang ditunjukkan dengan anak panah: (a) tanpa inokulasi fungi patogen, batang yang dilukai tidak menimbulkan gejala penyakit namun terlihat adanya kumpulan getah yang menutupi luka sebagai struktur bertahan, (b) dengan inokulasi fungi patogen, daun dan batang menunjukkan gejala
16 Berdasarkan hasil analisis ragam yang telah dilakukan, diketahui bahwa faktor dengan inokulasi fungi patogen berpengaruh nyata terhadap intensitas serangan penyakit mati pucuk yang ditimbulkan, sedangkan faktor tanpa inokulasi fungi patogen dan faktor umur serta interaksi kedua faktor tidak memberikan pengaruh yang nyata, seperti yang terlihat pada Tabel 4.
Tabel 4 Hasil uji Duncan pengaruh inokulasi patogen terhadap gejala penyakit
Perlakuan Kejadian penyakit1
Bibit jabon berumur 3 bulan tanpa inokulasi fungi patogen 0b
Bibit jabon berumur 4 bulan tanpa inokulasi fungi patogen 0b
Bibit jabon berumur 5 bulan tanpa inokulasi fungi patogen 0b
Bibit jabon berumur 3 bulan dengan inokulasi fungi patogen 100a
Bibit jabon berumur 4 bulan dengan inokulasi fungi patogen Bibit jabon berumur 5 bulan dengan inokulasi fungi patogen
100a 100a
1) Angka yang diikuti huruf yang berbeda menyatakan berbeda nyata pada selang kepercayaan 95% berdasarkan uji jarak berganda Duncan
Setelah diketahui kejadian penyakit berdasarkan gejala yang ditunjukkan oleh tanaman yang terserang, setiap umur tanaman memiliki nilai keparahan yang berbeda. Keparahan penyakit mati pucuk pada bibit jabon pada perlakuan dengan inokulasi fungi patogen, hingga akhir pengamatan yang memiliki nilai tertinggi mencapai 61% yaitu pada perlakuan bibit jabon dengan inokulasi fungi patogen berumur 3 bulan. Selanjutnya pada bibit jabon dengan inokulasi fungi patogen berumur 5 bulan dengan tingkat keparahan mencapai 54% dan bibit jabon dengan inokulasi fungi patogen berumur 4 bulan dengan tingkat keparahan 42%. Pada perlakuan tanpa inokulasi fungi patogen, semai yang berumur 3 bulan sampai 5 bulan tidak menunjukkan gejala serangan penyakit hingga akhir pengamatan, maka nilai keparahannya adalah 0%.
Hasil analisis ragam menunjukkan bahwa faktor dengan inokulasi fungi patogen dan faktor umur berpengaruh nyata terhadap keparahan penyakit (Tabel 5). Secara tunggal, gejala penyakit terjadi pada bibit yang di inokulasi fungi patogen. Bibit tanpa inokulasi fungi patogen tidak ada yang terserang.
Tabel 5 Hasil uji Duncan nilai keparahan penyakit mati pucuk pada bibit jabon
Perlakuan Tingkat keparahan1
Bibit jabon berumur 3 bulan tanpa inokulasi fungi patogen 0.00b
Bibit jabon berumur 4 bulan tanpa inokulasi fungi patogen 0.00b
Bibit jabon berumur 5 bulan tanpa inokulasi fungi patogen 0.00b
Bibit jabon berumur 3 bulan dengan inokulasi fungi patogen 61.00a
Bibit jabon berumur 4 bulan dengan inokulasi fungi patogen Bibit jabon berumur 5 bulan dengan inokulasi fungi patogen
42.00a 54.00a
1) Angka yang diikuti huruf yang berbeda menyatakan berbeda nyata pada selang kepercayaan 95% berdasarkan uji jarak berganda Duncan
Pembahasan
Pertumbuhan In Vitro Diameter Koloni Botryodiplodia sp. pada Media PDA dengan Berbagai Tingkatan pH
17 untuk bertahan hidup merupakan hal penting yang harus diperhatikan. Tindakan pengaturan pH media diarahkan untuk memberikan gambaran kondisi pH untuk menekan pertumbuhan patogen. Berdasarkan pengujian pertumbuhan in vitro Botryodiplodia sp. pada media PDA menunjukkan bahwa pada pH 2 fungi tersebut nyata tidak tumbuh. Tetapi pengendalian patogen dengan perlakuan pengaturan pH kurang dari 2 tidak mungkin dilakukan, karena pada kondisi ini kemungkinan hidup bagi inang atau tanaman juga sangat kecil. Kisaran pH untuk tanaman jabon yaitu antara pH 4 sampai dengan pH 7.5.
Koloni Botryodiplodia sp. berdasarkan pengamatan, dapat memenuhi cawan petri pada 3 hst. Secara makroskopis, koloni mula-mula berwarna putih seperti kapas atau rambut halus kemudian berubah menjadi abu-abu keruh dan lama kelamaan menghitam. Ciri-ciri tersebut sesuai dengan pernyataan Gandjar et al. (1999), yang menyebutkan bahwa koloni B. theobromae tumbuh cepat pada media PDA dengan membentuk miselia aerial yang lebat dan berwarna coklat kehitaman.
Pengamatan secara mikroskopis menunjukkan bahwa Botryodiplodia sp. memiliki konidia yang berpencar secara tunggal, berbentuk jorong atau silinder, konidia muda hyalin dan konidia tua memiliki sekat. Hal ini sesuai dengan ciri-ciri yang diungkapkan oleh Gandjar et al. (1999) bahwa B. theobromae memiliki konidia bersel dua, berbentuk elips, berwarna coklat tua. Akan tetapi pematangan konidia berjalan lambat, sehingga sering ditemukan konidia bersel satu dan berwarna hyalin.
Miselia Botryodiplodia sp. pada media PDA dengan pH 4, 6, 8, dan kontrol (6.8) sama-sama memenuhi cawan petri yang berdiameter 9 cm pada 3 hst, namun pertumbuhan pertambahan panjang diameter koloni per harinya berbeda antar perlakuan pH. Pertumbuhan miselia pada media PDA dengan pH 4 mengalami pertambahan panjang paling tinggi dibandingkan yang lainnya. Pada media PDA dengan pH 2, miselia Botryodiplodia sp. tidak mengalami pertambahan panjang karena Botryodiplodia tumbuh pada kisaran pH 3.5-8 dengan pH optimum untuk pertumbuhannya antara pH 5.5-6.5 (Saha etal. 2008) sehingga pada media PDA dengan pH 2 tidak mengalami pertumbuhan.
Secara visual, penampakan pertumbuhan miselia Botryodiplodiai sp. pada media PDA berbeda antara pH kontrol (6.8) dan yang lainnya. Berdasarkan pengamatan, pada pH kontrol (6.8) menunjukkan penampakan yang paling baik dengan miselia terlihat halus, kompak dan paling tebal serta pertumbuhannya merata dibandingkan dengan pH yang lainnya.
Berdasarkan hasil pengamatan, Botryodiplodia sp. dapat tumbuh baik pada pH 4, 6, 8, dan kontrol (pH 6.8) karena pH media masih dalam kisaran tumbuh
Botryodiplodia sp. sedangkan pada media PDA dengan pH 2, Botryodiplodia sp. tidak dapat tumbuh karena dibawah kisaran pH untuk pertumbuhan
Botryodiplodia sp. Pertumbuhan pertambahan panjang diameter koloni
18
Pertumbuhan In Vitro Biomassa Miselia Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan pH
Fungi adalah heterotrof yang mendapatkan nutrisinya melalui penyerapan (absorption) molekul-molekul organik kecil dari medium di sekitarnya. Fungi akan mencerna makanan diluar tubuhnya dengan cara mensekresikan enzim-enzim hidrolitik yang sangat ampuh ke dalam makanan tersebut. Enzim-enzim-enzim itu akan menguraikan molekul kompleks menjadi senyawa yang lebih sederhana yang dapat diserap dan digunakan oleh fungi (Campbell et al. 2003). Menurut Moore (1972) enzim tidak dapat aktif pada pH yang ekstrem, tetapi mereka mempunyai tingkat pH optimum yang berbeda untuk aktivitasnya. Derajat kemasaman (pH) optimum untuk enzim adalah kisaran pH 4-8 dan pH yang tidak menguntungkan dapat mengubah kemampuan normal dari sel.
Seperti yang telah diketahui bahwa pH optimum untuk pertumbuhan
Botryodiplodia sp. adalah pH 5.5-6.5 (Saha et al. 2008) sehingga pertumbuhan yang baik bagi Botryodiplodia sp. adalah pada media PDB dengan pH 6, karena berada pada kisaran pH optimum untuk aktivasi enzim dan pH optimum untuk pertumbuhan Botryodiplodia sp. jika dibandingkan pH yang lain.
Hasil analisis ragam menunjukkan bahwa perlakuan pH pada media PDB berpengaruh nyata terhadap pertumbuhan biomassa miselia Botryodiplodia sp. Pertumbuhan terbaik bagi fungi yaitu pada media PDB dengan pH 6, ditunjukkan dengan berat kering miselia tertinggi, diikuti dengan media PDB pH 8, pH 4, dan pH kontrol (6.25). Media PDB dengan pH 2 tidak mendukung untuk pertumbuhan fungi karena pH terlalu ekstrem sehingga enzim tidak dapat aktif dan tidak dapat menguraikan molekul kompleks menjadi senyawa yang lebih sederhana yang dapat diserap dan digunakan oleh fungi untuk pertumbuhan. Berat kering yang tercatat pada pH 2 adalah berat kering inokulum yang tidak mengalami pertumbuhan miselia selama pengamatan berlangsung.
Pertumbuhan In Vitro Biomassa Miselia Botryodiplodia sp. pada Media PDB dengan Berbagai Tingkatan Penggoyangan
Hasil analisis ragam menunjukkan bahwa perlakuan penggoyangan pada media PDB berpengaruh nyata terhadap biomassa miselia Botryodiplodia sp. Hasil inkubasi Botryodiplodia sp. pada media PDB yang diberi perlakuan penggoyangan menggunakan shaker, menunjukkan bahwa pada tingkat penggoyangan 50 rpm memiliki biomassa miselia tertinggi, selanjutnya diikuti pada tingkat penggoyangan 100 rpm, 150 rpm dan 0 rpm (tanpa penggoyangan). Hal ini menunjukkan bahwa Botryodiplodia sp. tumbuh lebih baik dengan perlakuan penggoyangan, karena menurut Stakman dan Harrar (1957) sebagian besar patogen tanaman adalah aerob dan oleh karena itu persediaan oksigen yang cukup sangat diperlukan agar pertumbuhan maksimum.
19 memang sangat diperlukan untuk pertumbuhan, namun tetap memiliki ambang batas untuk pertumbuhan yang optimal.
Patogenisitas Botryodiplodia sp.
Kejadian penyakit dapat diamati ketika timbul gejala pada tanaman. Gejala penyakit merupakan informasi penting dalam mengetahui penyebab suatu tanaman menjadi sakit. Menurut Martoredjo (1984), gejala (symptom) adalah perubahan yang ditunjukkan oleh tanaman itu sendiri sebagai reaksi terhadap patogen.
Perkembangan penyakit dimulai dengan inokulasi, yaitu jatuhnya inokulum pada tanaman inang. Pada penelitian ini, inokulasi terjadi ketika dilakukan penempelan isolat fungi patogen pada batang bibit jabon yang telah dilukai. Patogen kemudian masuk ke dalam jaringan tanaman inang, dinamakan penetrasi. Setelah patogen masuk ke dalam jaringan tanaman, akan terjadi interaksi antara tanaman inang dan patogen yang disebut dengan infeksi. Di dalam jaringan tanaman, patogen terus berkembang yang disebut invasi. Pada tahap invasi ini, gejala mulai muncul berupa bercak pada daun atau batang yang telah dilukai.
Gejala penyakit mati pucuk pada bibit jabon yang diamati disebabkan oleh faktor biotik yaitu fungi. Penyakit ini menunjukkan gejala nekrotis karena perlukaan pada batang yang diinokulasi fungi patogen dapat menyebar luas sehingga menyebabkan kematian sel pada seluruh organ tanaman.
Hasil inokulasi pada bibit jabon, fungi ini dapat menyebabkan mati pucuk. Hal yang sama juga terjadi sejak akhir 1980, dilaporkan bahwa pada area perkebunan kakao di Kamerun mengalami kejadian penyakit mati pucuk yang parah yang disebabkan oleh B. theobromae. Di beberapa perkebunan, penyakit ini dapat merugikan tanaman kakao sampai 100%, hal ini menjadi pembatas produksi kakao di Kamerun (Mbenoun et al. 2008). Pada tahun 1998 B. theobromae
ditemukan pada pohon karet di Vietnam dan menyebabkan mati pucuk pada pembibitan, fungi patogen terus berkembang dan menyebabkan kerusakan yang serius sehingga menekan produksi perkebunan di Dau Tieng Rubber Company (Pha etal. 2009).
Berdasarkan hasil pengamatan, serangan penyakit mati pucuk hanya terjadi pada tiga perlakuan dengan inokulasi fungi patogen sedangkan pada perlakuan tanpa inokulasi fungi patogen sama sekali tidak menunjukkan gejala penyakit. Hal ini membuktikan bahwa patogen memiliki kemampuan untuk menyebabkan penyakit atau bersifat virulen.
20 segera berkecambah dan kemudian melakukan penetrasi ke dalam jaringan tanaman. Kondisi suhu lingkungan yang berbeda sangat tinggi antara siang dan malam terutama pada musim kemarau merupakan lingkungan yang mempermudah perkembangan fungi ini, seperti yang terjadi selama penelitian berlangsung.
Gejala yang teramati mulai dari daun yang paling dekat dengan batang yang diinokulasi isolat patogen. Daun akan berubah warna, dari kekuningan sampai kecoklatan kemudian kerusakan akan terus meluas ke bagian tangkai dan helai daun yang terdekat sehingga tulang daun menjadi hitam, layu dan kadang-kadang rontok. Penyebaran infeksi pada pucuk dan batang, mengakibatkan seluruh bagian tanaman menghitam dan mati sampai pada pangkal batang. Bagian luar dan dalam batang juga mengalami perubahan warna menjadi cokelat. Hal tersebut dapat diduga sebagai akibat dari substansi-substansi yang disekresikan oleh patogen dalam mekanisme penyerangannya untuk melumpuhkan inang.
Luka merupakan salah satu jalan masuknya patogen. Penetrasi patogen akan lebih cepat dengan adanya luka. Berdasarkan pengamatan, pada bibit jabon yang di inokulasi patogen yang artinya dilakukan perlukaan terlebih dahulu seluruh tanaman (100%) menunjukkan gejala penyakit. Bibit jabon tanpa inokulasi patogen, meski dilakukan perlukaan pada batang tidak menunjukkan gejala penyakit sama sekali.
Sel dan jaringan tanaman akan bereaksi terhadap kerusakan, baik yang disebabkan oleh patogen atau karena mekanik dan kimia melalui serangkaian reaksi biokimia untuk mengisolasi gangguan dan menyembuhkan luka (Mert-Turk 2002).Tanaman jabon yang dilukai tanpa inokulasi fungi patogen, dapat bereaksi dengan cepat terhadap kerusakan sel tanaman yang terjadi. Hal ini ditunjukkan terbentuknya lapisan getah yang menutupi sayatan akibat perlukaan pada batang.
Secara umum tumbuhan akan memberikan respon terhadap serangan patogen dan respon tersebut akan bertanggung jawab terhadap resistensi tanaman terhadap patogen. Tanaman akan mempertahankan diri dengan dua cara, pertama dengan adanya sifat-sifat struktural pada tanaman yang berfungsi sebagai penghalang fisik dan akan menghambat patogen untuk masuk dan menyebar di dalam sel tanaman. Kedua, respon biokimia berupa reaksi-reaksi kimia yang terjadi di dalam sel dan jaringan tanaman sehingga patogen dapat mati atau terhambat pertumbuhannya (Groenewald 2005).
Tingkat keparahan penyakit mati pucuk pada bibit jabon yang terserang, hingga akhir pengamatan yang tertinggi mencapai 61% yaitu pada perlakuan bibit jabon dengan inokulasi fungi patogen berumur 3 bulan. Selanjutnya pada bibit jabon dengan inokulasi fungi patogen berumur 5 bulan dan bibit jabon dengan inokulasi fungi patogen berumur 4 bulan dengan tingkat keparahan penyakit mencapai 54% dan 42%. Bibit dengan perlakuan tanpa inokulasi patogen tidak ada yang menunjukkan gejala terserang penyakit, maka nilai keparahan serangan penyakit adalah 0%.
21 pertahanan inang yang digunakan, baik pertahanan struktural maupun biokimia. Serangan penyakit terjadi hanya pada periode umur tertentu, karena senyawa biokimia yang digunakan dalam mekanisme pertahanan inang dapat berubah sesuai dengan umur dan tempat tumbuh. Menurut Agrios (1997), ketahanan biokimia yang terdapat pada tanaman ditentukan oleh tersedianya senyawa bagi patogen sebagai nutrisi atau senyawa yang bersifat toksik. Senyawa tersebut antara lain adalah protein, gula dan fenol kompleks yang dapat berubah-ubah konsentrasinya dalam jaringan tanaman sesuai dengan umur dan faktor lingkungan tempat tanaman tumbuh. Sumaraw (1999) menyebutkan bahwa pada tanaman tomat, semakin tua tanaman maka semakin tinggi tingkat keparahan penyakitnya. Berbeda dengan tanaman pinus, menurut Achmad (2012) semakin tua semai, ketahanan terhadap serangan patogen lodoh semakin meningkat. Serangan lodoh pada semai Pinus merkusii terjadi dari benih hingga semai berumur tujuh minggu, semai berumur delapan minggu telah bebas dari penyakit.
Secara teknis di lapangan, pemilihan bibit berumur 4 bulan sebagai bahan penanaman lebih dianjurkan karena berdasarkan hasil penelitian bibit berumur 4 bulan memiliki nilai keparahan yang lebih rendah daripada bibit berumur 3 atau 5 bulan.
SIMPULAN DAN SARAN
Simpulan
Pemberian perlakuan pH pada media PDA berpengaruh nyata terhadap pertumbuhan Botryodiplodia sp. Respon pertumbuhan koloni Botryodiplodia sp. terbaik adalah pada media PDA dengan pH 4. Pada media PDA dengan pH 2,
Botryodiplodia sp. tidak mengalami pertumbuhan.
Uji pertumbuhan biomassa Botryodiplodia sp. pada media PDB dengan perlakuan berbagai tingkatan pH berpengaruh nyata terhadap pertumbuhan
Botryodiplodia sp. dengan bobot miselia tertinggi pada media PDB dengan pH 6. Pemberian tingkat penggoyangan pada media PDB dengan pH netral menggunakan shaker, berpengaruh nyata terhadap pertumbuhan Botryodiplodia
sp. Bobot miselia tertinggi yaitu pada tingkat penggoyangan 50 rpm.
22
Saran
Diharapkan adanya penelitian lebih lanjut mengenai mekanisme penyerangan patogen terhadap tanaman dan mengenai pengaruh faktor lingkungan terhadap perkembangan penyakit mati pucuk dan perkembangan fungi patogen serta pengendaliannya.
DAFTAR PUSTAKA
Achmad, Hadi S, Harran S, Sa’id EG, Satiawiharja B, Kardin εK. 2012.
Mekanisme serangan patogen lodoh pada semai pinus (Pinus merkusii).
Journal of Tropical Silviculture Science and Technology. 03(1):57-64. Agrios GN. 1988. Plant Pathology. Ed ke-3. New York (US): Academic Pr. Agrios GN. 1997. Plant Pathology. Ed ke-4. Toronto (CA): Academic Pr.
Alexopoulos CJ, Mims CW and Blackwell M. 1996. Introductory Mycology. Ed ke-4. New York (US): John Willey & Sons, Inc.
Begoude BAD, Bernard S, Michael JW, Jolanda R. 2009. Botryosphaeriaceae associated with Terminalia cattapa in Cameroon, South Africa and Madagascar. Mycol Progress 9: 101-123.
Bilgrami KS, Dube HC. 1976. A Textbook of Modern Plant Pathology. New Delhi (IN): PVT LTD.
Campbell NA, Reece JB, Mitchell LG. 2003. Biologi. Manalu W, penerjemah; Safitri A, editor. Jakarta (ID): Penerbit Erlangga. Terjemahan dari: Biology Fifth Edition.
Gandjar I, Samson RA, Vermeulen, Oetari A, Santoso I. 1999. Pengenalan Kapang Tropik Umum. Jakarta (ID): Yayasan Obor Indonesia.
Groenewald S. 2005. Biology, pathogenecity and diversity of Fusarium oxysporum f.sp. cubense [thesis]. Pretoria (ZA): University of Pretoria. Henuk JBD. 2010. Identifikasi dan uji patogenisitas penyebab busuk pangkal
batang pada jeruk (Citrus spp.) dari beberapa sentra produksi jeruk di Indonesia [tesis]. Bogor (ID): Institut Pertanian Bogor.
Heyne K, 1987. Tumbuhan Berguna Indonesia. Jilid ke-2. Jakarta (ID): Yayasan Sana Wana Jaya.
Kapisa N, Sapulata E. 1994. Informasi teknik tanaman jabon (Anthocephalus cadamba Miq.). Buletin Penelitian Kehutanan 10:3.
Khaerudin. 1994. Pembibitan Tanaman HTI. Jakarta (ID): Penebar Swadaya. Lembaga Biologi Nasional. 1980. Kayu Indonesia. Jakarta (ID): Balai Pustaka. Mansur I, Tuheru FD. 2010. Kayu Jabon. Jakarta (ID): Balai Pustaka
Martoredjo T. 1984. Pengantar Ilmu Penyakit Tumbuhan Bagian dari Perlindungan Tanaman. Yogyakarta (ID): Andi Offset.
Mattjik AA, Sumertajaya. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Bogor (ID): IPB Pr.
23 Mert-Turk F. 2002. Phytoalexin: defence or just a respon to stress. Journal of Cell
and Molecular Biology 1:1-6.
Moore E, Landecker. 1972. The Fungi. Toronto (CA): Prentice-Hall of Canada Ltd.
Mulyana D, Asmarahman C, Fahmi I. 2010. Bertanam Jabon. Jakarta (ID): Agromedia Pustaka.
Pha TA, Dung PT, Hieu ND, Nghia NA. 2009. Disease caused by Botryodiplodia theobromae Pat. on rubber tree in Vietnam. Rubber Research Institute of Vietnam. [internet]. [diacu 2012 Desember 20]. Tersedia dari: http://www. rriv.org.vn/uploads/userfiles/28-BCMalaysia-Pha.ppt.
Punithalingam E. 1976. CMI Descriptions of Pathogenic Fungi and Bacteria. England (NL): Commonwealth Mycological Institute.
Rustini NL. 2010. Aktivitas antijamur minyak atsiri rimpang dringo (Acorus calamus l.) Terhadap jamur Botryodiplodia theobromae penyebab busuk buah pisang. Jurnal Kimia 4 (2): 173-179.
Saha A, Mandal P, Dasgupta S, Saha D. 2008. Influence of Culture Media and Environmental Factors on Mycelial Growth and Sporulation of Lasiodiplodia theobromae (Pat.) Griffon and Maubl. Journal of Environmental Biology 29(3): 407-410.
Semangun H. 2000. Penyakit-penyakit Tanaman Perkebunan di Indonesia. Yogyakarta (ID): Gadjah Mada University Pr.
Semangun H. 2007 Penyakit-penyakit Tanaman Hortikultura di Indonesia. Ed ke-2. Yogyakarta (ID): Gadjah Mada University Pr.
Soerianegara I, Lemmens RHMJ. 1993. Plant Resources of South-East Asia 5(1) : Timber Trees: Major Commercial Timbers. Wageningen (NL): Pudoc Scientific Publishers.
Stakman EC, Harrar JG. 1957. Principles of Plant Pathology. New York (US): The Ronald Pr Company.
Sumaraw SM. 1999. Periode kritis tanaman tomat terhadap serangan Alternalia solani (Ell. & G.Martin) Sor. dan faktor penentunya. Buletin Hama dan Penyakit Tumbuhan 11(2):67-72.
Sutisna U, Kalima T, Purnadjaja. 1998. Training Manual Pedoman Pengenalan Pohon Hutan di Indonesia. Bogor (ID): Prosea.
Tantra IGM. 1980. Flora Pohon Indonesia. Bogor (ID): Balai Penelitian Hutan. Tarr. 1972. The Principles of Plant Pathology. London (GB): The Macmillan Pr. Urbez-Torres JR, Leavitt GM, Guerrero JC, Gubler WD. 2008. Identification and
pathogenicity of Lasiodiplodia theobromae and Diplodia seriata, the causal agents of Bot canker disease of grapevines in Mexico. Journal of Plant Disease 92: 519-529
24
LAMPIRAN
Lampiran 1 Komposisi media pertumbuhan Botryodiplodia sp. :
No Jenis Media Komposisi Media Jumlah
1 Potato Dextrose Agar Kentang 200 gr
Dextrose 20 gr
Agar 15 gr
Aquades 1 l
2 Potato Dextrose Broth Kentang 200 gr
Dextrose 20 gr
Aquades 1 l
Lampiran 2 Pertumbuhan diameter Botryodiplodia sp. pada media PDA dengan berbagai
tingkatan pH :
Perlakuan Ulangan ke- Pertumbuhan Hari
ke-1 2 3
pH Kontrol (6.8) 1 3.10 7.60 9.00
2 2.95 7.40 9.00
3 2.95 7.60 9.00
rata-rata 3.00 7.53 9.00
pH 2 1 0.00 0.00 0.00
2 0.00 0.00 0.00
3 0.00 0.00 0.00
rata-rata 0.00 0.00 0.00
pH 4 1 2.20 7.15 9.00
2 2.50 7.75 9.00
3 2.80 7.40 9.00
rata-rata 2.50 7.43 9.00
PH 6 1 2.70 7.15 9.00
2 2.50 7.15 9.00
3 2.20 6.90 9.00
rata-rata 2.47 7.07 9.00
pH 8 1 1.85 5.70 9.00
2 2.45 6.30 9.00
3 2.75 7.30 9.00
rata-rata 2.35 6.43 9.00
Lampiran 3 Biomassa miselia Botryodiplodia sp. dengan perlakuan pH Kontrol (6.25)
pada media PDB
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.912 1.077 0.165
2 0.907 1.107 0.200
3 0.901 1.087 0.186
25
Lampiran 4 Biomassa miselia Botryodiplodia sp. dengan perlakuan pH 2 pada media PDB
Lampiran 5 Biomassa miselia Botryodiplodia sp. dengan perlakuan pH 4 pada media PDB
Lampiran 6 Biomassa miselia Botryodiplodia sp. dengan perlakuan pH 6 pada media PDB
Lampiran 7 Biomassa miselia Botryodiplodia sp. dengan perlakuan pH 8 pada media PDB
Lampiran 8 Biomassa miselia Botryodiplodia sp. tanpa perlakuan penggoyangan (0 rpm)
pada media PDB
Lampiran 9 Biomassa miselia Botryodiplodia sp. dengan perlakuan penggoyangan 50 rpm
pada media PDB
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.884 1.003 0.119
2 0.901 1.039 0.138
3 0.918 1.015 0.097
Rata-rata 0.118
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.890 1.083 0.193
2 0.882 1.064 0.182
3 0.903 1.094 0.191
Rata-rata 0.189
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.907 1.100 0.193
2 0.897 1.085 0.188
3 0.893 1.102 0.209
Rata-rata 0.197
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.875 1.065 0.190
2 0.906 1.101 0.195
3 0.883 1.082 0.199
Rata-rata 0.195
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.837 0.906 0.069
2 0.830 0.941 0.111
3 0.853 0.928 0.075
Rata-rata 0.085
Ulangan ke- Berat kertas saring (g) Berat kertas saring + miselia (g) Biomassa miselia (g)
1 0.848 1.071 0.223
2 0.821 1.058 0.237
3 0.815 1.055 0.240
26
Lampiran 10 Biomassa miselia Botryodiplodia sp. dengan perlakuan penggoyangan 100 rpm
pada media PDB
Lampiran 11 Biomassa miselia Botryodiplodia sp. dengan perlakuan penggoyangan 150 rpm
pada media PDB
Lampiran 12 Rekapitulasi bibit jabon yang terserang mati pucuk pada akhir pengamatan
Ulangan Jumlah tanaman yang terserang
1 (bibit)
P0U1 P0U2 P0U3 P1U1 P1U2 P1U3
1 0 0 0 10 10 10
2 0 0 0 10 10 10
3 0 0 0 10 10 10
Total 0 0 0 30 30 30
1) P0U1= Bibit jabon berumur 3 bulan tanpa inokulasi fungi patogen, P0U2= Bibit jabon berumur 4 bulan tanpa inokulasi fungi patogen, P0U3= Bibit jabon berumur 5 bulan tanpa inokulasi fungi patogen, P1U1= Bibit jabon berumur 3 bulan dengan inokulasi fungi patogen, P1U2= Bibit jabon berumur 4 bulan dengan inokulasi fungi patogen, P1U3= Bibit jabon berumur 5 bulan dengan inokulasi fungi patogen
Lampiran 13 Tingkat keparahan mati pucuk pada bibit jabon hingga akhir pengamatan
Ulangan Tingkat keparahan pada tiap perlakuan
1 (%)
P0U1 P0U2 P0U3 P1U1 P1U2 P1U3
1 0 0 0 60 40 57
2 0 0 0 67 40 53
3 0 0 0 57 47 53
Rata-rata 0 0 0 61 42 54
1) P0U1= Bibit jabon berumur 3 bulan tanpa inokulasi fungi p