STABILITAS DAN EFEKTIVITAS BIOSENSOR GLUKOSA
BERBASIS
Escherichia coli
YANG DIIMOBILISASI PADA
MATRIKS NANOKOMPOSIT ZEOLIT
DIAN HERAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
DIAN HERAWATI. Stabilitas dan Efektivitas Biosensor Glukosa Menggunakan
Escherichia coli Yang Diimobilisasi Pada Matriks Nanokomposit Zeolit.
Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan
TRIVADILA
Biosensor menggabungkan elemen biologis dan sensitivitas transduser.
Penerapan biosensor sebagai pengukur glukosa darah untuk pasien diabetes
mellitus menggunakan enzim murni sebagai sensor biologi. Penggantian enzim
dengan sel mikroba yang memproduksi enzim sebagai sensor biologis dilakukan
untuk mengatasi kelemahan enzim seperti stabilitas rendah dari aktivitas enzim
dan biaya tinggi. Penelitian ini dilakukan untuk mengukur aktivitas dehidrogenase
glukosa (GDH) dari Escherichia coli, enzim bereaksi secara spesifik dengan
glukosa sebagai substrat dan mengikat dengan kedua pyrolloquinoline kuinon
(PQQ) dan ion Mg
2+sebagai kelompok prostetik dan aktivator yang kemudian
diukur menggunakan metode voltametri siklik.
Rancangan percobaan yang digunakan untuk pengoptimuman aktivitas GDH
sel bakteri E.coli
adalah metode permukaan respon. Diperoleh kondisi optimum
aktivitas GDH sel bakteri E.coli tanpa adanya matriks nanokomposit zeolit pada
proses imobilisasi ialah, suhu 30°C, pH 6, konsentrasi glukosa 15 mM,
konsentrasi PQQ 3,050 µM. Sedangkan untuk kondisi optimum aktivitas GDH sel
bakteri
E.coli dengan matriks nanokomposit zeolit ialah suhu 30°C, pH 6,
konsentrasi glukosa 15 mM, konsentrasi PQQ 3,050 µM, dan nanokomposit zeolit
137,50 mg. Reaksi kinetika GDH yang dikatalisis oleh glukosa mengikuti
persamaan kinetika Lineweaver-Burk. Nilai K
M appsel bakteri E.coli dengan
ABSTRACT
DIAN HERAWATI Stability and Effectiveness of Glucose Biosensor Using
Escherichia coli immobilized in the zeolite matrix nanocomposite Supervised by
DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT, dan TRIVADILA
Biosensor combines the selectivity of biological recognition element and
the sensitivity of the transducer. The application of biosensor as blood glucose
measurer for diabetes mellitus patients uses purified enzyme as biological sensor.
The substitution of purified enzyme with the microbial cells producing enzymes
as biological sensor is carried out to overcome the weaknesses of purified enzyme
such as the low stability of the enzyme activity and the high cost. This research
was carried out to measure the activity of glucose dehydrogenase (GDH)–the
enzyme reacting specifically with glucose as substrate and binding with both
pyrolloquinoline quinone (PQQ) and Mg2+ ion as prosthetic group and activator
respectively-which is exhibited by escherichia coli, using electrochemical
methods
STABILITAS DAN EFEKTIVITAS BIOSENSOR GLUKOSA
BERBASIS
Escherichia coli
YANG DIIMOBILISASI PADA
MATRIKS NANOKOMPOSIT ZEOLIT
DIAN HERAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Stabilitas dan Efektivitas Biosensor Glukosa Menggunakan
Escherichia coli Yang Diimobilisasi Pada Matriks Nanokomposit Zeolit
Nama : Dian Herawati
NIM : G44096040
Disetujui
Pembimbing I
Dr Dyah Iswantini Pradono, M.Agr
NIP 19670730 199103 2 001
Pembimbing II
Pembimbing III
Dr Novik Nurhidayat
Trivadila, SSi MSi.
NIP 19771029 200502 2 001
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT . Salawat serta salam
atas segala rahmat dan karunia-Nya, penulis dapat menyelesaikan karya ilmiah
dengan judul Peningkatan Stabilitas dan efektivitas Biosensor Glukosa Berbasis
Escherichia coli Yang Diimobilisasi Pada Matriks Nanokomposit Zeolit.
Terima kasih penulis ucapkan kepada Dr. Dyah Iswantini Pradono, M.Agr,
Dr. Novik Nurhidayat, dan Trivadila, S,Si, M.Si selaku pembimbing yang
senantiasa memberikan arahan, dorongan, semangat, dan doa kepada penulis
selama melaksanakan penelitian. Disamping itu penulis memberi hormat dan
terima kasih kepada Ibu Ai, Bapak Mail , dan Bapak Nano selaku Staf
Laboratorium Kimia Fisik. Ibu Heny Purwaningsih selaku kepala Laboratorium
Bersama Kimia, Bapak Wawan dan Mas Eko selaku staf Laboratorium bersama.
Ibu Neri, Ibu Erna, Ibu Ratih, Bapak Acun, dan Ibu Enok di PUSLIT
Mikrobiologi Genetika LIPI yang telah membantu selama pengumpulan data.
Serta mengucapkan banyak terima kasih kepada Papah, (Almrh) Mamah, teh gita,
ka Erdy, dan (Alm) Bey Haqh atas doa dan kasih sayangnya. Kepada mba Lucky,
mba Wiwin dan Dika atas segala doa, saran, dan bantuannya untuk menyelesaikan
skripsi ini.
Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi
perkembangan ilmu pengetahuan.
Bogor, April 2012
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 13 Maret 1988 dari Ayah
H. Herawan Hadi Putra S.H, L.L.M. dan Ibu (Almrh) Hj. Diniah M.H. Penulis
merupakan putri ketiga dari tiga bersaudara.
DAFTAR ISI
ABSTRAK ... ii
RIWAYAT HIDUP ... vii
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Tujuan Penelitian ... 2
Waktu dan Tempat Penelitian ... 2
METODOLOGI ... 2
Alat dan Bahan ... 2
Lingkup Kerja ... 2
Media Luria Broth(LB) Agar Miring ... 3
Media Luria Broth (LB) Cair ... 3
(Lysogeny broth 1951) ... 3
Isolat Bakteri Escherichia coli ... 3
Elektrode Pasta Karbon ... 3
Metode Pembuatan Elektrode Pembanding Ag/AgCl ... 3
Pelapisan AgCl (Huda 2010) ... 3
Pembuatan Elektroda Pembanding Ag/AgCl (Huda 2010) ... 3
Imobilisasi Sel E. coli tanpa Menggunakan Nanokomposit Zeolit (Ikeda et al.
1998) ... 4
Imobilisasi sel E.coli dengan menggunakan nanokomposit Zeolit ... 4
Pengukuran Elektrokimia ... 4
Pengoptimalisasian Aktivitas GDH Sel Bakteri E. coli Terimobilisasi ... 4
Parameter Kinetika ... 4
Stabilitas Aktivitas GDH Sel Bakteri ... 5
E .coli ... 5
HASIL DAN PEMBAHASAN ... 5
Pembuatan Elektrode Pembanding Ag/AgCl ... 5
Penentuan Kinerja Elektrode Pembanding Ag/AgCl ... 5
Pengoptimuman Aktivitas GDH Imobilisasi Sel Bakteri E.coli Tanpa
Nanokomposit Zeolit ... 6
Pengoptimuman Aktivitas GDH sel Bakteri E.coli Dengan Nanokomposit
Zeolit ... 7
Kinetika Enzim Glukosa Dehidrogenase Imobilisasi ... 8
Stabilitas Enzim Glukosa Dehidrogenase Sel Bakteri E. coli Imobilisasi ... 10
SIMPULAN DAN SARAN ... 11
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1 Nilai parameter kinetika sel
... 9
DAFTAR GAMBAR
Halaman
1 Pembuatan elektrode pembanding Ag/AgCl
... 3
2 Voltamogram siklik pada pengukuran larutan
... 6
3 Oksidasi glukosa dengan katalis PQQGDH
... 6
4 Alur kontur pada aktivitas GDH E.coli
... 6
5 Alur kontur pada aktivitas GDH dengan matriks nanokomposit zeolit
... 7
6 Hubungan konsentrasi glukosa dan aktivitas
... 8
7 Linearitas konsentrasi glukosa
... 9
8 Plot Libeweaver-Bulk sel bakteri E.coli
... 9
9 Stabilitas E.coli
... 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir Biosensor Glukosa Berbasis Escherichia coli Yang
... 14
2 Bagan alir pembuatan media
... 15
3 Bagan alir kerja
... 16
4 Bagan alir pembuatan elektroda pasta karbon dan imobilisasi
... 17
5 Pengoptimuman sel bakteri E.coli
... 18
6 Pengoptimuman sel bakteri E.coli Dengan Matriks Nanokomposit Zeolit
... 19
7 Voltagram Siklik Sel Bakteri E.coli imobilisasi
... 20
8 Voltagram Siklik Sel Bakteri E.coli Imobilisasi Nanokomposit Zeolit
... 20
9 Kinetika enzim glukosa dehidrogenase sel bakteri E.coli
... 22
PENDAHULUAN
Diabetes Melitus (DM) adalah suatu kelainan di mana kandungan gula darah (glukosa) di dalam darah sangat tinggi melebihi batas normal karena tubuh tidak memproduksi insulin yang cukup (Merck 2010). WHO memperkirakan bahwa dalam periode 2006-2015, Cina akan kehilangan 558 milyar pendapatan nasional terdahulu karena diabetes (WHO 2011).
Salah satu terapi yang paling banyak digunakan pada penyakit DM ialah dengan menggunakan suntik insulin. Penyuntikan insulin harus lah dilakukan dengan berhati-hati, karena jika berlebihan dapat menyebabkan hiperinsulin. Oleh karena itu dibutuhkan suatu alat pengukur glukosa darah sehingga kadar insulin yang disuntikkan dapat diketahui dengan jelas. Sebagian besar dari alat-alat pengukur tersebut menggunakan enzim sebagai sensor. Sensor enzim merupakan salah satu jenis biosensor, yakni sebagai suatu perangkat sensor yang menggabungkan senyawa hayati dengan suatu tranduser (Wang 2007).
Peranan enzim yang begitu penting dalam biosensor memiliki kekurangan, di antaranya harga yang mahal dan kestabilan enzim yang rendah. Untuk mengatasinya digunakan lah mikrob penghasil enzim sebagai sensor yang digunakan untuk mengukur kadar glukosa. Sensor ini disebut sensor mikrob. Keuntungan sensor mikrob dibandingkan dengan sensor enzim adalah sensor mikrob lebih tahan lama serta biaya yang lebih murah karena tidak diperlukan pengisolasian dan pemurnian enzim aktif. Karena menggunakan materi hayati
(biomaterial) sebagai sensor, maka sensor
mikrob juga termasuk biosensor. Biosensor yang pertama kali dibuat adalah sensor glukosa pada tahun 1962 oleh Leland C. Clark Jr. untuk mengukur kadar glukosa dalam darah. Clark menggunakan enzim glukosa oksidase (GOD) yang bereaksi spesifik dengan glukosa dan dapat dihasilkan secara ilmiah dari jamur
Aspergillus niger. Namun mekanisme kerja
enzim ini sangat bergantung pada keberadaan oksigen, sehingga menjadi sebab terjadinya perbedaan hasil glukosa yang terdeteksi dari individu yang sama. Hal tersebut medorong penggantian enzim GOD dengan enzim glukosa dehidrogenase (GDH). Enzim GDH spesifik terhadap substrat glukosa dan aktivitasnya tidak dipengaruhi kadar oksigen (Turner 2002).
Escherichia coli telah diketahui dapat
menhasilkan GDH. Akan tetapi, enzim GDH yang terdapat pada E .coli berada dalam bentuk apo-GDH (enzim yang belum aktif) dan tidak memiliki kemampuan menghasilkan PQQ. Maka dari itu diperlukan penambahan PQQ untuk mengubah apo-GDH menjadi holo-GDH (enzim yang aktif). Holo-GDH memiliki kemampuan untuk menghasilkan aktivitas yang besar (Matshushita et al 1997; Iswantini et al. 1998, Ikeda et al.1998; Iswantini et al. 2011).
Ito et al. (2002) mempelajari E. coli. dan
aplikasinya pada sensor glukosa menggunakan metode amperometri. Sensor glukosa menggunakan Qo sebagai mediator yang dikemas dalam pasta karbon sebagai elektrode kerja (mediator terintegrasi). Iswantini et al. (2011) melakukan penelitian mengenai pemilihan bakteri-bakteri yang ada di Indonesia untuk penggunaan biosensor glukosa. Uji enzim glukosa dehidrogenase menggunakan metode spektrofotometri dan elektrokimia menetapkan E. coli sebagai bakteri yang berpotensi paling baik dalam menghasilkan serapan cahaya dan stabilitas arus. Oleh karena itu E. coli. asal Indonesia ini mempunyai peluang untuk dikembangkan sebagai biosensor glukosa. Dari penelitian tersebut diketahui bahwa aktivitas GDH yang dihasilkan oleh bakteri E. coli KRGS memiliki aktivitas terbesar dibandingkan dengan Bacillus subtilis KRGL, baik dengan metode spektrofotometri maupun dengan metode elektrokimia (Iswantini et al 2011). Hapsari (2011) melakukan penelitian imobilisasi GDH E. coli dengan matriks glutaraldehida, dan diperoleh kenaikkan arus dan kestabilan yang cukup baik. Metode elektrokimia yang digunakan dalam pengoptimumam aktivitas enzim GDH adalah voltametri. Keunggulan metode ini adalah menggunakan sedikit contoh, jumlah suatu isolat bakteri E. coli dapat ditentukan dan lebih sensitif (Iswantini et al. 1998).
Menurut Trivadila (2006) setelah 6 jam aktivitas GDH yang dihasilkan oleh sel E.
coli KRGS mencapai keadaan tunak selama
menurun memerlukan pengoptimuman terhadap proses imobilisasi enzim.
Perancangan biosensor yang lebih inovatif terus dijajagi karena masih memiliki kelemahan, yaitu, waktu respon yang relatif lambat, rentang linear sempit, sensitivitas rendah dan stabilitas kurang baik, dan tidak dapat memenuhi persyaratan deteksi dengan presisi tinggi (Wang 2007). Dalam rangka meningkatkan kinerja biosensor glukosa, yakni meningkatkan sensitivitas dan selektivitas, penelitian yang signifikan dan upaya pengembangan telah dibuka untuk bidang ini dengan banyak metode, seperti penambahan redoks, penambahan mediator, melakukan polimerisasi, dan penambahan nanopartikel. Di antara berbagai metode, yang paling menarik saat ini adalah penggunaan nanopartikel sebagai maktriks sensor mikrob, yakni untuk meningkatkan transfer elektron dan meningkatkan elektrokatalitik yang dimiliki biosensor (Wang 2007).
Salah satu bahan yang berpotensi digunakan sebagai matriks imobilisasi GDH adalah zeolit, karena zeolit memiliki struktur yang sebagian besar tersusun dari silikon tetrahedral yang terhubung satu sama lain dengan atom oksigen membentuk pori yang khas dengan ukuran nano. Pori adalah tempat masuknya molekul gas maupun cairan dan menjerapnya dengan kuat. Pemanfaatan zeolit yang dikalsinasi sebagai matrik pengimobilisasi peroksidase dan metilena hijau telah dilakukan oleh Liu et al. 1999, juga telah dilakukan imobilisasi sitokrom c menggunakan matrik zeolit (Dai
et al. 2004). Penggunaan nanokomposit
zeolit telah dilakukan oleh Balalet al. 2009. Elektrode pasta karbon termodifikasi zeolit, dengan mediator Fe3+ menghasilkan arus yang lebih tinggi jika dibandingkan dengan tanpa menggunakan nanokomposit zeolit. Biosensor ini digunakan untuk mengukur dopamin dan triptofan. Hasil menunjukkan bahwa elektrode pasta karbon-Fe yang termodifikasi nanokomposit zeolit membuat pengukuran yang dilakukan menjadi lebih sensitif dan selektif. Karena zeolit tidak larut dalam air dan afinitas kuat zeolit menjaga Fe(III), elektrode ini memiliki stabilitas yang baik dalam percobaan berulang-ulang. Biosensor glukosa berbasis enzim GDH saat ini telah sangat berkembang dan pengembangan juga diarahkan ke arah material nano. Penelitian yang dilakukan sejauh ini hanya menggunakan matrik zeolit
terkalsinasi sedangkan penggunaan nanokomposit zeolit untuk mengimobilisasi GDH belum banyak dilaporkan. Maka pada penelitian ini, dilakukan pengoptimuman aktivitas GDH yang dihasilkan oleh E. coli
yang diimobilisasi pada matriks nanokomposit zeolit asli Indonesia, serta pengukuran stabilitas aktivitas GDH dan elektrode yang dihasilkan.
Tujuan Penelitian
Penelitian ini bertujuan menentukan kondisi optimum bagi aktivitas glukosa dehidrogenase yang dihasilkan oleh E. coli
yang diimobilisasi pada matriks nanokomposit zeolit, serta stabilitas aktivitas dan efektivitas GDH E. coli imobilisasi.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juli sampai Desember 2011 di Laboratorium Kimia Fisik dan Laboratorium Bersama, Departemen Kimia, kampus IPB Dramaga Bogor dan Laboratorium Genetika LIPI Cibinong Bogor.
METODOLOGI
Alat dan Bahan
Alat-alat yang digunakan ialah spektrofotometer spectronic 20, voltametric
analyzer, alat-alat gelas, pipet ukur, hot
plate, elektrode Ag/AgCl, elektrode pasta
karbon, platina, sel elektrokimia, laminar, inkubator, oven, otoklaf, dan sentrifuse. Bahan-bahan yang digunakan ialah mikrob (sel E.coli), tripton, yeast extract, agar nutrien, akuades, NaCl, alkohol 70%, larutan bufer fosfat pH 7 MgSO4, glukosa, pirolokuinolina kuinona (PQQ), 2,3-dimetoksi-5-metil-1,4-benzokuinon (Qo), larutan bufer fosfat, gas N2.
Lingkup Kerja
dihasilkan oleh E. coli terimobilisasi dengan metode elektrokimia. Penentuan parameter kinetika, dan juga dilakukan pengukuran stabilitas elektrode.
Media Luria Broth(LB) Agar Miring
Media Luria Broth(LB) agar miring dibuat dari tripton, yeast extract, NaCl, dan agar, dapat dilihat pada Lampiran 2. Media dibuat sebanyak satu liter yang terdiri dari 10 gram tripton, 5 gram yeast extract, 5 gram NaCl, 15 gram agar, dan akuades hingga satu liter. Media dipanaskan hingga mencair dan larut secara homogen, kemudian dituangkan ke dalam tabung reaksi yang masing-masing diisikan sebanyak 3 ml. Tabung reaksi ditutup dengan sumbat dan disterilisasi dengan otoklaf selama lebih kurang 2 jam. Setelah itu dikeluarkan dari otoklaf, tabung reaksi diletakkan pada rak miring hingga dingin dan memadat. Media selanjutkan digunakan sebagai tempat peremajaan bakteri.
Media Luria Broth (LB) Cair
(Lysogeny broth 1951)
Kandungan media LB cair sama dengan media LB agar miring, hanya saja tanpa agar. Selanjutnya proses sterilisasi tidak jauh berbeda dengan proses sterilisasi pada media agar. Dapat dilihat pada Lampiran 2.
Isolat Bakteri Escherichia coli
Bakteri E. coli ditumbuhkan pada media LB agar miring, yang dapat dilihat pada Lampiran 3, kemudian diinkubasi selama 2 hari pada suhu 37 0C. Bakteri yang tumbuh selanjutnya ditanam ke 10 ml media LB cair sebagai starter, diinkubasi hingga mencapai nilai OD610=0.5. Setengah mililiter starter
diinokulasi ke dalam 50 ml media LB cair dan diinkubasi. Sel bakteri dipanen dengan sentrifugasi kecepatan 10.000 rpm selama 15 menit. Pelet dipisahkan dengan supernatan, dicuci dengan air destilata sebanyak dua kali dan diresuspensikan dengan NaCl 0,85%.
Elektrode Pasta Karbon
Lampiran 4 menunjukkan pembuatan elektrode pasta karbon dibuat dari campuran grafit dan parafin cair 2:1. Grafit dicampur dengan parafin cair hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan elektrode sampai memadat ke permukaan. Permukaan elektrode
dihaluskan dan dibersihkan dengan kertas minyak.
Metode Pembuatan Elektrode Pembanding Ag/AgCl
Pelapisan AgCl (Huda 2010)
Kawat perak berdiameter 0,26 mm dipotong sepanjang 4 cm sebanyak 2 buah. Kawat perak ini ujungnya disambung dengan kawat tembaga yang telah dibentuk sedemikian rupa. Larutan KCl 1M disiapkan di dalam gelas piala sebanyak 50ml. Baterei 1,5V sebanyak 2 buah dirangkai seri kemudian di sambung ujung-ujung kutubnya dengan kabel yang ujungnya telah diberi penjepit. Kawat perak dihubungkan pada masing-masing kutub baterei kemudian dicelupkan ke dalam larutan KCl 1M selama 1,5 menit. Kawat diangkat dan dikeringkan. AgCl akan menempel pada kawat yang dihubungkan pada kutub negatif baterei. Kawat Ag/AgCl akan berwarna hitam keabu-abuan.
Pembuatan Elektroda Pembanding Ag/AgCl (Huda 2010)
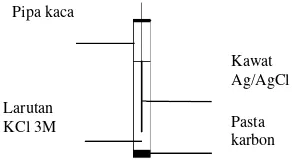
Bahan-bahan seperti pipa kaca, kawat Ag/AgCl, larutan KCl 3M, pasta karbon disiapkan. Pipa kaca sepanjang 5 cm disumbat ujungnya dengan pasta karbon. Pipa plastik yang telah disumbat dicelupkan ke dalam larutan KCl 3M. Pipa kaca tersebut dikeringkan kemudian diisi bagian dalamnya dengan larutan KCl 3M. Kawat Ag/AgCl dimasukkan ke dalam pipa kaca tersebut. Bahan-bahan tersebut disusun seperti pada Gambar 1 berikut ini:
Gambar 1 Pembuatan elektrode pembanding Ag/AgCl
(Huda 2010)
Kawat Ag/AgCl
Pasta karbon Pipa kaca
Karakterisasi Elektrode Ag/AgCl
Pengukuran elektrokimia dilakukan dengan menggunakan alat potensiostat E-DAQ, dengan 3 jenis elektrode. Emas sebagai elektrode kerja, elektrode Ag/AgCl sebagai elektrode pembanding, dan platina sebagai elektrode bantu. Larutan 0,01M K4[Fe(CN)6] dalam 0,1 M NaClO4 dimasukkan dalam gelas. Ketiga elektrode dipasang pada larutan. Potensiostat dioperasikan dengan parameter voltametri siklik (CV), pada potensial -400 mV sampai 600 mV, kecepatan sapuan 250 mV/detik, pada pengukuran 10 kali siklis. Pengukuran dilakukan sebanyak 6 kali pengulangan.
Imobilisasi Sel E. coli tanpa
Menggunakan Nanokomposit Zeolit
(Ikeda et al. 1998)
Sepuluh mikroliter larutan suspensi sel bakteri (OD E. coli =5,8) diteteskan pada elektrode pasta karbon, didiamkan hingga pelarutnya menguap (± 40 menit).
E. coli penghasil enzim GDH yang telah
diimobilisasi pada permukaan elektrode, kemudian dilapisi dengan membran dialisis, ditutup dengan jaring nilon dan diikat dengan parafilm. Elektrode kemudian direndam dalam larutan garam (NaCl fisiologis) pada suhu 5ºC ketika tidak digunakan, untuk memberikan keadaan yang sama dengan lingkungan sebenarnya, atau elektrode dapat langsung digunakan untuk pengukuran aktivitas GDH E. coli metode elektrokimia.
Imobilisasi sel E.coli dengan
menggunakan nanokomposit Zeolit
Zeolit yang digunakan dalam penelitian ini berasal dari Bayah, Banten. Matrik nanokomposit zeolit yang digunakan dibuat bervariasi 25 mg, 50 mg, 100 mg, 250 mg disuspensikan ke dalam larutan bufer fosfat pH 7 yang mengandung E. coli penghasil enzim GDH dan campuran reaksi selanjutnya didiamkan selama 24 jam dan diaduk secara konstan pada suhu 100C. Campuran selanjutnya disentrifugasi dan dipisahkan suspensinya. Suspensi dicuci dengan NaCl 0,85% beberapa kali dan disentrifugasi kembali. Sel bakteri E.coli yang telah diimobilisasi selanjutnya dikeringkan pada suhu 40C.
Sepuluh mikroliter larutan suspensi sel E
.coli (OD E. coli =5,8) diteteskan pada
elektrode pasta karbon, didiamkan hingga pelarutnya menguap ( ± 30 menit).
E. coli penghasil enzim GDH yang telah
diimobilisasi dalam matriks zeolit pada permukaan elektrode, kemudian dilapisi dengan membran dialisis, ditutup dengan jaring nilon dan diikat dengan parafilm. Elektrode kemudian direndam dalam larutan garam (NaCl fisiologis) pada suhu 5ºC ketika tidak digunakan, untuk memberikan keadaan yang sama dengan lingkungan sebenarnya. Elektrode dapat langsung digunakan untuk pengukuran aktivias GDH metode elektrokimia.
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan menggunakan alat potensiostat/ galvanostat eDAQ Potentiostat dan komputer beserta perangkat lunak pengolah data E.chem. Elektrode yang digunakan yaitu elektrode Ag/AgCl, platina dan elektrode pasta karbon-sel bakteri berturut-turut sebagai elektrode rujukan, pembantu, dan kerja. Parameter pengukuran disesuaikan sebagai berikut:
Mode : Cyclic
Initial : -400 mV
Final : 600 mV
Rate : 250 mV/s
Step W : 20 ms
Upper E : 600 mV
Lower E : -400 mV
Range : 5 V
Pengoptimalisasian Aktivitas GDH Sel
Bakteri E. coli Terimobilisasi
Optimalisasi yang dilakukan adalah optimalisasi suhu (25-350C), pH (7-11), konsentrasi PQQ (0,1–6 µM), konsentrasi glukosa (0,5-20 mM). Kombinasi dan parameter yang dioptimalisasi dapat dilihat di Lampiran 5 dan 6.
Parameter Kinetika
Penentuan parameter kinetika dilakukan setelah diperoleh kondisi optimum bagi aktivitas GDH imobilisasi (suhu, pH, [PQQ], dan [glukosa]). Prosedur secara umum adalah sama, namun pada uji kinetika, konsentrasi substrat glukosa divariasikan, yaitu dengan memvariasikan konsentrasi glukosa antara 0,5 – 75 mM.
Parameter kinetika GDH E. coli
Dengan adalah respon arus maksimum yang terukur (apparent), adalah konstanta Michaelis-Menten (apparent) dan [glukosa] adalah konsentrasi glukosa. Selanjutnya dari persamaan Michaelis– Menten dibuat kurva dari turunan persamaan Michaelis-Menten, yaitu plot Lineweaver-Burk (Trivadila 2011).
Stabilitas Aktivitas GDH Sel Bakteri
E .coli
Stabilitas aktivitas enzim GDH E. coli
imobilisasi dapat ditentunkan setelah diperoleh kondisi optimal. Penentuan stabilitas dilakukan pada bakteri E.coli tanpa nanokomposit zeolit dan dengan nanokomposit zeolit. Proses pengukuran sama seperti tahap optimalisasi. Akan tetapi pengukuran dilakukan setiap 2 jam sekali hingga 48 jam.
HASIL DAN PEMBAHASAN
Pembuatan Elektrode Pembanding Ag/AgCl
Larutan KCl sebagai larutan elektrolit yang digunakan untuk proses pelapisan AgCl pada kawat Ag. Baterei digunakan sebagai sumber arus pada proses elektrolisis. Ujung-ujung kutub baterei disambung dengan kabel yang ada penjepit, agar memudahkan dalam menghubungkan dengan kawat perak yang akan dielektrolisis. Kawat perak yang telah disiapkan dihubungkan pada masing masing kutub baterei, dicelupkan ke dalam larutan KCl 1 M untuk dielektrolisis. Proses elektrolisis dilakukan selama 1,5 menit. Kawat Ag pada kutub positif baterei sebagai anode sedangkan kawat Ag pada kutub negatif baterei sebagai katode. Pada katode akan terjadi proses reduksi sedangkan pada anode akan terjadi proses oksidasi. Kawat Ag pada katode akan terlapisi oleh AgCl yang berwarna hitam keabuabuan. Lama elektrolisis berpengaruh pada ketebalan AgCl pada kawat Ag, semakin lama prosesnya maka akan semakin tebal sampai batas tertentu, dan semakin sebentar prosesnya maka akan semakin tipis ketebalannya. Ketebalan optimum berada
pada saat kawat Ag/AgCl hitam keabuan yang cukup tebal (± 30 menit proses elektrolisis). Kawat Ag/AgCl yang telah terbentuk kemudian dikeringkan di udara terbuka.
Penentuan Kinerja Elektrode Pembanding Ag/AgCl
Pengukuran arus puncak K3Fe(CN)6 0,01M dalam elektrolit pendukung natrium perklorat (NaClO4) 0,1 M dengan menggunakan tekhnik voltametri siklik seperti yang dicantumkan pada Gambar 2 mengungkapkan bahwa arus puncak anodik (ipa) rata-rata diperoleh pada potensial +280,99 mV dan arus puncak katodik (ipc) rata-rata diperoleh pada potensial +222,49 mV. Berdasarkan nilai potensial puncak anodik dan katodik ini, jumlah elektron (n) yang terlibat dalam reaksi dapat ditentukan dengan Persamaan Nernst sebagai berikut :
dengan ∆Ep = |Epa – Epc|
Dari persamaan diatas, jumlah elektron yang terlibat pada pengukuran larutan K3Fe(CN)6 0,01 M adalah sebagai berikut :
Nilai n mendekati 1 mengindikasikan bahwa jumlah elektron yang terlibat (n) bersesuaian dengan nilai n pada reaksi oksidasi-reduksi [Fe(CN)6]3- yang hanya melibatkan satu elektron, seperti yang diperlihatkan pada reaksi berikut ini :
1. Reaksi reduksi :
[Fe(CN)6]3- + e-→ [Fe(CN)6]4- 2. Reaksi Oksidasi :
[Fe(CN)6]4-→ [Fe(CN)6]3- + e-
Disamping itu, selain berdasarkan analisis nilai potensial pengukuran, jumlah elektron yang terlibat dapat dihitung berdasarkan perbandingan arus puncak anodik dan katodik yang diperoleh
memiliki nilai yang tidak jauh berbeda dengan nilai potensial pada elektrode komersial yaitu dengan kisaran 0,21-0,25 V. (Amazon 2010).
-0,4 -0,2 0,0 0,2 0,4 0,6
-10 -8 -6 -4 -2 0 2 4 6 8 ar us , I ( µ A )
E (V vs Ag/AgCl)
NaOCl4 K3FeCN6
Gambar 2 Voltamogram siklik pada pengukuran larutan
K3Fe(CN)6 0,01 M
Pengoptimuman Aktivitas GDH
Imobilisasi Sel Bakteri E.coli Tanpa
Nanokomposit Zeolit
Penentuan aktivitas GDH ditunjukkan pada Lampiran 4 (tanpa maupun dengan nanokomposit zeolit). Voltamogram pada Lampiran 5 yang telah diperoleh kemudian dianalisis untuk mendapatkan nilai kenaikan puncak arus oksidasi yang terjadi. Gambar 2 menunjukkan mekanisme reaksi oksidasi glukosa yang dikatalis oleh GDH E. coli
imobilisasi pada permukaan elektrode pasta karbon dengan Q0 sebagai mediator.
Gambar 3 Oksidasi glukosa dengan katalis PQQGDH
dan mediator Qo (Ikeda et al. 2001)
Elektron yang dihasilkan pada proses oksidasi glukosa membentuk asam glukonat dengan GDH sebagai katalis menghasilkan respon arus yang terukur (Trivadila 2006). Substrat glukosa teroksidasi, elektron yang
dilepaskan akan ditangkap oleh Q0 yang berfungsi sebagai mediator. Substrat yang teroksidasi akan membentuk asam glukonat dan elektron yang dihasilkan sebanding dengan nilai arus yang terbaca. Gambar 3 menunjukkan kontur hubungan antara berbagai faktor dan puncak arus oksidasi yang dihasilkan. Berdasarkan hasil pengoptimalisasian diperoleh kondisi optimal aktivitas GDH E. coli yang diimobilisasi tanpa nanokomposit zeolit adalah pada suhu 30°C, pH 6, konsentrasi glukosa 15 mM, dan konsentrasi PQQ 2,6009 µM.
(a) (b)
(c) (d)
(e)
(f)
Gambar 4 Alur kontur pada aktivitas GDH E.coli tanpa matriks imobilisasi nanokomposit
zeolit, hubungan antara konsentrasi glukosa dan konsentrasi PQQ (a), pH dan konsentrasi PQQ (b), pH dan konsentrasi glukosa (c), suhu dan konsentrasi PQQ (d),suhu dan pH (e) dan konsentrasi glukosa terhadap puncak arus oksidasi (f).
Ito et al. 2002 melaporkan hasil
pengoptimuman sel E. coli K-12 (IFO3301) terhadap larutan bufer fosfat, dengan hasil optimum pada pH 6,5-7. Iswantini et al.
(2011) melakukan penelitian dan diperoleh kondisi optimum aktivitas GDH sel bakteri
[Glukosa] [ P Q Q } 20 18 16 14 12 10 6 5 4 3 2 1 Hold Values Suhu 30 pH6 MgSO4 0,0 - 0,5 0,5 - 1,0 1,0 - 1,5 > 1,5 < -0,5 -0,5 - 0,0
Contour Plot of MgSO4 vs [PQQ} ; [Glukosa]
pH [ P Q Q } 7,0 6,5 6,0 5,5 5,0 6 5 4 3 2 1 Hold Values Suhu 30 [Glukosa] 15 MgSO4 0,4 - 0,8 0,8 - 1,2 1,2 - 1,6 > 1,6 < 0,0 0,0 - 0,4
Contour Plot of MgSO4 vs [PQQ} ; pH
pH [ G lu k o s a ] 7,0 6,5 6,0 5,5 5,0 20 18 16 14 12 10 Hold Values Suhu30 [PQQ} 3,05 MgSO4 0,6 - 0,8 0,8 - 1,0 1,0 - 1,2 1,2 - 1,4 1,4 - 1,6 <
> 1,6 0,4 0,4 - 0,6
Contour Plot of MgSO4 vs [Glukosa]; pH
Suhu [ P Q Q } 35,0 32,5 30,0 27,5 25,0 6 5 4 3 2 1 Hold Values pH 6 [Glukosa] 15 MgSO4 -0,5 - 0,0 0,0 - 0,5 0,5 - 1,0 1,0 - 1,5 > 1,5 < -1,0 -1,0 - -0,5
Contour Plot of MgSO4 vs [PQQ} ; Suhu
Suhu p H 35,0 32,5 30,0 27,5 25,0 7,0 6,5 6,0 5,5 5,0 Hold Values [Glukosa]15 [PQQ}3,05 MgSO4 0,5 - 1,0 1,0 - 1,5 > 1,5 < 0,0 0,0 - 0,5
Contour Plot of MgSO4 vs pH; Suhu
Suhu [ G lu k o s a ] 35,0 32,5 30,0 27,5 25,0 20 18 16 14 12 10 Hold Values pH 6 [PQQ} 3,05 MgSO4 0,5 - 1,0 1,0 - 1,5 > 1,5 < 0,0 0,0 - 0,5
Contour Plot of MgSO4 vs [Glukosa]; Suhu
E. coli pada larutan bufer fosfat pH 6,5, konsentrasi PQQ 4,6 µM, dan konsentrasi glukosa 20 mM. Hapsari 2011 memperoleh kondisi optimum pada suhu 30 °C, pH larutan bufer fosfat 6, konsentrasi glukosa 10,25 mM dan konsentrasi PQQ 3,05 µM . Dapat diketahui bahwa hasil yang diperoleh pada penelitian ini dan sebelumnya, yang aktivitas optimum GDH sel bakteri E. coli
berada pada kisarann pH 6,5-7, dan suhu 30°C.
Pengoptimuman Aktivitas GDH sel
Bakteri E.coli Dengan Nanokomposit
Zeolit
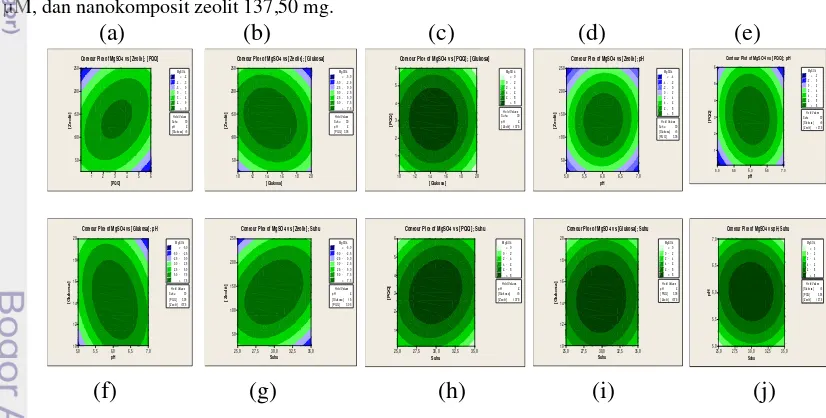
Data hasil pengoptimuman aktivitas
GDH E. coli imobilisasi dengan matriks
nanokomposit zeolit ditunjukkan pada Lampiran 6. Gambar 4 menunjukkan alur kontur hubungan berbagai variasi parameter optimalisasi dan puncak arus oksidasi yang dihasilkan.
Hasil pengoptimalisasian menghasilkan
GDH E. coli yang diimobilisasi dengan
nanokomposit zeolit tidak jauh berbeda dengan kondisi optimum yang dihasilkan oleh GDH E. coli yang diimobilisasi tanpa menggunakan matriks nanokomposit zeolit, yaitu pada suhu 30 °C, pH 6, konsentrasi glukosa 15,00 mM, konsentrasi PQQ 3,050 µM, dan nanokomposit zeolit 137,50 mg.
Pencampuran sel bakteri E. coli dengan larutan bufer fosfat pH 6,5 sangat berpengaruh terhadap pergeseran nilai pH optimum. Hal ini dikarenakan sel bakteri E. coli dijerap terlebih dahulu dengan nanokomposit zeolit yang telah dilarutkan dengan bufer fosfat pH 6,5 sebelum proses imobilisasi sel bakteri pada permukaan elektrode. Oleh karena itu, sel bakteri telah terstabilkan oleh penjerapan.
Jika dibandingkan dengan penelitian Hapsari (2011) yang mengimobilisasi sel E. coli menggunakan glutaraldehida sebagai matriks imobilisasi kondisi optimum yang didapat adalah suhu 30°C, pH 6, konsentrasi glukosa 10,25 mM, konsentrasi PQQ 3,05 µM, dan glutaraldehida 12,5 µL. Suhu, pH dan konsentrasi PQQ optimum yang diperoleh adalah sama. Sedangkan konsentrasi glukosa optimum berbeda. Konsentrasi glukosa optimum yang dihasilkan pada penelitian Hapsari sedikit lebih rendah dari pada penelitian ini. Karena GDH yang dihasilkan oleh E. coli dengan pembahan matriks glutaraldehida lebih mudah mengikat enzim, sehingga konsentrasi glukosa yang dibutuhkan lebih
(a)
(b) (c)
(d)
(e)
(f) (g) (h) (i) (j)
Gambar 5 Alur kontur pada aktivitas GDH dengan matriks nanokomposit zeolit, hubungan antara konsentrasi PQQ dan nanokomposit zeolit (a), konsentrasi glukosa dan nanokomposit zeolit (b), konsentrasi PQQ dan konsentrasi glukosa (c), pH dan nanokomposit zeolit (d), pH dan konsentrasi PQQ (e), pH dan konsentasi glukosa (f), nanokomposit zeolit dan suhu (g), konsentrasi PQQ dan suhu (h), konsentrasi glukosa dan suhu (i), pH dan suhu terhadap puncak arus oksidasi (j).
[PQQ] [Z e o lit ] 6 5 4 3 2 1 250 200 150 100 50 Hold Values Suhu 30 pH 6 [ Glukosa] 15 MgSO4
-3 - 0 0 - 3 3 - 6 6 - 9 > 9 < -6 -6 - -3 Contour Plot of MgSO4 vs [Zeolit]; [PQQ]
[Glukosa] [Z e o lit ] 20 18 16 14 12 10 250 200 150 100 50 Hold Values Suhu30 pH 6 [ PQQ] 3,05 MgSO4
-2,5 - 0,0 0,0 - 2,5 2,5 - 5,0 5,0 - 7,5 > 7,5 < -5,0 -5,0 - -2,5 Contour Plot of MgSO4 vs [Zeolit]; [Glukosa]
[ Glukosa] [ P Q Q ] 20 18 16 14 12 10 6 5 4 3 2 1 Hold Values Suhu 30 pH 6 [ Zeolit]137,5 MgSO4
2 - 4 4 - 6 6 - 8 > 8 < 0 0 - 2 Contour Plot of MgSO4 vs [ PQQ] ; [ Glukosa]
pH [Z e o lit ] 7,0 6,5 6,0 5,5 5,0 250 200 150 100 50 Hold Values Suhu 30 [ Gluk osa]15 [ PQQ]3,05 MgSO4
-2 - 0 0 - 2 2 - 4 4 - 6 6 - 8 <
> 8 -4 -4 - -2 Contour Plot of MgSO4 vs [Zeolit]; pH
pH [ P Q Q ] 7,0 6,5 6,0 5,5 5,0 6 5 4 3 2 1 Hold Values Suhu 30 [ Glukosa]15 [ Zeolit]137,5 MgSO4 0 - 2 2 - 4 4 - 6 6 - 8 > 8 < -2 -2 - 0 Contour Plot of MgSO4 vs [PQQ]; pH
pH [ G lu k o s a ] 7,0 6,5 6,0 5,5 5,0 20 18 16 14 12 10 Hold Values Suhu 30 [ PQQ]3,05 [ Zeolit] 137,5 MgSO4
-2,5 - 0,0 0,0 - 2,5 2,5 - 5,0 5,0 - 7,5 > 7,5 < -5,0 -5,0 - -2,5 Contour Plot of MgSO4 vs [Glukosa]; pH
Suhu [ Z e o lit ] 35,0 32,5 30,0 27,5 25,0 250 200 150 100 50 Hold Values pH 6 [ Glukosa]15 [ PQQ]3,05 MgSO4
-2,5 - 0,0 0,0 - 2,5 2,5 - 5,0 5,0 - 7,5 > 7,5 < -5,0 -5,0 - -2,5 Contour Plot of MgSO4 vs [Zeolit]; Suhu
Suhu [ P Q Q ] 35,0 32,5 30,0 27,5 25,0 6 5 4 3 2 1 Hold Values pH 6 [ Gluk osa]15 [ Zeolit]137,5 MgSO4
2 - 4 4 - 6 6 - 8 > 8 < 0 0 - 2 Contour Plot of MgSO4 vs [ PQQ] ; Suhu
Suhu [ G lu k o s a ] 35,0 32,5 30,0 27,5 25,0 20 18 16 14 12 10 Hold Values pH 6 [ PQQ]3,05 [ Zeolit] 137,5 MgSO4
2 - 4 4 - 6 6 - 8 > 8 < 0 0 - 2 Contour Plot of MgSO4 vs [Glukosa]; Suhu
Suhu p H 35,0 32,5 30,0 27,5 25,0 7,0 6,5 6,0 5,5 5,0 Hold Values [Glukosa]15 [PQQ] 3,05 [Zeolit]137,5 MgSO4
sedikit daripada nanokomposit zeolit. Terlihat dari nilai KM app yang lebih kecil pada GDH dengan penambahan matriks glutaraldehida dibandingkan dengan penambahan matriks naokomposit zeolit. Dikarenakan nilai KM app yang kecil mengartikan bahwa enzim mengikat substrat dengan kuat sehingga dengan subtrat yang sedikit cukup untuk menjenuhkan enzim, karena mudahnya proses pengikatan maka lebih dibutuhkan sedikit konsentrasi glukosa untuk menaikkan arus jika dibandingkan dengan matriks nanokomposit zeolit.
Terdapat perbedaan pada parameter konsentrasi glukosa dan konsentrasi PQQ yang didapat. Penambahan matriks nanokomposit zeolit memerlukan konsentrasi glukosa yang lebih tinggi untuk menaikkan arus GDH E. coli sedangkan konsentrasi PQQ yang diperlukan pada penggunaan matriks nanokomposit zeolit lebih rendah dibandingkan dengan glutaraldehida.
Hasil pengoptimalisasian menggunakan matriks nanokomposit zeolit diperoleh bahwa arus GDH E. coli yang dihasilkan sepuluh kali lebih tinggi jika dibandingkan tanpa matriks nanokomposit zeolit. Ditunjukkan dengan arus optimum yang dihasilkan GDH E. coli imobilisasi adalah sebesar 11,840 µA, sedangkan jika menggunakan glutaraldehida hanya 2 kali lebih besar, yaitu diperoleh arus optimum sebesar 1,290 µA. Kemampuan zeolit dalam meningkatkan puncak arus ini bisa disebabkan karena sifatnya yang hidrofilik karena adanya gugus –OH di sekitar pori sehingga baik untuk digunakan sebagai matriks imobilisasi enzim (Valdes et al. 2006). Selain itu zeolit memiliki karakteristik yang unik, di antaranya stabil pada suhu yang tinggi, tahan terhadap pelarut organik dan sifatnya yang keras. Sehingga lebih stabil terhadap tekanan mekanik yang tinggi, dan akan menyebabkan enzim yang terjerap akan lebih banyak. Selain itu rangka dan pori dari struktur zeolit yang beraturan menyebabkan selektivitas dan reprodusibilitas yang akan dihasilkan tinggi (Valdes et al. 2006).
Hasil pengoptimuman dilihat dari kontur hubungan antara GDH E. coli yang diimobilisasi dengan nanokomposit zeolit ataupun tanpa nanokomposit zeolit tidak jauh berbeda. Hal ini disebabkan kisaran daerah optimum sel GDH E.coli tidak berubah walaupun ada penambahan matriks lainnya. Untuk pengoptimalisasi
menggunakan glutaraldehida pun diperoleh banyak kesamaan, hanya terjadi perbedaan pada konsentrasi glukosa. Dapat diketahui bahwa adanya matriks imobilisasi hanya berpengaruh terhadap parameter konsentrasi glukosa saja.
Kinetika Enzim Glukosa Dehidrogenase Imobilisasi
Penentuan parameter kinetika enzim dilakukan untuk melihat pengaruh konsentrasi substrat glukosa terhadap aktivitas GDH E. coli imobilisasi, maka dilakukan pengukuran aktivitas GDH dengan variasi konsentrasi 0,5-75 mM. Data hasil pengoptimuman ditunjukkan pada Lampiran 8. Parameter kinetika enzim imobilisasi adalah tetapan Michaelis-Menten nyata (KM app) dan laju reaksi nyata (Vmaks app) yang dianalogikan dengan arus maksimum nyata (Imaks app).
Hubungan konsentrasi substrat dan aktivitas GDH E. coli tanpa maupun dengan matriks nanokomposit zeolit ditunjukkan pada Gambar 5.
Gambar 6 Hubungan konsentrasi glukosa dan aktivitas GDH
Berdasarkan kurva hubungan konsentrasi glukosa dengan aktivitas GDH, terjadi reaksi dalam 2 tahap: pada kisaran konsentrasi 0,5-20 mM reaksi berada pada fase pertama, pada saat tidak semua sisi aktif GDH mengikat substrat glukosa. Kemudian fase kedua terjadi pada kisaran konsentrasi 20-50 mM, tapak aktif GDH telah mengikat substrat glukosa seluruhnya, dan pada saat itu enzim telah bekerja dengan kapasitas penuh. Penambahan konsentrasi glukosa lebih dari 50 mM dan yang lebih tinggi tidak memengaruhi aktivitas GDH.
kisaran linearitas yang lebih lebar dibandingkan dengan tanpa nanokomposit zeolit, yaitu antara 0-55 mM untuk penggunaan matriks nanokomposit zeolit dan 0-50 mM untuk tanpa matriks nanokomposit zeolit. Begitu pula dengan nilai R2 dengan matriks nanokomposit zeolit diperoleh lebih tinggi daripada tanpa nanokomposit zeolit. Dapat menunjukkan bahwa GDH E. coli dengan matriks nanokomposit zeolit berpotensi memberikan hasil pengukuran yang lebih tepat dibandingkan tanpa nanokomposit zeolit Kisaran ini lebih lebar dibandingkan dengan Hapsari (2011) yang melakukan imobilisasi
GDH E. coli dengan matriks glutaraldehida
yaitu 0-30 mM. Gaikward (2006) yang melakukan imobilisasi GOD dengan taut-silang glutaraldehida memperoleh kisaran linear pada 0-50 mM.
Gambar 7 Linearitas konsentrasi glukosa dengan aktivitas GDH
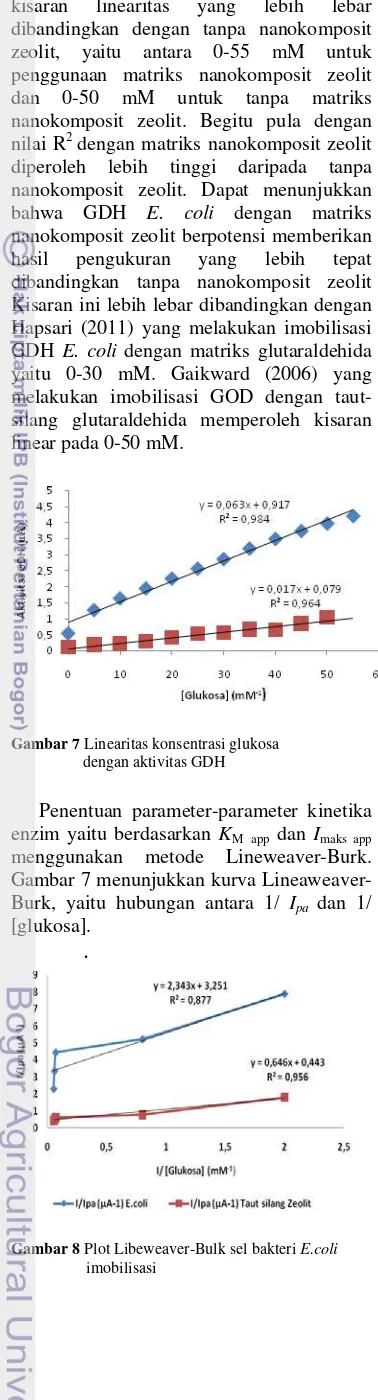
Penentuan parameter-parameter kinetika enzim yaitu berdasarkan KM app dan Imaks app menggunakan metode Lineweaver-Burk. Gambar 7 menunjukkan kurva Lineaweaver-Burk, yaitu hubungan antara 1/ Ipa dan 1/ [glukosa].
.
Gambar 8 Plot Libeweaver-Bulk sel bakteri E.coli imobilisasi
Nilai KM app ditunjukkan pada Tabel 1. Nilai KM app sel bakteri E. coli dengan nanokomposit zeolit diperoleh lebih besar dibandingkan dengan tanpa matriks nanokomposit zeolit. Begitu pula nilai Imaks app dengan nanokomposit zeolit. Nilai KM app yang dihasilkan pada enzim GDH sel bakteri
E. coli ialah 0,720 mM. Sedangkan pada sel
bakteri matriks nanokomposit zeolit diperoleh 1,4580 mM.
Tabel 1 Nilai parameter kinetika sel bakteri E.coli
Nilai KM merupakan ukuran kuat atau lemahnya enzim dalam mengikat substrat. Maka jika diperoleh nilai KM kecil, menandakan bahwa enzim mengikat kuat substrat sehingga dengan jumlah substrat yang sedikit cukup untuk menjenuhkan enzim. Begitu pula sebaliknya jika diperoleh nilai KM besar, menunjukkan bahwa enzim tidak terlalu dapat mengikat substrat sehingga substrat yang dibutuhkan untuk menjenuhkan enzim lebih banyak. Berdasarkan penelitian ini, dapat diketahui bahwa adanya nanokomposit zeolit menghasilkan KM app yang lebih besar dibandingan dengan KM app tanpa matriks nanokomposit zeolit. Adanya penambahan zeolit sebagai matriks imobilisasi dapat diartikan bahwa GDH E.coli dengan penambahan nanokomposit zeolit tidak terlalu dapat mengikat substrat glukosa dibandingkan dengan tanpa ada nanokomposit zeolit. Jika dibandingkan dengan Hapsari (2011) yang menggunakan glutaraldehida sebagai matriks imobilisasi KM app yang diperoleh pada penelitian tersebut juga lebih besar dibandingkan dengan penggunaan matriks nanokomposit zeolit. Hal ini dapat disebabkan, pada glutaraldehida terjadi taut-silang antara gugus asam amino pada GDH E. coli dengan glutaraldehida, sehingga lebih bisa mengikat substrat glukosa. Selain adanya penambahan BSA pada glutaraldehida dapat mengurangi denaturasi enzim. Yakni dengan cara memblok kelebihan gugus fungsional yang aktif (Cao 2005). Adanya ikatan taut-silang intramolekul yang berlebihan didalam enzim dapat dihindari sehingga taut-silang antar molekul enzim dan stabilitasnya dapat ditingkatkan. Sedangkan pada nanokomposit
Metode GDH sel Bakteri
E.coli
Penjerapan Nanokomposit
Zeolit
Imaks app
(µA)
KM app Imaks app
(µA)
KM app
Lineweaver-Burk
zeolit hanya dapat meningkatkan puncak arus anodik sehingga memiliki potensi sebagai reagen biofungsional yang dapat meningkatkan efektivitas biosensor glukosa berbasis E. coli.
Stabilitas Enzim Glukosa Dehidrogenase
Sel Bakteri E. coli Imobilisasi
Penggunaan voltametri juga dapat dilakukan untuk menentukan stabilitas dari aktivitas GDH sel bakteri E. coli. Pengukuran aktivitas dilakukan setelah imobilisasi diperoleh kondisi optimum bagi aktivitas GDH sel bakteri E. coli
.
Hubungan waktu dan arus yang menunjukkan aktivitas GDH sel bakteri E. coli diukur pada menit ke-0 dan kestabilan setelah 48 jam, dengan selang waktu 30 menit, 1 jam dan 6 jam.Stabilitas dan selektivitas sangat dibutuhkan dalam proses imobilisasi enzim. Aktivitas enzim sangat dipengaruhi oleh adanya perubahan suhu dan pH yang ekstrim, karena dapat membuat enzim mudah terdenaturasi. Untuk menjaga fungsi katalitik enzim pada kondisi ekstrim dilakukan imobilisasi pada permukaan material penyangga padat. Selain itu imobilisasi dapat meningkatkan kestabilan enzim, dan mempermudah pemisahan produk, sehingga tidak perlu dilakukan proses lebih lanjut seperti penghilangan enzim.
Stabilitas GDH ditunjukkan pada Gambar 8 baik menggunakan nanokomposit zeolit ataupun tidak. Stabilitas GDH dilakukan pada 0 hingga 6 jam setiap 1 jam, lalu 12 jam, 24 jam, dan 48 jam. Gambar tersebut menunjukkan bahwa stabilitas GDH baik dengan nanokomposit zeolit ataupun tanpa nanokomposit zeolit tidaklah jauh berbeda. Saat waktu 30 menit aktivitas sel GDH baik tanpa ataupun dengan nanokomposit zeolit mengalami penurunan masing-masing 52,8% dan 53,72%. GDH sel bakteri E. coli tanpa nanokomposit zeolit setelah 3 jam tidak menghasilkan puncak arus oksidasi. Akan tetapi sel bakteri yang diimobilisasi oleh nanokomposit zeolit masih menghasilkan puncak arus oksidasi hingga 48 jam. Penelitian Trivadila (2006), aktivitas GDH E. coli imobilisasi turun setelah 6 jam. Hasil Penelitian ini menunjukkan bahwa adanya nanokomposit zeolit yang menjerap sel bakteri E.coli dapat meningkatkan stabilitas enzim GDH.
Walaupun dapat meningkatkan kestabilan GDH E. coli, adanya penambahan
zeolit sebagai matriks imobilisasi pada sel bakteri E. coli tidak serta merta dapat memberikan stabilitas yang cukup baik. Tatiana et al (2010) dan Hapsari (2011) melakukan penelitian stabilisasi sel bakteri
E. coli menggunakan glutaraldehid, kedua
penelitian ini memperoleh kestabilan yang lebih tinggi dibanding yang hanya menggunakan zeolit. Gaikward et al. (2006) melakukan imobilisasi GOD pada film komposit polyanilin-polivinil sulfonat (PANI-PVS) menggunakan taut-silang glutaraldehida memiliki stabilitas yang tinggi, yaitu 100% saat waktu 2 jam. Hal ini dapat disebabkan, pada glutaraldehida terjadi taut-silang antara gugus asam amino pada GDH E. coli dengan glutaraldehida, senyawa-senyawa aldehida bereaksi pada kedua ujung glutaraldehida bereaksi dengan kelompok amino bebas (kelompok ɛ -amino, kelompok amino N-terminal) enzim, sehingga glutaraldehida lebih bisa mengikat substrat glukosa. Sedangkan pada nanokomposit zeolit hanya dapat meningkatkan puncak arus anodik sehingga memiliki potensi sebagai reagen biofungsional yang dapat meningkatkan efektivitas biosensor glukosa yang berbasis
E. coli. Pada mekanismenya sel bakteri
hanya terjerap pada pori-pori nanokomposit zeolit dan tidak mengalami ikatan taut-silang, sehingga kestabilan yang diperoleh nanokomposit zeolit lebih kecil jika dibandingkan dengan taut-silang glutaraldehida.
Gambar 9 Stabilitas E.coli
agen polifungsional yang membentuk ikatan kovalen antara partikel biokatalis atau protein. Oleh karena itu, enzim yang di imobilisasi dengan glutaraldehida sering digunakan untuk pengembangan biosensor berbasis enzim.
Penggunaan bufer fosfat dalam proses taut-silang dengan glutaraldehida juga menyebabkan enzim mengalami stabilisasi. Adanya perbedaan bentuk partikel nanokomposit zeolit yang berupa padatan, membuat enzim yang terimobilisasi tidak sehomogen glutaraldehida yang sudah dalam bentuk cairan. Enzim yang terimobilasi glutaraldehida dapat bertahan hingga 35 hari, sedangkan dengan nanokomposit zeolit hanya bertahan 7 hari (Tatiana et al 2010).
SIMPULAN DAN SARAN
Simpulan
Penggunaan nanokomposit zeolit sebagai matriks imobilisasi menghasilkan aktivitas GDH sel bakteri E. coli sebesar 10 kali lipat dibandingkan dengan sel bakteri E. coli
tanpa matriks nanokomposit zeolit. Diperoleh kondisi optimum untuk GDH E. coli tanpa nanokomposit zeolit pada suhu 30°C, pH 6, konsentrasi glukosa 15 mM, dan konsentrasi PQQ 2,6009 µM, sedang untuk imobilisasi GDH E. coli dengan matriks nanokomposit zeolit diperoleh kondisi optimum suhu 30°C, pH 6, konsentrasi glukosa 15 mM, dan konsentrasi PQQ 3,05 µM
Nilai KM app GDH sel bakteri E. coli dengan nanokomposit zeolit lebih besar dibandingkan tanpa nanokomposit zeolit. Hal ini menunjukkan bahwa afinitas GDH E. coli imobilisasi terhadap substrat glukosa tanpa nanokomposit zeolit lebih besar dibandingkan dengan matriks nanokomposit zeolit. Stabilitas aktivitas GDH dengan matriks nanokomposit zeolit lebih sedikit stabil jika dibandingkan tanpa matriks nanokomposit zeolit.
Efektivitas biosensor glukosa menggunakan matriks nanokomposit zeolit memiliki sensitivitas dan selektifitas yang cukup baik serta respon yang cukup cepat jika dibandingkan dengan biosensor glukosa tanpa matriks imobilisasi.
Saran
Perlu dilakukan penambahan glutaraldehida pada matriks imobilisasi sebagai penaut-silang agar dapat
mempertahankan kestabilan aktivitas GDH
sel E.coli.
DAFTAR PUSTAKA
Amazon. 2010.Potensials of common reference elektrodes. [terhubung
berkala].
research solution/electrochemistry resorces/potensial.html. [9 Januari 2012].
Balal Khalilzadeh. 2009. Zeolite Nanoparticle Modified Carbon Paste Electrode as a Biosensor for Simultaneous Determination of
Dopamine and Tryptophan.
[terhubung berkala].
16 April 2011].
Cao LQ. 2005. Immobilized enzyme: science or art Current Opinion. Chem
Biol9: 217-226.
Dai Z, Liu S, Ju H.2004. direct electron transfer of cytochrome c immobilized on a NaY zeolite matrix and its applications in biosensing. Electro
Acta 49:2139-2144.
Gaikwad et al. 2006. Immobilization of GOD on electrochemically synthesized PANI film by cross-linking via glutaraldehyde for determination of glucose. Int J
Electrochem Scien 1: 425-434.
Hapsari R. 2011. Stabilitas dan efektivitas biosensor glukosa berbasis
Escherichia coli menggunakan
imobilisasi glutaraldehida. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ikeda et al. 1998. Electrichemical monitoring of in vivo reconstitution of glucose dehydrogenase in
Escherichia coli cells with externally
added pyrroloquinoline quinone. J
Elekctroanal Chem 449: 219-224.
Ikeda T, Iswantini D, Yosuke I, Kano K. 2001. Electrochemical analysis of glucose dehydrogenase activity exhibited by Escherichia coli Cell. Anal Sci 17: i285-6 .
Iswantini D, Kano K, Ikeda T. 1998. Electrochemical measurements of glucose dehydrogenase activity exhibited by Escherichia coli cells; effect of the addition of pyrrloquinoline quinone, magnesium or calcium ions and ethylenediaminetetraacetic acid.
Bioelectrochem and Bioenerg 46:
249-254.
Iswantini D, Kano K, Ikeda T. 2000.
Kinetics and thermodynamics of activation of quinoprotein glucose dehydrogenase apoenzyme in vivo
and catalytic activity of the
activatedenzyme in Escherichia coli
cells. Biochem J. 350
(Pt3):917-923.PMCID:PMC 1221327.
Iswantini et al. 2011. Glucose Biosensor Using Selected Indonesian Bacteria.
[terhubung berkala].
http://jurnal.permi.or.id/index.php/mi online/ article/ download/128/pdf_1. [2 Juni 2011].
Ito Y, Yamazaki S, Karno K, Ikeda T. 2002.
Escherichia coli and its application in
a mediated amperometric glucose sensor. Biosens Bioelect 17:993-998. Liu B, Yan F, Kong J, Deng J. 1999.
Reagentless amperometric biosensor based on the coimmobilization of horseradish peroxidase and methylene green in a modified zeolite matrix. Anal Chem Acta 386 : 31-39. MatsushitaK et al. 1997. Escherichia coli is
unable to produce pyrroloquinoline quinine (PQQ). Microbiol 143 : 3149-3156.
Merck. 2010. Diabetes Mellitus. 2011].
Tatiana B, Goriuskina, Burcu Akata, Albert Sacco Jr, Sergei V, Dzyadevych. 2010. Application Of Zeolites For Immobilization Of Oxidase in Amperometric Biosensors. UDC 577.15.4+573.6
Trivadila. 2006. Aktivitas glukosa dehidrogenase pada tiga isolat bakteri Indonesia erpilih yang diimobilisasi untuk pengembangan biosensor glukosa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococcus radiodurans
diimobilisasi pada permukaan elektroda pasta karbon dan parameter kinetikanya, Bogor : Sekolah PascaSarjana, Institut Pertanian Bogor.
Turner APF. 2002. Biosensor: past, present and future.[terhubung berkala].
Valdes MG, Perez-cordoves AI,Diaz-Garcia ME. 2006. Zeolites and zeolite-based materials in analitycal chemistry. J.
Trends Anal Chem 25:24-30
Wang H.J, C.M. Zhou,. 2007. Glucose biosensor based on platinum nanoparticles supported sulfonated-carbon nanotubes modified glassy carbon electrode [terhubung berkala]. http://www.electrochemsci.org /papers/vol2/2070508 .pdf [19 Mei 2011].
. World Health Organization. 2011. Definition, Diagnosis and Classification of Diabetes Mellitus
and its Complications. [terhubung
berkala].
Lampiran 1 Bagan alir biosensor glukosa berbasis escherichia coli yang diimobilisasi pada matriks nanokomposit zeolit
Penanaman, Peremajaan, dan Panen Mikrob
Pembuatan Elektrode Pasta Karbon
Imobilisasi Mikrob Pada Permukaan Elektrode Pasta Karbon
≠ Zeolit Zeolit
Optimasi aktivitas GDH
E.coli Imobilisasi
Optimasi aktivitas GDH
E.coli imobilisasi
Penentuan Parameter Kinetika Enzim GDH
E.coli Imobilisasi
Penentuan Parameter Kinetika Enzim GDH
E.coli Imobilisasi
Kestabilan Elektrode
Lampiran 2 Bagan alir pembuatan media
Media Broth (LB) agar miring
Media LB cair
10g tripton + 5g yeast extract + 5g NaCl + 15g agar + 1L akuades
Diaduk hingga homogen dan dididihkan hingga mencair
Larutan media dipindahkan kedalam beberapa tabung reaksi 3 mL tabung
Tabung ditutup dengan sumbat
Sterilisasi dengan otoklaf selama 2 jam
Media didinginkan dan tabung ditempatkan pada rak miring hingga media padat
10g tripton + 5g yeast extract + 5g NaCl + 1L akuades
Diaduk hingga homogen dan didihkan
Wadah ditutup dengan sumbat
Sterilisasi dengan otoklaf selama 2 jam
Lampiran 3 Bagan alir kerja
Mikrob
Tanam pada media LB agar miring
Pelet (sel)
Resuspensi: +20 mL NaCl 0,85%
Supernatan Sentrifugasi (panen); Kec. 10000 rpm
inkubasi
Inokulasi pada 50 mL media LB cair
Inkubasi s.d. OD (610 nm) min 0,5 Tanam pada 10 mL media LB cair (starter)
Inkubasi 2 hari (37oC E.coli)
Lampiran 4 Bagan alir pembuatan elektroda pasta karbon dan imobilisasi sel bakteri
Parafin cair : grafit (1:2)
Permukaan karbon dihaluskan dengan kertas minyak
10 µL suspensi sel bakteri diimobilisasi pada permukaan elektrode
Permukaan elektrode dilapisi dengan membran dialisis Pelarut diuapkan
Elektrode disimpan dalam larutan garam fisiologis (NaCl 0,85%) 5oC jika tidak digunakan
Tutup dengan jaring nilon dan ikat dengan parafilm
Dimasukkan ke dalam badan elektroda hingga padat sampai permukaan Pasta Karbon
Lampiran 5 Pengoptimuman sel bakteri E.coli
No Suhu (°C) pH [Glukosa] [PQQ] (µM) Ipa (µA)
1 27,5 5,5 12,5 1,575 0,742
2 32,5 5,5 12,5 1,575 0,504
3 27,5 6,5 12,5 1,575 1,037
4 32,5 6,5 12,5 1,575 1,213
5 27,5 5,5 17,5 1,575 1,322
6 32,5 5,5 17,5 1,575 1,031
7 27,5 6,5 17,5 1,575 0,451
8 32,5 6,5 17,5 1,575 0,622
9 27,5 5,5 12,5 4,525 0,631
10 32,5 5,5 12,5 4,525 0,177
11 27,5 6,5 12,5 4,525 0,601
12 32,5 6,5 12,5 4,525 0,534
13 27,5 5,5 17,5 4,525 2,055
14 32,5 5,5 17,5 4,525 0,143
15 27,5 6,5 17,5 3,050 0,969
16 32,5 6,5 17,5 3,050 1,128
17 25,0 6,0 15,0 3,050 0,143
18 35,0 6,0 15,0 3,050 0,591
19 30,0 5,0 15,0 3,050 1,417
20 30,0 7,0 15,0 3,050 1,853
21 30,0 6,0 10,0 3,050 1,237
22 30,0 6,0 20,0 3,050 2,808
23 30,0 6,0 15,0 0,100 2,062
24 30,0 6,0 15,0 6,000 0,185
25 30,0 6,0 15,0 3,050 1,652
26 30,0 6,0 15,0 3,050 1,402
27 30,0 6,0 15,0 3,050 0,966
28 30,0 6,0 15,0 3,050 0,974
29 30,0 6,0 15,0 3,050 1,862
30 30,0 6,0 15,0 3,050 1,711
Lampiran 6 Pengoptimuman sel bakteri E.coli Dengan Matriks Nanokomposit Zeolit
No Suhu (°C) pH [Glukosa] [PQQ] (µM) Nanokomposit Zeolit (mg)
Ipa (µA)
1 27,5 5,5 12,5 1,575 193,75 2,462
2 32,5 5,5 12,5 1,575 81,25 2,018
3 27,5 6,5 12,5 1,575 81,25 7,798
4 32,5 6,5 12,5 1,575 193,75 5,905
5 27,5 5,5 17,5 1,575 81,25 5,996
6 32,5 5,5 17,5 1,575 193,75 2,211
7 27,5 6,5 17,5 1,575 193,75 1,485
8 32,5 6,5 17,5 1,575 81,25 2,653
9 27,5 5,5 12,5 4,525 81,25 1,946
10 32,5 5,5 12,5 4,525 193,75 6,370
11 27,5 6,5 12,5 4,525 193,75 6,453
12 32,5 6,5 12,5 4,525 81,25 1,680
13 27,5 5,5 17,5 4,525 193,75 2,836
14 32,5 5,5 17,5 4,525 81,25 2,172
15 27,5 6,5 17,5 3,050 81,25 1,400
16 32,5 6,5 17,5 3,050 193,75 3,986
17 25,0 6,0 15,0 3,050 137,50 3,581
18 35,0 6,0 15,0 3,050 137,50 4,640
19 30,0 5,0 15,0 3,050 137,50 2,485
20 30,0 7,0 15,0 3,050 137,50 1,255
21 30,0 6,0 10,0 3,050 137,50 4,020
22 30,0 6,0 20,0 3,050 137,50 2,620
23 30,0 6,0 15,0 0,100 137,50 1,393
24 30,0 6,0 15,0 6,000 137,50 4,237
25 30,0 6,0 15,0 3,050 25,00 2,183
26 30,0 6,0 15,0 3,050 250,00 -0,240
27 30,0 6,0 15,0 3,050 137,50 11,840
28 30,0 6,0 15,0 3,050 137,50 8,835
29 30,0 6,0 15,0 3,050 137,50 9,294
30 30,0 6,0 15,0 3,050 137,50 10,260
31 30,0 6,0 15,0 3,050 137,50 10,710
Lampiran 7 Voltagram Siklik Sel Bakteri E.coli imobilisasi
Bufer Q0 PQQ Glukosa MgSO4
-0,4 -0,2 0,0 0,2 0,4 0,6
-1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4
A
kt
ivi
ta
s G
D
H
(
A
)
Variasi
Bufer
Q0
PQQ
Glukosa
MgSO4
Lampiran 8 Voltagram Siklik Sel Bakteri E.coli Imobilisasi Dengan Matriks Nanokomposit Zeolit
-0.4 -0.2 0.0 0.2 0.4 0.6
-5 -4 -3 -2 -1 0 1 2 3 4
A
kt
ivi
ta
s G
D
H
(
A
)
variasi
Potensial
Lampiran 9 Kinetika enzim glukosa dehidrogenase sel bakteri E.coli
[Glukosa]
Ipa (µA) I/ [Glukosa] I/Ipa (µA-1)
(mM) E.coli Taut-silang zeolit
(mM-1) E.coli Taut silang
Zeolit
10,00 0,127 0,554 2 7,893 1,806
12,50 0,192 1,285 0,8 5,222 0,778
15,00 0,225 1,655 0,067 4,444 0,606
17,50 0,298 1,960 0,057 3,358 0,510
Lampiran 10 Stabilitas sel bakteri E.coli
Waktu (Jam) Presentase stabilisasi (% µA)
E.coli Penjerapan Nanokomposit Zeolit
0 100 100
0,5 52,8 53,72
1 28,44 43,7
2 20,02 37,6
3 15,34 26,33
4 25,19
5 16,13
6 15,93
12 10,61
24 9,64