DETEKSI SENYAWA ANTIBAKTERI DAUN KESUM
SECARA KLT-BIOAUTOGRAFI DAN PENGARUHNYA TERHADAP MEMBRAN Escherichia coli DAN Staphylococcus aureus
FENNY IMELDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi Senyawa Antibakteri Daun Kesum secara KLT-Bioautografi dan Pengaruhnya terhadap Membran Escherichia coli dan Staphylococcus aureus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Bioautografi dan Pengaruhnya terhadap Membran Escherichia coli dan Staphylococcus aureus. Dibimbing oleh HARSI DEWANTARI KUSUMANINGRUM dan DIDAH NUR FARIDAH.
Salah satu keanekaragaman hayati yang berasal dari Kalimantan Barat adalah tanaman kesum (Polygonum minus Huds) yang umum digunakan sebagai bumbu masak pada berbagai pangan olahan lokal. Daun kesum mengandung total fenolik yang tinggi, flavonoid, alkaloid, tanin dan terpenoid yang potensial sebagai antibakteri alami. Deteksi aktivitas antimikroba suatu fraksi senyawa dari ekstrak bahan alam dapat dilakukan dengan KLT-bioautografi. KLT-bioautografi merupakan metode gabungan dari metode kimia (teknik kromatografi lapis tipis/KLT) dan mikrobiologi (pengujian aktivitas antimikroba) yang memungkinkan lokalisasi senyawa aktif. Umumnya ekstrak daun kesum diperoleh dengan metode konvensional yaitu maserasi. Teknik ini memerlukan waktu ekstraksi yang panjang, pelarut yang relatif besar dan dapat menyebabkan beberapa degradasi dari molekul target. Ultrasonikasi merupakan salah satu metode nonkonvensional, dikenal sebagai teknik inovatif yang dikembangkan untuk meminimalkan waktu ekstraksi yang singkat, efisiensi pelarut, meminimalkan biaya dan meningkatkan kualitas ekstrak.
Penelitian ini bertujuan untuk: 1) membandingkan ekstraksi daun kesum dengan teknik maserasi dan ultrasonikasi secara bertingkat menggunakan pelarut dengan polaritas berbeda, 2) melakukan skrining ekstrak berdasarkan aktivitas antibakteri ekstrak daun kesum terhadap E. coli dan S. aureus, 3) melakukan fraksinasi ekstrak daun kesum dengan aktivitas antibakteri tertinggi menggunakan KLT, 4) melakukan deteksi fraksi aktif ekstrak daun kesum dengan KLT-bioautografi, serta 5) mengetahui mekanisme penghambatan ekstrak daun kesum terhadap membran sel E. coli dan S. aureus secara in-vitro.
Penelitian ini dilaksanakan dalam lima tahap. Tahap pertama meliputi ekstraksi dengan destilasi uap-air untuk memperoleh minyak atsiri, dilanjutkan ekstraksi bertingkat dengan maserasi dan ultrasonikasi untuk memperoleh ekstrak polar, semipolar dan nonpolar. Tahap kedua meliputi analisis kualitatif fitokimia ekstrak, persiapan kultur bakteri uji dan pengujian aktivitas antibakteri ekstrak menggunakan metode agar difusi cakram, penentuan konsentrasi hambat minimum (KHM) menggunakan metode pengenceran makro. Tahap ketiga adalah fraksinasi komponen antibakteri ekstrak dengan aktivitas antibakteri tertinggi menggunakan metode KLT. Tahap keempat adalah deteksi fraksi aktif ekstrak menggunakan metode KLT-bioautografi. Tahap terakhir adalah studi mekanisme penghambatan ekstrak daun kesum terhadap membran sel dengan DNA probe staining menggunakan mikroskop fluoresens dan deteksi kebocoran material sitoplasma dengan spektrofotometer UV – Vis.
ekstrak etanol daun kesum dengan aktivitas antibakteri baik terhadap E. coli maupun S. aureus. Mekanisme penghambatan ekstrak daun kesum terhadap E. coli dan S. aureus adalah terjadinya gangguan permeabilitas membran sitoplasma yang menyebabkan kebocoran material sel.
(Polygonum minus Huds) by TLC-Bioautography Method and the Effect to Escherichia coli and Staphylococcus aureus Membrane. Supervised by HARSI DEWANTARI KUSUMANINGRUM and DIDAH NUR FARIDAH.
Kesum (Polygonum minus Huds) is the one of biodiversities from West Borneo and commonly used as flavouring ingredient for local culinary. Kesum leaves contain some bioactive compounds i.e high phenolic compounds, flavonoids, alkaloids, tannins and terpenoids which are potential as natural antibacterial agent. Detection of antimicrobial fractions of compounds from natural extracts could be done by TLC-bioautography. It is a combining method of chemical (thin layer cromatography/TLC) and microbology technique (antimicrobial activity assay) which allowed the localization of active compound. Generally, the kesum leaves extracts have been obtained by conventional maceration technique. This technique is often time consuming and requires relatively large amounts of solvent and sometimes diminishes the active compounds. Ultrasound assisted extraction (UAE) is one of the emerging technologies being developed in order to minimize the length of the extraction time, to reduce the cost, and to maximize the extract quality.
The aims of this study are: 1) comparing extraction of kesum leaves maceration technique and UAE using some solvent with different polarity by multilevel extraction, 2) screening of extract based on antibacterial activity of kesum leaves extracts against E. coli and S. aureus, 3) fractination of kesum polar, semipolar and nonpolar. The second stage covers qualitative analysis of phytochemical extracts, preparation of bacterial test and test the bacterial activity of extracts using disc – diffusion method and Minimum Inhibitory Concentration (MIC) using macrodilution method. The third stage was fractionation of extract with the highest antibacterial activity by TLC method. The fourth stage was detection the active fraction of kesum leaves extracts with TLC-bioautography, followed by TLC-bioautography. The last stage was study of mechanism inhibition of kesum leaves extracts against cell membrane by DNA probe staining using fluorescen microscopy and detection leakage of the cytoplasmic membrane has been analysed by spectrophotometer UV – Vis.
4 5
most noticeable antibacterial activity for both E. coli and S. aureus. Inhibitory mechanism of kesum leaves extract against E. coli and S. aureus is the disruption cytoplasmic membrane permeability that causes leakage of cell materials.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
DETEKSI SENYAWA ANTIBAKTERI DAUN KESUM
(
Polygonum minus
Huds) SECARA KLT-BIOAUTOGRAFI
DAN PENGARUHNYA TERHADAP MEMBRAN
Escherichia coli
DAN
Staphylococcus aureus
FENNY IMELDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Fenny Imelda
NIM : F251110021
Disetujui oleh
Komisi Pembimbing
Dr Ir Harsi Dewantari Kusumaningrum Ketua
Dr Didah Nur Faridah, STP MSi Anggota
Diketahui oleh
A.n. Ketua Program Studi Ilmu Pangan
Dr Ir Feri Kusnandar, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 30 Oktober 2013
Puji syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini dapat diselesaikan. Tema yang diangkat dalam penelitian ini ialah senyawa antibakteri alami, dengan judul Deteksi Senyawa Antibakteri Daun Kesum (Polygonum minus Huds) secara KLT-Bioautografi dan Pengaruhnya terhadap Membran Escherichia coli dan Staphylococcus aureus.
Dalam penyusunan tesis ini penulis mengucapkan terima kasih kepada: 1. Suami tercinta Sandi Nurdin, STP yang senantiasa memberikan dukungan,
kasih sayang, doa dan pengertian, serta anak-anak penulis Khairunnisa Syauqina Mutmainnah dan Muhammad Fadhlurrahman untuk pengertian dan senyuman tulus yang membuahkan optimisme dalam penyelesaian tesis ini. 2. Orang tua tercinta Djapari Nazirin (alm) dan Husnaniah serta mertua tercinta
Achmad Darul Alam dan Aisyah yang senantiasa memberikan dukungan, kasih sayang dan doa.
3. Dr Ir Harsi Dewantari Kusumaningrum selaku ketua komisi pembimbing atas bimbingan, saran dan diskusi dalam penyusunan tesis ini.
4. Dr Didah Nur Faridah, STP MSi selaku anggota komisi pembimbing atas bimbingan, saran dan diskusi dalam penyusunan tesis ini.
5. Prof Dr Ir Sri Laksmi Suryaatmadja, MS selaku penguji luar komisi atas saran yang berarti dalam melengkapi tesis ini.
6. Prof Dr Ir Ratih Dewanti – Hariyadi, MSc selaku ketua Program Studi Ilmu Pangan.
7. Keluarga besar di Pontianak dan Bandung yang senantiasa memberikan dukungan.
8. Mbak Ari, Pak Taufik, Lita, Arum dan teman-teman ilmu pangan di Laboratorium SEAFAST Center gedung PAU yang sudah banyak membantu selama penelitian.
9. Teman-teman ilmu pangan 2010 dan 2011 atas kebersamaan dan dukungannya.
10.Direktorat Jenderal Pendidikan Tinggi Kementerian Pendidikan dan Kebudayaan atas bantuan dana penelitian dari Hibah Penelitian Unggulan Strategis Nasional tahun 2013.
Ungkapan terima kasih juga disampaikan kepada pihak-pihak yang membantu penyelesaian tesis ini. Semoga tesis ini bermanfaat.
Bogor, Oktober 2013
v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Tanaman Kesum 4
Ekstraksi Komponen Bioaktif 5
Senyawa Antimikroba dan Mekanisme Penghambatannya 6
Pengujian Aktivitas Antimikroba 7
KLT-Bioautografi 8
3 BAHAN DAN METODE 9
Waktu dan Tempat Penelitian 9
Bahan dan Alat Penelitian 9
Metodologi 10
Metode Penelitian 13
Prosedur Analisis 16
Analisa Statistik 19
4 HASIL DAN PEMBAHASAN 20
Pengaruh Ekstraksi Bertingkat terhadap Rendemen 20
Fitokimia Ekstrak Daun Kesum 23
Aktivitas Antibakteri Ekstrak Daun Kesum terhadap Escherichia coli
dan Staphylococcus aureus 26
Fraksi Komponen Ekstrak Daun Kesum 31
Fraksi Aktif Ekstrak Daun Kesum 34
Kerusakan Membran Sel Akibat Paparan Ekstrak Daun Kesum 35
5 SIMPULAN DAN SARAN 38
Simpulan 38
Saran 38
DAFTAR PUSTAKA 39
LAMPIRAN 45
vi
1 Aktivitas antimikroba berbagai ekstrak daun kesum 4 2 Mekanisme penghambatan senyawa antimikroba utama dari tanaman 7
3 Kadar air daun kesum 20
4 Rendemen dan waktu ekstraksi dengan metode ekstraksi yang berbeda 22
5 Fitokimia berbagai ekstrak daun kesum 24
DAFTAR GAMBAR
1 Tanaman kesum 4
2 Mekanisme terganggunya dinding sel (a) pecahnya dinding sel akibat kavitasi selama ultrasonikasi (b) difusi pelarut ke dalam struktur sel 6
3 Diagram alir tahapan penelitian 12
4 Diagram alir persiapan sampel daun kesum 13
5 Diagram alir ekstraksi bertingkat daun kesum 15 6 Ekstraksi daun kesum (A) maserasi, (B) ultrasonikasi dan (C) destilasi
uap-air 21
7 Ekstrak daun kesum (A) minyak atsiri, (B) ekstrak heksan, (C) ekstrak
etil asetat dan (D) ekstrak etanol 21
8 Zona hambat ekstrak daun kesum terhadap E. coli dengan metode
cakram 26
9 Zona hambat ekstrak daun kesum terhadap S. aureus dengan metode
cakram 26
10 Diameter hambat berbagai ekstrak daun kesum pada berbagai konsentrasi terhadap E. coli dengan metode cakram 27 11 Diameter hambat berbagai ekstrak daun kesum pada berbagai
konsentrasi terhadap S. aureus dengan metode cakram 28 12 Persen penghambatan (berbanding streptomisin) ekstrak daun kesum
pada berbagai konsentrasi terhadap E. coli dengan metode cakram 29 13 Persen penghambatan (berbanding streptomisin) ekstrak daun kesum
pada berbagai konsentrasi terhadap S. aureus dengan metode cakram 29 14 Penghambatan ekstrak etanol daun kesum terhadap jumlah bakteri (A)
E. coli dan (B) S. aureus dengan metode pengenceran makro 30 15 Kromatogram ekstrak etanol daun kesum dengan berbagai eluen
dibawah lampu UV pada λ 254 nm 32
16 Kromatogram ekstrak etanol daun kesum dengan eluen toluen:etil asetat (93:7) dibawah lampu UV pada λ 254 nm 33 17 Bioautogram dengan teknik agar overlay terhadap (a) E. coli dan (b)
S. aureus 34
18 Absorbansi supernatan pada 260 nm dari suspensi E. coli dan S. aureus setelah terpapar ekstrak etanol daun kesum 35 19 Absorbansi supernatan pada 280 nm dari suspensi E. coli dan S.
aureus setelah terpapar ekstrak etanol daun kesum 36 20 Kandungan protein supernatan kultur dari suspensi E. coli dan S.
aureus yang terpapar ekstrak etanol daun kesum 37
vii
dengan metode ekstraksi ultrasonikasi dan maserasi 45
2 Hasil uji-t rendemen ekstrak etil asetat daun kesum yang diekstraksi dengan metode ekstraksi ultrasonikasi dan maserasi 46
3 Hasil uji-t rendemen ekstrak etanol daun kesum yang diekstraksi dengan metode ekstraksi ultrasonikasi dan maserasi 47
4 Hasil analisa sidik ragam diameter hambat ekstrak daun kesum pada berbagai konsentrasi terhadap E. coli menggunakan metode cakram
dengan uji lanjut Duncan 48
5 Hasil analisa sidik ragam diameter hambat ekstrak daun kesum pada berbagai konsentrasi terhadap S. aureus menggunakan metode cakram
1 PENDAHULUAN
Latar Belakang
Peningkatan pengetahuan dan kesadaran akan pentingnya kesehatan telah mengubah pola pikir sebagian masyarakat untuk cenderung memilih bahan pangan alami dan produk olahan tanpa pengawet sintetik. Penggunaan pengawet atau antimikroba pada bahan pangan berdasarkan dua alasan utama, untuk mengontrol proses pembusukan (pengawetan pangan) dan untuk mencegah atau mengontrol pertumbuhan mikroba, termasuk mikroba patogen (keamanan pangan). Hal ini mendorong dilakukannya banyak penelitian untuk mencari sumber senyawa antimikroba alami yang difokuskan pada tanaman indigenus yang telah dimanfaatkan secara tradisional. Indonesia dikenal sebagai negara megadiversity dengan keanekaragaman hayati dan sumber daya genetik yang besar. Sebanyak 10% tumbuhan obat dunia (7500 jenis) terdapat di Indonesia (Kemlh 2013). Keragaman hayati untuk tanaman rempah sendiri telah dikenal dunia, Indonesia merupakan negara penghasil rempah-rempah khas. Rempah banyak digunakan sebagai bumbu ataupun digunakan untuk pengobatan suatu penyakit secara tradisional dan pengawetan bahan pangan.
Salah satu keanekaragaman hayati yang berasal dari Kalimantan Barat adalah tanaman kesum (Polygonum minus Huds). Masyarakat lokal menyebutnya daun kesum dan umum digunakan sebagai bumbu masak pada berbagai pangan olahan lokal. Daun kesum memiliki aroma wangi, citarasa yang khas dan rasa yang tajam (agak pedas). Daun dari famili Polygonaceae ini populer di Asia Tenggara sebagai bumbu masak. Selain meningkatkan citarasa masakan, daun kesum banyak dimanfaatkan untuk kesehatan seperti menyuburkan, menghitamkan rambut dan menghilangkan ketombe (Zakaria dan Mohd 2010), mengobati cacingan, merangsang haid, mengobati penyakit kudis, mencegah perut kembung dan gangguan maag (Wasman et al. 2010; Qader et al. 2012b) serta mempercepat pemulihan kesehatan paska melahirkan (Mahanom et al. 1999).
Penelitian terkait potensi famili Polygonaceae telah dilakukan, diantaranya adalah Polygonum minus sebagai antioksidan alami dengan total fenolik yang tinggi (Almey et al. 2010; Maizura M. et al. 2011; Qader et al. 2011) dan memiliki karakteristik mirip antioksidan sintetis butylated hydroxytoluene (BHT) (Huda-Faujan et al. 2007) dan lebih unggul dari BHT dalam mereduksi Fe (III) menjadi Fe (II) (Huda-Faujan et al. 2009). Berdasarkan kajian fitofarmaka, diduga tanaman kesum memiliki aktivitas antiviral, antibakteri, antijamur, antioksidan, antikanker dan antiulcer. Hal ini ditunjukkan dari beberapa hasil penelitian tentang aktivitas biologis tanaman ini (Qader et al. 2012a) sehingga sangat potensial untuk dikembangkan sebagai bahan pangan fungsional.
phospholipid dan protein. Membran plasma berperan penting dalam melindungi sel dari lingkungannya dan bersifat selektif permeabel yang berperan dalam sistem transportasi nutrisi dan ekskresi produk – produk limbah (Silhavy et al. 2010). Kerusakan membran sel umumnya terjadi akibat terganggunya permeabilitas membran oleh komponen antimikroba yang menginduksi kebocoran sel. Komponen fenolik berperan sebagai agen antimikroba dengan mekanisme aksi yang diduga melibatkan gangguan fungsi membran sitoplasma termasuk transpor aktif (Naidu 2000).
Deteksi aktivitas antimikroba suatu fraksi senyawa dari ekstrak bahan alam dapat dilakukan dengan KLT-Bioautografi. Metode KLT-Bioautografi merupakan metode gabungan metode kimia (teknik kromatografi lapis tipis/KLT) dan mikrobiologi (pengujian aktivitas antimikroba) yang memungkinkan lokalisasi senyawa aktif (Sudirman 2005). KLT-Bioautografi dianggap spesifik untuk mendeteksi bercak pada kromatogram KLT terhadap respon mikroba uji berdasarkan aktivitas biologis komponen bioaktif ekstrak tersebut sebagai antibakteri, antikapang dan antiprotozoa (Choma 2005; Kusumaningtyas et al. 2008).
Senyawa antibakteri terkait komponen bioaktif pada ekstrak tanaman. Umumnya ekstrak daun kesum diperoleh dengan metode ekstraksi konvensional yaitu maserasi (Wibowo et al. 2009; Almey et al. 2010; Jamal et al. 2011; Qader et al. 2012b). Teknik ini memerlukan waktu ekstraksi yang panjang, rendemen rendah, pelarut maksimal dan dapat terjadi degradasi komponen (Mantegna et al. 2012). Ultrasonikasi merupakan teknologi baru yang dikembangkan untuk meminimalkan waktu ekstraksi, efisiensi penggunaan pelarut dan memaksimalkan rendemen (Jabrak 2013).
Perumusan Masalah
ekstraksi tersebut terkait efisiensi waktu ekstraksi dan rendemen yang diperoleh perlu dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Membandingkan ekstraksi daun kesum dengan teknik maserasi dan ultrasonikasi secara bertingkat menggunakan pelarut dengan polaritas berbeda.
2. Melakukan skrining ekstrak berdasarkan aktivitas antibakteri ekstrak daun kesum terhadap E. coli dan S. aureus
3. Melakukan fraksinasi ekstrak daun kesum dengan aktivitas antibakteri tertinggi menggunakan metode KLT.
4. Melakukan deteksi fraksi aktif ekstrak daun kesum menggunakan metode KLT-Bioautografi terhadap E. coli dan S. aureus.
5. Mengetahui mekanisme penghambatan ekstrak daun kesum terhadap membran sel E. coli dan S. aureus secara in-vitro.
Hipotesis Penelitian
Berdasarkan rumusan masalah serta tujuan yang akan dicapai dalam penelitian ini maka dirumuskan hipotesis berikut:
1. Ekstraksi dengan teknik ultrasonikasi memberikan rendemen lebih besar dibandingkan teknik maserasi.
2. Ekstrak daun kesum dengan menggunakan pelarut yang berbeda kepolarannya akan memiliki aktivitas antibakteri yang berbeda.
3. Terpisahnya ekstrak daun kesum menjadi beberapa fraksi menggunakan metode KLT.
4. Terdeteksinya fraksi aktif dari ekstrak daun kesum menggunakan metode KLT-Bioautografi.
5. Ekstrak daun kesum dapat meusak integritas membran sel S. aureus dan E. coli
Manfaat Penelitian
2 TINJAUAN PUSTAKA
Tanaman Kesum
Kesum merupakan tanaman asli Asia Tenggara terutama di Malaysia, Thailand, Vietnam dan Indonesia yang termasuk tanaman perdu dan populer sebagai bumbu masak. Daun dari famili Polygonaceae ini disebut daun kesom (Malaysia dan Singapura), phak Phai (Thailand), rau ram (Vietnam), daun laksa, daun senahun, Knotweed, Vietnamese coriander dan Cambodian mint. Tanaman ini tumbuh liar, terutama di kawasan lembap dan basah seperti di rawa dan tepian sungai atau danau dengan mendapat cukup sinar matahari. Kesum merupakan tanaman herba yang kecil, menjalar dan dapat tumbuh sampai 1,0 m di dataran rendah dan 1,5 m di tanah tinggi. Daunnya panjang dan runcing berbentuk anak panah, dengan panjang 5−7 cm dan lebar 0,5–2,0 cm. Daun tersusun secara berselang pada batang, berwarna hijau tua dan sangat aromatik. Batangnya berbentuk silinder, berwarna hijau dengan sedikit kemerah-merahan, mempunyai ruas yang pendek dan mudah berakar. Bunga terdapat di pucuk, berbentuk kecil dan berwarna putih keungu-unguan.
Gambar 1 Tanaman kesum
Tabel 1 Aktivitas antimikroba berbagai ekstrak daun kesum
Ekstrak Aktivitas Pustaka
Etanol Antivirus terhadap herpes simplex virus (HSV-1) dan vesicular stomatitis virus (VSV)
Ali et al 1996
Minyak atsiri Antibakteri terhadap E. coli Wibowo dan Rika 2007
Metanol dan dietil eter Antibakteri terhadap Bacillus subtilis
dan E. coli
Wibowo 2008 Petroleum eter, metanol
dan kloroform
Antibakteri terhadap Helicobacter pylori
Uyub et al. 2010 Metanol Antikapang terhadap Colletotrichum
gloeosporioides
Johnny et al. 2011 Etanol dan metanol Antibakteri terhadap B. subtilis Jamal et al. 2011
kaya akan beta karoten, vitamin A, vitamin C dan juga trace elemen seperti kalium, kalsium dan fosfor. Ching dan Mohamed (2001) melaporkan kandungan α – tokoferol dalam daun kesum sebesar 1,41 mg/100 gram basis basah. Menurut Hunter (1996), daun kesum dapat menghasilkan minyak atsiri yang mengandung `aliphatic aldehyde‘ yang tinggi. Hasil analisis menggunakan GC-MS dan GC×GC-TOF MS menunjukkan n-decanal dan dodecanal sebagai aldehida yang merupakan komponen dominan minyak kesum. Selain itu juga mengandung senyawa–senyawa volatil dari kelompok ester (0,071%), furan (0,004%), alkohol (9,857%), aldehida (68,624%), hidrokarbon dan terpenoid (13,489%). Senyawa terpene ditemukan sebagai komponen utama dalam minyak kesum yang diduga berkontribusi besar terhadap flavour kesum (Baharum et al. 2010). Minyak atsiri ini mempunyai aplikasi yang potensial, terutama dalam industri perisa dan parfum.
Daun kesum telah dimanfaatkan sejak lama sebagai bahan tambahan makanan terutama untuk meningkatkan citarasa makanan. Berbagai laporan tentang senyawa-senyawa yang terkandung pada daun kesum di atas menunjukkan bahwa tanaman ini dapat dimanfaatkan baik sebagai bahan pangan fungsional maupun sebagai alternatif pengawet alami terkait aktivitas antimikrobanya.
Ekstraksi Komponen Bioaktif
Ekstraksi merupakan suatu cara pemisahan komponen tertentu dari suatu bahan baik secara kimiawi maupun secara fisik. Ekstraksi kimiawi sering dikaitkan sebagai metode pemisahan satu atau lebih komponen dengan pelarut cair (solvent) sebagai agen pemisah. Prinsip utama pemisahan adalah ‗like disolve like’, senyawa polar akan larut dalam pelarut polar dan senyawa nonpolar akan larut dalam pelarut nonpolar atau berdasarkan perbedaan kepolaran. Pemilihan pelarut merupakan faktor penentu dalam ekstraksi komponen bioaktif. Ekstrak yang baik dapat diperoleh melalui ekstraksi bertingkat, dimulai dari pelarut non polar (n-heksana, sikloheksana, toluena dan kloroform), kemudian pelarut semipolar (diklorometan, dietil eter dan etil asetat) dan pelarut polar (metanol, etanol dan air) sehingga diperoleh ekstrak nonpolar, semipolar dan polar (Houghton dan Raman 1998).
singkat, penggunaan pelarut yang lebih kecil dan efisien. UAE merupakan teknik pemberian gelombang ultrasonik (di atas 20 kHz) pada ekstraksi menggunakan pelarut. Gelombang ultrasonik dapat meningkatkan terjadinya reaksi kimia akibat terbentuknya ion dan partikel yang teraktivasi. UAE yang dioperasikan pada frekuensi 20 – 500 kHz dan intensitas lebih dari 1 W.cm-2 dapat mengganggu dan menginduksi efek fisik, mekanik atau kimia (biokimia) pada bahan (Jabrak 2013).
Prinsip utama ekstraksi dengan ultrasonikasi didasarkan pada fenomena kavitasi, efek mekanis dan termal. Fenomena kavitasi merupakan proses pecahnya gelembung pada fluida akibat penurunan tekanan secara tiba-tiba pada suhu konstan. Pecahnya gelembung kavitasi dekat permukaan bahan menghasilkan mikrojet, mengakibatkan kerusakan bahan diikuti peningkatan penetrasi pelarut ke dalam matriks bahan dan intensifikasi perpindahan massa (Gambar 2). Efek mekanis sendiri melibatkan proses difusi melalui dinding sel bahan dan proses pencucian isi sel setelah dinding sel rusak. Selain itu, energi oksidatif radikal yang diciptakan selama sonolysis juga mempengaruhi ekstraksi. Dapat dikatakan ultrasonikasi berpotensi digunakan sebagai metode untuk mengekstrak bahan alam dengan hasil yang lebih baik dari metode konvensional, baik dalam skala laboratorium maupun pilot plan (Khan et al. 2010). Ultrasonikasi berpotensi dapat meningkatkan ekstraksi komponen seperti polifenol, anthosianin, senyawa aromatik, polisakarida dan minyak. Penggunaan utrasonikasi untuk ekstraksi bahan baku yang mahal dapat menjadi alternatif ekonomis bagi industri (Shirsath et al. 2012).
Gambar 2 Mekanisme terganggunya dinding sel (a) pecahnya dinding sel akibat kavitasi selama ultrasonikasi (b) difusi pelarut ke dalam struktur sel (Shirsath et al. 2012).
Senyawa Antimikroba dan Mekanisme Penghambatannya
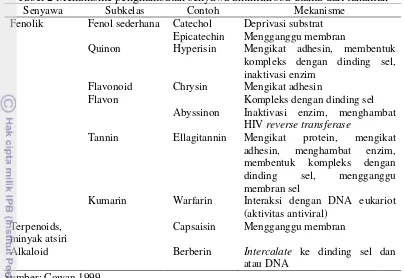
Tabel 2 Mekanisme penghambatan senyawa antimikroba utama dari tanaman
Senyawa Subkelas Contoh Mekanisme
Fenolik Fenol sederhana Catechol Deprivasi substrat Epicatechin Mengganggu membran
Quinon Hyperisin Mengikat adhesin, membentuk kompleks dengan dinding sel, inaktivasi enzim
Flavonoid Chrysin Mengikat adhesin
Flavon Kompleks dengan dinding sel
Abyssinon Inaktivasi enzim, menghambat HIV reverse transferase
Tannin Ellagitannin Mengikat protein, mengikat adhesin, menghambat enzim, membentuk kompleks dengan dinding sel, mengganggu membran sel
Kumarin Warfarin Interaksi dengan DNA eukariot (aktivitas antiviral)
Karakteristik penting dari ekstrak tanaman dan komponennya adalah hidrofobisitasnya, yang memungkinkan mereka untuk masuk ke lapisan lipid membran sel bakteri dan mitokondria, mengganggu struktur sel dan menyebabkan sel menjadi lebih permeabel (Burt 2004; Oonmetta-areea et al. 2006; Joshi et al. 2011). Kerusakan membran sel umumnya terjadi akibat terganggunya permeabilitas membran oleh komponen antimikroba yang menginduksi kebocoran sel (Tabel 2). Komponen fenolik berperan sebagai agen antimikroba dengan mekanisme aksi yang diduga melibatkan gangguan fungsi membran sitoplasma termasuk transpor aktif (Naidu 2000). Senyawa fenol yang teroksidasi menghambat metabolisme enzim yang menyebabkan inaktivasi kegiatan reproduksi sel. Struktur seperti antosianin dapat membentuk kompleks dengan asam amino nukleofilik dari dinding sel diikuti dengan hilangnya fungsi dinding sel (Cowan 1999; Pliego 2007).
Pengujian Aktivitas Antimikroba
(CLSI 2007; CLSI 2009). Broth dilution digunakan dalam penentuan konsentrasi hambat minimum (KHM) dari suatu senyawa antimikroba pada berbagai konsentrasi. Metode ini dapat dilakukan menggunakan tabung uji dengan pengenceran makro (macrodilution) atau pengenceran mikro (microdilution) dengan mikro tray. Dibandingkan dengan metode difusi, metode pengenceran mikro digunakan untuk menarik kesimpulan secara kualitatif dalam penentuan KHM dan mudah digunakan untuk pengujian rutin di laboratorium klinis (Jiang 2011). Namun, penggunaan hanya satu metode dalam pengujian aktivitas antimikroba menghasilkan kesimpulan yang terbatas (Weerakkody et al. 2010). Umumnya dilakukan pengujian dengan metode difusi yang dilanjutkan dengan penentuan KHM.
Reaksi senyawa antimikroba dengan membran sel bakteri dapat mengubah permeabilitas membran sitoplasma. Metabolit dengan berat molekul rendah diketahui keluar dari sel bakteri termasuk nukleotida dan struktur komponen (purin, pirimidin, pentosa dan fosfat anorganik), asam amino dan ion anorganik akibat terganggunya membran sitoplasma. Tingkat purin, pirimidin dan turunannya dalam supernatan dapat ditentukan menggunakan spektrofotometer UV – Vis dengan mengukur Optical Density (OD) pada 260 nm (Oonmetta-areea et al. 2006) dan 280 nm (Henie et al. 2009). Teknik lain untuk melihat pengaruh komponen antimikroba terhadap membran sel bakteri adalah dengan BacLight viability kit yang dapat diamati menggunakan mikroskop fluoresens atau flow cytometry. Teknik ini menggunakan DNA probe staining, yaitu pewarna fluoresens SYTO9 dan propidium iodida (PI) yang mewarnai DNA. SYTO9 dapat berpenetrasi ke dalam membran sel bakteri yang utuh dan mewarnai DNA sel menjadi hijau, sebaliknya PI hanya bisa berpenetrasi ke dalam sel bakteri bila terdapat pori atau kebocoran pada membran dan mewarnai DNA sel menjadi merah (Boulos et al, 1999).
KLT-Bioautografi
Kromatografi merupakan metode pemisahan senyawa kimia berdasarkan afinitas yang berbeda dari senyawa pada fase diam dan fase gerak. KLT adalah metode pemisahan senyawa kimia secara kimia – fisika berdasarkan perbedaan kecepatan migrasi atau rasio distribusi (Rf) dengan fase gerak cairan dan fase diam absorben padat. KLT umumnya dianggap metode kromatografi yang sederhana, cepat, dan murah untuk pemisahan, identifikasi tentatif, dan penilaian visual semikuantitatif dari fitokomplek (Striegel dan Hill 1996).
et al. 2009), selain itu murah dan interpretasi hasil relatif mudah dan akurat (Kusumaningtyas et al. 2008) serta dapat digunakan untuk mengetahui aktivitas antimikroba dari dua senyawa dengan sifat kepolaran yang sangat dekat (Sudirman 2005).
bioautografi dalam uji aktivitas antimikroba dibedakan menjadi KLT-bioautografi kontak, KLT-Bioautografi imersi atau agar overlay dan KLT-bioautografi langsung. KLT-Bioautografi kontak dilakukan dengan meletakkan plat kromatogram KLT dari senyawa uji selama waktu tertentu di atas media agar yang telah diinokulasi dengan mikroba uji. Selanjutnya kromatogram dilepaskan dengan hati – hati dan diinkubasi. Adanya aktivitas antimikroba dari senyawa uji ditandai dengan adanya zona bening. Namun, teknik ini kurang sensitif karena beberapa senyawa berikatan kuat dengan adsorbent silika sehingga sulit berdifusi ke agar (Kusumaningtyas et al. 2008). KLT-Bioautografi agar overlay dilakukan dengan melapisi plat kromatogram KLT senyawa uji dengan media agar cair yang telah diinokulasi dengan mikroba uji. Setelah agar memadat, plat kromatogram diinkubasi dan diwarnai dengan tetrazolium dye. Penghambatan dapat dideteksi dengan terbentuknya zona bening. Teknik ini dianggap sebagai salah satu metode yang efisien untuk mendeteksi senyawa antimikroba berdasarkan transfer senyawa aktif secara difusi dari kromatogram ke dalam lapisan agar berisi bakteri uji (Runyoro et al. 2006). KLT-Bioautografi langsung dilakukan dengan menyemprot plat kromatogram KLT senyawa uji dengan suspensi mikroba uji dan diinkubasi. Zona hambat yang terbentuk divisualisasikan dengan menyemprot plat kromatogram dengan tetrazolium dye. Tetrazolium dye yang banyak digunakan adalah 3-{4,5-dimethylthiazol-2-yl}-2,5-diphenyltetrazolium bromide atau MTT, p-iodonitro-tetrazolium violet dan 2,3,5 triphenyl tetrazolium chlorida (TTC) (Choma, 2005).
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Januari 2013 – Juli 2013 di Laboratorium Rekayasa Proses Jurusan Teknologi Pertanian Politeknik Negeri Pontianak, Laboratorium Kimia Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian IPB serta Laboratorium Mikrobiologi dan Keamanan Pangan SEAFAST Center IPB.
Bahan dan Alat Penelitian
Bahan
Agar (TSA), Tryptone Soya Broth (TSB), Mueller Hinton Agar (MHA), Baird Parker Agar (BPA) (Oxoid, Hampshire, UK), larutan garam fisiologis 0,85%, Dimethyl sulfoxide (DMSO) (Merck, Darmstadt, Germany), cakram steril (ø 6 mm, Oxoid, Hampshire, UK), 2,3,5 trifenil tetrazolium chloride (TTC) (Merck, Darmstadt, Germany) dan propidium iodida (PI) (Invitrogen, Carlsbad, USA).
Alat Penelitian
Alat – alat yang digunakan adalah freeze dryer (LABCONCO, British), blender (National, Taiwan), ayakan 48 mesh (Tyler No. 50), destilator uap, sonikator (BRANSONIC Ultrasonic cleaner 8510E-MTH, USA), shaker (New Brunswick Scientific, Innova 2100, USA), rotari evaporator (BUCHI Rotavapor RII, Switzerland), sentrifuge (Hermle z383k, Germany), laminar air flow, mikropipet (Finnpipette, Thermo Scientific, Finland), vortex, inkubator, refrigerator, plat TLC silika gel GF254 (Merck, Darmstadt, Germany), lampu UV,
mikroskop fluoresens (CH30, Olympus, Japan), spektofotometer UV - Vis (Shimadzu UV-1800, Japan)dan alat – alat gelas.
Metodologi
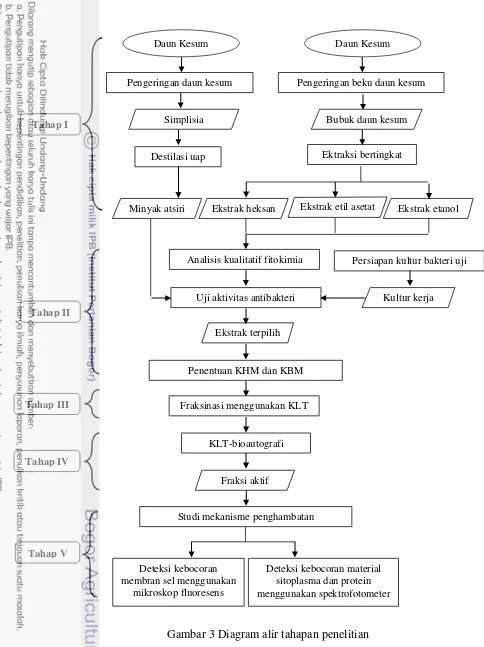
Penelitian dilaksanakan dalam empat tahap, yaitu: 1) Ekstraksi daun kesum, 2) Studi aktivitas antibakteri ekstrak daun kesum, 3) Fraksinasi komponen antibakteri dari ekstrak dengan aktivitas tertinggi menggunakan metode KLT, 4) Deteksi fraksi aktif ekstrak daun kesum menggunakan metode KLT-bioautografi dan 5) Studi mekanisme penghambatan ekstrak daun kesum terhadap membran sel bakteri secara in-vitro (Gambar 3).
1. Ekstraksi daun kesum
Tahapan ini merupakan tahap persiapan bahan baku daun kesum dan ekstraksi. Persiapan daun kesum untuk ekstraksi dengan pelarut meliputi pencucian, sortasi, pengeringbekuan dengan freeze dryer dan pengecilan ukuran sehingga diperoleh bubuk daun kesum. Selanjutnya dilakukan ekstraksi dengan ultrasonikasi (Celeghini et al. 2001; Velickovic et al. 2007 dengan modifikasi) dan maserasi secara bertingkat untuk memperoleh ekstrak polar, semipolar dan nonpolar yang dilanjutkan dengan perhitungan rendemen. Persiapan daun kesum untuk memperoleh minyak atsiri, dilakukan pencucian, sortasi dan pengeringan dalam ruang gelap pada suhu kamar selama 7 hari sehingga diperoleh simplisia. Selanjutnya simplisia diekstraksi dengan destilasi uap-air (Sharififar et al. 2007).
2. Studi aktivitas antibakteri ekstrak daun kesum
memiliki konsentrasi 107–108 CFU/ml (fase log akhir). Analisis fitokimia ekstrak dilakukan untuk senyawa fenol, tannin, flavonoid, alkaloid, steroid dan terpenoid (Harborne 2006). Selanjutnya dilakukan skrining ekstrak berdasarkan aktivitas antibakteri menggunakan metode agar difusi cakram terhadap pertumbuhan bakteri S. aureus dan E. coli (Sharififar et al. 2007) dan penentuan konsentrasi hambat minimum (KHM) serta konsentrasi bakterisidal minimum (KBM) menggunakan metode pengenceran makro (Mazzola et al. 2009 dengan modifikasi).
3. Fraksinasi komponen antibakteri dari ekstrak dengan aktivitas tertinggi menggunakan KLT
Tahapan ini bertujuan untuk melakukan fraksinasi komponen antibakteri dari ekstrak daun kesum dengan aktivitas antibakteri tertinggi. Fraksinasi dilakukan menggunakan KLT dengan plat silika gel GF254 dan skrining eluen
dilakukan secara trial and error.
4. Deteksi fraksi aktif ekstrak daun kesum menggunakan KLT-bioautografi
Tahapan ini bertujuan untuk mendeteksi fraksi aktif ekstrak pada kromatogram KLT. Uji deteksi fraksi aktif ekstrak dilakukan menggunakan KLT-bioautografi dengan teknik agar overlay (Rossi et al. 2011; Kannan et al. 2013 dengan modifikasi).
5. Studi mekanisme penghambatan ekstrak daun kesum terhadap membran
sel secara in-vitro
Tahap V
Deteksi kebocoran material sitoplasma dan protein menggunakan spektrofotometer Deteksi kebocoran
membran sel menggunakan mikroskop fluoresens
Studi mekanisme penghambatan
Tahap II
Ekstrak terpilih Uji aktivitas antibakteri
Persiapan kultur bakteri uji
Kultur kerja Analisis kualitatif fitokimia
Penentuan KHM dan KBM
Ektraksi bertingkat Pengeringan beku daun kesum
Bubuk daun kesum
Ekstrak etil asetat Ekstrak etanol Ekstrak heksan
Daun Kesum
Tahap I
Destilasi uap
Minyak atsiri
Pengeringan daun kesum
Simplisia Daun Kesum
Gambar 3 Diagram alir tahapan penelitian
Tahap III Fraksinasi menggunakan KLT
KLT-bioautografi
Fraksi aktif
Metode Penelitian
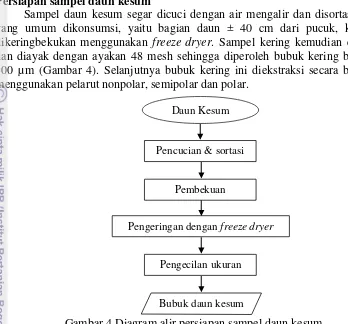
Persiapan sampel daun kesum
Sampel daun kesum segar dicuci dengan air mengalir dan disortasi bagian yang umum dikonsumsi, yaitu bagian daun ± 40 cm dari pucuk, kemudian dikeringbekukan menggunakan freeze dryer. Sampel kering kemudian diblender dan diayak dengan ayakan 48 mesh sehingga diperoleh bubuk kering berukuran 300 µm (Gambar 4). Selanjutnya bubuk kering ini diekstraksi secara bertingkat menggunakan pelarut nonpolar, semipolar dan polar.
Gambar 4 Diagram alir persiapan sampel daun kesum
Daun kesum segar dicuci di air mengalir dan disortasi bagian yang umum dikonsumsi, yaitu bagian daun ± 40 cm dari pucuk. Selanjutnya dikeringanginkan dalam ruang gelap pada suhu kamar (28oC) selama 7 hari sehingga diperoleh simplisia. Simplisia yang diperoleh diekstraksi dengan destilasi uap-air .
Ekstraksi daun kesum
Ekstraksi minyak atsiri. Simplisia didestilasi uap-air selama 4 jam
(Gambar 5) untuk memperoleh minyak atsiri (Sharififar et al. 2007). Minyak atsiri yang diperoleh dikeringkan dengan Na2SO4 anhidrous dan disimpan dalam vial
gelap untuk mencegah degradasi pada suhu 4oC sampai saat akan digunakan.
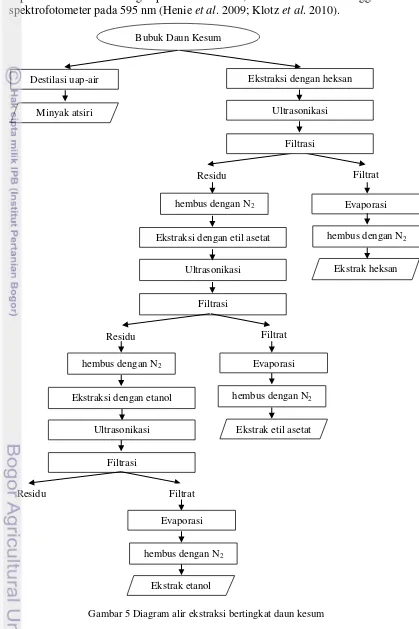
Ekstraksi bertingkat. Sampel bubuk diekstraksi secara bertingkat (Gambar
5) menggunakan tiga jenis pelarut yang berbeda polaritasnya yaitu heksan, etil asetat dan etanol dengan ultrasonikasi (Celeghini et al. 2001; Velickovic et al. 2007 dengan modifikasi). Ekstraksi pertama dilakukan menggunakan pelarut nonpolar heksan. Bubuk daun kesum (25 g) ditambahkan 250 ml pelarut (1:10 b/v) dalam erlenmeyer 500 mL dan diultrasonikasi dengan frekuensi 40 kHz pada suhu 40±1oC selama 20 menit. Campuran disaring dengan kertas saring Whatman no 1, selanjutnya supernatan diuapkan dengan rotari evaporator bertekanan rendah pada suhu 40oC. Ekstrak dihembus dengan gas N2 untuk menguapkan sisa pelarut.
Hasil yang diperoleh adalah ekstrak heksan. Ekstraksi tahap kedua dilakukan terhadap residu ekstrak nonpolar yang sebelumnya telah dihembus dengan gas N2
Pencucian & sortasi
Pengeringan dengan freeze dryer
Pengecilan ukuran Pembekuan
untuk menguapkan sisa pelarut. Ekstraksi menggunakan pelarut semipolar etil asetat dengan perlakuan serupa pada ekstraksi tahap pertama. Hasil yang diperoleh adalah ekstrak etil asetat. Ekstraksi terakhir dilakukan terhadap residu ekstrak semipolar yang sebelumnya telah dihembus dengan gas N2 untuk
menguapkan sisa pelarut. Ekstraksi menggunakan pelarut polar etanol 96% dengan perlakuan serupa pada ekstraksi tahap pertama. Hasil yang diperoleh adalah ekstrak etanol. Semua ekstrak disimpan dalam vial gelap pada suhu 4oC sampai saat akan digunakan. Ekstraksi dengan pelarut yang sama juga dilakukan secara maserasi selama 24 jam, pada suhu ruang (28oC) dengan agitasi 200 rpm sebagai pembanding. Ekstrak yang diperoleh ditimbang beratnya dan dilakukan perhitungan rendemen untuk masing – masing pelarut, dengan persamaan:
endemen ekstrak berat sampel awalberat ekstrak
Persiapan kultur bakteri uji (Oonmetta-aree et al. 2006 dengan modifikasi)
Satu ose (loop) kultur murni bakteri uji dari Trypticase Soy Agar (TSA) miring yang dipelihara pada suhu 4oC, diinokulasi secara aseptis ke 10 ml Brain Heart Infution Broth (BHIB) dan diinkubasi pada suhu 35°C selama 18 - 24 jam. Suspensi bakteri selanjutnya digores pada TSA dan diinkubasi pada suhu 35°C ± 2°C selama 48 jam. Koloni tunggal ditransfer ke 10 ml Trypticase Soy Broth (TSB) dan diinkubasi pada suhu 35°C ± 2°C selama 18 - 24 jam. Kultur ini (kultur kerja) yang digunakan untuk pengujian antibakteri.
Persiapan standar McFarland (Andrews 2005)
Kultur kerja dipisahkan dari media dengan sentrifugasi pada 10.000 rpm selama 10 menit dan diresuspensi dalam larutan garam fisiologis (0,85%). Selanjutnya optical density (OD) sel bakteri dibandingkan dengan standar McFarland No. 0,5 (campuran 0,5 ml BaCl2 0,048M (1,17% b/v BaCl2.2H2O) dan 99,5 ml H2SO4 terhadap permeabilitas membran diamati dengan DNA probe staining yaitu PI menggunakan mikroskop fluoresens (O‘Neill et al. 2004 dengan modifikasi).
integritas membran sel berdasarkan pelepasan material sitoplasma diamati menggunakan spektrofotometer UV – Vis pada 260 nm (Oonmetta-areea et al. 2006 dengan modifikasi) dan 280 nm(Henie et al. 2009) serta kandungan protein supernatan ditentukan dengan pereaksi Bradford, absorbansi diukur menggunakan spektrofotometer pada 595 nm (Henie et al. 2009; Klotz et al. 2010).
Filtrasi Ultrasonikasi
Residu
Ekstraksi dengan etil asetat hembus dengan N2
Filtrat
Ekstrak heksan Evaporasi
hembus dengan N2
Filtrasi Ultrasonikasi Ekstraksi dengan etanol
Residu
Residu hembus dengan N2
Filtrat
Evaporasi
Ekstrak etil asetat hembus dengan N2
Destilasi uap-air
Minyak atsiri
Ekstraksi dengan heksan
Ultrasonikasi
Filtrasi Bubuk Daun Kesum
Filtrat Evaporasi
Ekstrak etanol hembus dengan N2
Prosedur Analisis
Analisis Kadar Air (AOAC 2005)
Analisis dilakukan dengan metode termogravimetri. Botol timbang dikeringkan dalam oven pada suhu 105oC selama 15 menit dan didinginkan dalam desikator selama 10 menit lalu ditimbang. Sampel ditimbang sebanyak ± 2 g dalam botol timbang. Botol beserta isi dikeringkan dalam oven 105oC selama 3 jam. Cawan dipindahkan ke dalam desikator lalu didinginkan dan ditimbang, pemanasan sampel dilanjutkan dan ditimbang setiap 30 menit sampai diperoleh berat konstan. Kadar air sampel dilaporkan dalam persentase basis basah dengan rumus:
C = berat konstan botol timbang dan sampel (g)
Analisis Total Bakteri (BAM 2001)
Analisis dilakukan dengan teknik sebar (spread plate), sebanyak 100 µl kultur kerja dari pengenceran yang dikehendaki (10-6, 10-7, 10-8) disebar ke TSA dalam cawan petri steril. Kultur disebar merata menggunakan hockey stick pada permukaan agar. Cawan diinkubasi dengan posisi terbalik pada 35°C ± 2°C selama 48 jam. Selanjutnya dilakukan pengamatan dan perhitungan jumlah koloni yang tumbuh pada agar cawan. Hanya cawan dengan jumlah koloni 25 – 250 yang dilaporkan, jika > 250 maka dilaporkan TBUD (terlalu banyak untuk dihitung). Jumlah koloni dilaporkan sebagai CFU (coloni forming unit) per satuan berat atau volume dengan rumus:
N n ∑C n d
dimana: N = total CFU/gram atau total CFU/ml ΣC = jumlah koloni yang dihitung
n1 = jumlah cawan pada pengenceran pertama
n2 = jumlah cawan pada pengenceran kedua
d = pengenceran terendah
Pengujian aktivitas antibakteri ekstrak daun kesum dengan metode agar
difusi cakram terhadap pertumbuhan bakteri S. aureus dan E. coli
(Sharififar et al. 2007)
dan sebanyak 10 l ekstrak diteteskan pada cakram dan dibiarkan terserap. Sebagai kontrol negatif, sebanyak 10 l DMSO dan pelarut (hexan, etil asetat dan etanol) diteteskan pada cakram dan dibiarkan terserap. Sebagai kontrol positif, sebanyak 10 l Streptomisin 1 mg/ml (CLSI 2007) diteteskan pada cakram, dibiarkan terserap. Semua cawan uji diinkubasikan pada suhu 37oC selama 24 jam. Efek penghambatan pertumbuhan bakteri diamati dengan mengukur zona bening (termasuk diameter cakram) menggunakan jangka sorong. Pengukuran dilakukan di beberapa sisi dan hasilnya dirata – ratakan. Jenis ekstrak dengan zona penghambatan tertinggi dipilih untuk penelitian lanjut. Kemampuan penghambatan ekstrak terhadap pertumbuhan bakteri juga dilaporkan sebagai persen penghambatan ekstrak dengan rumus:
penghambatan d
Penentuan KHM (Minimum Inhibitory Concentration/MIC) dan KBM
(Minimum Bactericidal Concentration/MBC) (Mazzola et al. 2009)
Pengujian ini bertujuan untuk menentukan KHM ekstrak yang dapat menghambat pertumbuhan mikroba uji sebesar 90% atau menurunkan 1 log koloni dari jumlah koloni awal. KHM ditentukan menggunakan metode klasik dengan pengenceran makro, ekstrak dibuat seri pengenceran setengah kali sebagaimana yang dilakukan Mazzola et al. (2009) dengan modifikasi. Dalam 6 tabung ditambahkan 1 ml TSB kecuali untuk tabung pertama, ditambahkan 2,5 ml TSB. Tabung pertama ditambahkan 2,5 ml ekstrak (200 mg/ml), tabung divorteks dan 1 ml dipindahkan ke tabung ke 2. Perlakuan ini diulang dan dilakukan secara berturut – turut sampai tabung ke 5 sehingga diperoleh konsentrasi 100 mg/ml, 50 mg/ml, 25 mg/ml, 12,5 mg/ml dan 6,25 mg/ml. Selanjutnya setiap tabung diinokulasi dengan 100 µl bakteri uji (106 CFU/ml), kecuali untuk tabung pertama (0,4 ml bakteri uji) sedangkan tabung ke 6 sebagai kontrol (TSB + bakteri uji). Tabung diinkubasi pada suhu 35°C ± 2°C selama 24 jam. KHM adalah tabung dengan konsentrasi yang tidak menunjukkan pertumbuhan bakteri (bening). Tabung yang bening dan tabung terakhir yang keruh digunakan untuk penentuan KBM. 100 µl suspensi disebar di TSA cawan dan diinkubasi pada 35°C ± 2°C selama 18-24 jam (Oonmetta-aree et al. 2006).
Fraksinasi ekstrak daun kesum terpilih dengan KLT
Ekstrak daun kesum terpilih difraksinasi dengan KLT untuk mendeteksi banyaknya bercak senyawa dan KLT-bioautografi. Beberapa kombinasi eluen (cairan pengembang yang terpilih) dan beberapa konsentrasi ekstrak dicobakan untuk memperoleh pemisahan terbaik. Sebanyak 10 l dari konsentrasi ekstrak terpilih ditotolkan pada plat KLT silika gel 60 GF254 (Merck, Germany) yang
f jarak yang dilalui bercak
Banyaknya bercak senyawa menggambarkan banyaknya komponen senyawa yang terdapat dalam ekstrak. Dengan cara yang sama dilakukan untuk KLT-bioautografi.
KLT-Bioautografi (Rossi et al. 2011; Kannan et al. 2013 dengan modifikasi)
Sebanyak 1 ml kultur kerja yang telah disesuaikan dengan McFarland No. 0,5 (108 CFU/ml) diencerkan sampai konsentrasi akhir 106 CFU/ml dan 100 µl diinokulasi ke 10 ml MHA cair (45oC). Plat kromatogram yang telah disterilisasi dengan sinar UV selama 1 jam diletakkan di MHA cawan steril dengan posisi menghadap ke atas, selanjutnya MHA cair yang telah diinokulasi kultur dituang ke atas kromatogram. Pada penelitian ini MH agar lunak (soft agar) dengan kandungan agar 0,8% dimodifikasi menggunakan MHA dengan ketebalan ± 1 mm. Setelah agar memadat, cawan petri diinkubasi pada suhu 37oC selama 24 jam. Cawan di semprot dengan TTC dan diinkubasi pada suhu 37oC selama 2 jam. Zona hambat akan terlihat di sekitar bercak senyawa aktif.
Analisis kualitatif fitokimia (Harborne 2006)
Analisis fenol hidrokuinon. Sebanyak 0,1-0,2 g ekstrak yang telah dilarutkan,
diteteskan pada spot plate dan ditambahkan NaOH 10%. Terbentuknya warna merah menandakan uji positif adanya fenol hidrokuinon.
Analisis steroid dan triterpenoid. Sebanyak 1 mg ekstrak dilarutkan ke dalam 2
ml kloroform. Selanjutnya ditambahkan 10 tetes asam asetat anhidrida dan 3 tetes asam sulfat pekat. Larutan dikocok perlahan dan dibiarkan beberapa menit. Terbentuknya warna hijau menandakan uji positif adanya steroid dan terbentuknya warna merah atau ungu menandakan uji positif adanya triterpenoid.
Analisis tanin. Sebanyak 0,1 g ekstrak kering, ditambahkan air panas dan
dididihkan selama 15 menit lalu disaring. Filtrat kemudian ditambah beberapa ml larutan FeCl3 1%. Terbentuknya warna biru tua atau hijau kehitaman menandakan
uji positif adanya tanin.
Analisis flavonoid. Sebanyak 0,1 g ekstrak kering, ditambahkan air panas dan
dididihkan selama 5 menit lalu disaring. Pada filtrat ditambahkan 0,5 g serbuk magnesium dan 2 ml alkohol klorhidrat (campuran HCl 37% dan etanol 95% dengan volume sama) dan 2 ml amil alkohol. Campuran divortex, terbentuknya warna merah, kuning dan jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
Analisis alkaloid. Sebanyak 1 ml ekstrak ditambahkan beberapa tetes NaOH, lalu
divorteks dan disaring Pada filtrat ditambahkan beberapa tetes H2SO4 pekat, lalu
Studi mekanisme penghambatan ekstrak daun kesum terhadap membran sel secara in-vitro
Deteksi kebocoran membran sel dengan DNA probestaining
Suspensi bakteri uji yang telah dipaparkan ekstrak daun kesum disentrifugasi untuk memperoleh pelet bakteri uji. Selanjutnya pelet bakteri uji dibilas sebanyak tiga kali dengan larutan garam fisiologis. Pewarna fluoresens, yaitu 0,02 mg/ml PI ditambahkan 1 ml ke pelet bakteri dan diinkubasi selama 15 menit pada kondisi gelap dan suhu ruang (28oC). Satu tetes suspensi bakteri yang telah diwarnai diteteskan di atas kaca objek dan ditutup dengan cover glass. Pengamatan dilakukan menggunakan mikroskop fluoresens. Pelet bakteri yang tidak dipaparkan dengan ekstrak juga diwarnai dengan PI sebagai kontrol.
Deteksi kebocoran material sitoplasma (Oonmetta-areea et al. 2006 dengan
modifikasi)
Suspensi bakteri uji yang telah dipaparkan ekstrak daun kesum disentrifuse pada 10.000 rpm selama 5 menit untuk memisahkan sel bakteri. Selanjutnya OD supernatan diukur pada 260 nm dan 280 nm menggunakan spektrofotometer UV– Vis. Metabolit dengan berat molekul rendah diketahui merembes dari sel termasuk nukleotida dan struktur komponen (purin, pirimidin, pentosa dan fosfat anorganik), asam amino dan ion anorganik. Tingkat purin, pirimidin dan turunannya dalam supernatan dapat ditentukan dengan mengukur OD. Sebagai blanko digunakan larutan garam fisiologis yang ditambahkan 20 µl ekstrak daun kesum. OD supernatan dari sel bakteri yang tidak dipaparkan dengan ekstrak juga diukur sebagai kontrol.
Penentuan kandungan protein supernatan (Henie et al. 2009; Klotz et al.
2010)
Suspensi bakteri uji yang telah dipaparkan ekstrak daun kesum disentrifugasi pada 10.000 rpm selama 5 menit untuk memisahkan sel bakteri. Kandungan protein supernatan ditentukan dengan pereaksi Bradford, sebanyak 1 ml pereaksi Bradford ditambahkan ke 1 ml supernatan dan diinkubasi pada kondisi gelap dan suhu ruang selama 5 menit. Absorbansi diukur menggunakan spektrofotometer pada 595 nm dan Bovine serum albumin (BSA) digunakan sebagai protein standar pada konsentrasi 0 - 20 µg/ml. Supernatan dari sel bakteri yang tidak dipaparkan dengan ekstrak juga diukur sebagai kontrol.
Analisa Statistik
4 HASIL DAN PEMBAHASAN
Pengaruh Ekstraksi Bertingkat terhadap Rendemen
Kadar air daun kesum sebagai bahan baku ekstraksi dapat dilihat pada Tabel 3. Pada penelitian ini dilakukan dua teknik pengeringan yang berbeda pada daun kesum segar, yaitu pengeringan pada suhu ruang (kering angin) untuk bahan destilasi uap-air dan pengeringan beku untuk bahan ekstraksi dengan pelarut. Pengeringan daun kesum pada tahap persiapan ini bertujuan untuk mengurangi kadar air bahan dan meminimalkan kehilangan senyawa volatil pada bahan untuk destilasi uap-air. Kadar air bahan sangat mempengaruhi rendemen yang diperoleh (Seth et al. 2010), adanya air pada sampel dapat mengganggu proses ekstraksi. Makin rendah kadar air bahan maka makin tinggi efisiensi ekstraksi (Nagy and Simándi 2008) sehingga rendemen yang diperoleh maksimal.
Tabel 3 Kadar air daun kesum
Perlakuan Kadar air (%) Keterangan
Segar 70,94 ± 0,23
Keringangin
(kamar gelap, 28oC) 7 hari
11,39 ± 0,19 Bahan untuk destilasi uap-air
Keringbeku 24 jam 3,18 ± 0,06 Bahan untuk ekstraksi dengan pelarut
Daun kesum segar dikeringanginkan selama tujuh hari di kamar gelap pada suhu 28oC, teknik pengeringan ini umum dilakukan untuk menyediakan simplisia tanaman herbal. Manika et al. (2013) melaporkan tanaman herba Gymnema sylvestre yang dikeringkan dengan teknik ini menghasilkan rendemen gymnemagenin yang lebih tinggi dibandingkan pengeringan dengan sinar matahari, oven dan microwave. Selanjutnya daun kesum kering diekstraksi dengan destilasi uap-air (Gambar 6) yang merupakan metode paling umum digunakan dalam produksi minyak atsiri (Burt 2004; Handa 2008). Destilasi uap-air adalah istilah yang secara umum digunakan untuk destilasi campuran uap-air dengan senyawa yang tidak larut dalam air yaitu minyak atsiri berdasarkan perbedaan titik didih. Bahan dijaga agar tidak kontak dengan air, minyak atsiri akan terdestilasi oleh uap yang berasal dari air mendidih. Komponen volatil bahan akan menguap pada suhu yang lebih rendah dari pada dengan pemanasan langsung. Selanjutnya dikondensasikan dengan bantuan kondensor dan minyak atsiri dapat dipisahkan dari air. Minyak atsiri yang diperoleh dikontakkan dengan Na2SO4 anhidrous untuk mengikat air yang terbawa selama proses ekstraksi
(Sharififar et al. 2007) sehingga diperoleh minyak atsiri murni (Gambar 7). Dengan teknik destilasi ini, resiko kerusakan komponen minyak atsiri akibat hidrolisis dan polimerisasi selama destilasi dapat ditekan. Minyak atsiri yang diperoleh disimpan dalam vial gelap pada suhu 4oC sampai saat akan digunakan, hal ini bertujuan untuk mencegah terjadinya degradasi komponen bioaktif.
pengeringan menggunakan freeze dryer dapat mempertahankan kehilangan komposisi fitokimia bahan dibandingkan pengeringan menggunakan oven pada suhu 50oC dan 70oC. Sejalan dengan Liazid et al. (2010) yang menyatakan penerapan suhu tinggi dapat menyebabkan degradasi kimia sehingga bahan kehilangan bioaktifitasnya. Daun kesum kering yang diperoleh dikecilkan ukurannya sehingga diperoleh bubuk kesum lolos ayakan 48 mesh (300 µm) dengan tujuan menyeragamkan ukuran partikel. Pecahnya jaringan dan struktur sel saat pengecilan ukuran akan mempermudah ekstraksi komponen bioaktif dan memperbesar luas permukaan kontak sampel dengan pelarut (Handa 2008). Semakin kecil ukuran partikel sampel, maka makin besar luas permukaan kontak antara sampel dengan pelarut sehingga proses ekstraksi akan lebih efisien (Vinatoru 2001).
Gambar 6 Ekstraksi daun kesum (A) maserasi, (B) ultrasonikasi dan (C) destilasi uap-air
Ekstraksi dilakukan untuk mengisolasi komponen bioaktif daun kesum dengan menggunakan pelarut yang sesuai. Polaritas dari senyawa target merupakan faktor penting dalam pemilihan pelarut (Cowan 1999). Pemilihan pelarut untuk ekstraksi komponen bioaktif hendaknya mempertimbangkan afinitas molekul antara pelarut dan zat terlarut, transfer massa, keamanan lingkungan, toksisitas terhadap manusia dan kelayakan finansial (Azmir et al. 2013). Ekstraksi dilakukan secara bertingkat dengan tiga pelarut yang berbeda polaritasnya, mulai dari pelarut nonpolar (heksan), pelarut semipolar (etil asetat) dan pelarut polar (etanol) (Gambar 5). Ekstraksi bertingkat dinilai efisien untuk jumlah sampel yang terbatas dan efektif untuk pemisahan komponen aktif ekstrak berdasarkan polaritasnya (Houghton dan Raman 1998).
Pada penelitian ini ekstraksi dilakukan secara bertingkat dengan membandingkan metode ekstraksi konvensional yaitu maserasi dengan agitasi 200 rpm selama 24 jam dengan metode nonkonvensional yaitu ultrasonikasi dengan frekuensi 40 kHz selama 20 menit (Gambar 6). Maserasi merupakan metode ekstraksi sederhana yang dilakukan dengan merendam bubuk sampel dalam suatu pelarut untuk jangka waktu tertentu (Azmir et al. 2013), sedangkan ultrasonikasi merupakan teknik pemberian gelombang ultrasonik (umumnya antara 20 kHz-100MHz) pada ekstraksi menggunakan pelarut (Azmir et al. 2013; Jabrak 2013). Ekstrak yang diperoleh adalah ekstrak heksan (nonpolar), ekstrak etil asetat (semipolar) dan ekstrak etanol (polar) (Gambar 7).
Secara keseluruhan, rendemen tertinggi diperoleh dari ekstrak etanol sebesar 15,45 ± 0,36% dan rendemen terendah diperoleh dari minyak atsiri sebesar 0,14 ± 0,01%. Rendemen ekstraksi secara berurutan dari yang tertinggi sampai terendah adalah ekstrak etanol > ekstrak etil asetat > ekstrak heksan > minyak atsiri (Tabel 4). Hasil tersebut memperlihatkan perbedaan polaritas senyawa yang terekstrak sesuai polaritas pelarut, semakin tinggi polaritas pelarut makin meningkat rendemen ekstrak yang diperoleh. Ekstrak daun kesum yang diperoleh didominasi senyawa polar, yang terekstrak dengan pelarut polar yaitu etanol. Senyawa aktif yang dapat diekstrak menggunakan etanol adalah tannin, polifenol, poliasetilen, flavonol, terpenoid, sterol, alkaloid dan propolis (Cowan 1999).
Tabel 4 Rendemen dan waktu ekstraksi dengan metode ekstraksi yang berbeda
Metode ekstraksi
Rendemen ekstrak (%) Waktu ekstraksi per pelarut Heksan Etil asetat Etanol Minyak
atsiri
Ultrasonikasi** 1,71*±0,08 1,92*±0,02 15,38*±0,41 - 20 menit Maserasi** 0,71±0,05 1,41±0,01 5,98±0,02 - 24 jam
Destilasi uap-air *** - - - 0,14±0,01 8 jam
*berbeda nyata (uji-t, p = 0,05)
**ekstraksi dilakukan secara bertingkat
***tidak dibandingkan dengan metode ultrasonikasi dan maserasi
memungkinkan hasil ekstraksi yang lebih tinggi dalam periode waktu yang lebih singkat dibanding maserasi sehingga mengurangi penggunaan energi (Khan et al. 2010; Mantegna et al. 2012). Jabrak (2013) menyatakan ultrasonikasi merupakan salah satu teknologi baru yang dikembangkan untuk meminimalkan waktu proses, biaya dan memaksimalkan kualitas. Sebaliknya proses ekstraksi dengan metode konvensional memerlukan waktu yang panjang dan juga dapat menyebabkan beberapa degradasi dari molekul target (Mantegna et al. 2012).
Keunggulan ultrasonikasi dibanding maserasi dalam hal rendemen dan waktu ekstraksi dapat dijelaskan oleh mekanisme yang berbeda. Prinsip utama ekstraksi dengan ultrasonikasi didasarkan pada fenomena kavitasi, efek mekanis dan termal yang dapat menyebabkan terganggunya dinding sel sehingga terjadi intensifikasi perpindahan massa dan interaksi antara pelarut dan bahan (Shirsath et al. 2012; Azmir et al. 2013). Ultrasonikasi akan memfasilitasi pengembangan dan hidrasi pori-pori dinding sel bahan sehingga meningkatkan proses difusi dan perpindahan massa (Vinatoru 2001). Daya ultrasonikasi berfokus pada kerusakan lapisan kutikula diikuti perforasi ke dinding sel bahan yang menyebabkan kerusakan (Aspe dan Fernandez 2011) sehingga rendemen ekstrak yang diperoleh maksimal.
Prinsip utama maserasi didasarkan pada kontak langsung antara pelarut dan bahan, dimana pelarut akan berpenetrasi ke dalam matriks bahan melalui kapiler – kapiler dan melarutkan ekstrak karena adanya perbedaan konsentrasi antara larutan di dalam dan luar sel (proses difusi). Perlakuan agitasi sebesar 200 rpm bertujuan untuk meningkatkan efek mekanis yang akan meningkatkan perpindahan massa dan interaksi antara pelarut dan bahan. Sebagaimana dilaporkan Azmir et al. (2013), perlakuan agitasi pada maserasi memfasilitasi ekstraksi dengan meningkatkan difusi dan melepaskan larutan pekat dari permukaan sampel agar proses difusi berlanjut hingga tercapai keseimbangan konsentrasi larutan di dalam dan luar sel. Namun, efek mekanis yang dihasilkan tidak mampu menimbulkan kerusakan berarti pada matriks bahan sehingga rendemen ekstrak yang diperoleh tidak maksimal. Hal ini menjelaskan bahwa perlakuan agitasi sebesar 200 rpm selama 24 jam untuk meningkatkan difusi pelarut kurang efektif dibandingkan dengan aplikasi ultrasonikasi.
Fitokimia Ekstrak Daun Kesum
senyawa fenolik, alkaloid, flavonoid dan terpenoid-steroid, sedangkan pada penelitian ini selain senyawa-senyawa tersebut juga teridentifikasi senyawa tanin dan saponin.
Tabel 5 Fitokimia berbagai ekstrak daun kesum
Komponen Ekstrak hexan Ekstrak Etil asetat Ekstrak Etanol
Alkaloid - - +
(+) teridentifikasi dan menunjukkan intensitas warna (-) tidak teridentifikasi
Analisis fitokimia ekstrak tanaman mengindikasikan keberadaan satu atau lebih kelompok fitokonstituen seperti tannin, flavonoid, glikosida, fenolik, saponin, alkaloid, terpenoid dan lain-lain yang terkait aktivitas antibakteri ekstrak baik sendiri atau dalam kombinasi (Ahmad dan Aqil 2007). Telah diketahui bahwa kandungan senyawa aktif tanaman terutama rempah-rempah dan herbal merupakan komponen yang banyak berperan sebagai senyawa antimikroba (Nychas 1995).
Senyawa fenolik merupakan suatu substansi yang mempunyai cincin aromatik dengan satu atau lebih substansi gugus hidroksil (Harborne 2006). Senyawa fenolik berperan sebagai agen antimikroba dengan mekanisme aksi yang diduga melibatkan gangguan fungsi membran sitoplasma termasuk transpor aktif (Naidu 2000). Senyawa fenolik terbukti memiliki sifat antimikroba dengan mengubah permeabilitas membran sitoplasma sehingga terjadi kebocoran bahan – bahan intraseluler, kemudian mendenaturasi dan menginaktifkan protein seperti enzim. Senyawa ini dapat melalui dinding sel dengan memutus ikatan silang peptidoglikan yang berakibat meningkatnya permeabilitas membran. Hal ini berakibat pada terhambatnya aktivitas dan biosintesis enzim – enzim spesifik yang diperlukan dalam reaksi metabolisme sel. Senyawa fenol yang teroksidasi menghambat metabolisme enzim yang menyebabkan inaktivasi kegiatan reproduksi sel. Struktur seperti antosianin dapat membentuk kompleks dengan asam amino nukleofilik dari dinding sel diikuti dengan hilangnya fungsi dinding sel (Pliego 2007; Cowan 1999).
2000). Cushnie dan Andrew (2005) menyatakan flavonoid memiliki aktivitas antimikroba yang luas dan penghambatan enzim, diantaranya flavanon terhadap Methicillin – Resistant S. aureus (MRSA) dan isoflavon terhadap spesies Streptococcal.
Ekstrak etanol kesum mengandung senyawa fenolik yang tinggi ( Huda-Faujan et al. 2007; Maizura M. et al. 2011; Qader et al. 2011) dengan asam galat sebagai senyawa aktif utama, diikuti asam kumarat, rutin dan quercetin (Qader et al. 2012b). Daun kesum mengandung total flavonoid sebesar 308,5 mg/kg berat kering, dengan komponen utama myricetin dan quercetin (Miean dan Mohamed 2001). Senyawa fenolik yang dilaporkan memiliki aktivitas antibakteri diantaranya asam galat dari Lawsonia inermis (Cowan 1999) dan quercetin melalui penghambatan DNA gyrase terhadap E. coli (Cushnie dan Andrew 2005).
Alkaloid mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem siklik (Harborne 2006). Senyawa alkaloid dapat masuk ke dinding sel dan mengganggu sintesis DNA. Alkaloid memiliki aktivitas antimikroba, diantaranya berberine dari Berberis vulgaris dan piperine dari Piper nigrum (Cowan, 1999) dan bromotirosin alkaloid terhadap bakteri gram positif, termasuk mycobacteria and staphylococci (Pick et al. 2006). Prinsip utama senyawa saponin sebagai agen antimikroba adalah interaksinya dengan membran sterol, dengan efek utama mengganggu membran sel (Cowan 1999) menyebabkan kebocoran protein dan enzim tertentu dari sel bakteri terutama beberapa bakteri Gram positif seperti Bacillus sp. Senyawa saponin yang dilaporkan antibakterinya diantaranya steroid dari Henricia laeviuscola dan triterpenoid dari Symphytum officinale (Naidu 2000).
Aktivitas Antibakteri Ekstrak Daun Kesum terhadap E. coli dan S. aureus
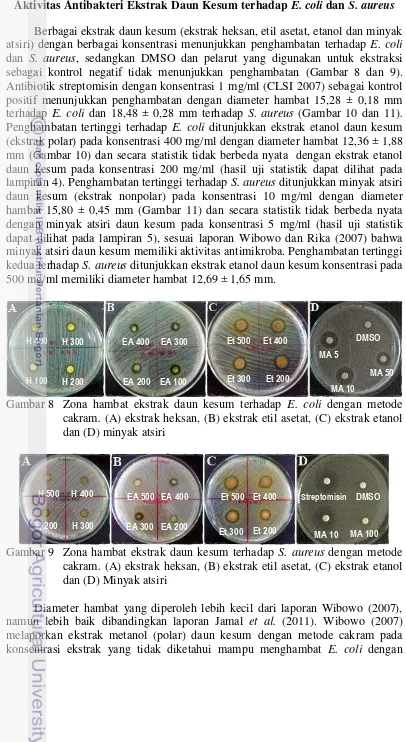
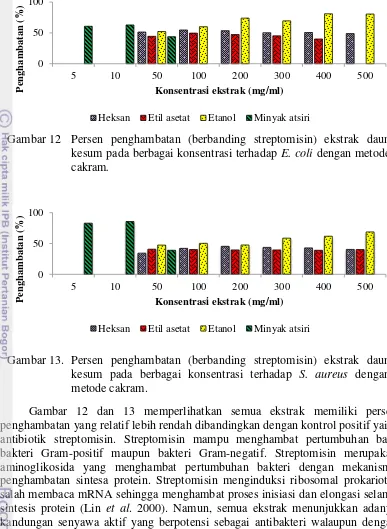
Berbagai ekstrak daun kesum (ekstrak heksan, etil asetat, etanol dan minyak atsiri) dengan berbagai konsentrasi menunjukkan penghambatan terhadap E. coli dan S. aureus, sedangkan DMSO dan pelarut yang digunakan untuk ekstraksi sebagai kontrol negatif tidak menunjukkan penghambatan (Gambar 8 dan 9). Antibiotik streptomisin dengan konsentrasi 1 mg/ml (CLSI 2007) sebagai kontrol positif menunjukkan penghambatan dengan diameter hambat 15,28 ± 0,18 mm terhadap E. coli dan 18,48 ± 0,28 mm terhadap S. aureus (Gambar 10 dan 11). Penghambatan tertinggi terhadap E. coli ditunjukkan ekstrak etanol daun kesum (ekstrak polar) pada konsentrasi 400 mg/ml dengan diameter hambat 12,36 ± 1,88 mm (Gambar 10) dan secara statistik tidak berbeda nyata dengan ekstrak etanol daun kesum pada konsentrasi 200 mg/ml (hasil uji statistik dapat dilihat pada lampiran 4). Penghambatan tertinggi terhadap S. aureus ditunjukkan minyak atsiri daun kesum (ekstrak nonpolar) pada konsentrasi 10 mg/ml dengan diameter hambat 15,80 ± 0,45 mm (Gambar 11) dan secara statistik tidak berbeda nyata dengan minyak atsiri daun kesum pada konsentrasi 5 mg/ml (hasil uji statistik dapat dilihat pada lampiran 5), sesuai laporan Wibowo dan Rika (2007) bahwa minyak atsiri daun kesum memiliki aktivitas antimikroba. Penghambatan tertinggi kedua terhadap S. aureus ditunjukkan ekstrak etanol daun kesum konsentrasi pada 500 mg/ml memiliki diameter hambat 12,69 ± 1,65 mm.
Gambar 8 Zona hambat ekstrak daun kesum terhadap E. coli dengan metode cakram. (A) ekstrak heksan, (B) ekstrak etil asetat, (C) ekstrak etanol dan (D) minyak atsiri
Gambar 9 Zona hambat ekstrak daun kesum terhadap S. aureus dengan metode cakram. (A) ekstrak heksan, (B) ekstrak etil asetat, (C) ekstrak etanol dan (D) Minyak atsiri
Diameter hambat yang diperoleh lebih kecil dari laporan Wibowo (2007), namun lebih baik dibandingkan laporan Jamal et al. (2011). Wibowo (2007) melaporkan ekstrak metanol (polar) daun kesum dengan metode cakram pada konsentrasi ekstrak yang tidak diketahui mampu menghambat E. coli dengan