INDUKSI EMBRIO SOMATIK DURIAN (
Durio zibethinus
)
PADA BEBERAPA MEDIA YANG DILENGKAPI DENGAN
AUKSIN DAN SITOKININ
RATIH PUSPARANI
A24063048
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
RATIH PUSPARANI. Induksi Embrio Somatik Durian (Durio zibethinus) pada Beberapa Media yang Dilengkapi dengan Auksin Dan Sitokinin. (Dibimbing oleh DARDA EFENDI dan DEWI SUKMA).
Durian merupakan buah unggulan Indonesia yang bernilai ekonomi tinggi, namun budidaya skala besarnya belum optimal. Durian secara konvensional diperbanyak dengan sambungan (grafting). Kelemahannya ketersediaan biji untuk semaian batang bawah tergantung pada musim dan bahan sambungan untuk batang atas sangat tergantung pada fase perkembangan tanaman induk. Perbanyakan secara in vitro melalui embriogenesis somatik dapat dijadikan alternatif penyediaan bibit durian sepanjang musim.
Penelitian terdiri dari tiga percobaan yang saling terkait dalam hal tujuan dan penggunaan eksplan. Eksplan yang digunakan adalah embrio zigotik dewasa dari buah durian. Percobaan I bertujuan mengetahui jenis media dan konsentrasi picloram yang terbaik dalam menginduksi kalus pada durian varietas Monthong dan Chanee. Percobaan II bertujuan mengetahui kombinasi media dan konsentrasi ZPT (BAP dan picloram) yang terbaik untuk proliferasi kalus dan induksi kalus embriogenik. Percobaan III bertujuan mendapatkan komposisi media yang optimal untuk pendewasaan embrio somatik. Penelitian dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura Institut Petanian Bogor pada bulan April 2010 sampai April 2011.
Percobaan I menggunakan Rancangan Acak Lengkap (RAL). Percobaan terdiri dari 2 faktor yang disusun secara faktorial. Faktor pertama yaitu tiga jenis media (MS, WPM dan B5). Faktor kedua yaitu konsentrasi picloram dengan 6 taraf yaitu 0, 1, 2, 3, 4 dan 5 ppm. Terdapat 18 perlakuan, tiap perlakuan terdiri dari 3 ulangan dan setiap ulangan terdiri dari 1 botol kultur yang berisi 4 eksplan.
dengan komposisi media MS + BAP 1 + picloram (3, 4 atau 5 ppm). Percobaan menggunakan rancangan acak lengkap 1 faktor dengan 5 ulangan dan setiap ulangan terdiri dari 1 botol kultur yang berisi 4 eksplan.
Percobaan III menggunakan Rancangan Acak Lengkap (RAL), terdiri dari percobaan III.a dan percobaan III.b, dimana masing-masing percobaan terdiri dari 2 faktor yang disusun secara faktorial. Faktor pertama adalah konsentrasi BAP dengan 3 taraf yaitu 0, 1 dan 2 ppm. Untuk percobaan III.a, faktor kedua adalah konsentrasi NAA dengan 5 taraf yaitu 0, 1, 2, 3 dan 4 ppm, sehingga terdapat 15 perlakuan. Untuk percobaan III.b, faktor kedua adalah konsentrasi Picloram dengan 4 taraf yaitu 0, 4, 8 dan 12 ppm, sehingga terdapat 12 perlakuan. Tiap perlakuan terdiri dari 10 ulangan yang terdiri dari 1 botol kultur berisi 2 eksplan.
Kalus dapat terbentuk pada hampir semua media perlakuan induksi kalus. Kalus dari eksplan varietas Chanee lebih cepat diinduksi namun varietas Monthong menghasilkan kalus yang kualitasnya lebih baik. Persentase eksplan yang membentuk kalus pada eksplan varietas Monthong mencapai 100 % pada media MS + picloram (1, 2, 3 dan 5 ppm). Kalus yang telah terbentuk dapat berproliferasi lebih baik jika disubkultur pada media MS + BAP 1 ppm + picloram (3, 4 dan 5 ppm). Kalus embriogenik dapat diinduksi pada semua media perlakuan pada rentang waktu subkultur II – IV.
Pro-embrio globular dapat terbentuk pada semua perlakuan kombinasi taraf BAP dan NAA. Kombinasi perlakuan yang terbaik dan menunjukkan rata-rata jumlah pro-embrio globular yang berbeda nyata dengan kombinasi media lainnya adalah media MS + BAP 2 ppm + NAA 1 ppm. Namun pro-embrio globular yang telah terbentuk tidak ada yang berhasil mengalami pendewasaan embrio. Embrio somatik tidak berhasil terbentuk pada semua perlakuan kombinasi taraf BAP dan picloram.
INDUKSI EMBRIO SOMATIK DURIAN (
Durio zibethinus
)
PADA BEBERAPA MEDIA YANG DILENGKAPI DENGAN
AUKSIN DAN SITOKININ
Skripsi sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian pada Fakultas Pertanian
Institut Pertanian Bogor
RATIH PUSPARANI
A24063048
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Dr. Ir. Darda Efendi, MSi Dr. Dewi Sukma, SP. MSi NIP. 19630616 198903 1 006 NIP. 19700404 199702 2 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr NIP. 1961101 198703 1 003
Tanggal Lulus :
Judul
:
INDUKSI
EMBRIO
SOMATIK
DURIAN
(
Durio zibethinus
) PADA BEBERAPA MEDIA YANG
DILENGKAPI DENGAN AUKSIN DAN SITOKININ
RIWAYAT HIDUP
Penulis dilahirkan di Pasuruan, Jawa Timur pada 26 Nopember 1987. Penulis merupakan putri pertama dari 6 bersaudara dari pasangan Bapak Muhamad Hariono dan Ibu Pupung Ratnasari.
Penulis menyelesaikan sekolah dasar pada tahun 2000 di SDN Mangun Jaya 06, Bekasi, kemudian melanjutkan sekolah menengah pertama ke SLTP Negeri 2 Garut dan lulus pada tahun 2003. Pada tahun 2006 penulis berhasil menamatkan jenjang studi sekolah menengah atas di SMA Negeri 1 Tarogong kidul, Garut. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama perkuliahan penulis aktif di berbagai organisasi mahasiswa. Tahun 2006-2007 sebagai anggota di Forum for Scientific Studies (FORCES) dan Organisasi Mahasiswa Daerah-Garut (HIMAGA), tahun 2007-2008 sebagai pengurus di Himpunan Mahasiswa Agronomi (Himagron) dan Forum Komunikasi Rohis Departemen- Fakultas Pertanian (FKRD-A). Tahun 2008-2009 menjadi staf Kebijakan Pertanian di Badan Eksekutif Mahasiswa kabinet IPB-Gemilang. Pada semester 8 penulis menjadi asisten praktikum pada mata kuliah Dasar-Dasar Hortikultura. Penulis juga pernah mendapatkan beasiswa PPA (Peningkatan Prestasi Akademik) dari DIKTI pada semester 3-4 dan beasiswa Tanoto Foundation pada semester 5-8.
KATA PENGANTAR
Puji syukur penulis panjatkan kepada kehadirat Allah SWT yang telah memberi kekuatan, keyakinan dan petunjuk sehingga penelitian ini dapat diselesaikan dengan baik.
Penelitian ini dilaksanakan terdorong oleh keinginan penulis untuk memiliki keterampilan dan keterampilan di bidang bioteknologi khususnya kultur jaringan. Selain itu, belum ada laporan tentang keberhasilan induksi embrio somatik durian sehingga penulis tertantang untuk melakukan penelitian ini. Jika penelitian ini berhasil, harapan kedepannya mampu menyediakan bibit durian yang memiliki sifat seragam dan sama dengan induknya dalam jumlah cukup untuk skala perkebunan dengan waktu penyediaan yang tidak tergantung pada musim.
Penulis menyampaikan terima kasih kepada:
1. Dr. Ir. Darda Efendi, MSi dan Dr. Dewi Sukma, SP. MSi yang telah menyediakan waktu untuk memberikan masukan yang berharga dan dengan sabar memberikan bimbingan dan pengarahan selama proses penelitian dan penulisan skripsi.
2. Ir. Dini Dinarti, MSi yang telah bersedia menjadi dosen penguji. Terima kasih atas masukan bermanfaat yang diberikan selama sidang skripsi.
3. Dr. Herdhata Agusta, MSi selaku dosen pembimbing akademik. Terima kasih atas bimbingannya dalam menentukan rencana belajar penulis selama menempuh pendidikan di Institut Pertanian Bogor.
4. Dr. Ir. Yudiwati, MSi dan Ir. Edhi Sandra, MSi untuk diskusi yang menarik dan banyak memberikan pengetahuan baru bagi penulis baik mengenai penelitian maupun diluar penelitian yang sedang dilakukan.
5. Kedua orang tua yang dengan penuh pengertian selalu mendukung penelitian penulis meskipun memerlukan waktu lama, dan untuk adik-adik penulis yang selalu menginspirasi penulis untuk selalu memberikan yang terbaik.
7. Laboran, senior dan teman-teman di Laboratorium Kultur Jaringan, Teh Juju, Teh Iif, Pak Arifin, Mba Nofia, Mba Arrin, Mba Prima, Kak Dendih, Chandra, Siffa dan Sadewi yang telah membantu penulis selama penelitian.
8. Teman-teman seperjuangan AGH-ers 43, terutama Himma, Yuli, Fiet, Anif dan Febriani yang telah membantu penulis selama penelitian dan penulisan skripsi. Kak Arif dan Hapshoh yang telah memberikan masukan kepada penulis untuk pengolahan data.
9. Teman-teman Cresh (Creative Shop), terutama Mba Desty dan Desi yang dengan penuh pengertian selalu mendukung penulis untuk selalu mengutamakan penelitian.
10. Staf pengajar Teknik Penulisan Ilmiah atas bimbingannya dalam membuat tulisan ilmiah yang benar dan tepat.
Bogor, Oktober 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang... 1
Tujuan ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA... 5
Botani durian ... 5
Durian Monthong dan Chanee ... 6
Kultur Jaringan ... 7
Embriogenesis Somatik... 7
Media Kultur Jaringan ... 9
Zat Pengatur tumbuh ... 10
BAHAN DAN METODE ... 12
Tempat danWaktu ... 12
Bahan dan Alat ... 12
Metode Penelitian ... 12
Pelaksanaan Penelitian ... 17
HASIL DAN PEMBAHASAN ... 22
Percobaan I. Induksi Kalus... 22
Percobaan II. Proliferasi Kalus dan Induksi Kalus Embriogenik ... 28
Percobaan III. Pendewasaan Embrio Somatik ... 36
KESIMPULAN DAN SARAN ... 45
Kesimpulan... 45
Saran ... 45
DAFTAR PUSTAKA ... 46
DAFTAR TABEL
Nomor Halaman 1. Kombinasi Media dan Konsentrasi Picloram ... 3
2. Kombinasi Media dan ZPT ... 15 Error! Bookmark 3. Kombinasi Auksin (NAA dan Picloram) dan BAP ... 16 Error! Bookmark 4. Respon Berbagai Varietas Bahan Eksplan Tahap Inisiasi
terhadap Berbagai Media Perlakuan pada 4 MST ... 23 5. Pengaruh Jenis Media dan ZPT terhadap Rata-rata Persentase
Eksplan Berkalus Tahap Sub Kultur I pada 4 MST ... 25 6. Pengaruh Jenis Media dan ZPT terhadap Bobot dan Diameter
Eksplan Berkalus Tahap Sub Kultur II ... 26 7. Pengaruh Jenis Media dan ZPT terhadap % Eksplan Berkalus,
% Kalus Berstruktur Remah, Skor, dan Warna Kalus Tahap Sub Kultur I pada 4 MST ... 27 8. Pengaruh Jenis Media dan ZPT terhadap Persentase Kalus yang
Membentuk Kalus Baru Sub Kultur III, IV, V dan VI pada 4 MST ... 29 9. Pengaruh Jenis Media dan ZPT terhadap Bobot, Diameter dan
Skor Ukuran Kalus Tahap Sub Kultur III, IV, V dan VI pada 4 MST ... 30 10. Pengaruh Jenis Media dan ZPT terhadap Waktu Munculnya
Kalus Embrionik dan Persentase Kalus Embrionik pada Tahap Sub Kultur III, IV, V dan VI pada 4 MST ... 32 11. Pengaruh Jenis Media dan ZPT terhadap Persentase Struktur
Kalus (Remah (RH) dan Kompak (KP)) Tahap Sub Kultur III, IV, V dan VI pada 4 MST ... 35 12. Pengaruh Kombinasi Taraf Konsentrasi BAP dan NAA terhadap
Persentase Tipe Kalus Sub Kultur I pada 0 MST, 4 MST dan 8 MST ... 38 13. Pengaruh Kombinasi Taraf Konsentrasi BAP dan Picloram
terhadap Persentase Tipe Kalus Sub Kultur I pada 0 MST, 4 MST dan 8 MST ... 39 14. Pengaruh Taraf Konsentrasi BAP dan NAA terhadap Rata-Rata
Jumlah Pro-Embrio ... 41 15. Pengaruh Interaksi BAP dan NAA Berbagai Kombinasi Taraf
DAFTAR GAMBAR
Nomor Halaman 1. Tanaman Durian (www.bibitunggul.wordpress.com) ... 5 2. Durian Monthong (Wiryanta, 2002) ... 6
3. Durian Chanee (www.teakdoor.com) ... 6 Error! Bookmark 4. Warna Kalus : (A) Putih, (B) Putih kekuningan, (C) Putih
kecoklatan, (D) Kuning, (E) Kuning kecoklatan, (F) Coklat muda, (G) Coklat ... 20 5. Skor Penutupan Kalus: (A) Skor 1: < 25% eksplan tertutup kalus,
(B) Skor 2: 25 - 50% eksplan tertutup kalus, (C) Skor 3: 51 - 75% eksplan tertutup kalus, (D) Skor 4: ≥ 75% eksplan tertutup kalus ... 20
6. Tipe kalus : (A) Tipe 1, (B) Tipe 2, (C) Tipe 3, (D) Tipe 4 ... 21 Error! Bookmark 7. Tipe Kalus : (A) Kalus Tipe 1, (B) Kalus Tipe ... 23
8. Kalus Berstruktur Remah ... 28 9. Kalus dengan Pro-Embrio Globular pada Media Perlakuan MS +
BAP 1 ppm + Picloram 4 ppm ... 33 10.Kalus Bernodul pada Media Perlakuan MS + BAP 1 ppm +
Picloram 4 ppm ... 37 11.Pro-Embrio Globular : (A) Di Media Perlakuan MS + BAP 1 ppm
+ NAA 5 ppm, (B) Perbesaran 40 kali (C) Irisan Melintang Perbesaran 40 kali ... 40 12.Pro-embrio globular yang terbentuk pada media perlakuan :
DAFTAR LAMPIRAN
Nomor Halaman
1. . Komposisi Media MS, B5 dan WPM ... 51 2. Pengaruh Jenis Media dan ZPT terhadap Warna Kalus Tahap
PENDAHULUAN
Latar Belakang
Durian (Durio zibethinus L.) merupakan tanaman yang populer di Asia Tenggara dan sudah dikenal sejak abad 17 M. Durian tumbuh ditempat beriklim tropika basah, khususnya di Indonesia, Malaysia, Philippina, Brunei Darussalam dan Thailand (Subhadrabandhu, 2001). Tidak mengherankan bila durian menjadi
buah “kebanggaan nasional” di Indonesia, yang juga digemari oleh masyarakat di dunia dengan sebutan “Raja Buah” atau “The King of Fruits” (Sunarjono, 1998).
Indonesia mempunyai peluang besar menjadi salah satu negara produsen dan pengekspor durian di dunia. Keunggulan komparatif negara kita adalah wilayahnya yang amat luas dengan kondisi iklim tropis memungkinkan durian tumbuh di semua provinsi di Indonesia, terutama di pulau Jawa, Sumatera dan Kalimantan. Disamping itu Indonesia juga kaya akan sumber daya (plasma nutfah) aneka jenis durian. Di Indonesia diperkirakan terdapat lebih dari 100 kultivar durian, 17 varietas diantaranya telah dilepas oleh Menteri Pertanian, yaitu 15 varietas asli Indonesia (Sunan, Sukun, Simas, Sihijau, Matahari, dan lain-lain) dan 2 varietas diintroduksi dari Thailand (Kani dari Chanee dan Otong dari Monthong) (Direktorat Pemasaran Pertanian, 2007).
Suatu ironi bahwa Indonesia masih dibawah Thailand dan Malaysia dalam ekspor buah durian. Indonesia menghasilkan durian sebanyak 747 848 ton pada tahun 2006 dan meningkat menjadi 797 798 ton pada tahun 2009 (BPS, 2010). Ekspor durian Indonesia adalah 2 635 kg pada tahun 2006, sementara nilai impornya 16 334 236 kg pada tahun 2006 (Direktorat Tanaman Buah, 2008a dan 2008b). Thailand saja yang memiliki wilayah daratan jauh lebih kecil dari Indonesia mampu mengekspor 138.000 ton durian pada tahun 2010 ke Cina dengan nilai hampir US$70 juta atau sekitar 60% dari ekspor durian global negara itu (www.liputan6.com).
memenuhi permintaan pasar yang ada serta diharapkan dapat meningkatkan pendapatan dan kesejahteraan masyarakat.
Durian secara konvensional diperbanyak dengan cara sambungan
(grafting) menggunakan batang bawah hasil semaian dari biji “asalan” atau “sapuan” dengan batang atas dari jenis yang diinginkan seperti Monthong, Matahari, Chanee atau lainnya. Kelemahan dari perbanyakan konvensional tersebut adalah ketersediaan biji untuk semaian batang bawah tergantung pada musim. Demikian juga untuk batang atas bahan sambungan sangat tergantung pada fase perkembangan tanaman induk. Biji untuk bahan batang bawah bisa jadi membawa penyakit, sehingga bibit yang dihasilkan tidak bebas patogen. Oleh karena itu perlu diupayakan suatu teknologi yang dapat menjamin produksi bibit sehat dan berkualitas sepanjang musim.
Perbanyakan durian melalui teknik kultur jaringan merupakan alternatif untuk penyediaan bibit durian bebas patogen dan dapat digunakan tanpa mengenal musim. Regenerasi tanaman dalam kultur jaringan dapat terjadi melalui jalur organogenesis atau embriogenesis somatik. Bedanya, dalam organogenesis organ yang terbentuk dapat berupa organ akar atau tunas saja sedangkan dalam embriogenesis somatik, embrio yang dihasilkan dapat memiliki organ yang utuh secara bersamaan seperti tanaman yang berasal dari embrio zigotik.
Menurut Purnamaningsih (2002) beberapa faktor yang mempengaruhi pembentukan embrio somatik adalah jenis eksplan, sumber nitrogen dan gula serta jenis dan konsentrasi zat pengatur tumbuh. Penelitian mengenai keberhasilan embriogenesis somatik pada tanaman buah berkayu telah banyak dilakukan menggunakan berbagai jenis media dengan tambahan ZPT. Zat pengatur tumbuh yang dapat menginduksi embrio somatik biasanya dari golongan auksin dan sitokinin. Auksin yang pernah dilaporkan berhasil menginduksi embrio somatik adalah 2,4-D, Picloram, dan NAA, sedangkan dari golongan sitokinin adalah BA/BAP, TDZ dan Kinetin.
2004), jarak pagar (Nindita, 2010), mangga (Litz and Gomez, 2005), jeruk (Germana, 2005), Kakao (Maximova et al, 2005; Figuera and Laurence, 2005). Namun belum pernah dilaporkan keberhasilan embriogenesis somatik pada durian, sehingga perlu dilakukan penelitian mengenai jenis media dan ZPT yang tepat untuk pembentukan embrio somatik durian.
Pengembangan protokol embriogenesis somatik pada durian dibedakan berdasarkan tujuannya. Jika planlet yang diinginkan adalah untuk penyediaan batang bawah, maka embriogenesis somatik dapat menggunakan jaringan embrio. Sebaliknya, jika tujuannya adalah untuk penyediaan batang atas yang akan digunakan untuk mikrografting, maka embriogenesis somatik harus menggunakan eksplan asal jaringan somatik.
Tujuan
Penelitian ini dilakukan untuk mengembangkan protokol embriogenesis somatik pada durian dengan eksplan embrio zigotik dalam upaya penyediaan batang bawah untuk mikrografting, yang dilakukan melalui tiga tahap percobaan. Percobaan I bertujuan untuk mengetahui jenis media dan konsentrasi picloram yang terbaik dalam menginduksi kalus pada durian Monthong dan Chanee. Percobaan II bertujuan untuk mengetahui kombinasi media dan zat pengatur tumbuh (BAP dan picloram) yang terbaik untuk proliferasi kalus dan induksi kalus embriogenik. Percobaan III bertujuan untuk mendapatkan komposisi media yang optimal untuk pendewasaan embrio somatik.
Hipotesis Hipotesis percobaan I yang diajukan yaitu
1. Terdapat media yang tepat untuk induksi kalus durian menggunakan eksplan embrio zigotik dewasa.
2. Terdapat konsentrasi picloram yang tepat untuk induksi kalus durian menggunakan eksplan embrio zigotik dewasa.
Hipotesis percobaan II yang diajukan yaitu
Terdapat komposisi media dan ZPT yang optimum untuk proliferasi kalus durian dan induksi kalus embriogenik.
Hipotesis percobaan III yang diajukan yaitu
1. Terdapat konsentrasi auksin (NAA atau Picloram) yang optimum untuk pendewasaan embrio somatik durian.
2. Terdapat konsentrasi BAP yang optimum untuk pendewasaan embrio somatik durian.
TINJAUAN PUSTAKA
Botani Durian
Durian di Jawa dikenal sebagai duren (bahasa Jawa, bahasa Betawi) dan kadu (bahasa Sunda). Di Sumatera dikenal sebagai durian dan duren (bahasa
Gayo). Di Sulawesi, orang Manado menyebutnya duriang, sementara orang Toraja duliang (Wikipedia, 2011). Klasifikasi tanaman durian dalam taksonominya adalah sebagai berikut :
Divisio : Magnoliophyta Classis : Magnoliopsida Ordo : Malvales Familia : Malvaceae Genus : Durio
Species : Durio zibethinus
Gambar 1. Tanaman Durian (www.bibitunggul.wordpress.com)
Pohon durian dapat mencapai ketinggian 25 m-40 m dgn diameter batang 50-100 cm. Syarat tumbuh tanaman durian adalah pada suhu 27-320C, kelembaban 75-80% dan curah hujan 1 500-2 500 mm/tahun dengan bulan basah 9-11 bulan/tahun (Untung, 1999). Tanaman durian dapat tumbuh di dataran rendah sampai ketinggian 1.000 m di atas permukaan laut. Namun, produksi terbaiknya dicapai jika penanaman dilakukan pada ketinggian 400-600 m di atas permukaan laut. Tanaman ini menyukai daerah yang beriklim basah atau tempat-tempat yang banyak turun hujan. Jenis tanah yang baik untuk pertumbuhannya yaitu tanah yang lembap, subur, gembur, tak bercadas, dan kedalaman air tanahnya tidak lebih dari 1 meter.
penyusuan dan penyambungan hipokotil (mini grafting) (Subhadrabandhu, 2001). Menurut Sunarjono (1998) bibit asal biji baru berbuah pada umur 7-15 tahun, perakaran kuat, tidak dipengaruhi oleh batang bawah, sifatnya tidak sama dengan sifat pohon induk. Sementara bibit hasil grafting akan berbuah pada umur 4-5 tahun (tergantung varietas).
Durian Monthong dan Chanee
Durian asal Thailand yang paling popular dan sudah resmi dianggap kultivar unggul adalah Monthong dan Chanee. Tanaman durian Monthong maupun Chanee merupakan tanaman genjah yang mampu berproduksi pada umur 4-5 tahun sejak ditanam dengan bibit asal sambung pucuk. Kedua jenis durian ini produksi buahnya cukup banyak dan mampu beradaptasi pada berbagai tempat di Indonesia, sayangnya tanaman ini tidak mempunyai ketahanan terhadap penyakit Phytophthora sp (Wiryanta, 2002).
Bentuk buah durian Monthong bervariasi, dari bulat panjang sampai hampir persegi dengan duri yang besar-besar dan tersusun jarang. Bobot buahnya mampu mencapai 6 kg. Dalam buahnya terdapat 5 juring dengan 6 pongge per juring. Daging buah sangat tebal dengan rasa manis legit, aroma harum sedang dan berwarna kuning keemasan (Wiryanta, 2002). Di Indonesia, durian ini berhasil diintroduksi dan dilepas oleh Menteri Pertanian dengan nama durian Otong pada 14 Januari 1987 ( Sobir dan Napitupulu, 2010).
2002).. Di Indonesia, durian ini berhasil diintroduksi dan dilepas oleh Menteri Pertanian dengan nama durian Kani pada 14 Januari 1987 ( Sobir dan Napitupulu, 2010).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bagian tanaman, seperti sel, jaringan dan organ serta menumbuhkan dalam kondisi aseptik sehingga bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali (Gunawan, 1992). Keberhasilan perbanyakan tanaman dengan kultur jaringan dipengaruhi oleh sifat genetik tanaman, karakteristik eksplan, komposisi media tumbuh, ZPT dan lingkungan kultur (Wiendi et al, 1991).
Perbanyakan secara kultur jaringan bertujuan untuk memproduksi tanaman dalam jumlah besar pada waktu singkat, tanpa memerlukan tempat yang luas, penanaman tidak tergantung musim, bibit yang dihasilkan lebih sehat dan memungkinkan terjadinya manipulasi genetik. Menurut Pisesha (2005), dalam perkembangan ilmu perbanyakan tanaman, teknik kultur jaringan mempunyai dua kegunaan utama yaitu untuk perbanyakan klonal yang akan menghasilkan propagula bermutu dan perbaikan utama tanaman untuk menghasilkan kultivar baru yang lebih unggul dan lebih mantap sesuai dengan program perbaikan sifat-sifat genetik yang dikehendaki.
Kultur jaringan memungkinkan regenerasi sel somatik melalui dua alternatif jalur yaitu organogenesis dan embriogenesis somatik (Terzi and Loschiavo, 1990). Organogenesis adalah proses terbentuknya organ seperti pucuk dan akar, sedangkan embriogenesis yaitu proses terbentuknya embrio somatik (Gunawan, 1992).
Embriogenesis Somatik
Beberapa faktor yang mempengaruhi pembentukan embrio somatik adalah jenis eksplan, sumber nitrogen dan gula serta jenis dan konsentrasi zat pengatur tumbuh. Induksi embriogenesis somatik membutuhkan penggunaan zat pengatur tumbuh dari golongan auksin dan sitokinin. Untuk induksi kalus embriogenik kultur umumnya ditumbuhkan pada media yang mengandung auksin dengan daya aktivitas kuat atau dengan konsentrasi tinggi seperti 2,4-D (Purnamaningsih, 2002). Auksin sintetik yang umum digunakan untuk embriogenesis adalah 2,4-D, IBA, dicamba dan picloram, sedangkan dari golongan sitokinin adalah BA, TDZ dan kinetin (Acquaah, 2004).
Menurut Hartman and Kester (1983) embrio somatik dapat terbentuk melalui 2 cara yaitu embriogenesis secara langsung dan tidak langsung. Embriogenesis langsung terjadi pada saat embrio terbentuk langsung dari jaringan eksplan atau Pre Embryonically Determined Cells (PEDC). Embriogenesis tidak langsung terjadi melalui fase kalus atau kultur suspensi yang biasa disebut Induced Embryonically Determined Cells (IEDC). Menurut Gray (2005) tahap perkembangan embrio somatik dan embrio zigotik memliki pola yang sama yaitu dimulai dari fase globular, hati, torpedo dan planlet untuk tanaman dikotil.
Menurut Efendi (2003) embriogenesis somatik dapat dibagi menjadi 4 tahap yaitu tahap induksi kultur embriogenik, pemeliharaan kultur embriogenik, perkembangan dan pendewasaan embrio somatik dan perkecambahan. Masing-masing tahap umumnya mempunyai kebutuhan komposisi media yang berbeda. Seperti pada Kakao, hasi penelitian Li et al dalam Maximova et al (2005) menemukan bahwa kultur embrionik berhasil diinduksi pada media yang mengandung 9.05 µM 2.4-D dan 0.22 µM BAP untuk eksplan staminodes dan dasar kelopak bunga (petal base). Sedangkan perkembangan dan pendewasaan embrio somatik terjadi pada media tanpa ZPT.
Media Kultur Jaringan
Media tanam merupakan faktor penting dalam kultur jaringan. Menurut Wetter and Constabel (1991) medium hara untuk kultur jaringan setidaknya mengandung lima kelompok senyawa. Senyawa tersebut terdiri atas garam anorganik, sumber karbon, vitamin, zat pengatur tumbuh, dan pelengkap berupa bahan organik. Komponen utama media hanya terdiri dari garam mineral, sumber karbon (gula), vitamin, dan zat pengatur tumbuh. Adapun pelengkap organik seperti nitrogen organik, berbagai asam organik, metabolit dan ekstrak tambahan tidak mutlak diperlukan, akan tetapi dapat menguntungkan untuk ketahanan dan perbanyakan sel.
Media in vitro sangat beraneka ragam, namun yang banyak digunakan adalah media Murashige and Skoog (MS), B5 dan WPM. Media MS dapat digunakan untuk hampir semua jenis kultur terutama herbaecious (Hartmann and Kester, 1983). Media MS memiliki komposisi garam dan hara mineral yang dapat digunakan secara luas dalam sistem kultur tanaman yang berbeda-beda. Media ini merupakan kombinasi antara zat-zat yang mengandung hara makro, mikro, sumber energi dan vitamin. Morfogenesis secara in vitro dipacu oleh beberapa faktor, yang paling utama adalah kadar Nitrogen. Media MS telah berhasil digunakan sebagai media dasar embriogenesis somatik pada Manggis (Te-chato and lim, 2005), Alpukat (Litz et al, 2005), Citrus spp (Germana, 2005), dan Cacao (Figuera and Laurence, 2005).
Dalam media MS terkandung garam N dan K yang sangat tinggi. Menurut Gunawan (1992) untuk mengurangi sensitivitas garam pada tanaman berkayu, maka Llyod dan McCown membuat Woody Plant Medium (WPM) pada tahun 1981. Media WPM telah digunakan sebagai media dasar embriogenesis somatik pada Garcinia indica Choiss (Thengane et al, 2006) dan Manggis (Purba, 2009).
pada alpukat (Witjaksono and Litz dalam Litz et al, 2005) manggis (Purba, 2009) dan mangga (Litz and Gomez-lim, 2005).
Jenis media yang umum digunakan adalah media padat. Menurut George dan Sherrington (1984), jenis media padat dapat menghasilkan tunas dan pucuk dengan cepat, morfogenesis dari kalus lebih baik, tunas serta akar tumbuh teratur dan tidak memerlukan pengocokan seperti pada medium cair. Bahan yang umum digunakan untuk memadatkan media adalah agar-agar. Menurut Gunawan (1992) keuntungan menggunakan agar-agar adalah bahan tersebut membeku pada suhu 45oC dan mencair pada suhu 100oC, sehingga dalam suhu ruang kultur, agar-agar akan berada dalam keadaan beku yang stabil, tidak dicerna oleh enzim tanaman dan tidak bereaksi dengan persenyawaan-persenyawaan penyusun media. Derajat keasaman (pH) optimum untuk sel-sel tanaman dalam kultur jaringan berkisar antara 5,5-5,8.
Zat Pengatur Tumbuh
Zat pengatur tumbuh merupakan senyawa-senyawa sintetik yang mempunyai pengaruh fisiologis yang serupa dengan hormon tanaman (Wattimena, 1992). Zat pengatur tumbuh berbeda dengan hormon yang dibentuk secara alami oleh tanaman. Pada umumnya terdapat lima jenis zat pengatur tumbuh, yaitu auksin, sitokinin, giberelin, asam absisik, dan etilen (Gaba, 2005). Zat pengatur tumbuh yang dihasilkan oleh tanaman disebut fitohormon.
Terdapat dua jenis zat pengatur tumbuh yang sering digunakan dan berperan sangat penting dalam kultur jaringan tanaman. Kedua jenis zat pengatur tumbuh ini adalah auksin dan sitokinin. Auksin digunakan secara luas dalam kultur jaringan untuk merangsang pertumbuhan kalus, suspensi sel dan organ, sementara sitokinin sangat penting dalam pengaturan pembelahan sel dan morfogenesis (Gunawan, 1992).
Sherrington, 1984). Kadar sitokinin tinggi justru akan menghambat embryogenesis dan pembentukan akar (Acquaah, 2004).
Penelitian-penelitian mengenai embriogenesis somatik telah membuktikan bahwa jenis dan konsentrasi ZPT adalah salah satu faktor penentu keberhasilan pembentukan embrio somatik. ZPT tersebut umumnya adalah dari golongan auksin dan sitokinin. Diantaranya pada manggis, telah dilaporkan oleh Te-chato dan Lim (2005) bahwa embrio somatik berhasil diperoleh dari kultur daun muda pada media MS dengan penambahan 2.2 µM BA, 2.3 µM thidiazuron (TDZ) dan PVP (Polyvinylpirolidone). Selain itu dari eksplan embrio zigotik muda juga telah berhasil diinduksi embrio somatik pada media WPM yang mengandung
picloram 1 µM dan media B5 yang mengandung Picloram 0.1-1 µM (Purba, 2009).
BAHAN DAN METODE
Tempat danWaktu
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan April 2010 sampai April 2011.
Bahan dan Alat
Bahan yang digunakan dalam penelitian meliputi beberapa jenis media yaitu media MS (Murashige and Skoog), media B5 (Gamborg et al., 1968) dan media WPM (Woody Plant Medium). Zat pengatur tumbuh yang digunakan meliputi jenis auksin (NAA dan Picloram) dan jenis sitokinin berupa BAP. Eksplan yang digunakan berupa embrio zigotik yang berasal dari durian matang varietas Monthong dan Chanee. Bahan lain yang digunakan meliputi serbuk agar-agar, gula, bakterisida, fungisida, antibiotik, aquades steril, karet, kapas, tissue, plastik, betadine, alkohol 70%, alkohol 96%, spirtus, clorox, detergen, dan kain hitam.
Alat yang digunakan adalah autoclave, botol kultur, pipet, labu takar, gelas ukur, cawan petri, timbangan analitik, mikroskop stereo, mikroskop BX-41, kamera, kertas indikator pH, laminar air flow cabinet, pinset, scalpel, bunsen, botol sprayer dan rak kultur.
Metode Penelitian
Percobaan I (Tahap Induksi Kalus)
Percobaan ini menggunakan eksplan embrio zigotik dewasa (Mature Zigotic Embryo/MZE) durian dari varietas Chanee dan Monthong, dengan varietas Monthong dibagi menjadi embrio bagian aksis dan terminal. Tahap induksi kalus ini berlangsung selama 3 bulan, yaitu 1 bulan untuk inisiasi dan 2 bulan untuk subkultur. Percobaan dilaksanakan dengan menggunakan Rancangan Acak Lengkap (RAL). Percobaan terdiri dari 2 faktor yang disusun secara faktorial. faktor pertama yaitu jenis media dengan 3 macam media dasar yaitu media MS, WPM dan B5. Faktor kedua yaitu konsentrasi picloram dengan 6 taraf yaitu 0, 1, 2, 3, 4 dan 5 ppm, sehingga terdapat 18 perlakuan. Masing-masing perlakuan terdiri dari 3 ulangan dan setiap ulangan terdiri dari 1 botol kultur yang berisi 4 eksplan. Karena eksplan terdiri dari tiga jenis sehingga terdapat 162 satuan percobaan. Kombinasi media dan picloram yang digunakan adalah sebagai berikut:
Tabel 1. Kombinasi Media dan Konsentrasi Picloram
Media Konsentrasi picloram (ppm)
0 1 2 3 4 5
MS Z-1 Z-2 Z-3 Z-4 Z-5 Z-6
WPM Z-7 Z-8 Z-9 Z-10 Z-11 Z-12
B5 Z-13 Z-14 Z-15 Z-16 Z-17 Z-18
Model rancangan yang digunakan dalam penelitian adalah
Yijk = µ + αi + j + (α )ij + k + εijk
Dimana :
Yijk = Respon perlakuan µ = Nilai tengah umum
αi = Pengaruh perlakuan media tanam
j = Pengaruh perlakuan taraf konsentasi picloram
k = Pengaruh ulangan ke-k
(α )ij = Pengaruh interaksi antara dua faktor perlakuan εijk = Pengaruh galat pecobaan
i = perlakuan media tanam
Data dianalisis dengan menggunakan uji F pada taraf 5%. Apabila hasil analisisnya berpengaruh nyata dari perlakuan terhadap peubah yang diamati, maka akan dilanjutkan dengan menggunakan uji lanjut Duncan Multiple Range Test (DMRT) pada taraf 5 %. Pengolahan data dilakukan dengan perangkat lunak Statistical Analysis System (SAS) versi 6.12.
Percobaan II (Tahap Proliferasi Kalus dan Induksi Kalus Embriogenik) Pada tahap proliferasi kalus, eksplan yang memiliki kalus yang berkembang dengan baik pada percobaan I digunakan sebagai eksplan pada percobaan II. Eksplan berkalus dipotong menjadi 2-5 bagian (tergantung ukuran eksplan, dengan ketebalan kurang lebih 2 mm). Bagian eksplan yang berkalus disubkultur pada media yang sama dengan induksi kalus (tersisa 9 perlakuan setelah subkultur II) dan sebagian kalus dari media B5 dipindahkan pada media baru sebanyak 3 perlakuan dengan komposisi media MS + BAP 1 ppm yang ditambahkan picloram dengan taraf yang sama dengan sebelumnya (3, 4 atau 5 ppm). Percobaan II dilakukan dengan menggunakan rancangan acak lengkap yang terdiri dari 1 faktor dengan 5 ulangan dan setiap ulangan terdiri dari 1 botol kultur yang berisi 4 eksplan, sehingga terdapat 60 satuan percobaan. Untuk lebih jelasnya rincian perlakuan disajikan pada Tabel 2.
Model rancangan yang digunakan dalam penelitian adalah
Yij = µ + αi + εij
Dimana :
Yijk = Respon perlakuan µ = Nilai tengah umum
αi = Pengaruh perlakuan media tanam dengan ZPT
εijk = Pengaruh galat pecobaan
i = perlakuan media tanam dengan ZPT j = 1, 2, 3 (ulangan)
akan dilanjutkan dengan menggunakan uji lanjut Duncan Multiple Range Test (DMRT) pada taraf 5 %.
Tabel 2. Kombinasi Perlakuan Media dan ZPT
Media BAP (ppm) Picloram (ppm)
MS 1 3
MS 1 4
MS 1 5
MS 0 1
WPM 0 0
WPM 0 3
WPM 0 4
WPM 0 5
B5 0 0
B5 0 3
B5 0 4
B5 0 5
Percobaan III (Pendewasaan Embrio Somatik)
Percobaan III terdiri dari 2 paket perlakuan yang berbeda, yaitu percobaan III.a dan percobaan III.b, dimana masing-masing percobaan terdiri dari 2 faktor yang disusun secara faktorial. Percobaan III.a menggunakan media MS yang dilengkapi dengan kombinasi taraf konsentrasi BAP dan NAA. Eksplan yang digunakan pada percobaan ini adalah eksplan yang memiliki riwayat 1 bulan inisiasi dan 2 kali subkultur (2 bulan) pada media B5 + Picloram 4 ppm, dilanjutkan dengan 4 kali subkultur (4 bulan) pada media MS + BAP 1 ppm + Picloram 4 ppm.
Percobaan III.b menggunakan media MS yang dilengkapi dengan kombinasi taraf konsentrasi BAP dan Picloram. Eksplan yang digunakan pada percobaan ini adalah eksplan yang memiliki riwayat 1 bulan inisiasi dan 2 kali subkultur (2 bulan) pada media B5 + Picloram 3 ppm, dilanjutkan dengan 4 kali subkultur (4 bulan) pada media MS + BAP 1 ppm + Picloram 3 ppm.
taraf yaitu 0, 1 dan 2 ppm, sehingga terdapat 15 perlakuan. Untuk percobaan III.b, faktor pertama adalah konsentrasi Picloram dengan 4 taraf yaitu 0, 4, 8 dan 12 ppm. Faktor kedua yaitu konsentrasi BAP dengan 3 taraf yaitu 0, 1 dan 2 ppm, sehingga terdapat 12 perlakuan. Masing-masing perlakuan terdiri dari 10 ulangan dan setiap ulangan terdiri dari 1 botol kultur yang berisi 2 eksplan. Sehingga percobaan III.a terdiri dari 150 satuan percobaan dan percobaan III.a terdiri dari 150 satuan percobaan. Kombinasi auksin (NAA dan Picloram) dan BAP yang digunakan adalah sebagai berikut :
Tabel 3. Kombinasi Auksin (NAA dan Picloram) dan BAP
Auksin (ppm) BAP (ppm)
0 1 2
NAA 0 BN1 BN2 BN3
1 BN4 BN5 BN6
2 BN7 BN8 BN9
3 BN10 BN11 BN12
4 BN13 BN14 BN15
Picloram 0 BP1 BP2 BP3
4 BP4 BP5 BP6
8 BP7 BP8 BP9
12 BP10 BP11 BP12
Model rancangan yang digunakan dalam penelitian adalah
Yijk = µ + αi + j + (α )ij + k + εijk
Dimana :
Yijk = Respon perlakuan µ = Nilai tengah umum
αi = Pengaruh perlakuan media tanam
j = Pengaruh perlakuan taraf konsentasi picloram
k = Pengaruh ulangan ke-k
(α )ij = Pengaruh interaksi antara dua faktor perlakuan
εijk = Pengaruh galat pecobaan i = perlakuan media tanam
Data dianalisis dengan menggunakan uji F pada taraf 5%. Apabila hasil analisisnya berpengaruh nyata dari perlakuan terhadap peubah yang diamati, maka akan dilanjutkan dengan menggunakan uji lanjut Duncan Multiple Range Test (DMRT) pada taraf 5 %. Pengolahan data dilakukan dengan perangkat lunak Statistical Analysis System (SAS).
Pelaksanaan Penelitian
Sterilisasi Alat
Alat yang digunakan dalam penelitian ini berupa botol kultur, pinset, scalpel, cawan petri dan pisau. Alat dicuci bersih menggunakan detergen lalu dikeringkan. Kemudian diautoclaf pada suhu 1210C dengan tekanan 1.1 kgcm2 selama 1 jam.
Pembuatan Larutan Stok
Pembuatan larutan stok bertujuan memudahkan dalam pembuatan media. Larutan stok dibuat sesuai komposisi pada masing-masing media dasar yaitu media MS, B5 dan WPM (lampiran 1). Pembuatan larutan stok biasanya dibuat sebanyak 1 liter, dimulai dengan menimbang bahan kimia sesuai dengan bobot yang dibutuhkan per satuan liter dari larutan stok yang akan dibuat. Bahan kimia dilarutkan dengan aquades steril sampai larut kemudian larutan dimasukkan ke dalam labu takar ukuran 1 liter dan ditambahkan aquades steril sampai tanda tera.
Khusus pembuatan larutan stok Fe, Na2EDTA baru dapat larut jika
dilarutkan di dalam aquades panas, setelah bahan kimia larut dan larutan berwarna kekuningan, baru dicampur dengan larutan FeSO4.7H2O yang sebelumnya telah
dilarutkan dengan aquades steril. Kemudian larutan stok dimasukkan ke dalam botol kaca gelap, atau jika yang ada hanya botol bening, maka perlu ditutupi dengan plastik hitam atau aluminium foil, karena stok Fe dapat bereaksi dan rusak jika terkena cahaya matahari langsung. Masing-masing larutan stok dimasukkan ke dalam botol kaca tebal dan disimpan pada suhu 150C.
dilarutkan dengan KOH atau NaOH 1 N. Sedangkan golongan sitokinin bersifat basa sehingga perlu dilarutkan dengan HCl 1 N. Cara membuatnya yaitu dengan mengambil bahan ZPT sesuai dengan konsentrasi yang akan dibuat, kemudian bahan dilarutkan menggunakan pelarutnya. Kemudian larutan dimasukkan ke dalam labu takar dan ditambahkan aquades steril ke dalamnya sampai batas tanda tera. Larutan stok ZPT kemudian dimasukkan ke dalam botol kaca tebal dan disimpan di lemari pendingin.
Pembuatan Media
Media MS, B5 dan WPM dibuat dari larutan stoknya masing-masing, yaitu larutan stok makro, mikro, Ca, Fe, myo-inositol, dan vitamin serta sukrosa sebanyak 30 g/l, lalu ditambahkan aquades sampai volume 1 liter (Tabel Lampiran 1). Kemudian ditambahkan ZPT sesuai dengan perlakuan dan PVP sebanyak 300 ppm. Selanjutnya dilakukan pengukuran pH pada larutan antara 5,6-5,8. Bila pH terlalu rendah maka ditambahkan KOH atau NaOH 1N, sedangkan bila pH terlalu tinggi maka ditambahkan HCl 1N. Apabila pH sudah sesuai kemudian ditambahkan agar-agar dan dimasak sampai mendidih. Setelah itu larutan dimasukan ke dalam botol kultur, ditutup plastik dan karet gelang kemudian disterilisasi dengan autoclave elektrik selama 30 menit pada tekanan
17.5 psi dan suhu 1β1˚C.
Sterilisasi Eksplan
Penanaman Perlakuan
Penanaman eksplan dilakukan dalam laminar air flow cabinet yang sebelumnya telah dibersihkan dengan alkohol 70 % dan disterilkan dengan lampu UV selama 1 jam sebelum penanaman. Semua alat dan bahan lainnya dimasukkan ke dalam laminar setelah disemprot terlebih dahulu dengan alkohol 70 %. Eksplan yang sudah berumur 1 bulan dikeluarkan dari dalam media inisiasi dan dipotong dalam petri dish sebesar 5 mm (dipotong melintang) kemudian eksplan ditanam dalam media subkultur dengan media yang sama dengan saat inisiasi. Hal ini dilakukan sampai subkultur II.
Satu bulan kemudian eksplan yang berkalus disubkultur lagi ke media perlakuan seperti pada percobaan II. Subkultur dilakukan sebulan sekali selama empat bulan (empat kali subkultur) sehingga terseleksi media yang cocok untuk proliferasi kalus dan induksi kalus embriogenik. Kalus dari media yang terseleksi dilanjutkan menjadi bahan eksplan bagi percobaan III. Sementara kalus yang tersisa pada media lainnya disubkultur pada media yang sudah terseleksi di percobaan II.
Pemeliharaan Kultur
Botol kultur yang telah berisi eksplan diletakkan pada rak kultur yang ditutup rapat dengan kain hitam dalam ruangan bersuhu 18-β0 ˚C. Eksplan yang terkontaminasi cendawan ataupun bakteri segera dikeluarkan dari ruang kultur. Pengamatan
Pengamatan dilakukan terhadap semua eksplan. Eksplan diamati satu persatu dan dicatat sesuai dengan respon yang muncul. Data setiap perlakuan diperoleh dari data rata-rata tiap botol.
Pengamatan yang dilakukan pada pecobaan 1 adalah:
1. Persentase kultur yang kontaminasi (dihitung tiap sebelum subkultur selanjutnya)
2. Respon eksplan terhadap media inisiasi kalus (bengkak, berkalus dan warna kalus yang muncul, atau eksplan tidak memberikan respon)
A B
G C
D E F
A B C D
4. Pada subkultur 2, parameter yang diamati adalah bobot, diameter (0 sampai 4 MST), persentase eksplan berkalus, persentase kalus
berstruktur remah, skor penutupan kalus dan warna kalus (diamati pada 4 MST, kecuali diameter ).
Pengamatan yang dilakukan pada pecobaan 2 adalah:
1. Bobot eksplan berkalus, ditimbang pada saat awal (0 MST) dan akhir (4 MST) subkultur kemudian dihitung selisihnya.
2. Diameter eksplan berkalus, diameter diukur sejak subkultur sampai 4 MST dan data yang ditampilkan adalah selisih dari diameter saat diamati dikurangi diameter semula (1-0 MST, 2-0 MST, 3-0 MST dan 4-0 MST) 3. Warna kalus (gambar 4) diamati saat 4 MST
4. Skor penutupan kalus (gambar 5) diamati saat 4 MST
[image:32.595.83.512.34.838.2]
Gambar 4. Warna Kalus: (A) Putih, (B) Putih kekuningan, (C) Putih kecoklatan, (D) Kuning, (E) Kuning kecoklatan, (F) Coklat muda, (G) Coklat
Gambar 5. Skor Penutupan Kalus: (A) Skor 1: < 25% eksplan tertutup kalus, (B) Skor 2: 25 - 50% eksplan tertutup kalus, (C) Skor 3: 51 - 75% eksplan
A B C D
5. Persentase eksplan yang membentuk kalus embriogenik, dihitung pada akhir pengamatan (pada 4 MST di setiap kali subkultur).
Pengamatan yang dilakukan pada percobaan III adalah: 1. Persentase tipe kalus (diamati pada 0, 4 dan 8 MST)
2. Jumlah embrio somatik (dihitung fase globular, hati, torpedo dan kotiledon yang terlihat pada eksplan, diamati pada 4, 8 dan 12 MST)
Kalus pada percobaan III digolongkan ke dalam empat tipe dengan ciri morfologi kalus yang berbeda, sebagai berikut:
Tipe 1 : bentuk seperti eksplan yang membengkak, terdapat kalus berwarna putih sampai putih kecoklatan, struktur kompak
Tipe 2 : terdapat bentukan globular diantara kalus berwarna coklat muda sampai coklat tua, struktur kalus remah dan bentukan globular mudah dilepaskan dari kalus
Tipe 3 : warna kalus kuning, kuning kecoklatan sampai coklat muda, agak transparan, struktur remah
Tipe 4: kalus berwarna putih sampai putih kecoklatan, struktur kompak, namun tidak terdapat bagian yang membengkak.
HASIL DAN PEMBAHASAN
Percobaan I. Induksi Kalus
Awalnya percobaan ini menggunakan rancangan percobaan RAL 2 faktorial namun terdapat beberapa perlakuan yang hilang akibat kontaminasi kultur yang cukup besar disertai banyaknya eksplan yang mengering/mati. Maka pada percobaan I pengolahan data dilakukan menggunakan RAL 1 faktor yaitu kombinasi media perlakuan.
Tahap Inisiasi
[image:34.595.107.516.319.738.2]Inisiasi dilakukan pada tanggal 27 April, 11 dan 14 Mei 2010. Respon awal yang muncul dalam tahap inisiasi yaitu eksplan mulai membengkak pada minggu pertama. Sebagian besar eksplan hanya mengalami pembengkakan, sebagian lagi mulai muncul kalus pada minggu kedua dan sebagian kecil tidak menunjukkan respon yang berarti sampai minggu keempat.
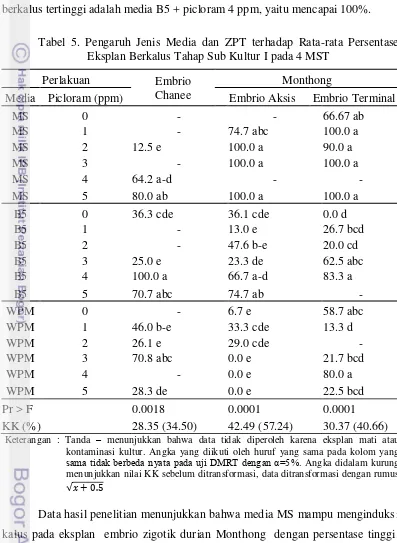
Tabel 4. Respon Berbagai Varietas Bahan Eksplan Tahap Inisiasi terhadap Berbagai Media Perlakuan pada 4 MST
Perlakuan Varietas
Media Picloram (ppm) Chanee Monthong Aksis Monthong Terminal
MS 0 bengkak - kalus coklat muda
MS 1 kalus putih bengkak Bengkak
MS 2 kalus putih kalus coklat muda Bengkak
MS 3 - bengkak Bengkak
MS 4 kalus putih bengkak Bengkak
MS 5 kalus coklat muda kalus coklat muda Bengkak
B5 0 kalus putih bengkak
-B5 1 - bengkak kalus putih
B5 2 - - Bengkak
B5 3 kalus putih bengkak Bengkak
B5 4 kalus putih bengkak Bengkak
B5 5 kalus putih bengkak kalus putih
WPM 0 bengkak bengkak Bengkak
WPM 1 kalus putih bengkak kalus putih
WPM 2 kalus putih bengkak
-WPM 3 kalus putih bengkak Bengkak
WPM 4 - bengkak Bengkak
WPM 5 kalus putih bengkak kalus putih
A B
Menurut George dan Sherrington (1984) kalus merupakan kumpulan sel yang tidak terorganisir, tidak berbentuk dan terjadi karena pembelahan yang sangat aktif. Dengan adanya rangsangan dari hormon endogen atau zat pengatur tumbuh yang ditambahkan (eksogen) menyebabkan metabolisme sel menjadi aktif. Dalam keadaan demikian jaringan dikatakan sedang mengalami dedifferensiasi. Keadaan ini terus berlangsung selama proliferasi kalus.
Jika melihat respon pada tahap inisiasi ini, embrio zigotik durian Chanee terlihat lebih responsif dibandingkan durian Monthong. Dari 18 jenis media perlakuan yang diujikan (Tabel 4), embrio zigotik durian Chanee memberikan respon bengkak pada 2 media perlakuan, berkalus pada 12 media perlakuan dan ada juga eksplan yang tidak memberikan respon. Sedangkan embrio zigotik durian Monthong memberikan respon berkalus hanya pada dua media perlakuan untuk embrio bagian aksis dan pada lima media perlakuan untuk embrio bagian terminal.
Gambar 7. Tipe Kalus: (A) Kalus Tipe 1, (B) Kalus Tipe 2
memanjang, dari kumpulan kalus tipe ini tidak pernah ada yang berkembang menjadi embrio somatik. Tipe kedua terdiri dari sel-sel bulat berwarna coklat terang hingga coklat gelap dan friable (remah). Kumpulan sel tipe ini seringkali ditemukan berasosiasi dengan embrio somatik. Kalus pada kakao dan durian memiliki penampakan yang hampir sama kemungkinan karena kedua tanaman ini berkerabat dekat (berasal dari satu Famili yaitu Malvaceae).
Tahap Subkultur I (SK I)
Parameter yang diamati pada tahap subkultur I ini adalah persentase eksplan berkalus. Pada tiap varietas terdapat beberapa perlakuan yang tidak terisi data, hal ini terjadi karena kultur mengalami kontaminasi sehingga tidak memenuhi ulangan. Jika dibandingkan dengan respon kultur pada saat inisiasi, pada subkultur I ini varietas Monthong mengalami perkembangan respon kalus yang cukup pesat, terlihat dari banyaknya eksplan yang mulai berkalus pada berbagai perlakuan media dan persentase eksplan berkalus yang cukup tinggi jika dibandingkan dengan varietas Chanee.
Eksplan dari embrio zigotik durian Chanee memiliki kalus yang sedikit dan kalusnya cepat berubah warna. Sehingga pada subkultur berikutnya, kalus durian Chanee mengalami perubahan warna yang cukup drastis, sebagian besar kalusnya mencoklat lalu kering dan mati, dan sebagian lagi terkontaminasi oleh cendawan dan bakteri (7 perlakuan), sehingga hanya sedikit yang mampu bertahan sampai akhir penelitian.
Sementara untuk eksplan yang berasal dari embrio zigotik dewasa durian varietas Monthong, meskipun responnya terhadap media perlakuan agak lambat, yaitu sebagian besar kalus baru muncul pada subkultur I (eksplan berumur 5-8 MST), namun kalus yang dihasilkan lebih banyak, proliferasi kalusnya lebih cepat sementara pola perubahan warnanya lebih lambat, sehingga kalus dari varietas Monthong inilah yang dominan dipakai dalam percobaan berikutnya (percobaan II dan percobaan III).
media MS hampir semua taraf konsentrasi picloram. Pada eksplan embrio zigotik Monthong bagian aksis, kalus berhasil diinisiasi pada eksplan sebesar 100% pada media MS dengan tambahan Picloram 2, 3 dan 5 ppm, sedangkan untuk eksplan bagian terminal pada media MS yang dilengkapi dengan Picloram 1, 3 dan 5 ppm. Untuk varietas Chanee, media yang menunjukkan rata-rata persentase eksplan berkalus tertinggi adalah media B5 + picloram 4 ppm, yaitu mencapai 100%.
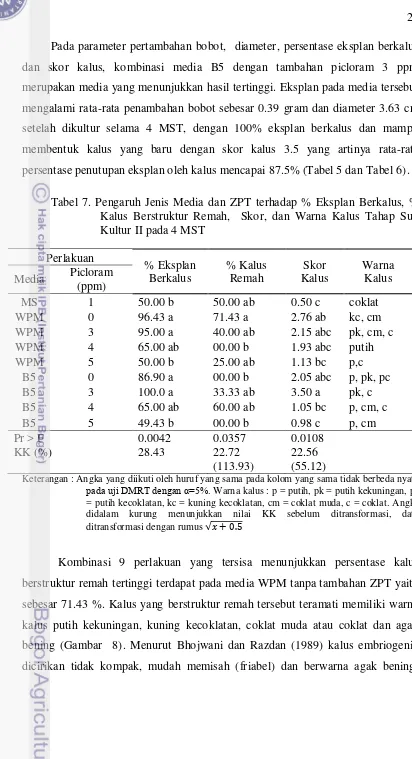
Tabel 5. Pengaruh Jenis Media dan ZPT terhadap Rata-rata Persentase Eksplan Berkalus Tahap Sub Kultur I pada 4 MST
Perlakuan Embrio
Chanee
Monthong
Media Picloram (ppm) Embrio Aksis Embrio Terminal
MS 0 - - 66.67 ab
MS 1 - 74.7 abc 100.0 a
MS 2 12.5 e 100.0 a 90.0 a
MS 3 - 100.0 a 100.0 a
MS 4 64.2 a-d - -
MS 5 80.0 ab 100.0 a 100.0 a
B5 0 36.3 cde 36.1 cde 0.0 d
B5 1 - 13.0 e 26.7 bcd
B5 2 - 47.6 b-e 20.0 cd
B5 3 25.0 e 23.3 de 62.5 abc
B5 4 100.0 a 66.7 a-d 83.3 a
B5 5 70.7 abc 74.7 ab -
WPM 0 - 6.7 e 58.7 abc
WPM 1 46.0 b-e 33.3 cde 13.3 d
WPM 2 26.1 e 29.0 cde -
WPM 3 70.8 abc 0.0 e 21.7 bcd
WPM 4 - 0.0 e 80.0 a
WPM 5 28.3 de 0.0 e 22.5 bcd
Pr > F 0.0018 0.0001 0.0001
KK (%) 28.35 (34.50) 42.49 (57.24) 30.37 (40.66) Keterangan : Tanda – menunjukkan bahwa data tidak diperoleh karena eksplan mati atau
kontaminasi kultur. Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT dengan α=5%. Angka didalam kurung menunjukkan nilai KK sebelum ditransformasi, data ditransformasi dengan rumus �+ 0.5
[image:37.595.111.508.186.729.2]somatik manggis yang memperoleh hasil bahwa media MS sangat nyata menginduksi lebih banyak eksplan untuk membentuk kalus yang diduga embriogenik dibandingkan dengan media B5 dan WPM. Namun sampai disini belum dapat dipastikan apakah kalus yang terbentuk dari embrio zigotik durian Monthong ini adalah kalus embriogenik.
Tahap Subkultur II (SK II)
[image:38.595.89.515.67.812.2]Eksplan yang digunakan pada subkultur II merupakan eksplan berkalus pada tahap sub kultur I, sehingga paket perlakuan pada subkultur II tidak selengkap pada subkultur I, hanya tersisa 9 perlakuan saja, seperti terlihat pada Tabel 6 dan Tabel 7. Hasil yang berbeda nyata antar perlakuan dapat terlihat pada parameter rata-rata diameter eksplan berkalus (2-4 MST) (Tabel 6), rata-rata persentase kalus remah dan rata-rata skor kalus (Tabel 7). Pada parameter rata-rata persentase eksplan berkalus hasil yang ditunjukkan antar perlakuan sangat berbeda nyata.
Tabel 6. Pengaruh Jenis Media dan ZPT terhadap Bobot dan Diameter Eksplan Berkalus Tahap Sub Kultur II
Perlakuan
Bobot 4 MST (g)
Diameter (cm) Media Picloram
(ppm) 1 MST 2 MST 3 MST 4 MST
MS 1 0.02 b 0.04 b 0.34 b 0.50 b 0.59 b
WPM 0 0.04 b 0.09 b 0.22 b 0.41 b 0.66 b
WPM 3 0.02 b 0.00 b 0.36 b 0.39 b 0.44 b
WPM 4 0.09 b 0.10 b 0.55 b 0.96 b 1.28 b
WPM 5 0.00 b 0.00 b 0.25 b 0.25 b 0.25 b
B5 0 0.11 b 0.22 ab 1.03 ab 1.29 b 1.53 b
B5 3 0.39 a 0.50 a 1.92 a 2.79 a 3.63 a
B5 4 0.02 b 0.00 b 0.10 b 0.17 b 0.53 b
B5 5 0.04 b 0.00 b 0.13 b 0.25 b 0.49 b
Pr > F 0.0004 0.1179 0.0413 0.0373 0.0401
KK (%) 7.67 (133.87) 15.93 (217.62) 31.88 (137.95) 36.54 (134.89) 37.19 (124.48) Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata
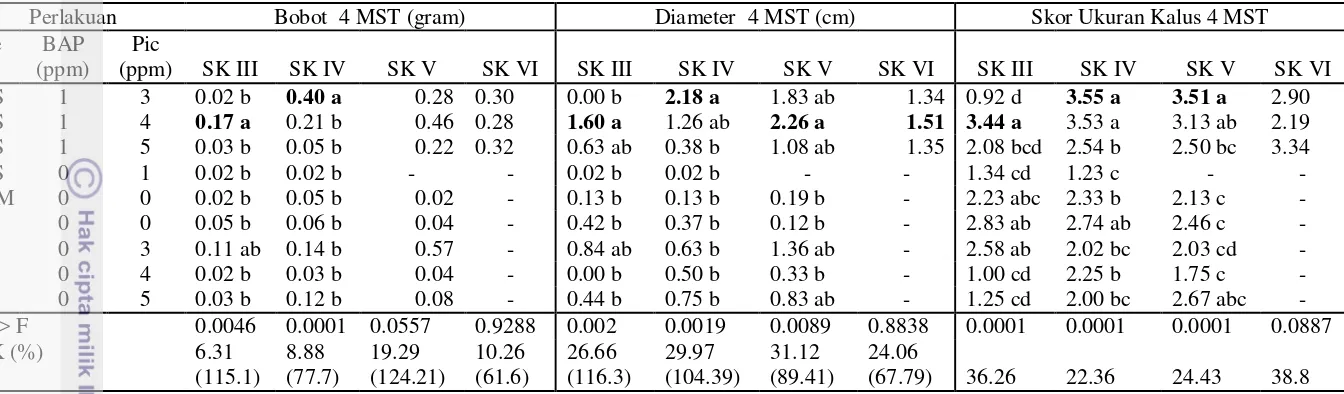
Pada parameter pertambahan bobot, diameter, persentase eksplan berkalus dan skor kalus, kombinasi media B5 dengan tambahan picloram 3 ppm merupakan media yang menunjukkan hasil tertinggi. Eksplan pada media tersebut mengalami rata-rata penambahan bobot sebesar 0.39 gram dan diameter 3.63 cm setelah dikultur selama 4 MST, dengan 100% eksplan berkalus dan mampu membentuk kalus yang baru dengan skor kalus 3.5 yang artinya rata-rata persentase penutupan eksplan oleh kalus mencapai 87.5% (Tabel 5 dan Tabel 6).
Tabel 7. Pengaruh Jenis Media dan ZPT terhadap % Eksplan Berkalus, % Kalus Berstruktur Remah, Skor, dan Warna Kalus Tahap Sub Kultur II pada 4 MST
Perlakuan % Eksplan Berkalus % Kalus Remah Skor Kalus Warna Kalus Media Picloram
(ppm)
MS 1 50.00 b 50.00 ab 0.50 c coklat
WPM 0 96.43 a 71.43 a 2.76 ab kc, cm
WPM 3 95.00 a 40.00 ab 2.15 abc pk, cm, c
WPM 4 65.00 ab 00.00 b 1.93 abc putih
WPM 5 50.00 b 25.00 ab 1.13 bc p,c
B5 0 86.90 a 00.00 b 2.05 abc p, pk, pc
B5 3 100.0 a 33.33 ab 3.50 a pk, c
B5 4 65.00 ab 60.00 ab 1.05 bc p, cm, c
B5 5 49.43 b 00.00 b 0.98 c p, cm
Pr > F 0.0042 0.0357 0.0108
KK (%) 28.43 22.72
(113.93)
22.56
(55.12)
Keterangan : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT dengan α=5%. Warna kalus : p = putih, pk = putih kekuningan, pc = putih kecoklatan, kc = kuning kecoklatan, cm = coklat muda, c = coklat. Angka didalam kurung menunjukkan nilai KK sebelum ditransformasi, data ditransformasi dengan rumus �+ 0.5
[image:39.595.91.503.46.805.2]Namun sampai disini belum dapat dipastikan apakah kalus durian yang dihasilkan pada tahap ini embriogenik atau tidak.
Gambar 8. Kalus Berstruktur Remah
Percobaan II. Proliferasi Kalus dan Induksi Kalus Embriogenik
Pada awalnya percobaan II terdiri dari 12 perlakuan, namun akibat kontaminasi kultur terdapat tiga perlakuan yang hilang yaitu WPM + picloram (3, 4 dan 5 ppm), sehingga hanya tinggal 9 perlakuan yang tersisa.
Persentase Kalus yang Membentuk Kalus Baru
Kalus yang mampu beregenerasi dengan baik ditandai dengan munculnya kalus-kalus baru pada bagian segmen kalus bekas pelukaan. Kalus yang diharapkan muncul pada bekas pelukaan adalah kalus embriogenik, namun pada subkultur III sebagian besar kalus baru yang muncul hanya berupa kalus putih yang berstruktur seperti kapas. Pada subkultur III dan IV, semua kalus yang disubkultur pada media perlakuan dapat berkembang dengan cukup baik (yaitu > 70 % kalus pada subkultur III dan ≥ 75 % kalus pada subkultur IV mampu membentuk kalus baru). Perlakuan yang menunjukkan persentase kalus yang membentuk kalus baru paling cepat mencapai 100% adalah perlakuan media B5 tanpa ZPT dan media MS + BAP 1 ppm + Picloram 4 ppm.
Tabel 8. Pengaruh Jenis Media dan ZPT terhadap Persentase Kalus yang Membentuk Kalus Baru Sub Kultur III, IV, V dan VI pada 4 MST Perlakuan (ppm) Persentase Kalus yang Membentuk Kalus Baru
(4 MST) Media BAP
(ppm)
Pic
(ppm) SK III SK IV SK V SK VI
MS 1 3 75.00 100.0 a 100.0 a 98.33
MS 1 4 100.0 98.00 a 100.0 a 98.33
MS 1 5 91.67 87.50 ab 100.0 a 100.0
MS 0 1 85.71 93.34 a - -
WPM 0 0 72.92 100.0 a 100.0 a -
B5 0 0 100.0 95.24 a 100.0 a -
B5 0 3 81.38 97.22 a 75.84 bc -
B5 0 4 83.33 75.00 b 75.00 c -
B5 0 5 83.35 100.0 a 100.0 a -
Pr > F 0.2905 0.0359 0.0050 0.9075
KK (%) 21.9 10.47 16.27 6.33
Keterangan : Tanda – menunjukkan bahwa data tidak diperoleh karena eksplan mati atau kontaminasi kultur. Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT dengan α=5%.
Bobot, Diameter dan Skor Penutupan Kalus
Proliferasi kalus adalah perbanyakan/perkembangan sel-sel kalus. Kemampuan proliferasi kalus dapat terlihat dari pertambahan bobot, diameter dan skor penutupan kalus (Tabel 9). Menurut Gunawan (1992) suatu sifat yang teramati dalam jaringan yang membentuk kalus adalah bahwa pembelahan sel tidak terjadi pada semua sel dalam jaringan asal, tetapi hanya sel di lapisan periphery yang membelah terus menerus, sedangkan sel-sel ditengah tetap muda, sehingga terjadi pertambahan diameter gumpalan dan bobot kalus yang terbentuk.
[image:41.595.79.519.68.829.2]Tabel 9. Pengaruh Jenis Media dan ZPT terhadap Bobot, Diameter dan Skor Ukuran Kalus Tahap Sub Kultur III, IV, V dan VI pada 4 MST
Perlakuan Bobot 4 MST (gram) Diameter 4 MST (cm) Skor Ukuran Kalus 4 MST Me
dia
BAP (ppm)
Pic
(ppm) SK III SK IV SK V SK VI SK III SK IV SK V SK VI SK III SK IV SK V SK VI MS 1 3 0.02 b 0.40 a 0.28 0.30 0.00 b 2.18 a 1.83 ab 1.34 0.92 d 3.55 a 3.51 a 2.90
MS 1 4 0.17 a 0.21 b 0.46 0.28 1.60 a 1.26 ab 2.26 a 1.51 3.44 a 3.53 a 3.13 ab 2.19
MS 1 5 0.03 b 0.05 b 0.22 0.32 0.63 ab 0.38 b 1.08 ab 1.35 2.08 bcd 2.54 b 2.50 bc 3.34
MS 0 1 0.02 b 0.02 b - - 0.02 b 0.02 b - - 1.34 cd 1.23 c -
-WPM 0 0 0.02 b 0.05 b 0.02 - 0.13 b 0.13 b 0.19 b - 2.23 abc 2.33 b 2.13 c -B5 0 0 0.05 b 0.06 b 0.04 - 0.42 b 0.37 b 0.12 b - 2.83 ab 2.74 ab 2.46 c -B5 0 3 0.11 ab 0.14 b 0.57 - 0.84 ab 0.63 b 1.36 ab - 2.58 ab 2.02 bc 2.03 cd -B5 0 4 0.02 b 0.03 b 0.04 - 0.00 b 0.50 b 0.33 b - 1.00 cd 2.25 b 1.75 c -B5 0 5 0.03 b 0.12 b 0.08 - 0.44 b 0.75 b 0.83 ab - 1.25 cd 2.00 bc 2.67 abc -Pr > F 0.0046 0.0001 0.0557 0.9288 0.002 0.0019 0.0089 0.8838 0.0001 0.0001 0.0001 0.0887
KK (%) 6.31
(115.1) 8.88 (77.7) 19.29 (124.21) 10.26 (61.6) 26.66 (116.3) 29.97 (104.39) 31.12 (89.41) 24.06 (67.79) 36.26 22.36 24.43 38.8
Keterangan : Tanda – menunjukkan bahwa data tidak diperoleh karena eksplan mati atau kontaminasi kultur. Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT dengan α=5%. Angka didalam kurung menunjukkan nilai KK sebelum ditransformasi, data ditransformasi dengan rumus �+ 0.5
Pada parameter diameter kalus, perlakuan berpengaruh sangat nyata pada subkultur III, IV dan V. Perlakuan yang memberikan diameter tertinggi adalah kombinasi media MS + BAP 1 ppm + picloram 4 ppm pada SK III, SK V dan SK VI. Pada SK IV rata-rata diameter tertinggi terjadi pada kombinasi media MS + BAP 1 ppm + picloram 3 ppm sebesar 2.18 cm.
Pada parameter skor ukuran kalus, perlakuan berpengaruh sangat nyata pada subkultur III, IV dan V. Media yang memberikan skor ukuran kalus tertinggi adalah kombinasi media MS + BAP 1 ppm + picloram 4 ppm pada SK III, kombinasi media B5 + picloram 3 ppm pada SK IV dan SK V dan kombinasi media MS + BAP 1 ppm + picloram 5 ppm pada SK VI.
Data-data tersebut menunjukkan bahwa kalus dari media B5 + picloram mengalami proliferasi yang lebih baik jika disubkultur pada media MS + BAP 1 ppm + picloram, dibandingkan tetap disubkultur pada media B5 + picloram tanpa penambahan BAP. Menurut Wattimena et al. (1992) kemampuan jaringan eksplan membentuk kalus dan laju pertumbuhan kalus dapat berbeda-beda pada tiap tanaman, tergantung medium, zat pengatur tumbuh dan faktor lingkungan lainnya.
Persentase Kalus Embriogenik dan Waktu Awal Kemunculannya
Waktu mulai munculnya kalus yang diduga embriogenik terjadi dalam rentang waktu subkultur II hingga subkultur IV (Tabel 10). Media yang memberikan hasil persentase kalus embrionik yang tertinggi pada subkultur III adalah media MS + picloram 1 ppm sebesar 85.7 %, namun tidak berbeda nyata dengan media B5 + picloram 3 ppm (81.4 %) dan media MS + BAP 1 ppm + Picloram 3 ppm (75 %).
dan V), media MS + BAP 1 ppm + Picloram 5 ppm (subkultur VI) dan B5 + Picloram 5 ppm (subkultur IV dan V).
Tabel 10. Pengaruh Jenis Media dan ZPT terhadap Waktu Munculnya Kalus Embrionik dan Persentase Kalus Embrionik pada Tahap Sub Kultur III, IV, V dan VI pada 4 MST
Perlakuan Waktu
Munculnya Persentase Kalus Embrionik (4 MST) Media BAP
(ppm) Pic (ppm)
Kalus
Embrionik SK III SK IV SK V SK VI
MS 1 3 SK III, 3 MST 75.0 ab 44.4 ab 70.0 ab 33.3 b MS 1 4 SK IV, 2 MST 0.00 c 100.0 a 100.0 a 66.7 ab MS 1 5 SK IV, 4 MST 0.00 c 87.5 ab 50.0 abc 100.0 a
MS 0 1 SK II, 4 MST 85.7 a 93.3 a - -
WPM 0 0 SK II, 4 MST 0.00 c 33.3 b 0.00 c -
B5 0 0 SK IV, 2 MST 0.00 c 28.6 b 28.5 abc -
B5 0 3 SK II, 4 MST 81.4 a 77.7 ab 55.8 ab -
B5 0 4 SK II, 4 MST 50.0 b 50.0 ab 75.0 ab -
B5 0 5 SK IV, 3 MST 0.00 c 100.0 a 100.0 a -
Pr > F 0.0001 0.0059 0.0015 0.0463
KK (%) 10.78 (57.44) 18.87 (56.45) 18.84 (57.86) 25.03 (86.42) Keterangan : Tanda – menunjukkan bahwa data tidak diperoleh karena eksplan mati atau
kontaminasi kultur. Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT dengan α=5%. Angka didalam kurung menunjukkan nilai KK sebelum ditransformasi, data ditransformasi dengan rumus �+ 0.5
Menurut Evans et al. (1981) terdapat dua macam kalus yang dapat terbentuk dalam kultur jaringan suatu tanaman, yaitu kalus embriogenik dan kalus non embriogenik. Kalus embriogenik adalah kalus yang memiliki potensi untuk beregenerasi menjadi tanaman, baik melalui organogenesis (langsung membentuk organ) maupun embriogenesis (melalui pembentukan embrio somatik).
Menurut Jimenez (2001), pembelahan asimetrik tidak secara langsung membentuk embrio, tetapi terlebih dahulu membentuk proembryogenic masses (PEMs) yang kemudian hanya satu atau beberapa sel saja yang berkembang menjadi embrio. Sisa PEMs yang yang tidak membentuk embrio akan tereleminasi melalui suatu siklus kematian sel yang teratur.
Kalus yang diduga embriogenik pada perlakuan kombinasi media MS + BAP 1 ppm + Picloram (3-5) ppm, mulai menunjukan tanda-tanda terbentuknya embrio somatik fase pro-embrio globular pada subkultur VI setelah disubkultur selama 1 MST (Gambar 9). Diantara kalus yang remah mulai terlihat bentukan menyerupai bulatan-bulatan kecil yang menempel pada eksplan.
Gambar 9. Kalus dengan Pro-Embrio Globular pada Media Perlakuan MS + BAP 1 ppm + Picloram 4 ppm
Dodds & Robert (1985) menyebutkan bahwa faktor kimia terpenting dalam media induksi embriogenesis somatik adalah auksin dan nitrogen tereduksi. Diduga karena nitrogen pada media MS lebih tinggi konsentrasinya dibandingkan media B5 dan WPM maka media MS mampu mempercepat waktu munculnya kalus yang diindikasikan sebagai kalus embrionik. Namun dalam penelitian ini waktu terbentuknya kalus pada semua jenis media terlihat relatif seimbang dan dipengaruhi juga oleh jenis dan konsentrasi ZPT yang ditambahkan. Karena percobaan II ini menggunakan rancangan RAL 1 faktor, sehingga pengaruh jenis media tidak dapat dilihat secara statistik.
secara statistik tidak berbeda nyata namun meningkatnya konsentrasi picloram, menurunkan embrio somatik yang terbentuk. Didukung oleh hasil penelitian yang dilakukan oleh Nindita (2010) yang menunjukkan bahwa embrio somatik dapat terbentuk dari kalus yang dikulturkan pada media MS yang mengandung picloram 1.0 mg/l saja untuk jenis eksplan aksis embrio dan kotiledon pada tanaman jarak pagar. Penelitian yang dilakukan oleh Purba (2009) menunjukkan bahwa embrio somatik pada manggis dapat terbentuk pada media WPM + picloram 1 µM, B5 + picloram 0.5 µM dan B5 + picloram 1 µ M, dengan persentase yang sama yaitu. 6.25 %.
Meskipun pada beberapa penelitian tersebut di atas picloram baik untuk menginduksi embrio somatik secara tunggal dan dalam taraf rendah, namun pada penelitian ini embrio somatik baru mulai terbentuk saat terjadi kombinasi antara sitokinin taraf rendah (BAP 1 ppm) dan auksin taraf lebih tinggi (Picloram 3-5 ppm). Hal ini sesuai dengan teori yang dikemukakan oleh Wattimena et al (1992) bahwa umumnya induksi embriogenesis memerlukan nisbah auksin-sitokinin yang tinggi, yaitu konsentrasi auksin dalam media lebih tinggi dibandingkan konsentrasi sitokinin.
Struktur dan Warna Kalus
Kalus yang embriogenik cenderung memiliki struktur yang remah, pada Tabel 10 disajikan data mengenai persentase kalus yang remah dan kompak pada berbagai kombinasi media perlakuan. Pada subkultur III, kalus berstruktur remah hanya dimiliki oleh 4 media dari 9 media yang ada, sisanya baru mulai terlihat pada subkultur IV. Kalus pada perlakuan kombinasi media MS + BAP 1 ppm + Picloram 4 ppm, MS + BAP 1 ppm + Picloram 5 ppm, MS + picloram 1 ppm dan B5 + picloram 5 ppm pada subkultur IV memiliki persentase kalus remah mencapai 100 %. Persentase kalus remah cenderung meningkat pada subkultur IV dan V, walaupun ada 2 media yang mengalami penurunan yaitu perlakuan MS + BAP 1 ppm + picloram 3 ppm dan B5 + picloram 3 ppm (Tabel 11).
coklat muda. Namun seiring dengan berjalannya waktu subkultur, keragaman warna kalus yang muncul mulai beragam menjadi 7 (tujuh) warna seperti terlihat pada Lampiran 2. Kalus yang pada waktu inisiasi percobaan I memiliki warna putih dan berstruktur kompak, pada subkultur berikutnya warrnanya berubah dan memiliki pola sebagai berikut: putih putih kekuningan putih kecoklatan kuning kuning kecoklatan coklat muda coklat mati/kering.
Tabel 11. Pengaruh Jenis Media dan ZPT terhadap Persentase Struktur Kalus (Remah (RH) dan Kompak (KP)) Tahap Sub Kultur III, IV, V dan VI pada 4 MST
Perlakuan Persentase Struktur Kalus (4 MST) Media BAP (ppm Pic (ppm) SK III SK IV SK V SK VI
RH KP RH KP RH KP RH KP
MS 1 3 100 0 44 56 84 16 39 61
MS 1 4 0 100 100 0 100 0 68 32
MS 1 5 0 100 100 0 67 33 100 0
MS 0 1 100 0 100 0 - - - -
WPM 0 0 0 100 33 67 0 100 - -
B5 0 0 0 100 28 72 28 72 - -
B5 0 3 100 0 78 22 80 20 - -
B5 0 4 67 33 67 33 100 0 - -
B5 0 5 0 100 100 0 100 0 - -
Keterangan : Tanda – menunjukkan bahwa data tidak diperoleh karena eksplan mati atau kontaminasi kultur. Pic = Picloram.
[image:47.595.88.516.18.813.2]Percobaan III. Pendewasaan Embrio Somatik
Persentase Tipe Kalus
Meskipun eksplan berasal dari perlakuan yang sama, namun terdapat 4 tipe kalus yang teramati (Gambar 6, pada Bab Bahan dan Metode). Kalus tersebut disebar dalam 15 kombinasi media perlakuan (percobaan III.a) dan 12 kombinasi media perlakuan (Percobaan III.b). Agak sulit untuk mengelompokkan kalus yang setipe sebelum masuk ke media perlakuan pada percobaan III. Karena keempat tipe kalus tersebut ada pada hampir semua botol. Sehingga kalus-kalus tersebut disubkultur pada media perlakuan tanpa terlebih dahulu menyamaratakan persentasenya. Sehingga persentase dari setiap tipe pada awal subkultur (0 MST) ditampilkan juga pada Tabel 12 dan Tabel 13.
Kalus yang diduga embriogenik adalah tipe 2 dan tipe 3, tipe 2 adalah kalus yang memiliki bentukan globular yang menyatu dengan kalus yang bertekstur remah dan transparan, sementara kalus tipe 3 memiliki ciri kalus embriogenik yaitu bertekstur remah dan berwarna kuning hingga coklat dengan warna agak transparan, namun belum terlihat bentukan globularnya.
Percobaan III.a (perlakuan BAP-NAA, Tabel 12) menunjukkan pada hampir semua perlakuan, persentase kalus tipe 2 menurun pada 4 MST dan semakin berkurang pada 8 MST, bahkan habis pada beberapa perlakuan BAP 1 dan 2 ppm. Sedangkan persentase kalus tipe 3 pada hampir semua perlakuan meningkat pada 4 MST dan untuk hampir semua perlakuan BAP 0 ppm (kecuali picloram 4) persentase kalus tipe 3 menurun, sedangkan untuk perlakuan yang lain tetap. Jika dilihat selisih antara data 8 MST dan 0 MST, penurunan persentase kalus tipe 2 yang paling besar terjadi pada media MS + BAP 1 ppm + NAA 1 ppm dan MS + BAP 2 ppm + NAA 1 ppm yaitu sebesar 60 %. Sedang