ABSTRAK
ALFONSUS ANGKY. Karakterisasi Aktivitas Dialisat Enzim Protease
Fibrinolitik dari Cacing Tanah (Eisenia foetida) Galur Lokal. Dibimbing oleh
SULISTIYANI dan DONDIN SAJUTHI.
ABSTRACT
ALFONSUS ANGKY. Activity Characterization of Local Strain Earthworm
(Eisenia foetida) Fibrinolytic Protease Enzyme. Under the direction of
SULISTIYANI and DONDIN SAJUTHI.
Commercially available thrombolytic drugs were usually administered
intraveously and priced above consumer resources. Earthworm, in several Eastern
Asia countries, was known for its thrombolytic properties. Its herbal drug had
been used to increase blood flow and to treat leakage in blood vessel.
Thrombolytical properties of fibrinolytic protease (lumbrokinase) enzyme from
local strain
Eisenia foetida had never been reported. This research was purposed
to characterize its enzyme activity and its specificity to fibrin as substrate.
Enzyme was purified through precipitation, dialysis, and column chromatography
fractionation. The highest protease activity was obtained when the dialysate
sample was incubated for 10 minutes in pH 8 at 60°C which activity was 0.239
UPENDAHULUAN
Cacing tanah dikenal sebagai hewan avertebrata yang banyak dijumpai di tanah-tanah gembur. Jenis cacing tanah-tanah yang umum ditemukan, antara lain Lumbricus rubellus, Lumbricus terrestris, Eisenia foetida, dan Eisenia andrei. Cacing ini umum dipergunakan sebagai salah satu indikator kesuburan tanah, namun pemanfaatan cacing ini untuk kesehatan dan kosmetika baru dimulai akhir-akhir ini. Hewan ini secara tradisional hanya dimanfaatkan untuk makanan ternak dan umpan ikan. Beberapa negara di Asia Timur diketahui telah menggunakan ekstrak cacing tanah untuk mengobati penyakit yang disebabkan oleh gangguan peredaran darah dan pengobatan pada pecahnya pembuluh darah (Zhao et al. 2007).
Penelitian dan pemahaman mengenai enzim mengalami kemajuan pesat sejak abad ke-20. Enzim merupakan protein yang disintesis di dalam sel dan dapat mempercepat reaksi termodinamika sedemikian rupa sehingga kecepatan reaksi dapat berjalan sesuai dengan proses biokimia yang dibutuhkan untuk mengatur kehidupan (Nelson & Cox 2005). Enzim digunakan pada beberapa industri, antara lain keju, sirup, bir, sari buah, gula pasir, asam amino, kertas, dan deterjen. Salah satu enzim yang banyak dimanfaatkan industri adalah protease. Protease pada cacing tanah, seperti dikemukakan oleh Charles Darwin pada tahun 1883, dapat melarutkan fibrin (Zhao et al. 2007).
Ekstraksi enzim protease fibrinolitik cacing tanah diprakarsai oleh ilmuwan Jepang, Hisashi Mihara (1991). Mihara berhasil mengisolasi 6 fraksi protease tersebut dan diberi nama komersial lumbrokinase. Yanti (2003) menemukan bahwa ekstraksi menggunakan kromatografi kolom penukar anion Streamline-DEAE menghasilkan 3 fraksi protease fibrinolitik dari L. rubellus.
Para peneliti dari Korea dan Cina meneliti kemungkinan penggunaan ekstrak cacing tanah sebagai suplemen pencegah penyumbatan darah dan penstabil tekanan darah. Titik berat penelitian mereka adalah penemuan senyawa aktif pada ekstrak cacing tanah. Pengembangan penelitian protease cacing tanah di Indonesia belum banyak dilakukan, terutama yang menggunakan E.foetida galur lokal. Perbedaan lokasi dan kondisi dapat mempengaruhi karakter enzim yang didapat (Liu et al. 2004). Produsen obat di Indonesia umumnya menggunakan ekstrak
kasar L. rubellus yang kemudian dikemas dan digunakan sebagai obat trombolitik dan fibrinolitik komersial.
Berdasarkan data yang ada saat ini, harga obat trombolitik yang ada di pasaran relatif mahal dan pemberiannya disuntikkan secara intravena. Sebagai contoh, anistreplase dijual dengan harga £495 tiap dosisnya (Gray, et al. 2009). Lumbrokinase dari E. foetida galur lokal belum pernah ditentukan aktivitas trombolitiknya secara in vitro. Maka, tujuan penelitian ini adalah mengisolasi ekstrak enzim, memurnikan, serta menentukan untuk mengetahui aktivitas enzim secara in vitro. Aktivitas enzim digunakan sebagai dasar untuk menghasilkan obat trombolitik baru. Cacing E. foetida juga diharapkan dapat menjadi substitusi L. rubellus yang telah banyak dimanfaatkan. Hipotesis penelitian ini adalah cacing E. foetida dapat menghasilkan enzim protease fibrinolitik yang dapat dikarakterisasi dan diuji secara in vitro dengan fibrin sebagai substrat. Manfaat penelitian ini adalah berdasarkan enzim yang sudah dikarakterisasi dapat menghasilkan obat trombolitik baru yang dapat diberikan per oral dan lebih ekonomis.
TINJAUAN PUSTAKA
Cacing Eisenia foetida
E. foetida adalah kelompok cacing tanah yang memiliki 75-165 segmen tubuh. Klitelium, atau penebalan kulit yang berfungsi sebagai organ reproduksi cacing, terletak pada segmen ke-13 dan segmen ke-17. Cacing ini berwarna merah coklat hingga ungu tua dan berbentuk gilig. E. foetida termasuk dalam dunia Eukariota, filum Coelomata, kelas Annelida, ordo Oligochaeta, famili Lumbricideae, genus Eisenia, spesies Eisenia foetida sesuai data Uniprot dengan nomor akses 6396.
1
PENDAHULUAN
Cacing tanah dikenal sebagai hewan avertebrata yang banyak dijumpai di tanah-tanah gembur. Jenis cacing tanah-tanah yang umum ditemukan, antara lain Lumbricus rubellus, Lumbricus terrestris, Eisenia foetida, dan Eisenia andrei. Cacing ini umum dipergunakan sebagai salah satu indikator kesuburan tanah, namun pemanfaatan cacing ini untuk kesehatan dan kosmetika baru dimulai akhir-akhir ini. Hewan ini secara tradisional hanya dimanfaatkan untuk makanan ternak dan umpan ikan. Beberapa negara di Asia Timur diketahui telah menggunakan ekstrak cacing tanah untuk mengobati penyakit yang disebabkan oleh gangguan peredaran darah dan pengobatan pada pecahnya pembuluh darah (Zhao et al. 2007).
Penelitian dan pemahaman mengenai enzim mengalami kemajuan pesat sejak abad ke-20. Enzim merupakan protein yang disintesis di dalam sel dan dapat mempercepat reaksi termodinamika sedemikian rupa sehingga kecepatan reaksi dapat berjalan sesuai dengan proses biokimia yang dibutuhkan untuk mengatur kehidupan (Nelson & Cox 2005). Enzim digunakan pada beberapa industri, antara lain keju, sirup, bir, sari buah, gula pasir, asam amino, kertas, dan deterjen. Salah satu enzim yang banyak dimanfaatkan industri adalah protease. Protease pada cacing tanah, seperti dikemukakan oleh Charles Darwin pada tahun 1883, dapat melarutkan fibrin (Zhao et al. 2007).
Ekstraksi enzim protease fibrinolitik cacing tanah diprakarsai oleh ilmuwan Jepang, Hisashi Mihara (1991). Mihara berhasil mengisolasi 6 fraksi protease tersebut dan diberi nama komersial lumbrokinase. Yanti (2003) menemukan bahwa ekstraksi menggunakan kromatografi kolom penukar anion Streamline-DEAE menghasilkan 3 fraksi protease fibrinolitik dari L. rubellus.
Para peneliti dari Korea dan Cina meneliti kemungkinan penggunaan ekstrak cacing tanah sebagai suplemen pencegah penyumbatan darah dan penstabil tekanan darah. Titik berat penelitian mereka adalah penemuan senyawa aktif pada ekstrak cacing tanah. Pengembangan penelitian protease cacing tanah di Indonesia belum banyak dilakukan, terutama yang menggunakan E.foetida galur lokal. Perbedaan lokasi dan kondisi dapat mempengaruhi karakter enzim yang didapat (Liu et al. 2004). Produsen obat di Indonesia umumnya menggunakan ekstrak
kasar L. rubellus yang kemudian dikemas dan digunakan sebagai obat trombolitik dan fibrinolitik komersial.
Berdasarkan data yang ada saat ini, harga obat trombolitik yang ada di pasaran relatif mahal dan pemberiannya disuntikkan secara intravena. Sebagai contoh, anistreplase dijual dengan harga £495 tiap dosisnya (Gray, et al. 2009). Lumbrokinase dari E. foetida galur lokal belum pernah ditentukan aktivitas trombolitiknya secara in vitro. Maka, tujuan penelitian ini adalah mengisolasi ekstrak enzim, memurnikan, serta menentukan untuk mengetahui aktivitas enzim secara in vitro. Aktivitas enzim digunakan sebagai dasar untuk menghasilkan obat trombolitik baru. Cacing E. foetida juga diharapkan dapat menjadi substitusi L. rubellus yang telah banyak dimanfaatkan. Hipotesis penelitian ini adalah cacing E. foetida dapat menghasilkan enzim protease fibrinolitik yang dapat dikarakterisasi dan diuji secara in vitro dengan fibrin sebagai substrat. Manfaat penelitian ini adalah berdasarkan enzim yang sudah dikarakterisasi dapat menghasilkan obat trombolitik baru yang dapat diberikan per oral dan lebih ekonomis.
TINJAUAN PUSTAKA
Cacing Eisenia foetida
E. foetida adalah kelompok cacing tanah yang memiliki 75-165 segmen tubuh. Klitelium, atau penebalan kulit yang berfungsi sebagai organ reproduksi cacing, terletak pada segmen ke-13 dan segmen ke-17. Cacing ini berwarna merah coklat hingga ungu tua dan berbentuk gilig. E. foetida termasuk dalam dunia Eukariota, filum Coelomata, kelas Annelida, ordo Oligochaeta, famili Lumbricideae, genus Eisenia, spesies Eisenia foetida sesuai data Uniprot dengan nomor akses 6396.
Lingkungan cacing dipenuhi berbagai mikrob lain seperti kapang, parasit, dan bakteri baik patogen maupun nonpatogen, tetapi cacing E. foetida tidak memiliki antibodi dalam tubuhnya. Tidak adanya antibodi menyebabkan cacing tidak dapat membuat respon imun dapatan untuk melawan mikrob. Sistem kekebalan bawaan yang dimiliki oleh spesies ini adalah berbagai jenis peptida untuk melawan bakteri (Liu et al. 2004).
Gambar 1 Cacing tanah E. foetida Sumber: www.carigold.com
Protease Cacing
Enzim fibrinolitik cacing tanah termasuk kelompok protease serina, yang memiliki aktivitas fibrinolitik dan trombolitik kuat (Cong et al. 2001). Isolasi beberapa jenis protease E. foetida yang dilakukan sekitar tahun 1980 berhasil memurnikan dan mengemasnya dalam bentuk obat. Protease ini dapat digunakan dalam pengobatan penggumpalan darah (Wang et al. 2003; Parcell 2011).
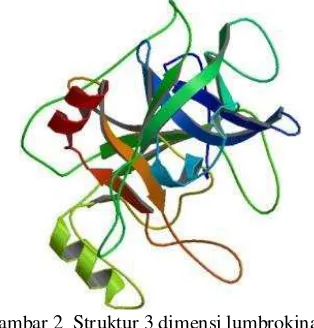
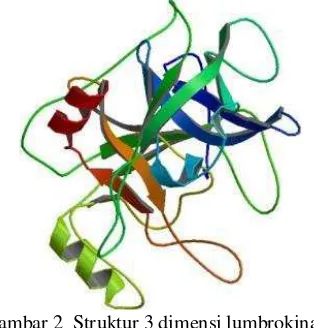
Enzim ini, seperti halnya protease serina menyerupai tripsin lain, mempunyai dua rantai. N-pyroglutamated sebagai rantai pendek dan N-glycosylated sebagai rantai panjangnya. Rantai panjang enzim ini mempunyai struktur cincin yang belum pernah ditemukan sebelumnya. Struktur tersebut berupa delapan cincin yang terbentuk akibat ikatan disulfida pada dua residu sistein yang berdekatan. Kedua residu sisteina ini juga dihubungkan oleh ikatan cis-peptida (Zhao et al. 2007). Struktur lumbrokinase pada Gambar 2 diperoleh dari Protein Data Bank dengan nomor akses 1m9u.
Enzim protease adalah jenis enzim yang dapat menghidrolisis protein menjadi peptida atau asam amino yang lebih sederhana (Jain et al. 2005). Jenis-jenis protease dibedakan berdasarkan residu asam amino pada masing-masing enzim. Contoh residu asam amino yang terdapat pada enzim protease, antara lain gugus imidazol histidina, gugus hidroksil
serina, rantai samping karboksil aspartat dan glutamat, gugus sulfhidril sisteina, rantai samping amino lisina, dan gugus fenol tirosina (Campbell & Farrell 2006).
Lumbrokinase, seperti protease serina lainnya, memiliki inhibitor yang spesifik. Contoh inhibitor yang spesifik terhadap protease serina, antara lain diisopropilfosfoflouridat (DIPF) (Campbell & Farrell 2006), aprotinin (Katzung 2006; Cho et al. 2003), fenilmetilsulfonil fluorida, torsil-L-lisina klorometil keton (TLCK), N-p-torsil-L-fenilalanina klorometil keton (TPCK), inhibitor tripsin dari kacang kedelai (SBTI), inhibitor tripsin dari kacang lima, dan leupeptin (Cho et al. 2003). Asam aminokaproat dapat berperan sebagai inhibitor fibrinolisis dengan menghambat aktivasi plasmin. Asam aminokaproat diinjeksikan secara intravena untuk mengobati perdarahan (Katzung 2006).
Gambar 2 Struktur 3 dimensi lumbrokinase Sumber: www.pdb.org
Mekanisme Koagulasi Darah Darah adalah cairan tubuh yang mengalir di dalam pembuluh darah. Darah terbagi atas fase cair dan fase padat. Fase cair darah disebut plasma dan mengandung air, protein, dan zat-zat terlarut lain. Sementara fase padatan darah terdiri atas sel darah merah, sel darah putih, dan keping darah (Bell 2002). Pembentukan sel-sel darah manusia, atau dikenal dengan hematopoiesis, terjadi di sumsum tulang belakang (Hoffbrand, et al. 2006; Smith, et al. 2004).
Darah memiliki fungsi yang penting dalam metabolisme dan pertahanan sistem imun. Sel darah merah memegang peranan penting dalam metabolisme karena sel-sel darah merah mentranspor oksigen menuju sel-sel tubuh dan karbon dioksida menuju paru-paru (Hoffbrand, et al. 2006). Tubuh yang kekurangan pasokan oksigen tidak dapat Kantung
Kerongkongan Ampela
3
menjalankan fungsi respirasinya dengan baik dan akan mengalami respirasi anaerobik. Respirasi anaerobik yang berkelanjutan dapat menyebabkan tubuh mengalami asidosis dan ketosis (Nelson & Cox 2005). Sementara, sel darah putih berperan dalam pertahanan tubuh terhadap antigen (Smith, et al. 2004). Peran sel darah putih ini menyebabkan sel-sel ini harus mampu bergerak dengan cepat menuju tempat terjadinya infeksi (Bell 2002). Laju alir darah dalam pembuluh senantiasa harus dijaga dengan serangkaian mekanisme yang memastikan darah tidak terlalu encer dan tidak terlalu pekat. Mekanisme ini lazim disebut hemostasis. Hemostasis terdiri atas dua proses yang saling setimbang, yaitu prokoagulasi dan fibrinolisis (Escobar et al. 2002).
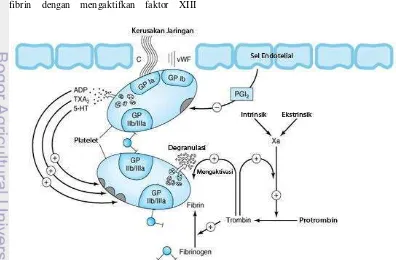
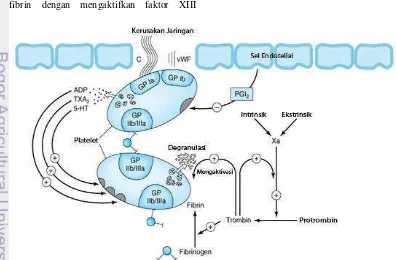
Penggumpalan darah atau prokoagulasi terjadi ketika sel darah bertemu dengan sel-sel endotelial atau jika terjadi kerusakan pada jaringan kulit. Mekanisme pembekuan ini dapat dilihat pada Gambar 3. Sel-sel endotelial sebenarnya bersifat antikoagulan dan inert terhadap faktor-faktor pembekuan darah (Escobar et al. 2002). Namun adanya luka dapat mengubah sifat sel endotelial menjadi sangat prokoagulan. Perubahan sifat sel dipengaruhi, antara lain oleh adanya kolagen, faktor von Willebrand, dan glikoprotein Ib (GPIb) yang ada pada membran keping darah (Katzung 2006; Olson 2004; Escobar et al. 2002).
Sifat prokoagulan sel endotelial menyebabkan penempelan trombosit atau keping darah pada dinding pembuluh darah (Katzung 2006). Penempelan keping darah diikuti oleh perubahan bentuk trombosit dan pelepasan adenosin difosfat (ADP). Pelepasan ADP menyebabkan pecahnya keping-keping darah lain dan mulai menyumbat lubang pada pembuluh. Keping darah yang telah aktif akan menyediakan permukaan fosfolipida yang bertindak sebagai perantara kedua yang akan mengaktifkan faktor-faktor pembekuan darah, baik pada sistem intrinsik maupun ekstrinsik. Seiring dengan terjadinya kerusakan pembuluh darah, sistem hemostasis juga akan mengalirkan darah melalui pembuluh darah lain di sekitar pembuluh yang rusak untuk mempercepat proses pembekuan darah (Escobar et al. 2002).
Bekuan darah merupakan trombosit-trombosit yang saling terangkai melalui sejumlah reaksi biokimia dan membentuk agregat trombosit (Escobar et al. 2002). Asam arakidonat dalam trombosit akan diubah menjadi tromboksan A2 (TXA2) yang
berfungsi sebagai pengaktif trombosit dan vasokonstriktor bersama ADP dan serotonin (5-HT) (Olson 2004; Escobar et al. 2002). Pengaktifan trombosit mengubah konformasi pada reseptor αIIbβIII integrin (glikoprotein IIb/IIIa) sehingga mudah mengikat fibrinogen dan membentuk ikatan silang antarmolekul trombosit sehingga terbentuk agregat trombosit. Agregat trombosit terdiri dari fibrin, trombosit, dan sisa-sisa eritrosit yang tidak larut. Agregat yang pembentukannya tidak terkendali dapat menyumbat pembuluh darah, serta menyebabkan iskemia jaringan (Olson 2004; Katzung 2006).
Akhir pembekuan darah adalah pembentukan fibrin melalui dua jalur, yaitu jalur ekstrinsik dan jalur intrinsik yang keduanya akan mengaktifkan jalur normal (Escobar et al. 2002). Inisiasi reaksi berantai pembentukan agregat trombosit dipengaruhi oleh pengaktifan faktor-faktor pembekuan darah yang prosesnya berbentuk reaksi berantai atau efek domino (Katzung 2006; Escobar et al. 2002). Faktor-faktor pembekuan darah yang terlibat dalam proses ini dapat dilihat pada Lampiran 2. Setiap reaksi merupakan akibat dari reaksi sebelumnya. Jika satu di antara faktor-faktor tersebut tidak dapat diaktifkan, maka akan mengakibatkan koagulasi terhambat, inisiasi tahap selanjutnya terhambat, waktu pembentukan bekuan darah semakin lama, atau terjadi perdarahan secara terus-menerus (cenderung disalahartikan dengan kekurangan faktor XII) (Escobar et al. 2002). Jalur pembentukan bekuan yang paling singkat dimulai dengan pengaktifan jalur ekstrinsik.
Jalur ekstrinsik adalah aktivasi faktor pembekuan darah yang dipicu oleh kerusakan dinding endotelial pembuluh darah. Jalur ini disebut ekstrinsik karena masuknya faktor jaringan, senyawa yang tidak ditemukan di dalam darah, ke dalam pembuluh. Faktor jaringan ini, atau dikenal juga sebagai tromboplastin atau faktor III, dilepaskan oleh jaringan pembuluh yang terluka. Bersama-sama dengan ion kalsium, faktor III ini akan mengaktifkan faktor VII menjadi faktor VIIa. Faktor VIIa, bersama dengan faktor III dan ion kalsium dapat memproduksi trombin dalam jumlah kecil dengan sangat cepat. Tujuannya, mempercepat pembentukan fibrin melalui pelepasan keping darah dari eritrosit. Selain itu, faktor VIIa juga akan mengaktifkan faktor IX pada jalur intrinsik (Escobar et al. 2002).
fosfolipida sehingga mengaktifkan faktor XII menjadi XIIa. Faktor XIIa bersama dengan faktor Fitzgerald (high-molecular-weight kininogen (HMWK)) dan faktor Fletcher (prekallikrein) akan mengaktifkan faktor XI menjadi XIa. Peran HMWK adalah mempercepat aktivasi faktor XI. Selanjutnya, faktor XIa dengan ion kalsium akan mengaktifkan faktor IX menjadi IXa. Ion kalsium juga akan berperan dalam tahap selanjutnya pada jalur intrinsik ini, yaitu ketika bersama faktor IXa, VIIa, dan fosfolipida faktor keping darah 3 (platelet factor 3 (PF3)) mengaktifkan jalur normal (faktor X menjadi faktor Xa) (Escobar et al. 2002).
Pertemuan jalur intrinsik dan ekstrinsik adalah pembentukan faktor Xa. Faktor koagulasi ini mengkatalis perubahan protrombin menjadi trombin (faktor IIa) pada jalur akhir dengan bantuan faktor Va, PF3, dan ion kalsium (Escobar et al. 2002). Trombin memotong fibrinopeptida dari fibrinogen yang larut air menjadi monomer fibrin lalu akhirnya menjadi polimer fibrin yang tidak larut. Perubahan bentuk peptida tersebut meningkatkan densitas darah (Jackson 1988). Trombin memiliki beberapa peranan. Peranan pertama adalah kembali ke siklus sebelumnya untuk mempercepat aktivasi faktor V dan VIII. Peranan kedua adalah mengubah fibrinogen menjadi monomer fibrin yang masih larut air. Peranan ketiga adalah membuat ikatan silang polimer fibrin dengan mengaktifkan faktor XIII
menjadi XIIIa. Peranan trombin yang terakhir adalah sebagai bioregulator hemostasis darah dalam keadaan normal dan patologis (Escobar et al. 2002).
Enzim Protease Fibrinolisis dan Obat Trombolitik
Fibrinolisis adalah proses degradasi fibrin secara enzimatis. Proses ini secara otomatis diaktifkan bersamaan dengan pembekuan darah, yaitu ketika terjadi luka pada dinding endotelial. Proses fisiologis ini akan menghilangkan deposit polimer fibrin secara bertahap hingga menjadi produk degradasi yang larut air. Produk degradasi yang dihasilkan kemudian akan dibuang dari peredaran darah oleh makrofag-makrofag yang ada pada sistem retikuloendotelial. Fungsi penting proses ini adalah untuk membebaskan pembuluh dari bekuan darah dan memulai proses penyembuhan dinding pembuluh (Escobar et al. 2002).
Enzim yang mampu mendegradasi fibrin secara spesifik adalah plasmin. Plasmin termasuk dalam kelompok protease serin dan bersirkulasi dalam bentuk inaktifnya, yaitu plasminogen. Plasminogen akan diaktifkan oleh aktivator (tissue plasminogen activator/ t-PA) jika terjadi luka pada dinding endotelial. Plasmin dapat mempengaruhi bentuk koagulasi darah dan mengurangi kecepatan pembentukan bekuan trombosit karena kemampuan spesifiknya mendegradasi fibrin (Katzung 2006).
5
Obat trombolitik adalah obat yang bekerja menghancurkan bekuan darah yang telah terbentuk dengan mengaktifkan plasminogen. Agregat fibrin yang terbentuk dan menyumbat pembuluh darah akan dihancurkan oleh plasmin dan menghasilkan produk degradasi berupa cuplikan-cuplikan protein yang larut air. Obat trombolitik digunakan pada pencegahan penyakit trombosis seperti infark jantung, serebrovaskular, dan emboli paru (Olson 2004). Obat trombolitik efektif melisiskan trombin jika diberikan secara intravena (Katzung 2006).
Contoh golongan obat trombolitik yang umum digunakan, antara lain streptokinase, urokinase, anistreplase, dan aktivator plasminogen jaringan. Streptokinase adalah protein ekstraseluler yang disintesis oleh
Streptococcus β-hemoliticus yang bergabung dengan plasminogen proaktivator. Urokinase adalah enzim yang disintesis di ginjal manusia dan memiliki kemampuan melisiskan plasmin. Kedua jenis obat ini mengaktifkan plasminogen, terutama plasminogen yang terperangkap di dalam bekuan darah sehingga bekuan darah dapat dihancurkan dari dalam (Katzung 2006). Anistreplase (streptokinase yang diberi gugus anisol) merupakan obat trombolitik yang terdiri atas plasminogen yang dimurnikan dan streptokinase yang telah diasilasi untuk melindungi sisi aktif enzim. Gugus asil streptokinase segera terhidrolisis, ketika obat disuntikkan secara intravena, dan mengaktifkan streptokinase. Keuntungan obat ini adalah kemampuannya berikatan dengan plasminogen terikat trombin daripada plasminogen bebas dan aktivitas trombolitiknya lebih tinggi (Katzung 2006). Aktivator plasminogen jaringan (tissue plasminogen activators/ tPA) adalah obat yang menyebabkan fibrinolisis hanya pada plasminogen yang terikat pada bekuan darah. Beberapa contoh aktivator plasminogen jaringan, antara lain alteplase, reteplase, dan tenecteplase. Ketiganya merupakan DNA rekombinan dari t-PA manusia (Katzung 2006).
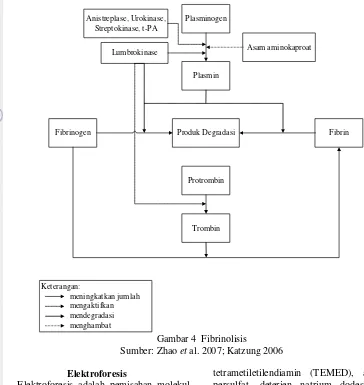
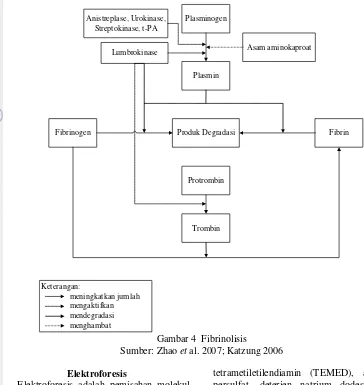
Titik kerja obat-obatan secara umum terbagi dalam empat titik utama, yaitu mengaktivasi plasmin, mendegradasi fibrin, mendegradasi fibrinogen, dan mencegah aktivasi fibrinogen menjadi fibrin (Gambar 4). Sebagai contoh, anistreplase dan streptokinase bekerja mengaktifkan plasmin. Menurut Yanti (2003), lumbrokinase memiliki kelebihan dapat bekerja pada keempat titik kerja utama obat-obatan trombolitik tersebut sehingga peluruhan bekuan darah berlangsung lebih cepat.
Pemurnian Enzim
Enzim bekerja sebagai katalis yang mengaktifkan atau mempercepat berbagai reaksi di dalam tubuh dengan menurunkan energi aktivasi. Reaksi-reaksi enzimatis dalam sistem biologis sangat rumit dan sulit untuk mempelajari reaksi suatu jenis enzim secara in vivo, maka perlu dilakukan pemurnian enzim dari protein dan metabolit lainnya sehingga dihasilkan produk murni yang hanya mengandung enzim yang akan dipelajari. Enzim yang telah dimurnikan tersebut dapat diamati aktivitasnya dengan jelas secara in vitro (Farrell & Ranallo 2000).
Fraksi yang akan didapatkan dari pemurnian enzim, antara lain ekstrak kasar, presipitat, dialisat, dan eluat. Fraksi tersebut diukur konsentrasi protein, aktivitas enzim, dan spesifisitas terhadap substrat untuk memastikan bahwa enzim yang didapat adalah enzim yang sedang diteliti dan mendapatkan karakter enzim tersebut. Ekstrak kasar enzim diperoleh dengan resuspensi dengan menggunakan bufer. Resuspensi harus dilakukan pada suhu rendah untuk mencegah kerusakan enzim. Campuran kemudian disentrifugasi pada kecepatan 6000 g (Campbell & Farrell 2006).
Perlakuan dengan sentrifugasi mungkin masih meninggalkan protein lain yang tidak dikehendaki, yang dapat mengurangi efektifitas enzim sehingga harus dilakukan presipitasi atau pengendapan protein dengan menggunakan garam amonium sulfat dengan konsentrasi tertentu. Garam ini akan mengikat air bebas sehingga protein yang sebelumnya berikatan dengan air pada gugus hidrofiliknya akan mengendap karena air yang dapat menstabilkan protein tersebut sekarang terikat pada garam (Farrell & Ranallo 2000). Selanjutnya, dilakukan dialisis untuk menghilangkan garam-garam yang terikat pada endapan protein. Dialisis dilakukan dengan memasukkan larutan ke kantong dialisis dengan pori-pori 10 kD dalam larutan bufer. Perlakuan dilakukan beberapa kali hingga amonium sulfat tidak terdeteksi.
Plasminogen
Plasmin Lumbrokinase
Fibrinogen Produk Degradasi Fibrin
Protrombin
Trombin Anistreplase, Urokinase,
Streptokinase, t-PA
Asam aminokaproat
Keterangan:
meningkatkan jumlah mengaktifkan mendegradasi menghambat
Gambar 4 Fibrinolisis
Sumber: Zhao et al. 2007; Katzung 2006
Elektroforesis
Elektroforesis adalah pemisahan molekul berdasarkan bobot molekul dan muatan elektronnya. Molekul yang bermuatan negatif cenderung bergerak ke kutub positif. Kecepatan perpindahan molekul tergantung muatan elektronnya, tegangan yang digunakan, dan koefisien gesek. Molekul yang secara umum dipisahkan menggunakan teknik ini adalah protein dan asam nukleat. Media penahan yang dapat digunakan dalam elektroforesis, antara lain cairan, kertas, gel. Akan tetapi, media yang sering digunakan adalah media berbasis gel. Agarosa dan poliakrilamida termasuk golongan media berbasis gel. Agarosa mampu memisahkan asam nukleat sementara poliakrilamida mampu memisahkan molekul protein (Farrell & Ranallo 2000).
Gel poliakrilamida adalah gabungan
polimer akrilamida den an N,N’ -metilenbisakrilamida. Semakin tinggi konsentrasi akrilamida yang digunakan, semakin lambat pergerakan protein di dalam gel. Konsentrasi bisakrilamida yang optimum berkisar antara 3-5%. Komponen lain yang diperlukan adalah N,N,N’,N’
-tetrametiletilendiamin (TEMED), amonium persulfat, deterjen natrium dodesil sulfat (SDS), dan merkaptoetanol. TEMED adalah katalis yang menyebabkan pembentukan radikal bebas selama reaksi ikatan silang antarmolekul akrilamida. Jumlah TEMED menentukan kecepatan pengerasan gel. Amonium persulfat berfungsi menginisiasi pembentukan radikal bebas yang mengikat semua molekul akrilamida (Farrell & Ranallo 2000). Deterjen SDS terikat pada protein dengan perbandingan 1.4 g SDS untuk setiap gram protein dan menyelubunginya dengan muatan negatif. Merkaptoetanol menyebabkan kerusakan struktur 3 dimensi protein yang dipanaskan. Kerusakan ini disebabkan pecahnya ikatan disulfida menjadi gugus-gugus sulfhidrin sehingga protein menjadi berbentuk spiral yang sama dan memiliki rasio muatan:massa yang sama pula. Akibatnya, keterpisahan protein di dalam gel hanya ditentukan oleh massa protein tersebut. Bufer Tris digunakan untuk mengarahkan dan mengatur arus pada gel penahan (Girindra 1990; Farrell & Ranallo 2000).
7
menjadi satu. Sejumlah besar gel di lapisan bawah memiliki konsentrasi akrilamida tinggi dan pH sekitar 8.5 (gel pemisah) sementara lapisan tipis gel di atas, gel penahan, memiliki pH sekitar 6.5 dan konsentrasi akrilamida yang lebih rendah, yaitu sekitar 3%. Protein yang memasuki gel penahan cenderung bergerak lebih cepat karena ukuran pori gel lebih besar. Protein yang telah memasuki gel pemisah pergerakannya melambat karena konsentrasi akrilamida pada gel pemisah yang lebih tinggi sehingga menimbulkan efek akordeon dan pita protein yang terbentuk lebih tipis. Perbedaan pH pada kedua lapisan gel juga mempengaruhi perpindahan protein. Protein yang memasuki gel penahan akan dikelilingi oleh ion klorida yang sangat elektronegatif dan glisin yang kurang elektronegatif. Protein tersebut kemudian didorong memasuki gel penahan dengan adanya perbedaan tegangan. Kenaikan pH menjadi 8.5 menyebabkan efek ikatan glisin-protein menjadi hilang dan glisin-protein terpisahkan akibat perbedaan bobot molekulnya (Farrell & Ranallo 2000).
Pengukuran Aktivitas dan Spesifisitas Enzim
Penelitian ini mengukur aktivitas enzim dengan menggunakan beberapa faktor, antara lain pH, suhu inkubasi, dan waktu inkubasi. Faktor-faktor lain yang mempengaruhi aktivitas enzim namun tidak diteliti, antara lain kekuatan ionik ikatan dan keberadaan inhibitor atau aktivator (Farrell & Ranallo 2000).
Aktivitas enzim umumnya diukur berdasarkan jumlah µmol produk yang terbentuk tiap satuan waktu (menit). Namun, untuk mengukur jumlah aktivitas pada volume tertentu, digunakan aktivitas relatif yaitu pengukuran jumlah unit aktivitas tiap satuan volume (Farrell & Ranallo 2000). Produk yang akan diukur pada penelitian ini adalah jumlah tirosina yang terbentuk pada pemecahan molekul kasein oleh enzim protease. Reagen Folin-Ciocalteau digunakan dalam pengukuran molekul tirosina dengan menghasilkan warna biru (Folin & Ciocalteu 1972 di dalam Acharya & Katyare 2004) dan diukur serapannya pada panjang gelombang 578 nm (Jackson 1988; Walter 1988). Warna biru tersebut diakibatkan reduksi fosfomolibdat oleh tirosina dengan adanya ion tembaga dalam suasana basa (Spies 1957 dalam Acharya & Katyare 2004).
Pengujian spesifisitas enzim dilakukan dengan metode spektrofotometri dengan
menggunakan modifikasi metode Harris (1991). Substrat yang digunakan untuk menguji spesifisitas enzim adalah fibrin. Fibrin yang berwarna putih dan tidak larut air diwarnai menggunakan karmoisin. Campuran tersebut kemudian diresuspensi dalam bufer dan diamati intensitas warnanya pada 515 nm. Campuran kemudian dibagi ke dalam 5 tabung. Dua tabung di antaranya ditambahkan akuades (blanko), sementara ketiga tabung lainnya ditambahkan enzim (sampel). Absorban kelima tabung diukur dan dirata-rata. Selisih absorban menunjukkan kemampuan enzim memotong molekul fibrin menjadi molekul yang larut air sehingga ikatan fibrin dan pewarna menjadi terpotong. Akibatnya, intensitas warna pada sampel meningkat.
Inhibitor enzim adalah senyawa yang dapat menginaktivasi enzim dan menyebabkan penurunan laju reaksi yang dikatalisis oleh enzim tersebut (Jain et al. 2005). Inhibitor dibagi menjadi dua kelas besar, yaitu inhibitor reversibel dan inhibitor nonreversibel. Inhibitor reversibel dapat memisah secara cepat dari enzim target karena ikatannya sangat lemah. Inhibitor reversibel dapat dibagi lagi menjadi tiga kelompok, yaitu kompetitif, nonkompetitif, dan inkompetitif. Faktor-faktor utama yang membagi ketiga kelompok enzim tersebut, antara lain konsentrasi substrat, situs penempelan enzim, dan keadaan kompleks enzim ketika inhibitor menempel. Inhibitor nonreversibel terikat secara kuat dengan enzim targetnya dan tidak mudah lepas. Ikatan yang terjadi antara enzim dan inhibitor dapat berupa ikatan kovalen atau nonkovalen (Jain et al. 2005).
Ion logam adalah kofaktor dalam aktivasi zimogen tertentu. Ion logam berperan sebagai donor asam Lewis. Beberapa ion logam yang terlibat dalam reaksi-reaksi di tubuh manusia, antara lain Mn2+, Mg2+, dan Zn2+. Contoh peranan ion logam pada enzim adalah perikatan Zn2+ dengan rantai samping imidazol pada histidina atau rantai samping karboksilat pada asam glutamat (Campbell & Farrell 2006).
BAHAN DAN METODE
Alat dan Bahan
menjadi satu. Sejumlah besar gel di lapisan bawah memiliki konsentrasi akrilamida tinggi dan pH sekitar 8.5 (gel pemisah) sementara lapisan tipis gel di atas, gel penahan, memiliki pH sekitar 6.5 dan konsentrasi akrilamida yang lebih rendah, yaitu sekitar 3%. Protein yang memasuki gel penahan cenderung bergerak lebih cepat karena ukuran pori gel lebih besar. Protein yang telah memasuki gel pemisah pergerakannya melambat karena konsentrasi akrilamida pada gel pemisah yang lebih tinggi sehingga menimbulkan efek akordeon dan pita protein yang terbentuk lebih tipis. Perbedaan pH pada kedua lapisan gel juga mempengaruhi perpindahan protein. Protein yang memasuki gel penahan akan dikelilingi oleh ion klorida yang sangat elektronegatif dan glisin yang kurang elektronegatif. Protein tersebut kemudian didorong memasuki gel penahan dengan adanya perbedaan tegangan. Kenaikan pH menjadi 8.5 menyebabkan efek ikatan glisin-protein menjadi hilang dan glisin-protein terpisahkan akibat perbedaan bobot molekulnya (Farrell & Ranallo 2000).
Pengukuran Aktivitas dan Spesifisitas Enzim
Penelitian ini mengukur aktivitas enzim dengan menggunakan beberapa faktor, antara lain pH, suhu inkubasi, dan waktu inkubasi. Faktor-faktor lain yang mempengaruhi aktivitas enzim namun tidak diteliti, antara lain kekuatan ionik ikatan dan keberadaan inhibitor atau aktivator (Farrell & Ranallo 2000).
Aktivitas enzim umumnya diukur berdasarkan jumlah µmol produk yang terbentuk tiap satuan waktu (menit). Namun, untuk mengukur jumlah aktivitas pada volume tertentu, digunakan aktivitas relatif yaitu pengukuran jumlah unit aktivitas tiap satuan volume (Farrell & Ranallo 2000). Produk yang akan diukur pada penelitian ini adalah jumlah tirosina yang terbentuk pada pemecahan molekul kasein oleh enzim protease. Reagen Folin-Ciocalteau digunakan dalam pengukuran molekul tirosina dengan menghasilkan warna biru (Folin & Ciocalteu 1972 di dalam Acharya & Katyare 2004) dan diukur serapannya pada panjang gelombang 578 nm (Jackson 1988; Walter 1988). Warna biru tersebut diakibatkan reduksi fosfomolibdat oleh tirosina dengan adanya ion tembaga dalam suasana basa (Spies 1957 dalam Acharya & Katyare 2004).
Pengujian spesifisitas enzim dilakukan dengan metode spektrofotometri dengan
menggunakan modifikasi metode Harris (1991). Substrat yang digunakan untuk menguji spesifisitas enzim adalah fibrin. Fibrin yang berwarna putih dan tidak larut air diwarnai menggunakan karmoisin. Campuran tersebut kemudian diresuspensi dalam bufer dan diamati intensitas warnanya pada 515 nm. Campuran kemudian dibagi ke dalam 5 tabung. Dua tabung di antaranya ditambahkan akuades (blanko), sementara ketiga tabung lainnya ditambahkan enzim (sampel). Absorban kelima tabung diukur dan dirata-rata. Selisih absorban menunjukkan kemampuan enzim memotong molekul fibrin menjadi molekul yang larut air sehingga ikatan fibrin dan pewarna menjadi terpotong. Akibatnya, intensitas warna pada sampel meningkat.
Inhibitor enzim adalah senyawa yang dapat menginaktivasi enzim dan menyebabkan penurunan laju reaksi yang dikatalisis oleh enzim tersebut (Jain et al. 2005). Inhibitor dibagi menjadi dua kelas besar, yaitu inhibitor reversibel dan inhibitor nonreversibel. Inhibitor reversibel dapat memisah secara cepat dari enzim target karena ikatannya sangat lemah. Inhibitor reversibel dapat dibagi lagi menjadi tiga kelompok, yaitu kompetitif, nonkompetitif, dan inkompetitif. Faktor-faktor utama yang membagi ketiga kelompok enzim tersebut, antara lain konsentrasi substrat, situs penempelan enzim, dan keadaan kompleks enzim ketika inhibitor menempel. Inhibitor nonreversibel terikat secara kuat dengan enzim targetnya dan tidak mudah lepas. Ikatan yang terjadi antara enzim dan inhibitor dapat berupa ikatan kovalen atau nonkovalen (Jain et al. 2005).
Ion logam adalah kofaktor dalam aktivasi zimogen tertentu. Ion logam berperan sebagai donor asam Lewis. Beberapa ion logam yang terlibat dalam reaksi-reaksi di tubuh manusia, antara lain Mn2+, Mg2+, dan Zn2+. Contoh peranan ion logam pada enzim adalah perikatan Zn2+ dengan rantai samping imidazol pada histidina atau rantai samping karboksilat pada asam glutamat (Campbell & Farrell 2006).
BAHAN DAN METODE
Alat dan Bahan
8
magnet, pemanas, dan perangkat elektroforesis Bio-Rad.
Bahan-bahan yang digunakan adalah cacing E. foetida yang diperoleh dari pembiakan di rumah sakit hewan FKH IPB, kasein Hammerstein, standar L-tirosin, standar BSA fraksi V, etanol, bufer fosfat, amonium sulfat padat, BaCl2 padat, NaOH,
HCl, NaCl, bufer Tris-HCl, fase diam DEAE-selulosa, bufer glisina-NaOH 0.1 M, dan bufer Na2HPO4-NaOH 0.1 M, TCA 0.1 M, Na2CO3
0.4 M, pereaksi Folin-Ciocalteau, pewarna Coomasie Brilliant Blue R-250, akrilamida, bis-akrilamida, SDS, amonium persulfat, gliserol, merkaptoetanol, penanda bobot molekul rendah Bio-Rad, indikator bromfenol biru, Tris, glisina, asam asetat glasial, TEMED, fibrin, pewarna karmoisin, dan akuades.
Metode
Pembuatan Tepung Cacing Kering
Cacing E. foetida sebanyak 2 kg berukuran relatif sama dicuci di bawah air mengalir selama 15 menit. Cacing direndam dalam larutan etanol 30% selama 1 menit untuk mengeluarkan kotoran sekaligus mematikan cacing. Cacing kembali direndam dalam air selama 5 menit untuk menghilangkan etanol. Cacing yang sudah bersih dimasukkan ke dalam oven vakum bersuhu 60°C, 0.73 bar (0.72 atm) hingga kering. Cacing yang sudah kering diblender untuk mendapatkan tepung cacing (Setiawan 2008). Cacing yang telah dikeringkan kemudian digiling hingga menjadi bubuk dan ditimbang 5 g tiap kantung. Cacing sebanyak 55 g kemudian dilarutkan di dalam 50 mM bufer fosfat pH 7 hingga menjadi 550 mL larutan ekstrak kasar 10% (Yanti 2003).
Pemurnian Ekstrak Enzim
Presipitasi. Protein dari ekstrak kasar protease diendapkan menggunakan amonium sulfat dengan modifikasi Jewel (2000) dan Watanabe et al. (2005). 500 mL ekstrak kasar ditambahkan amonium sulfat sambil diaduk perlahan-lahan. Tingkat kejenuhan amonium sulfat yang digunakan antara 60%. Campuran didiamkan selama 30 menit hingga setimbang kemudian disentrifugasi pada 10000 g, 4°C selama 15 menit. Pelet hasil presipitasi berupa endapan garam dan enzim.
Dialisis. Endapan protein diresuspensi dengan 50 mM bufer fosfat pH 7.0 kemudian didialisis dengan akuades (modifikasi metode Anderson 2011). Dialisis menggunakan kantung dialisis dengan cut-off 10 kD. Akuades untuk dialisis diganti setiap dua jam.
Dialisis dilakukan sebanyak 2 kali hingga campuran bebas amonium sulfat yang diuji dengan penambahan BaCl2 2%.
Fraksinasi Enzim. Fraksinasi menggunakan kromatografi kolom penukar ion dengan jenis kolom DEAE-selulosa Sigma D4618 menggunakan modifikasi metode Chen et al. (2007). Kolom ini diregenerasi terlebih dahulu sebelum digunakan (prosedur pada Lampiran 4). Kolom yang telah diregenerasi dimasukkan ke dalam tabung kromatografi disertai bufer 50 mM Tris-HCl pH 7.5. Sampel dialisat yang dikeringbekukan sebanyak 5 mL kemudian dimasukkan ke dalam kolom yang telah dikemas. Elusi dilakukan menggunakan eluen NaCl secara gradien bertingkat dengan kecepatan alir 2
m
menit . Volume eluen yang digunakan
adalah 50 mL bufer 50 mM Tris-HCl pH 7.5, 150 mL 0.25 M NaCl di dalam bufer 50 mM Tris-HCl pH 7.5, dan 0.5 M NaCl di dalam bufer 50 mM Tris-HCl pH 7.5. Eluat dipisahkan setiap 5 mL.
Karakterisasi Dialisat Enzim
Analisis Aktivitas Protease. Protease diukur dengan metode Jackson (1988). Substrat yang digunakan adalah kasein Hammerstein 2% v. Sebuah tabung reaksi diisi 4.5 mL kasein 2% v dan 4.5 mL bufer sebagai stok sampel. Tabung reaksi kedua dan ketiga diisi 1.5 mL kasein 2% v dan 1.5 mL bufer sebagai stok standar dan blanko. Bufer yang digunakan untuk stok sampel, standar, dan blanko adalah bufer fosfat 0.1 M (untuk pH 6 dan 7.4) dan bufer 0.1 M glisina-NaOH (untuk pH 8). Tabung pertama ditambahkan 450 µL larutan enzim, tabung kedua ditambahkan standar L-tirosin, dan tabung ketiga ditambahkan akuades. Ketiga tabung diinkubasi pada suhu dan waktu tertentu. Suhu yang digunakan adalah 25, 37, dan 60°C. Waktu inkubasi yang digunakan adalah 0, 5, 10, 20, 40, dan 60 menit.
Setiap selang waktu inkubasi, 500 µL larutan tiap tabung diambil dan dimasukkan ke dalam vial yang telah ditambahkan 500 µL TCA 0.1 M untuk menghentikan reaksi. Tabung sampel diambil triplo. Masing-masing tabung blanko dan standar kemudian ditambahkan 50 µL enzim, sementara ke dalam tabung sampel ditambahkan 50 µL akuades. Tabung diinkubasi kembali pada suhu 37°C selama 10 menit kemudian disentrifugasi 6000 g, 4°C selama 10 menit.
Supernatan sebanyak 375 µL diambil dan ditambahkan 1.25 mL Na2CO3 0.4 M dan 250
menit. Absorban larutan diukur pada panjang gelombang 578 nm. Satu unit aktivitas protease didefinisikan sebagai jumlah enzim yang dapat menghasilkan satu µmol produk tirosina per menit pada kondisi pengukuran, sedangkan aktivitas relatif merupakan jumlah aktivitas enzim tiap satuan volume. Aktivitas relatif enzim diukur berdasarkan persamaan berikut.
U m
sampel lanko
standar lanko t
Keterangan
Ar = aktivitas relatif protease
Fp = faktor pengenceran
t = waktu inkubasi
Penentuan Aktivitas Fibrinolitik. Aktivitas fibrinolitik dilakukan secara spektrofotometri menggunakan modifikasi metode Harris (1991). Protein fibrin yang didapat dari pemurnian serum darah diwarnai menggunakan pewarna merah tua lalu dikeringkan di dalam oven bersuhu 50°C. Fibrin kemudian dihaluskan dan ditimbang sebanyak 6.5 mg. Bubuk fibrin dilarutkan dalam bufer pH optimum dengan konsentrasi 650 ppm. Larutan dipisahkan dalam 5 tabung reaksi. Dua tabung ditambahkan 100 µL akuades (blanko) dan ketiga tabung lainnya ditambahkan enzim dengan jumlah yang sama (sampel). Tabung-tabung tersebut diinkubasi pada suhu dan waktu inkubasi optimum kemudian diukur absorbannya pada panjang gelombang maksimum menggunakan spektrofotometer. Absorban diplotkan pada kurva standar. Kurva standar enam titik dibuat dengan mengencerkan pewarna dengan akuades dengan konsentrasi antara 66.5 hingga 344.5 ppm ( v). Suhu, pH, dan waktu inkubasi optimum yang digunakan merupakan hasil dari tahap analisis aktivitas protease.
Analisis Tambahan
Deteksi Protein. Protein yang ada pada tiap tabung dideteksi secara spektrofotometri dengan pengukuran absorban tanpa pewarnaan pada panjang gelombang 280 nm (Harris 1991). Metode ini mengukur asam amino triptofan dan tirosina pada sampel. Triptofan dan tirosina memiliki absorban maksimum pada 280 nm (Analytik Jena 2007).
Pengukuran Bobot Molekul. Sampel enzim dipisahkan berdasarkan bobot molekulnya menggunakan elektroforesis SDS-PAGE modifikasi metode Laemmli (1970) yang umum digunakan dalam pengujian protein. Konsentrasi akrilamida yang digunakan pada gel pemisah adalah sebesar
15% dan dilarutkan dalam bufer 1.5 M Tris pH 8.8. Gel dicetak dan dibiarkan mendingin, kemudian ditambahkan gel penahan. Gel penahan mengandung 4% akrilamida yang dilarutkan menggunakan bufer 0.5 M Tris pH 6.8. Gel dibiarkan mendingin dan siap digunakan untuk elektroforesis.
Sampel sebanyak 20 µL ditambahkan 20 µL bufer sampel yang mengandung 2-merkaptoetanol kemudian dipanaskan pada suhu 100°C selama 4 menit. Sampel kemudian dimasukkan ke dalam sumur sebanyak 30 µL. Sebanyak 5 µL penanda dimasukkan ke dalam sumur. Gel kemudian dialiri listrik pada tegangan 200 V selama 150 menit. Gel yang telah selesai melalui elektroforesis kemudian diwarnai dengan larutan pewarna selama minimal 6 jam. Larutan pewarna yang digunakan adalah campuran 1.0 g Coomasie Brilliant Blue R-250, 450 mL etanol, dan 100 mL asam asetat glasial. Larutan diaduk dan ditera dengan akuades hingga volum 1000 mL.
Warna biru yang berlebihan akibat pewarnaan kemudian dicuci beberapa kali hingga didapatkan pita protein berwarna biru dengan latar gel yang tidak berwarna. Larutan pencuci yang digunakan adalah campuran 100 mL metanol dan 100 mL asam asetat glasial. Larutan diaduk dan ditera menggunakan akuades hingga volum 1000 mL.
Analisis Konsentrasi Protein. Konsentrasi protein ditentukan dengan metode Bradford (1976). Disiapkan dua buah tabung reaksi dan masing-masing diisi 1 mL akuades dan 1 mL pereaksi Bradford. Tabung pertama diisi 100 µL enzim dan tabung kedua diisi 100 µL air sebagai blanko. Disiapkan delapan buah tabung dan diisi 1 mL akuades dan 1 mL pereaksi Bradford lalu ditambahkan 100 µL standar BSA fraksi V dengan konsentrasi antara 0.025 hingga 0.2 m m . Setiap tabung diamati absorbannya pada 595 nm. Absorban larutan sampel diplotkan pada kurva standar yang diperoleh dari plot tabung-tabung berisi larutan standar sehingga didapatkan konsentrasi protein sampel.
HASIL DAN PEMBAHASAN
9
menit. Absorban larutan diukur pada panjang gelombang 578 nm. Satu unit aktivitas protease didefinisikan sebagai jumlah enzim yang dapat menghasilkan satu µmol produk tirosina per menit pada kondisi pengukuran, sedangkan aktivitas relatif merupakan jumlah aktivitas enzim tiap satuan volume. Aktivitas relatif enzim diukur berdasarkan persamaan berikut.
U m
sampel lanko
standar lanko t
Keterangan
Ar = aktivitas relatif protease
Fp = faktor pengenceran
t = waktu inkubasi
Penentuan Aktivitas Fibrinolitik. Aktivitas fibrinolitik dilakukan secara spektrofotometri menggunakan modifikasi metode Harris (1991). Protein fibrin yang didapat dari pemurnian serum darah diwarnai menggunakan pewarna merah tua lalu dikeringkan di dalam oven bersuhu 50°C. Fibrin kemudian dihaluskan dan ditimbang sebanyak 6.5 mg. Bubuk fibrin dilarutkan dalam bufer pH optimum dengan konsentrasi 650 ppm. Larutan dipisahkan dalam 5 tabung reaksi. Dua tabung ditambahkan 100 µL akuades (blanko) dan ketiga tabung lainnya ditambahkan enzim dengan jumlah yang sama (sampel). Tabung-tabung tersebut diinkubasi pada suhu dan waktu inkubasi optimum kemudian diukur absorbannya pada panjang gelombang maksimum menggunakan spektrofotometer. Absorban diplotkan pada kurva standar. Kurva standar enam titik dibuat dengan mengencerkan pewarna dengan akuades dengan konsentrasi antara 66.5 hingga 344.5 ppm ( v). Suhu, pH, dan waktu inkubasi optimum yang digunakan merupakan hasil dari tahap analisis aktivitas protease.
Analisis Tambahan
Deteksi Protein. Protein yang ada pada tiap tabung dideteksi secara spektrofotometri dengan pengukuran absorban tanpa pewarnaan pada panjang gelombang 280 nm (Harris 1991). Metode ini mengukur asam amino triptofan dan tirosina pada sampel. Triptofan dan tirosina memiliki absorban maksimum pada 280 nm (Analytik Jena 2007).
Pengukuran Bobot Molekul. Sampel enzim dipisahkan berdasarkan bobot molekulnya menggunakan elektroforesis SDS-PAGE modifikasi metode Laemmli (1970) yang umum digunakan dalam pengujian protein. Konsentrasi akrilamida yang digunakan pada gel pemisah adalah sebesar
15% dan dilarutkan dalam bufer 1.5 M Tris pH 8.8. Gel dicetak dan dibiarkan mendingin, kemudian ditambahkan gel penahan. Gel penahan mengandung 4% akrilamida yang dilarutkan menggunakan bufer 0.5 M Tris pH 6.8. Gel dibiarkan mendingin dan siap digunakan untuk elektroforesis.
Sampel sebanyak 20 µL ditambahkan 20 µL bufer sampel yang mengandung 2-merkaptoetanol kemudian dipanaskan pada suhu 100°C selama 4 menit. Sampel kemudian dimasukkan ke dalam sumur sebanyak 30 µL. Sebanyak 5 µL penanda dimasukkan ke dalam sumur. Gel kemudian dialiri listrik pada tegangan 200 V selama 150 menit. Gel yang telah selesai melalui elektroforesis kemudian diwarnai dengan larutan pewarna selama minimal 6 jam. Larutan pewarna yang digunakan adalah campuran 1.0 g Coomasie Brilliant Blue R-250, 450 mL etanol, dan 100 mL asam asetat glasial. Larutan diaduk dan ditera dengan akuades hingga volum 1000 mL.
Warna biru yang berlebihan akibat pewarnaan kemudian dicuci beberapa kali hingga didapatkan pita protein berwarna biru dengan latar gel yang tidak berwarna. Larutan pencuci yang digunakan adalah campuran 100 mL metanol dan 100 mL asam asetat glasial. Larutan diaduk dan ditera menggunakan akuades hingga volum 1000 mL.
Analisis Konsentrasi Protein. Konsentrasi protein ditentukan dengan metode Bradford (1976). Disiapkan dua buah tabung reaksi dan masing-masing diisi 1 mL akuades dan 1 mL pereaksi Bradford. Tabung pertama diisi 100 µL enzim dan tabung kedua diisi 100 µL air sebagai blanko. Disiapkan delapan buah tabung dan diisi 1 mL akuades dan 1 mL pereaksi Bradford lalu ditambahkan 100 µL standar BSA fraksi V dengan konsentrasi antara 0.025 hingga 0.2 m m . Setiap tabung diamati absorbannya pada 595 nm. Absorban larutan sampel diplotkan pada kurva standar yang diperoleh dari plot tabung-tabung berisi larutan standar sehingga didapatkan konsentrasi protein sampel.
HASIL DAN PEMBAHASAN
kasar. Suspensi ini masih berwarna coklat keruh dengan endapan-endapan yang terlihat kasat mata, maka perlu dilakukan sentrifugasi untuk mendapatkan larutan ekstrak kasar. Jumlah ekstrak kasar yang didapat adalah 350 mL. Enzim protease, yang termasuk dalam golongan protein, masih terlarut bersama dengan sisa-sisa nukleus dan membran sel yang berukuran kecil, maka perlu dilakukan pengendapan enzim menggunakan garam amonium sulfat, atau presipitasi. Hasil yang didapat dari presipitasi ini adalah 42.5 mL endapan protein. Endapan ini mengandung garam dalam konsentrasi tinggi yang akan mengganggu analisis selanjutnya, maka perlu dilakukan dialisis menggunakan kantung selofan di dalam akuades. Selanjutnya, langkah purifikasi yang terakhir adalah fraksinasi dan penjernihan dialisat menggunakan kromatografi kolom. Fraksi yang dikumpulkan dari penjernihan adalah sebanyak 52 tabung dengan volume masing-masing 5 mL.
Pada penelitian ini, cacing dikeringkan pada suhu sekitar 60°C di dalam oven vakum. Oven jenis ini digunakan untuk mengeringkan cacing karena bekerja dalam kondisi vakum. Tekanan ruang pada kondisi vakum lebih rendah daripada lingkungannya. Pada tekanan rendah, air dapat menguap pada suhu di bawah 100°C (Stoker 2009). Secara biokimia, penggunaan panas minimal diharapkan dapat mempertahankan aktivitas enzim karena salah satu faktor yang mempengaruhi aktivitas enzim adalah suhu. Pemanasan pada suhu di atas 70°C dapat menyebabkan denaturasi atau kerusakan struktur tersier dan kuartener protein sehingga kemudian enzim akan kehilangan aktivitasnya (Nelson & Cox 2005). Suspensi ekstrak kasar disentrifugasi untuk menghilangkan endapannya yang berwarna coklat. Menurut Farrell & Ranallo (2000), endapan ini merupakan sisa-sisa inti sel yang berbobot molekul besar. Namun ternyata supernatan coklat jernih itu diduga masih mengandung pengotor. Pengotor yang terdapat pada supernatan diperkirakan adalah hancuran mitokondria, peroksisom, lisosom, mikrosom, dan molekul-molekul yang terlarut dalam sitosol. Maka, perlu dilakukan langkah purifikasi selanjutnya untuk membebaskan protein dari pengotor tersebut.
Presipitasi adalah salah satu langkah purifikasi yang bertujuan mengendapkan protein lumbrokinase yang terlarut dalam campuran ekstrak kasar menggunakan garam amonium sulfat. Garam ini digunakan karena memiliki daya larut yang tinggi di dalam air dan kepolarannya tinggi sehingga mudah
mengikat air pada protein (Nelson & Cox 2005). Penggunaan konsentrasi garam sebesar 60% mempercepat pelepasan molekul air dari protein, sehingga protein dapat mengendap dengan baik (Farrell & Ranallo 2000). Endapan coklat yang diduga merupakan protein kemudian disentrifugasi dan dikumpulkan untuk didialisis.
Sampel yang memiliki kandungan garam tinggi harus didialisis, karena berpotensi mengganggu hasil analisis selanjutnya, menggunakan kantung dialisis yang memiliki pori-pori berukuran 10 kD yang dimasukkan ke dalam wadah berisi pelarut akuades yang digunakan untuk menciptakan lingkungan hipotonik di luar membran dialisis (Gambar 5a). Pori-pori ini menyebabkan molekul garam dan air yang kecil dapat bertukar dengan lingkungan, sementara protein yang berbobot molekul besar tidak dapat melewatinya (Nelson & Cox 2005). Proses ini dilakukan berulang kali hingga pelarut yang digunakan tidak lagi mengandung amonium sulfat—diuji menggunakan penambahan larutan barium klorida. Reaksi amonium sulfat dan barium klorida menghasilkan endapan barium sulfat yang berwarna putih (Gambar 5b). Setelah dialisis dilakukan sebanyak dua kali, akuades yang digunakan untuk dialisis tidak lagi menghasilkan endapan putih karena garam amonium sulfat sudah tidak ditemukan pada sampel, maka dialisis dapat dihentikan.
Tahap pemurnian terakhir adalah fraksinasi sampel. Pemisahan protein menghasilkan serial tabung yang memiliki gradasi warna kuning berbeda pada fraksi yang berbeda. Gambar 6 menunjukkan perbedaan warna kelima puluh dua tabung yang dihasilkan pada berbagai eluen. Dua hal penting yang harus diperhatikan dalam fraksinasi adalah jenis matriks dan bufer eluen yang digunakan.
11
Gambar 5 Skema dialisis sampel (a) dan pengujian bebas sulfat (b)
Perbedaan warna yang terlihat pada Gambar 6 didapat dari penggunaan bufer dengan konsentrasi garam yang berbeda. Lumbrokinase yang berasal dari E. foetida memiliki gugus aktif serin dengan pI 5.68. Bufer yang digunakan untuk mengelusi, yaitu 50 mM bufer Tris-HCl pH 7.5, mengakibatkan protease serina dalam keadaan bermuatan negatif. Protease ini akan berikatan dengan gugus fungsi dietilaminoetil yang bermuatan positif. Penambahan garam NaCl akan melepaskan asam amino dari ikatannya dengan matriks secara bertahap. Perbedaan warna dapat juga terjadi akibat perbedaan jenis protein yang terelusi.
Gambar 6 Tabung-tabung hasil fraksinasi protein
Karakterisasi Enzim
Karakterisasi enzim bertujuan menentukan jenis enzim berdasarkan ciri-ciri fisik dan biokimianya. Penelitian ini menggunakan pengukuran aktivitas enzim pada suhu, pH, dan waktu inkubasi tertentu dan pengukuran spesifisitas substrat menggunakan fibrin menggunakan dialisat enzim, disertai pengukuran bobot molekul dan konsentrasi protein pada ekstrak kasar, presipitat, dialisat, dialisat yang dikeringbekukan, dan beberapa fraksi dari hasil kromatografi kolom.
Analisis Aktivitas Protease
Tabel 1 menunjukkan pengaruh pH, suhu, dan waktu inkubasi terhadap kemampuan enzim protease mendegradasi kasein sebagai substrat. Kondisi laboratorium optimum yang diperoleh dalam penelitian ini adalah inkubasi selama 10 menit, pada suhu 60°C dan pH 8 dengan nilai aktivitas protease sebesar 0.239 Um . Kondisi ini menghasilkan nilai aktivitas yang lebih tinggi 13.81% dibanding nilai aktivitas yang diperoleh pada inkubasi selama 5 menit pada suhu 37°C dan pH 8. Namun, untuk keperluan komersial, inkubasi selama 5 menit pada suhu 37°C dan pH 8 sudah memberikan hasil yang cukup baik.
Jika ditinjau berdasarkan waktu inkubasi, waktu inkubasi optimum untuk protease yang berasal dari E. foetida galur lokal adalah 5-10 menit. Secara umum, terjadi pola kenaikan aktivitas hingga menit ke-10, namun selanjutnya aktivitas menurun cenderung stabil hingga menit ke-60. Contoh pada perlakuan pH 8.0 suhu inkubasi 60°C, waktu inkubasi 5 menit memiliki aktivitas 0.041
U
m . Ketika enzim diinkubasi selama 10
menit, aktivitasnya meningkat menjadi 0.239
U
m . Namun, setelah waktu inkubasi
ditingkatkan menjadi 20 menit, aktivitas menurun menjadi 0.105 Um . Ketika waktu inkubasi mencapai 40 menit, aktivitasnya hanya 0.049 Um dan cenderung stabil pada menit ke-60, yaitu 0.043 Um .
Aktivitas protease pada tiga nilai pH yang berbeda menunjukkan bahwa semakin tinggi pH aktivitasnya semakin meningkat. Aktivitas optimum ditemukan pada pH 8. Pada inkubasi 37°C selama 5 menit, aktivitas yang diukur pada pH 6 adalah sebesar -0.040 Um . Ketika pH dinaikkan menjadi 7.4, aktivitas pun meningkat menjadi 0.099 Um . Nilai aktivitas tertinggi dicapai pada penggunaan bufer pH 8, yaitu sebesar 0.210 Um . Berdasarkan penelitian Leipner et al. (1993), pH optimum enzim protease E. foetida berkisar antara 8.0-10.0. Dapat disimpulkan, berdasarkan pH optimumnya, enzim yang diteliti termasuk protease dari E. foetida.
Kenaikan suhu dalam penelitian juga berbanding lurus terhadap aktivitas enzim. Sebagai contoh, pada pH 8.0 dengan waktu inkubasi 10 menit, aktivitas meningkat seiring perubahan suhu–yaitu 25°C, 37°C, dan 60°C. Kenaikan aktivitas akibat suhu yang dinaikkan berturut-turut adalah 0.015 Um pada suhu 25°C, 0.146 Um pada suhu 37°C, dan 0.239
U
Tabel 1 Pengujian aktivitas protease (Um ) Waktu
pH-Suhu 5 10 20 40 60
6
25°C - 0.425 - 0.060 - 0.060 0.022 0.074 37°C - 0.040 0.075 - 0.077 - 0.015 - 0.003 60°C 0.084 0.036 0.056 0.007 0.019
7.4
25°C 0.222 - 0.019 0.022 0.003 0.002 37°C 0.099 - 0.054 0.005 - 0.013 0.006 60°C 0.185 0.031 0.054 0.070 0.057
8
25°C 0.143 0.015 - 0.027 0.006 0.006 37°C 0.210 0.146 0.045 0.017 0.008 60°C 0.041 0.239 0.105 0.049 0.043
Analisis Aktivitas Fibrinolitik
Aktivitas fibrinolitik diukur untuk menentukan kemampuan enzim protease yang didapat untuk mendegradasi fibrin. Analisis ini dilakukan berdasarkan serapan cahaya oleh molekul pewarna terikat fibrin pada sampel dibandingkan dengan serapan cahaya pada blanko. Absorban blanko (fibrin dan pewarna) diukur pada panjang gelombang 515 nm. Absorban tersebut kemudian dibandingkan dengan absorban fibrin yang telah ditambahkan sampel. Rerata absorban blanko adalah sebesar 0.367, sementara rerata absorban sampel adalah 0.474. Absorban tersebut kemudian diplotkan pada kurva standar 6 titik dengan konsentrasi antara 66.5 hingga 344.5 ppm ( v) (Lampiran 12). Diasumsikan setiap molekul fibrin berikatan dengan satu molekul pewarna, sehingga didapatkan konsentrasi fibrin terlarut pada blanko dan sampel berturut-turut sebesar 157.41 dan 206.05 ppm. Merck & Schenk (1914) menyatakan jika absorban sampel lebih besar daripada absorban blanko, maka enzim sampel yang ditambahkan mampu melarutkan fibrin yang terikat pada molekul pewarna. Artinya, enzim ini mampu mendegradasi fibrin dan mengaktifkan mekanisme patofisiologis untuk menyebabkan fibrinolisis (Fedan 2003).
Fibrin diperoleh dari pengotor pada pemurnian plasma darah (Harris 1991). Fibrin tersebut diwarnai dengan pewarna yang mengandung karmoisin lalu dikeringkan hingga menjadi bubuk. Pewarna karmoisin (Gambar 7) dapat digunakan untuk menggantikan pewarna karmin yang umum digunakan untuk mewarnai fibrin. Karmin (Gambar 8) merupakan pewarna alami yang berasal dari ekstrak Dactiopius coccus, sejenis serangga pengisap kaktus endemik daerah Amerika Tengah, sedangkan karmoisin adalah pewarna sintetis yang memiliki gugus Azo dan bersifat tahan panas (Hanssen 1987). Menurut Walford (1977) dan Freund et al.
(1988) di dalam Hutchings (1999), karmoisin dapat digunakan sebagai pengganti karmin, sehingga dalam penelitian ini bahan pewarna yang digunakan adalah karmoisin yang relatif lebih mudah didapat.
Spektrofotometri dipilih sebagai metode penelitian karena sifatnya yang cepat, mudah dilakukan, keterulangannya baik, dan bahan bakunya yang mudah didapatkan. Selain spektrofotometri, metode lain yang dapat digunakan, antara lain cawan fibrin dan zimografi. Metode cawan adalah menggunakan campuran fibrinogen dan trombin yang dilarutkan dalam media agar. Metode ini sangat spesifik terhadap fibrinolisis, namun membutuhkan waktu ekstra untuk pengerjaannya (Pan, et al. 2010). Zimografi menyerupai elektroforesis SDS-PAGE, namun pada gel yang digunakan ditambahkan fibrinogen dan trombin (Yanti 2003). Metode ini spesifik terhadap fibrinolisis dan cepat dilakukan.
Gambar 7 Struktur karmoisin
Gambar 8 Struktur karmin
Deteksi Protein
13
0.000 0.500 1.000 1.500 2.000 2.500 3.0001 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43 45 47 49 51
A b so rb a n si
Nomor Tabung Fraksi
17
37
9
pada panjang gelombang 280 nm. Terdapat tiga puncak, yaitu pada tabung bernomor 9, 17, dan 37. Ketinggian masing-masing puncak yang berbeda-beda menunjukkan perbedaan konsentrasi protein. Menurut Harris (1991), absorban yang diperoleh sebanding dengan
m
m konsentrasi protein yang terdapat pada
sampel.
Tabung bernomor 9 memiliki absorban 0.737, tabung nomor 17 memiliki absorban 1.980, dan tabung bernomor 37 memiliki absorban 2.403. Perbedaan konsentrasi protein ini diduga berdasarkan kandungan garam dalam bufer eluen. Puncak pertama didapat dari elusi menggunakan bufer tanpa penambahan garam. Puncak kedua, yang memiliki konsentrasi protein lebih tinggi, dielusi menggunakan bufer dengan penambahan NaCl 0.25 M. Konsentrasi protein tertinggi didapat menggunakan bufer dengan penambahan garam 0.5 M. Campbell & Farrell (2006) menyatakan bahwa konsentrasi garam berpengaruh pada kemampuan bufer mengelusi sampel dari matriks kolom. NaCl berfungsi sebagai ion senama, yang akan melepaskan protein dari ikatan dengan matriks, dan berikatan dengan matriks kolom menggantikan molekul protein (Farrell & Ranallo 2000).
Pengukuran Bobot Molekul
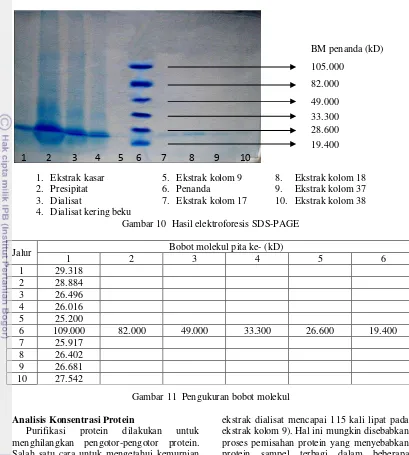
Tahapan ini bertujuan menentukan bobot molekul sampel menggunakan elektroforesis dan hasilnya dibandingkan dengan penanda berbobot molekul rendah Bio-Rad. Penanda ini menggunakan 6 jenis protein yang bobot molekulnya telah diketahui. Keenam protein tersebut, berturut-turut dari molekul terendah hingga tertinggi, adalah lisozim (19.4 kD), inhibitor tripsin dari kacang kedelai (28.6 kD), karbonat anhidrase (33.3 kD), ovalbumin (49.0 kD), BSA (82.0 kD), dan fosforilase (105.0 kD). Sampel yang dipilih untuk
elektroforesis merupakan puncak-puncak berdasarkan hasil tahapan deteksi protein. Gambar 10 menunjukkan pergerakan sampel di dalam gel. Jarak pergerakan sampel (rf) berbanding terbalik dengan bobot molekul sampel. Lajur 1 pada Gambar 10 menunjukkan pergerakan yang paling dekat dengan titik awal, yaitu bagian bawah gambar, sementara lajur 5 bergerak paling jauh dari titik awal. Lajur 2, yang merupakan presipitat, memiliki ekor yang menunjukkan adanya pengotor. Diduga, pengotor ini adalah garam yang digunakan untuk pengendapan protein. Ekstrak kolom pada lajur 5, 7, 8, 9, dan 10 memiliki pita yang tipis karena konsentrasi protein yang ada tidak setinggi sampel pada lajur 1 hingga 4. Namun sampel ekstrak kolom tidak memiliki ekor, yang artinya kromatografi kolom mampu menjernihkan protein.
Data pada Gambar 11 diperoleh menggunakan perangkat lunak PhotoCaptMW yang dapat menghitung bobot molekul sampel berdasarkan perbandingan antara jarak pergerakan sampel dan jarak pergerakan standar. Data-data bobot molekul standar yang digunakan telah dimasukkan terlebih dahulu ke dalam basis data. Gambar tersebut menunjukkan bahwa bobot molekul terkecil ditemukan pada lajur 5, yaitu sampel ekstrak kolom 9, dengan bobot molekul 25.200 kD sementara bobot molekul terbesar ditemukan pada lajur pertama, yaitu sampel ekstrak kasar. Bobot molekul sampel ini adalah 29.318 kD. Wang, et al. (2003) mengungkapkan bahwa bobot molekul enzim lumbrokinase dari E. foetida berkisar antara 23.028 hingga 29.690 kD. Maka berdasarkan bobot molekul sampel, dapat disimpulkan sampel yang diperoleh merupakan lumbrokinase dari E. foetida.
Gambar 10 Hasil elektroforesis SDS-PAGE
Jalur Bobot molekul pita ke- (kD)
1 2 3 4 5 6
1 29.318 2 28.884 3 26.496 4 26.016 5 25.200
6 109.000 82.000 49.000 33.300 26.600 19.400 7 25.917
8 26.402 9 26.681 10 27.542
Gambar 11 Pengukuran bobot molekul
Analisis Konsentrasi Protein
Purifikasi protein dilakukan untuk menghilangkan pengotor-pengotor protein. Salah satu cara untuk mengetahui kemurnian sampel adalah melalui pengukuran konsentrasi protein. Dapat dilihat pada Tabel 2, konsentrasi protein tertinggi didapat pada sampel dialisat dan dialisat yang dikeringbekukan, sementara konsentrasi protein terendah ditemukan pada sampel ekstrak kolom 9. Berdasarkan data tersebut, seperti dikemukakan Farrell & Ranallo (2006), setiap tahap purifikasi protein mampu memurnikan protein secara lebih baik –dilihat dari kenaikan konsentrasi protein pada tiap tahapan. Kenaikan konsentrasi protein setelah presipitasi dan dialisis meningkat masing-masing sebesar 24.75 dan 72.28% dibandingkan dengan ekstrak kasar.
Tabel 2 juga menunjukkan sampel yang diperoleh pada tahapan setelah fraksinasi memiliki konsentrasi protein yang jauh lebih kecil dibandingkan dengan sampel-sampel sebelum fraksinasi (konsentrasi protein
ekstrak dialisat mencapai 115 kali lipat pada ekstrak kolom 9). Hal ini mungkin disebabkan proses pemisahan protein yang menyebabkan protein sampel terbagi dalam beberapa kelompok tabung sesuai dengan waktu retensi dan kelarutannya dalam bufer eluen. Menurut Lucy & Hatsis (2004), hal-hal lain yang dapat mempengaruhi konsentrasi protein adalah konsentrasi garam yang ditambahkan dalam eluen atau jenis bufer eluen yang digunakan. Konsentrasi garam yang semakin tinggi dapat memutuskan ikatan antara matriks kolom dengan gugus aktif dari enzim yang terjerap.
Sampel bernomor 1-4 pada Tabel 2 diencerkan 10x agar hasil absorban yang diperoleh dapat dimasukkan ke dalam kurva standar. Jika hasil tersebut dikonversi ke keadaan sebelum pengenceran, didapatkan konsentrasi dialisat protein yang didapat dari 10% suspensi ekstrak adalah sebesar 1.74
m
m . Hasil ini mendekati penelitian Ochiai
& Enoki (1980) yang menyatakan bahwa konsentrasi protein dalam ekstrak E. foetida adalah antara 1.3-1.6 m m .
1. Ekstrak kasar 2. Presipitat 3. Dialisat
4. Dialisat kering beku
5. Ekstrak kolom 9 6. Penanda
7. Ekstrak kolom 17
8. Ekstrak kolom 18 9. Ekstrak kolom 37 10. Ekstrak kolom 38
1 2 3 4 5 6 7 8 9 10
BM penanda (kD)
105.000
82.000
15
Tabel 2 Pengukuran konsentrasi protein
No. Sampel Konsentrasi protein
(mg/mL) 1 Ekstrak kasar 1.009 2 Presipitat 1.259 3 Dialisat 1.746 4 Dialisat kering beku 1.729
5 Ekstrak kolom 9 0.015 6 Ekstrak kolom 17 0.139 7 Ekstrak kolom 18 0.162 8 Ekstrak kolom 37 0.135 9 Ekstrak kolom 38 0.104
SIMPULAN DAN SARAN
Simpulan
Purifikasi enzim dengan teknik presipitasi, dialisis, dan fraksinasi menggunakan kromatografi pertukaran ion mampu memurnikan enzim dari pengotornya dan memisahkan menjadi tiga kelompok isozim. Bobot molekul enzim yang diperoleh berkisar antara 25.200 kD hingga 29.318 kD. Konsentrasi protein tertinggi ditemukan pada ekstrak dialisat dengan konsentrasi 1.74
m
m . Konsentrasi protein dialisat lebih
tinggi 72.28% dibandingkan dengan ekstrak kasar. Aktivitas enzim tertinggi didapatkan pada inkubasi selama 10 menit, pada suhu 60°C dan pH 8 dengan aktivitas protease sebesar 0.239 Um . Enzim protease yang diperoleh mampu melarutkan fibrin berdasarkan pengukuran menggunakan spektrofotometer. Rerata konsentrasi fibrin pada sampel 30.9% lebih tinggi dibandingkan blanko.
Saran
Perlu dilakukan penentuan titik isolistrik pada enzim protease dari E. foetida galur lokal sehingga penggunaan bufer untuk elusi dapat lebih optimal. Perlu dilakukan pengendapan protein pada berbagai konsentrasi garam. Perlu dilakukan uji penggunaan matriks yang paling efektif untuk fraksinasi enzim. Perlu dilakukan pengujian aktivitas fibrinolitik menggunakan metode yang lebih spesifik pada substrat fibrin.
DAFTAR PUSTAKA
Acharya MM, Katyare SS. 2004. An Improved Micromethod for Tyrosine Estimation. J Naturforsch. 59 c: 897-900.
Agustinus MD. 2009. Jurnal tingkah laku cacing tanah. [terhubung berkala]. http://edukasi.kompasiana.com/2009/11/27
/tingkah-laku-cacing-tanah/. Diakses pada 21 Juni 2011.
Analytik Jena. 2007. UV spectrophotometric protein detection at 280 nm. [komunikasi singkat]. Jena: Analytik Jena.
Anderson KS. 2011. Multiplexed detection of antibodies using programmable bead arrays. Di dalam Wu CJ, editor. Protein Microarray for Disease Analysis: Methods and Protocols. New York: Humana
Bell A. 2002. Morphology of human blood and marrow cells: hematopoiesis. Di dalam Harmening DM, editor. Clinical Hematology and Fundamentals of Hemostasis. Ed ke-4. Philadelphia: FA Davis hlm 1-38.
Bradford M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. J Anal Biochem. 72: 248-254.
Campbell MK, Farrell SO. 2006. Biochemistry. Ed ke-5. California: Thomson Learning.
Chen H et al. 2007. Earthworm fibrinolytic enzyme: anti-tumor activity on human hepatoma cells in vitro and in vivo. Chin Med J. 120(10): 898-904.
Cho IH et al. 2003. Purification and characterization of six fibrinolytic serine-proteases from earthworm Lumbricus rubellus. J Biochem Mol Biol. 37: 199-205.
Cong Y, Liu Y, Chen J. 2001. The advance of lumbrokinase. Chin J Biochem Pharm. 21:159-162.
Escobar CE et al. 2002. Introduction to hemostasis. Di dalam Harmening DM, editor. Clinical Hematology and Fundamentals of Hemostasis. Ed ke-4. Philadelphia: FA Davis hlm 441-470.
Farrell SO, Ranallo RT. 2000. Experiments in Biochemistry: A Hands-on Approach. California: Thomson Learning.
Fedan JS. 2003. Anticoagulant, antiplatelet, and fibrinolytic (thrombolytic) drugs. Di dalam: Craig CR, Stitzel RE, editor. Modern Pharmacol